32006L0063[1]
A Bizottság 2006/63/EK irányelve ( 2006. július 14. ) a Ralstonia solanacearum (Smith) Yabuuchi et al. elleni védekezésről szóló 98/57/EK tanácsi irányelv II-VII. melléklete módosításáról
A BIZOTTSÁG 2006/63/EK IRÁNYELVE
(2006. július 14.)
a Ralstonia solanacearum (Smith) Yabuuchi et al. elleni védekezésről szóló 98/57/EK tanácsi irányelv II-VII. melléklete módosításáról
AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA,
tekintettel az Európai Közösséget létrehozó szerződésre,
tekintettel a Ralstonia solanacearum (Smith) Yabuuchi et al. elleni védekezésről szóló, 1998. július 20-i 98/57/EK tanácsi irányelvre (1) és különösen annak 11. cikkére,
mivel:
(1) A burgonya és a paradicsom egyik fontos károsítója a Ralstonia solanacearum (Smith) Yabuuchi et al., a burgonya barna rothadásának, valamint a burgonya és a paradicsom baktériumos hervadásának kórokozója (a továbbiakban: "a károsító").
(2) A károsító még mindig előfordul a Közösség egyes részein.
(3) A 98/57/EK irányelv meghatározta a tagállamokban a károsító ellen annak érdekében végrehajtandó részletes intézkedéseket, hogy lokalizálják és meghatározzák a földrajzi elterjedését; megelőzzék az előfordulását és a terjedését; valamint - előfordulása esetén - megakadályozzák a továbbterjedését és védekezzenek ellene a felszámolása céljából.
(4) Azóta jelentősen bővültek a károsító biológiájára, valamint kimutatási és azonosítási eljárásaira vonatkozó ismeretek; továbbá a károsító elleni védekezésben szerzett gyakorlati ismeretek szükségessé teszik több - a védekezési intézkedésekkel összefüggő - szakmai rendelkezés felülvizsgálatát.
(5) E fejlemények eredményeképpen szükségesnek látszik a 98/57/EK irányelv bizonyos mellékleteiben lévő intézkedések felülvizsgálata és naprakésszé tétele.
(6) A kimutatási és azonosítási eljárások vonatkozásában a fluoreszcens in situ hibridizáció (FISH), egy korszerű kimutatási módszer kerül beépítésre. A polimeráz láncreakció (PCR) módszer vonatkozásában elért előrelépések, valamint a jelenlegi kimutatási és azonosítási eljárás különböző szakmai elemei, és a károsítónak a burgonyától eltérő gazdanövényekben, illetve vízben és talajban történő kimutatására és azonosítására szolgáló módszerek fejlesztése vonatkozásában elért előrelépések szintén beépítésre kerültek.
(7) A védekezési intézkedések szakmai elemei tekintetében, továbbfejlesztett rendelkezések készülnek: a vizsgált minták megőrzésének módjára vonatkozóan a károsító visszakövetésének biztosítása érdekében, a feltételezhető fertőzöttség mértékének meghatározására, a károsító bármely igazolt előfordulása és a vonatkozó fertőzött övezet bejelentésének részleteire, valamint a fertőzöttnek minősített termesztési helyeken és a kijelölt övezeteken belül alkalmazandó intézkedésekre vonatkozóan. Továbbá, beépítésre került néhány rendelkezés a paradicsomra vonatkozóan annak érdekében, hogy nagyobb hangsúlyt kapjon e növénynek a károsító gazdanövényeként játszott szerepe.
(8) Az ebben az irányelvben előírt intézkedések összhangban vannak a Növény-egészségügyi Állandó Bizottság véleményével,
ELFOGADTA EZT AZ IRÁNYELVET
1. cikk
A 98/57/EK irányelv II-VII. melléklete helyébe ezen irányelv mellékletének megfelelő szövege lép.
2. cikk
(1) A tagállamok legkésőbb 2007. március 31-ig elfogadják és kihirdetik azokat a rendelkezéseket, amelyek szükségesek ahhoz, hogy ennek az irányelvnek megfeleljenek. Erről haladéktalanul tájékoztatják a Bizottságot.
Ezeket a rendelkezéseket 2007. április 1-jétől alkalmazzák.
Amikor a tagállamok elfogadják ezeket a rendelkezéseket, azokban hivatkozni kell erre az irányelvre, vagy azokhoz hivatalos kihirdetésük alkalmával ilyen hivatkozást kell fűzni. A hivatkozás módját a tagállamok határozzák meg.
(2) A tagállamok haladéktalanul közlik a Bizottsággal nemzeti joguknak azokat a főbb rendelkezéseit, amelyeket az ezen irányelv által szabályozott területen fogadnak el. A Bizottság tájékoztatja erről a többi tagállamot.
3. cikk
Ez az irányelv az Európai Unió Hivatalos Lapjában való kihirdetését követő huszadik napon lép hatályba.
4. cikk
Ennek az irányelvnek a tagállamok a címzettjei.
Kelt Brüsszelben, 2006. július 14-én.
a Bizottság részéről
Markos KYPRIANOU
a Bizottság tagja
(1) HL L 235., 1998.8.21., 1. o.
MELLÉKLET
"
II. MELLÉKLET
VIZSGÁLATI PROGRAM A RALSTONIA SOLANACEARUM (SMITH) YABUUCHI ET AL. DIAGNOSZTIZÁLÁSÁRA, KIMUTATÁSÁRA ÉS AZONOSÍTÁSÁRA
A VIZSGÁLATI PROGRAM ALKALMAZÁSI KÖRE
A bemutatott program az alábbi esetekben használt eljárások leírását tartalmazza:
i. a barna rothadás diagnosztizálása burgonyagumókban, és a baktériumos hervadás diagnosztizálása burgonya-, paradicsom- és néhány egyéb gazdanövényben;
ii. a Ralstonia solanacearum kimutatása burgonyagumó-mintákban, burgonya-, paradicsom- és egyéb gazdanövényekben, vízben és talajban;
iii. a Ralstonia solanacearum (R. solanacearum) azonosítása.
TARTALOMJEGYZÉK
| Oldal | ||||||
| Általános alapelvek | 40 | |||||
| I. SZAKASZ: | A vizsgálati program alkalmazása | 40 | ||||
| 1. | Kimutatási program a barna rothadás és a baktériumos hervadás (R. solanacearum) diagnosztizálására burgonyagumókban, valamint a barna rothadás vagy a baktériumos hervadás tüneteit mutató burgonya-, paradicsom- vagy egyéb gazdanövényekben | 40 | ||||
| 2. | Az R. solanacearum tünetmentes burgonyagumó-mintákban történő kimutatásának és azonosításának programja | 43 | ||||
| 3. | Az R. solanacearum tünetmentes burgonya-, paradicsom- vagy egyéb gazdanövény-mintákban történő kimutatásának és azonosításának programja | 46 | ||||
| II. SZAKASZ: | Részletes módszerek az R. solanacearum kimutatására burgonyagumókban, valamint a barna rothadás vagy a baktériumos hervadás tüneteit mutató burgonya-, paradicsom- vagy egyéb gazdanövényekben | 48 | ||||
| 1. | Tünetek | 48 | ||||
| 2. | Gyors szűrővizsgálatok | 48 | ||||
| 3. | Izolálási eljárás | 49 | ||||
| 4. | Az R. solanacearum azonosítási vizsgálatai | 49 | ||||
| III. SZAKASZ: | 1. | Részletes módszerek az R. solanacearum kimutatására és azonosítására tünetmentes burgonyagumó-mintákban | 49 | |||
| 1.1. | Mintaelőkészítés | 49 | ||||
| 1.2. | Vizsgálat | 51 | ||||
| 2. | Részletes módszerek az R. solanacearum kimutatására és azonosítására tünetmentes burgonya-, paradicsom- vagy egyéb gazdanövény-mintákban | 51 | ||||
| 2.1. | Mintaelőkészítés | 51 | ||||
| 2.2. | Vizsgálat | 52 | ||||
| IV. SZAKASZ: | 1. | Az R. solanacearum kimutatásának és azonosításának programja, vízben | 53 | |||
| 2. | Az R. solanacearum vízben történő kimutatásának és azonosításának módszerei | 55 | ||||
| 2.1. | Mintaelőkészítés | 55 | ||||
| 2.2. | Vizsgálat | 55 | ||||
| V. SZAKASZ: | 1. | Az R. solanacearum kimutatásának és azonosításának programja, talajban | 56 | |||
| 2. | Az R. solanacearum talajban történő kimutatásának és azonosításának módszerei | 58 | ||||
| 2.1. | Mintaelőkészítés | 58 | ||||
| 2.2. | Vizsgálat | 58 | ||||
| VI. SZAKASZ: | Optimalizált protokollok az R. solanacearum kimutatására és azonosítására | 58 | ||||
| A. | Diagnosztikai és kimutatási vizsgálatok | 58 | ||||
| 1. | Áramlásvizsgálat a szárban | 58 | ||||
| 2. | Poli-β-hidroxibutirát szemcsék kimutatása | 58 | ||||
| 3. | Szerológiai agglutinációs vizsgálat | 59 | ||||
| 4. | Szelektív izolálás | 60 | ||||
| 4.1. | Szelektív lemeztenyésztés | 60 | ||||
| 4.2. | Dúsítási eljárás | 60 | ||||
| 5. | Immunofluorescence test (IF) | 61 | ||||
| 6. | Polimeráz láncreakció teszt (PCR) | 64 | ||||
| 6.1. | DNS-tisztítási módszerek | 65 | ||||
| a. | A Pastrik-féle módszer (2000) | 65 | ||||
| b. | Egyéb módszerek | 65 | ||||
| 6.2. | PCR | 66 | ||||
| 6.3. | A PCR termék elemzése | 66 | ||||
| 7. | Fluorescent in-situ hybridization test (FISH) teszt | 67 | ||||
| 8. | Enzyme Linked ImmunoSorbent Assay (ELISA) tesztek | 69 | ||||
| a. | Közvetett ELISA | 69 | ||||
| b. | DASI (Double-Antibody Sandwich Indirect) ELISA | 70 | ||||
| 9. | Biológiai vizsgálat | 71 | ||||
| B. | Azonosítási vizsgálatok | 72 | ||||
| 1. | Táplálkozási és enzimes azonosítási vizsgálat | 72 | ||||
| 2. | IF-teszt | 72 | ||||
| 3. | ELISA-teszt | 73 | ||||
| 4. | PCR-teszt | 73 | ||||
| 5. | FISH-teszt | 73 | ||||
| 6. | Zsírsav-meghatározás (FAP) | 73 | ||||
| 7. | A törzs jellemzésének módszerei | 73 | ||||
| 7.1. | Biovariáns-meghatározás | 73 | ||||
| 7.2. | Genom-ujjlenyomat készítés | 74 | ||||
| 7.3. | PCR-módszerek | 74 | ||||
| C. | Megerősítő vizsgálat | 74 | ||||
| 1. függelék | A protokollok optimalizálásába és validálásába bevont laboratóriumok | 76 | ||||
| 2. függelék | Az R. solanacearum izolálására és tenyésztésére szolgáló táptalajok | 77 | ||||
| 3. függelék | A. | Kereskedelmi forgalomban kapható standardizált kontrollanyag | 79 | |||
| B. | A kontrollok készítése | 80 | ||||
| 4. függelék | Pufferek a vizsgálati eljárásokhoz | 82 | ||||
| 5. függelék | A fertőzöttségi szint meghatározása az IF- és a FISH-próbában | 85 | ||||
| 6. függelék | Validált PCR-protokollok és reagensek | 86 | ||||
| 7. függelék | Validált reagensek a FISH-próbához | 91 | ||||
| 8. függelék | A paradicsom és tojásgyümölcs termesztési feltételei | 93 | ||||
| Irodalomjegyzék | 94 | |||||
ÁLTALÁNOS ALAPELVEK
A különböző módszerek optimalizált protokolljai, a validált reagensek, valamint a vizsgálati- és a kontrollanyagok elkészítésének részletei megtalálhatók a függelékekben. A protokollok optimalizálásába és validálásába bevont laboratóriumok felsorolása az 1. függelékben található.
Mivel a protokollok egy zárlati károsító kimutatásával járnak, és életképes R. solanacearum tenyészetek kontrollanyagként történő felhasználását fogják magukban foglalni, szükséges lesz, hogy az eljárások elvégzésére megfelelő növény-egészségügyi zárlati feltételek mellett - beleértve a hulladék ártalmatlanítására szolgáló megfelelő berendezéseket -, valamint a hivatalos növény-egészségügyi zárlatért felelős hatóságok által kiállított megfelelő engedély feltételei szerint kerüljön sor.
A vizsgálati paramétereknek biztosítaniuk kell az R. solanacearum szintjének következetes és reprodukálható kimutatását a kiválasztott módszerek megadott küszöbértékein.
A pozitív kontrollok precíz elkészítése elengedhetetlenül szükséges.
A szükséges küszöbértékek szerinti vizsgálat ugyancsak magában foglalja az eszközök helyes beállítását, karbantartását és kalibrációját, a reagensek gondos kezelését és megőrzését, valamint minden olyan intézkedést, amely a minták közötti fertőződés megakadályozását szolgálja, pl. a pozitív kontrollok elválasztása a vizsgálati mintáktól. Az adminisztratív és egyéb hibák elkerülése érdekében minőségellenőrzési előírásokat kell alkalmazni, különösen a címkézés és a dokumentáció vonatkozásában.
A károsító előfordulásának a 98/57/EK irányelv 4. cikke (2) bekezdésében említett gyanúja feltételezi az alábbi folyamatábrában meghatározott mintán elvégzett diagnosztikai vagy szűrővizsgálatok pozitív eredményét. A pozitív első szűrővizsgálatot (IF-teszt, PCR/FISH, szelektív izolálás) meg kell erősíteni egy második szűrővizsgálattal, amely eltérő biológiai elven alapul.
Ha az első szűrővizsgálat pozitív, akkor az R. solanacearum-mal való fertőzöttség gyanúja fennáll, és egy második szűrővizsgálatot kell elvégezni. Ha a második szűrővizsgálat pozitív, akkor a gyanú megerősítésre került (gyanított előfordulás), és az eljárás szerinti vizsgálatokat kell lefolytatni. Ha a második szűrővizsgálat negatív, akkor úgy tekintik, hogy a minta nem fertőzött az R. solanacearum-mal.
A 98/57/EK irányelv 5. cikke (1) bekezdésében említett megerősített előfordulás feltételezi az R. solanacearum tiszta tenyészetének izolálását és azonosítását, beleértve a patogenitás megerősítését.
I. SZAKASZ
A VIZSGÁLATI PROGRAM ALKALMAZÁSA
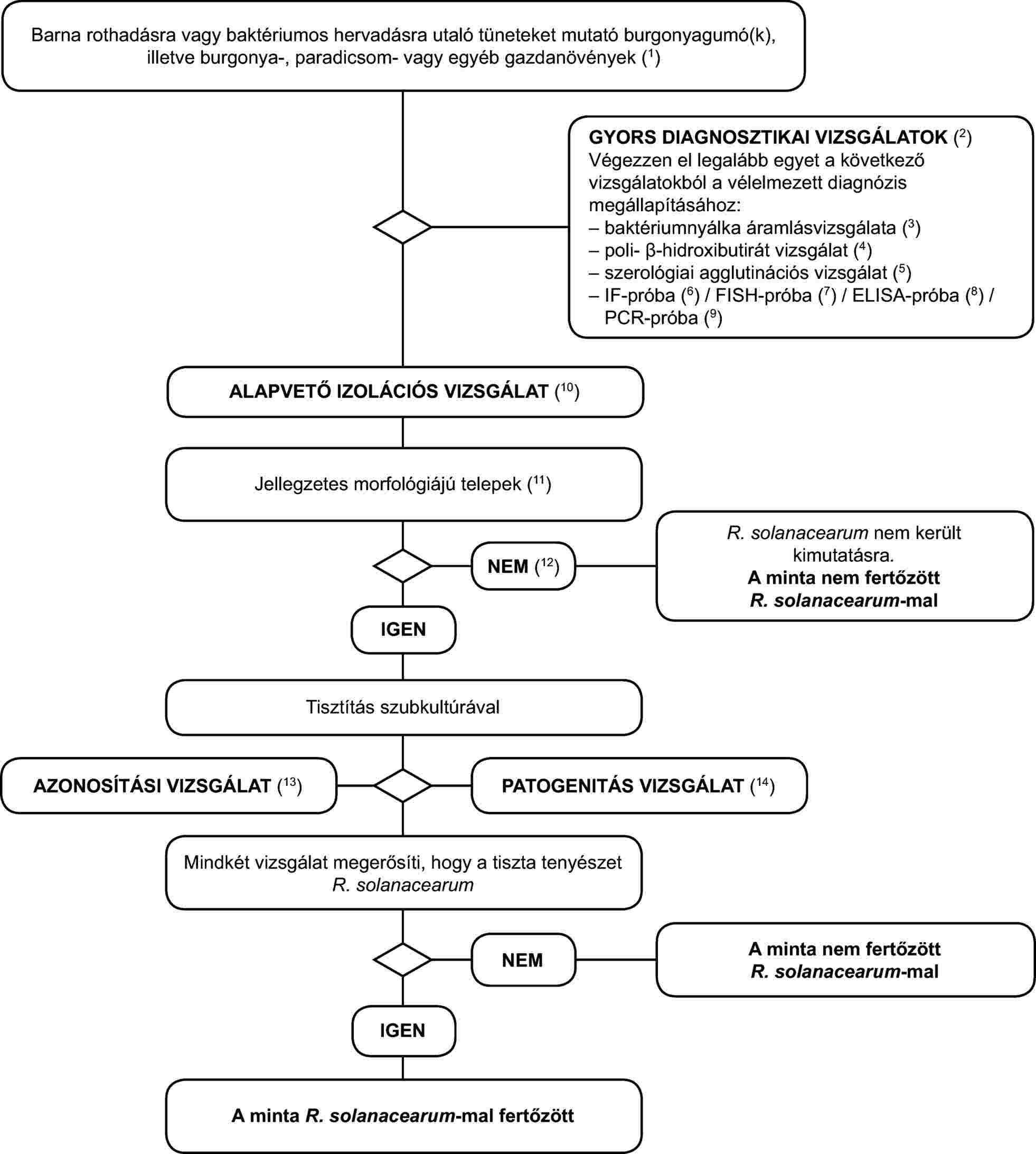
1. Kimutatási program a barna rothadás és a baktériumos hervadás (R. solanacearum) diagnosztizálására burgonyagumókban, valamint a barna rothadás vagy a baktériumos hervadás tüneteit mutató burgonya-, paradicsom- vagy egyéb gazdanövényekben.
A vizsgálati eljárás a barna rothadás vagy a vaszkuláris hervadás jellegzetes vagy gyanított tüneteit mutató burgonyagumók és -növények vizsgálatára szolgál. Tartalmaz egy gyors szűrővizsgálatot, a kórokozó izolálását fertőzött edénynyaláb szövetből (szelektív) táptalajon, és - pozitív eredmény esetén - a tenyészet azonosítását Ralstonia solanacearum-ként.

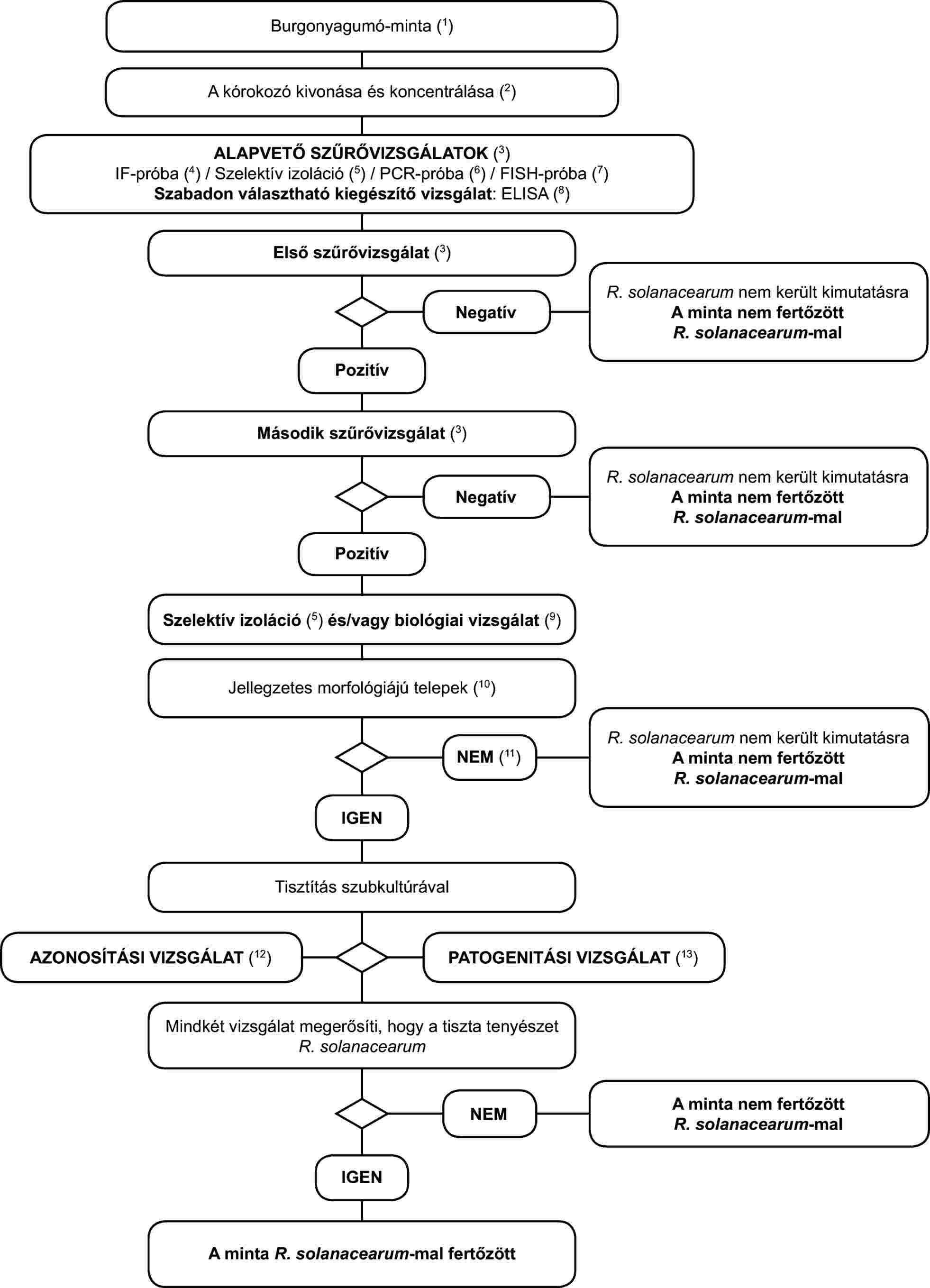
2. A Ralstonia solanacearum tünetmentes burgonyagumó-mintákban történő kimutatásának és azonosításának programja
Az alapelv:
A vizsgálati eljárás a lappangó fertőzések burgonyagumókban történő kimutatására szolgál. Legalább két - eltérő biológiai elven alapuló - szűrővizsgálat pozitív eredményét3 ki kell egészíteni a kórokozó izolálásával; ezt jellegzetes telepek izolálása esetén a tiszta tenyészet R. solanacearum-ként történő azonosítása követi. Mindössze egy szűrővizsgálat pozitív eredménye nem elegendő a minta gyanúsnak tekintéséhez.
A szűrővizsgálatoknak és az izolálási vizsgálatoknak lehetővé kell tenniük 103-104 sejt/ml újraszuszpendált pellet kimutatását, amely pozitív kontrollként kerül alkalmazásra minden egyes vizsgálati sorozatnál.

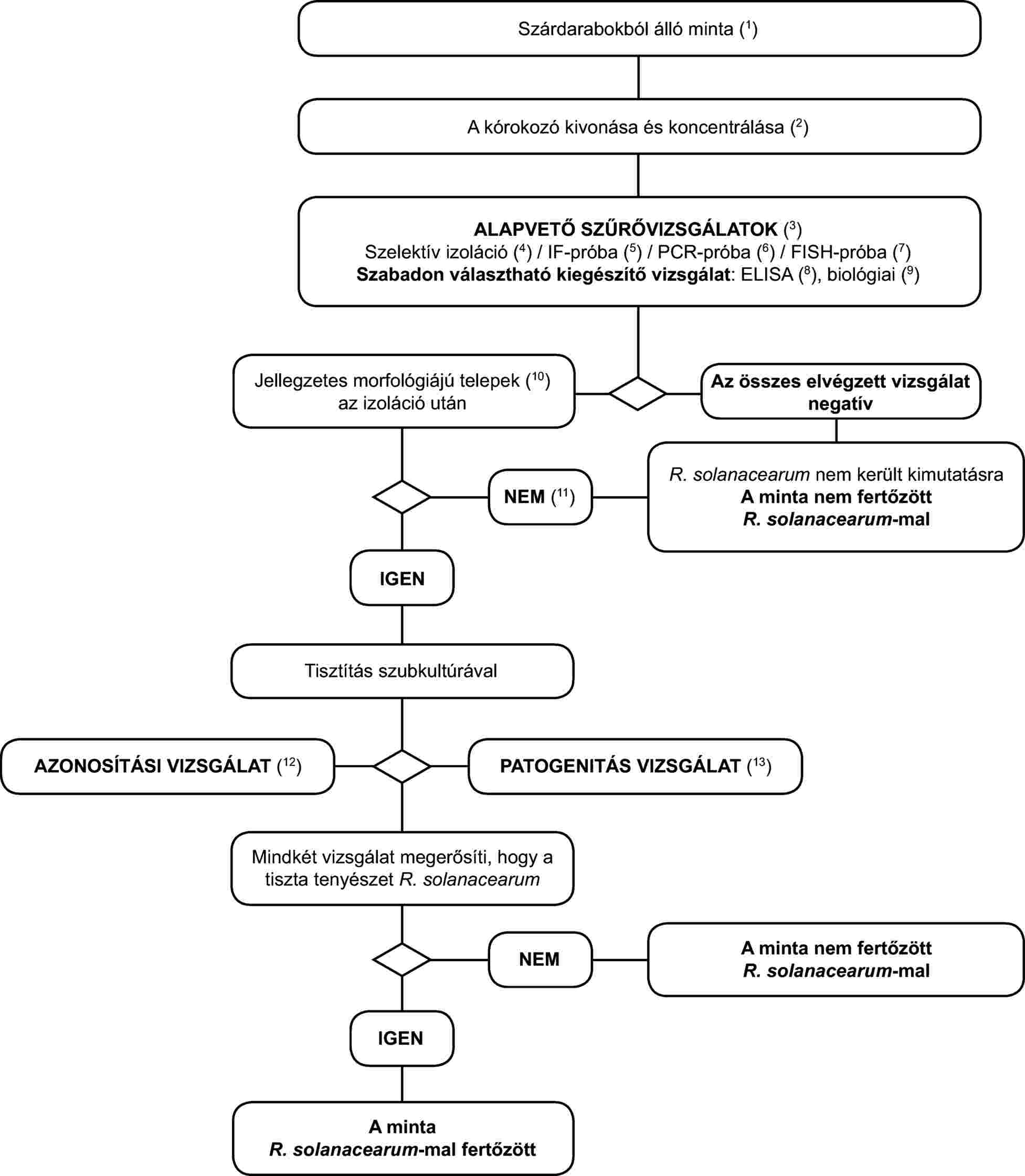
3. A Ralstonia solanacearum tünetmentes burgonya-, paradicsom- vagy egyéb gazdanövény-mintákban történő kimutatásának és azonosításának programja

II. SZAKASZ
RÉSZLETES MÓDSZEREK A RALSTONIA SOLANACEARUM KIMUTATÁSÁRA BURGONYAGUMÓKBAN, VALAMINT A BARNA ROTHADÁS VAGY A BAKTÉRIUMOS HERVADÁS TÜNETEIT MUTATÓ BURGONYA-, PARADICSOM- VAGY EGYÉB GAZDANÖVÉNYEKBEN
1. Tünetek (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main)
1.1. Tünetek burgonyában
A burgonyanövény. A fertőzés korai szakaszában a szántóföldön magas hőmérsékleten nappal a növénycsúcs tájékán a levelek hervadása jelentkezik, amit éjszakai regenerálódás követ. A hervadás korai szakaszában a levelek zöldek maradnak, de később elsárgulnak, és barna elhalás alakul ki. Epinasztia is jelentkezik. Egy hajtás vagy az egész növény hervadása gyorsan visszafordíthatatlanná válik, és a növény összeesését és elpusztulását eredményezi. Az elhervadt növények keresztirányban elvágott szárában lévő edénynyaláb-szövet rendszerint barna színű, és a metszéslapból összenyomással tejszerű baktériumnyálka szivárog ki vagy préselhető ki. Amikor az elvágott szárat függőlegesen vízbe helyezzük, nyálkafonalak áramlanak ki az edénynyaláb-kötegekből.
A burgonyagumó. A burgonyagumókat keresztirányban kell elvágni a köldökrész közelében vagy hosszirányban a köldökrész fölött. A fertőzés korai szakaszában az edénynyaláb-gyűrű üvegszerű sárgától világosbarnáig terjedő elszíneződése figyelhető meg, és az edénynyaláb gyűrűből spontán módon halvány krémszínű baktériumnyálka szivárog ki néhány perc elteltével. Később az edénynyaláb elszíneződése kifejezettebben barnává válik, és az elhalás kiterjedhet a parenchima-szövetre is. Az előrehaladott szakaszokban a fertőzés kifelé terjed a köldökrésztől és a szemektől, amelyekből baktériumnyálka szivároghat ki talajrészecskék odatapadását eredményezve. Vörösesbarna, kissé bemélyedő elváltozások jelenhetnek meg a héjon az edénynyaláb-szövetek belső összeomlása következtében. A betegség előrehaladott szakaszában általános a gombás vagy baktériumos lágyrothadás másodlagos kialakulása.
1.2. Tünetek paradicsomban
A paradicsomnövény. Az első látható tünet a legfiatalabb levelek hervadt megjelenése. A kórokozó számára kedvező környezeti feltételek mellett (talajhőmérséklet kb. 25 °C, telített páratartalom) a növény egyik oldalának vagy a teljes növénynek az epinasztiája vagy hervadása következik be néhány napon belül, amely a teljes növény összeeséséhez vezet. Kevésbé kedvező körülmények között (21 °C alatti talajhőmérséklet) a hervadás kisebb mértékű, de nagy számú mellékgyökér fejlődhet ki a száron. A szár tövétől induló átázott sávok figyelhetők meg, ami a vaszkuláris rendszerben bekövetkezett elhalást jelzi. Amikor a szárat keresztirányban elvágjuk, az elszíneződött barna edénynyaláb-szövetek fehér vagy sárgás baktériumnyálkát bocsátanak ki.
1.3. Tünetek egyéb gazdanövényekben
Solanum dulcamara és S. nigrum növények. Természetes feltételek mellett a hervadási tünetek ritkán figyelhetők meg ezeken a gazda-gyomnövényeken, hacsak a talajhőmérséklet nem emelkedik 25 °C fölé vagy az oltóanyag szintje nem szélsőségesen magas (pl. beteg paradicsom- vagy burgonyanövények közelében növő S. nigrum esetében). Amikor hervadás következik be, a tünetek a paradicsomnál leírtakkal megegyeznek. A vízben lévő szárral és gyökérzettel növő, nem hervadó S. dulcamara növények edénynyaláb-szövetei világosbarna elszíneződést mutathatnak a szár tövének vagy a víz alatti szárrészek keresztmetszetében. Baktériumnyálka szivároghat az elvágott edénynyaláb-szövetekből, vagy nyálkafonalakat képezhet, ha az elvágott szárat függőlegesen vízbe helyezzük, még a hervadási tünetek hiányában is.
2. Gyors szűrővizsgálatok
A gyors szűrővizsgálatok megkönnyíthetik a vélelmezett diagnózis felállítását, de nem nélkülözhetetlenek. Az alábbi validált vizsgálatok közül egyet vagy többet használjunk:
2.1. Áramlásvizsgálat a szárban
(Lásd a VI.A.1. szakaszt)
2.2. Poli-β-hidroxibutirát (PHB) szemcsék kimutatása
Az R. solanacearum sejtjeiben lévő jellegzetes PHB szemcsék a fertőzött szövetből vett baktériumnyálka tárgylemezre hővel rögzített kenetének níluskék »A« vagy szudánfekete festésével tehetők láthatóvá (Lásd a VI.A.2. szakaszt).
2.3. Szerológiai agglutinációs vizsgálat
(Lásd a VI.A.3. szakaszt)
2.4. Egyéb vizsgálatok
A további megfelelő gyors szűrővizsgálatok közé tartozik az IF-teszt (lásd: a VI.A.5. szakaszt), a FISH-teszt (lásd a VI.A.7. szakaszt), az ELISA-teszt (lásd: a VI.A.8. szakaszt) és a PCR-teszt (lásd a VI.A.6. szakaszt).
3. Izolálási eljárás
a) Távolítsuk el a nyálkát vagy az elszíneződött szövetet tartalmazó részeket a burgonyagumó edénynyaláb gyűrűjéből, illetve a burgonya-, a paradicsom- vagy egyéb hervadó gazdanövények szárában lévő edénynyaláb-kötegekből. Szuszpendáljuk kis mennyiségű steril desztillált vízben vagy 50 mM foszfátpufferben (4. függelék), és hagyjuk 5-10 percig állni.
b) Készítsünk a szuszpenzióból tízes léptékű hígítássorozatot.
c) Vigyük át a szuszpenzió 50-100 µl-jét és a hígításokat egy általános táptalajra (NA, YPGA vagy SPA; lásd a 2. függeléket) és/vagy a Kelman-féle tetrazóliumos táptalajra (2. függelék) és/vagy egy validált szelektív táptalajra (pl. SMSA; lásd a 2. függeléket). Szélesztés bottal vagy kaccsal a megfelelő hígításos lemeztenyésztési technika használatával. Ha hasznosnak ítéljük, készítsünk külön lemezeket a 2. biovariánsba tartozó R. solanacearum higított sejtszuszpenziójával pozitív kontrollnak.
d) Inkubáljuk a lemezeket 2-6 napig 28 °C hőmérsékleten.
- Az általános táptalajon az R. solanacearum virulens izolátumai gyöngyházfényű, krémfehér, lapos, szabálytalan alakú és folyadékszerű telepeket hoznak létre, középpontjukban gyakran jellegzetes spirálokkal. Az R. solanacearum avirulens formái kicsi, kerek, nem folyékony, vajszerű telepeket képeznek, melyek teljes egészükben krémfehérek.
- A Kelman-féle tetrazóliumos táptalajon és az SMSA táptalajon a spirálok vérvörös színűek. A Ralstonia solanacearum avirulens formái kicsi, kerek, nem folyékony, vajszerű telepeket képeznek, melyek teljes egészükben mélyvörösek.
4. Az R. solanacearum Azonosítási vizsgálatai
Az R. solanacearum vélelmezett izolátumai azonosságának megerősítésére szolgáló vizsgálatok a VI.B. szakaszban kerülnek bemutatásra.
III. SZAKASZ
1. Részletes módszerek a Ralstonia solanacearum kimutatására és azonosítására tünetmentes burgonyagumó-mintákban
1.1. Mintaelőkészítés
Megjegyzés:
- A standard mintaméret 200 burgonyagumó vizsgálatonként. Intenzívebb mintavétel esetén több vizsgálatot kell elvégezni ekkora mintákon. Ha ennél több burgonyagumót tartalmaz a minta, az gátláshoz vagy nehezen értelmezhető eredményekhez vezet. Az eljárás azonban könnyen alkalmazható 200-nál kevesebb burgonyagumóból álló mintákra is, amennyiben kevesebb burgonyagumó áll rendelkezésre.
- Az alábbiakban leírt valamennyi kimutatási módszer validálása 200 burgonyagumóból álló minták vizsgálatán alapszik.
- Az alábbiakban leírt burgonyakivonat felhasználható a burgonya gyűrűs rothadás baktérium, a Clavibacter michiganensis subsp. sepedonicus kimutatására is.
A mintaelőkészítést megelőző, szabadon választható előkezelés:
a) Inkubáljuk a mintákat 25-30 °C-on két hétig a vizsgálat előtt az R. solanacearum populációk szaporodásának elősegítése érdekében.
b) Mossuk le a burgonyagumókat. Megfelelő fertőtlenítőszereket (a PCR-teszt alkalmazása esetén klórvegyületeket a kórokozó DNS-ek eltávolítása céljából) és mosószereket használjunk az egyes minták között. Levegőn szárítsuk meg a burgonyagumókat. Ez a lemosási eljárás különösen akkor hasznos (de nem kötelező), ha a minták földesek, és ha PCR-próbát vagy közvetlen izolálási eljárást kell alkalmazni.
1.1.1. Távolítsuk el tiszta, fertőtlenített szikével vagy gyümölcskéssel a burgonyagumó köldökrészén a héjat úgy, hogy az edénynyaláb-szövetek láthatóvá váljanak. Óvatosan vágjunk ki egy kis darabot az edénynyaláb-szövetből a köldökrészen, és tartsuk a nem edénynyaláb-szövet mennyiségét minimális szinten. (Lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Megjegyzés: Tegyük félre a feltételezett tüneteket mutató (rothadó) burgonyagumókat, és vizsgáljuk azokat külön.
Ha a köldökrészből vett darab eltávolítása során a barna rothadás alapvető feltételezett tünetei észlelésére kerül sor, akkor el kell végezni az adott burgonyagumó szemrevételezéses vizsgálatát, majd a köldökrész közelében elvágjuk a gumót. A feltételezett tüneteket mutató, elvágott gumókat szobahőmérsékleten kell tartani legalább 2 napig a parásodás lehetővé tétele érdekében, majd hűtőszekrényben tárolni (4-10 °C között) megfelelő növény-egészségügyi zárlati feltételek mellett. Minden burgonyagumót, beleértve a gyanús tüneteket mutatókat is, a III. melléklet szerint kell tárolni.
1.1.2. A köldökrészből vett darabokat még nem használt, becsukható és/vagy lezárható egyszer használatos tartályokban gyűjtsük össze (amennyiben a tartályok ismét felhasználásra kerülnek, akkor azokat alaposan ki kell tisztítani, és klórvegyületekkel fertőtleníteni kell). A köldökrészből vett darabokat lehetőleg azonnal fel kell dolgozni. Ha ez nem lehetséges, akkor azokat a tartályban kell tárolni, puffer hozzáadása nélkül, hűtött állapotban legfeljebb 72 órán át vagy szobahőmérsékleten legfeljebb 24 órán át vagy
dolgozzuk fel a köldökrészből vett darabokat a következő eljárások egyikével:
a) Töltsünk a darabokra megfelelő mennyiségű (mintegy 40 ml) kivonópuffert (4. függelék), és rázzuk rotációs rázógépen (50-100 fordulat/perc) 4 órán át 24 °C alatt, vagy 16-24 órán át hűtött állapotban.
b) Homogenizáljuk a darabokat megfelelő mennyiségű (mintegy 40 ml) kivonópufferrel (4. függelék) aprítógépben (pl. Waring vagy Ultra Thurax), vagy lezárt, egyszer használatos macerációs tasakban (pl. Stomacher vagy Bioreba, erős guage polietilén, 150 mm × 250 mm; sugárzással sterilizált) gumikalapáccsal vagy megfelelő zúzóberendezéssel (pl. Homex) történő összezúzás útján.
Megjegyzés: A minták keresztbe fertőződésének nagy a veszélye az aprítógépben történő homogenizálás esetén. Tegyünk óvintézkedéseket az aeroszol képződés és a kilöttyenés elkerülése érdekében a kivonási eljárás során. Biztosítsuk, hogy frissen sterilizált aprítókések és edények kerüljenek felhasználásra minden mintánál. A PCR-teszt elvégzésekor, kerüljük el a DNS-ek áthozatalát a tartályokon vagy a zúzóberendezésen. A PCR alkalmazásánál az egyszer használatos tasakokban történő összezúzás és egyszer használatos kémcsövek használata ajánlott.
1.1.3. Fejtsük le a felülúszó folyadékot. Ha nagyon zavaros, derítsük lassú centrifugálással (legfeljebb 180 g-vel, 10 percig, 4-10 °C közötti hőmérsékleten) vagy vákuumszűréssel (40-100 µm) a szűrőt további (~10 ml) kivonópufferrel átmosva.
1.1.4. Koncentráljuk a baktérium frakciót 7 000 g-vel 15 percig (vagy 10 000 g-vel 10 percig) tartó centrifugálással 4-10 °C közötti hőmérsékleten, és távolítsuk el a felülúszó folyadékot a pellet felkavarása nélkül.
1.1.5. Szuszpendáljuk újra a pelletet 1,5 ml pellet-pufferben (4. függelék). Használjunk 500 µl-t az R. solanacearum vizsgálatához, 500 µl-t a Clavibacter michiganensis subsp. sepedonicus-hoz és 500 µl-t referencia célokra. Adjunk steril glicerint, melynek végkoncentrációja 10-25 % (v/v), a referencia aliquot 500 µl-éhez és a fennmaradó vizsgálati aliquothoz, Vortex-szel keverjük össze, és tároljuk -16 és -4 °C között (hetekig) vagy -68 és -86 °C között (hónapokig). A vizsgálat során a vizsgálati aliquotokat 4-10 °C-on tartsuk.
A többszöri lefagyasztás és felengedés nem ajánlott.
Ha szükséges a kivonat szállítása, akkor biztosítsuk, hogy a szállítás hűtőtáskában történjen 24-48 órán belül.
1.1.6. Rendkívül fontos, hogy az összes R. solanacearum pozitív kontrollt és mintát külön kezeljük a fertőzés elkerülése érdekében. Ez vonatkozik az IF-lemezekre és minden vizsgálatra.
1.2. Vizsgálat
Lásd a folyamatábrát, valamint a vizsgálatok és az optimalizált protokollok leírását a vonatkozó függelékekben:
Szelektív izolálás (lásd a VI.A.4. szakaszt)
IF-teszt (lásd a VI.A.5. szakaszt)
PCR-teszt (lásd a VI.A.6. szakaszt)
FISH-teszt (lásd a VI.A.7. szakaszt)
ELISA-teszt (lásd a VI.A.8. szakaszt)
Biológiai vizsgálat (lásd a VI.A.9. szakaszt)
2. Részletes módszerek az R. solanacearum kimutatására és azonosítására tünetmentes burgonya-, paradicsom- vagy egyéb gazdanövény-mintákban
2.1. Mintaelőkészítés
Megjegyzés: A látens R. solanacearum populációk kimutatásához összetett minták vizsgálata ajánlott. Az eljárás könnyen alkalmazható a legfeljebb 200 szárdarabból álló összetett mintákra. Amennyiben vizsgálatokat végzünk, azoknak a vizsgálat alatt álló növénypopuláció statisztikailag reprezentatív mintáján kell alapulniuk.
2.1.1. Gyűjtsünk 1-2 cm-es szárdarabokat egy zárt és steril tartályban a következő mintavételi eljárásoknak megfelelően:
Paradicsompalánták a palántaneveldében: Tiszta, fertőtlenített késsel távolítsunk el mindegyik szár tövéből - közvetlenül a földfelszín felett - egy 1 cm-es darabot.
Szántóföldi vagy üvegházi paradicsomnövények: Tiszta, fertőtlenített késsel távolítsuk el mindegyik növény legalsó oldalhajtását úgy, hogy levágjuk azt közvetlenül a főszárba való becsatlakozási pont felett. Távolítsuk el a legalsó 1 cm-es darabot mindegyik oldalhajtásról.
Egyéb gazdanövények: Tiszta, fertőtlenített késsel vagy metszőollóval távolítsunk el egy 1 cm-es darabot mindegyik szár tövéből közvetlenül a földfelszín felett. Az S. dulcamara vagy más vízben növő gazdanövény esetében távolítsunk el 1-2 cm-es szakaszokat a víz alatti szárakból vagy vízi gyökerekkel rendelkező indákból.
Egy adott helyszínen végzett mintavétel esetén ajánlott a mintavételi helyenként minden egyes lehetséges gazda gyomnövény legalább 10 egyedéből álló statisztikailag reprezentatív minta vizsgálata. A kórokozó kimutatása késő tavasszal, nyáron és ősszel lesz a legmegbízhatóbb, bár a természetes fertőzések egész évben kimutathatók az évelő Solanum dulcamara-ban, amely vízfolyásokban nő. Az ismert gazdanövények közé tartoznak az árvakelésű burgonyanövények, a Solanum dulcamara, az S. nigrum, a Datura stramonium és a Solanaceae család más tagjai. További gazdanövények a Pelargonium fajok és a Portulaca oleracea. A következő európai gyomfajok potenciális befogadói lehetnek az R. solanacearum 2. biovariánsba/3. rasszba tartozó populációinak a gyökérben és/vagy a gyökérzónában speciális környezeti feltételek mellett: Atriplex hastata, Bidens pilosa, Cerastium glomeratum, Chenopodium album, Eupatorium cannabinum, Galinsoga parviflora, Ranunculus scleratus, Rorippa spp, Rumex spp., Silene alba, S. nutans., Tussilago farfarra és Urtica dioica.
Megjegyzés: A belső tünetekre (edénynyalábok elszíneződése, baktériumnyálka) irányuló szemrevételezéses vizsgálatot ebben a szakaszban lehet elvégezni. Tegyük félre a tüneteket mutató szárdarabokat, és vizsgáljuk azokat külön (lásd a II. szakaszt).
2.1.2. Fertőtlenítsük rövid ideig a szádarabokat 70 %-os etil-alkohollal, és itatóspapíron azonnal itassuk szárazra azokat. Majd dolgozzuk fel a szárdarabokat az alábbi eljárások egyikével:
a) Töltsünk a darabokra megfelelő mennyiségű (mintegy 40 ml) kivonópuffert (4. függelék), és rázzuk rotációs rázógépen (50-100 rpm) 4 órán át 24 °C alatt, vagy hűtötten 16-24 órán át, vagy
b) Azonnal dolgozzuk fel a darabokat erős macerációs tasakban (pl. Stomacher vagy Bioreba) történő összezúzás útján megfelelő mennyiségű kivonópuffer hozzáadásával (4. függelék) gumikalapács vagy megfelelő zúzóberendezés (pl. Homex) felhasználásával. Ha ez nem lehetséges, tároljuk a szárdarabokat hűtve legfeljebb 72 órán át, vagy legfeljebb 24 órán át szobahőmérsékleten.
2.1.3. Fejtsük le a felülúszó folyadékot 15 perces ülepítés után.
2.1.4. A kivonat további derítése vagy a baktérium frakció koncentrálása általában nem szükséges, de szűréssel és/vagy centrifugálással elérhető III.1.1.3-1.1.5. szakaszban leírtak szerint.
2.1.5. Osszuk a híg vagy koncentrált mintakivonatot két egyenlő részre. Az egyik felét tartsuk 4-10 °C között a vizsgálat során, a másik felét pedig tároljuk 10-25 % (v/v) steril glicerinben -16 és -24 °C között (hetekig) vagy -68 és -86 °C között (hónapokig), arra az esetre, ha további vizsgálatokat kell végezni.
2.2. Vizsgálat
Lásd a folyamatábrát, valamint a vizsgálatok és az optimalizált protokollok leírását a vonatkozó függelékekben:
Szelektív izoláció (lásd a VI.A.4. szakaszt)
IF-teszt (lásd a VI.A.5. szakaszt)
PCR-teszt (lásd a VI.A.6. szakaszt)
FISH-teszt (lásd a VI.A.7. szakaszt)
ELISA-teszt (lásd a VI.A.8. szakaszt)
Biológiai vizsgálat (lásd a VI.A.9. szakaszt)
IV. SZAKASZ
1. Az R. solanacearum vízben történő kimutatásának és azonosításának programja
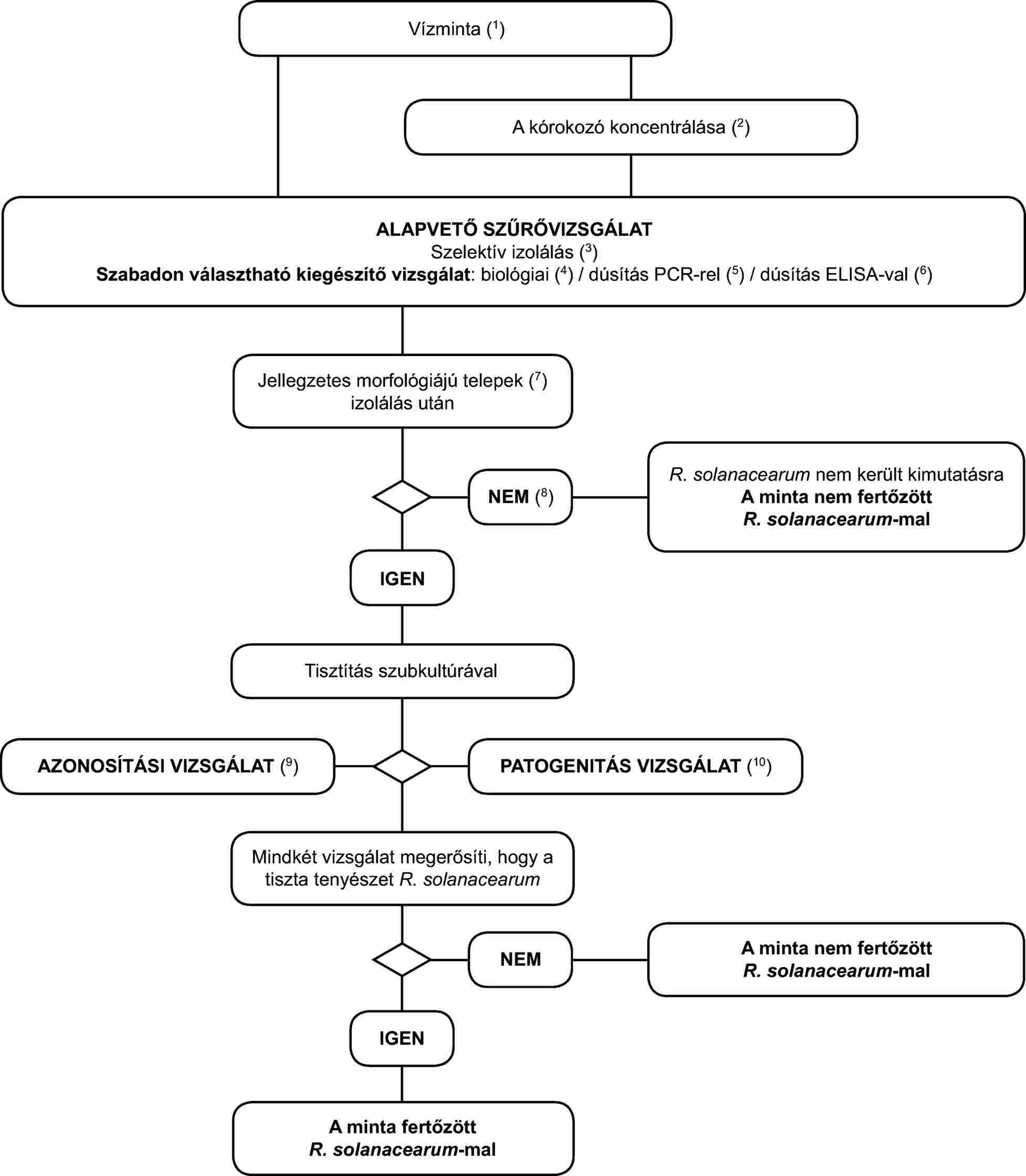

2. Az R. solanacearum vízben történő kimutatásának és azonosításának módszerei
Az alapelv
Az ebben a szakaszban leírt validált kimutatási módszer a kórokozó felszíni vizekből vett mintákban történő kimutatására alkalmazható, és ugyancsak alkalmazni lehet a burgonya-feldolgozásból vagy a szennyvízhálózatból származó szennyvízből vett minták vizsgálatára. Azt azonban fontos megjegyezni, hogy a kimutatás várt érzékenysége az anyagtól függően változni fog. Az izolálási vizsgálat érzékenységét befolyásolják a kompetitív szaprofita baktériumok populációi, amelyek általában sokkal népesebbek a burgonya-feldolgozásból és a szennyvízhálózatból származó szennyvízben, mint a felszíni vizekben. Mivel az alábbi módszerrel szemben literenként mintegy 103 sejt kimutatása az elvárás a felszíni vizek esetében, a kimutatás érzékenysége valószínűleg jelentősen alacsonyabb lesz a burgonya-feldolgozásból vagy a szennyvízhálózatból származó szennyvíz esetében. Ezért a szennyvizek vizsgálatát ajánlott valamilyen tisztítási eljárás (pl. ülepítés vagy szűrés) után végezni, melynek során csökken a szaprofita baktérium populációk száma. A vizsgálati módszer érzékenységének korlátait figyelembe kell venni a kapott negatív eredmények megbízhatóságának megállapításánál. Mivel ezt a módszert sikerrel használják a felméréseknél a kórokozó jelenlétének vagy hiányának felszíni vizekben történő kimutatására, a korlátaival tisztában kell lennünk, amikor a burgonya-feldolgozásból vagy szennyvízhálózatból származó szennyvizeken végzett hasonló felméréseknél alkalmazzuk.
2.1. Mintaelőkészítés
Megjegyzés:
- Az R. solanacearum felszíni vizekben történő kimutatása késő tavasszal, nyáron és ősszel a legmegbízhatóbb, amikor a vízhőmérséklet meghaladja a 15 °C-ot.
- A fent említett időszak különböző időpontjaiban a kijelölt mintavételi helyeken végzett ismételt mintavétel növeli a kimutatás megbízhatóságát a klimatikus ingadozás hatásainak csökkentése révén.
- Vegyük figyelembe a heves esőzések és a vízfolyás földrajzi adottságainak hatását a nagyarányú hígulási hatás kiküszöbölése érdekében, melynek következtében rejtve maradhat a kórokozó jelenléte.
- A gazdanövények közelében vegyünk mintát a felszíni vizekből, ha azok előfordulnak.
2.1.1. A kiválasztott mintavételi helyeken egyszer használatos, steril kémcsövekbe vagy üvegekbe gyűjtsük a vízmintákat, ha lehetséges, 30 cm-nél mélyebbről és a parttól számított 2 méteren belülről. A feldolgozóipari és a szennyvízhálózati szennyvizek esetében a szennyvízkibocsátás helyén gyűjtsük a mintákat. Az ajánlott mintaméret 500 ml mintavételi helyenként. Ha a kisebb mintákat részesítjük előnyben, akkor ajánlatos mintavételi helyenként legalább 3 alkalommal mintát venni, és az egyes minták 2 legalább 30 ml-es megismételt részmintából álljanak. Az intenzív felméréseknél legalább 3 mintavételi helyet jelöljünk ki 3 kilométerenként a vízfolyás mentén, és gondoskodjunk arról, hogy a vízfolyásba ömlő mellékfolyókban is történjen mintavételezés.
2.1.2. A mintákat hűvösben és sötétben (4-10 °C) szállítsuk, és 24 órán belül vizsgáljuk meg
2.1.3. Ha szükséges, a baktériumfrakciót koncentrálhatjuk az alábbi módszerek egyikével:
a) Centrifugáljunk 30-50 ml részmintát 10 000 g-vel 10 percig (vagy 7 000 g-vel 15 percig) lehetőleg 4-10 °C között, távolítsuk el a felülúszó folyadékot, szuszpendáljuk újra a pelletet 1 ml pellet-pufferben (4. függelék).
b) Membránszűrés (minimális pórusméret 0,45 µm), majd a szűrő kimosása 5-10 ml pelletpufferben, és a mosástermékek megtartása. Ez a módszer alkalmazható kevés szaprofitát tartalmazó nagy mennyiségű víznél.
A koncentrálás rendszerint nem ajánlott a burgonya-feldolgozásból vagy a szennyvízhálózatból származó szennyvízminták esetében, mivel a kompetitív szaprofita baktériumok megnövekedett populációi meg fogják gátolni a R. solanacearum kimutatását.
2.2. Vizsgálat
Lásd a folyamatábrát, valamint a vizsgálatok leírását a vonatkozó függelékekben.
V. SZAKASZ
1. Az R. solanacearum talajban történő kimutatásának és azonosításának programja

2. Az R. solanacearum talajban történő kimutatásának és azonosításának módszerei
Az alapelvek
Az ebben a szakaszban leírt validált kimutatási módszer a kórokozó talajmintákban történő kimutatásánál alkalmazható, de ugyancsak alkalmazni lehet a szilárd burgonya-feldolgozási hulladék vagy a szennyvíziszap vizsgálatára. Meg kell azonban jegyezni, hogy ezek a módszerek nem kellően érzékenyek ahhoz, hogy garantálják az alacsony egyedszámú és/vagy szabálytalan eloszlású R. solanacearum populációk kimutatását, amelyek előfordulhatnak ezen anyagok természetes úton fertőződött mintáiban.
A vizsgálati módszer érzékenységének korlátait figyelembe kell venni a kapott negatív eredmények megbízhatóságának megállapításánál, és akkor is, amikor a kórokozó jelenlétének vagy hiányának talajban vagy szennyvíziszapban történő kimutatására használják. A kórokozó jelenlétének a szántóföld talajában történő kimutatására a legmegbízhatóbb vizsgálati módszer az, hogy elültetünk egy fogékony gazdanövényt, és figyeljük rajta a fertőzés megjelenését, de még ezzel a módszerrel sem lehet kimutatni a kismértékű fertőzéseket.
2.1. Mintaelőkészítés
2.1.1. A szántóföld talajából történő mintavételnek a fonalférgek kimutatása céljából történő mintavételnél alkalmazott standard elvek szerint kell történnie. Gyűjtsünk mintánként 0,5-1 kg talajt 60 helyről 0,3 hektáronként 10-20 cm mélyről (vagy egy 7x7 méteres négyzethálóban). Ha feltételezzük a kórokozó előfordulását, akkor növeljük a gyűjtőhelyek számát 120-ra 0,3 hektáronként. Tartsuk a mintákat 12-15 °C-on a vizsgálat előtt. A burgonya-feldolgozásból és a szennyvízhálózatból származó szennyvíziszapokból történő mintavétel esetén összesen 1 kg-nyi mintát vegyünk a vizsgálandó szennyvíziszap teljes mennyiségét reprezentáló helyeken. Minden mintát jól keverjünk össze a vizsgálat megkezdése előtt.
2.1.2. Oszlassuk szét a 10-25 g talajt vagy szennyvíziszapot tartalmazó részmintákat rotációs rázógépen (250 fordulat/perc) 60-150 ml kivonópufferben (4. függelék) 2 órán át. Ha szükséges, 0,02 % steril Tween-20 és 10-20 g steril kavics hozzáadásával elősegíthetjük a szétoszlatást.
2.1.3. Tartsuk a szuszpenziót 4 °C-on a vizsgálat során.
2.2. Vizsgálat
Lásd a folyamatábrát, valamint a vizsgálatok leírását a vonatkozó függelékekben.
VI. SZAKASZ
OPTIMALIZÁLT PROTOKOLLOK AZ R. SOLANACEARUM KIMUTATÁSÁRA ÉS AZONOSÍTÁSÁRA
A. DIAGNOSZTIKAI ÉS KIMUTATÁSI VIZSGÁLATOK
1. Áramlásvizsgálat a szárban
A R. solanacearum hervadó burgonya-, paradicsom- vagy egyéb gazdanövények szárában való jelenlétét a következő egyszerű valószínűsítő vizsgálattal határozhatjuk meg: vágjuk el a szárat közvetlenül a talajszint felett. Állítsuk a metszéslapot egy tiszta vízzel teli kémcsőbe. Néhány perc múlva megfigyelhető a baktériumnyálka-fonalak jellegzetes spontán kiáramlása az átvágott edénynyaláb kötegekből.
2. Poli-β-hidroxibutirát szemcsék kimutatása
1. Készítsünk kenetet a fertőzött szövetből vagy a YPGA vagy SPA táptalajon (2. függelék) nyert 48 órás tenyészetből származó baktériumnyálkából egy tárgylemezen.
2. Készítsünk pozitív kontrollkeneteket az R. solanacearum valamely 2. biovariánsba tartozó törzséből, és - ha ezt hasznosnak véljük - egy negatív kontrollkenetet egy közismert PHB-negatív törzsből.
3. Hagyjuk levegőn megszáradni, majd a tárgylemezek alsó felületét gyorsan vigyük át láng felett, hogy a kenet rögzüljön.
4. Festékkészítés níluskékkel vagy szudánfeketével, és mikroszkópos megfigyelés az alábbiakban leírtak szerint:
A níluskék vizsgálat:
a) Öntsünk minden tárgylemezre níluskék »A« 1 %-os vizes oldatot, és 10 percig inkubáljuk 55 °C-on.
b) Öntsük le a festékoldatot. Mossuk le gyengén folyó csapvízzel. Távolítsuk el a felesleges vizet itatóspapírral.
c) Öntsük le kenetet ecetsav 8 %-os vizes oldatával, és inkubáljuk egy percig szobahőmérsékleten.
d) Gyorsan öblítsük le gyengén folyó csapvízzel. Távolítsuk el a felesleges vizet itatóspapírral.
e) Nedvesítsük meg újra egy csepp vízzel, és tegyünk rá fedőlemezt.
f) Vizsgáljuk meg a megfestett kenetet epifluoreszcens mikroszkóppal 450 nm hullámhosszon, olajimmerzió mellett, 600-1 000-szeres nagyításnál, olaj- vagy vízimmerziós tárgylencsével.
g) Figyeljük meg a PHB-szemcsék élénk narancsszínű fluoreszkálását. Tanulmányozzuk átbocsátott normál fénynél is, hogy megbizonyosodjunk arról, hogy a szemcsék intracellulárisak, és a sejtmorfológia az R. solanacearum-ra jellemző.
A szudánfekete vizsgálat:
a) Öntsünk minden tárgylemezre 0,3 %-os szudánfekete »B« 70 %-os etil-alkoholos oldatát, és inkubáljuk 10 percig szobahőmérsékleten.
b) Öntsük le a festékoldatot, és öblítsük le kissé csapvízzel, majd a felesleges vizet itatóspapírral távolítsuk el.
c) Merítsük a tárgylemezeket rövid időre xilolba, és itassuk szárazra itatóspapírral. Vigyázat: a xilol veszélyes anyag, tegyük meg a szükséges óvintézkedéseket, és dolgozzunk vegyifülkében!
d) Öntsünk a tárgylemezekre 0,5 %-os (m/v) vizes szafranin oldatot, és hagyjuk 10 másodpercig szobahőmérsékleten. Vigyázat: a szafranin veszélyes anyag, tegyük meg a szükséges óvintézkedéseket, és dolgozzunk vegyifülkében!
e) Öblítsük le gyengén folyó csapvízzel, itassuk szárazra szűrőpapíron, és tegyünk rá fedőlemezt.
f) Tanulmányozzuk a megfestett keneteket átbocsátott fénnyel működő fénymikroszkóppal, olajimmerzió mellett, 1 000-szeres nagyításnál, olajimmerziós tárgylencsével.
g) Figyeljük meg, hogy a PHB-szemcsék az R. solanacearum sejtekben kékesfeketére színeződnek, a sejtfal pedig rózsaszínűre festődik.
3. Szerológiai agglutinációs vizsgálat
Az R. solanacearum sejtek agglutinációját baktériumnyálkában vagy tüneteket mutató szövetek kivonataiban legjobban validált ellenanyagok (lásd a 3. függeléket) felhasználásával figyelhetjük meg, melyek megfelelő színes markerrel vannak megjelölve, mint például vörös Staphylococcus aureus sejtekkel vagy színes latex szemcsékkel. A kereskedelmi forgalomban kapható készlet (lásd a 3. függeléket) használata esetén, kövessük a gyártó útmutatásait. Egyébként végezzük el a következő eljárást:
a) Keverjük össze a megjelölt ellenanyag szuszpenziójának cseppjeit a baktériumnyálkával (mindegyik hozzávetőlegesen 5 µl) több mintahelyes vizsgálati lemezek ablakaiban.
b) Készítsünk pozitív és negatív kontrollokat az R. solanacearum 2. biovariánsába tartozó törzs és egy heterológ törzs szuszpenzióinak a felhasználásával.
c) Figyeljük meg az agglutinációt a pozitív mintákban 15 másodpercig tartó enyhe keverés után.
4. Szelektív izolálás
4.1. Szelektív lemeztenyésztés
Megjegyzés: Mielőtt először használjuk ezt a módszert, végezzünk előzetes vizsgálatokat, hogy biztosítsuk a korábbi vizsgálatokban negatívnak bizonyult minták kivonataihoz adott 103-104/ml R. solanacearum telepalkotó egység kimutatásának reprodukálhatóságát.
Használjunk megfelelően validált szelektív táptalajt, mint például a SMSA-t (Elphinstone et al. által módosított, 1996; lásd a 2. függeléket).
Ügyelni kell az R. solanacearum megkülönböztetésére a táptalajon telepeket létrehozni képes egyéb baktériumoktól. Továbbá az R. solanacearum telepei mutathatnak atipikus morfológiát, ha a táptalaj lemezek túlzsúfoltak, vagy antagonisztikus baktériumok is jelen vannak. Amennyiben a verseny vagy az antagonizmus hatásai gyaníthatók, a mintát újra kell vizsgálni egy másik vizsgálati eljárással.
A legmagasabb kimutatási érzékenység ezzel a módszerrel akkor várható, ha frissen készített mintakivonatokat használunk. A módszer azonban alkalmazható olyan mintáknál is, amelyeket glicerinben tároltak -68és-86 °C között.
Pozitív kontroll céljára készítsünk tízes léptékű hígításokat egy virulens, 2. biovariánsba tartozó R. solanacearum törzs (pl. NCPPB 4156 = PD 2762 = CFBP 3857) 106 cfu/ml szuszpenziójából. A fertőzés bármely lehetőségének kiküszöbölése érdekében, a pozitív kontrollokat a vizsgálandó mintáktól teljesen elkülönítve készítsük el.
A szelektív táptalaj minden egyes újonnan készített tétele esetében meg kell vizsgálni, hogy az megfelel-e a kórokozó szaporodásához, mielőtt a rutin minták vizsgálatánál felhasználásra kerülne.
A kontrollanyagot a mintával/mintákkal azonos módon vizsgáljuk.
4.1.1. Használjunk megfelelő hígításos lemeztenyésztési technikát annak biztosítása érdekében, hogy a háttérben lévő szaprofita telepalkotó populációk kihígítódjanak. Lemezenként szélesszünk 50-100 µl-t a mintakivonatból és az egyes hígításokból.
4.1.2. Inkubáljuk a lemezeket 28 °C-on. Olvassuk le a lemezeket 48 óra elteltével, majd azt követően naponta 6 napon át. A jellemző R. solanacearum telepek SMSA-táptalajon tejfehérek, laposak, szabálytalanok és elfolyósodottak, és 3 napos inkubáció után a közepükön a rózsaszíntől a vérvörösig terjedő elszíneződés alakul ki, melynek belsejében csíkok és spirálok mutatkoznak. (Lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
Megjegyzés: Néha kifejlődnek ezen a táptalajon az R. solanacearum atipikus telepei. Ezek kicsik, kerekek, színük teljesen vörös és nincsenek elfolyósodva, vagy csak részben elfolyósodottak, és ezért nehéz megkülönböztetni azokat a szaprofita telepalkotó baktériumoktól.
4.1.3. Tisztítsuk a vélelmezett R. solanacearum telepeket szélesztés vagy hígításos lemeztenyésztés után általános táptalajon, hogy izolált telepeket kapjunk (lásd a 2. függeléket).
4.1.4. Tároljuk a tenyészeteket rövid távon steril vízben (pH 6-8, klórmentes) szobahőmérsékleten és sötétben, vagy hosszú távon megfelelő mélyhűtéstől védő közegben -68 és -86 °C között vagy liofilizálva.
4.1.5. Azonosítsuk a vélelmezett tenyészeteket (lásd a VI.B. szakaszt), és végezzük el a patogenitás vizsgálatot (lásd a VI.C. szakaszt).
A szelektív lemeztenyésztési vizsgálat eredményeinek kiértékelése
A szelektív lemeztenyésztési vizsgálat negatív, ha baktériumtelepek nem figyelhetők meg 6 nap után, vagy ha az R. solanacearum-ra jellemző vélelmezett telepek nem kerülnek izolálásra, feltéve, hogy a más baktériumok általi verseny vagy antagonizmus okozta gátlás gyanúja nem merül fel, és hogy, jellemző R. solanacearum telepek kerülnek izolálásra a pozitív kontrollokban.
A szelektív lemeztenyésztési vizsgálat pozitív, ha vélelmezett R. solanacearum telepek kerülnek izolálásra.
4.2. Dúsítási eljárás
Használjunk validált dúsítási táptalajt, mint például módosított Wilbrink-táplevest (lásd a 2. függeléket).
Az eljárás az R. solanacearum populációk szelektív növesztésére használható a mintakivonatokban, valamint a kimutatás érzékenységének növelésére. Az eljárás a PCR-reakció gátlóit is hatékonyan hígítja (1:100). Meg kell jegyezni azonban, hogy az R. solanacearum dúsítása sikertelen lehet a szaprofita szervezetek által okozott verseny vagy antagonizmus következtében, melyek dúsulása gyakran párhuzamosan bekövetkezik. Emiatt az R. solanacearum izolálása a dúsított tápleves tenyészetekből nehézkes lehet. Továbbá, mivel a szerológiailag rokon szaprofiták populációi növekedhetnek, a specifikus monoklonális ellenanyagok használata ajánlott a poliklonális ellenanyagokkal szemben, amennyiben ELISA-teszt alkalmazására kerül sor.
4.2.1. Dúsítási PCR céljára vigyünk át 100 µl mintakivonatot 10 ml dúsítási táplevesbe (2. függelék), melyből korábban aliquot részeket mértünk DNS-mentes kémcsövekbe vagy lombikokba. Dúsítási ELISA céljára nagyobb arányban tartalmazhat mintakivonatot a tápleves (pl. 100 µl mintakivonat 1,0 ml dúsítási táplevesben).
4.2.2. Inkubáljuk 72 órán át 27 és 30 °C között rázótenyészetben vagy statikus tenyészetben, a kupakokat lazán illesztve a levegőzés biztosítása érdekében.
4.2.3. Jól keverjük össze mielőtt az ELISA- vagy a PCR-vizsgálatoknál felhasználjuk.
4.2.4. A dúsított táplevest ugyanúgy kezeljük, mint a mintá(ka)t a fenti vizsgálatokban.
Megjegyzés: Ha az R. solanacearum dúsulásának a gátlása várható - bizonyos kompetitív szaprofita baktériumok népes populációinak következtében - akkor a mintakivonatok bármilyen centrifugálás vagy egyéb koncentrálás előtti dúsítása jobb eredményeket adhat.
5. IF-teszt
Az alapelv
Az IF-teszt elsőszámú szűrővizsgálatként történő használata ajánlott, mivel bizonyított erőteljessége a szükséges küszöbértékek elérésében.
Amennyiben az IF-tesztet használjuk elsőszámú szűrővizsgálatként, és az IF eredménye pozitív, második szűrővizsgálatként el kell végezni az izolálási, a PCR- vagy a FISH-vizsgálatot. Amennyiben az IF-tesztet második szűrővizsgálatként használjuk, és az IF eredménye pozitív, további vizsgálatra van szükség a folyamatábrának megfelelően az elemzés befejezéséhez.
Megjegyzés: Az R. solanacearum validált forrásból származó ellenanyagait használjuk (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main). Ajánlott a titert minden egyes új ellenanyag tételre meghatározni. A titer úgy van definiálva, hogy az a legmagasabb hígítás, melyen optimális reakció megy végbe az R. solanacearum homológ törzsének 105-106 sejt/ml-es szuszpenziója vizsgálatánál a megfelelő fluoreszcein-izotiocianát (FITC) konjugátumnak a gyártó ajánlásai szerint történő felhasználása esetén. A validált poliklonális antiszérumok mindegyike legalább 1:2 000-es IF-titerű volt. A vizsgálat során az ellenanyagokat a titerhez közeli vagy az azzal megegyező munkahígítás(ok)ban kell használni.
A vizsgálatot frissen készített mintakivonatokon kell elvégezni. Szükség esetén sikeresen elvégezhető -68 és -86 °C között glicerin alatt tárolt kivonatokon. A glicerin 1 ml pellet-puffer hozzáadásával (4. függelék) eltávolítható a mintáról, újracentrifugálás 15 percen át 7 000 g-vel, és újraszuszpendálás azonos térfogatú pellet-pufferben. Ez gyakran nem szükséges, különösen, ha a mintalemezeken a mintákat láng segítségével rögzítjük.
Készítsünk külön pozitív kontroll-lemezeket a homológ törzsből vagy az R. solanacearum bármely más referenciatörzséből, burgonyakivonatban - a 3. B. függelékben leírtak szerint - és szabadon választhatóan pufferben szuszpendálva.
Természetes úton fertőződött (liofilizálással vagy -16 és -24 °C közötti fagyasztással fenntartott) szövetet kell használni - amennyiben lehetséges - hasonló kontrollként ugyanazon a lemezen.
Negatív kontrollként olyan mintakivonat aliquot térfogatait lehet használni, melynek vizsgálata az R. solanacearum-ra nézve negatív eredményt hozott.
Az ehhez a vizsgálathoz rendelkezésre álló standardizált pozitív és negatív kontrollanyagok felsorolása a 3. függelékben található.
Használjunk több mintahelyes tárgylemezeket lehetőleg 10, legalább 6 mm átmérőjű ablakkal.
A kontrollanyagot a mintával/mintákkal azonos módon vizsgáljuk.
5.1. A tesztlemezeket a következő eljárások egyikével készítsük el:
i. Viszonylag kevés keményítő-üledéket tartalmazó pelletek esetén:
Pipettázzunk egy kimért állandó térfogatot (15 µl megfelelő a 6 mm-es ablakátmérőhöz - nagyobb ablakokhoz használjunk arányosan nagyobb térfogatot) az újraszuszpendált burgonyapellet 1/100 hígításából az első ablakra. Ezután pipettázzunk hasonló térfogatot a hígítatlan pelletből (1/1) a sor fennmaradó ablakaira. A második sor használható ismétlésként vagy egy második mintaként, amint azt az 1. ábra mutatja.
ii. Egyéb pelletek esetén:
Készítsünk tízes hígítási sorozatot (1/10, 1/100) az újraszuszpendált pelletből pelletpufferben. Pipettázzunk egy kimért állandó térfogatot (15 µl megfelelő a 6 mm-es ablakátmérőhöz - nagyobb ablakokhoz használjunk arányosan nagyobb térfogatot) az újraszuszpendált pelletből és mindegyik hígításból az ablakok egy sorára. A második sor használható ismétlésként vagy egy második mintaként, amint azt a 2. ábra mutatja.
5.2. Szárítsuk a cseppeket szobahőmérsékleten vagy 40-45 °C-os hőmérsékletig történő melegítéssel. Rögzítsük a baktériumsejteket a lemezhez hevítéssel (15 percig 60 °C-on), lánggal vagy 95 %-os etil-alkohollal, vagy az ellenanyagok szállítójának specifikus útmutatása szerint.
Szükség esetén a rögzített lemezeket ezután egy kiszárított dobozban fagyasztva lehet tárolni a szükséges kis ideig (legfeljebb 3 hónapig) a további vizsgálatok elvégzését megelőzően.
5.3. IF-eljárás
i. Az 5.1. i. pontban leírt tesztlemez-készítési eljárás szerint:
Készítsünk egy sorozatot a kétszeres hígításokból. Az első mintahely tartalmazza a titer 1/2-ét (T/2), a többi a titer 1/4-ét (T/4), a titer 1/2-ét (T/2), a titert (T) és a titer kétszeresét (2T).
ii. Az 5.1. ii. pontban leírt tesztlemez-készítési eljárás szerint:
Készítsük el az ellenanyag munkahígítását (WD) IF-pufferben. A munkahígítás befolyásolja a specifikusságot.
1. ábra A tesztlemez elkészítése az 5.1. i. és az 5.3. i. pont szerint
| Az újraszuszpendált pellet hígításai | |||||||
| 1/100 | 1/1 | 1/1 | 1/1 | 1/1 | | Az újraszuszpendált pellet hígításai | |
| (T = titer) | T/2 | T/4 | T/2 | T | 2T | | Az antiszérum/ellenanyag kétszeres hígításai |
| 1. minta | [Kép #1] | [Kép #2] | [Kép #3] | [Kép #4] | [Kép #5] | ||
| 1 | 2 | 3 | 4 | 5 | |||
| Az 1. minta ismétlése vagy 2. minta | [Kép #6] | [Kép #7] | [Kép #8] | [Kép #9] | [Kép #10] | ||
| 6 | 7 | 8 | 9 | 10 | |||

Kép #1

Kép #2

Kép #3

Kép #4

Kép #5

Kép #6

Kép #7

Kép #8

Kép #9

Kép #10
2. ábra A tesztlemez elkészítése az 5.1. ii. és az 5.3. ii. pont szerint
| Az antiszérum/ellenanyag munkahígítása | |||||||
| 1/1 | 1/10 | 1/100 | üres | üres | | Az újra-szuszpendált pellet tízes hígítása | |
| 1. minta | [Kép #11] | [Kép #12] | [Kép #13] | [Kép #14] | [Kép #15] | ||
| 1 | 2 | 3 | 4 | 5 | |||
| Az 1. minta ismétlése vagy 2. minta | [Kép #16] | [Kép #17] | [Kép #18] | [Kép #19] | [Kép #20] | ||
| 6 | 7 | 8 | 9 | 10 | |||

Kép #11

Kép #12

Kép #13

Kép #14

Kép #15

Kép #16

Kép #17

Kép #18

Kép #19

Kép #20
5.3.1. Rendezzük el a tesztlemezeket nedves itatóspapíron. Borítsuk a tesztablakokat teljesen az ellenanyag hígításával (hígításaival). Az ablakokra felvitt ellenanyag térfogatának legalább akkorának kell lennie, mint az alkalmazott kivonat térfogata.
A következő eljárást abban az esetben kell elvégezni, ha az ellenanyagok szállítója nem szolgáltatott specifikus útmutatásokat:
5.3.2. Lefedve inkubáljuk a tesztlemezeket nedves papíron 30 percig szobahőmérsékleten (18-25 °C).
5.3.3. Rázzuk le a cseppeket a tesztlemezekről, és gondosan öblítsük le azokat IF-pufferrel. Alámerítve mossuk 5 percig IF-puffer-Tween-ben (4. függelék), és ezt követően IF-pufferben. Kerüljük el az aeroszolok vagy cseppek átvitelét, ami keresztbefertőződéshez vezethet. Gondosan távolítsuk el a felesleges nedvességet gyengéd felitatással.
5.3.4. Rendezzük el a tesztlemezeket nedves itatóspapíron. Borítsuk a tesztablakokat a FITC konjugátumnak a titer meghatározásához használt hígításával. Az ablakokra felvitt konjugátum térfogatának meg kell egyeznie az alkalmazott ellenanyag térfogatával.
5.3.5. Lefedve inkubáljuk a tesztlemezeket nedves papíron 30 percig szobahőmérsékleten (18-25 °C).
5.3.6. Rázzuk le a konjugátumcseppeket a tesztlemezről. Öblítsük és mossuk el a korábbiak szerint (5.3.3.).
Gondosan távolítsuk el a felesleges vizet.
5.3.7. Pipettázzunk 5-10 µl 0,1 M foszfátpufferes glicerint (3. függelék) vagy valamilyen kereskedelmi forgalomban kapható »montírozót« minden egyes ablakra, és helyezzünk fel fedőlemezt.
5.4. Az IF-teszt leolvasása:
5.4.1. Tanulmányozzuk a tesztlemezeket epifluoreszcens mikroszkóppal az FITC gerjesztésére alkalmas szűrőkkel, víz- vagy olajimmerzió mellett, 500-1 000-szeres nagyításban. Alaposan vegyük szemügyre az ablakokat két egymásra merőleges átmérőjük és a kerületük mentén. Azon minták esetében, amelyekben egyáltalán nem vagy csak kis számban mutatkoznak sejtek, legalább 40 mikroszkóp látómezőt vizsgáljunk meg.
Először a pozitív kontroll-lemezt ellenőrizzük. A sejteknek fényesen kell fluoreszkálniuk, és teljes mértékű festődést kell mutatniuk a meghatározott ellenanyag titeren vagy a munkahígításon. Az IF-próbát (VI.A.5. szakasz) meg kell ismételni, ha a festődés rendellenes.
5.4.2. Figyeljük meg az R. solanacearum jellegzetes morfológiájával rendelkező, fényesen fluoreszkáló sejteket a tesztlemezek tesztablakaiban (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main). A fluoreszcencia intenzitásának meg kell egyeznie a pozitív kontroll-törzs által ugyanazon ellenanyag-hígításnál adottal. A nem teljesen festődött vagy gyengén fluoreszkáló sejteket figyelmen kívül kell hagyni.
Ha bármilyen fertőzés gyanúja felmerül, a vizsgálatot meg kell ismételni. Ilyen eset lehet, amikor egy tételben minden tesztlemez pozitív sejteket mutat a puffer fertőződésének következtében, vagy amikor pozitív sejtekre bukkanunk (a tesztablakokon kívül) a tesztlemez bevonatán.
5.4.3. Sok olyan probléma létezik, amely az immunfluoreszcenciás vizsgálat specifikusságából adódik. Az atipikus morfológiájú fluoreszkáló sejtek háttérpopulációi és a keresztbe reagáló szaprofita baktériumok, melyek mérete és morfológiája hasonló az R. solanacearum-éhoz, valószínűleg előfordulnak a burgonyagumó köldökrészéből vett darabokból és a szár darabjaiból készített pelletben.
5.4.4. Csak a jellemző méretű és morfológiájú, az ellenanyagok titerén vagy munkahígításán fluoreszkáló sejteket vegyük figyelembe, ahogy az 5.3. pontnál.
5.4.5. Az IF eredményének kiértékelése:
i. Ha találunk jellegzetes morfológiájú, fényesen fluoreszkáló sejteket, akkor határozzuk meg a mikroszkóp látómezejébe eső jellemző sejtek számának középértékét, és számítsuk ki az újraszuszpendált pellet 1 ml-ében lévő jellemző sejtek számát (5. függelék).
Az IF-teszt eredménye pozitív azon minták esetében, amelyek 1 ml újraszuszpendált pelletben legalább 5x103 jellemző sejtet tartalmaznak. Az ilyen minta potenciálisan fertőzöttnek minősül, és további vizsgálatok elvégzése szükséges.
ii. Az IF-teszt eredménye negatív azon minták esetében, amelyek 1 ml újraszuszpendált pelletben kevesebb, mint 5x103 sejtet tartalmaznak, és az ilyen minta negatívnak minősül. További vizsgálatok elvégzése nem szükséges.
6. PCR-teszt
Az alapelvek
Amennyiben a PCR-tesztet elsőszámú szűrővizsgálatként használjuk, és pozitívnak bizonyul, akkor el kell végezni az izolálási vizsgálatot vagy az IF-et második, kötelező szűrővizsgálatként. Amennyiben PCR-t második szűrővizsgálatként használunk, és pozitívnak bizonyul, további vizsgálatra van szükség a folyamatábrának megfelelően a diagnosztizálás befejezéséhez.
E módszer elsőszámú szűrővizsgálatként történő teljes körű felhasználása csak akkor ajánlott, ha a szükséges specifikus szakmai ismeretek elsajátításra kerültek.
Megjegyzés: Az e módszerrel végzett előzetes vizsgálatnak lehetővé kell lennie a korábbi vizsgálatok szerint negatív mintakivonatokhoz adott 103-104/ml R. solanacearum sejt reprodukálható kimutatását. Optimalizálási kísérletekre lehet szükség a maximális érzékenység és specifikusság eléréséhez minden laboratóriumban.
Használjunk validált PCR-reagenseket és protokollokat (lásd a 6. függeléket). Lehetőleg belső ellenőrzésű módszert válasszunk.
Tegyük meg a megfelelő óvintézkedéseket annak érdekében, hogy elkerüljük a minta megfertőződését a cél DNS-sel. A PCR-próbát gyakorlott technikusoknak kell végezniük erre szolgáló molekuláris biológiai laboratóriumokban, hogy minimalizáljuk a cél DNS-sel való fertőződés veszélyét.
A negatív kontrollokat (DNS kivonási és PCR eljárásokra) mindig úgy kell kezelni, mint végső mintákat az eljárás során, hogy nyilvánvaló legyen, vajon történt-e DNS-átvitel.
A következő negatív kontrollokat kell alkalmazni a PCR-próbánál:
- Mintakivonat, amelyet előzőleg megvizsgáltak és az R. solanacearum-ra negatívnak bizonyult,
- Puffer kontrollok, amelyeket a baktérium és a DNS-mintából történő kivonására használnak,
- PCR-reakcióelegy.
A következő pozitív kontrollokat kell alkalmazni:
- Aliquot térfogatok az újraszuszpendált pelletből, melyhez R. solanacearum került hozzáadásra (elkészítését lásd a 3.B. függelékben).
- Egy virulens izolátumból származó 106/ml R. solanacearum sejt szuszpenziója vízben (pl. NCPPB 4156 = PD 2762 = CFBP 3857; lásd a 3.B. függeléket).
- Ha lehetséges, használjunk a pozitív kontroll mintákból származó DNS-t is a PCR elvégzése során.
A lehetséges fertőzések elkerülése érdekében a pozitív kontrollokat a vizsgálandó mintáktól különálló környezetben készítsük el.
A mintakivonatok amennyire csak lehetséges legyenek mentesek a talajtól. Ezért ajánlatos lehet megmosott burgonyából készíteni a kivonatokat a PCR-protokollok alkalmazásakor.
Az ehhez a vizsgálathoz használható standardizált pozitív és negatív kontrollok felsorolása a 3. függelékben található.
6.1. DNS-tisztítási módszerek
Használjuk a fentiekben leírt pozitív és negatív kontrollmintákat (lásd a 3. függeléket).
Vizsgáljuk a kontrollanyagot a mintával/mintákkal azonos módon.
Különféle módszerek állnak rendelkezésre a cél DNS megtisztítására a komplex minta szubsztrátumoktól, melyek eltávolítják a PCR és más enzimatikus reakciók inhibitorait, és koncentrálják a cél DNS-t a mintakivonatban. A következő módszert optimalizálták a 6. függelékben bemutatott validált PCR módszereknél történő felhasználásra.
a) A Pastrik-féle módszer (2000)
1. Pipettázzunk 220 µl lízis-puffert (100 mM NaCl, 10 mM tris-HCl [pH 8,0], 1 mM EDTA [pH 8,0]) egy 1,5 ml-es Eppendorf-csőbe.
2. Adjunk hozzá 100 µl mintakivonatot, és helyezzük egy hevítő blokkba vagy vízfürdőbe 95 °C-ra 10 percig.
3. Tegyük a csövet jégre 5 percre.
4. Adjunk hozzá 80 µl lizozim törzsoldatot (50 mg/ml lizozim 10 mM-os tris-HCl-ben, pH 8,0), és inkubáljuk 37 °C-on 30 percig.
5. Adjunk hozzá 220 µl Easy DNA® A oldatot (Invitrogen), vortex-szel jól keverjük össze, és inkubáljuk 65 °C-on 30 percig.
6. Adjunk hozzá 100 µl Easy DNA® B oldatot (Invitrogen), erőteljesen vortex-szeljük, amíg a csapadék már szabadon mozog a csőben, és a minta egyenletesen viszkózus lesz.
7. Adjunk hozzá 500 µl kloroformot, és vortex-szeljük, amíg a viszkozitás csökken, és az elegy homogénné válik.
8. Centrifugáljuk 15 000 g-vel 20 percig 4 °C-on, hogy a fázisok elkülönüljenek, és kialakuljon az interfázis.
9. Vigyük át a felső fázist egy új Eppendorf-csőbe.
10. Adjunk hozzá 1 ml 100 %-os etil-alkoholt (-20 °C) rövid ideig Vortex-szeljük, és inkubáljuk jégen 10 percig.
11. Centrifugáljuk 15 000 g-vel 20 percig 4 °C-on, és távolítsuk el az etil-alkoholt a pelletből.
12. Adjunk hozzá 500 µl 80 %-os etil-alkoholt (-20 °C), és keverjük össze a cső felfordításával.
13. Centrifugáljuk 15 000 g-vel 10 percig 4 °C-on, őrizzük meg a pelletet, és távolítsuk el az etil-alkoholt.
14. Hagyjuk a pelletet megszáradni a levegőn vagy egy gyors DNS vákuumszárítóban.
15. Szuszpendáljuk újra a pelletet 100 µl steril UPW-ben, és hagyjuk szobahőmérsékleten legalább 20 percig.
16. Tároljuk -20 °C-on amíg a PCR-hez szükség lesz rá.
17. Centrifugálással húzzuk le a fehér csapadékot, és vegyünk 5 µl-t a DNS-t tartalmazó felülúszó folyadékból a PCR-hez.
b) Egyéb módszerek
Egyéb DNS kivonási módszerek, pl. a Qiagen DNeasy Plant Kit, is alkalmazhatók, feltéve, hogy bizonyítottan ugyanennyire hatékonyan végzik a DNS-tisztítást 103-104/ml kórokozó sejtet tartalmazó kontroll mintákból.
6.2. PCR
6.2.1. Készítsünk teszt- és kontrollmintákat a PCR-hez a validált protokolloknak megfelelően (VI.A.6. szakasz). Készítsünk egy tízes léptékű hígítást a minta DNS-kivonatból (1:10 UPW-ben).
6.2.2. Készítsük el a megfelelő PCR reakcióelegyet fertőzésmentes környezetben a közzétett protokollok szerint (6. függelék). Amennyiben lehetséges, ajánlatos a multiplex PCR protokoll használata, amely magában foglal egy belső PCR ellenőrzést is.
6.2.3. Adjunk 2-5 µl DNS-kivonatot 25 µl PCR reakcióelegyhez steril PCR csövekben a PCR protokolloknak megfelelően (lásd a 6. függeléket).
6.2.4. Vonjunk be egy negatív kontroll-mintát, amely csak PCR reakcióelegyet tartalmaz, és adjunk hozzá UPW-t, mely ugyanabból a forrásból származzon, mint amit a PCR reakcióelegyben a minta helyén használtunk.
6.2.5. Helyezzük a csöveket ugyanabba a thermal cycler-be, melyet az előzetes vizsgálat során használtunk, és futtassuk le a megfelelően optimalizált PCR-programot (6. függelék).
6.3. A PCR termék elemzése
6.3.1. Elemezzük a PCR-fragmentumokat agarózgél-elektroforézissel. Futtassunk legalább 12 µl felerősített DNS reakcióelegyet mindegyik mintából, 3 µl töltőpufferrel keverve (6. függelék) 2,0 %-os (m/v) agarózgélben tris-acetát-EDTA (TAE) pufferben (6. függelék) 5-8 V/cm-en. Használjunk megfelelő DNS markert, pl. 100 bp ladder-t.
6.3.2. Tárjuk fel a DNS láncokat etidium-bromid festéssel (0,5 mg / L) 30-60 percig, kellő óvintézkedések mellett dolgozzunk ezzel a mutagénnel.
6.3.3. Tanulmányozzuk a megfestett gélt rövidhullámú UV átvilágítás (λ = 302 nm) mellett a várható méretű felerősített PCR-termékekre nézve (6. függelék), és dokumentáljuk.
6.3.4. Minden új leletnél/esetnél igazoljuk a PCR-fragmentum hitelességét restrikciós enzim analízissel, melyet a maradék felerősített DNS-ből származó mintán végezzünk el optimális hőmérsékleten és ideig inkubálva a megfelelő enzimmel és pufferrel (lásd a 6. függeléket). Elemezzük a feltárt fragmentumokat agarózgél-elektroforézissel, mint korábban, és tanulmányozzuk a jellegzetes restrikciós fragmentum mintázatot UV átvilágítás mellett etidium-bromid festés után, és hasonlítsuk össze a feltáratlan és a feltárt pozitív kontrollal.
A PCR-teszt eredményeinek kiértékelése:
A PCR-teszt negatív, ha az R. solanacearum-specifikus várható méretű PCR-fragmentum nem mutatható ki a kérdéses mintában, viszont kimutatható valamennyi pozitív kontroll mintában (a belső ellenőrzésű primerekkel végzett multiplex PCR esetében: egy második várható méretű PCR-terméket kell felerősíteni a kérdéses mintával együtt).
A PCR-teszt pozitív, ha az R. solanacearum-specifikus várható méretű PCR-fragmentum és (amennyiben szükséges) a restrikciós mintázat kimutatható, feltéve, hogy az nem erősödött fel valamelyik negatív kontroll mintától. A pozitív eredmény megbízható megerősítése elérhető a vizsgálat megismétlésével a PCR-primerek második sorozatán (6. függelék).
Megjegyzés: A PCR gátlása gyanítható, ha a várható fragmentumot nyerjük a vízben lévő R. solanacearum-ot tartalmazó pozitív kontroll mintából, viszont negatív eredményeket kapunk a burgonyakivonatban lévő R. solanacearum-ot tartalmazó pozitív kontrollokból. A belső PCR ellenőrzésű multiplex PCR-protokollokban jelzik a reakció gátlását, ha a két fragmentum egyike sem kerül kinyerésre.
Gyanítható a fertőzés, ha a várható fragmentumot nyerjük egy vagy több negatív kontrollból.
7. FISH-teszt
Az alapelv
Amennyiben a FISH-tesztet használjuk első szűrővizsgálatként, és pozitívnak bizonyul, akkor el kell végezni az izolálási eljárást vagy az IF-tesztet kötelező második szűrővizsgálatként. Amennyiben a FISH-tesztet második szűrővizsgálatként használjuk, és pozitívnak bizonyul, akkor további vizsgálat szükséges a folyamatábrának megfelelően a diagnosztizálás befejezéséhez.
Megjegyzés: Használjunk validált R. solanacearum-specifikus oligo-szondákat (lásd a 7. függeléket). Az ezzel a módszerrel végzett előzetes vizsgálatnak lehetővé kell tennie a korábban negatívnak vizsgált mintakivonathoz adott legalább 103-104/ml R. solanacearum sejt reprodukálható kimutatását.
A következő eljárást lehetőleg frissen készült mintakivonaton kell elvégezni, de sikeresen elvégezhető glicerin alatt -16 és -24 vagy -68 és -86 °C között tárolt mintakivonaton.
Negatív kontrollként használjuk a korábban R. solanacearum-ra negatívnak vizsgált mintakivonat aliquot térfogatait.
Pozitív kontrollnak készítsünk szuszpenziót, amely 105-106/ml 3-5 napos tenyészetből származó, 2. biovariánsba tartozó R. solanacearum sejtet (pl. NCPPB 4156 = PD 2762 = CFBP 3857 törzs, lásd a 3. függeléket) tartalmaz 0,01M foszfát-pufferben (PB). Készítsünk külön pozitív kontroll lemezeket a homológ törzsből vagy az R. solanacearum bármely más referenciatörzséből, burgonyakivonatban szuszpendálva, a 3.B. függelékben meghatározottak szerint.
A FITC-vel címkézett eubakteriális oligoszonda használata biztosítja a hibridizáció folyamatának ellenőrzését, mivel megfesti a mintában jelen levő összes eubaktériumot.
Az ehhez a vizsgálathoz rendelkezésre álló standardizált pozitív és negatív kontrollanyagok felsorolása a 3.A. függelékben található.
Vizsgáljuk a kontrollanyagot a mintával/mintákkal azonos módon.
7.1. A burgonyakivonat fixálása
A következő protokoll Wullings et al. (1998) alapján készült:
7.1.1. Készítsünk fixáló oldatot (lásd a 7. függeléket).
7.1.2. Pipettázzunk 100 µl-t mindegyik mintakivonatból egy Eppendorf-csőbe, és centrifugáljuk 7 percig 7 000 g-vel.
7.1.3. Távolítsuk el a felülúszó folyadékot, és oldjuk fel a pelletet 200 µl fixálóban, melyet kevesebb, mint 24 órával korábban készítettünk. Vortex-szeljük, és inkubáljuk 1 órán át hűtőszekrényben.
7.1.4. Centrifugáljuk 7 percig 7 000 g-vel, távolítsuk el a felülúszó folyadékot, és szuszpendáljuk újra a pelletet 75 µl 0,01M PB-ben (lásd a 7. függeléket).
7.1.5. Cseppentsünk 16 µl-t a fixált szuszpenzióból egy tiszta multiteszt lemezre, ahogy a 7.1. ábra mutatja. Két különböző mintát használjunk lemezenként hígítatlanul, és használjunk 10 µl-t egy 1:100 hígításhoz (0,01 M PB-ben). A maradék mintaoldatot (49 µl) tárolhatjuk -20 °C-on 1 térfogatnyi 96 %-os etil-alkohol hozzáadása után. Abban az esetben, ha a FISH-próbát meg kell ismételni, távolítsuk el az etil-alkoholt centrifugálással, és adjunk a mintaoldathoz azonos térfogatnyi 0,01 M PB-t (keverjük össze vortex-szeléssel).
7.1. ábra A FISH-lemez elrendezése
| 1. minta | vak | vak | vak | 2. minta |
| [Kép #21] | [Kép #22] | [Kép #23] | [Kép #24] | [Kép #25] |
| 1. ablak | 2. ablak | 3. ablak | 4. ablak | 5. ablak |
| 1. minta | vak | vak | vak | 2. minta |
| [Kép #26] | [Kép #27] | [Kép #28] | [Kép #29] | [Kép #30] |
| 6. ablak | 7. ablak | 8. ablak | 9. ablak | 10. ablak |
| 1. fedőlemez | 2. fedőlemez | |||

Kép #21

Kép #22

Kép #23

Kép #24

Kép #25

Kép #26

Kép #27

Kép #28

Kép #29

Kép #30
7.1.6. Levegőn szárítsuk meg a lemezeket (vagy lemezszárítón, 37 °C-on), és rögzítsük azokat lángon való áthúzással.
Ezen a ponton az eljárást félbeszakíthatjuk, és a hibridizációval másnap folytathatjuk. A lemezeket pormentesen és száraz szobahőmérsékleten kell tárolni.
7.2. Hibridizáció
7.2.1. Dehidratáljuk a sejteket egy fokozatos - 50, 80 és 96 %-os - etil-alkohol sorozatban, mindegyikben 1 percig. Levegőn hagyjuk megszáradni a lemezeket egy lemeztartóban.
7.2.2. Készítsünk egy nedves inkubációs kamrát úgy, hogy egy légmentesen záródó doboz aljára 1x hibmix-be (lásd a 7. függeléket) áztatott itatós- vagy szűrőpapírt terítünk. Végezzük el a doboz előinkubálását a hibridizációs kemencében 45 °C-on legalább 10 percig.
7.2.3. Tegyünk 10 μl hibridizációs oldatot (7. függelék) mindegyik lemez 8 ablakába (1., 2., 4., 5., 6., 7., 9. és 10. ablak; lásd a 7.1. ábrát), a két középső ablakot (3. és 8) üresen hagyva.
7.2.4. Tegyünk fedőlemezt (24 x 24 mm) az első és az utolsó négy ablakra a levegő beszorítása nélkül. Helyezzük a lemezeket az előmelegített nedves kamrába, majd hibridizáljuk azokat 5 órán át a kemencében 45 °C-on sötétben.
7.2.5. Készítsünk el 3 főzőpoharat, melyek 1 l Milli Q (molekuláris fokozatú) vizet, 1 l 1x hibmix-et (334 ml 3x hibmix és 666 ml Milli Q víz) és 1 l 1/8x hibmix-et (42 ml 3x hibmix és 958 ml Milli Q víz) tartalmaznak. Végezzük el az előinkubációjukat vízfürdőben 45 °C-on.
7.2.6. Vegyük le a fedőlemezeket a lemezekről, és helyezzük a lemezeket lemeztartóba.
7.2.7. Mossuk ki a felesleges szondát a főzőpohárban 1x hibmix-szel 45 °C-on történő, 15 percig tartó inkubálással.
7.2.8. Vigyük át a lemeztartót 1/8 hibmix mosóoldatba, és inkubáljuk további 15 percig.
7.2.9. Mártsuk a lemezeket rövid időre Milli Q vízbe, és tegyük őket szűrőpapírra. Távolítsuk el a felesleges nedvességet a felszínük szűrőpapírral történő óvatos letakarásával. Pipettázzunk 5-10 μl »montírozó« oldatot (pl. Vectashield-et, Vecta Laboratories, CA, USA vagy azzal egyenértékűt) mindegyik ablakra, és takarjuk le egy nagyméretű fedőlemezzel (24 x 60 mm) az egész lemezt.
7.3. A FISH-teszt leolvasása
7.3.1. Azonnal nézzük meg a lemezeket epifluoreszcens mikroszkóppal 630 nm hullámhosszon vagy 1 000-szeres nagyításon olajimmerzió mellett. Fluoreszcein-izotiocianáthoz (FITC) használható szűrővel a mintában lévő eubakteriális sejtek (beleértve a legtöbb gram-negatív sejtet) fluoreszkáló zöldre festődnek. Tetrametilrodamin-5-izotiocianáthoz használható szűrővel az R. solanacearum Cy3-mal festett sejtjei fluoreszkáló vörösnek tűnnek. Hasonlítsuk össze a sejtmorfológiát a pozitív kontrollokéval. A sejteknek élénken kell fluoreszkálniuk, és teljesen meg kell festődniük. A FISH-próbát (VI.A.7. szakasz) meg kell ismételni, ha a festődés rendellenes. Alaposan vegyük szemügyre az ablakokat két egymásra merőleges átmérőjük és a kerületük mentén. Azon minták esetében, amelyekben egyáltalán nem vagy csak kis számban mutatkoznak sejtek, legalább 40 mikroszkóp látómezőt vizsgáljunk meg.
7.3.2. Tanulmányozzuk az R. solanacearum élénken fluoreszkáló, jellegzetes morfológiájú sejtjeit a tesztlemezek tesztablakaiban (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main). A fluoreszkálás intenzitásának meg kell egyeznie, vagy erősebbnek kell lennie a pozitív kontroll törzsénél. A tökéletlen festődésű vagy gyengén fluoreszkáló sejteket nem szabad figyelembe venni.
7.3.3. Ha bármilyen fertőzés gyanúja felmerül, a vizsgálatot meg kell ismételni. Ilyen eset lehet, amikor egy tételben minden tesztlemez pozitív sejteket mutat a puffer fertőződésének következtében, vagy amikor pozitív sejtekre bukkanunk (a tesztablakokon kívül) a tesztlemez bevonatán.
7.3.4. Sok olyan probléma létezik, amely a FISH-teszt specifikusságából adódik. Az atipikus morfológiájú fluoreszkáló sejtek háttérpopulációi és a keresztbe reagáló szaprofita baktériumok, melyek mérete és morfológiája hasonló az R. solanacearum-éhoz, előfordulhatnak - bár sokkal ritkábban, mint az IF-tesztnél - a burgonyagumó köldökrészéből vett darabokból és a szár darabjaiból készített pelletben.
7.3.5. Csak a jellemző méretű és morfológiájú, fluoreszkáló sejteket vegyük figyelembe.
7.3.6. A FISH-teszt eredményének kiértékelése:
i. A FISH-teszt eredménye akkor érvényes, ha az R. solanacearum-ra jellemző méretű és morfológiájú, élénk zölden fluoreszkáló sejtek figyelhetők meg FITC-szűrő használatával és élénkvörösen fluoreszkáló sejtek a rodamin-szűrő használatával az összes pozitív kontrollnál, viszont a negatív kontrollok egyikénél sem. Ha találunk élénken fluoreszkáló, jellegzetes morfológiájú sejteket, becsüljük meg a jellemző sejtek átlagos számát mikroszkóp látómezőnként, és számoljuk ki a jellemző sejtek számát az újraszuszpendált pellet 1 ml-ére (4. függelék). Azok a minták, amelyek legalább 5x103 jellemző sejtet tartalmaznak az újraszuszpendált pellet 1 ml-ében potenciálisan fertőzöttnek tekinthetők. További vizsgálat szükséges. Azok a minták, amelyek kevesebb, mint 5x103 jellemző sejtet tartalmaznak az újraszuszpendált pellet 1 ml-ében negatívnak tekinthetők.
ii. A FISH-teszt negatív, ha az R. solanacearum-ra jellemző méretű és morfológiájú, élénkvörösen fluoreszkáló sejtek nem figyelhetők meg rodamin-szűrő használatával, feltéve, hogy jellemző, élénkvörösen fluoreszkáló sejtek figyelhetők meg a pozitív kontroll készítményekben rodamin-szűrő használatával.
8. ELISA-TESZT
Az alapelv
Az ELISA csak szabadon választható vizsgálatként alkalmazható az IF-, a PCR- vagy a FISH-vizsgálaton felül a viszonylag alacsony érzékenysége miatt. Amennyiben DASI ELISA-t használunk a dúsítás és a monoklonális ellenanyagok használata kötelező (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main). A minta dúsítása az ELISA alkalmazása előtt hasznos lehet a vizsgálat érzékenységének növelése szempontjából, de sikertelennek bizonyulhat a mintában található más szervezetek által okozott verseny következtében.
Megjegyzés: Az R. solanacearum validált forrásból származó ellenanyagait használjuk (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main). Ajánlott a titert minden egyes új ellenanyag-tételre meghatározni. A titer úgy van definiálva, hogy az a legmagasabb hígítás, melyen optimális reakció megy végbe az R. solanacearum homológ törzsének 105-106 sejt/ml-es szuszpenziója vizsgálatánál a megfelelő másodlagos ellenanyag konjugátumoknak a gyártó ajánlásai szerint történő felhasználása esetén. A vizsgálat során az ellenanyagokat a kereskedelmi készítmények titeréhez közeli vagy azzal megegyező munkahígításban kell használni.
Határozzuk meg az ellenanyagok titerét az R. solanacearum homológ törzsének 105-106 sejt/ml-es szuszpenzióján.
Negatív kontrollként használjunk egy mintakivonatot, melynek vizsgálata korábban az R. solanacearum-ra nézve negatív eredményt hozott, és egy keresztbe nem reagáló baktérium szuszpenzióját foszfátpufferes sóoldatban (PBS).
Pozitív kontrollként használjuk az aliquot térfogatait egy mintakivonatnak, melynek vizsgálata korábban negatív eredményt hozott, összekeverve 103-104/ml 2. biovariánsba tartozó R. solanacearum sejttel (pl. NCPPB 4156 = PD 2762 = CFBP 3857 törzs, lásd a 2.A. és 2.B. függeléket). Az eredmények összehasonlíthatósága érdekében mindegyik lemezen használjuk a 105-106/ml R. solanacearum sejtet PBS-ben tartalmazó standard szuszpenziót. Gondoskodjunk arról, hogy a pozitív kontrollok jól el vannak különítve a mikrotiter-lemezen a vizsgált mintá(k)tól.
Az ehhez a vizsgálathoz rendelkezésre álló standardizált pozitív és negatív kontrollanyagok felsorolása a 3.A. függelékben található.
A kontrollanyagot a mintával/mintákkal azonos módon vizsgáljuk.
Két ELISA-protokollt validáltak.
a) Közvetett ELISA (Robinson Smith et al., 1995)
1. Használjuk a mintakivonat 100-200 µl-es aliquot térfogatait. (A vízfürdőben vagy hevítő blokkban 100 °C-on 4 percig történő hevítés csökkentheti a nem specifikus eredményeket bizonyos esetekben.)
2. Adjunk hozzá egyenlő térfogatban kétszeres erősségű bevonópuffert (4. függelék) és Vortex-szeljük.
3. Vigyünk a mikrotitráló-lemez (pl. Nunc-Polysorp vagy azzal egyenértékű) legalább 2 vájulatának mindegyikébe 100 µl aliquot térfogatot, és inkubáljuk 1 órán át 37 °C-on vagy egy éjszakán át 4 °C-on.
4. Távolítsuk el a kivonatokat a vájulatokból. Mossuk ki a vájulatokat háromszor PBS-Tween-nel (4. függelék) úgy, hogy az utolsó mosóoldatot legalább 5 percig a vájulatokban hagyjuk.
5. Készítsük el az R. solanacearum elleni ellenanyagok megfelelő hígítását blokkoló pufferben (4. függelék). A validált kereskedelmi ellenanyagok esetében használjuk az ajánlott hígításokat (rendszerint kétszer olyan tömények, mint a titer).
6. Vigyünk 100 µl-t mindegyik vájulatba, és inkubáljuk 1 órán át 37 °C-on.
7. Távolítsuk el az ellenanyag oldatot a vájulatokból, és a vájulatokat mossuk ki az előbbiekben leírtak szerint (4. pont).
8. Készítsük el a másodlagos ellenanyag - alkalikus foszfatáz konjugátum megfelelő hígítását blokkoló pufferben. Tegyünk 100 µl-t mindegyik vájulatba, és inkubáljuk 1 órán át 37 °C-on.
9. Távolítsuk el az ellenanyag konjugátumot a vájulatokból, és mossuk ki a vájulatokat az előbbiekben leírtak szerint (4. pont).
10. Vigyünk 100 µl alkalikus foszfatáz szubsztrát oldatot (4. függelék) mindegyik vájulatba. Inkubáljuk sötétben szobahőmérsékleten, és olvassuk le az abszorbanciát 405 nm-nél rendszeres -90 percen belüli - időközönként.
b) DASI ELISA
1. Készítsünk megfelelő hígítást az R. solanacearum elleni poliklonális immunglobulinokból pH 9,6-os bevonó pufferben (4. függelék). Vigyünk 200 µl-t mindegyik vájulatba. Inkubáljuk 37 °C-on 4-5 órán át vagy 4 °C-on 16 órán át.
2. Mossuk ki a vájulatokat háromszor PBS-Tween-nel (4. függelék).
Vigyünk 190 µl mintakivonatot legalább 2 vájulatba. Ugyancsak vigyünk pozitív és negatív kontrollokat 2-2 vájulatba lemezenként. Inkubáljuk 16 órán át 4 °C-on.
3. Mossuk ki a vájulatokat háromszor PBS-Tween-nel (4. függelék).
4. Készítsünk megfelelő hígítást R. solanacearum-specifikus monoklonális ellenanyagokból PBS-ben (4. függelék), amely 0,5 % szarvasmarha szérum albumint (BSA) is tartalmaz, és vigyünk 190 µl-t mindegyik vájulatba. Inkubáljuk 37 °C-on 2 órán át.
5. Mossuk ki a vájulatokat háromszor PBS-Tween-nel (4. függelék).
6. Készítsünk megfelelő hígítást alkalikus foszfatázzal konjugált anti-egér immunglobulinokból PBS-ben. Vigyünk 190 µl-t mindegyik vájulatba. Inkubáljuk 37 °C-on 2 órán át.
7. Mossuk ki a vájulatokat háromszor PBS-Tween-nel (4. függelék).
8. Készítsünk alkalikus foszfatáz szubsztrát oldatot, amely 1 mg/ml p-nitrofenil-foszfátot tartalmaz szubsztrát-pufferben (4. függelék). Vigyünk 200 µl-t mindegyik vájulatba. Inkubáljuk sötétben szobahőmérsékleten, és olvassuk le az abszorbanciát 405 nm-nél rendszeres -90 percen belüli - időközönként.
Az ELISA-teszt eredményeinek kiértékelése:
Az ELISA-teszt negatív, ha az ismételt minta vájulatokból leolvasott átlagos optikai sűrűség (OD) kisebb, mint a negatív mintakivonat kontroll vájulatban leolvasott átlagos optikai sűrűség kétszerese, feltéve, hogy az OD-értékek az összes pozitív kontroll esetében 1,0 fölött vannak (a szubsztráttal való 90 perces inkubáció után), és meghaladják a negatív mintakivonatnál kapott OD kétszeresét.
Az ELISA-teszt pozitív, ha az ismételt minta vájulatokból leolvasott átlagos optikai sűrűség (OD) nagyobb, mint a negatív mintakivonat vájulatban leolvasott átlagos optikai sűrűség kétszerese, feltéve, hogy az OD-értékek az összes negatív kontroll vájulat esetében meghaladják a pozitív kontroll vájulatokban kapott OD kétszeresét.
A negatív ELISA leolvasások a pozitív kontroll vájulatokban azt jelzik, hogy a vizsgálatot nem megfelelően végezték el, vagy azt, hogy gátolva volt. A pozitív ELISA leolvasások a negatív kontroll vájulatokban azt jelzik, hogy keresztbe fertőződés vagy nem specifikus ellenanyagkötődés történt.
9. Biológiai vizsgálat
Megjegyzés: Az ezzel a módszerrel végzett előzetes vizsgálatnak lehetővé kell tennie a korábbi vizsgálatokban negatívnak bizonyult mintakivonatokhoz (elkészítését lásd a 3. fügelékben) adott 103-104/ml R. solanacearum telepalkotó egység reprodukálható kimutatását.
A kimutatás érzékenysége várhatóan akkor lesz a legmagasabb, ha frissen készített mintakivonatot használunk, és optimális szaporodási feltételeket biztosítunk. A módszert azonban sikeresen lehet alkalmazni olyan kivonatokon, amelyeket glicerin alatt -68 és -86 °C között tároltunk.
A következő protokoll Janse (1988) alapján készült:
9.1. Használjunk minden mintához 10 tesztnövényt egy fogékony paradicsomfajtából (pl. a »Moneymaker«-ből vagy azzal azonos fogékonyságú, a vizsgálati laboratórium által meghatározott fajtát) három valódi leveles állapotukban. A tenyésztéssel kapcsolatos részleteket lásd a 8. függelékben. Használhatunk tojásgyümölcsöt is (pl. a »Black Beauty« fajtát vagy azzal azonos fogékonyságú fajtákat), csak 2-3 leveles növényeket használjunk a harmadik valódi levél teljes kifejlődéséig. A tünetek enyhébbnek mutatkoztak, és lassabban jelentek meg a padlizsánnál. Ezért - amennyiben lehetséges - használjunk paradicsompalántákat.
Osszunk el 100 µl mintakivonatot a tesztnövények között.
9.2.1. Befecskendezéses beoltás
Oltsuk be a növények szárát közvetlenül a sziklevelek felett injekciós tűvel ellátott fecskendővel (legalább 23G). Osszuk el a mintát a tesztnövények között.
9.2.2. Bemetszéses beoltás
Két ujjunk között tartva a növényt, pipettázzunk egy csepp (mintegy 5-10 µl) szuszpendált pelletet a szárra a sziklevelek és az első levél közé.
Steril szikével ejtsünk átlós bemetszést, amely mintegy 1,0 cm hosszú és a mélysége körülbelül a szárvastagság 2/3-a, a vágás a pelletcsepptől induljon.
Zárjuk le a bevágást fecskendőből kinyomott steril vazelinnel.
9.3. Oltsunk be ugyanezzel a technikával 5 palántát egy virulens, 2. biovariánsba tartozó R. solanacearum törzs 48 órás tenyészetéből készített, 105-106/ml sejtet tartalmazó vizes szuszpenzióval, mint pozitív kontrollal, valamint pellet-pufferrel (4. függelék), mint negatív kontrollal. Különítsük el a pozitív és a negatív kontrollnövényeket a többi növénytől a keresztbe fertőződés elkerülése érdekében.
9.4. Neveljük a tesztnövényeket növény-egészségügyi zárlati létesítményekben egészen 4 héten keresztül 25-30 °C-on és magas relatív páratartalom mellett, valamint a megfelelő öntözés biztosításával, hogy megelőzzük a vízzel való átitatódást, vagy a vízhiány okozta hervadást. A fertőzések elkerülése érdekében inkubáljuk a pozitív és a negatív kontrollnövényeket jól elkülönített padokon, üvegházban vagy nevelőkamrában, abban az esetben, ha a tér korlátozott, biztosítani kell a kezelések közötti szigorú elkülönítést. Ha az eltérő mintákhoz tartozó növényeket egymás közelében kell inkubálni, különítsük őket el egymástól megfelelő válaszfallal. A műtrágyázásnál, az öntözésnél, a szemrevételezésnél és minden más beavatkozásnál fordítsunk kiemelt figyelmet a keresztbe fertőződés elkerülésére. Alapvető fontosságú, hogy az üvegházat és a nevelő kamrát a rovarkártevőktől mentesen tartsuk, mivel azok átvihetik a baktériumot egyik mintáról a másikra.
Figyeljük meg a hervadás, az epinasztia, a klorózis és/vagy satnyulás tüneteit.
9.5. Izoláljunk a fertőzött növényekből (II.3. szakasz), és azonosítsuk a vélelmezett R. solanacearum tisztított tenyészeteit (VI.B. szakasz).
9.6. Ha 3 hét után nem figyelhetők meg tünetek, akkor végezzünk IF/PCR/Izolálási vizsgálatot az egyes tesztnövények szárának a beoltás helye feletti részéről vett 1 cm-es darabokból álló összetett mintán. Ha a vizsgálat pozitív, végezzünk hígításos lemeztenyésztést (4.1. szakasz).
9.7. Azonosítsuk a vélelmezett R. solanacearum tisztított tenyészeteit (VI.B. szakasz).
A biológiai vizsgálat eredményeinek kiértékelése
Érvényes biológiai vizsgálati eredményeket akkor kapunk, ha a pozitív kontrollnövények jellemző tüneteket mutatnak, a baktériumokat újra lehet izolálni ezekről a növényekről, és a negatív kontrollokon nem találhatók tünetek.
A biológiai vizsgálat negatív, ha a tesztnövények nem fertőzöttek R. solanacearum-mal, és feltéve, hogy az R. solanacearum kimutatható a pozitív kontrollokban.
A biológiai vizsgálat pozitív, ha a tesztnövények fertőzöttek R. solanacearum-mal.
B. Azonosítási vizsgálatok
Azonosítsuk a vélelmezett R. solanacearum izolátumok tiszta tenyészeteit a következő - eltérő biológiai elveken alapuló - vizsgálatok közül legalább kettő alkalmazásával.
Használjunk ismert referenciatörzseket - amennyiben helyénvaló - mindegyik elvégzett vizsgálatnál (lásd a 3. függeléket).
1. Táplálkozási és enzimatikus azonosítási vizsgálat
Határozzuk meg a következő fenotípusos jellemzőket - amelyek általánosan megfigyelhetők vagy nem találhatók meg az R. solanacearum-nál - Lelliott és Stead (1987), Klement et al. (1990), és Schaad (2001) módszerei szerint.
| Vizsgálat | Várható eredmény |
| Fluorescens pigment képződés | – |
| Poli-β-hidroxibutirát zárványok | + |
| Oxidációs/Fermentációs (O/F) vizsgálat | O+/F– |
| Kataláz-aktivitás | + |
| Kovács-féle oxidáz vizsgálat | + |
| Nitrát-redukció | + |
| Citrát-hasznosítás | + |
| Szaporodás 40 °C-on | – |
| Szaporodás 1 %-os NaCl-ben | + |
| Szaporodás 2 %-os NaCl-ben | – |
| Arginin-dihidroláz aktivitás | – |
| Zselatin elfolyósítása | – |
| Keményítő-hidrolízis | – |
| Eszkulin-hidrolízis | – |
| Levan-képződés | – |
2. IF-teszt
2.1. Készítsünk hozzávetőleg 106/ml sejtet IF-pufferben tartalmazó szuszpenziót (4. függelék).
2.2. Készítsünk kétszeres hígítási sorozatot egy megfelelő antiszérumból (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
2.3. Alkalmazzuk az IF-eljárást (VI.A.5. szakasz).
2.4. Az IF-teszt pozitív, ha a tenyészet IF titere megegyezik a pozitív kontrolléval.
3. ELISA-teszt
Megjegyzés: Ha csak 2 azonosítási vizsgálatot végzünk, ne használjunk egy másik szerológiai vizsgálatot e módszeren felül.
3.1. Készítsünk hozzávetőleg 108/ml sejtet 1x PBS-ben tartalmazó szuszpenziót (4. függelék).
3.2. Végezzük el a megfelelő ELISA-eljárást R. solanacearum-specifikus monoklonális ellenanyaggal.
3.3. Az ELISA-teszt pozitív, ha a tenyészet leolvasásából származó ELISA-eredmény legalább a fele a pozitív kontrollnál kapotténak.
4. PCR-teszt
4.1. Készítsünk hozzávetőleg 106/ml sejtet molekuláris fokozatú steril vízben tartalmazó szuszpenziót.
4.2. Hevítsünk 100 µl sejtszuszpenziót lezárt csövekben hevítő blokkban vagy forrásban lévő vízfürdőben 100 °C-on 4 percig. A mintákat ezután -16 és -24 °C között tárolhatjuk, amíg szükséges.
4.3. Alkalmazzuk a megfelelő PCR-eljárásokat az R. solanacearum-specifikus fragmentumok felerősítésre (pl. Seal et al. (1993); Pastrik és Maiss (2000); Pastrik et al. (2002); Boudazin et al. (1999); Opina et al. (1997), Weller et al. (1999).
4.4. Az R. solanacearum pozitív azonosítása megvalósul, ha a PCR-fragmentumok azonos méretűek, és azonos restrikciós fragmentumhossz polimorfizmusokkal rendelkeznek, mint a pozitív kontrolltörzs esetében képződöttek.
5. FISH-teszt
5.1. Készítsünk hozzávetőleg 106/ml sejtet UPW-ben tartalmazó szuszpenziót.
5.2. Alkalmazzuk a FISH-eljárást (VI.A.7. szakasz) legalább két R. solanacearum-specifikus oligoszondával (7. függelék).
5.3. A FISH-teszt pozitív, ha ugyanazok a reakciók játszódnak le a tenyészet és a pozitív kontroll esetében.
6. Zsírsav-meghatározás (FAP)
6.1. Szaporítsuk a tenyészetet triptikáz szója agaron (Oxoid) 48 órán át 28 °C-on.
6.2. Alkalmazzuk a megfelelő FAP-eljárást (Janse, 1991; Stead, 1992).
6.3. A FAP-vizsgálat pozitív, ha a vélelmezett tenyészet profilja megegyezik a pozitív kontrolléval. A jellegzetes 14:0 3OH, 16:0 2OH, 16:1 2OH és 18:1 2OH zsírsavak jelenléte, valamint a 16:0 3OH zsírsav hiánya erőteljesen Ralstonia sp. fajra utal.
7. A törzs jellemzésének módszerei
A törzsnek a következő módszerek egyikével elvégzett jellemzése ajánlott az R. solanacearum izolálásának minden új eseténél.
Használjunk ismert referenciatörzseket - amennyiben helyénvaló - minden elvégzett vizsgálatnál (lásd a 3. függeléket).
7.1. Biovariáns-meghatározás
Az R. solanacearum-ot több biovariánsra osztjuk három diszacharid és három hexóz alkohol hasznosításának és/vagy oxidálásának képessége alapján (Hayward, 1964 és Hayward et al., 1990). A biovariáns-vizsgálatnál használt növekedési táptalajok leírása a 2. függelékben található. A vizsgálat sikeresen elvégezhető a táptalajnak az R. solanacearum izolátumok tiszta tenyészeteivel történő szúrásos beoltásával, és 28 °C-on történő inkubálásával. Ha a táptalajt szétosztjuk steril, 96 mintahelyes sejttenyészet-lemezekre (200 µl/vájulat), megfigyelhető, hogy a színe olajzöldről sárgára változik 72 órán belül, ami a vizsgálat pozitív eredményét jelzi.
| Biovariáns | |||||
| 1 | 2 | 3 | 4 | 5 | |
| Hasznosítás: | |||||
| Maltóz | – | + | + | – | + |
| Laktóz | – | + | + | – | + |
| D (+) Cellobióz | – | + | + | – | + |
| Mannitol | – | – | + | + | + |
| Szorbitol | – | – | + | + | – |
| Dulcitol | – | – | + | + | – |
További vizsgálatok a 2. biovariáns alfenotípusainak meghatározására
| 2.A. biovariáns (Világszerte elterjedt) | 2.A. biovariáns (Chilében és Kolumbiában fordul elő) | 2.T. biovariáns (A trópusi területeken fordul elő) | |
| Trehalóz-hasznosítás | – | + | + |
| Mezo-inozitol-hasznosítás | + | – | + |
| D-ribóz-hasznosítás | – | – | + |
| Pektolitikus aktivitás (1) | alacsony | Alacsony | magas |
7.2. Genom-ujjlenyomat készítés
Az R. solanacearum komplexumba tartozó törzsek molekuláris differenciálására több technika áll rendelkezésre, beleértve az alábbiakat:
7.2.1. Restrikciós fragmentumhossz polimorfizmus (RFLP) elemzés (Cook et al., 1989).
7.2.2. Repetitív szekvencia PCR-, REP-, boksz- és ERIC-primerek felhasználásával (Louws et al., 1995; Smith et al., 1995).
7.2.3. Felerősített fragmentumhossz polimorfizmus (AFLP) elemzés (Van der Wolf et al., 1998).
7.3. PCR-módszerek
Specifikus PCR-primereket (Pastrik et al, 2002; lásd a 6. függeléket) használhatunk az R. solanacearum 1. csoportjába (3., 4. és 5. biovariáns) és 2. csoportjába (1., 2A és 2T biovariáns) tartozó törzsek differenciálására, amit eredetileg RFLP elemzéssel (Cook et al., 1989) és 16S rDNS szekvenálással (Taghavi et al., 1996) határoztak meg.
C. MEGERŐSÍTŐ VIZSGÁLAT
A patogenitás vizsgálatot el kell végezni az R. solanacearum diagnosztizálásának végső megerősítésére, és az R. solanacearum-ként azonosított tenyészetek virulenciájának felmérésére.
1. Készítsünk a vizsgálandó izolátum 24-48 órás tenyészetéből hozzávetőleg 106/ml sejtet tartalmazó oltóanyagot, és egy R. solanacearum törzsből megfelelő pozitív kontrollt (pl. NCPPB 4156 = PD 2762 = CFBP 3857; lásd a 3. függeléket).
2. Oltsunk be 5-10 fogékony paradicsom- vagy padlizsánpalántát a harmadik valódi leveles állapotukban (lásd a VI.A.9. szakaszt).
3. Inkubáljuk egészen 2 héten át 25-28 °C-on és magas relatív páratartalom mellett, valamint a megfelelő öntözés biztosításával, hogy megelőzzük a vízzel való átitatódást, vagy a vízhiány okozta stresszt. A tiszta tenyészeteknél a tipikus hervadásnak 14 napon belül be kell következnie. Ha ezen időszak után a tünetek nincsenek jelen, akkor nem lehet megerősíteni, hogy a tenyészet az R. solanacearum patogén formája.
4. Figyeljük meg a hervadás és/vagy az epinasztia, a klorózis és a satnyulás tüneteit.
5. Izoláljunk a tüneteket mutató növényekből a szár egy darabjának a beoltási pont felett mintegy 2 cm-rel történő eltávolításával. Zúzzuk össze és szuszpendáljuk kis mennyiségű steril desztillált vízben vagy 50 mM foszfátpufferben (4. függelék). Izoláljuk a szuszpenzióból bottal vagy kaccsal végzett hígításos szélesztéssel megfelelő táptalajra, lehetőleg szelektív táptalajra (2. függelék), inkubáljuk 48-72 órán át 28 °C-on, és figyeljük meg az R. solanacearum-ra jellemző telepek kialakulását.
1. függelék
A protokollok optimalizálásában és validálásában résztvevő laboratóriumok
| Laboratórium (2) | Település | Ország |
| Agentur für Gesundheit und Ernährungssicherheit | Bécs és Linz | Ausztria |
| Departement Gewasbescherming | Merelbeke | Belgium |
| Plantedirektoratet | Lyngby | Dánia |
| Central Science Laboratory | York | Anglia |
| Scottish Agricultural Science Agency | Edinburgh | Skócia |
| Laboratoire National de la Protection des Végétaux, Unité de Bactériologie | Angers | Franciaország |
| Laboratoire National de la Protection des Végétaux, Station de Quarantaine de la Pomme de Terre | Le Rheu | Franciaország |
| Biologische Bundesanstalt | Kleinmachnow | Németország |
| Pflanzenschutzamt Hannover | Hannover | Németország |
| State Laboratory | Dublin | Írország |
| Dipartimento di Scienze e Tecnologie Agroambientali | Bologna | Olaszország |
| Regione Veneto Unità Periferica per i Servizi Fitosanitari | Verona | Olaszország |
| Nederlandse Algemene Keuringsdienst | Emmeloord | Hollandia |
| Plantenziektenkundige Dienst | Wageningen | Hollandia |
| Direcção-Geral de Protecção das Culturas | Lisszabon | Portugália |
| Centro Diagnostico de Aldearrubia | Salamanca | Spanyolország |
| Instituto Valenciano de Investigaciones Agrarias | Valencia | Spanyolország |
| Swedish University of Agricultural Sciences | Uppsala | Svédország |
2. függelék
Az R. solanacearum izolálására és tenyésztésére szolgáló táptalajok
a) Általános táptalajok
Tápagar (NA)
| Tápagar (Difco) | 23,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, és sterilizáljuk autoklávban 121 °C-on 15 percig.
Élesztő-pepton-glükóz agar (YPGA)
| Élesztőkivonat (Difco) | 5,0 g |
| Bacto-pepton (Difco) | 5,0 g |
| D(+)-glükóz (monohidrát) | 10,0 g |
| Bacto-agar (Difco) | 15,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, és sterilizáljuk autoklávban 121 °C-on 15 percig.
Szacharóz pepton agar (SPA)
| Szacharóz | 20,0 g |
| Bacto-pepton (Difco) | 5,0 g |
| K2HPO4 | 0,5 g |
| MgSO4.7H2O | 0,25 g |
| Bacto-agar (Difco) | 15,0 g |
| Desztillált víz | 1,0 liter |
| pH 7,2–7,4 |
Oldjuk fel az összetevőket, és sterilizáljuk autoklávban 121 °C-on 15 percig.
Kelman-féle tetrazóliumos táptalaj
| Kazaminosavak (Difco) | 1,0 g |
| Bacto-pepton (Difco) | 10,0 g |
| Dextróz | 5,0 g |
| Bacto-agar (Difco) | 15,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, és sterilizáljuk autoklávban 121 °C-on 15 percig.
Hűtsük le 50 °C-ra, és adjunk hozzá 2,3,5-trifenil-tetrazólium-klorid (Sigma) szűréssel sterilizált oldatát, hogy a végkoncentráció 50 mg/l legyen.
b) Validált szelektív táptalajok
SMSA táptalaj (Englebrecht, 1994; módosítva Elphinstone et al., 1996)
| Alap táptalaj | |
| Kazaminosavak (Difco) | 1,0 g |
| Bacto-pepton (Difco) | 10,0 g |
| Glicerin | 5,0 ml |
| Bacto-agar (Difco) (lásd a 2. megjegyzést) | 15,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, és sterilizáljuk autoklávban 121 °C-on 15 percig.
Hűtsük le 50 °C-ra, és adjunk hozzá szűréssel sterilizált vizes törzsoldatokat, melyek az alábbi összetevőkből állnak, hogy megkapjuk a meghatározott végkoncentrációkat:
| Kristályibolya (Sigma) | 5 mg/l |
| Polimixin-B-szulfát | (Sigma P-1004) 600 000 U(hozzávetőleg 100 mg) literenként |
| Bacitracin (Sigma B-0125) | 1 250 U (hozzávetőleg 25 mg) literenként |
| Klóramfenikol (Sigma C-3175) | 5 mg/l |
| Penicillin-G (Sigma P-3032) | 825 U (hozzávetőleg 0,5 mg) literenként |
| 2,3,5-trifenil-tetrazólium-klorid (Sigma) | 50 mg/l |
MEGJEGYZÉS:
1. A fentiekben megadottaktól eltérő reagensek használata befolyásolhatja az R. solanacearum szaporodását.
2. Oxoid agar #1 használható Bacto-agar (Difco) helyett. Ebben az esetben az R. solanacearum szaporodása lelassul, bár a kompetitív szaprofiták szaporodása ugyancsak lelassulhat. Az R. solanacearum jellemző telepeinek kialakulása 1-2 nappal tovább tarthat, és a vörös színeződés halványabb és szétterjedtebb lehet, mint a Bacto-agaron.
3. A bacitracin koncentráció 2 500 U/l-re növelésével csökkenthetjük a kompetitív baktérium populációkat, a R. solanacearum szaporodásának befolyásolása nélkül.
Tároljuk a táptalajokat és az antibiotikumok törzsoldatait 4 °C-on sötétben, és egy hónapon belül használjuk fel azokat.
A lemezeket meg kell szabadítani a felületi kondenzációtól használat előtt.
Kerüljük el a lemezek túlzott szárítását.
Minőségellenőrzést kell végezni a táptalajok minden egyes új tételének elkészítése után az R. solanacearum egy referencia tenyészetének (lásd a 3. függeléket) lemeztenyésztése és a jellemző telepek kialakulásának 28 °C-on 2-5 napig végzett inkubálás utáni megfigyelése révén.
c) Validált dúsítási táptalajok
SMSA-tápleves(Elphinstone et al., 1996)
Úgy készítsük, mint az SMSA szelektív agar táptalajt, de hagyjuk ki a Bacto-agart és a 2,3,5-tetrazólium-kloridot.
Módosított Wilbrink-tápleves (Caruso et al., 2002)
| Szacharóz | 10g |
| Proteóz pepton | 5g |
| K2HPO4 | 0,5g |
| MgSO4 | 0,25g |
| NaNO3 | 0,25g |
| Desztillált víz | 1 liter |
Sterilizáljuk autoklávban 121 °C-on 15 percig, és hűtsük le 50 °C-ra.
Adjunk hozzá antibiotikum törzsoldatokat, mint az SMSA-táplevesnél.
3. függelék
A. Kereskedelmi forgalomban kapható standardizált kontrollanyag
a) Baktérium izolátumok
A következő baktérium izolátumok, mint standard referenciaanyagok használata ajánlott, akár pozitív kontrollként (1. táblázat), akár a vizsgálatok optimalizálása során a keresztreakciók elkerülése érdekében (2. táblázat). Valamennyi törzs beszerezhető kereskedelmi úton az alábbi forrásokból:
1. National Collection of Plant Pathogenic Bacteria (NCPPB), Central Science Laboratory, York, UK.
2. Culture Collection of the Plant Protection Service (PD), Wageningen, The Netherlands.
3. Collection Française de Bactéries Phytopathogènes (CFBP), INRA Station Phytobactériologie, Angers, France.
1. táblázat Az R. solanacearum izolátumainak SMT referencia táblázata
| NCPPB kód | SMT # | Egyéb kódok | Származá-si ország | Biova-riáns |
| NCPPB 4153 | 6 | CFBP 4582, Pr 3020, EURS11 | Egyiptom | 2 |
| NCPPB 4154 | 10 | CFBP 4585, 550, EURS21 | Törökország | 2 |
| NCPPB 3857 | 12 | CFBP 4587, Pr 1140, EURS26 | Anglia | 2 |
| NCPPB 1584 | 23 | CFBP 4598, EURS49 | Ciprus | 2 |
| NCPPB 2505 | 24 | CFBP 4599, EURS50 | Svédország | 2 |
| NCPPB 4155 | 26 | CFBP 4601, 502, EURS55 | Belgium | 2 |
| NCPPB 4156 (3) | 71 (3) | PD 2762, CFBP 3857 | Hollandia | 2 |
| NCPPB 4157 | 66 | LNPV 15.59 | Franciaország | 2 |
| NCPPB 4158 | 39 | CFBP 4608, Port 448, EURS80 | Portugália | 2 |
| NCPPB 4160 | 69 | IVIA-1632-2 | Spanyolország | 2 |
| NCPPB 4161 | 76 | B3B | Németország | 2 |
| NCPPB 325 | 41 | CFBP 2047, KEL60-1, R842 | USA | 1 |
| NCPPB 3967 | 42 | CFBP 4610, R285, GONg7 | Costa Rica | 1 |
| NCPPB 4028 | 43 | CFBP 4611, R303/571, CIP310, SEQ205 | Kolumbia | 2 |
| NCPPB 3985 | 44 | CFBP 4612, R578, CIP312 | Peru | 2T |
| NCPPB 3989 | 45 | CFBP 4613, R568, CIP226 | Brazília | 2T |
| NCPPB 3996 | 46 | CFBP 3928, R276/355, CIP72, SEQ225 | Peru | 3 |
| NCPPB 3997 | 47 | CFBP 4614, R280/363, CIP49, HAY0131a | Ausztrália | 3 |
| NCPPB 4029 | 48 | CFBP 4615, R297/349, CIP121, CMIb2861 | Srí Lanka | 4 |
| NCPPB 4005 | 49 | CFBP 4616, R470 | Fülöp-szigetek | 4 |
| NCPPB 4011 | 50 | CFBP 4617, R288, HEmps2 | Kína | 5 |
Megjegyzés: A fenti törzsek hitelessége csak akkor garantálható, ha hiteles baktériumtenyészet-gyűjteményből származnak.
2. táblázat: A kimutatási vizsgálatok optimalizálásánál használt, szerológiailag vagy genetikailag rokon baktériumok SMT referencia táblázata
| NCPPB kód | SMT # | Egyéb kód | Azonosítás |
| NCPPB 4162 | 51 | CFBP 1954 | Bacillus polymyxa (4) |
| NCPPB 4163 | 52 | CFBP 1538 | Pseudomonas marginalis pv. marginalis (4) |
| NCPPB 4164 | – | CFBP 2227 | Burkholderia cepacia (5) |
| NCPPB 4165 | – | CFBP 2459 | Ralstonia pickettii (5) |
| NCPPB 4166 | 58 | CFBP 3567 CSL Pr1150 | Ralstonia pickettii (4) |
| NCPPB 4167 | 60 | CFBP 4618 PD 2778 | Ralstonia sp. (4) |
| NCPPB 1127 | 53 | CFBP 3575 | Burkholderia andropogonis (4) |
| NCPPB 353 | 54 | CFBP 3572 | Burkholderia caryophylli (4) |
| NCPPB 945 | 55 | CFBP 3569 | Burkholderia cepacia (4) |
| NCPPB 3708 | 56 | CFBP 3574 | Burkholderia glumae (4) |
| NCPPB 3590 | 57 | CFBP 3573 | Burkholderia plantarii (4) |
| NCPPB 3726 | 59 | CFBP 3568 | Banana Blood Disease Bacterium (4) (5) (6) |
| NCPPB 4168 | 61 | CFBP 4619 IPO S339 | Enterobacter sp. (4) |
| NCPPB 4169 | 62 | IPO 1695 | Enterobacter sp. (4) |
| NCPPB 4170 | 63 | CFBP 4621 IPO S306 | Ochrobactrum anthropi (4) (5) |
| NCPPB 4171 | 64 | CFBP 4622 IPO 1693 | Curtobacterium sp. (4) (5) |
| NCPPB 4172 | 65 | IPO 1696a | Pseudomonas sp. (4) |
| NCPPB 4173 | – | PD 2318 | Aureobacterium sp. (5) |
| NCPPB 4174 | 81 | IVIA 1844.06 | Flavobacterium sp. (4) (5) |
b) Kereskedelmi forgalomban kapható standardizált kontrollanyag
A következő standard kontrollanyag beszerezhető az NCPPB baktériumtenyészet-gyűjteményből.
Fagyasszunk le 200 egészséges burgonyagumóból nyert burgonyakivonat-pelletet a vizsgálatokhoz negatív kontroll céljára.
Fagyasszunk le 200 egészséges burgonyagumóból nyert burgonyakivonat-pelletet, amely 103-104 és 104-106 2. biovariánsba tartozó R. solanacearum sejtet (NCPPB 4156 = PD 2762 = CFBP 3857 törzs) tartalmaz, pozitív kontrollnak a szerológiai- és a PCR-vizsgálatokhoz. Mivel a sejtek életképességére hatással van a fagyasztásos szárítás, ezek nem alkalmasak standard kontrollnak az izolálási és a biológiai vizsgálatokhoz.
A 2. biovariánsba tartozó R. solanacearum sejtek (NCPPB 4156 = PD 2762 = CFBP 3857 törzs) formalinnal fixált szuszpenziója 106 sejt/ml koncentrációban pozitív kontrollnak a szerológiai vizsgálatokhoz.
B. Pozitív és negatív kontrollok készítése az alapvető szűrővizsgálatokhoz: a PCR/IF- és a FISH-próbához
Készítsünk 48 órás tenyészetet az R. solanacearum 3. rasszba/2. biovariánsba tartozó virulens törzséből (pl. NCPPB 4156 = PD 2762 = CFBP 3857 törzs) alap SMSA táptalajon, és szuszpendáljuk 10 mM fosztát-pufferben, hogy hozzávetőleg 2 × 108 cfu/ml sejtsűrűséget kapjunk. Ezt rendszerint kissé zavaros szuszpenzióval érjük el, amely 0,15-os optikai sűrűségnek felel meg 600 nm-nél.
Távolítsuk el a köldökrész egy darabját 200 burgonyagumóból, melyek egy fehér héjú fajta termesztéséből származnak, és ismeretes, hogy mentesek az R. solanacearum-tól.
Dolgozzuk fel a köldökrészeket a szokásos módon, és szuszpendáljuk újra a pelletet 10 ml-ben.
Készítsünk 10 steril 1,5 ml-es mikrocsövet 900 µl újraszuszpendált pellettel.
Vigyünk 100 µl R. solanacearum szuszpenziót az első mikrocsőbe. Vortex-szel keverjük össze.
Hozzuk létre a fertőzés tizedes szintjeit további hígítással a következő öt mikrocsőben.
A hat fertőzött mikrocsövet pozitív kontrollként fogjuk használni. A négy nem fertőzött mikrocsövet negatív kontrollként fogjuk használni. Ennek megfelelően címkézzük meg a mikrocsöveket.
Készítsünk 100 µl aliquot térfogatokat steril 1,5 ml-es mikrocsövekben, így 9 ismétlést alakítva ki mindegyik kontrollmintából. Tároljuk -16 és -24 °C között a felhasználásig.
Az R. solanacearum jelenlétét és kvantifikálását a kontrollmintákban először IF-próbával kell megerősíteni.
A PCR-próbához végezzünk DNS-kivonást a pozitív és a negatív kontrollmintákból minden egyes vizsgálatiminta-sorozat esetében.
Az IF- és a FISH-próbákhoz végezzünk vizsgálatokat a pozitív és a negatív kontrollmintákon minden egyes vizsgálatiminta-sorozat.
Az IF-, a FISH- és a PCR-vizsgálatokhoz az R. solanacearum-ot legalább 106-104 sejt/ml koncentrációban kell kimutatni a pozitív kontrollokban, és a negatív kontrollok egyikében sem szabad, hogy kimutatható legyen.
4. függelék
Pufferek a vizsgálati eljárásokhoz
ÁLTALÁNOS: A felbontatlan sterilizált puffereket egy évig lehet tárolni.
1. Pufferek a kivonási eljáráshoz
1.1. Kivonó-puffer (50 mM foszfát-puffer, pH 7,0)
Ez a puffer szolgál a baktériumnak a növényi szövetekből homogenizálás vagy rázás útján történő kivonására.
| Na2HPO4 (vízmentes) | 4,26 g |
| KH2PO4 | 2,72 g |
| Desztillált víz | 1,00 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t és sterilizáljuk autoklávban 121 °C-on 15 percig.
Az alábbi kiegészítő összetevők hasznosak lehetnek:
| Rendeltetés | Mennyiség (literenként) | |
| Lubrol-pelyhek | Diszpergálószer (7) | 0,5 g |
| DC Silicone habzásgátló | Habzásgátló anyag (7) | 1,0 ml |
| Tetranátrium-pirofoszfát | Antioxidáns | 1,0 g |
| Polivinilpirolidon-40000 (PVP-40) | PCR inhibitorok megkötése | 50 g |
1.2. Pellet-puffer (10 mM foszfát-puffer, pH 7,2)
Ez a puffer a burgonyagumók köldökrészéből vett darabok kivonatainak újraszuszpendálására és hígítására szolgál a pellet centrifugálással végzett koncentrálása után.
| Na2HPO4.12H2O | 2,7 g |
| NaH2PO4.2H2O | 0,4 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t és sterilizáljuk autoklávban 121 °C-on 15 percig.
2. Pufferek az IF-próbához
2.1. IF-puffer (10 mM foszfát-pufferes sóoldat (PBS), pH 7,2)
Ez a puffer az ellenanyagok hígítására szolgál.
| Na2HPO4.12H2O | 2,7 g |
| NaH2PO4.2H2O | 0,4 g |
| NaCL | 8,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t és sterilizáljuk autoklávban 121 °C-on 15 percig.
2.2. IF-puffer-Tween
Ez a puffer a lemezek mosására szolgál.
Adjunk 0,1 % Tween 20-at az IF-pufferhez.
2.3. Foszfát-pufferes glicerin, pH 7,6
Ez a puffer »ragasztó« folyadékként szolgál az IF-lemezek ablakain a fluoreszcencia megnöveléséhez.
| Na2HPO4.12H2O | 3,2 g |
| NaH2PO4.2H2O | 0,15 g |
| Glicerin | 50 ml |
| Desztillált víz | 100 ml |
Az elhalványulás elleni »ragasztó« oldatok kereskedelmi forgalomban kaphatók pl. Vectashield® (Vector Laboratories) vagy Citifluor® (Leica).
3. Pufferek a közvetett ELISA-próbához
3.1. Kétszeres erősségű bevonó-puffer, pH 9,6.
| Na2CO3 | 6,36 g |
| NaHCO3 | 11,72 g |
| Desztillált víz | 1,00 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t és sterilizáljuk autoklávban 121 °C-on 15 percig.
Szükség esetén nátrium-szulfit (0,2 %) adható hozzá antioxidánsként az oxidált aromás vegyületek kialakulásának megakadályozására.
3.2. 10X Foszfát-pufferes sóoldat (PBS), pH 7,4
| NaCL | 80,0 g |
| KH2PO4 | 2,0 g |
| Na2HPO4.12H2O | 29,0 g |
| KCl | 2,0 g |
| Desztillált víz | 1,0 liter |
3.3. PBS-Tween
| 10x PBS | 100 ml |
| 10 % Tween 20 | 5 ml |
| Desztillált víz | 895 ml |
3.4. Blokkoló (ellenanyag) puffer (frissen kell készíteni)
| 10X PBS | 10,0 ml |
| Polivinilpirolidon-44000 (PVP-44) | 2,0 g |
| 10 % Tween 20 | 0,5 ml |
| Tejpor | 0,5 g |
| Desztillált víz | egészítsük ki 100 ml-re |
3.5. Alkalikus foszfatáz szubsztrát oldat, pH 9,8
| Dietanol-amin | 97 ml |
| Desztillált víz | 800 ml |
Keverjük össze, és állítsuk be pH 9,8-ra tömény HCl-lel.
Egészítsük ki 1 literre desztillált vízzel.
Adjunk hozzá 0,2 g MgCl2-ot.
Oldjunk fel két 5 mg-os foszfatáz szubsztrát tablettát (Sigma) 15 ml oldathoz.
4. Pufferek a DASI ELISA-próbához
4.1. Bevonópuffer, pH 9,6
| Na2CO3 | 1,59 g |
| NaHCO3 | 2,93 g |
| Desztillált víz | 1 000 ml |
Oldjuk fel az összetevőket, és állítsuk be pH 9,6-ra.
4.2. 10X Foszfát-sóoldat puffer (PBS) pH 7,2-7,4
| NaCl | 80,0 g |
| NaH2PO4.2 H2O | 4,0 g |
| Na2HPO4.12H2O | 27,0 g |
| Desztillált víz | 1 000 ml |
4.3. PBS-Tween
| 10X PBS | 50 ml |
| 10 % Tween 20 | 5 ml |
| Desztillált víz | 950 ml |
4.4. Szubsztrát-puffer, pH 9,8
| Dietanol-amin | 100 ml |
| Desztillált víz | 900 ml |
Keverjük össze, és állítsuk be pH 9,8-ra tömény HCl-lel.
5. függelék
A fertőzöttségi szint meghatározása az IF- és a FISH-próbában
1. Állapítsuk meg a jellemzően fluoreszkáló sejtek számának középértékét látómezőnként (c).
2. Számítsuk ki a jellemzően fluoreszkáló sejtek számát mikroszkóplemez ablakonként (C).
C = c × S/s
| ahol | S | = | az ablak területe a több mintahelyes lemezen |
| és | s | = | a tárgylencse látómezőjének területe |
| s = πi2/4G2K2 | ahol | i | = | látómező koefficiens (az okulár típusától függően 8-24 között változik) |
| K | = | cső koefficiens (1 vagy 1,25) | ||
| G | = | a tárgylencse nagyítása (100x, 40x stb.) |
3. Számítsuk ki a jellemzően fluoreszkáló sejtek számát 1 ml újraszuszpendált pelletben (N).
N = C × 1 000/y × F
| ahol | y | = | az újraszuszpendált pellet térfogata az egyes ablakokban |
| és | F | = | az újraszuszpendált pellet hígítási-tényezője |
6. függelék
Validált PCR-protokollok és reagensek
Megjegyzés: Az előzetes vizsgálatnak lehetővé kell tennie 103-104/ml R. solanacearum sejt reprodukálható kimutatását a mintakivonatban.
Az előzetes vizsgálat nem mutathat hamis pozitív eredményeket a kiválasztott baktériumtörzsek esetében (lásd a 3. függeléket).
1. Seal et al. (1993) PCR-protokollja
1.1. Oligonukleotid primerek:
| OLI-1 előre haladó primer | 5′-GGG GGT AGC TTG CTA CCT GCC-3′ |
| Y-2 fordított primer | 5′-CCC ACT GCT GCC TCC CGT AGG AGT-3′ |
Várható fragmentum méret az R. solanacearum DNS templátból = 288 bp.
1.2. PCR reakcióelegy
| Reagens | Mennyiség reakciónként | Végkoncentráció |
| Steril UPW | 17,65 µl | |
| 10X PCR-puffer (8) (15 mM MgCl2) | 2,5 µl | 1X (1,5 mM MgCl2) |
| dNTP elegy (20mM) | 0,25 µl | 0,2 mM |
| OLI-1 primer (20 µM) | 1,25 µl | 1 µM |
| Y-2 primer (20 µM) | 1,25 µl | 1 µM |
| Taq polimeráz (5 U/µl) (8) | 0,1 µl | 0,5 U |
| A minta térfogata | 2,0 µl | |
| Össztérfogat: | 25 µl |
1.3. A PCR-reakció feltételei
Futtassuk a következő programot:
| 1 ciklusban: | i. | 2 percig 96 °C-on (DNS templát denaturálása) |
| 35 ciklusban: | ii. | 20 másodpercig 94 °C-on (DNS templát denaturálása) |
| iii. | 20 másodpercig 68 °C-on (primerek temperálása) | |
| iv. | 30 másodpercig 72 °C-on (másolat meghosszabbítása) | |
| 1 ciklusban: | v. | 10 percig 72 °C-on (végső meghosszabbítás) |
| vi. | tartsuk 4 °C-on |
Megjegyzés: Ezt a programot a Perkin Elmer 9600 thermal cycler-re optimalizálták. Más modellek használata szükségessé teheti a ii), iii) és iv) cikluslépések időtartamának megváltoztatását.
1.4. A fragmentum restrikciós enzim elemzése
Az R. solanacearum DNS-ből felerősített PCR-termékek jellegzetes restrikciós fragmentumhossz polimorfizmust mutatnak Ava II enzimmel 37 °C-on végzett inkubálás után.
2. Pastrik és Maiss (2000) PCR-protokolja
2.1. Oligonukleotid primerek:
| Ps-1 előre haladó primer | 5′- agt cga acg gca gcg ggg g -3′ |
| Ps-2 fordított primer | 5′- ggg gat ttc aca tcg gtc ttg ca -3′ |
Várható fragmentum méret az R. solanacearum DNS templátból = 553 bp.
2.2. PCR reakcióelegy
| Reagens | Mennyiség reakciónként | Végkoncentráció |
| Steril UPW | 16,025 µl | |
| 10X PCR puffer (9) | 2,5 µl | 1X (1,5 mM MgCl2) |
| BSA (V. frakció) (10 %) | 0,25 µl | 0,1 % |
| d-nTP elegy (20mM) | 0,125 µl | 0,1 mM |
| Ps-1 primer (10 µM) | 0,5 µl | 0,2 µM |
| Ps-2 primer (10 µM) | 0,5 µl | 0,2 µM |
| Taq polimeráz (5U/µl) (9) | 0,1 µl | 0,5 U |
| A minta térfogata | 5,0 µl | |
| Össztérfogat: | 25,0 µl | |
| Megjegyzés: Eredetileg MJ Research PTC 200 thermocycler-re optimalizálták Gibco Taq polimerázzal. A Perkin Elmer AmpliTaq és a puffer alkalmazható azonos koncentrációban. | ||
2.3. A PCR-reakció feltételei
Futtassuk a következő programot:
| 1 ciklusban: | i. | 5 percig 95 °C-on (DNS templát denaturálása) |
| 35 ciklusban: | ii. | 30 másodpercig 95 °C-on (DNS templát denaturálása) |
| iii. | 30 másodpercig 68 °C-on (primerek temperálása) | |
| iv. | 45 másodpercig 72 °C-on (másolat meghosszabbítása) | |
| 1 ciklusban: | v. | 5 percig 72 °C-on (végső meghosszabbítás) |
| vi. | tartsuk 4 °C-on. |
Megjegyzés: Ezt a programot MJ Research PTC 200 thermal cycler-re optimalizálták. Más modellek használata szükségessé teheti a ii., iii. és iv. cikluslépések időtartamának megváltoztatását.
2.4. A fragmentum restrikciós enzim elemzése
Az R. solanacearum DNS-ből felerősített PCR-termékek jellegzetes restrikciós fragmentumhossz polimorfizmust mutatnak Taq I enzimmel 65 °C-on 30 percig végzett inkubálás után. Az R. solanacearum-specifikus fragmentumból nyert restrikciós fragmentumok mérete 457 bp és 96 bp.
3. Multiplex PCR-protokoll belső PCR-ellenőrzéssel (Pastrik et al., 2002)
3.1. Oligonukleotid primerek:
| RS-1-F előre haladó primer | 5′- ACT AAC GAA GCA GAG ATG CAT TA -3′ |
| RS-1-R fordított primer | 5′- CCC AGT CAC GGC AGA GAC T -3′ |
| NS-5-F előre haladó primer | 5′- AAC TTA AAG GAA TTG ACG GAA G -3′ |
| NS-6-R fordított primer | 5′- GCA TCA CAG ACC TGT TAT TGC CTC -3′ |
Várható fragmentum méret az R. solanacearum DNS templátból = 718 bp (RS-primer készlet).
Várható fragmentum méret a 18S rRNS belső PCR ellenőrzésből = 310 bp (NS-primer készlet).
3.2. PCR reakcióelegy
| Reagens | Mennyiség reakciónként | Végkoncentráció |
| Steril UPW | 12,625 µl | |
| 10X PCR-puffer (10) (15 mM MgCl2) | 2,5 µl | 1X (1,5 mM MgCl2) |
| BSA (V. frakció) (10 %) | 0,25 µl | 0,1 % |
| d-nTP elegy (20 mM) | 0,125 µl | 0,1 mM |
| RS-1-F primer (10 µM) | 2,0 µl | 0,8 µM |
| RS-1-R primer (10 µM) | 2,0 µl | 0,8 µM |
| NS-5-F primer (10 µM) (11) | 0,15 µl | 0,06 µM |
| NS-6-R primer (10 µM) (11) | 0,15 µl | 0,06 µM |
| Taq polimeráz (5 U/µl) (10) | 0,2 µl | 1,0 U |
| A minta térfogata | 5,0 µl | |
| Össztérfogat: | 25,0 µl |
3.3. A PCR-reakció feltételei
Futtassuk a következő programot:
| 1 ciklusban: | i. | 5 percig 95 °C-on (DNS templát denaturálása) |
| 35 ciklusban: | ii. | 30 másodpercig 95 °C-on (DNS templát denaturálása) |
| iii. | 30 másodpercig 58 °C-on (primerek temperálása) | |
| iv. | 45 másodpercig 72 °C-on (másolat meghosszabbítása) | |
| 1 ciklusban: | v. | 5 percig 72 °C-on (végső meghosszabbítás) |
| vi. | tartsuk 4 °C-on. |
Megjegyzés: Ezt a programot MJ Research PTC 200 thermal cycler-re optimalizálták. Más modellek használata szükségessé teheti a ii., iii. és iv. cikluslépések időtartamának megváltoztatását.
3.4. A fragmentum restrikciós enzim elemzése
Az R. solanacearum DNS-ből felerősített PCR-termékek jellegzetes restrikciós fragmentumhossz polimorfizmust mutatnak Bsm I enzimmel vagy egy izoschizomerrel (pl. Mva 1269 I) 65 °C-on 30 percig végzett inkubálás után.
4. R. solanacearum-biovariáns-specifikus PCR-protokoll (Pastrik et al, 2001)
4.1. Oligonukleotid primerek:
| Rs-1-F előre haladó primer | 5′- ACT AAC GAA GCA GAG ATG CAT TA -3′ |
| Rs-1-R fordított primer | 5′- CCC AGT CAC GGC AGA GAC T -3′ |
| Rs-3-R fordított primer | 5′- TTC ACG GCA AGA TCG CTC -3′ |
A várható fragmentum méret az R. solanacearum DNS templátból:
Rs-1-F/Rs-1-R esetén = 718 bp
Rs-1-F/Rs-3-R esetén = 716 bp
4.2. PCR reakcióelegy
a)
1. /2. biovariánsra specifikus PCR
| Reagens | Mennyiség reakciónként | Végkoncentráció |
| Steril UPW | 12,925 µl | |
| 10X PCR-puffer (12) | 2,5 µl | 1X (1,5 mM MgCl2) |
| BSA (V. frakció) (10 %) | 0,25 µl | 0,1 % |
| d-NTP elegy (20mM) | 0,125 µl | 0,1 mM |
| Rs-1-F primer (10 µM) | 2 µl | 0,8 µM |
| Rs-1-R primer (10 µM) | 2 µl | 0,8 µM |
| Taq polimeráz (5 U/µl) (12) | 0,2 µl | 1 U |
| A minta térfogata | 5,0 µl | |
| Össztérfogat: | 25,0 µl |
b)
3. /4./5. biovariánsra specifikus PCR
| Reagens | Mennyiség reakciónként | Végkoncentráció |
| Steril UPW | 14,925 µl | |
| 10X PCR-puffer (13) | 2,5 µl | 1X (1,5 mM MgCl2) |
| BSA (V. frakció) (10 %) | 0,25 µl | 0,1 % |
| dNTP elegy (20 mM) | 0,125 µl | 0,1 mM |
| Rs-1-F primer (10 µM) | 1 µl | 0,4 µM |
| Rs-3-R primer (10 µM) | 1 µl | 0,4 µM |
| Taq polimeráz (5 U/µl) (13) | 0,2 µl | 1 U |
| A minta térfogata | 5,0 µl | |
| Össztérfogat: | 25,0 µl |
4.3. A PCR-reakció feltételei
Futtassuk a következő programot az 1./2. biovariánsra- és a 3./4./5. biovariánsra specifikus reakcióknál egyaránt:
| 1 ciklusban: | i. | 5 percig 95 °C-on (DNS templát denaturálása) |
| 35 ciklusban: | ii. | 30 másodpercig 95 °C-on (DNS templát denaturálása) |
| iii. | 30 másodpercig 58 °C-on (primerek temperálása) | |
| iv. | 45 másodpercig 72 °C-on (másolat meghosszabbítása) | |
| 1 ciklusban: | v. | 5 percig 72 °C-on (végső meghosszabbítás) |
| vi. | tartsuk 4 °C-on. |
Megjegyzés: Ezt a programot az MJ Research PTC 200 thermal cycler-re optimalizálták. Más modellek használata szükségessé teheti a ii), iii) és iv) cikluslépések időtartamának megváltoztatását.
4.4. A fragmentum restrikciós enzim elemzése
Az R. solanacearum DNS-ből Rs-1-F és Rs-1-R primerek felhasználásával felerősített PCR-termékek jellegzetes restrikciós fragmentumhossz polimorfizmust mutatnak Bsm I enzimmel vagy egy izoschizomerrel (pl. Mva 1269 I) 65 °C-on 30 percig végzett inkubálás után. Az R. solanacearum DNS-ből Rs-1-F és Rs-3-R primerek felhasználásával felerősített PCR-termékek nem rendelkeznek restrikciós helyekkel.
5. A betöltő puffer elkészítés
5.1. Brómfenol kék (10 %-os törzsoldat)
| Brómfenol kék | 5 g |
| Desztillált víz (bidest) | 50 ml |
5.2. Betöltő puffer
| Glicerin (86 %) | 3,5 ml |
| Brómfenol kék (5.1) | 300 µl |
| Desztillált víz (bidest) | 6,2 ml |
6. 10x Tris-acetát-EDTA (TAE) puffer, pH 8,0
| Tris puffer | 48,40 g |
| Jégecet | 11,42 ml |
| EDTA (dinátrium só) | 3,72 g |
| Desztillált víz | 1,00 liter |
Hígítsuk 1x-re használat előtt.
Kereskedelmi forgalomban is kapható (pl. Invitrogen vagy azzal egyenértékű).
7. függelék
Validált reagensek a FISH-próbához
1. Oligo-szondák
OLI-1-CY3 R. solanacearum-specifikus szonda: 5′-ggc agg tag caa gct acc ccc-3′
EUB-338-FITC nem-specifikus eubaktérium szonda: 5′-gct gcc tcc cgt agg agt-3′
2. Fixáló oldat
[VIGYÁZAT! A FIXÁLÓ PARAFORMALDEHIDET TARTALMAZ, AMELY MÉRGEZŐ. HASZNÁLJON KESZTYŰT, ÉS NE LÉLEGEZZE BE. TANÁCSOS VEGYIFÜLKÉBEN DOLGOZNI.]
i. Melegítsünk 9 ml molekuláris fokozatú vizet (pl. Ultra tiszta vizet (UPW)) körülbelül 60 °C-ra, és adjunk hozzá 0,4 g paraformaldehidet. A paraformaldehid feloldódik 5 csepp 1N NaOH hozzáadása és mágneses keverőbottal végzett keverés után.
ii. Állítsuk be a pH-t 7,0-ra 1ml 0,1M foszfát-puffer (PB; pH 7,0) és 5 csepp 1N HCl hozzáadásával. Ellenőrizzük a pH-t indikátorpapírral, és szükség esetén állítsuk be HCl-lel vagy NaOH-val. [FIGYELEM! NE HASZNÁLJON PH-MÉRŐT A PARAFORMALEDHIDET TARTALMAZÓ OLDATOKBAN.]
iii. Szűrjük át az oldatot 0,22 µm membránszűrőn, és pormentesen 4 °C-on a további használatig.
3. 3x Hibmix
| NaCl | 2,7 M |
| Tris-HCl | 60 mM (pH 7,4) |
| EDTA (szűréssel sterilizált és autoklávozott) | 15 mM |
Hígítsuk 1x-re szükség szerint.
4. Hibridizációs oldat
| 1x Hibmix | |
| Nátrium-dodecil szulfát (SDS) | 0,01 % |
| Formamid | 30 % |
| EUB 338 szonda | 5 ng/μl |
| OLI-1 vagy OLI-2 szonda | 5 ng/μl |
Készítsünk nagyobb mennyiséget a hibridizációs oldatból az 1. táblázatban megadott értékek szerint. Mindegyik lemezhez (melyek 2 különböző mintát tartalmaznak, és azok másolatait) 90 μl hibridizációs oldatra van szükség. FONTOS: A FORMAMID NAGYON MÉRGEZŐ, EZÉRT VISELJEN KESZTYŰT, ÉS TEGYE MEG A SZÜKSÉGES ÓVINTÉZKEDÉSEKET!
1. táblázat A hibridizációs elegy elkészítéséhez javasolt mennyiségek
| A lemezek száma: | 1 | 4 | 6 | 8 | 10 |
| Steril UPW | 23,1 | 92,4 | 138,6 | 184,8 | 231,0 |
| 3x hibmix | 30,0 | 120,0 | 180,0 | 240,0 | 300,0 |
| 1 % SDS | 0,9 | 3,6 | 5,4 | 7,2 | 9,0 |
| Formamid | 27,0 | 108,0 | 162,0 | 216,0 | 270,0 |
| EUB 338 szonda (100 ng/μl) | 4,5 | 18,0 | 27,0 | 36,0 | 45,0 |
| OLI-1 vagy OLI-2 szonda (100 ng/μl) | 4,5 | 18,0 | 27,0 | 36,0 | 45,0 |
| Össztérfogat (μl) | 90,0 | 360,0 | 540,0 | 720,0 | 900,0 |
| Megjegyzés: A fényérzékeny oligo-szondákat tartalmazó oldatokat tároljuk sötétben –20 °C-on. Óvjuk a közvetlen napfénytől és a mesterséges fénytől a használat során. | |||||
5. 0,1 M Foszfát-puffer, pH 7,0
| Na2HPO4 | 8,52 g |
| KH2PO4 | 5,44 g |
| Desztillált víz | 1,00 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t, és sterilizáljuk autoklávban 121 °C-on 15 percig.
8. függelék
A padlizsán és a paradicsom termesztése
Vessünk el paradicsom (Lycopersicon esculentum) vagy padlizsán (Solanum melongena) vetőmagját pasztörizált vetőmag elvetésénél használt komposztba. Ültessük át a teljesen szétnyílt sziklevelekkel rendelkező palántákat (10-14 nap) pasztörizált tenyészedénybe való ültetésnél használt komposztba.
A padlizsán- vagy a paradicsomnövényeket üvegházban kell nevelni a beoltást megelőzően a következő környezeti feltételek mellett:
| Nappalhossz: | 14 óra vagy természetes nappalhossz, ha az hosszabb; |
| Hőmérséklet: | nappali: 21–24 °C, éjszakai:.14–18 °C |
| Fogékony paradicsomfajta: | »Moneymaker« |
| Fogékony padlizsánfajta: | »Black Beauty« |
| Beszállítók: | lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main |
IRODALOMJEGYZÉK
1. Amann, R.I., L. Krumholz and D.A. Stahl. 1990. Fluorescent-oligonucleotide probing of whole cells for determinative, phylogenetic and environmental studies in microbiology. J. Bacteriol. 172: 762-770.
2. Anon. 1998. Council Directive 98/57/EC of 20 July 1998 on the control of Ralstonia solanacearum (Smith) Yabuuchi et al. Official Journal of the European Communities L235, 1-39.
3. Boudazin, G., A.C. Le Roux, K. Josi, P. Labarre and B. Jouan. 1999. Design of division specific primers of Ralstonia solanacearum and application to the identification of European isolates. European Journal of Plant Pathology 105; 373-380.
4. Caruso, P., Gorris, M.T., Cambra, M., Palomo, J.L., Collar, J and Lopez, M.M. 2002. Enrichment Double-Antibody Sandwich Indirect Enzyme-Linked Immunosorbent Assay That Uses a Specific Monoclonal Antibody for sensitive Detection of Ralstonia solanacearum in Asymptomatic Potato Tubers. Applied and Environmental Microbiology, 68, 3634-3638.
5. Cook, D., Barlow, E. and Sequeira, L. 1989. Genetic diversity of Pseudomonas solanacearum: detection of restriction fragment length polymorphisms with DNA probes that specify virulence and the hypersensitive response. Molecular Plant-Microbe Interactions 1:113-121.
6. Elphinstone, J.G., Hennessy, J., Wilson, J.K. and Stead, D.E. 1996. Sensitivity of detection of Ralstonia solanacearum in potato tuber extracts. EPPO Bulletin 26; 663-678.
7. Englebrecht, M.C. (1994) Modification of a semi-selective medium for the isolation and quantification of Pseudomonas solanacearum. In: A.C. Hayward (ed.) Bacterial Wilt Newsletter 10, 3-5. Australian Centre for International Agricultural Research, Canberra, Australia.
8. Hayward, A.C. 1964. Characteristics of Pseudomonas solanacearum. Journal of Applied Bacteriology 27; 265-277.
9. Hayward, A.C., El-Nashaar, H.M., Nydegger, U. and De Lindo, L. 1990. Variation in nitrate metabolism in biovars of Pseudomonas solanacearum. Journal of Applied Bacteriology 69; 269-280.
10. Ito, S., Y. Ushijima, T. Fujii, S. Tanaka, M. Kameya-Iwaki, S. Yoshiwara and F. Kishi. 1998. Detection of viable cells of Ralstonia solanacearum in soil using a semi-selective medium and a PCR technique. J. Phytopathology 146; 379-384.
11. Janse, J.D. (1988) A detection method for Pseudomonas solanacearum in symptomless potato tubers and some data on its sensitivity and specificity. Bulletin OEPP/EPPO Bulletin 18, 343-351.
12. Janse, J.D. 1991. Infra- and intra-specific classification of Pseudomonas solanacaerum strains using whole cell fatty-acid analysis. Systematic and Applied Microbiology 14; 335-345.
13. Kelman, A. 1954. The relationship of pathogenicity of Pseudomonas solanacearum to colony appearance on a tetrazolium medium. Phytopathology 44; 693-695.
14. Klement Z.; Rudolph, K and D.C. Sands, 1990. Methods in Phytobacteriology. Akadémiai Kiadó, Budapest, 568 pp.
15. Lelliott, R.A. and Stead, D.E. 1987. Methods for the diagnosis of bacterial diseases of plants. Blackwell scientific Publications Ltd., Oxford. 216 pp.
16. Lopez, M.M., Gorris, M.T., Llop, P., Cubero, J., Vicedo, B., Cambra, M., 1997. Selective enrichment improves selective isolation, serological and molecular detection of plant pathogenic bacteria. In: H.W. Dehne et al., (eds). Klewer Academic Publishers. pp. 117-121.
17. Louws, F.J., Fulbright, D.W., Stephens, C.T. and De Bruijn, F.J., 1994. Specific genomic fingerprints of phytopathogenic Xanthomonas and Pseudomonas pathovars and strains generated with repetitive sequences and PCR. Applied and Environmental Microbiology, 60, 2286-2295.
18. Louws, F.J., Fulbright, D.W., Stephens, C.T. and De Bruijn, F.J. 1995. Differentiation of genomic structure by rep-PCR fingerprinting to rapidly classify Xanthomonas campestris pv. vesicatoria. Phytopathology 85; 528-536.
19. Opina, N., F. Tavner, G. Holloway, J.-F Wang, T.-H Li, R. Maghirang, M. Fegan, A.C. Hayward, V. Krishnapillai, W.F. Hong, B.W. Holloway, J.N. Timmis. 1997. A novel method for development of species and strain-specific DNA probes and PCR primers for identifying Burkholderia solanacearum (formerly Pseudomonas solanacearum). As Pac. J. Mol. Biol. Biotechnol. 5; 19-33.
20. Pastrik, K.H. and Maiss, E. 2000. Detection of R. solanacearum in potato tubers by polymerase chain reaction. J. Phytopathology 148; 619-626.
21. Pastrik, K.H., Elphinstone, J.G. and Pukall, R. 2002. Sequence analysis and detection of Ralstonia solanacearum by multiplex PCR amplification of 16S-23S ribosomal intergenic spacer region with internal positive control. European Journal of Plant Pathology 108, 831-842.
22. Robinson-Smith, A., Jones, P., Elphinstone, J.G. and Forde, S.M.D. (1995) Production of antibodies to Pseudomonas solanacearum, the causative agent of bacterial wilt. Food and Agricultural Immunology 7, 67-79.
23. Schaad, W. 2001. Laboratory guide for identification of plant pathogenic bacteria. Schaad [Hrsg.]. - 3. ed.; St. Paul, Minnesota: 373 pp.
24. Seal, S.E., L.A. Jackson, J.P.W. Young, and M.J. Daniels. 1993. Detection of Pseudomonas solanacearum, Pseudomonas syzygii, Pseudomonas pickettii and Blood Disease Bacterium by partial 16S rRNA sequencing: construction of oligonucleotide primers for sensitive detection by polymerase chain reaction. J. Gen. Microbiol. 139: 1587-1594.
25. Smith, J.J., Offord, L.C., Holderness, M. and Saddler, G.S. 1995. Genetic diversity of Burkholderia solanacearum (synonym Pseudomonas solanacearum) race 3 in Kenya. Applied and Environmental Microbiology 61; 4262-4268.
26. Stead, D.E. 1992. Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty-acid profiles. International Journal of Systematic Bacteriology 42; 281-295.
27. Taghavi, M., Hayward, A.C., Sly, L.I., Fegan, M. 1996. Analysiss of the phylogenetic relationships of strains of Burkholderia solanacearum, Pseudomonas syzygii, and the blood disease bacterium of banana based on 16S rRNA gene sequences. International Journal of Systematic Bacteriology 46; 10-15.
28. Van Der Wolf, J.M., Bonants, P.J.M., Smith, J.J., Hagenaar, M., Nijhuis, E., Van Beckhoven, J.R.C., Saddler, G.S., Trigalet, A., Feuillade, R. 1998. Genetic diversity of Ralstonia solanacearum Race 3 in Western Europe as determined by AFLP, RC-PFGE and rep-PCR. In: Prior, P., Allen, C. and Elphinstone, J. (eds.) Bacterial wilt disease: Molecular and Ecological Aspects. Springer (Berlin) pp. 44-49.
29. Weller, S.A., Elphinstone, J.G., Smith, N., Stead, D.E. and Boonham, N. 1999. Detection of Ralstonia solanacearum strains using an automated and quantitative flourogenic 5' nuclease TaqMan assay. Applied and Environmental Microbiology 66; 2853-2858.
30. Wullings, B.A., A.R. van Beuningen, J.D. Janse and A.D.L. Akkermans. 1998. Detection of R. solanacearum, which causes brown rot of potato, by fluorescent in situ hybridization with 23s rRNA-targeted probes. Appl. Environ. Microbiol. 64: 4546-4554.
III. MELLÉKLET
1. A károsító minden olyan gyanított előfordulása esetén, amikor a szűrővizsgálat(ok) során pozitív eredmény került megállapításra - a felsorolt növényanyag és minden egyéb eset vonatkozásában - a II. mellékletben meghatározott vonatkozó módszereknek megfelelően, és a gyanú az említett módszerek befejezése révén megerősítésre vagy eloszlatásra vár, meg kell őrizni és megfelelően fent kell tartani:
- az összes gumót és - amennyiben lehetséges - az összes növényt, amelyekből mintát vettünk,
- a kivonatok maradékait és a szűrővizsgálat(ok)hoz készített további anyagokat, pl. immunfluoreszcenciás lemezeket,
és
- a teljes vonatkozó dokumentációt, az említett módszerek befejezéséig.
A gumók megőrzése lehetőséget fog biztosítani a fajtavizsgálat elvégzésére, amennyiben helyénvaló.
2. A károsító előfordulásának pozitív megerősítése esetén, meg kell őrizni és megfelelően fent kell tartani:
- az 1. bekezdésben meghatározott anyagokat,
és
- megfelelő esetben a gumó- vagy növénykivonattal beoltott, fertőzött paradicsomból vagy padlizsánból vett mintát,
és
- a károsító izolált tenyészetét,
legalább egy hónapig az 5. cikk (2) bekezdése szerinti eljárás bejelentését követően.
IV. MELLÉKLET
Az 5. cikk (1) bekezdése a) pontjának i. alpontjában említett vizsgálat elemei - amennyiben helytállók - az alábbiakat foglalják magukba:
i. azokat a termőhelyeket,
- ahol a károsítóval fertőzöttnek talált burgonyával klonális rokonságban álló burgonyát termesztenek vagy termesztettek,
- ahol a károsítóval fertőzöttnek talált paradicsommal azonos forrásból származó paradicsomot termesztenek vagy termesztettek,
- ahol olyan burgonyát vagy paradicsomot termesztenek vagy termesztettek, amelyet hatósági ellenőrzés alá helyeztek a károsító szervezet előfordulásának gyanúja miatt,
- ahol a károsítóval fertőzöttnek talált termőhelyen termesztett burgonyával klonális rokonságban álló burgonyát termesztenek vagy termesztettek,
- ahol burgonyát vagy paradicsomot termesztenek, és amelyek fertőzött termőhelyek szomszédságában találhatók, beleértve az olyan termőhelyeket, ahol - közvetlenül, vagy közös szolgáltatón keresztül - közösen használnak termelési eszközöket és létesítményeket,
- ahol bármely olyan forrásból származó felszíni vizet használnak öntözés vagy permetezés céljára, amelynél fennáll vagy megerősítést nyert a károsítóval való fertőzöttség gyanúja,
- ahol olyan forrásból származó felszíni vizet használnak öntözés vagy permetezés céljára, amely közös használatban van olyan termőhelyekkel, amelyeknél fennáll vagy megerősítést nyert a károsítóval való fertőzöttség gyanúja,
- amely olyan felszíni vízzel van vagy volt elöntve, amelynél fennáll vagy megerősítést nyert a károsítóval való fertőzöttség gyanúja;
és
ii. ahol megerősítést nyert, hogy a tábla/táblák vagy a termőhely(ek) öntözésére vagy permetezésére használt, vagy az azokat elöntő felszíni vizek fertőzöttek a károsítóval.
V. MELLÉKLET
1. A feltételezett fertőzés mértékének az 5. cikk (1) bekezdése a) pontjának iii. alpontja és c) pontjának iii. alpontja szerinti meghatározásánál figyelembe vett elemek:
- az 5. cikk (1) bekezdése a) pontjának ii. alpontja szerint fertőzöttnek minősülő termőhelyen termesztett felsorolt növényanyagot,
- az 5. cikk (1) bekezdése a) pontjának ii. alpontja szerint fertőzöttnek minősülő felsorolt növényanyaggal termelési kapcsolatban álló termőhely(ek)et vagy tárolóhelyeket, beleértve azokat, ahol - közvetlenül, vagy közös szolgáltatón keresztül - közösen használnak termelési eszközöket és létesítményeket,
- a felsorolt növényanyagot, amelyet az előző francia bekezdésben említett termőhelye(ke)n termesztettek, vagy amely jelen volt ilyen termőhelye(ke)n abban az időszakban, amikor az 5. cikk (1) bekezdése a) pontjának ii. alpontja szerint fertőzöttnek minősülő növényanyag jelen volt az első francia bekezdésben említett termőhelyeken,
- a raktárakat, ahol a fenti termőhelyekről származó felsorolt növényanyagot tárolják,
- mindazokat a gépeket, járműveket, hajókat, raktárakat, vagy azok részeit, valamint minden egyéb tárgyat, beleértve a csomagolóanyagokat is, amelyek érintkezésbe kerülhettek az 5. cikk (1) bekezdése a) pontjának ii. alpontja szerint fertőzöttnek minősülő felsorolt növényanyaggal,
- mindazt a felsorolt növényanyagot, amely az előző francia bekezdésben felsorolt építmények vagy tárgyak bármelyikében tárolásra került, vagy bármelyikével érintkezésbe került ezeknek az építményeknek és tárgyaknak a tisztítását és fertőtlenítését megelőzően,
- az 5. cikk (1) bekezdése a) pontja i. alpontjának megfelelően elvégzett vizsgálat és laboratóriumi eljárások eredményeként, a burgonya esetében azokat a gumókat vagy növényeket, amelyek egyenes- vagy oldalági klonális kapcsolatban állnak az 5. cikk (1) bekezdése a) pontjának ii. alpontja szerint fertőzöttnek minősülő felsorolt növényanyaggal, illetve a paradicsom esetében azokat a növényeket, amelyek ugyanabból a forrásból származnak, mint az 5. cikk (1) bekezdése a) pontjának ii. alpontja szerint fertőzöttnek minősülő felsorolt növényanyag, és amelyeknél úgy tűnik, hogy - bár a károsító kimutatására irányuló vizsgálat hozhatott negatív eredményt - a fertőzés valószínűsíthető a klonális kapcsolat útján. Fajtavizsgálatra kerülhet sor a fertőzött gumók vagy növények azonosságának igazolására,
- az előző francia bekezdésben említett felsorolt növényanyag termőhelyét/termőhelyeit,
- az olyan felsorolt növényanyag termőhelyét/termőhelyeit, melynek öntözéséhez vagy permetezéséhez az 5. cikk (1) bekezdése c) pontjának ii. alpontja szerint fertőzöttnek minősülő vizet használtak,
- a felszíni vízzel - mely esetében megerősítést nyert, hogy a károsítóval fertőzött - elárasztott táblákon termesztett felsorolt növényanyagot.
2. A fertőzés lehetséges terjedésének az 5. cikk (1) bekezdése a) pontjának iv. alpontja és c) pontjának iii. alpontja szerinti meghatározásánál figyelembe vett elemek:
i. az 5. cikk (1) bekezdése a) pontjának iv. alpontja szerinti esetekben:
- a felsorolt növényanyag egyéb termőhelyeinek közelségét,
- a vetőburgonya-készletek közös termesztését és felhasználását,
- a felsorolt növényanyag öntözéséhez vagy permetezéséhez felszíni vizet használó termőhelyeket azokban az esetekben, amikor fennáll vagy fennállt a veszélye, hogy a felszíni víz elfolyik az 5. cikk (1) bekezdése a) pontjának ii) alpontja szerint fertőzöttnek minősített termőhelyekről, vagy elárasztja azokat;
ii. olyan esetekben, amikor az 5. cikk (1) bekezdése c) pontjának ii alpontja szerint a felszíni víz fertőzöttnek minősült:
- a felsorolt növényanyag olyan termőhelyeit, amelyek fertőzöttnek minősített felszíni víz közelében találhatók, vagy amelyeket az ilyen felszíni víz általi elárasztás fenyeget,
- a fertőzöttnek minősített felszíni vízzel összeköttetésben lévő különálló öntözővíz tározókat,
- a fertőzöttnek minősített felszíni vízzel összeköttetésben lévő víztömegeket, figyelembe véve:
- a fertőzött víz folyásirányát és folyási sebességét,
- vadon élő burgonyafélék, mint gazdanövények jelenlétét.
3. Az 5. cikk (2) bekezdése első albekezdésében említett bejelentés részletei a következőkre terjednek ki:
- közvetlenül a károsító jelenlétének a II. mellékletben meghatározott módszerekkel végzett laboratóriumi vizsgálat útján történt megerősítése után, legalább:
- burgonya esetében,
a) a tétel fajtaneve,
b) a típus (áru-, vető-, stb.) és - ahol alkalmazható - a vetőmag kategóriája,
- paradicsom esetében, a tétel fajtaneve és - ahol alkalmazható - a kategória.
- a 4. cikk (3) bekezdésében a feltételezett előfordulás bejelentése tekintetében meghatározott követelmények sérelme nélkül, a tagállam - amelyben az előfordulás megerősítést nyert - amikor fennáll a veszélye másik tagállam(ok)ból érkező vagy oda szállított burgonya megfertőződésének, azonnal közli az érintett tagállammal/tagállamokkal az 5. cikk (3) bekezdésének megfelelő információkat, úgymint:
a) a burgonyatétel fajtaneve;
b) a feladó és a címzett neve és címe;
c) a burgonyatétel szállításának időpontja;
d) a szállított burgonyatétel mérete;
e) a növényútlevél másolata vagy legalább a növényútlevél száma, ahol helyénvaló, valamint ahol helyénvaló, a termelő regisztrációs száma és a szállítási értesítés másolata.
A Bizottságot haladéktalanul értesíteni kell ezen információ közléséről.
4. Az 5. cikk (2) bekezdésének második albekezdésében említett kiegészítő bejelentés részletei a következőkre terjednek ki:
Az összes vizsgálat lezárása után, minden egyes esetben:
a) a fertőzés megerősítésének időpontja;
b) a fertőzés forrásának és lehetséges terjedésének azonosítása céljából végzett vizsgálat rövid leírása, a szintet is beleértve;
c) a fertőzés azonosított vagy vélelmezett forrására/forrásaira vonatkozó információ;
d) a minősített fertőzés mértékére vonatkozó részletek, beleértve a termőhelyek számát és burgonya esetében, a tételek számát a fajta és - vetőburgonyánál - a kategória megjelölésével;
e) a kijelölt övezetre vonatkozó részletek, beleértve a fertőzöttnek nem minősített, de az övezetbe bevont termőhelyek számát;
f) a víz minősítésének részletei, beleértve a víztömeg nevét és helyét, és a minősítés/öntözési tilalom mértékét;
g) a fertőzöttnek minősített paradicsomnövény szállítmányok vagy tételek esetében a 200/29/EK irányelv 13. cikke (1) bekezdésének ii. pontjában előírt okmányok és az útlevélszám, a 2000/29/EK irányelv V. melléklete A. része I.2.2. szakaszának megfelelően;
h) egyéb információk a megerősített kitörésre vonatkozóan a Bizottság esetleges igénye szerint.
VI. MELLÉKLET
1. A 6. cikk (1) bekezdésében említett rendelkezések, melyek az 5. cikk (1) bekezdése a) pontja ii. alpontja szerint fertőzöttnek minősített felsorolt növényanyagra vonatkoznak, a következők:
- állati takarmányként való felhasználás olyan hőkezelés után, hogy ne állhasson fenn a károsító túlélésének a veszélye,
vagy
- mélyre történő elásás egy olyan hulladék-ártalmatlanító telepen, ahol nem áll fenn a veszélye a mezőgazdasági területekre való átszivárgásnak vagy olyan vízforrásokkal való érintkezésnek, amelyeket mezőgazdasági területek öntözésére használhatnak,
vagy
- elégetés,
vagy
- ipari feldolgozás azonnali elszállítással közvetlenül egy olyan feldolgozóüzembe, amely rendelkezik hatóságilag engedélyezett hulladék-ártalmatlanító berendezésekkel, melyek tekintetében megállapítást nyert, hogy nem áll fenn a károsító terjedésének azonosítható veszélye, és rendelkezik egy programmal legalább a szállítójárművek tisztítására és fertőtlenítésére,
vagy
- egyéb intézkedések, feltéve, hogy megállapítást nyert, hogy nem áll fenn a károsító terjedésének azonosítható veszélye; ezekről az intézkedésekről és az indoklásukról értesíteni kell a Bizottságot és a többi tagállamot.
Bármilyen a fenti lehetőségekkel összefüggő vagy azokból eredő fennmaradó hulladékot hatóságilag jóváhagyott módszerekkel kell megsemmisíteni az irányelv VII. mellékletének megfelelően.
2. A felsorolt növényanyagnak a 6. cikk (2) bekezdésében említett megfelelő felhasználása vagy ártalmatlanítása - az érintett tagállam vagy tagállamok illetékes hivatalos szerveinek felügyelete mellett, az illetékes hivatalos szervek közötti megfelelő információcserével e felügyelet mindenkori biztosítása érdekében, és azon tagállam illetékes hivatalos szervének jóváhagyásával az első és a második francia bekezdésben említett hulladék-ártalmatlanító berendezések vonatkozásában, ahol a burgonyát csomagolják vagy feldolgozzák - a következőképpen történik:
i. burgonyagumók esetében,
- fogyasztásra szánt áruburgonyaként való felhasználás, közvetlen szállításhoz és átcsomagolás nélküli felhasználáshoz csomagolva, egy megfelelő hulladék-ártalmatlanító berendezésekkel rendelkező telepen. A vetőburgonyát csak ugyanazon a telepen lehet kezelni, ha arra elkülönítve vagy tisztítás és fertőtlenítés után kerül sor,
vagy
- ipari feldolgozásra szánt áruburgonyaként való felhasználás, és azonnali elszállításra szánva közvetlenül egy olyan feldolgozóüzembe, amely rendelkezik megfelelő hulladék-ártalmatlanító berendezésekkel és egy programmal legalább a szállítójárművek tisztítására és fertőtlenítésére,
vagy
- néhány egyéb felhasználási vagy ártalmatlanítási mód, feltéve, hogy nem áll fenn a károsító terjedésének azonosítható veszélye, és az említett illetékes hivatalos szervek jóváhagyásától függően;
ii. egyéb növényi részek esetében, beleértve a szár- és levélhulladékot,
- megsemmisítés,
vagy
- néhány egyéb felhasználási vagy ártalmatlanítási mód, feltéve, hogy nem áll fenn a károsító terjedésének azonosítható veszélye, és az említett illetékes hivatalos szervek jóváhagyásától függően.
3. A 6. cikk (3) bekezdésében említett eszközök fertőzéstől való mentesítésének megfelelő módszere a tisztítás és - amennyiben helyénvaló - a fertőtlenítés, oly módon, hogy ne álljon fenn a károsító terjedésének azonosítható veszélye, és a tagállamok illetékes hivatalos szerveinek felügyelete mellett végezve.
4. Az 5. cikk (1) bekezdése a) pontja iv. alpontja és c) pontja iii. alpontja szerint létrehozott és a 6. cikk (4) bekezdésében említett kijelölt övezetben/övezetekben a tagállamok által végrehajtandó intézkedéssorozat magában foglalja:
4.1. Az 5. cikk (1) bekezdése a) pontja ii. alpontja szerint fertőzöttnek minősített termőhelyek esetében:
a) védett kultúrának az 5. cikk (1) bekezdése a) pontja ii. alpontja szerint fertőzöttnek minősített tábláján vagy egységében, vagy
i. a fertőzöttséget követő négy tenyészidőszak során,
- intézkedéseket hoznak az árvakelésű burgonya- és paradicsomnövények, valamint a károsító egyéb gazdanövényeinek - beleértve a burgonyafélékhez tartozó gyomnövényeket - eltávolítása céljából,
és
- nem ültetnek:
- burgonyagumókat vagy -növényeket,
- paradicsomnövényeket és -vetőmagokat,
- a károsító biológiájának figyelembevételével,
- egyéb gazdanövényeket,
- olyan Brassica-fajok növényeit, amelyeknél fennáll a károsító túlélésének azonosítható veszélye,
- olyan kultúrákat, amelyeknél fennáll a károsító túlélésének és terjedésének azonosítható veszélye,
- az előző francia bekezdésben meghatározott időszakot követő első burgonya- vagy paradicsomtermesztési évben, és azzal a feltétellel, hogy a táblát mentesnek találták az árvakelésű burgonya- és paradicsomnövényektől, valamint az egyéb gazdanövényektől, beleértve a burgonyafélékhez tartozó gyomnövényeket a hatósági ellenőrzések során az ültetést megelőző legalább két egymást követő tenyészidőszakban,
- burgonya esetében csak az áruburgonya-termesztés engedélyezhető,
- a burgonya és a paradicsom esetében a betakarított burgonyagumókat és paradicsomokat - megfelelő módon - megvizsgálják a II. mellékletben részletezett eljárásnak megfelelően,
- az előző francia bekezdésben említett időszakot követő burgonya- vagy paradicsomtermesztési évben és a megfelelő vetésforgót követően, burgonya ültethető mind vető-, mind áruburgonya-termesztési céllal, valamint a burgonya és a paradicsom esetében elvégzik a 2. cikk (1) bekezdésében részletezett hatósági felmérést;
vagy
ii. a fertőzöttség évét követő öt tenyészidőszakon át,
- intézkedéseket hoznak az árvakelésű burgonya- és paradicsomnövények, valamint a károsító egyéb, természetben fellelhető, gazdanövényeinek - beleértve a burgonyafélékhez tartozó gyomnövényeket - eltávolítása céljából,
és
- az első három évben a táblát fekete ugaroltatják, vagy gabonát termesztenek rajta az azonosított veszélynek megfelelően, vagy állandó legelőként hasznosítják, melyet gyakran és alacsonyan kaszálnak vagy intenzíven legeltetnek, vagy fűmagtermesztés céljára használják, majd a rákövetkező két évben olyan növényekkel ültetik be, amelyek nem gazdanövényei a károsítónak, és amelyek esetében nem áll fenn a károsító túlélésének és terjedésének azonosítható kockázata,
- az előző francia bekezdésben meghatározott időszakot követő első burgonya- vagy paradicsomtermesztési évben, és azzal a feltétellel, hogy a táblát mentesnek találták az árvakelésű burgonya- és paradicsomnövényektől, valamint az egyéb gazdanövényektől, beleértve a burgonyafélékhez tartozó gyomnövényeket a hatósági ellenőrzések során az ültetést megelőző legalább két egymást követő tenyészidőszakban,
- burgonya esetében a vető- vagy az áruburgonya-termesztés engedélyezhető,
- a burgonya és a paradicsom esetében a betakarított burgonyagumókat és paradicsomokat - ahogy megfelelő - megvizsgálják a II. mellékletben részletezett eljárásnak megfelelően;
b) a fertőzött termőhely egyéb tábláin és azzal a feltétellel, hogy az illetékes hivatalos szervek megbizonyosodtak az árvakelésű burgonya- és paradicsomnövények, és a károsító egyéb természetben fellelhető gazdanövényei - beleértve a burgonyafélékhez tartozó gyomnövényeket - által jelentett veszély megszűnéséről:
- a fertőzötté minősítés évét követő tenyészidőszakban, és
- vagy nem ültetnek burgonyagumókat, vagy burgonyanövényeket, vagy valódi burgonyamagokat, vagy a károsító egyéb gazdanövényeit,
vagy
- a burgonyagumók esetében, ültethetnek tanúsított vetőburgonyát kizárólag áruburgonya-termesztés céljára,
- paradicsomnövények esetében a 2000/29/EK irányelv követelményeinek megfelelő vetőmagról termesztett paradicsomnövényeket kizárólag termés-előállítás céljára,
- a fertőzötté minősítés évét követő második tenyészidőszakban,
- a burgonya esetében, vető- vagy áruburgonya termesztés céljára kizárólag tanúsított vetőburgonyát vagy olyan vetőburgonyát ültetnek, amelyet hatóságilag bevizsgáltak a barna rothadás hiányára nézve, és hatósági felügyelet mellett termesztették a 4.1. pontban említettektől eltérő termőhelyeken,
- paradicsomnövények esetében kizárólag a 2000/29/EK irányelv követelményeinek megfelelő vetőmagról termesztett paradicsomnövényeket, vagy vegetatív szaporítás esetén, az ilyen vetőmagoktól származó és hatósági felügyelet mellett a 4.1. pontban említettektől eltérő helyeken termesztett paradicsomnövényeket kell ültetni növény- vagy termés-előállítás céljára.
- legalább a fertőzötté nyilvánítás évét követő harmadik tenyészidőszakban,
- a burgonya esetében, vető- vagy áruburgonya termesztés céljára kizárólag tanúsított vetőburgonyát vagy olyan vetőburgonyát ültetnek, amelyet hatósági felügyelet mellett termesztettek tanúsított vetőburgonyából,
- a paradicsom esetében kizárólag a 2000/29/EK irányelv követelményeinek megfelelő magról vagy ilyen növényről hatósági felügyelet mellett termesztett paradicsomnövények ültethetők növény- vagy termés-előállítás céljára.
- a korábbi francia bekezdésekben említett tenyészidőszakok mindegyikében intézkedéseket hoznak az árvakelésű burgonyanövények és a károsító természetben fellelhető egyéb gazdanövényei eltávolítása céljából, és hatósági vizsgálatot végeznek a fejlődő növényeken a megfelelő időben, és burgonya esetében valamennyi táblán hatóságilag megvizsgálják a betakarított burgonyát a II. mellékletben részletezett eljárásnak megfelelően;
c) közvetlenül az 5. cikk (1) bekezdése a) pontja ii) szerinti fertőzötté minősítés és az azt követő első tenyészidőszak után:
- az összes gépet és tároló létesítményt, amely a termőhelyen található és szerepet kapott a burgonya- vagy paradicsomtermesztésben, megtisztítják, és - amennyiben helyénvaló - fertőtlenítik a megfelelő módszerek felhasználásával, a 3. pontban meghatározottak szerint,
- bevezetik az öntözési és permetezési programok hatósági ellenőrzését, beleértve azok - megfelelő módon való - tilalmát a károsító terjedésének megakadályozása érdekében;
d) egy védett kultúra termőhelyeinek az 5. cikk (1) bekezdése a) pontja ii) alpontja szerint fertőzöttnek minősített olyan egységében, ahol lehetőség van a termesztő közeg teljes cseréjére,
- nem ültetnek burgonyagumókat, burgonyanövényeket, valódi magot vagy a károsító egyéb gazdanövényeit, beleértve a paradicsomnövényeket és vetőmagot, csak akkor, ha a termesztési egységet hatóságilag felügyelt intézkedéseknek vetették alá a károsító elpusztítása és valamennyi gazdanövényanyag eltávolítása céljából, beleértve - legalább - a termesztő közeg teljes cseréjét és a szóban forgó egység és az összes felszerelés tisztítását és - amennyiben helyénvaló - fertőtlenítését, és ezt követően az illetékes hivatalos szervek engedélyt adtak a burgonya- vagy a paradicsomtermesztésre,
és
- burgonyatermesztés esetében, a termesztést tanúsított vetőburgonyával, vagy bevizsgált forrásból származó minigumókkal vagy mikronövényekkel végzik,
- paradicsomtermesztés esetében kizárólag a 2000/29/EK irányelv követelményeinek megfelelő vetőmagról vagy, vegetatív szaporítás esetén, ilyen magról származó és hatósági felügyelet mellett termesztett paradicsomnövényekkel végzik a termesztést,
- bevezetik az öntözési és permetezési programok hatósági ellenőrzését, beleértve azok - megfelelő módon való - tilalmát a károsító terjedésének megakadályozása érdekében.
4.2. A kijelölt övezeten belül, a 4.1. pontban részletezett intézkedések sérelme nélkül, a tagállamok:
a) a fertőzötté nyilvánítást követően azonnal intézkednek az ilyen telephelyen lévő, és a burgonya- vagy paradicsomtermesztésbe bevont valamennyi gép és tárolóhely megtisztításának és fertőtlenítésének biztosításáról - ahogy helyénvaló - a megfelelő módszerek felhasználásával a 3. pontban meghatározottak szerint;
b) azonnal, és a fertőzötté minősítést követő legalább három tenyészidőszakon át:
ba) amennyiben a kijelölt övezet meghatározásra került az 5. cikk (1) bekezdése a) pontja iv) alpontja szerint,
- illetékes hivatalos szerveik által biztosítják a burgonyagumókat vagy paradicsomot termesztő, tároló vagy kezelő telephelyek felügyeletét, azon telephelyek felügyeletével együtt, amelyek burgonya- vagy paradicsomtermesztéshez használt gépeket üzemeltetnek szerződéses alapon,
- megkövetelik, hogy az adott övezeten belül bármiféle burgonyatermesztés céljára kizárólag tanúsított vetőburgonyát vagy hatósági felügyelet mellett termesztett vetőburgonyát használjanak, és hogy betakarítás után az 5. cikk (1) bekezdése a) pontja iii) alpontja szerint feltehetően fertőzöttnek minősített termőhelyen termesztett vetőburgonyát laboratóriumi vizsgálatnak vessék alá,
- megkövetelik a betakarított vetőburgonya készleteknek az áruburgonya készletektől elkülönített kezelését az övezeten belüli összes telephelyen, vagy a vetőburgonya és az áruburgonya készletek kezelése közötti tisztításra és - amennyiben helyénvaló - fertőtlenítésre szolgáló program lebonyolítását,
- megkövetelik, hogy az adott övezeten belül kizárólag a 2000/29/EK irányelv követelményeinek megfelelő vetőmagról vagy, vegetatív szaporítás esetén, ilyen magról származó és hatósági felügyelet mellett termesztett paradicsomnövényeket ültessenek valamennyi paradicsomnövény esetében,
- hivatalos felmérést végeznek a 2. cikk (1) bekezdésében részletezettek szerint,
bb) amennyiben valamely felszíni vizet fertőzöttnek minősítettek az 5. cikk (1) bekezdése c) pontja ii) alpontja szerint, vagy a károsító lehetséges terjedésének elemei közé sorolták az V. melléklet 2. pontjának megfelelően,
- éves felmérést végeznek a megfelelő időben, amely magában foglalja a felszíni vízből és - amennyiben helyénvaló - a vonatkozó vízforrásokban található, burgonyafélékhez tartozó gazdanövényekből történő mintavételt és a felsorolt növényanyagra és az egyéb esetekre a II. mellékletben meghatározott vonatkozó módszereknek megfelelően végzett laboratóriumi vizsgálatot,
- hatósági felügyeletet vezetnek be az öntözési és permetezési programokra, beleértve a fertőzöttnek minősített víznek a felsorolt növényanyag és - amennyiben helyénvaló - egyéb gazdanövények öntözéséhez vagy permetezéséhez való felhasználásának tilalmát a károsító terjedésének megakadályozása érdekében. Ezt a tilalmat felülvizsgálhatják a szóban forgó éves felmérés eredményei alapján, és a minősítéseket visszavonhatják, amennyiben az illetékes hivatalos szervek megbizonyosodtak arról, hogy a felszíni víz már nem fertőzött. A tilalom alatt álló víz felhasználását engedélyezhetik - hatósági felügyelet mellett - a gazdanövények öntözésére vagy permetezésére, amennyiben hatóságilag engedélyezett technikákat alkalmaznak, melyek elpusztítják a károsítót, és megakadályozzák a terjedését,
- a károsítóval fertőzött szilárd vagy folyékony hulladék kibocsátása esetén, hatósági ellenőrzést vezetnek be a felsorolt növényanyagot kezelő ipari feldolgozó- vagy csomagolóüzemek által kibocsátott szilárd vagy folyékony hulladék ártalmatlanítására vonatkozóan;
c) kialakítanak egy programot - amennyiben helyénvaló - a teljes vetőburgonya-készletnek megfelelő időtartam alatt történő lecserélésére.
VII. MELLÉKLET
A VI. melléklet (1) bekezdésében említett hatóságilag jóváhagyott hulladékelhelyezési módszereknek eleget kell tenniük az alábbi rendelkezéseknek, hogy megelőzzék a károsító terjedésének bármilyen azonosítható veszélyét:
i. burgonya- és paradicsomhulladék (beleértve a kiselejtezett burgonyát és burgonyahéjat, valamint a paradicsomot) és bármilyen egyéb, a burgonyához és paradicsomhoz kapcsolódó szilárd hulladékot (beleértve a talajt, köveket és egyéb törmeléket) vagy
- olyan hatóságilag engedélyezett, erre a célra rendelt hulladéklerakó telepen kell elhelyezni, ahol nem áll fenn a kórokozó környezetbe jutásának azonosítható veszélye, pl. a mezőgazdasági területekre való átszivárgással vagy mezőgazdasági területek öntözésére használható vízforrásokkal való érintkezéssel. A hulladékot biztonságos körülmények között közvetlenül a lerakóhelyre kell szállítani, oly módon, hogy ne álljon fenn a hulladék elveszítésének veszélye,
vagy
- elégetés,
vagy
- egyéb intézkedések, feltéve hogy megállapítást nyert, hogy nem áll fenn a károsító terjedésének azonosítható veszélye; ezekről az intézkedésekről értesíteni kell a Bizottságot és a többi tagállamot;
ii. technológiai szennyvíz: az elhelyezést megelőzően a lebegő szilárd anyagokat tartalmazó szennyvizet szűrési vagy ülepítési eljárásnak kell alávetni e szilárd anyagok eltávolítása érdekében. Ezeket a szilárd anyagokat az i. albekezdésben foglaltak szerint kell elhelyezni.
A folyadékot ezt követően vagy:
- úgy kell hőkezelni az elhelyezést megelőzően, hogy a szennyvíz minden részében a hőmérséklet 30 percen keresztül legalább 60 °C legyen,
vagy
- egyéb olyan hatóságilag engedélyezett és hatóságilag felügyelt módon kell elhelyezni, amelynél nem áll fenn a hulladék mezőgazdasági területtel vagy a mezőgazdasági terület öntözésére felhasználható vízforrásokkal való érintkezésének azonosítható veszélye. Ennek módozatairól értesíteni kell a többi tagállamot és a Bizottságot.
Az e mellékletben meghatározott rendelkezéseket kell alkalmazni a fertőzött tételek kezelésére, elhelyezésére és feldolgozására vonatkozóan is.
"
(1) Lásd: Lelliott és Stead (1987)
(2) Kapcsolattartó kutatók: lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main
(3) Használjuk az R. solanacearum 2. biovariánsba/3. rasszba tartozó referencia törzseként.
(4) A szerológiai vizsgálatokban (IF és/vagy ELISA) a poliklonális antiszérummal potenciálisan keresztreakciót mutató törzs.
(5) Olyan törzs, amelyből PCR-terméket lehet felerősíteni néhány laboratóriumban, melynek mérete hasonló az OLI-1 és Y-2 specifikus primerek használata esetén várhatóhoz (lásd a 6. függeléket).
(6) Valószínű, hogy a legtöbb vizsgálatban keresztreakciót mutat, de ismereteink szerint csak Indonéziában és csak banánon fordul elő.
(7) A homogenizálással végzett kivonási módszerhez.
(8) A módszer validálását Taq polimeráz felhasználásával végezték (Perkin Elmer (AmpliTaq) és Gibco BRL).
(9) A módszereket Taq polimeráz felhasználásával validálták (Perkin Elmer (AmpliTaq) és Gibco BRL).
Megjegyzés: Eredetileg MJ Research PTC 200 thermocycler-re optimalizálták Gibco Taq polimerázzal.
A Perkin Elmer AmpliTaq és a puffer alkalmazható azonos koncentrációban.
(10) A módszereket Taq polimeráz felhasználásával validálták (Perkin Elmer (AmpliTaq) és Gibco BRL).
(11) Az NS-5-F és az NS-6-R primerek koncentrációját a burgonyagumó köldökrészéből vett darab homogenizációs módszerrel végzett extrakciójára és a Pastrik-féle DNS-tisztításra (2000) optimalizálták (lásd a VI.A.6.1.a. szakaszt). A reagens koncentrációk újraoptimalizálására lesz szükség rázással végzett extrakció vagy eltérő DNS-izolálási módszerek használata esetén.
(12) A módszerek Taq polimeráz felhasználásával validálták (Perkin Elmer (AmpliTaq) és Gibco BRL).
(13) A módszereket Taq polimeráz felhasználásával validálták (Perkin Elmer (AmpliTaq) és Gibco BRL).
Lábjegyzetek:
[1] A dokumentum eredetije megtekinthető CELEX: 32006L0063 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:32006L0063&locale=hu


