31993L0085[1]
A Tanács 93/85/EGK irányelve (1993. október 4.) a burgonya gyűrűs rothadása elleni védekezésről
A TANÁCS 93/85/EGK IRÁNYELVE
(1993. október 4.)
a burgonya gyűrűs rothadása elleni védekezésről
AZ EURÓPAI KÖZÖSSÉGEK TANÁCSA,
tekintettel az Európai Gazdasági Közösséget létrehozó szerződésre és különösen annak 43. cikkére,
tekintettel a Bizottság javaslatára ( 1 ),
tekintettel az Európai Parlament véleményére ( 2 ),
tekintettel az Európai Gazdasági és Szociális Bizottság javaslatára ( 3 ),
mivel a burgonyatermesztés fontos helyet foglal el a Közösség mezőgazdaságában; mivel a burgonyatermést folyamatosan veszélyeztetik a károsító szervezetek;
mivel a burgonyatermesztésnek e károsítók elleni védekezéssel nemcsak a termelési kapacitást lehet fenntartani, hanem növelhető a mezőgazdasági termelékenység is;
mivel a károsító szervezeteknek egy tagállam területére történő behurcolása elleni védekezési intézkedések csak korlátozottan hatásosak, amennyiben ezek ellen a károsítók ellen nem védekeznek egyidejűleg és módszeresen a Közösség egész területén és nem akadályozzák meg elterjedésüket;
mivel a burgonyában kárt okozó egyik károsító a Clavibacter michiganensis (Smith) Davis et al. ssp. sepedonicus (Spieckermann et Kotthoff) Davis et al., a burgonya gyűrűs rothadás betegségének kórokozója; mivel ez a betegség előfordult a Közösség egyes területein és néhány fertőzési forrás még mindig létezik;
mivel a burgonyatermesztés jelentős kockázattal jár a Közösségben, ha nem születnek hatékony intézkedések a betegség lokalizálására és elterjedésének meghatározására, előfordulása és elterjedése megakadályozására, és ha a betegség előfordul, elterjedése megakadályozására és - felszámolás céljával - az ellene való védekezésre;
mivel ennek biztosítására bizonyos intézkedéseket kell tenni a Közösségen belül; mivel a növények vagy növényi eredetű termékek károsító szervezeteinek a tagállamokba történő behurcolása elleni védekezési intézkedésekről szóló, 1976. december 21-i 77/93/EGK tanácsi irányelvben ( 4 ) meghatározottakon túlmenően a tagállamoknak szükség esetén képesnek kell lenniük további vagy szigorúbb intézkedések meghozatalára, feltéve hogy ez nem hátráltatja a burgonya Közösségen belüli szállítását; mivel ezekről az intézkedésekről tájékoztatni kell a többi tagállamot és a Bizottságot;
mivel a burgonya gyűrűs rothadása elleni védekezéséről szóló, 1980. június 24-i 80/665/EGK tanácsi irányelv ( 5 ) meghatározza a tagállamok számára a burgonya gyűrűs rothadása elleni minimális intézkedéseket;
mivel azóta jelentős mértékben nőttek a burgonya gyűrűs rothadásával kapcsolatos ismeretek, és fejlődés történt a burgonya gyűrűs rothadás kórokozójának felismerésében;
mivel a közösségi növény-egészségügyi rendszernek a Közösségre mint belső határok nélküli területre való alkalmazása szükségessé tette a 80/665/EGK irányelv néhány rendelkezésének átvizsgálását és felülvizsgálatát;
mivel ezen átvizsgálás eredményeként a 80/665/EGK irányelv rendelkezései nem bizonyultak elégségesnek és további intézkedések meghatározása szükséges;
mivel ebben a helyzetben a 80/665/EGK irányelvet hatályon kívül kell helyezni és a szükséges intézkedéseket el kell fogadni;
mivel az intézkedéseknek figyelembe kell venniük elsősorban azt, hogy a betegség látens és észrevétlen maradhat mind a fejlődő növényekben, mind pedig a raktározott burgonyagumókban, és így csak a fertőzéstől mentes vetőburgonya előállításával és felhasználásával lehet ellene hatékonyan védekezni, és másodsorban azt, hogy a lokalizáláshoz rendszeres hivatalos felmérések szükségesek; mivel nem a kórokozónak a fejlődésben lévő növényben való elterjedése a legfontosabb tényező, hanem az, hogy a kórokozó árvakelésű burgonyanövényben áttelel, és ezek az egyik évszakról a másikra átvitt fertőzés legjelentősebb forrásai; mivel a kórokozó leginkább úgy terjed el, hogy a burgonya fertőzött burgonyával vagy olyan palántázó-, betakarító- és kezelőeszközökkel vagy szállító- és tárolókonténerekkel érintkezik, amelyek korábban fertőzött burgonyával érintkeztek, és így megfertőződtek; mivel ezek a fertőzött tárgyak a fertőződést követően egy ideig még fertőzőek maradhatnak; mivel a kórokozó elterjedése csökkenthető vagy megelőzhető ezeknek a tárgyaknak a fertőtlenítésével; mivel a vetőburgonya bármilyen ilyen fertőzése a kórokozó elterjedésének súlyos veszélyével fenyeget;
mivel ezen általános intézkedések részletes meghatározása, valamint a tagállamok által hozott, a kórokozónak a területükre történő behurcolását megelőző, további vagy szigorúbb intézkedések meghatározása céljából kívánatos a szoros együttműködés a Bizottsággal a Növény-egészségügyi Állandó Bizottság (a továbbiakban: "a bizottság") keretein belül,
ELFOGADTA EZT AZ IRÁNYELVET:
1. cikk
Ez az irányelv a tagállamokban a burgonya gyűrűs rothadását okozó Clavibacter michiganensis (Smith) Davis et al. ssp. sepedonicus (Spieckermann et Kotthoff) Davis et al. (a továbbiakban: "a károsító") ellen meghozandó intézkedésekre vonatkozik, azzal a céllal, hogy:
a) a károsítót lokalizálni lehessen, és meg lehessen határozni elterjedését;
b) meg lehessen előzni előfordulását és terjedését; és hogy
c) felfedezése esetén elterjedését meg lehessen előzni és a felszámolás céljával ellene védekezni lehessen.
2. cikk
(1) A tagállamok területükről származó burgonyagumókon, és szükség esetén a burgonyanövényeken (Solanum tuberosum L.) a károsítóra vonatkozó rendszeres hivatalos felméréseket végeznek, hogy megerősítsék annak hiányát.
Ezekhez a felmérésekhez burgonyagumók esetében, lehetőleg raktári tételből származó vetőburgonyából és más burgonyából kell mintát venni, és hatósági vagy hatóságilag felügyelt laboratóriumban, az I. mellékletben meghatározott, a kárósítóra vonatkozó észlelő és diagnosztizáló módszer alapján kell megvizsgálni. Továbbá, amennyiben szükséges, további hatósági vagy hatóságilag felügyelt szemrevételezés végezhető más minták gumóinak felvágásával.
Növények esetén ezeket a felméréseket megfelelő módszerek szerint végzik, és a mintákat megfelelő hatósági vagy hatóságilag felügyelt vizsgálatoknak vetik alá.
A minták számát, származását, rétegzettségét és begyűjtésének idejét a 77/93/EGK irányelv értelmében illetékes hivatalos szervek határozzák meg megalapozott tudományos és statisztikai elvek, illetve a károsító biológiája alapján, figyelembe véve az érintett tagállam burgonyatermesztési rendszereit. Ezek részleteit évente eljuttatják a többi tagállamhoz és a Bizottsághoz, hogy a tagállamok között biztosítsák a károsító hiányának megerősítésére vonatkozó összehasonlítható biztosítékszinteket.
(2) Az (1) bekezdésben meghatározott hivatalos felmérések eredményeit évente legalább egyszer közlik a többi tagállammal és a Bizottsággal. A jelentésben szereplő adatok bizalmasak. Az adatok a 77/93/EGK irányelv 16a. cikkében szabályozott eljárásnak megfelelően nyújthatók be a Bizottsághoz.
(3) Az alábbi rendelkezéseket a 77/93/EGK irányelv 16a. cikkében szabályozott eljárásnak megfelelően kell meghozni:
- a fenti (1) bekezdésben meghatározott azon felmérések részletei, amelyeket a megalapozott tudományos és statisztikai elvek alapján kell elvégezni,
- a fenti (2) bekezdés szerinti jelentés részletei.
(4) Az alábbi rendelkezéseket a 77/93/EGK irányelv 16a. cikkében szabályozott eljárásnak megfelelően valósítják meg:
- a fenti (1) bekezdés harmadik albekezdése szerinti felmérések és vizsgálatok megfelelő módszere.
3. cikk
A tagállamok biztosítják, hogy a károsító feltételezett előfordulását vagy bizonyított jelenlétét a burgonyanövényen és gumókon, vagy a területükön betakarított, tárolt vagy forgalomba hozott gumókon a saját illetékes hivatalos szerveiknek jelentik.
4. cikk
(1) A feltételezett előfordulás esetén annak a tagállamnak az illetékes hivatalos szervei, amelyben ezen eseteket jelentették, biztosítják a hatósági vagy hatóságilag felügyelt laboratóriumi vizsgálatok elvégzését az I. melléklet szerinti módszer alapján, illetve a II. melléklet 1. pontja szerinti feltételeknek megfelelően a feltételezett előfordulás megerősítése vagy cáfolása céljából. Az előbbi esetre a II. melléklet 2. pontjában meghatározott követelmények vonatkoznak.
(2) Az (1) bekezdés szerinti feltételezett előfordulás megerősítéséig vagy megcáfolásáig azokban a feltételezett előfordulási esetekben, amikor:
i. a betegség feltételezett látható tünetei voltak láthatók; vagy
ii. az I. mellékletben meghatározott immunofluoreszcens teszt vagy egyéb megfelelő vizsgálat eredménye pozitív;
a tagállamok illetékes hivatalos szervei:
a) megtiltják az összes olyan tételnek vagy szállítmánynak a mozgását, amelyekből a mintákat vették, kivéve ha ezeket ellenőrzésük alatt tartották, és feltéve hogy megállapítást nyert, hogy a károsító elterjedésének nincsen azonosítható kockázata;
b) lépéseket tesznek a feltételezhető előfordulás forrásának felkutatására;
c) a becsült kockázati szintet alapul véve további megfelelő óvintézkedéseket tesznek, hogy megakadályozzák a károsító elterjedését. Ezek az intézkedések kiterjedhetnek az összes gumó vagy növény szállításának ellenőrzésére a feltételezett előfordulással kapcsolatos helyiségekben vagy azokon kívül.
(3) Az alábbi rendelkezések a 77/93/EGK irányelv 16a. cikkében meghatározott eljárással összhangban fogadhatók el:
- a fenti (2) bekezdés c) pontjában hivatkozott intézkedések.
(4) Az alábbi rendelkezések a 77/93/EGK irányelv 16a. cikkében meghatározott eljárással összhangban fogadhatók el:
- a fenti (2) bekezdés ii. pontjában megállapított egyéb megfelelő vizsgálatok.
5. cikk
(1) Amennyiben az I. melléklet szerinti eljárást alkalmazó hatósági vagy hatóságilag felügyelt laboratóriumi vizsgálat megerősíti a gumók vagy a növények vagy a növényi részek mintájában a károsító jelenlétét, a tagállam illetékes hivatalos szervei, a megalapozott tudományos elvekre, a károsító biológiájára és a tagállam termelési, marketing- és feldolgozási rendszereire tekintettel:
a) fertőzöttnek nyilvánítják azokat a gumókat vagy növényeket, szállítmányokat és/vagy tételt, és gépeket, járműveket, edényeket, raktárakat vagy azok egységeit, illetve minden tárgyat, a csomagolóanyagokat is ideértve, amelyekből a mintát vették és amennyiben szükséges, azokat a termőhelye(ke)t és a táblá(ka)t, ahonnan a gumókat vagy növényeket betakarították;
b) a III. melléklet 1. pontja rendelkezéseinek figyelembevételével megállapítják a fertőzés valószínűsíthető mértékét, amely a betakarítás előtti vagy utáni érintkezés miatt vagy amiatt jött létre, hogy termelési kapcsolat áll fenn a meghatározott fertőzéssel;
c) a III. melléklet 2. pontjának rendelkezéseit figyelembe véve az a) pontban meghatározott fertőzés b) pont szerinti valószínűsíthető mértéke, és a károsító lehetséges elterjedése alapján egy övezetet jelölnek ki.
(2) A tagállamok a III. melléklet 3. pontjának rendelkezéseivel összhangban haladéktalanul értesítik a többi tagállamot és a Bizottságot bármilyen, az (1) bekezdés a) pontjában meghatározott fertőzésről és az (1) bekezdés c) pontja szerinti övezet kijelölésének részleteiről.
Ezen értesítés részletei bizalmasak. Az értesítések a 77/93/EGK irányelv 16a. cikkében meghatározott eljárással összhangban nyújthatók be a bizottsághoz.
(3) A (2) bekezdés szerinti értesítés és az abban szereplő adatok eredményeként, az értesítésben szereplő többi tagállam szükség esetén az (1) bekezdés a), b) és c) pontjával összhangban megállapítja a fertőzést, meghatározza a valószínűsíthető fertőzés mértékét és egy övezetet jelöl ki.
6. cikk
A tagállamok előírják, hogy amennyiben a gumókat vagy növényeket az 5. cikk (1) bekezdésének a) pontja szerint fertőzöttnek nyilvánították, a 4. cikk (1) bekezdése szerinti vizsgálatot kell végezni azokon a burgonyakészleteken, amelyek klonális rokonságban vannak a fertőzésben érintettekkel. A vizsgálatot annyi ilyen gumón és növényen végzik el, amennyi szükséges a fertőzés valószínűsíthető elsődleges forrásának és a fertőzés valószínűsíthető mértékének meghatározásához, lehetőleg a kockázat mértéke által meghatározott sorrendben.
A vizsgálatok eredményeként az 5. cikk (1) bekezdésének a), b) és c) pontjának megfelelő módon a fertőzés további meghatározására, a valószínűsíthető fertőzés mértékének megállapítására és övezetkijelölésre kerül sor.
7. cikk
(1) A tagállamok előírják, hogy az 5. cikk (1) bekezdésének a) pontja szerint fertőzöttnek nyilvánított gumók vagy növények nem ültethetők el, valamint az illetékes hivatalos szerveik ellenőrzésével:
- megsemmisítésre kerülnek, vagy
- a IV. melléklet 1. pontjának rendelkezéseivel összhangban levő, hatóságilag felügyelt intézkedéssel/intézkedésekkel valamilyen más módon ártalmatlanításra kerülnek, feltéve hogy megállapítást nyer, hogy a károsító elterjedésének nincs azonosítható kockázata.
(2) A tagállamok előírják, hogy az 5. cikk (1) bekezdésének b) pontja alapján valószínűsíthetően fertőzöttnek nyilvánított gumók vagy növények nem ültethetők el, és - a klonális rokonságban lévő készleteken elvégzendő 6. cikk szerinti vizsgálat eredményének sérelme nélkül - az illetékes hivatalos szerveik ellenőrzésével a IV. melléklet 2. pontjában meghatározott felhasználásra vagy ártalmatlanításra kerülnek olyan módon, hogy megállapítható, hogy a károsító elterjedésének nincs azonosítható kockázata.
(3) A tagállamok előírják, hogy az 5. cikk (1) bekezdésének a) pontja szerint fertőzöttnek vagy b) pontja alapján valószínűsíthetően fertőzöttnek nyilvánított bármilyen gép, jármű, edény, tároló vagy azok egységei, illetve bármilyen más tárgy, beleértve a csomagolóanyagot is, megsemmisítésre vagy tisztításra és fertőtlenítésre kerülnek az IV. melléklet 3. pontjában meghatározott megfelelő módszerekkel. A fertőtlenítést követően ezek a tárgyak nem minősülnek fertőzöttnek.
(4) Az (1), (2) és (3) bekezdés szerint végrehajtott intézkedések sérelme nélkül a tagállamok előírják, hogy az 5. cikk (1) bekezdésének c) pontja szerint kijelölt övezetben a IV. melléklet 4. pontja szerinti intézkedéssorozatot kell végrehajtani.
8. cikk
(1) A tagállamok előírják, hogy a vetőburgonyának meg kell felelnie a 77/93/EGK irányelv követelményeinek, és közvetlenül egy olyan, hatóságilag jóváhagyott programban megszerzett anyagból kell származnia, amelyet az I. melléklet által előírt hatósági vagy hatóságilag felügyelt vizsgálatban a károsítótól mentesnek találtak.
A fenti vizsgálatot:
- amennyiben a fertőzés érinti a vetőburgonya termelését, a kezdeti klónszelekció növényein,
- más esetekben pedig vagy a kezdeti klónszelekció növényein, vagy a vetőburgonya reprezentatív mintáin, vagy a korábbi szaporításokon
kell elvégezni.
(2) Az alábbi rendelkezéseket a 77/93/EGK irányelv 16a. cikkében meghatározott eljárással összhangban kell elfogadni:
- e cikk (1) bekezdése második albekezdésének első francia bekezdése végrehajtásának részletes szabályai,
- e cikk (1) bekezdése második albekezdésének második francia bekezdése szerinti reprezentatív mintákra vonatkozó szabályok.
9. cikk
A tagállamok megtiltják a károsító tartását és kezelését.
10. cikk
A 77/93/EGK irányelv rendelkezéseinek sérelme nélkül a tagállamok eltéréseket engedélyezhetnek ezen irányelv 6., 7. és 9. cikkében meghatározott intézkedésektől kísérleti vagy tudományos célú és fajtaszelekciós tevékenység céljából, feltéve hogy ezek az eltérések nem sértik a károsító ellenőrzését és nem fenyegetnek a károsító elterjedésével.
11. cikk
A tagállamok, ha szükséges, a károsító elleni védekezés kapcsán vagy elterjedésének megakadályozására további, illetve szigorúbb intézkedéseket fogadhatnak el, amennyiben azok összhangban vannak a 77/93/EGK irányelv rendelkezéseivel.
Az első albekezdésben említett további rendelkezések kiterjedhetnek annak előírására, hogy csak olyan vetőburgonya ültethető, amely hivatalos tanúsítvánnyal rendelkezik, vagy amelyet hivatalosan megvizsgáltak a tekintetben, hogy megfelelnek az előírt növény-egészségügyi követelményeknek. Ez utóbbi különösen arra az esetre vonatkozhat, mikor a termelők a saját birtokukon jogosultak a saját termésből származó vetőburgonya használatára, illetve egyéb olyan esetekre, amikor saját termelésű vetőburgonyát ültetnek.
Ezen intézkedések részleteiről tájékoztatják a többi tagállamot és a Bizottságot.
12. cikk
Ezen irányelv mellékleteinek módosításai a tudományos vagy technikai ismeretek fejlődésére való tekintettel a 77/93/EGK irányelv 16a. cikkében meghatározott eljárással összhangban fogadhatók el.
13. cikk
(1) A tagállamok legkésőbb 1993. november 15-ig elfogadják és kihirdetik azokat a rendelkezéseket, amelyek szükségesek ahhoz, hogy ennek az irányelvnek megfeleljenek. Erről haladéktalanul tájékoztatják a Bizottságot.
Amikor a tagállamok elfogadják ezeket az intézkedéseket, azokban hivatkozni kell erre az irányelvre, vagy azokhoz hivatalos kihirdetésük alkalmával ilyen hivatkozást kell fűzni. A hivatkozás módját a tagállamok határozzák meg.
A tagállamok ezeket a rendelkezéseket 1993. november 16-tól alkalmazzák.
(2) A tagállamok haladéktalanul közlik a Bizottsággal nemzeti joguknak azokat a rendelkezéseit, amelyeket az ezen irányelv által szabályozott területen fogadnak el. A Bizottság tájékoztatja erről a többi tagállamot.
14. cikk
A 80/665/EGK irányelv 1993. november 16-tól kezdődően hatályát veszti.
15. cikk
Ennek az irányelvnek a tagállamok a címzettjei.
I. MELLÉKLET
VIZSGÁLATI PROGRAM A GYŰRŰS ROTHADÁS BAKTÉRIUM, CLAVIBACTER MICHIGANENSIS (Smith) Davis et al. ssp. SEPEDONICUS (Spieckermann et Kotthoff) Davis et al. DIAGNOSZTIZÁLÁSÁRA, KIMUTATÁSÁRA ÉS AZONOSÍTÁSÁRA
A VIZSGÁLATI PROGRAM HATÓKÖRE
A bemutatott program az alábbi esetekben használt eljárások leírását tartalmazza:
i. A gyűrűs rothadás diagnosztizálása burgonyagumókban és burgonyanövényekben;
ii. A Clavibacter michiganensis ssp. sepedonicus kimutatása burgonyagumó- és burgonyanövény-mintákban;
iii. A Clavibacter michiganensis ssp. sepedonicus (C. m. subsp. sepedonicus) azonosítása.
ÁLTALÁNOS ALAPELVEK
A különböző módszerek optimalizált protokolljai, a validált reagensek, valamint a vizsgálati- és a kontrollanyagok elkészítésének részletei megtalálhatók a függelékekben. A protokollok optimalizálásába és validálásába bevont laboratóriumok felsorolása az 1. függelékben található.
Mivel a protokollok egy zárlati károsító kimutatásával járnak, és életképes C. m. subsp. sepedonicus tenyészetek kontrollanyagként történő felhasználását fogják magukban foglalni, szükséges lesz, hogy az eljárások elvégzésére megfelelő növény-egészségügyi zárlati feltételek mellett - beleértve a hulladék ártalmatlanítására szolgáló megfelelő berendezéseket - valamint a hivatalos növény-egészségügyi zárlatért felelős hatóságok által kiállított megfelelő engedély feltételei szerint kerüljön sor.
A vizsgálati paramétereknek biztosítaniuk kell a C. m. subsp. sepedonicus szintjének következetes és reprodukálható kimutatását a kiválasztott módszerek megadott küszöbértéke esetén.
A pozitív kontrollok precíz elkészítése elengedhetetlenül szükséges.
A szükséges küszöbértékek szerinti vizsgálat ugyancsak magában foglalja az eszközök helyes beállítását, karbantartását és kalibrációját, a reagensek gondos kezelését és megőrzését, valamint minden olyan intézkedést, amely a minták közötti átfertőződés megakadályozását szolgálja, pl. a pozitív kontrollok elválasztása a vizsgálati mintáktól. Az adminisztratív és egyéb hibák elkerülése érdekében minőségellenőrzési előírásokat kell alkalmazni, különösen a címkézés és a dokumentáció vonatkozásában.
A károsító előfordulásának a 93/85/EGK irányelv 4. cikke (2) bekezdésében említett gyanúja feltételezi a folyamatábrákban meghatározott mintán elvégzett diagnosztikai vagy szűrővizsgálatok pozitív eredményét.
Ha az első szűrővizsgálat (IF vagy PCR/FISH) pozitív, akkor a Cms-sel való fertőzöttség gyanúja fennáll, és egy második szűrővizsgálatot kell elvégezni. Ha a második szűrővizsgálat pozitív, akkor a gyanú megerősítésre került (gyanított előfordulás), és az eljárás szerinti vizsgálatokat kell lefolytatni. Ha a második szűrővizsgálat negatív, akkor úgy tekintik, hogy a minta nem fertőzött a Cms-sel.
Ezért a 4. cikk (2) bekezdésében említett pozitív IF-tesztet a pozitív IF-leolvasás határozza meg, melyet a második szűrővizsgálat (PCR/FISH) erősít meg.
A 93/85/EGK irányelv 5. cikke (1) bekezdésében említett megerősített előfordulás feltételezi a C. m. subsp. sepedonicus tiszta tenyészetének izolálását és azonosítását, beleértve a patogenitás megerősítését.
1. A FOLYAMATÁBRÁK ISMERTETÉSE
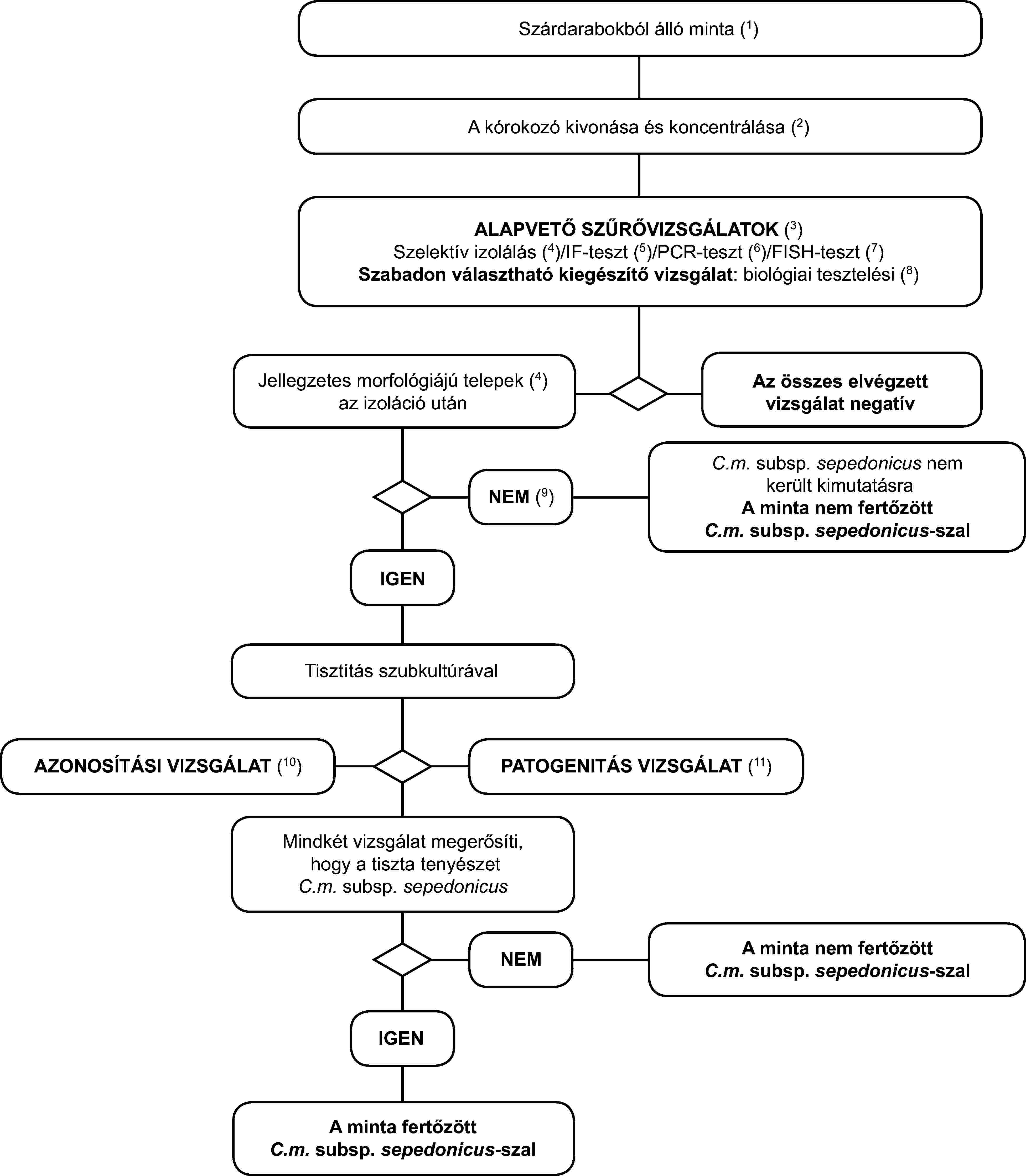
1.1. Kimutatási program a gyűrűs rothadás diagnosztizálására a gyűrűs rothadás tüneteit mutató burgonyagumókban és burgonyanövényekben
A vizsgálati eljárás a gyűrűs rothadás jellegzetes vagy gyanított tüneteit mutató burgonyagumók és burgonyanövények vizsgálatára szolgál. Tartalmaz egy gyors szűrővizsgálatot, a kórokozó fertőzött edénynyaláb-szövetből történő izolálását diagnosztikai táptalajon, és - pozitív eredmény esetén - a tenyészet azonosítását C. m. subsp. sepedonicus-ként.
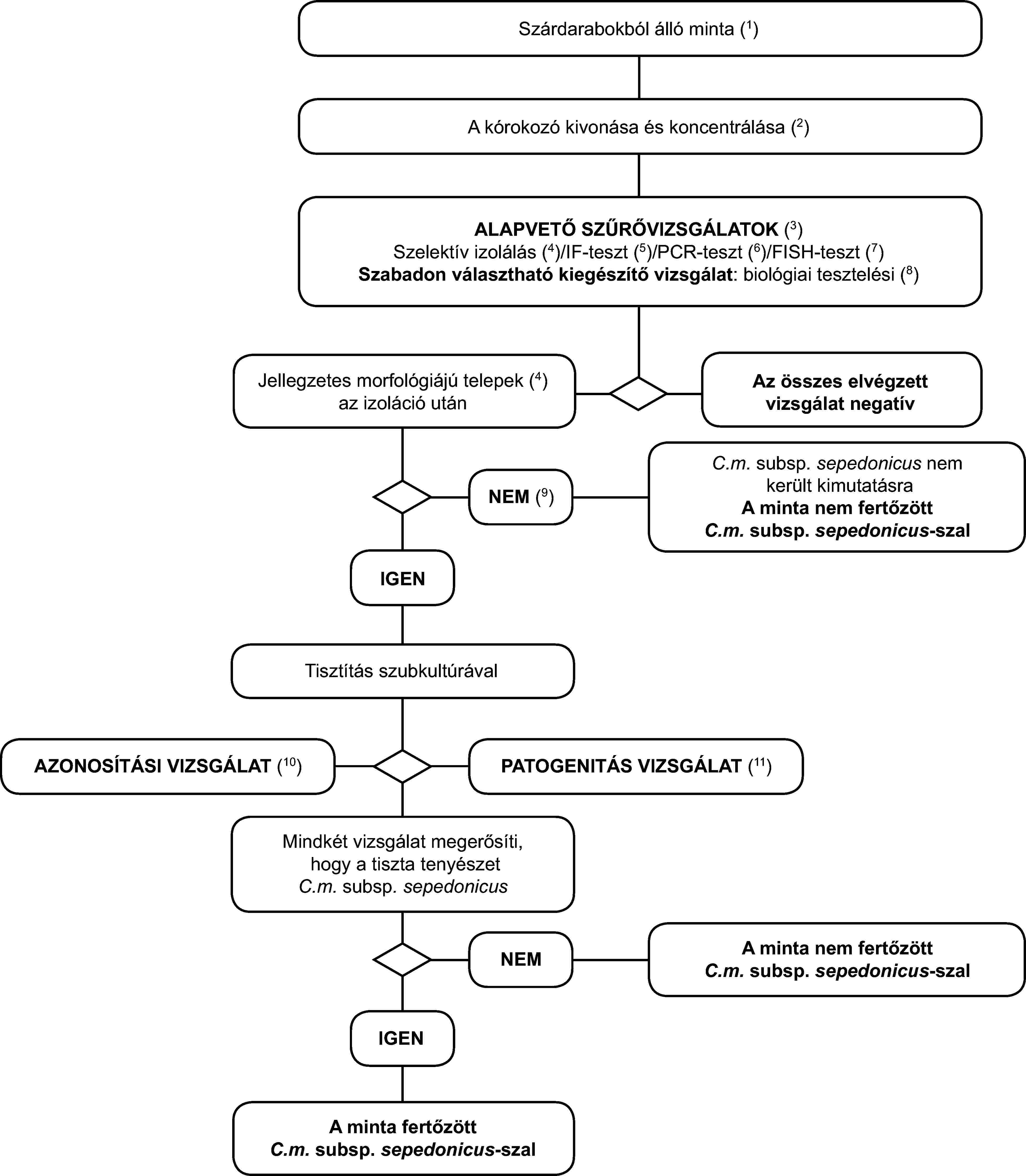
1.2. A Clavibacter michiganensis ssp. sepedonicus tünetmentes burgonyagumó-mintákban történő kimutatásának és azonosításának programja
Az alapelv
A vizsgálati eljárás a látens fertőzések burgonyagumókban történő kimutatására szolgál. Legalább két - eltérő biológiai elven alapuló - szűrővizsgálat pozitív eredményét ki kell egészíteni a kórokozó izolálásával; ezt jellegzetes telepek izolálása esetén a tiszta tenyészet C. m. subsp. sepedonicus-ként történő azonosítása követi. Mindössze egy szűrővizsgálat pozitív eredménye nem elegendő a minta gyanúsnak tekintéséhez.
A szűrővizsgálatoknak és az izolálási vizsgálatoknak lehetővé kell tenniük 103-104 sejt/ml újraszuszpendált üledékben kimutatását, amely pozitív kontrollként kerül alkalmazásra minden egyes vizsgálati sorozatnál.
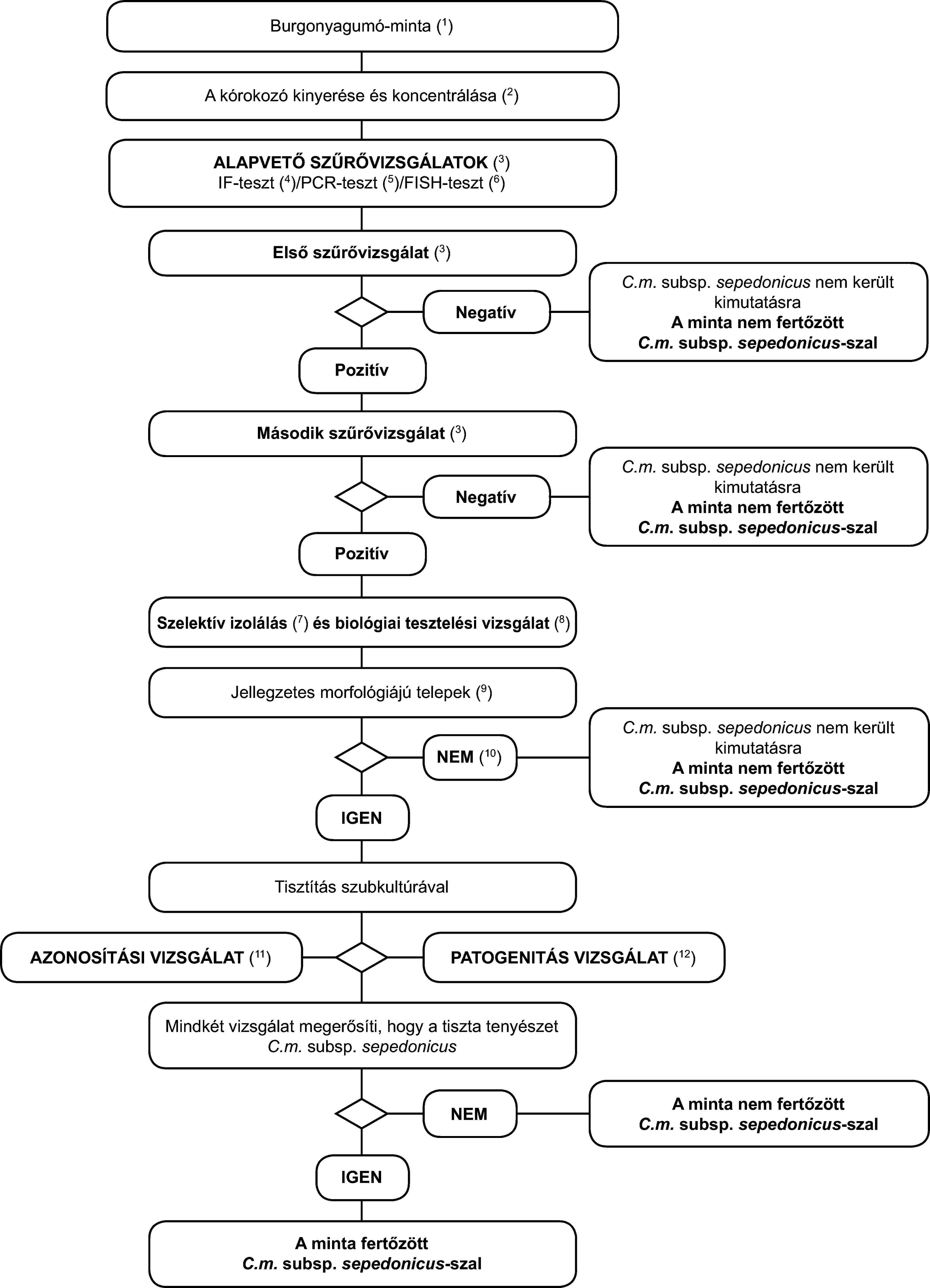

1.3. A Clavibacter michiganensis ssp. sepedonicus tünetmentes burgonyanövényekből történő kimutatásának és azonosításának programja

2. A GYŰRŰS ROTHADÁS TÜNETEINEK SZEMREVÉTELEZÉSES VIZSGÁLATA
2.1. Burgonyanövények
Az európai éghajlati adottságok között a tünetek ritkán észlelhetők a szántóföldön, és gyakran csak a tenyészidőszak végén. Továbbá a tüneteket gyakran elfedik más betegségek, az öregedés vagy mechanikai sérülések, illetve azokkal keverik össze a tüneteket. Ezért a tünetek könnyen észrevétlenek maradnak a szántóföldi vizsgálatok során. A hervadási tünetek nagyon különböznek a barna rothadásnál jelentkezőktől; a hervadás rendszerint lassú, és eleinte a levélszélekre korlátozódik. A fertőzött fiatal levelek gyakran továbbra is fejlődnek, bár a fertőzött részeken kisebb mértékben. Ez szabálytalan alakú levelek kialakulásához vezet. A lejjebb a szárban lévő edénynyaláb-szövetek elzáródása által befolyásolt leveleken gyakran alakulnak ki klorotikus levélér közötti foltok, melyek színe a sárgától a narancssárgáig terjed. A fertőzött levélkék, levelek és végül még a szárak is elpusztulhatnak. Gyakran a levelek és a gumók egyszerűen csak elsorvadnak. Esetenként a növények visszamaradnak a fejlődésben. A honlapon megtalálható egy sor tünet színes fényképe: http://forum.europa.eu.int/Public/irc/sanco/Home/main
2.2. Burgonyagumók
A legkorábbi tünet a szövet enyhe üvegessége vagy áttetszősége a körülötte lévő edénynyaláb-rendszer megpuhulása nélkül, különösen a köldökrészhez közel. A köldökrészen lévő edénynyaláb-gyűrű színe kissé sötétebb lehet a normálisnál. Az első könnyen azonosítható tünet az, amikor az edénynyaláb-gyűrű sárgás elszíneződést mutat, és a gumóból enyhe nyomásra sajtszerű anyag tör elő oszlop alakban az edénynyalábokból. Ez a váladék baktériumok millióit tartalmazza. Az edénynyaláb-szövet megbarnulhat, és a gumón jelentkező tünetek ebben a stádiumban hasonlítanak a Ralstonia solanacearum által okozott barna rothadás tüneteihez. Először ezek a tünetek a gyűrű egyik szakaszára korlátozódhatnak, nem feltétlenül a köldökrészhez közelire, majd fokozatosan kiterjedhetnek az egész gyűrűre. A fertőzés előrehaladtával az edénynyaláb-szövet pusztul; a külső háncsrész elválhat a belsőtől. A fertőzés előrehaladott stádiumaiban a gumó felszínén repedések jelennek meg, melyek szélei gyakran vörösesbarnák. Az utóbbi időben Európában számos olyan eset volt, amikor a középső háncsrész az edénynyaláb-gyűrűvel párhuzamosan rothadt, ami másodlagos inváziót eredményezett belső üregképződéssel és nekrózissal. A másodlagos gombás vagy baktériumos invázió elfedheti a tüneteket, és nehézzé, sőt lehetetlenné is válhat, az előrehaladott gyűrűs rothadás tüneteinek megkülönböztetése más gumórothadásoktól. Atipikus tünetek is lehetnek. A honlapon megtalálható egy sor tünet színes fényképe: http://forum.europa.eu.int/Public/irc/sanco/Home/main
3. MINTAELŐKÉSZÍTÉS
3.1. Burgonyagumók
Megjegyzés:
- A standard mintaméret 200 burgonyagumó vizsgálatonként. Intenzívebb mintavétel esetén több vizsgálatot kell elvégezni ekkora mintákon. Ha ennél több burgonyagumót tartalmaz a minta, az gátláshoz vagy nehezen értelmezhető eredményekhez vezet. Az eljárás azonban könnyen alkalmazható 200-nál kevesebb burgonyagumóból álló mintákra is, amennyiben kevesebb burgonyagumó áll rendelkezésre.
- Az alábbiakban leírt valamennyi kimutatási módszer validálása 200 burgonyagumóból álló minták vizsgálatán alapszik.
- Az alábbiakban leírt burgonyakivonat felhasználható a burgonya barna rothadás baktérium, a Ralstonia solanacearum kimutatására is.
A mintaelőkészítést megelőző, szabadon választható előkezelés:
Mossuk le a burgonyagumókat. Használjunk megfelelő fertőtlenítőszereket (a PCR-teszt alkalmazása esetén klórvegyületeket az esetleges kórokozó DNS-ek eltávolítása céljából) és mosószereket az egyes minták között. Levegőn szárítsuk meg a burgonyagumókat. Ez a lemosási eljárás különösen akkor hasznos (de nem kötelező), ha a minták földesek, és ha PCR-tesztet vagy közvetlen izolálási eljárást kell alkalmazni.
3.1.1. Távolítsuk el tiszta, fertőtlenített szikével vagy gyümölcskéssel a burgonyagumó köldökrészén a héjat úgy, hogy az edénynyaláb-szövetek láthatóvá váljanak. Óvatosan vágjunk ki egy kis darabot az edénynyaláb-szövetből a köldökrészen, és tartsuk a nem edénynyaláb-szövet mennyiségét minimális szinten (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main
Megjegyzés:
Tegyük félre a feltételezett tüneteket mutató (rothadó) burgonyagumókat, és vizsgáljuk azokat külön.
Ha a köldökrészből vett darab eltávolítása során a gyűrűs rothadás feltételezett tünetei észlelésére kerül sor, akkor a köldökrész közelében a gumó elvágása után el kell végezni az adott burgonyagumó szemrevételezéses vizsgálatát. A feltételezett tüneteket mutató, elvágott gumókat szobahőmérsékleten kell parásítani 2 napig, majd tároljuk a gumókat hűtőszekrényben (4-10 °C között) megfelelő növény-egészségügyi zárlati feltételek mellett a vizsgálatok befejezéséig. Minden burgonyagumót (beleértve a gyanús tüneteket mutatókat is), a II. melléklet szerint kell tárolni.
3.1.2. A köldökrészből vett darabokat még nem használt, becsukható és/vagy lezárható egyszer használatos tartályokban gyűjtsük össze (amennyiben a tartályok ismét felhasználásra kerülnek, akkor azokat alaposan ki kell tisztítani, és klórvegyületekkel fertőtleníteni kell). A köldökrészből vett darabokat lehetőleg azonnal fel kell dolgozni. Ha ez nem lehetséges, akkor azokat a tartályban kell tárolni, puffer hozzáadása nélkül, hűtött állapotban legfeljebb 72 órán át vagy szobahőmérsékleten legfeljebb 24 órán át. A darabok száradása és parásodása, valamint a szaprofita baktériumok elszaporodása a tárolás során akadályozhatja a gyűrűs rothadás baktérium kimutatását.
3.1.3. Dolgozzuk fel a köldökrészből vett darabokat a következő eljárások egyikével:
a) Töltsünk a darabokra megfelelő mennyiségű (mintegy 40 ml) kivonópuffert (3. függelék), és rázzuk rotációs rázógépen (50-100 fordulat/perc) 4 órán át 24 °C alatt, vagy 16-24 órán át hűtött állapotban.
b) Homogenizáljuk a darabokat megfelelő mennyiségű (mintegy 40 ml) kivonópufferrel (3. függelék) aprítógépben (pl. Waring vagy Ultra Thurax), vagy lezárt, egyszer használatos macerációs tasakban (pl. Stomacher vagy Bioreba, erős guage polietilén, 150 mm × 250 mm; sugárzással sterilizált) gumikalapáccsal vagy megfelelő zúzóberendezéssel (pl. Homex) történő összezúzás útján.
Megjegyzés:
A minták keresztbe fertőződésének nagy a veszélye az aprítógépben történő homogenizálás esetén. Tegyünk óvintézkedéseket az aeroszol képződés és a kilöttyenés elkerülése érdekében a kivonási eljárás során. Biztosítsuk, hogy frissen sterilizált aprítókések és edények kerüljenek felhasználásra minden mintánál. A PCR-teszt elvégzésekor kerüljük el a DNS-ek áthozatalát a tartályokon vagy a zúzóberendezésen. A PCR alkalmazásánál az egyszer használatos tasakokban történő összezúzás és egyszer használatos kémcsövek használata ajánlott.
3.1.4. Fejtsük le a felülúszó folyadékot. Ha nagyon zavaros, ülepítsük lassú centrifugálással (legfeljebb 180 g-vel, 10 percig, 4-10 °C közötti hőmérsékleten) vagy vákuumszűréssel (40-100 µm) a szűrőt további (10 ml) kivonópufferrel átmosva (3. függelék).
3.1.5. Koncentráljuk a baktérium frakciót 7 000 g-vel 15 percig (vagy 10 000 g-vel 10 percig) tartó centrifugálással 4-10 °C közötti hőmérsékleten, és távolítsuk el a felülúszó folyadékot a üledék felkavarása nélkül.
3.1.6. Szuszpendáljuk újra a üledéket 1,5 ml üledék-pufferben (3. függelék). Használjunk 500 µl-t a C. m. subsp. sepedonicus-hoz, 500 µl-t a Ralstonia solanacearum-hoz és 500 µl-t referencia célokra. Adjunk hozzá steril glicerint, melynek végkoncentrációja 10-25 % (v/v), a referencia mennyiség 500 µl-éhez és a fennmaradó vizsgálati mennyiséghez, Vortex-szel keverjük össze, és tároljuk 16 és 24 °C között (hetekig) vagy 68 és 86 °C között (hónapokig). A vizsgálat során a vizsgálati aliquotokat 4-10 °C-on tartsuk.
A többszöri lefagyasztás és felengedés nem ajánlott.
Ha szükséges a kivonat szállítása, akkor biztosítsuk, hogy a szállítás hűtőtáskában történjen 24-48 órán belül.
3.1.7. Rendkívül fontos, hogy az összes C. m. subsp. sepedonicus pozitív kontrollt és mintát külön kezeljük a fertőzés elkerülése érdekében. Ez vonatkozik az IF-lemezekre és minden vizsgálatra.
3.2. Burgonyanövények
Megjegyzés:
A látens C. m. subsp. sepedonicus populációk kimutatásához összetett minták vizsgálata ajánlott. Az eljárás könnyen alkalmazható a legfeljebb 200 szárdarabból álló összetett mintákra. (Amennyiben vizsgálatokat végzünk, azoknak a vizsgálat alatt álló növénypopuláció statisztikailag reprezentatív mintáján kell alapulniuk.)
3.2.1. Tiszta, fertőtlenített késsel vagy metszőollóval távolítsunk el egy 1-2 cm-es darabot mindegyik szár tövéből közvetlenül a földfelszín felett.
Fertőtlenítsük rövid ideig a szádarabokat 70 %-os etil-alkohollal, és itatóspapíron azonnal itassuk szárazra azokat.
Gyűjtsük a szárdarabokat egy zárt és steril tartályban a következő mintavételi eljárásoknak megfelelően:
3.2.2. Dolgozzuk fel a szárdarabokat az alábbi eljárások egyikével:
a) Töltsünk a darabokra megfelelő mennyiségű (mintegy 40 ml) kivonópuffert (3. függelék), és rázzuk rotációs rázógépen (50-100 rpm) 4 órán át 24 °C alatt, vagy hűtötten 16-24 órán át.
b) Azonnal dolgozzuk fel a darabokat erős macerációs tasakban (pl. Stomacher vagy Bioreba) történő összezúzás útján megfelelő mennyiségű kivonópuffer hozzáadásával (3. függelék) gumikalapács vagy megfelelő zúzóberendezés (pl. Homex) felhasználásával. Ha ez nem lehetséges, tároljuk a szárdarabokat hűtve legfeljebb 72 órán át, vagy legfeljebb 24 órán át szobahőmérsékleten.
3.2.3. Fejtsük le a felülúszó folyadékot 15 perces ülepítés után.
3.2.4. A kivonat további ülepítése vagy a baktérium frakció koncentrálása általában nem szükséges, de szűréssel és/vagy centrifugálással elérhető a 3.1.4-3.1.6. szakaszban leírtak szerint.
3.2.5. Osszuk a híg vagy koncentrált mintakivonatot két egyenlő részre. Az egyik felét tartsuk 4-10 °C között a vizsgálat során, a másik felét pedig tároljuk 10-25 % (v/v) steril glicerinben 16 és 24 °C között (hetekig) vagy 68 és 86 °C között (hónapokig), arra az esetre, ha további vizsgálatokat kell végezni.
4. IF-teszt
Az alapelv
Az IF-teszt elsőszámú szűrővizsgálatként történő használata ajánlott, mivel bizonyított megbízhatósága a szükséges küszöbértékek elérésében.
Amennyiben az IF-tesztet használjuk elsőszámú szűrővizsgálatként, és az IF eredménye pozitív, második szűrővizsgálatként el kell végezni az izolálási, a PCR-vagy a FISH-vizsgálatot. Amennyiben az IF-tesztet második szűrővizsgálatként használjuk, és az IF eredménye pozitív, további vizsgálatra van szükség a folyamatábrának megfelelően az elemzés befejezéséhez.
Megjegyzés:
Mindig poliklonális ellenanyagot használjunk, ha az IF-tesztet használjuk elsőszámú szűrővizsgálatként. Abban az esetben, ha az IF leolvasás pozitív egy poliklonális ellenanyaggal, a minta további szűrése egy monoklonális ellenanyaggal specifikusabb eredményt adhat, de kisebb lehet az érzékenység.
A C. m. subsp. sepedonicus egyik referenciatörzsének ellenanyagát használjuk. Ajánlott a titert minden egyes új ellenanyag-tételre meghatározni. A titer úgy van definiálva, hogy az a legmagasabb hígítás, melyen optimális reakció megy végbe a C. m. subsp. sepedonicus homológ törzsének 105-106 sejt/ml-es szuszpenziója vizsgálatánál a megfelelő fluoreszcein-izotiocianát (FITC) konjugátumnak a gyártó ajánlásai szerint történő felhasználása esetén. A nyers poliklonális vagy monoklonális ellenanyagoknak legalább 1:2000-es IF-titerűnek kell lenniük. A vizsgálat során az ellenanyagokat a titerhez közeli vagy azzal megegyező munkahígítás(ok)ban (WD) kell használni. Használjunk validált ellenanyagokat (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
A vizsgálatot frissen készített mintakivonatokon kell elvégezni. Szükség esetén sikeresen elvégezhető 68 és 86 °C között glicerin alatt tárolt kivonatokon. A glicerin 1 ml üledékpuffer hozzáadásával (4. függelék) eltávolítható a mintáról, újracentrifugálás 15 percen át 7 000g-vel, és újraszuszpendálás azonos térfogatú üledékpufferben. Ez gyakran nem szükséges, különösen, ha a mintalemezeken a mintákat láng segítségével a lemezekhez rögzítjük (lásd 2.2).
Készítsünk külön pozitív kontroll-lemezeket a homológ törzsből vagy a C. m. subsp. sepedonicus bármely más referenciatörzséből, burgonyakivonatban - a 2. függelékben leírtak szerint - és szabadon választhatóan pufferben szuszpendálva.
Természetes úton fertőződött (liofilizálással vagy 16 és 24 °C közötti fagyasztással fenntartott) szövetet kell használni - amennyiben lehetséges - hasonló kontrollként ugyanazon a lemezen.
Negatív kontrollként olyan mintakivonatokat lehet használni, melynek korábbi vizsgálata negatív eredményt hozott.
Használjunk több mintahelyes tárgylemezeket lehetőleg 10 darab, legalább 6 mm átmérőjű ablakkal.
A kontrollanyagot a mintával/mintákkal azonos módon vizsgáljuk.
4.1. A tesztlemezeket a következő eljárások egyikével készítsük el:
i. Viszonylag kevés keményítő üledéket tartalmazó üledékek esetén:
Pipettázzunk egy kimért, meghatározott térfogatot (15 µl megfelelő a 6 mm-es ablakátmérőhöz - nagyobb ablakokhoz használjunk arányosan nagyobb térfogatot) az újraszuszpendált burgonyaüledék 1/100 hígításából az első ablakra. Ezután pipettázzunk hasonló térfogatot a hígítatlan üledékből (1/1) a sor fennmaradó ablakaira. A második sor használható ismétlésként vagy egy második mintaként, amint azt az 1. ábra mutatja.
ii. Egyéb üledékek esetén:
Készítsünk tízes hígítási sorozatot (1/10, 1/100) az újraszuszpendált üledékből üledékpufferben. Pipettázzunk egy meghatározott térfogatot (15 µl megfelelő a 6 mm-es ablakátmérőhöz - nagyobb ablakokhoz használjunk arányosan nagyobb térfogatot) az újraszuszpendált üledékből és mindegyik hígításból az ablakok egy sorára. A második sor használható ismétlésként vagy egy második mintaként, amint azt a 2. ábra mutatja.
4.2. Szárítsuk a cseppeket szobahőmérsékleten vagy 40-45 °C-os hőmérsékletre történő melegítéssel. Rögzítsük a baktériumsejteket a lemezhez hevítéssel (15 percig 60 °C-on), lelángolással vagy 95 %-os etil-alkohollal, vagy az ellenanyagok szállítójának specifikus útmutatása szerint.
Szükség esetén a rögzített lemezeket ezután egy száraz dobozban fagyasztva lehet tárolni a szükséges ideig (legfeljebb 3 hónapig) a további vizsgálatok elvégzését megelőzően.
4.3. IF-eljárás
i. A 4.1. i. pontban leírt tesztlemez-készítési eljárás szerint:
Készítsünk egy sorozatot a kétszeres hígításokból. Az első mintahely tartalmazza a titer 1/2-ét (T/2), a többi a titer 1/4-ét (T/4), a titer 1/2-ét (T/2), a titert (T) és a titer kétszeresét (2T).
ii. A 4.1. ii. pontban leírt tesztlemez-készítési eljárás szerint:
Készítsük el az ellenanyag munkahígítását (WD) IF-pufferben. A munkahígítás befolyásolja a specifikusságot.
1. ábra A tesztlemez elkészítése a 4.1. i. és a 4.3. i. pont szerint
| Az újraszuszpendált üledék hígításai | |||||||
| 1/100 | 1/1 | 1/1 | 1/1 | 1/1 | | Az újraszuszpendált üledék hígításai | |
| (T = titer) | T/2 | T/4 | T/2 | T | 2T | | Az antiszérum/ellenanyag kétszeres hígításai |
| 1. minta | [Kép #1] | [Kép #2] | [Kép #3] | [Kép #4] | [Kép #5] | ||
| 1 | 2 | 3 | 4 | 5 | |||
| Az 1. minta ismétlése vagy 2. minta | [Kép #6] | [Kép #7] | [Kép #8] | [Kép #9] | [Kép #10] | ||
| 6 | 7 | 8 | 9 | 10 | |||

Kép #1

Kép #2

Kép #3

Kép #4

Kép #5

Kép #6

Kép #7

Kép #8

Kép #9

Kép #10
2. ábra A tesztlemez elkészítése a 4.1. ii. és a 4.3. ii. pont szerint
| Az antiszérum/ellenanyag munkahígítása | |||||||
| 1/1 | 1/10 | 1/100 | üres | üres | | Az újraszuszpendált üledék tizedes hígítása | |
| 1. minta | [Kép #11] | [Kép #12] | [Kép #13] | [Kép #14] | [Kép #15] | ||
| 1 | 2 | 3 | 4 | 5 | |||
| Az 1. minta ismétlése vagy 2. minta | [Kép #16] | [Kép #17] | [Kép #18] | [Kép #19] | [Kép #20] | ||
| 6 | 7 | 8 | 9 | 10 | |||

Kép #11

Kép #12

Kép #13

Kép #14

Kép #15

Kép #16

Kép #17

Kép #18

Kép #19

Kép #20
4.3.1. Rendezzük el a tesztlemezeket nedves papíron. Borítsuk a tesztablakokat teljesen az ellenanyag hígításával (hígításaival). Az ablakokra felvitt ellenanyag térfogatának legalább akkorának kell lennie, mint az alkalmazott kivonat térfogata.
A következő eljárást abban az esetben kell elvégezni, ha az ellenanyagok szállítója nem szolgáltatott specifikus útmutatásokat:
4.3.2. Lefedve inkubáljuk a tesztlemezeket nedves papíron 30 percig szobahőmérsékleten (18-25 °C).
4.3.3. Rázzuk le a cseppeket a tesztlemezekről, és gondosan öblítsük le azokat IF-pufferrel. Alámerítve mossuk 5 percig IF-puffer-Tween-ben (4. függelék), és ezt követően IF-pufferben. Kerüljük el az aeroszolok vagy cseppek átvitelét, ami keresztbefertőződéshez vezethet. Gondosan távolítsuk el a felesleges nedvességet gyengéd felitatással.
4.3.4. Rendezzük el a tesztlemezeket nedves papíron. Borítsuk a tesztablakokat a FITC konjugátumnak a titer meghatározásához használt hígításával. Az ablakokra felvitt konjugátum térfogatának meg kell egyeznie az alkalmazott ellenanyag térfogatával.
4.3.5. Lefedve inkubáljuk a tesztlemezeket nedves papíron 30 percig szobahőmérsékleten (18-25 °C).
4.3.6. Rázzuk le a konjugátum cseppeket a tesztlemezről. Öblítsük és mossuk el a korábbiak szerint (4.3.3.).
Gondosan távolítsuk el a felesleges vizet.
4.3.7. Pipettázzunk 5-10 µl 0,1 M foszfátpufferes glicerint (3. függelék) vagy valamilyen kereskedelmi forgalomban kapható fedő oldatot minden egyes ablakra, és helyezzünk fel fedőlemezt.
4.4. Az IF-teszt leolvasása:
4.4.1. Tanulmányozzuk a tesztlemezeket epifluoreszcens mikroszkóppal az FITC gerjesztésére alkalmas szűrőkkel, víz- vagy olajimmerzió mellett, 500-1 000-szeres nagyításban. Alaposan vizsgáljuk át az ablakokat két egymásra merőleges átmérőjük és a kerületük mentén. Azon minták esetében, amelyekben egyáltalán nem vagy csak kis számban mutatkoznak sejtek legalább 40 mikroszkóp látómezőt vizsgáljunk meg.
Először a pozitív kontroll-lemezt ellenőrizzük. A sejteknek fényesen kell fluoreszkálniuk, és teljes mértékű festődést kell mutatniuk a meghatározott ellenanyag titeren vagy a munkahígításon. Az IF-tesztet (4. szakasz) meg kell ismételni, ha a festődés rendellenes.
4.4.2. Figyeljük meg a C. m. subsp. sepedonicus jellegzetes morfológiájával rendelkező, fényesen fluoreszkáló sejteket a tesztlemezek tesztablakaiban (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main). A fluoreszcencia intenzitásának meg kell egyeznie a pozitív kontroll-törzs által ugyanazon ellenanyag-hígításnál adottal. A nem teljesen festődött vagy gyengén fluoreszkáló sejteket figyelmen kívül kell hagyni.
Ha bármilyen fertőzés gyanúja felmerül, a vizsgálatot meg kell ismételni. Ilyen eset lehet, amikor egy tételben minden tesztlemez pozitív sejteket mutat a puffer fertőződésének következtében, vagy amikor pozitív sejtekre bukkanunk (a tesztablakokon kívül) a tesztlemez bevonatán.
4.4.3. Sok olyan probléma létezik, amely az immunfluoreszcenciás vizsgálat specifikusságából adódik. Az atipikus morfológiájú fluoreszkáló sejtek háttér-populációi és a keresztbe reagáló szaprofita baktériumok, melyek mérete és morfológiája hasonló a C. m. sepedonicus-éhoz, valószínűleg előfordulnak a burgonyagumó köldökrészéből vett darabokból és a szár darabjaiból készített üledékben.
4.4.4. Csak a jellemző méretű és morfológiájú, az ellenanyagok titerén vagy munkahígításán fluoreszkáló sejteket vegyük figyelembe, ahogy a 4.3. pontnál.
4.4.5. Az IF eredményének kiértékelése:
i. Ha találunk jellegzetes morfológiájú, fényesen fluoreszkáló sejteket, akkor határozzuk meg a mikroszkóp látómezejébe eső jellemző sejtek számának középértékét, és számítsuk ki az újraszuszpendált üledék 1 ml-ében lévő jellemző sejtek számát (4. függelék).
Az IF-teszt eredménye pozitív azon minták esetében, amelyek 1 ml újraszuszpendált üledékben legalább 5×103 jellemző sejtet tartalmaznak. Az ilyen minta potenciálisan fertőzöttnek minősül, és további vizsgálatok elvégzése szükséges.
ii. Az IF-teszt eredménye negatív azon minták esetében, amelyek 1 ml újraszuszpendált üledékben kevesebb, mint 5×103 sejtet tartalmaznak, és az ilyen minta negatívnak minősül. További vizsgálatok elvégzése nem szükséges.
5. FISH-TESZT
Az alapelv
Amennyiben a FISH-tesztet használjuk első szűrővizsgálatként és pozitívnak bizonyul, akkor el kell végezni az izolálási eljárást vagy az IF-tesztet kötelező második szűrővizsgálatként. Amennyiben a FISH-tesztet második szűrővizsgálatként használjuk, és pozitívnak bizonyul, akkor a diagnosztizálás befejezéséhez további vizsgálat szükséges a folyamatábrának megfelelően.
Megjegyzés:
Használjunk validált C. m. subsp. sepedonicus-specifikus oligopróbákat (7. függelék). Az ezzel a módszerrel végzett előzetes vizsgálatnak lehetővé kell tennie a korábban negatívnak vizsgált mintakivonathoz adott legalább 103-104/ml C. m. subsp. sepedonicus sejt reprodukálható kimutatását.
A következő eljárást lehetőleg frissen készült mintakivonaton kell elvégezni, de sikeresen elvégezhető glicerinoldatban 16 és 24 °C vagy 68 és 86 °C között tárolt mintakivonaton.
Negatív kontrollként használjuk a korábban C. m. subsp. sepedonicus-ra negatívnak vizsgált mintakivonatot.
Pozitív kontrollnak készítsünk szuszpenziót, amely 105-106/ml 3-5 napos tenyészetből származó C. m. subsp. sepedonicus sejtet (pl. NCPPB 4053, vagy PD 406 törzs) tartalmaz 0,01M foszfát-pufferben (PB) (elkészítését lásd a 2. függelékben). Készítsünk külön pozitív kontroll lemezeket a homológ törzsből vagy a C. m. subsp. sepedonicus bármely más referenciatörzséből, burgonyakivonatban szuszpendálva, a 2. függelékben meghatározottak szerint.
A FITC-vel címkézett eubakteriális oligo-teszt használata biztosítja a hibridizáció folyamatának ellenőrzését, mivel megfesti a mintában jelen levő összes eubaktériumot.
Vizsgáljuk a kontrollanyagot a mintával/mintákkal azonos módon.
5.1. A burgonyakivonat fixálása
A következő protokoll Wullings et al. (1998) alapján készült:
5.1.1. Készítsünk fixálóoldatot (lásd a 7. függeléket).
5.1.2. Pipettázzunk 100 µl-t mindegyik mintakivonatból egy Eppendorf-csőbe, és centrifugáljuk 8 percig 7 000 g-vel.
5.1.3. Távolítsuk el a felülúszó folyadékot, és oldjuk fel a üledéket 500 µl fixálóban, melyet kevesebb, mint 24 órával korábban készítettünk. Vortex-szeljük, és inkubáljuk egy éjszakán át 4 °C-on.
Egy alternatív fixáló a 96 %-os etil-alkohol. Ennek használatakor oldjuk fel a üledéket az 5.1.2. lépéstől 50 µl 0,01M PB-ben, és 50 µl 96 %-os etil-alkoholban. Vortex-szel keverjük össze, és inkubáljuk 4 °C-on 30-60 percig.
5.1.4. Centrifugáljuk 8 percig 7 000 g-vel, távolítsuk el a felülúszó folyadékot, és szuszpendáljuk újra a üledéket 75 µl 0,01 M PB-ben (lásd a 3. függeléket).
5.1.5. Cseppentsünk 16 µl-t a fixált szuszpenzióból egy tiszta többablakos lemezre, ahogy a 3. ábra mutatja. Két különböző mintát használjunk lemezenként hígítatlanul, és használjunk 10 µl-t egy 1:100 hígításhoz (0,01 M PB-ben). A maradék mintaoldatot (49 µl) tárolhatjuk 20 °C-on 1 térfogatnyi 96 %-os etil-alkohol hozzáadása után. Abban az esetben, ha a FISH-tesztet meg kell ismételni, távolítsuk el az etil-alkoholt centrifugálással, és adjunk a mintaoldathoz azonos térfogatnyi 0,01 M PB-t (keverjük össze vortex-szeléssel).
3. ábra A FISH-lemez elrendezése
| 1. minta | vak | vak | vak | 2. minta |
| [Kép #21] | [Kép #22] | [Kép #23] | [Kép #24] | [Kép #25] |
| 1. ablak | 2. ablak | 3. ablak | 4. ablak | 5. ablak |
| 1. minta | vak | vak | vak | 2. minta |
| [Kép #26] | [Kép #27] | [Kép #28] | [Kép #29] | [Kép #30] |
| 6. ablak | 7. ablak | 8. ablak | 9. ablak | 10. ablak |
| 1. fedőlemez | 2. fedőlemez | |||

Kép #21

Kép #22

Kép #23

Kép #24

Kép #25

Kép #26

Kép #27

Kép #28

Kép #29

Kép #30
5.1.6. Levegőn szárítsuk meg a lemezeket (vagy lemezszárítón, 37 °C-on), és rögzítsük azokat lelángolással.
Ezen a ponton az eljárást félbeszakíthatjuk, és a hibridizációval másnap folytathatjuk. A lemezeket pormentesen és szárazon kell tárolni szobahőmérsékleten.
5.2. Elő-hibridizáció és hibridizáció
5.2.1. Készítsünk lizozim oldatot, amely 10 mg lizozimet (Sigma L-6876) tartalmaz 10 ml pufferben (100 mM Tris-HCl, 50 mM EDTA, pH 8,0). Ezt az oldatot lehet tárolni, de csak egyszer szabad lefagyasztani/felengedni. Öntsünk mindegyik ablakra hozzávetőleg 50 µl lizozim oldatot, és inkubáljuk 10 percig szobahőmérsékleten. Majd mártsuk a lemezeket ásványtalanított vízbe, csak egyszer és szárítsuk meg azokat szűrőpapírral.
Egy másik lehetőség, hogy a lizozim helyett 50 µl 40-400µg ml-1 proteináz-K-t adunk hozzá pufferben (20 mM Tris-HCl, 2 mM CaCl2, pH 7,4) mindegyik ablakra, és inkubáljuk 37 °C-on 30 percig.
5.2.2. Dehidratáljuk a sejteket egy fokozatos 50, 80 és 96 %-os - etil-alkohol sorozatban, mindegyikben 1 percig. Levegőn hagyjuk megszáradni a lemezeket egy lemeztartóban.
5.2.3. Készítsünk egy nedves inkubációs kamrát úgy, hogy egy légmentesen záródó doboz aljára 1x hibmix-be (7. függelék) áztatott itatós- vagy szűrőpapírt terítünk. Végezzük el a doboz előinkubálását a hibridizációs kemencében 55 °C-on legalább 10 percig.
5.2.4. Készítsük el a hibridizációs oldatot (7. függelék), 45 µl jusson lemezenként, és végezzünk előinkubálást 5 percig 55 °C-on.
5.2.5. Helyezzük a lemezeket fűtőlapra 45 °C-on, és vigyünk 10 µl hibridizációs oldatot a lemezen/lemezeken lévő mind a 4 vájulatba.
5.2.6. Tegyünk 2 fedőlemezt (24 × 24 mm) mindegyik lemezre a levegő beszorítása nélkül. Helyezzük a lemezeket az előmelegített nedves kamrába, majd hibridizáljuk azokat egy éjszakán át a kemencében 55 °C-on sötétben.
5.2.7. Készítsünk el 3 főzőpoharat, melyek 1 l ultra tiszta vizet (UPW), 1 l 1x hibmix-et (334 ml 3x hibmix és 666 ml UPW) és 1 l 1/2x hibmix-et (167 ml 3x hibmix és 833 ml UPW) tartalmaznak. Végezzük el az elő-inkubációjukat vízfürdőben 55 °C-on.
5.2.8. Vegyük le a fedőlemezeket a lemezekről, és helyezzük a lemezeket egy lemeztartóba.
5.2.9. Mossuk ki a felesleges próbát a főzőpohárban 1x hibmix-szel 55 °C-on történő, 15 percig tartó inkubálással.
5.2.10. Vigyük át a lemeztartót 1/2 hibmix mosóoldatba, és inkubáljuk további 15 percig.
5.2.11. Mártsuk a lemezeket rövid időre UPW-be, és tegyük őket szűrőpapírra. Távolítsuk el a felesleges nedvességet a felszínük szűrőpapírral történő óvatos leitatással. Pipettázzunk 5-10μl fedőoldatot (pl. Vectashield-et, Vecta Laboratories, CA, USA vagy azzal egyenértékűt) mindegyik ablakra, és takarjuk le egy nagyméretű fedőlemezzel (24 x 60 mm) az egész lemezt.
5.3. A FISH-teszt leolvasása
5.3.1. Azonnal nézzük meg a lemezeket epifluoreszcens mikroszkóppal 630 nm hullámhosszon vagy 1 000-szeres nagyításon olajimmerzió mellett. Fluoreszcein-izotiocianáthoz (FITC) használható szűrővel a mintában lévő eubakteriális sejtek (beleértve a legtöbb gram-negatív sejtet) zölden fluoreszkálnak, Tetrametilrodamin-5-izotiocianáthoz használható szűrővel a C. m. subsp. sepedonicus Cy3-mal festett sejtjei vörösen fluoreszkálnak. Hasonlítsuk össze a sejtmorfológiát a pozitív kontrollokéval. A sejteknek élénken kell fluoreszkálniuk, és teljesen meg kell festődniük. A FISH-tesztet (9.4. szakasz) meg kell ismételni, ha a festődés rendellenes. Alaposan vegyük szemügyre az ablakokat két egymásra merőleges átmérőjük és a kerületük mentén. Azon minták esetében, amelyekben egyáltalán nem vagy csak kis számban mutatkoznak sejtek, legalább 40 mikroszkóp látómezőt vizsgáljunk meg.
5.3.2. Tanulmányozzuk a C. m. subsp. sepedonicus élénken fluoreszkáló, jellegzetes morfológiájú sejtjeit a tesztlemezek tesztablakaiban (lásd a honlapot: http://forum.europa.eu.int/Public/irc/sanco/Home/main). A fluoreszkálás intenzitásának meg kell egyeznie, vagy erősebbnek kell lennie a pozitív kontroll törzsénél. A tökéletlen festődésű vagy gyengén fluoreszkáló sejteket nem szabad figyelembe venni.
5.3.3. Ha bármilyen fertőzés gyanúja felmerül, a vizsgálatot meg kell ismételni. Ilyen eset lehet, amikor egy tételben minden tesztlemez pozitív sejteket mutat a puffer fertőződésének következtében, vagy amikor pozitív sejtekre bukkanunk (a tesztablakokon kívül) a tesztlemez bevonatán.
5.3.4. Sok olyan probléma létezik, amely a FISH-teszt specifikusságából adódik. Az atipikus morfológiájú fluoreszkáló sejtek háttér-populációi és a keresztbe reagáló szaprofita baktériumok, melyek mérete és morfológiája hasonló a C. m. subsp. sepedonicus-éhoz, előfordulhatnak - bár sokkal ritkábban, mint az IF-tesztnél - a burgonyagumó köldökrészéből vett darabokból és a szár darabjaiból készített üledékben.
5.3.5. Csak a jellemző méretű és morfológiájú, fluoreszkáló sejteket vegyük figyelembe, lásd az 5.3.2. pontban.
5.3.6. A FISH-teszt eredményének kiértékelése:
i. A FISH-teszt eredménye akkor érvényes, ha a C. m. subsp. sepedonicus-ra jellemző méretű és morfológiájú, élénkzölden fluoreszkáló sejtek figyelhetők meg FITC-szűrő használatával és élénkvörösen fluoreszkáló sejtek a rodamin-szűrő használatával az összes pozitív kontrollnál, viszont a negatív kontrollok egyikénél sem. Ha találunk élénken fluoreszkáló, jellegzetes morfológiájú sejteket, becsüljük meg a jellemző sejtek átlagos számát mikroszkóp látómezőnként, és számoljuk ki a jellemző sejtek számát az újraszuszpendált üledék 1 ml-ére (4. függelék). Azok a minták, amelyek legalább 5×103 jellemző sejtet tartalmaznak az újraszuszpendált üledék 1 ml-ében potenciálisan fertőzöttnek tekinthetők. További vizsgálat szükséges. Azok a minták, amelyek kevesebb, mint 5×103 jellemző sejtet tartalmaznak az újraszuszpendált üledék 1 ml-ében negatívnak tekinthetők.
ii. A FISH-teszt negatív, ha a C. m. subsp. sepedonicus-ra jellemző méretű és morfológiájú, élénkvörösen fluoreszkáló sejtek nem figyelhetők meg rodamin-szűrő használatával, feltéve, hogy jellemző, élénkvörösen fluoreszkáló sejtek figyelhetők meg a pozitív kontrollkészítményekben rodamin-szűrő használatával.
6. PCR-TESZT
Az alapelvek
Amennyiben a PCR-tesztet elsőszámú szűrővizsgálatként használjuk, és pozitívnak bizonyul, akkor el kell végezni az izolálási vizsgálatot vagy az IF-tesztet második, kötelező szűrővizsgálatként. Amennyiben a PCR-tesztet második szűrővizsgálatként használjuk, és pozitívnak bizonyul, további vizsgálatra van szükség a folyamatábrának megfelelően a diagnosztizálás befejezéséhez.
E módszer elsőszámú szűrővizsgálatként történő teljes körű felhasználása csak akkor ajánlott, ha a szükséges specifikus szakmai ismeretek elsajátításra kerültek.
Megjegyzés:
Az e módszerrel végzett előzetes vizsgálatnak lehetővé kell tennie a korábbi vizsgálatok szerint negatív mintakivonatokhoz adott 103-104/ml C. m. subsp. sepedonicus sejt reprodukálható kimutatását. Optimalizálási kísérletekre lehet szükség a maximális érzékenység és specifikusság eléréséhez minden laboratóriumban.
Használjunk validált PCR reagenseket és protokollokat. Lehetőleg belső kontrollal rendelkező módszert válasszunk.
Tegyük meg a megfelelő óvintézkedéseket annak érdekében, hogy elkerüljük a minta befertőződését a cél DNS-sel. A PCR-tesztet gyakorlott technikusoknak kell végezniük erre szolgáló molekuláris biológiai laboratóriumokban, hogy minimalizáljuk a cél DNS-sel való fertőződés veszélyét.
A negatív kontrollokat mindig (DNS-kivonás és PCR) úgy kell kezelni, mint végső mintákat az eljárás során, hogy nyilvánvaló legyen, vajon történt-e DNS átvitel.
A következő negatív kontrollokat kell alkalmazni a PCR-tesztnél:
- Mintakivonat, amelyet előzőleg megvizsgáltak és a C. m. subsp. Sepedonicus-ra negatívnak bizonyult.
- Puffer kontrollok, amelyeket a baktérium és a DNS mintából történő kivonására használnak.
- PCR-reakcióelegy.
A következő pozitív kontrollokat kell alkalmazni:
- Újraszuszpendált üledék, melyhez C. m. subsp. sepedonicus került hozzáadásra (elkészítését lásd a 2. függelékben).
- Egy virulens izolátumból származó 106/ml C. m. subsp. sepedonicus sejt szuszpenziója vízben (pl. NCPPB 2140 vagy NCPPB 4053).
- Ha lehetséges, használjunk a pozitív kontroll mintákból származó DNS-t is a PCR-vizsgálat során.
A lehetséges befertőzések elkerülése érdekében a pozitív kontrollokat a vizsgálandó mintáktól különálló környezetben készítsük el.
A mintakivonatok amennyire csak lehetséges, legyenek mentesek a talajtól. Ezért ajánlatos lehet megmosott burgonyából készíteni a kivonatokat, amikor PCR-protokollok kerülnek alkalmazásra.
6.1. DNS-tisztítási módszerek
Használjuk a fentiekben leírt pozitív és negatív kontrollmintákat.
Vizsgáljuk a kontrollanyagot a mintával/mintákkal azonos módon.
Különféle módszerek állnak rendelkezésre a cél DNS megtisztítására a komplex minta szubsztrátumoktól, melyek eltávolítják a PCR és más enzimes reakciók inhibitorait, és koncentrálják a cél DNS-t a mintakivonatban.
A következő módszer lett optimalizálva a 6. függelékben bemutatott validált PCR-módszernél történő felhasználásra.
6.1. a) A Pastrik-féle módszer (2000):
1. Pipettázzunk 220 µl lízis-puffert (100 mM NaCl, 10 mM tris-HCl [pH 8,0], 1 mM EDTA [pH 8,0]) egy 1,5 ml-es Eppendorf-csőbe.
2. Adjunk hozzá 100 µl mintakivonatot, és helyezzük egy hevítő blokkba vagy vízfürdőbe 95 °C-ra 10 percig.
3. Tegyük a csövet jégre 5 percre.
4. Adjunk hozzá 80 µl lizozim törzsoldatot (50 mg/ml lizozim 10 mM-os tris-HCl-ben, pH 8,0), és inkubáljuk 37 °C-on 30 percig.
5. Adjunk hozzá 220 µl Easy DNA® A oldatot (Invitrogen), vortex-szel jól keverjük össze, és inkubáljuk 65 °C-on 30 percig.
6. Adjunk hozzá 100 µl Easy DNA® B oldatot (Invitrogen), erőteljesen vortex-szeljük, amíg a csapadék már szabadon mozog a csőben, és a minta egyenletesen viszkózus lesz.
7. Adjunk hozzá 500 µl kloroformot, és vortex-szeljük, amíg a viszkozitás csökken, és az elegy homogénné válik.
8. Centrifugáljuk 15 000 g-vel 20 percig 4 °C-on, hogy a fázisok elkülönüljenek, és kialakuljon az interfázis.
9. Vigyük át a felső fázist egy új Eppendorf-csőbe.
10. Adjunk hozzá 1 ml 100 %-os etil-alkoholt (20 °C) rövid ideig vortex-szeljük, és inkubáljuk jégen 10 percig.
11. Centrifugáljuk 15 000 g-vel 20 percig 4 °C-on, és távolítsuk el az etil-alkoholt a üledékről.
12. Adjunk hozzá 500 µl 80 %-os etil-alkoholt (20 °C), és keverjük össze a cső átforgatásával.
13. Centrifugáljuk 15 000 g-vel 10 percig 4 °C-on, őrizzük meg a üledéket, és távolítsuk el az etil-alkoholt.
14. Hagyjuk a üledéket megszáradni a levegőn vagy egy gyors DNS vákuumszárítóban.
15. Szuszpendáljuk újra azüledéket 100 µl steril UPW-ben, és hagyjuk szobahőmérsékleten legalább 20 percig.
16. Tároljuk 20 °C-on amíg a PCR-hez szükség lesz rá.
17. Centrifugálással ülepítsük le a fehér csapadékot, és vegyünk 5 µl-t a DNS-t tartalmazó felülúszó folyadékból a PCR-hez.
6.1. b) Egyéb módszerek
Egyéb DNS kivonási módszerek, pl. a Qiagen DNeasy Plant Kit is alkalmazhatók, feltéve, hogy bizonyítottan ugyanennyire hatékonyan végzik a DNS-tisztítást 103-104/ml kórokozó sejtet tartalmazó kontroll mintákból.
6.2. PCR
6.2.1. Készítsünk teszt és kontroll templátokat a PCR-hez a validált protokolloknak megfelelően (6. függelék). Készítsünk tízszeres hígítást a minta DNS-kivonatból (1:10 UPW-ben).
6.2.2. Készítsük el a megfelelő PCR reakcióelegyet fertőzésmentes környezetben a közzétett protokollok szerint (6. függelék). Amennyiben lehetséges, ajánlatos a multiplex PCR-protokoll használata, amely magában foglal egy belső PCR-kontrolt is.
6.2.3. Adjunk 5 µl DNS-kivonatot 25 µl PCR reakcióelegyhez steril PCR-csövekben.
6.2.4. Vonjunk be egy negatív kontroll mintát, amely csak PCR reakcióelegyet tartalmaz, és adjunk hozzá UPW-t, mely ugyanabból a forrásból származzon, mint amit a PCR reakcióelegyben a minta helyén használtunk.
6.2.5. Helyezzük a csöveket ugyanabba a thermal cycler-be, melyet az előzetes vizsgálat során használtunk, és futtassuk le a megfelelően optimalizált PCR-programot (6. függelék).
6.3. A PCR termék elemzése
6.3.1. Elemezzük a PCR-fragmentumokat agarózgél-elektroforézissel. Futtassunk legalább 12 µl felszaporított DNS reakcióelegyet mindegyik mintából, 3 µl betöltőpufferrel keverve (6. függelék) 2,0 %-os (m/v) agarózgélben tris-acetát-EDTA (TAE) pufferben (6. függelék) 5-8 V/cm-en. Használjunk megfelelő DNS markert, pl. 100 bp ladder-t.
6.3.2. Fessük a DNS láncokat etidium-bromiddal (0,5 mg/liter) 30-45 percig, kellő óvintézkedések mellett dolgozzunk ezzel a mutagénnel.
6.3.3. Tanulmányozzuk a megfestett gélt rövidhullámú UV átvilágítás (λ = 302 nm) mellett a várható méretű felerősített PCR termékekre nézve (6. függelék), és dokumentáljuk.
6.3.4. Minden új leletnél/esetnél igazoljuk a PCR-fragmentum hitelességét restrikciós enzimanalízissel, melyet a maradék felszaporított DNS-ből származó mintán végezzünk el optimális hőmérsékleten és ideig inkubálva a megfelelő enzimmel és pufferrel (lásd a 6. függeléket). Elemezzük a feltárt fragmentumokat agarózgél-elektroforézissel, mint korábban, és tanulmányozzuk a jellegzetes restrikciós fragmentum mintázatot UV átvilágítás mellett etidium-bromid festés után, és hasonlítsuk össze a feltáratlan és a feltárt pozitív kontrollal.
A PCR-teszt eredményeinek kiértékelése:
A PCR-teszt negatív, ha a C. m. subsp. sepedonicus-specifikus várható méretű PCR-fragmentum nem mutatható ki a kérdéses mintában, viszont kimutatható valamennyi pozitív kontroll mintában (a belső kontroll primerekkel végzett multiplex PCR esetében: egy második várható méretű PCR-terméket kell felerősíteni a kérdéses mintával együtt).
A PCR-teszt pozitív, ha a C. m. subsp. sepedonicus-specifikus várható méretű PCR-fragmentum és (amennyiben szükséges) a restrikciós mintázat kimutatható, feltéve, hogy az nem erősödött fel valamelyik negatív kontroll mintától. A pozitív eredmény megbízható megerősítése elérhető a vizsgálat megismétlésével a PCR primerek második sorozatán (9.3. szakasz).
Megjegyzés:
A PCR gátlása gyanítható, ha a várható fragmentumot nyerjük a vízben lévő C. m. subsp. sepedonicus-t tartalmazó pozitív kontroll mintából, viszont negatív eredményeket kapunk a burgonyakivonatban lévő C. m. subsp. sepedonicus-t tartalmazó pozitív kontrollokból. A belső PCR kontrollal rendelkező multiplex PCR-protokollokban jelzik a reakció gátlását, ha a két fragmentum egyike sem kerül kinyerésre.
Gyanítható a fertőzés, ha a várható fragmentumot nyerjük egy vagy több negatív kontrollból.
7. BIOLÓGIAI TESZTELÉSI VIZSGÁLAT
Megjegyzés:
Az ezzel a módszerrel végzett előzetes vizsgálatnak lehetővé kell tennie a korábbi vizsgálatokban negatívnak bizonyult mintakivonatokhoz (elkészítését lásd a 2. függelékben) adott 103-104/ml C. m. subsp. sepedonicus telepalkotó egység reprodukálható kimutatását.
A kimutatás érzékenysége várhatóan akkor lesz a legmagasabb, ha frissen készített mintakivonatot használunk, és optimális szaporodási feltételeket biztosítunk. A módszert azonban sikeresen lehet alkalmazni olyan kivonatokon, amelyeket glicerinnel 68 és 86 °C között tároltunk.
Néhány tojásgyümölcs-fajta kiváló szelektív dúsítási táptalajt jelent a C. m. subsp. sepedonicus szaporodásához még a tünetek hiányában is, és ugyancsak kiváló megerősítő gazdanövény-vizsgálatra ad lehetőséget.
A szaporodási feltételeknek optimálisaknak kell lenniük a hamis negatív vizsgálati eredmények kockázatának csökkentése érdekében.
A növénynevelés részleteit lásd a 8. függelékben.
7.1. Osszuk el teljes egészében az újraszuszpendált üledék vizsgálati mennyiségeinek a 3.1.6. és a 3.2.5. szakaszban megmaradó részét a tojásgyümölcs-növények között az alábbiakban megadott módszerek egyikével (7.3. vagy 7.4.). 2-3 leveles növényeket használjunk, a harmadik valódi levél teljes kifejlődéséig. Az újraszuszpendált üledék teljes hasznosításának biztosítása, valamint a hatékony beoltás érdekében az alábbiakban felvázolt eljáráshoz 15-25 tojásgyümölcs-növényre lesz szükség mintánként.
7.2. Ne öntözzük a tojásgyümölcs-növényeket 1-2 napig a beoltást megelőzően a turgornyomás csökkentése érdekében.
7.3. Bemetszéses beoltás
7.3.1. Két ujjunk között tartva a növényt, pipettázzunk egy csepp (mintegy 5-10 µl) szuszpendált üledéket a szárra a sziklevelek és az első levél közé.
7.3.2. Steril szikével ejtsünk átlós bemetszést, amely mintegy 1,0 cm hosszú és a mélysége körülbelül a szárvastagság 2/3-a, a vágás a üledékcsepptől induljon.
7.3.3. Zárjuk le a bevágást fecskendőből kinyomott steril vazelinnel.
7.4. Befecskendezéses beoltás
Oltsuk be a tojásgyümölcs-növények szárát közvetlenül a sziklevelek felett injekciós tűvel ellátott fecskendővel (legalább 23G). Osszuk el a mintát a tojásgyümölcs-növények között.
7.5. Pozitív kontrollként oltsunk be ugyanazzal a beoltási módszerrel (7.3. vagy 7.4.) 5 növényt egy ismert C. m. subsp. sepedonicus tenyészet 105-106/ml sejtet tartalmazó vizes szuszpenziójával, és - amennyiben lehetséges - természetesen fertőződött gumó szövettel (lásd a 4. szakaszt).
7.6. Negatív kontrollként oltsunk be ugyanazzal a beoltási módszerrel (7.3. vagy 7.4.) 5 növényt steril üledékpufferrel.
7.7. Inkubáljuk a növényeket növény-egészségügyi zárlati létesítményekben 4 héten keresztül 18-24 °C-on, elegendő fény és magas relatív páratartalom (70-80 %) mellett, valamint a megfelelő öntözés biztosításával, hogy megelőzzük a vízzel való átitatódást, vagy a vízhiány okozta hervadást. A C. m. sepedonicus sejtek elpusztulnak 30 °C felett, az optimális hőmérséklet pedig 21 °C. A fertőzések elkerülése érdekében inkubáljuk a pozitív és a negatív kontrollnövényeket jól elkülönített padokon, üvegházban vagy nevelő kamrában, abban az esetben, ha a tér korlátozott, biztosítani kell a kezelések közötti szigorú elkülönítést. Ha az eltérő mintákhoz tartozó növényeket egymás közelében kell inkubálni, különítsük őket el egymástól megfelelő válaszfallal. A műtrágyázásnál, az öntözésnél, a szemrevételezésnél és minden más beavatkozásnál fordítsunk kiemelt figyelmet a keresztbe fertőződés elkerülésére. Alapvető fontosságú, hogy az üvegházat és a nevelő kamrát a rovarkártevőktől mentesen tartsuk, mivel azok átvihetik a baktériumot egyik mintáról a másikra.
7.8. Rendszeresen ellenőrizzük az egy hét elteltével megjelenő tüneteket. Számoljuk meg a tüneteket mutató növényeket. A C. m. subsp. sepedonicus a levelek hervadását okozza a tojásgyümölcs-növényeknél, amely kezdődhet levélszéli vagy levélerek közötti petyhüdtséggel. A hervadt szövet kezdetben sötétzöld vagy foltos lehet, de elhalványul mielőtt nekrotikussá válna. A levélerek közötti hervadt szövetek gyakran zsírosnak és vízzel átitatottnak tűnnek. A nekrotikus szövet széle gyakran világossárga. A növények nem feltétlenül pusztulnak el; minél hosszabb idő telik el a tünetek megjelenéséig, annál nagyobb az esélyük a túlélésre. A növények kinőhetik a fertőzést. A fiatal tojásgyümölcs-növények sokkal fogékonyabbak a C. m. subsp. sepedonicus gyér populációira, mint az idősebb növények, ezért szükséges 3 leveles állapotban vagy közvetlenül az előtt lévő növényeket használni.
A hervadást a gumószövet-üledékben található más baktériumok vagy gombák populációi is kiválthatják. Ezek közé tartozik a Ralstonia solanacearum, az Erwinia carotovora subsp. carotovora és az E. carotovora subsp. atroseptica, az Erwinia chrysanthemi, a Phoma exigua var. foveata, valamint a szaprofita baktériumok népes populációi. Különösen az Erwinia chrysanthemi okozhat a C. m. sepedonicus tüneteihez nagyon hasonló levéltüneteket és hervadást. Az egyetlen különbség az, hogy az Erwinia chrysanthemi által okozott fertőzések esetében a szár elfeketedik. Az egyéb hervadásokat meg lehet különböztetni a C. m. subsp. sepedonicus által okozottaktól, mivel egész levelek vagy egész növények gyorsan elhervadnak. Gram-festést is lehet végezni: ezzel a vizsgálattal meg lehet különböztetni a C. m. subsp. sepedonicus-t az Erwinia-fajoktól.
7.9. Amint a tünetek megjelennek a tojásgyümölcs-növényeken, el kell végezni az újraizolálást a növényekből vett hervadt levélszövet vagy szárszövet felhasználásával (lásd a szövetmacerációs eljárást a 3.1.3. pontban). Fertőtlenítsük a tojásgyümölcs-növény leveleit és szárait 70 %-os etil-alkohollal való letörléssel. Végezzünk IF-tesztet vagy PCR-t a tojásgyümölcs nedvén, és izoláljuk megfelelő (szelektív) táptalajra (lásd a 8. szakaszt). A Gram-festést (9. függelék) is el lehet végezni. Azonosítsuk a vélelmezett C. m. subsp. sepedonicus megtisztított tenyészeteit, és igazoljuk a patogenitást (lásd a 9. és 10. szakaszt).
7.10. Bizonyos körülmények között, különösen, amikor a szaporodási feltételek nem optimálisak, lehetséges lehet, hogy a C. m. subsp. sepedonicus látens fertőzés formájában létezzen a tojásgyümölcs-növényekben még 4 hetes inkubálási időszak után is. Ha 4 hét után nem figyelhetők meg tünetek, akkor végezzünk IF-/PCR-vizsgálatot az egyes tesztnövények szárának a beoltás helye feletti részéről vett 1 cm-es darabokból álló összetett mintán. Ha a vizsgálat pozitív, újraizolálást kell végezni megfelelő (szelektív) táptalajon a 8. szakaszban leírt eljárást követően. Azonosítsuk a vélelmezett C. m. subsp. sepedonicus megtisztított tenyészeteit, és igazoljuk a patogenitást (9. és 10. szakasz).
A biológiai tesztelési vizsgálat eredményeinek kiértékelése
Érvényes biológiai tesztelési vizsgálati eredményeket akkor kapunk, ha a pozitív kontrollnövények jellemző tüneteket mutatnak, a baktériumokat újra lehet izolálni ezekről a növényekről, és a negatív kontrollokon nem találhatók tünetek.
A biológiai tesztelési vizsgálat negatív, ha a tesztnövények nem fertőzöttek C. m. subsp. sepedonicus-szal, és feltéve, hogy az C. m. subsp. sepedonicus kimutatható a pozitív kontrollokban.
A biológiai tesztelési vizsgálat pozitív, ha a tesztnövények fertőzöttek C. m. subsp. sepedonicus-szal.
8. A C. M. SUBSP. SEPEDONICUS IZOLÁLÁSA
Megjegyzés:
A diagnosztizálás csak akkor fejeződik be, ha a C. m. subsp. sepedonicus izolálásra, majd azonosításra kerül (lásd a 9. szakaszt), amit a patogenitás vizsgálat megerősít (10. szakasz). Bár a C. m. subsp. sepedonicus válogatós károsító, tüneteket mutató szövetből izolálható.
Azonban növekedésben lehagyhatják a gyorsan szaporodó szaprofita baktériumok, és ezért izolálása közvetlenül gumó- vagy szárszövet üledékből (3.1.6. vagy 3.2.5. szakasz) nehéz. Szelektív táptalajon és a köldökrészből vett darabokból vagy a szárdarabokból származó, újraszuszpendált üledék megfelelő hígításával a C. m. subsp. sepedonicus közvetlen izolálása lehetséges lehet.
Az izolálást tüneteket mutató burgonyagumókból vagy szárdarabokból kell elvégezni, valamint tojásgyümölcs-növényekből, ha tünetek nem figyelhetők meg, de az összetett mintán végzett IF-/PCR-vizsgálat pozitív volt (lásd a 7.10. szakaszt). A tojásgyümölcs-növények szárainak macerálását - szükség esetén - a 3.1.3. szakaszban leírtak szerint kell elvégezni.
Pozitív kontrollként készítsünk tízszeres hígításokat C. m. subsp. sepedonicus 106 cfu/ml-es szuszpenziójából (pl. NCPPB 4053 vagy PD 406). A fertőzés lehetőségének elkerülése érdekében, a pozitív kontrollokat a vizsgálandó mintáktól teljesen elkülönítve készítsük el.
A szelektív táptalaj minden egyes újonnan elkészített tételénél meg kell vizsgálni, hogy az megfelelő-e a kórokozó szaporodása szempontjából, mielőtt a rutin minták vizsgálatánál felhasználásra kerülne.
A kontrollanyagot a mintával/mintákkal azonos módon vizsgáljuk.
8.1. Szelektív lemeztenyésztés
8.1.1. Újraszuszpendált burgonyakivonat-minta vagy tojásgyümölcs-növény nedv 100 µl-nyi ennyiségéből készítsünk 10-szeres hígításokat üledékpufferben (3. függelék).
8.1.2. A hígítatlan burgonyaüledékből végzett izolálás rendszerint sikertelen a Cms nehezen kielégíthető szaporodási szokásai és a szaprofiták által okozott verseny következtében. Mivel a baktérium általában népes populációkban van jelen a fertőzött szövetekben, a szaprofitákat általában ki lehet hígítani, miközben a patogén megmarad. Ezért ajánlatos 100 µl-t széleszteni mindegyik mintából, 1/100-astól egészen 1/10 000-es hígításig MTNA táptalajra vagy NCP-88 táptalajra (5. függelék) (ha 90 mm átmérőjű Petri-csészéket használunk, akkor igazítsuk hozzá a térfogatot az alternatív csészemérethez), szélesztőbot (jéghokibot) és szélesztéses lemeztenyésztési technika felhasználásával.
Megjegyzés:
Alternatív stratégiát az jelent, ha a burgonyaüledék kezdeti 100 µl aliquot térfogatát szélesztjük az első agarlemezre a szélesztőkengyellel, majd a szélesztőkengyelt továbbvisszük a második agarlemezre, ahol szétkenjük a kengyelen maradt maradékot; végül ugyanezt megismételjük a harmadik lemezzel, így a hígításos lemeztenyésztésnek megfelelő hatást érünk el a szélesztőkengyellel.
8.1.3. Inkubáljuk a lemezeket sötétben 21-23 °C-on.
8.1.4. A lemezek első vizsgálataira, beleértve - a kontroll-lemezekhez való viszonyítással - a C. m. subsp. sepedonicus-szerű telepek megszámolását, 3 nap után kerül sor, amit további számolás követ 5, 7, és végül 10 nap után.
8.2. A gyanús telepek tisztítása
Megjegyzés:
A C. m. subsp. sepedonicus-szerű telepek szubkultúráit YGM táptalajon kell létrehozni a tojásgyümölcs-növények beoltásához és/vagy a későbbi azonosításhoz; ezt a lemezek túlzott túlszaporodottá válása előtt kell elvégezni, vagyis lehetőleg 3-5 nap után.
8.2.1. Szélesszük kaccsal a C. m. subsp. sepedonicus-szerű telepeket a következő táptalajok egyikére: (összetételüket lásd az 5. függelékben):
dextróz-tápagar (kizárólag a szubkultúránál történő felhasználásra),
élesztő-pepton-glükóz agar,
élesztőkivonat-ásványi só agar.
Inkubáljuk 21-24 °C-on 10 napig.
A C. m. subsp. sepedonicus lassan szaporodik, általában 10 napon belül hozza létre gombostűfejnyi, krémszínű, domború telepeit. (A C. m. subsp. sepedonicus jellegzetes telepeinek fényképei megtalálhatók a honlapon: http://forum.europa.eu.int/Public/irc/sanco/Home/main).
8.2.2. Újraszélesztés kaccsal a tisztaság elérése céljából
A szubkultúrával javul a szaporodási ráta. A jellegzetes telepek krémfehérek vagy elefántcsontszínűek, alkalmanként sárgák, kerekek, simák, kiemelkedők, konvex domborúak, nyálkás-folyósak, ép szélekkel és az átmérőjük rendszerint 1-3 mm.
Egy egyszerű Gram-festés (9. függelék) segíthet a telepek kiválasztásában a további vizsgálathoz.
8.2.3. Azonosítsuk a vélelmezett tenyészeteket (lásd a 9. szakaszt), és végezzük el a patogenitás vizsgálatot (lásd a 10. szakaszt).
9. AZONOSÍTÁS
Azonosítsuk a vélelmezett C. m. subsp. sepedonicus izolátumok tiszta tenyészeteit az alábbiak közül legalább két - eltérő biológiai elveken alapuló - vizsgálat felhasználásával.
Használjunk ismert referencia törzseket - amennyiben helyénvaló - mindegyik elvégzett vizsgálatnál.
9.1. Tápanyaghasznosítási és enzimes azonosítási vizsgálat
Határozzuk meg a következő fenotípusos jellemzőket - amelyek általánosan megfigyelhetők vagy nem találhatók meg a C. m. subsp. sepedonicus-nál - Lelliott és Stead (1987), Klement et al. (1990), Schaad (2001), Anonymous (1987) módszerei szerint.
Valamennyi táptalajt inkubálni kell 21 °C-on, és meg kell vizsgálni hat nap elteltével. Ha nincs növekedés, akkor inkubáljuk 20 napon át.
Minden vizsgálatba be kell vonni egy ismert C. m. subsp. sepedonicus kontrollt. A tápanyaghasznosítási és az élettani vizsgálatokat a tápagar szubkultúrákból vett inokulumok felhasználásával kell elvégezni. Morfológiai összehasonlításokat kell végezni a dextróz-tápagar tenyészetekből.
| Vizsgálat | Várható eredmény |
| Oxidációs/Fermentációs (O/F) vizsgálat | Inaktív vagy gyengén oxidatív |
| Oxidáz-aktivitás | – |
| Szaporodás 37 °C-on | – |
| Ureáz-aktivitás | – |
| Eszkulin-hidrolízis | + |
| Keményítő-hidrolízis | – vagy gyenge |
| 7 %-os NaCl tolerancia | – |
| Indolképződés | – |
| Kataláz-aktivitás | + |
| H2S-képződés | – |
| Citrát-hasznosítás | – |
| Zselatin elfolyósítása | – |
| Savképződés glicerinből | – |
| Savképződés laktózból | – vagy gyenge |
| Savképződés ramnózból | – |
| Savképződés szalicinből | – |
| Gram-festés (9. függelék) | + |
9.2. IF-teszt
a) Készítsünk egy szuszpenziót, amely hozzávetőleg 106/ml sejtet tartalmaz IF-pufferben (3. függelék).
b) Készítsük el a megfelelő antiszérum kétszeres hígítási sorozatát.
c) Végezzük el az IF eljárást (4. szakasz).
d) Az IF-teszt pozitív, ha a tenyészet IF-titere egyenlő a pozitív kontrolléval.
9.3. PCR-teszt
a) Készítsünk hozzávetőleg 106/ml sejtet ultra tiszta vízben (UPW) tartalmazó szuszpenziót.
b) Hevítsünk 100 µl sejtszuszpenziót lezárt csövekben hevítő blokkban vagy forrásban lévő vízfürdőben 100 °C-on 4 percig. Ha szükséges, frissen készített 0,05 M végkoncentrációjú NaOH hozzáadása segítheti a sejtbomlást. A mintákat ezután 16 és 24 °C között tárolhatjuk, amíg szükséges.
c) Alkalmazzuk a megfelelő PCR-eljárásokat a C. m. subsp. sepedonicus-specifikus fragmentumok felszaporítására (pl. Pastrik, 2000; lásd a 4. függeléket; Li és de Boer, 1995; Mills et al., 1997; Pastrik és Rainey, 1999; Schaad et al., 1999).
d) A C. m. subsp. sepedonicus pozitív azonosítása megvalósul, ha a PCR fragmentumok azonos méretűek, és azonos restrikciós fragmentumhossz polimorfizmusokkal rendelkeznek, mint a pozitív kontrolltörzs esetében képződöttek.
9.4. FISH-teszt
a) Készítsünk egy szuszpenziót, amely hozzávetőleg 106/ml sejtet tartalmaz UPW-ben.
b) Végezzük el a FISH-eljárást (5. szakasz).
c) A FISH-teszt pozitív, ha ugyanazokat a reakciókat kapjuk a tenyészetnél és a pozitív kontrollnál.
9.5. Zsírsav meghatározás (FAP)
a) Szaporítsuk a tenyészetet triptikáz-szója agaron (Oxoid) 72 órán át 21 °C-on (+/- 1°).
b) Alkalmazzuk a megfelelő FAP eljárást (Janse, 1991; Stead, 1992).
c) A FAP vizsgálat pozitív, ha a vélelmezett tenyészet profilja megegyezik a pozitív kontrolléval. A jellegzetes zsírsavak jelenléte, azaz 15:1 Anteiso A, 15:0 Iso, 15:0 Anteiso, 16:0 Iso, 16:0 és 17:0 Anteiso, erőteljesen a C. m. sepedonicus-ra utal. Más nemzetségek, mint például a Curtobacterium, az Arthrobacter és a Micrococcus, szintén rendelkeznek ezen savak némelyikével, de a 15:1 Anteiso A ritka ezekben a baktériumokban, viszont minden Clavibacter fajban megtalálható 1-5 %-ban. A C. m. sepedonicus esetében ez az érték általában 5 % körüli.
9.6. BOX-PCR
a) Készítsünk egy szuszpenziót, amely hozzávetőleg 106/ml sejtet tartalmaz UPW-ben.
b) Végezzük el a vizsgálatot az eljárás szerint (Smith et al., 2001).
10. MEGERőSÍTő VIZSGÁLAT
A patogenitás vizsgálatot el kell végezni a C. m. subsp. sepedonicus diagnosztizálásának végső megerősítésére, és a C. m. subsp. Sepedonicus-ként azonosított tenyészetek virulenciájának felmérésére.
10.1. Készítsünk a vizsgálandó izolátum 3 napos tenyészetéből hozzávetőleg 106/ml sejtet tartalmazó oltóanyagot, és egy C. m. subsp. sepedonicus törzsből megfelelő pozitív kontrollt.
10.2. Oltsuk be 5-10 fiatal, 3 leveles korban lévő tojásgyümölcs-palánta szárát (7.3. vagy 7.4. szakasz).
10.3. Inkubáljuk 18-24 °C-on elegendő fény és magas relatív páratartalom mellett, valamint a megfelelő öntözés biztosításával, hogy megelőzzük a vízzel való átitatódást, vagy a szárazság okozta stresszt (7.7. szakasz). A tiszta tenyészeteknél a tipikus hervadásnak 2 héten belül be kell következnie, de azokat a növényeket, amelyeken nem mutatkoznak tünetek (lásd a 7.8. szakaszt) ezen időszak letelte után, inkubálni kell 3 héten át a tojásgyümölcs növekedését elősegítő hőmérsékleten, amely nem haladhatja meg a 25 °C-ot (8. függelék). Ha 3 hét után nem mutatkoznak tünetek, akkor nem lehet megerősíteni, hogy a tenyészet a C. m. subsp. sepedonicus patogén formája.
10.4. Izoláljunk a tüneteket mutató növényekből a szár egy darabjának a beoltási pont felett mintegy 2 cm-rel történő eltávolításával. Zúzzuk össze és szuszpendáljuk kis mennyiségű steril desztillált vízben vagy 50 mM foszfát-pufferben (3. függelék). Izoláljuk a szuszpenzióból kengyellel vagy kaccsal végzett hígításos szélesztéssel MTNA vagy YPGA táptalajra (5. függelék), inkubáljuk 3-5 napon át 21-23 °C-on, és figyeljük meg a C. m. subsp. sepedonicus-ra jellemző telepek kialakulását.
1. függelék
A protokollok optimalizálásába és validálásába bevont laboratóriumok
| Laboratórium (1) | Település | Ország |
| Agentur für Gesundheit und Ernährungssicherheit | Bécs és Linz | Ausztria |
| Departement Gewasbescherming | Merelbeke | Belgium |
| Plantedirektoratet | Lyngby | Dánia |
| Central Science Laboratory | York | Anglia |
| Scottish Agricultural Science Agency | Edinburgh | Skócia |
| Laboratoire National de la Protection des Végétaux, Unité de Bactériologie | Angers | Franciaország |
| Laboratoire National de la Protection des Végétaux, Station de Quarantaine de la Pomme de Terre | Le Rheu | Franciaország |
| Biologische Bundesanstalt | Kleinmachnow | Németország |
| Pflanzenschutzamt Hannover | Hannover | Németország |
| State Laboratory | Dublin | Írország |
| Plantenziektenkundige Dienst | Wageningen | Hollandia |
| Norwegian Crop Research Institute, Plant Protection Centre | Aas | Norvégia |
| Direcção-Geral de Protecção das Culturas | Lisszabon | Portugália |
| Nacionalni institut za biologijo | Ljubljana | Szlovénia |
| Centro de Diagnóstico de Aldearrubia | Salamanca | Spanyolország |
| (1) Kapcsolattartó kutatók: lásd a honlapot http://forum.europa.eu.int/Public/irc/sanco/Home/main). | ||
2. függelék
A pozitív és a negatív kontrollok elkészítése az alapvető szűrővizsgálatokhoz: a PCR/IF- és a FISH-teszthez
Készítsünk 72 órás tenyészetet a C. m. subsp. sepedonicus egy virulens törzséből (NCPPB 4053 vagy 406) alap MTNA táptalajon, és szuszpendáljuk 10 mM foszfát-pufferben, hogy hozzávetőleg 1-2 × 108 cfu/ml sejtsűrűséget kapjunk. Ezt rendszerint kissé zavaros szuszpenzióval érjük el, amely 0,2-es optikai sűrűségnek felel meg 600 nm-nél.
Távolítsuk el a köldökrész egy darabját 200 burgonyagumóból, melyek egy fehér héjú fajtából származnak, és ismeretes, hogy mentesek a C. m. subsp. sepedonicus-tól.
Dolgozzuk fel a köldökrészeket a szokásos módon, és szuszpendáljuk újra a üledéket 10 ml-ben.
Készítsünk 10 steril 1,5 ml-es mikrocsövet 900 µl újraszuszpendált üledékkel.
Vigyünk 100 µl C. m. subsp. sepedonicus szuszpenziót az első mikrocsőbe. Vortex-szel keverjük össze.
Hozzuk létre a fertőzés tizedes szintjeit további hígítással a következő öt mikrocsőben.
A hat fertőzött mikrocsövet pozitív kontrollként fogjuk használni. A négy nem fertőzött mikrocsövet negatív kontrollként fogjuk használni. Ennek megfelelően címkézzük a mikrocsöveket.
Készítsünk 100 µl mennyiségeket steril 1,5 ml-es mikrocsövekben, így 9 ismétlést alakítva ki mindegyik kontrollmintából. Tároljuk 16 és 24 °C között a felhasználásig.
Az C. m. subsp. sepedonicus jelenlétét és kvantifikálását a kontrollmintákban először IF-teszttel kell megerősíteni.
A PCR-teszthez végezzünk DNS-kivonást a pozitív és a negatív kontrollmintákból minden egyes vizsgálatiminta-sorozat esetében.
Az IF- és a FISH-tesztekhez végezzünk vizsgálatokat a pozitív és a negatív kontrollmintákon minden egyes vizsgálatiminta-sorozattal.
Az IF-, a FISH- és a PCR-vizsgálatokhoz a C. m. subsp. sepedonicus-t legalább 106 és 104 sejt/ml koncentrációban kell kimutatni a pozitív kontrollokban, és a negatív kontrollok egyikében sem szabad, hogy kimutatható legyen.
3. függelék
Pufferek a vizsgálati eljárásokhoz.
ÁLTALÁNOS: A felbontatlan sterilizált puffereket egy évig lehet tárolni.
1. Pufferek a kivonási eljáráshoz
1.1. Kivonó-puffer (50 mM foszfát- puffer, pH 7,0)
Ez a puffer a baktériumnak a növényi szövetekből homogenizálás vagy rázás útján történő kivonására szolgál.
| Na2HPO4 (vízmentes) | 4,26 g |
| KH2PO4 | 2,72 g |
| Desztillált víz | 1,00 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t és sterilizáljuk autoklávban 121 °C-on 15 percig.
Az alábbi kiegészítő összetevők hasznosak lehetnek:
| Rendeltetés | Mennyiség (literenként) | |
| Lubrol-pelyhek | Diszpergálószer (1) | 0,5 g |
| DC Silicone habzásgátló | Habzásgátló anyag (1) | 1,0 ml |
| Tetranátrium-pirofoszfát | Antioxidáns | 1,0 g |
| Polivinilpirolidon-40 000 (PVP-40) | PCR inhibitorok megkötése | 50 g |
| (1) A homogenizálással végzett kivonási módszerhez | ||
1.2. Üledék-puffer (10 mM foszfát-puffer, pH 7,2)
Ez a puffer a burgonyagumók köldökrészéből vett darabok kivonatainak újraszuszpendálására és hígítására szolgál a üledék centrifugálással végzett koncentrálása után.
| Na2HPO4.12H2O | 2,7 g |
| NaH2PO4.2H2O | 0,4 g |
| Desztillált víz | 1,00 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t és sterilizáljuk autoklávban 121 °C-on 15 percig.
2. Pufferek az IF-teszthez
2.1. IF-puffer (10 mM foszfát-pufferes sóoldat (PBS), pH 7,2)
Ez a puffer az ellenanyagok hígítására szolgál.
| Na2HPO4.12H2O | 2,7 g |
| NaH2PO4.2H2O | 0,4 g |
| NaCl | 8,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t és sterilizáljuk autoklávban 121 °C-on 15 percig.
2.2. IF-puffer-Tween
Ez a puffer a lemezek mosására szolgál.
Adjunk 0,1 %-os Tween 20-at az IF-pufferhez.
2.3. Foszfát-pufferes glicerin, pH 7,6
Ez a puffer fedő folyadékként szolgál az IF-lemezek ablakain a fluoreszcencia megnöveléséhez.
| Na2HPO4.12H2O | 3,2 g |
| NaH2PO4.2H2O | 0,15 g |
| Glicerin | 50 ml |
| Desztillált víz | 100 ml |
Az elhalványulás elleni "ragasztó" oldatok kereskedelmi forgalomban kaphatók pl. Vectashield® (Vector Laboratories) vagy Citifluor® (Leica).
4. függelék
A fertőzöttségi szint meghatározása az IF- és a FISH-tesztben
1. Állapítsuk meg a jellemzően fluoreszkáló sejtek számának középértékét látómezőnként (c).
2. Számítsuk ki a jellemzően fluoreszkáló sejtek számát tárgylemez ablakonként (C)
C = c × S/s
| ahol | S | = | az ablak területe a több mintahelyes lemezen és |
| s | = | az objektív látómezőjének területe |
| s = πi2/4G2K2 | ahol | i | = | látómező koefficiens (az okulár típusától függően 8–24 között változik) |
| K | = | cső koefficiens (1 vagy 1,25) | ||
| G | = | az objektív nagyítása (100x, 40x stb.) |
3. Számítsuk ki a jellemzően fluoreszkáló sejtek számát 1 ml újraszuszpendált üledékben (N)
N = C × 1 000/y × F
| ahol | y | = | az újraszuszpendált üledék térfogata az egyes ablakokban és |
| F | = | az újraszuszpendált üledék hígítási tényezője. |
5. függelék
A C. m. subsp. sepedonicus izolálására és tenyésztésére szolgáló táptalajok
a) Általános táptalajok
Tápagar (NA)
| Tápagar (Difco) | 23,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, és sterilizáljuk autoklávban 121 °C-on 15 percig.
Dextróz-tápagar (NDA)
Difco bacto tápagar, amely 1 % D(+)-glükózt (monohidrát) tartalmaz. Sterilizáljuk autoklávban 115 °C-on 20 percig.
Élesztő-pepton-glükóz agar (YPGA)
| Élesztőkivonat (Difco) | 5,0 g |
| Bacto-pepton (Difco) | 5,0 g |
| D(+)-glükóz (monohidrát) | 10,0 g |
| Bacto-agar (Difco) | 15,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, és sterilizáljuk autoklávban 121 °C-on 15 percig.
Élesztőkivonat-ásványi sók táptalaj (YGM)
| Bacto-élesztőkivonat (Difco) | 2,0 g |
| D(+)-glükóz (monohidrát) | 2,5 g |
| K2HPO4 | 0,25 g |
| KH2PO4 | 0,25 g |
| MgSO4.7H2O | 0,1 g |
| MnSO4.H2O | 0,015 g |
| NaCl | 0,05 g |
| FeSO4.7H2O | 0,005 g |
| Bacto-agar (Difco) | 18 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, és sterilizáljuk a táptalaj 0,5 literes térfogatait autoklávban 115 °C-on 20 percig.
b) Validált szelektív táptalajok
MTNA táptalaj
Ha csak nincs más feltüntetve, valamennyi táptalaj összetevő a BDH-tól került beszerzésre.
| Élesztőkivonat (Difco) | 2,0 g |
| Mannitol | 2,5 g |
| K2HPO4 | 0,25 g |
| KH2PO4 | 0,25 g |
| NaCl | 0,05 g |
| MgSO4.7H2O | 0,1 g |
| MnSO4.H2O | 0,015 g |
| FeSO4.7H2O | 0,005 g |
| Agar (Oxoid No. 1) | 16,0 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, állítsuk be a pH-t 7,2-re. Autoklávozás (121 °C-on 15 percig) és 50 °C-ra történő lehűtés után adjuk hozzá az antibiotikumokat: trimetoprim 0,06 g, nalidixinsav 0,002 g, amfotericin B 0,01 g.
Készítsünk antibiotikum törzsoldatokat: trimetoprim (Sigma) és nalidixinsav (Sigma) (mindkettőből 5 mg/ml), 96 %-os metil-alkoholban, amfotericin B (Sigma) (1 mg/ml) dimetil- szulfoxidban. A törzsoldatokat szűréssel sterilizáljuk.
Megjegyzés:
Az alap táptalaj eltarthatósága 3 hónap. Az antibiotikumok hozzáadása után az eltarthatóság 1 hónap hűtőszekrényben való tárolás esetén.
NCP-88 táptalaj
| Tápagar (Difco) | 23 g |
| Élesztőkivonat (Difco) | 2 g |
| D-mannitol | 5 g |
| K2HPO4 | 2 g |
| KH2PO4 | 0,5 g |
| MgSO4.7H2O | 0,25 g |
| Desztillált víz | 1,0 liter |
Oldjuk fel az összetevőket, állítsuk be a pH-t 7,2-re. Autoklávozás és 50 °C-ra történő lehűtés után, adjuk hozzá a következő antibiotikumokat: polimixin B szulfát (Sigma) 0,003 g, nalidixiksav (Sigma) 0,008 g, cikloheximid (Sigma) 0,2 g.
Oldjuk fel az antibiotikumokat törzsoldatokban a következők szerint: a nalidixinsavat 0,01 M NaOH-ban, a cikloheximid-et 50 %-os etil-alkoholban, a polimixin B szulfátot desztillált vízben. A törzsoldatokat szűréssel sterilizáljuk.
Megjegyzés:
Az alap táptalaj eltarthatósága 3 hónap. Az antibiotikumok hozzáadása után az eltarthatóság 1 hónap hűtőszekrényben való tárolás esetén.
6. függelék
Validált PCR-protokollok és reagensek
Megjegyzés:
Az előzetes vizsgálatnak lehetővé kell tennie 103-104/ml C. m. sepedonicus sejt reprodukálható kimutatását a mintakivonatban.
Az előzetes vizsgálat nem mutathat hamis pozitív eredményeket a kiválasztott baktériumtörzsek esetében.
1. Multiplex PCR-protokoll belső PCR- kontrollal (Pastrik, 2000)
1.1. Oligonukleotid primerek
| PSA-1 előre haladó primer | 5′- ctc ctt gtg ggg tgg gaa aa -3′ |
| PSA-R fordított primer | 5′- tac tga gat gtt tca ctt ccc c -3′ |
| NS-7-F előre haladó primer | 5′- gag gca ata aca ggt ctg tga tgc -3′ |
| NS-8-R fordított primer | 5′- tcc gca ggt tca cct acg ga -3′ |
Várható fragmentum méret a C. m. subsp. sepedonicus DNS templátból = 502 bp (PSA-primerkészlet)
Várható fragmentum méret a 18S rRNS belső PCR-ellenőrzésből = 377 bp (NS-primerkészlet)
1.2. PCR reakcióelegy
| Reagens | Mennyiség reakciónként | Végkoncentráció |
| Steril UPW | 15,725 µl | |
| 10x PCR-puffer (1) (15 mM MgCl2) | 2,5 µl | 1x (1,5 mM MgCl2) |
| BSA (V. frakció) (10 %) | 0,25 µl | 0,1 % |
| d-nTP elegy (20 mM) | 0,125 µl | 0,1 mM |
| PSA-1 primer (10 µM) | 0,5 µl | 0,2 µM |
| PSA-R primer (10 µM) | 0,5 µl | 0,2 µM |
| NS-7-F primer (10 µM) (2) | 0,1 µl | 0,04 µM |
| NS-8-R primer (10 µM) (2) | 0,1 µl | 0,04 µM |
| Taq polimeráz (5 U/µl) (1) | 0,2 µl | 1,0 U |
| A minta térfogata | 5,0 µl | |
| Össztérfogat: | 25,0 µl | |
| (1) A módszereket Taq polimeráz felhasználásával validálták (Perkin Elmer [AmpliTaq] and Gibco BRL). (2) Az NS-7-F és az NS-8-R primerek koncentrációját a burgonyagumó köldökrészéből vett darab homogenizációs módszerrel végzett extrakciójára és a Pastrik-féle DNS-tisztításra (2000) optimalizálták (lásd a 6.1. a) és a 6.2. szakaszt). A reagens koncentrációk újraoptimalizálására lesz szükség rázással végzett extrakció vagy eltérő DNS-izolálási módszerek használata esetén. | ||
1.3. A PCR-reakció feltételei
Futtassuk a következő programot:
| 1 ciklusban: | i. | 3 percig 95 °C-on (DNS templát denaturálása) |
| 10 ciklusban: | ii. | 1 percig 95 °C-on (DNS templát denaturálása) |
| iii. | 1 percig 64 °C-on (primerek temperálása) | |
| iv. | 1 percig 72 °C-on (másolat meghosszabbítása) | |
| 25 ciklusban: | v. | 30 másodpercig 95 °C-on (DNS templát denaturálása) |
| vi. | 30 másodpercig 62 °C-on (primerek temperálása) | |
| vii. | 1 percig 72 °C-on (másolat meghosszabbítása) | |
| 1 ciklusban: | viii. | 5 percig 72 °C-on (végső meghosszabbítás) |
| ix. | tartsuk 4 °C-on. |
Megjegyzés:
Ezt a programot MJ Research PTC 200 thermal cycler-re optimalizálták. Más modellek használata szükségessé teheti a ii., iii., iv., v., vi. és vii. cikluslépések időtartamának megváltoztatását.
1.4. A fragmentum restrikciós enzim elemzése
A C. m. subsp. sepedonicus DNS-ből felerősített PCR-termékek jellegzetes fragmentumhossz polimorfizmust mutatnak Bgl II. enzimmel 37 °C-on 30 percig végzett inkubálás után. A C. m. subsp. sepedonicus-specifikus fragmentumból kapott restrikciós fragmentumok mérete 282 bp és 220 bp.
2. A betöltő puffer elkészítése
2.1. Brómfenol kék (10 %-os törzsoldat)
| Brómfenol kék | 5 g |
| Desztillált víz (bidest) | 50 ml |
2.2. Betöltő puffer
| Glicerin (86 %) | 3,5 ml |
| Brómfenol kék (5.1) | 300 µl |
| Desztillált víz (bidest) | 6,2 ml |
3. 10x Tris-acetát-EDTA (TAE) puffer, pH 8,0
| Tris puffer | 48,4 g |
| Jégecet | 11,42 ml |
| EDTA (dinátrium só) | 3,72 g |
| Desztillált víz | 1,00 liter |
Hígítsuk 1x-re használat előtt.
Kereskedelmi forgalomban is kapható (pl. Invitrogen vagy azzal egyenértékű).
7. függelék
Validált reagensek a FISH-teszthez
1. Oligo-próbák
| CMS-CY3-01Cms-specifikus teszt | 5’- ttg cgg ggc gca cat ctc tgc acg -3’ |
| EUB-338-FITC nem-specifikus eubaktérium teszt | 5’- gct gcc tcc cgt agg agt-3’ |
2. Fixáló oldat
(VIGYÁZAT! A FIXÁLÓ PARAFORMALDEHIDET TARTALMAZ, AMELY MÉRGEZŐ. HASZNÁLJON KESZTYŰT, ÉS NE LÉLEGEZZE BE. TANÁCSOS VEGYIFÜLKÉBEN DOLGOZNI.)
i. Melegítsünk 9 ml molekuláris tisztaságú vizet (pl. Ultra tiszta vizet [UPW]) körülbelül 60 °C-ra, és adjunk hozzá 0,4 g paraformaldehidet. A paraformaldehid feloldódik 5 csepp 1N NaOH hozzáadása és mágneses keverőbottal végzett keverés után.
ii. Állítsuk be a pH-t 7,0-ra 1 ml 0,1 M foszfát-puffer (PB; pH 7,0) és 1 N HCl cseppek hozzáadásával. Ellenőrizzük a pH-t indikátorpapírral, és szükség esetén állítsuk be HCl-lel vagy NaOH-val.
(FIGYELEM! NE HASZNÁLJON PH-MÉRŐT A PARAFORMALEDHIDET TARTALMAZÓ OLDATOKBAN.)
iii. Szűrjük át az oldatot 0,22 µm membránszűrőn, és pormentesen 4 °C-on tároljuk a további használatig.
iv. Megjegyzés:
Alternatív fixáló oldat: 96 %-os etil-alkohol.
3. 3x Hibmix
| NaCl | 2,7 M |
| Tris-HCl | 60 mM (pH 7,4) |
| EDTA (szűréssel sterilizált és autoklávozott) | 15 mM |
Hígítsuk 1x-re szükség szerint.
4. Hibridizációs oldat
1x Hibmix
| Nátrium-dodecil-szulfát (SDS) | 0,01 % |
| EUB 338 teszt | 5 ng/μl |
| CMSCY301 teszt | 5 ng/μl |
Készítsünk nagyobb mennyiséget a hibridizációs oldatból az 1. táblázatban megadott értékek szerint. Mindegyik lemezhez (melyek 2 különböző mintát tartalmaznak, és azok másolatait) 90 μl hibridizációs oldatra van szükség.
Táblázat: A hibridizációs elegy elkészítéséhez javasolt mennyiségek
| A lemezek száma: | 2 | 8 |
| Steril UPW | 50,1 | 200,4 |
| 3x hibmix | 30,0 | 120,0 |
| 1 % SDS | 0,9 | 3,6 |
| EUB 338 teszt (100 ng/μl) | 4,5 | 18,0 |
| CMSCY301 teszt (100 ng/μl) | 4,5 | 18,0 |
| Össztérfogat (μl) | 90,0 | 360,0 |
Megjegyzés: A fényérzékeny oligo-próbákatt tartalmazó oldatokat tároljuk sötétben 20 °C-on. Óvjuk a közvetlen napfénytől és a mesterséges fénytől a használat során.
5. 0,1 M Foszfát-puffer, pH 7,0
| Na2HPO4 | 8,52 g |
| KH2PO4 | 5,44 g |
| Desztillált víz | 1,00 liter |
Oldjuk fel az összetevőket, ellenőrizzük a pH-t, és sterilizáljuk autoklávban 121 °C-on 15 percig.
8. függelék
A tojásgyümölcs nevelése
Vessük el a tojásgyümölcs (Solanum melongena) vetőmagját pasztörizált, vetőmag elvetésénél használt komposztba. Ültessük át a teljesen szétnyílt sziklevelekkel rendelkező palántákat (10-14 nap) pasztörizált, tenyészedénybe való ültetésnél használt komposztba.
A tojásgyümölcs-növényeket üvegházban kell nevelni a következő környezeti feltételek mellett:
| Nappalhossz | 14 óra vagy természetes nappalhossz, ha az hosszabb; | |
| Hőmérséklet | nappali | 21–24 °C, |
| éjszakai | 15 °C. |
| Fogékony tojásgyümölcs-fajta: | „Black Beauty”, |
| „Long Tom”, | |
| „Rima”, | |
| „Balsas”. |
Beszállítók: lásd a honlapot http://forum.europa.eu.int/Public/irc/sanco/Home/main
9. függelék
Gram-festési eljárás (Hucker-féle módosítás) (Doetsch, 1981) ( 6 )
Kristályibolya-oldat
Oldjunk fel 2 g kristályibolyát 20 ml 95 %-os etil-alkoholban.
Oldjunk fel 0,8 g ammónium-oxalátot 80 ml desztillált vízben.
Elegyítsük a két oldatot.
Lugol-féle jód
| Jód | 1 g |
| Kálium-jodid | 2 g |
| Desztillált víz | 300 ml |
Törjük össze együtt a szilárd összetevőket mozsártörővel egy mozsárban. Adjuk hozzá a vízhez, és keverjük, hogy feloldódjanak egy zárt edényben.
Szafranin ellenfestő oldat
Törzsoldat:
| Szafranin O | 2,5 g |
| 95 %-os etil-alkohol | 100 ml |
Elegyítsük, és tároljuk.
Hígítsuk: 1:10 arányban, hogy megkapjuk a munkaoldatot.
Festési eljárás
1. Készítsünk keneteket, levegőn szárítsuk meg, és hővel rögzítsük.
2. Árasszuk el a lemezt kristályibolya oldattal egy percre.
3. Rövid ideig mossuk csapvízzel.
4. Árasszuk el Lugol-féle jóddal egy percre.
5. Mossuk le csapvízzel, és itassuk szárazra.
6. Színtelenítsük 95 %-os etil-alkohollal, cseppenként hozzáadva, amíg további szín már nem vonható ki, vagy merítsük bele enyhén rázogatva 30 másodpercre.
7. Mossuk le csapvízzel, és itassuk szárazra.
8. Árasszuk el szafranin-oldattal 10 másodpercre.
9. Mossuk le csapvízzel, és itassuk szárazra.
A Gram-pozitív baktériumok ibolyakékre festődnek; a Gram-negatív baktériumok szegfűvörösre festődnek.
IRODALOM
1. Anonymous, 1987. Scheme of the detection and diagnosis of the ring rot bacterium Corynebacterium sepedonicum in batches of potato tubers. Commission of the European Communities, Luxembourg. Publ EUR 11 288 EN, 21 pp.
2. Bradbury, J. F., 1970. Isolation and preliminary study of bacteria from plants. Rev. Pl. Path., 49, 213-218.
3. Dinesen, I. G., 1984. The extraction and diagnosis of Corynebacterium sepedonicum from diseased potato tubers. EPPO Bull. 14 (2), 147-152.
4. Doetsch, R. N., 1981. Determinative methods of light microscopy. In: Manual of methods for general bacteriology, American Society for Microbiology, Washington, 21-23.
5. Hugh, R. and Leifson, F., 1953. The taxonomic significance of fermentative versus oxidative metabolism of carbohydrates by various gram-negative bacteria. J. Bact., 66, 24-26.
6. Janse, J. D., 1991. Infra- and intra-specific classification of Pseudomonas solanacearum strains using whole cell fatty-acid analysis. Systematic and Applied Microbiology 14; 335-345.
7. Janse, J. D. and J. Van Vaerenbergh. The interpretation of the EC method for the detection of latent ring rot infections (Corynebacterium sepedonicum) in potato. EPPO Bull., No 17, 1987, pp. 1-10.
8. Jansing, H. and K. Rudolph, 1998. Physiological capabilities of Clavibacter michiganensis ssp. sepedonicus and development of a semi-selective medium. Journal of Plant Diseases and Protection, 105, 590-601.
9. Kovacs, N., 1956. Identification of Pseudomonas pyocyanea by the oxidase reaction. Nature, Lond., 178, 703.
10. Klement Z.; Rudolph, K and D. C. Sands, 1990. Methods in Phytobacteriology. Akadémiai Kiadó, Budapest, 568 pp.
11. Lelliott, R. A., 1966. The plant pathogenic coryneform bacteria. J. appl. Bact., 29, 114-118.
12. Lelliott, R. A., E. Billing and A. C. Hayward, 1966. A determinative scheme for the fluorescent plant pathogenic pseudomonads J. appl. Bact., 29, 470-489.
13. Lelliott, R. A. and P. W., Sellar, 1976. The detection of latent ring rot (Corynebacterium sepedonicum (Spiek. et Kotth.) Skapt. et Burkh.) in potato stocks. EPPO Bull., 6 (2), 101-106.
14. Li, X. and S.H. de Boer, 1995. Selection of Polymerase Chain Reaction primers from RNA intergenic spacer region for specific detection of Clavibacter michiganensis ssp. sepedonicus. Phytopathology, 85, 837-842.
15. Mills, D., Russell, B., W. and J., W. Hanus, 1997. Specific detection of Clavibacter michiganensis ssp. sepedonicus by amplification of three unique DNA sequences isolated by subtraction hybridization. Phytopathology, 87, 8, 853-861.
16. Pastrik, K. -H. and R.A. Rainey. 1999. Identification and differentiation of Clavibacter michiganensis subspecies by polymerase chain reaction-based techniques. J. Phytopathology 147; 687-693.
17. Pastrik, K.-H., 2000. Detection of Clavibacter michiganensis ssp. sepedonicus in potato tubers by multiplex PCR with coamplification of host DNA. European Journal of Plant Pathology, 106, 155-165.
18. Ramamurthi, C. S., 1959. Comparative studies on some Gram-positive phytopathogenic bacteria and their relationship to the Corynebacteria. Mem. Cornell agric. Exp. Sta., 366, 52 pp.
19. Schaad, W., Berthier-Schaad, Y., Sechler, A. and Knorr, D. (1999) Detection of Clavibacter michiganensis subsp. sepedonicus in potato tubers by BIO-PCR and an automated real-time fluorescence detection system. Plant Disease 83; 1095-1100.
20. Schaad, W. 2001. Laboratory guide for identification of plant pathogenic bacteria. Schaad [Hrsg.]. - 3. ed.; St. Paul, Minnesota:, 373 pp.
21. Skerman, V. B. D., 1967. A guide to the identification of the genera of bacteria. 2nd ed., William and Wilkins Company, Baltimore.
22. Smith, N. C.; Hennesy, J; Stead, D.E., 2001. Repetetive sequence-derived PCR profiling using the BOX-A1Ralstonia solanacearum primer for rapid identification of plant pathogen Clavibacter michiganensis ssp. sepedonicus. European Journal of Plant Pathology, 107 (7), 739-748.
23. Sneath, P. H. A. and V. G. Collins, 1974. A study in test reproductibility between laboratories: report of Pseudomonas working party. Antonie van Leeuwenhoek, 40, 481-527.
24. Stead, D.E. 1992. Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty-acid profiles. International Journal of Systematic Bacteriology 42; 281-295.
25. Wullings, B. A.; van Beuningen, A. R.; Janse, J. D. and A. D. L. Akkermans, 1998. Detection of Ralstonia solanacearum, which causes brown rot of potato, by fluorescent in situ hybridization with 23s rRNA-targeted probes. Appl. Environ. Microbiol. 64, 4546-4554.
II. MELLÉKLET
1. A károsító minden olyan gyanított előfordulása esetén, amikor a szűrővizsgálat(ok) során pozitív eredmény került megállapításra az I. mellékletben meghatározott módszereknek megfelelően, és a gyanú az említett módszerek befejezése révén megerősítésre vagy eloszlatásra vár, meg kell őrizni és megfelelően fent kell tartani:
- az összes gumót és - amennyiben lehetséges - az összes növényt, amelyekből mintát vettünk,
- a kivonatok maradékait és a szűrővizsgálat(ok)hoz készített további anyagokat, pl. immunfluoreszcenciás lemezeket,
- és
- a teljes vonatkozó dokumentációt,
az említett módszerek befejezéséig.
A gumók megőrzése lehetőséget fog biztosítani a fajtavizsgálat elvégzésére, amennyiben helyénvaló.
2. A károsító előfordulásának pozitív megerősítése esetén, meg kell őrizni és megfelelően fent kell tartani:
- az 1. bekezdésben meghatározott anyagokat,
- és
- a gumó- vagy növénykivonattal beoltott, fertőzött tojásgyümölcsből vett mintát,
- és
- a károsító izolált tenyészetét,
legalább egy hónapig az 5. cikk (2) bekezdése szerinti bejelentési eljárást követően.
III. MELLÉKLET
1. A feltételezett fertőzés mértékének az 5. cikk (1) bekezdése b) pontja szerinti meghatározásánál a következőket kell figyelembe venni:
- az 5. cikk (1) bekezdése a) pontja szerint fertőzöttnek minősülő termőhelyen termesztett gumókat vagy növényeket,
- az 5. cikk (1) bekezdése a) pontja szerint fertőzöttnek minősülő gumókkal vagy növényekkel termelési kapcsolatban álló termőhely(ek)et, beleértve azokat, ahol - közvetlenül, vagy közös szolgáltatón keresztül - közösen használnak termelési eszközöket és létesítményeket,
- a gumókat vagy növényeket, amelyeket az előző francia bekezdésben említett termőhelye(ke)n termesztettek, vagy amelyek jelen voltak ilyen termőhelye(ke)n abban az időszakban, amikor az 5. cikk (1) bekezdése a) pontja szerint fertőzöttnek minősülő gumók vagy növények jelen voltak az első francia bekezdésben említett telephelyeken vagy termőhelyen,
- telephelyeket, ahol a fenti francia bekezdésekben említett termőhelyekről származó burgonyát kezelik,
- mindazokat a gépeket, járműveket, hajókat, raktárakat, vagy azok részeit, valamint minden egyéb tárgyat, beleértve a csomagolóanyagokat is, amelyek érintkezésbe kerülhettek az 5. cikk (1) bekezdése a) pontja szerint fertőzöttnek minősülő gumókkal vagy növényekkel,
- mindazokat a gumókat vagy növényeket, amelyek az előző francia bekezdésben felsorolt építmények vagy tárgyak bármelyikében tárolásra kerültek, vagy azok bármelyikével érintkezésbe kerültek, ezen építmények és tárgyak tisztítását és fertőtlenítését megelőzően,
- a 6. cikk szerint elvégzett vizsgálat eredményeként, azokat a gumókat vagy növényeket, amelyek egyenes- vagy oldalági klonális kapcsolatban állnak az 5. cikk (1) bekezdése a) pontja szerint fertőzöttnek minősülő gumókkal vagy növényekkel, és amelyeknél úgy tűnik, hogy - bár a károsító kimutatására irányuló vizsgálat hozhatott negatív eredményt - a fertőzés valószínűsíthető a klonális kapcsolat útján. Fajtavizsgálatra kerülhet sor a fertőzött és klonális kapcsolatban álló gumók vagy növények azonosságának igazolására,
- és
- az előző francia bekezdésben említett gumók vagy növények termőhelyét/termőhelyeit.
2. A fertőzés lehetséges terjedésének az 5. cikk (1) bekezdése c) pontja szerinti meghatározásánál a következőket kell figyelembe venni:
- a burgonya vagy az egyéb gazdanövények más termőhelyeinek közelségét,
- a vetőburgonya készletek közös termesztését és felhasználását.
3. Az 5. cikk (2) bekezdése első albekezdésében említett bejelentést a következőképpen kell megtenni:
- közvetlenül a károsító jelenlétének az I. mellékletben meghatározott módszerekkel végzett laboratóriumi vizsgálat útján történt megerősítése után, legalább:
-
- a burgonyatétel fajtaneve,
- a típus (áru-, vető-, stb.) és - ahol alkalmazható - a vetőmag kategóriája,
- amikor fennáll a veszélye másik tagállam(ok)ból érkező vagy oda szállított burgonya befertőződésének, a tagállam - amelyben az előfordulást megerősítették - haladéktalanul értesíti az érintett tagállamo(ka)t azon információkról, amelyek az 5. cikk (3) bekezdésének való megfeleléshez szükségesek, úgymint:
-
- a burgonyatétel fajtaneve,
- a feladó és a címzett neve és címe,
- a burgonyatétel szállításának időpontja,
- a szállított burgonyatétel mérete,
- a növényútlevél másolata vagy legalább a növényútlevél száma, adott esetben, vagy a termelő vagy forgalmazó regisztrációs száma és a szállítási értesítés másolata.
A Bizottságot haladéktalanul értesítik ezen információ közléséről.
- az összes vizsgálat lezárása után, minden egyes esetben:
-
- a fertőzés megerősítésének időpontja,
- a fertőzés forrásának és lehetséges terjedésének azonosítása céljából végzett vizsgálat rövid leírása, ideértve a mintavételezés szintjét,
- a fertőzés azonosított vagy vélelmezett forrására/forrásaira vonatkozó információ,
- a minősített fertőzés mértékére vonatkozó részletek, beleértve a termőhelyek számát és burgonya esetében, a tételek számát a fajta és - vetőburgonyánál - a kategória megjelölésével,
- a kijelölt övezetre vonatkozó részletek, beleértve a fertőzöttnek nem minősített, de az övezetbe bevont termőhelyek számát,
- egyéb információk a megerősített gócszerű előfordulásokra vonatkozóan a Bizottság esetleges igénye szerint.
IV. MELLÉKLET
1. A 7. cikk (1) bekezdésében említett hatóságilag felügyelt intézkedések a következők:
- állati takarmányként való felhasználás olyan hőkezelés után, hogy ne állhasson fenn a károsító túlélésének a veszélye,
- vagy
- a biztonságos elhelyezés egy olyan hatóságilag engedélyezett biztonságos hulladéklerakó telepen, ahol nem áll fenn a kórokozó környezetbe jutásának az azonosítható veszélye, pl. a mezőgazdasági területekre való átszivárgással,
- vagy
- elégetés,
- vagy
- ipari feldolgozás azonnali elszállítással közvetlenül egy olyan feldolgozóüzembe, amely rendelkezik hatóságilag engedélyezett hulladék-ártalmatlanító berendezésekkel, melyek tekintetében megállapítást nyert, hogy nem áll fenn a károsító terjedésének azonosítható veszélye, és rendelkezik egy programmal legalább a szállítójárművek tisztítására és fertőtlenítésére,
- vagy
- egyéb intézkedések, feltéve, hogy megállapítást nyert, hogy nem áll fenn a károsító terjedésének azonosítható veszélye; ezekről az intézkedésekről és az indoklásukról értesíteni kell a Bizottságot és a többi tagállamot.
Bármilyen, a fentiekkel összefüggő vagy azoktól származó hulladékot ezen irányelv V. mellékletének megfelelően hatóságilag jóváhagyott módszerrel kell elhelyezni.
2. Az 5. cikk (1) bekezdése b) pontja szerint valószínűleg fertőzöttnek nyilvánított gumóknak vagy növényeknek a 7. cikk (2) bekezdésében említett megfelelő felhasználása vagy biztonságos elhelyezése - az érintett tagállamok illetékes hivatalos szerveinek felügyelete mellett, az illetékes hivatalos szervek közötti megfelelő információcserével e felügyelet mindenkori biztosítása érdekében, és azon tagállam illetékes hivatalos szervének jóváhagyásával az első és a második francia bekezdésben említett hulladékelhelyezésre szolgáló berendezések vonatkozásában, ahol a burgonyát csomagolják vagy feldolgozzák - a következőképpen történik:
- fogyasztásra szánt áruburgonyaként való felhasználás, közvetlen szállításhoz és átcsomagolás nélküli felhasználáshoz csomagolva, egy megfelelő hulladékelhelyezésre szolgáló berendezésekkel rendelkező telepen. A vetőburgonyát csak ugyanazon a telepen lehet kezelni, ha arra elkülönítve vagy tisztítás és fertőtlenítés után kerül sor,
- vagy
- ipari feldolgozásra szánt áruburgonyaként való felhasználás, és azonnali elszállításra szánva közvetlenül egy olyan feldolgozóüzembe, amely rendelkezik megfelelő hulladékelhelyezésre szolgáló berendezésekkel és egy programmal legalább a szállítójárművek tisztítására és fertőtlenítésére,
- vagy
- néhány egyéb felhasználási vagy elhelyezési mód, feltéve, hogy nem áll fenn a károsító terjedésének azonosítható veszélye, és az említett illetékes hivatalos szervek jóváhagyásától függően.
3. A 7. cikk (3) bekezdésében említett eszközök fertőzéstől való mentesítésének megfelelő módszere a tisztítás és - amennyiben helyénvaló - a fertőtlenítés, oly módon, hogy ne álljon fenn a károsító terjedésének azonosítható veszélye, és a tagállamok illetékes hivatalos szerveinek felügyelete mellett végezve.
4. Az 5. cikk (1) bekezdése c) pontja szerint létrehozott és a 7. cikk (4) bekezdésében említett kijelölt övezetben a tagállamok által végrehajtandó intézkedéssorozat magában foglalja:
4.1. az 5. cikk (1) bekezdése a) pontja szerint fertőzöttnek minősített termőhelyek esetében:
a) az 5. cikk (1) bekezdése a) pontja szerint fertőzöttnek minősített tábláján, vagy
i. - a fertőzötté minősítés évét követő legalább három tenyészidőszak során,
-
- intézkedéseket hoznak az árvakelésű burgonyanövények, valamint a károsító egyéb, a természetben megtalálható gazdanövényeinek eltávolítása céljából,
- és
- nem ültetnek burgonyagumókat, -növényeket vagy valódi magokat, vagy a károsító egyéb, természetben megtalálható gazdanövényét, vagy olyan kultúrnövényeket, amelyek esetében azonosítható kockázata van a károsító terjedésének,
- az előző francia bekezdésben meghatározott időszakot követő első burgonyatermesztési évben, és azzal a feltétellel, hogy a táblát mentesnek találták az árvakelésű burgonyanövényektől, valamint a károsító egyéb, természetben megtalálható gazdanövényeitől a hatósági ellenőrzések során az ültetést megelőző legalább két egymást követő tenyészidőszakban, csak az áruburgonya-termesztés engedélyezhető, és a betakarított burgonyagumókat megvizsgálják az I. mellékletben részletezett eljárásnak megfelelően,
- az előző francia bekezdésben említett időszakot követő burgonyatermesztési évben és a megfelelő vetésforgót követően, amely vetőburgonya-termesztési cél esetén legalább két év, burgonya ültethető mind vető-, mind áruburgonya-termesztési céllal, és el kell végezni a 2. cikk (1) bekezdésében részletezett hatósági felmérést, vagy
ii. - a fertőzötté minősítés évét követő négy tenyészidőszakon át,
-
- intézkedéseket hoznak az árvakelésű burgonyanövények, valamint a károsító egyéb, természetben megtalálható gazdanövényeinek eltávolítása céljából,
- és
- a táblát fekete ugaroltatják, vagy állandó legelőként hasznosítják, melyet gyakran és alacsonyan kaszálnak, vagy intenzíven legeltetnek,
- az előző francia bekezdésben meghatározott időszakot követő első burgonyatermesztési évben, és azzal a feltétellel, hogy a táblát mentesnek találták az árvakelésű burgonyanövényektől, valamint a károsító egyéb, természetben megtalálható gazdanövényeitől a hatósági ellenőrzések során az ültetést megelőző legalább két egymást követő tenyészidőszakban, a vető- vagy az áruburgonya-termesztés engedélyezhető, és a betakarított burgonyagumókat megvizsgálják az I. mellékletben részletezett eljárásnak megfelelően;
b) a fertőzött termőhely egyéb tábláin és azzal a feltétellel, hogy az illetékes hivatalos szervek megbizonyosodtak az árvakelésű burgonyanövények és a károsító egyéb, természetben megtalálható gazdanövényei által jelentett veszély megszűnéséről:
- a fertőzötté minősítés évét követő tenyészidőszakban vagy nem ültetnek burgonyagumókat, burgonyanövényeket vagy valódi burgonyamagokat, vagy a károsító egyéb, természetben megtalálható gazdanövényeit, vagy
-
- ültethetnek tanúsított vetőburgonyát kizárólag áruburgonya-termesztés céljára,
- a fertőzötté minősítés évét követő második tenyészidőszakban vető- vagy áruburgonya-termesztés céljára kizárólag hatóságilag tanúsított vetőburgonyát vagy olyan vetőburgonyát ültetnek, amelyet bevizsgáltak a gyűrűs rothadás hiányára nézve, és hatósági felügyelet mellett termesztették a 4.1. pontban említettektől eltérő termőhelyeken,
- legalább a fertőzötté nyilvánítás évét követő harmadik tenyészidőszakban, vető- vagy áruburgonya-termesztés céljára kizárólag tanúsított vetőburgonyát vagy olyan vetőburgonyát ültetnek, amelyet hatósági felügyelet mellett termesztettek tanúsított vetőburgonyából,
- a korábbi francia bekezdésekben említett tenyészidőszakok mindegyikében, intézkedéseket kell hozni az árvakelésű burgonyanövények és a károsító egyéb, természetben megtalálható gazdanövényei által jelentett veszély megszüntetéséről, valamint, hogy mindegyik burgonyatáblán hatóságilag megvizsgálják a betakarított gumókat az I. mellékletben meghatározott eljárás szerint;
c) közvetlenül az 5. cikk (1) bekezdése a) pontja szerinti fertőzötté minősítés és az azt követő első tenyészidőszak után a termőhelyen található és a burgonyatermesztéshez használt valamennyi gépet és tároló létesítményt megtisztítják, és - amennyiben szükséges - fertőtlenítik a megfelelő módszerek felhasználásával, a 3. pontban meghatározottak szerint;
d) a védett kultúra olyan egységében, ahol lehetőség van a termesztőközeg teljes cseréjére,
- nem ültetnek burgonyagumókat, burgonyanövényeket vagy valódi magokat, csak akkor, ha a termesztési egységet hatóságilag felügyelt intézkedéseknek vetették alá a károsító elpusztítása és valamennyi gazdanövényanyag eltávolítása céljából, beleértve - legalább - a termesztőközeg teljes cseréjét, valamint a termesztési egység és az összes felszerelés tisztítását és fertőtlenítését, és ezt követően az illetékes hivatalos szervek engedélyt adtak a burgonyatermesztésre,
- és
- a burgonyatermesztést tanúsított vetőburgonyával, vagy bevizsgált forrásból származó minigumókkal vagy mikronövényekkel végzik;
4.2. a kijelölt övezeten belül, a 4.1. pontban részletezett intézkedések sérelme nélkül, a tagállamoknak:
a) a fertőzötté nyilvánítást követően azonnal gondoskodniuk kell az ilyen telephelyen lévő, és a burgonyatermesztéshez használt valamennyi gép és tárolóhely megtisztításáról és fertőtlenítéséről - ahogy helyénvaló - a megfelelő módszerek felhasználásával a 3. pontban meghatározottak szerint;
b) azonnal, és a fertőzötté minősítést követő legalább három tenyészidőszakon át:
- illetékes hivatalos szerveik által biztosítják a burgonyagumókat termesztő, tároló vagy kezelő telephelyek felügyeletét, azon telephelyek felügyeletével együtt, amelyek burgonyatermesztéshez használt gépeket üzemeltetnek szerződéses alapon,
- megkövetelik, hogy az adott övezeten belül bármiféle burgonyatermesztés céljára kizárólag tanúsított vetőburgonyát vagy hatósági felügyelet mellett termesztett vetőburgonyát használjanak, és hogy betakarítás után az 5. cikk (1) bekezdése b) pontja szerint feltehetően fertőzöttnek minősített termőhelyen termesztett vetőburgonyát laboratóriumi vizsgálatnak vessék alá,
- megkövetelik a betakarított vetőburgonya-készleteknek az áruburgonya-készletektől elkülönített kezelését az övezeten belüli összes telephelyen, vagy a tisztításra és fertőtlenítésre szolgáló program lebonyolítását a vetőburgonya és az áruburgonya készletek kezelése között,
- hivatalos felmérést végeznek a 2. cikk (1) bekezdésében részletezettek szerint;
c) kialakítanak egy programot - amennyiben helyénvaló - a teljes vetőburgonya készletnek megfelelő időtartam alatt történő lecserélésére.
V. MELLÉKLET
A IV. melléklet (1) bekezdésében említett hatóságilag jóváhagyott hulladék elhelyezési módszereknek eleget kell tenniük az alábbi rendelkezéseknek, hogy megelőzzék a károsító elterjedésének bármilyen azonosítható veszélyét:
i. burgonyahulladék (beleértve a kiselejtezett burgonyát és héjat), valamint bármilyen más, a burgonyához kapcsolódó szilárd hulladékot (beleértve földet, köveket és egyéb törmeléket) vagy
- olyan hatóságilag engedélyezett, erre a célra rendelt hulladéklerakó telepen kell elhelyezni, ahol nem áll fenn a kórokozó környezetbe jutásának azonosítható veszélye, pl. a mezőgazdasági területekre való átszivárgással. A hulladékot biztonságos körülmények között közvetlenül a lerakóhelyre kell szállítani oly módon, hogy ne álljon fenn a hulladék elveszítésének veszélye,
- vagy
- elégetés,
- vagy
- egyéb intézkedések, feltéve, hogy megállapítást nyert, hogy nem áll fenn a károsító terjedésének azonosítható veszélye; ezekről az intézkedésekről és az indokolásukról értesíteni kell a Bizottságot és a többi tagállamot;
ii. technológiai szennyvíz: az elhelyezést megelőzően a lebegő szilárd anyagokat tartalmazó szennyvizet szűrési vagy ülepítési eljárásnak kell alávetni e szilárd anyagok eltávolítása érdekében. Ezeket a szilárd anyagokat az i. albekezdésben foglaltak szerint kell elhelyezni.
A folyadékot ezt követően vagy
- úgy kell hőkezelni az elhelyezést megelőzően, hogy a szennyvíz minden részében a hőmérséklet 30 percen keresztül legalább 60 °C legyen,
- vagy
- egyéb olyan hatóságilag engedélyezett és hatóságilag felügyelt módon kell elhelyezni, amelynél nem áll fel a hulladék mezőgazdasági területtel való érintkezésének azonosítható veszélye. Ennek módozatairól értesíteni kell a többi tagállamot és a Bizottságot.
Az e mellékletben foglalt rendelkezéseket kell alkalmazni a fertőzött tételek kezelésére, elhelyezésére és feldolgozására vonatkozóan is.
( 1 ) HL C 93., 1993.4.2., 12. o.
( 2 ) HL C 176., 1993.6.28., 210. o.
( 3 ) HL C 161., 1993.6.14., 18. o.
( 4 ) HL L 26., 1977.1.31., 20. o. A legutóbb a 92/103/EGK bizottsági irányelvvel (HL L 363., 1992.12.11., 1. o.) módosított irányelv.
( 5 ) HL L 180., 1980.7.14., 30. o.
( 6 ) Szintén használhatók kereskedelmi forgalomban kapható oldatok és festőkészletek.
Lábjegyzetek:
[1] A dokumentum eredetije megtekinthető CELEX: 31993L0085 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:31993L0085&locale=hu Utolsó elérhető, magyar nyelvű konszolidált változat CELEX: 01993L0085-20060707 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:01993L0085-20060707&locale=hu


