BM egészségügyi szakmai irányelve (EüK 2024/18.)
a felnőttkorú irritábilis bél szindrómában szenvedő betegek diagnózisáról, terápiájáról és gondozásáról
Típusa: Klinikai Egészségügyi Szakmai Irányelv
Azonosító: 002250
Érvényesség időtartama: megjelenést követő 3 évig
I. IRÁNYELVFEJLESZTÉSBEN RÉSZTVEVŐK
Társszerző Egészségügyi Szakmai Kollégiumi Tagozat(ok):
1. Gasztroenterológia és Hepatológia Tagozat
Prof. Dr. Wittmann Tibor, gasztroenterológus, belgyógyász, elnök
2. Háziorvostan Tagozat
Dr. Szabó János, háziorvostan, foglalkozás-orvostan (üzemorvostan) szakorvosa, elnök
3. Mozgásterápia, fizioterápia Tagozat
Zaletnyik Zita, gyógytornász, elnök
Dr. Hock Márta, gyógytornász, elnök (2024. április 22-től)
4. Dietetika, humán táplálkozás Tagozat
Gubicskóné Dr. Kisbenedek Andrea, dietetikus, elnök
5. Pszichiátria Tagozat
Prof. Dr. Réthelyi János, pszichiátria, klinikai genetika, pszichoterápia szakorvosa, elnök
Fejlesztő munkacsoport tagjai:
Dr. Ágoston Gabriella, pszichiáter, társszerző
Dr. Ambrus Ildikó, háziorvostan, foglalkozás-orvostan szakorvosa, társszerző
Dr. Bajzik Éva, fizikális medicina és rehabilitációs orvoslás, társszerző
Benkovics Edit, gyógytornász, társszerző
Dr. Bíró Gizella, gasztroenterológus, belgyógyász, társszerző
Dr. Czimmer József, gasztroenterológus, belgyógyász, társszerző
Dakó Sarolta, dietetikus, okleveles táplálkozástudományi szakember, társszerző
Dr. Inczefi Orsolya, gasztroenterológus, belgyógyász, társszerző
Dr. Izbéki Ferenc, gasztroenterológus, belgyógyász, klinikofarmakológus, társszerző
Lada Szilvia, dietetikus, okleveles táplálkozástudományi szakember, társszerző
Dr. Lőrinczy Katalin, gasztroenterológus szakorvos, társszerző
Dr. Patai Árpád ifj., gasztroenterológus, belgyógyász, társszerző
Dr. Róka Richárd, gasztroenterológus, belgyógyász, társszerző
Dr. Rosztóczy András, gasztroenterológus, belgyógyász, társszerző
Dr. Séber-Juhász Lilla, belgyógyász szakorvos, társszerző
Véleményező Egészségügyi Szakmai Kollégiumi Tagozat(ok):
1. Belgyógyászat, endokrinológia, diabétesz és anyagcserebetegségek Tagozat
Dr. Bedros J. Róbert, reumatológia és fiziotherápia, belgyógyászat, hipertonológia, lipidológia, obezitológia szakorvosa, elnök, véleményező
"Az egészségügyi szakmai irányelv készítése során a szerzői függetlenség nem sérült."
"Az egészségügyi szakmai irányelvben foglaltakkal a fent felsorolt tagozatok dokumentáltan egyetértenek."
Az irányelvfejlesztés egyéb szereplői
Betegszervezet(ek) tanácskozási joggal:
Nem került bevonásra.
Egyéb szervezet(ek) tanácskozási joggal:
Nem került bevonásra.
Szakmai társaság(ok) tanácskozási joggal:
Nem került bevonásra.
Független szakértő(k):
Nem került bevonásra.
II. ELŐSZÓ
A bizonyítékokon alapuló egészségügyi szakmai irányelvek az egészségügyi szakemberek és egyéb felhasználók döntéseit segítik meghatározott egészségügyi környezetben. A szisztematikus módszertannal kifejlesztett és alkalmazott egészségügyi szakmai irányelvek, tudományos vizsgálatok által igazoltan, javítják az ellátás minőségét. Az egészségügyi szakmai irányelvben megfogalmazott ajánlások sorozata az elérhető legmagasabb szintű tudományos eredmények, a klinikai tapasztalatok, az ellátottak szempontjai, valamint a magyar egészségügyi ellátórendszer sajátosságainak együttes figyelembevételével kerülnek kialakításra. Az irányelv szektorsemleges módon fogalmazza meg az ajánlásokat. Bár az egészségügyi szakmai irányelvek ajánlásai a legjobb gyakorlatot képviselik, amelyek az egészségügyi szakmai irányelv megjelenésekor a legfrissebb bizonyítékokon alapulnak, nem pótolhatják minden esetben az egészségügyi szakember döntését, ezért attól indokolt esetben dokumentáltan el lehet térni.
III. HATÓKÖR
Egészségügyi kérdéskör: Az irritábilis bél szindróma diagnosztikája és kezelése
Ellátási folyamat szakasza(i): diagnosztika, terápia, követés
Érintett ellátottak köre: Hasi fájdalommal és hasmenéssel vagy székrekedéssel küzdő felnőttek.
A tervezett irányelv 18 évesnél fiatalabb személyekre nem vonatkozik.
Érintett ellátók köre
Szakterület: 0104 gasztroenterológia
1800 pszichiátria
1805 pszichoterápia
6301 háziorvosi ellátás
7600 dietetika
8021 manuálterápia (gyógytornász/gyógytornász-fizioterapeuta által is végezhető)
5700 fizioterápia-gyógytorna
Ellátási forma: F1 fekvőbeteg-szakellátás, aktív fekvőbeteg-ellátás
J1 járóbeteg-szakellátás, járóbeteg-szakellátás
Progresszivitási szint: I-III. szint
Egyéb specifikáció: Nincs
IV. MEGHATÁROZÁSOK
1. Fogalmak
Alarm tünetek
Az irritábilis bél szindróma diagnosztikai kritériumainak megfelelő betegek körében felmérendő olyan klinikai tünetek, eltérések melyek organikus eredetű betegségek fennállására utalnak.
Bristol széklet skála
A Bristol skálát 1997-ben a széklet formájának egységes klinikai megítélése, klasszifikációja céljából alkották meg. A skála a széklet konzisztenciája alapján hét típust különít el, ezzel megkönnyíti az orvos és beteg számára a székelési panaszokkal kapcsolatos kommunikációt és a beteg panaszainak monitorozását.
Irritábilis bél szindróma
Az irritábilis bél szindróma krónikus, relapszusokkal járó tápcsatornai tünetek kombinációja, mely hasi fájdalommal és a széklet gyakoriságának és/vagy formájának változásával jár. A széklethabitus alapján megkülönböztethetünk hasmenés vagy székrekedés predomináns, kevert és nem klasszifikálható székelési habitussal járó alcsoportokat.
Róma IV. kritériumrendszer
A Róma klasszifikáció a funkcionális tápcsatornai kórképek egységes diagnosztikai megközelítését segítő, a témában jártas nemzetközi szakemberek klinikai konszenzusára és evidenciákra alapuló tünetorientált kritériumrendszer. A rendszer megalkotása óta több alkalommal került revízió alá, jelenleg 2016 óta a negyedik verzió van érvényben.
2. Rövidítések
1RM: 1 Repetition Maximum/egy ismétléses maximum
5-HT: Szerotonin
CBT: Cognitive behavioral therapy/kognitív viselkedésterápia
CRP: C-reaktív protein
DAO: Deamino-oxidáz enzim
DGBI: Disorders of Gut-Brain Interaction/Bél-Agy tengely működési zavarai
EMA: Endomysium antibody/anti-endomízium elleni antitest
FODMAP: Fermentable oligo-, di-, mono-saccharides and polyols/fermentábilis Oligoszacharidok, diszacharidok, monoszacharidok és polyolok
FDA: Az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hivatala
GDH: Gut-Directed Hypnotherapy/Bélvezérelt hipnózis
GI diszkomfort: Gastrointestinál diszkomfort /gyomor-bélrendszer diszkomfort
HPA: Hypothalamo-hypohysealis tengely
HRR: Heart Rate Reserve / tartalék pulzus
IBS: Irritábilis bél szindróma
IBS-C: Irritábilis bél szindróma székrekedéses altípusa
IBS-D: Irritábilis bél szindróma hasmenéses altípusa
IBS-M: Irritábilis bél szindróma kevert altípusa
IBS-U: Irritábilis bél szindróma nem meghatározott altípusa
Ig: Immunglobulin
KIR: Központi idegrendszer
MBSR: Mindfulness based stress reduction/mindfullness-alapú stresszredukció
NCGS: Non-celiac gluten sensitivity/nem coeliakiás gluténszenzitivitás
NSAID: Nonsteroidal anti-inflammatory drugs/nem szteroid gyulladásgátló gyógyszer
PPI: Proton-pump inhibitor/protonpumpagátló
RCT: Randomized controlled trial/randomizált kontrollált tanulmány
SeHCAT: 23-seleno-25-homo-tauro-cholic acid/23-szeleno-25-homotaurocholsav
SNRI: Serotonin-norepinephrine reuptake inhibitors/szelektív szerotonin és noradrenalin visszavétel gátlók
SSRI: Selective serotonin reuptake inhibitors/ szelektív szerotonin visszavétel gátlók
TCA: Selective serotonin reuptake inhibitors/ triciklikus antidepresszánsok
TIA: Átmeneti agyi keringészavar
TRPV1: Tranziens receptor potenciál vanilloid 1
TSH: Thyreoidea stimuláló hormon
TTG: Tissue transglutaminase/szöveti transzglutamináz
3. Bizonyítékok szintje
A bizonyítékok szintjének besorolása a GRADE beosztás alapján történt, mely a bizonyítékokat azok minősége alapján rangsorolja [1]:
| Szint - Bizonyítékok | |
| A | - jó minőségű evidencia: További klinikai vizsgálatoktól nem várható, hogy megváltoztassák az állásfoglalást. |
| B | - közepes minőségű evidencia: További klinikai vizsgálatok befolyásolhatják az állásfoglalást. |
| C | - gyenge minőségű evidencia: További klinikai vizsgálatok jelentősen befolyásolhatják az állásfoglalást. |
| D | - nagyon gyenge minőségű evidencia: Nagyon bizonytalan az állásfoglalás. |
4. Ajánlások rangsorolása
Az ajánlások rangsorolása a GRADE beosztás alapján történt [1]:
| I. szint: erős ajánlás - hatékony, minden esetben választandó |
| IIa. szint: közepes ajánlás - valószínűleg hatékony, célszerű választani |
| IIb. szint: gyenge ajánlás - a hatékonyság nem kellően bizonyított, választható |
V. BEVEZETÉS
1. A témakör hazai helyzete, a témaválasztás indokolása:
Az irritábilis bél szindróma (IBS) gyakori tápcsatornai kórkép, prevalenciája a betegség alkalmazott definíciójától függő. Kevésbé szigorú kritériumok alapján az átlag populáció több mint 10%-a szenved ebben a betegségben világszerte, míg a korábbiaknál kevésbé megengedő Róma IV. kritériumrendszer alapján a betegség prevalenciája 3-5% közé tehető [2, 3]. Nemzetközi adatok alapján ez a krónikus megbetegedés jelentős terhet ró az egészségügyi ellátásra úgy a gasztroenterológiai szakrendelések felkeresése, mint az aktív munkából való kiesés miatt [4] . Az irritábilis bél szindróma a nagyon jelentős direkt orvosi és indirekt egyéb költségek generálásával nemcsak az egészségügyi szolgáltatókat terheli jelentősen, hanem tágabb értelemben az általános költségvetést is. Magyarországon az IBS kezelésének nincs elfogadott egészségügyi szakmai irányelve. A jelenlegi magyarországi gyakorlat szerint a betegek sokszor a nem megfelelő diagnosztikai és terápiás lépések, így a terápia sikertelensége miatt számos felesleges diagnosztikai modalitást vesznek igénybe, sokszor több orvost felkeresve, akár több centrumot is igénybe véve. Mindemellett jelenleg a betegség kezeléséhez szükséges interdiszciplináris megközelítés nagymértékben hiányzik a hazai gyakorlatból. A betegség kezelésének összefogott ajánlása segítené a nagyszámú, jelenleg heterogén módon kezelt beteg egységesebb szempontok szerinti ellátását, ezzel önmagában csökkentve a feleslegesen igénybe vett diagnosztikai hátteret és felesleges terápiás próbálkozásokat.
2. Felhasználói célcsoport
Jelen egészségügyi szakmai irányelv célja, hogy az IBS-el diagnosztizált betegek ellátása egy egységes egészségügyi szakmai iránymutatás szerint történjen. Az egészségügyi szakmai irányelv alapján, különös tekintettel a megfelelő háziorvosi és gasztroenterológus szakorvosi diagnosztikus és terápiás szintek figyelembevételére, a betegek korai diagnózisa és kezelése jelentősen tehermentesítheti az ellátó rendszert a felesleges szakorvosi vizitek száma, a felesleges vizsgálatok elvégzése és a munkából távol töltött idő vonatkozásában. Mindemellett az IBS tüneti kritériumainak megfelelő betegek közül az alarm tünetekkel rendelkező egyének kiszűrése a súlyos, organikus betegségek korai diagnózisát és kezelését is szolgálja.
3. Kapcsolat a hivatalos hazai és külföldi szakmai irányelvekkel
Egészségügyi szakmai irányelv előzménye:
Hazai egészségügyi szakmai irányelv ebben a témakörben még nem jelent meg.
Kapcsolat külföldi szakmai irányelv(ek)kel:
Jelen irányelv az alábbi külföldi irányelv(ek) ajánlásainak adaptációjával készült.
| Szerző(k): | Brian E. Lacy, PhD, MD, FACG, Mark Pimentel, MD, FACG, Darren M. Brenner, MD, FACG, William D. Chey, MD, FACG, Laurie A. Keefer, PhD, Millie D. Long, MDMPH, FACG (GRADE Methodologist) and Baha Moshiree, MD, MSc, FACG; |
| Tudományos szervezet: Cím: Megjelenés adatai: Elérhetőség | American College of Gastroenterology ACG Clinical Guideline: Management of Irritable Bowel Syndrome Am J Gastroenterol 2021;116:17-44. https://doi.org/10.14309/ ajg.0000000000001036; published online December 14, 2020 |
| Szerző(k): | Dipesh H Vasant, Peter A Paine, Christopher J Black, Lesley A Houghton, Hazel A Everitt, Maura Corsetti, Anurag Agrawal, Imran Aziz, Adam D Farmer, Maria P Eugenicos, Rona Moss-Morris, Yan Yiannakou, Alexander C Ford; |
| Tudományos szervezet: Cím: | British Society of Gastroenterology British Society of Gastroenterology guidelines on the management of irritable bowel syndrome |
| Megjelenés adatai: Elérhetőség | Gut 2021;70:1214-1240. https://gut.bmi.com/content/70/7/1214.long doi:10.1136/gutjnl-2021-324598 |
| Szerző(k): | P. Layer, V. Andresen, H. Allescher, S. C. Bischoff, M. Claßen, S. Elsenbruch, M. Freitag, T. Frieling, M. Gebhard, M. Goebel-Stengel, W.Häuser, G. Holtmann, J. Keller, M. E. Kreis, W. Kruis, J. Langhorst, P. Lynen Jansen; A. Madisch, H. Mönnikes, S. Müller-Lissner, B. Niesler, C. Pehl, D. Pohl, M. Raithel, G. Röhrig-Herzog, M. Schemann, S. Schmiedel, J. Schwille-Kiuntke, M. Storr, J. C. Preiß; |
| Tudományos szervezet: Cím: | Deutsche Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) Deutsche Gesellschaft für Neurogastroenterologie und Motilität (DGNM) Update S3-Leitlinie Reizdarmsyndrom: Definition, Pathophysiologie, Diagnostik und Therapie. Gemeinsame Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM) |
| Megjelenés adatai: Elérhetőség | Z Gastroenterol. 2021 Dec;59(12):1323-1415. German. PMID: 34891206. https://register.awmf.org/assets/guidelines/021-016lS3 Definition- |
| Pathophysiologie-Diagnostik-Therapie-Reizdarmsyndroms 2022-02.pdf | |
| doi: 10.1055/a-1591-4794. | |
| Szerző(k): | S. Kindt, H. Louis, H. De Schepper, J. Arts, P. Caenepeel, D. De Looze, A. Gerkens, T. Holvoet, P. Latour, T. Mahler, F. Mokaddem, S. Nullens, H. Piessevaux, P. Poortmans, G. Rasschaert, M. Surmont, H. Vafa, K. Van Malderen, T. Vanuytsel, .Wuestenberghs, J. Tack; |
| Tudományos szervezet: Cím: Megjelenés adatai: Elérhetőség | Belgian Society of Gastroenterology Belgian consensus on irritable bowel syndrome Acta Gastroenterol Belg. 2022 Apr-Jun;85(2):360-382. https://www.ageb.be/ageb-journal/ageb-volume/ageb-article/2013/ |
| DOI 10.51821/85.2.10100 |
Kapcsolat hazai egészségügyi szakmai irányelv(ek)kel:
Jelen irányelv nem áll kapcsolatban más hazai egészségügyi szakmai irányelvvel.
VI. AJÁNLÁSOK SZAKMAI RÉSZLETEZÉSE
AZ IRRITÁBILIS BÉL SZINDRÓMA DEFINÍCIÓJA ÉS KLASSZIFIKÁCIÓJA
Az IBS az agy-bél interakció zavarai közül az egyik leggyakoribb klinikai kórkép. Korábban ezt a betegség csoportot funkcionális tápcsatornai kórképeknek nevezték. E kórképek klasszikus definíció szerint olyan krónikus vagy visszatérő tápcsatornai tünetek kombinációi, melyek strukturális vagy biokémiai eltérésekkel nem magyarázhatók. Az IBS krónikus, relapszusokkal járó kórkép, mely hasi fájdalommal és a széklet gyakoriságának és/vagy formájának változásával jár. A széklethabitus alapján megkülönböztethetünk hasmenés vagy székrekedés predomináns, kevert székelési habitussal járó és nem klasszifikálható alcsoportokat. A funkcionális tápcsatornai kórképek klasszikus definíciója annyiban mindenképp túlhaladott, hogy a kórképek komplex patomechanizmusáról ma már széles körű tudással rendelkezünk. Az IBS tüneteinek kialakulásában az agy-bél tengely központi jelentőségű. Az IBS tüneteinek kiváltásában szerepet játszhatnak korai traumatikus életesemények, számos pszichológiai faktor és pszichiátriai komorbiditás, a fájdalomérzékelés zavara, hormonális eltérések, a gasztrointesztinális mikrobiom zavara, tápcsatornai motilitászavarok, a tápcsatornában zajló alacsony grádusú gyulladásos folyamat és kóros permeábilitás is. [5]. A funkcionális tápcsatornai kórképek egységes megközelítésének céljából a témában jártas nemzetközi szakemberek klinikai konszenzusra és evidenciákra alapuló tünetorientált kritériumrendszert hoztak létre. A Róma kritériumok megalkotása óta a rendszer több alkalommal került revízió alá, jelenleg 2016 óta a negyedik verzió van érvényben. Ez a rendszer az agy-bél interakció zavarainak 8 csoportját különíti el, ez 6 felnőttkori és 2 gyermekkori kategóriát jelent. A felnőttkori kórképek a tápcsatorna különböző részei alapján sorolódnak csoportokba, ezeket érintően a Róma rendszer további alcsoportokat különít el. Az IBS a funkcionális bélbetegségek csoportjába tartozik. Az IBS Róma IV. definíciójának alapja egyrészt a klinikai tünetek értékelése (hasi fájdalom mely összefügg a székletürítéssel és/vagy a széklet gyakoriságának ill. formájának változásával jár), másrészt a betegség krónikus jellege (legalább 6 hónapja fennálló panaszok). A szisztéma az IBS-ben szenvedő betegeket a széklethabitus alapján további négy alcsoportra osztja (székrekedés és hasmenés predomináns csoportok, kevert székletritmus és nem meghatározható széklethabitusú alcsoport) [2] (1. ábra).
Róma IV. kritériumok - IBS
1. Visszatérő hasi fájdalom, mely legalább heti 1x jelentkezett az elmúlt 3 hónapban és a következők közül legalább kettővel társul:
a) Székletürítéshez kapcsolódik
b) A székletürítés gyakoriságának változásával jár
c) A széklet állagának változásával jár
ÉS
2. A panaszok legalább 6 hónapja kezdődtek és az elmúlt 3 hónapban a következők szerint alakulnak:
1. ábra: Róma IV. kritériumok az IBS diagnózisának felállítására [2]
| IBS-C | IBS-D | IBS-M | IBS-U |
| A székletek ≥ 25%-a a Bristol skálán 1. vagy 2. típusú és a székletek <25%-a a Bristol skálán 6. vagy 7. | A székletek ≥ 25%-a a Bristol skálán 6. vagy 7. típusú és a székletek <25%-a a Bristol skálán 1. vagy 2. típus. | A székletek ≥ 25%-a a Bristol skálán 1. vagy 2. típusú és a székletek ≥25%-a a Bristol skálán 6. vagy 7. típus. | Azok a betegek, akik az IBS kritériumainak megfelelnek, de nem sorolhatóak egyik egyéb alkategóriába sem. |
A széklet formájának egységes megítélésében úgy az orvost, mint a pácienst is a Bristol székletskála segítheti, mely a széklet formája alapján 7 típust különít el [6]. (2. ábra)
2. ábra: A széklet formájának osztályozása a Bristol skála alapján [6]

Ajánlás1
Az IBS diagnózisának felállításához javasolt a Róma IV. kritériumok használata. (IIb -C, konszenzus mértéke: 100 %) A Róma IV. konszenzus meghatározása szerint az irritábilis bélbetegség (IBS) visszatérő hasi fájdalmat jelent, ami átlagosan legalább hetente egy nap jelentkezik, legalább 3 hónapja fennáll és a diagnózis felállítása előtt 6 hónappal kezdődött. A hasi fájdalomhoz társul a további 3 diagnosztikus kritériumból legalább kettő: (1) a széklet alakjának vagy (2) a széklet ürítés gyakoriságának megváltozása társul és (3) a székletürítés a fájdalmat megváltoztatja (többnyire csökkenti vagy megszünteti, de ritkán fokozhatja is).
A Róma IV. kritériumok több szempontból is eltérnek a korábbi, de a Róma III. kritériumoktól is. Egyrészt a nehezen definiálható "diszkomfort" helyett egyértelműbb fájdalom lett a vezető diagnosztikus kritérium, mivel e fogalmak értelmezésében nagy eltérések mutatkoztak, illetve nem volt világos, hogy a fájdalom és a kellemetlenség közötti különbségtétel minőségi vagy mennyiségi. [7]. A második fontos változás az, hogy a hasi fájdalom gyakorisága átlagosan havi 3 napról heti egy napra nőtt. Bár ez a változtatás csekélynek tűnik, egy nagy populációs vizsgálaton alapult, amelynek célja a kritériumok érzékenységének és specificitásának növelése volt [8]. Harmadik jelentős változás annak kiemelése, hogy a puffadás és a felfúvódás (hasi disztenzió), noha gyakori tünet, nem tartozik az IBS diagnosztikus kritériumainak sorába és ezáltal rávilágít arra, hogy e tünetek más a Bél-Agy tengely működési zavaraiban (Disorders of Gut-Brain; DGBI) szenvedő betegeknél (pl. krónikus székrekedés, funkcionális diszpepszia) is előfordulnak.
Ajánlás2
A székletgyakoriság és konzisztencia alapján javasolt az IBS betegek alcsoportba sorolása (IIb-B, konszenzus mértéke: 100%)
Az IBS altípusainak a diagnosztikájában a Bristol székletforma-skála (BSFS) a leggyakrabban használt eszköz a széklet konzisztenciájának rögzítésére [9]. Bár a visszatérő hasi fájdalom a legfontosabb IBS-tünet, a BSFS alapján az uralkodó székletmintázat azonosítása a rendellenes székletet mutató napokon döntő fontosságú a megfelelő diagnosztikai vizsgálat kiválasztásához és a kezelés irányításához. A római osztályozás szerint az IBS-t négy különböző altípusba sorolják: IBS túlsúlyos (predomináns) hasmenéssel (IBS-D), IBS túlsúlyos (predomináns) székrekedéssel (IBS-C), IBS vegyes bélműködéssel (IBS-M), és IBS osztályozhatatlan (IBS-U) [2]. A széklet konzisztenciájának predomináns volta - legalább megközelítő mértékben - százalékosan is rögzíthető. IBS-C esetén a széklet az esetek több, mint egy negyedében (25%) BSFS 1-2 és kevesebb, mint egy negyedében BSFS 6-7; IBS-D esetén a széklet több mint egy negyede (25%) BSFS 6-7 és kevesebb, mint egy negyede BSFS 1-2. A kevert forma esetében (IBS-M) a széklet több mint egy negyede hasmenéses (BSFS 1-2) ugyanakkor több mint egy negyedében székrekedéses (BSFS 6-7). Ha a hasi fájdalom IBS-nek megfelel, de a széklet habitus és konzisztencia alapján a beteg nem sorolható az előbbiek egyikébe sem, akkor a nem klasszifikálható (IBS-U) csoportba kerül. Valójában a jelenlegi farmakológiai kezelések a domináns tüneteken alapulnak, általában a hasmenést vagy a székrekedést célozzák. Csak nagyon kevés RCT-ben vizsgálták a kezelés hatását IBS-M vagy IBS-U betegek esetében. Ezenkívül az IBS gyakran átfedésben van más gasztrointesztinális betegségek tüneteivel (pl. diszpepszia) és nem gasztrointesztinális eredetű panaszokkal (pl. pszichés tünetek, migrén, fejfájás, fibromyalgia, intersticialis cystitis, dyspareunia) [10]. Mindezeket a szempontokat együttesen figyelembe kell venni a diagnosztikai folyamatban, mivel döntő szerepet játszanak a beteg fenotípusának meghatározásában, és fontosak a betegség megfelelő kezelése szempontjából.
AZ IRRITÁBILIS BÉL SZINDRÓMA DIAGNOSZTIKÁJA
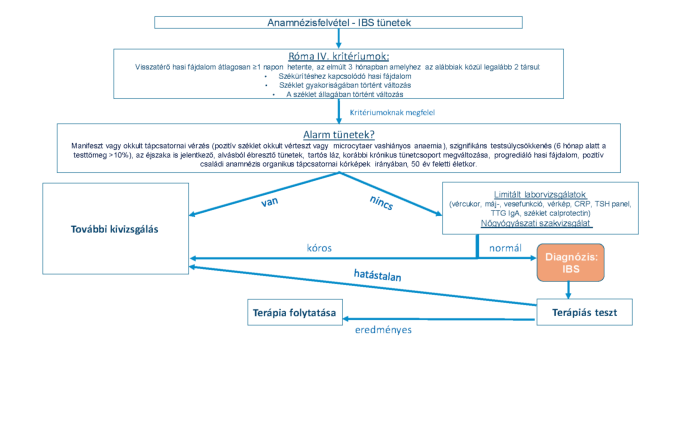
Tekintve az IBS magas prevalenciájára a napjainkban elfogadott és követendő eljárás a tünetorientált pozitív diagnosztikai megközelítés. A diagnózis első lépcsője a megfelelő anamnézis felvétel és fizikális vizsgálat. Az anamnézis felvételekor külön hangsúly fektetendő az ún. alarm tünetek felmérésére. Ezek olyan klinikai tünetek, eltérések, melyek organikus eredetű betegségek fennállására utalnak. Alarm tünetnek számít a manifeszt vagy okkult tápcsatornai vérzés, anaemia a szignifikáns testsúlycsökkenés, az éjszakai tünetek, a tartós láz, a korábbi krónikus tünetcsoport megváltozása, a kóros fizikális vagy képalkotó lelet, a pozitív családi anamnézis organikus tápcsatornai kórképek irányában és az 50 év feletti életkor. Amennyiben a beteg tünetei megfelelnek az IBS kritériumainak és alarm eltérések nem állnak fenn, néhány, limitált alapvizsgálat értékelését követően a betegség diagnózisa kimondható. Alarm tünet vagy tünetek fennállása, illetve a limitált diagnosztikus lépések kóros eredménye esetén a beteg további kivizsgálása a háttérben álló esetleges organikus betegség tisztázása céljából feltétlenül indokolt. (3. ábra)
3. ábra: Az IBS terápiás lépcsői [11]
| Enyhe | Középsúlyos | Súlyos |
| - Felvilágosítás - Megnyugtatás - Diéta - Életmód | - Provokáció faktorok felderítése, eliminálása - Pszichoterápiás, viselkedésterápiás technikák - Predomináns tünet gyógyszeres kezelése | - Multidiszciplináris megközelítés - Pszicho-farmakológiai kezelés - Fájdalomambulancia |
Ajánlás3
Az IBS diagnózisának felállítása pozitív diagnosztikai megközelítés alapján kell, hogy történjen. (I-B, konszenzus mértéke: 100%)
Jelen tudásunk szerint nem létezik az IBS-re specifikus diagnosztikai teszt. A diagnózis felállítására napjainkban elfogadott és követendő eljárás a Róma IV. kritériumokon alapuló tünetorientált pozitív diagnosztikai megközelítés. A pozitív diagnosztikai hozzáállás azt jelenti, hogy amennyiben az anamnézis felvétel alapján beteg tünetei megfelelnek az IBS kritériumainak és az anamnézis, részletes fizikális vizsgálat és néhány limitált, alapvető diagnosztikai lépés alapján alarm eltérések nem állnak fenn, a betegség diagnózisa felállítható [12]. Ezzel a megközelítéssel nem csak megkíméljük a beteget és a finanszírozót a negatív, kizárásos diagnosztika szükségtelen és sokszor költséges lépéseitől [13], hanem a beteg kezelése is korábban elkezdhető.
Ajánlás4
Alarm tünet a manifeszt vagy okkult tápcsatornai vérzés (pozitív széklet okkult vérteszt vagy microcytaer vashiányos anaemia), a szignifikáns testsúlycsökkenés (6 hónap alatt a testtömeg >10%-a), az éjszaka is jelentkező, alvásból ébresztő tünetek, a tartós láz, a korábbi krónikus tünetcsoport megváltozása, a progrediáló hasi fájdalom, a pozitív családi anamnézis organikus tápcsatornai kórképek irányában és az 50 év feletti életkor. Alarm tünet vagy tünetek fennállása esetén a tüneteknek megfelelő differenciál diagnosztikai lépések elvégzése szükséges. (I-B, konszenzus mértéke: 100%)
Alarm tünetek olyan klinikai jelek, eltérések, amelyek organikus eredetű betegségek fennállására utalnak. Az életkor önmagában alarm eltérésnek tekinthető, hiszen az életkor előrehaladtával megnövekszik a daganatos betegségek előfordulásának lehetősége. Az alarm tünetek nagy specificitással jelzik a gyulladásos vagy rosszindulatú kórképek jelenlétét [14], viszont az alarm tünetek IBS esetén csak alacsony prediktív értékkel bírnak [15-17]. Alarm tünetek hiányában a Róma IV. kritériumok érzékenysége több mint 85%-os az IBS diagnózisának felállításában [18].
Ajánlás5
A részletes anamnézis felvétel és általános fizikális vizsgálat mellett első alkalommal javasolt laboratóriumi vizsgálat elvégzése, mely tartalmazza a vércukor, a vesefunkció és a májfunkció vizsgálatát, vérkép, CRP és TSH szérum szint mérést. (I-B, konszenzus mértéke: 89%)
A limitált laboratóriumi vizsgálatok elvégzésének célja az organikus betegségek lehetőség szerinti kiszűrése [19]. Az anaemia önmagában alarm tünetként értékelendő, organikus betegségre utal. A CRP meghatározás segítséget nyújt a funkcionális és gyulladásos bélbetegségek elkülönítésében [20, 21]. Jól ismert a pajzsmirigyhormonok tápcsatornai motilitásra gyakorolt hatása. Típusos esetben a pajzsmirigy-alulműködés székrekedést, a túlműködés hasmenést okozhat [22], ezért IBS tüneteinek fennállása esetén javasolt a pajzsmirigybetegségek szűrése TSH mérésével. Megjegyzendő azonban, hogy a nemzetközi ajánlások sem egységesek a javasolt limitált laboratóriumi alapvizsgálatokkal kapcsolatosan. Az IBS diagnosztikai kritériumainak megfeleltethető és alarm tünetekkel nem rendelkező betegek esetén a szűrő jellegű laboratóriumi vizsgálatok diagnosztikus hozama igen alacsony [23] .
Ajánlás6
A glutén szenzitív enteropathia kizárásához szerológiai vizsgálat (TTG IgA) elvégzése szükséges. (I-B, konszenzus mértéke: 100%)
A glutén szenzitív enteropathia (coeliakia) tünetei az esetek egy részében nagyon hasonlóak az IBS-hez. A biopsziával igazolt coeliakia gyakorisága négyszer nagyobb az IBS tüneteit mutató betegekben az IBS kritériumainak nem megfeleltethető kontrollokhoz képest [24]. Habár a kórkép az IBS-D, illetve az IBS-M csoportba tartozó betegekben fordult elő nagyobb arányban a többi IBS alcsoporthoz képest [25], a nemzetközi ajánlások szerint mindegyik altípusban javasolt a megfelelő diagnosztikus értékkel bíró immunszerológiai vizsgálat (tTG IgA, IgG, EMA) elvégzése. A nem coeliakiás glutén/búza szenzitivitás (NCGS) az elmúlt pár évben került a figyelem középpontjába. A coeliakiához hasonlóan az NCGS is járhat IBS-nek megfeleltethető tápcsatornai tünetekkel. A betegség kialakulásában felmerült a nem specifikus immunválasz szerepe a búza alkotóelemei ellen, amely órákkal, napokkal az étel elfogyasztása után okoz panaszt. A coeliakiával ellentétben itt a vékonybél azonban nem károsodik, nem nő az intesztinális permeábilitás [26]. NCGS irányában, a kórkép természetéből adódóan az első diagnosztikai lépések körében szűrő jellegű vizsgálat nem áll rendelkezésre.
Ajánlás7
Széklet kalprotektin (vagy laktoferrin) vizsgálat javasolt alarm eltérések nélkül jelentkező IBS-es tünetek és hasmenés esetén IBD kizárása céljából. (I-B, konszenzus mértéke: 100%)
Az IBS diagnosztikájának az egyik legnagyobb gyengesége a pontos biomarkerek hiánya. A széklet kalprotektin negatív prediktív értéke a funkcionális betegek és a gyulladásos bélbetegek elkülönítésében a szerológiai gyulladásos markereknél magasabb [27]. Az 50 ng/mg határérték használata mellett a széklet kalprotektin pozitív eredménnyel rendelkező betegek között hatszor magasabb az esély a gyulladásos bélbetegség jelenlétére, mint a határérték alatti eredmény mellett. A vizsgálat negatív prediktív értéke magas, ugyanakkor pozitív eredmény esetén az eltérés okának tisztázására további vizsgálatok szükségesek. [28]. Egy 13 vizsgálatot magában foglaló metaanalízis alapján az endoszkóposan igazolt felnőtt gyulladásos bélbetegek esetén a széklet kalprotektin vizsgálat poolozott szenzitivitása igen magas, 0.93, míg a specificitása 0.96 [29].
Ajánlás8
A széklet mikrobiológia vizsgálat nem javasolt rutinszerűen minden IBS betegnél. (IIb-C, konszenzus mértéke: 53%)
A bakteriális és virális eredetű tápcsatornai fertőzések az esetek zömében rövid lefolyásúak, míg a protozoonok által okozott infekciók (Giardia, Entamoeba) krónikus jellegűek is lehetnek, ezek a fertőzések önmagukban okozhatnak IBS-hez hasonló tüneteket. Mindemellett számos infektív gasztroenteritisz (Campylobacter, Salmonella, Norwalk, Cryptosporidium, Giardia) lezajlását követően hónapokig perzisztálóan IBS tüneteijelentkezhetnek. A posztinfekciózus IBS prevalenciája 11%, gyakrabban alakul ki nőkben, antibiotikumot szedőkben, vagy olyan betegekben, akiknek az anamnézisében szorongás vagy depresszió szerepel [30]. A fentiek ellenére és tekintettel arra, hogy az infekciók igazolása érdemben nem befolyásolja az IBS betegek diagnózisát és a betegség kimenetelét, a nemzetközi ajánlások a széklet tenyésztés elvégzésének szükségességének kérdésében nem egységesek, többségében a rutin vizsgálat ellen foglalnak állást még az IBS-D és IBS-M esetében is, mindemellett az Amerikai Gasztroenterológiai társaság az ez irányú rizikófaktorral rendelkező betegek esetén javasolja a tápcsatornai Giardia infekció kizárását.
Ajánlás9
IBS tüneteit mutató betegeknél a diagnózis felállításakor rutinszerűen nem javasolt hasi ultrahang vizsgálat végzése alarm tünetek hiányában (IIb-D, konszenzus mértéke: 90%)
Annak ellenére, hogy a hasi ultrahangvizsgálat noninvazív, költséghatékony és könnyen hozzáférhető diagnosztikus eljárás az organikus hasi kórképek kizárásában és empírikusan széles körben használt a funkcionális betegek kivizsgálásában is, nem rendelkezünk megfelelő kontrollált klinikai tanulmányokkal és ezeken alapuló szisztémás áttekintő munkákkal az ultrahang diagnosztikai értékével kapcsolatosan IBS-ben. A megfelelő klinikai bizonyíték hiányában a nemzetközi irányelvek nem fogalmaznak meg ajánlásokat a hasi ultrahangvizsgálat indikációjával kapcsolatosan IBS esetén [31, 32].
Ajánlás10
IBS tüneteit mutató nőbetegeknél nőgyógyászati szűrővizsgálat javasolt. (I-B, konszenzus mértéke: 95%)
Ovarium carcinomás betegek több mint 85%-ánál a diagnózis előtt tipikus IBS-es tünetek észlelhetők, a betegek többségénél több mint 6 hónappal a daganat diagnózisa előtt már megfigyelhetők [33, 34].
Ajánlás11
Rutin colonoscopia nem ajánlott 50 évnél fiatalabb IBS tüneteit mutató betegekben alarm tünetek hiányában. (I-B, konszenzus mértéke: 95%)
50 év feletti betegek esetén szűrő jelleggel javasolt a colonoscopia elvégzése, amely során leggyakrabban aranyereket, diverticulosist vagy polypokat találunk. Ugyanakkor IBS-es betegekben a polypok előfordulása 7,7%, míg a nem IBS-es betegekben 26,1% [35]. Egy japán vizsgálatban 4528 colonoscopián átesett betegből 203-an teljesítették az IBS kritériumait, akik között 5 vastagbéldaganatot találtak, de mind az 5 beteg 50 év feletti volt [36].
Ajánlás12
Colonoscopia során szövettani mintavétel javasolt a mikroszkópos colitis kizárására IBS-D-nek megfelelő tünettan esetén (IIa-A, konszenzus mértéke: 100%)
IBS-D-re jellemző panaszok esetén csak a klinikum alapján nem lehetséges a mikroszkópos colitis és az IBS elkülönítése, ez csak colonoscopia során szövettani minták segítségével lehetséges. A mikroszkópos colitises betegek mintegy harmadának tipikus IBS-es tünetei is vannak, ugyanakkor IBS-es betegek közel 10%-ának valójában mikroszkópos colitise. A betegség diagnózisára elegendő 2-2 mintát venni a colon ascendensből valamint a descendensből, sorozatbiopszia vétele nem indokolt [37-39]. Mikroszkópos colitisre hajlamosító rizikófaktorok: női nem, 50 évnél magasabb életkor, ismert autoimmun betegség, éjszakai vagy súlyos vizes hasmenés, testsúlycsökkenés, bizonyos gyógyszerek szedése (NSAID, PPI) [40, 41].
Ajánlás13
IBS tünetek fennállása esetén gastroscopia rutinszerű elvégzése nem javasolt (IIb-C, konszenzus mértéke: 100%)
IBS tüneteket mutató betegekben a coeliakia gyakorisága tünetmentes populációhoz viszonyítva magasabb, így e betegcsoportban coeliakia irányában történő szerológiai vizsgálat javasolt (lásd Ajánlás 6.). IBS tünetcsoport fennállása esetén elsősorban a coeliakia megerősítése vagy kizárása indokolná a felső tápcsatornai endoszkópia elvégzését. A nemzetközi ajánlások vagy egyáltalán nem foglalnak állást a gastroscopia szükségességének tekintetében ebben a betegcsoportban vagy fenntartják a gastroscopia indikációját azokra az esetekre, ahol klinikai gyanú van organikus betegség jelenlétére (pl. coeliakia, lymphoma). Amennyiben a gastroscopia megtörténik, akkor a duodenumból történő szövettani mintavétel elvégzése már javasolt.
Ajánlás14
Nem javasolt ételallergia rutinszerű tesztelése irritábilis bél szindrómával diagnosztizált betegeknél. Ha típusos, reprodukálható tünetei vannak ételallergia vagy ételintolerancia irányában, akkor étkezési napló és eliminációs étrend alkalmazása javasolt. (IIa-D, konszenzus mértéke: 95%)
Az átlagpopuláció közel 20%-a tapasztal kellemetlen tüneteket ételfogyasztást követően [42, 43]. Ezek a tünetek jellemzően nem specifikusak egyes betegségekre, a leggyakoribbak a hasi fájdalom, hasi puffadás (érzés), hányinger és a hasmenés. Ezen tünetek 2-3%-ban jelentkeznek megnevezhető ételek fogyasztásával kapcsolatosan reprodukálható módon, ismételt expozíció mellett is [42, 44]. Az IBS betegek gyakrabban (akár 50%-ban) tapasztalnak adverz reakciókat ételek fogyasztását követően, azonban ezek jellemzően nem allergiás természetűek [45-47]. Az ételallergiák a felnőtt lakosság kb. 1-3%-ában fordulnak elő. Az allergiás reakciók (pl. bőrkiütések, szájnyálkahártya duzzanat stb.) gyorsan jelentkeznek, jól reprodukálhatók, IgE-, nem-IgE- és kevert (IgE és nem-IgE) immunválaszok által meditáltak. Az allergiás reakciók szünetelnek az allergén szigorú kerülése esetén. A nem-IgEközvetített ételallergiák T-sejtes immunválasszal jönnek létre, jellemzően a gyermekkorban, típusos megjelenésük az ételfehérje kiváltotta enterocolitis szindróma és enterocolitis. A kevert (IgE és nem-IgE kiváltott) ételallergiákra példák a tejfehérje allergia, eosinophyl oesophagitis és az eosinophyl gastroenteritis. Az ételallergia diagnózisának javasolt menete az anamnesztikusan ételfogyasztáskor reprodukálható típusos tünetek jelenléte esetén (pl. szájpad vagy ajak viszketés, dysphagia, laryngospasmus, bronchospasmus, hányinger, hányás, hasi fájdalom, hasmenés, urticaria, hypotensio és anafilaxia) az allergia tesztek elvégzése. A hasi panaszokkal is járó, ételallergiára vagy étel intoleranciára típusos tünetek esetén interdiszciplináris megközelítés a célravezető (allergológia, bőrgyógyászat, dietetika bevonásával).
Ajánlás15
Nem javasolt pancreas exocrin funkció tesztelése irritábilis bél szindróma típusos tüneteinek fennállása esetén, kivéve steatorrhea tünet fennállása esetén. (I-C, konszenzus mértéke: 85%)
Néhány tanulmányban magas exocrin pancreas insufficiencia prevalenciát mutattak ki IBS gyanús populációban [48]. Más tanulmányok ezt nem támasztották alá [49]. Pancreatogen maldigestio tesztelése széklet elasztáz vizsgálattal zsír malabsorptio tünete esetén javasolt [50]. IBS-D fennállása esetén nem javasolt a széklet elasztáz tesztelése, csak steatorrhea együttes fennállása esetén.
Ajánlás16
Nem javasolt H2 kilégzéses teszt végzése vékonybél bakteriális túlnövekedés (SIBO) tesztelése irritábilis bél szindróma típusos tüneteinek fennállása esetén. (I-B, konszenzus mértéke: 79%)
Nincsen szerepe a hidrogén kilégzési tesztekkel történő laktóz intolerancia vagy vékonybél bakteriális túlnövekedés kizárásának az IBS diagnosztikájában. A terheléses tesztek fals pozitivitást is adhatnak IBS esetén a meggyorsult tranzit miatt [51]. Az IBS esetén alkalmazott rifaximin kezelés hatásosságát nem jelezte előre a pozitív H2 kilégzéses laktulóz teszt [52], amely emellett rosszul korrelált a vékonybél aspirátum tenyésztések eredményével is [53].
Ajánlás17
Nem javasolt H2 kilégzéses teszt végzése laktóz intolerancia vagy fruktóz intolerancia tesztelése irritábilis bél szindróma típusos tüneteinek fennállása esetén. (I-B, konszenzus mértéke: 78%)
Az ételek fogyasztásával kapcsolatos legtöbb kellemetlen reakció az ételintolerancia vagy étel-túlérzékenység. Ezek közül a laktóz intolerancia kialakulása enzimdefektussal (laktázhiány), a fruktóz intolerancia transzport mechanizmus defektusával (glut-2, glut-5 transzporter) áll összefüggésben. Nincsen szerepe a hidrogén kilégzési tesztekkel történő laktóz intolerancia vagy vékonybél bakteriális túlnövekedés kizárásának az IBS diagnosztikájában. A terheléses tesztek fals pozitivitást is adhatnak IBS esetén a meggyorsult tranzit miatt [51]. A tesztek alacsony specificitása egyebekben magas álpozitivitási rátával jár együtt, az alacsony betegség prevalencia pedig nem teszi a vizsgálatokat költséghatékonnyá az IBS differenciáldiagnosztika vonatkozásában.
Ajánlás18
Szérum IgG panel vizsgálatok elvégzése nem javasolt irritábilis bél szindróma típusos tüneteinek fennállása esetén. (IIb-D, konszenzus mértéke: 100%)
Az ételintolerancia-vizsgálat céljára a piacon értékesített szérum IgG meghatározási módszereket nem validálták ez idáig megfelelő módon (vak-kontrollált, jól szervezett vizsgálatokkal), így azok nem javasolhatók erre a vizsgálati célra. Az étel eliminációs diéta irányítására (azaz a feltételezetten panaszt okozó ételek diétához történő kiválasztására) sem javasolt emiatt ilyen vizsgálat alkalmazása [54].
Ajánlás19
Nem javasolt hisztamin intolerancia irányában tesztek végzése irritábilis bél szindróma típusos tüneteinek fennállása esetén. (IIb-D, konszenzus mértéke: 100%)
A szubjektív hisztamin intoleranciáról gyakran számolnak be az irritábilis bél szindrómás betegek [46]. A hisztamin- és más biogén aminok intoleranciája ritka, ellentmondásos irodalmi adatok állnak rendelkezésre [55]. Egyelőre nem áll rendelkezésre megfelelő laboratóriumi diagnosztika, és az enzimek, például a diamin-oxidáz (DAO) meghatározása nem alkalmas sem a hisztamin intolerancia kizárására, sem kimutatására [56]. Hisztamin intolerancia klinikai gyanúja esetén az allergológiai kivizsgálás mellett orális provokációs vizsgálat mérlegelhető pl. 75 mg hisztaminnal. Ilyen orális provokációs tesztet orvosi felügyelet és panaszpontszám dokumentálása mellett javasolt elvégezni. A hisztaminban gazdag ételek és a hisztamin-felszabadítónak tekintett élelmiszerek fogyasztásának elhagyása csak akkor javasolt, ha a hisztamin intolerancia bizonyított, amely igen ritkán lehetséges. Ha megbízható bizonyíték hiánya ellenére erős a klinikai gyanú, akkor ideiglenes (2-6 hét) eliminációs diétás kísérlet végezhető, 2 hét után csak javulás esetén folytatandó maximum 6 hétig, majd revideálandó [57]. Dietetikus bevonása a jelentős megszorításokat tartalmazó diéta alkalmazása miatt minden esetben ajánlott.
Ajánlás20
Az anorectalis motilitási vizsgálatok elvégzése javasolt azon IBS tünetekkel rendelkező betegek esetén, akiknél medencefenék-eredetre utaló tünetek (széklet inkontinencia, székürítési nehezítettség) és/vagy székrekedés áll fenn, ha nem reagálnak a konvencionális orvosi kezelésekre. Az elsődleges vizsgálati cél, az anorectalis biofeedback kezelésből profitáló betegek kiválasztása. (IIa-C, konszenzus mértéke: 100%)
Az irritábilis bél szindróma egy multifaktoriális megbetegedés, amely egyes tünetei (székletürítési nehezítettség és feszítő érzés) alapján nem mindig különíthető el pontosan a dyssinergiás székürítéstől (dyssynergic defecation) [58-61] A dyssinergiás székürítés pontos diagnózisához a székürítés fiziológiás tesztelése elengedhetetlen. 3 vizsgálati modalitásból legalább 2 eredménynek támogatnia kell a diagnózist: pl. az anorectalis manometria, a ballon expulziós teszt és/vagy a defecographia (evacuatios proctographia) vizsgálatok közül [61]. Az anorectalis biofeedback kezelésre alkalmas betegek kiválasztására alkalmas az anorectalis manometria [62]. Prospektív tanulmányok nem igazoltak műtéti beavatkozások utáni tüneti javulást IBS-C betegek körében, így a műtét relatív ellenjavallatot is képez az esetükben [63]. Megjegyzendő, hogy Magyarországon a tápcsatornai motilitási vizsgálatokat és az ezekhez kapcsolódó terápiás intervenciókat végző központok száma alacsony, a lakosság számához mért diagnosztikai és terápiás igényeket nem fedi le. Megfelelő vizsgálatok és tesztek segíthetnek kiválasztani azokat az alanyokat, akik valószínűleg részesülhetnek a testre szabott medencefenék-rehabilitációból, amely multimodális megközelítéssel végezhető, beleértve a biofeedbacket, mozgásterápiát, az elektromos funkcionális stimulációt, és a végbél érzékenységében megváltozott betegeknél a volumetrikus rehabilitációt is. [64]
Ajánlás21
A bél mikrobiom vizsgálata nem javasolt az IBS diagnózisában (IIa-C, konszenzus mértéke: 100%)
A bél mikrobióta szerepét egyre inkább hangsúlyozzák az IBS patogenezisében és számos vizsgálat tűzte ki célul az IBS-re jellemző mintázat(ok) felderítését. Jelenleg azonban még nem bizonyított, hogy volna az IBS-re vagy legalább az alcsoportjaira jellemző általános mikrobiom mintázat, és ebből következően nem is áll rendelkezésre széles körben elfogadott és bizonyítottan hatékony eljárás ennek azonosítására. [65] A mikrobiom analízis végzése így jelenleg nem javasolt sem általában IBS-ben sem alcsoport specifikusan. Ugyanígy a piacon elérhető a "jó" és a "rossz" baktériumok jelenlétét vizsgáló tesztek használata sem javasolt érdemi bizonyíték hiányában. [66, 67] Az alcsoportok tekintetében várható, hogy a multi-omicus analíziseknek köszönhetően sikerülhet a szubtípusra jellemző mintázatok jelenlétének azonosítása [68].
Ajánlás22
Klinikai döntésnél figyelembe kell venni, hogy az IBS diagnózisában nem áll rendelkezésre betegség specifikus biomarker. (IIa-C, konszenzus mértéke: 100%)
A mikrobiota vizsgálata mellett számos kutatás tűzte ki célul betegség specifikus markerek azonosítását, mely segítségével megerősíthető, bizonyítható az IBS jelenléte. Bár ezek közt vannak bíztató pozitív eredményű vizsgálatok, ám jelenleg még hiányoznak a validált széles körben elfogadott eredmények. Emiatt jelenleg még a mindennapi gyakorlatban nem javasolható egyik ilyen marker vizsgálata sem [60, 67, 69-75].
Ajánlás23
Az IBS tüneteiben szenvedő betegeknél már az alap anamnézisben javasolt felmérni és dokumentálni a pszichológiai befolyásoló tényezőket, kísérő betegségeket, mint például a szorongás és a depresszió. (I-A, konszenzus mértéke: 100%)
Az IBS biopszichoszociális betegségmodellje alapján már az első orvos-beteg találkozás során ki kell térni a pszichoszociális anamnézis alapvető kérdéseire úgy, mint pl. a munkahelyi, magánéleti stressztényezőkre, szorongásra, hangulati zavarokra. Ebben segítségünkre lehetnek különböző kérdőívek, de egyszerű kérdések feltevésével is fel lehet mérni a depressziót, szorongásos zavart vagy más mentális rendellenességet. Indokolt esetben a beteget pszichoszomatikus/pszichoterápiás szakemberhez kell irányítani [76-80].
Ajánlás24
Az anamnézisfelvétel során fel kell tárni az esetleges traumákat, illetve a bántalmazást. Szükség esetén pszichiátriai kezelésre, vagy pszichoszomatikus/pszichoterápiás intézménybe kell utalni a beteget. Pszichológiai terápiákat akkor kell mérlegelni, ha a tünetek 12 hónapos gyógyszeres kezelés után sem javulnak. Ha a pszichológiai terápia helyben elérhető, már korábban is beutalható a beteg preferenciái alapján. (I-B, konszenzus mértéke: 100%)
Az előzményben szereplő trauma és a bántalmazás szerepet játszhat az IBS tünetek progressziójában. Vannak olyan adatok, amelyek arra utalnak, hogy a gyermekkori traumatizációs élmények hozzájárulhatnak a felnőttkori IBS kialakulásához [81]. Az IBS és manifeszt poszttraumás stressz zavar között is írtak már le összefüggést [82]. Azonban vannak olyan tanulmányok is, melyek nem találtak kapcsolatot köztük [83]. Összességében úgy tűnik, hogy a trauma és /vagy bántalmazás és az IBS között nincs szoros összefüggés, az IBS nem korlátozódik egy bizonyos típusú traumára (pl. fizikai, pszichológiai, szexuális). Fontos megjegyezni azt, hogy a trauma feltárása során bizalmon alapuló orvos-beteg kapcsolatra van szükség, mert a nem megfelelő megközelítés retraumatizációhoz vezethet [84].
Ajánlás25
Az IBS-es betegek ellátása során feltétlenül javasolt a megfelelő orvos-beteg kapcsolat kialakítása, hisz ez a feltétele a megfelelő pszichoszociális háttér, terhelő életesemények, esetleges traumák tisztázásának is. (IIa-B, konszenzus mértéke: 100%)
A figyelmes és empatikus meghallgatása a betegnek biztosítja azt a feltételt, hogy a beteg az orvos-beteg kapcsolatban biztonságban érzi magát. Ehhez bizonyos szintű pszichoterápiás szemléletváltás szükséges, amihez bármelyik orvos segítséget kaphat egy Bálint-csoportban [85-89]. Az anamnézis felvétele során javasolt megkérdezni a beteget, hogy élt-e át korábban traumatikus eseményeket, bántalmazást vagy aktuálisan nehéz élethelyzetben van-e.
Ajánlás26
IBS-es betegek esetén az egyéb extraintesztinális fizikális panaszokat is dokumentálni kell. (I-A, konszenzus mértéke: 100%)
A pszichiátriai komorbiditáshoz (anxietas, depresszió) hasonlóan az extraintesztinális manifesztációk is igen gyakoriak (pl. fibromialgia és krónikus fáradtság) IBS-ben. Az extraintesztinális tünetek ronthatják a betegség tüneteit és lefolyását, illetve jelentősen hozzájárulhatnak a beteg életminőségének romlásához. Ezen tünetek feltárása és a beteg globális panaszainak kezelése jelentősen javíthatja a terápia sikerességét [90, 91].
Ajánlás27
Major depresszió és/vagy szorongásos folyamatok gyanúja esetén javasolt ezek szűrését elvégezni vagy konzílium céljából pszichiáterhez irányítani a beteget, mert a kezeletlen komorbid major depressszió és komorbid szorongásos zavarok negatívan befolyásolják az IBS kimenetelét, terápiáját. (I-A, konszenzus mértéke: 100%)
Az IBS betegek szignifikánsan gyakrabban mutatnak szorongásos és depresszív tüneteket, mint az egészséges kontrollok [92]. A pszichiátriai zavarok közül a major depresszió és a szorongásos zavarok relatív rizikója háromszorosa a normál populációénak IBS-ben [93]. A leggyakoribb pszichiátriai komorbiditás, a major depresszió az IBS betegek kb. 30%-ánál, a leggyakoribb komorbid szorongásos zavar, a generalizált szorongás zavar az IBS betegek kb. 15%-ánál fordul elő [94]. Egy meta-analízis nem talált szignifikáns különbséget az IBS különböző altípusai közt a depresszió súlyossági szintjében [95]. A szerotonin központi szerepet játszik az intesztinális folyamatok szabályozásában és a hangulatzavarok, szorongásos zavarok kialakulásában egyaránt. Ez a közös pathomechanizmus magyarázhatja az IBS és hangulatzavarok, szorongásos zavarok magas komorbiditási arányát, melyhez hozzájárulhatnak a gyulladásos folyamatok és a bél-agy tengely eltérések [96]. A HPA tengely és egyéb neuroendokrin hatások is szerepet játszanak a kölcsönös egymásra hatásban [97]. A pszichés zavarokat megélő IBS betegek viszcerális és fájdalom érzékenysége magasabb az egészséges populációhoz képest, súlyosabb emésztőrendszeri tüneteket, fáradtságot, szorongást mutatnak és életminőségük is rosszabb [98]. A pszichológiai tényezők jelentősen befolyásolják a tüneti súlyosságot, a tünet tartamot, a kezelésre adott terápiás választ és gyakoribb orvoshoz fordulást eredményeznek [92]. A komorbid szorongás és depresszió szűrése és adekvát kezelése a beteg életminőségét és terápiás esélyeit egyaránt javítja.
AZ IRRITÁBILIS BÉL SZINDRÓMA KEZELÉSE
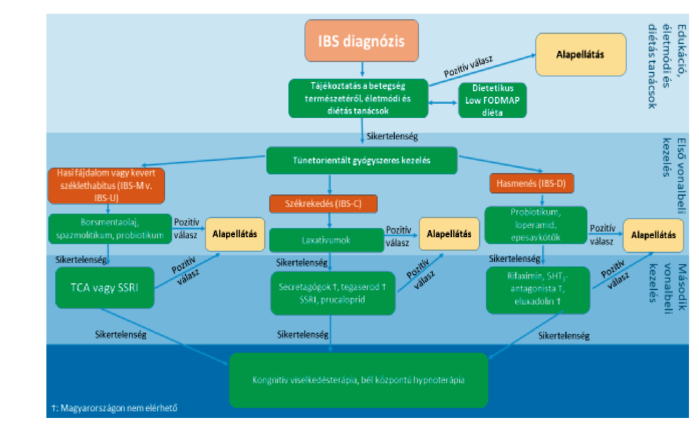
Az IBS betegek jelentős részének tünetei gyógyszeres kezelés nélkül is uralhatók. A terápia alapvető tényezője a megfelelő orvos-beteg kapcsolat, a beteg részletes felvilágosítása az IBS természetéről, lefolyásáról. Első lépésben javasolt életmódi és diétás tanácsok önmagukban hatékonyak lehetnek, ezek sikertelensége esetén vagy a betegek kifejezettebb klinikai tünetei esetén már diagnózis felállítása idején a betegek vezető tünetein alapuló első vonalbeli gyógyszeres kezelés az alapellátásban megkezdhető. A terápia megkezdését követően 2 hónappal szükséges a terápia hatékonyságát felülvizsgálni. Amennyiben a kezelés hatékonynak bizonyul, a beteg további teendőt nem igényel, a terápia folytatható. Az első terápiás próbálkozás sikertelensége esetén javasolt a beteget a gasztroenterológiai szakellátásba irányítani, a másodvonalbeli gyógyszeres kezelés a kórkép terápiájában való nagyobb jártasságot igényel. A gyógyszeres kezelésre nem reagáló esetek számára javasolt a pszichiátriai kezelés igénybevétele. (4-5. ábra)
4. ábra: Az IBS diagnosztikájának algoritmusa - az egészségügyi szakmai irányelvet fejlesztő bizottság saját szerkesztése
5. ábra: Az IBS terápiás algoritmusa - A Brit Gasztroenterológiai Társaság terápiás algoritmusának az egészségügyi szakmai irányelvet fejlesztő bizottság által a hazai viszonyokra adaptált változata
Ajánlás28
Az IBS sikeres kezelésében kulcsfontosságú, ezért javasolt a hatékony orvos-beteg kapcsolat kialakítása, mely javítja az életminőséget, csökkenti a szükséges vizitek számát és fokozza a kezelés iránti adherenciát. (I-C, a konszenzus mértéke: 100%)
Az IBS-es betegek gondozása fokozott empátiát, támogatást igényel. Fontos az információk részletes, széles körű átadása a betegség természetéről és az opcionális terápiás lehetőségekről. A betegek gyakran érzik úgy, hogy a tüneteiket trivializálják vagy figyelmen kívül hagyják, a diagnosztika menetét nehezen követhetőnek érzik, illetve frusztráló számukra, hogy a hatékony kezelés kiválasztásához gyakran hosszú idő szükséges [99-106]. A betegek gyakran különböző forrásokból igyekeznek információhoz jutni, beleértve az internetet és a különböző webes fórumokat [107], ahol ellentmondó és téves tanácsokhoz juthatnak. A klinikus célja, hogy a beteggel együttműködve megértse a beteg elvárásait, elképzeléseit és aggodalmait a diagnosztikával és a kezeléssel kapcsolatban. Számos tényező befolyásolja, hogy felkeresi-e a beteg az orvost az IBS-sel, aktívan közreműködik-e a tünetek csökkentésében, illetve mennyire elhivatott a kezeléssel kapcsolatban. Ezen tényezők közé tartoznak a beteg saját és családtagjainak korábbi tapasztalatai, szociális és fiziológiai faktorok, a foglalkoztatottság, a komorbiditások, valamint az egészségtudatosság mértéke, amelyeket figyelembe kell venni a hatékony diagnosztika és kezelés megvalósításához, illetve a jó orvos-beteg kommunikáció megalapozásához.
Ajánlás29
Minden irritábilis bél szindrómás beteg számára javasolt a rendszeres fizikai aktivitás, a rendszeres mérsékelt és/vagy magas intenzitású fizikai aktivitás hatékonyan csökkenti az IBS tüneteket. (I-C, a konszenzus mértéke: 100%)
A rendszeresen végzett mérsékelt fizikai aktivitás (heti öt alkalommal, alkalmanként 30 percig, mérsékelt intenzitással) csökkenti az IBS tüneteket, a fáradtságot, puffadást, depressziós tüneteket, idegességet és javítja a betegség specifikus életminőség számos aspektusát. Mérsékelt fizikai aktivitás az IBS betegek kezdő kezelésének részét kell képeznie. A háttérben álló mechanizmusok összetettek. A testmozgás javítja az intesztinális gáz clearence-t, ezáltal csökkenti a fokozott gázképződéssel összefüggő panaszokat. Kedvezően befolyásolja ezenkívül a stressz indukálta neuroendokrin választ és a viszcerális észlelést. A betegség tüneteit csökkentő céllal végzett fizikai aktivitás motiválja a betegeket és fokozza a kompetencia érzésüket, hiszen ezáltal aktív résztvevői a betegségük kontrollálásának [108, 109]. Az Egészségügyi Világszervezet (WHO) és az Amerikai Sportorvosi Társaság (ACSM) állásfoglalása szerint tudományos bizonyítékon alapul, hogy a rendszeres fizikai aktivitás egészségügyi előnyökkel jár. A 2018-as amerikai Fizikai Aktivitás Szakmai leirat szerint a mozgásprogram, beleértve az aerob és a rezisztencia tréninget, elengedhetetlen része a fizikai fittség és általános egészségi állapot fejlesztésének és fenntartásának a legtöbb felnőtt esetében. A fizikai fittség megfelelő szintje csökkenti a szív- és érrendszer és számos krónikus betegség, valamint a halálozás kockázatát. A fizikai hatások mellett, javítja a közérzetet, a mentális állapotot, fokozza a kognitív funkciót, és csökkenti a szorongás és a depresszió tüneteit [110, 111]. A SEPAHAM vizsgálat 2018-ban 5000 felnőtt (férfi és nő) vizsgálatával kimutatta, hogy az inaktív életmódot folytatók között 27%-kal nagyobb az IBS előfordulása a fizikailag aktív egyénekkel szemben [112]. Daley és kollegái RTC vizsgálatában igazolta, hogy a fizikai aktivitás csökkentette az IBS tüneteit, különös tekintettel a székrekedésre, de nem hozott különbséget az életminőségben [113]. Két Svéd kontrollált vizsgálat 12 hónapon keresztül végzett megfigyelést IBS-es betegeken moderálttól magas aerob fizikai aktivitásig (gyaloglás, kerékpár, aerobik) 3-5 alkalom/hét gyakorisággal. Ez a mozgásprogram jótékony hatással volt a GI tünetekre és az IBS betegek jólétére. Az intervenciós csoport továbbá jobb életminőségről és kevesebb szorongásról és depresszióról számolt be [108, 109, 114]. Az aerob és/vagy rezisztencia tréning ajánlásaiban meg kell határozni a gyakoriságot, az intenzitást, az időtartamot és az edzés típusát. Az aerob mozgások a moderált terheléstől az magas intenzitásig növelik a kardiorespiratorikus fittséget, akár tradicionális, akár intervall jellegű formában történik a mozgás. Az aerob mozgás megfelelő és hatékony szintjének beállításához az egészségügyi szakembernek fel kell mérnie az IBS-es betegek fizikai aktivitási szintjét. Az alacsony aktivitási szintű IBS-es betegeket ösztönözni kell a fizikai aktivitás elkezdésére, és rövid tanácsokkal ismertetni kell azok jótékony hatásait betegségükre vonatkozóan [111, 115]. Javasoljuk a rendszeres gyaloglást, amely könnyen kivitelezhető, a vizsgálatok szerint pedig szignifikáns csökkenést mutatott a GI-tüneteiben és a szorongásban, és mindezek hosszú távon fenn is maradtak. Az önálló (felügyelet nélküli) mozgásprogramok között a gyaloglás, futás vagy jóga egyaránt javasolt, de megfelelő kivitelezése és így hatékonysága a gyaloglás/futásnak nagyobb, szemben a jógával [116]. Az aerob mozgás javasolt frekvenciáját (3-5 nap/hét), intenzitását (moderált intenzitás HRR 40-59% és/vagy magas intenzitás HRR 60-89%), időtartamát (30-60 perc /nap ≥ 150 perc/hét moderált intenzitású mozgás, 20-60 perc/nap ≥ 75 perc/hét magas intenzitású mozgás, vagy a kettő kombinációja) és formáját (gyaloglás, futás, szoba- vagy kültéri kerékpározás, úszás) mindig a beteg adott fizikai állapotához viszonyítva kell meghatározni. Míg a jógázó IBS-es betegek a szomatikus tünetek csökkenéséről számoltak be, addig a gyaloglást végző IBS-es betegek a GI- diszkomfort csökkenéséről, amely a háttérben levő szorongás és negatív érzelmek csökkenésére utal. A betegek a gyaloglást rendszeresebben végezték a jóga bonyolult pozíciói és nehezebb kivitelezhetősége miatt, ezért hatásossága hosszabban fennmaradt. Rezisztencia gyakorlatokat minden nagyobb izomcsoportra javasolt elvégezni legkevesebb 1 szettben, 8-12-es ismétlésszámmal, legkevesebb 2x/hét alkalommal. Edzetlen egyéneknél 40-60%/1RM már eredményt hoz, edzetteknél ≥ 75%/1RM fejleszti az izomerőt. Időseknél 30-40% 1RM elégséges az izomállapot fenntartásához. IBS-es betegeknél a tünetek figyelembevételével kell a mozgásprogram ajánlásokat megtenni és tanácsokkal ellátni a beteget. Összességében az IBS-es betegeknél 6-24 hét fizikai aktivitás javíthatja a tüneteket, de a bizonyítékok alacsony evidencia szintűek. A fizikai aktivitás, az életminőség és a hasi fájdalom között minimális vagy nincs összefüggés [117],
Ajánlás30
Minden irritábilis bél szindrómás beteget javasolt első vonalban étrendi tanácsadásban részesíteni. (I-C, a konszenzus mértéke: 100%)
Az IBS betegek 60-80%-a számol be összefüggésről az étkezések vagy legalább egy élelmiszer komponens és a tünetei között [46, 118]. A klinikai gyakorlatban az elmúlt évtizedben egyre nagyobb az érdeklődés az IBS kezelésére szolgáló diéták iránt. A hagyományos diétás tanácsadás alapelvei, az egészséges táplálkozási szokások elfogadásán alapulnak úgy, mint a rendszeres étkezés, a megfelelő táplálékbevitel biztosítása, az alkohol- és koffeinbevitel korlátozása, a rostbevitel biztosítása, a zsíros és fűszeres ételek fogyasztásának csökkentése [119].
Ajánlás31
Hosszabb távú eliminációs diéta tartása IBS-ben csak abban az esetben javasolt, ha a betegnek van klinikailag igazolt élelmiszer intoleranciája. Az eliminációs diéta alkalmazása csak szoros dietetikai ellenőrzés mellett biztonságos. (IIa-B, a konszenzus mértéke: 100%)
A legtöbb eliminációs diéta hatásosságával kapcsolatban IBS-ben nem állnak rendelkezésre megfelelő klinikai tanulmányok. Amennyiben klinikailag alátámasztottnak látszik az élelmiszer intolerancia kóroki szerepe, a diéta időtartama alatt a diéta folytatásának szükségességét a tényleges klinikai haszon mérlegelésével kell ellenőrizni és időszakosan felülvizsgálni. A klinikailag releváns javulást nem eredményező eliminációs diétát meg kell szüntetni. Az egyetlen bizonyítékokon alapuló hatékony hosszabb távú eliminációs diéta az alacsony FODMAP-tartalmú étrend [120]. A nagyon szigorú és hosszabb ideig tartott eliminációs étrend elkerülése javasolt, mivel alultápláltsághoz vezethet.
Ajánlás32
Az élelmi rostok hatékony kezelést jelenthetnek az irritábilis bél szindrómás betegek részére úgy hasmenés, mint székrekedés esetén megfelelő folyadékfogyasztás mellett. A vízben oldódó élelmi rostok fogyasztását kis mennyiségben (3-4g/nap) ajánlott kezdeni, majd a mennyiség fokozatos beépítése javasolt az étrendbe. Azonban a vízben nem oldódó élelmi rostok kerülése javasolt, mert a tüneteket felerősíthetik. (I-B, a konszenzus mértéke: 100%)
A vízben oldódó rostok, úgymint a psyllium (útifűmaghéj) hatékonyak az IBS terápiájában, ellentétben a vízben nem oldódó rostokkal, pl. gabona- és búzakorpa [121]. Egy ellenőrzött, randomizált vizsgálatban napi 30 g búzakorpa fogyasztását hasonlították össze napi 5 g részben hidrolizált guargumival. A tünetek enyhülése és a tolerálhatóság kedvezőbb eredményt mutatott a guargumival [122]. Meta-analízisek igazolták a tünetek jelentős javulását és a hasi panaszok csökkenését a vízben oldható élelmi rostok hatására, míg a nem oldódó élelmi rostok az IBS kezelésében nem bizonyultak hatékonynak [123, 124]. Ajánlott alacsony adaggal kezdeni a rostbevitelt (3-4 g naponta), és fokozatosan a tolerálhatóság figyelembevételével emelni, maximum 20-30 g/napig. A székrekedéses típusú IBS-ben az élelmi rostok pozitív hatásainak fokozása érdekében a Német Táplálkozástudományi Társaság (DGE) ajánlásai szerint figyelmet kell fordítani a megfelelő napi folyadékbevitelre [125].
Ajánlás33
A "Low-FODMAP" étrend hatékony lehet az IBS általános tüneteinek kezelésében. A diéta megvalósítása 3 fázisban javasolt, mely az eliminációt, a tolerancia megállapítását és a hosszú távú étrend kialakítását jelenti. A nyersanyagok étrendbe történő fokozatos visszavezetése az alacsony FODMAP étrend alkalmazásában jártas szakképzett dietetikus felügyelete mellett kell történjen. (IIa-D, a konszenzus mértéke: 100%)
A FODMAP rövidítés fermentábilis oligoszacharidok, diszacharidok, monoszacharidok és polyolok gyűjtőfogalmát takarja. Számos tanulmány igazolta a tünetek javulását IBS-ben a FODMAP-ok bevitelének korlátozásával [126-128]. Szisztematikus áttekintő munkák és meta-analízisek alapján tünetkontroll szempontjából a low-FODMAP diéta hatékonynak tűnik, azonban a jelenleg rendelkezésre álló tanulmányok alacsony evidenciája miatt nem teszik lehetővé, hogy egyértelmű ajánlást tegyünk az alacsony FODMAP-tartalmú diétára hasi fájdalom, puffadás és hasmenés esetén. Az alacsony FODMAP-értékű étrend klinikai dietetikus tájékoztatása és felügyelete mellett javasolt, hogy elkerülhetőek legyenek a szükségtelen korlátozások és az alultápláltság [129-131].
Ajánlás34
Az irritábilis bél szindrómás betegeknek nem javasolt a gluténmentes diéta tartása. (IIb-C, a konszenzus mértéke: 100%)
Egy szisztematikus review és meta-analízis (2 RCT, 111 IBS beteg) alapján a gluténmentes diéta csökkenti a globális IBS tüneteket, de ez a változás a kontroll étrendhez képest statisztikailag nem szignifikáns [130]. Jelenleg nincs elegendő bizonyíték a gluténmentes étrend rutinszerű ajánlására IBS-ben szenvedő betegekben, ezen diéta széleskörű népszerűsége miatt a terápiás hatékonyság felmérése céljából további vizsgálatokra (RCT) van szükség. Felmerült az is, hogy a gluténmentes diéta klinikai előnyei főként nem önmagában a glutén eltávolításából származnak, hanem inkább az étrend fruktán tartalom csökkentésére vezethetők vissza. A fruktán egy FODMAP, így a betegek tüneti javulása a búza kizárása okán történhet [132, 133].
Ajánlás35
Rifaximin adása javasolt a hasmenés predomináns IBS altípusban. (IIa-B, a konszenzus mértéke: 95%)
A rifaximin fel nem szívódó széles spektrumú antibiotikum, melyet az Egyesült Államokban a Target 1, 2 és 3 tanulmányokban vizsgáltak nagy betegszámon, randomizált kontrollált körülmények közt. [52, 134, 135] Rifaximin kezeltek esetében a kezelni szükséges esetek száma 9. A mellékhatásprofilja kifejezetten jó a többi gyógyszeres kezeléshez képest. A pozitív terápiás kimenetelt valószínűsíti, ha a betegnek pozitív glukóz + H2 kilégzési eredménye is volt a vizsgálat megkezdése előtt (SIBO vs. IBS). [136] Ezeken kívül további 2 RCT bizonyított kismértékű, de szignifikáns javulást az IBS globális tüneteiben, illetve a haspuffadásban rifaximin kezelést követően. [137] A mellékhatások nem különböztek a placebo csoportban tapasztalttól. A vizsgálatokban jelentős placebohatást tapasztaltak. Nincs egyértelmű bizonyíték az ismételt alkalmazás kapcsán esetlegesen kialakuló rezisztenciára, illetve a hosszú távú hatékonyságra vonatkozóan. [138-140]
Az amerikai vizsgálatokban alkalmazott 550 mg hatóanyagtartalmú tabletták nem hozzáférhetőek Európában és így Magyarországon sem. A hazánkban elérhető 200 mg/tabletta formulációban az amerikai vizsgálatnak megfelelő dozírozás napi 3x3 tablettának felel meg.
Ajánlás36
Probiotikumok adása javasolt az IBS kezelésére (IIa-C, a konszenzus mértéke: 84%)
Sok probiotikumokkal foglalkozó tanulmány elvégzése idején az érvényes IBS definíció eltért a jelenlegitől. Ezen tanulmányok az IBS aktuális, Róma IV. kritériumrendszere szempontjából nem diagnosztikus tüneteket (pl. flatulencia, haspuffadás, hasi diszkomfort) valamint az általános életminőség változását is értékelték, esetenként ezek szignifikáns javulását is leírták. A rendelkezésre álló nagyszámú, de legtöbbször kis esetszámú, nagyon heterogén, vizsgálati adatok alapján nem foglalható általánosan állás a probiotikumok IBS-ben való alkalmazásának hatékonyságáról. Sokkal valószínűbb, hogy adott törzsek, adott szelektált betegcsoportokban képesek szignifikáns és a placebo csoportét meghaladó tüneti javulást eredményezni. A vizsgálatok eredményességét jelentősen befolyásolja, hogy milyen törzset használtak, mennyi ideig, milyen formulációval és dózissal. A legtöbb vizsgálatban nem történt meg külön az egyes IBS alcsoportok elemzése, így a meta-analízisek alábecsülhetik e készítmények hatékonyságát. Tovább bonyolítja a helyzetet, hogy a piacon elérhető készítmények közt vannak gyógyszerek és orvostechnikai eszközök (nem gyógyszer) is, melyekre eltérő forgalomba hozatali szabályok vonatkoznak. A legtöbb kedvező bizonyíték a Lactobacillus, Bifidobacterium és Escherichia törzseket használó tanulmányokkal áll rendelkezésre [141-154]. A probiotikum terápia eredményessége 3 hónap után értékelendő és a kezelés adott készítménnyel való folytatása csak akkor javasolt, ha az hatásosnak bizonyult.
Ajánlás37
Prebiotikumok adása nem javasolt az IBS kezelésére. (IIb-D, a konszenzus mértéke: 94%)
A prebiotikumok hatékonyságát nem támogatja kellő mennyiségű vizsgálati adat. A legtöbbet vizsgált inulin egy 2014-es meta-analizis szerint nem jobb a placebonál. [144] A transgalactooligosaccharidok egy kis esetszámú randomizált vizsgálatban a placebohoz képest jobbnak bizonyultak. [155]
Ajánlás38
Széklet transzplantáció nem javasolt az IBS kezelésére (I-D, a konszenzus mértéke: 100%)
A széklet transzplantáció hatékonyságát nem támogatja kellő mennyiségű és minőségű vizsgálati adat. Az esetriportokon túl ugyan vannak már kisebb kontrollált vizsgálatok, de legjobb esetben is mérsékelt eredményességűek. [156-161] Emellett számos, jelenleg még tisztázatlan kérdés vethető fel biztonságossági és etikai oldalról a módszerrel kapcsolatban. A Xu által végzett összegző elemzésből az derül ki, hogy szemben az így kezeltek 49%-os pozitív tüneti válasza nem volt jobb a placebo csoporténál (51%). [156] Ugyanakkor a nasojejunalis és a colonoscopos adminisztráció esetén mutatkozott némi terápiás előny a széklet transzplantáció javára. Egyelőre hiányoznak a nagyesetszámú multicentrikus randomizált placebo kontrollált vizsgálatok úgy önmagában a terápiás modalitásra, mint annak legmegfelelőbb alkalmazási módjára vonatkozóan.
Ajánlás39
Exocrin pancreas szubsztitúciós kezelés nem indokolt IBS-ben (I-C, a konszenzus mértéke: 100%)
Továbbra sincsenek használható tanulmányok az IBS hasnyálmirigy enzim pótlással történő kezelésre, ezért ajánlás nem tehető. Az idült hasnyálmirigy gyulladás és az IBS tünetek alapján felmerült átfedését és a hasmenéssel járó IBS betegekben a hasnyálmirigy enzimpótlás hasznát illetőn prospektív tanulmányok, különösen a jelenleg érvényes Róma IV. klasszifikáció alapján felállított diagnózis esetén, nem történtek [48, 162].
Ajánlás40
Mesalazin alkalmazása nem indokolt IBS kezelésében (I-B, a konszenzus mértéke: 100%)
A mesalazin alkalmazását IBS betegekben két randomizált kettős vak, placebo kontrollált tanulmány vizsgálta [163, 164]. A 2,4-4 g mesalazinnal 3 hónapos kezelések után alcsoport analízis alapján a poszt-infekt alcsoportba sorolható, kisszámú betegben volt kimutatható szignifikáns javulás. Mindazonáltal, a mesalazin kezelés lehetséges mellékhatásainak kockázatát is figyelembe véve az IBS betegekben a mesalazin kezelés nem ajánlott [165].
Ajánlás41
Antihisztaminok alkalmazása nem indokolt IBS-ben (I-C, a konszenzus mértéke: 100%)
Az IBS betegekre jellemző viszcerális hiperszenzitivitás, amelyet a TRPV1 receptorok közvetítenek, H1 receptor antagonista (ebastin) alkalmazásával csökkenthető, ami szignifikáns javulást eredményezett egy kis számú betegen végzett placebo kontrollált vizsgálatban [166]. Egyelőre ezek az eredmények nem nyertek megerősítést és ennek a Magyarországon is forgalmazott antihisztaminnak az IBS kezelésére az alkalmazási leiratban nincs indikációja.
Ajánlás42
Loperamid kezelés javasolt hasmenés predomináns IBS betegekben (I-B, a konszenzus mértéke: 100%)
A loperamid piperidinből szintetikusan előállított perifériás opioid µ-receptor agonista. A bélfal körkörös és hosszanti simaizomzatára gyakorolt direkt hatása következtében növeli az intesztinális tranzitidőt, csökken a bélmotilitás, gátolja a folyadék- és elektrolit szekréciót. Fokozza a béltónust, akadályozza a propulzív perisztaltikát és hasmenéskor csökkenti a béltartalom áthaladásának sebességét, a székletürítés gyakoriságát, javítja azok konzisztenciáját. A loperamid nem változtatja meg a fiziológiás bélflórát, és növeli az anális sphincter tónusát. Megnövekszik az abszorpciós ráta is. A bélfal iránti nagy affinitása és a magas "first-pass" effektus miatt alig jut el a szisztémás keringésbe és korlátozott az átjutása a vér-agy gáton is.
A tüneti terápiás hatékonyságát három prospektív, randomizált, kettős vak, placebo-kontrollált vizsgálat kimutatta a hasmenéssel járó IBS betegekben [167-169]. Ez vonatkozik a széklet állagára és a székelési ingerre, de a hasi panaszokra is. A vizsgálatok azonban kis betegszámmal, mintegy 30 éve, és nem a klinikai vizsgálatokkal manapság elvárt feltételekkel történtek.
Alkalmazás: Minden híg vízszerű székletürítés esetén 2 mg loperamid bevétele javasolt, és szükség szerint 5-8 alkalommal ismételhető. A hasmenés kezelésére a tapasztalat alapján az egyszer bevett adag növelhető is. Tartós kezelés lehetséges és gyakran szükséges is. A reggeli hasmenés megelőzésére loperamid előző este történő bevétele javasolt. Az éjszakai hasi panaszok megjelenése viszont a székrekedés kialakulásának veszélyére hívhatja fel a figyelmet [169]. Az IBS kevert típusában a loperamid alkalmazására vonatkozóan nincs ajánlás, mindazonáltal tünetorientált alkalmazása észszerűnek mondható.
A loperamid nem gyógyítja meg az IBS betegeket, csupán tüneti kezelésre lehet alkalmazni. Az alkalmazására vonatkozó evidenciák hiányosak, ezért nagy jelentősége van az orvos és a beteg tapasztalatának a személyre szabott alkalmazás és az életminőség minél jelentősebb javítása érdekében. A loperamid folyamatos alkalmazását a vonatkozó tanulmányok hiánya miatt az IBS terápiás ajánlások ellentmondásosan ítélik meg.
Ajánlás43
Epesavkötő gyógyszerek (cholestyramin, colesevelam) adása javasolt IBS-D-ben (IIa-B, a konszenzus mértéke: 100%)
Epesav felszívódási zavar esetén a vastagbélbe jutó epesavak fokozzák a nyálkahártya áteresztőképességét, víz-és elektrolitkiválasztást indukálnak, és felgyorsítják a vastagbéltranzitot, ezáltal utánozhatják az IBS-D tüneteit. Különösen érdemes erre gondolni, ha éjszakai hasmenés is előfordul, vagy az anamnézisben kolecisztektómia szerepel. Az epesav felszívódási zavar kimutatására nukleáris diagnosztikai módszer, SeHCAT (23-szeleno-25-homotaurokolsav) áll rendelkezésre, azonban hozzáférhetősége az európai országok többségében (így hazánkban is) korlátozott. Alternatív lehetőség az epesavkötő gyanta (cholestyramin, colesevelam) terápiás hatásának kipróbálása jön szóba. Az IBS-D-re gyanús betegek közül minden harmadik-negyedikben kóros SeHCAT-retenciót észlelnek, és az epesav-szekvesztránsra adott terápiás válaszok aránya magasabb a <10%-os vagy a <5%-os retenciót mutató betegek esetében [170]. Az irodalmi adatok meta-analizise szerint a súlyosságához igazított cholestyramin kezelés nem csak a súlyos, hanem a közepes mértékű epesav felszívódási zavar esetén is kifejezett eredményeket hozott (96, illetve 80%) [171]. IBS-D betegekben az epesavkötő gyanták használatáról kevés tapasztalat áll rendelkezésre, alkalmazásuk módját az ajánlások a klinikus tapasztalatára bízzák. Epesav malabsorptio igazolt eseteiben végzett klinikai vizsgálatokban 8 hétig 2x4 g alkalmazott cholestyramin a vizes hasmenést és a székletek napi számát 2 héten belül csökkentette. [172]. A colesevelam az Európai Unióban forgalmazott epesavkötő gyanta, ami az epesav malabszorbció kezelésére nincs törzskönyvezve, kisebb betegcsoporton végzett tanulmány kedvező hatását írta le [173].
Ajánlás44
Laxativumok adása javasolt IBS-C-ben (I-C, a konszenzus mértéke: 100%)
A laxativumok alkalmazásának tekintetében is nagyon fontos a krónikus székrekedés és az IBS-C elkülönítése, elsősorban a hasi fájdalom - mint diagnosztikus kritérium - helyes értékelése alapján. Ugyanakkor a hashajtók alkalmazásával kapcsolatos tanulmányok többsége nem az IBS-C hanem a krónikus székrekedés terápiájára vonatkozik. De nemcsak a betegek kezelésében és az erre vonatkozó tanulmányok (evidenciák) értékelésében, hanem a vezető gasztroenterológiai szakmai társaságok egymásnak ellentmondó ajánlásainak alkalmazása során is szem előtt kellene ezt tartanunk. Így tehát az orvos egyéni tapasztalatának és a személyre szabott gyógyításnak az IBS-C kezelésében rendkívül nagy szerepe marad.
Az IBS-C és krónikus székrekedésben szenvedő betegek többsége rendszerint kipróbál egy vény nélkül kapható gyógyszert, mielőtt konzultált volna az egészségügyi szakemberrel [2]. A betegek a hasi fájdalom vagy görcsök, kellemetlen érzés és/vagy puffadás kezelésére olyan görcsoldókat használnak, mint a borsmentaolaj, de ezek általában nem javítják, sőt ronthatják is a tranzit időt, vagy a széklet minőségét [2]. Az ozmotikus hashajtók - a polietilénglikol (PEG, makrogol) és a laktulóz - bizonyították hatékonyságukat a krónikus székrekedés kezelésében, és javították a széklet állagát IBS-C-ben, de placebóval összehasonlítva kevés hatást mutattak az IBS globális tüneteire, beleértve a hasi fájdalmat is [174]. A makrogol készítmények alkalmazása akkor jön szóba, ha rostterápia mellett puffadás lép fel, mivel ezeknek jelentős mértékű bakteriális lebontásuk nincs. Az IBS-C betegekben makrogol alkalmazására vonatkozó evidenciákat a német és a brit ajánlásokban gyengének minősítik, az AGA guideline pedig nem is javasolja használatát. ("A krónikus székrekedés kezelésében a hosszú távú biztonságossága és hatékonysága ellenére - még a legveszélyeztetettebb személyek (idősek és gyermekek) esetében is, nincs bizonyíték arra, hogy a PEG enyhítené a hasi fájdalmat és így a globális tüneteket az IBS-C-ben szenvedő betegeknél. Ezért nem javasoljuk a PEG önmagában történő alkalmazását az IBS-C globális tüneteinek kezelésére, bár elismerjük, hogy a klinikusok a PEG-et az IBS-ben a székrekedés első vonalbeli kezelésére használhatják, tekintettel annak alacsony költségére és elérhetőségére"). A német szakmai ajánlás által hivatkozott tanulmány az IBS-C betegekben azt igazolta, hogy a makrogol jelentősen javítja a székletürítés gyakoriságát és a széklet állagát, de kevésbé hat a fájdalom intenzitására és a puffadásra [175], és ez lehet a terápia megszakításának oka is.
Az IBS-C betegek körében ugyancsak elsővonalban alkalmazott difenilmetánok és az antrakinolok esetében a görcsös hasi fájdalom a leggyakoribb korlátozó tényezője [176]. Ugyanakkor megemlíti, hogy a tipikus mellékhatások, pl. görcsszerű hasi fájdalom a difenilmetánok és antrakinonok esetében, vagy puffadás a laktulóz esetében, az IBS-C beteg kísérő tüneteinek súlyosbodásához vezethetnek, ezért alkalmazásuk korlátozott.
Az IBS-C-ben szenvedő betegeknél, akiknél a hashajtók hatására nem javulnak a tünetek, a nemzetközi iránymutatók másodvonalbeli gyógyszerek alkalmazását javasolják - szekunder és tercier ellátóhelyeken. Ezek a gyógyszerek két fő csoportba sorolhatók, a szekréciót kiváltó szerek és az 5-HT4-agonisták. A szekretagógok (linaclotid, lubiproston, plecanatid, tenapanor) ioncsatornákat aktiválnak az enterocyták intraluminális felszínén, ami ionok és víz kiáramlását eredményezi a béllumenbe, lágyítja a székletet és gyorsítja a tranzitot. Általában magas költségvonzatú és Magyarországon a társadalombiztosítás által nem támogatott készítmények.
Ajánlás45
Spazmolitikumok alkalmazása javasolt IBS-ben a hasi fájdalom kezelésére (IIb-C, a konszenzus mértéke: 100%)
A spazmolitikumok simaizom ellazítók, amelyek alkalmazásának célja a bél simaizom tónusának csökkentése, görcsök oldása, amely az IBS betegek hasi fájdalmában szerepet játszó egyik tényező. A hatásukat közvetlenül a bél simaizomzatára fejtik ki (mebeverin, papaverin-származékok), kalciumcsatorna blokkoló szerek (pinaverinum-bromid, otilium-bromid, alverin, fenoverin, rociverin, pirenzepin) és antikolinerg szerek (hioszcin-butilbromid, hioszcin, hyoscyamin, dicycloverin, butylscopolamin, trimebutin és cimetropium-bromid).
Egy Cochrane meta-analizis 29 RCT-t foglalt össze 2333 beteggel, amelyekben a görcsoldókat (cimetropium, pinaverium, trimebutin, otilinium, hyoscin butylbromid, butilszkopolaminium-bromid, borsmentaolaj) hasonlították össze placébóval. A fájdalomra kedvező hatás mutatkozott (58% spazmolitikum kontra 46% placebo, 13 vizsgálat, 1392 beteg, RR 1,32; 95% CI 1,12-1,55, p < 0,0001, NNT 5), az IBS-tünetek globális javulására (57% spazmolitikum kontra 39% placebo, 22 vizsgálat, 1983 beteg, RR 1,49, 95% CI 1,25-1,77, p < 0,0001, NNT 5) és az egyéni tüneti pontszámok javulása (37% spazmolitikum kontra 22% placebo, 4 vizsgálat, 586 beteg, RR 1,86, 95%-os CI 1,26-2,76, p < 0,01, NNT 3) szintén kedvező hatást mutat [177]. Mindazonáltal a görcsoldók IBS kezelésében történő használatára vonatkozó evidenciák gyengék, az RTC-k korlátozott vizsgálati időtartam és eltérő módszertani minősége miatt. Az AGA guideline használatukat ellenjavallja, a német vezérfonal viszont nagy egyetértéssel erősen javasolja. Egyéb (brit, belga) vezérfonalak a használatukat a gyakorlatban, elsősorban az első vonalbeli ellátásban nem ellenjavallják, de felhívják a figyelmet a hatásosságukat illető gyenge evidenciákra, és a jelentős mellékhatásprofilra is különösen az antikolinerg szerek esetében.
Ajánlás46
Borsmentaolaj adása javasolt IBS-ben a hasi fájdalom csökkentésére (IIb-C, a konszenzus mértéke: 100%)
A borsmentaolajat (Mentha piperita) kiterjedten használják az IBS tüneteinek enyhítésére. Hatásosságát metaanalízis [178] és egy közelmúltban megjelent újabb randomizált kontrollált tanulmány is bizonyítja [179]. A hatásmechanizmusa részben az L-mentol kalciumcsatorna blokkoló tulajdonságával és az ezzel járó simaizom-relaxációval, illetve a TRPV1 csatornák modulációjával, valamint az antimikrobiális és gyulladáscsökkentő és a pszichoszociális distresszt csökkentő hatásainak összességével is magyarázható [180]. A randomizált kontrollált tanulmányok meta-analízise azt mutatta, hogy borsmenta olajjal kezelt 3 betegből 1 tartósan tünetmentessé vált az IBS általános tüneteinek, és négyből 1 a hasi fájdalom tekintetében.
A legújabb tanulmány, Róma IV. kritériumok szerint diagnosztizált 190 hollandiai IBS-betegben vizsgálta 182 mg borsmentaolaj (vékonybélben és ileocolicus felszabadulású) hatását placebóval szemben 8 héten keresztül [179]. A 4. héten már a placebóval szemben a vékonybélben felszabaduló borsmentaolaj szignifikáns javulást eredményezett a hasi fájdalom és az IBS súlyossága tekintetében. A borsmentaolaj mellékhatás profilja nem tért el a placeboétól. Mindazonáltal, a kereskedelmi forgalomban kapható borsmentaolaj hatékonyságát és biztonságosságát csak néhány készítmény esetében vizsgálták szigorúan. További nagy, módszertanilag szigorú vizsgálatok elvégzése javasolt a készítmény optimális kiszerelésének, a különböző IBS-alcsoportokban jelentkező relatív előnyöknek és az összehasonlító hatékonyság megállapítására.
Ajánlás47
Nem javasolt sem az intesztinális permabilitás mérése diagnosztikus céllal, sem mukoprotektív kezelés alkalmazása irritábilis bél szindróma típusos tüneteinek fennállása esetén az erre irányuló kellő evidenciák hiánya miatt. (IIb-C, a konszenzus mértéke: 94%)
A károsodott intesztinális barrier koncepciója tudományosan kutatott terület irritábilis bél szindróma etiológiai és tünetképző szerepének vonatkozásában is. Több tanulmány pozitív korrelációt talált a fokozott permeábilitás mértéke és az IBS tüneteinek erőssége között [181-183], azonban inverz korrelációt leíró tanulmány is született [184]. A glutamint eddig egy tanulmányban vizsgálták posztinfekt IBS betegcsoportban, ahol javította a panaszokat [185]. A xyloglucan borsófehérjével, szőlőmag tanninokkal és xylo-oligoszaccharidokkal kombinált készítménye a Gelsectan® két randomizált tanulmányban is szignifikánsan javította hasi fájdalmat és csökkentette a hasmenést, járulékosan javította a bélgázosságot és az életminőséget [186, 187]. Ezen tanulmányokban leírt váratlanul nagyon alacsony placébó válasz és a nagyon magas klinikai válasz felvetette a beválogatási hiba és a vizsgálat nem vakon történő kivitelezésének lehetőségét. Ezen bizonytalanságok tisztázása előtt nem javasolt terápiás modalitásnak tekinteni IBS-D-ben a készítményt.
Ajánlás48
Hasmenéssel járó IBS-ben (IBS-D) eluxadolin használata javasolt. (IIa-B, a konszenzus mértéke: 95%)
Az eluxadolin egy minimálisan felszívódó kevert µ- és K-opioid receptor agonista, valamint ɗ-opioid receptor antagonista, amelyet azért fejlesztettek ki, hogy csökkentsék a tiszta µ-opioid agonisták székrekedést okozó hatását és fokozzák a fájdalomcsillapító hatásukat. Az FDA 2x75 mg dózisban hagyta jóvá IBS-D kezelésére. 2 nagy betegszámú, fázis 3 vizsgálatban 26 hétig alkalmazva 808 betegben szignifikánsan csökkentette az IBS-D-s betegek tüneteit (RR 0,87). A leggyakoribb mellékhatások a székrekedés (8%), hányinger (7%) és hasi fájdalom (7%) voltak. 5 olyan betegnél észleltek pancreatitist, akik cholecystectomizáltak voltak, vagy rendszeresen fogyasztottak alkoholt [188]. Az eluxadolin használata kontraindikált cholecystectomizált betegekben és napi >3 egység alkohol fogyasztása esetén.
Ajánlás49
Bizonyos terápia refrakter IBS-D-s esetekben hasmenés és hasi fájdalom kezelésére 5-HT3 antagonisták adása javasolt. (IIa-B, a konszenzus mértéke: 100%)
A szerotonin (5-HT) a GI traktus motoros és szenzoros szabályozásában alapvető szerepet játszó neurotranszmitter, Számos prospektív, randomizált, kettős vak, placebo kontrollált vizsgálatban kimutatták a 5-HT3 antagonisták hatásosságát IBS-D-ben: szignifikánsan csökkentették a hasmenéses panaszokat, a hasi fájdalmat, a sürgető székelési ingert és az életminőséget is. A leggyakoribb mellékhatás a székrekedés volt (szertől függően akár 25% is). Az alosetronnál az esetek 0,1-0,2%-ban ischaemiás colitist is megfigyeltek, ezért a szer csak az USA-ban engedélyezett nők számára egy szigorú program keretein belül. A ramosteron csak Japánban engedélyezett. Az ondansetron a legtöbb országban IBS-ben off label indikációval írható fel [189-194].
Ajánlás50
Székrekedéssel járó IBS-ben (IBS-C) tegaserod használata javasolt 65 évesnél fiatalabb, negatív cardiovascularis (myocardialis infarktus, stroke, TIA, angina) anamnézissel rendelkező nőknek, akik egyéb szekretagógokra nem megfelelően reagáltak. (IIa-B, a konszenzus mértéke: 95%)
Az 5-HT4 receptor stimulálásával a GI tranzit gyorsul, csökken a viszcerális érzékenység. A tegaserod a 5-HT4 receptor parciális agonistája [195]. A tegaserodot az FDA 2002-ben engedélyezte IBS-C-s nőbetegek számára, majd 2007-ben visszavonta a piacról, mivel egy retrospektív elemzésben a gyógyszert szedőkben placebóhoz képest csekély mértékben ugyan, de több cardiovascularis eseményt rögzítettek [13/11 614 (0,11%) vs 1/7031 (0,01%)]. Későbbi obszervációs vizsgálatokban nem figyeltek meg ilyen összefüggést, ezért az FDA az adatokat újra megvizsgálva, ismét engedélyezte 65 évesnél fiatalabb IBS-C-ben szenvedő, negatív cardiovascularis (myocardialis infarktus, stroke, TIA, angina) anamnézissel rendelkező nők számára. Napi 2x6 mg dózisban a placebónál hatékonyabban csökkenti az IBS-C-s panaszokat (RR 0,87), a leggyakoribb mellékhatás a hasmenés (1,6%) és fejfájás (1,0%) volt [196-199].
Ajánlás51
Hagyományos hashajtókra refrakter székrekedéses panaszok esetén prucaloprid adása javasolt. (IIa-B, a konszenzus mértéke: 100%)
Az 5-HT4 agonista prucaloprid számos placebo kontrollált vizsgálatban hatékony volt krónikus székrekedés kezelésében [200, 201]. Mindeddig nem készült RCT az IBS-C-ben.
Ajánlás52
Székrekedéssel járó IBS-ben (IBS-C) linaclotid, plecanatid (guanilát cikláz aktivátorok) használata javasolt. (I-A, a konszenzus mértéke: 100%)
A linaclotide hatékony másodvonalbeli gyógyszer az IBS-C másodlagos ellátásban. A linaclotide guanilát-cikláz C agonistaként a CFTR-receptoron (cystic fibrosis transmembrane conductance regulator/cisztás fibrózis transzmembrán konduktancia szabályozó) keresztül serkenti a klorid- és bikarbonát-szekréciót, és ezáltal a bélbe történő folyadékelválasztást és ezen a mechanizmuson keresztül javíthatja a székrekedést. Három RCT (1773 beteggel kb. 90% nő) bizonyítja a linaclotid hatékonyságát az IBS-C székrekedés enyhítése tekintetében. A hasi fájdalom tekintetében is jelentős javulást mutattak ki [202]. A puffadás mértéke is csökkent. A hasmenés a leggyakoribb mellékhatás, a betegek akár 22%-ánál is előfordulhat, de általában enyhe és azonnal visszafordítható, csupán a betegek legfeljebb 5%-ánál olyan súlyos, hogy a gyógyszer szedését abba kell hagyni [203]. A linaclotidot az EMA 2012-ben engedélyezte az IBS-C és a krónikus székrekedés kezelésére. IBS-C kezelésére orálisan adható, napi adagja 1 kapszula (290 ug). Valószínűleg ez a leghatékonyabb szekréciós szer, amely a székrekedéssel járó IBS kezelésére jelenleg rendelkezésre áll. Egyaránt hatásos a székrekedés és a hasi fájdalom csökkentésére. (ajánlás: erős, bizonyítékok minősége: magas).
A plecanatide (guanilát-cikláz-C agonista), hatékony másodvonalbeli gyógyszer a székrekedéssel járó IBS kezelésére a másodlagos ellátásban [204]. A hasmenés gyakori mellékhatás, és nem kevésbé valószínű, mint a linaclotid vagy a tenapanor esetében. A gyógyszer az USA-ban engedélyezett a székrekedéssel járó IBS kezelésére, Európában még nem áll rendelkezésre ebben az indikációban (ajánlás: erős, bizonyítékok minősége: magas).
Ajánlás53
Székrekedéssel járó IBS-ben (IBS-C) lubiproston (prostaglandin E1 analóg) használata javasolt. (I-B, a konszenzus mértéke: 100%)
A lubiprostone (kloridcsatorna-aktivátor), a másodlagos ellátásban a székrekedéssel járó IBS hatékony másodvonalbeli gyógyszere. A kloridcsatorna 2 aktivátor lubiproston növeli a folyadékkiválasztást a bélben, és így lágyíthatja a székletet és enyhítheti a székrekedés tüneteit. Elősegíti a kloridionok ClC-2 csatornákon keresztül történő szállítását a bélbe, ami fokozott paracelluláris folyadékszekrécióhoz vezet és elősegíti a bél kiürülését. Mivel az anyag prosztaglandin-származék, az esetleges szisztémás prosztaglandin hatás veszélye is szóba kerül, bár mérhető plazmaszintje nagyon alacsony (biológiai hasznosulás < 1%) [205]. Két meta-analizis, illetve 3 RCT jó hatékonyságot mutat a lubiprostonra az IBS székrekedés és fájdalom enyhítésében, és mérsékelt hatékonyságot a puffadásban [206]. A hatása azonban következetesen csak rövid távon (< 3 hónap) mutatható ki meggyőzően. A hasmenés volt a leggyakoribb mellékhatás, amely a betegek 27%-ánál fordult elő. Hasmenést okozó hatása kevéssé valószínű, mint egyéb szekréciót kiváltó szereké. A hányinger gyakori mellékhatás. Költséges volta is korlátozza használatát. (ajánlás: erős, bizonyítékok minősége: közepes).
Ajánlás54
A perifériás analgetikumok az IBS okozta hasi fájdalom kezelésére nem javasoltak. (IIa-C, a konszenzus mértéke: 100%)
Jelenleg nem állnak rendelkezésre ellenőrzött vizsgálatok perifériás analgetikumok (aszpirin, metamizol és non-steroid) hatásosságának igazolására. Egy a butilscopolaminnal kombinált paracetamollal végzett klinikai vizsgálatban a kombinált terápia hatékonyabbnak bizonyult a placebóval szemben, de a paracetamol önmagában nem volt hatékonyabb a placebónál [207, 208]. A perifériás analgetikumok jelentős mellékhatás profilja miatt sem javasolt használatuk az IBS kezelésében.
Ajánlás55
Az IBS okozta hasi fájdalom kezelésére a µ-opioid agonista fájdalomcsillapítók nem javasoltak. (I-D, a konszenzus mértéke: 100%)
A µ-opioid agonista fájdalomcsillapítók súlyos gyomor-bélrendszeri mellékhatásaik, alkalmazásuk során kialakuló függőség és a túladagolás kockázata miatt nem tartoznak a funkcionális kórképekben használt gyógyszerek közé, nem áll rendelkezésre megfelelő adat µ-opioid agonisták használatával kapcsolatosan az IBS kezelésében sem [209].
Ajánlás56
Pregabalin kezelés nem ajánlott IBS tüneti kezelésére (IIb-B, a konszenzus mértéke: 100%)
A kezdetben antiepileptikumként használt pregabalin egy gamma-aminovajsav analóg, ami a központi idegrendszerben a feszültségfüggő kalcium csatornákon hat. Neuropathiás fájdalom kezelésére régóta használják. Irritábilis bél szindrómában egyes tanulmányok szerint a pregabalin kezelés csökkentette a zsigeri túlérzékenységet [210] és a globális tünetek (hasi fájdalom, hasmenés és puffadás) jelentős javulásához vezetett [211]. A gyógyszer mellékhatásai (homályos látás, szédülés és a megváltozott érzékelés) jelentősen korlátozzák a klinikai alkalmazását. További randomizált, kontrollált tanulmányok szükségesek a pregabalin kezelés IBS-ben történő alkalmazhatóságának vizsgálatára.
Ajánlás57
IBS kezelésére simeticon adása monoterápiaként nem javasolt. (IIb-D, a konszenzus mértéke: 100%)
Felületi feszültséget csökkentő simeticon hatékonyságával kapcsolatban egyelőre csak néhány tanulmány áll rendelkezésre, amelyekben görcsoldókkal együtt adva hatékonynak bizonyult [212, 213] azonban a simeticon monoterápiával kapcsolatosan nem áll rendelkezésre klinikai adat.
Ajánlás58
A tenapanor másodvonalbeli gyógyszerként javasolt az IBS-C kezelésére. (I-A, a konszenzus mértéke: 100%)
A tenapanor a bélből csekély mértékben felszívódó kis molekulájú szekretoros hashajtó. A gyógyszer az enterocyták intraluminális felszínén lévő Na-H cseretranszporter 3-at gátolja szelektíven, ezáltal csökkenti a nátrium és a víz visszaszívását, ami így a bél lumenében marad, lágyítva a székletet és gyorsítva a tranzit időt. Egy nemrég közzétett meta-analízis szerint amelyben a szekretoros hashajtók hatékonyságát vizsgálták, a naponta kétszer adagolt 50 mg tenapanor hatékonynak bizonyult a hasi fájdalom, puffadás kezelésére és növelte a teljes spontán székletürítések számát [214]. A tenapanornak a hasmenés kivételével nem volt több mellékhatása a placebóhoz képest. Tenapanor egy hatékony, jól tolerálható új gyógyszer, ami hosszú távú kezelési lehetőséget kínál az IBS-C-ben szenvedő betegek számára [215]. Az USA-ban az FDA 2019-ben engedélyezte a székrekedéssel járó IBS kezelésére, de a hatóanyag sok országban még nem elérhető, ahogy Magyarországon sem.
Ajánlás59
A sacralis neurostimulációs kezelés alkalmazása nem javasolt irritábilis bél szindróma kezelésére. (IIb-C, a konszenzus mértéke: 100%)
Egy munkacsoport vizsgálta több alkalommal a sacralis neurostimulációs kezelést irritábilis bél szindrómával diagnosztizált betegpopulációban prospektív jelleggel és arra a következtetésre jutottak, hogy jelenleg experimentális terápiás modalitásnak tartandó ezen a területen, amíg multicentrikus randomizált tanulmányok nem támasztják alá a jelenleg biztató kísérleti eredményeket [216-219].
Ajánlás60
A pszichoterápiás eljárások használata egyértelműen javasolt az IBS kezelésében. (I-C, a konszenzus mértéke: 95%)
Az IBS pszichoterápiájának hatékonyságára egyértelmű bizonyítékok állnak rendelkezésre, még akkor is, ha az egyes tanulmányok minősége néha korlátozott [220]. Az IBS kezelésére alkalmas pszichoterápiás eljárások a következők: kognitív viselkedésterápia, pszichodinamikus pszichoterápia, szervspecifikus hipnózis, kombinált pszichoterápia. Pszichoterápia indokolt IBS-ben akkor, ha mérsékelt vagy súlyos emésztőszervi panaszok állnak fenn, melyek jelentősen rontják az életminőséget. Az életminőség károsodása akkor feltételezhető, ha az életmódot és a mindennapi tevékenységet a tünetek relevánsan korlátozzák. Ha a kórfolyamat során a megfelelő gyógyszeres kezelés ellenére a gasztrointesztinális panaszok 3-6 hónap után is fennállnak, és az életminőség jelentős mértékű korlátozásával vagy a kiújulások esetén pl. stresszhelyzetekkel összefüggésben állnak, szintén igénybe vehető a pszichoterápia. Ezeken kívül, ha a beteg kéri, vagy pszichológiai komorbiditás áll fenn, mint pl. depresszió, csökkent motiváció, fokozott fáradékonyság, érdeklődés-vesztés, rossz kedélyállapot, kilátástalanság, szociális visszahúzódás, akár szuicid hajlam, kifejezett szorongás, félelmek, elkerülő magatartás. Pszichoterápiát javasolhatunk akkor is, ha az egészségügyi ellátórendszert a beteg diszfunkcionálisan és feltűnően intenzíven használja, kitartóan ragaszkodik a már elvégzett, és negatív eredménnyel járó diagnosztikus vizsgálatok ismételt elvégzéséhez. A kiegészítő pszichológiai terápiáknak számos előnye van, mint pl. az egészségügyi költségek csökkentése, a megküzdés és az életminőség javítása [221-223]. A pszichoterápiák előnye a pszichofarmakonokkal szemben a biztonságosság és a kezelés időtartamán túlmutató tartós hatás. A pszichoterápiáknak is vannak azonban korlátai, pl. hosszabb kezelési időtartam szükséges, fontos a beteg motiváltsága, illetve kevés a speciális, mentális egészséggel foglalkozó szakember. A pszichoterápiák esetén is előfordulhatnak nemkívánatos események, melyek a tünetek súlyosbodásához, illetve a szorongásszint emelkedéséhez vezethetnek, vagy akár öngyilkossághoz. Azonban ezekkel kapcsolatban még nagy a bizonytalanság, hogy ezek a nemkívánatos események mennyire állnak összefüggésben a kezeléssel.
Ajánlás61
A kognitív viselkedésterápia javasolt az IBS globális tüneteinek a kezelésére. (I-C, a konszenzus mértéke: 100%)
A kognitív viselkedésterápia (CBT) az egyik legfontosabb pszichoterápiás módszer. Erről rendelkezünk a legtöbb adattal. A CBT hatékonynak minősült és a kontrollokhoz képest jobbnak bizonyult IBS-ben [220]. Egy 18 randomizált kontrollált vizsgálaton alapuló meta-analízisben azonban nem találtak jelentősebb előnyt más pszichológiai módszerekkel szemben [224]. Néhány vizsgálat alátámasztja a CBT mint internetalapú terápia lehetséges hatékonyságát, de az adatok jelenleg túl gyengék ahhoz, hogy egyértelmű ajánlást lehessen adni. A CBT arra összpontosít, hogy a betegek fel tudják dolgozni a környezeti információkat, illetve megszerezzék azok feletti irányítást és ezzel csökkenteni tudják a tüneteiket. Ez a terápia a maladaptív gondolkodási minták azonosítása és megváltoztatása, a kognitív hibák és a hibás logika felismerése révén működik. Ez segíthet a betegeknek a nehézségek kezelésében és a viselkedésük megváltoztatásában, valamint abban, hogy érzelmileg és fizikailag jobban érezzék magukat. A klasszikus pszichoterápiával ellentétben a CBT a pácienstől aktív részvételt igényel, probléma központúbb, célirányosabb és időkorlátos [225].
Ajánlás62
A pszichodinamikus terápiák nem javasoltak IBS-ben. (IIb-C, a konszenzus mértéke: 100%)
A pszichodinamikus terápiáról kevés tanulmány létezik, de ez a terápia is hatásosnak bizonyult [220]. Azonban meg kell jegyezni, hogy mind a CBT, mind a pszichodinamikus terápiák vonatkozásában vizsgált tanulmányokra jellemző, hogy ezek közül csak igen kevés kifejezetten gasztroenterológiai témájú létezik.
Ajánlás63
A bélre irányuló hipnoterápia javasolt az IBS globális tüneteinek kezelésére. (I-C, a konszenzus mértéke: 100%)
Az egyetlen ún. szervspecifikus eljárás a bélvezérelt hipnózis (GDH). Ez csak erre szakosodott központokban érhető el, hazánkban igen korlátozottan. A hipnózis olyan tudatállapotot képvisel, amely koncentrált figyelmet és csökkent perifériás tudatosságot foglal magában, amelyet a szuggesztióra való fokozott válaszadási képesség jellemez [226]. Különböző tanulmányok, meta-analízis és még a Cochrane-vélemények is elismerik a hipnózist [227], mint potenciális és biztonságos kezelést az IBS-ben szenvedő betegek számára, akik rezisztensek a standard terápiával szemben, és a sikerarány valamivel meghaladja az 50%-ot. A terápia akadálya, hogy kevés a képzett hipnoterapeuta, és ebből kifolyólag a klinikai gyakorlati tapasztalat is hiányos, így nem sikerült konszenzusos álláspontot kialakítani ezzel az állítással kapcsolatban.
Ajánlás64
A Mindfulness alapú stressz menedzselés javasolt pszichoterápiás módszer IBS-ben. (I-A, a konszenzus mértéke: 100%)
A Mindfulness-Based Stress Reduction (MBSR) tréningeken a betegek megtanulják, hogyan figyeljék meg a jelen pillanatot azáltal, hogy együttérzéssel és ítélkezés nélkül észreveszik a fizikai érzéseiket, érzelmeiket és gondolataikat. Ebben terápiában is szükséges a beteg aktív részvétele. Ez a tudatosság megkönnyítheti a fokozott érzelmi feldolgozást és megküzdést a krónikus betegségek és a stressz hatásaival kapcsolatban, valamint javíthatja az önhatékonyságot és az irányítás érzését [228]. A PubMed szerint 2021 júliusáig 46 közlemény jelent meg a mindfulness szerepéről az IBS-ben, azonban a legtöbb vizsgálat minősége nem mindig volt optimális a résztvevők kis száma és a betegek nagyon specifikus csoportjának kiválasztása miatt. Három tanulmány egyértelmű tünet csökkenést mutatott, ami további kutatásokat igényel [229-231].
Ajánlás65
A relaxációs terápia, mint pl. a Jacobson-féle progresszív relaxáció, autogén tréning) önmagában nem javasolt az IBS kezelésére. (IIa-B, a konszenzus mértéke: 100%)
Az olyan relaxációs terápiák, mint a progresszív izomrelaxáció vagy az autogén tréning célja az érzékelt stressz csökkentése, mivel a stressz fiziológiai arousalhoz vezethet, ami tovább fokozza a szomatikus panaszokat, és negatívan befolyásolja a bél és az agy közötti kommunikációt. Egy randomizált, kontrollált vizsgálat a stresszkezelő program hatását mutatta ki a borsmentaolajjal összehasonlítva. A betegek különböző relaxációs módszereket tanultak, és 2/3-uknak sikerült csökkenteniük a fájdalomrohamokat, valamint a panaszaikat. A csökkenés 1 éves követésig fennmaradt. A gyógyszeres terápia és a progresszív izomrelaxáció összehasonlítása azt mutatta, hogy a relaxációs módszer hatékonyabban tudta csökkenteni a szorongást, a szomatikus tünetek csökkentésében azonban nem volt szignifikáns különbség. A progresszív izomrelaxációs programot 2 hónapon át otthon gyakorlóknál a gasztrointesztinális tünetek javuláshoz vezetett a csak tüneti kontrollhoz képest [232].
Ajánlás66
A stressz elkerülésére és/vagy a stresszel való megküzdésre irányuló stratégiákat egyénileg javasolt ajánlani, mint segítő intézkedéseket. (IIa-B, a konszenzus mértéke: 95%)
A stressz megelőzésére, a relaxációra és a betegséggel való megküzdésre irányuló stratégiák bizonyítottan hatékonyak az IBS kezelésében. Ha azonban fennáll a pszichoterápia szükségességének indikációja, egymagában egyik módszer sem helyettesítheti a pszichoterápiát, csak kiegészítheti azt, illetve egy multimodális terápiás program része lehet. Egyénileg is alkalmazhatók. Egy 2018-as meta-analizis kimutatta a relaxációs technikák előnyét [220]. Egy régebbi Cochrane-tanulmányban a tünetek súlyosságát illetően 2-3 hónap után mind a hasi fájdalom, mind az életminőség javulása területén átlagos hatásméreteket írtak le, azonban 6-12 hónap elteltével már ellentmondásosnak tűntek az eredmények [233].
Ajánlás67
Az IBS-s betegek stresszkezelésére javasolt a Semmelweis Egyetem Magatartástudományi Intézete által adaptált Williams Életkészségek (WÉK) tréning. (IIa-C, a konszenzus mértéke: 100%)
A Williams Életkészségek Programot az amerikai Duke Egyetem (Durham, NC, USA) vezető szakemberei, Dr. Virginia Williams és Dr. Robert Williams dolgozták ki a stresszkutatás legfrissebb eredményei alapján, több évtizedes csoportterápiás tapasztalatuk felhasználásával. A program magyar változatát a SE Magatartástudományi Intézet munkatársai adaptálták 2004-ben, azóta sikeresen alkalmazzák csoportosan és önálló tanulási program formájában is, melynek során egyszerű, a mindennapokban jól alkalmazható stratégiákat és kommunikációs technikákat lehet elsajátítani. Az IBS etiológiájában is nagy szerepe van a stressznek, így ez a 16 órás, strukturált, meghatározott egységekből álló tréning hasznos lehet azoknak, akik szeretnék eredményesebben kezelni a mindennapi életük során adódó stressz konfliktusokat, az elkerülhetetlen stresszhelyzeteket, ezáltal csökkenteni az IBS tüneteit. A technikát már több pszichoszomatikus betegségcsoport alkalmazta sikeresen, IBS-sel küzdő betegekről csak sporadikus adatok állnak egyelőre rendelkezésre, ahhoz azonban, hogy biztonságosan ajánlható legyen és jó minőségű evidenciává váljon, széles körben elérhetővé kellene tenni, és ezáltal a hatékonyságát jobban lehetne vizsgálni. A stresszkezelő tréning tartását a SE Magatartástudományi intézete által képzett facilitátorok végezhetik, akiknek nem feltétlenül kell pszichológusnak vagy pszichoterapeutának lenni, elegendő hozzá valamilyen segítő foglalkozású alapképzettség [234, 235].
A különböző pszichoterápiás eljárások és ezek eredményessége csak igen nehezen hasonlítható össze, azonban figyelembe véve azt a tényt, hogy az IBS egy igen nagyszámú beteganyagot érint, és ezáltal hatalmas terhet jelent az egészségügyi ellátó rendszerre, a pszichoterápiának mindenképpen helyet kell kapni a betegek komplex kezelésében.
Ajánlás68
Triciklusos antidepresszívumok (TCA) kis dózisban ajánlottak második vonalbeli szerként, különösen hasi fájdalommal és/vagy hasmenéssel járó IBS esetén. (I-B, a konszenzus mértéke: 100%)
Bár az IBS gyakran komorbiditást mutat major depresszióval és szorongásos zavarokkal, így az antidepresszív terápia javulást eredményez pszichés és szomatikus panaszokban egyaránt, a TCA szerek (imipramin, amitriptilin) komorbiditás nélküli esetben is hatékonyak az IBS tüneteinek kezelésében. A TCA-k csökkenteni tudják a zsigeri fájdalmat és fájdalomérzékenységet a centrális noradrenalin és dopamin receptorokon keresztül, továbbá antikolinerg hatásuk révén kedvezően hatnak a hasi fájdalomra. Terápiás dózistartományban a gasztrointesztinális tranzitidőt növelik [236]. A nemzetközi ajánlások RCT vizsgálatokra és meta-analízisekre támaszkodva egyetértenek abban, hogy kis dózisban alkalmazott TCA-k placebonál hatékonyabban csökkentik az IBS általános tüneteit. Emellett a TCA-k az antidepresszívumok között egyedüliként igazoltan csökkentik az IBS-ben fellépő hasi fájdalmat [174]. A TCA-k alkalmazását limitálják a kezelés során fellépő kellemetlen mellékhatásaik [237]. A TCA-t kapó betegek leggyakrabban álmosságra és szájszárazságra panaszkodnak [220], emellett ortosztatikus hipotenzió, látászavar, aritmia, obstipáció, szexuális diszfunkció, hízás észlelhető gyakran. Mindezek miatt a TCA-k a pszichiátriai betegségek (major depresszió, szorongásos zavarok) kezelésében már nem első választandó szerek [238], azonban IBS terápiájában hatékony másodvonalbeli szerek lehetnek, IBS-D esetén pedig obstipációs mellékhatásuk is előnyösen hasznosítható. A TCA beállítást fokozatosan érdemes végezni, kisebb dózissal indítva, lépcsőzetes emelésekkel érjük el a végső terápiás adagot, mely a hatás és a mellékhatások szempontjából optimális. IBS esetén a TCA-k adagja általában alatta marad a TCA-k depresszióban alkalmazott adagjának [239]. A TCA-k ajánlott adagjai IBS-ben: imipramin 50-100 mg, amitriptilin 50-100 mg. Az antidepresszívum mellékhatása azonnal észlelhető, terápiás hatékonysága azonban leghamarabb 4 hét után ítélhető meg, erről a latencia időről a beteget tájékoztatni kell a megfelelő compliance kialakítása érdekében. Néha a hatás a 4-8 hét között indul. A kezelést nemzetközi konszenzus alapján 6-12 hónapig érdemes folytatni. Idős betegek esetén a TCA-k alkalmazása a haszon/kockázat mérlegelésével történhet [238]. EKG-n szárblokkot vagy QT-idő megnyúlást mutató betegnek TCA adása ellenjavallt. Mindezek alapján kis dózisú TCA hatékonyan csökkentheti az IBS tüneteit pszichiátriai komorbiditás nélkül is, különösen a hasi fájdalommal járó IBS vagy IBS-D esetén. Az antidepresszívumok felírása az adott szer alkalmazási előiratában szereplő indikációk figyelembevételével történhet.
Ajánlás69
Az SSRI antidepresszívumok második vonalbeli szerként ajánlottak IBS kezelésére. (IIa-B, a konszenzus mértéke: 100%)
Az SSRI-k a szerotonin transzporter gátlásán keresztül emelik a szerotonin koncentrációt a KIR szinaptikus réseiben és a gasztrointesztinális traktusban. Az SSRI-k a KIR hatásaikon túl prokinetikus hatásúak a vékonybélben, ezáltal csökkentik a széklet tranzitidejét, emellett antiinflammatoros hatásokat közvetítenek, illetve a HPA tengely és vegetatív idegrendszer stressz efferentációit csökkentik [97]. Az SSRI-k az első választandó szerek az antidepresszív terápiákban [238], azonban alkalmazásuk az IBS terápiájában egyelőre kevés RCT vizsgálatra támaszkodhat. A legátfogóbb meta-analizis 7 RCT-re alapozva placebonál hatékonyabbnak ítélte meg az SSRI-ket az IBS terápiájában [220]. A meta-analízisben az SSRI családból citalopram, fluoxetin és paroxetin szerepelt, míg egy nemrégiben publikált kis esetszámú RCT escitalopram hatékonyságát is igazolta IBS-ben [240]. Bár az SSRI-k hatékonynak bizonyultak az IBS terápiájában, az SSRI-k hasi fájdalomra gyakorolt hatása elmarad a TCA-k fájdalmat csökkentő hatásától [174]. Az antidepresszívumok RCT vizsgálatai IBS-ben általában nem választják külön az IBS-D és IBS-C tüneti csoportokat, a farmakológiai mechanizmusok az antidepresszívum választást megkönnyíthetik: az SSRI-k csökkentik a széklet áthaladás idejét, így IBS-C esetén javasoltak, míg a TCA-k növelik a széklet áthaladás idejét, így IBS-D esetén előnyösebbek [241]. Az SSRI-k kedvezőbb mellékhatás profilúak a TCA antidepresszívumokhoz képest, leggyakrabban émelygés, fejfájás, alvászavar, szorongás fordul elő [242]. A vizsgálatokban az SSRI-k jól tolerálhatók voltak, adagjuk általában megegyezett a major depresszió és szorongásos zavarok kezelésében használt terápiás adagokkal [220]. IBS-hez társult komorbid depresszió és/vagy szorongás esetén az SSRI-k az IBS szomatikus tüneteire gyakorolt hatásukon túl a pszichés panaszokat is csökkentik, a beteg életminőségét jelentősen javítva [240, 243]. Komorbiditás esetén az SSRI-k kedvező hatása az IBS tüneteire a hangulati javulástól független tényező [244]. Az SSRI terápiát érdemes fokozatos adag emeléssel indítani. Terápiás hatás legkorábban 3-6 hét múlva ítélhető meg [238]. Komorbid depresszió esetén mérlegelendő a beteg pszichiáterhez irányítása. Az antidepresszívumok felírása az adott szer alkalmazási előiratában szereplő indikációk figyelembevételével történhet. Összefoglalva elmondható, hogy a nemzetközi ajánlások egyetértenek abban, hogy az SSRI-k előnyösebbek a TCA-knál az IBS-C típusa és komorbid depresszió vagy komorbid szorongásos zavar esetén. Előnyt jelent kedvezőbb mellékhatás profiljuk és terápiás dózisban adagolhatóságuk.
Ajánlás70
Az SNRI családba tartozó duloxetin második vonalbeli szerként ajánlott IBS kezelésére, különösen a hasi fájdalommal járó esetekben. (IIb-C, a konszenzus mértéke: 100%)
Az SNRI családba tartozó duloxetinnek 3 nyílt vizsgálata történt IBS-ben. Egy nyílt vizsgálat hatékonynak találta a duloxetint az IBS kezelésében: a tüneti súlyosság, hasi fájdalom és bél diszfunkció csökkent, az életminőség javult [245]. A duloxetin komorbid major depresszió és komorbid generalizált szorongás zavar esetén is hatékony volt 1-1 nyílt vizsgálat tanúsága szerint [246]. Egy kis esetszámú, de randomizált, kettős vak vizsgálatban mebeverine terápia mellett kaptak az IBS betegek 30 mg duloxetint vagy placebot. A duloxetin csoport szignifikáns javulást mutatott a placebo ághoz viszonyítva, a két aktív szer együtt adása jól tolerálható volt. A vizsgálati idő 12 hét volt, ennek végére a vizsgálatban résztvevők szignifikáns javulást mutattak a 4. heti állapothoz képest is, ami mutatja, hogy az antidepresszívum adását legalább 3 hónapon keresztül érdemes folytatni [247]. Egyéb fájdalommal járó kórképekben (fibromyalgia, derékfájás, diabéteszes neuropáthia) jó evidenciákkal támasztható alá az SNRI családba tartozó duloxetin hatékonysága a fájdalom csökkentésében [236], azonban a duloxetin IBS-ben jelentkező hasi fájdalomra gyakorolt hatását igazoló RCT vizsgálat még nem készült, ennek ellenére a nemzetközi gyakorlatban duloxetin adása gyakori IBS esetén. A duloxetin a vizsgálatokban jól tolerálható volt, mellékhatásként émelygés és alvászavar léphet fel és ezek a mellékhatások is a terápia első két hetében voltak legtöbbször észlelhetők [247]. A duloxetin felírása csak az alkalmazási előiratában foglaltak figyelembevételével történhet.
Ajánlás71
A jóga, mint komplementer terápiás lehetőség ajánlott az IBS kezelésében (IIb-C, a konszenzus mértéke: 100%)
A jóga egy olyan test-lélek-légzés gyakorlat, amely hagyományosan kombinálja a meditációs testtartásokat és a légzésszabályozást. A résztvevők a gyakorlat során a légzésükhöz igazítják minden mozdulatukat, ezáltal önkontrollt és relaxációt érnek el. Számos tanulmány kimutatta, hogy az irritábilis bél szindrómában szenvedő betegeknél a jóga gyakorlása csökkenti a globális tünetek súlyosságát és javítja az életminőséget [116, 248-250], A tanulmányok eredményének értékelése problémás a heterogenitásuk miatt, további vizsgálatok szükségesek a jóga hatékonyságának megítélésére az IBS tüneteinek javításában.
Ajánlás72
Súlyos vagy refrakter IBS tünetek esetén az IBS diagnózisának mihamarabbi felülvizsgálata szükséges, megfontolandó további célzott kivizsgálás elvégzése (IIb-D, a konszenzus mértéke: 100%)
Ajánlás73
Súlyos vagy refrakter IBS esetén integrált multidiszciplináris megközelítés szükséges (IIb-D, a konszenzus mértéke: 100%)
Jelenleg nem áll rendelkezésünkre pontos, konszenzus-alapú definíció a súlyos IBS-re vonatkozóan, amely egy összetett biopszichológiai állapot, különböző gasztrointesztinális és extraintesztinális tünetekkel, változó súlyosságú rokkantsággal, eltérő betegséggel kapcsolatos magatartással [251], a konvencionális kezelésre adott elégtelen válasszal [252], valamint az egészségügyi ellátórendszer fokozott igénybevételével jellemezhető [253]. A refrakter IBS hasonló, de külön entitás, melynek jellemzésére szintén nem rendelkezünk konszenzus-alapú definícióval. Refrakter IBS-ről beszélünk, amennyiben a beteg tünetei nem javulnak a kezelés hatására. Habár a nem diagnosztizált, vagy időközben progrediáló organikus betegség rizikója IBS esetén alacsony, ez az arány magasabb lehet a súlyos tünetekkel rendelkező betegekben [254], terápia refrakter esetekben a diagnózis mielőbbi revideálása szükséges, megfontolandó a további célzott kivizsgálás. Egy közelmúltban publikált tanulmány alapján az IBS ellátásának integrált megközelítése, azaz gasztroenterológus, dietetikus, klinikai szakpszichológus bevonásával történő ellátás kedvezőbb kimenetelű, a gasztroenterológus által egyedül irányított terápiához képest [223]. Súlyos, terápia refrakter esetekben referálás javasolt multidiszciplináris krónikus fájdalom team felé az optimális tünet kontroll megvalósítása céljából.
AZ IRRITÁBILIS BÉL SZINDRÓMÁS BETEGEK GONDOZÁSA
Az IBS ugyan jelentősen befolyásolja a betegek életminőségét és a szociális kapcsolatrendszerét, de önmagában nem vezet súlyos betegségek kialakulásához (pl. daganat), illetve nem befolyásolja a betegek mortalitását sem. A betegség természete miatt reguláris ellenőrzési program kidolgozását és követését nem igényli. Fontos megjegyezni azonban, hogy az IBS nem is véd organikus tápcsatornai betegségek kialakulásával szemben, az érintettek ugyanolyan eséllyel betegedhetnek meg más kórképekben, mint az átlag populáció. A megfelelő betegedukációnak ki kell térnie a fenti tények ismertetésére is. Fel kell hívni a betegek figyelmét arra, hogy a hullámzó lefolyású alapbetegségük egyébként tisztázott, "megszokott" karakterisztikáján túl fellépő bármely új keletű panasz esetén kezelőorvosukat mindenképp keressék fel [255, 256].
VII. JAVASLAT AZ AJÁNLÁSOK ALKALMAZÁSÁHOZ
1. Az alkalmazás feltételei a hazai gyakorlatban
1.1. Ellátók kompetenciája (pl. licence, akkreditáció stb.), kapacitása
Az IBS ellátása alapvetően háziorvosi, gasztroenterológiai feladatkörbe tartozik, mindemellett a komplex, interdiszciplináris betegellátásban szereppel bírnak a pszichiáter szakorvosok, pszichológusok, pszichoterápiás szakemberek, gyógytornászok és dietetikusok, illetve a komplementer medicinával foglalkozó szakemberek is. Az irányelvben lefektetett első vonalbeli diagnosztikai lépések és az ezen alapuló első terápiás teszt háziorvosi és gasztroenterológus szakorvosi kompetenciába tartoznak. Az első vizsgálatok során kiszűrt alarm tünetek alapján szükséges kivizsgálás, illetve az első terápiás teszt sikertelenségét követő további kivizsgálás és terápiás döntések a gasztroenterológus hatáskörébe tartoznak. A komplex ellátás megszervezése már az első ellátás szinten is hatékony lehet (dietetikus, esetleg pszichológus, pszichoterápiás szakember bevonása), de a komplikált esetek multidiszciplináris ellátásának koordinálása már gasztroenterológus feladata. Az IBS betegek ellátásához nem szükséges speciális licence vagy akkreditáció megszerzése.
1.2. Speciális tárgyi feltételek, szervezési kérdések (gátló és elősegítő tényezők, és azok megoldása)
Kémiai és mikrobiológiai laboratóriumi háttér, endoszkópos és radiológiai háttér rendelkezésre áll. Az esetek döntő többséges járóbeteg ellátásban ellátható, csak válogatott, bonyolult esetekben van szükség fekvőbeteg ellátó egység elérhetőségére. Az irányelvekben lefektetett célok eléréséhez a jelenlegi adottságokhoz képest szélesebb körben biztosítandó a dietetikai szolgálat igénybevételének lehetősége. A jelenlegi hazai viszonyok alapján mindenképp javítandó az IBS betegek részére a pszichoterápiás lehetőségek elérhetősége. A felnőtt háziorvosi ellátában a diagnosztikai lehetőségek korlátozottak. A gasztroenterológiai kórképek gyanúja esetén lehetőség van általános vérvizsgálatok elvégzésére, széklet bakteriológiai vizsgálatra, okkult vér kimutatására, azonban a széklet kalprotektin vizsgálat a társadalombiztosító által nem finanszírozott, illetve a coeliakia szerológiai vizsgálat az alapellátásban nem végezhető el. A dietetikai tanácsadás és a pszichoterápia elérhetősége erősen korlátozott a háziorvosi praxisokban.
Magyarországon a tápcsatornai motilitási vizsgálatokat és az ezekhez kapcsolódó terápiás intervenciókat végző központok száma alacsony, a lakosság számához mért diagnosztikai és terápiás igényeket nem fedi le. Az IBS kezelésére számos, részben az EU-n belül már hozzáférhető, bizonyítottan hatékony gyógyszer hazánkban közforgalomban jelenleg nem érhető el.
1.3. Az ellátottak egészségügyi tájékozottsága, szociális és kulturális körülményei, egyéni elvárásai
Az egészségügyi szakmai irányelv a magyarországi felnőtt populáció ellátására vonatkozik, speciális egyéni elvárás nincs.
1.4. Egyéb feltételek
Egyéb feltétel nincs.
2.Alkalmazást segítő dokumentumok listája
2.1. Betegtájékoztató, oktatási anyagok
Nem készültek.
2.2. Tevékenységsorozat elvégzésekor használt ellenőrző kérdőívek, adatlapok
Nem készültek.
2.3. Táblázatok
Lásd 1., 2. és 3. ábra
1. ábra: Róma IV. kritériumok az IBS diagnózisának felállítására [2]
2. ábra: A széklet formájának osztályozása a Bristol skála alapján [6]
3. ábra: Az IBS terápiás lépcsői [11]
2.4. Algoritmusok
Lásd 4. és 5. ábra
4. ábra: Az IBS terápiás algoritmusa - A Brit Gasztroenterológiai Társaság terápiás algoritmusának az egészségügyi szakmai irányelvet fejlesztő bizottság által a hazai viszonyokra adaptált változata
5. ábra: Az IBS diagnosztikájának algoritmusa - az egészségügyi szakmai irányelvet fejlesztő bizottság saját szerkesztése
2.5. Egyéb dokumentumok
Nem készültek.
3. A gyakorlati alkalmazás mutatói, audit kritériumok
Ajánlás1
Az IBS diagnózisának felállításához javasolt a Róma IV. kritériumok használata. (IIb -C, konszenzus mértéke: 100%)
Mérendő: Az IBS tüneteivel jelentkező betegek első vizsgálata során az alapellátásban a vizsgált esetetek hány %-ában alkalmazták a Róma IV. kritériumokat a diagnózis felállításához? Minimum standard: nem került megállapításra. Célértrék: 100%
Ajánlás4
Alarm tünet a manifeszt vagy okkult tápcsatornai vérzés (pozitív széklet okkult vérteszt vagy microcytaer vashiányos anaemia), a szignifikáns testsúlycsökkenés (6 hónap alatt a testtömeg >10%-a), az éjszaka is jelentkező, alvásból ébresztő tünetek, a tartós láz, a korábbi krónikus tünetcsoport megváltozása, a progrediáló hasi fájdalom, a pozitív családi anamnézis organikus tápcsatornai kórképek irányában és az 50 év feletti életkor. Alarm tünet vagy tünetek fennállása esetén a tüneteknek megfelelő differenciál diagnosztikai lépések elvégzése szükséges! (I-B, konszenzus mértéke: 100%)
Mérendő: Az IBS tüneteivel jelentkező betegek első vizsgálata során az alapellátásban a vizsgált esetek hány %-ában történt meg az alarm tünetek felmérése és alarm tünetek fennállása esetén a betegek hány %-ában történt meg a gasztroenterológiára történő beutalás.
Minimum standard: nem került megállapításra. Célérték: 100-100%
Ajánlás5
A részletes anamnézis felvétel és általános fizikális vizsgálat mellett első alkalommal javasolt laboratóriumi vizsgálat elvégzése, mely tartalmazza a vércukor, a vesefunkció és a májfunkció vizsgálatát, vérkép, CRP és TSH szérum szint mérést. (I-B, konszenzus mértéke: 89%)
Mérendő: Az IBS tüneteivel jelentkező betegek kivizsgálásának első lépcsőjében az alapellátásban az alarm tünet nélküli betegek hány %-ában történnek meg a javasolt tájékozódó vizsgálatok. Minimum standard: nem került megállapításra. Célérték: 100%
Ajánlás6
A glutén szenzitív enteropathia kizárásához szerológiai vizsgálat (TTG IgA) elvégzése szükséges. (I-B, konszenzus mértéke: 100%)
Mérendő: A vizsgált esetek hány %-ában történt meg a glutén szenzitív enteropathia kizárásához szerológiai vizsgálat (TTG IgA)?
Minimum standard: nem került megállapításra. Célérték: 100%
Ajánlás30
Minden irritábilis bél szindrómás beteget javasolt első vonalban étrendi tanácsadásban részesíteni. (I-C, a konszenzus mértéke: 100%)
Mérendő: A vizsgált esetek hány %-ában történt meg az irritábilis bél szindrómás betegeknekjavasolt első vonalbeli étrendi tanácsadás?
Minimum standard: nem került megállapításra. Célérték: 100%
Az IBS diagnózisának felállítása pozitív diagnosztikai megközelítés alapján történik. Amennyiben az anamnézis felvétel alapján beteg tünetei megfelelnek az IBS kritériumainak és az anamnézis, részletes fizikális vizsgálat és néhány limitált, alapvető diagnosztikai lépés alapján alarm eltérések nem állnak fenn, a betegség diagnózisa felállítható és a terápia megkezdhető.
Mérendő: Alarm tünetek hiányában és a limitált diagnosztikai tesztek negativitása esetén az életmódi és dietetikai változtatásokra nem reagáló IBS betegek hány %-ában történt meg az alapellátásban a vezető tünetekre fókuszáló első vonalbeli gyógyszeres terápiás teszt?
Minimum standard: nem került megállapításra. Célérték: 100%
VIII. IRÁNYELV FELÜLVIZSGÁLATÁNAK TERVE
Az egészségügyi szakmai irányelv tervezett felülvizsgálata 3 évenként történik. A felülvizsgálat folyamata, az érvényesség lejárta előtt fél évvel kezdődik el. Az egészségügyi szakmai irányelvek felülvizsgálatát általában az ajánlások alátámasztását biztosító bizonyítékokban bekövetkezett változás, vagy a jogszabályokban, a hazai ellátórendszerben, körülményekben bekövetkezett változás indokolja.
Az Egészségügyi Szakmai Kollégium Gasztroenterológia és Hepatológia Tagozat elnöke kijelöli a tartalomfejlesztő felelőst, aki meghatározza a fejlesztő munkacsoport tagjait, illetve befogadja a társtagozatok által delegált szakértőket. Az aktuális egészségügyi szakmai irányelv kidolgozásában résztvevő, fejlesztő csoporttagok folyamatosan követik a szakirodalomban megjelenő, illetve a hazai ellátó környezetben bekövetkező változásokat. A tudományos bizonyítékokban, valamint az ellátókörnyezetben bekövetkező jelentős változás esetén a fejlesztő munkacsoport konszenzus alapján dönt a hivatalos változtatás kezdeményezéséről és annak mértékéről.
Soron kívüli felülvizsgálat: ha a szakirodalom és az ellátási eredmények folyamatos nyomon követése során az egészségügyi szakmai irányelv hatókörében a tudományos és/vagy tapasztalati bizonyítékokban és/vagy a hazai ellátórendszerben, ellátási körülményekben releváns és szignifikáns változás következik be, az egészségügyi szakmai irányelvben meghatározott időpontnál korábban kell elvégezni annak bizonyos mértékű felülvizsgálatát. A felülvizsgálat mértékét a felmerülő változás jellege és mértéke határozza meg.
Ha a soron kívüli felülvizsgálat csak bizonyos ajánlásokat érintett, és az egész egészségügyi szakmai irányelv felülvizsgálata nem történt meg, akkor a tervezett időpontban a teljes körű felülvizsgálatot is el kell végezni.
IX. IRODALOM
[1.] Guyatt, G.H., et al., GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. Bmj, 2008. 336(7650): p. 924-6.
[2.] Mearin, F., et al., Bowel Disorders. Gastroenterology, 2016.
[3.] Sperber, A.D., et al., Worldwide Prevalence and Burden of Functional Gastrointestinal Disorders, Results of Rome Foundation Global Study. Gastroenterology, 2021. 160(1): p. 99-114.e3.
[4.] Maxion-Bergemann, S., et al., Costs of irritable bowel syndrome in the UK and US. Pharmacoeconomics, 2006. 24(1): p. 21-37.
[5.] Talley, N.J., What Causes Functional Gastrointestinal Disorders? A Proposed Disease Model. Official journal of the American College of Gastroenterology | ACG, 2020. 115(1).
[6.] Lewis, S.J. and K.W. Heaton, Stool form scale as a useful guide to intestinal transit time. Scand J Gastroenterol, 1997. 32(9): p. 920-4.
[7.] Spiegel, B.M., et al., Measuring symptoms in the irritable bowel syndrome: development of a framework for clinical trials. Aliment Pharmacol Ther, 2010. 32(10): p. 1275-91.
[8.] Palsson, O.S., et al., Rome IV Diagnostic Questionnaires and Tables for Investigators and Clinicians. Gastroenterology, 2016.
[9.] Ford, A.C., B.E. Lacy, and N.J. Talley, Irritable Bowel Syndrome. N Engl J Med, 2017. 376(26): p. 2566-2578.
[10.] Vandvik, P.O., et al., Comorbidity of irritable bowel syndrome in general practice: a striking feature with clinical implications. Aliment Pharmacol Ther, 2004. 20(10): p. 1195-203.
[11.] Khan, S. and L. Chang, Diagnosis and management of IBS. Nat Rev Gastroenterol Hepatol, 2010. 7(10): p. 565-81.
[12.] Begtrup, L.M., et al., A positive diagnostic strategy is noninferior to a strategy of exclusion for patients with irritable bowel syndrome. Clin Gastroenterol Hepatol, 2013. 11(8): p. 956-62.e1.
[13.] Spiegel, B.M., et al., Is irritable bowel syndrome a diagnosis of exclusion?: a survey of primary care providers, gastroenterologists, and IBS experts. Am J Gastroenterol, 2010. 105(4): p. 848-58.
[14.] Vanner, S.J., et al., Predictive value of the Rome criteria for diagnosing the irritable bowel syndrome. Am J Gastroenterol, 1999. 94(10): p. 2912-7.
[15.] Whitehead, W.E., et al., Utility of red flag symptom exclusions in the diagnosis of irritable bowel syndrome. Aliment Pharmacol Ther, 2006. 24(1): p. 137-46.
[16.] Patel, P., et al., Prevalence of organic disease at colonoscopy in patients with symptoms compatible with irritable bowel syndrome: cross-sectional survey. Scand J Gastroenterol, 2015. 50(7): p. 816-23.
[17.] Black, T.P., C.S. Manolakis, and J.A. Di Palma, "Red flag" evaluation yield in irritable bowel syndrome. J Gastrointestin Liver Dis, 2012. 21(2): p. 153-6.
[18.] Black, C.J., et al., Comparison of the Rome IV criteria with the Rome III criteria for the diagnosis of irritable bowel syndrome in secondary care. Gut, 2021. 70(6): p. 1110-1116.
[19.] Hookway, C., et al., Irritable bowel syndrome in adults in primary care: summary of updated NICE guidance. Bmj, 2015. 350: p. h701.
[20.] Menees, S.B., et al., A meta-analysis of the utility of C-reactive protein, erythrocyte sedimentation rate, fecal calprotectin, and fecal lactoferrin to exclude inflammatory bowel disease in adults with IBS. Am J Gastroenterol, 2015. 110(3): p. 444-54.
[21.] Henriksen, M., et al., C-reactive protein: a predictive factor and marker of inflammation in inflammatory bowel disease. Results from a prospective population-based study. Gut, 2008. 57(11): p. 1518-23.
[22.] Maser, C., A. Toset, and S. Roman, Gastrointestinal manifestations of endocrine disease. World J Gastroenterol, 2006. 12(20): p. 3174-9.
[23.] Kramer, S., et al., Commonly used biomarkers do not contribute to diagnosing irritable bowel syndrome. Eur J Gastroenterol Hepatol, 2022. 34(3): p. 302-307.
[24.] Ford, A.C., et al., Yield of diagnostic tests for celiac disease in individuals with symptoms suggestive of irritable bowel syndrome: systematic review and meta-analysis. Arch Intern Med, 2009. 169(7): p. 651-8.
[25.] Irvine, A.J., W.D. Chey, and A.C. Ford, Screening for Celiac Disease in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-analysis. Am J Gastroenterol, 2017. 112(1): p. 65-76.
[26.] Catassi, C., et al., Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts' Criteria. Nutrients, 2015. 7(6): p. 4966-77.
[27.] Schoepfer, A.M., et al., Discriminating IBD from IBS: comparison of the test performance of fecal markers, blood leukocytes, CRP, and IBD antibodies. Inflamm Bowel Dis, 2008. 14(1): p. 32-9.
[28.] Carrasco-Labra, A., et al., AGA Technical Review on the Evaluation of Functional Diarrhea and Diarrhea-Predominant Irritable Bowel Syndrome in Adults (IBS-D). Gastroenterology, 2019. 157(3): p. 859-880.
[29.] van Rheenen, P.F., E. Van de Vijver, and V. Fidler, Faecal calprotectin for screening of patients with suspected inflammatory bowel disease: diagnostic meta-analysis. Bmj, 2010. 341: p. c3369.
[30.] Klem, F., et al., Prevalence, Risk Factors, and Outcomes of Irritable Bowel Syndrome After Infectious Enteritis: A Systematic Review and Meta-analysis. Gastroenterology, 2017. 152(5): p. 1042-1054.e1.
[31.] O'Connor, O.J., et al., Role of radiologic imaging in irritable bowel syndrome: evidence-based review. Radiology, 2012. 262(2): p. 485-94.
[32.] Maconi, G., et al., Gastrointestinal Ultrasound in Functional Disorders of the Gastrointestinal Tract - EFSUMB Consensus Statement. Ultrasound Int Open, 2021. 7(1): p. E14-e24.
[33.] Goff, B.A., et al., Frequency of symptoms of ovarian cancer in women presenting to primary care clinics. Jama, 2004. 291 (22): p. 2705-12.
[34.] Behtash, N., E. Ghayouri Azar, and F. Fakhrejahani, Symptoms of ovarian cancer in young patients 2 years before diagnosis, a case-control study. Eur J Cancer Care (Engl), 2008. 17(5): p. 483-7.
[35.] Chey, W.D., et al., The yield of colonoscopy in patients with non-constipated irritable bowel syndrome: results from a prospective, controlled US trial. Am J Gastroenterol, 2010. 105(4): p. 859-65.
[36.] Ishihara, S., et al., Prevalence of organic colonic lesions in patients meeting Rome III criteria for diagnosis of IBS: a prospective multi-center study utilizing colonoscopy. J Gastroenterol, 2012. 47(10): p. 1084-90.
[37.] Kamp, E.J., J.S. Kane, and A.C. Ford, Irritable Bowel Syndrome and Microscopic Colitis: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol, 2016. 14(5): p. 659-68.e1; quiz e54-5.
[38.] Guagnozzi, D., Á. Arias, and A.J. Lucendo, Systematic review with meta-analysis: diagnostic overlap of microscopic colitis and functional bowel disorders. Aliment Pharmacol Ther, 2016. 43(8): p. 851-862.
[39.] Miehlke, S., et al., European guidelines on microscopic colitis: United European Gastroenterology and European Microscopic Colitis Group statements and recommendations. United European Gastroenterol J, 2021. 9(1): p. 13-37.
[40.] Macaigne, G., et al., Microscopic colitis or functional bowel disease with diarrhea: a French prospective multicenter study. Am J Gastroenterol, 2014. 109(9): p. 1461-70.
[41.] Kane, J.S., et al., Development and validation of a scoring system to identify patients with microscopic colitis. Clin Gastroenterol Hepatol, 2015. 13(6): p. 1125-31.
[42.] Young, E., et al., A population study of food intolerance. Lancet, 1994. 343(8906): p. 1127-30.
[43.] Pereira, B., et al., Prevalence of sensitization to food allergens, reported adverse reaction to foods, food avoidance, and food hypersensitivity among teenagers. J Allergy Clin Immunol, 2005. 116(4): p. 884-92.
[44.] Zuberbier, T., et al., Prevalence of adverse reactions to food in Germany - a population study. Allergy, 2004. 59(3): p. 338-45.
[45.] Lacy, B.E., et al., Irritable bowel syndrome: patients' attitudes, concerns and level of knowledge. Aliment Pharmacol Ther, 2007. 25(11): p. 1329-41.
[46.] Böhn, L., et al., Self-reported food-related gastrointestinal symptoms in IBS are common and associated with more severe symptoms and reduced quality of life. Am J Gastroenterol, 2013. 108(5): p. 634-41.
[47.] Monsbakken, K.W., P.O. Vandvik, and P.G. Farup, Perceived food intolerance in subjects with irritable bowel syndrome-- etiology, prevalence and consequences. Eur J Clin Nutr, 2006. 60(5): p. 667-72.
[48.] Leeds, J.S., et al., Some patients with irritable bowel syndrome may have exocrine pancreatic insufficiency. Clin Gastroenterol Hepatol, 2010. 8(5): p. 433-8.
[49.] Talley, N.J., et al., Undiagnosed pancreatic exocrine insufficiency and chronic pancreatitis in functional GI disorder patients with diarrhea or abdominal pain. J Gastroenterol Hepatol, 2017. 32(11): p. 1813-1817.
[50.] Arasaradnam, R.P., et al., Guidelines for the investigation ofchronic diarrhoea in adults: British Society of Gastroenterology, 3rd edition. Gut, 2018. 67(8): p. 1380-1399.
[51.] Yu, D., F. Cheeseman, and S. Vanner, Combined oro-caecal scintigraphy and lactulose hydrogen breath testing demonstrate that breath testing detects oro-caecal transit, not small intestinal bacterial overgrowth in patients with IBS. Gut, 2011. 60(3): p. 334-40.
[52.] Pimentel, M., et al., Rifaximin therapy for patients with irritable bowel syndrome without constipation. N Engl J Med, 2011. 364(1): p. 22-32.
[53.] Ghoshal, U.C., et al., Breath tests in the diagnosis of small intestinal bacterial overgrowth in patients with irritable bowel syndrome in comparison with quantitative upper gut aspirate culture. Eur J Gastroenterol Hepatol, 2014. 26(7): p. 753-60.
[54.] Atkinson, W., et al., Food elimination based on IgG antibodies in irritable bowel syndrome: a randomised controlled trial. Gut, 2004. 53(10): p. 1459-64.
[55.] Sattler, J., et al., Food-induced histaminosis as an epidemiological problem: plasma histamine elevation and haemodynamic alterations after oral histamine administration and blockade of diamine oxidase (DAO). Agents Actions, 1988. 23(3-4): p. 361-5.
[56.] Music, E., et al., Serum diamine oxidase activity as a diagnostic test for histamine intolerance. Wien Klin Wochenschr, 2013. 125(9-10): p. 239-43.
[57.] Maintz, L. and N. Novak, Histamine and histamine intolerance. Am J Clin Nutr, 2007. 85(5): p. 1185-96.
[58.] Suttor, V.P., et al., Evidence for pelvic floor dyssynergia in patients with irritable bowel syndrome. Dis Colon Rectum, 2010. 53(2): p. 156-60.
[59.] Prott, G., et al., Relationships between pelvic floor symptoms and function in irritable bowel syndrome. Neurogastroenterol Motil, 2010. 22(7): p. 764-9.
[60.] Whitehead, W.E., O.S. Palsson, and M. Simrén, Biomarkers to distinguish functional constipation from irritable bowel syndrome with constipation. Neurogastroenterol Motil, 2016. 28(6): p. 783-92.
[61.] Prior, A., D.G. Maxton, and P.J. Whorwell, Anorectal manometry in irritable bowel syndrome: differences between diarrhoea and constipation predominant subjects. Gut, 1990. 31 (4): p. 458-62.
[62.] Rao, S.S., et al., Long-term efficacy of biofeedback therapy for dyssynergic defecation: randomized controlled trial. Am J Gastroenterol, 2010. 105(4): p. 890-6.
[63.] Corsetti, M., et al., Chronic constipation in adults: Contemporary perspectives and clinical challenges. 2: Conservative, behavioural, medical and surgical treatment. Neurogastroenterol Motil, 2021. 33(7): p. e14070.
[64.] Barbara, G., et al., Italian guidelines for the management of irritable bowel syndrome: Joint Consensus from the Italian Societies of: Gastroenterology and Endoscopy (SIGE), Neurogastroenterology and Motility (SINGEM), Hospital Gastroenterologists and Endoscopists (AIGO), Digestive Endoscopy (SIED), General Medicine (SIMG), Gastroenterology, Hepatology and Pediatric Nutrition (SIGENP) and Pediatrics (SIP). Dig Liver Dis, 2023. 55(2): p. 187-207.
[65.] Rodino-Janeiro, B.K., et al., A Review of Microbiota and Irritable Bowel Syndrome: Future in Therapies. Adv Ther, 2018. 35(3): p. 289-310.
[66.] Dahlqvist, G. and H. Piessevaux, Irritable bowel syndrome: the role of the intestinal microbiota, pathogenesis and therapeutic targets. Acta Gastroenterol Belg, 2011. 74(3): p. 375-80.
[67.] Camilleri, M., H. Halawi, and I. Oduyebo, Biomarkers as a diagnostic tool for irritable bowel syndrome: where are we? Expert Rev Gastroenterol Hepatol, 2017. 11 (4): p. 303-316.
[68.] Mars, R.A.T., et al., Longitudinal Multi-omics Reveals Subset-Specific Mechanisms Underlying Irritable Bowel Syndrome. Cell, 2020. 182(6): p. 1460-1473.e17.
[69.] Valentin, N., et al., Biomarkers for bile acid diarrhoea in functional bowel disorder with diarrhoea: a systematic review and meta-analysis. Gut, 2016. 65(12): p. 1951-1959.
[70.] Whitehead, W.E. and O.S. Palsson, Is rectal pain sensitivity a biological marker for irritable bowel syndrome: psychological influences on pain perception. Gastroenterology, 1998. 115(5): p. 1263-71.
[71.] Lembo, A.J., et al., Use of serum biomarkers in a diagnostic test for irritable bowel syndrome. Aliment Pharmacol Ther, 2009. 29(8): p. 834-42.
[72.] Aerssens, J., et al., Alterations in mucosal immunity identified in the colon of patients with irritable bowel syndrome. Clin Gastroenterol Hepatol, 2008. 6(2): p. 194-205.
[73.] Mujagic, Z., et al., A novel biomarker panel for irritable bowel syndrome and the application in the general population. Sci Rep, 2016. 6: p. 26420.
[74.] Parsons, K., et al., Novel Testing Enhances Irritable Bowel Syndrome Medical Management: The IMMINENT Study. Glob Adv Health Med, 2014. 3(3): p. 25-32.
[75.] Pimentel, M., et al., Development and validation of a biomarker for diarrhea-predominant irritable bowel syndrome in human subjects. PLoS One, 2015. 10(5): p. e0126438.
[76.] Roenneberg C., S.H., Schafert R., Henningsen P., Hausteiner-Wiehle C., Funktionelle Körperbeschwerden. DTSCH ARZTEBL INT, 2019. 116: p. 553-560.
[77.] Herrmann-Lingen, C., U. Buss, and R.P. Snaith, HADS-D: Hospital Anxiety and Depression Scale: deutsche Version. 3., aktual. und neu normierte Aufl ed. 2011, Bern: Huber.
[78.] Berth, H., B. Löwe, R.L. Spitzer, S. Zipfel & W. Herzog: PHQ-D. Gesundheitsfragebogen für Patienten. Zeitschrift für Medizinische Psychologie, 2003. 12(2): p. 90-93.
[79.] Palsson, O.S. and W.E. Whitehead, Psychological treatments in functional gastrointestinal disorders: a primer for thegastroenterologist. Clin Gastroenterol Hepatol, 2013. 11(3): p. 208-16; quiz e22-3.
[80.] Hinz, A., et al., Hospital Anxiety and Depression Scale - Deutsche Version(HADS-D). Diagnostica, 2002. 48: p. 112-113.
[81.] Chitkara, D.K., et al., Early life risk factors that contribute to irritable bowel syndrome in adults: a systematic review. Am J Gastroenterol, 2008. 103(3): p. 765-74; quiz 775.
[82.] Ng, Q.X., et al., Systematic review with meta-analysis: The association between post-traumatic stress disorder and irritable bowel syndrome. J Gastroenterol Hepatol, 2019. 34(1): p. 68-73.
[83.] Cohen, H., et al., Post-traumatic stress disorder and other co-morbidities in a sample population of patients with irritable bowel syndrome. Eur J Intern Med, 2006. 17(8): p. 567-71.
[84.] Fischer, G., P. Riedesser, and A.G. Fischer, Lehrbuch der psychotraumatologie. 2020: Ernst Reinhardt Verlag München.
[85.] Balint, M., Az orvos, a betege és a betegség. Akadémiai Kiadó, Budapest, 1961.
[86.] Kjeldmand, D., I. Holmström, and U. Rosenqvist, Balint training makes GPs thrive better in their job. Patient Educ Couns, 2004. 55(2): p. 230-5.
[87.] Freyberger, H. and L. Besser, Teaching psychosomatic medicine with special reference to the Balint group and the case supervision group. Psychother Psychosom, 1982. 38(1): p. 239-43.
[88.] Torppa, M.A., et al., A qualitative analysis of student Balint groups in medical education: contexts and triggers of case presentations and discussion themes. Patient Educ Couns, 2008. 72(1): p. 5-11.
[89.] Van Roy, K., S. Vanheule, and R. Inslegers, Research on Balint groups: A literature review. Patient Educ Couns, 2015. 98(6): p. 685-94.
[90.] Wang, X.J., et al., Comorbid extra-intestinal central sensitization conditions worsen irritable bowel syndrome in primary care patients. Neurogastroenterol Motil, 2023. 35(4): p. e14546.
[91.] Ohlsson, B., Extraintestinal manifestations in irritable bowel syndrome: A systematic review. Therap Adv Gastroenterol, 2022. 15: p. 17562848221114558.
[92.] Fond, G., et al., Anxiety and depression comorbidities in irritable bowel syndrome (IBS): a systematic review and meta-analysis. Eur Arch Psychiatry Clin Neurosci, 2014. 264(8): p. 651-60.
[93.] Zamani, M., S. Alizadeh-Tabari, and V. Zamani, Systematic review with meta-analysis: the prevalence of anxiety and depression in patients with irritable bowel syndrome. Aliment Pharmacol Ther, 2019. 50(2): p. 132-143.
[94.] Surdea-Blaga, T., A. Bäban, and D.L. Dumitrascu, Psychosocial determinants of irritable bowel syndrome. World J Gastroenterol, 2012. 18(7): p. 616-26.
[95.] Hu, Z., et al., The level and prevalence of depression and anxiety among patients with different subtypes of irritable bowel syndrome: a network meta-analysis. BMC Gastroenterol, 2021. 21(1): p. 23.
[96.] Vahora, I.S., et al., How Serotonin Level Fluctuation Affects the Effectiveness of Treatment in Irritable Bowel Syndrome. Cureus, 2020. 12(8): p. e9871.
[97.] Mudyanadzo, T.A., et al., Irritable Bowel Syndrome and Depression: A Shared Pathogenesis. Cureus, 2018. 10(8): p. e3178.
[98.] Midenfjord, I., et al., Anxiety and depression in irritable bowel syndrome: Exploring the interaction with other symptoms and pathophysiology using multivariate analyses. Neurogastroenterol Motil, 2019. 31(8): p. e13619.
[99.] Ringstrom, G., et al., The importance of a person-centered approach in diagnostic workups of patients with irritable bowel syndrome: a qualitative study. Gastroenterol Nurs, 2013. 36(6): p. 443-51.
[100.] Black, C.J., et al., Functional gastrointestinal disorders: advances in understanding and management. Lancet, 2020. 396(10263): p. 1664-1674.
[101.] Sibelli, A., et al., Patients' perspectives on GP interactions after cognitive behavioural therapy for refractory IBS: a qualitative study in UK primary and secondary care. Br J Gen Pract, 2018. 68(674): p. e654-e662.
[102.] Jakobsson Ung, E., et al., How patients with long-term experience of living with irritable bowel syndrome manage illness in daily life: a qualitative study. Eur J Gastroenterol Hepatol, 2013. 25(12): p. 1478-83.
[103.] Bertram, S., et al., The patient's perspective of irritable bowel syndrome. J Fam Pract, 2001. 50(6): p. 521-5.
[104.] Hákanson, C., Everyday life, healthcare, and self-care management among people with irritable bowel syndrome: an integrative review of qualitative research. Gastroenterol Nurs, 2014. 37(3): p. 217-25.
[105.] Casiday, R.E., et al., Patients' explanatory models for irritable bowel syndrome: symptoms and treatment more important than explaining aetiology. Fam Pract, 2009. 26(1): p. 40-7.
[106.] Farndale, R. and L. Roberts, Long-term impact of irritable bowel syndrome: a qualitative study. Prim Health Care Res Dev, 2011. 12(1): p. 52-67.
[107.] Teasdale, E., et al., Online forum users' views and experiences of managing irritable bowel syndrome: a qualitative analysis of discussion content. BJGP Open, 2020. 4(5).
[108.] Johannesson, E., et al., Physical activity improves symptoms in irritable bowel syndrome: a randomized controlled trial. Am J Gastroenterol, 2011. 106(5): p. 915-22.
[109.] Johannesson, E., et al., Intervention to increase physical activity in irritable bowel syndrome shows long-term positive effects. World J Gastroenterol, 2015. 21 (2): p. 600-8.
[110.] WHO Guideline. Physical Activity. Updated 5 October 2022. https://www.who.int/news-room/fact-sheets/ detail/ physical-activity (accessed on 18 March 2023) 2022.
[111.] General Priciple of Exercise Prescription in: ACSM's Guidelines for Exercise Testing ans Prescription. https://www. acsm.org/education-resources/books/guidelines-exercise-testing-prescription, 2022(11th): p. 142-165.
[112.] Sadeghian, M., et al., Physical activity in relation to irritable bowel syndrome among Iranian adults. PLoS One, 2018. 13(10): p. e0205806.
[113.] Daley, A.J., et al., The effects of exercise upon symptoms and quality of life in patients diagnosed with irritable bowel syndrome: a randomised controlled trial. Int J Sports Med, 2008. 29(9): p. 778-82.
[114.] Ford, A.C., et al., American College of Gastroenterology Monograph on Management of Irritable Bowel Syndrome. Am J Gastroenterol, 2018. 113(Suppl 2): p. 1-18.
[115.] Radziszewska, M., J. Smarkusz-Zarzecka, and L. Ostrowska, Nutrition, Physical Activity and Supplementation in Irritable Bowel Syndrome. Nutrients, 2023. 15(16).
[116.] Shahabi, L., B.D. Naliboff, and D. Shapiro, Self-regulation evaluation of therapeutic yoga and walking for patients with irritable bowel syndrome: a pilot study. Psychol Health Med, 2016. 21(2): p. 176-88.
[117.] National Institute for Health and Care Excellence: Guidelines, in Irritable bowel syndrome in adults: diagnosis and management. 2017, National Institute for Health and Care Excellence (NICE) Copyright © NICE 2018.: London.
[118.] Simrén, M., et al., Food-related gastrointestinal symptoms in the irritable bowel syndrome. Digestion, 2001. 63(2): p. 108-15.
[119.] McKenzie, Y.A., et al., British Dietetic Association systematic review and evidence-based practice guidelines for the dietary management of irritable bowel syndrome in adults (2016 update). J Hum Nutr Diet, 2016. 29(5): p. 549-75.
[120.] Moayyedi, P., et al., The Effect of Dietary Intervention on Irritable Bowel Syndrome: A Systematic Review. Clin Transl Gastroenterol, 2015. 6(8): p. e107.
[121.] Bijkerk, C.J., et al., Systematic review: the role of different types of fibre in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther, 2004. 19(3): p. 245-51.
[122.] Parisi, G.C., et al., High-fiber diet supplementation in patients with irritable bowel syndrome (IBS): a multicenter, randomized, open trial comparison between wheat bran diet and partially hydrolyzed guar gum (PHGG). Dig Dis Sci, 2002. 47(8): p. 1697-704.
[123.] Nagarajan, N., et al., The role of fiber supplementation in the treatment of irritable bowel syndrome: a systematic review and meta-analysis. Eur J Gastroenterol Hepatol, 2015. 27(9): p. 1002-10.
[124.] Moayyedi, P., et al., The effect of fiber supplementation on irritable bowel syndrome: a systematic review and meta-analysis. Am J Gastroenterol, 2014. 109(9): p. 1367-74.
[125.] Anti, M., et al., Water supplementation enhances the effect of high-fiber diet on stool frequency and laxative consumption in adult patients with functional constipation. Hepatogastroenterology, 1998. 45(21): p. 727-32.
[126.] Rao, S.S., S. Yu, and A. Fedewa, Systematic review: dietary fibre and FODMAP-restricted diet in the management of constipation and irritable bowel syndrome. Aliment Pharmacol Ther, 2015. 41(12): p. 1256-70.
[127.] Eswaran, S.L., et al., A Randomized Controlled Trial Comparing the Low FODMAP Diet vs. Modified NICE Guidelines in US Adults with IBS-D. Am J Gastroenterol, 2016. 111(12): p. 1824-1832.
[128.] Halmos, E.P., et al., A diet low in FODMAPs reduces symptoms of irritable bowel syndrome. Gastroenterology, 2014. 146(1): p. 67-75.e5.
[129.] Black, C.J., H.M. Staudacher, and A.C. Ford, Efficacy of a low FODMAP diet in irritable bowel syndrome: systematic review and network meta-analysis. Gut, 2022. 71(6): p. 1117-1126.
[130.] Dionne, J., et al., A Systematic Review and Meta-Analysis Evaluating the Efficacy of a Gluten-Free Diet and a Low FODMAPs Diet in Treating Symptoms of Irritable Bowel Syndrome. Am J Gastroenterol, 2018. 113(9): p. 1290-1300.
[131.] Rej, A., et al., The role of diet in irritable bowel syndrome: implications for dietary advice. J Intern Med, 2019. 286(5): p. 490-502.
[132.] Biesiekierski, J.R., et al., No effects of gluten in patients with self-reported non-celiac gluten sensitivity after dietary reduction of fermentable, poorly absorbed, short-chain carbohydrates. Gastroenterology, 2013. 145(2): p. 320-328. e3.
[133.] Skodje, G.I., et al., Fructan, rather than gluten, induces symptoms in patients with self-reported non-celiac gluten sensitivity. Gastroenterology, 2018. 154(3): p. 529-539. e2.
[134.] Lembo, A., et al., Repeat Treatment With Rifaximin Is Safe and Effective in Patients With Diarrhea-Predominant Irritable Bowel Syndrome. Gastroenterology, 2016. 151(6): p. 1113-1121.
[135.] Pimentel, M., et al., Repeat Rifaximin for Irritable Bowel Syndrome: No Clinically Significant Changes in Stool Microbial Antibiotic Sensitivity. Dig Dis Sci, 2017. 62(9): p. 2455-2463.
[136.] Rezaie, A., et al., Lactulose Breath Testing as a Predictor of Response to Rifaximin in Patients With Irritable Bowel Syndrome With Diarrhea. Am J Gastroenterol, 2019. 114(12): p. 1886-1893.
[137.] Schoenfeld, P., et al., Safety and tolerability of rifaximin for the treatment of irritable bowel syndrome without constipation: a pooled analysis of randomised, double-blind, placebo-controlled trials. Aliment Pharmacol Ther, 2014. 39(10): p. 1161-8.
[138.] Menees, S.B., et al., The efficacy and safety of rifaximin for the irritable bowel syndrome: a systematic review and meta-analysis. Am J Gastroenterol, 2012. 107(1): p. 28-35; quiz 36.
[139.] Black, C.J., et al., Efficacy of pharmacological therapies in patients with IBS with diarrhoea or mixed stool pattern: systematic review and network meta-analysis. Gut, 2020. 69(1): p. 74-82.
[140.] Fodor, A.A., et al., Rifaximin is associated with modest, transient decreases in multiple taxa in the gut microbiota of patients with diarrhoea-predominant irritable bowel syndrome. Gut Microbes, 2019. 10(1): p. 22-33.
[141.] Ford, A.C., et al., Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther, 2018. 48(10): p. 1044-1060.
[142.] Tiequn, B., C. Guanqun, and Z. Shuo, Therapeutic effects of Lactobacillus in treating irritable bowel syndrome: a meta-analysis. Intern Med, 2015. 54(3): p. 243-9.
[143.] Dimidi, E., et al., The effect of probiotics on functional constipation in adults: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr, 2014. 100(4): p. 1075-84.
[144.] Ford, A.C., et al., Efficacy of prebiotics, probiotics, and synbiotics in irritable bowel syndrome and chronic idiopathic constipation: systematic review and meta-analysis. Am J Gastroenterol, 2014. 109(10): p. 1547-61; quiz 1546, 1562.
[145.] Nikfar, S., et al., Effectiveness Of Probiotics In Irritable Bowel Syndrome: A Systematic Review With Meta-Analysis. Value Health, 2014. 17(7): p. A363.
[146.] Didari, T., et al., Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with meta-analysis. World J Gastroenterol, 2015. 21(10): p. 3072-84.
[147.] Zhang, Y., et al., Effects of probiotic type, dose and treatment duration on irritable bowel syndrome diagnosed by Rome III criteria: a meta-analysis. BMC Gastroenterol, 2016. 16(1): p. 62.
[148.] Cayzeele-Decherf, A., et al., Saccharomyces cerevisiae CNCM I-3856 in irritable bowel syndrome: An individual subject meta-analysis. World J Gastroenterol, 2017. 23(2): p. 336-344.
[149.] Han, K., et al., Efficacy of double-coated probiotics for irritable bowel syndrome: a randomized double-blind controlled trial. J Gastroenterol, 2017. 52(4): p. 432-443.
[150.] Pedersen, N., et al., Ehealth: low FODMAP diet vs Lactobacillus rhamnosus GG in irritable bowel syndrome. World J Gastroenterol, 2014. 20(43): p. 16215-26.
[151.] Yeun, Y. and J. Lee, Effect of a double-coated probiotic formulation on functional constipation in the elderly: a randomized, double blind, controlled study. Arch Pharm Res, 2015. 38(7): p. 1345-50.
[152.] Whorwell, P.J., et al., Efficacy of an encapsulated probiotic Bifidobacterium infantis 35624 in women with irritable bowel syndrome. Am J Gastroenterol, 2006. 101(7): p. 1581-90.
[153.] Spiller, R., et al., Randomized double blind placebo-controlled trial of Saccharomyces cerevisiae CNCM I-3856 in irritable bowel syndrome: improvement in abdominal pain and bloating in those with predominant constipation. United European Gastroenterol J, 2016. 4(3): p. 353-62.
[154.] Abbas, Z., et al., Cytokine and clinical response to Saccharomyces boulardii therapy in diarrhea-dominant irritable bowel syndrome: a randomized trial. Eur J Gastroenterol Hepatol, 2014. 26(6): p. 630-9.
[155.] Silk, D.B., et al., Clinical trial: the effects of a trans-galactooligosaccharide prebiotic on faecal microbiota and symptoms in irritable bowel syndrome. Aliment Pharmacol Ther, 2009. 29(5): p. 508-18.
[156.] Xu, D., et al., Efficacy of Fecal Microbiota Transplantation in Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis. Am J Gastroenterol, 2019. 114(7): p. 1043-1050.
[157.] Ianiro, G., et al., Systematic review with meta-analysis: efficacy of faecal microbiota transplantation for the treatment of irritable bowel syndrome. Aliment Pharmacol Ther, 2019. 50(3): p. 240-248.
[158.] Johnsen, P.H., et al., Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel-group, single-centre trial. Lancet Gastroenterol Hepatol, 2018. 3(1): p. 17-24.
[159.] Halkjaer, S.I., et al., Faecal microbiota transplantation alters gut microbiota in patients with irritable bowel syndrome: results from a randomised, double-blind placebo-controlled study. Gut, 2018. 67(12): p. 2107-2115.
[160.] Holvoet, T., et al., Fecal Microbiota Transplantation Reduces Symptoms in Some Patients With Irritable Bowel Syndrome With Predominant Abdominal Bloating: Short- and Long-term Results From a Placebo-Controlled Randomized Trial. Gastroenterology, 2021. 160(1): p. 145-157.e8.
[161.] Aroniadis, O.C., et al., Faecal microbiota transplantation for diarrhoea-predominant irritable bowel syndrome: a double-blind, randomised, placebo-controlled trial. Lancet Gastroenterol Hepatol, 2019. 4(9): p. 675-685.
[162.] Aziz, I. and M. Simrén, The overlap between irritable bowel syndrome and organic gastrointestinal diseases. The Lancet Gastroenterology & Hepatology, 2021. 6(2): p. 139-148.
[163.] Barbara, G., et al., Randomised controlled trial of mesalazine in IBS. Gut, 2016. 65(1): p. 82-90.
[164.] Lam, C., et al., A mechanistic multicentre, parallel group, randomised placebo-controlled trial of mesalazine for the treatment of IBS with diarrhoea (IBS-D), Gut, 2016. 65(1): p. 91-9.
[165.] Tuteja, A.K., et al., Double-blind placebo-controlled study of mesalamine in post-infective irritable bowel syndrome--a pilot study, Scand J Gastroenterol, 2012. 47(10): p. 1159-64.
[166.] Wouters, M.M., et al., Histamine Receptor Hi-Mediated Sensitization of TRPV1 Mediates Visceral Hypersensitivity and Symptoms in Patients With Irritable Bowel Syndrome, Gastroenterology, 2016. 150(4): p. 875-87.e9.
[167.] Cann, P.A., et al., Role of loperamide and placebo in management of irritable bowel syndrome (IBS), Dig Dis Sci, 1984. 29(3): p. 239-47.
[168.] Lavö, B., M. Stenstam, and A.L. Nielsen, Loperamide in treatment of irritable bowel syndrome--a double-blind placebo controlled study, Scand J Gastroenterol Suppl, 1987. 130: p. 77-80.
[169.] Efskind, P.S., T. Bernklev, and M.H. Vatn, A double-blind placebo-controlled trial with loperamide in irritable bowel syndrome, Scand J Gastroenterol, 1996. 31(5): p. 463-8.
[170.] Slattery, S.A., et al., Systematic review with meta-analysis: the prevalence of bile acid malabsorption in the irritable bowel syndrome with diarrhoea, Aliment Pharmacol Ther, 2015. 42(1): p. 3-11.
[171.] Wedlake, L., et al., Systematic review: the prevalence of idiopathic bile acid malabsorption as diagnosed by SeHCAT scanning in patients with diarrhoea-predominant irritable bowel syndrome, Aliment Pharmacol Ther, 2009. 30(7): p. 707-17.
[172.] Fernández-Banares, F., et al., Randomised clinical trial: colestyramine vs, hydroxypropyl cellulose in patients with functional chronic watery diarrhoea, Aliment Pharmacol Ther, 2015. 41(11): p. 1132-40.
[173.] Camilleri, M., et al., Effect of colesevelam on faecal bile acids and bowel functions in diarrhoea-predominant irritable bowel syndrome, Aliment Pharmacol Ther, 2015. 41(5): p. 438-48.
[174.] Ford, A.C., et al., American College of Gastroenterology Monograph on Management of Irritable Bowel Syndrome, Official journal of the American College of Gastroenterology | ACG, 2018. 113: p. 1-18.
[175.] Chapman, R.W., et al., Randomized clinical trial: macrogol/PEG 3350 plus electrolytes for treatment of patients with constipation associated with irritable bowel syndrome, Am J Gastroenterol, 2013. 108(9): p. 1508-15.
[176.] Ramkumar, D. and S.S. Rao, Efficacy and safety of traditional medical therapies for chronic constipation: systematic review, Am J Gastroenterol, 2005. 100(4): p. 936-71.
[177.] Ruepert, L., et al., Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome, Cochrane Database Syst Rev, 2011. 2011(8): p. Cd003460.
[178.] Alammar, N., et al., The impact of peppermint oil on the irritable bowel syndrome: a meta-analysis of the pooled clinical data, BMC Complement Altern Med, 2019. 19(1): p. 21.
[179.] Weerts, Z., et al., Efficacy and Safety of Peppermint Oil in a Randomized, Double-Blind Trial of Patients With Irritable Bowel Syndrome, Gastroenterology, 2020. 158(1): p. 123-136.
[180.] Chumpitazi, B.P., G.L. Kearns, and R.J. Shulman, Review article: the physiological effects and safety of peppermint oil and its efficacy in irritable bowel syndrome and other functional disorders, Aliment Pharmacol Ther, 2018. 47(6): p. 738-752.
[181.] Vivinus-Nébot, M., et al., Functional bowel symptoms in quiescent inflammatory bowel diseases: role of epithelial barrier disruption and low-grade inflammation, Gut, 2014. 63(5): p. 744-52.
[182.] Vivinus-Nébot, M., et al., Combination of allergic factors can worsen diarrheic irritable bowel syndrome: role of barrier defects and mast cells, Am J Gastroenterol, 2012. 107(1): p. 75-81.
[183.] Zhou, Q., B. Zhang, and G.N. Verne, Intestinal membrane permeability and hypersensitivity in the irritable bowel syndrome, Pain, 2009. 146(1-2): p. 41-6.
[184.] Witt, S.T., et al., Interactions between gut permeability and brain structure and function in health and irritable bowel syndrome, Neuroimage Clin, 2019. 21: p. 101602.
[185.] Zhou, Q., et al., Randomised placebo-controlled trial of dietary glutamine supplements for postinfectious irritable bowel syndrome, Gut, 2019. 68(6): p. 996-1002.
[186.] Trifan, A., et al., Efficacy and safety of Gelsectan for diarrhoea-predominant irritable bowel syndrome: A randomised, crossover clinical trial, United European Gastroenterol J, 2019. 7(8): p. 1093-1101.
[187.] Alexea, O., V. Bacarea, and N. Piqué, The combination of oligo- and polysaccharides and reticulated protein for the control of symptoms in patients with irritable bowel syndrome: Results of a randomised, placebo-controlled, double-blind, parallel group, multicentre clinical trial, United European Gastroenterol J, 2016. 4(3): p. 455-65.
[188.] Lembo, A.J., et al., Eluxadoline for Irritable Bowel Syndrome with Diarrhea, N Engl J Med, 2016. 374(3): p. 242-53.
[189.] Andresen, V., et al., Effects of 5-hydroxytryptamine (serotonin) type 3 antagonists on symptom reliefand constipation in nonconstipated irritable bowel syndrome: a systematic review and meta-analysis of randomized controlled trials. Clin Gastroenterol Hepatol, 2008. 6(5): p. 545-55.
[190.] Zheng, Y., et al., Efficacy and safety of 5-hydroxytryptamine 3 receptor antagonists in irritable bowel syndrome: A systematic review and meta-analysis of randomized controlled trials. PLoS One, 2017. 12(3): p. e0172846.
[191.] Qi, Q., et al., Ramosetron for the treatment of irritable bowel syndrome with diarrhea: a systematic review and meta-analysis of randomized controlled trials. BMC Gastroenterol, 2018. 18(1): p. 5.
[192.] Rahimi, R., S. Nikfar, and M. Abdollahi, Efficacy and tolerability of alosetron for the treatment of irritable bowel syndrome in women and men: a meta-analysis of eight randomized, placebo-controlled, 12-week trials. Clin Ther, 2008. 30(5): p. 884-901.
[193.] Ford, A.C., et al., Efficacy of 5-HT3 antagonists and 5-HT4 agonists in irritable bowel syndrome: systematic review and meta-analysis. Am J Gastroenterol, 2009. 104(7): p. 1831-43; quiz 1844.
[194.] Garsed, K., et al., A randomised trial of ondansetron for the treatment of irritable bowel syndrome with diarrhoea. Gut, 2014. 63(10): p. 1617-25.
[195.] Prather, C.M., et al., Tegaserod accelerates orocecal transit in patients with constipation-predominant irritable bowel syndrome. Gastroenterology, 2000. 118(3): p. 463-8.
[196.] Tack, J., et al., Systematic review: cardiovascular safety profile of 5-HT(4) agonists developed for gastrointestinal disorders. Aliment Pharmacol Ther, 2012. 35(7): p. 745-67.
[197.] Anderson, J.L., et al., Lack of association of tegaserod with adverse cardiovascular outcomes in a matched case-control study. J Cardiovasc Pharmacol Ther, 2009. 14(3): p. 170-5.
[198.] Loughlin, J., et al., Tegaserod and the risk of cardiovascular ischemic events: an observational cohort study. J Cardiovasc Pharmacol Ther, 2010. 15(2): p. 151-7.
[199.] Shah, E.D., et al., Tegaserod for Irritable Bowel Syndrome With Constipation in Women Younger Than 65 Years Without Cardiovascular Disease: Pooled Analyses of 4 Controlled Trials. Am J Gastroenterol, 2021. 116(8): p. 1601-1611.
[200.] Sajid, M.S., et al., Use of Prucalopride for Chronic Constipation: A Systematic Review and Meta-analysis of Published Randomized, Controlled Trials. J Neurogastroenterol Motil, 2016. 22(3): p. 412-22.
[201.] Tack, J., et al., Effect of prucalopride on symptoms of chronic constipation. Neurogastroenterol Motil, 2014. 26(1): p. 21-7.
[202.] Rao, S.S., et al., Effect of linaclotide on severe abdominal symptoms in patients with irritable bowel syndrome with constipation. Clin Gastroenterol Hepatol, 2014. 12(4): p. 616-23.
[203.] Chang, L., A. Lembo, and S. Sultan, American Gastroenterological Association Institute Technical Review on the pharmacological management of irritable bowel syndrome. Gastroenterology, 2014. 147(5): p. 1149-72.e2.
[204.] Shah, E.D., H.M. Kim, and P. Schoenfeld, Efficacy and Tolerability of Guanylate Cyclase-C Agonists for Irritable Bowel Syndrome with Constipation and Chronic Idiopathic Constipation: A Systematic Review and Meta-Analysis. Am J Gastroenterol, 2018. 113(3): p. 329-338.
[205.] Wilson, N. and R. Schey, Lubiprostone in constipation: clinical evidence and place in therapy. Ther Adv Chronic Dis, 2015. 6(2): p. 40-50.
[206.] Li, F., et al., Lubiprostone Is Effective in the Treatment of Chronic Idiopathic Constipation and Irritable Bowel Syndrome: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Mayo Clin Proc, 2016. 91 (4): p. 456-68.
[207.] Schäfer, E. and K. Ewe, The treatment of irritable colon. Efficacy and tolerance of buscopan plus, buscopan, paracetamol and placebo in ambulatory patients with irritable colon. Fortschritte der Medizin, 1990. 108(25): p. 488-492.
[208.] Mueller-Lissner, S., et al., Placebo-and paracetamol-controlled study on the efficacy and tolerability of hyoscine butylbromide in the treatment of patients with recurrent crampy abdominal pain. Alimentary pharmacology & therapeutics, 2006. 23(12): p. 1741-1748.
[209.] Kariv, R., et al., Low-dose naltreoxone for the treatment of irritable bowel syndrome: a pilot study. Dig Dis Sci, 2006. 51 (12): p. 2128-33.
[210.] Houghton, L.A., et al., Effect of a second-generation a2ő ligand (pregabalin) on visceral sensation in hypersensitive patients with irritable bowel syndrome. Gut, 2007. 56(9): p. 1218-1225.
[211.] Saito, Y.A., et al., Randomised clinical trial: pregabalin vs placebo for irritable bowel syndrome. Alimentary pharmacology & therapeutics, 2019. 49(4): p. 389-397.
[212.] Ducrotté, P., et al., On-demand treatment with alverine citrate/simeticone compared with standard treatments for irritable bowel syndrome: results of a randomised pragmatic study, International journal of clinical practice, 2014. 68(2): p. 245-254.
[213.] Wittmann, T., et al., Clinical trial: the efficacy of alverine citrate/simeticone combination on abdominal pain/ discomfort in irritable bowel syndrome-a randomized, double-blind, placebo-controlled study, Alimentary pharmacology & therapeutics, 2010. 31(6): p. 615-624.
[214.] Black, C.J., et al., Efficacy of secretagogues in patients with irritable bowel syndrome with constipation: systematic review and network meta-analysis, Gastroenterology, 2018. 155(6): p. 1753-1763.
[215.] Chey, W.D., et al., Efficacy of tenapanor in treating patients with irritable bowel syndrome with constipation: a 26-week, placebo-controlled phase 3 trial (T3MPO-2), The American Journal of Gastroenterology, 2021. 116(6): p. 1294.
[216.] Fassov, J., et al., Sacral nerve stimulation changes rectal sensitivity and biomechanical properties in patients with irritable bowel syndrome, Neurogastroenterol Motil, 2014. 26(11): p. 1597-604.
[217.] Fassov, J., et al., Three-year follow-up of sacral nerve stimulation for patients with diarrhoea-predominant and mixed irritable bowel syndrome, Colorectal Dis, 2017. 19(2): p. 188-193.
[218.] Fassov, J.L., et al., A randomized, controlled, crossover study of sacral nerve stimulation for irritable bowel syndrome, Ann Surg, 2014. 260(1): p. 31-6.
[219.] Tipsmark, L.S., et al., Cost-effectiveness analysis of sacral nerve stimulation as treatment for severe irritable bowel syndrome, Colorectal Dis, 2016. 18(1): p. O30-6.
[220.] Ford, A.C., et al., Effect of Antidepressants and Psychological Therapies in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-Analysis, Official journal of the American College of Gastroenterology | ACG, 2019. 114(1): p. 21-39.
[221.] Montero, A.M. and S. Jones, Roles and impact of psychologists in interdisciplinary gastroenterology care, Clinical Gastroenterology and Hepatology, 2020. 18(2): p. 290-293.
[222.] Black, C.J., et al., O61 Efficacy of psychological therapies for irritable bowel syndrome: systematic review and network meta-analysis, Gut, 2021. 70(Suppl 1): p. A34-A35.
[223.] Basnayake, C., et al., Standard gastroenterologist versus multidisciplinary treatment for functional gastrointestinal disorders (MANTRA): an open-label, single-centre, randomised controlled trial, The lancet Gastroenterology & hepatology, 2020. 5(10): p. 890-899.
[224.] Li, L., et al., Cognitive-behavioral therapy for irritable bowel syndrome: A meta-analysis, Journal of psychosomatic research, 2014. 77(1): p. 1-12.
[225.] Van Oudenhove, L., et al., Biopsychosocial aspects of functional gastrointestinal disorders: how central and environmental processes contribute to the development and expression of functional gastrointestinal disorders, Gastroenterology, 2016. 150(6): p. 1355-1367. e2.
[226.] Elkins, G.R., et al., Advancing research and practice: The revised APA Division 30 definition of hypnosis, American Journal of Clinical Hypnosis, 2015. 57(4): p. 378-385.
[227.] Moser, G., et al., Long-term success of GUT-directed group hypnosis for patients with refractory irritable bowel syndrome: a randomized controlled trial, Official journal of the American College of Gastroenterology! ACG, 2013. 108(4): p. 602-609.
[228.] Kabat-Zinn, J. and T.N. Hanh, Full catastrophe living: Using the wisdom of your body and mind to face stress, pain, and illness. 2009: Delta.
[229.] Gaylord, S.A., et al., Mindfulness training reduces the severity of irritable bowel syndrome in women: results of a randomized controlled trial, The American journal of gastroenterology, 2011. 106(9): p. 1678.
[230.] Zernicke, K.A., et al., Mindfulness-based stress reduction for the treatment of irritable bowel syndrome symptoms: a randomized wait-list controlled trial, International journal of behavioral medicine, 2013. 20: p. 385-396.
[231.] Naliboff, B.D., et al., Mindfulness-based stress reduction improves irritable bowel syndrome (IBS) symptoms via specific aspects of mindfulness, Neurogastroenterology & Motility, 2020. 32(9): p. e13828.
[232.] Hetterich, L. and A. Stengel, Psychotherapeutic interventions in irritable bowel syndrome, Frontiers in Psychiatry, 2020. 11: p. 286.
[233.] Zijdenbos, I.L., et al., Psychological treatments for the management of irritable bowel syndrome, Cochrane Database of Systematic Reviews, 2009(1).
[234.] Williams, R. and V. Williams, Lifeskills: 8 simple ways to build stronger relationships, communicate more clearly, and improve your health. 2010: Harmony.
[235.] Williams, V.P., et al., Coping Skills Training to Reduce Psychosocial Risk Factors for Medical Disorders: A Field Trial Evaluating Effectiveness in Multiple Worksites. Journal of Occupational Health, 2009. 51(5): p. 437-442.
[236.] Drossman, D.A., et al., Neuromodulators for Functional Gastrointestinal Disorders (Disorders of Gut-Brain Interaction): A Rome Foundation Working Team Report. Gastroenterology, 2018. 154(4): p. 1140-1171.e1.
[237.] Chen, L., S.J. Ilham, and B. Feng, Pharmacological Approach for Managing Pain in Irritable Bowel Syndrome: A Review Article. Anesth Pain Med, 2017. 7(2): p. e42747.
[238.] Emberi Erőforrások Minisztériuma egészségügyi szakmai irányelve: Az unipoláris major depresszió diagnosztikája és kezelése. Egészségügyi Közlöny, 2021. 12.
[239.] JM, S., Recommandations sur la pris en charge du Syndrome del'Intestin Irritable (SII). Post'U, 2022: p. 147-164.
[240.] Kreiter, D., et al., Symptom-network dynamics in irritable bowel syndrome with comorbid panic disorder using electronic momentary assessment: A randomized controlled trial of escitalopram vs. placebo. J Psychosom Res, 2021. 141: p. 110351.
[241.] Moayyedi, P., et al., Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol, 2019. 2(1): p. 6-29.
[242.] Acharekar, M.V., et al., A Systematic Review on the Efficacy and Safety of Selective Serotonin Reuptake Inhibitors in Gastrointestinal Motility Disorders: More Control, Less Risk. Cureus, 2022. 14(8): p. e27691.
[243.] Törnblom, H. and D.A. Drossman, Psychotropics, Antidepressants, and Visceral Analgesics in Functional Gastrointestinal Disorders. Curr Gastroenterol Rep, 2018. 20(12): p. 58.
[244.] Dekel, R., D.A. Drossman, and A.D. Sperber, The use of psychotropic drugs in irritable bowel syndrome. Expert Opin Investig Drugs, 2013. 22(3): p. 329-39.
[245.] Brennan, B.P., et al., Duloxetine in the treatment of irritable bowel syndrome: an open-label pilot study. Hum Psychopharmacol, 2009. 24(5): p. 423-8.
[246.] Camilleri, M., Management Options for Irritable Bowel Syndrome. Mayo Clin Proc, 2018. 93(12): p. 1858-1872.
[247.] Salehian, R., et al., Investigation the Effectiveness of Duloxetine in Quality of Life and Symptoms of Patients with Irritable Bowel Syndrome. Adv Biomed Res, 2021. 10: p. 14.
[248.] Schumann, D., et al., Effect of Yoga in the Therapy of Irritable Bowel Syndrome: A Systematic Review. Clin Gastroenterol Hepatol, 2016. 14(12): p. 1720-1731.
[249.] Evans, S., et al., Iyengaryoga for adolescents andyoung adults with irritable bowel syndrome. J Pediatr Gastroenterol Nutr, 2014. 59(2): p. 244-53.
[250.] D'Silva, A., et al., Yoga as a Therapy for Irritable Bowel Syndrome. Dig Dis Sci, 2020. 65(9): p. 2503-2514.
[251.] Drossman, D.A., et al., Severity in irritable bowel syndrome: a Rome Foundation Working Team report. Am J Gastroenterol, 2011. 106(10): p. 1749-59; quiz 1760.
[252.] Harris, L.A. and M.M. Heitkemper, Practical considerations for recognizing and managing severe irritable bowel syndrome. Gastroenterol Nurs, 2012. 35(1): p. 12-21; quiz 22-3.
[253.] Olden, K.W. and A.R. Brown, Treatment of the severe refractory irritable bowel patient. Curr Treat Options Gastroenterol, 2006. 9(4): p. 324-30.
[254.] Carter, D., et al., The Severity of Symptoms Related to Irritable Bowel Syndrome is a Risk Factor for the Misclassification of Significant Organic Disease. J Clin Gastroenterol, 2017. 51 (5): p. 421-425.
[255.] Canavan, C., J. West, and T. Card, The epidemiology of irritable bowel syndrome. Clin Epidemiol, 2014. 6: p. 71-80.
[256.] Faresjö, Á., et al., Patients with irritable bowel syndrome are more burdened by co-morbidity and worry about serious diseases than healthy controls-eight years follow-up of IBS patients in primary care. BMC Public Health, 2013. 13: p. 832.
X. FEJLESZTÉS MÓDSZERE
1. Fejlesztőcsoport megalakulása, a fejlesztési folyamat és a feladatok dokumentálásának módja
Az egészségügyi szakmai irányelv kidolgozását az Egészségügyi Szakmai Kollégium Gasztroenterológia és Hepatológia Tagozat kezdeményezte. A fejlesztés megkezdésekor a Tagozat elnöke a Magyar Gasztroenterológiai Társaság vezetőségének és elnökségének javaslatára kijelölte az irányelvfejlesztés felelősét és a fejlesztő csoport tagjait. Az egészségügyi szakmai irányelv fejlesztés fő felelőse meghatározta a tagok feladatait. Az egészségügyi szakmai irányelv kialakítása a tagok egyéni munkáján és többszöri konzultáción keresztül valósult meg. Az eljárás a releváns nemzetközi irányelvek áttekintésével és intenzív irodalom kereséssel kezdődött, a naprakész ajánlások megfogalmazása és a szakmailag indokolt tartalombővítés megvalósítása érdekében. A fejlesztési folyamat során kommunikáltak egymással a szakemberek, illetve kéthavi rendszerességgel strukturált formában az addig elkészült munkáról, illetve a folyamatról visszajelzést adtak. Az egészségügyi szakmai irányelv kialakítása a tagok egyéni munkáján, és többszöri konzultáción keresztül valósult meg.
2. Irodalomkeresés, szelekció
A felhasznált nemzetközi irányelvek irodalomjegyzékeiben, valamint a MEDLINE, Cochrane és EMBASE adatbázisokban megtalálható, az utóbbi 10-15 éves periódusban megjelent releváns közleményeket összefoglaló nemzetközi szakmai ajánlásokat használtuk fel az egészségügyi szakmai irányelv fejlesztéséhez. A keresés az alábbi keresőszavakkal, azok különböző változataival és kombinációival történt: irritable bowel syndrome, medical treatment, psychotherapy, guideline, management.
3. Felhasznált bizonyítékok erősségének, hiányosságainak leírása (kritikus értékelés, "bizonyíték vagy ajánlás mátrix"), bizonyítékok szintjének meghatározási módja
Az egészségügyi szakmai irányelv fejlesztése a külföldi irányelvek adaptációjával és az eredeti evidenciák feldolgozásával történt, amelyekben a bizonyítékok erősségi szintjének meghatározása a GRADE módszertanon alapult (lásd Kapcsolat külföldi szakmai irányelvekkel) [1, 2]. A hazai egészségügyi szakmai irányelv is ezt a módszertant követi, amelynek segítségével megállapításra kerültek a bizonyítékok megbízhatósági szintjei. A nemzetközi irányelvek által megállapított bizonyítékerősségi szinteket a fejlesztőcsoport elfogadta.
4. Ajánlások kialakításának módszere
Az egészségügyi szakmai irányelv fejlesztése a külföldi irányelvek adaptációjával és az eredeti evidenciák feldolgozásával történt. A fejlesztőcsoport mindig ellenőrizte a bizonyítékok hazai viszonyok közötti relevanciáját. Amennyiben a bizonyíték nem a magyarországi viszonyoknak megfelelő kiindulási adatokra támaszkodott, ott a fejlesztőcsoport konszenzusa volt mérvadó.
5. Véleményezés módszere
A különböző fejezetek megírása, valamint a részfolyamatok befejezése során a szerzők egymás munkáit többlépcsős folyamat során véleményezték és módosításokra tettek javaslatot, mely korrigálását követően újabb véleményezésre, majd pontosításra került sor, ezt követően került az irányelv véglegesítésre. Az egészségügyi szakmai irányelv szakmai tartalmának összeállítását követően, a visszaérkező javaslatok beillesztésre kerültek az irányelv szövegébe, vagy azok alapján módosításra került a dokumentum szerkezete, amennyiben az irányelvfejlesztők egyetértettek azok tartalmával. A folyamat végén az irányelvfejlesztésben résztvevő szakemberek kiegészülve a témában jártas hazai szakértőkkel egy konszenzus megbeszélésen vettek részt. A megbeszélés során az irányelv minden egyes ajánlását a résztvevők ismételten áttekintették és ajánlásonként informatikai rendszer segítségével szavaztak arról, hogy az adott irányelvvel egyetértenek vagy sem (igen/nem válaszlehetőség). Az igen válaszok százalékos arányának megadásával határozták meg az adott ajánlással kapcsolatos konszenzus mértékét.
Az egészségügyi szakmai irányelv megküldésre került az egészségügyi ellátási folyamatban érintett Egészségügyi Szakmai Kollégium Tagozatoknak véleményezésre. A visszaérkező javaslatok beillesztésre kerültek az irányelv szövegébe, vagy azok alapján módosításra került a dokumentum, amennyiben az irányelvfejlesztők egyetértettek azok tartalmával. Az egészségügyi szakmai irányelvben foglaltak megfelelnek a véleményezőkkel kialakított konszenzusnak.
6. Független szakértői véleményezés módszere
Nem került bevonásra.
XI. MELLÉKLETEK
1. Alkalmazást segítő dokumentumok
1.1. Betegtájékoztató, oktatási anyagok
Nem készültek.
1.2. Tevékenységsorozat elvégzésére használt adatlapok
Nem készültek.
1.3. Táblázatok
Lásd 1., 2. és 3. ábra
Róma IV. kritériumok - IBS
1. Visszatérő hasi fájdalom, mely legalább heti 1x jelentkezett az elmúlt 3 hónapban és a következők közül legalább kettővel társul:
a) Székletürítéshez kapcsolódik
b) A székletürítés gyakoriságának változásával jár
c) A széklet állagának változásával jár
ÉS
2. A panaszok legalább 6 hónapja kezdődtek és az elmúlt 3 hónapban a következők szerint alakulnak:
1. ábra: Róma IV. kritériumok az IBS diagnózisának felállítására [2]
| IBS-C | IBS-D | IBS-M | IBS-U |
| A székletek ≥ 25%-a a Bristol skálán 1. vagy 2. típusú és a székletek <25%-a a Bristol skálán 6. vagy 7. | A székletek ≥ 25%-a a Bristol skálán 6. vagy 7. típusú és a székletek <25%-a a Bristol skálán 1. vagy 2. típus. | A székletek ≥ 25%-a a Bristol skálán 1. vagy 2. típusú és a székletek ≥25%-a a Bristol skálán 6. vagy 7. típus. | Azok a betegek, akik az IBS kritériumainak megfelelnek, de nem sorolhatóak egyik egyéb alkategóriába sem. |
2. ábra: A széklet formájának osztályozása a Bristol skála alapján [6]

3. ábra: Az IBS terápiás lépcsői [11]
| Enyhe | Középsúlyos | Súlyos |
| -Felvilágosítás - Megnyugtatás - Diéta - Életmód | - Provokáció faktorok felderítése, eliminálása - Pszichoterápiás, viselkedésterápiás technikák - Predomináns tünet gyógyszeres kezelése | - Multidiszciplináris megközelítés - Pszicho-farmakológiai kezelés - Fájdalomambulancia |
1.4. Algoritmusok
Lásd 4. és 5. ábra.
4. ábra: Az IBS diagnosztikájának algoritmusa - az egészségügyi szakmai irányelvet fejlesztő bizottság saját szerkesztése
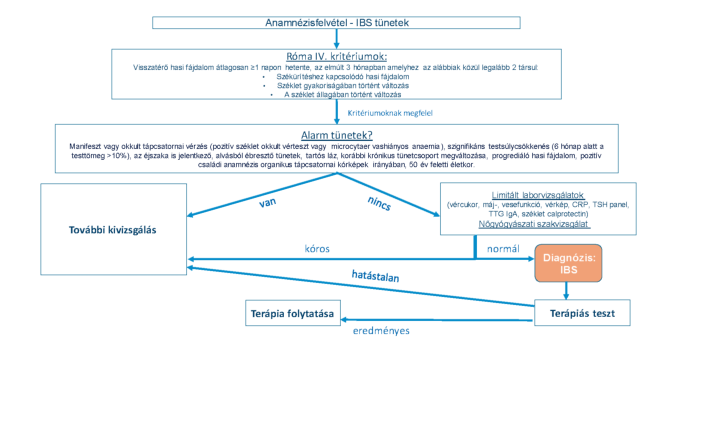
5. ábra: Az IBS terápiás algoritmusa - A Brit Gasztroenterológiai Társaság terápiás algoritmusának az egészségügyi szakmai irányelvet fejlesztő bizottság által a hazai viszonyokra adaptált változata
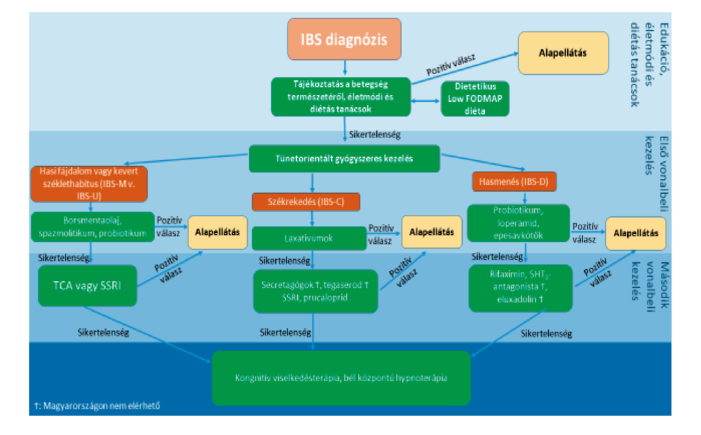
1.5 Egyéb dokumentumok
Nem készültek.


