EMMI egészségügyi szakmai irányelv (EüK 2021/24.)
a differenciált pajzsmirigyrák diagnosztikája és kezelése
Típusa: Klinikai egészségügyi szakmai irányelv
Azonosító: 002190
Érvényesség időtartama: 2024. 12. 23.
I. IRÁNYELVFEJLESZTÉSBEN RÉSZTVEVŐK
Társszerző Egészségügyi Szakmai Kollégiumi Tagozatok:
1. Onkológia és Sugárterápia Tagozat
Prof. Dr. Polgár Csaba sugárterápia szakorvosa, klinikai onkológus, elnök, társszerző
2. Sebészet és Egynapos sebészet Tagozat
Prof. Dr. Oláh Attila sebész, elnök, társszerző
3. Belgyógyászat, endokrinológia, diabétesz és anyagcserebetegségek Tagozat
Dr. Bedros J. Róbert belgyógyász, elnök, társszerző
4. Klinikai szakpszichológia és pszichoterapeutea klinikai szakszichológus Tagozat
Dr. Kovács Péter klinikai szakpszichológia szakorvosa, elnök, társszerző
5. Klinikai genetika Tagozat
Dr. Török Olga genetikus, elnök, társszerző
6. Nukleáris medicina Tagozat
Prof. Dr. Borbély Katalin DSc, Med. Habil., nukleáris medicina, neurológia szakorvosa, elnök, társszerző
7. Fül-orr-gégészet Tagozat
Dr. Lujber László fül-orr-gégegyógyászat, audiológia szakorvosa, elnök, társzerző
8. Radiológia Tagozat
Prof. Dr. Gődény Mária radiológia szakorvosa, elnök, társzerző
9. Patológia Tagozat
Prof. Dr. Kiss András DSc, molekuláris genetikai diagnosztika, patológia, cytopatológia szakorvosa, elnök, társszerző
A Tagozatok részéról delegált szakértők, a Fejlesztő munkacsoport tagjai
Dr. Dohán Orsolya belgyógyászat, endokrinológia, klinikai onkológia szakorvosa, társszerző
Prof. Dr. Nagy Endre belgyógyászat, endokrinológia szakorvosa, társszerző
Dr. Uhlyarik Andrea endokrinológia, klinikai onkológia szakorvosa, társszerző
Dr. Oberna Ferenc klinikai onkológia, fül-orr-gégészet, arc-állcsont sebészet szakorvosa, társszerző
Dr. Lévay Bernadett sebészet, égés-plasztikai sebészet, klinikai onkológia szakorvosa, társszerző
Dr. Zámbó Orsolya fül-orr-gégegyógyászat, foniátri, klinikai onkológia szakorvosa, társszerző
Dr. Győry Ferenc sebészet szakorvosa, társszerző
Prof. Dr. Tamás László fül-orr-gégegyógyászat, audiológia, foniátria szakorvosa, társszerző
Dr. Polony Gábor fül-orr-gégegyógyászat, audiológia szakorvosa, társszerző
Dr. Pogány Péter patológia, citopatológia szakorvosa, társszerző
Dr. Schmidt Erzsébet izotópdiagnosztika szakorvosa, társszerző
Prof. Dr. Toldy Erzsébet orvosi laboratóriumi diagnosztika szakorvosa, társszerző
Dr. Bhattoa Harjit Pál laboratóriumi hematológia és immunológia, orvosi laboratóriumi diagnosztika szakorvosa, társszerző
Dr. Hitre Erika belgyógyászat, klinikai onkológia, klinikai farmakológia szakorvosa, társszerző
Dr. Molnár Krisztián radiológia szakorvosa, társszerző
Dr. Gellén Balázs csecsemő- és gyermekgyógyászat, neonatológia, endokrinológia szakorvosa, társszerző
Dr. Takácsi-Nagy Zoltán sugárterápia, klinikai onkológia szakorvosa, társszerző
Dr. Szilágyi István patológia szakorvosa, társszerző
Prof. Dr. Altorjay Áron sebészet, mellkassebészet szakorvosa, társszerző
Prof. Dr. Mezősi Emese belgyógyászat, endokrinológia szakorvosa, társszerző
Prof. Dr. Lakatos Péter belgyógyászat, endokrinológia szakorvosa, társszerző
Lacsán Katalin Anna klinikai és mentálhigiéniai felnőtt szakpszichológus, társszerző
Prof. Dr. Patócs Attila molekuláris genetikai diagnosztika szakorvosa, társszerző
Prof. Dr. Pávics László belgyógyászat, izotópdiagnosztika szakorvosa, társszerző
Dr. Helfferich Frigyes fül-orr-gégegyógyászat, fej-nyaksebészet, audiológia szakorvosa, társszerző
Dr. Léránt Gergely radiológia szakorvosa, társszerző
Dr. Tóth Erika patológia, molekuláris patológiai diagnosztika, klinikai genetika szakorvosa, társszerző
Prof. Dr. Sápi Zoltán patológia, citopatológia szakorvosa, társszerző
Prof. Dr. Tornóczki Tamás patológia szakorvosa, társszerző
Dr. Borka Katalin patológia, citopatológia szakorvosa, társszerző
Dr. Molnár Csaba patológia, citopatológia szakorvosa, társszerző
Véleményező Egészségügyi Szakmai Kollégiumi Tagozatok:
1. Kórházi klinikai gyógyszerészet Tagozat
Dr. Juhász Ákos szakgyógyszerész, elnök, véleményező
2. Klinikai farmakológia Tagozat
Dr. Rojkovich Bernadette reumatológia, klinikai farmakológia szakorvosa, elnök, véleményező
3. Háziorvostan Tagozat
Dr. Szabó János háziorvostan, elnök, véleményező
4. Orvosi laboratórium Tagozat
Prof. Dr. Miseta Attila orvosi laboratórium szakorvosa, elnök, véleményező
5. Ápolási, szakdolgozói és Szülésznő Tagozat
Pap-Szekeres Anita okleveles ápoló, elnök, véleményező
6. Hospice-palliatív ellátás Tagozat
Dr. Csikós Ágnes háziorvostan szakorvosa, elnök, véleményező
Az egészségügyi szakmai irányelv készítése során a szerzői függetlenség nem sérült.
Az egészségügyi szakmai irányelvben foglaltakkal a fent felsorolt tagozatok dokumentáltan egyetértenek.
Az irányelvfejlesztés egyéb szereplői
Szakmai társaság(ok) tanácskozási joggal:
Nem került bevonásra.
Betegszervezet(ek) tanácskozási joggal:
Nem került bevonásra.
Egyéb szervezet(ek) tanácskozási joggal:
Nem került bevonásra.
II. ELŐSZÓ
A bizonyítékokon alapuló egészségügyi szakmai irányelvek az egészségügyi szakemberek és egyéb felhasználók döntéseit segítik meghatározott egészségügyi környezetben. A szisztematikus módszertannal kifejlesztett és alkalmazott egészségügyi szakmai irányelvek, tudományos vizsgálatok által igazoltan, javítják az ellátás minőségét. Az egészségügyi szakmai irányelvben megfogalmazott ajánlások sorozata az elérhető legmagasabb szintű tudományos eredmények, a klinikai tapasztalatok, az ellátottak szempontjai, valamint a magyar egészségügyi ellátórendszer sajátságainak együttes figyelembevételével kerülnek kialakításra. Az irányelv szektorsemleges módon fogalmazza meg az ajánlásokat. Bár az egészségügyi szakmai irányelvek ajánlásai a legjobb gyakorlatot képviselik, amelyek az egészségügyi szakmai irányelv megjelenésekor a legfrissebb bizonyítékokon alapulnak, nem pótolhatják minden esetben az egészségügyi szakember döntését, ezért attól indokolt esetben dokumentáltan el lehet térni.
III. HATÓKÖR
Egészségügyi kérdéskör: Felnőttkori rákos megbetegedések, azon belül a pajzsmirigy rosszindulatú daganatok, azon belül a follicularis hám eredetű pajzsmirigykarcinómák teljes körű, sokszakmás ellátása.
Ellátási folyamat szakasza(i): Daganatos betegség elsődleges és másodlagos megelőzése, komplex diagnosztikája, multimodális terápiája, a betegek követéses gondozása, rehabilitációja és hospice támogatása.
Érintett ellátottak köre: Azok a személyek, akik a címben foglalt daganatok korai felfedezését elősegítő általános, vagy szűrő jellegű orvosi vizsgálaton, illetve a daganat konkrét gyanúját tisztázó, vagy a diagnózist pontosító speciális vizsgálatokban, diagnosztikus eljárásokban vesznek részt, továbbá akik a daganat diagnózisa alapján kuratív, vagy palliatív célú aktív, vagy krónikus gyógykezelésben részesülnek, illetve a daganatos állapot kontrollálása, követéses gondozása alatt állnak.
Érintett ellátók köre
Szakterületek: 0100 belgyógyászat
0103 endokrinológia, anyagcsere és diabetológia
0200 sebészet
0600 fül-orr-gégegyógyászat
1200 klinikai onkológia
1201 sugárterápia
2200 Rehabilitációs medicina alaptevékenységek
5000 orvosi laboratóriumi diagnosztika
5006 molekuláris genetikai laboratóriumi diagnosztika
5100 röntgendiagnosztika
5103 angiográfiás diagnosztika
5108 CT diagnosztika
5109 MRI diagnosztika
5301 teljeskörű ultrahang-diagnosztika
5400 kórbonctan
5401 szövettan, kórszövettan
5402 cytológia, cytopatológia
5403 aspirációs cytológia
5404 immunhisztológia
5408 molekuláris patológia
5501 PET-MRI
6301 háziorvosi ellátás
6500 izotópdiagnosztika
6501 radioizotópos terápia
6503 PET-CT
6504 SPECT-CT
6700 klinikai genetika
7001 klinikai farmakológia
7002 intézeti gyógyszerellátás (külön jogszabályban foglalt feltételek alapján)
7101 klinikai és mentálhigiéniai szakpszichológia
7305 szakápolás (egészségügyi diplomával és/vagy szakápolói szakképesítéssel külön jogszabályban meghatározottak alapján)
7306 felnőtt hospice-palliatív ellátás
Ellátási forma: A1 alapellátás, alapellátás
A2 alapellátás, ügyeleti ellátás
J1 járóbeteg szakellátás, szakrendelés
J2 járóbeteg szakellátás, egynapos sebészet
J3 járóbeteg szakellátás, jellemzően terápiás beavatkozást végző szakellátás
J4 járóbeteg szakellátás, nem orvosi szakfeladatot ellátó szakellátás
J5 járóbeteg szakellátás, betegek otthonában végzett szakellátás
J6 járóbeteg szakellátás, mozgó/változó helyszínen végzett szakellátás
J7 járóbeteg szakellátás, gondozás
J8 járóbeteg szakellátás, nappali ellátás
D1 diagnosztika, diagnosztika
F1 fekvőbeteg szakellátás, aktív fekvőbeteg-ellátás
F2 fekvőbeteg szakellátás, krónikus fekvőbeteg-ellátás
F3 fekvőbeteg szakellátás, ápolási ellátás
F4 fekvőbeteg szakellátás, rehabilitációs ellátás
F5 fekvőbeteg szakellátás, nappali kórházi ellátás
F6 fekvőbeteg szakellátás, sürgősségi ellátás
E1 egyéb szolgáltatás, bentlakásos szociális vagy gyermekvédelmi intézményben szervezett egészségügyi ellátás
E2 egyéb szolgáltatás, fegyveres és rendvédelmi szervek egészségügyi ellátása
(dolgozók és fogvatartottak alapellátása)
E3 egyéb szolgáltatás, önálló "megelőző egészségügyi ellátások"
E4 egyéb szolgáltatás, mentést igénylő ellátás
E5 egyéb szolgáltatás, betegszállítás
E6 egyéb szolgáltatás, az előzőekbe be nem sorolható ellátások
Progresszivitási szintek: I-II-III.
Egyéb specifikáció: Nincs
IV. MEGHATÁROZÁSOK
1. Fogalmak
adjuváns kezelés - az előzetes terápia eredményét támogató, kiegészítő, erősítő kezelés (pl. a műtét után sugár- és/ vagy kemo-terápia)
aktív gyógykezelés - a diagnózis első felállítását követő, a betegség megszűntetését célzó egy- vagy többféle orvosi beavatkozás vagy ezek sorozata amenorrhoea - a női havivérzés kimaradása
aspirációs citológia - tűbiopszia során vákuumszívással nyert szövettani sejtvizsgálat
azoospermia - teljes spermiumhiány
betegség gyakorisága - egy adott betegségtípusban egy éven belül megbetegedettek (incidencia) vagy meghaltak (mortalitás) száma egy adott számú populációra összesen, nemenként vagy korcsoportonamenorrhoeaként meghatározott népesség-csoportban
calcificatio - képalkotó vizsgálatnál látható "meszesedés", amely a daganatos elfajulás kezdeti jelei lehetnek citosztatikus hatás - sejtek szaporodásának (proliferáció) gátlása
daganatok prognózisa - a rosszindulatú daganatos állapot lehetséges lefolyásának, gyógyíthatóságának becslése az epidemiológiai ismeretek és a beteg részletes vizsgálati eredményei alapján
differenciált tumor - a daganat kiindulási szervének kiérett egészséges sejtjeinek tulajdonságait mutató daganatos setburjánzás
Damoklész kardja-effektus - a daganat súlyosbodásától, kiújulásától való félelem a gyógykezelés során és után differenciál diagnosztika - a diagnózis tisztázása, pontosítása többféle betegségre utaló tünetek, vizsgálati leletek esetén
early detection and treatment - a már diagnosztizálható rákbetegség teljes gyógyulása reményében végzett "korai vizsgálatok" (pl. szűrés) és "korai kuratív beavatkozások" összessége
egészségügyi szakmai irányelvek - a tudomány mindenkori állása szerinti legjobb gyakorlatot képviselő ajánlások, amelyek a legfrissebb bizonyítékokon alapulnak
ellátási algoritmus - a betegellátási teendők egymásba kapcsolódó folyamatának leírása
eradikáció - a daganat teljes kiírtása
evidence based medicina - bizonyítékokon alapuló orvoslás - olyan orvosi beavatkozások alkalmazása, amelyek megfelelő hatékonyságát tudományos vizsgálatok eredményei bizonyítják
follow up - a daganatos beteg állapotának - általában hosszabb idejű (legalább 3-5 vagy 10 éves) követése
high risk tumor - magas kockázatú daganat
hospice támogatás - a nem gyógyítható rosszindulatú daganatos beteg fizikális, pszichológiai és szociális támogatása
hypoechogenitas - UH-vizsgálatnál a leképezett szervek, szövetek alacsony intenzitású képi megjelenése
irreszekábilis - műtétileg nem eltávolítható
kompetens társzakmák - egy adott daganat lokalizációja és szövődményei szerint érintett orvosi szakterületek összessége, az onkológiai team tagjai
komplex diagnosztika - több diagnosztikai szakterület vizsgálatainak egybehangzó, vagy egymást kiegészítő eredménye alapján felállított diagnózis
komprehenzív onkológiai ellátás - a daganatos beteg valamennyi orvosi szakterület együttműködésével biztosítható kivizsgálása, gyógykezelése, rehabilitációja és minden tekintetben szakértői támogatása
konformális sugárterápia - besugárzási izodózis térfogatának illesztése a daganatos céltérfogathoz
követéses gondozás - a betegek aktív gyógykezelését követő gondoskodás a betegségből való teljes felépülés vagy a kiújulás korai észlelése és ellátása érdekében
krónikus gyógykezelés - a hosszadalmas lefolyású betegség súlyosbodását és az életminőség rosszabbodását akadályozó orvosi beavatkozások rendszeresen ismétlődő alkalmazása
kuratív gyógykezelés - a daganatos betegség gyógyulását célzó orvosi beavatkozás
megelőzés (elsődleges, másodlagos, harmadlagos, negyedleges) - a daganatos elfajulás kialakulásának, illetőleg súlyosbodó stádiumainak bekövetkezése elleni tevékenység
mindfulness based technikák - pszichedukációs kezelések az éberség fejlesztésével, relaxáció, meditáció, vizualizáció elősegítésére a súlyos betegséggel való megküzdés és az új életmód kialakítása érdekében
morfológia - alaktan, orvosi kifejezésként általában szövettani, citológiai, patológiai vizsgálat
multidiszciplináris team - sokszakmás csapat, több orvosi szakterületet képviselő szakemberekből álló munkacsoport, az onkológiai ellátásban az onkoteam megnevezés használatos
multimodális terápia - különböző orvosi szakterületek által (pl. sebészet, sugárterápia, klinikai onkológia) által a rosszindulatú daganatos betegnek nyújtott komplex daganatellenes gyógykezelések tervszerű kombinálása nyaki dissectio - nyaki nyirokcsomó eltávolítása
rezisztencia - ellenállás, ellenszegülés, ellenállóképesség, az egészségügyi ellátásban valamely kezelésnek ellenálló kórtényező eredeti vagy a kezelés során szerzett tulajdonsága
rizikóklasszifikáció - a betegség kimenetelének prognosztizálása a gyógykezelés intenzitásának előzetes tervezhetősége érdekében
stádiumbesorolás (I-II-III-IV) - a betegség súlyosságának osztályozása a daganat kiterjedésének, nyirokcsomó- és távoli-áttétei megjelenésének (TNM) paraméterei alapján
palliativ gyógykezelés - a nem gyógyítható betegség súlyosbodását megakadályozó, késleltető orvosi beavatkozás
perzisztáló tumor - a kezelések mellett is fennmaradó, de nem előrehaladó daganatos állapot
progresszív egészségügyi ellátó rendszer - a kistérségi-megyei-regionális-országos szintű területi ellátási kötelezettséggel működő egészségügyi intézmények hierarchikus kapcsolatrendszere
RákRegiszter - a rosszindulatú daganatos megbetegedések kötelező orvosi jelentéseit fogadó és rendszerező nyilvántartás a rákbetegség terjedésének követése és a rákellenes harc reális alapokra helyezése érdekében
recidíva - visszamarad daganat - műtét vagy már eltávolító kezelés után
recurrens tumor - kiújuló (visszatérő) daganat
sialoadenitis - nyálmirigygyulladás
sialolithiasis - nyálmirigykövesség
sporadikus előfordulás - egy betegségtípus halmozódó előfordulása egy meghatározott földrajzi területen
szcintigráfia - radio-izotópos szer felvételének és szervi eloszlásának sugárdetektoros képalkotó vizsgálata
sztereotaxiás sugárterápia - a daganatos céltérfogatra adandó sugárdózis több irányból való leadása a daganat körüli ép szövetek sugá-károsodásának csökkentése érdekében
supportív kezelések - a daganatellenes kezeléseket követően a beteg felépülését, rehabilitációját elősegítő kezelési módok
terápiás terv - az onkológiai team által készített, diagnosztizált rákbeteg gyógyítását és teljes körű ellátását célzó orvosi beavatkozásokat leíró tervezet, illetve ajánlás
területi ellátási kötelezettség - az egészségügyi intézmények kötelezése az ország meghatározott területén élő lakosság-csoport ellátására a lakóhelyi nyilvántartás szerint
transitional treatment and care - egymásba kapcsolódó gyógykezelési és gondozási teendők
tumor lokalizációja - a rosszindulatú daganat kiindulási helye a szervezet anatómiai régiói, szervrendszerei és szervei szerinti meghatározással, amely alapját képezi a Betegségek Nemzetközi Osztályozásának
UH elasztrográfia - szöveti merevség, keménység ultrahangos vizsgálata
vascularisatió - szervek, szövetek vérerekkel való ellátottsága
WHO klasszifikáció - az Egészségügyi VilágSzervezet által kiadott, nemzetközileg egyeztetett és elfogadott rendszerező osztályozás a betegség vizsgálati tulajdonságai alapján
2. Rövidítések
99mTC: 99m technécium
ALK: a 2-es es kromoszómán elhelyezkedő gén
ATA: American Thyroid Association (Amerikai Pajzsmirigy Szövetség)
BDI: Beck Deprossziós Kérdőív (Depression Inventory)
BNO: Betegségek Nemzetközi Osztályozása
BRAF: a 7-es kromoszómán elhelyezkedő gén, un. protoonkogén, vagyis mutáció esetén onkogénné válik, így hozzájárul a tumor kialakulásához
CD56: az NK (natural killer=természetes gyilkos) sejtek prototípusos markere
CR: complete response (képalkotó vizsgálattal megállapított biológiai válasz rákellenes kezelésre
CTV: clinical target volume; sugárterápia során az a szöveti térfogat, amely tartalmazza a bruttó tumor térfogatot (GTV) és a szubklinikai mikroszkopikus malignus elváltozásokat
DAXX: a Death-associated protein 6 proteint kódoló gén
DCE-MRI: funkcionális MRI technika (dinamikus- mágneses rezonancia vizsgálat
DICER1: szindróma, ritka genetikai rendellenesség, többféle rákos betegségre hajlamosít
DTC: differenciált pajzsmirigy carcinóma
DW-MRI: funkcionális MRI technika (diffúzió súlyozott mágneses rezonancia vizsgálat
EANM: European Association of Nuclear Medicine (Európai Nukleáris Orvostudományi Szövetség)
EBM: evidence based medicine
EBRT: külső sugárterápia
EIF1AX: az emberben eukarióta transzlációs iniciátor faktort (fehérjét) kódoló gén
EMA: European Medicines Agency (Európai Gyógyszer Ügynökség)
EORTC: European Organisation for Research and Treatment of Cancer (Európai Rákügyi Kutatási és Kezelési Szervezet)
ESMO: European Society for Medical Oncology
ETE: extrathyroidal extension
ETA : European Thyroid Association (Európai Pajzsmirigy Szövetség)
EZH1: embereknél a Histone-lysine N-methyltransferase enzyme termelését kódoló gén
FDA: Food and Drug Administration (Élelmiszer és Gyógyszer Felügyelet)
FDG: 18Fluoro-DezoxiGlükóz PET/CT-vizsgálathoz
FNAB: fine needle aspiration biopsy (aspirációs vékonytű biopszia)
FNAC: fine needle aspiration cytology (aspirációs vékonytű biopszia utáni sejtvizsgálat)
fT3: free (szabad) Thyroxin3
FT4: free (szabad) Thyroxin4
FTC: follicularis pajzsmirigy carcinoma
GIST: gastro-intestinalis stroma tumor
GTV: gross tumor volume; sugárterápia során az a szöveti térfogat, amely tartalmazza a bruttó tumor térfogatot
HAMA: endogenous Human Anti-Mouse Antibodies
HBME1 : immunhisztokémiai marker endokrin daganatok vizsgálatánál
HR: hazard ratio, a túlélési elemzésben a veszélyességi arány (HR), pl. gyógyszeres vizsgálatban a kezelt és a kontroll populációban időegység alatt meghaltak aránya
ICD: International Classification of Diseases, a Betegségek Nemzetközi Osztályozása
ICD-O: ICD Oncology, a Betegségek Nemzetközi Osztályozásának onko-patológiai fejezete
IGRT: Image Guided RadioTherapy (kép vezérlésű sugárterápia)
IMA: Immuno-Metrikus-Assay
IMRT: Intenzitás Modulalt RadioTerápia
KRAS: a 12- es kromoszómán elhelyezkedő gén
MACIS: a papillaris pajzsmirigyrák prognózisának becsléséhez kidolgozott rendszer
MGG: May-Grünwald-Giemsa (festés szövettani vizsgálat során)
MKI: MultiKináz Inhibitor
MRI: Magnetic Resonancy Immagination (mágneses rezonanciás leképező vizsgálat)
MP-MRI: multiplanárispercutan, multiparametrikus MRI, mágneses rezonanciás vizsgálat több síkú ábrázolással
mtDNA: mitochondriális DNS
NCCN: National Comprehensive Cancer Network
N/H RAS: génmutáció: - az 1-es kromoszómán elhelyezkedő NRAS gén a sejtosztódás szabályozásában játszik szerepet
NF1: a 17. kromoszómán található gén, a neurofibromin nevű fehérjét kódolja, ami segít a sejtnövekedés szabályozásában
NIBSC: National Institute of Biological Standards and Control: - WHO által ellenőrzött laboratórium
NIFTP: noninvazív follicularis pajzsmirigytumor papillaris magjelenséggel
NRAS: az 1-es kromoszómán elhelyezkedő gén
NTRK: neurotrofikus tropomiozin receptor-tirozin-kináz gén és általa termelt fehérje
OECI: Organisation of European Cancer Institutes, az onkológiai ellátásra sprcializált intézmények európai szervezete
ORR: Overall Response Rate (teljes válaszadási arány) pl. gyógyszeres vizsgálatban a kezelésre biológiai választ adók aránya
OS: Overall Survival (teljes túlélés) pl. gyógyszeres vizsgálatban az összes túlélő a kezelt populációban
PAX8: pajzsmirigy-specifikus transzkripciós faktor a pajzsmirigyrák differenciálódásában
PD-L1: programmed death-ligand1 egy transzmembrán fehérje, amely szerepet játszik az immunrendszer adaptív karjának elnyomásában
PEI: percutan alkoholos infiltráció
PET/CT: Pozitron Emissziós Tomográfia és Computer Tomográfia leképezés kombinációja
PFS: progression-free survival
PI3K/AKT: jelátviteli útvonal a foszfatidil-inozitol-3-kináz és az AKT/ protein kináz B. között
PM: pajzsmirigy
PMC: pajzsmirigy
PPRGI: pajzsmirigy specifikus transzkripciós faktor a pajzsmirigyrák-sejtek differenciáltságának vizsgálata során
PR: Partial Response - képalkotó vizsgálattal megállapított részleges biológiai válasz a rákellenes kezelésre
PTEN: a szervezet szinte minden szövetében megtalálható - más fehérjékről és zsírokról foszfátcsoportot eltávolító enzim előállításához utasításokat adó gén
PTC: papillaris pajzsmirigy carcinoma
pTNM: a daganatos betegség patológiai súlyossága szerinti besorolás a daganat (Tumor) kiterjedése, nyirokcsomó (Nodus) és távoli áttét (Metastasis) megjelenése alapján
PTSD: poszttraumás stresszbetegség
PTV: Planning Target Volume
PSF: progressziómentes túlélés
QTc : az EKG görbe Q és T hullám közötti időszakasz
RAI: RadioAktívIodin (jód) kezelés, postoperatív radiojód terápia
RCT: randomized controlled trial
RECIST: Response Evaluation Criteria in Solid Tumors - Válasz Értékelési Kritériumok Körülírt Tumorok gyógykezelése során
RET/PTC: génátrendeződés (fúzió) a pajzsmirigyrák tumorgenezisében
RIA: radioimmun assay
RFA: rádiófrekvenciás abláció
rhTSH: rekombinans human TSH
SBRT: sztereotaktikus test radioterápia
SD: Stable Disease
SPECT: Single Photon Emission Computed Tomography
SRS: sztereotaktikus sugársebészet
STAI: Spielberger-féle Állapotszorongás Kérdőív (State-Trait Anxiety Inventory)
TAE: transzarteriális embolizáció
TBS I, II, III, IV, V, VI: cytológiai vizsgálat eredménye "Bethesda 2001" osztályozással (TBS: Tris-Buffered Saline (tris pufferelt sóoldat)
TERT: telomeráz reverz transzkriptáz gén, a kromoszóma nem kódoló, promoter regiójának része
TIRADS: pajzsmirigydaganatok klasszifikációs rendszere
Tg: thyreoglobulin szint
TgAb: thyreoglobulin antitest szint
TKI: tirozin-kináz-gátló
TNM: a daganatos betegség klinikai súlyossága szerinti besorolás a daganat (Tumor) kiterjedése, nyirokcsomó (Nodus) és távoli áttét (Metastasis) megjelenése alapján
TP53: a p53 fehérje előállítását kódoló gén, ami tumorszuppresszorként működik a DNS-javítás és a sejtosztódás szabályozásával, ezért a "genom őre" nevet kapta
TSH: Thyreotrop stimuláló hormon
tT3: total (összes) Thyroxin 3
TTF1: pajzsmirigy-specifikus transzkripciós faktor a pajzsmirigyrák differenciálódásában
V600: a BRAF gén többféle daganatnál megfigyelt mutációs helye
WBRT: teljes agyi sugárterápia
WHO: World Health Organization (Egészségügyi Világszervezet).
3. Bizonyítékok szintje
A fejlesztőcsoport kritikusan értékelte az adaptációra kiválasztott és a hivatkozott irányelvek bizonyíték- és ajánlásbesorolási rendszerét és ennek alapján döntötte el, hogy a jelen egészségügyi szakmai irányelvben mely ajánlás erősségi rendszert alkalmazza.
A más irányelvből/publikációból származó evidenciákat a fejlesztőcsoport szintén megvizsgálta és a kialakított ajánlás-besorolási rendszernek megfelelően átsorolta.
| Ajánlás erőssége (grade) | Haszon és kockázat | Evidencia szintje (level) | Evidencia létrejötte | Evidencia interpretációja | Jelölés |
| erősen ajánlott | a haszon egyértelműen meghaladja a kockázatot | Magas | 1. Randomizált, kontrollált vizsgálat (RCT), amelynek nincs fontosabb korlátja. 2. Megfigyelésekből származó, nagyon meggyőző evidencia | A terápiás beavatkozás a legtöbb betegben alkalmazható, szinte minden körülmény között megszorítás nélkül | A |
| Közepes | 1. RCT vagy más jó minőségű vizsgálat, fontos korlátokkal 2. Megfigyelésekből származó, meggyőző evidencia | ||||
| Alacsony | Megfigyelésekből vagy esetleírásokból származó evidencia | Változhat, ha jobb minőségű evidencia keletkezik. | |||
| korlátokkal ajánlott | a haszon és kockázat közel egyensúlyban van | Magas | 1. RCT, amelynek fontosabb korlátja nem ismert. 3. Megfigyelésekből származó, nagyon meggyőző evidencia | A legkedvezőbbnek tartott beavatkozás különböző lehet a körülményektől vagy a betegvizsgálat eredményeitől függően. | B |
| Közepes | 1. RCT vagy más jó minőségű vizsgálat, fontos korlátokkal. 2. Megfigyelésekből származó, meggyőző evidencia | ||||
| Alacsony | Megfigyelésekből vagy esetleírásokból származó evidencia | Más beavatkozások is azonos eredményességgel szóba jönnek | |||
| gyengén ajánlott | a haszon és kockázat aránya nem becsülhető | Ellentmondó vagy hiányzó | szakértői tapasztalatból származó javaslat (expert opinion) | Nincs elég evidencia, ami a beavatkozás mellett vagy ellene szólna. | C |
| + | |||||
| Ajánlás erőssége (grade) | Haszon és kockázat | Evidencia szintje (level) | Evidencia létrejötte | Evidencia interpretációja | Jelölés |
| nem ajánlott | a haszon egyértelműen kisebb a kockázatnál | nem értelmezhető | 1. RCT vagy más jó minőségű vizsgálat eredménye 2, Megfigyelésekből származó egyértelmű álláspont | Elegendő ismeret áll rendelkezésre a beavatkozás indikációja ellen | D |
Forrás: Fejlesztő munkacsoport által szerkesztett
4. Ajánlások rangsorolása
A fejlesztőcsoport konszenzusával kialakított és alkalmazott ajánlás-rangsorolási rendszer.
| Jelölés | Ajánlás erőssége* |
| A | Erősen ajánlott - A terápiás beavatkozás a legtöbb betegben alkalmazható, szinte minden körülmény között megszorítás nélkül. |
| B | Korlátokkal ajánlott - A legkedvezőbbnek tartott beavatkozás különböző lehet a körülményektől vagy a betegvizsgálat eredményeitől függően. |
| C | Gyengén ajánlott - Nincs elég evidencia, ami a beavatkozás mellett vagy ellene szólna. |
| D | Nem ajánlott - Elegendő ismeret áll rendelkezésre a beavatkozás indikációja ellen. |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
V. BEVEZETÉS
1. A témakör hazai helyzete, a témaválasztás indokolása
A pajzsmirigyrákos incidencia utóbbi évtizedben tapasztalt növekedése mellett csökkenő mortalitási arány és ezáltal a túlélési adatok jelentős javulása a korai felfedezés-és-kezelés (early detection and treatment) ellátási elv érvényesülésének köszönhető, ami szervezett népességi szűrővizsgálatára alkalmas módszer hiányában az onkológiai éberség javulásának tudható be az orvos-beteg találkozások, különösen a pajzsmirigyműködéssel összefüggő panaszok és tünetek alap- és szakorvosi ellátása során.
A pajzsmirigydaganatok földrajzi régiónként eltérően 100 000 lakosra évente 1-5 új megbetegedést okoznak. A daganat specifikus túlélési adatok az utóbbi évtizedben folyamatosan javultak. Az évenként regisztrált új betegek mortalitása 10% körül van. A daganat specifikus túlélési valószínűségek 20 év múltán papillaris rák esetén 80-90%, follicularis daganat esetén 70-80%. Az irányelvben a pajzsmirigydaganatok kb. 95%-át kitevő follicularis hám eredetű daganatokkal foglalkozunk.
A Rákregiszter adatai szerint Magyarországon 2015-ben összesen 854, 2018-ban 944 pajzsmirigyrákos esetet jelentettek. [1] A differenciált pajzsmirigyrák incidenciája az elmúlt években hazánkban is jelentősen növekedett, a daganatspecifikus halálozás azonban érdemben nem változott. A daganatok többsége korai stádiumú, jó prognózisú, ezért a nemzetközi irányelvek a kevésbé radikális ellátás mellett foglaltak állást. [2]
Sporadikus előfordulás jellemzi a papillaris, follicularis daganatokat, bár halmozódás figyelhető meg a régió jódellátottságának, illetve háttérsugárzásának megfelelően. Jódgazdag vidéken és magasabb háttérsugárzás esetén a papillaris carcinomák, jódhiányos területen a follicularis carcinomák száma emelkedik. Az anaplasticus rákok jelentős része a papillaris és follicularis daganatok terminalis átalakulásával alakul ki. Az anaplasticus rákok megjelenése csökkenőben van, mely összefüggésbe hozható a papillaris, follicularis daganatok korai primer ellátásával. Három autoszomalis dominansan öröklődő kórkép esetén figyeltek meg papillaris carcinomát (Familiaris adenomatosus colon polyposis, Gardner-szindróma, Cowden-betegség).
A differenciált pajzsmirigyrákos betegek körében lokalizált betegség esetén a várható 5 éves túlélés 98.1%, távoli áttét esetén 55.5%, jódfelvevő, perzisztáló daganatban szenvedők 10 éves túlélése 29%, a kezdettől hiányzó jódfelvétel esetében pedig a 10 éves túlélés 10%. [3]
A témaválasztást indokolja az össztársadalmi rákellenes küzdelemben (Nemzeti Rákellenes Program) kiemelt jelentősége, a daganatok társadalmi veszélyessége (a népesség halálozása szempontjából a második legveszélyesebb betegségcsoport) és a tudományos ismeretszerzés felgyorsulása.
Az egészségügyi szakmai irányelv ajánlásainak betartásával egészségnyereséget, az egészségügyi ellátás minőségének, valamint a beteg kimenetel javulását (pl. túlélés, életminőség stb.) lehet elérni, hatékony erőforrás felhasználás mellett.
E daganatellenes ellátásokra is érvényes az egészségügyi ellátás egyenetlensége mind az új tudományos módszerek ismerete és alkalmazása, mind a nyújtott szolgáltatások minőségi színvonala, a minőségi ellátás hozzáférhetősége, a rendelkezésre álló szellemi és anyagi erőforrások eloszlása és hatékony felhasználása, együttesen az elvárható gyógyítási eredmények elérése tekintetében. Jelen egészségügyi szakmai irányelv közvetlen célja a betegek ellátásában jelenleg tapasztalható egyenetlenség és szervezetlenség felszámolása, a komprehenzív szemléletű komplex ellátás folyamatosságának (transitional treatment and care) biztosítása minden egyes beteg részére. Az ellátás biztonságát és egyenletesen magasabb színvonalra emelését olyan egységes módszerek alkalmazása/ elterjesztése szolgálja, amelyek a gyógyítás eredményessége és költséghatékonysága szempontjából egyaránt megfelelnek a bizonyítékokon alapuló orvoslás (evidence based medicine=EBM) követelményeinek, vagy ahol ilyen evidenciák még nem ismeretesek, ott a szakma szabályainak megfelelő és a lehető legszélesebb nemzetközi/hazai szakmai körben konszenzussal elfogadott szakértői álláspont (expert opinion) talaján állnak.
Megbízható tudományos bizonyítékok állnak rendelkezésre az egészségügyi szakmai irányelv ajánlásainak összeállításához.
2. Felhasználói célcsoport
Ellátottak: a továbbiakban részletezett ajánlások célcsoportjai azok a panasz, tünet nélküli személyek, akik a címben foglalt daganatok korai felfedezését elősegítő általános, vagy szűrő jellegű orvosi vizsgálaton részt vesznek. Célcsoportba tartoznak továbbá azok a személyek, akik a daganat konkrét gyanúját tisztázó, vagy a diagnózist pontosító speciális vizsgálatokban, diagnosztikus eljárásokban vesznek részt. A célcsoportot képezik továbbá azok a személyek, akik a daganat diagnózisa alapján kuratív vagy palliatív célú aktív vagy krónikus gyógykezelésben részesülnek, illetve a daganatos állapot kontrollálása, követéses gondozása alatt állnak.
Ellátók: a címben foglalt daganattal rendelkező betegek felfedezése, kivizsgálása, gyógykezelése és gondozása során ellátást nyújtó minden, a magyarországi progresszív betegellátás valamennyi szintjén tevékenykedő egészségügyi ellátó.
3. Kapcsolat a hivatalos hazai és külföldi szakmai irányelvekkel
Egészségügyi szakmai irányelv előzménye:
Hazai egészségügyi szakmai irányelv ebben a témakörben még nem jelent meg.
Kapcsolat külföldi szakmai irányelv(ek)kel:
Jelen irányelv az alábbi külföldi irányelv(ek) ajánlásainak adaptációjával készült.
| Szerző(k): | HaugenBR, Alexander EK, Bible KC, Doherty GM, Mandel SJ, NikiforovYE, Pacini F, Randolph GW, Sawka AM, Schlumberger M, SchuffKG, Sherman SI, Sosa JA, Steward DL, Tuttle RM, Wartofsky L. |
| Tudományos szervezet: Cím: | American Thyroid Association 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer |
| Megjelenés adatai: Elérhetőség: | Thyroid 26:1-133, 2016 DOI: 10.1089/thy.2015.0020 |
| Szerző(k): Tudományos szervezet: Cím: Megjelenés adatai: Elérhetőség: | NCCN Guidelines Panel National Comprehensive Cancel Network Clinical Practice Guidelines in Oncology: Thyroid Cancer Version 2.2021 - September 1. 2021 https://www.nccn.org/professionals/physician_gls/pdf/thyroid_ blocks.pdf |
| Szerző(k): | S. Filetti, C. Durante, D. Hartl, S. Leboulleux, LD Locati, K. Newbold, |
| MG Papotti, A. Berruti | |
| Tudományos szervezet: | European Society for Medical Oncology (ESMO) |
| Cím: | Thyroid Cancer: ESMO Clinical Practice Guidelines for diagnosis, |
| treatmant and follow up | |
| Megjelenés adatai: | Annals of Oncology 30: 1856.1883, 2019 |
| Elérhetőség: | doi:10.1093/annonc/mdz400 |
Kapcsolat hazai egészségügyi szakmai irányelv(ek)kel:
Jelen irányelv az alábbi, közzététel időpontjában megjelenés alatt álló hazai egészségügyi szakmai irányelvvel áll kapcsolatban.
Azonosító: 002200
Cím: A pajzsmirigybetegségek radiojód kezeléséről
Megjelenés adatai: folyamatban
Elérhetőség: Egészségügyi Közlöny
VI. AJÁNLÁSOK SZAKMAI RÉSZLETEZÉSE
1. A BETEGSÉG ÁLTALÁNOS JELLEMZŐI
1.1. Kiindulási hely
A pajzsmirigyrák leggyakrabban a lebenyekben, aztán az isthmus területén, nagyon ritkán a ductus thyreoglossusnak megfelelő maradványban alakulhat ki.
A primer tumor lokális terjedése
A pajzsmirigy állományában a daganat akadálytalanul terjed, amíg a szerv tokját el nem éri. A tok infiltrációja után a pajzsmirigy melletti zsír, kötőszöveten keresztül a környező képletek felé terjed. Leggyakrabban az egyenes nyakizmokat, a garatizmokat és a nervus recurrenst infiltrálja. A légcső és a gége porcos váza tovább ellenáll. A nagy nyaki érképletek mint a v. jugularis interna és az arteria carotis communis pedig nagy kiterjedésű daganatok esetén általában dislocalt, de sokáig nem beszűrt. A papillaris carcinoma szinte kizárólag limfogén úton, a follicularis és az anaplasticus carcinoma jellemzően vérér invázióval terjed.
A metasztatizálás irányai
A pajzsmirigy regionális nyirokcsomói a nyaki, illetve a felső mediastinalis nyirokcsomók. A nyaki régiót compartmenekre, illetve ezekkel összehasonlítható szintekre (level) oszthatjuk.
A centrális nyaki compartment (a jugulum, a nyelvcsont és a kétoldali v. jugularis interna által bezárt terület) megfelel a VI-os szintnek. Ez az áttétképződés első állomása. A terjedés innen két irányba, a kétoldali parajugularis nyirokláncon át (lateralis compartmentek, illetve Level II-IV) a koponyaalap felé, illetve a praetrachealis-paratrachealis-parapharyngealis nyirokláncon keresztül a felső mediastinum (paratrachealis, paraoesophagealis, elülső és hátsó mediastinalis lánc) felé történhet.
A papillaris carcinoma 60-90%-ban ad mikroszkopikus nyaki nyirokcsomó áttétet, melyeknek közel fele klinikailag nem felismerhető. Ezek egy része ún. nyugvó áttét marad. A megfelelő radikalitással elvégzett műtétek preparátumainak feldolgozása alapján a felső mediastinumban szintén gyakori (40-60%) az áttétek száma. A follicularis rák ritkán, inkább a rossz kórjóslatú variánsokban képez nyirokcsomóáttétet. Az anaplasticus rákok felfedezésével egy időben gyakran már környezetét infiltráló nyaki áttétek is jelen vannak, melyeket nehéz elkülöníteni a primer tumortól. Kétoldali nyaki nyirokcsomóáttétek jelenlétében gyakran található mediastinalis áttét. Az agyi metastasis kialakulását többnyire tüdőáttét előzi meg.
A follicularis hám eredetű rákok haematogen szórása miatt általában a tüdőben és a csontokban alakulnak ki távoli áttétek. Agyi áttét kialakulása ritka, általában már manifeszt tüdőáttét után jelentkezik.
1.2. A daganat szövettani típusai
A pajzsmirigy follicularis hámból kiinduló rosszindulatú daganatok fő szövettani típusai a jelenleg érvényben lévő 2017-es WHO klasszifikáció alapján: papillaris carcinoma, follicularis carcinoma, Hürthle sejtes carcinoma, rosszul differenciált és anaplasticus carcinoma. Előfordulási gyakoriságuk: papillaris carcinoma 65-90%, follicularis carcinoma 6-10%, Hürthle sejtes carcinoma 1-2%, rosszul differenciált carcinoma 4%, anaplasticus carcinoma 1-2%. Az irodalmi adatok és a halmozódó tapasztalatok alapján várható, hogy a 2022-es WHO klasszifikációban megjelenik a "low risk tumorok" csoportja. [4]
Az 1. táblázatban összefoglaltuk a rosszindulatú follicularis hám eredetű pajzsmirigytumorok 2017-es WHO szerinti klasszifikációját.
1. táblázat: Follicularis hám eredetű pajzsmirigytumorok 2017-es WHO szerinti klasszifikációja.
| Papillaris carcinoma |
| Papillaris carcinoma (PTC) klasszikus |
| Encapsulalt papillaris carcinoma klasszikus |
| Infiltratívfollicularisvariánsú papillariscarcinoma |
| Invazívencapsulaltfollicularisvariánsú PTC* |
| Diffúz sclerotisalo PTC |
| Solid/trabecularis PTC |
| Warthin-like PTC |
| Oncocyter PTC |
| Világos sejtes PTC |
| Orsósejtes PTC |
| PTC fibromatosis-like stromával |
| Magas sejtes (tall cell) PTC |
| Hobnail PTC |
| PTC columnar sejtes variáns |
| Papillarismicrocarcinoma |
| Folliculariscarcinoma |
| Folliculariscarcinoma, minimálisan invazív |
| Folliculariscarcinoma, encapsulalt angioinvazív |
| Folliculariscarcinoma, szélesen invazív |
| Hürthle sejtes carcinoma |
| Hürthle sejtes carcinoma, minimálisan invazív |
| Hürthle sejtes carcinoma, encapsulalt angioinvazív |
| Hürthle sejtes carcinoma, szélesen invazív |
| Rosszul differenciált pajzsmirigy carcinoma* |
| Anaplasticuscarcinoma |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
*A rendelkezésre álló irodalmi adatok és a legújabb molekuláris eredmények alapján várható, hogy a 2022-es új WHO klasszifikációban változik majd ezen daganatok besorolása, nomenklatúrája, de a biológiai viselkedésüket és a terápiás konzekvenciákat illetően lényegi változás nem valószínű.
Papillaris carcinoma
Ajánlás1
A pajzsmirigy follicularis hám eredetű rákjainak leggyakoribb típusa a papillaris carcinoma. Pajzsmirigydaganatok makroszkópos feldolgozása során papillaris carcinoma gyanúja vagy diagnózisa esetén a teljes eltávolított lebenyt vagy lebenyeket fel kell dolgozni a többgócúság és invazivitás pontos megítéléséhez. (A) [5]
A pajzsmirigy follicularis hám eredetű rákjainak leggyakoribb típusa. Pajzsmirigydaganatok makroszkópos feldolgozása során papillaris carcinoma gyanúja vagy diagnózisa esetén a teljes eltávolított lebenyt vagy lebenyeket fel kell dolgozni a többgócúság és invazivitás pontos megítéléséhez. [5] A többgócúság önmagában nem rontja a kórjóslatot. Legfontosabb diagnosztikus kritérium a "papillaris magok" megléte. Jellemzői: ún. tejüveg mag, ami a normál folliculus hámsejtek magjánál legalább kétszer nagyobb és vaskos, gyakran rigid, szögletes, éles magkontúr, magbarázda (coffee bean) megjelenése, maginklúziók. Az immmunhisztokémiai vizsgálatok szerepe másodlagos, inkább csak a morfológia további alátámasztására alkalmazzuk. A papillaris carcinoma jellemzően cytokeratin 19, HBME1 és Galectin pozitív, míg gyakori a CD56 vesztés. Gyakran ad nyirokcsomóáttétet, nem jellemző a vérér invázió. Vérér invázió esetén mindig ki kell zárni a follicularis carcinoma lehetőségét. A papillaris mikrocarcinoma definíciója: <_1cm átmérőjű daganat. Amennyiben metasztázis nincs, kiváló prognózisú. [6]
A papillaris carcinomák döntő többsége jó prognózisú, kedvezőtlenebb biológiai viselkedésű típusai a diffúz szklerotizáló, a "tall cell" és a "hobnail" sejtes variánsok. Ezekre jellemző a gyakoribb nyirokcsomó és távoli áttét, illetve a lokális recidíva. A follicularis variáns infiltratív típusa a klasszikus papillaris carcinomához hasonlóan viselkedik, míg az encapsulalt follicularis típusú papillaris carcinoma indolens daganat. A "cribriform morular" variáns összefüggést mutat a vastagbél familiáris adenomatosus polyposissal, Adenomatous Polyposis Coli (APC) és a béta-catenin 1-es típust kódoló gén (CTNNB1) mutáció jellemzi.
Follicularis carcinoma
Ajánlás2
Follicularis szerkezetű daganat esetén a malignitás kritériuma a tok- vagy vérérinvázió jelenléte. [7, 8] Az elváltozást teljes egészében fel kell dolgozni, különös tekintettel a széli részekre, a tokra. Az invazivitás megítéléséhez javasolt sorozatmetszetek készítése és immunhisztokémiai vizsgálat az érinvázió megítélésére. (A)
A második leggyakoribb follicularis hám eredetű rák a follicularis carcinoma. A malignitás kritériuma a tok- vagy vérérinvázió jelenléte. [7, 8] Follicularis szerkezetű daganat esetén az elváltozást teljes egészében fel kell dolgozni, különös tekintettel a széli részekre, a tokra. Az invazivitás megítéléséhez javasolt sorozatmetszetek készítése és immunhisztokémiai vizsgálat az érinvázió megítélésére. A tokinvázió definíciója a tok teljes vastagságának tumoros infiltrációja. Az érinvázió a tokban vagy azon kívül elhelyezkedő érben endothellel fedett, vagy trombussal asszociált intravascularis daganatsejtcsoportot jelenti. A minimálisan invazív follicularis carcinoma esetén csak tokinfiltráció azonosítható. Vérér invázió jelenlétekor (akár egyetlen fókuszban is), az encapsulált angioinvazív csoportba sorolandó a daganat. [9] A szélesen invazív daganat a tokját több ponton, szélesen infiltrálja, gyakori az extrathyroidalis terjedés és a vérérinvázió.
Hürthle sejtes carcinoma
A WHO 2017-es klasszifikáció külön entitásként határozza meg ezen daganatokat, elsősorban az agresszívebb viselkedésük és a gyakori radioaktív jód rezisztencia alapján. Nem mutatja a papillaris cc. és a high grade tumorok jellegzetességeit.
A Hürthle sejtes, vagy oncocytás carcinoma oncocytaer sejtekből felépülő, encapsulalt, gyakran szélesen invazív, angio- és/vagy tokinváziót mutató daganat.
Rosszul differenciált carcinoma
Agresszív biológiai viselkedésű daganat. Általában solid, trabecularis vagy insuláris szöveti mintázatot mutat. Jól differenciált carcinoma komponens gyakran azonosítható, anaplasia nem jellemző. A növekedési mintázat mellett további diagnosztikus kritériumok: > 5 osztódás/2 mm2, necrosis jelenléte, papillaris magjelenség hiánya. Jól differenciált tumorokban 10%-os rosszul differenciált komponens jelenléte már agresszívebb biológiai viselkedéssel jár. A 2017-es WHO beosztás hátránya, hogy a differenciált tumorok, pl. papillaris carcinoma magjelenségeit még mutató, de high grade jellemzőkkel (magas mitotikus aktivitás, necrosis) rendelkező daganatoknak megfelelő kategóriát nem tartalmaz. A rosszul differenciált csoportba a Torinói kritériumok alapján nem sorolhatók be ezek a daganatok. [10, 11]
Anaplasticus carcinoma
A follicularis hámból kiinduló legrosszabb prognózisú, kifejezetten agresszív daganat. Orsósejtes, pleomorf, squamoid vagy rhabdoid morfológiát is mutathat. A pajzsmirigy follicularis hámra jellemző immunhisztokémiai markereket (TTF1, PAX8) általában elveszti. Gyakran csak fokális cytokeratin pozitivitás jellemzi és kizárásos diagnózis. Ritkán jól differenciált pajzsmirigy tumoron belül minor komponensként megjelenhet, ilyenkor kedvezőbb biológiai viselkedés jellemző.
A 2017-es WHO klasszifikációban újdonság a bizonytalan malignitási potenciállal rendelkező, low risk kategóriába sorolható tumorok elkülönítése. Ezek a noninvazív follicularis pajzsmirigytumor papillarisszerű magokkal (NIFTP) [12], a jól differenciált tumor bizonytalan malignitási potenciállal és a follicularis tumor bizonytalan malignitási potenciállal. Ezek várhatóan a következő klasszifikációban egy új, elkülönült "low risk" kategóriába kerülnek majd.
A differenciált pajzsmirigytumorok diagnosztikájában a papillaris magjelenségek, a tok- és vérérinvázió megítélése alapvető a dignitás meghatározásában. A 2. táblázatban látható az ezeken alapuló egyszerűsített diagnosztikus algoritmus tisztán follicularis mintázatú daganatok esetén.
2. táblázat: Egyszerűsített diagnosztikus algoritmus tisztán follicularis mintázatú daganatok diagnosztizálására.
| Tokinfiltráció, vérérinvázió | ||||
| Jelen van | Kérdéses | Hiányzik | ||
| Papillaris magjelenség | Jelen van | Papillaris carcinoma invazív encapsulalt follicularisvariáns | Jól differenciált tumor bizonytalan malignitási potenciállal | Noninvazív follicularis pajzsmirigytumor papillarisszerű magokkal (NIFTP) |
| Kérdéses | Jól differenciált carcinoma NOS | |||
| Hiányzik | Follicularis carcinoma | Follicularis tumor bizonytalan malignitási potenciállal | Follicularis adenoma | |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Ajánlás3
A differenciált pajzsmirigydaganatok molekuláris patológiai vizsgálata diagnosztikus, prognosztikus és terápiás céllal történhet. Terápiás célú vizsgálat elsősorban radiojód rezisztens tumorok, illetve rosszul differenciált és anaplasticus carcinoma esetén indokolt. (B) [2]
Diagnosztikus céllal leggyakrabban papillaris carcinoma megerősítésére BRAF mutáció vizsgálat történik. [13] A prognosztikus célú mutációk közül a TERTp mutáció emelhető ki, ami follicularis carcinoma és papillaris carcinoma esetén is egyértelműen negatív prognosztikai faktor, gyakori a high grade jellemzőket (vérér invázió, magas mitotikus aktivitás, necrosis) mutató daganatokban, jelenléte kiterjesztettebb műtéti beavatkozást indokolhat. A 3. táblázatban összefoglaltuk a pajzsmirigy follicularis hám eredetű tumorokra jellemző leggyakoribb genetikai eltéréseket.
3. táblázat: A pajzsmirigy follicularis hám eredetű tumorokra jellemző leggyakoribb genetikai eltérések.
| Mutációk | Follicularisca | Papillaris/anaplasticus ca | Analízis célja |
| BRAF V600E | - | + | Diagnosztikus, terápiás |
| TERTp | + | + | Prognosztikus (negatív prognosztikai faktor) |
| NRAS | + | -/+ | Diagnosztikus |
| Fúziók | |||
| RET/PTC | - | + | Terápiás |
| NTRK1/3 | - | + | Terápiás |
| ALK | - | + | Terápiás |
| PAX8/PPRG | + | - | Diagnosztikus |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
1.3. A várható biológiai viselkedést befolyásoló tényezők
A beteg kezelését, túlélését döntően meghatározza a daganat kiterjedése, környezetéhez való viszonya, a szövettani típusa és a differenciáltsága, valamint a beteg életkora (a fiatal betegek kórjóslata kedvezőbb).
4. táblázat. A daganatspecifikus túlélés prognosztikai faktorai differenciált pajzsmirigyrákokban.
| Prognosztikai faktor | Papillariscarcinoma | Folliculariscarcinoma |
| pT (tumornagyság) | + | + |
| pT4 (pajzsmirigytokon való tumoráttörés) | + | + |
| pN (nyirokcsomóáttét) | - | ± |
| M (távoli áttét) | + | + |
| Szövettani differenciáltság | - | + |
| S-fázis-arány | + | + |
| DNS-ploidia | + | + |
| Életkor | + | + |
| Öröklődésmenet típusa | - | - |
| Sebészi kezelés teljessége | + | + |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
1.4. A klasszifikáció szabályai
A pajzsmirigy rosszindulatú daganat megbetegedéseinek klinikai diagnózisait a Betegségek Nemzetközi Osztályozása (BNO) vagy International Classification of Diseases (ICD) a C73 kódjel alá sorolja, míg a szövettani diagnózisokat és morfológiai kódjaikat az ICD Oncology fejezete (ICD-O) tartalmazza. Utóbbi klasszifikáció csak daganatokra érvényes. A klinikai diagnózis és kód mellett kötelező a szövettani diagnózis megadása, amelybe a szövettani altípus meghatározása is beletartozik.
A daganatos állapot előrehaladottsága (kiterjedése) a tumor szervi helyzetével (T), a nyirokcsomók érintettségével (N) és metasztázis jelenlétével (M) jellemezhető, amely kategóriák meghatározásához használt vizsgálati módszerektől függően beszélhetünk klinikai "TNM" vagy patológiai "pTNM" rendszerről.
A pajzsmirigy daganatok nyirokcsomó-érintettsége szempontjából fontos regionális nyirokcsomók a cervicalis és felső/alsó mediastinalis nyirokcsomók.
TNM osztályozás
A klinikai TNM kategóriák meghatározásához a következő eljárások alkalmazása javasolt:
T kategóriák Fizikális vizsgálat, endoszkópia és képalkotó eljárás
N kategóriák Fizikális vizsgálat és képalkotó eljárás
M kategóriák Fizikális vizsgálat és képalkotó eljárás
T - Primer tumor
TX Primer tumor nem ítélhető meg
T0 Primer tumor nem mutatható ki
T1 2 cm vagy annál kisebb maximális átmérőjű tumor, a pajzsmirigy anatómiai határain belül
T2 A tumor nagyobb, mint 2 cm, de nem nagyobb, mint 4 cm, a pajzsmirigy határain belül
T3 A tumor (legnagyobb átmérője) nagyobb, mint 4 cm, a pajzsmirigy határain belül, vagy bármely méretű, minimális extrathyreoid terjedést mutató tumor (pl. a sternothyreoid izom vagy a perithyreoid lágy részek)
T4a A tumor a pajzsmirigy tokján túlra terjed, és a következő helyek valamelyikét szűri be: bőr alatti lágy részek, larynx, trachea, oesophagus, laryngealis nervus recurrens
T4b A tumor ráterjed a praevertebralis fasciára, a mediastinum ereire, vagy befogja az a. carotist
T4a* (csak anaplasticus rák esetén): Bármely méretű, a pajzsmirigyre korlátozott daganat**
T4b* (csak anaplasticus rák esetén): Bármely méretű, a pajzsmirigy tokján túlra terjedő daganat***
Megjegyzés:
* Bármely szövettani típushoz tartozó multifocalis tumor esetében az (m) szimbólumot kell alkalmazni (mindig a legnagyobb méretű daganathoz kell igazítani a T stádiumot), Pl. T2 (m)
* Minden anaplasticus vagy nem differenciált carcinoma eleve T4-nek tekintendő.
** Intrathyreoid elhelyezkedésű anaplasticus carcinoma sebészileg reszekábilisnak tekintendő.
*** Extrathyreoid elhelyezkedésű anaplasticus carcinoma sebészileg irreszekábilisnak tekintendő.
N - Regionális nyirokcsomók
NX Regionális nyirokcsomóáttét nem igazolható
N0 Nincs regionális nyirokcsomóáttét
N1 Regionális nyirokcsomóáttét
N1a Áttét a VI-os szinten (Level VI = pretrachealis és paratrachealis nyirokcsomók, beleértve a prelaryngealis és a Delphian-nyirokcsomókat is)
N1b Egyoldali, kétoldali vagy ellenoldali cervicalis, vagy felső mediastinalis nyirokcsomók
M - Távoli áttétek
MX Távoli áttét nem igazolható
M0 Távoli áttét nincs
M1 Távoli áttét(ek)
pTNM (UICC 8.kiadás):
pT
pT0: Primer tumor nem azonosítható
pT1: Tumor ≤ 2cm legnagyobb átmérőjű, pajzsmirigyre lokalizált
pT1a: Tumor ≤ 1 cm legnagyobb átmérőjű, pajzsmirigyre lokalizált
pT1b: Tumor > 1 cm de ≤ 2 cm legnagyobb átmérőjű, pajzsmirigyre lokalizált
pT2: Tumor > 2 cm, de ≤ 4 cm legnagyobb átmérőjű, pajzsmirigyre lokalizált
pT3: Tumor > 4 cm pajzsmirigyre lokalizált, vagy makroszkópos extrathyroidalis terjedés harántcsíkolt izomba
pT3a: Tumor > 4 cm pajzsmirigyre lokalizált
pT3b: Makroszkópos extrathyroidalis terjedés csak harántcsíkolt izomba (sternohyoid, sternothyroid, thyrohyoid, vagy omohyoid izmok) bármilyen tumorméret
pT4: Makroszkópos extrathyroidalis terjedés harántcsíkolt izmon túl
pT4a: Makroszkópos extrathyroidalis terjedés subcutan lágyrészek, larynx, trachea, esophagus, vagy nervus laryngealis recurrens, bármilyen tumorméret
pT4b: Makroszkópos extrathyroidalis terjedés prevertebralis fascia vagy arteria carotica vagy mediastinalis erek körüli infiltráció, bármilyen tumorméret
pN
pNX: Regionális nyirokcsomó nem került eltávolításra
pN0: Nincs lokoregionális nyirokcsomó metasztázis#
pN0a: Egy vagy több citológiával vagy szövettanilag igazolt benignus nyirokcsomó
pN1: Metasztázis regionális nyirokcsomókban
pN1a: Metasztázis VI vagy VII régió (pretrachealis, paratrachealis, vagy prelaryngealis, vagy felső mediastinalis) nyirokcsomóiban. Lehet egyoldali vagy kétoldali.
pN1b: Metasztázis egyoldali, kétoldali, vagy kontralateralis lateralis nyaki nyirokcsomókban (I, II, III, IV, vagy V régió) vagy retropharyngealis nyirokcsomó.
# N0b: nincs radiológiailag vagy klinikailag igazolt lokoregionális nyirokcsomó metasztázis
pM (csak akkor adjuk meg, ha patológiailag igazolt)
pM1: Távoli metasztázis
Stádiumbesorolás
A stádium beosztás a pTNM 8. kiadás alapján történik. [14] A stádium beosztáshoz használt életkor 45-ről 55 évre emelkedett. A nyirokcsomó áttét nem sorolja a beteget III. klinikai stádiumba, 55 év alatt az N1 betegség I. klinikai stádiumot, 55 év felett II. stádiumot jelent. A csak szövettani vizsgálattal azonosítható extrathyreoideális terjedés nem módosítja a T stádiumot.
pN0 A szelektív nyaki blokk-disszekció útján nyert szövetmintából lehetőség szerint 6 vagy több nyirokcsomó szövettani vizsgálatát kell elvégezni. Amennyiben a vizsgált nyirokcsomók negatívnak bizonyulnak, de a megkívánt nyirokcsomószám nem áll rendelkezésre, a besorolás pN0.
Külön stádiumbesorolás szükséges a papillaris és follicularis és teljesen különböző az anaplasticus carcinoma eseteiben.
| Papillaris vagy follicularis, 55 év alatt | |||
| Stádium I | bármely T | bármely N | M0 |
| Stádium II | bármely T | bármely N | M1 |
| Papillaris vagy follicularis 55 év felett | |||
| Stádium I | T1-2 | N0 | M0 |
| Stádium II | T3 | N0 | M0 |
| T1-3, | N1 | M0 | |
| Stádium III | T4a | bármely N | M0 |
| Stádium IVA | T4b | bármely N | M0 |
| Stádium IVB | bármely T | bármely N | M1 |
| Anaplasticus carcinoma (minden eset stádium IV) | |||
| Stádium IVA | T1, T2, T3a | N0 | M0 |
| Stádium IVB | T1, T2, T3a | N1 | M0 |
| Stádium IVB | T3b, T4a, T4b | N0, N1 | M0 |
| Stádium IVC | bármely T | bármely N | M1 |
Ajánlás4
A pajzsmirigyrák klinikai jelentőségének értékeléséhez részletes patológiai lelet szükséges, amely támpontot ad a prognózis megítéléséhez is [5] (Prognosztikai patológiai lelet, 1. sz. melléklet). (B)
1. sz. melléklet: Elvárások a prognosztikai patológiai lelettel szemben
| Prognosztikai patológiai lelet |
| Klinikai adatok: |
| Korábban besugárzás |
| Történt |
| Nem történt |
| Pajzsmirigy daganat családi halmozódás |
| Ismert |
| Nem ismert |
| Citológiai vizsgálat eredménye |
| TBS I |
| TBS II |
| TBS III |
| TBS IV |
| TBS V |
| TBS VI |
| Beavatkozás típusa: |
| Total thyroidectomia |
| Jobb lobectomia |
| Bal lobectomia |
| Jobb részleges excisio |
| Bal részleges excisio |
| Jobb lobectomia isthmusectomiával (hemithyroidectomia) |
| Bal lobectomia isthmusectomiával (hemithyroidectomia) |
| Jobb lebeny és részleges bal lobectomia (subtotal vagy közel total thyroidectomia) |
| Bal lebeny és részleges jobb lobectomia (subtotal vagy közel total thyroidectomia) |
| Komplettáló thyroidectomia (reoperáció) |
| Tumor lokalizációja: |
| Jobb lebeny |
| Bal lebeny |
| Isthmus |
| Pyramidalis lebeny |
| Egyéb: |
| Tumor fokalitás: |
| Egygócú |
| Több gócú (1cm-nél nagyobb tumor gócokra vonatkozóan külön-külön meg kell adni a prognosztikai |
| paramétereket) |
| Nem határozható meg |
| Tumor méret: |
| Legnagyobb átmérő (centiméter): cm |
| További kiterjedés (centiméter): x cm |
| Nem adható meg |
| Daganat szövettani típusa |
| Papillaris carcinoma, klasszikus |
| Papillaris carcinoma, encapsulalt, klasszikus |
| Papillaris carcinoma, follicularis variáns, encapsulalt, tok invázióval |
| Papillaris carcinoma, follicularis variáns, infiltrativ |
| Papillaris carcinoma, tall cell variáns |
| Papillaris carcinoma, hobnail variáns |
| Papillaris carcinoma, solid variáns |
| Papillaris carcinoma, cribriform-morular variáns |
| Papillaris carcinoma, diffúz sclerotisalo variáns |
| Papillaris carcinoma, hengersejtes variáns |
| Papillaris microcarcinoma |
| Papillaris carcinoma, egyéb tipus: |
| Follicularis carcinoma, minimalisan invaziv |
| Follicularis carcinoma, encapsulalt angioinvaziv |
| Follicularis carcinoma, szélesen invaziv |
| Oncocyter (Hürthle sejtes) carcinoma, minimálisan invaziv |
| Oncocyter (Hürthle sejtes) carcinoma, encapsulalt angioinvaziv |
| Oncocyter (Hürthle sejtes) carcinoma, szélesen invaziv |
| Rosszul differenciált pajzsmirigy carcinoma, fokális/ minor komponensként jelen van, extrathyroidalis |
| terjedés nélkül |
| Rosszul differenciált pajzsmirigy carcinoma |
| Anaplasticus carcinoma |
| Egyéb: |
| Mitotikus aktivitás |
| Nem azonosítható/ alacsony (<5 mitózis/2 mm2) |
| Kifejezett, >5 mitózis/2 mm2 |
| Tumor körülírtsága |
| Encapsulalt |
| Infiltratív |
| Érinvázió |
| Vérér invázió |
| Nem azonosítható |
| Jelen van |
| Fokális (1-3 fókusz) |
| Kiterjedt (>4 fókusz)) |
| Nyirokér invázió |
| Nem azonosítható |
| Jelen van |
| Kisér invázió, pontosan nem tipizálható |
| Necrosis |
| Nem azonosítható |
| Jelen van |
| Extrathyroidalis terjedés |
| Nem azonosítható |
| Jelen van a perithyroidalis kötőszövetben Jelen van, mikroszkópos harántcsíkolt izom invázió, makroszkóposan nem azonosítható Jelen van, képalkotó vizsgálattal és makroszkóposan azonosítható, hisztológia megerősítette Harántcsíkolt izom invázió (pT3b) Subcutanszövetek, larynx, trachea, nyelőcső vagy n.recurrens infiltráció (pT4a) Prevertebralisfascia infiltráció vagy carotisvagy mediastinalis ér érintettség (pT4b) Nem adható meg Sebészi szélek Nem adható meg Épek, az invazív carcinoma széltől való legkisebb távolsága: ________mm Tumorosan infiltrált. Érintett szél lokalizációja radio button (egy választható) anterior posterior Regionális nyirokcsomók Nyirokcsomó nem került eltávolításra Nyirokcsomó eltávolításra került VI régió (pretrachealis, paratrachealis, prelaryngealis, perithyroidalis): áttétes/ vizsgált nyirokcsomók száma: ________ legnagyobb áttét átmérője: ________mm extranodalis terjedés nem azonosítható Jelen van VII régió (felső mediastinalis) áttétes/ vizsgált nyirokcsomók száma: ________ legnagyobb áttét átmérője: ________mm extranodalis terjedés nem azonosítható Jelen van Jobb lateralis I-V régió áttétes/ vizsgált nyirokcsomók száma: ________ legnagyobb áttét átmérője: ________mm extranodalis terjedés nem azonosítható Jelen van Bal lateralis I-V régió áttétes/ vizsgált nyirokcsomók száma: ________ legnagyobb áttét átmérője: ________mm extranodalis terjedés nem azonosítható Jelen van Egyéb: áttétes/ vizsgált nyirokcsomók száma: ________ legnagyobb áttét átmérője:________mm extranodalis terjedés nem azonosítható Jelen van (A nyirokcsomó státusz megadásához használható az alábbi táblázatos forma is) | ||||||
| Nyirokcsomó lokalizációja | Vizsgált nyirokcsomók száma | Áttétes nyirokcsomók száma | Legnagyobb áttét átmérője | Extranodalis terjedés Nem azonosítható/jelen van | ||
| VI régió: pretrachealis, paratrachealis prelaryngealis perithyroidalis | ||||||
| VII régió: superior mediastinalis nyirokcsomók | ||||||
| I-V régió: lateralisnyaki blokkdisszekció | ||||||
| Jobb lateralisI-V régió | ||||||
| Bal lateralisI-V régió | ||||||
| Egyéb | ||||||
| Daganat körüli pajzsmirigy állományban az alábbi eltérések azonosíthatók Follicularis adenoma Nodularis hyperplasia Diffúz hyperplasia Dyshormogenetikus golyva Chronicuslymphocytas thyroiditis Nem azonosítható egyéb eltérés, a daganat körüli pajzsmirigy megtartott szerkezetű C-sejt hyperplasia (típusa): reaktív/ preneoplasticus |
| Mellékpajzsmirigy Nem került eltávolításra Eltávolításra került (száma):____________ Megjegyzés, immunhisztokémia Biomarker vizsgálat: Molekuláris patológiai vizsgálatra alkalmas blokk: |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Prognózis becslési módszerek
Ajánlás5
A DTC-ben szenvedő betegek prognózisának becslésére a rizikóklasszifikáció ajánlott, amely alapvetően meghatározza a kezelés módját, annak megjegyzésével, hogy a jelenlegi rizikóklasszifikációs módszerek nem optimálisak, az ETA klasszifikáció csak a TNM beosztást veszi figyelembe, az ATA 2015-ös irányelvben szereplő klasszifikáció pedig túlzottan bonyolult a gyakorlat számára (5. táblázat). (B)
Rizikóklasszifikáció
A DTC-ben szenvedő betegek prognózisa igen különböző lehet, ezért különösen fontos a rossz prognózisú betegek minél előbbi kiemelése és a jó prognózisú betegeknél a "túlkezelés" elkerülése. A prognózis becslésére a rizikóklasszifikáció szolgál, amely alapvetően meghatározza a kezelés módját. A relapsus és a betegségspecifikus halálozás valószínűségének felmérése a betegséglefolyás során bármikor elvégezhető (dinamikus rizikóklasszifikáció), de vannak kitüntetett időpontok a betegek gondozása során, amikor a prognózis felmérése kötelező. Ilyen időpontok: 1. A műtét előtt, a műtét típusának eldöntésére; 2. A műtét után, a szövettani lelet birtokában, a radiojód kezelés vagy külső sugárkezelés elbírálására; 3. A radiojód kezelés és posztterápiás képalkotás után; a korai rizikóklasszifikációhoz ekkor áll rendelkezésre minden adat - a további tumorellenes kezelésekről és a TSH céltartományáról ekkor lehet dönteni; 4. 9-12 hó múlva, ekkor ítélhető meg a terápiás válasz (kiváló, bizonytalan, inkomplett biokémiai vagy inkomplett struktúrális válasz). Ezeken kívül bármikor végezhető a betegség lefolyása során - dinamikus rizikóbecslés. A jelenlegi rizikóklasszifikációs módszerek nem optimálisak, az ETA klasszifikáció csak a TNM beosztást veszi figyelembe, az ATA 2015-ös irányelvben szereplő klasszifikáció pedig túlzottan bonyolult a gyakorlat számára (5. táblázat)
5. táblázat: ETA és ATA rizikóklasszifikáció a DTC prognózisának megítélésére.
| ETA 2006 | ATA 2015 |
| Nagyon alacsony rizikó: | Alacsony rizikó: |
| Unifokális T1 (≤1 cm) N0M0 és | nincs lokális vagy távoli áttét |
| nem terjed a pajzsmirigy tokján | tumorszövet R0 rezekciója |
| kívül | a tumor nem infiltrálja a környező szöveteket |
| Alacsony rizikó: | nem agresszív szövettani típus |
| pT1 (> 1 cm) N0M0 | az első RAI kezelést követően nem ábrázolódik 131I felvétel a |
| pT2N0M0 | pajzsmirigyágyon kívül |
| mpT1N0M0 | N0 vagy N1 < 5 mikromet (< 0,2 cm) |
| Magas rizikó: | PTC enkapszulált follicularisvariánsa |
| T3 | FTC vaszkuláris invázió nélkül vagy minimális vaszkuláris invázióval (< 4) |
| T4 | Uni-vagy multifokális PTC (BRAF mutációval is!) |
| N1 | Közepes rizikó: |
| M1 | mikroszkópikus tumor invázió a környező lágy szövetekben |
| 131I felvétel a pajzsmirigy ágyon kívül | |
| agresszív szövettani típus | |
| érinvázió | |
| N1 vagy mikroNl > 5, a nyirokcsomó áttét < 3 cm | |
| Multifokális mikroPTC, környező szövetekbe terjedés, BRAF + | |
| Magas rizikó: | |
| makroszkópikus tumorinvázió | |
| inkomplett tumor rezekció | |
| távoli áttét | |
| aránytalanul magas thyreoglobulinszint | |
| N1, ha bármelyik áttét > 3 cm | |
| FTC extenzív vaszkuláris invázióval (> 4) |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
További probléma, hogy a két leggyakrabban használt rizikóklasszifikáció is időnként jelentősen eltér egymástól ugyanazon beteg prognózisának megítélésében és egyik rendszer sem különíti el a perzisztáló és a kiújuló betegséget. A DTC kimenetelének megítélésére a korábbi és jelenlegi prognosztikai rendszerekben számos egyéb tényezőt is megvizsgáltak, ezeket összefoglalóan mutatja a 6. táblázat.
6. táblázat: Prognosztikai tényezők a korábbi és jelenleg használt rizikó besorolási rendszerekben.
| EORTC | MACIS | ETA | ATA | TNM | vizsgálatok száma (betegszám) | pozitív vizsgálatok száma | negatív vizsgálatok száma | pozitív vizsgálatok aránya (%) | |
| radiojód kezelés | 3 (97 287) | 3 | 0 | 100 | |||||
| x | postoperatív Tg | 13 (6991) | 13 | 0 | 100 | ||||
| x | x | x | x | x | távoli áttét | 29 (208 794) | 28 | 1 | 96,6 |
| x | klinikai stádium | 22 (163 538) | 21 | 1 | 95,5 | ||||
| x | x | x | tumorméret | 38 (216 744) | 34 | 4 | 89,5 | ||
| x | x | x | nyirokcsomóáttét | 38 (212 023) | 34 | 4 | 89,5 | ||
| x | x | R0 rezekció | 12 (66 994) | 10 | 2 | 83,3 | |||
| PET pozitivitás | 6 (538) | 5 | 1 | 83,0 | |||||
| x | x | x | x | x | pajzsmirigyen túlra terjedés | 27 (114 496) | 21 | 5 | 80,8 |
| x | x | x | életkor | 45 (328 988) | 34 | 11 | 75,6 | ||
| x | áttétes nyirok-csomók száma | 7 (5120) | 5 | 2 | 71,4 |
| EORTC | MACIS | ETA | ATA | TNM | vizsgálatok száma (betegszám) | pozitív vizsgálatok száma | negatív vizsgálatok száma | pozitív vizsgálatok aránya (%) | |
| bilateralis tumor | 3 (3636) | 2 | 1 | 66,0 | |||||
| x | x | szövettani típus | 23 (66 724) | 15 | 8 | 65,2 | |||
| x | vaszkuláris invázió | 8 (4346) | 4 | 4 | 50,0 | ||||
| nyirokcsomóáttét helye | 6 (1429) | 3 | 3 | 50,0 | |||||
| tokinvázió | 11 (4840) | 5 | 6 | 45,0 | |||||
| multifokalitás | 10 (1548) | 4 | 6 | 40,0 | |||||
| x | nem | 37 (136 892) | 14 | 23 | 37,8 | ||||
| teljes pajzsmi-rigy | 4 (1115) | 1 | 3 | 25,0 | |||||
| eltávolítás | |||||||||
| pozitív családi anamnézis | 1 (1262) | 1 | 0 | 100 |
Forrás: Glikson és mtsai közleménye alapján, módosítva [14]. Az egyes rizikó besorolási rendszerekben vizsgált prognosztikai tényezőket x-k jelölik.
A DTC-re jellemző, hogy a nyirokcsomó áttéteknek mérsékelt prognosztikai szerepe van, így az N1 csoportban elválik egymástól a kiújulás és a betegségspecifikus halálozás rizikója. A 7. táblázat foglalja össze a perzisztáló/kiújuló betegség és a betegségspecifikus halálozás rizikóját a tumor stádium és a szövettan függvényében.
7. táblázat: A perzisztáló/kiújuló betegség és a betegségspecifikus halálozás rizikója a tumorstádium és a szövettan függvényében.
| Tumorstádium | Megjegyzés | Maradék betegség / kiújulás rizikója | Betegségspecifikus halálozás rizikója |
| pT1aN0M0R0 | nem invazív, szövettan nem agresszív | igen alacsony | igen alacsony |
| mpT1aN0M0R0 | nem invazív, szövettan nem agresszív | alacsony | igen alacsony |
| pT1b-T2N0M0R0 | nem invazív, szövettan nem agresszív | alacsony | igen alacsony |
| T3 | magas | alacsony | |
| T4 | 55 év alatt | magas | alacsony |
| T4 | 55 év felett | magas | magas |
| N1 | magas | alacsony | |
| R1 resectio | magas | alacsony | |
| Vascularisinfiltráció | magas | ? | |
| Agresszív szövettan | magas | ? |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
A rizikóklasszifikáció lehetőségei a közeljövőben várhatóan bővülni fognak a DTC keletkezésében szerepet játszó molekuláris genetikai eltérések megismerése és a driver mutációk prognosztikai jelentőségének felmérése által. [14, 15]
2. DIAGNOSZTIKA
Diagnosztikai eljárások
Anamnézis
A szokásos anamnestikus adatokon kívül tisztázni kell, hogy a betegnél, illetve családjában volt-e pajzsmirigydaganat vagy bármilyen pajzsmirigy-működési zavar, vastagbél-, emlő- és bőrdaganat. Rögzíteni kell a kórelőzményben
szereplő ionizáló sugárzást (környezeti, munkahelyi, terápiás). Azokat a fiatal betegeket, akik bármilyen okból nyaki régió vagy egésztest sugárkezelésben részesültek, életük végéig a papillaris rák kialakulásának veszélye miatt rendszeresen ellenőrizni kell (klinikai, illetve UH-vizsgálat).
Fizikális vizsgálat
A pajzsmirigy fizikális vizsgálata során különösen fontos a teljes nyaki régió beleértve a supraclavicularis területet gondos áttapintása. A tapintható pajzsmirigygöbök száma, keménysége gyanút kelthet, de malignitásra egyértelműen nem utal. Pajzsmirigydaganat gyanúja esetén vagy pajzsmirigyműtét előtt gégészeti vizsgálat elvégzése feltétlenül szükséges. A hangszalag fixáltsága extracapsularis terjedésre utalhat. Műtét után status rögzítés céljából ismét szükséges gégészeti vizsgálat.
Aspirációs citológia
Ajánlás6
A pajzsmirigy aspirációs citológia (ABC), a golyvák és soliter pajzsmirigy nodulusok első vonalba tartozó, leghatékonyabb preoperatív diagnosztikus módszere. A citológiai vizsgálat kiértékelését a Bethesda szisztéma szerint kell végezni. (A) [16]
Az aspirációt elvégezheti klinikus (sebész, endokrinológus), radiológus vagy citopatológus abban az esetben, ha ehhez megfelelő jártassága és tapasztalata van. A megfelelően fixált nedves, vagy levegőn szárított preparátumok hematoxilin-eosin és/ vagy MGG festése ajánlott. A megfelelő sejt mintának legalább hat csoportban kell follicularis hámsejteket tartalmazni, minden csoportban kb. 10-20 sejtet. A citológiai vizsgálat kiértékelését a Bethesda szisztéma szerint végezzük. [16]
Bethesda-kategóriák, 6 általános csoport:
TBS I. Nem diagnosztikus (ezek aránya 5-15% lehet);
TBS II. Benignus (idetartoznak a gyulladás, a hyperplasias nodulusok, cysticus vagy nem cysticus colloid struma göbök);
TBS III. Nem meghatározható jelentőségű atípia;
TBS IV. Follicularis neoplázia vagy annak gyanúja;
TBS V. Malignitásra gyanús;
TBS VI. Malignus.
A pajzsmirigy ABC vizsgálatok műveléséhez nagy tapasztalat, és évente kb. 2-300 vizsgálat elvégzése szükséges. A pajzsmirigy ABC vizsgálatának kontraindikációja nincs. Szövődmény ritkán vérzés vagy haematoma lehet.
Szövettani vizsgálatok
Ajánlás7
Pajzsmirigyműtét előtt biopszia végzése csak kivételes esetekben indokolt, elsősorban nagy kiterjedésű, a pajzsmirigy tokján túlterjedő daganatok esetében. Az intraoperatív fagyasztásnak nincs indikációja pajzsmirigyre lokalizált tumorok esetén. [17] A papillaris carcinoma citológiai vizsgálattal diagnosztizálható, a follicularis neoplasia diagnózisához pedig a lézió teljes feldolgozása szükséges, amire az intraoperatív fagyasztás nem alkalmas. (C)
Képalkotó vizsgálatok
Ajánlás8
A pajzsmirigy vizsgálatára, nyaki terime megítélésére az ultrahangvizsgálat (UH) az elsőként javasolt eljárás. (A)
Mivel kiváló a lágyrész felbontó képessége, ezért informatív, nem jár sugárterheléssel és a regionális nyirokcsomó státuszról is felvilágosítást ad. Az UH-vizsgálatok, berendezések fejlődésével az UH képalkotó technika a pajzsmirigy gócok detektálhatóságát nagyban javította.
UH-vizsgálat
Technikai alapfeltétel: legalább 10 Mhz frekvenciájú, lineáris transducer
Vizsgálandó régió: pajzsmirigy, nyaki, valamint a látótérbe hozható felső mediastinális nyirokrégiók
UH vizsgáló módszerek:
- B kép - méret, szerkezet, környező szövetek megítélésére,
- Doppler - (Color Power) -góc erezettsége,
- Kontrasztanyagos ultrahang (CEUS) -vascularisatio, többlet információ,
- UH elasztográfia (shear wave, strain, dynamic, ARFI, stb.) - szöveti keménység,
- Mesterséges intelligencia alkalmazása, asszisztált detektálás (CAD), számítógépes adatok feldolgozása, értékelése (AI).
UH-vizsgálat értékelése
Ajánlás9
A végleges döntésben ajánlott a malignus gócra gyanús jelek integrálásával kialakult TIRADS értékelő rendszer használata. (B) [26, 27]
Az UH-értékelés szempontjai: méret, alak, kontúr, echogenitas, makro-, microcalcificatiok jelenléte vagy hiánya, szöveti elaszticitás, vascularisatio jellege. [18]
Malignus góc UH jelei: hypodenz, szabálytalan alak, elmosódott kontúr, microcalcificatio, magasabb, mint szélesebb, vascularisált, kemény. A nyaki, több mint 85%-os specifitással jelenik meg a legtöbb publikációban, de van, ahol még magasabb adatról is beszámolnak. [19] Az UH B-képen a microcalcificatio csillogó pontokként mutatkozik. Microcalcificatio gyakrabban megfigyelhető a malignus léziókban mint a benignus gócokban (69,6% vs. 30,4%, P < 0,001). [20, 21]
Papillaris rák esetén gyakran észlelhető microcalcificatio, háromszorosra növeli a papillaris rák valószínűségét, follicularis vagy Hürthle sejtes rák esetén nem észlelhető, specifitása 85-95%. Az egyéb kritériumok közül az elmosódott kontúr, az extracapsularis terjedésre utaló lokális invázió szintén fontos kritériumok, malignitásra suspectek. A pajzsmirigygóc centrális hypervascularitása magas pozitív prediktív értékű. [22, 23, 24]
Az UH elasztrográfia a szöveti merevséget vizsgálja és a szöveti elaszticitást 1-5 pontig pontozzák, a nagyobb pontszám merevebb szövetet jelent. Amennyiben a szöveti keménység értéke 4-5 pont, 90% fölé növeli a malignitás valószínűségét. A szöveti merevség vizsgálata a jó- és rosszindulatú göbök differenciálásakor kiegészítő eljárás. Az elasztographiát kombinálva az UH B-képpel a szenzitivitás malignus gócra 98,5%-ra emelkedik. [25]
Az UH-val látható pajzsmirigygócok közül a rákos góc relatíve ritka, előfordulása kb. 5%. Az FNAB nem végezhető el minden gócnál rutinszerűen - gyakorlati és anyagi szempontok alapján. Számos kutatás kísérelte meg a pajzsmirigygócok osztályozását, hogy ezzel javítsa az UH-val nyerhető karakterizálást és szelektálhassa azokat a gócokat, melyek malignus rizikója alapján FNAB-ra jelöltek.
A malignus gócra gyanús jelek integrálásával kialakított TIRADS értékelő rendszer, mely, bár pusztán UH-értékelésen alapul, nagyban segít a végleges döntésben. [26, 27].
Előnyei:
1. A TIRADS klasszifikáció a malignitásra suspect UH-kritériumok szerint pontoz, mely a napi gyakorlatba könnyen beilleszthető, egységes a terminológiája, a klasszifikáció szempontjai, ez megkönnyíti a különböző szakmák közötti kommunikációt.
2. Statisztikailag bizonyított, hogy a TIRADS pontosabb értékelést nyújt, amennyiben az értékeléskor több UH-kritériumot alkalmazunk.
3. A malignitás rizikója score szisztémán alapulva különböző. A 4/a kategóriában relatíve alacsony a malignitás esélye (4,3%), a klinikum figyelembevételével kell dönteni az FNAB szükségességéről. Az értékelésben figyelembe kell venni a beteg általános klinikai állapotát, a családi anamnézist, a korábban kapott sugár expozíciót. Manar M. Nasr. és Amal A. Sakrana a malignitás rizikóját a következők szerint publikálták: TIRADS 4/a: 4,3%, 4/b: 11,6%, 4/c: 51,8%, TIRADS 5: 91,7%. FNAB-t azoknál a betegeknél javasolják, ahol a malignus elváltozás kifejlődésének rizikója magas, 4/b és 4/c-ben kötelező FNAB-t végezni - kivéve, ha kontraindikáció áll fenn. A TIRADS 5 kategóriában műtétet kell végezni, hogy hisztológiai feldolgozás történhessen. [28]
Az UH alapján benignus/malignus elváltozás valószínűsíthető, de pusztán az UH morfológia szerint egy pajzsmirigy göb dignitásáról, a nyaki nyirokcsomók érintettségéről biztonsággal nyilatkozni nem lehet. Tumorra szuszpekt elváltozásnál UH vezérelt mintavétel szükséges A módszer szenzitivitása és specifitása magas, pozitív prediktív értéke csaknem 100%, álpozitív vagy álnegatív esetek csak néhány százalékban fordulnak elő. Az aspirátum nemcsak citológiai vagy hisztológiai feldolgozásra alkalmas, hanem tumormarker tartalma is megvizsgálható, illetve genetikai vizsgálat is végezhető. [29]
A pajzsmirigyben lévő elváltozások UH-vezérelt FNAC technikáját Bak és mtsai által 2015-ben közölt metodika szerint javasolt elvégezni. [30] A mintavétel alatt a beteg a hátán fekszik, a nyaka hyperextendalt pozícióban volt. A punctio előtt felületi bőrfertőtlenítést kell alkalmazni. A transducer hossztengelyével párhuzamos ferde tűvezetés lehetővé teszi a tű végének folyamatos "real-time" nyomon követhetőségét. Az eljárás során 27-25 G, 3-6 cm hosszú tűt és aspirációs pisztolyba (Cameco) helyezett 20 ml-es gumidugós fecskendőt használtunk. A szélesztés után a keneteket levegőn szárítjuk, melyet a citológusok megfelelő festés (Hemacolor, Merck-D) festés után értékelnek. A pajzsmirigy microcarcinoma (PMC) 1 cm-nél kisebb daganat, a DTC külön entitásának tekinthető, legtöbbször papillaris rák. Felismerésében az UH-vizsgálat jelentőségét kell kiemelni. Amennyiben a göb echoszegény, széle elmosódott, a széli "haló" jel megtört, UH vezérelt mintát kell venni.
Egyéb rétegképalkotó módszerek
Ajánlás10
A környező szervek tumoros infiltrációja, mediastinumba terjedő daganat esetén a pontos stádium meghatározáshoz elsősorban mágneses rezonanciás vizsgálat (MRI) javasolt. A kontrasztanyagos komputer tomográfia (CT) lágyrész felbontó képessége kontrasztanyaggal sem éri el az MR felbontását, valamint a jódos kontrasztanyag gátolja a jód izotóp diagnosztikai és terápiás alkalmazását. (B)
Amennyiben az aspirációs citológia malignitást igazolt, bizonyos esetekben szükség lehet a tumor kiterjedésének pontosabb meghatározására (pl. trachea, nyelőcső, izomszövet infiltrációja, mediastinumba terjedő daganat). A pontos stádium meghatározáshoz elsősorban mágneses rezonanciás vizsgálat (MRI) javasolt. Bár a kontrasztanyagos komputer tomográfia (CT) is jó anatómiai felbontást nyújt, de lágyrész felbontó képessége kontrasztanyag alkalmazásával sem éri el az MR felbontását, valamint fontos tényező, hogy a jódos kontrasztanyag gátolja a jód izotóp diagnosztika és kezelés hatékonyságát, amennyiben a betegnél izotóp kezelésre is sor kerülhet.
A multiplanáris, multiparametrikus MRI (MP-MRI) kiválóan tájékoztat az anatómiai viszonyokról, tőle várhatók a legpontosabb adatok a tumor környezetbe terjedéséről és az UH számára rejtett régiókról. A több síkú ábrázolás lehetővé teszi a mediastinumba terjedő tumor környező képletekhez, az erekhez, a tracheához való viszonyának felmérését, akár kontrasztanyag nélkül is. Az MR-angiográfia az erekről nyújt kiegészítő többlet információt. Az MP-MRI részét képező funkcionális MRI technikák, a dinamikus és a diffúzió súlyozott MRI (DCE-MRI, DW-MRI) növelik a szövetek karakterizálhatóságát. Az MP-MRI főleg a terápia hatékonyságának vizsgálatában, a műtét utáni állapot felmérésében, residualis vagy recidív tumor kimutatásában, a postoperatív hegesedéstől való elkülönítésében előnyös. Kérdéses esetben, egy mediastinális elhelyezkedésű, mellékpajzsmirigyre gyanús lágyrészgóc kimutatására, elemzésére is MRI a legpontosabb módszer.
Az MP-MRI kiváló lágyrész felbontó képessége ellenére, pusztán a jelmenet alapján nem mindig lehet különbséget tenni a tumoros és a nem tumoros elváltozás között. Az MRI a nyirokcsomókat is jól ábrázolja, de bizonytalan lehet az áttétes és hiperplasztikus nyirokcsomók elkülönítésében.
Nyirokrégiókban a 10 mm-nél nagyobb haránt átmérőt mutató lágyrészcsomókat tekintjük kóros méretűnek, de metasztázis kisebb nyirokcsomóban is előfordul, valamint nagyméretű nyirokcsomó reaktív is lehet. DTC szempontjából egy nyirokcsomó akkor tartható áttétre gyanúsnak, ha gömb alakú, szerkezete hypodenz, inhomogén, cisztózus komponenst vagy mikromeszeket tartalmaz, erezettsége perifériás, kontúrja elmosódott. Amennyiben ezek valamelyike észlelhető, a mérettől függetlenül felvethető az áttétes nyirokcsomó gyanúja.
A 10 mm-nél nagyobb, gyanús UH morfológiát mutató nyirokcsomókból - ha terápiás konzekvenciája van - FNAB-t javasolt végezni, UH vezérelve. Számos esetben akár 4-5 mm-es nyirokcsomókból is lehet diagnosztikus értékű aspirátumot nyerni.
A műtét után státuszt rögzítő vizsgálat szükséges és nyaki UH évenként javasolt.
A követés során a felső mediastinum rutinszerű CT/MR vizsgálata abban az esetben hagyható el, ha a tumormarkerek negatívak, a műtét előtt nem volt mediastinális lokalizációjú elváltozás, illetve a műtét utáni követéskor a nyakon nincs daganatos recidíva.
A tüdő áttétek nagy gócos formáját a hagyományos röntgen vizsgálat is kimutatja, azonban az apró metasztázisokat a CT pontosabban detektálja. Mellkas CT-t végezhetünk azokban az esetekben is, ha papillaris és follicularis carcinománál megemelkedik a szérum tumormarker szintje.
A mellkas CT-nek elsősorban a tüdőáttétek és a mediastinális vagy hilusi nyirokcsomó érintettség kimutatásában van szerepe.
Megjegyzés: A jódos kontrasztanyaggal végzett CT-vizsgálat az egésztest-jódvizsgálat eredményességét, valamint a radiojód kezelés alkalmazását legalább fél évre megakadályozza.
Radiojód refrakter tumorok esetén azonban nincs akadálya a kontrasztanyagos CTvizsgálatnak, szisztémás kezelés esetén is ez alkalmazandó a terápiás válasz követésére.
MR-vizsgálat javasolt:
- Emelkedő tumormarkerek (szérumTG/TgAB), nyaki UH negativitása esetén a nyaki és a felső mediastinális nyirokcsomók megítélésére. Cystosus áttét esetében az MR valóban hasznos lehet, lévén az ilyen típusú nyirokcsomók - főként a zsírelnyomásos szekvenciákon - kis méretben is jól detektálhatóak.
- A nyaki nagyerekhez való viszony megítélése - (megjegyzendő, hogy a legtöbb esetben egy célzottan erre a kérdésre választ kereső UH-nál többet ritkán tud adni).
- Klinikai gyanú esetén a koponya, gerinc, hasi manifesztáció kimutatásában adhat segítséget. [31]
Mit tartalmazzon a lelet?
- Pajzsmirigy mérete, szerkezete, _ Gócok státusa, száma, szerkezete
- Szervet meghaladó tumornál terjedése, a környezettel való viszonya _ Nyirokcsomóstátusz - morfológiai elemzéssel - Ha áttétre gyanúsak:
- számuk
- helyük: nyaki nyirokrégiók szerint
- méretük
- szerkezetük
- Erekhez való viszony az operabilitás felméréséhez
Képalkotás által vezérelt terápiás intervenciók
Ajánlás11
A diagnosztikai céllal végzett képalkotás lehetőséget biztosít olyan terápiás intervencióra is, mint amilyen a percutan alkoholos infiltráció (PEI) [32, 33] és a rádiófrekvenciás abláció (RFA) [34, 35], amelyek palliativ vagy kuratív céllal alkalmazhatók. (B) [36, 37, 38, 39]
Számos tanulmány szerint a PEI és az RFA jó lehetőségek a biopsziával igazolt nyaki nyirokcsomó áttétek vagy lokális recidívák kezelésére, műtétek és radio-jód terápia után, ha a betegnek nincsenek távoli áttétei.
- A legtöbb esetben a nyirokcsomók méretbeli csökkenésén túl a szérum Tg és/vagy a TgAb szintje is redukálódik.
- Főként a többször operált, magas sebészeti kockázattal rendelkező, vagy a műtétet visszautasító betegeknél, citológiával igazolt esetekben - onkoteam döntés után végzendő valamelyik tumorablációs módszer.
- A palliatív PEI/RFA kezelés számos alkalommal ismételhető.
- Kuratív RFA kezelés várható, ha a teljes tumormassza kezelhetőnek bizonyul radiológiai vizsgálatokkal, nincs távoli metastasis, a nyirokcsomóáttétek száma 3-4, átmérőjük nem haladja meg a 2 cm-t.
Képalkotó vizsgálatok összegzése
- A pajzsmirigyrákok diagnosztikája, gyógyítása és követése multidiszciplináris feladat.
- A pajzsmirigy szerkezeti eltéréseinek megítélésében az UH-vizsgálatnak, és az UH vezérelt aspirációs citológiának alapvető szerepe van a további teendők meghatározásában.
- Bár az UH tekinthető a pajzsmirigy megítélésére az első és legfontosabb modalitásnak, de figyelembe kell venni, hogy gép-, technika- és vizsgáló függő.
- A pajzsmirigyágyban talált UH-eltéréseket minden esetben nagy tapasztalattal rendelkező radiológus szakorvosnak kell értékelni.
- A CT-, MR-válogatott esetekben jön szóba.
- A radiológus szerepe a primer tumor képi elemzése és a képalkotó által vezérelt mintavétel, valamint a stádiumot meghatározó vizsgálatokon túl, az adekvát terápiát követően a beteg onkológiai statusának képalkotókkal történő követése, annak érdekében, hogy a recidívát hamar megtalálhassuk.
- A radiológus feladata a minimál invazív tumorablációs módszerek (PEI, RFA) alkalmazása is.
Nukleáris medicina vizsgálatok
99mTc-pertechnetat pajzsmirigy-szcintigráfia
Ajánlás12
A preoperatív diagnosztikában a 99mTc-pertechnetat szcintigráfia értékes preoperatív diagnosztikai eszköz a tapintható göb funkciójának (pl. autonom adenoma) megítélésében. A műtét utáni 99mTc-pertechnetat szcintigráfia segítségével a maradékállomány nagysága ítélhető meg. A vizsgálatot minden esetben nyaki UH-vizsgálattal célszerű kiegészíteni. (B)
Egésztest 131/123I-szcintigráfia
Ajánlás13
A 131/123|-NaI-szcintigráfiát a teljes thyreoidectomiát követően akkor kell beiktatni, ha nem tervezünk radiojód ablatiot (kis kockázatú betegek csoportja). Ablatio esetén a diagnosztikus vizsgálat ronthatja a terápiás hatást (stunning), ugyanakkor az ablatiohoz szükséges lényegesen nagyobb izotóp dózis utáni ún. postterápiás kép 30-40%-kal több információt nyújt, mint a diagnosztikus vizsgálat. (B)
Ajánlás14
Nagy dózisú radiojód terápiát követően 6-12 hónappal, recidív vagy residuális daganat gyanúja esetén végezhető diagnosztikus célú radiojód szcintigráfia felnőtteknél 131I gyermekeknél a kisebb sugárterheléssel járó 123I izotóppal. A radiojód (131/123|) teljes test szcintigráfiát a teljestest felvételek mellett SPECT/CT-vel célszerű végezni. Alacsony rizikójú betegcsoportban elegendő a tumormarkerek mérése és nyaki UH. Igazolt recidív vagy residuális betegség esetén 131I terápia végzendő. (B)
A 131/123I-NaI-szcintigráfiát a papillaris és follicularis carcinomás betegekben a teljes thyreoidectomiát követően akkor kell beiktatni a diagnosztikai programba, ha nem tervezünk radiojód ablatiot (kis kockázatú betegek csoportja). Ablatio esetén a diagnosztikus vizsgálat ronthatja a terápiás hatást (stunning), ugyanakkor az ablatiohoz szükséges lényegesen nagyobb izotóp dózis utáni ún. postterápiás kép 30-40%-kal több információt nyújt, mint a diagnosztikus vizsgálat. Mivel a radiojódot az ép pajzsmirigymaradvány veszi fel a legintenzívebben, így jelentős pajzsmirigy-residuum esetén az esetleges áttétek kimutatása nem mindig lehetséges. Ilyenkor előfordul, hogy az ablatiós mennyiségű (az ép pajzsmirigymaradványt kiirtó) radiojód alkalmazását követően észlelhetők csak a metasztázisok. Alacsony rizikójú betegcsoportban elegendő a szérum Tg szint mérése és nyaki UH a követésre. Nagy dózisú radiojód terápiát követően 6-12 hónappal, recidív vagy residuális daganat gyanúja esetén végezhető diagnosztikus célú radiojód szcintigráfia. Gyermekeknél, amennyiben van rá lehetőség, a szcintigráfiát a 8 napos felezési idejű, fotont és elektront egyaránt kibocsátó 131I helyett a kisebb sugárterheléssel járó 123I-dal kell elvégezni, ugyanis ennek az izotópnak rövidebb (13 óra) a felezési ideje, és kizárólag gammasugárzást bocsát ki (nem várható stunning sem). A radiojód (131/123I) teljes test szcintigráfiát a teljestest felvételek mellett SPECT/CT-vel célszerű elvégezni.
99mTc-MIBI (metoxi-izobutil-izonitril), 99mTc-tetrofoszmin szcintigráfia
Ajánlás15
A gócos pajzsmirigybetegségek differenciáldiagnosztikájában értékes segítséget nyújthat, ezért javasolt az 99mTc-MIBI vagy 99mTc-Tetrofosminnal végzett szcintigráfia. A vizsgálatnak elsősorban a negatív prediktív értéke magas a göbök malignitásának gyanújában. (B)
Mindkét radiofarmakon kálium analóg, a mithocondriumban gazdag struktúrákban dúsul.
Csontáttét keresése
Ajánlás16
A csontáttétek kimutatásának szenzitív módszere az egésztest felvételek mellett SPECT/CT-leképezést alkalmazó csontszcintigráfia. Alternatívája lehet a 18F- fluorit PET/CT-vizsgálat. Papillaris karcinománál a csontszcintigráfia rutinszerű elvégzése panaszmentes betegnél nem indokolt, míg a többi pajzsmirigy karcinománál emelkedett tumormarkerek esetén teljestest csontscintigráfia segítségével tisztázhatjuk az esetleges áttétek jelenlétét. (B)
A csontáttétek kimutatásának általánosan alkalmazott szenzitív módszere a csontszcintigráfia. Az egésztest felvételek mellett SPECT/CT-leképezést kell alkalmazni, ami a vizsgálat specificitását jelentősen javítja. A csontáttétek megjelenítésének alternatívája lehet a 18F- fluorit PET/CT-vizsgálat melynek pontos klinikai szerepe még tisztázásra vár. Papillaris karcinománál kicsi a csontáttét valószínűsége, ezért a csontszcintigráfia rutinszerű elvégzése panaszmentes betegnél nem indokolt. A többi pajzsmirigy karcinománál teljestest csontszcintigráfia végzése akkor jön szóba, ha a tumormarkerek emelkedettek és távoli áttét valószínűsíthető.
PET/CT
Ajánlás17
Radiojódot nem dúsító, vagy megszűnt jódfelvételű elváltozások tisztázására a glükóz vagy sz.e. aminosav anyagcsere megjelenítésére alkalmas PET/CT-vizsgálatot kell végezni, ami alkalmas a terápia követésére is. (B)
A 18fluoro-dezoxiglükóz (FDG) glükózzal végzett PET/CT-vizsgálat minden olyan esetben indokolt, amikor az emelkedő szérum tumor marker érték okát hagyományos módszerekkel nem sikerül tisztázni. Ugyancsak el kell végezni a vizsgálatot akkor is, amikor egyéb klinikai jelek recidívára utalnak, de azt a rutin követési módszerekkel nem lehet igazolni (a tumor dedifferenciálódása következtében csökkent markerszint, illetve hiányzó radionuklid-felvétel következtében). Amennyiben az FDG-vel végzett vizsgálat nem ad eredményt, még diagnózishoz vezethet az aminosav-transzportot és fehérjeszintézist megjelenítő PET/CT-vizsgálat, különösen akkor, ha alacsony proliferatív aktivitású tumor recidíváját kell kimutatni. A PET-vizsgálat alkalmas a terápia követésére is, hiszen minden más módszernél korábban képes jelezni a kezelés hatására bekövetkező anyagcsere-változásokat. Az FDG-PET/CT különösen fontos a radiojódot nem dúsító pajzsmirigy carcinomák loko-regionális és távoli metasztázisainak kimutatásában.
Csontsűrűség-meghatározás
Ajánlás18
Magas rizikójú vagy igazoltan maradék betegséggel élő, szuppresszív dózisú levothyroxin kezelésben részesülő pajzsmirigy carcinomás betegek csontsűrűségének meghatározása a műtét körüli időszakban azért szükséges, mert a TSH-szuppresszív tiroxinkezelés okozta enyhe thyreotoxicosis - a túlnyomóan nőkből álló betegcsoportban - korai osteoporosishoz vezethet (elsősorban a postmenopausában), amelynek megítélését a kiindulási helyzet ismerete nagymértékben megkönnyíti. (B)
Magas rizikójú vagy igazoltan maradék betegséggel élő, szuppresszív dózisú levothyroxin kezelésben részesülő pajzsmirigy carcinomás betegek csontsűrűségének meghatározása a műtét körüli időszakban azért szükséges, mert a TSH-szuppresszív dózisú, egész életen át folytatott tiroxinkezelés enyhe thyreotoxicosist tart fenn. Ez a csontlebontás fokozása révén - a túlnyomóan nőkből álló betegcsoportban - korai osteoporosishoz vezethet (elsősorban a postmenopausában), melynek megítélését a kiindulási helyzet ismerete nagy mértékben megkönnyíti.
Laboratóriumi vizsgálatok
Ajánlás19
Amennyiben referencia tartományon kívül esik a TSH, akkor fT4: szabad thyroxin, tT3: összes T3 és/vagy fT3: szabad T3, valamint tumormarkerként a Tg: thyreoglobulin és TgAb: thyreoglobulin-antitest meghatározása szükséges. (A)
Funkció megítélés
Ugyan a PM-carcinomák - különösen a kezdeti időszakban - ritkán társulnak diszfunkcióval, de differenciáldiagnosztikai okokból a PM-göb(ök) felismerésekor a PM-funkció megítélésére szolgáló tesztek (fT4, fT3 és/vagy tT3) elvégzési rendje a TSH-ra alapozott algoritmus szerint javasolt. Később a megfelelő szubsztitúció/szuppresszió ellenőrzése és biztonságos TSH célértékek elérése céljából a hazánkban alkalmazott összes 2. és 3. generációs TSH módszer olyan funkcionális szenzitivitással (0,004-0,02 mIU/L) rendelkezik, amely magas rizikójú beteg esetében is biztonságosan garantálja az elvárt kisebb, mint 0,1 mIU/L terápia monitorozását. Ezen alacsony tartományban mért értékek reprodukálhatóságát a laboratórium rendszeres külső kontrollálással is ellenőrzi. [40, 41, 42, 43]
Tumormarkerek
Thyreoglobulin (Tg)
Ajánlás20
A thyreoglobulin (Tg) DTC-ben szenvedő, felnőtt beteg esetében, csak akkor használható specifikus tumormarkerként, ha a totál thyreoidectomia és a remnant abláció radiojóddal (RAI) megtörtént, műtét előtt a Tg meghatározása fölösleges. (D) [31, 42]
A DTC terápiamonitorozásában a Tg-meghatározás csak legalább 2. generációs, 0,1 ng/ml funkcionális szenzitivitású IMA Tg assay alkalmazható, amelyet a CRM-457 nemzetközi standardra kalibráltak. (A) [31, 44, 45, 46]
Meghatározása szérumból
A thyreoglobulin (Tg) egy PM-specifikus fehérje [43]. DTC-ben szenvedő, felnőtt beteg esetében, csak akkor használható specifikus tumormarkerként, ha a totál thyreoidectomia és a remnant abláció radiojóddal (RAI) megtörtént. Egyébként, intakt PM esetében nincs jellegzetes biomarkere sem a PTC-nek, sem az FTC-nek. Ezért műtét előtt a Tg meghatározása fölösleges. [31, 42] A DTC terápiamonitorozásában használható Tg meghatározására csak olyan szenzitív (legalább 2. generációs: 0,1 ng/ml funkcionális szenzitivítású), IMA Tg assay alkalmazható, amelyet a CRM-457 nemzetközi standardra kalibráltak és lehetővé teszi a thyroxin szedése mellett, az alacsony tartományban (0,1-1.0 ng/ml) is a Tg pontos mérését. [31, 44, 45, 46] Tg leletértékeléshez figyelembeveendő szempontok:
- A Tg biológiai féléletideje 65 óra, így totál thyreoidectomia esetében is csak 4 hét múlva eliminálódik.
- TgAb szintek ismerete nélkül nem értékelhető (lásd alább a módszert zavaró interakcók részben). [46, 47, 48, 49]
Tg meghatározása nyirokcsomó aspirátum mosófolyadékból.
Ajánlás21
Nyirokcsomó aspirátum mosófolyadékból a Tg meghatározása nem javasolt. (C) [31]
Irodalmi adatok szerint hasznos lehet a Tg-meghatározás a nyirokcsomó metastasis korai diagnosztikájában, de ez még nem lehet evidencia, már analitikai megfontolásból sem, mert nem standardizált módszer. Az eredményt nem csak a rendkívül alacsony Tg-szint, hanem a mátrix effektus is kétségessé teszi. Ezért aspirátum mosófolyadékból a Tg meghatározása nem javasolt. [31]
A Tg-meghatározáskor fellépő interakciók:
Ajánlás22
A Tg-mérés megbízhatóságát (technikai tényezők mellett) az endogén thyreoglobulin ellenes antitest (TgAb) jelenléte befolyásolhatja, amely a DTC betegek plazmájában 15-30%-os gyakorisággal van jelen, ezért TgAb-szint meghatározása kötelező a Tg-szint mérésre használt vérvételi mintából. (B)
- Tg ellen keletkező endogén antitestek
A Tg-mérés megbízhatóságát több technikai tényező befolyásolja, amelyek közül az endogén thyreoglobulin ellenes antitest (TgAb) jelenléte okozza a legtöbb gondot a gyakorlatban. A TgAb a DTC-ben szenvedő betegek plazmájában 15-30%-os gyakorisággal jelen van, ezért TgAb-szint meghatározása kötelező, párhuzamosan a Tg-szintméréssel, ugyanabból a vérvételi mintából. Ezzel hitelesíthető, hogy a Tg-mérést megbízhatóságát nem veszélyezteti az endogén antitestek jelenléte. Amennyiben eléri vagy meghaladja a beteg mintájában mért antitest szint a Tg meghatározását zavaró szintet, akkor a pontos Tg-szint mérése lehetetlen, így a laboratórium a leleten csak azt jelenítheti meg, hogy "a jelenlévő Tg-antitestek miatt a feltüntetett Tg-szint nem értékelhető". Ennek eldöntéséhez szolgáló TgAb-határérték nem azonos az autoimmun kórfolyamatot jelző cut-off értékkel, annál jóval alacsonyabb [46, 47, 48, 49, 50, 51]. Ezért, ez utóbbi módszerspecifikus, döntéshozatali határértéket a reagenst gyártóknak vagy a laboratóriumnak kell megállapítaniuk. Ez a feladat, mivel nem rutinszerű, fokozott szakmai körültekintést igényel, ezért a mérések centralizálása merül fel.
Az endogén TgAb-interakció kiderítésének másik megközelítése, ha IMA (szendvics v. telítő) módszer mellett RIA (kompetitív) módszerrel is meghatározzák a Tg-szinteket. A két módszerrel nyert RIA/IMA Tg koncentrációk hányadosa még biztonságosabban rámutat az antitest interakcióra [45, 46, 49, 50, 51, 52]. Ezért, különösen a bizonytalan "indeterminate response" terápiás válasz esetében javasolható lenne ennek a hányadosnak a meghatározása, ami a RIA-módszer piaci visszaszorulásával jelenleg nehezen elérhető.
A magas szenzitivitású (2. gen.) Tg assay a TgAb-val éppúgy interakciót mutat, mint a korábbi Tg-módszerek. Nem jelentősen emelkedett endogén TgAb-szint esetében a Tg-szint alsó kimutathatósági határa 0,1 ng/ml (korábbi módszerekkel 1 ng/ml volt ez az érték). [45, 50, 51]
- A beteg mintájában jelenlévő egyéb zavaró anyagok
Mint minden immunanalitikai módszernél, a lelet értékelésekor gondolnunk kell a beteg mintájában jelenlévő olyan szubsztanciák jelenlétére, amelyek miatt téves eredmény is adódhat. Így a klinikai képbe nem illő eredmény esetében célszerű a méréseket olyan másik módszerrel megismételni, amelyben eltérő állatfajból származó antitestet használnak. Ezek hátterében nemcsak endogén antitestek, de egyéb eredetű interferenciák is állhatnak (pl. heterophil antitestek, HAMA, rheuma faktor, autoantitestek, gyógyszerek). Ezek okozhatnak "biokémiailag inkomplett választ". A nagy dózisú biotin alkalmazása (sclerosis multiplex vagy bőrgyógyászati indikáció) szintén zavaró hatású lehet. A Tg- és a TSH-szint mérésekor tévesen alacsony, a TgAb-szintek esetében módszertől függően (kompetitív v. telítő) eltérő irányú torzításokat okozhat. [53]
TgAb-szint, mint kiegészítő tumormarker
A TgAb méréséhez, csak szenzitív és kvantitatív módszer alkalmazható. Fontos, hogy 65/93 NIBSC standardra kalibrált legyen, valamint funkcionális szenzitivitása 20%-os variációs koefficiensnél ismert legyen. Ezen túl ismertté kell tenni azt a legalacsonyabb TgAb titert, amely már nem zavarja jelentősen az alkalmazott Tg-mérési módszert. [52, 54, 55, 56] A TgAb-módszerek hiányossága, hogy még akkor is eltérő Tg-epitopokhoz kötődnek, ha ugyanazon, referencia standardra kalibráltak. Ez az eltérés, különösen DTC-ben szenvedő betegek esetében nagyobb, annak ellenére, hogy az elvárásnak megfelelően szenzitívek és kvantitatívak. Ez az oka annak, hogy hazánkban alkalmazott 7 módszernek az autoimmun kórfolyamatot jelölő határértéke rendkívül széles tartománnyal (4-150 IU/ml) jellemezhető. [47, 57, 58] A TgAb-szintek értelmezése DTC-ben
Ha a TgAb-szint 50%-kal csökkent a fél évvel korábban mért szinthez képest az remissziót, ha nem változott, vagy nőtt, akkor az recidívát jelezhet. Fontos megjegyezni, hogy a betegek TgAb pozitivitása a gondozás során változhat, megszűnhet, vagy újra kialakulhat. Egy tanulmány szerint a TgAb-pozitívvá válás az esetek többségében (75%) csak átmeneti (hónapokig tart) és a sebészi vagy biopszia vagy RAI okozta trauma miatt következik be. Ez az oka annak, hogy a Tg mellett mindig meg kell a TgAb-t is határozni. [54, 56, 57, 58]
TgAb-szint a stimulációra nem változik, mérésére csak annak igazolására van szükség, hogy az endogén TgAb mennyiben zavarja aTg meghatározását. A TgAb interakció fennállhat stimuláltTg-szint esetén is, de ha aTg biztonsággal mérhető, mert a funkcionális szenzitivitás 10-szeresét meghaladja (> 1 ng/ml), akkor arra hagyatkozhatunk. RAI után átlagosan 3 év múlva tűnik el a TgAb, ha a beteg tumormentes. [31, 42, 54, 55, 56, 57, 58]
1. ábra: A DTC terápiamonitorozását szolgáló laboratóriumi vizsgálatok folyamata
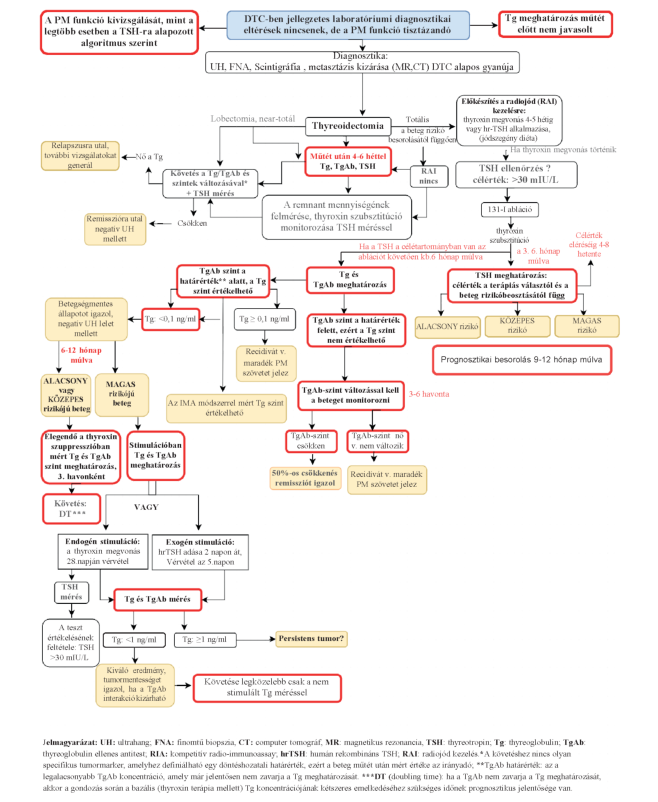
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
A DTC terápiamonitorozását szolgáló laboratóriumi vizsgálatok elvégzésének szükségességét a folyamatábra (1. ábra) szemlélteti. Ez az algoritmus a szenzitívebb (2. generációs) módszerre alapozott. Minden DTC-ben szenvedő beteg, rizikóbesorolástól függetlenül az élet végéig tartó gondozást igényel, ezért is fontos, hogy a biokémiai követés (Tg és TgAb) ugyanazon immunanalitikai módszerrel történjen, mert a pontos döntéshozatali határértékek módszerspecifikusak! Mivel a Tg elválasztása TSH-dependens, ezért javasolható, hogy a laboratórium automatikusan a Tg-kérés mellett nemcsak TgAb-t, hanem TSH-át is határozza meg.
Ábramagyarázat:
A műtét után 4 héttel javasolt a TSH- és Tg-, TgAb-szintek meghatározása a remnant mennyiségének felmérésére a műtét radikalitásától függetlenül. Hangsúlyozandó, hogy azoknál a betegeknél, akiknél lobectomia történik, illetve nem kerül RAI-ra sor, a követéshez nem alkotható olyan specifikus tumormarker, amelyhez definiálható lenne egy megbízható cut-off érték, ezért a műtét után 4 héttel mért alapérték lehet csak a referencia, egyénre szabottan. Totál thyreoidektomiát követően a beteg thyroxin szubsztitúcióban részesül, majd a rizikó besorolásától függően RAI-ra való előkészítés az effektívebb RAI-abláció érdekében napjainkban Thyrogennel történik, de ha mégis thyroxin megvonásra kényszerülnénk, ilyenkor a TSH-szint ellenőrizhető és akkor jó az előkészítés, ha a TSH > 30 mIU/L. Ha az előkészítés humán rekombináns TSH (hrTSH) adásával történt, értelmetlen a TSH-mérés (a módszer beméri a hrTSH-t). Az ablációt követően thyroxin szuppresszió indul, ezután általában 3 hónap múlva javasolt TSH-ellenőrzés. A thyroxin dózisának megfelelő beállításához a beteg a rizikó besorolásának megfelelő TSH-célérték eléréséig 4-8 hetente szükséges a TSH-t ellenőrizni. Az első Tg- és TgAb-, valamint TSH-mérés, a RAI ablatiot követően 6 hónap múlva történjen.
Míg a korábban megjelent egészségügyi szakmai irányelvek a TgAb interferencia, valamint a Tg-módszerek nem megfelelő és nem egységes szenzitivitása miatt ajánlják a TSH stimulációs teszt elvégzését rizikó besorolástól függetlenül, addig az újabb szenzitív Tg-módszerrel ezt már csak a magas rizikójú betegek esetében kell a műtét utáni 6. hónapban elvégezni. Ha a TgAb-interakció kizárható és stimulációra megfelelő eredmény születik, akkor a beteg a jövőben már thyroxin szuppresszió alatt mért Tg alapján is monitorozható. [44-47]
3. GYÓGYKEZELÉS
3.1. Műtéti kezelés
Preoperatív kivizsgálás: [59]
- elsődleges képalkotó a nyaki UH, mely a pajzsmirigy és a nyaki nyirokcsomó-régiók vizsgálatára is kiváló,
- FNAB-indikációk a patológiai fejezetben,
- hormonpanel,
- n. recurrensek működésének megítélése: anamnézis, fizikális vizsgálat, indirect gégetükrözés, laryngo-fiberoscopia, korábbi esetleges recurrens bénulás vizsgálata translaryngeális ultrahanggal,
- CT-substernalis terjedés esetén,
- MR a környező szervek infiltrációjának gyanúja esetén,
- molekuláris patológiai vizsgálat,
- elasztográfia (limitált alkalmazás, nem ad információt az extrathyreoidális terjedésről, illetve a nyirokcsomóstátuszról),
- PET CT rutinszerűn nem javasolt.
Sebészi kezelés [31, 60, 61, 62, 63]
Ajánlás23
A pajzsmirigyrák-eltávolító műtétek nyaki feltárásból vagy extracervicalis behatolásból (transzaxillaris, retroauricularis, transzoralis) végezhetőek. A nyaki feltárás lehet hagyományos "széles" sebészi behatolás vagy minimálisan invazív, endoszkóp asszisztált műtét. Az extracervicalis behatolásból végzett beavatkozások vagy endoszkóp- vagy robot asszisztált műtétek. (B)
Ajánlás24
A pajzsmirigyműtétek általában általános anaesthesiában történnek, de megfelelő indikációval helyi érzéstelenítésben is elvégezhetőek. (B)
Daganat gyanúja vagy igazolt daganat miatt végzett pajzsmirigyműtétek típusai:
- Lobectomia: egyik lebeny eltávolítása isthmus nélkül.
- Lobectomia+isthmectomia: egyik oldali lebeny eltávolítása isthmussal és a lobus pyramidalissal együtt.
- Isthmectomia: csak az isthmus kerül izoláltan eltávolításra.
- Thyreoidectomia near-total: kis maradék állomány a Berry szalag mentén (kb. 1 cm3 oldalanként) ennek jelentősége olyan esetekben van, amikor a daganatos oldali lebeny eltávolításakor a n. recurrens identifikálása nem egyértelmű, épsége megkérdőjelezhető, a másik oldalon a Berry szalag mentén kb 1 cm3-nyi állomány meghagyása megengedett az itt futó n. recurrens biztos megkímélése érdekében.
- Thyreoidectomia totalis: makroszkóposan a teljes pajzsmirigyállomány eltávolítása.
- Komplettáló műtét a maradék pajzsmirigyállomány reoperatív eltávolítása.
Ezek a műtétek nyaki feltárásból vagy extracervicalis behatolásból (transaxillaris, retroauricularis, transzoralis) is elvégezhetőek.
A nyaki feltárás lehet hagyományos "széles" sebészi behatolás vagy minimálisan invazív, endoszkóp asszisztált műtét. Az extracervicalis behatolásból végzett beavatkozások vagy endoszkóp- vagy robot asszisztált műtétek.
A primer tumor sebészi kezelésének indikációi:
Ajánlás25
Thyreoidectomia totalis javasolt azoknál a betegeknél, akiknél a következők közül egy kritérium is előfordul: távoli áttét, a tumor 4 cm-nél nagyobb, nyaki nyirokcsomó áttét van, korábbi nyaki sugárkezelés történt. (A)
Ajánlás26
Komplettálás szükséges szövettani eredmény után azon alacsony kockázatú betegeknél, kiknél: a daganat 4 cm-nél nagyobb, a rezekciós szél pozitív, a pajzsmirigytokon kívül terjed, makroszkóposan multifokális, mikroszkópos érinvázió vagy nyirokérinvázió vagy nyirokcsomó metastasis van. (B)
Lobectomia isthmectomiával elégséges:
- negatív reszekciós szél esetén (patológiai lelet alapján),
- ellenoldalon képalkotóval nem detektálható malignitásra szuszpekt lézió,
- nincs nyirokcsomó érintettség,
- a tumor kisebb mint 4 cm,
- nincs családi halmozódás,
- nem szerepel az anamnézisben nyaki irradiáció,
- nincs extrathyroidális terjedés.
Thyreoidectomia totalis javasolt azoknál a betegeknél, akiknél a következők közül egy kritérium is előfordul:
- távoli áttét,
- a tumor nagyobb, mint 4 cm,
- nyaki nyirokcsomó áttét,
- korábbi nyaki sugárkezelés történt.
Komplettálás szükséges szövettani eredmény után azon alacsony kockázatú betegeknél, akiknél:
- a daganat mérete nagyobb, mint 4 cm,
- rezekciós szél pozitivitás,
- pajzsmirigytokon kívüli terjedés ETE (extrathyroidal extension),
- makroszkópos multifokalitás,
- érinvázió,
- nyirokérinvázió,
- nyirokcsomó metastasis.
A differenciált pajzsmirigy carcinoma sebészi kezelésének algoritmusa TNM alapján Papillaris carcinoma
T1a - lobectomia
- thyreoidectomia végzendő:
- megelőző nyaki sugárkezelés,
- pajzsmirigyrák a családi anamnézisben,
- agresszivitás jelei a citológiai leletben,
- multifokalitás,
- extrathyroidealis terjedés (ETE) valószínűsíthető.
T1b,T2 - lobectomia:
- thyreoidectomia végzendő
- megelőző nyaki sugárkezelés,
- pajzsmirigyrák a családi anamnézisben,
- agresszivitás jelei a citológiai leletben,
- multifokalitás,
- extrathyroidealis terjedés (ETE) valószínűsíthető,
- radiojód terápia tervezett,
- molekuláris patológiai vizsgálat alapján (BRAF, V600, TERT),
- ellenoldalon toxikus adenoma,
- Graves betegség,
- ellenoldalon malignitásra szuszpekt elváltozás.
T3a, T3b, T4a - thyreoidectomia
T1-T4a+N1a- - thyreoidectomia+centrális nyaki dissectio
N1b- - thyreoidectomia+centrális+uni/bilateralis disszekció
Follicularis carcinoma sajátságai
- A follicularis carcinoma szövettani diagnózis (capsularis és/vagy vascularis invázió). Az FNAB-vizsgálat során jelzett follicularis neoplasia lehetősége nem specifikus: a szövettani feldolgozás eredménye az esetek csupán 20%-ban follicularis carcinoma, a 80%-a follicularis adenoma.
- Follicularis neoplasia gyanúja esetén lobectomia isthmectomiával végzendő. Az intraoperatív fagyasztásos szövettani vizsgálatnak nincs létjogosultsága. Ha a végleges szövettan follicularis carcinomát igazol, komplettálás szükséges.
- A műtét kiterjesztésében egyéb szempontok is figyelembe vehetők, úgymint a beteg kérése, (nem szeretne két beavatkozást), daganatos megbetegedés az anamnézisben, göbös ellenoldali lebeny vagy éppen endokrinológiai javaslat az optimális követés érdekében.
Hürthle-sejtes carcinoma (oxyphil sejtes tumor) sajátságai
Prognózisa rosszabb, mint a papillaris és follicularis carcinomáé. Kezelése megegyezik a follicularis carcinoma kezelésével, de a lokoregionális nyirokcsomóáttét valószínűsége nagyobb.
A nyaki nyirokcsomók sebészi kezelésének (disszekciók) típusai és indikációi (66)
Ajánlás27
Nyaki dissectiót jól differenciált pajzsmirigydaganat esetén profilaktikusan nem végzünk, a disszekció igazolt nyirokcsomóáttét esetén (FNA vagy intraop. fagyasztott vizsgálat) indikált. (B)
- Bizonyos esetekben azonban N0 nyakon megfontolható. Ezek a PTC agresszív variánsai, idős kor vagy gyermekkor, T3, T4 daganatméret, multifokalitás, extrathyroidalis terjedés. Az előbb említett esetekben azonos oldali centrális profilaktikus disszekció javasolható. Az érintett nyirokcsomó áttét szelektív eltávolítása (berry picking) a korábban még nem operált régióból nem elfogadott, ehelyett blokkdisszekciót szükséges végezni.
- Az intraoperatív elvégzett fagyasztásos hisztológiai vizsgálat pozitivitása a kezelési tervünket módosíthatja. Jól differenciált pajzsmirigydaganatok esetén szelektív nyaki dissectiót végezhetünk az elsődleges nyirokcsomóáttétek helyén, a centralis (VI) regióban, valamint a lateralis nyaki regióban (II, III, IV, Vb), valamint szükség esetén az I, Va nyirokcsomó régiókban is. A műtét során a funkcionális anatómiai képletek maradéktalan megtartására törekszünk. Radikális nyaki dissectió nyirokcsomó pozitivitás esetén sem elfogadott.
Ajánlás28
Centralis nyirokcsomó érintettség esetén centralis (level VI) disszekció szükséges. (A)
Ajánlás29
Laterális nyirokcsomó áttét (FNAB által igazolt) esetén, szelektív (level II, III, IV, Vb) nyaki dissectio ajánlott legalább azonos oldali centrális (level VI) disszekcióval (2. ábra). (B)
Ajánlás30
Level I, illetve Va disszekció csak ezen régióban levő áttétre pozitív nyirokcsomó(k) esetén ajánlott (2. ábra). (B) [64]
2. ábra: A nyaki rég A k bem utatása: Levell-VI
Forrás: 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid CancenThe American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer
Residualis daganatszövet, lokális recidíva kérdése
Ajánlás31
Residualis vagy recidív daganat esetén, képalkotó eredménye alapján FNAB-val igazolt pozitivitás esetén ismételt exploráció jön szóba. Amennyiben az elváltozás a sebész megítélése szerint nehezen identifikálható, a t mort a műtét előtt izotóppal javasolt megjelölni.
Ha az UH-vizsgálat környezeti érintettséget, infiltrációt igazol, MR vagy CT kiegészítő vizsgálat szükséges a pontosabb kiterjedés megítélésére a műtéti tervezéshez. (B)
- A lokálisan előrehaladott pajzsmirigyrák (locally advanced TC) a következő szerveket érintheti: 53% egyenes nyakizmok, 47% n. recurrens, 30% trachea, 21% nyelőcső, 12% gége. 4 szervre terjedés (trachea, oesophagus, n. recurrens, nagyerek) a műtétet kontraindikálja. A n. recurrens infiltrációval járó gégefél bénulás esetén az ideg feláldozható.
- Ép gégefél mozgás mellett az infiltrált ideg megkímélésére kell törekedni.
- Trachea érintettség esetén-shave excizió, segment reszekció, sleeve reszekciót végzünk. 4-5 trachea porc reszekálható.
- Nyelőcső érintettség esetén reszekció szóba jöhet. A gége érintettsége esetén egyidejűleg partialis gégereszekció vagy laryngectomia is végezhető.
Ajánlás32
Kiterjesztett műtét esetén minden esetben mérlegelni kell a beteg túlélési esélyét, valamint a szövődményeket és ezeknek az életminőségre gyakorolt hatását. (B)
- Lokális és regionális recidiv daganatok nagyobb arányban, 5-20%-ban fordulnak elő: nagyméretű primer tumorok, extrathyreoidealis terjedés, nyirokcsomó érintettség esetén. Radiójód kezelés után műtét végezhető. A külső sugárforrású kezelés (EBRT) indikációit a sugárterápiás fejezet részletezi.
- Távoli áttétek a tüdőben (50%), a csontokban (25%), a tűdőben és csontban együttesen (20%) fordulnak elő. Agyi, és máj áttétek 5%-ban észlelhetőek.
- Fennállásuk esetén sebészi kezelés, vagy radiojód terápia javasolt. Radiojód refrakter áttétek esetén EBRT vagy radiofrekvenciás (RFA) vagy laseres abláció megkísérelhető.
Ajánlás33
Nagyméretű, aggresszív típusú, légutat elzáró daganat esetén palliatív sebészi beavatkozásnak van létjogosultsága a tumort megkisebbítő, debulking műtét formájában a légút biztosítását követően. (B)
A pajzsmirigyműtétek szövődményei:
- haematoma 0.7-1.5% között fordul elő. Ezek 80%-a 24 órán belül jelentkezik. Azonnali ellátást igényel. Drain behelyezése nem csökkenti a postoperatív haematoma gyakoriságát,
- nervus laryngeus recurrens diszfunkció az intubálást követően jelentkező oedema következtésben néhány nap alatt normalizálódik. Átmeneti bénulás 0.5-10%, végleges bénulás 0-5% közötti. A reoperáció növeli a gyakoriságot. Kétoldali bénulás 0.1-0.4%. Azonnali ellátátást igényel. Tracheotomia vagy hangszalagkiöltés szükséges.
- A hypoparathyreosis hypocalcaemiát okoz, átmeneti 19-38%, végleges 0-3% között. Teljes pajzsmirigy-eltávolítás, centrális disszekció növeli az előfordulását. [67]
A pajzsmirigyműtétekkel kapcsolatos sebésztechnikai megfontolások
Ritka esetek kivételével a thyreoidectomia elektív beavatkozás, amely interdiszciplináris csapatmunkát igényel.
- műtét során a disszekciót a kapszula (tok) mentén végezzük (Strong recommendation, low-quality evidence),
- ha a mellékpajzsmirigy eltávolításra kerül, autotranszplantációja szükséges. (Strong recommendation, low-quality evidence), [67]
- a mellékpajzsmirigyek funkciója vérellátásuk függvénye, ezért javasolt az a. thyroidea inferior óvatos ellátása,
- a n. laryngeus recurrens, valamint a n. laryngeus superior ramus externus felkeresése és látótérbe hozása minden pajzsmirigyműtét egyik alaplépése,
- az átmeneti és végleges ideg paresis gyakoriságát, multicentrikus vizsgálatok eredményei alapján, az idegmonitor használata nem csökkenti. Az eredmények csakis az anatómiai ismereteken alapuló gyakorlattal javíthatóak.
A pajzsmirigyműtétek elvégzésének szükséges, elvárható feltételei:
Személyi feltételek
Ajánlás34
Rosszindulatú daganat miatt indikált pajzsmirigy műtét önálló végzése csak azon fül-orr gége, általános sebészeti vagy arc-, állcsontsebészeti szakvizsgával rendelkező szakorvosoknak ajánlott, akik évente minimum 50 darab primer pajzsmirigyműtétben (operatőr és/vagy 1. asszisztens) közreműködnek, ezen kívül 10 db centrális, illetve 10 darab lateralis nyaki dissectiót végeznek megfelelő számú nyirokcsomó eltávolításával. A beavatkozásokat végző intézményben évente legalább 100 primer pajzsmirigyműtét történjen 20-20 db centralis, illetve lateralis blokkdisszekcióval. (B) [66]
A műtét tárgyi feltételei, illetve ajánlott tárgyi feltételei
A pajzsmirigy sebészete specialis műtéti felszerelést az alap műtői felszereltségen kívül nem igényel, de több speciális eszköz beszerzése ajánlható:
- nagy energiájú vágóeszköz-lekötések nélkül, vérveszteség nélkül, tiszta műtét végezhető,
- neuromonitor (alkalmazása megfelelő tanulási folyamat után kedvező lehet a kevesebb gyakorlattal rendelkező, vagy n. recurrenst nem napi szinten felkereső operatőr esetében),
- gamma-kamera izotópjelölt recidívák sebészetéhez,
- sebészeti kisméretű titán klippek az ideg melletti vérzések ellátásához.
3.2. A nukleáris medicina szerepe a DTC-k kezelésében
Ajánlás35
Az ATA és az európai társaságok (EANM, ETA) ajánlásai között diszkrepancia van, hiányoznak a nagy beteganyagra kiterjedő prospektiv, bizonyító erejű vizsgálatok [31, 68, 69]. A radiojód kezelésre a total/near total thyreoidectomiát követően 4-6 hét múlva kerülhet sor. A megfelelő pajzsmirigy hormonpótlás mellett a prognózis szempontjából nem jelent hátrányt a RAI kezelés maximum féléves halasztása, de halasztott kezelés esetén figyelni kell a megfelelő pajzsmirigy-hormonpótlásra. (B)
Ajánlás36
Lobectomia esetén radiojód abláció nem végezhető. (D) Ha kérdéses a residualis pajzsmirigyszövet mérete, pajzsmirigy szcintigráfia elvégzése javasolt 99mTc-mal. (B)
A pajzsmirigy radiojód felvételét a TSH fokozza, ezért a radiojód kezelés előtt a TSH szintet legalább 30 mU/l-re kell növelni.
Ajánlás37
A radiojód kezeléshez szükséges magas TSH elérésében a rekombináns humán TSH (rhTSH) adása a thyroxin kihagyás alternatívája lehet. (A)
Ajánlás38
A radiojód kezelés hatékonyságát lényegesen csökkenti a jódkontamináció, ezért a kezelést megelőző 3 hónapban kontrasztanyagos CT-vizsgálat vagy koronarográfia végzése nem javasolt, a beteg nem fogyaszthat jódtartalmú vitaminokat sem és fel kell hívni figyelmét a jódszegény étrendre. (D)
- Nem szükséges radiojód kezelés, ha a differenciált daganat egygócú, átmérője <1,0 cm, a daganat teljes egészében eltávolításra került, nem adott áttéteket (T1N0M0), nem invazív, szövettana nem mutat agresszív jelleget. (ATA low risk, ETA very low risk)
- Remnant abláció (1,1 GBq radiojód) javasolható az európai irányelvek szerint, ha a tumor átmérője < 1,0 cm (T1N0M0) de többgócú, vagy ha a tumor 1-4 cm közötti átmérőjű (T2N0M0), de teljes egészében eltávolításra került, nem adott áttéteket. Célja a maradék pajzsmirigy szövet eliminációja. Az amerikai irányelv rutinszerű remnant ablációt nem javasol. (ATA low és intermedier risk, ETA low risk)
- Adjuváns radiojód terápia (3,7 GBq) szükséges, ha a tumor átmérője > 4 cm (T3a), ha regionális nyirokcsomó áttét igazolódott (N1), ha a pajzsmirigy tokját áttörte a daganat (T3b), betört az érbe (V1), függetlenül a tumor méretétől, ha a rezekciós szél érintett (R1), de makroszkópos residualis tumor nincs, illetve, ha a tumor szövettana agresszív. (ATA intermedier és high risk, ETA high risk)
- Terápiás célú radiojód kezelés (3,7 GBq) szükséges, ha ismert residualis betegség van, a daganatot sebészileg, helyileg nem sikerült teljes egészében eltávolítani (R2) illetve, ha távoli áttét van, függetlenül a primer tumor átmérőjétől. (M1). (ATA és ETA high risk)
A postoperatív, első radiojód terápia céljait a 8. táblázat foglalja össze.
8. táblázat: A műtét utáni első radiojód kezelés típusai és céljai.
| Postoperatív 131I terápia | |||
| Cél | Remnant abláció (1,1 GBq) | Adjuváns terápia (3,7 GBq) | Ismert betegség terápiája (3,7 GBq) |
| Staging | + | + | + |
| Követés elősegítése | + | + | + |
| Recidíva csökkentése | + | + | |
| Betegségspecifikus túlélés | + | + | |
| javítása | |||
| Terápiás cél | + | + | |
| Palliatív cél | + | ||
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Ismételt, kuratív/palliatív terápia indikált, ha:
- a differenciált pajzsmirigyrák helyileg kiújult; amennyiben lehetséges, a recidív tumor tömegét sebészileg a lehető legkisebbre kell csökkenteni, és ezt követően végzendő el a radiojód kezelés,
- a posztablációs egésztest szcintigram, illetve SPECT/CT felvétel a pajzsmirigyágyon kívül - a regionális nyirokcsomókban és/vagy más szervekben is mutat jódhalmozó áttéteket,
- a posztterápiás egésztest szcintigráfia, illetve SPECT/CT csak a pajzsmirigyágyban mutatott felvételt, áttétet nem jelzett, de a tumormarker [thyreoglobulin (Tg) vagy a thyreoglobulin elleni antitest (TgAb)] titere növekszik.
Ajánlás39
Habár az ajánlott kuratív/palliatív aktivitás 3,7-7,4 GBq, sugárvédelmi szempontból az 5 GBq feletti aktivitás esetében javasolt a dózisbecslés elvégzése az EANM útmutatójának megfelelően. A radiojód terápia 6-12 havonta ismételhető. (B)
Ajánlás40
A korrekt staging része a radiojód kezelést követően 3-6 nappal elvégzett anterior és posterior irányú egésztest szcintigráfia, és tekintettel prognosztikai jelentőségére, kiegészítő SPECT/CT-felvételek elkészítése is szükséges. A posztterápiás egésztest szcintigráfia és SPECT/CT alapvetően hozzájárul a rizikóbesoroláshoz (9. táblázat). (B)
9. táblázat: A betegség-specifikus halálozás rizikója a posztterápiás egésztest szcintigráfia és SPECT/CT függvényében.
| Egész test szcintigráfia és SPECT/CT | Betegség-specifikus halálozás rizikója |
| Negatív | Igen alacsony |
| Nyirokcsomó áttét | Alacsony |
| Micronodularis tüdő áttét | Jó terápiás válasz esetén alacsony |
| Macronodularis tüdő áttét | Magas |
| Egyéb lokalizációjú távoli áttét | Magas |
| Jódfelvételt nem mutató áttét | Magas |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Diagnosztikus célú radiojód szcintigráfia elvégzése a tumor stádiumától függően meghatározott kontroll vizsgálatokat követően akkor mérlegelendő, ha az abláció utáni radiojód egésztest szcintigram negatív volt, de a követés során recidíva/áttét gyanúja merül fel, elsősorban TgAb pozitív betegeken, amennyiben a titer nem csökken vagy emelkedik és egyéb képalkotóval áttét nem igazolható. A negatív diagnosztikai vizsgálat megnöveli annak valószínűségét, hogy a beteg DTC-je 131I refrakter, de nem abszolút kritériuma. Ismert tény ugyanis, hogy a diagnosztikai radiojód vizsgálat gyakran negatív, míg a nagyobb dózissal végzett 131I postterápiás vizsgálattal megjelennek a jód avid metastasisok. Amíg a betegnek jódfelvevő tumora vagy metaszázisa van, vagy annak a valószínűsége fennáll, a radiojód kezelés ismétlése javasolt.
Jód-refrakteritás gyanúja estén FDG PET/CT-vizsgálat elvégzése javasolt.
Radiojód (131I) terápia
A radiojód kiemelt, különlegesen fontos szerepe a differenciált pajzsmirigyrákok terápiájában több mint 50 éve ismert. A radioaktív jód az inaktív jódhoz hasonlóan a pajzsmirigyben halmozódik fel, ezért a pajzsmirigybetegségek sugárterápiájára alkalmas. A 131I fizikai felezési ideje 8,04 nap. Gamma és béta sugárzó. A sugárterápiás hatásért 90%-ban a pajzsmirigyben feldúsult radioaktív jód ß sugárzása felelős, amely a pajzsmirigy állományában nyelődik el (hatótávolság: 0,5-2,2 mm). A gammasugárzás teszi lehetővé a postterápiás méréseket. A kialakuló sugárhatás a pajzsmirigyszövet radioaktív koncentrációjától, tehát a radiojód felvétel mértékének és a működő pajzsmirigyállomány nagyságának arányától, valamint az effektív felezési időtől függ.
A radionuklid kezelés a papillaris és follicularis pajzsmirigy carcinoma ellátásának, a műtétet követő második legfontosabb eleme.
A radiojód-kezelés előkészítése:
- A megfelelő radikalitású műtét, amely totális, vagy "near" totális pajzsmirigy eltávolítást jelent.
- A TSH szint kellően magas (> 30mU/L). Ennek érdekében a pajzsmirigy hormon készítmény szedését fel kell függeszteni (T4 szedését 4-6 hétre, a T3 készítmény szedését 2 hétre). Rekombináns humán TSH (alfa thyrotropin) adása esetén a pajzsmirigyhormon szedését csak a kezelés idejére kell abbahagyni.
- Alacsony jódtartalmú diéta a kezelés előtt 2 héttel (jódot tartalmazó kontrasztanyaggal végzett vizsgálatokat 6 hónappal a kezelés előttől mellőzni szükséges, illetve célszerű a jódtartalmú gyógyszerek kiváltása a gyógyszer kiürülésének felezési idejétől függően).
A radiojód-kezelés hatékonysága
A helyi, regionális kiújulás terápiája elsősorban sebészi. A radiojód terápia azonban önmagában is képes recidív tumoros gócok elpusztítására, amennyiben a radiojód felvétel 80 Gy sugárdózis leadását biztosítja a tumorban. 1 cm-nél nagyobb tumor esetén a tumor elpusztításához szükséges dózis 131I kezeléssel nem érhető el. A legjobb terápiás eredményeket a sebészi beavatkozás és a 131I kezelés kombinációja biztosítja.
A nyirokcsomó metasztázisok - amennyiben lehetséges - műtéti eltávolítása indokolt. A sebészi beavatkozást itt is minden esetben 131I kezelés követi. Kialakult hegesedések, többszöri műtétek után - megfelelő radiojód felvétel esetén - az ismételt műtét helyett egyedül radiojód kezelés elvégzése is indokolt lehet.
Ajánlás41
A nyirokcsomóáttétek általában jól reagálnak a radiojód kezelésre, de a metasztatikus nyirokcsomó hatásos gyógyíthatósága érdekében az elnyelt sugárdózis a kérdéses elváltozásban legalább 80Gy legyen. (B)
- Ez a dózis 60-70%-ban teljes, 80%-ban partiális remissziót eredményez. Fiatal betegeknél, magasan differenciált tumorok esetén, és ha a nyirokcsomó mérete az 1 cm-t nem haladja meg, a 131I terápia egyedüli alkalmazásával komplett remissziót, gyógyulást lehet elérni.
- Az 1 cm-nél nagyobb tumor esetén a tumor elpusztításához szükséges dózis 131I kezeléssel nem érhető el. A legjobb terápiás eredményeket a sebészi beavatkozás és a 131I kezelés kombinációja biztosítja.
- Idősebb korban, kiterjedt nagy tumorok és dedifferenciált rákok esetén még extrém magas izotóp dózis alkalmazása esetén is csekélyebb a terápiás hatás.
- A radiojód terápia kombinálható külső besugárzással is (különösen akkor, ha a nyirokcsomó izotóp felvétele csekély).
Ajánlás42
A tüdőáttét általában többszörös, sebészi eltávolítására csak ritkán kerül sor, az ilyen esetekben a radiojód-kezelés lehet ajánlható. (B)
A micronoduláris tüdőmetasztázisokkal jelentkező betegek különösen jól reagálnak a kezelésre. Ezen betegek több mint 80%-ában komplett remisszió, "gyógyulás" érhető el. Fontos tényező azonban a betegek kora. A 40 év alatti betegek 95%-a jól reagál a radiojód kezelésre, míg a 40 év felett csak mintegy 25%-ban észlelhető a tumor regressziója. A 40 év feletti betegekben többnyire macronoduláris tüdőmetasztázisok jelennek meg, és az áttétek mintegy 2/3-a nem veszi fel a radiojódot. Jódfelvétel esetén az átlagos túlélés 3-4 év, míg hiányzó jódfelvétel maximum 1-2 éves túléléssel jár. Végleges tumorregresszió, gyógyulás igen ritka.
Általánosságban elmondható, hogy csontmetasztázis esetén a prognózis rosszabb, mint lágyrész metasztázisok esetében.
Ajánlás43
Monofokális csontáttét esetén elsődlegesen a sebészi eltávolítás vagy a tumor megkisebbítése ajánlott ortopediai megoldással az esetleges fractura vagy a neurológiai komplikációk megelőzése érdekében. A radiojód kezelés a sebészi beavatkozást követi. (B)
Ajánlás44
Multifokális csontmetasztázis esetén a radiojód terápia akkor ajánlott, ha radiojód felvétel mutatható ki a metasztázisban. A terápiás hatás függ a radiojód felvétel mértékétől, és a terápiás dózis nagyságától. (B)
- A radiojód terápia hatására a lyticus metasztázisban meszesedés indul meg. Radiojód adása a csontáttétet önmagában meggyógyítani ritkán képes, de a fájdalom többnyire jelentősen csökken. Végleges gyógyulás ritkán fordul elő, a betegek 2/3-a 8-9 éven belül meghal.
- A radiojód-terápiás kezelés évtizedek ótajátszik fontos szerepet az áttétes, vagy kiújult differenciált pajzsmirigyrákok kezelésében. Segítségével disszeminált pajzsmirigyrákos betegek jelentős része meggyógyítható, de még a véglegesen nem gyógyítható esetekben is hosszú évekre szóló tünetmentesség érhető el. Helyi-regionális kiújulás esetén 60%, távoli áttét kialakulását követően pedig 25-40% a 10 éves túlélés.
A radiojód-kezelés mellékhatásai
Ajánlás45
A radiojód terápia jól tolerálható, megbízható és kellően biztonságos. A kezelés során a nyálmirigyek védelme erősen ajánlott. A nyálmirigyek által felvett radioaktív jód forszírozott kiürítése különböző nyáltermelést fokozó ételek (rágógumi, citrom, cukrok) fogyasztásával érhető el. A terápia ideje alatti bő folyadékfogyasztás szintén a célszervben nem dúsuló radiofarmakon további fokozott eliminációját segíti elő. (B)
A mellékhatások jelentkezésük időpontja szerint lehetnek korai vagy késői mellékhatások. A korai mellékhatások az izotóp beadása után néhány órán belül jelentkezhetnek és néhány napig is eltarthatnak. A késői mellékhatások évek, évtizedek múlva jelenhetnek meg.
- Korai mellékhatások:
- nyaki feszülés, fájdalom,
- hányinger, émelygés, nagyon ritkán hányás,
- akut sialoadenitis, sialolithiasis,
- átmeneti csontvelő depresszió.
A korai mellékhatások legtöbbször megelőzhetőek és enyhe, átmeneti lefolyásúak. A nyaki feszítő érzés, esetlegesen fájdalom lokális és gyógyszeres fájdalomcsillapítók alkalmazásával megszüntethető. Az emésztőszervrendszeri panaszok kialakulását a gyomorvédelem mellett beadott radioaktív jódkapszula jelentős mértékben csökkenti, esetleges hányinger, émelygés megjelenésekor anti-emetikumok használata javasolt. A nyálmirigygyulladás, igen ritkán, elsősorban nem, vagy nem megfelelően alkalmazott nyálmirigyvédelem vagy kövesség következtében alakulhat ki. A csontvelő átmeneti károsodása elsősorban előrehaladott stádiumú, csontáttétes betegek nagy dózisú kezelését követően fordulhat elő. A betegek alapos állapotfelmérésével, illetve a kezelést megelőző vérkép analízisével a csontvelői károsodás rizikója minimálisra csökkenthető.
- Késői mellékhatások:
- az ízérzés megváltozása, átmeneti elvesztése, szájszárazság,
- férfiaknál átmeneti oligo-, azoospermia és emelkedett FSH-szint,
- nőknél az ovárium funkció átmeneti csökkenése, amenorrhoea, valamint emelkedett LH- és FSH-szint.
A szájszárazság, illetve a csökkent nyálelválasztás a nyálmirigyek károsodásával van kapcsolatban, melynek kialakulása megfelelő nyálmirigyvédelem mellett minimalizálható. A radiojód-kezelés után férfiak esetében minimálisan 3 hónapig (a germinalis hám újraképződéséig) nem javasolják a gyermeknemzést, nők esetében pedig 1 évig a terhességet. A radiojód csak nagy dózisban és igen ritkán okoz infertilitást, és eddig nem írtak le az utódokban radiojód-terápiára visszavezethető károsodást.
A patológiás késői mellékhatások (második malignus tumor, tüdőfibrózis) rendkívül ritkák, irodalmi adatok alapján is a kialakulásuk kockázata kevesebb, mint 1%-ra tehető. A radiojód terápia elmaradásából adódó egészségkárosodás kockázata ezt a tényezőt szinte minden esetben meghaladja.
3.3. Gyógyszeres kezelés
Ajánlás46
Radiojód-kezelésre reagáló DTC esetén RAI az elsődlegesen választandó kezelési forma. TSH-szuppressziós kezelés a kockázatbesorolástól függően egy évig vagy nagy kockázatúaknál és metasztatikus betegségnél végig szükséges, kiegészítésként külső sugárkezelés, lokoregionális kezelések (thermoablativ kezelések: laser, RFA) alkalmazhatók. (B)
A DTC ellátása során radiojód-refrakter inoperábilis recidíva vagy metasztatikus betegség diagnózisa esetén jön szóba szisztémás onkológiai kezelés. Adjuvánsan sem kemoterápia, sem tirozin-kináz-gátló (TKI) nem javasolható. A metasztatikus betegség kezelési tervének felállításakor figyelembe kell venni az érintett lokalizációk mellett a szervezet daganatterhelését, a progresszió ütemét. Differenciált pajzsmirigydaganatok leggyakrabban nyirokcsomó-, tüdő-, csontmetasztázisokat okoznak. Lokoregionális relapszus esetén lehetőleg műtéti megoldásra kell törekedni. Radiojód-kezelésre reagáló betegség esetén RAI az elsődlegesen választandó kezelési forma. TSH-szuppressziós kezelés a kockázatbesorolástól függően egy évig vagy nagy kockázatúaknál és metasztatikus betegségnél végig szükséges (lásd részletesen jelen egészségügyi szakmai irányelv szuppressziós kezelést részleteiben tárgyaló fejezetét), kiegészítésként külső sugárkezelés, lokoregionális kezelések (thermoablativ kezelések: laser, RFA) alkalmazhatók.
Ajánlás47
A szisztémás onkológiai kezelés a radiojód-refrakter inoperábilis recidíva vagy metasztatikus betegség diagnózisa esetén jön szóba. Adjuvánsan sem kemoterápia, sem tirozin-kináz-gátló (TKI) nem javasolható. A TKI-kezelésről az előző terápiákra adott válasz, a válasz időtartama, a mellékhatások és a kockázat-haszon arány mérlegelése alapján lehet dönteni, ha nagyobb a várható haszon, mint a toxicitás. A terápiára adott válasz értékelése a RECIST kritériumok alapján történik. (B)
Jódrefrakter a betegség, ha az áttét sohasem vett fel RAI-t, vagy elvesztette jódfelvevő képességét, vagy a RAI-kezelést követően progresszió észlelhető (általánosságban egy éven belül). Bár számos klinikai vizsgálat használta a 22,2 GBq-t meghaladó kumulatív aktivitást a jódrefrakteritás kritériumaként és a TKI-kezelés indikációjának felállításához, ennek megítélése nem egyértelmű. A korábbi vizsgálatokból ismert, hogy ennél nagyobb kumulatív dózis a másodlagos malignitások valószínűségének jelentős emelkedésével jár. A radiojód-kezelés folytatásáról vagy a TKI-kezelés elkezdéséről ezekben az esetekben az előző terápiákra adott válasz, a válasz időtartama, a mellékhatások, valamint az adott betegre vonatkozó kockázat-haszon arány mérlegelése alapján lehet dönteni.
Számos esetben a perzisztáló betegség kis volumenű, tünetmentes, stabil, lassú progressziójú. A szisztémás kezelés toxicitása nagyobb lehet, mint a hatékonysága, ezért progresszió esetén is csak akkor javasolt szisztémás kezelés, ha nagyobb a várható haszon, mint a toxicitás.
Fontos kihangsúlyozni a TSH szupresszió folyamatos fenntartásának szükségességét előrehaladott, áttétes betegség kezelése során, akár kap a beteg további szisztémás kezelést, akár nem.
A betegség progressziójának megítélése és a terápiára adott válasz értékelése a RECIST kritériumok alapján történik. Multikinázgátlók
A gastro-intestinalis stroma tumorok (GIST) daganatok után a pajzsmirigydaganatok tartalmazzák a leggyakoribb potenciálisan célzottan kezelhető genetikai eltéréseket, és mintegy a betegek 61%-nak van célzottan kezelhető mutációja, gén-fúziója. [70, 71]
10. táblázat: A pajzsmirigyrákok célzott kezelése szempontjából vizsgálandó génmutációk.
| PTC | FTC | Hürthle | PDTC |
| BRAF V600E | N/H/K RAS | Kromoszóma vesztés | BRAF V600E |
| TERT promoter | mutációk | mtDNA komplex I mutációk | TERT promoter mutációk |
| mutációk | DICER 1 | TERT promoter mutációk | N/H/K RAS mutációk |
| RET fúziók | EZH1 | DAXX | EIF1AX |
| N/H RAS mutációk | PTEN | TP53 | PI3K/AKT |
| BRAF fúziók | PAX8-PPARG | NRAS | RET fúziók |
| NTRK3 és 1 fúziók | fúziók | NF1 | ALK fúziók |
| ALK fúziók | CDKN1 | ||
| EIF1AX |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Progrediáló, tüneteket okozó esetekben multikináz inhibítor (MKI) kezelés bevezetése javasolt. MKI-ok citosztatikus hatásúak, de nem citotoxikusak, így a sejtek növekedését/proliferációját gátolják, de ha ezt a gátlást felfüggesztjük akkor a sejtnövekdés/osztódás újra beindul. Ezért adagolásuk folyamatos, addig adandók, amíg alkalmazásukból bizonyíthatóan további előny nem származik. MKI alkalmazása során számos mellékhatás léphet fel, ezeket figyelni, követni és multidiszciplináris ellátási környezet segítségével kezelni kell.
Ajánlás48
Az Európai Pajzsmirigy Társaság javaslata [72] szerint MKI-val kezelt betegeket az első két hónapban kéthetente, következő 6 hónapban havonta, következő egy évben 3 havonta, ezt követően 4 havonta javasolt ellenőrizni. (B)
MKI kezelés során észlelt leggyakoribb melléhatások: hypertonia, hasmenés, fogyás, fáradtság, hányinger, mucositis, stomatitis, kéz-láb syndroma, bőrkiütések, alopecia. Ritkább, de életet veszélyeztető mellékhatások: QTc megnyúlás, vérzés/thromboembolia, fistula képződés. Ezek gyakran (páciensek 64-79%-nál) a terápiás dózis csökkentését teszik szükségessé. [72]
Ajánlás49
A nemzetközi irányelvek [76] elsővonalban a lenvatinib kezelést részesítik előnyben, mivel az objektív daganatválasz 64,8% volt a sorafenib 12,2% os objektív daganatválaszával szemben. A döntés során azonban a várható terápiás válasz mellett a beteg kísérőbetegségeit is figyelembe kell venni. (B)
11. táblázat: A multikináz inhibítor (MKI) kezelés mellett követendő paraméterek.
| panasz/tünet | Testsúly, étvágy, fáradékonyság, hasmenés, bőrelváltozások, páciens napló: mellékhatásokról, tünetekről |
| labor | TSH, FT4 (thyreoglobulin, anti-Tg időszakosan), elektrolitok (Na, K, CA, Mg), vérkép, májenzimek, vérzsírok, lipidek |
| kardiovaszk. paraméterek | EKG (QTc), vérnyomás |
| képalkotás | Egész test leképezése CT/MRI/18-FDG-PET, opcionálisan csontszcintigráfia |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Jódrefrakter, lokálisan előrehaladott vagy metasztatikus DTC kezelésére jelenleg két multikináz inhibitor van törzskönyvezve Európában, a sorafenib (DECISION vizsgálat alapján) [74] és a lenvatinib (SELECT vizsgálat alapján) [75]. Mindkét TKI javítja a progressziómentes túlélést (PSF) placeboval szemben, azonban a teljes túlélés (OS) javulásáról csak a lenvatinibbel kezelt, és csak a 65 év feletti betegek csoportjában számoltak be. [73]
Sorafenib - multikinázgátló (VEGFR1-3, RET, RET/PTC BRAF), 2013-ban engedélyezte az FDA a DECISION vizsgálat alapján, amelyben a PFS a placebo csoportban talált 5,8 hónapról 10,8 hónapra növekedett. Minden szövettani típusban és BRAF mutációtól függetlenül is hatékony volt. Mellékhatások gyakoriak, a betegek 98.6%-ában jelentkeztek (placebo: 87.6%), a legfontosabbak a kéz-láb syndroma, hasmenés, alopecia, bőrtünetek, fáradékonyság voltak. [77]
Lenvatinib - multikinázgátló - (VEGFR1-3, FGFR1-4, PDGFR, RET, c-KIT), az FDA 2015-ben engedélyezte a SELECT vizsgálat alapján, amelyben a PFS 18.3 hóra növekedett a placebo ágon tapasztalt 3,6 hónappal szemben, Minden szövettani típusban és BRAF mutációtól függetlenül hatott. Mellékhatás 97.3%-nál jelentkezett (placebo: 59.5%), hypertonia, hasmenés, fáradtság, étvágytalanság, súlycsökkenés voltak a leggyakoribbak. [78]
A nemzetközi irányelvek [76] elsővonalban a lenvatinib kezelést részesítik előnyben, mivel az objektív daganatválasz 64,8% volt a sorafenib 12,2% os objektív daganatválaszával szemben. A döntés során azonban a várható terápiás válasz mellett a beteg kísérőbetegségeit is figyelembe kell venni.
A pajzsmirigy daganatokban gyakran egyéb célozható molekuláris eltérések is kimutathatók. Ajánlás50
NTRK 1/3 fúzió a papillaris carcinomák (PTC) közel 2%-ban mutatható ki, a gyermekkori esetekben azonban sokkal gyakoribb. A larotrectinibbel végzett vizsgálatban az NTRK fúziót mutató DTC betegek 90%-a reagált a kezelésre. [77] NTRK-fúziót mutató daganatokban entrectinib kezelés szintén ajánlott. (B) [76]
Az FDA által engedélyezett két RET inhibitor közül a pralsetinib kezelés válaszadás aránya 89% volt [80], míg az EMA által is regisztrált (rövidesen Mo-n is elérhető) selpercatinibre a betegek 100% a reagált. [79]
RET fúzió a PTC betegek 10%-ban fordul elő, a gyermekkor betegek, valamint a fiatal felnőttek esetében gyakorisága azonban közel 30%. [78]
A selpercatinib gyermekek (> 12 éves kor), valamint felnőttek előrehaladott vagy metasztatikus RET fúzió pozitív, radiojód refrakter pajzsmirigytumoros betegek kezelésére javallt, amennyiben szisztémás kezelést igényelnek. A LIBRETTO-001 klinikai vizsgálatban a megelőző szisztémás kezelésben nem részesült, RET fúzió pozitív betegek 100% a reagált a kezelésre. [79]
A pralsetinib szintén 12 éves vagy idősebb gyermekek, valamint felnőttek RET fúzió pozitív előrehaladott, jódrefrakter pajzsmirigy daganatainak kezelésre javasolt, amennyiben szisztémás kezelést igényelnek. A pralsetinib hatékonyságát az ARROW vizsgálatban értékelték. A vizsgálat 9 beteg esetében a válaszadás aránya 89% volt. [80]
A BRAF V600E mutáns daganatok dabrafenib +/- trametinib kezelése egy fázis II vizsgálatban nem bizonyult jobbnak az elsővonalbeli lenvatinib kezelésnél. [81]
Jelenleg nem áll rendelkezésünkre olyan terápiás lehetőség, mely metasztatikus DTC-ben a beteg számára tartós komplett remissziót vagy a teljes túlélés jelentős javulását biztosítja.
Előrehaladott/metasztatikus DTC okozta multiplex tünetek (légúti compressio, dysphagia, csontfájdalmak, patológiás törések...stb) palliatív kezelése során az életminőség javítására multimodalis kezelés jön szóba: műtét (pl. compressios tünetek esetén), palliativ sugárterápia, csigolya plasztika, intervenciós radiológiai beavatkozások (RFA, TAE).
Ajánlás51
Csontmetasztázisok detektálhatók az előrehaladott DTC-ben szenvedők 4%-ban. Szisztémás kezelésként biszfoszfonátok (elsősroban zolendronsav), valamint a csonttörések megelőzésében hatékonyabb, az osteoclast aktivitást gátló monoclonalis IgG2 antitest denosumab ajánlottak. (B)
Megjegyzendő, hogy a denosumab - hasonlóan a biszfoszfonátokhoz - szintén okozhat hypocalcaemiat és állcsontnecrosist, de kevésbé befolyásolja a vesefunkciót és kevesebb akut fázis reakciót okoz. [82, 83]
Immunterápia
Ajánlás52
Az előrehaladott pajzsmirigyrák immunterápiáját illetően korlátozott számban rendelkezésre álló adat szerint ígéretes eredményű kezeléseket a daganat molekuláris profilja és a részleges vagy teljes regresszió szerint racionálisan ajánlott alkalmazni - klinikai vizsgálatok keretében amennyiben az elérhető. (B)
A közelmúltban publikált KEYNOTE-028 fázis Ib klinikai vizsgálatban 22 előrehaladott papillaris és follicularis pajzsmirigydaganatos beteget kezeltek pembrolizumab monoterápiával. [84] A vizsgálat célja a biztonságosság, illetve a tumorellenes aktivitás volt. A vizsgálat során két részleges választ észleltek, az ORR (CR+PR+SD) 9%-nak bizonyult. A válasz időtatrtama 8-20 hónap volt. Beválasztási kritériumként PD-L1 nagyobb 1% szerepelt.
Az immuncheck-point gátlók szerepe ígéretesnek tűnik az előrehaladott pajzsmirigyrák kezelésében. [85] Annak ellenére, hogy az előrehaladott pajzsmirigyrákok esetén nincs evidencia arra, hogy prediktív biomarkereket expresszálnak, számos irodalmi adat utal ígéretes eredményekre. Kollipara és munkatársai kivételes hatékonyságot, terápiás választ írtak le egy előreheledott BRAFV600E-positív pajzsmirigyrákos beteg immun kezelése során. 12 ciklus nivolumab kezelést követően jelentős regressziot észleltek. A kezelést folytatva teljes radiológiai és klinikai remissziót tudtak elérni, képalkotó vizsgálatokkal igazolva. Hasonló eredményeket közöltek Spalart és munkatársai. Előrehaladott pajzsmirigyrákos betegnél két ciklus pembrolizumab kezelést követően jelentős javulást értek el. Három ciklust követően közel teljes remissziót mutattak a képalkotó vizsgálatok. A közelmúltban publikálták 30 előrehaladott pajzsmirigyrákos beteg immunterápiás kezelésének eredményeit. [86] FázisI/II klinikai vizsgálatban spartalizumab monoterápiát alkalmaztak. A teljes válaszadási arány, RECIST 1.1 szerint 17% volt (5 beteg/30 beteg). Ezzel szemben Khan és munkatársai 4 betegből 2 esetében észleltek részleges regressziót pembrolizumab kezelés során.
Összefoglalva bár csak korlátozott számú adat áll rendelkezésre az előrehaladott pajzsmirigy rák imunterápiáját illetően, azonban ezek az eredmények ígéretesek. Sok esetben fordul elő a daganat részleges vagy teljes regressziója. Így az imunterápiákat racionálisan kell alkalmazni ebben az indikációban, meghatározva a daganat molekuláris profilját. Esetleg az egyes onkológiai stratégiákat együttesen használva a kezelés során. Ezen betegcsoport kezelésére a klinikai vizsgálatok, amennyiben elérhetőek, mindenképpen javasoltak.
3.4. Külső sugárkezelés
Ajánlás53
A külső sugárkezelést megavoltos sugárforrással, CT, MRI vagy sz.e. 131/123I teljes test szcintigráfiával végzett teljestest felvételek mellett SPECT/CT vagy PET/CT (FGD, DOTATATE) alapú besugárzás-tervezéssel és IMRT, IGRT technikával célszerű végezni. A besugárzás céltérfogatát, dózisait és napi frakcionálásait a beavatkozás kuratív vagy palliatív célja, a metasztázisok száma és a beteg általános állapota figyelembevételével kell meghatározni. (B)
DTC-ben a külső sugárkezelés szerepe (RT: radioterápia) limitált. Prospektív vizsgálatok hiánya miatt számos esetben kérdéses a külső radioterápia szerepe a differenciát pajzsmirigydaganatok adjuváns kezelésében. Az izotóp kezelés és az RT sorrendjében nincs egyértelmű állásfoglalás. A külső RT indikációját és elvégzésének idejét, a sugárterápiás szakorvost is magában foglaló onkoteam határozza meg.
Azon betegek, akik radioablatiós terápiában és külső sugárkezelésben is részesülnek, ezen terápiák sorrendjét egyénre szabva kell meghatározni.
Obszervációs vizsgálatok alapján az RTjavíthatja a túlélést idős betegek nagy extrathyreoidealis terjedésű daganatának műtéte után, vagy olyan betegeknél, ahol nagy a residualis betegség kockázata és várhatóan nem reagál jól radiojód terápiára. Az újabb konformális besugárzási technikákkal (Intenzitás-modulált radioterápia [IMRT]) a sugárkezelés mellékhatásai jelentős mértékben csökkenthetőek, ezért ez a javasolt besugárzási mód, lehetőség szerint képvezérelt technika (IGRT: image guided radiotherapy) alkalmazásával.
Metasztatikus betegségben sugárterápia adása javasolt tüneteket okozó áttétek esetén vagy olyan tünetmentes esetekben, amikor például teherviselő csontban van áttét. Konformális vagy sztereotaxiás kezelés egyaránt szóba jön.
Az adjuváns sugárkezelés indikációi:
- Irrezekábilis, vagy műtét után visszamaradt terjedelmes daganat.
- R1, R2 rezekció esetén jódot nem halmozó daganatnál.
- pT4 esetben 60 év fölött, tokot áttörő nyirokcsomó áttéttel, még totális daganateltávolítást követően is. [87, 88]
Ajánlás54
Az alábbi, 12. táblázatban felsorolt mérlegelési szempontok alapján meghatározható 4 ponttól az irradiáció mérlegelhető, 6 ponttól már szükséges. (B) [89]
12. táblázat: Külső sugárkezelés indikálásának mérlegelési szempontjai.
| 0 pont | 1 pont | 2 pont | 4 pont | |
| Életkor | < 45 | 45-60 | > 60 | |
| Nem | nő | férfi | ||
| Rezekabilitás | rezekabilis | irrezekabilis | ||
| Extenzív extracapsularis terjedés | nincs | van | ||
| Extrathyroideális terjedés | T3 | T4 | ||
| R0-R1-R2 | R0 | R1 | R2 | |
| Hisztológiai variáns (tall-cell, Hürthlecell, columnar, diffuse sclerosing, solid variant) | nincs | van | ||
| Recidíva | nincs | van | ||
| Radiojód fölvétel | van | nincs |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Céltérfogat: A céltérfogatot és a dózisokat illetően kevés evidencia van az irodalomban.
A leggyakrabban alkalmazott céltérfogat és dózis előírások a következőek:
- A CTV (Clinical target volume) - a műtét után - a daganat ágy és mindkét oldali nyaki IB-VI. és a felső mediastinalis (VII.) nyirokrégiók területe.
- Inkomplett rezekciónál vagy irrezekábilis esetben a daganat és az érintett nyirokcsomók a GTV-t (Gross Tumor Volume) képezik, amelyből a CTV 0,5-1,5 cm-es kiterjesztéssel adódik.
- A PTV (Planning Target Volume) 3-5 mm-es kiterjesztése a CTV-nek.
(CTV mediastinum: ha a paratrachealis limfoglandula pozitív, a felső mediastinumot az aortaívig kell bevenni; ha a mediastinum pozitív akkor a carina alatti terület a határ).
Sugárkezelés technikája
- Megavoltos sugárforrás.
- CT vagy MR (szükség esetén teljes test jód scan/SPECT, vagy FGD, illetve DOTATATE-PET/) alapú besugárzástervezés.
- IMRT, IGRT.
Dózisok
- Adjuváns RT R1 reszekció (tumorágy vagy nyirokcsomó) esetén: 60-66 Gy/1,8-2 Gy/nap; elektív nyirokcsomók: 50-56 Gy/1,6-2 Gy/nap (Magasabb dózis - 66 Gy - extrathyroidealis terjedés, nyirokcsomó extracapsularis terjedésénél is).
- Salvage RT R2 vagy inoperabilis tumor esetén: 66-70 Gy/1,8-2 Gy/nap; elektív nyirokcsomók: 50-56 Gy/1,6-2 Gy/ nap.
A palliativ sugárkezelés indikációi és dózisai
- Oligometastasis és jó általános állapot esetén: 45-60 Gy/1,8-2 Gy/nap vagy SBRT (stereotactic body radiotherapy).
- Disszeminált áttétek és rossz általános állapot esetén: 1x8 Gy vagy 5x4 Gy vagy 10x3 Gy, napi frakcionálással.
- ≤ 4 darab központi idegrendszeri (agyi) áttét esetén: SRS (stereotactic radiosurgery) reszekciót követően vagy egyedüli terápiaként.
- Multiplex agyi áttétek esetén: WBRT (whole brain radiotherapy) 10x3 Gy dózisban. [76]
Mellékhatások:
korai: a bőr, a gége, a nyelő- és légcső gyulladása,
késői: myelopathia, fibrosis, második daganat kialakulása.
3.5. Pajzsmirigyhormon-kezelés
A DTC ellátásában a korábbi gyakorlat a TSH total strumectomia utáni tartós szuppressziója volt. Ennek elvi alapja az, hogy a differenciált daganatszövet számára aTSH növekedési faktorként szolgálhat. Az újabb vizsgálatok a kis és közepes kockázatú csoportokban megkérdőjelezték a TSH szuppresszió előnyét a betegség kimenetele szempontjából. Ezzel párhuzamosan egyre több adat támasztja alá a szubklinikus vagy mérsékelt manifeszt hyperthyreosis súlyos hosszú távú következményeit, alacsony TSH mellett mind a kardiovaszkuláris, mind az összmortalitás jelentősen fokozódik. A TSH céltartományt a korai prognosztikai besorolás mellett a terápia sikeressége is alapvetően meghatározza. A TSH céltartományt a kiújulás rizikója és a terápiás válasz függvényében a 13. táblázat foglalja össze.
13. táblázat. TSH célértékek (mU/L) a terápiás válasz és a rizikóbesorolás függvényében.
| alacsony | közepes | magas rizikó | |
| Kezdeti | 0,5-2 | 0,1-0,5 | < 0,1 |
| Kiváló válasz | 0,5-2 | 0,5-2 | 0,1-0,5 (5 év) |
| Bizonytalan | 0,1-0,5 | 0,1-0,5 | < 0,1 |
| Biokémiailag inkomplett | 0,1-0,5 | 0,1-0,5 | < 0,1 |
| Struktúrálisaninkomplett | < 0,1 | < 0,1 | < 0,1 |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
Ajánlás55
A nagykockázatú/perzisztáló betegséggel élő betegek esetében egyelőre célszerű a TSH-t a 0,01-0,1 mU/L tartományban tartani határozatlan ideig. Törekedjünk arra, hogy a pajzsmirigy hormonok a normál tartományban legyenek. A közepes kockázatú betegek esetében kezdetben a TSH legyen a 0,1-0,5 mU/L tartományban, kiváló terápiás válasz esetén a szuppressziót felengedhetjük a 0,5-2,0 mU/L tartományba. A kiskockázatú csoport betegei esetében a TSH optimálisan a 0,5-2,0 mU/L sávban legyen. (B)
Ajánlás56
Amennyiben a tumormarkerek és/vagy képalkotó vizsgálatok bizonytalan terápiás választ vagy a betegség kiújulását jelzik, a TSH céltartomány ennek megfelelően módosítandó. (B)
4. REHABILITÁCIÓ
4.1. A beteg aktuális fizikai és lelki állapotának figyelembevétele
Ajánlás57
A pajzsmirigyrák komplex és komprehenzív ellátása során az onkopszichológiai gondozás szempontjait a beteg aktuális fizikai és lelki állapotát figyelembe véve minden esetben ajánlott érvényesíteni és az alábbiak szerint alkalmazni. (B) [90, 91, 92, 93, 94, 95, 96, 97, 98].
A pajzsmirigyrák az egyik legjellemzőbb endokrin daganat, mely többnyire jó prognózissal rendelkezik az 5 éves túlélési ráta szempontjából [90, 91]. Azonban javasolt a hosszú távú utánkövetés a 15-35%-os loko-regionális kiújulás, valamit a távoli metasztázisok kialakulása okán [91]. Hasonlóan az egyéb daganatos megbetegedésekhez, az elváltozás klinikai viselkedése, malignitásának mértéke, valamint a betegség várható kimenetele (prognózis) határozza meg a választandó kezelési módot [92]. A kezelések komplex volta következtében a gyógyulás, illetve a betegség kontroll alatt tartása aktív együttműködést igényel a páciens részéről. A megfelelő mértékű és színvonalú adherencia fontos a hosszú távú túlélés szempontjából.
A standard kezelés jellemzően a pajzsmirigy-eltávolítás, amely következtében a páciens élethosszig tartó pajzsmirigyhormon kiegészítést/pótlást igényel [93]. Emellett szükség esetén radiojód terápia is indikált lehet. A pajzsmirigy működésének zavarai gyakran negatívan befolyásolják a beteg mindennapi életét, és fizikai panaszokat (mint fáradtság, alvászavar, száraz bőr, hidegérzékenység, súlygyarapodás és székrekedés), valamint neuropszichológiai és pszichiátriai zavarokat okozhatnak (mint pszichomotoros lassulás, depresszió vagy szorongás). Ezen tünetek megnehezíthetik a megfelelő együttműködés színvonalának kialakítását és fenntartását, ezáltal csökkentve a túlélés esélyét.
A prognosztikus mutatók kapcsán könnyen nevezhető úgynevezett "jó ráknak" [94] a malignus pajzsmirigy-daganat, ugyanakkor a betegség prognózisának bagatellizálónak imponáló eredendően biztató szándékot kifejező közlési attitűdje könnyen akadályát jelenti a pszichés megküzdésnek, és a megfelelő pszichés támogatás nyújtásának is [95]. A megélt distresszt 2 összehasonlítva más, "rosszabb rákokkal" - nem tudják megfelelően értékelni a páciensek: a szenvedésük a szégyennel társulva nem teszi lehetővé, hogy adekvátan jelezzék azt.
A páciensek várható élettartamának meghosszabbítása mellett nem elhanyagolható szempont annak minőségi aspektusa sem: a betegség lefolyása, a kezelések fizikális és pszichés terhe jelentős életminőségbeli romlást hozhat a beteg életébe, illetve kapcsolatrendszerébe. A túlélők leggyakoribb félelme a betegség kiújulása (Damoklész kardja-effektus), a további kezelések szükségességétől való szorongás, valamint az elszigetelődéstől való félelem [98]. A pajzsmirigydaganat túlélőinek egyik leggyakoribb és legfontosabb igényei közé tartozik a részletes felvilágosítás, mely felöleli az orvosi, fizikai és gyakorlati kérdéseket, valamint lélektani nehézségeik támogatását, illetve a pszichoedukációt is.
A betegség korai tüneteivel összefüggésben kialakuló lélektani reakciók a diagnózis közlését megelőzően megjelenhetnek, így az onkopszichológiai kivizsgálásra és gondozásra már egészen a kivizsgálás szakaszától, prevenciós szempontokat is szem előtt tartva, érdemes figyelmet fordítani. A különféle pszichológiai jelenségek, illetve tünetek minden esetben egyedileg, személyes élettörténetbe ágyazottan értelmezendők, azok a kontextusukból nem kiemelhetők.
4.2. Onkopszychológiai intervenciók
Ajánlás58
A pajzsmirigyrák komplex és komprehenzív ellátása során az onkopszichológiai gondozást a beteg fizikai és lelki állapotához illesztett módon, illetve az orvosi onkológiai kezelés adott szakaszához kapcsoltan, az alábbi szempontok (az ellátási időszakra jellemző leggyakoribb pszichoszociális problémákhoz ajánlott pszichológiai intervenciók) mentén szükséges végezni. (B) [98, 99, 100, 101, 102, 103]
Jelen egészségügyi szakmai irányelv célja, hogy átfogó áttekintést adjon a pajzsmirigyrák lefolyásának jellegzetesen egy-egy szakasza mentén előforduló lelki jelenségek és az azokhoz kapcsolódóan ajánlott onkopszichológiai intervenciók kapcsán.
Az alábbi specializált onkopszichológiai megfontolások, az adott terület onkodiagnosztikai és onkoterápiás irányelveihez illeszkedve kerültek kialakításra. [98] Az irányelvek vonatkoznak minden olyan pszichológusra, (klinikai) szakpszichológusra, pszichoterapeutára, aki aktív orvosi kezelést nyújtó onkológiai osztályon/ambulancián tevékenykedik, illetőleg más területen a fent leírt onkológiai betegséggel küzdő beteg számára nyújt komplex pszichoszociális ellátást.
14. táblázat: Pajzsmirigyrákos megbetegedésében előforduló gyakori pszichoszociális problémák, tünetek, és javasolt kezelési irányelvek A felsorolt pszichológiai tünetek az adott szakaszban a legjellemzőbbek, de más stádiumban is előfordulhatnak.
| A betegség lefolyásának szakaszai | Leggyakoribb pszichés tünetek | Onkopszichológiai intervenciók |
| Szűrővizsgálat, onkológiai tünetek/ betegségjelzők megjelenése, kivizsgálás | Önerőből leküzdhetetlennek érzett distressz növekedése (egyéni/családi), - szorongás a bizonytalanságtól, a kivizsgálás eredményétől - depresszív tünetek, - tagadás, - kognitív torzítások, - A betegség belátásának hiánya (különösen ha komorbid pszichiátriai zavar áll fenn) a további segítség/vizsgálat elutasításával is járhat. | Barátságos légkör, és bizalomteljes kommunikáció megteremtése a vizsgálatok körül. Pszichológiai szűrés és krízisintervenció a korai szakaszban is: A pszichológus legyen elérhető már ebben a fázisban, a vizsgálatot végző szakemberek kapjanak segítséget az esetleges szélsőséges reakciók körültekintő és tapintatos kezeléséhez, a pszichiátriai zavarok meglétének felismeréséhez. Amennyiben szükséges, hozzátartozók segítése. |
| Szövettani vizsgálat /biopsia/ | - Distressz erősödése, - szorongás a testi integritás "áttörésétől", - félelem a fájdalomtól | Szupportáció, kommunikációs problémák segítése, kríziskezelés, relaxációs technikák alkalmazása. |
| Diagnózisközlés, informatív, mindenre kiterjedő kezelés- megbeszélés | - fokozott szorongás, - depresszív tünetek, - halálfélelem, - érzelmi hullámzás, - felfokozott érzelmi reakciók a maradandó testi elváltozások lehetőségére. - szenzitivitás fokozódása, - tagadás, - lelki disszociáció, - beszűkült tudati állapot, - impulzivitás, szuggesztibilitás, - döntésképtelenség, - kognitív és kommunikációs zavarok, - poszttraumás stresszbetegség (PTSD), - megváltozott viselkedés, - pszichofiziológiai tünetek, - kapcsolati problémák. - Az esetleges pszichiátriai komorbiditás további komplikációkat generálhat. (Az énkép és a jövőkép összeomlása, a kapcsolatokba vetett bizalom elvesztése, reménytelenség érzése, melyek együttes és tartós fennállása suicidumhoz vezethet.) | Akut stressz kezelése, onkopszichológus elérhetőségének biztosítása mind a beteg, mind hozzátartozói számára. Önkéntes, komplex pszichoszociális szűrővizsgálat elvégzése (szociodemográfiai adatok, esetleges pszichológiai/pszichiátriai kísérőbetegségek adatai, depresszió, szorongás és társas támogatottság mértékének felmérése pl. BDI, STAI kérdőívek használatával.) A vizsgálat alapján a megfelelő onkopszichológiai intervenciók egyénre szabása. |
| Onkoterápia - Műtét (lobectomia, thyreoidectomia) | A beteg szövetek műtéti úton való részleges vagy teljes elvesztése fizikai és lélektani traumával jár. A nehezen eltakarható torzulás, illetve funkcionális károsodás (nyelési nehézség, fájdalom) a beteg önképét és társadalmi beilleszkedési lehetőségét mélyebben érintheti | A megváltozott testkép megfelelő kezelése az intervenciók fókuszában (pszichoedukáció, szupportív terápia). A család együttműködése nagymértékben könnyíti a beteg alkalmazkodását az új helyzethez. (családterápia, rendszer szemléletű egyéni tanácsadás). |
| Onkoterápia - Radiojód ablációs kezelés | - Sugárkezelés megkezdése előtte normatív jelenség a szorongás fokozódása, mely irányulhat magára a kezelésre (izoláció, mellékhatások, "sugárfertőzéssel" kapcsolatos félelmek), valamint a kezelést követő otthoni izolációs időszakra (fantáziált és valós veszély elkülönítésének nehézsége a közvetlen környezettel kapcsolatban pl. házastárs, gyermekek sugárterhelése, ha megöleli) - A kezelés okán bevezetett dietetikai változtatások a veszteség élményt egy megfoghatóbb, praktikus szintre emelik, így a kapcsolódó érzelmek felszínközelebbivé válhatnak - Palliatív besugárzás esetén csalódás és kudarcélmény, amennyiben az elvárt fájdalomcsillapító hatás elmarad | Pszichoedukációscsoportfoglalkozás/ felkészítés a várható kezelés menetéről, a mellékhatásokról, azok menedzseléséről (átkeretezés, figyelemelterelési technikák elsajátítása), illetve az otthoni (rehabilitációs) időszakkal kapcsolatos félelmek, túlzó fantáziák racionalitással való egyeztetése. Személyre szabott relaxációs technikák elsajátítása |
| Onkoterápia - Hormonterápia | - érzelmi instabilit-s, - súlygyarapodás, 'fatigve'-kuánikvs f-uedts-a - átmeneti affektív zavar (mélyülő hangulat, szouong-s, depresszív tünetek) - döntési nehézségek, fokozádá szouong-s - kognitív zavarok | Pszichoedukatív csoportfoglalkozások tartása, egyéni konzultáció keretében pszichoedukációbiztosítása a fizikális mellékhatások menedzselésének megkönnyítésére Kognitív teljesítményromlás esetén az önmegfigyelés vagy a hozzátartozó jelzése esetén neuropszichológiai kivizsgálás javasolt |
| Onkoterápia - kemoterápia | Kemoterápia, gyógyszeres terápiák mellékhatásai - ismert daganatellenes gyógyszermellékhatások - idegrendszeri és mozgásszervi tünetek: - fáradékonyság tünetegyüttes, posztkemoterápiás tünetegyüttes, fájdalom szindróma - alv-szavauok, pszichi-tuiai zavarok (pl. depresszió) - általános lehangoltság, jövőkép elvesztése, mag-ra maradotts-g érzés - önértékelési zavarok - PTSD | Aktív kemoterápia alatt szupportív követés javasolt. Ha a beteg fizikai állapota lehetővé teszi, akkor nagyon hatékony és ajánlott stresszcsökkentési mód az éber figyelmen alapuló Mindfulness based technikák megtanítása (csoportos illetve egyéni formában). |
| Tartós tünetmentesség | - alkalmazkodási nehézségek, - kondicionálódott pszichogén mellékhatások fennmaradása, - krónikus fáradtság, - Damoklész kardja szindróma, - PTSD, - szenvedélybetegség kialakulása/ felerősödése, - pszichofiziológiai tünetek jelentkezése, fennmaradása - hipochondria | Ambuláns pszichoterápiás gondozás javasolt a betegség feldolgozására, a megküzdési stratégiák tudatos alkalmazásának megerősítéséhez, önismereti munkához. Egyéni, csoportos, család és párterápiák. Relaxációs technikák, edukáció a mellékhatások menedzselése kapcsán Mindfulness based módszerek alkalmazása, amely lehetővé teszi egy új életmód kialakítását és begyakorlását. |
| Visszaesés | - érzelmi krízis, - düh, - szorongás, depresszió, - halálfélelem, - alkalmazkodási/megküzdési nehézségek | Stresszcsökkentés, szupportáció, életminőség javítását célzó intervenciók, krízisintervenció |
| Palliatív terápia | - érzelmi krízis, - düh, - szorongás, depresszió, - halálfélelem, - alkalmazkodási/megküzdési nehézségek | Stresszcsökkentés, szupportáció, életminőség javítását célzó intervenciók, pasztorálterápia, spirituális kísérés, telefon/skype útján történő speciális segítségnyújtás. |
| Terminális állapot | Bio-pszicho-szocio-spirituális válság szakaszai: - elutasítás, - alkudozás, - szorongás, - depresszió, - halálfélelem, - megbékélés. | Stresszcsökkentés, szupportáció a családtagok számára is, életminőség javítását célzó intervenciók, spirituális kísérés. |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
4.3. A team munka jelentősége
Ajánlás59
Az onkopszichológiai ellátást szükséges a beteg/páciens/kliens onkológiai kezelésében érintett szakszemélyzettel, illetve az egészségügyi ellátónál elérhető pszichológus kollégákkal is szorosan együttműködve, közös teamet/teameket alkotva végezni. (B) [104]
A Magyar Nemzeti Rákkontroll Program (1994, 2006) ajánlása alapján az onkológiai betegellátás minden területén és a betegség lefolyásának minden stádiumában szükség van az orvosi ellátás mellett klinikai és alkalmazott egészségpszichológiai szakpszichológusok, pszichológusok, pszichiáterek, gyógytornászok, szociális munkások együttműködésére, akik leghatékonyabban az onkológiai munkacsoport aktív és teljesértékű tagjaiként tevékenykedhetnek.
A daganatos betegekkel foglalkozó pszichológusok, pszichiáterek a szükséges onkológiai ismereteket elsősorban az onkológiai szakemberekkel való együttműködés révén szerezhetik meg, illetve speciális posztgraduális képzés során sajátíthatják el. Ezzel egy időben szükséges az onkológiai munkacsoport érdeklődő (vagy azzá váló) tagjait felvilágosítani, és folyamatosan tájékoztatni az onkopszichológusok és a velük együtt dolgozó más szakemberek által végzett munkáról, annak elméleti alapjairól. Kedvező esetben tehát a multidiszciplináris munkacsoport tagjai állandó konzultációban állnak egymással, ennek következtében munkájukban, a betegellátás holisztikus szemléletű végzése mellett, egymás számára is szükségessé válnak. Így valósítható meg a sokrétű onkopszichológiai ellátás integrálása a daganatos betegek komplex terápiájába és a korszerű szemléletbővítés az onkológiai munkacsoportban, majd az onkológiai ellátás teljes területén. A kezelő team részeként dolgozó onkopszichológus az egyéni munkája során használt integratív és reflektív funkciók beemelésével a betegekről történő közös gondolkodása segíthet a burnout jelenségének megelőzésében.
5. GONDOZÁS
Ajánlás60
A pajzsmirigyrák eradikációjával járó hormonális státuszváltozás és a betegség késői recidívájának lehetősége miatt a betegek élethosszig tartó rehabilitációja és gondozásos követése ajánlott. (B)
5.1. Képalkotók szerepe a DTC-terápia utáni ellátásában és követésében
Ajánlás61
Thyreoidectomia után a pajzsmirigyrák kiújulása, a residualis tumorszövet előfordulása 15-30% esetén e betegcsoport gondos követése erősen ajánlott, mert ha a recidív tumorszövet a pajzsmirigyágyban jelenik meg, a mortalitás kockázata ötször nagyobb, mint nyirokcsomóáttét esetén. (B) [105, 106] A recidíva általában a műtét utáni első 10 évben fordult elő, leggyakrabban a nyaki és a mediastinalis nyirokcsomókban (74%), pajzsmirigyágyban (20%), ritkábban a tracheában vagy a környező izmokban (6%). [18, 107]
Ajánlás62
Pajzsmirigyrákműtét után a tumorágyban megjelenő térfoglaló elváltozás kimutatásában az UH-vizsgálat az első és alapvető képalkotó eljárás, 6-12 hónappal a primer ellátást követően. [108] A recidívák és a tumort utánzó képletek végleges diagnosztikájában az UH-vezérelt FNAC megbízható módszer, kiegészítésként mindig elvégzendő. (B)
Thyreoidectomia után aspirációs citológia vagy hisztológiai mintavétel alkalmazásával a lokoregionális status megítélésében a nyaki UH szenzitivitását 94-96% között adják meg. [109, 99]
A lokális recidívák szerkezete többségükben echoszegény, szabálytalan szélűek, fokozott vascularisatiot mutatnak, a longitudinális síkban ovális, de a transversalis síkban vizsgálva "taller than wide" alak a jellemző. [110] A microcalcificatiok, cystosus területek leginkább a papillaris pajzsmirigy carcinoma lokális recidíváira jellemzők. Ritkábban, a fokozott thyreoglobulin depositio következményeként a recidív tumor echodús is lehet. Fontos, hogy az ellenőrző nyaki UH-vizsgálat során a ductus thyreoglossus régióját is vizsgáljuk, mert a pajzsmirigyrák cranialisabb lokalizációban, a ductus mentén is recidíválhat.
A pajzsmirigyágyban talált benignus eltérések, postoperatív következmények UH-morphológiája legtöbbször jellegzetes [111, 112], ez is alátámasztja, hogy a műtét utáni lokoregionális status megítélésében a nyaki UH-vizsgálat az arany standard képalkotó eljárás. Benignus elváltozásra típusos esetekben elegendő az időszakos UH kontroll, a mintavételtől eltekinthetünk. A fonalgranuloma, fibrosis, seroma és residualis pajzsmirigyszövet általában már az UH-morphológia alapján diagnosztizálható.
A pajzsmirigyágyban talált UH-eltéréseket minden esetben nagy tapasztalattal rendelkező radiológus szakorvosnak kell értékelni. Az értékelés kritériumai (megegyeznek a primér diagnosztika feltételeivel): méret, alak, kontúr, echogenitas, makro-, microcalcificatiok jelenléte vagy hiánya, szöveti elaszticitás, vascularisatio jellege. [18]
A nyaki nyirokrégiókban általánosságban a 10 mm-nél nagyobb haránt átmérőt mutató nyirokcsomókat tekintjük kóros méretűnek, de metasztázis kisebb nyirokcsomóban is előfordul. DTC szempontjából egy nyirokcsomó akkor tartható áttétre gyanúsnak, ha cisztózus komponenst vagy mikromeszeket tartalmaz, ha perifériásan erezett. Amennyiben ezek valamelyike észlelhető, a mérettől függetlenül felvethető az áttétes nyirokcsomó gyanúja és FNAB-t javasolt végezni, UH vezérelve. [113] A patológiásnak ítélt nyirokcsomóból - különösen, ha emelkedő Tg szint is társul hozzá - minden esetben mintát kell venni. Számos esetben akár 4-5 mm-es nyirokcsomókból is lehet diagnosztikus értékű aspirátumot nyerni.
Metasztázisra alacsony kockázatú betegeknél - amennyiben a Tg sem utal recidívára - az időszakos klinikai kontrollokat - az ATA ajánlás szerint - nem szükséges mindig UH-val kiegészíteni. Kontrasztanyagos nyaki CT-vizsgálat helye a követésben:
- ha a daganat olyan nagy méretű, hogy nem sikerül UH-val pontosan feltérképezni,
- ha infiltrálja a légcsövet vagy a trachea infiltrációját kell megítélni,
- ha a tumoros folyamat a mélybe terjed.
Ajánlás63
Emelkedő Tg, de negatív nyaki UH esetén, az esetleges tüdőáttétek, mediastinális nyirokcsomó érintettség kimutatására mellkasi és/vagy nyaki CT (natív vagy kontrasztanyagos) szükséges. (B)
Megjegyzés: A jódos kontrasztanyaggal végeztt CT-vizsgálat az egésztest jód vizsgálat eredményességét, valamint a radiojód kezelés alkalmazását legalább fél évre gátolja.
Ajánlás64
Emelkedő tumormarkerek mellett, nyaki UH negativitása esetén a nyaki és a felső mediastinális nyirokcsomók vizsgálatára és a nyaki nagyerekhez való viszony megítélése, valamint klinikai gyanú esetén a koponya, gerinc, hasi manifesztáció kimutatásában MR-vizsgálat mérlegelendő. (B):
Megjegyzés:
- cystosus áttét esetében az MR kifejezetten hasznos lehet, lévén az ilyen típusú nyirokcsomók - főként a zsírelnyomásos szekvenciákon - kis méretben is jól detektálhatóak,
- a nyaki nagyerekhez való viszony megítélése a legtöbb esetben egy célzottan erre a kérdésre választ kereső UH-nál többet ritkán tud adni az MRI,
- emelkedő Tg, negatív nyaki UH és az azt követő CT sikertelensége esetén MRI-t javasol. [31]
Képalkotás által vezérelt terápiás intervenciót illetően utalunk a 2. DIAGNOSZTIKA / Képalkotó vizsgálatoknál leírtakra.
A képalkotók által vezérelt PEI és az RFA jó lehetőségek a biopsziával igazolt nyaki nyirokcsomó áttétek vagy lokális recidívák kezelésére, műtétek és radio-jód terápia után, ha a betegnek nincsenek távoli áttétei. A legtöbb esetben a nyirokcsomók méretbeli csökkenésén túl a Tg- és/vagy a TgAb-szintje is redukálódott. Főként a többször operált, magas sebészeti kockázattal rendelkező, vagy a műtétet visszautasító betegeknél, citológiával igazolt esetekben
- onkoteam döntés után megkísérelhető valamelyik tumorablációs módszer elvégzése. A palliatív PEI/RFA kezelés számos alkalommal ismételhető.
5.2. Az izotóp diagnosztika szerepe a betegek követésében
Lásd 3.2 pontnál.
5.3. A DTC kezelésének és gondozásának laboratóriumi vonatkozásai
A gondozás során elérendő TSH célértékeket a 3.5. pontnál ismertettük.
A pajzsmirigy hormonpótlás megítélésére a TSH-meghatározás szolgál. A legtöbb laboratórium alacsony TSH esetén automatikusan megméri az fT4 értéket is. Ahol ez nem történik meg, a terápia monitorozása során kérni kell az fT4 meghatározást. Az emelkedett fT4 értéket azoknál a betegeknél is el kell kerülni, akiknél TSH szuppresszió kívánatos. Ellenkező esetben a tartósan fennálló hyperthyreosis önmagában is mortalitást fokozó tényezővé válik. Az fT4 érték objektív értékeléséhez lényeges, hogy a beteg a vizsgálat napján csak a vérvétel után vegye be az L-thyroxin tablettát. A thyreoglobulin intakt pajzsmirigy esetén nem használható a DTC tumormarkereként, ezért műtét előtt a Tg- és TgAb-meghatározás nem javasolt.
A Tg biológiai féléletideje 65 óra, totál thyreoidectomia után 3-4 hét múlva mérhető a minimum. A Tg-szintet a TSH is jelentősen befolyásolja. A radiojód abláció előtt, magas TSH mellett mért stimulált Tg korlátozottan alkalmazható ugyan a maradék pajzsmirigy és az esetleges maradék tumorszövet becslésére, de nem alkalmas annak eldöntésére, hogy kinél szükséges radiojód kezelés.
A Tg-mérés megbízhatóságát több technikai tényező korlátozhatja:
- a módszerek közötti eltérések,
- a nem megfelelő funkcionális szenzitivitás,
- high dose hook effektus,
- interferenciák endogén Tg-autoantitestekkel és heterophil antitesttel.
A felsoroltak közül az endogén TgAb jelenléte okozza a legtöbb gondot a gyakorlatban. Ez a DTC-ben szenvedő betegek plazmájában 15-30%-os gyakorisággal jelen van, ezért a TgAb-szint meghatározását kötelező a Tg-szintméréssel párhuzamosan, ugyanabból a mintából elvégezni. A TgAb már jóval alacsonyabb titerben zavarja a Tg-meghatározást, mint az autoimmun thyreoiditis diagnózisára megadott cut-off érték. Tekintettel a Tg-érték TSH-függőségére, a beteg követése során a Tg mellett a TSH-meghatározás is elengedhetetlen.
Azoknál a betegeknél, akiknél csak lobectomia történt és radiojód kezelésre nem került sor, a tumormarkerek szerepe korlátozott, a műtét után 4-6 héttel on-thyroxin mért Tg vagy TgAb lehet a kiindulási érték.
A magas szenzitivitású Tg-módszerek megjelenése szemléletváltozást hozott a betegek gondozásában [114]. Ezekkel a módszerekkel a Tg-szint alsó kimutathatósági határa 0,1 ng/ml, míg a korábbi módszerekkel 1 ng/ml volt ez az érték. Az új, érzékeny Tg-módszerrel a betegek on-thyroxin Tg-meghatározással is követhetőek, a TSH stimulációs teszt elvégzését (thyroxin kihagyással vagy rhTSH-val) csak a magas rizikójú betegek esetében javasolják a műtét utáni 6-12. hónapban. A TgAb pozitív betegek az antitest titer változásával követhetőek, náluk TSH-stimulációnak nincs értelme.
Tg-meghatározás végezhető a nyirokcsomó aspirátum mosófolyadékából is. Irodalmi adatok szerint ez hasznos lehet a nyirokcsomó metastasis korai diagnosztikájában, de kevés még a tapasztalat, a módszer nem standardizált, így analitikai okok miatt megbízhatósága kérdéses.
5.4. A terápiás válasz értékelése
A terápiás válasz értékelésére a 2015-ös amerikai irányelv négy kategóriát fogalmazott meg [70]:
- Kiváló terápiás válasz:
- negatív képalkotó vizsgálatok,
- on-thyroxin Tg < 0,2 ng/ml,
- stimulált Tg < 1 ng/ml,
- TgAb negatív.
- Bizonytalan terápiás válasz:
- negatív képalkotó vizsgálatok,
- on-thyroxin Tg 0,2-1 ng/ml,
- stimulált Tg 1-10 ng/ml,
- TgAb nem változik vagy csökken.
- Inkomplett biokémiai választ:
- negatív képalkotó vizsgálatok,
- on-thyroxin Tg > 1 ng/ml,
- stimulált Tg > 10 ng/ml,
- TgAb emelkedik.
- Strukturális betegség:
- képalkotó vizsgálatokkal és/vagy citológiával/szövettannal kimutatott tumor,
- on-thyroxin Tg többnyire emelkedett,
- stimulált Tg többnyire emelkedett,
- TgAb emelkedik.
A kontroll vizsgálatok gyakoriságát az első éven túl alapvetően meghatározza a terápiás válasz jellege. Kiváló terápiás válasz esetén a betegeket elegendő évente ellenőrizni. Igazolt strukturális betegség, aktív onkológiai kezelés esetén gyakoribb kontroll vizsgálatokra van szükség, az adott kezelés jellegétől függően.
A műtét után hypoparathyreosisban szenvedő betegeknél a kalcium anyagcsere is rendszeres ellenőrzést igényel. Szuppresszív dózisú pajzsmirigy hormon kezelésben részesülő betegeknél külön figyelmet kell fordítani az osteoporosis diagnosztikájára/kezelésére.
VII. JAVASLATOK AZ AJÁNLÁSOK ALKALMAZÁSÁHOZ
1. Az alkalmazás feltételei a hazai gyakorlatban
1.1. Ellátók kompetenciája (pl. licence, akkreditáció stb.), kapacitása
A komprehenzív onkológiai ellátást szolgáló egészségügyi szakmai irányelv bevezetésének feltétele a címben szereplő daganatok ellátásában résztvevő orvosi szakterületek (diagnosztikai és terápiás) képviselőiből álló csoport munkájának összehangolása. Ezt a feladatot, a legösszehangoltabban a diagnózis pontosítása alapján az adott beteg "terápiás tervét" elkészítő és ezt a betegről szóló orvosi dokumentációban rögzítő - multidiszciplináris onkológiai team tudja elvégezni.
1.2. Speciális tárgyi feltételek, szervezési kérdések (gátló és elősegítő tényezők, és azok megoldása)
Nem kerültek meghatározásra.
1.3. Az ellátottak egészségügyi tájékozottsága, szociális és kulturális körülményei, egyéni elvárásai
A pajzsmirigyrák felfedezése után a terápia eredményességében különösen fontos a beteg együttműködése, öngondoskodása az aktiv gyógykezelés alatt, és a követéses gondozás idején, amelynek szintje a betegségről, az ellátásáról, és legfőképp a saját felelősségéről a kezelőorvosa által nyújtandó ismeretekkel emelhető, az egészségi állapotának javulása érdekében.
1.4. Egyéb feltételek
Az egészségügyi szakmai irányelv alkalmazásának feltétele a benne foglalt gyógyászati eszközök, gyógyszerek, diagnosztikai és terápiás modalitások, valamint a hozzátett szellemi érték méltányos és a sokszakmás tevékenység részeire nézve is arányos finanszírozása.
2. Alkalmazást segítő dokumentumok listája
2.1. Betegtájékoztató, oktatási anyagok
Nem készült.
2.2. Tevékenységsorozat elvégzésekor használt ellenőrző kérdőívek, adatlapok
1. sz. melléklet Elvárások a prognosztikai patológiai lelettel szemben
2.3. Táblázatok
1. táblázat: Follicularis hám eredetű pajzsmirigytumorok 2017-es WHO szerinti klasszifikációja.
2. táblázat: Egyszerűsített diagnosztikus algoritmus tisztán follicularis mintázatú daganatok diagnosztizálására.
3. táblázat: A pajzsmirigy follicularis hám eredetű tumorokra jellemző leggyakoribb genetikai eltérések.
4. táblázat: A daganatspecifikus túlélés prognosztikai faktorai differenciált pajzsmirigyrákokban.
5. táblázat: ETA és ATA rizikóklasszifikáció a DTC prognózisának megítélésére.
6. táblázat: Prognosztikai tényezők a korábbi és jelenleg használt rizikó besorolási rendszerekben.
7. táblázat: A perzisztáló/kiújuló betegség és a betegség-specifikus halálozás rizikója a tumor stádium és a szövettan függvényében.
8. táblázat: A műtét utáni első radiojód kezelés típusai és céljai.
9. táblázat: A betegség-specifikus halálozás rizikója a posztterápiás egésztest szcintigráfia és SPECT/CT függvényében.
10. táblázat: A pajzsmirigyrákok célzot kezelése szempontjából vizsgálandó génmutációk.
11. táblázat: A multikináz inhibítor (MKI) kezelés mellett követendő paraméterek.
12. táblázat: Külső sugárkezelés indikálásának mérlegelési szempontjai.
13. táblázat: TSH célértékek (mU/L) a terápiás válasz és a rizikóbesorolás függvényében.
14. táblázat: Pajzsmirigyrákos megbetegedésében előforduló gyakori pszichoszociális problémák, tünetek, és javasolt kezelési irányelvek A felsorolt pszichológiai tünetek az adott szakaszban a legjellemzőbbek, de más stádiumban is előfordulhatnak.
2.4. Algoritmusok
1. ábra: A DTC terápiamonitorozását szolgáló laboratóriumi vizsgálatok folyamata.
2.5. Egyéb dokumentumok
2. ábra: A nyaki régiók bemutatása: Level I-VI.
3. A gyakorlati alkalmazás mutatói, audit kritériumok
A komprehenzív onkológiai ellátás speciális kritériumainak - mint a rákprobléma globális szemlélete, a multidiszciplináris diagnosztika, megelőzés, kezelés és követéses gondozás - lehetséges indikátorai közül az alábbiak országos és helyi használata szükséges, a daganatok összessége és lokalizációs megoszlásai tekintetében:
- A primer megelőzés céljából orvosi tanácsadásban részesült személyek lakossági aránya.
- Az adott évben felfedezett (regisztrált) új betegek (incidencia) és a multidiszciplináris onkológiai team döntése alapján ellátottak aránya.
- A műtéttel, kemoterápiával, sugárterápiával, biológiai válaszmódosító terápiával gyógykezelt betegek számának modalitások szerinti aránya.
- A terápiás modalitások komplex alkalmazásával kezelt betegek számának aránya.
- A hospice ellátásban részesült betegek számának aránya.
- Az adott év daganatos mortalitásának és morbiditásának (incidencia, prevalencia) aránya.
- Az adott évben elhalálozott daganatos betegek átlagos túlélési ideje a diagnózis felállítása és a halál bekövetkezése között.
VIII. IRÁNYELV FELÜLVIZSGÁLATÁNAK TERVE
A fejlesztés során felhasznált egészségügyi szakmai irányelvek aktuális megújításait nyomon követve, és az ajánlások módosításainak függvényében kell a jelen egészségügyi szakmai irányelv felülvizsgálatát elvégezni. Az egészségügyi szakmai irányelv felülvizsgálatának kezdeményezője és felelőse az Egészségügyi Szakmai Kollégium Onkológia és Sugárterápia Tagozata, valamint az egészségügyi szakmai irányelv fejlesztésében résztvevő Társszerző Tagozatok. A Fejlesztő munkacsoport feladata: az egészségügyi szakmai irányelvek megújításainak nyomonkövetése, szakirodalom kutatása, nyomonkövetése, megbeszélés, konszenzus, felülvizsgálat kezdeményezése. A felülvizsgálat megkezdésének ideje: legkésőbb az érvényesség lejárta előtt félévvel, de a változtatások szükségességének függvényében hamarabb.
IX. IRODALOM
[1.] http://www.onkol.hu/hu/rakregiszter-statisztika
[2.] Pereira M, Williams VL, Hallanger Johnson J, et al. Thyroid Cancer Incidence Trends in the United States: Association with Changes in Professional Guideline Recommendations. Thyroid. 2020 Aug;30(8):1132-1140.
[3.] https://seer.cancer.gov/statfacts/html/th
[4.] DeLellis RA, Lloyd RV, Osamura RY, et al. Pathology and Genetics of Tumours of the Endocrine Organs. Lyons: IARC PRess; 2017. 04. World Health Organization Classification of Tumours.
[5.] Protocol for the Examination of Specimens From Patients With Carcinomas of the Thyroid Gland Version: Thyroid 4.1.0.0 CAP Laboratory Accreditation Program Protocol
[6.] Rovira A, Nixon IJ, Simo R. Papillary microcarcinoma of the thyroid gland: current controversies and management. Otolaryngology 27:110-116, 2019
[7.] Zhu Y, Li Y, Jung CK, et al. Histopathologic Assessment of Capsular Invasion in Follicular Thyroid Neoplasms-an Observer Variation Study. Endocr Pathol. 2020 Jun;31(2):132-140.
[8.] Lin X, Zhu B, Liu Y, et al. Follicular thyroid carcinoma invades venous rather than lymphatic vessels. Diagn Pathol. 2010 Jan;5():8.
[9.] Ito Y, Hirokawa M, Masuoka H, et al. Prognostic factors of minimally invasive follicular thyroid carcinoma: extensive vascular invasion significantly affects patient prognosis. Endocr J. 2013 60(5):637-42.
[10.] Wong KS, Dong F, Telatar M, et al. Papillary Thyroid Carcinoma with High-Grade Features Versus Poorly Differentiated Thyroid Carcinoma: An Analysis of Clinicopathologic and Molecular Features and Outcome. Thyroid. 2021 Jan;():
[11.] Landa I, Ibrahimpasic T, Boucai L, et al. Genomic and transcriptomic hallmarks of poorly differentiated and anaplastic thyroid cancers. J Clin Invest. 2016 Mar;126(3):1052-66.
[12.] Macerola E , Proietti A , Basolo F. Noninvasive follicular neoplasm with papillary-like nuclear features (NIFTP): a new entity. Gland Surg 2020;9(Suppl 1):S47-S53
[13.] Cancer Genome Atlas Research Network. Integrated genomic characterization of papillary thyroid carcinoma. Cell. 2014 Oct;159(3):676-90.
[14.] Glikson E, Alon E, Bedrin L, Talmi YP. Prognostic Factors in Differentiated Thyroid Cancer Revisited. Israel Medical Association Journal. 2017;19(2):114-118.
[15.] Maggiore R, Perticone F, Mari G, et al. Impact of the 8th Edition of the AJCC-TNM Staging System on Estimated Cancer-Specific Survival in Patients Aged 45-54 Years at Diagnosis with Differentiated Thyroid Carcinoma: A Single Center Report International Journal of Endocrinology Volume 2021, https://doi. org/10.1155/2021/8820364
[16.] Cibas ES, Ali SZ. The 2017 Bethesda System for Reporting Thyroid Cytopathology. Thyroid. 2017 Nov;27(11):1341-1346.
[17.] Sanabria A, Zafereo M, Thompson LDR, et al. Frozen section in thyroid gland follicular neoplasms: It's high timet o abandon it! Surgical Oncology 2021 36:76-81.
[18.] Shin JH, Han BK, Ko EZ, et al. Sonographic findings in the surgical bed after thyroidectomy: comparison of recurrent tumors and nonrecurrent lesions. J Ultrasound Med. 2007; 26: 1359-1366.
[19.] Moifo B, Takoeta EO, Tamb e J, Blanc F, Fotsin JG. Reliability of Thyroid Imaging Reporting and Data System (TIRADS) Classification in Differentiating Benign from Malignant Thyroid Nodules. Open Journal of Radiology. 2013; 3, 103-107.
[20.] Horvath E, Majis Rossi R, Franco C, Niedmann JP, Castro A, Dominguez M. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J. Clin. Endocrinol. Metab. 2009;94 (5): 1748-1751
[21.] Cabelli C, Castellano M, Pirola I, Gandossi E, De Martino E, Cumetti D, Agosti B, Rosei EA, Clinical Study Thyroid nodule shape suggests malignancy, European Journal of Endocrinology. 2006; 155, 27-31
[22.] Kim KM, Park JB, Kang SJ and Bae KS. Ultrasonographic Guideline for Thyroid Nodules Cytology: Single Institute Experience. Journal of the Korean Surgical Society. 2013; 84 (2), 73-79.
[23.] Kwak JY, Han KH, Yoon JH, Moon HJ, Son EJ, Park SH, Jung HK, Choi JS, Kim BM, Kim EK. Thyroid imaging reporting and data system for US features of nodules: a step in establishing better stratification of cancer risk. Radiology. 2011; 260: 892-899
[24.] Park JY, Lee HJ, Jang HW, Kim HK, Yi JH, Lee W, Kism SH. A Proposal for a Thyroid Imaging Reporting and Data System for Ultrasound Features of Thyroid Carcinoma. Thyroid, 2009; 19 (11): 1257-1264
[25.] Russ G, Royer B, Bigorgne C, Rouxel A, Perrard BM, Leenhardt L. Clinical Study Prospective evaluation of thyroid imaging reporting and data system on 4550 nodules with and without elastography. European Journal of Endocrinology. 2013; 168, 649-655.
[26.] Sanchez JF. TIRADS, modified TIRADS-Classification or ultrasound based classification of thyroid lesions Ultraschall in Med 2013; 34. DOI: 10.1055/s-0033-1354868
[27.] Russ G, Bigorgne C, Royer B, Rouxel A, Bien- venu-Perrard M. The Thyroid Imaging Reporting and Data System (TIRADS) for Ultrasound of the Thyroid. Journal of Radiology. 2011; 92 (7-8), 701-713.
[28.] Manar M. Nasr. and Amal A. Sakrana, Modified thyroid imoging reporting and data system of thyroid nodules with suspicious sonographic critelia: prediction of malignancy for clinical management, int. J. Adv. Res.2 2014, (11, 1000-1012)
[29.] Konrády András, Differenciált pajzsmirigy rák, Orvosi hetilap, 2011, 152. évfolyam, 5. szám, 163-170., DOI: 10.1556/OH. 2011.29028, 2011
[30.] Bak M, Péter I, Nyári T, et al. On-site fine-needle aspiration cytology of thyroid nodules. Quality assurance of the Bethesda System for Reporting Thyroid Cytopathology (2008). [Pajzsmirigygöbök vékonytű-aspirációs citológiai vizsgálata. A Bethesda-rendszer (2008) minőségbiztosítása] Orv Hetil. 2015; 156: 1661-1666. [Hungarian]
[31.] Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid 2016, 26:1-133
[32.] Heilo A, Sigstad E, Fagerlid KH, Haskjold OI, Groholt KK, Berner A, Bjoro T, Jorgensen LH Efficacy of ultrasound-guided percutaneous ethanol injection treatment in patients with a limited number of metastatic cervical lymph nodes from papillary thyroid carcinoma. J Clin Endocrinol Metab 2011, 96:2750-2755
[33.] Hay ID, Lee RA, Davidge-Pitts C, Reading CC, Charboneau JW, Long-term outcome of ultrasoundguided percutaneous ethanol ablation of selected "recurrent" neck nodal metastases in 25 patients with TNM stages III or IVA papillary thyroid carcinoma previously treated by surgery and 131I therapy. Surgery 2013, 154:1448-1454
[34.] Baek JH, Kim YS, Sung JY, Choi H, Lee JH. Locoregional control of metastatic well differentiated thyroid cancer by ultrasound-guided radiofrequency ablation. AJR Am J Roentgenol 2011; 197:W331-W336
[35.] Zhao Q, Tian G, Kong D, Jiang T. Meta-analysis of radiofrequency ablation for treating the local recurrence of thyroid cancers. J Endocrinol Invest 2016; 39:909-916, 2016
[36.] Wang L, Ge M, Xu D, Chen L, Qian C, Shi K, et al. Ultrasonography-guided percutaneous radiofrequency ablation for cervical lymph node metastasis from thyroid carcinoma. J Cancer Res Ther 2014;10 Suppl:C144-C149
[37.] Zhang M, Luo Y, Zhang Y, Tang J. Efficacy and safety of ultrasound-guided radiofrequency ablation for treating low-risk papillary thyroid microcarcinoma: a prospective study. Thyroid, 2016 ;26:1581-1587
[38.] Suh CH, Baek JH, Choi YJ, Lee JH. Efficacy and safety of radiofrequency and ethanol ablation for treating locally recurrent thyroid cancer: a systematic review and metaanalysis. Thyroid 2016;26:420-428
[39.] Guenette JP, Monchik JM, Dupuy DE. Image-guided ablation of postsurgical locoregional recurrence of biopsy-proven well-differentiated thyroid carcinoma. J Vasc Interv Radiol2013, 24:672-679
[40.] Kondrády A. A pajzsmirigy rosszindulatú megbetegedései. Pajzsmirigybetegségek az orvosi gyakorlatban. Szerk. Lakatos P, Takács I. Spring med. 2017; 139-150.
[41.] Konrády A. Differenciált pajzsmirigy-carcinoma. Az Endokrin és anyagcsere-betegségek gyakorlati kézikönyve. Szerk. Leővey A, Nagy VE, Paragh Gy, Rácz K. Medicina. 2017; 203-178.
[42.] Mezősi E, Altorjai Á, Deák P, Dohán O, Forgács A, Gellén B, et al: Összefoglalás a 2019. április 24-én tartott konszenzuskonferencia anyagából. ORVOSTOVÁBBKÉPZŐ SZEMLE (1218-2583 ): 26 9: 2019; 31-40.
[43.] Di Jeso B, Arvan P. Thyroglobulin From Molecular and Cellular Biology to Clinical Endocrinology. Endocrine Reviews, 2016; 37 (1): 2-36.
[44.] Giovanella L, Treglia G, Sadeghi R, Trimboli P, Ceriani L, Verburg FA. Unstimulated Highly Sensitive Thyroglobulin in Follow-up of Differentiated Thyroid Cancer Patients: A Meta-Analysis. J Clin Endocrinol Metab. 2014, 99; 440-447.
[45.] Giuovanella L, Clark PM, Chiovato L, Duntas L, Elisei R, Feldt-Rasmussen U. et al. Thyroglobulin measurement using highly sensitive assays in patients with differentiated thyroid cancer: a clinical position paper. European J Endocrinol. 2014,171;R33-R46.
[46.] Spencer C, Petrovic I, Fatemi Sh, LoPresti J. Serum Thyroglobulin (Tg) Monitoring of Patients with Differentiated Thyroid Cancer Using Sensitive (Second Generation) Immunometric Assays can be Disrupted by False-Negative and False-Positive Serum Thyroglobulin Autoantibody Misclassifications. J Endocrinol Metab.2014, 999 (12) 4589- 4599.
[47.] Spencer C, LoPresti J, Fatemi S.: How sensitive (second-generation) thyroglobulin measurement is changing paradigms for monitoring patients with differentiated thyroid cancer, in the absence or presence of thyroglobulin autoantibodies.www.co-endocrinology.com 2014, 21,5 394-404.
[48.] Latrofa F, Ricci D, Montanelli L, Rocchi R, Piaggi P Sisti E. et al. Thyroglobulin Autoantibodies in Patients with Papillary Thyroid Carcinoma: Comparison of Different Assays and Evaluation of Causes of Discrepancies.J Clin Endocriniol Metab. 2012, 97; (11) 3974- 3982.
[49.] Spenser C. Commentary on: Implications of Thyroglobulin Antibody Positivity in patients with Differentiated Thyroid Cancer: A Clinical Position Statement. Thyroid 2013; 23:1190-92. DOI:10.1089/th.2013.0496.
[50.] Giovanella L, Feldt-Rasmussen U, Verburg FA, Grebe S,K,Plebani M, Clark PM. Thyroglobulin messurement by highly sensitive assays focus on laboratory challenges. Clin Chem Lab Med. 2015; 53(9) 1301- 1314.
[51.] Netzel BC, Grebe SKG, Leon GC, Castro R, Clark PM, Hoofnagle AN. et al. Thyroglobulin (Tg) Testing Revisited: Tg Assays, TgAb, Assays and Correlation of Results With Clinical Outcomes. J. Clin Endocrinol Metab 2015; 100: E1074- E1083.
[52.] Guastapaglia L, Kasamatsu TS, Nakabashi CCD, Camacho CP, et al. The role of a new polyclonal competitive thyroglobulin assay in the follow-up of patients with differentiated thyroid cancer with structural disease but low levels of serum thyroglobulin by immunometric and LC-MS/MS methods Endocrine. 2021;72:784-790. doi: 10.1007/s12020-020-02526-8. PMID: 33222120
[53.] Ylli D, Soldin SJ, Stolze B, Wei B, Nigussie G, et al. Biotin Interference in Assays for Thyroid Hormones, Thyrotropin and Thyroglobulin.Published Online:3 Aug 2021https://doi.org/10.1089/thy.2020.0866
[54.] Rosario PW, Carvalho Souza Côrtes M, Franco Mouräo G. Follow-up of patients with thyroid cancer and antithyroglobulin antibodies: a review for clinicians Endocrine-Related Cancer, (2021) 28, R111-R119
[55.] Oswald ZJ, Lee, Eslick G. Investigating anti-thyroglobulin antibody as a prognostic marker for differentiated thyroid cancer: a meta-analysis and systematic review. Thyroid DOI: 10.1089/thy.2019.0368
[56.] Drake T. Serum Antithyroglobulin Antibodies Predict Differentiated Thyroid Cancer Persistence/Recurrence and Mortality Clin Thyroidol 2020;32:344-346.
[57.] Lupoli GA, Okosieme OE, Evans C, Pickett AJ, Premawardhana LDKE, Kupoli G, Lazarus JH. Prognostic Significance of Thyroglobulin Antibody Epitopes of Differentiated Thyroid Cancer. J. Clin Endocrinol Metab. 2015, 100; 100-108.
[58.] Yin N, Sherman SI, Pak Y, Litofsky DR, Gianoukakis AG. The De novo Detection of Anti-thyroglobulin Antibodies and Differentiated Thyroid Cancer Recurrence. Thyroid DOI: 10.1089/thy.2019.0791
[59.] American Thyroid Association Statement on Preoperative Imaging for Thyroid Cancer Surgery Yeh MW, Bauer AJ, Bernet VA, Ferris LR, Loevner LA, Mandel SJ, Orloff LA, Randolph GW: Thyroid Vol 25, No1: 3-13, 2015 DOI: 10.1089/thy.2014.0096
[60.] The American Association of Endocrine Surgeons Guidelines for the Definitive Surgical Management of Thyroid Disease in Adults. Patel KN, Yip L, Lubitz CC, Grubbs EG, Miller BS, Shen W, Angelos P, Chen H, Doherty GM, Fahey TJ 3rd, Kebebew E, Livolsi VA, Perrier ND, Sipos JA, Sosa JA, Steward D, Tufano RP, McHenry CR, Carty SE. Ann Surg. 2020 Mar;271(3):e21-e93. doi: 10.1097/SLA.0000000000003580.PMID: 32079830
[61.] Surgery of the Thyroid and Parathyroid Gland. G. W. Randolph.3rd Edition, 2020. Elseviser
[62.] NCCN Guidelines Insights: Thyroid Carcinoma, Version 2.2018. Haddad RI, Nasr C, Bischoff L, Busaidy NL, Byrd D, Callender G, Dickson P, Duh QY, Ehya H, Goldner W, Haymart M, Hoh C, Hunt JP, Iagaru A, Kandeel F, Kopp P, Lamonica DM, McIver B, Raeburn CD, Ridge JA, Ringel MD, Scheri RP, Shah JP, Sippel R, Smallridge RC, Sturgeon C, Wang TN, Wirth LJ, Wong RJ, Johnson-Chilla A, Hoffmann KG, Gurski LA.J Natl Compr Canc Netw. 2018 Dec;16(12):1429-1440. doi: 10.6004/jnccn.2018.0089.PMID: 30545990
[63.] Thyroid cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Filetti S, Durante C, Hartl D, Leboulleux S, Locati LD, Newbold K, Papotti MG, Berruti A; ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org. Ann Oncol. 2019 Dec 1;30(12):1856-1883. doi: 10.1093/annonc/mdz400
[64.] Consensus statement on the terminology and classification of central neck dissection for thyroid cancer. Carty SE, Cooper DS, Doherty GM, Duh QY, Kloos RT, Mandel SJ, Randolph GW, Stack BC Jr, Steward DL, Terris DJ, Thompson GB, Tufano RP, Tuttle RM, Udelsman R. Thyroid. 2009 Nov;19(11):1153-8. doi: 10.1089/thy.2009.0159.
[65.] 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: What is new and what has changed? Haugen BR. Cancer. 2017 Feb 1;123(3):372-381. doi: 10.1002/cncr.30360. Epub 2016 Oct 14.
[66.] Volume, outcomes, and quality standards in thyroid surgery: an evidence-based analysis-European Society of Endocrine Surgeons (ESES) positional statement. Lorenz K, Raffaeli M, Barczynski M, Lorente-Poch L, Sancho J. Langenbecks Arch Surg. 2020 Jun;405(4):401-425. doi: 10.1007/s00423-020-01907-x. Epub 2020 Jun 10.PMID: 32524467
[67.] Parathyroid Autotransplantation During Thyroid Surgery. Where we are? A Systematic Review on Indications and Results. Iorio O, Petrozza V, De Gori A, Bononi M, Porta N, De Toma G, Cavallaro G.J Invest Surg. 2019 Nov;32(7):594-601. doi: 10.1080/08941939.2018.1441344. Epub 2018 Apr 16
[68.] Luster M, Clarke SE, Dietlein M, et al. Guidelines for radioiodine therapy of differentiated thyroid cancer. Eur J Nucl Med Mol Imaging 35:1941-59, 2008
[69.] Pacini F, Schlumberger M, Dralle H, et al. European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium. Eur J Endocrinol 154:787-803, 2006
[70.] Zehir A, Benayed R, Shah RH, et al. Mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000 patients. Nat Med 2017;23:703-713.
[71.] J Natl Compr Canc Netw 2021;19(5.5):658-661
[72.] Eur Thyroid J 2019;8:227-245
[73.] Brose MS, Worden FP, Newbold KL, Guo M, Hurria A. Effect of Age on the Efficacy and Safety of Lenvatinib in Radioiodine-Refractory Differentiated Thyroid Cancer in the Phase III SELECT Trial. J Clin Oncol. 2017 Aug 10;35(23):2692-2699. doi: 10.1200/JCO.2016.71.6472. Epub 2017 Jun 14. PMID: 28613956.
[74.] Brose MS, Nutting CM, Jarzab B, et al. Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial. Lancet 2014;384:319-328
[75.] Schlumberger M, Tahara M, Wirth LJ, et al. Lenvatinib versus placebo in radioiodine-refractory thyroid cancer. N Engl J Med 2015;372:621-63
[76.] (NCCN Guidelines Thyroid Carcinoma Version 2. 2021)
[77.] (Hong DS, DuBois SG, Kummar S, et al. Larotrectinib in patients with TRK fusion-positive solid tumours: a pooled analysis of three phase 1/2 clinical trials. Lancet Oncol 2020;21:531-540)
[78.] Advanced Thyroid Carcinoma: Evolving Systemic Therapy Options Presented by Lori J. Wirth, MD, J Natl Compr Canc Netw 2021;19(5.5):658-661 doi: 10.6004/jnccn.2021.5018 9
[79.] (Bradford D, Larkins E, Mushti SL, Rodriguez L, Skinner AM, Helms WS, Price LSL, Zirkelbach JF, Li Y, Liu J, Charlab R, Turcu FR, Liang D, Ghosh S, Roscoe D, Philip R, Zack-Taylor A, Tang S, Kluetz PG, Beaver JA, Pazdur R, Theoret MR, Singh H. FDA Approval Summary: Selpercatinib for the Treatment of Lung and Thyroid Cancers with RET Gene Mutations or Fusions. Clin Cancer Res. 2021 Apr 15;27(8):2130-2135. doi: 10.1158/1078-0432. CCR-20-3558. Epub 2020 Nov 25. PMID: 33239432.)
[80.] Hu M, Subbiah V, Wirth LJ, et al. Results from the registrational phase I/II ARROW trial of pralsetinib (BLU-667) in patients (pts) with advanced RET mutation-positive medullary thyroid cancer (RET1 MTC) [abstract]. Ann Oncol 2020;31(Suppl 4):Abstract 19130)
[81.] Shah MH, Wei L, Wirth LJ, et al. Results of randomized phase II trial of dabrafenib versus dabrafenib plus trametinib in BRAF-mutated papillary thyroid carcinoma [abstract]. J Clin Oncol 2017;15(Suppl):Abstract 602)
[82.] Choksi P, Papaleontiou M, Guo C, Worden F, Banerjee M, Haymart M. Skeletal Complica- tions and Mortality in Thyroid Cancer: A Population-Based Study. J Clin Endocrinol Metab. 2017 Apr;102(4):1254-60.
[83.] Henry D, Vadhan-Raj S, Hirsh V, von Moos R, Hungria V, Costa L, et al. Delaying skeletal- related events in a randomized phase 3 study of denosumab versus zoledronic acid in pa- tients with advanced cancer: an analysis of data from patients with solid tumors. Support Care Cancer. 2014 Mar;22(3):679-87.
[84.] Pembrolizumab for advanced papillary or follicular thyroid cancer: preliminary results from the phase 1b KEYNOTE-028 study.Abstract 6091 Janice M. Mehnert, Andrea Varga, Marcia Brose, Rahul Raj Aggarwal, Chia-Chi Lin, Amy Prawira, ASCO, Vol 34, Issue 15, 2016
[85.] Eur J Endocrinol. 2020 Aug;183(2):R41-R55. doi: 10.1530/EJE-20-0283. THERAPY OF ENDOCRINE DISEAS E Immunotherapy of advanced thyroid cancer: from bench to bedside Sonia Moretti, Elisa Menicali, Nicole Nucci, Martina Guzzetti, Silvia Morelli, Efisio Puxeddu PMID: 32449696 DOI: 10.1530/EJE-20-0283
[86.] Mehnert JM, Varga A, Brose MS, Aggarwal RR, Lin CC, Prawira A, de Braud F, Tamura K, Doi T & Piha-Paul SA et al. Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with advanced, PD-L1-positive papillary or follicular thyroid cancer. BMC Cancer 2019 19 196. (https://doi.org/10.1186/ s12885-019-5380-3)
[87.] Nixon IJ, Simo R, Newbold K, Rinaldo A, Suarez C, Kowalski LP, Silver C, Shah JP, Ferlito A. Management of Invasive Differentiated Thyroid Cancer. Thyroid, 2016, 26, 1156-1166)
[88.] Powell C, Newbold K, Harrington KJ, Bhide SA, Nutting CM. External Beam Radiotherapy for Differentiated Thyroid Cancer. Clinical Oncology 2010. 22. 456-463.
[89.] Billan S, Charas T:External Beam Radiation in Differentiated Thyroid Carcinoma Rambam Maimonides Med J. 2016 Jan; 7(1): e0008. doi: 10.5041/RMMJ.10235
[90.] D.M. Kimberly, R. Siegel, C.C. Lin, A.B. Mariotto, J. Kramer, J.H. Rowland, K.D. Stein, R. Alteri, A. Jemal, Cancer Treatment and Survivorship Statistics. CA Cancer J. Clinicians 66, 271-289 (2016)
[91.] R.L. Siegel, K.D. Miller, A. Jemal, Cancer Statistics. CA Cancer J. Clinicians 66, 7-30 (2016)
[92.] O. Husson, H.R. Haack, L.M. Buffart, W.A. Nieuwlaat, W.A. Oranje, F. Mols, J.L. Kuijpens, J.W. Coebergh, L.V. Van de Poll-Franse, Health-related quality of life and disease specific symptoms in long-term thyroid cancer survivors: A study from the population-based PROFILES registry. Acta Oncologica 52, 249-258 (2013)
[93.] Remenár É. A fej-nyak területének daganatos betegségei. in: J. Horti J., Riskó Á. Onkopszichológia a gyakorlatban 2. Online kiadás. (2017)
[94.] S. Tagay, S. Herpertz, M. Langkafel, Y. Erim et al. Health-related quality of life, depression and anxiety in thyroid cancer patients. Qual. Life Res. 15, 695-703 (2006)
[95.] S. Dogan, N.A. Sahbaz, N. Aksakal, F. Tutal, B.C. Torun, N.K. Yildirim, M. Ozkan, B. Oxcinar, Y. Erbil, Quality of life after thyroid surgery. J. Endocrinological Investig. 40, 1085-1090 (2017)
[96.] E.M. Gamper, L.M. Wintner, M. Rodrigues, S. Buxbaum et al. Persistent quality of life impairments in differentiated thyroid cancer patients: results from a monitoring program. Eur. J. Nucl. Med. Mol. Imaging 42, 1179-1188 (2015)
[97.] Y.G. Hyun, A. Alhashemi, R. Fazelzad, A.S. Goldberg, D.P. Goldstein, A.M. Sawka, A systematic review of unmet information and psychosocial support needs of adults diagnosed with thyroid cancer. Thyroid 26, 1239-50 (2016)
[98.] K. Hodgkinson, P. Butow, G.E. Hunt et al. The development and evaluation of a measure to assess cancer survivors' unmet supportive care needs: the CaSUN (Cancer Survivor's Unmet Needs measure). Psycho-Oncol. 16, 796-804 (2007)
[99.] Kásler M. (szerk.) (2008): A komplex onkodiagnosztika és onkoterápia irányelvei, Semmelweis kiadó, Budapest
[100.] Kovács P, Konz Zs, Peti J, et al. Az onkopszichológiai rehabilitáció területei és kihívásai. Magy Onkol 1017;61:284-291.
[101.] Perczel F. D., Kiss Zs., Ajtai Gy. (Szerk.) (2005) Kérdőívek, becslőskálák a klinikai pszichológiában. Országos Pszichiátriai és Neurológiai Intézet, Budapest.
[102.] Carlson L.E, Speca, M.; (2003): Mindfulness-based stress reduction in relation to quality of life, mood, symptoms of stress, and immune parameters in breast and prostate cancer outpatients. Psychosomatic Medicine. 65.(4.) p. 571-581.
[103.] Szőnyi G, Füredi J. (2008): A pszichoterápia tankönyve. Medicina Könyvkiadó Zrt. Budapest
[104.] Murali K., Banerjee S. Burnout in Oncologists is a serious issue: What can we do about it? Cancer Treatment Reviews (2018), doi: https://doi.org/10.1016/j.ctrv.2018.05.009
[105.] Park DS, Cho JS, Park MH, et al. Malignant thyroid bed mass after total thyroidectomy. J Korean Surg Soc. 2013; 85: 97-103.
[106.] Kamaya A, Gross M, Akatsu H, et al. Recurrence in the thyroidectomy bed: sonographic findings. AJR Am J Roentgenol. 2011; 196: 66-70.
[107.] Zhao L, Gong Y, Wang J, et al. Ultrasound-guided fine-needle aspiration biopsy of thyroid bed lesions from patients with thyroidectomy for thyroid carcinomas. Cancer Cytopathol. 2013; 121: 101-7.
[108.] Ko MS, Lee JH, Shong YK, et al. Normal and abnormal sonographic findings at the thyroidectomy sites in postoperative patients with thyroid malignancy. AJR Am J Roentgenol. 2010; 194: 1596-609.
[109.] Torlontano M, Attard M, Crocetti U, et al. Follow-up of low risk patients with papillary thyroid cancer: role of neck ultrasonography in detecting lymph node metastases. J Clin Endocrinol Metab. 2004; 89: 3402-7.
[110.] Leenhardt L, Erdogan MF, Hegedus L, et al. European Thyroid Association guidelines for cervical ultrasound scan and ultrasound-guided techniques in the postoperative management of patients with thyroid cancer. Eur Thyroid J. 2013; 2: 147-159.
[111.] Zaheer S, Tan A, Ang ES, et al. Post-thyroidectomy neck ultrasonography in patients with thyroid cancer and a review of the literature. Singapore Med J. 2014; 55: 177-183.
[112.] Kobaly K, Mandel SJ, Langer JE. Clinical Review: Thyroid Cancer Mimics on Surveillance Neck Sonography. J Clin Endocrinol Metab. 2015; 100: 371-5.
[113.] Webster N, Fox C, Fan F. Thyroid bed fine needle aspiration in patients after thyroidectomy--a useful follow-up tool with proposed diagnostic categories. Ann Diagn Pathol. 2014; 18: 177-180.
[114.] Spencer C, LoPresti J, Fatemi S. How sensitive (second-generation) thyroglobulin measurement is changing paradigms for monitoring patients with differentiated thyroid
[115.] 60/2003. (X. 20.) ESzCsM rendele az egészségügyi szolgáltatások nyújtásához szükséges szakmai minimumfeltételekről
Kapcsolódó internetes oldalak
http://www.oncol.hu http://www-dep.iarc.fr/GLOBOCAN/database.htm
http://www.nccn.org/professionals/physician_gls/f-guidlines.asp
http://www.cancer.gov/cancer_information/pdq/National Cancer Institute (NCI)
http://www.agreecollaboration.org/
X. FEJLESZTÉS MÓDSZERE
1. Fejlesztőcsoport megalakulása, a fejlesztési folyamat és a feladatok dokumentálásának módja
Jelen egészségügyi szakmai irányelv az Egészségügyi Szakmai Kollégium Onkológia és Sugárterápia Tagozata, valamint a daganatlokalizáció ellátásában együttműködő társszakmák kollégiumi Tagozatai részéről tett javaslatok alapján felkért multidiszciplináris Fejlesztő munkacsoport közreműködésével készült. A Fejlesztőcsoport munkáját a kapcsolattartó szakértő koordinálta. Az egészségügyi szakmai irányelvfejlesztés a szakértők szakmai tapasztalatainak felhasználásával és a releváns nemzetközi szakirodalomban publikált közlemények, irányelvek és evidenciák feldolgozásával történt, a vizsgálati és terápiás eljárási rendek kidolgozásának, szerkesztésének, valamint az ezeket érintő szakmai egyeztetések lefolytatásának egységes szabályairól szóló 18/2013. (III. 5.) EMMI rendelet által meghatározott szerkezeti formában.
Az onkológiai tárgyú egészségügyi szakmai irányelvek fejlesztése speciális, mivel az Országos Onkológiai Intézet feladata: "...az onkológiai ellátás szakmai irányelveinek és követelményrendszereinek multidiszciplináris kidolgozása során az Egészségügyi Szakmai Kollégium tagozatai közötti, a szakmai irányelvek kidolgozására vonatkozó jogszabályoknak megfelelő koordináció biztosítása." [115]
A jelen egészségügyi szakmai irányelv fejlesztésében közreműködő Tagozatok társszerzőként és véleményezőként delegált szakértőit az Egészségügyi Szakmai Kollégium elnöke kérte fel az egészségügyi szakmai irányelv kidolgozására alakult fejlesztőcsoport munkájában való aktív részvételre. A Fejlesztő munkacsoport munkájában való közreműködésre irányuló felkérés elsődleges szempontja értelemszerűen a jelen egészségügyi szakmai irányelv témája szerint érintett társszakmák álláspontjainak kölcsönös kifejtése, képviselete és a kiadáshoz szükséges konszenzus létrehozása volt. Az így összeállított és az érintett társzakmák Szakmai Tagozatai által konszenzussal jóváhagyott dokumentum az Emberi Erőforrások Minisztériuma Hivatalos Lapjában, az Egészségügyi Közlönyben kap széleskörű szakmai nyilvánosságot.
A fejlesztőcsoport tagjai elfogadták a kapcsolattartó személyére tett javaslatot és megállapodtak abban, hogy a fejlesztés során elsősorban elektronikus úton fogják tartani a kapcsolatot. Ennek megfelelően a fejlesztés dokumentációját is elsősorban az elektronikusan archivált és/vagy kinyomtatott dokumentumok képezik. Az egészségügyi szakmai irányelv tervezet elkészülte után, a véleményező tagozatok véleményezték a tervezetet. Az egészségügyi szakmai irányelv készítése során a szerzői függetlenség nem sérült.
2. Irodalomkeresés, szelekció
A jelen egészségügyi szakmai irányelv fejlesztése a kapcsolódó amerikai és európai irányelvek (ATA, NCCN, ESMO és ETA) hazai adaptációjával, valamint az egyéb releváns - a hivatkozásokban feltűntetett - külföldi és hazai szakirodalom feldolgozásával történt. Itt kell megjegyezni, hogy a jelen egészségügyi szakmai irányelv által felölelt klinikai döntéshozatali folyamatok szükségszerű sokszakmás, multidiszciplináris team jellegű megközelítését legjobban az amerikai NCCN irányelvek fejezik ki, azonban a magyar ellátórendszer és betegpopuláció sajátosságai az európai rendszerekhez hasonlítanak inkább, így az NCCN Thyroid Cancer című (2021 v2) irányelvben foglaltakat elérhetőségét a szakirodalmi hivatkozásoknál ismertettük.
A kritikusan értékelt ajánlásokhoz kapcsolódó hivatkozások is az Irodalom című fejezetben kerültek feltüntetésre.
Az irodalomkeresés az adaptált egészségügyi szakmai irányelveknek és a releváns szakirodalom keresési stratégiáinak megfelelően történt. Az első keresésre, az adaptált egészségügyi szakmai irányelv fejlesztésre irányuló tagozati javaslat elfogadása idején került sor. A keresés utolsó végrehajtása az egészségügyi szakmai irányelv végleges kialakítása előtt is megtörtént.
A fellelt szakirodalmak szelekciója során a fejlesztőcsoport első sorban a magas szintű bizonyítékokat tartalmazó publikációkat, illetve a szisztematikus review-kat vette figyelembe. Legtöbb esetben az ismertetett vizsgálatok, retrospektív elemzések, nagyobb multicentrikus tanulmányok és jól megtervezett kontrollált vizsgálatok eredményei álltak rendelkezésre. Ettől csak néhány esetben tértünk el, mivel bizonyos adatok esetében csak néhány randomizált, kontrollált vizsgálat érhető el, amelyekben erős bizonyítékok nem állnak rendelkezésre.
Az irodalomkutatás a Cochrane Database of Systematic Reviews, a Cochrane Library of Controlled Clinical Trials és a Medline and Embase on the Dialog-Datastar alapján történt. (Az alkalmazott keresőszavak: trhyroid, endocrin, carcinoma, tumour, metastatic, systematic, review, randomized, controlled, diagnosis, treatment, therapy, active surveillance, follow-up). Az irodalomkeresés és kiválasztás, valamint a nemzetközi szakirodalomban közzétett egészségügyi szakmai irányelvek adaptálása a Fejlesztő munkacsoport (multidiszciplináris munkacsoport) tagjainak egyetértésével (konszenzusával) történt - az adott témában publikált nemzeti/nemzetközi szakmai egészségügyi szakmai irányelvek (guideline-ok), metaanlaysisek és egyéb szakértői álláspontok (expert opinion) szakirodalmi vizsgálata-feldolgozása és összegző eljárása során, a feldolgozott forrásművek szövegközi jelölésével.
3. Felhasznált bizonyítékok erősségének, hiányosságainak leírása (kritikus értékelés, "bizonyíték vagy ajánlás mátrix"), bizonyítékok szintjének meghatározási módja
A fejlesztőcsoport kritikusan értékelte az adaptációra kiválasztott és a hivatkozott egészségügyi szakmai irányelvek bizonyíték- és ajánlásbesorolási rendszerét és ennek alapján döntötte el, hogy a jelen egészségügyi szakmai irányelvben mely ajánlás erősségi rendszert alkalmazza.
A más egészségügyi szakmai irányelvből/publikációból származó evidenciákat a fejlesztőcsoport szintén megvizsgálta és a kialakított ajánlásbesorolási rendszernek megfelelően átsorolta.
4. Az ajánlási rangsor kialakításának módszere
Az ajánlások egységes rangsorolási módszerének kialakítása érdekében összehasonlítva egyeztettük az onkológiai gyakorlatban vezető - így Magyarországon is elterjedt -, de jelentős eltéréseket tartalmazó (NCCN, ATA, ESMO, ETA) ajánlási rangsorolásokat, illetőleg az ezekben alkalmazott ajánláserősségi jelöléseket és azok definícióit, amelyek összevetése alapján állítottunk fel a jelen ajánlásoknál is egységesen használható rangsorolási rendszert.
Az egészségügyi szakmai irányelv ajánlásainak minősítése a beavatkozásokra vonatkozó evidenciák minőségére alapozva történt.
| Ajánlás erőssége (grade) | Haszon és kockázat | Evidencia szintje (level) | Evidencia létrejötte | Evidencia interpretációja | Jelölés |
| erősen ajánlott | a haszon egyértelműen meghaladja a kockázatot | Magas | 1. Randomizált, kontrollált vizsgálat (RCT), amelynek nincs fontosabb korlátja. 2. Megfigyelésekből származó, nagyon meggyőző evidencia | A terápiás beavatkozás a legtöbb betegben alkalmazható, szinte minden körülmény között megszorítás nélkül | A |
| Közepes | 1. RCT vagy más jó minőségű vizsgálat, fontos korlátokkal 2. Megfigyelésekből származó, meggyőző evidencia | ||||
| Alacsony | Megfigyelésekből vagy esetleírásokból származó evidencia | Változhat, ha jobb minőségű evidencia keletkezik. | |||
| korlátokkal ajánlott | a haszon és kockázat közel egyensúlyban van | Magas | 1. RCT, amelynek fontosabb korlátja nem ismert. 3. Megfigyelésekből származó, nagyon meggyőző evidencia | A legkedvezőbbnek tartott beavatkozás különböző lehet a körülményektől vagy a betegvizsgálat eredményeitől függően. | B |
| Közepes | 1. RCT vagy más jó minőségű vizsgálat, fontos korlátokkal. 2. Megfigyelésekből származó, meggyőző evidencia | ||||
| Alacsony | Megfigyelésekből vagy esetleírásokból származó evidencia | Más beavatkozások is azonos eredményességgel szóba jönnek | |||
| gyengén ajánlott | a haszon és kockázat aránya nem becsülhető | Ellentmondó vagy hiányzó | szakértői tapasztalatból származó javaslat (expert opinion) | Nincs elég evidencia, ami a beavatkozás mellett vagy ellene szólna. | C |
| + | |||||
| nem ajánlott | a haszon egyértelműen kisebb a kockázatnál | nem értelmezhető | 1. RCT vagy más jó minőségű vizsgálat eredménye 2, Megfigyelésekből származó egyértelmű álláspont | Elegendő ismeret áll rendelkezésre a beavatkozás indikációja ellen | D |
Forrás: Fejlesztő munkacsoport által szerkesztett
Az ajánlás-erősségek explicit megjelölései - az EBM követelményinek megfelelő, multicentrikus, prospectív, randomizált trial/ek, metaanalitikus tanulmányok és egyéb közlemények adatainak kritikus értékelése és a fejlesztőcsoport konszenzusa alapján került meghatározásra.
"A" kategóriájú ajánlás Olyan alapelvek, amelyeknek a beteg számára hasznos voltáról magas (multicentrikus, prospectív, randomizált trial/ek, illetve metaanalitikus tanulmányok) vagy alacsonyabb szintű, nagyon meggyőző és egyértelmű evidenciák (irodalmi adatok) állnak rendelkezésre, ezért alkalmazásuk ajánlása nem képezi vita tárgyát.
"B" kategóriájú ajánlás Olyan irányelvek, amelyeknek hatékonyságáról magas vagy alacsonyabb szintű, meggyőző, de nem egyértelmű evidenciák irodalmi adatai állnak rendelkezésre, amelyek egyes fontos részletkérdései nem kellően tisztázottak vagy nem minden tekintetben bizonyító erejű orvosi kutatások eredményeiről szólnak ahhoz, hogy teljes egyetértés legyen az alkalmazásuk fontosságának hangsúlyozásában.
"C" kategóriájú ajánlás Olyan szakirodalomban közölt szakértői tapasztalatokon alapuló ajánlások, amelyek evidenciái hiányoznak vagy ellentmondóak, így hatékonyságuk megítélésében nincs egyetértés, illetőleg nincs elég evidencia, ami a beavatkozás mellett vagy ellene szólna. Az irányelvekben való felvételüket indokolja, hogy a rosszindulatú daganatos betegek komplex ellátásában távolról sem teljes körű az evidenciák rendelkezésre állása (pl. ritka daganatok), de a betegek ellátását ezekben az esetekben is a tudomány mindenkori állásának megfelelő orvosi gyakorlat kötelezettsége alapján kell végezni. - alkalmazandó olyan eljárások, amelyek a betegségtípusok sokasága miatt Az evidenciák explicit megjelölhetőségét így nélkülöző ajánlások az orvostovábbképzés azon ismereteire és szakértői álláspontokra (expert opinion) épülnek, amelyek megegyeznek az irányelv fejlesztésében közreműködő és az adott szubspecialitásban jártas Szakértők kisebbségi álláspontjával.
"D" kategóriájú ajánlás Olyan ajánlások, amelyekhez elegendő ismeret áll rendelkezésre az adott beavatkozás indikációja ellen, amikor az adott helyzetben a beavatkozás nem minősül a szakma szabályai szerinti malpraxisnak, de felesleges és/vagy haszna egyértelműen kisebb a kockázattal szemben. Meg kell említeni, hogy a rákbetegségek ellátásában a legmagasabb szintű bizonyítékok csak ritkán állnak rendelkezésre az ismeretek hiánya vagy éppen ezek túl gyors változásával járó intenzív kutatások miatt, ami nem zárja ki egy adott beavatkozás ajánlásának magasabb szintű konszenzus kategóriába sorolását.
5. Véleményezés módszere
A minél szélesebb körű elfogadottság érdekében az EMMI Minőségfejlesztési és Módszertani Főosztálya a tervezetet megküldte az ellátásban érintett Egészségügyi Szakmai Kollégiumi Tagozatoknak (I. Fejezet) jóváhagyásra. A visszaérkező javaslatokat és véleményeket a koordinátor összesítette, majd a fejlesztőcsoport tagjainak ismételten elküldte és a fejlesztőcsoport által elfogadott módosítások így kerültek beépítésre.
6. Független szakértői véleményezés módszere
Nem került bevonásra.
XI. MELLÉKLET
1. Alkalmazást segítő dokumentumok
1.1. Betegtájékoztató, oktatási anyagok
1.2. Tevékenységsorozat elvégzésekor használt ellenőrző kérdőívek, adatlapok
1. sz. melléklet Elvárások a prognosztikai patológiai lelettel szemben
| Prognosztikai patológiai lelet |
| Klinikai adatok: |
| Korábban besugárzás |
| Történt |
| Nem történt |
| Pajzsmirigy daganat családi halmozódás |
| Ismert |
| Nem ismert |
| Citológiai vizsgálat eredménye |
| TBS I |
| TBS II |
| TBS III |
| TBS IV |
| TBS V |
| TBS VI |
| Beavatkozás típusa: |
| Total thyroidectomia |
| Jobb lobectomia |
| Bal lobectomia |
| Jobb részleges excisio |
| Bal részleges excisio |
| Jobb lobectomia isthmusectomiával (hemithyroidectomia) |
| Bal lobectomia isthmusectomiával (hemithyroidectomia) |
| Jobb lebeny és részleges bal lobectomia (subtotal vagy közel total thyroidectomia) |
| Bal lebeny és részleges jobb lobectomia (subtotal vagy közel total thyroidectomia) |
| Komplettáló thyroidectomia (reoperáció) |
| Tumor lokalizációja: |
| Jobb lebeny |
| Bal lebeny |
| Isthmus |
| Pyramidalis lebeny |
| Egyéb: |
| Tumor fokalitás: |
| Egygócú |
| Több gócú (1cm-nél nagyobb tumor gócokra vonatkozóan külön-külön meg kell adni a prognosztikai |
| paramétereket) |
| Nem határozható meg |
| Tumor méret: |
| Legnagyobb átmérő (centiméter): cm |
| További kiterjedés (centiméter): x cm |
| Nem adható meg |
| Daganat szövettani típusa |
| Papillaris carcinoma, klasszikus |
| Papillaris carcinoma, encapsulait, klasszikus |
| Papillaris carcinoma, follicularis variáns, encapsulalt, tok invázióval |
| Papillaris carcinoma, follicularis variáns, infiltrativ |
| Papillaris carcinoma, tall cell variáns |
| Papillaris carcinoma, hobnail variáns |
| Papillaris carcinoma, solid variáns |
| Papillaris carcinoma, cribriform-morular variáns |
| Papillaris carcinoma, diffúz sclerotisalo variáns |
| Papillaris carcinoma, hengersejtes variáns |
| Papillaris microcarcinoma |
| Papillaris carcinoma, egyéb tipus: |
| Follicularis carcinoma, minimalisan invaziv |
| Follicularis carcinoma, encapsulalt angioinvaziv |
| Follicularis carcinoma, szélesen invaziv |
| Oncocyter (Hürthle sejtes) carcinoma, minimálisan invazív |
| Oncocyter (Hürthle sejtes) carcinoma, encapsulalt angioinvaziv |
| Oncocyter (Hürthle sejtes) carcinoma, szélesen invazív |
| Rosszul differenciált pajzsmirigy carcinoma, fokális/ minor komponensként jelen van, extrathyroidalis |
| terjedés nélkül |
| Rosszul differenciált pajzsmirigy carcinoma |
| Anaplasticus carcinoma |
| Egyéb: |
| Mitotikus aktivitás |
| Nem azonosítható/ alacsony (<5 mitózis/2mm2) |
| Kifejezett, >5 mitózis/ 2mm2 |
| Tumor körülírtsága |
| Encapsulalt |
| Infiltratív |
| Érinvázió |
| Vérér invázió |
| Nem azonosítható |
| Jelen van |
| Fokális (1-3 fókusz) |
| Kiterjedt (>4 fókusz)) |
| Nyirokér invázió |
| Nem azonosítható |
| Jelen van |
| Kisér invázió, pontosan nem tipizálható |
| Necrosis |
| Nem azonosítható |
| Jelen van |
| Extrathyroidalis terjedés |
| Nem azonosítható |
| Jelen van a perithyroidalis kötőszövetben Jelen van, mikroszkópos harántcsíkolt izom invázió, makroszkóposan nem azonosítható Jelen van, képalkotó vizsgálattal és makroszkóposan azonosítható, hisztológia megerősítette Harántcsíkolt izom invázió (pT3b) Subcutanszövetek, larynx, trachea, nyelőcső vagy n.recurrens infiltráció (pT4a) Prevertebralisfascia infiltráció vagy carotisvagy mediastinalis ér érintettség (pT4b) Nem adható meg Sebészi szélek Nem adható meg Épek, az invazív carcinoma széltől való legkisebb távolsága: _________ mm Tumorosan infiltrált. Érintett szél lokalizációja radio button (egy választható) anterior posterior Regionális nyirokcsomók Nyirokcsomó nem került eltávolításra Nyirokcsomó eltávolításra került VI régió (pretrachealis, paratrachealis, prelaryngealis, perithyroidalis): áttétes/ vizsgált nyirokcsomók száma: legnagyobb áttét átmérője: _________ mm extranodalis terjedés nem azonosítható Jelen van VII régió (felső mediastinalis) áttétes/ vizsgált nyirokcsomók száma: _________ legnagyobb áttét átmérője: _________ mm extranodalis terjedés nem azonosítható Jelen van Jobb lateralis I-V régió áttétes/ vizsgált nyirokcsomók száma: _________ legnagyobb áttét átmérője: _________ mm extranodalis terjedés nem azonosítható Jelen van Bal lateralis I-V régió áttétes/ vizsgált nyirokcsomók száma: _________ legnagyobb áttét átmérője: _________ mm extranodalis terjedés nem azonosítható Jelen van Egyéb: áttétes/ vizsgált nyirokcsomók száma: _________ legnagyobb áttét átmérője: _________ mm extranodalis terjedés nem azonosítható Jelen van (A nyirokcsomó státusz megadásához használható az alábbi táblázatos forma is) | ||||||
| Nyirokcsomó lokalizációja | Vizsgált nyirokcsomók száma | Áttétes nyirokcsomók száma | Legnagyobb áttét átmérője | Extranodalis terjedés Nem azonosítható/jelen van | ||
| VI régió: pretrachealis, paratrachealis prelaryngealis perithyroidalis | ||||||
| VII régió: superior mediastinalis nyirokcsomók | ||||||
| I-V régió: lateralisnyaki blokkdisszekció | ||||||
| Jobb lateralisI-V régió | ||||||
| Bal lateralisI-V régió | ||||||
| Egyéb | ||||||
| Daganat körüli pajzsmirigy állományban az alábbi eltérések azonosíthatók |
| Follicularis adenoma |
| Nodularis hyperplasia |
| Diffúz hyperplasia |
| Dyshormogenetikus golyva |
| Chronicuslymphocytas thyroiditis |
| Nem azonosítható egyéb eltérés, a daganat körüli pajzsmirigy megtartott szerkezetű |
| C-sejt hyperplasia (típusa): reaktív/ preneoplasticus |
| Mellékpajzsmirigy |
| Nem került eltávolításra |
| Eltávolításra került (száma):____________ |
| Megjegyzés, immunhisztokémia |
| Biomarker vizsgálat: |
| Molekuláris patológiai vizsgálatra alkalmas blokk: |
| Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat |
1.3. Táblázatok
1. táblázat: Follicularis hám eredetű pajzsmirigytumorok 2017-es WHO szerinti klasszifikációja.
| Papillaris carcinoma |
| Papillaris carcinoma (PTC) klasszikus |
| Encapsulalt papillaris carcinoma klasszikus |
| Infiltratívfollicularisvariánsú papillariscarcinoma |
| Invazívencapsulaltfollicularisvariánsú PTC* |
| Diffúz sclerotisalo PTC |
| Solid/trabecularis PTC |
| Warthin-like PTC |
| Oncocyter PTC |
| Világos sejtes PTC |
| Orsósejtes PTC |
| PTC fibromatosis-like stromával |
| Magas sejtes (tall cell) PTC |
| Hobnail PTC |
| PTC columnar sejtes variáns |
| Papillarismicrocarcinoma |
| Folliculariscarcinoma |
| Folliculariscarcinoma, minimálisan invazív |
| Folliculariscarcinoma, encapsulalt angioinvazív |
| Folliculariscarcinoma, szélesen invazív |
| Hürthle sejtes carcinoma |
| Hürthle sejtes carcinoma, minimálisan invazív |
| Hürthle sejtes carcinoma, encapsulalt angioinvazív |
| Hürthle sejtes carcinoma, szélesen invazív |
| Rosszul differenciált pajzsmirigy carcinoma* |
| Anaplasticuscarcinoma |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
2. táblázat: Egyszerűsített diagnosztikus algoritmus tisztán follicularis mintázatú daganatok diagnosztizálására.
| Tokinfiltráció, vérérinvázió | ||||
| Jelen van | Kérdéses | Hiányzik | ||
| Papillaris magjelenség | Jelen van | Papillaris carcinoma invazív encapsulalt follicularis variáns | Jól differenciált tumor bizonytalan malignitási potenciállal | Noninvazív follicularis pajzsmirigytumor papillarisszerű magokkal (NIFTP) |
| Kérdéses | Jól differenciált carcinoma NOS | |||
| Hiányzik | Follicularis carcinoma | Follicularis tumor bizonytalan malignitási potenciállal | Follicularis adenoma | |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
3. táblázat: A pajzsmirigy follicularis hám eredetű tumorokra jellemző leggyakoribb genetikai eltérések
| Mutációk | Follicularisca | Papillaris/anaplasticus ca | Analízis célja |
| BRAF V600E | - | + | Diagnosztikus, terápiás |
| TERTp | + | + | Prognosztikus (negatív prognosztikai faktor) |
| NRAS | + | -/+ | Diagnosztikus |
| Fúziók | |||
| RET/PTC | - | + | Terápiás |
| NTRK1/3 | - | + | Terápiás |
| ALK | - | + | Terápiás |
| PAX8/PPRG | + | - | Diagnosztikus |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
4. táblázat. A daganatspecifikus túlélés prognosztikai faktorai differenciált pajzsmirigyrákokban.
| Prognosztikai faktor | Papillariscarcinoma | Folliculariscarcinoma |
| pT (tumornagyság) | + | + |
| pT4 (pajzsmirigytokon való tumoráttörés) | + | + |
| pN (nyirokcsomóáttét) | - | ± |
| M (távoli áttét) | + | + |
| Szövettani differenciáltság | - | + |
| S-fázis-arány | + | + |
| DNS-ploidia | + | + |
| Életkor | + | + |
| Öröklődésmenet típusa | - | - |
| Sebészi kezelés teljessége | + | + |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
5. táblázat. ETA és ATA rizikóklasszifikáció a DTC prognózisának megítélésére.
| ETA 2006 | ATA 2015 |
| Nagyon alacsony rizikó: | Alacsony rizikó: |
| Unifokális T1 (≤1 cm) N0M0 és | nincs lokális vagy távoli áttét |
| nem terjed a pajzsmirigy tokján | tumorszövet R0 rezekciója |
| kívül | a tumor nem infiltrálja a környező szöveteket |
| Alacsony rizikó: | nem agresszív szövettani típus |
| pT1 (> 1 cm) N0M0 | az első RAI kezelést követően nem ábrázolódik 131I felvétel a |
| pT2N0M0 | pajzsmirigyágyon kívül |
| mpT1N0M0 | N0 vagy N1 < 5 mikromet (< 0,2 cm) |
| Magas rizikó: | PTC enkapszulált follicularisvariánsa |
| T3 | FTC vaszkuláris invázió nélkül vagy minimális vaszkuláris invázióval (< 4) |
| T4 | Uni-vagy multifokális PTC (BRAF mutációval is!) |
| N1 | Közepes rizikó: |
| M1 | mikroszkópikus tumor invázió a környező lágy szövetekben |
| 131I felvétel a pajzsmirigy ágyon kívül | |
| agresszív szövettani típus | |
| érinvázió | |
| N1 vagy mikroNl > 5, a nyirokcsomó áttét < 3 cm | |
| Multifokális mikroPTC, környező szövetekbe terjedés, BRAF + | |
| Magas rizikó: | |
| makroszkópikus tumorinvázió | |
| inkomplett tumor rezekció | |
| távoli áttét | |
| aránytalanul magas thyreoglobulinszint | |
| N1, ha bármelyik áttét > 3 cm | |
| FTC extenzív vaszkuláris invázióval (> 4) |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
6. táblázat: Prognosztikai tényezők a korábbi és jelenleg használt rizikó besorolási rendszerekben.
| EORTC | MACIS | ETA | ATA | TNM | vizsgálatok száma (betegszám) | pozitív vizsgálatok száma | negatív vizsgálatok száma | pozitív vizsgálatok aránya (%) | |
| radiojód kezelés | 3 (97 287) | 3 | 0 | 100 | |||||
| x | postoperatív Tg | 13 (6991) | 13 | 0 | 100 | ||||
| x | x | x | x | x | távoli áttét | 29 (208 794) | 28 | 1 | 96,6 |
| x | klinikai stádium | 22 (163 538) | 21 | 1 | 95,5 | ||||
| x | x | x | tumorméret | 38 (216 744) | 34 | 4 | 89,5 | ||
| x | x | x | nyirokcsomóáttét | 38 (212 023) | 34 | 4 | 89,5 | ||
| x | x | R0 rezekció | 12 (66 994) | 10 | 2 | 83,3 | |||
| PET pozitivitás | 6 (538) | 5 | 1 | 83,0 | |||||
| x | x | x | x | x | pajzsmirigyen túlra terjedés | 27 (114 496) | 21 | 5 | 80,8 |
| x | x | x | életkor | 45 (328 988) | 34 | 11 | 75,6 | ||
| x | áttétes nyirok-csomók száma | 7 (5120) | 5 | 2 | 71,4 | ||||
| bilateralis tumor | 3 (3636) | 2 | 1 | 66,0 | |||||
| x | x | szövettani típus | 23 (66 724) | 15 | 8 | 65,2 | |||
| x | vaszkuláris invázió | 8 (4346) | 4 | 4 | 50,0 | ||||
| nyirokcsomóáttét helye | 6 (1429) | 3 | 3 | 50,0 | |||||
| tokinvázió | 11 (4840) | 5 | 6 | 45,0 |
| EORTC | MACIS | ETA | ATA | TNM | vizsgálatok száma (betegszám) | pozitív vizsgálatok száma | negatív vizsgálatok száma | pozitív vizsgálatok aránya (%) | |
| multifokalitás | 10 (1548) | 4 | 6 | 40,0 | |||||
| x | nem | 37 (136 892) | 14 | 23 | 37,8 | ||||
| teljes pajzsmi-rigy | 4 (1115) | 1 | 3 | 25,0 | |||||
| eltávolítás | |||||||||
| pozitív családi anamnézis | 1 (1262) | 1 | 0 | 100 |
Forrás: Glikson és mtsai közleménye alapján, módosítva [14]. Az egyes rizikó besorolási rendszerekben vizsgált prognosztikai tényezőket x-k jelölik.
7. táblázat: A perzisztáló/kiújuló betegség és a betegség-specifikus halálozás rizikója a tumor stádium és a szövettan függvényében.
| Tumorstádium | Megjegyzés | Maradék betegség / kiújulás rizikója | Betegségspecifikus halálozás rizikója |
| pT1aN0M0R0 | nem invazív, szövettan nem agresszív | igen alacsony | igen alacsony |
| mpT1aN0M0R0 | nem invazív, szövettan nem agresszív | alacsony | igen alacsony |
| pT1b-T2N0M0R0 | nem invazív, szövettan nem agresszív | alacsony | igen alacsony |
| T3 | magas | alacsony | |
| T4 | 55 év alatt | magas | alacsony |
| T4 | 55 év felett | magas | magas |
| N1 | magas | alacsony | |
| R1 resectio | magas | alacsony | |
| Vascularisinfiltráció | magas | ? | |
| Agresszív szövettan | magas | ? |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat 8. táblázat: A műtét utáni első radiojód kezelés típusai és céljai.
| Postoperatív 131I terápia | |||
| Cél | Remnant abláció (1,1 GBq) | Adjuváns terápia (3,7 GBq) | Ismert betegség terápiája (3,7 GBq) |
| Staging | + | + | + |
| Követés elősegítése | + | + | + |
| Recidíva csökkentése | + | + | |
| Betegségspecifikus túlélés | + | + | |
| javítása | |||
| Terápiás cél | + | + | |
| Palliatív cél | + | ||
| Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat | |||
9. táblázat: A betegségspecifikus halálozás rizikója a posztterápiás egésztest szcintigráfia és SPECT/CT függvényében.
| Egész test szcintigráfia és SPECT/CT | Betegség-specifikus halálozás rizikója |
| Negatív | Igen alacsony |
| Nyirokcsomó áttét | Alacsony |
| Micronodularis tüdő áttét | Jó terápiás válasz esetén alacsony |
| Macronodularis tüdő áttét | Magas |
| Egyéb lokalizációjú távoli áttét | Magas |
| Jódfelvételt nem mutató áttét | Magas |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
10. táblázat: A pajzsmirigyrákok célzott kezelése szempontjából vizsgálandó génmutációk
| PTC | FTC | Hürthle | PDTC |
| BRAF V600E | N/H/K RAS | Kromoszóma vesztés | BRAF V600E |
| TERT promoter | mutációk | mtDNA komplex I mutációk | TERT promoter mutációk |
| mutációk | DICER 1 | TERT promoter mutációk | N/H/K RAS mutációk |
| RET fúziók | EZH1 | DAXX | EIF1AX |
| N/H RAS mutációk | PTEN | TP53 | PI3K/AKT |
| BRAF fúziók | PAX8-PPARG | NRAS | RET fúziók |
| NTRK3 és 1 fúziók | fúziók | NF1 | ALK fúziók |
| ALK fúziók | CDKN1 | ||
| EIF1AX |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
11. táblázat: A multikináz inhibítor (MKI) kezelés mellett követendő paraméterek.
| panasz/tünet | Testsúly, étvágy, fáradékonyság, hasmenés, bőrelváltozások, páciens napló: mellékhatásokról, tünetekről |
| labor | TSH, FT4 (thyreoglobulin, anti-Tg időszakosan), elektrolitok (Na, K, CA, Mg), vérkép, májenzimek, vérzsírok, lipidek |
| kardiovaszk. paraméterek | EKG (QTc), vérnyomás |
| képalkotás | Egész test leképezése CT/MRI/18-FDG-PET, opcionálisan csontszcintigráfia |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
12. táblázat: Külső sugárkezelés indikálásának mérlegelési szempontjai.
| 0 pont | 1 pont | 2 pont | 4 pont | |
| Életkor | < 45 | 45-60 | > 60 | |
| Nem | nő | férfi | ||
| Rezekabilitás | rezekabilis | irrezekabilis | ||
| Extenzív extracapsularis terjedés | nincs | van | ||
| Extrathyroideális terjedés | T3 | T4 | ||
| R0-R1-R2 | R0 | R1 | R2 | |
| Hisztológiai variáns (tall-cell, Hürthle cell, columnar, diffuse sclerosing, solid variant) | nincs | van | ||
| Recidíva | nincs | van | ||
| Radiojód fölvétel | van | nincs |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
13. táblázat: TSH-célértékek (mU/L) a terápiás válasz és a rizikóbesorolás függvényében.
| alacsony | közepes | magas rizikó | |
| Kezdeti | 0,5-2 | 0,1-0,5 | < 0,1 |
| Kiváló válasz | 0,5-2 | 0,5-2 | 0,1-0,5 (5 év) |
| Bizonytalan | 0,1-0,5 | 0,1-0,5 | < 0,1 |
| Biokémiailag inkomplett | 0,1-0,5 | 0,1-0,5 | < 0,1 |
| Struktúrálisaninkomplett | < 0,1 | < 0,1 | < 0,1 |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
14. táblázat: Pajzsmirigyrákos megbetegedésében előforduló gyakori pszichoszociális problémák, tünetek, és javasolt kezelési irányelvek A felsorolt pszichológiai tünetek az adott szakaszban a legjellemzőbbek, de más stádiumban is előfordulhatnak.
| A betegség lefolyásának szakaszai | Leggyakoribb pszichés tünetek | Onkopszichológiai intervenciók |
| Szűrővizsgálat, | Önerőből leküzdhetetlennek érzett distressz | Barátságos légkör, és bizalomteljes |
| onkológiai | növekedése (egyéni/családi), | kommunikáció megteremtése a vizsgálatok |
| tünetek/ | - szorongás a bizonytalanságtól, a | körül. |
| betegségjelzők | kivizsgálás eredményétől | Pszichológiai szűrés és krízisintervenció a |
| megjelenése, | - depresszív tünetek, | korai szakaszban is: |
| kivizsgálás | - tagadás, | A pszichológus legyen elérhető már ebben |
| - kognitív torzítások, | a fázisban, a vizsgálatot végző szakemberek | |
| - A betegség belátásának hiánya (különösen | kapjanak segítséget az esetleges szélsőséges | |
| ha komorbid pszichiátriai zavar áll fenn) a | reakciók körültekintő és tapintatos | |
| további segítség/vizsgálat elutasításával is | kezeléséhez, a pszichiátriai zavarok | |
| járhat. | meglétének felismeréséhez. | |
| Amennyiben szükséges, hozzátartozók | ||
| segítése. | ||
| Szövettani | - Distressz erősödése, | Szupportáció, kommunikációs problémák |
| vizsgálat | - szorongás a testi integritás "áttörésétől", | segítése, kríziskezelés, relaxációs |
| /biopsia/ | - félelem a fájdalomtól | technikák alkalmazása. |
| Diagnózisközlés, informatív, mindenre kiterjedő kezelés- megbeszélés | - fokozott szorongás, - depresszív tünetek, - halálfélelem, - érzelmi hullámzás, - felfokozott érzelmi reakciók a maradandó testi elváltozások lehetőségére. - szenzitivitás fokozódása, - tagadás, - lelki disszociáció, - beszűkült tudati állapot, - impulzivitás, szuggesztibilitás, - döntésképtelenség, - kognitív és kommunikációs zavarok, - poszttraumás stresszbetegség (PTSD), - megváltozott viselkedés, - pszichofiziológiai tünetek, - kapcsolati problémák. - Az esetleges pszichiátriai komorbiditás további komplikációkat generálhat. (Az énkép és a jövőkép összeomlása, a kapcsolatokba vetett bizalom elvesztése, reménytelenség érzése, melyek együttes és tartós fennállása suicidumhoz vezethet.) | Akut stressz kezelése, onkopszichológus elérhetőségének biztosítása mind a beteg, mind hozzátartozói számára. Önkéntes, komplex pszichoszociális szűrővizsgálat elvégzése (szociodemográfiai adatok, esetleges pszichológiai/pszichiátriai kísérőbetegségek adatai, depresszió, szorongás és társas támogatottság mértékének felmérése pl. BDI, STAI kérdőívek használatával.) A vizsgálat alapján a megfelelő onkopszichológiai intervenciók egyénre szabása. |
| Onkoterápia - Műtét (lobectomia, thyreoidectomia) | A beteg szövetek műtéti úton való részleges vagy teljes elvesztése fizikai és lélektani traumával jár. A nehezen eltakarható torzulás, illetve funkcionális károsodás (nyelési nehézség, fájdalom) a beteg önképét és társadalmi beilleszkedési lehetőségét mélyebben érintheti | A megváltozott testkép megfelelő kezelése az intervenciók fókuszában (pszichoedukáció, szupportív terápia). A család együttműködése nagymértékben könnyíti a beteg alkalmazkodását az új helyzethez. (családterápia, rendszer szemléletű egyéni tanácsadás). |
| Onkoterápia - Radiojód ablációs kezelés | - Sugárkezelés megkezdése előtte normatív jelenség a szorongás fokozódása, mely irányulhat magára a kezelésre (izoláció, mellékhatások, "sugárfertőzéssel" kapcsolatos félelmek), valamint a kezelést követő otthoni izolációs időszakra (fantáziált és valós veszély elkülönítésének nehézsége a közvetlen környezettel kapcsolatban pl. házastárs, gyermekek sugárterhelése, ha megöleli) - A kezelés okán bevezetett dietetikai változtatások a veszteség élményt egy megfoghatóbb, praktikus szintre emelik, így a kapcsolódó érzelmek felszínközelebbivé válhatnak - Palliatív besugárzás esetén csalódás és kudarcélmény, amennyiben az elvárt fájdalomcsillapító hatás elmarad | Pszichoedukációs csoportfoglalkozás/ felkészítés a várható kezelés menetéről, a mellékhatásokról, azok menedzseléséről (átkeretezés, figyelemelterelési technikák elsajátítása), illetve az otthoni (rehabilitációs) időszakkal kapcsolatos félelmek, túlzó fantáziák racionalitással való egyeztetése. Személyre szabott relaxációs technikák elsajátítása |
| Onkoterápia - Hormonterápia | - érzelmi instabilitás, - súlygyarapodás, 'fatigue'-krónikus fáradtság - átmeneti affektív zavar (mélyülő hangulat, szorongás, depresszív tünetek) - döntési nehézségek, fokozódó szorongás - kognitív zavarok | Pszichoedukatív csoportfoglalkozások tartása, egyéni konzultáció keretében pszichoedukációbiztosítása a fizikális mellékhatások menedzselésének megkönnyítésére Kognitív teljesítményromlás esetén az önmegfigyelés vagy a hozzátartozó jelzése esetén neuropszichológiai kivizsgálás javasolt |
| Onkoterápia - kemoterápia | Kemoterápia, gyógyszeres terápiák mellékhatásai - ismert daganatellenes gyógyszermellékhatások - idegrendszeri és mozgásszervi tünetek: - fáradékonyság tünetegyüttes, posztkemoterápiás tünetegyüttes, fájdalom szindróma - alvászavarok, pszichiátriai zavarok (pl. depresszió) - általános lehangoltság, jövőkép elvesztése, magára maradottság érzés - önértékelési zavarok - PTSD | Aktív kemoterápia alatt szupportív követés javasolt. Ha a beteg fizikai állapota lehetővé teszi, akkor nagyon hatékony és ajánlott stresszcsökkentési mód az éber figyelmen alapuló Mindfulness based technikák megtanítása (csoportos illetve egyéni formában). |
| Tartós tünetmentesség | - alkalmazkodási nehézségek, - kondicionálódott pszichogén mellékhatások fennmaradása, - krónikus fáradtság, - Damoklész kardja szindróma, - PTSD, - szenvedélybetegség kialakulása/ felerősödése, - pszichofiziológiai tünetek jelentkezése, fennmaradása - hipochondria | Ambuláns pszichoterápiás gondozás javasolt a betegség feldolgozására, a megküzdési stratégiák tudatos alkalmazásának megerősítéséhez, önismereti munkához. Egyéni, csoportos, család és párterápiák. Relaxációs technikák, edukáció a mellékhatások menedzselése kapcsán Mindfulness based módszerek alkalmazása, amely lehetővé teszi egy új életmód kialakítását és begyakorlását. |
| Visszaesés | - érzelmi krízis, - düh, - szorongás, depresszió, - halálfélelem, - alkalmazkodási/megküzdési nehézségek | Stresszcsökkentés, szupportáció, életminőség javítását célzó intervenciók, krízisintervenció |
| Palliatív terápia | - érzelmi krízis, - düh, - szorongás, depresszió, - halálfélelem, - alkalmazkodási/megküzdési nehézségek | Stresszcsökkentés, szupportáció, életminőség javítását célzó intervenciók, pasztorálterápia, spirituális kísérés, telefon/skype útján történő speciális segítségnyújtás. |
| Terminális állapot | Bio-pszicho-szocio-spirituális válság szakaszai: - elutasítás, - alkudozás, - szorongás, - depresszió, - halálfélelem, - megbékélés. | Stresszcsökkentés, szupportáció a családtagok számára is, életminőség javítását célzó intervenciók, spirituális kísérés. |
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
1.4. Algoritmusok
1. ábra: A DTC terápiamonitorozását szolgáló laboratóriumi vizsgálatok folyamata.
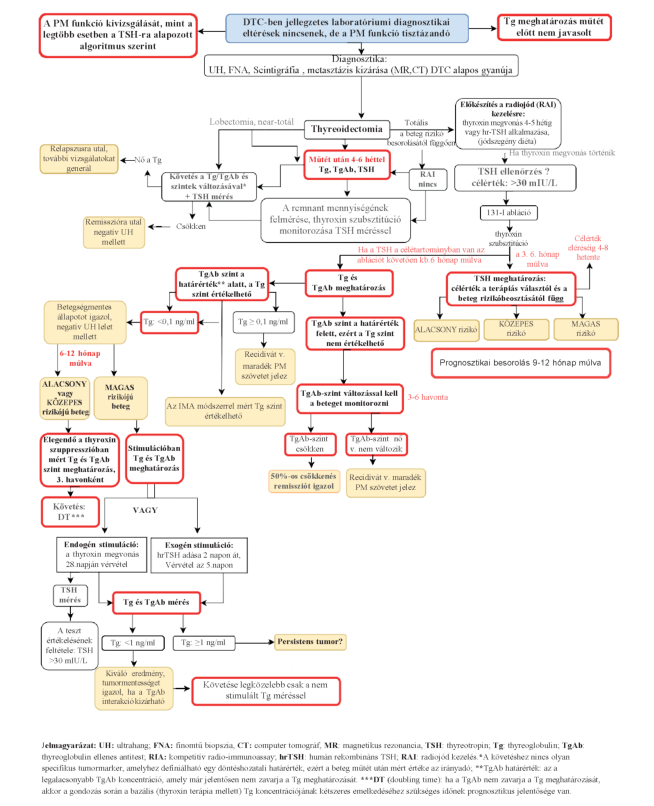
Forrás: a Fejlesztő munkacsoport által jóváhagyott ad hoc szakértői javaslat
1.5. Egyéb dokumentumok
2. ábra: A nyaki régiók bemutatása: Level I-VI.
Forrás: 2015 American Thyroid Associât ion Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Tyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer


