32006L0086[1]
A Bizottság 2006/86/EK irányelve ( 2006. október 24. ) a 2004/23/EK európai parlamenti és tanácsi irányelvnek a nyomonkövethetőségi követelmények, a súlyos szövődmények és káros események bejelentése, valamint az emberi szövetek és sejtek kódolására, feldolgozására, konzerválására, tárolására és elosztására vonatkozó egyes technikai követelmények tekintetében történő végrehajtásáról
A BIZOTTSÁG 2006/86/EK IRÁNYELVE
(2006. október 24.)
a 2004/23/EK európai parlamenti és tanácsi irányelvnek a nyomonkövethetőségi követelmények, a súlyos szövődmények és káros események bejelentése, valamint az emberi szövetek és sejtek kódolására, feldolgozására, konzerválására, tárolására és elosztására vonatkozó egyes technikai követelmények tekintetében történő végrehajtásáról
(EGT vonatkozású szöveg)
AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA,
tekintettel az Európai Közösséget létrehozó szerződésre,
tekintettel az emberi szövetek és sejtek adományozására, gyűjtésére, vizsgálatára, feldolgozására, konzerválására, tárolására és elosztására vonatkozó minőségi és biztonsági előírások megállapításáról szóló, 2004. március 31-i 2004/23/EK európai parlamenti és tanácsi irányelvre ( 1 ) és különösen annak 8. cikkére, 11. cikkének (4) bekezdésére és 28. cikkének a), c), g) és h) pontjára,
mivel:
(1) A 2004/23/EK irányelv meghatározza az emberi felhasználásra szánt emberi szövetek és sejtek, valamint az emberi felhasználásra szánt, emberi szövetekből és sejtekből előállított termékek adományozására, gyűjtésére, vizsgálatára, feldolgozására, konzerválására, tárolására és elosztására alkalmazandó minőségi és biztonsági előírásait az emberi egészség magas szintű védelmének biztosítása érdekében.
(2) A betegségek az emberi felhasználásra szánt emberi szövetek és sejtek által történő átvitelének megakadályozása, valamint a minőségi és biztonsági előírások megfelelő szintjének biztosítása érdekében a 2004/23/EK irányelv az emberi szövetek és sejtek felhasználási folyamatának minden egyes lépésére vonatkozóan speciális technikai követelményeket állapít meg, köztük a szövetfeldolgozó és -tároló egységek minőségbiztosító rendszerére vonatkozó szabványokat és előírásokat.
(3) A 2004/23/EK irányelvvel összhangban és az emberi egészség magas szintű védelmének biztosítása érdekében a szövetfeldolgozó és -tároló egységek, valamint az ezekben zajló előkészítő folyamatok tekintetében a tagállamokban akkreditáló, kijelölő, felhatalmazó vagy engedélyező rendszert kell bevezetni. E rendszerre technikai követelményeket kell megállapítani.
(4) A szövetfeldolgozó és -tároló egységek akkreditálására, kijelölésére, felhatalmazására vagy engedélyezésére vonatkozó követelményeknek a szervezeti felépítésre és irányításra, a személyzetre, a berendezésekre és anyagokra, a létesítményekre/helyszínekre, a dokumentációra, a nyilvántartásokra, valamint a minőség-ellenőrzésre is ki kell terjedniük. Az akkreditált, kijelölt, felhatalmazott vagy engedélyezett szövetfeldolgozó és -tároló egységeknek az általuk elvégzett speciális tevékenységhez kiegészítő követelményeknek is meg kell felelniük.
(5) A szövetek és sejtek feldolgozásakor szükséges levegőminőségre vonatkozó előírás olyan kulcsfontosságú tényező, amely befolyásolhatja a szövetek vagy sejtek szennyeződésének kockázatát. Általános követelmény az olyan minőségű levegő, amelynek részecske- és mikrobaszáma megfelel a helyes gyártási gyakorlatra vonatkozó európai iránymutatások 1. mellékletében és a 2003/94/EK bizottsági irányelvben ( 2 ) meghatározott A. osztály vonatkozó adatainak. Ugyanakkor bizonyos helyzetekben az A. osztály előírásainak megfelelő részecske- és mikrobaszámú levegő minősége nem megfelelő. Ilyen esetekben igazolni és dokumentálni kell, hogy a választott környezet megfelel az érintett szövet- és sejttípusok, valamint a folyamat és emberi felhasználás vonatkozásában előírt minőségi és biztonsági követelményeknek.
(6) Ezen irányelv alkalmazási körébe kell vonni az emberi szövetek és sejtek minőségét és biztonságát a kódolás, feldolgozás, konzerválás, tárolás, valamint azon egészségügyi létesítmény felé való elosztás során, amelyekben e szöveteket és sejteket emberi testen vagy testben alkalmazzák. Ezzel szemben ezen irányelv alkalmazása nem terjed ki e szövetek és sejtek humán célú felhasználására, azaz az implantációs sebészetre, a vérátömlesztésre, a megtermékenyítésre vagy az embrióátültetésre. Ezen irányelvnek a nyomon követhetőségre, valamint a súlyos szövődmények és káros események bejelentésére vonatkozó rendelkezései az emberi szövetek és sejtek 2006/17/EK bizottsági irányelvben ( 3 ) szabályozott adományozására, gyűjtésére és vizsgálatára is vonatkoznak.
(7) A szövetek és sejtek humán célú felhasználása magában hordozza betegségek átvitelének és a recipiensekben fellépő egyéb lehetséges káros szövődmények előfordulásának kockázatát. E hatások ellenőrzése és csökkentése érdekében a nyomon követhetőségre vonatkozóan különleges követelményeket, valamint a súlyos szövődmények, és súlyos káros események bejelentésére szolgáló közösségi eljárást kell megállapítani.
(8) A donornál vagy recipiensnél felmerülő súlyos szövődmény gyanúját, valamint a szövetek és a sejtek adományozásától az elosztásáig felmerülő, azok minőségét és biztonságát befolyásoló azon súlyos káros eseményeket, amelyek vélhetően az emberi szövetek és sejtek gyűjtésére - beleértve a donor értékelését és kiválasztását -, vizsgálatára, feldolgozására, konzerválására, tárolására és elosztására vezethetők vissza, haladéktalanul jelenteni kell az illetékes hatóságnak.
(9) Súlyos káros szövődmények az élő donoroktól való gyűjtés alatt vagy után, illetve az emberi felhasználás során vagy azt követően figyelhetők meg. E szövődményeket - további vizsgálat és az illetékes hatóságok felé tett bejelentés céljából - jelenteni kell az érintett szövetfeldolgozó és -tároló egységnek. Ez nem zárja ki azt, hogy a gyűjtést végző szervezet vagy az emberi felhasználásért felelős szervezet - amennyiben úgy kívánja - maga is közvetlen bejelentést tegyen az illetékes hatóság felé. Ezen irányelvnek meg kell határoznia az illetékes hatóságok számára minimálisan bejelentendő adatokat, a tagállamok abbéli lehetőségének sérelme nélkül, hogy területükön az EK-szerződés követelményeinek megfelelő, még szigorúbb védő intézkedéseket tarthatnak fenn vagy vezethetnek be.
(10) Az átvitel költségeinek minimalizálása, az átfedések elkerülése és a hatékonyabb adminisztráció érdekében korszerű technológiákat és e-kormányzati megoldásokat kell alkalmazni az információk átadásával és kezelésével kapcsolatos feladatok ellátásához. E technológiáknak a referenciaadatok kezelésére alkalmas rendszert használó szabványos adatcsere-formátumokon kell alapulniuk.
(11) A nyomon követhetőség, valamint a szövetek és sejtek főbb jellemzőiről és tulajdonságairól szóló információáramlás megkönnyítése érdekében meg kell állapítani az egységes európai kódolási rendszerben feltüntetendő alapvető adatokat.
(12) Ez az irányelv tiszteletben tartja az alapvető jogokat, és mindenekelőtt betartja az Európai Unió alapjogi chartája által elismert elveket.
(13) Az ezen irányelvben előírt intézkedések összhangban állnak a 2004/23/EK irányelv 29. cikkével felállított bizottság véleményével,
ELFOGADTA EZT AZ IRÁNYELVET:
1. cikk
Alkalmazási kör
(1) Ezt az irányelvet az alábbiak kódolására, feldolgozására, konzerválására, tárolására és elosztására kell alkalmazni:
a) emberi felhasználásra szánt emberi szövetek és sejtek; és
b) az emberi felhasználásra szánt, emberi szövetekből és sejtekből előállított termékek, amennyiben e termékekre más irányelvek nem vonatkoznak.
(2) A követhetőségre, valamint a súlyos szövődmények és káros események bejelentésére vonatkozó és ezen irányelv 5-9. cikkében szereplő rendelkezéseket az emberi szövetek és sejtek adományozásával, gyűjtésével és vizsgálatával kapcsolatban is alkalmazni kell.
2. cikk
Fogalommeghatározások
Ezen irányelvvel kapcsolatban a következő fogalommeghatározások használandók:
a) "reproduktív sejtek": az asszisztált reprodukció céljára történő felhasználásra szánt valamennyi szövet és sejt;
b) "partnerek közötti adományozás": reproduktív sejtek adományozása olyan férfi és nő között, akik állításuk szerint intim testi kapcsolatban állnak;
c) "minőségbiztosítási rendszer": a minőségirányítás végrehajtására szolgáló szervezeti felépítés, körülhatárolt felelősségi körök, eljárások, folyamatok és erőforrások, amely magában foglal a minőséghez közvetlenül vagy közvetve hozzájáruló minden tevékenységet;
d) "minőségirányítás": egy szervezet minőségi vonatkozású irányítására és ellenőrzésére szolgáló összehangolt tevékenységek;
e) "szabványos műveleti eljárások" (Standard Operating Procedures, SOPs): egy adott folyamat lépéseit bemutató írott utasítások - beleértve a felhasználandó anyagokat és módszereket, valamint a várható végterméket is;
f) "validálás" (berendezések, illetve környezetek esetében "minősítés"): olyan dokumentált bizonyítékok létrehozása, amelyek nagy biztonsággal igazolják, hogy egy adott folyamat, berendezés vagy környezet következetesen az előre meghatározott előírásoknak és minőségi tulajdonságoknak megfelelő terméket fog eredményezni; valamely folyamat validálása annak igazolása céljából történik, hogy a rendszer a kitűzött célnak megfelelően hatékonyan működik;
g) "nyomon követhetőség": képesség a szövet/sejt hollétének meghatározására és azonosítására a gyűjtéstől a feldolgozáson, vizsgálaton és tároláson keresztül a recipiens számára történő eljuttatásig vagy a megsemmisítésig tartó folyamat bármely lépése során, ami magában foglalja a donor és a szövetfeldolgozó és -tároló egység vagy a szöveteket/sejteket fogadó, feldolgozó, illetve tároló gyártóüzem azonosításának képességét, valamint a recipiens(ek) azonosításának képességét abban/azokban az egészségügyi intézményben/intézményekben, amely(ek) a szöveteket/sejteket a recipiens(ek)nél felhasználja/felhasználják; a nyomon követhetőség kiterjed az e szövetekkel/sejtekkel érintkezésbe kerülő termékekkel és anyagokkal kapcsolatos minden lényeges adat meghatározásának és azonosításának képességére is;
h) "kritikus": ami hatással lehet a szövetek és sejtek minőségére és/vagy biztonságára, illetve azokkal érintkezhet;
i) "gyűjtő szervezet": azon egészségügyi intézmény vagy kórházi egység, illetve egyéb olyan testület, amely emberi szövetek és sejtek gyűjtését végzi, de nem feltétlenül akkreditált, kijelölt, jóváhagyott vagy engedélyezett szövetfeldolgozó és -tároló egység;
j) "emberi felhasználásért felelős szervezet": olyan egészségügyi létesítmény vagy kórházi egység, vagy egyéb intézmény, amely emberi szöveteket és sejteket emberi célra használ fel;
k) "egységes európai kód" vagy "SEC" (Single European Code) az Unióban elosztott szövetekre és sejtekre alkalmazott egyedi azonosító. Az egységes európai kód tartalmazza az adományozásazonosító karaktersort, valamint a termékazonosító karaktersort az e melléklet VII. mellékletében részletezettek szerint;
l) "adományozásazonosító karaktersor" az egységes európai kód első része, amely az uniós szövetfeldolgozó és -tároló egység kódjából, valamint az egyedi adományozási számból áll;
m) "uniós szövetfeldolgozó és -tároló egység kódja" akkreditált, kijelölt, jóváhagyott vagy engedélyezett uniós szövetfeldolgozó és -tároló egység egyedi azonosítója. A szövetfeldolgozó és -tároló egység kódja az ISO-országkódból és a szövetfeldolgozó és -tároló egységnek a szövetfeldolgozó és -tároló egységek uniós gyűjteményében meghatározott számából áll az ezen irányelv VII. mellékletében részletezettek szerint;
n) "egyedi adományozási szám" szövetek és sejtek adományozásának konkrét esetéhez rendelt egyedi szám az adott tagállamban az ilyen számok hozzárendelésére vonatkozóan érvényes rendszernek megfelelően, az ezen irányelv VII. mellékletében részletezettek szerint;
o) "termékazonosító karaktersor" az egységes európai kód második része, amely a termékkódból, az altételek számából és a lejárati időből áll;
p) "termékkód" a szóban forgó szövet és sejt konkrét típusát meghatározó azonosító. A termékkód a szövetfeldolgozó és -tároló egység által használt kódolási rendszert jelző termékkódrendszer-azonosítóból ("E" az EUTC, "A" az ISBT128, "B" az Eurocode esetében) és az érintett kódolási rendszerben a terméktípushoz tartozó szövet- és sejttermékszámból áll;
q) "altételek száma" olyan szám, amely megkülönbözteti és egyedileg azonosítja az ugyanazon egyedi adományozási számmal és ugyanazzal a termékkóddal rendelkező, ugyanazon szövetfeldolgozó és -tároló egységből származó szöveteket és sejteket az ezen irányelv VII. mellékletében részletezettek szerint;
r) "lejárati idő" az a dátum, ameddig a szövetek és sejtek felhasználhatók, az e melléklet VII. mellékletében részletezettek szerint;
s) "uniós kódolási platform" ottság által üzemeltetett informatikai platform, amely magában foglalja a szövetfeldolgozó és -tároló egységek uniós gyűjteményét, valamint a szövet- és sejttermékek uniós gyűjteményét;
t) "szövetfeldolgozó és -tároló egységek uniós gyűjteménye" a tagállamok illetékes hatósága(i) által akkreditált, kijelölt, felhatalmazott vagy engedélyezett valamennyi szövetfeldolgozó és -tároló egység gyűjteménye, amely információkat tartalmaz ezekről az egységekről az ezen irányelv VII. mellékletében részletezettek szerint;
u) "szövet- és sejttermékek uniós gyűjteménye" az Unióban forgalomban lévő szövetek és sejtek valamennyi típusának és a három megengedett kódolási rendszer (EUTC, ISBT128 és Eurocode) szerinti megfelelő termékkódoknak a gyűjteménye;
v) "EUTC" az Unió által a szövetekre és sejtekre vonatkozóan kifejlesztett termékkódrendszer, amely az Unióban megtalálható szövetek és sejtek valamennyi típusának és a megfelelő termékkódoknak a nyilvántartása;
w) "forgalomba bocsátott" emberi felhasználás céljából elosztott vagy egy másik szereplőnek továbbított, például további feldolgozásra, akár visszakerül-e a termék, akár nem;
x) "ugyanazon a központon belül" a gyűjtéstől az emberi felhasználásig tartó folyamat összes lépése ugyanannak a személynek a felelőssége alatt, ugyanannak a minőségbiztosítási rendszernek és nyomonkövethetőségi rendszernek a keretében történik olyan egészségügyi központban, amely egyazon helyen legalább egy akkreditált, kijelölt, felhatalmazott vagy engedélyezett szövetfeldolgozó és -tároló egységet, valamint egy emberi felhasználásért felelős szervezetet foglal magában;
y) "egyesítés (poolozás)" ugyanazon donortól egynél több gyűjtésből, illetve két vagy több donortól származó szövetek és sejtek fizikai kontaktusa vagy keveredése egyetlen tartályban.
3. cikk
A szövetfeldolgozó és -tároló egységek akkreditálására, kijelölésére, felhatalmazására vagy engedélyezésére vonatkozó követelmények
Az adott szövetfeldolgozó és -tároló egységnek teljesítenie kell az I. mellékletben megállapított követelményeket.
4. cikk
A szövet- és sejtelőkészítő folyamatok akkreditálására, kijelölésére, felhatalmazására és engedélyezésére vonatkozó követelmények
A szövetfeldolgozó és -tároló egységekben zajló előkészítő folyamatoknak a II. mellékletben megállapított követelményeknek kell eleget tennie.
5. cikk
A súlyos szövődmények bejelentése
(1) A tagállamok biztosítják az alábbiakat:
a) a gyűjtést végző szervezeteknél álljanak rendelkezésre a begyűjtött szövetek és sejtek nyilvántartásához, valamint az ahhoz szükséges eljárások, hogy élő donornál felmerülő és a szövetek és a sejtek minőségét és biztonságát esetlegesen befolyásoló bármely súlyos szövődményt haladéktalanul bejelentsenek a szövetfeldolgozó és -tároló egységeknek;
b) a szövetek és sejtek emberi felhasználásért felelős szervezeteknél álljanak rendelkezésre azok az eljárások, amelyek szükségesek a felhasznált szövetek és sejtek nyilvántartásához, valamint a klinikai felhasználás során vagy azt követően észlelt, a szövetek és a sejtek minőségével és biztonságával esetlegesen összefüggő bármely súlyos szövődmény haladéktalan bejelentéséhez a szövetfeldolgozó és -tároló egységek részére;
c) az emberi felhasználásra szánt szöveteket és sejteket elosztó szövetfeldolgozó és -tároló egységek tájékoztassák a szövetek és sejtek emberi felhasználásáért felelős szervezetet a b) pontban előírt súlyos szövődmények bejelentésekor követendő eljárásról.
(2) A tagállamok biztosítják, hogy a szövetfeldolgozó és -tároló egységek:
a) rendelkezzenek azokkal az eljárásokkal, amelyek segítségével az (1) bekezdés a) és b) pontjában előírt, súlyos szövődmény gyanújával kapcsolatos valamennyi lényeges és rendelkezésre álló információról haladéktalanul tájékoztatni tudják az illetékes hatóságot;
b) rendelkezzenek a szükséges eljárásokkal, amelyek segítségével az illetékes hatóságot haladéktalanul tájékoztatni tudják az okok és következmények elemzését célzó vizsgálat következtetéseiről.
(3) A tagállamok biztosítják az alábbiakat:
a) a 2004/23/EK irányelv 17. cikkében említett felelős személy értesítse az illetékes hatóságot a III. melléklet A. részében feltüntetett bejelentésben szereplő információkról;
b) a szövetfeldolgozó és -tároló egységek értesítik az illetékes hatóságot az emberi felhasználásra elosztott szövetek és sejtek tekintetében hozott egyéb intézkedésekről;
c) a szövetfeldolgozó és -tároló egységek legalább a III. melléklet B. részében szereplő információk megadásával értesítik az illetékes hatóságot a vizsgálat következtetéseiről.
6. cikk
A súlyos káros események bejelentése
(1) A tagállamok biztosítják az alábbiakat:
a) rendelkezzenek azokkal az eljárásokkal, amelyek szükségesek a begyűjtött szövetek és sejtek nyilvántartásához és a gyűjtés során felmerülő és az emberi szövetek és a sejtek minőségét és/vagy biztonságát esetlegesen befolyásoló bármely súlyos káros esemény haladéktalan bejelentéséhez a szövetfeldolgozó és -tároló egységek részére;
b) a szövetek és sejtek emberi felhasználásáért felelős szervezetek rendelkezzenek az ahhoz szükséges eljárásokkal, hogy a szövetfeldolgozó és -tároló egységeket haladéktalanul értesítsék a szövetek és a sejtek minőségét és biztonságát esetlegesen befolyásoló bármely súlyos káros eseményről;
c) a szövetfeldolgozó és -tároló egységek tájékoztatják az emberi felhasználásért felelős szervezeteket arról, hogyan kell e szervezeteknek a szövetek és sejtek minőségét és biztonságát esetlegesen befolyásoló súlyos káros eseményeket számukra bejelenteni.
(2) Asszisztált reprodukció esetén az ivarsejtek vagy az embriók bármely téves azonosítását vagy felcserélését súlyos káros eseménynek kell tekinteni. Az ilyen eseteket az asszisztált reprodukciót végző valamennyi személynek, gyűjtést végző, vagy az emberi felhasználásért felelős szervezetnek vizsgálat és az illetékes hatóság értesítése céljából jelentenie kell a beszállító szövetfeldolgozó és -tároló egységek felé.
(3) A tagállamok biztosítják, hogy a szövetfeldolgozó és -tároló egységek:
a) rendelkezzenek azokkal az eljárásokkal, amelyekkel az (1) bekezdés a) és b) pontjában előírt súlyos káros esemény gyanújával kapcsolatos valamennyi lényeges és rendelkezésre álló információról haladéktalanul tájékoztatják az illetékes hatóságot;
b) rendelkezzenek azokkal az eljárásokkal, amelyekkel haladéktalanul tájékoztatják az illetékes hatóságot az okok és következmények elemzését célzó vizsgálat következtetéseiről.
(4) A tagállamok biztosítják az alábbiakat:
a) a 2004/23/EK irányelv 17. cikkében említett felelős személy értesítse az illetékes hatóságot a IV. melléklet A. részében feltüntetett bejelentésben szereplő információkról;
b) a szövetfeldolgozó és -tároló egységek a folyamat során elkerülhető okok meghatározása érdekében értékeljék a súlyos káros eseményeket;
c) a szövetfeldolgozó és -tároló egységek a IV. melléklet B. részében szereplő minimálisan szükséges információk közlésével értesítsék az illetékes hatóságot a vizsgálat következtetéseiről.
7. cikk
Éves jelentések
(1) A tagállamok legkésőbb a következő év június 30-ig éves jelentést nyújtanak be a Bizottságnak az illetékes hatósághoz a súlyos szövődményekkel és káros eseményekkel kapcsolatban beérkezett bejelentésekre vonatkozóan. A Bizottság a tagállamok illetékes hatóságainak elküldi a beérkezett jelentések összefoglalóját. Az illetékes hatóság e jelentést a szövetfeldolgozó és -tároló egységek számára hozzáférhetővé teszi.
(2) Az adatátvitel az V. melléklet A. és B. részében meghatározott, az adatcserére vonatkozó formai előírások szerint történik, és minden olyan információt tartalmaz, amely a küldő azonosításához és a rá vonatkozó referenciaadatok naprakésszé tételéhez szükséges.
8. cikk
Információközlés az illetékes hatóságok között és a Bizottság felé
A tagállamok biztosítják, hogy illetékes hatóságaik a súlyos szövődményre és káros eseményre vonatkozó minden információt közöljenek egymás és a Bizottság felé a megfelelő intézkedések meghozatalának biztosítása érdekében.
9. cikk
Nyomonkövethetőség
(1) A tagállamok biztosítják, hogy a szövetek és sejtek a gyűjtéstől az emberi felhasználásig vagy az ártalmatlanításig és visszafelé is, dokumentáció és az egységes európai kód használata révén nyomonkövethetőek legyenek. A fejlett terápiás gyógyszerkészítményekhez felhasznált szöveteknek és sejteknek ezen irányelv értelmében legalább addig nyomonkövethetőknek kell lenniük, amíg átkerülnek az említett készítmények gyártóihoz.
(2) A tagállamok biztosítják, hogy a szövetfeldolgozó és -tároló egységek és az emberi felhasználásért felelős szervezetek legalább 30 évig megfelelő és olvasható adathordozón megőrizzék a VI. mellékletben meghatározott adatokat.
(3) Amikor az elhunyt donor testéből két vagy több szövetfeldolgozó és -tároló egység számára dolgozó csapat veszi ki a szöveteket és sejteket, a tagállamoknak gondoskodniuk kell megfelelő nyomonkövethetőségi rendszerről a különböző gyűjtő szervezetek között.
10. cikk
Európai kódolási rendszer
(1) E cikk (2) vagy (3) bekezdésének sérelme nélkül az egységes európai kódot az emberi felhasználás céljából elosztott valamennyi szövetre és sejtre alkalmazni kell. A szövetek és sejtek más célú forgalomba bocsátása esetén alapkövetelményként legalább a kísérő dokumentációnak tartalmaznia kell az adományozásazonosító karaktersort.
(2) Az (1) bekezdés nem alkalmazandó a következőkre:
a) ivarsejtek partnerek közötti adományozása;
b) a 2004/23/EK irányelv 6. cikkének (5) bekezdésének megfelelően azonnali transzplantáció céljából közvetlenül a recipienshez eljuttatott szövetek és sejtek;
c) a 2004/23/EK irányelv 9. cikke (3) bekezdésének b) pontjának megfelelően sürgős esetekben az illetékes hatóság(ok) közvetlen engedélyével az Unióba behozott szövetek és sejtek.
(3) A tagállamok az (1) bekezdésben előírt követelmények alól mentesíthetik továbbá a következőket:
a) a partnerek közötti adományozásra szánt ivarsejteken kívüli szövetek és sejtek, ha azok ugyanabban a központban maradnak;
b) az Unióba behozott szövetek és sejtek, ha azok a behozataltól a felhasználásig ugyanabban a központban maradnak, feltéve, hogy a központ rendelkezik az importtevékenységek elvégzésére akkreditált, kijelölt, felhatalmazott vagy engedélyezett szövetfeldolgozó és -tároló egységgel.
10a. cikk
Az egységes európai kód formátuma
(1) A 10. cikk (1) bekezdésben említett egységes európai kódnak meg kell felelnie az e cikkben és a VII. mellékletben meghatározott előírásoknak.
(2) Az egységes európai kódnak szabad szemmel olvashatónak kell lennie és azt a "SEC" rövidítés előzi meg. Párhuzamosan más címke vagy nyomonkövethetőségi rendszer használata is megengedett.
(3) Az egységes európai kódot úgy kell feltüntetni, hogy az adományozásazonosító karaktersort és a termékazonosító karaktersort vagy egyetlen szóköz választja el egymástól, vagy azok két egymást követő sorban szerepelnek.
10b. cikk
Az egységes európai kód alkalmazásával kapcsolatos követelmények
(1) A tagállamok biztosítják, hogy a szövetfeldolgozó és -tároló egységek - beleértve az (EU) 2015/566 bizottsági irányelv ( 4 ) által meghatározott importáló szövetfeldolgozó és -tároló egységeket is - megfeleljenek a következő minimumkövetelményeknek:
a) legkésőbb az emberi felhasználás céljából való elosztás előtt egységes európai kódot rendelnek minden olyan szövethez és sejthez, amely esetében ilyen kódot kell alkalmazni;
b) adományozásazonosító karaktersort rendelnek a szövetekhez és sejtekhez azok gyűjtését követően vagy a gyűjtő szervezettől való beérkezésükkor vagy egy harmadik országbeli szállítótól való behozatalukkor. Az adományozásazonosító karaktersor a következőkből áll:
(1) az uniós szövetfeldolgozó és -tároló egység kódja a szövetfeldolgozó és -tároló egységek uniós gyűjteménye szerint,
(2) a szövetfeldolgozó és -tároló egység által kiadott egyedi adományozási szám, kivéve, ha az említett szám kiadása nemzeti szinten, központilag történik vagy ha az - például az ISBT128 kódrendszerben - világszerte használatos egyedi adományozási szám. Ha lehetőség van rá, a szövetek és sejtek egyesítése esetében a végtermékhez új adományozásazonosító számot kell rendelni; az egyes adományok nyomonkövethetőségéről az a szövetfeldolgozó és -tároló egység gondoskodik, amely az egyesítést végzi;
c) nem változtatják meg a már forgalomba bocsátott szövetekhez és sejtekhez rendelt adományozásazonosító karaktersort, kivéve, ha az kódolási hiba javítása miatt szükséges; minden egyes javítást megfelelően kell dokumentálni;
d) legkésőbb az emberi felhasználás céljából való elosztás előtt alkalmazzák a megengedett termékkódolási rendszer egyikét és a szövet- és sejttermékek uniós gyűjteményében található megfelelő szövet- és sejttermékszámot;
e) feltüntetik a megfelelő altétel-számot és a lejárati időt. Azoknak a szöveteknek és sejteknek az esetében, amelyeknél nincs meghatározva lejárati idő, a lejárati idő 00000000, amelyet legkésőbb az emberi felhasználás céljából való elosztás előtt fel kell tüntetni;
f) egy termék emberi felhasználás céljából való elosztása előtt annak címkéjén letörölhetetlen és tartós módon feltüntetik az egységes európai kódot, és azt szerepeltetik a megfelelő kísérő dokumentációban. A szövetfeldolgozó és -tároló egység e feladattal megbízhat harmadik felet, illetve feleket, feltéve, hogy gondoskodik ezen irányelv rendelkezéseinek betartásáról, különös tekintettel a kód egyediségére. Ha a címke mérete miatt a címkén nem lehet feltüntetni az egységes európai kódot, a kódnak a kísérő dokumentáció révén egyértelműen kapcsolódnia kell az érintett címkével ellátott szövetekhez és sejtekhez;
g) értesítik az illetékes hatóságot, illetve hatóságokat abban az esetben, ha:
(1) a szövetfeldolgozó és -tároló egységek uniós gyűjteményében található információk aktualizálásra vagy javításra szorulnak;
(2) a szövet- és sejttermékek uniós gyűjteményét aktualizálni kell;
(3) a szövetfeldolgozó és -tároló egység megállapítja, hogy egy másik uniós szövetfeldolgozó és -tároló egységtől kapott szövetek és sejtek vonatkozásában az egységes európai kóddal kapcsolatos követelményeknek való jelentős meg nem felelés esete áll fenn;
h) meghozzák a szükséges intézkedéseket abban az esetben, ha az egységes európai kód helytelenül kerül alkalmazásra a címkén.
(2) A tagállamok gondoskodnak arról, hogy a következő minimumkövetelményeket minden illetékes hatóság alkalmazza:
a) egyedi azonosító számot rendel minden egyes, az érintett tagállamban akkreditált, kijelölt, felhatalmazott vagy engedélyezett szövetfeldolgozó és -tároló egységhez. Ha a szövetfeldolgozó és -tároló egység több különböző konkrét helyszínnel, de az egyedi adományozási számok kiadásához egyetlen rendszerrel rendelkezik, egy és ugyanazon szövetfeldolgozó és -tároló egységnek tekinthető. Ha a szövetfeldolgozó és -tároló egység az egyedi adományozási számok kiadásához két vagy több rendszert használ, az egységnek a használt rendszerek számának megfelelő számú, külön szövetfeldolgozó és -tároló egység kóddal kell rendelkeznie;
b) eldönti, melyik rendszer, illetve rendszerek kerüljenek alkalmazásra az egyedi adományozási számok kiadásához a tagállamában. A megengedett rendszerek között szerepelnek a nemzeti szinten egyedi adományozási számok központi kiadására létrehozott nemzeti rendszerek és olyan rendszerek is, amelyek minden egyes szövetfeldolgozó és -tároló egységtől megkövetelik egyedi adományozási számok kiadását, valamint olyan nemzetközi rendszerek, amelyek az egységes európai kóddal kompatibilis, világszerte használatos egyedi adományozási számokat adnak ki;
c) nyomon követi és biztosítja az egységes európai kód teljes körű alkalmazását az érintett tagállamban;
d) gondoskodik az érintett tagállam szövetfeldolgozó és -tároló egységek uniós gyűjteményében található szövetfeldolgozó és -tároló egységekre vonatkozó adatok validálásáról, és indokolatlan késedelem nélkül naprakésszé teszi a gyűjteményt, különösen a következő helyzetekben:
(1) új szövetfeldolgozó és -tároló egység akkreditációja, kijelölése, jóváhagyása vagy engedélyezése esetén;
(2) ha a szövetfeldolgozó és -tároló egységre vonatkozó információk megváltoznak vagy nem helyesen szerepelnek a szövetfeldolgozó és -tároló egységek uniós gyűjteményében;
(3) ha a szövetfeldolgozó és -tároló egység akkreditációjára, kijelölésére, jóváhagyására vagy engedélyezésére vonatkozó, ezen irányelv VIII. mellékletében felsorolt információk megváltoznak, többek között:
- új szövet- vagy sejttípusra vonatkozó akkreditáció, kijelölés, jóváhagyás vagy engedély,
- új előírt tevékenységre vonatkozó akkreditáció, kijelölés, jóváhagyás vagy engedély,
- valamely engedélyhez fűzött feltételre és/vagy kivételre vonatkozó részletek,
- egy bizonyos tevékenységre, illetve szövet- vagy sejttípusra vonatkozó konkrét akkreditáció, kijelölés, jóváhagyás vagy engedély részleges vagy teljes felfüggesztése,
- egy szövetfeldolgozó és -tároló egységre vonatkozó akkreditáció, kijelölés, jóváhagyás vagy engedély részleges vagy teljes visszavonása,
- olyan helyzetek, amikor valamely szövetfeldolgozó és -tároló egység önként részlegesen vagy teljesen megszünteti az akkreditáció, kijelölés, jóváhagyás vagy engedély által érintett tevékenységet, illetve tevékenységeket.
Az indokolatlan késedelem nélkül kifejezés azt jelenti, hogy az érintett szövetfeldolgozó és -tároló egység akkreditációját, kijelölését, jóváhagyását vagy engedélyét jelentősen befolyásoló változások esetében legkésőbb tíz munkanapon belül.
Amennyiben valamely szövetfeldolgozó és -tároló egység különböző szövet- és sejttípusokra vagy különböző tevékenységekre vonatkozóan két vagy több illetékes hatóságtól kap engedélyt, mindegyik illetékes hatóság gondoskodik a felelősségi körébe tartozó tevékenységekkel kapcsolatos információk naprakésszé tételéről;
e) figyelmezteti egy másik tagállam illetékes hatóságait, ha e tagállammal kapcsolatban helytelen információt észlel a szövetfeldolgozó és -tároló egységek uniós gyűjteményében, vagy ha megállapítja, hogy a másik tagállam vonatkozásában az egységes európai kóddal kapcsolatos rendelkezéseknek való jelentős meg nem felelés esete áll fenn;
f) figyelmezteti a Bizottságot és más illetékes hatóságokat, ha meglátása szerint a szövet- és sejttermékek uniós gyűjteményét aktualizálni kell.
(3) Az egységes európai kód alkalmazása nem zárja ki, hogy a tagállamok nemzeti követelményeivel összhangban további kódok is alkalmazásra kerüljenek.
10c. cikk
Az európai kódolási rendszer elérhetősége és karbantartása
(1) A Bizottság informatikai platformot ("uniós kódolási platform") üzemeltet és tart karban, amely a következőket foglalja magában:
a) a szövetfeldolgozó és -tároló egységek uniós gyűjteménye;
b) a szövet- és sejttermékek uniós gyűjteménye.
(2) A Bizottság biztosítja, hogy az uniós kódolási platformon található információk 2016. október 29. előtt nyilvánosan hozzáférhetők legyenek.
(3) A Bizottság szükség szerint naprakésszé teszi az EUTC-t, és gondoskodik a szövet- és sejttermékek uniós gyűjteményének átfogó naprakésszé tételéről. A Bizottság szükségesnek tartja, hogy az ISBT128 és az Eurocode rendszereket kezelő szervezetekkel megállapodás szülessen arról, hogy a Bizottság rendszeresen megkapja a frissített termékkódokat, hogy azokat fel lehessen venni a szövet- és sejttermékek uniós gyűjteményébe. Ha az említett szervezetek nem felelnek meg az egyetértési megállapodások feltételeinek, a Bizottság - részben vagy teljesen - felfüggesztheti érintett termékkódjaik jövőbeli alkalmazását, miután megbizonyosodott arról, hogy az érintett terméktípusokból - bizonyos átmeneti időszakot figyelembe véve - elegendő mennyiség áll rendelkezésre a tagállamokban, valamint az emberi eredetű anyagokkal foglalkozó illetékes hatóságok szakértői csoportja keretében konzultált a tagállami szakértőkkel.
10d. cikk
Átmeneti időszak
A 2016. október 29-én már tárolás alatt lévő szövetek és sejtek mentesülnek az egységes európai kóddal kapcsolatos követelmények alól, feltéve, hogy a szöveteket és sejteket az Unióban az említett dátumtól számított öt éven belül forgalomba bocsátják, és teljes nyomonkövethetőségük más módon biztosított. Az olyan szövetek és sejtek esetében, amelyek tárolása hosszabb ideig tart és csak az említett öt éves időszak lejárta után kerülnek forgalomba, valamint amelyeken nem lehet alkalmazni az egységes európai kódot - nevezetesen azért, mert tárolásuk mélyhűtéssel történik -, a szövetfeldolgozó és -tároló egységek a kis címkével ellátott termékekre vonatkozó eljárásokat alkalmazzák a 10b. cikk (1) bekezdése f) pontjának megfelelően.
11. cikk
Átültetés
(1) A tagállamok hatályba léptetik azokat a törvényi, rendeleti és közigazgatási rendelkezéseket, amelyek ahhoz szükségesek, hogy ennek az irányelvnek legkésőbb 2007. szeptember 1-jéig megfeleljenek. A tagállamok haladéktalanul közlik a Bizottsággal e rendelkezések szövegét, valamint a rendelkezések és ezen irányelv közötti megfelelést mutató korrelációs táblázatot.
A tagállamok hatályba léptetik azokat a törvényi, rendeleti és közigazgatási rendelkezéseket, amelyek ahhoz szükségesek, hogy ezen irányelv 10. cikkének legkésőbb 2008. szeptember 1-jéig megfeleljenek.
Amikor a tagállamok elfogadják ezeket az intézkedéseket, azokban hivatkozni kell erre az irányelvre, vagy azokhoz hivatalos kihirdetésük alkalmával ilyen hivatkozást kell fűzni. A hivatkozás módját a tagállamok határozzák meg.
(2) A tagállamok közlik a Bizottsággal nemzeti joguk azon főbb rendelkezéseinek szövegét, amelyeket az ezen irányelv által szabályozott területen fogadnak el.
12. cikk
Hatálybalépés
Ez az irányelv az Európai Unió Hivatalos Lapjában való kihirdetésétől számított huszadik napon lép hatályba.
13. cikk
Címzettek
Ennek az irányelvnek a tagállamok a címzettjei.
I. MELLÉKLET
A szövetfeldolgozó és -tároló egységek akkreditálására, kijelölésére, felhatalmazására vagy engedélyezésére vonatkozó, a 3. cikkben említett követelmények
A. SZERVEZETI FELÉPÍTÉS ÉS IRÁNYÍTÁS
1. Ki kell jelölni egy olyan felelős személyt, aki rendelkezik a 2004/23/EK irányelv 17. cikkében előírt képesítésekkel és felelősségi körökkel.
2. Az adott szövetfeldolgozó és -tároló egységnek rendelkeznie kell az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységekhez szükséges szervezeti és működési eljárásokkal, valamint olyan szervezeti ábrával, amely egyértelműen feltünteti az elszámoltathatóság és a jelentéstétel kapcsán fennálló viszonyrendszert.
3. Minden szövetfeldolgozó és -tároló egységhez ki kell rendelni egy orvost, aki a létesítményben zajló orvosi tevékenységekkel - mint a donor kiválasztása, a felhasznált szövetekkel vagy sejtekkel kapcsolatos klinikai eredmények felülvizsgálata, vagy adott esetben a klinikai felhasználókkal folytatott kapcsolattartás - kapcsolatban tanácsot ad, és azokat felügyeli.
4. Az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységekre vonatkozóan - ezen irányelvben meghatározott előírásokkal összhangban - dokumentált minőségirányítási rendszert kell működtetni.
5. A szövetek és a sejtek felhasználási céljának megfelelő minőségi és biztonsági szint fenntartása mellett biztosítani kell a biológiai anyagok felhasználásával és kezelésével együtt járó kockázatok azonosítását és minimalizálását. E kockázatok közé tartoznak különösen az eljárásokkal, a környezettel, a személyzet egészségi állapotával kapcsolatos, a szövetfeldolgozó és -tároló egységre jellemző kockázatok.
6. A szövetfeldolgozó és -tároló egységek és harmadik felek között kötött megállapodásoknak meg kell felelniük a 2004/23/EK irányelv 24. cikkében foglaltaknak. A harmadik felekkel kötött megállapodásokban pontosítani kell a kapcsolatrendszerekre és a felelősségi körökre vonatkozó részletes szabályokat, valamint a teljesítményre vonatkozó előírások teljesítéséhez betartandó szabályokat.
7. Működtetni kell egy, a felelős személy által felügyelt dokumentált rendszert, amely jóváhagyja, hogy a szövetek és/vagy a sejtek - felszabadításuk és elosztásuk érdekében - teljesítik a megfelelő biztonsági és minőségi előírásokat.
8. A tevékenységek valamely okból történő megszüntetése esetén a 2004/23/EK irányelv 21. cikkének (5) bekezdése értelmében megkötött megállapodásokba és elfogadott eljárásokba bele kell építeni a szövetek és sejtek minőségével és biztonságával kapcsolatos követhetőségi adatokat és információkat.
9. Működtetni kell egy dokumentált rendszert, amely az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységek valamennyi szakaszában azonosítani tudja az egyes szövet- és sejtegységeket.
B. SZEMÉLYZET
1. A szövetfeldolgozó és -tároló egységekben dolgozó személyzetnek kellő létszámban kell rendelkezésre állnia, és tagjainak képesítéssel kell rendelkeznie a rájuk bízott feladatok elvégzésére. A személyzet kompetenciáját a minőségbiztosítási rendszerben előírt megfelelő időközönként értékelni kell.
2. A személyzet minden tagjának világos, dokumentált és naprakész munkaköri leírással kell rendelkeznie. Feladataikat, felelősségi köreiket és elszámoltathatóságukat világosan dokumentálni kell, és a személyzetnek mindezekkel tisztában kell lennie.
3. Amennyiben az eljárások változása vagy a tudományos ismeretek előrehaladása megkívánja, a személyzet részére alapképzést és egy frissített anyagú képzést kell szervezni, és az érintett területen megfelelő szakmai fejlődési lehetőségeket kell biztosítani számukra. A képzési programnak biztosítania és dokumentumokkal igazolnia kell, hogy a résztvevők mindegyike:
a) a számára kijelölt feladatok elvégzése során tanúbizonyságot tett hozzáértéséről;
b) a számára kijelölt feladatokkal kapcsolatos tudományos/technikai folyamatokról és elvekről kielégítő ismeretekkel rendelkezik és átlátja azokat;
c) tisztában van a munkahelyéül szolgáló létesítmény szervezeti keretével, minőségbiztosítási rendszerével, egészségügyi és biztonsági szabályaival; és
d) kellő tájékozottsággal rendelkezik munkájának bővebb etikai, jogi, szabályozási vonatkozásairól.
C. BERENDEZÉSEK ÉS ANYAGOK
1. Minden berendezést és anyagot a rendeltetésének megfelelően kell megtervezni és működtetni, és azoknak a recipiensekre és/vagy a személyzetre nézve a lehető legkisebb kockázatot kell jelenteniük.
2. Valamennyi kritikus berendezést és technikai műszert azonosítani és minősíteni kell, valamint a gyártó utasításainak megfelelően rendszeres vizsgálatnak és megelőző karbantartásnak kell alávetni. Amennyiben egy berendezés vagy anyag a feldolgozás vagy a tárolás kritikus paramétereit (pl. hőmérséklet, nyomás, részecskeszám, mikrobiális szennyezés szintje) érinti, azokat azonosítani kell és megfelelő ellenőrzésnek, figyelemfelkeltésnek, riasztásnak és adott esetben korrekciós intézkedéseknek kell alávetni a rendellenességek és hibák feltárása, valamint annak biztosítása érdekében, hogy a kritikus paraméterek mindenkor az elfogadható határokon belül maradjanak. A kritikus mérési tulajdonságú berendezéseket lehetőség szerint azonosítható szabvány szerint kell kalibrálni.
3. Az új és javított berendezéseket működésbe helyezésükkor be kell vizsgálni, és használat előtt minősíteni kell. A vizsgálatok eredményét dokumentálni kell.
4. A kritikus berendezéseket rendszeres időközönként kell karbantartani, szervizelni, tisztítani, fertőtleníteni és sterilizálni, valamint ezeket a lépéseket megfelelően nyilván kell tartani.
5. Minden egyes kritikus berendezéshez működési ismertetőt kell mellékelni, amely részletezi a zavar vagy hiba fellépése esetén követendő lépéseket.
6. Az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységekre vonatkozó eljárásoknak valamennyi kritikus berendezés és reagens esetében részletesen ismertetniük kell az előírásokat. Az előírásokat különösen az adalékanyagokra (pl. oldatok) és a csomagolóanyagokra vonatkozóan kell meghatározni. A kritikus reagenseknek és anyagoknak meg kell felelniük a dokumentált előírásoknak és adott esetben az orvostechnikai eszközökről szóló, 1993. június 14-i 93/42/EGK tanácsi irányelv ( 5 ), valamint az in vitro diagnosztikai orvostechnikai eszközökről szóló, 1998. október 27-i 98/79/EK európai parlamenti és tanácsi irányelv ( 6 ) követelményeinek.
D. LÉTESÍTMÉNYEK/TELEPHELYEK
1. A szövetfeldolgozó és -tároló egységnek megfelelő létesítményekkel kell rendelkeznie az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységek elvégzésére - az ezen irányelvben meghatározott előírásokkal összhangban.
2. Amennyiben e tevékenységek bármelyike a környezeti hatásoknak kitett szövetek és sejtek feldolgozása, azt - a fertőződés (beleértve az adományok közötti keresztfertőződés) veszélyének minimalizálása érdekében - meghatározott minőségű és tisztaságú levegőben kell végrehajtani. Ezen intézkedések hatékonyságát validálni és ellenőrizni kell.
3. Amennyiben a 4. pont másképp nem rendelkezik, ha a szövetek vagy sejtek a feldolgozás alatt környezeti hatásoknak vannak kitéve anélkül, hogy a mikrobák inaktiválását célzó utólagos eljárásra sor kerülne, általános követelmény az olyan minőségű levegő, amelynek részecske- és mikrobaszáma megfelel a helyes gyártási gyakorlatra vonatkozó európai iránymutatások (GMP) 1. mellékletében és a 2003/94/EK irányelvben meghatározott A. osztálynak; emellett a környezetnek idomulnia kell az érintett szövet vagy sejt feldolgozásához, de a részecske- és a mikrobaszám tekintetében legalább a helyes gyártási gyakorlatra vonatkozó európai iránymutatásokban megállapított D. osztálynak kell megfelelnie.
4. A 3. pontban ismertetetteknél kevésbé szigorú környezeti feltételek érvényesek az alábbiak esetében:
a) ha validált mikrobiális inaktiválásra vagy validált végső sterilizálásra kerül sor;
b) vagy ha igazolható, hogy az A. osztályba sorolt környezetnek való kitettség károsan hat az érintett szövet vagy sejt előírt tulajdonságaira;
c) vagy ha igazolható, hogy a szövet vagy sejt recipiensben való felhasználási módja jelentősen alacsonyabb kockázatot jelent a bakteriális vagy gombás fertőzés recipiensre való átvitele szempontjából, mint a sejt- vagy szövetátültetés;
d) vagy amennyiben az előírt folyamat A. osztályba sorolt környezetben való végrehajtása - például a feldolgozásra szolgáló területen az A. osztály kívánalmainak nem teljesen megfelelő speciális berendezés szükségessége miatt - technikailag kivitelezhetetlen.
5. A 4. pont a), b), c) és d) alpontjában szereplő helyzetek esetében pontosítani kell a környezetet. Igazolni és dokumentálni kell, hogy a választott környezetben az előírt minőségi és biztonsági követelmények - legalább a felhasználás célja, módja és a recipiens immunstátusa tekintetében - teljesülnek. A szövetfeldolgozó és -tároló egység minden vonatkozó részlegében rendelkezésre kell állnia a következőknek: a személyvédelmet és a higiéniát szolgáló megfelelő berendezés és védőöltözet, valamint a higiéniáról és a munkaruháról szóló írásos utasítások.
6. Amennyiben az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységek között a szövetek és sejtek tárolása is szerepel, az előírt szövet- és sejttulajdonságok - köztük az olyan lényeges paraméterek, mint a hőmérséklet, páratartalom vagy a levegő minősége - fenntartásához szükséges tárolási körülményeket meg kell határozni.
7. A kritikus paramétereket (pl. hőmérséklet, páratartalom, levegő minősége) ellenőrizni, felülvizsgálni és jegyzőkönyvezni kell annak igazolására, hogy azok megfelelnek az előírt tárolási feltételeknek.
8. A tárolóeszközöknek biztosítaniuk kell, hogy azok a szöveteket és sejteket - felszabadításuk előtt/karantén alá vonásukkor, felcserélésük és a közöttük előforduló keresztfertőződés elkerülése érdekében - egyértelműen elkülönítsék és megkülönböztessék a felszabadított és visszautasított szövetektől és sejtektől. A speciális kritériumok szerint gyűjtött egyes szövetek és sejtek tárolása érdekében fizikailag elkülönített területeket vagy tárolóeszközöket kell kijelölni, illetve a berendezés belsejében elszigetelt tárolást kell biztosítani a karantén alá vett és a felszabadított szövetek és sejtek tárolására alkalmas helyeken egyaránt.
9. A szövetfeldolgozó és -tároló egységnek a beléptetés ellenőrzésére, a takarításra, a karbantartásra, a hulladék ártalmatlanítására, valamint vészhelyzet esetén a szolgáltatások újraszervezésére vonatkozóan írásos szabályzattal és eljárásokkal kell rendelkeznie.
E. DOKUMENTÁCIÓK ÉS NYILVÁNTARTÁSOK
1. Az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységek tekintetében olyan rendszert kell működtetni, amely világosan meghatározott és hatékony dokumentációt biztosít, pontos nyilvántartásokat vezet és szabványműveleti előírások (SOP) alapján működik. A dokumentumokat rendszeresen felül kell vizsgálni és azoknak meg kell felelniük az ezen irányelvben megállapított előírásoknak. A rendszernek biztosítania kell, hogy az elvégzett munka szabványok szerint történjen, és hogy valamennyi lépés - a kódolás, a donorok alkalmassága, a gyűjtés, a feldolgozás, a konzerválás, a tárolás, a szállítás, az elosztás vagy az ártalmatlanítás - visszakövethető legyen, beleértve a minőség-ellenőrzési és -biztosítási szempontokat is.
2. Minden kritikus tevékenység esetében az abba bevont anyagokat, berendezéseket és személyzetet azonosítani és dokumentálni kell.
3. A szövetfeldolgozó és -tároló egységekben az arra felhatalmazott személyzet a dokumentumok minden változását felülvizsgálja, keltezi, jóváhagyja, dokumentálja, és haladéktalanul végrehajtja.
4. Dokumentum-ellenőrzési folyamatot kell kialakítani, hogy folyamatosan követhető legyen a dokumentumok felülvizsgálata és módosítása, és biztosítani lehessen, hogy kizárólag a dokumentumok legutolsó változatát használják.
5. Bizonyítani kell, hogy a nyilvántartások megbízhatóak és hűen tükrözik az eredményeket.
6. Fontos, hogy a nyilvántartások olvashatók és kitörölhetetlenek legyenek; készülhetnek kézírással, de akár másik validált hordozóra (számítógép, mikrofilm) is átmenthetők.
7. A 9. cikk (2) bekezdésének sérelme nélkül a szövetek és a sejtek biztonsága és minősége szempontjából kritikus nyilvántartásokat - beleértve az alapadatokat is - oly módon kell őrizni, hogy azok a lejárat napja, a klinikai felhasználás vagy a megsemmisítés után még legalább tíz évig hozzáférhetőek legyenek.
8. A nyilvántartásoknak meg kell felelniük a 2004/23/EK irányelv 14. cikkében előírt bizalmas adatkezeléssel kapcsolatos követelményeknek. A nyilvántartásokhoz és az adatokhoz kizárólag a felelős személy által felhatalmazott személy, valamint az illetékes hatóság férhet hozzá vizsgálati és ellenőrzési intézkedések végrehajtása végett.
F. MINŐSÉG-ELLENŐRZÉS
1. Az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységekhez ellenőrzési rendszert kell működtetni. Ezeket az ellenőrzéseket arra kiképzett és abban jártas személyek végzik el - független módon - legalább kétévente a jóváhagyott eljárásoknak és a szabályozási követelményeknek való megfelelés ellenőrzése érdekében. A megállapításokat és a korrekciós intézkedéseket dokumentálni kell.
2. A kötelező minőségi és biztonsági előírások be nem tartása esetén dokumentált vizsgálatokra kell, hogy sor kerüljön, amelyek az esetleges korrekciós és megelőző intézkedésekre is kiterjednek. A nem megfelelő szövetek és sejtek további sorsáról a felelős személy által felügyelt írásos eljárások szerint kell határozni, és azt dokumentálni kell. Valamennyi érintett szövetet és sejtet azonosítani kell és nyilvántartásba kell venni.
3. A korrekciós intézkedéseket kellő időben és eredményesen kell dokumentálni, végrehajtani és befejezni. A korrekciós és megelőző intézkedések hatékonyságát végrehajtásuk után értékelni kell.
4. A szövetfeldolgozó és -tároló egységnek a folyamatos és a rendszeres javulás biztosítása érdekében a minőségirányítási rendszer teljesítményét felülvizsgáló folyamatot kell működtetnie.
II. MELLÉKLET
A szövetfeldolgozó és -tároló egységeknél zajló szövet- és sejtelőkészítő folyamatok engedélyezésére vonatkozó, a 4. cikkben említett követelmények
Az illetékes hatóság - miután értékelte a donorkiválasztási kritériumokat, a gyűjtési eljárásokat, a folyamat minden egyes lépésére vonatkozó protokollokat, a minőségirányítási kritériumokat, valamint a szövetekre és sejtekre vonatkozó végső mennyiségi és minőségi kritériumokat - minden szövet-, illetve sejtelőkészítő folyamatot külön engedélyez. Ennek az értékelésnek legalább az ebben a mellékletben megállapított követelményeknek kell megfelelnie.
A. ÁTVÉTEL A SZÖVETFELDOLGOZÓ ÉS -TÁROLÓ LÉTESÍTMÉNYBEN
A gyűjtött szöveteknek és sejteknek a szövetfeldolgozó és -tároló egységben való átvételükkor meg kell felelniük a 2006/17/EK irányelvben meghatározott követelményeknek.
B. FELDOLGOZÁS
Amennyiben az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységek között a szövet- és sejtfeldolgozás is szerepel, a szövetfeldolgozó és -tároló egységben alkalmazott eljárásoknak az alábbi kritériumoknak kell megfelelnie:
1. A kritikus feldolgozási eljárásokat validálni kell, és azok nyomán a szövetek vagy sejtek nem válhatnak klinikailag hatástalanná vagy a recipiensre nézve ártalmassá. E validálás alapjául a létesítmény által elvégzett tanulmányok vagy már közzétett tanulmányokból vett adatok, míg a meghonosodott feldolgozási eljárások esetében a létesítmény által szállított szövetekre vonatkozó klinikai eredmények visszamenőleges értékelése szolgálhat.
2. Igazolni kell, hogy a validált eljárást a szövetfeldolgozó és -tároló egységben adott környezetben annak személyzete rendszeresen és következetesen végre tudja hajtani.
3. Az eljárásokat szabványos műveleti eljárásokban kell dokumentálni, amelyeknek az I. melléklet E. pontja 1-4. pontja értelmében meg kell felelniük az ebben az irányelvben megállapított validált módszernek és előírásoknak.
4. Biztosítani kell, hogy valamennyi folyamatot a jóváhagyott szabványműveleti előírásokkal összhangban hajtsanak végre.
5. Amennyiben a szövetekre vagy sejtekre mikrobák inaktiválását célzó eljárást alkalmaznak, azt pontosan meg kell határozni, illetve dokumentálni és validálni kell.
6. A feldolgozás bármely jelentős változása előtt a módosított folyamatot validálni és dokumentálni kell.
7. A feldolgozási eljárásokat rendszeres kritikai értékelésnek kell alávetni annak biztosítása érdekében, hogy azok folyamatosan a várt eredményeket hozzák.
8. A szövet- és sejtmegsemmisítő eljárásokkal meg kell előzni az egyéb adományok és termékek, a feldolgozási környezet szennyeződését vagy a személyzet megfertőződését. Ezeknek az eljárásoknak meg kell felelniük a vonatkozó nemzeti rendelkezéseknek.
C. A TERMÉKEK TÁROLÁSA ÉS FELSZABADÍTÁSA
Amennyiben az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységek között a szövetek és sejtek tárolása és felszabadítása is szerepel, az engedéllyel rendelkező szövetfeldolgozó és -tároló egységben alkalmazott eljárásnak az alábbi kritériumoknak kell megfelelnie:
1. A maximális tárolási időt minden típusú tárolási körülmény esetére meg kell határozni. A választott tárolási időnek többek között tükröznie kell az előírt szövet- és sejttulajdonságok esetleges romlását.
2. Fel kell állítani egy szövet- és/vagy sejtbevételezési rendszert annak biztosítására, hogy azokat az ebben az irányelvben meghatározott valamennyi követelmény teljesülése előtt ne lehessen felszabadítani. Szabványműveleti előírásokban kell részletezni az elosztásra váró szövetek és sejtek felszabadítására vonatkozó körülményeket, felelősségi köröket és eljárásokat.
3. A szövet- és sejtazonosító rendszernek a szövetfeldolgozó és -tároló egységben zajló feldolgozási eljárás valamennyi fázisa alatt világosan meg kell különböztetnie egymástól a felszabadított, a fel nem szabadított (karantén alá helyezett), valamint a megsemmisített termékeket.
4. A nyilvántartásokból ki kell derülnie, hogy a szövetek és a sejtek felszabadítását megelőzően valamennyi vonatkozó előírás teljesül, és különösen annak, hogy a bejelentésre alkalmas hatályos nyomtatványokat, a vonatkozó kórtörténeteket, a feldolgozással kapcsolatos nyilvántartásokat és a vizsgálati eredményeket a 2004/23/EK irányelv 17. cikkében megállapított felelős személy által e feladatra felhatalmazott személy által kiadott írásos eljárás értelmében ellenőrizték. Amennyiben az eredményeket a laboratóriumból számítógép segítségével továbbították, az ellenőrzési nyomvonalból ki kell derülnie a továbbításért felelős személy nevének.
5. A 2004/23/EK irányelv 17. cikkében meghatározott felelős személy által jóváhagyott dokumentált kockázatértékelést kell készíteni annak meghatározására, hogy mi lesz a tárolt szövetek és sejtek sorsa az egyes új donorkiválasztási vagy vizsgálati kritériumok bevezetése, illetve a feldolgozás bármely olyan jelentősen módosított lépésének meghonosítása után, amelynek nyomán javul a biztonság vagy a minőség.
D. ELOSZTÁS ÉS VISSZAHÍVÁS
Amennyiben az akkreditáció/kijelölés/felhatalmazás/engedélyezés köteles tevékenységek között a szövetek és a sejtek elosztása is szerepel, az engedéllyel rendelkező szövetfeldolgozó és -tároló egységben alkalmazott eljárásoknak az alábbi kritériumoknak kell megfelelniük:
1. A szállítás kritikus feltételeit - mint hőmérséklet és időkorlát - oly módon kell meghatározni, hogy a szövetek és a sejtek megőrizzék az előírt tulajdonságaikat.
2. A tartálynak/csomagnak biztonságosnak kell lennie, és a szövetek és sejtek tárolását a meghatározott körülmények között kell biztosítania. Valamennyi tartálynak és csomagnak rendeltetési céljára szóló minősítéssel kell rendelkeznie.
3. Amennyiben az elosztást szerződéses viszonyban álló harmadik fél végzi, az előírt feltételek teljesítését írásos megállapodásban kell rögzíteni.
4. A szövetfeldolgozó és -tároló egységnél olyan személyzetet kell alkalmazni, amely felméri, hogy szükséges-e a visszahívás, valamint kezdeményezi és összehangolja a szükséges intézkedéseket.
5. Hatékony visszahívási eljárást kell működtetni, amely magában foglalja a felelősségi körök és a megteendő intézkedések meghatározását. Ennek az eljárásnak az illetékes hatóság értesítésére is ki kell terjednie.
6. Az intézkedéseket előre meghatározott időn belül kell meghozni, és magában kell foglalniuk az adott szövetek és sejtek nyomon követését és adott esetben visszakeresését. A vizsgálat célja, hogy minden olyan donort azonosítson, aki hozzájárulhatott szövődmény kiváltásához a recipiensben, valamint hogy visszahívja az e donortól rendelkezésre álló szöveteket és sejteket, továbbá hogy értesítse az ugyanazon donortól gyűjtött szövetek és sejtek címzettjeit és recipienseit abban az esetben, ha ők kockázatnak lehetnek kitéve.
7. A szövet- és sejtigények kezelésére eljárásokat kell bevezetni. A szövetek és sejtek bizonyos betegek vagy egészségügyi intézmények részére történő elosztásának szabályait dokumentálni kell, és kérés esetén e felek számára rendelkezésre kell bocsátani.
8. A visszaküldött termékek kezelésére dokumentált rendszert kell működtetni - adott esetben e termékek leltárba való visszavételére vonatkozó feltételek meghatározásával.
E. VÉGSŐ JELÖLÉS AZ ELOSZTÁS ELŐTT
1. Az elsődleges szövet/sejttároló tartályon az alábbiakat kell feltünteni:
a) a szövetek és sejtek típusát, a szövet/sejtek azonosító számát vagy kódját, valamint adott esetben a tételszámot vagy a tételek számát;
b) a szövetfeldolgozó és -tároló egység azonosítóját;
c) a lejárat napját;
d) autológ adományozás esetén azt pontosítani kell ("kizárólag autológ felhasználásra") és meg kell adni a donor/recipiens személyazonosságát;
e) célzott adományozás esetén a címkén meg kell adni a recipiens nevét, akinek az adományt szánták;
f) amennyiben a szövetek és sejtek ismerten pozitívak egy releváns fertőző betegség markerére nézve, fel kell tüntetni a BIOLÓGIAI VESZÉLY feliratot is;
g) egységes európai kódot az emberi felhasználás céljából elosztott szövetek és sejtek esetében vagy az adományozásazonosító karaktersort a - nem emberi felhasználás céljából elosztott - forgalomba bocsátott szövetek és sejtek esetében.
Ha a fenti d), e) és g) pontokban felsorolt információk valamelyike nem tüntethető fel az elsődleges tartály címkéjén, akkor azt az elsődleges tartályhoz csatolt külön lapon kell megadni. Ezt a lapot az elsődleges tartállyal együtt kell csomagolni, biztosítva, hogy azok ne válhassanak szét.
2. A címkén vagy a kísérő dokumentumokon az alábbi információkat kell feltüntetni:
a) a szövet- vagy sejttermék leírása (meghatározása) és szükség esetén méretei;
b) amennyiben releváns, a morfológiai és a működésére vonatkozó adatok;
c) a szövet/sejtek elosztásának időpontja;
d) a donoron végzett biológiai meghatározások és azok eredményei;
e) a tárolással kapcsolatos ajánlások;
f) a tartály és a csomag felnyitására, valamint az előírt kezelésre és a visszazárásra/visszacsomagolásra vonatkozó utasítások;
g) a felnyitás/kezelés után érvényes lejárati határidők;
h) a súlyos szövődmények és/vagy a súlyos káros eseményeknek az 5-6. cikkben szereplő bejelentésére vonatkozó utasítások;
i) potenciálisan káros maradványanyagok (pl. antibiotikumok, etilén-oxid stb.) jelenléte;
j) az importált szövetek és sejtek esetében a gyűjtés helye szerinti ország és az exportáló ország (ha különbözik a gyűjtés helye szerinti országtól).
F. A SZÁLLÍTÓTARTÁLYOK KÜLSŐ CÍMKÉZÉSE
A szállításhoz az elsődleges tartályt olyan szállítótartályban kell elhelyezni, amelynek címkéjén legalább a következő információk szerepelnek:
a) a kibocsátó szövetfeldolgozó és -tároló egység azonosítása (címmel és telefonszámmal);
b) a címzett emberi felhasználásért felelős szervezet azonosítása (címmel és telefonszámmal);
c) annak feltüntetése, hogy a csomag emberi szövetet/sejteket tartalmaz, valamint a "VIGYÁZZ, TÖRÉKENY!" felirat;
d) amennyiben az átültetéshez élő sejtre - mint az őssejt, ivarsejt vagy embrió - van szükség, a "SUGÁRZÁSNAK KITENNI TILOS!" feliratot is fel kell tüntetni;
e) ajánlott szállítási körülmények (pl. hűtendő, állított helyzetben szállítandó stb.);
f) biztonsági előírások/(adott esetben) hűtési módszerek.
III. MELLÉKLET
SÚLYOS SZÖVŐDMÉNYEK BEJELENTÉSE
A. RÉSZ
Súlyos szövődmény gyanújának gyors bejelentése
Szövetfeldolgozó és -tároló egység
Az uniós szövetfeldolgozó és -tároló egység kódja (adott esetben)
A bejelentés azonosítója
A bejelentés időpontja (év/hónap/nap)
Az érintett személy (recipiens vagy donor)
A gyűjtés vagy az emberi célú felhasználás időpontja (év/hónap/nap) és helye
Egyedi adományozásazonosító szám
A feltételezett súlyos szövődmény időpontja (év/hónap/nap)
A feltételezett súlyos szövődmény által érintett szövetek és sejtek típusa
A feltételezett súlyos szövődmény által érintett szövetek és sejtek egységes európai kódja (adott esetben)
A feltételezett súlyos szövődmény(ek) típusa
B. RÉSZ
A súlyos szövődményekkel kapcsolatos vizsgálat következtetései
Szövetfeldolgozó és -tároló egység
Az uniós szövetfeldolgozó és -tároló egység kódja (adott esetben)
A bejelentés azonosítója
A megerősítés időpontja (év/hónap/nap)
A súlyos szövődmény bekövetkezésének időpontja (év/hónap/nap)
Egyedi adományozásazonosító szám
Súlyos szövődmény megerősítése (igen/nem)
A megerősített súlyos szövődmény által érintett szövetek és sejtek egységes európai kódja (ha alkalmazandó)
A súlyos szövődmény típusának megváltozása (igen/nem). Ha IGEN, pontosítsa.
Klinikai eredmény (ha ismert)
- Teljes gyógyulás
- Kisebb következmény
- Súlyos következmény
- Halál
A vizsgálat eredménye és a záró következtetések
Megelőző és korrekciós intézkedésekre vonatkozó ajánlások
IV. MELLÉKLET
SÚLYOS KÁROS ESEMÉNYEK BEJELENTÉSE
A. RÉSZ
Súlyos káros események gyanújának gyors bejelentése
| Szövetfeldolgozó és -tároló egység | ||||
| Az uniós szövetfeldolgozó és -tároló egység kódja (adott esetben) | ||||
| A bejelentés azonosítója | ||||
| A bejelentés időpontja (év/hónap/nap) | ||||
| A súlyos káros esemény bekövetkezésének időpontja (év/hónap/nap) | ||||
| A szövetek és sejtek minőségét és biztonságát érintő, az alábbiak valamelyikében bekövetkezett hiba miatti súlyos káros esemény: | Leírás | |||
| Szövet- és sejthiba | Berendezés meghibásodása | Emberi mulasztás | Egyéb (pontosítsa) | |
| Gyűjtés | ||||
| Vizsgálat | ||||
| Szállítás | ||||
| Feldolgozás | ||||
| Tárolás | ||||
| Eloszlás | ||||
| Anyagok | ||||
| Egyéb (pontosítsa) | ||||
B. RÉSZ
A súlyos káros eseményekkel kapcsolatos vizsgálat következtetései
Szövetfeldolgozó és -tároló egység
Az uniós szövetfeldolgozó és -tároló egység kódja (adott esetben)
A bejelentés azonosítója
A megerősítés időpontja (év/hónap/nap)
A súlyos káros esemény bekövetkezésének időpontja (év/hónap/nap)
A kiváltó ok elemzése (részletek)
A megtett korrekciós intézkedések (részletek)
V. MELLÉKLET
AZ ÉVES JELENTÉSHEZ ALKALMAZANDÓ FORMANYOMTATVÁNY
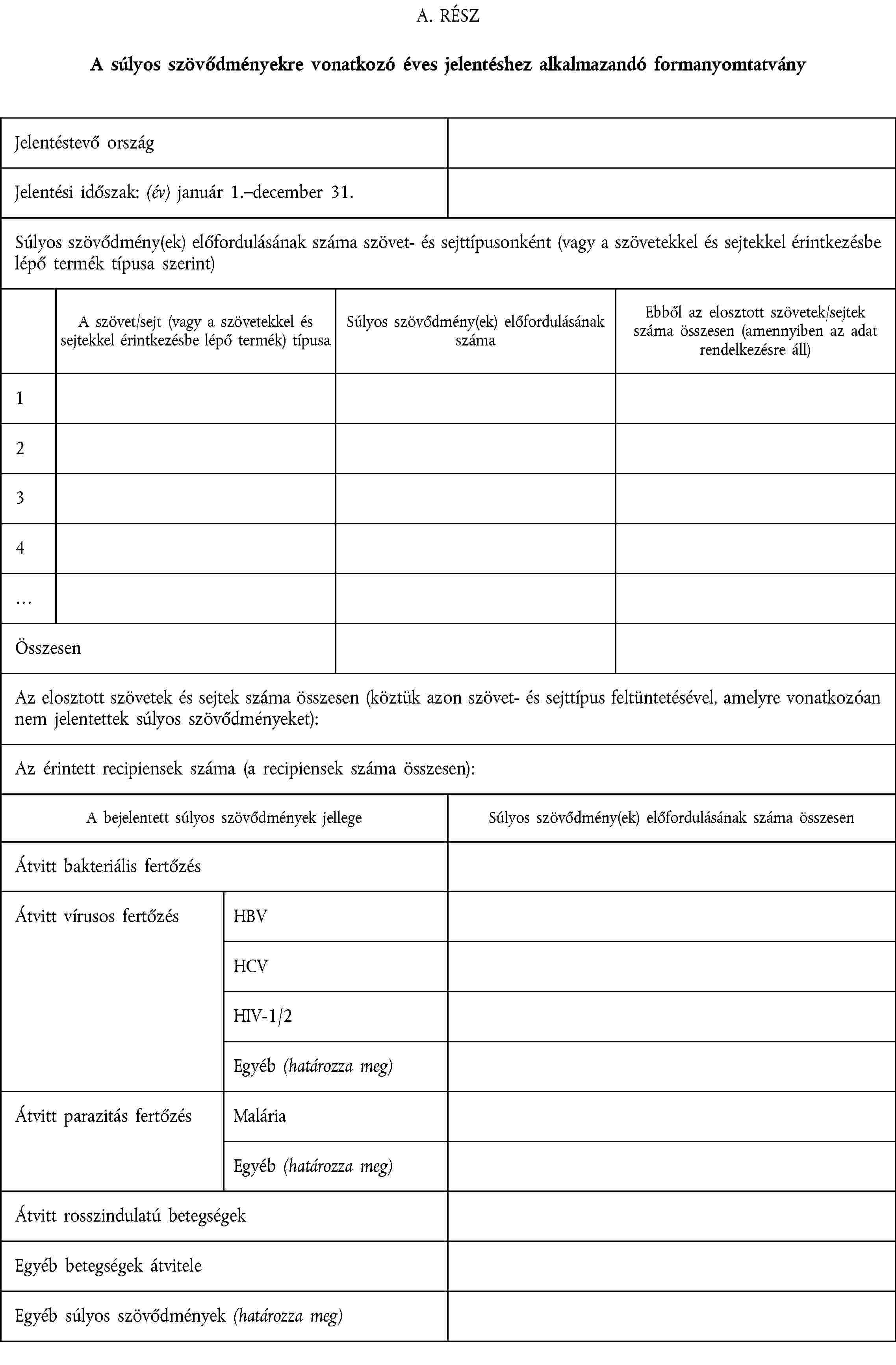
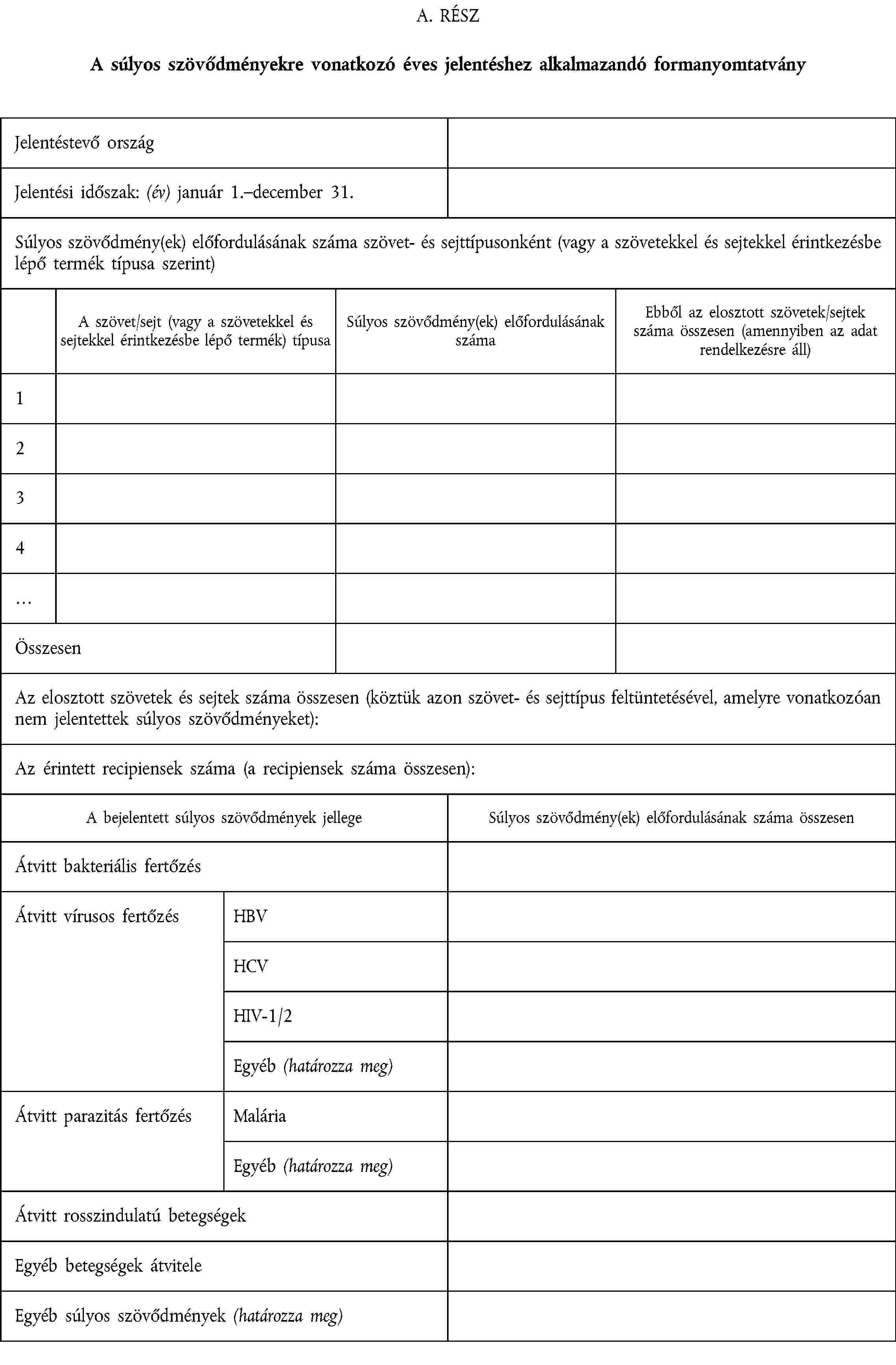
VI. MĘLLÉKLET
A minimálisan szükséges, a 9. cikk (2) bekezdésével összhangban megőrizendő adatok
A. A SZÖVETFELDOLGOZÓ ÉS -TÁROLÓ EGYSÉGEK RÉSZÉRŐL
(1) A donor személyazonossága
(2) Az adományozás azonosítása, amely legalább az alábbi információkat tartalmazza:
- A gyűjtő szervezet azonosítója (elérhetőségi adatokkal) vagy a szövetfeldolgozó és -tároló egység azonosítója
- Egyedi adományozási szám
- A gyűjtés időpontja
- A gyűjtés helye
- Az adományozás típusa (például egy vagy több sejttípusból álló szövet, autológ vagy allogén, élő vagy elhunyt donor)
(3) Termékazonosító, amely legalább az alábbi információkat tartalmazza:
- A szövetfeldolgozó és -tároló egység azonosítója
- A szövet-/sejt-/terméktípus (alapvető nómenklatúra)
- Tételcsoportok száma (egyesítés esetén)
- Altételek száma (adott esetben)
- A lejárat napja (adott esetben)
- A szövet/sejt státusa (azaz karantén alá vont, felhasználásra alkalmas stb.)
- A termékek leírása és eredete, az alkalmazott feldolgozási lépések, a szövetekkel és sejtekkel érintkezésbe lépő és azok minőségét és/vagy biztonságát befolyásoló anyagok és adalékanyagok
- A végleges címkét kiállító létesítmény azonosítója
(4) Egységes európai kód (adott esetben)
(5) Az emberi felhasználás azonosítója, amely legalább az alábbi információkat tartalmazza:
- Az elosztás/megsemmisítés időpontja
- Az orvos vagy a végfelhasználó/létesítmény azonosítója
B. AZ EMBERI FELHASZNÁLÁSÉRT FELELŐS SZERVEZET RÉSZÉRŐL
(1) A szállító szövetfeldolgozó és -tároló egység azonosítója
(2) Az orvos vagy a végfelhasználó/létesítmény azonosítója
(3) A szövetek és sejtek típusa
(4) Termékazonosító
(5) A recipiens személyazonossága
(6) A felhasználás időpontja
(7) Egységes európai kód (adott esetben)
VII. MELLÉKLET
AZ EGYSÉGES EURÓPAI KÓD SZERKEZETE
| ADOMÁNYOZÁSAZONOSÍTÓ KARAKTERSOR | TERMÉKAZONOSÍTÓ KARAKTERSOR | |||||
| AZ UNIÓS SZÖVETFELDOLGOZÓ- ÉS TÁROLÓ EGYSÉG KÓDJA | EGYEDI ADOMÁNYOZÁSI SZÁM | TERMÉKKÓD | TÉTELCSOPORT SZÁMA | LEJÁRATI DÁTUM (ÉÉÉÉHHNN) | ||
| ISO-országkód | A szövetfeldolgozó és -tároló egység száma | Termékkódrendszer-azonosító | Termékszám | |||
| 2 alfabetikus karakter | 6 alfa-numerikus karakter | 13 alfa-numerikus karakter | 1 alfabetikus karakter | 7 alfa-numerikus karakter | 3 alfa-numerikus karakter | 8 numerikus karakter |
VIII. MELLÉKLET
A szövetfeldolgozó és -tároló egységek uniós gyűjteményében rögzítendő adatok
A. A szövetfeldolgozó és -tároló egységgel kapcsolatos információk
1. A szövetfeldolgozó és -tároló egység neve
2. A szövetfeldolgozó és -tároló egység nemzeti vagy nemzetközi kódja
3. Annak a szervezetnek a neve, amelyen belül a szövetfeldolgozó és -tároló egység található (adott esetben)
4. A szövetfeldolgozó és -tároló egység címe
5. Közzétehető elérhetőségi adatok: funkcionális e-mail cím, telefon- és faxszám
B. A szövetfeldolgozó és -tároló egység akkreditálására, kijelölésére, felhatalmazására vagy engedélyezésére vonatkozó adatok
1. Az akkreditálást, kijelölést, felhatalmazást vagy engedélyezést végző illetékes hatóság(ok)
2. A szövetfeldolgozó és -tároló egységek uniós gyűjteményének gondozásáért felelős illetékes hatóság(ok) neve
3. Az akkreditáció, kijelölés, felhatalmazás vagy engedély jogosultjának neve (adott esetben)
4. Azok a szövetek és sejtek, amelyekre az akkreditáció, a kijelölés, a felhatalmazás vagy az engedély vonatkozik
5. Azok a ténylegesen végrehajtott tevékenységek, amelyekre az akkreditáció, a kijelölés, a felhatalmazás vagy az engedély vonatkozik
6. Az akkreditáció, kijelölés, felhatalmazás vagy engedély státusa (engedélyezve, felfüggesztve, részlegesen vagy teljesen visszavonva, a tevékenységek önként megszüntetve)
7. Az engedélyre vonatkozó további feltételekkel és kivételekkel kapcsolatos információk (adott esetben).
( 1 ) HL L 102., 2004.4.7., 48. o.
( 2 ) http://pharmacos.eudra.org/F2/eudralex/vol-4/home.htm és HL L 262., 2003.10.14., 22. o.
( 3 ) HL L 38., 2006.2.9., 40. o.
( 4 ) A Bizottság 2015. április 8-i (EU) 2015/566 irányelve a 2004/23/EK irányelvnek az importált szövetekre és sejtekre vonatkozó minőségi és biztonsági előírások egyenértékűségének ellenőrzését szolgáló eljárások tekintetében történő végrehajtásáról (HL L 93., 2015.4.9., 56. o.).
( 5 ) HL L 169., 1993.7.12., 1. o. A legutóbb az 1882/2003/EK európai parlamenti és tanácsi rendelettel (HL L 284., 2003.10.31., 1. o.) módosított irányelv.
( 6 ) HL L 331., 1998.12.7., 1. o. Az 1882/2003/EK rendelettel módosított irányelv.
Lábjegyzetek:
[1] A dokumentum eredetije megtekinthető CELEX: 32006L0086 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:32006L0086&locale=hu Utolsó elérhető, magyar nyelvű konszolidált változat CELEX: 02006L0086-20150429 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:02006L0086-20150429&locale=hu


