47/2008. (XII. 17.) EüM rendelet
a törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet módosításáról
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés c) pontjában foglalt felhatalmazás alapján - a pénzügyminiszter feladat- és hatásköréről szóló 169/2006. (VII. 28.) Korm. rendelet 1. § a) pontjában megállapított feladatkörében eljáró pénzügyminiszterrel egyetértésben az egészségügyi miniszter feladat- és hatásköréről szóló 161/2006. (VII. 28.) Korm. rendelet 1. § b) pontjában megállapított feladatkörömben eljárva a következőket rendelem:
1. §
A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet (a továbbiakban: R.) 5. §-a helyébe a következő rendelkezés lép:
"5. § A Gyftv. 27. § (4) bekezdésében foglalt, a kiemelt és emelt indikációhoz kötött támogatási csoportba tartozó betegségcsoportok és indikációs területek megnevezését és a támogatással történő felírásra jogosultak körét a 2. és 3. számú melléklet, a Gyftv. 27. § (7) bekezdésében foglalt, a különkeretes gyógyszerek körét a gyógyszerhatóanyag és a betegségcsoport megjelölésével pedig a 4. számú melléklet tartalmazza. A 2-3. számú melléklet szerinti indikációs pontokhoz tartozó finanszírozási algoritmusokat a 8. számú melléklet tartalmazza."
2. §
(1) Az R. 2. számú melléklete e rendelet 1. számú melléklete szerint módosul.
(2) Az R. e rendelet 2. számú melléklete szerinti 8. számú melléklettel egészül ki.
3. §
(1) Ez a rendelet a kihirdetését követő napon lép hatályba.
(2) Az R.
a) 2. számú mellékletének 1-8. n) 2. pontjában, 8. o)-8. u) pontjában, 9. b)-15. b) pontjában, 22-23. a) 1. pontjában, 23. b) 1-25. pontjában, 27-28. pontjában, 30. a)-32. pontjában, 34. a) pontjában, 35-36. pontjában, 38. a) pontjában, 50. pontjában, 3. számú melléklete "A) Eü 90 százalékos támogatási kategória" részének 1. d)-e) pontjában, 2. a)-b) pontjában, 3. a) 3-23. pontjában, 25. pontjában, 28-31. pontjában, 3. számú melléklete "B. Eü 70 százalékos támogatási kategória" részének 1-12. pontjában, 14-18. pontjában, és 3. számú melléklete "C. Eü 50 százalékos támogatási kategória" részének 1-9. a) 2. pontjában az "az alábbi gyógyszereket:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszereket." szöveg;
b) 2. számú mellékletének 33., 34. b), 38. b)-39. pontjában, és 3. számú melléklete "B. Eü 70 százalékos támogatási kategória" részének 21. pontjában az "az alábbi gyógyszert:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszereket." szöveg;
c) 2. számú mellékletének 9. a) pontjában, és 3. számú melléklete "A) Eü 90 százalékos támogatási kategória" részének 27. pontjában az "az alábbi gyógyszereket és tápszereket:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszereket és tápszereket." szöveg;
d) 2. számú mellékletének 17-18., 21. a)-b) pontjában, 3. számú melléklete "A) Eü 90 százalékos támogatási kategória" részének 24. és 26. pontjában, és 3. számú melléklete "B. Eü 70 százalékos támogatási kategória" részének 13. pontjában az "az alábbi tápszereket:*" szövegrész helyébe az "az OEP által közleményben közzétett tápszereket." szöveg;
e) 2. számú mellékletének 16. pontjában az "az alábbi tápszereket és gyógyszeranyagokat:*" szövegrész helyébe az "az OEP által közleményben közzétett tápszereket és gyógyszeranyagokat." szöveg;
f) 2. számú mellékletének 19. pontjában az "az alábbi tápszert és gyógyszeranyagokat:*" szövegrész helyébe az "az OEP által közleményben közzétett tápszereket és gyógyszeranyagokat." szöveg;
g) 2. számú mellékletének 20. pontjában az "az alábbi gyógyszeranyagokat:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszeranyagokat." szöveg;
h) 2. számú mellékletének 23. a) 2-3. pontjában, 29. b) pontjában, 40., 42. pontjában, 3. számú melléklete "A) Eü 90 százalékos támogatási kategória" részének 1. f) pontjában, 3. számú melléklete "B. Eü 70 százalékos támogatási kategória" részének 20. pontjában, és 3. számú melléklete "C. Eü 50 százalékos támogatási kategória" részének 10. pontjában az "az alábbi készítményeket:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszereket." szöveg;
i) 2. számú mellékletének 8. n) 3., 41., 43. pontjában, és 3. számú melléklete "B. Eü 70 százalékos támogatási kategória" részének 22. pontjában az "az alábbi készítményt:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszereket." szöveg;
j) 2. számú mellékletének 37. a)-b) pontjában az "a következő készítményeket:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszereket." szöveg;
k) 3. számú melléklete "A) Eü 90 százalékos támogatási kategória" részének 3. a) 1. és 2. pontjában az "az alábbi szereket:*" szövegrész helyébe az "az OEP által közleményben közzétett gyógyszereket." szöveg;
l) az R. 3. számú melléklete "A) Eü 90 százalékos támogatási kategória" részének 14. a) pontjában a "reumato-lógus vagy bőrgyógyász" szövegrész helyébe a "reumatológus, bőrgyógyász, szemész vagy immunológus" szöveg lép.
(3) Ez a rendelet 2009. január 1-jén hatályát veszti.
Dr. Székely Tamás s. k.,
egészségügyi miniszter
1. számú melléklet a 47/2008. (XII. 17.) EüM rendelethez
1. Az R. 2. számú mellékletének 26. pontja helyébe a következő rendelkezés lép:
"26. a) Rheumatoid arthritis (több, mint 4 ACR kritérium legalább 3 hónapja) (BNO: M05.9, M06.0, M06.9) kezelésére, amennyiben 15 mg/hét methotrexát monoterápiát, vagy legalább 20 mg/nap leflunomid monoterápiát követő legalább 3 hónapig alkalmazott kombinációs DMARD kezelés ellenére a betegség aktivitása 5,1 DAS28 felett van (DAS28 = módosított Disease Activity Score) a kijelölt intézmény re-umatológus szakorvosa 3 hónapig, megfelelő válaszkészség esetén (DAS28 aktivitási index csökkenése 3 hónap kezelést követően minimum 0,6 és 6 hónap kezelést követően minimum 1,2) a remisszió fennállásáig (készítményváltás lehetséges mellékhatás vagy hatástalanság esetén) - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket.
26. b) Juvenilis idiopáthiás arthritis (BNO: M08.0) po-liartikuláris típusainak kezelésére, amennyiben konvencionális kezelés ellenére legalább 5 ízület duzzadt és legalább további 3 mozgáskorlátozott, fájdalmas vagy érzékeny, a kijelölt intézmény reumatológus szakorvosa 3 hónapig, megfelelő válaszkészség esetén (Giannini javulási kritérium mértéke 30%-nál magasabb) az aktivitás rendszeres kontrollja mellett a remisszió fennállásáig - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket.
26. c) Súlyos rheumatoid arthritis (BNO: M05.9, M06.0, M06.9) kezelésére, amennyiben előzetes, legalább három hónapig tartó TNF-alfa gátló terápia ellenére a betegség aktivitása megfelelően nem csökken (aktivitási index csökkenés kevesebb mint 1,2), a remisszió fennállásáig a kijelölt intézmény reumatológus szakorvosa - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket."
2. Az R. 2. számú mellékletének 44-49. pontja helyébe a következő rendelkezés lép:
"44. Felnőttkori súlyos Crohn-betegség (18 éves kor felett és CDAI>300) (K5001, K5011, K5081) kezelésére, amennyiben legalább három hónapig alkalmazott hagyományos gyógykezelés (szteroid- és immunszuppresszív terápia, fisztulázó Crohn-betegség (K5012, K5082) esetén antibiotikum-terápia, drenázs és immunszuppresszív kezelés) ellenére a betegség aktivitása igazoltan nem csökken (CDAI>300), vagy szteroidfüggőség (3 hónapon túl szisztémásan >10 mg/nap prednisolon eqvivalens dózis, vagy >3 mg/nap lokális szteroid alkalmazása) igazolható, vagy a hagyományos gyógykezelés toxicitás miatt nem alkalmazható, a kijelölt intézmény gasztroenterológus szakorvosa három hónapig, ezt követően megfelelő válaszkészség esetén (CDAI minimum 70 pontos csökkenése) további kilenc hónapig (készítményváltás lehetséges mellékhatás vagy progresszió esetén, illetve panaszmentes időszakot követő relapszus fellépésekor ismételt terápia megkísérelhető) - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket.
45. Gyermekkori Crohn-betegség (6-17 éves korig) (K5001, K5011, K5081) kezelésére, amennyiben legalább három hónapig alkalmazott hagyományos gyógykezelés (szteroid és immunszuppresszív terápia) ellenére a betegség aktivitása igazoltan nem csökken (PCDAI>30), vagy a hagyományos gyógykezelés toxicitás miatt nem alkalmazható, a kijelölt intézmény gasztroenterológus szakorvosa három hónapig, ezt követően megfelelő válaszkészség esetén (PCDAI minimum 15 pontos csökkenése) további kilenc hónapig (készítményváltás lehetséges mellékhatás vagy progresszió esetén, illetve panaszmentes időszakot követő relapszus fellépésekor ismételt terápia megkísérelhető) - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket.
46. Súlyos, aktív colitis ulcerosa (UCDAI>9) (K5180, K5190) indukciós kezelésére, amennyiben intenzív, teljes dózisú parenteralis szteroid és maximálisan tolerálható dózisú immunszuppresszív terápia ellenére a betegség aktivitása nem csökken (UCDAI>9) és a kezelés megkezdése nélkül a colectomia nem kerülhető el, dokumentált sebészeti konzílium alapján a kijelölt intézmény gasztroentero-lógus szakorvosa három hónapig, ezt követően megfelelő válaszkészség esetén (UCDAI minimum 3 pontos csökkenése) további kilenc hónapig (panaszmentes időszakot követő relapszus fellépésekor ismételt terápia megkísérelhető) -a8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket.
47. Spondylitis ankylopoeticában (M45H0) szenvedő felnőtt betegek részére, amennyiben radiológiailag legalább 2-es stádiumú bilateralis, vagy 3-as, 4-es stádiumú unilateralis sacroiletitis, és legalább 3 hónapja mozgásra fokozódó háti fájdalom, frontális és szagittális síkban beszűkült gerinc-, illetve beszűkült légzőmozgás igazolt, és a BASDAI aktivitási index >40, és kettő vagy több különböző nem-szteroid gyulladásgátló maximális vagy tolerálható dózisban történő alkalmazása ellenére a betegség aktivitása igazoltan nem csökkent, a kijelölt intézmény reu-matológus szakorvosa három hónapig, ezt követően megfelelő válaszkészség esetén (BASDAI index minimum relatív 50%-os csökkenése esetén) a remisszió fennállásáig (mellékhatás vagy hatástalanság esetén készítményváltás lehetséges) - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket.
48. Aktív arthritis psoriaticában (BNO: L4050, M0700, M0710, M0720, M0730) szenvedő beteg részére, amennyiben axiális érintettség esetén a BASDAI aktivitási index (0-100) átlaga több, mint 40, és kettő vagy több különböző nem-szteroid gyulladásgátló maximális vagy tolerálható dózisban történő alkalmazása ellenére a betegség aktivitása igazoltan nem csökken, vagy perifériás érintettség esetén (aktivitási index 5,1 DAS28 érték felett) legalább 3 hónapig tartó DMARD terápia hatására (methotre-xat, sulfasalazin, ciklosporin, leflunomid) a betegség aktivitása igazoltan nem csökken, a kijelölt intézmény reuma-tológus szakorvosa, súlyos psoriasisos bőrtünetek egyidejű fennállása esetén a reumatológus és bőrgyógyász szakorvos dokumentált közös döntését követően három hónapig, ezt követően kizárólag megfelelő válaszkészség (BASDAI index minimum relatív 50%-os csökkenése, vagy DAS28 aktivitási index csökkenése 3 hónap kezelést követően minimum 0,6 és 6 hónap kezelést követően minimum 1,2; vagy a PASI index minimum relatív 50%-os csökkenése) esetén a remisszió fennállásáig (készítményváltás lehetséges mellékhatás vagy hatástalanság esetén) - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket.
49. Súlyos tünetekkel járó plakkos psoriasisban (BNO: L4003, L4004, L4005) szenvedő beteg részére, amennyiben legalább 3 hónapig tartó standard szisztémás kezelés (acitrein, cyclosporin, methotrexat, fototerápia [szűk spektrumú UVB vagy PUVA]) ellenére a PASI>15 (vagy BSA>10%, amennyiben a PASI nem meghatározható) és a DLQI>10, a kijelölt intézmény bőrgyógyász szakorvosa, súlyos arthritis psoriatica tüneteinek egyidejű fennállása esetén bőrgyógyász és reumatológus szakorvos dokumentált közös döntését követően három hónapig, ezt követően kizárólag megfelelő válaszkészség (PASI index minimum relatív 50%-os csökkenése) esetén a remisszió fennállásáig (mellékhatás vagy hatástalanság esetén készítményváltás lehetséges) - a 8. számú mellékletben meghatározott finanszírozási algoritmus figyelembevételével - az OEP által közleményben közzétett gyógyszereket."
2. számú melléklet a 47/2008. (XII. 17.) EüM rendelethez
8. számú melléklet a 32/2004. (IV. 26.) ESZCSM rendelethez
A 2. számú melléklet szerinti egyes indikációs pontokon rendelt gyógyszerek finanszírozásának ellenőrzési algoritmusa
A rheumatoid arthritis finanszírozásának ellenőrzési algoritmusa
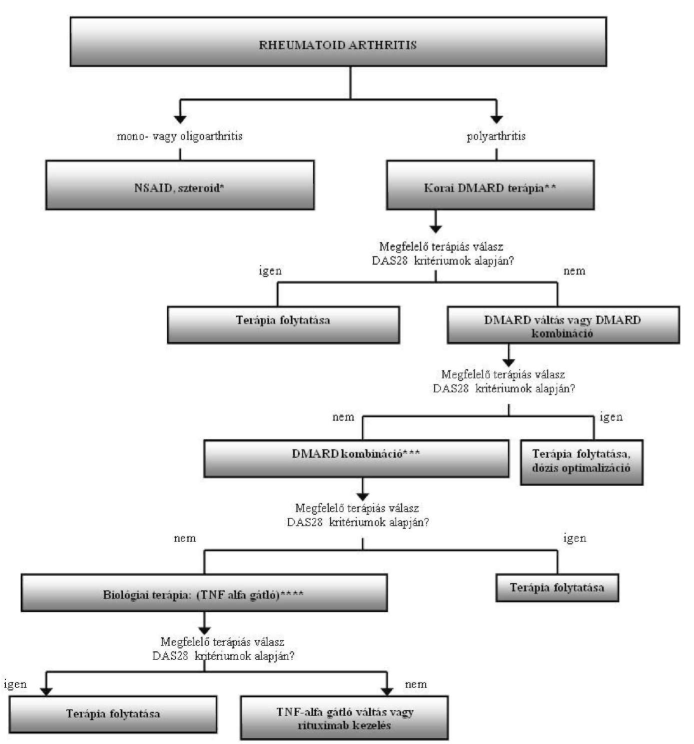
Az Egészségbiztosítási Alap terhére finanszírozott biológiai terápiák alkalmazásának ellenőrzési kritériumai a rheumatoid arthritis gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: M06.9) (4 ACR kritérium együttes jelenléte az alábbiak közül) |
| 1. Reggeli ízületi merevség (>1 óra) 2. Három vagy több ízületi régió gyulladása 3. A kéz ízületeinek gyulladása legalább egy régióban 4. Szimmetrikus ízületi gyulladás 5. Rheumatoid csomók 6. Radiológiai elváltozások (erosiók, sávos decalcificatio a kézfelvételen, RTG) 7. Rheumatoid faktor jelenléte a szérumban (RF faktor) (Labor) |
| A betegség aktivitásának meghatározása (aktivitási index DAS 28) és dokumentálásának ellenőrzése |
| 1. súlyos: 5,1 felett DAS28 aktivitási index (módosított Disease Activity Score) 2. középsúlyos: 5,1 és 3,2 között a DAS28 aktivitási index 3. enyhe: 3,2 alatt a DAS28 aktivitási index |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség, SLE kizárása 4. Terhesség kizárása 5. Életvitel módja (fertőzésveszély) 6. Kardiológia (szívultrahang, EF nagyobb, mint 40%) 7. Labor (rutin, immun: RF, anti-CCP, ANA) |
| A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. Havonta: labor (Wgr, Fvs, CRP, AAT, ALAT, GGT, Karb, Kreat, Na, K) 2. 3 havonta: aktivitási index (DAS 28) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * A betegség monitorizálása során mono- vagy oligoarthritis esetén ismételten ** Elfogadott DMARD terápiák: metothrexat (MTX), leflunomid (LEF), szulfaszalazin (SSZ), cyclosporin A (CsA), chloroquin (CQ), azathioprin (AZA), speciális esetben (vasculitis) cyclophosphamid (CPH) *** Elfogadott DMARD kombinációk: (Ia szint) MTX + CsA, MTX + SSZ, MTX + CQ, MTX + SSZ + CQ, MTX + CQ + AZA, legújabban MTX + LEF **** TNF alfa gátlók: adalimumab, etanercept, infliximab |
A juvenilis idiopáthiás arthritis finanszírozásának ellenőrzési algoritmusa
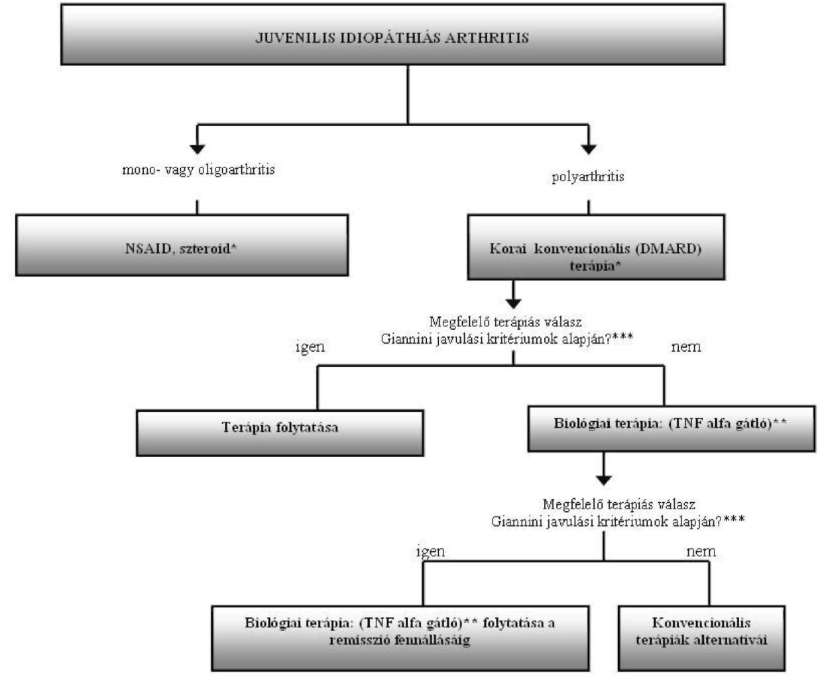
Az Egészségbiztosítási Alap terhére finanszírozott biológiai terápiák alkalmazásának ellenőrzési kritériumai a juvenilis idiopathiás arthritis gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: M08.0) |
| 1. 16 éves kor alatt 2. legalább 1 ízület érintett 3. az ízületi gyulladás tünetei legalább 6 hete fennállnak 4. egyéb, ismeretlen ízületi gyulladást okozó betegség kizárható 5. 7 alcsoport valamelyikének meghatározása 6. Radiológiai elváltozások identifikálása vagy kizárása (RTG) 7. Rheumatoid faktor jelenléte a szérumban (RF faktor) (egyéb labor) |
| A betegség aktivitásának meghatározása (Giannini kritériumok) és dokumentálásának ellenőrzése |
| 1. az orvos véleménye a betegségről /vizuális analóg skálával=VAS/ 2. a beteg vagy szülő véleménye a beteg állapotáról /VAS/ 3. a gyermekkorra adaptált Health Assessment Questionnaire /CHAQ/ értéke 4. a gyulladt ízületek száma 5. a mozgáskorlátozott ízületek száma 6. vörösvértest-süllyedés |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség, SLE kizárása 4. Életvitel módja (fertőzésveszély) 5. Kardiológia (szívultrahang, EF nagyobb, mint 40%) 6. Labor (rutin, immun: RF, anti-CCP, ANA) A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. Havonta: labor (Wgr, Fvs, CRP, AAT, ALAT, GGT, Karb, Kreat, Na, K) 2. 3 havonta: aktivitási index (Giannini) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * Elfogadott DMARD terápiák: metothrexat (MTX), leflunomid (LEF), szulfaszalazin (SSZ), cyclosporin A (CsA), chloroquin (CQ), azathioprin (AZA), speciális esetben (vasculitis) cyclophosphamid (CPH) Törzskönyvi indikációkra különös figyelmet kell fordítani ** TNF alfa gátlók: etanercept *** Giannini 30% javulás: értékelhető javulásról akkor beszélünk, ha legalább 3 paraméterben a javulás eléri a 30%-ot és csak egy paraméterben haladhatja meg a romlás a 30%-ot. |
Crohn-betegség finanszírozásának ellenőrzési algoritmusa
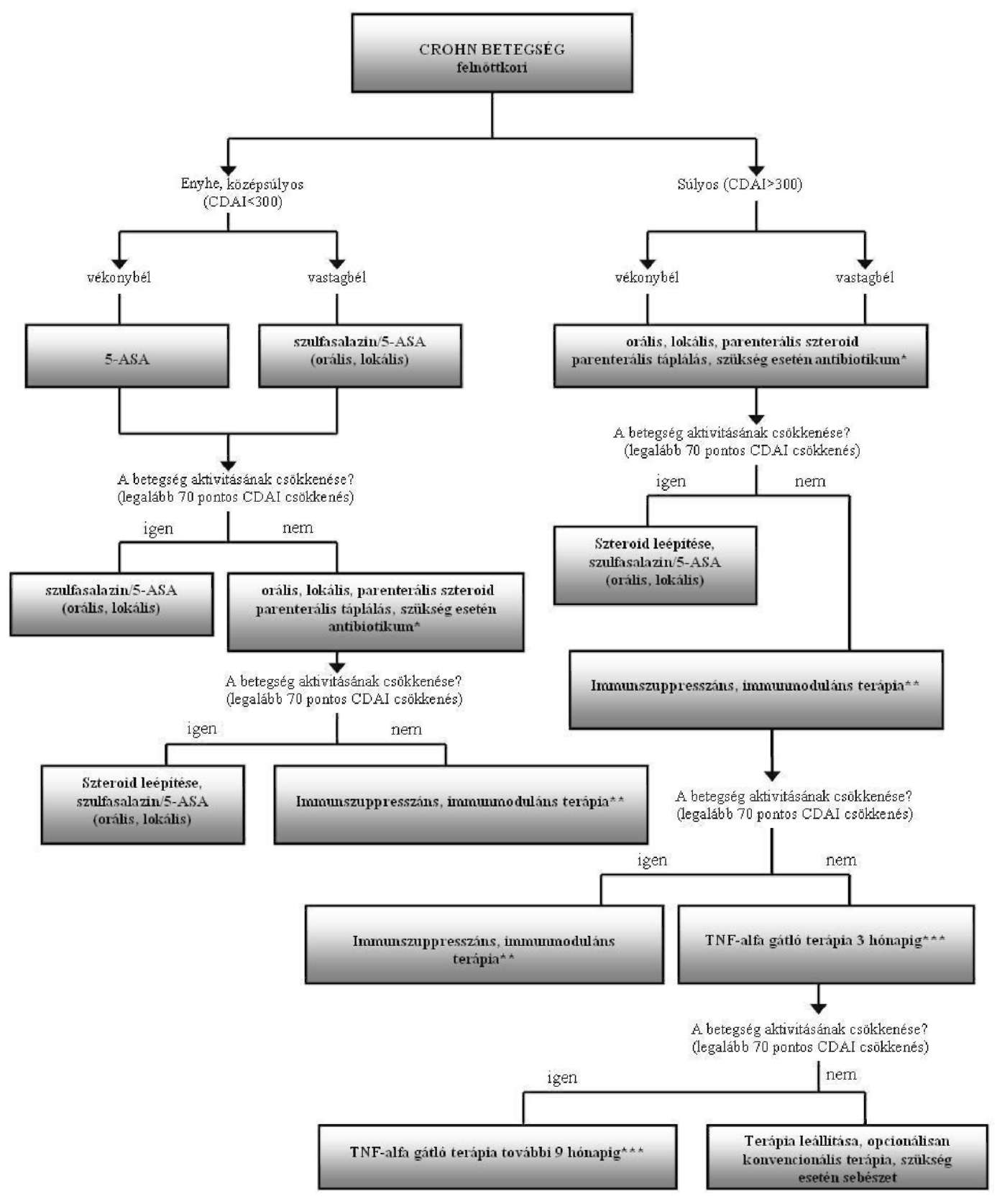
Az Egészségbiztosítási Alap terhére finanszírozott biológiai terápiák alkalmazásának ellenőrzési kritériumai a felnőttkori Crohn-betegség gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: K5001, K5011, K5081), klinikai súlyosság meghatározása az alábbi kritériumok alapján (CDAI: Crohn-betegség aktivitási index, 0-600) |
| 1. Hasi fájdalom, hasmenések száma 2. Általános állapot 3. Láz, extra manifesztáció (pl. arthritis, uveitis, fistula) 4. Opioid alkalmazása diarrhoea miatt 5. Abdominalis terime 6. Súlycsökkenés 7. Haematokrit (Labor), endoszkópia (szövettan) |
| A betegség aktivitásának meghatározása (CDAI: Crohn-betegség aktivitási index) és dokumentálásának ellenőrzése |
| 1. Inaktív betegség: CDAI<150 2. Enyhe betegség: CDAI<220 3. Közepesen súlyos: 220<CDAI<300 4. Súlyos: 300<CDAI<450 5. Nagyon súlyos: CDAI>450 |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség, SLE kizárása 4. Terhesség kizárása 5. Életvitel módja (fertőzésveszély) 6. Kardiológia (szívultrahang, EF: kisebb, mint 40%) 7. Labor (rutin, immun: ANCA, ANF) |
| A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. Havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K) 2. 3 havonta: aktivitási index (CDAI meghatározása és dokumentálása) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * Fisztulázó Crohn-betegség esetén antibiotikum-terápia, drenázs és immunszuppresszív kezelés ** Elfogadott, dokumentált immunszuppresszív, immunmoduláns terápia *** TNF alfa gátlók: adalimumab, infliximab |
Gyermekkori Crohn-betegségfinanszírozásának ellenőrzési algoritmusa
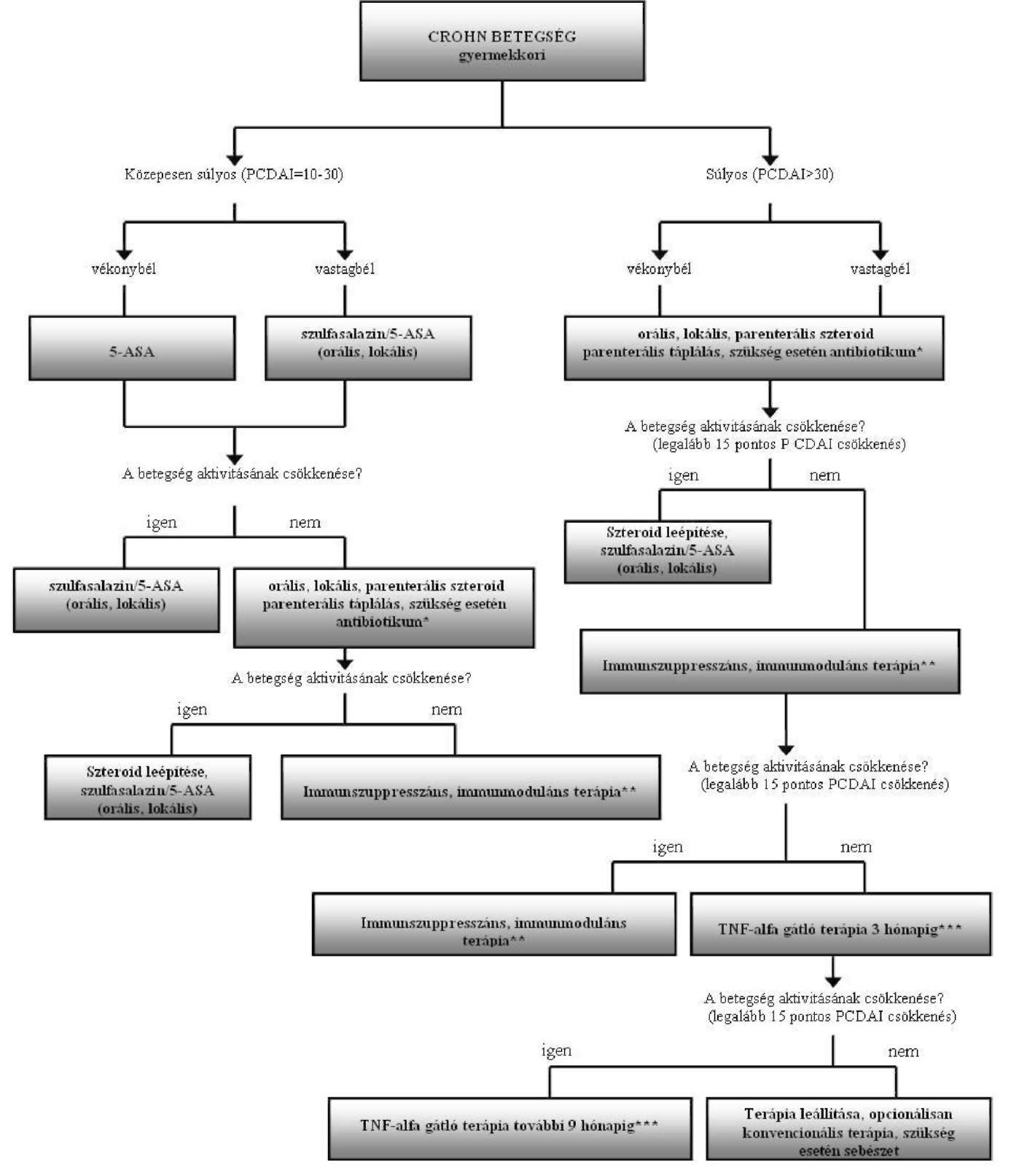
Az Egészségbiztosítási Alap terhére finanszírozott biológiai terápia alkalmazásának ellenőrzési kritériumai a gyermekkori Crohn-betegség gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: K5001, K5011, K5081), klinikai súlyosság meghatározása az alábbi kri tériumok alapján (PCDAI: Pediatric Crohn-betegség aktivitási index, 0-100) |
| 1. Hasi fájdalom, hasmenések száma, vér a székletben 2. Általános állapot 3. Láz, extraintestinalis manifesztáció (pl. arthritis, uveitis) 4. Perirectalis elváltozás 5. Abdominalis terime 6. Súlycsökkenés, növekedési elmaradás 7. Haematokrit, albumin, süllyedés/CRP |
| A betegség aktivitásának meghatározása (PCDAI: Pediatric Crohn-betegség aktivitási index) és dokumentálásának ellenőrzése |
| 1. Inaktív betegség: PCDAI<10 2. Közepesen súlyos: 10<PCDAI<30 3. Súlyos: 30<CDAI<100 |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség, SLE kizárása 4. Kardiológia 5. Labor (rutin, immun: ANCA, ANF) |
| A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. Havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K) 2. 3 havonta: aktivitási index (PCDAI meghatározása és dokumentálása) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * Fisztulázó Crohn-betegség esetén antibiotikum-terápia, drenázs és immunszuppresszív kezelés ** Immunszuppresszív, immunmoduláns terápia: kellő odafigyelést igényel a készítmények törzskönyvi indikációja gyermekek esetén *** TNF alfa gátlók: infliximab |
Spondylitis ankylopoetica finanszírozásának ellenőrzési algoritmusa
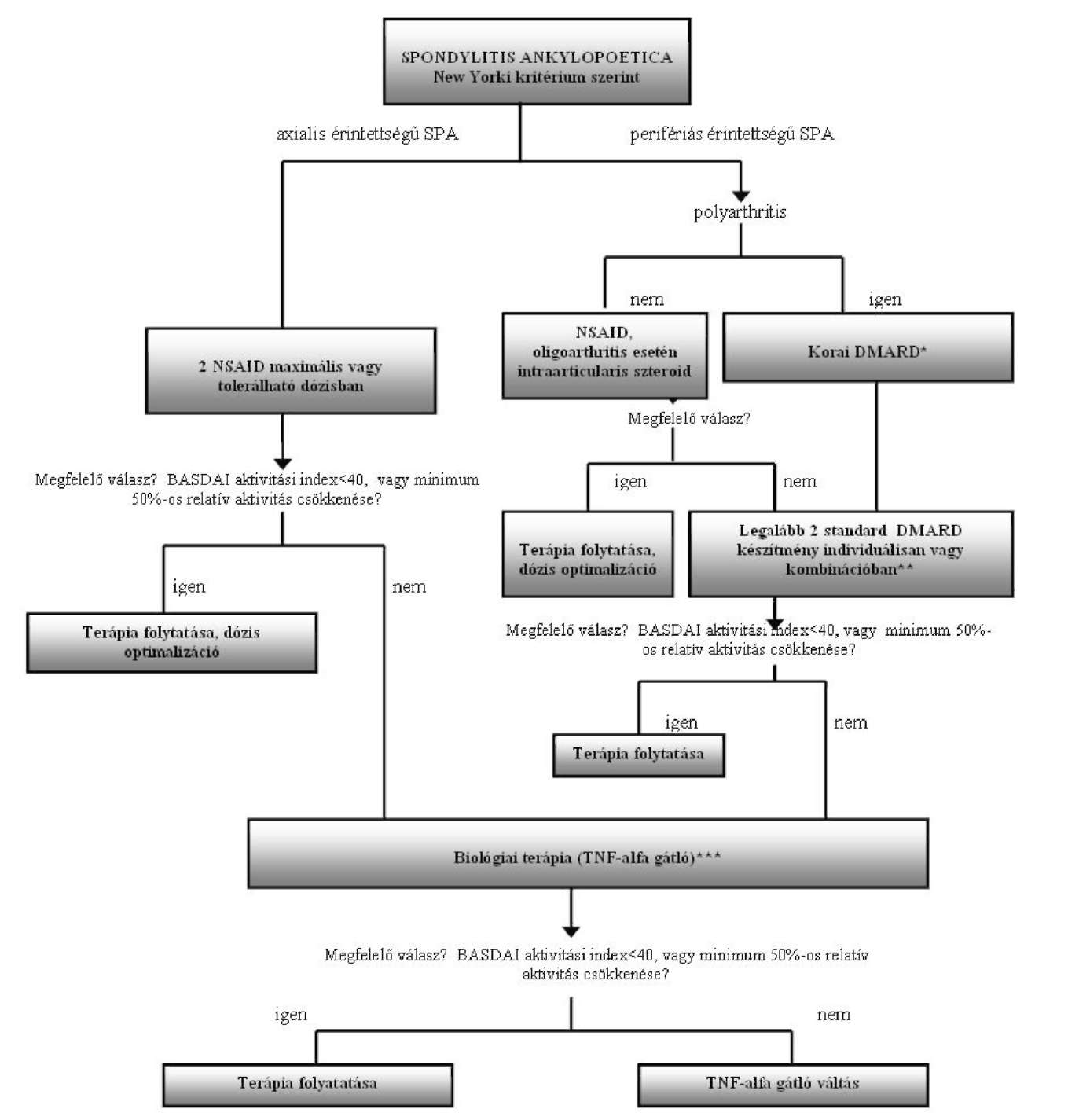
Az Egészségbiztosítási Alap terhére finanszírozott biológiai terápiák alkalmazásának ellenőrzési kritériumai a spondylitis ankylopoetica gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: M45.H0) |
| 1. 2-es stádiumú bilateralis, vagy 2. 3-as, 4-es stádiumú unilateralis sacroiletitis (MR vizsgálat) 3. legalább 3 hónapja mozgásra fokozódó háti fájdalom, 4. frontális és szagittális síkban beszűkült gerincmozgás, 5. beszűkült légzőmozgás |
| A betegség aktivitásának meghatározása (BASDAI INDEX 0-100) és dokumentálásának ellenőrzése |
| 1. BASDAI index (0-100) átlaga több, mint 40 2. klinikai tünetek súlyossága 3. akut fázis fehérjék magas szintje (laborvizsgálat) 4. gyors radiológiai progresszió (RTG felvétel) 5. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel) |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség, SLE kizárása 4. Terhesség kizárása 5. Életvitel módja (fertőzésveszély) 6. Kardiológia (szívultrahang, EF: kisebb, mint 50%) 7. Labor (rutin, immun: RF, anti-CCP, ANA, ANF) A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. Havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K) 2. 3 havonta: aktivitási index (BASDAI) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * Elfogadott DMARD terápiák: metothrexat (MTX), leflunomid (LEF), szulfaszalazin (SSZ), cyclosporin A (CsA), chloroquin (CQ), azathioprin (AZA), speciális esetben (vasculitis) cyclophosphamid (CPH) (csak perifériás érintettség esetén) ** Elfogadott DMARD kombinációk: (Ia szint) MTX + CsA, MTX + SSZ, MTX + CQ, MTX + SSZ + CQ, MTX + CQ + AZA, legújabban MTX + LEF (csak perifériás érintettség esetén) *** TNF alfa gátlók: adalimumab, etanercept, infliximab |
Súlyos tünetekkel járó plakkos psoriasis finanszírozásának ellenőrzési algoritmusa
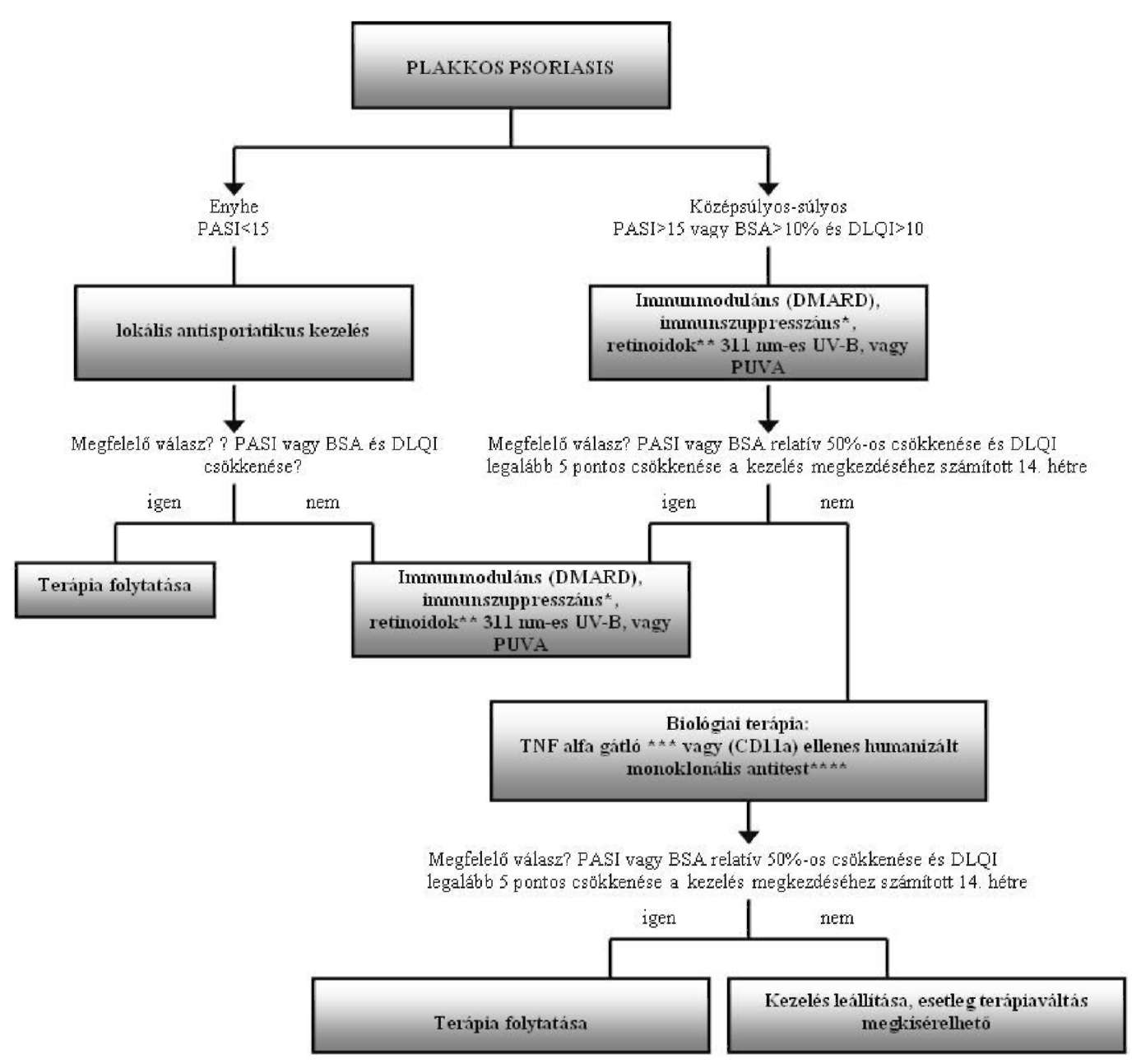
Az Egészségbiztosítási Alap terhére finanszírozott biológiai terápiák alkalmazásának ellenőrzési kritériumai a plakkos psoriasis gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: L4003, L4004, L4005) |
| 1. PASI, BSA, DLQI, dokumentálása 2. Reumatológus konzilium dokumentálása 2. Perifériás ízületi érintettség esetén: DAS28 aktivitási index dokumentálása 3. Axiális ízületi érintettség esetén: BASDAI index dokumentálása |
| A betegség aktivitásának meghatározása és dokumentálásának ellenőrzése |
| 1. Klinikai tünetek súlyossága 2. PASI "psoriasis kiterjedési és súlyossági index" (értéke 0-72 között) 3. BSA "testfelszín százalékban kifejezett értéke" (súlyos 10% felett) 4. DLQI "Bőrgyógyászati Életminőségi Index" (DLQI értéke 0-30 között) 5. Ízületi érintettség esetén: DAS 28, BASDAI index meghatározása |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség kizárása, SLE kizárása 4. Terhesség kizárása 5. Életvitel módja (fertőzésveszély) 6. Kardiológia (szívultrahang, EF: nagyobb, mint 40%) 7. Labor (rutin, immun: ANA, ANF) |
| A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. Havonta: labor (We, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K) 2. 3 havonta: aktivitási index (PASI, BSA, DLQI) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * Standard szisztémás terápiák: immunmoduláns, immunszuppresszáns kezelések: metothrexat (MTX), leflunomid (LEF), cyclosporin A (CsA), terápiás dózisban ** Retinoidok: acitretin *** TNF alfa gátlók: adalimumab, etanercept, infliximab **** CD11a ellenes humanizált monoklonális antitest: efalizumab |
Az arthritis psoriatica finanszírozásának ellenőrzési algoritmusa
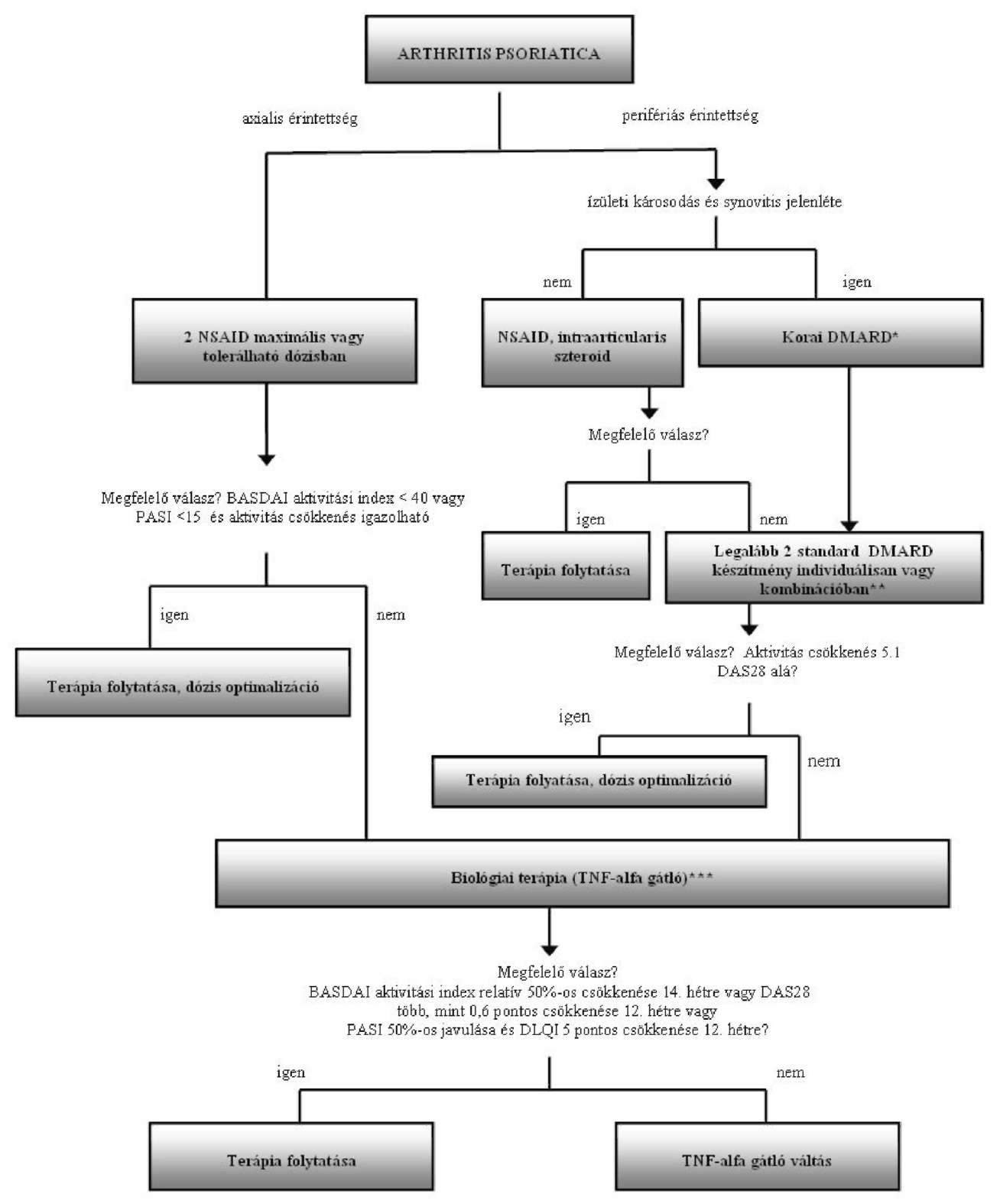
Az Egészségbiztosítási Alap terhére finanszírozott biológiai terápiák alkalmazásának ellenőrzési kritériumai az arthritis psoriatica gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: L40.5, M07.0-M07.3) |
| 1. Moll-Wright kritérium alapján 2. Perifériás érintettség: DAS 28 aktivitási index dokumentálása 3. Axiális érintettség: BASDAI index dokumentálása 4. Dermális érintettség: PASI index dokumentálása |
| A betegség aktivitásának meghatározása (aktivitási index DAS 28) és dokumentálásának ellenőrzése |
| 1. BASDAI index (0-100) átlaga több, mint 40 (axialis) VAGY 2. 5,1 feletti DAS28 aktivitási index (perifériás) VAGY 3. 15 vagy nagyobb PASI index (dermális komponens) 4. klinikai tünetek súlyossága 5. akut fázis fehérjék magas szintje, Wgr, CRP, (laborvizsgálat) 6. gyors radiológiai progresszió (RTG felvétel) 7. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel) |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség, SLE kizárása 4. Terhesség kizárása 5. Életvitel módja (fertőzésveszély) 6. Kardiológia (szívultrahang, EF: nagyobb, mint 50%) 7. Labor (rutin, immun: RF, anti-CCP, ANA, ANF) |
| A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. Havonta: labor (We. Fvs, CRP, AAT, ALAT, GGT, Karb, Kreat, Na, K) 2. 3 havonta: aktivitási index (DAS28, BASDAI, PASI) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * Elfogadott DMARD terápiák: metothrexat (MTX), leflunomid (LEF), szulfaszalazin (SSZ), cyclosporin A (CsA), chloroquin (CQ), azathioprin (AZA), speciális esetben (vasculitis) cyclophosphamid (CPH) (csak perifériás érintettség és bőr tünet esetén) ** Elfogadott DMARD kombinációk: (Ia szint) MTX + CsA, MTX + SSZ, MTX + CQ, MTX + SSZ + CQ, MTX + CQ + AZA, legújabban MTX + LEF (csak perifériás és dermális érintettség esetén) *** TNF alfa gátlók: adalimumab, etanercept, infliximab |
Colitis ulcerosa finanszírozásának ellenőrzési algoritmusa
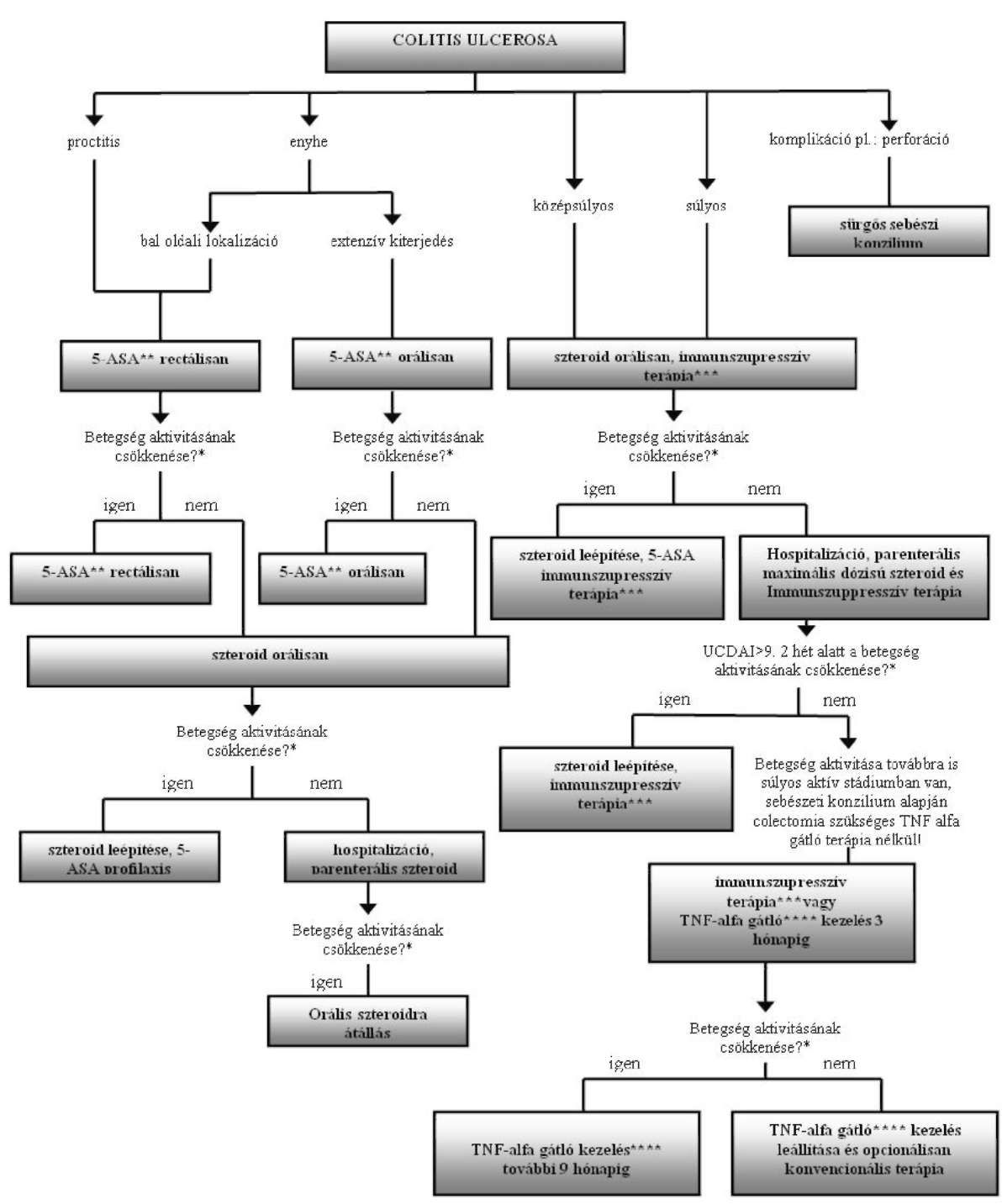
Az Egészségbiztosítási Alapterhére finanszírozott biológiai terápia alkalmazásának ellenőrzési kritériumai a colitis ulcerosa gyógyszeres terápiájának finanszírozási algoritmusa alapján
| Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés) |
| 1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése 2. Betegadatok (online TAJ ellenőrzés) 3. Jogszabályban rögzített indikációs terület BNO ellenőrzése |
| Szakmai ellenőrzési pontok A diagnózis kritériumainak rögzítése (BNO: K51.80, K51.90) MAYO kritériumai alapján |
| 1. széklet napi gyakorisága (0-3 pont) 2. rektális vérzés súlyossága (0-3 pont) 3. nyálkahártya elváltozás: endoszkópia (0-3 pont) 4. fizikális vizsgálat, az orvos általános értékelése (0-3 pont) |
| A betegség klinikai tüneteinek és aktivitásának meghatározása és dokumentálásának ellenőrzése (UCDAI: colitis ulcerosa betegség aktivitási index) |
| 1. Klinikai tünetek Mayo kritériumok alapján: UCDAI maximum 12 pont 2. Enyhe colitis ulcerosa (UCDAI<6) 3. Közepesen súlyos colitis ulcerosa (6<UCDAI>9) 4. Súlyos colitis ulcerosa (UCDAI>9) |
| A biológiai terápia kontraindikációinak kizárása és ellenőrzése |
| 1. TBC kizárása (mellkas RTG) 2. Fertőzések kizárása 3. Demyelinizációs betegség, SLE kizárása 4. Terhesség kizárása 5. Életvitel módja (fertőzésveszély) 6. Kardiológia (szívultrahang, EF: kisebb, mint 40%) 7. Labor (rutin, immun: ANA, ANF) |
| A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat) |
| 1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K) 2. MAYO részleges UCDAI meghatározása (endoszkópia nélkül) 3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából) |
| Megjegyzés |
| * A betegség monitorizálása UCDAI vagy részleges UCDAI alapján ** Gyulladáscsökkentő: 5-ASA (mesalazin) *** Elfogadott, dokumentált immunszupresszív terápiák **** TNF alfa gátló: infliximab |


