22/1996. (VII. 9.) FM rendelet
az állatgyógyászati készítményekről
Az állategészségügyről szóló 1995. évi XCI. törvény 45. §-ának 4. pontjában kapott felhatalmazás alapján, az állatgyógyászati készítmények előállításáról, forgalomba hozataláról, forgalmazásáról és felhasználásáról - az érintett miniszterekkel egyetértésben - a következőket rendelem el:
1. § A rendelet hatálya
a) az állatgyógyászati készítmények hazai előállítására, kiszerelésére (a továbbiakban: előállítás), forgalomba hozatalára, forgalmazására, felhasználására, az importkészítmények forgalomba hozatalára, forgalmazására és felhasználására; továbbá
b) az állatgyógyászati készítményeket előállító, forgalmazó és felhasználó természetes és jogi személyekre, valamint jogi személyiséggel nem rendelkező gazdasági társaságokra
terjed ki.
2. § A rendelet alkalmazásában
a) állatgyógyászati készítmény: minden olyan anyag, készítmény, amelyet az élő állat élettani és kóros állapotának befolyásolására, illetőleg vizsgálatára alkalmaznak, az állatgyógyszerek, állatgyógyászati oltó- és kórjelző anyagok, állatgyógyászati gyógyhatású készítmények, az élettani szükségleten felül adott nem nutritív testidegen takarmánykiegészítő anyagok, telepspecifikus oltóanyagok, magisztrális állatgyógyászati készítmények, állatgyógyászati segédanyagok;
b) törzskönyvezett állatgyógyászati készítmény: a forgalombahozatali engedéllyel rendelkező, törzskönyvbe bejegyzett állatgyógyszer (gyógyszer, gyógypremix, homeopatiás készítmény), gyógyhatású készítmény, oltó- és kórjelző anyag, az élettani szükségleten felül adott nem nutritív testidegen takarmánykiegészítő anyag, az állatgyógyászati segédanyag;
c) vizsgálati készítmény: még nem törzskönyvezett, forgalombahozatali engedéllyel nem rendelkező, a b) pontban felsorolt állatgyógyászati készítmény;
d) magisztrális állatgyógyászati készítmény: a Magyar Gyógyszerkönyvben (a továbbiakban: Gyógyszerkönyv) szereplő anyagokból, illetve törzskönyvezett készítményekből az állatorvos előírása alapján gyógyszertárban egyedi kezelésre készített gyógyszer, mely tovább nem forgalmazható;
e) gyógypremix: gyógyszer hatóanyagot és vivőanyagot, esetleg segédanyagot tartalmazó készítmény, amely gyógyszeres takarmányelőkeverék és gyógyszeres takarmánykeverék előállítására szolgál;
f) állatgyógyászati gyógyhatású készítmény: kizárólag természetes eredetű anyagokat tartalmazó, kedvező biológiai hatást kiváltó, állatorvosi vény nélkül alkalmazható, előírásszerű használat esetén ártalmat nem okozó készítmény;
g) telepspecifikus oltóanyag: egy állatból vagy állatcsoportból izolált kórokozókból előállított készítmény, mely ugyanazon állat vagy állatcsoport, illetve a vele egy telepen tartott egyedek védőoltására szolgál;
h) nem nutritív testidegen takarmánykiegészítő anyagok: tápláló értékkel nem rendelkező, maradékképző anyag - a hozamfokozókat is ideértve -, az állati testnek nem természetes alkotója, amely a takarmánykihasználás fokozására szolgál;
i) előállító: a törzskönyvezett állatgyógyászati készítmény és a telepspecifikus oltóanyag gyártója, illetve kiszerelője;
j) előállítási engedély: az adott törzskönyvezett állatgyógyászati készítmény és telepspecifikus oltóanyag gyártására és/vagy kiszerelésére alkalmas helyre, illetve berendezésre kiadott engedély;
k) forgalombahozatali engedély: a törzskönyvezett állatgyógyászati készítmények forgalomba hozatalát és felhasználását engedélyező okirat;
l) engedélyes: a forgalombahozatali engedély címzettje, aki általában azonos a törzskönyvi dokumentáció tulajdonosával;
m) forgalmazó: aki törzskönyvezett állatgyógyászati készítményekkel kereskedelmi tevékenységet folytat;
n) forgalmazási engedély: a törzskönyvezett állatgyógyászati készítmények kereskedelmi forgalmazására jogosító okirat;
o) élelmiszer-termelő állat: olyan állat, amelynek húsa vagy egyéb terméke az európai étkezési szokásokat figyelembe véve emberi fogyasztásra kerülhet;
p) élelmezés-egészségügyi várakozási idő: az állatgyógyászati készítmény alkalmazása és a kezelt állat levágása, illetve termékének fogyaszthatósága közötti időtartam;
r) kedvtelésből tartott állat: olyan állat, amelynek húsa az európai étkezési szokások figyelembevételével nem szolgálhat emberi fogyasztásra;
s) importőr: aki a külföldi törzskönyvezett állatgyógyászati készítményt Magyarországra behozza;
t) FoNoVet: szabványosított állatorvosi vényminták gyűjteménye, amelyet az állatorvos rendeléskor, a gyógyszerész a magisztrális gyógyszer készítésekor segédletként használ.
3. § (1) Törzskönyvezett állatgyógyászati készítmény és telepspecifikus oltóanyag kizárólag a földművelésügyi miniszter (a továbbiakban: miniszter) előzetes engedélyével állítható elő. Az előállítási engedély iránti kérelmet a Földművelésügyi Minisztériumhoz (a továbbiakban: minisztérium) kell benyújtani.
(2) A megfelelő személyi és tárgyi feltételek megléte esetén az előállítási engedélyt az Állatgyógyászati Oltóanyag-, Gyógyszer- és Takarmányellenőrző Intézet (a továbbiakban: ÁOGYTI) szakvéleménye alapján a miniszter adja ki. Az engedély kizárólag az abban megjelölt helyen folytatott előállításra, gyógyszerformára és készítményre érvényes. Az előállítás személyi és tárgyi feltételeit az 1. számú melléklet tartalmazza.
(3) Törzskönyvezett állatgyógyászati készítmény és telepspecifikus oltóanyag kizárólag állatorvosi, orvosi, gyógyszerészi, vegyészi, vegyészmérnöki vagy biológusi végzettséggel rendelkező személy irányításával és felügyeletével állítható elő.
4. § (1) Vizsgálati készítmény laboratóriumon kívüli gyakorlati kipróbálását a miniszter engedélyezi. A gyakorlati kipróbálást a 2. számú melléklet előírásai szerint, állatorvos irányításával kell végezni. A gyakorlati kipróbálást az illetékes megyei állategészségügyi és élelmiszer ellenőrző állomás (a továbbiakban: Állomás) ellenőrzi. A gyakorlati kipróbálásról készült jegyzőkönyv egy példányát az ÁOGYTI-nek meg kell küldeni. Törzskönyveztetni kívánt készítmény esetében - a vizsgálat eredményétől függetlenül - a jegyzőkönyvet négy példányban a törzskönyvi dokumentációhoz kell csatolni.
(2) A gyakorlati kipróbálásba vont állatokból származó élelmiszerek forgalomba hozatalának és felhasználásának feltételeit (élelmezés-egészségügyi várakozási idő, maradékanyag határértékek) a népjóléti miniszter által kijelölt, élelmezés-egészségügyi kérdésekben illetékes intézet szakvéleménye alapján a miniszter határozza meg.
(3) A megfelelő maradékanyag-vizsgálatokkal még nem rendelkező vizsgálati készítmény esetén a kipróbálásban részt vevő állatcsoport, illetve az azokból származó élelmiszer (ehető testszövetek, tej, tojás, méz) emberi fogyasztásra nem kerülhet.
5. § A külföldi törzskönyvezett állatgyógyászati készítmény behozatalához a miniszter szállítmányonkénti engedélye szükséges. Az engedély iránti kérelemben fel kell tüntetni a törzskönyvezett állatgyógyászati készítmény nevét, mennyiségét, magyarországi törzskönyvi bejegyzés vagy egyedi engedély számát, kiszerelési formáját, előállítási helyét és címét, a forgalmazó nevét, címét, telephelyét.
6. § (1) Állatgyógyászati készítményt - a magisztrális állatgyógyászati készítmény és a telepspecifikus oltóanyag kivételével - belföldön forgalomba hozni, forgalmazni és/vagy felhasználni - takarmányba kevert formában is - csak Magyarországon történt törzskönyvezési eljárás után, forgalombahozatali engedéllyel lehet.
(2) A forgalombahozatali engedély iránti kérelemnek tartalmaznia kell a 3/a), 3/b) és 3/c) számú mellékletben foglalt adatlapok szerinti dokumentációt.
(3) A forgalombahozatali engedélyt a miniszter adja meg. Az engedély megadása előtt a miniszter - az állati testbe nem kerülő kórjelző anyagok kivételével - gondoskodik a népjóléti miniszter egyetértésének beszerzéséről.
(4) A törzskönyvezési eljárás a kérelem benyújtásától számított maximum kettőszáztíz munkanapig tart. Az esetleges hiánypótlásra a kérelmezőt a kérelem benyújtásától számított maximum százhúsz munkanapon belül kell felszólítani. A hiány pótlásáig eltelt idővel a kettőszáztíz napos eljárási időtartam meghosszabbodik.
(5) A forgalombahozatali engedély tartalmazza az engedélyest, az előállítót, a törzskönyvezett állatgyógyászati készítmény összetételét, a javallatot, a kiszerelést, a lejárati időt és tárolási előírásait, az élelmezés-egészségügyi várakozási időt, a hatáserősséget, a rendelhetőséget, a forgalmazására jogosultakat, a használati utasítást és a címkét, a törzskönyvi számot és az esetleges figyelmeztetéseket, a bonthatóságot.
(6) A törzskönyvezett állatgyógyászati készítmény csak a forgalombahozatali engedélyben előírt kiszerelési egységekben, a 4. számú melléklet szerinti címkével és magyar nyelvű használati utasítással hozható forgalomba. Az állatgyógyászati készítmény kiszerelési egységeit a forgalmazás során tilos megbontani.
7. § (1) A forgalomba hozatal engedélyezésére irányuló eljárás során a vizsgálati készítményt a 6. § (3) bekezdésében foglalt egyetértés megszerzésével kell törzskönyvezni.
(2) A törzskönyvezési eljárásban az ÁOGYTI szakértőként közreműködik. Kivételes esetekben a miniszter az eljárásba külső szakértőt von be, továbbá szakértői bizottságot is felkérhet az eljárás eredményes lefolytatásához.
(3) A törzskönyvezési eljárás során szakértőként, illetve szakértői bizottsági tagként nem járhat el az a személy, aki a törzskönyvezés tárgyát képező készítmény előállításában, előzetes vizsgálatában részt vett, illetve, akitől az ügy tárgyilagos megítélése egyébként nem várható el.
(4) A törzskönyvezett állatgyógyászati készítményekről a minisztérium törzskönyvet vezet.
8. § Járványveszély, illetve az ellátás veszélyeztetése esetén a miniszter törzskönyvezési eljárás nélkül eseti behozatali, illetve eseti forgalombahozatali engedélyt adhat ki.
9. § (1) A forgalombahozatali engedély öt évig érvényes. Az engedély érvényessége az engedélyes által kezdeményezett megújítási eljárás során, esetenként legfeljebb öt évvel meghosszabbítható. A megújítás iránti kérelmet a forgalombahozatali engedély érvényességének lejárta előtt hat hónappal kell benyújtani a minisztériumhoz.
(2) A megújítási kérelem benyújtásának elmulasztása vagy a kérelem elutasítása esetén a törzskönyvezett állatgyógyászati készítményt az eredeti határidő lejárta utáni egy éven belül a forgalomból ki kell vonni.
(3) A forgalombahozatali engedély megújítására irányuló kérelemhez csatolni kell a törzskönyvezett állatgyógyászati készítménnyel kapcsolatos minden újabb adatot és információt.
(4) Az engedélyes a törzskönyvezett állatgyógyászati készítményért a forgalombahozatali engedélyben foglaltak szerint felel. Bármely eltérési szándékot (gyártástechnológia, összetétel, csomagolás, használati utasítás stb. megváltoztatását) köteles előzetesen a miniszternek engedélyezés céljából bejelenteni.
(5) A forgalombahozatali engedély megújítására, illetve az attól való eltérésre a 6. § (3) bekezdésében foglaltakat kell alkalmazni.
10. § (1) A minisztérium hivatalos lapjában közzé kell tenni
a) a forgalombahozatali engedély kiadásakor, megújításakor és módosításakor az engedély számát, az engedélyes nevét, a készítmény nevét, javallatát, élelmezés-egészségügyi várakozási idejét, rendelhetőségének módját és a forgalmazásra vonatkozó előírásokat;
b) az engedély visszavonását.
(2) A törzskönyvezett állatgyógyászati készítményt kizárólag a forgalombahozatali engedélyben foglaltakkal összhangban lehet hirdetni és reklámozni.
11. § (1) A törzskönyvezett állatgyógyászati készítmény - a közforgalmú gyógyszertárakban való forgalmazást kivéve - csak külön engedéllyel forgalmazható.
(2)[1] Az állatgyógyászati készítmények forgalmazására jogosító engedélyt, a területileg illetékes Állomás szakvéleménye alapján, a minisztérium adja ki. A minisztérium a kiadott engedélyekről nyilvántartást vezet.
(3)[2]
(4) A törzskönyvezett állatgyógyászati készítmények forgalmazására engedélyt állatorvos vagy gyógyszerész, illetve állatorvost vagy gyógyszerészt foglalkoztató jogi személy vagy jogi személyiséggel nem rendelkező gazdasági társaság kaphat.
(5) A törzskönyvezett állatgyógyászati készítmények kiadását kizárólag állatorvos vagy gyógyszerész, illetve ezek állandó felügyelete mellett gyógyszertári szakasszisztens végezheti.
(6) A forgalmazási feltételekben bekövetkezett bármilyen változást 15 napon belül a forgalmazó az Állomásnak köteles jelenteni. Az Állomás a bejelentésben foglaltakat megvizsgálja, és a vizsgálat eredményéről 15 napon belül jelentést készít a miniszternek.
12. § (1) A forgalmazók - a közforgalmú gyógyszertárak kivételével - a törzskönyvezett állatgyógyászati készítmények bevételezéséről és kiadásáról kötelesek nyilvántartást vezetni. A nyilvántartásnak tartalmaznia kell a törzskönyvezett állatgyógyászati készítmény nevét, származási helyét, gyártási számát, a forgalmazott mennyiséget, a továbbforgalmazó, illetve felhasználó nevét és címét, a kiadás idejét. A nyilvántartást az alapbizonylatokkal együtt három évig meg kell őrizni.
(2) A közforgalmú gyógyszertárak az állatorvosi vényeket, továbbá a 14. § (3) bekezdésében foglalt kimutatást három évig kötelesek megőrizni.
13. § (1) A törzskönyvezett állatgyógyászati készítményeket - a közforgalmú gyógyszertárak kivételével - önálló bejáratú, elkülönített, jól zárható helyen kell tárolni. A készítmények tárolására a Gyógyszerkönyv, valamint a forgalombahozatali engedélyben foglalt előírások, továbbá az állategészségügyi és járványvédelmi jogszabályok az irányadók.
(2) Kábítószer vagy pszichotróp anyag esetén a tartásról, illetve tárolásról külön jogszabályok rendelkeznek.
14. § (1) Vényköteles állatgyógyászati készítmény - állatorvosnak történő kiadás kivételével, amennyiben végzettségét hitelt érdemlően igazolni tudja - kizárólag állatorvosi rendelvényre adható ki. Egy vényre egy állatgyógyászati készítmény rendelhető, és egyszeri alkalommal adható ki.
(2)[3] A vényen fel kell tüntetni az állatorvos nevét, székhelyét, telefonszámát, hivatali beosztását, az állatorvost alkalmazó intézmény nevét, székhelyét, magánállatorvos esetében nevét, címét, telefonszámát, a magángyakorlati nyilvántartási számát. A vényt az állatorvosnak alá kell írni és bélyegző lenyomatával - magánállatorvos esetében a Magyar Állatorvosi Kamara által kiadott bélyegző lenyomatával - el kell látni.
(3) Az állatorvosnak vény nélkül kiadott vényköteles állatgyógyászati készítményről kimutatást kell vezetni, amelyben az átvételt az állatorvos aláírásával kell hitelesíteni.
(4) Kábítószer vagy pszichotróp anyag esetén annak rendelésekor és nyilvántartásakor a külön jogszabályok szerint kell eljárni.
15. § (1) Az állatgyógyászati készítmények rendelése vagy felhasználása alkalmával a használati utasításban foglaltakról az alkalmazást elrendelő állatorvos köteles tájékoztatni az állat tartóját.
(2) Amennyiben az állatgyógyászati készítményt az állat tartója alkalmazza, az elrendelő állatorvos köteles őt írásban tájékoztatni a használat módjáról, a tárolási előírásairól, valamint az élelmezés-egészségügyi várakozási időről. A tájékoztatás szakszerűségéért az állatorvos, az előírásszerű alkalmazásért és az élelmezés-egészségügyi várakozási idő betartásáért az állat tartója a felelős.
(3) Az élelmezés-egészségügyi várakozási idővel jelzett állatgyógyászati készítmények rendeléséről az állatorvos, a felhasználásáról az állattartó nyilvántartást köteles vezetni.
(4) Az állattartó nyilvántartásának tartalmaznia kell
a) az alkalmazott állatgyógyászati készítmény nevét, adagolását és az alkalmazás módját,
b) az alkalmazás időpontját és időtartamát,
c) a kezelt állatok számát és fajtáját.
(5) A nyilvántartásokat három évig meg kell őrizni.
(6) A nyilvántartásokat az Állomás ellenőrzi. A nyilvántartást vezető köteles az ellenőrzést lehetővé tenni.
16. § (1) Élelmiszer-termelő állat számára csak olyan törzskönyvezett állatgyógyászati készítmény rendelhető, amelynek élelmezés-egészségügyi várakozási idejét arra az állatfajra megállapították.
(2) Az (1) bekezdésben meghatározott állatok részére az adott állatfajra nem törzskönyvezett állatgyógyászati készítmény, továbbá embergyógyászati célú, FoNoVet, magisztrális állatgyógyászati készítmény kizárólag egyedi kezelésre és csak akkor rendelhető, ha az állat kezeléséhez az adott állatfajra törzskönyvezett, állatgyógyászati készítmény nem áll rendelkezésre. Ez az előírás vonatkozik a törzskönyvezett állatgyógyászati készítménynek a használati utasításban foglaltaktól eltérő rendelése, illetve alkalmazása esetére is.
(3) A (2) bekezdésben felsorolt esetekben az élelmezés-egészségügyi várakozási időt az alkalmazást elrendelő állatorvos határozza meg. Ennek szakszerűségéért az állatorvos felel. Az élelmezés-egészségügyi várakozási idő nem lehet kevesebb mint
a) tojás és tej esetében 7 nap,
b) hús, illetve ehető testszövetek esetében 28 nap,
c) hal esetében 500 lebomlási nap.
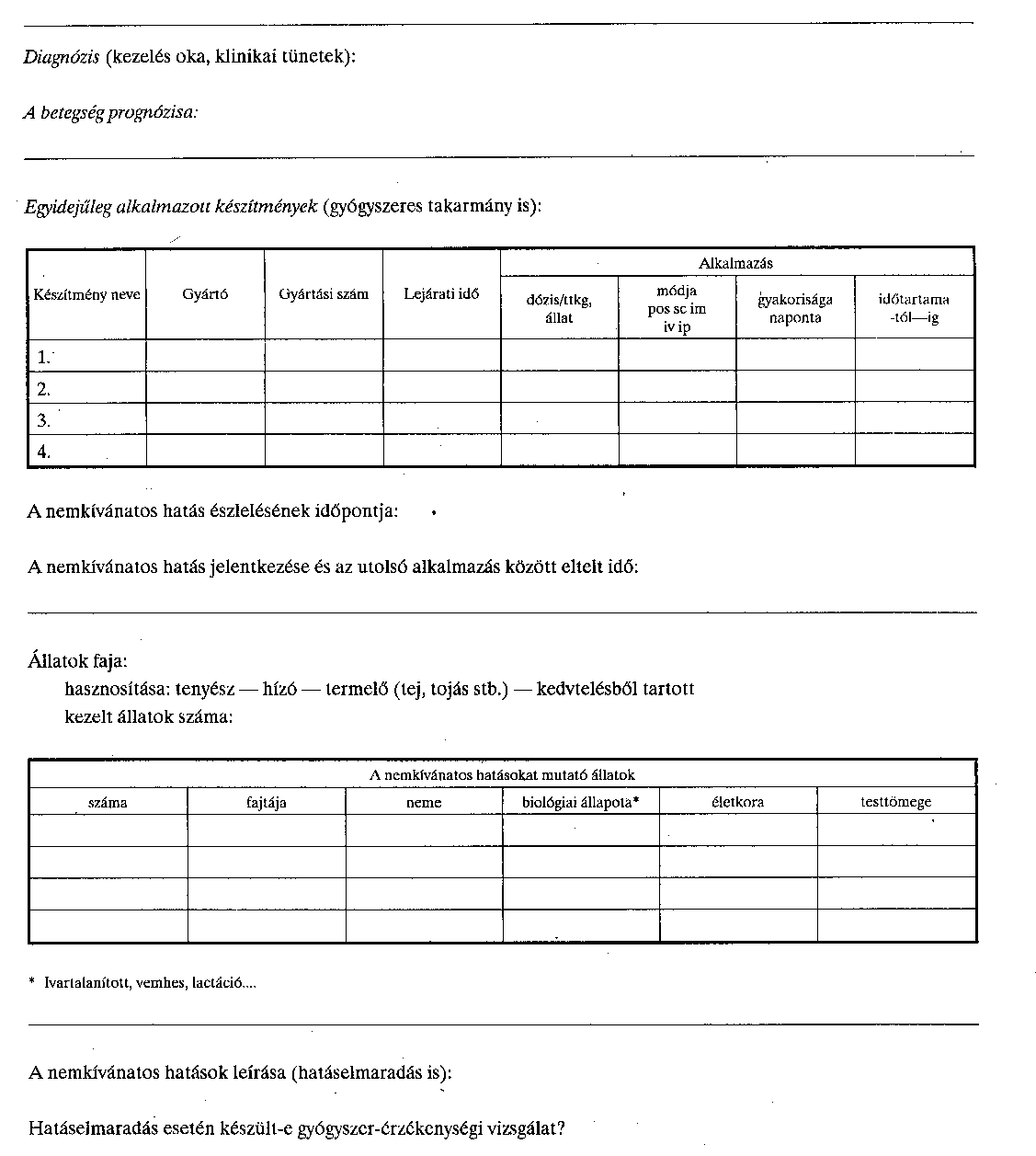
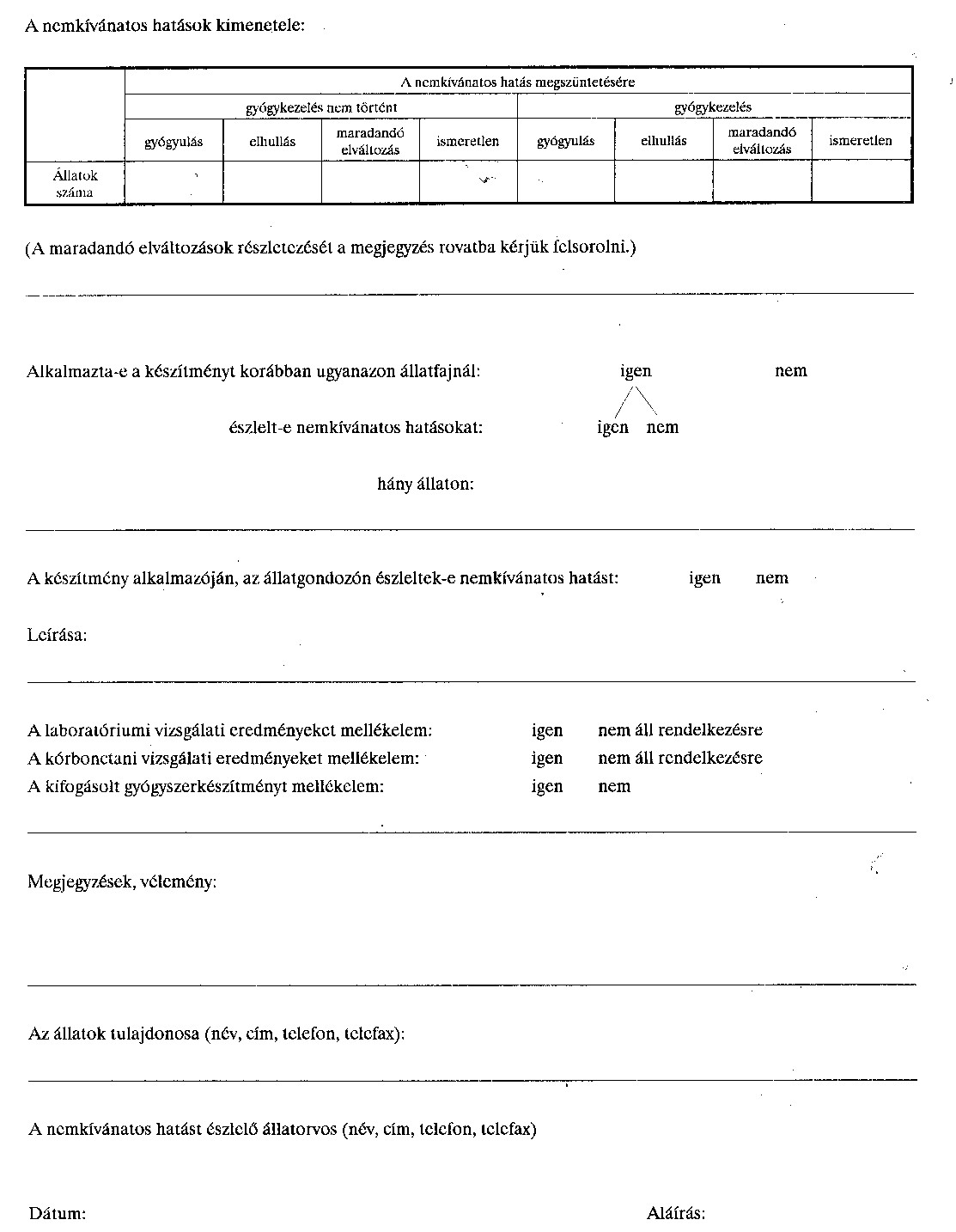
(4) Az állatorvos az 5. számú mellékletben foglaltak szerint azonnal jelenteni köteles az ÁOGYTI-nak és az Állomásnak a törzskönyvezett állatgyógyászati készítmények alkalmazásakor tapasztalt nemkívánatos hatást.
17. § (1) A törzskönyvezett állatgyógyászati készítményeket a hazai előállítónál, import esetében pedig az első tárolási helyén az Állomás, az ÁOGYTI szakértőjével ellenőrzi.
(2) Az állami felhasználásra kerülő, készletezett állatgyógyászati oltó- és kórjelző anyagok valamennyi tételét, a készletbe vétel előtt az ÁOGYTI sterilitási, ártalmatlansági és hatékonysági szempontból megvizsgálja.
(3) A hazai előállító, illetve az importőr, az oltó- és kórjelző anyagok valamennyi gyártási számú tételének a törzskönyvi dokumentációban előírt saját ellenőrzési-vizsgálati eredményét, a forgalombahozatal előtt az előállítás, illetve az első tárolás helye szerint illetékes Állomásnak köteles megküldeni. Az Állomás a forgalombahozatal előtt valamennyi gyártási számu tételből mintát vesz és a dokumentumokkal együtt az ÁOGYTI-nek sterilitási, ártalmatlansági és hatékonysági vizsgálatra megküldi. A laboratóriumi vizsgálat évente - hazai előállítónként, illetve importőrönként - az adott készítmény legalább egy gyártási számú tételére és legfeljebb a tételek 30%-ára terjed ki. Az Állomás, ismételt kifogásoltság esetén 30%-on felüli vizsgálatot is elrendelhet. Az ÁOGYTI a vizsgálat eredményét megküldi az Állomásnak, a vizsgálati eredmény másolatát a fel nem használt mintákkal együtt, az oltó- és kórjelző anyag lejáratát követő egy évig megőrzi.
(4) A (2)-(3) bekezdésben nem szabályozott, egyéb törzskönyvezett állatgyógyászati készítménynek a törzskönyvi dokumentációjában leírt ellenőrző vizsgálatát az ÁOGYTI évente egyszer, szúrópróbaszerűen elvégzi. A vizsgálathoz a minisztérium útmutatása alapján a mintát az Állomás veszi.
(5) Az ÁOGYTI a (3)-(4) bekezdésben foglaltaktól eltérően, valamennyi gyártási tétel sterilitási, ártalmatlansági és hatékonysági, illetve a dokumentációjában leírt ellenőrző vizsgálatát elvégzi azoknál az előállítóknál, akik nem rendelkeznek saját minőség-ellenőrzési részleggel. A mintát a vizsgálathoz az Állomás veszi.
(6) A minisztérium elrendelheti bármely törzskönyvezett állatgyógyászati készítmény gyártási tételenként való sterilitási, ártalmatlansági, hatékonysági, illetve hatóanyag-tartalomra irányuló ellenőrzését. Egy gyártási tételnek minősül az egy munkafolyamat során előállított, a műszaki berendezések kapacitása által meghatározott, azonos gyártási számmal ellátott, törzskönyvezett állatgyógyászati készítménymennyiség.
(7) A telepspecifikus oltóanyag felhasználását - az ÁOGYTI sterilitási és ártalmatlansági vizsgálata után - a minisztérium engedélyezi.
18. § (1) Az Állomás jogosult az előállítónál ellenőrizni az állatgyógyászati készítmények előállítási körülményeit, illetve a forgalombahozatali engedélyben előírtak megtartását.
(2) Az előállítás folyamatának ellenőrzése során az Állomás jogosult betekinteni az előállító nyilvántartásaiba, mintát vehet és azt megvizsgálhatja. A mintavételről jegyzőkönyvet kell készíteni. Az ellenőrzés során az ÁOGYTI szakértőként közreműködik. Az Állomás a mintát az ÁOGYTI-be küldi vizsgálatra.
(3) Mintavétel esetén az előállító ellenminta vételére tarthat igényt, amelyet az eljárás befejezéséig vizsgálatra alkalmas állapotban meg kell őriznie.
19. § (1) A törzskönyvezett állatgyógyászati készítmény előállításának irányítására a 3. § (3) bekezdése szerint jogosult személyek, az előállítás folyamatában, gyártási tételenként nyilvántartást kötelesek vezetni az 1. számú melléklet 9. pontjában felsorolt adatokról.
(2) Az előállító az (1) bekezdés szerinti iratokat és az előállított tétel mintáját köteles a lejárati idő után egy évig, de legalább az előállítástól számított három évig megőrizni, a végtermékre vonatkozó minőség-ellenőrzési bizonylatot és a végtermék vizsgálatra alkalmas mintáját az Állomásnak ellenőrzéskor átadni.
(3) Az előállító a törzskönyvezett állatgyógyászati készítményével kapcsolatos, nem kívánatos hatásokról tudomására jutott információt tizenöt napon belül köteles kivizsgálni, és a vizsgálat lezárását követő három napon belül a vizsgálat eredményét az Állomásnak és az ÁOGYTI-nek megküldeni.
20. § (1) A törzskönyvezett állatgyógyászati készítmények forgalmazásának feltételeit az Állomás ellenőrzi.
(2) A forgalmazóknál az Állomás ellenőrzi, különösen
a) a forgalmazói jogosultságot,
b) a forgalmazás személyi és tárgyi feltételeit,
c) a nyilvántartásokat és vényeket,
d) a törzskönyvezett állatgyógyászati készítmények csomagolásának eredetiségét és sértetlenségét, a használati utasítások meglétét és a lejárati időt,
e) a tárolási körülményeket.
(3) Az Állomás jogosult mintát venni és azt vizsgálatra az ÁOGYTI-ba küldeni. A forgalmazó ellenminta vételét kérheti, amelyet a vizsgálat befejezéséig köteles vizsgálatra alkalmas állapotban megőrizni.
21. § (1) Az ellenőrzés eredményétől függően az Állomás
a) elrendelheti a kifogásolt tétel zárolását, a forgalmazás felfüggesztését, a tétel forgalomból való kivonását, illetőleg felügyelet mellett való ártalmatlanítását,
b) javaslatot tehet a miniszternek a kifogásolt tételnek az országos forgalomból való kivonására, illetőleg a forgalmazási tevékenység megtiltására.
(2) Az Állomás lefoglalja a forgalmazónál talált telepspecifikus oltóanyagot, a kizárólag állatgyógyászati készítményt forgalmazónál talált magisztrális készítményt, továbbá minden olyan állatgyógyászati készítményt, amely nem rendelkezik a rendeletben előírt engedéllyel, és elrendeli azok azonnali ártalmatlanítását.
(3) A forgalmazónál, illetve a felhasználónál szabálytalanul tárolt, de még le nem járt idejű törzskönyvezett állatgyógyászati készítményt az Állomás zárolja. A forgalmazó, illetve a felhasználó a zárolás elrendelését követő 15 napon belül kérheti a zárolt törzskönyvezett állatgyógyászati készítmény újravizsgálatát az Állomástól. Az újravizsgálatot az ÁOGYTI végzi. Amennyiben az újravizsgálatot a forgalmazó, illetve a felhasználó nem kéri, az Állomás az ártalmatlanítást elrendeli.
(4) A törzskönyvezett állatgyógyászati készítmény újravizsgálatakor, annak felhasználhatóságáról - az ÁOGYTI vizsgálata alapján - az Állomás határozatban dönt.
(5) A lejárt, törzskönyvezett állatgyógyászati készítmények esetében a forgalmazó vagy felhasználó a minisztertől kérheti a lejárati idő esetleges hosszabbítását. A kérelmet az ÁOGYTI-hez kell benyújtani, melyhez mellékelni kell az engedélyes egyetértését és az előállító vizsgálati eredményét. Az ÁOGYTI a kérelmet mellékleteivel és szakvéleményével együtt a miniszterhez terjeszti fel. A lejárt törzskönyvezett állatgyógyászati készítmény további felhasználhatóságáról a miniszter dönt.
(6) A bármely ok miatt használhatatlanná vált állatgyógyászati készítményt a forgalmazó, illetve a felhasználó köteles ártalmatlaníttatni.
(7) A (2)-(4) bekezdésben foglalt eljárással kapcsolatos költségek a forgalmazót, illetve a felhasználót terhelik.
(8) Az állatgyógyászati készítmény ártalmatlanításának helyét és módszereit az Állomás az illetékes környezetvédelmi felügyelőséggel és az Állami Népegészségügyi és Tisztiorvosi Szolgálat megyei (fővárosi) intézetével együttesen az illetékességi területükön e rendelet hatálybalépését követő 90 napon belül kijelöli, illetőleg a módszereket meghatározza.
22. § Az ÁOGYTI vizsgálati eredményétől függően javaslatot tehet a miniszternek a törzskönyvezett állatgyógyászati készítmény további forgalomba hozatalának megtiltására, törzskönyvi törlésére, vagy az előállítási engedély visszavonására.
23. § A törzskönyvezéssel és forgalombahozatali engedély kiadásával kapcsolatos díjakról külön jogszabály rendelkezik.
24. § (1) Ez a rendelet a kihirdetése napján lép hatályba, rendelkezéseit 1996. július 1. napjától kell alkalmazni; egyidejűleg az állatgyógyászati készítményekről szóló 24/1994. (V. 4.) FM rendelet hatályát veszti.
(2) Az 1994. május 4. előtt határozatlan időtartamra kiadott forgalombahozatali engedélyeket 1998. január 1. napját követően meg kell újítani.
(3) Ez a rendelet az Európai Megállapodás kihirdetéséről szóló 1994. évi I. törvény alapján az Európai Közösségek jogszabályaihoz való közelítést célozza. Az irányadó és e rendelet alkotásánál figyelembe vett közelítő jogszabályok:
a) a Tanács 81/851/EGK irányelve a tagállamok állatgyógyászati gyógyszerekkel kapcsolatos szabályainak közelítéséről;
b) a Tanács 81/852/EGK irányelve a tagállamok állatgyógyászati termékek vizsgálatára vonatkozó analitikai, gyógyszerészeti és klinikai szabványokkal és követelményrendszerekkel kapcsolatos jogszabályainak közelítéséről;
c) a Tanács 91/412/EGK irányelve állatgyógyászati termékek jó minőségű gyártása elveinek és útmutatóinak megalapozásáról;
d) a Tanács 2377/90/EGK rendelete az állati eredetű ételekben maradó állatgyógyászati termékekből származó maradékok maximális mennyiségének meghatározását szabályozó közösségi eljárásról;
e) a Tanács 92/74/EGK irányelve a 81/851/EGK irányelv hatályának kibővítéséről az állatgyógyászati termékekkel kapcsolatos törvényileg, rendeletileg vagy igazgatási intézkedésekben meghatározott rendelkezések közelítéséről és a homeopátiás állatgyógyászati termékekre vonatkozó kiegészítő rendelkezések meghatározásáról;
f) a Tanács azokat a feltételeket meghatározó 90/167/EGK irányelve, amelyek a gyógyhatású tápanyagok elkészítésére, piacra vitelére és használatára vonatkoznak;
g) a Tanács 70/524/EGK irányelve az adalékanyagokról a takarmányozásban.
1. számú melléklet a 22/1996. (VII. 9.) FM rendelethez
A törzskönyvezett állatgyógyászati készítmények előállításának szabályai
Az állatgyógyászati készítmények ellenőrzés mellett történő és a jó termelési gyakorlatnak megfelelő előállítása biztosítja azt, hogy a készítmények megfeleljenek a minőségi előírásoknak és a gyógyszerfelhasználás követelményeinek. Ezért az előállítónak gondoskodnia kell arról, hogy az állatgyógyászati készítményeket a nemzetközileg is elismert jó termelési gyakorlatnak megfelelően, valamint az előállítási engedélyben foglaltak szerint állítsák elő.
Ezért az előállítónak a következő feltételeket kell teljesítenie:
1. Minden gyógyszer-előállító helyen egy olyan felelős személynek kell lennie, akinek az irányítása alatt a jogszabályban előírt képzettségű szakemberek végzik a készítmények előállítását.
2. Az előállítás folyamatában részt vevő személyek feladatait, egymáshoz való viszonyukat munkaköri leírásban pontosan rögzíteni kell.
3. A folyamatos minőségbiztosítás érdekében gondoskodni kell a szakemberek elméleti és gyakorlati továbbképzéséről.
4. Az előállítási folyamatnak megfelelő higiénés programot kell kialakítani, amely az egészségügyi követelményeket, a személyzet higiénés magatartását és a személyzet ruházatára vonatkozó előírásokat tartalmazza. A gyártásra szolgáló helyiségekben tilos dohányozni, étkezni és bármilyen nem higiénikus tevékenységet folytatni. A programnak tartalmaznia kell a munkavédelmi előírásokat is.
5. Az állatgyógyászati készítmények előállítására szolgáló helyiségeknek és készülékeknek a rendeltetési célnak megfelelő tervezésűnek, elhelyezésűnek, kivitelezésűnek, fenntartásúnak kell lenniük. Ezért
a) a helyiségek elrendezésének, a készülékek tervezésének és működésének olyannak kell lennie, hogy az kizárja vagy a minimálisra csökkentse a hiba lehetőségét, könnyen karbantartható és tisztítható legyen. Továbbá lehetőség szerint kizárható legyen a szennyeződés és a keresztszennyeződés, valamint a készítmény minőségét hátrányosan befolyásoló bármilyen külső hatás,
b) minősíteni kell az előállító helyeket és az előállításhoz használt valamennyi készüléket. A minősítésről jegyzőkönyvet kell készíteni,
c) a higiénikus munkafeltételek megteremtésére az előállító helyeken ruhaváltásra és tisztálkodásra, étkezésre szolgáló helyiségeket kell kialakítani.
Az előállítás
6. Az előállítónak olyan nyilvántartási rendszerrel kell rendelkeznie, amely tartalmazza a meghatározásokat, a gyártási előírásokat és folyamatokat, a csomagolási előírásokat, a különböző előállítási műveletek elvégzésének dokumentálását. A dokumentációnak érthetőnek, hibátlannak és naprakésznek kell lennie. Az általános, előre meghatározott előállítási folyamatok és az egyes gyártási számok dokumentumainak egyaránt hozzáférhetőeknek kell lenniük. A hozzáférhetőség biztosítja az egyes gyártási számok előállítási, gyártási folyamatának nyomon követését. A gyártási számok dokumentációját a lejárati idő után egy évig, de legalább három évig meg kell őrizni.
7. Amennyiben az írott nyilvántartás helyett elektronikus, filmes vagy más hasonló rendszert használnak, akkor az előállítónak e rendszert engedélyeztetnie kell. Gondoskodni kell az ilyen módon tárolt adatok olvashatóvá tételéről. Az elektronikusan tárolt adatokat védeni kell a megsemmisüléstől, a károsodástól (pl. másolattal vagy más adattároló rendszerre való átvitellel).
8. A gyártási előirat nem tartalmazhat kézzel írott javítást vagy megjegyzést. Ha az előiraton változtatás szükséges az előiratot újra kell írni. Idejétmúlt előiratot vissza kell vonni, azt azonban dokumentumként meg kell őrizni.
9. Minden készítmény minden gyártási tételének előállításáról nyilvántartást kell vezetni. A nyilvántartásnak tartalmaznia kell:
a) a gyártási előirat megfelelő részeit,
b) a készítmény nevét, mennyiségét és gyártási (műszaki) tételszámát,
c) a különböző előállítási szakaszok időpontjait,
d) az előállítás minden részletét, beleértve az alkalmazott készülékekre való hivatkozást is,
e) az előállítás során felhasznált minden alapanyag gyártási tételszámát (vagy vizsgálati számát),
f) az elvégzett gyártásközi ellenőrzések jegyzékét és eredményét, beleértve az értékhatárokat is,
g) a műveletet végző személyek kézjegyét, valamint az előállítási folyamatért felelős személy aláírását és az aláírás keltét,
h) a gyártási tételre vonatkozó minden vizsgálati jegyzőkönyvet vagy ezek elhelyezésére való utalást,
i) a gyártási tétel felszabadítását vagy visszautasítását, a döntésért felelős személy aláírását és a dátumot.
10. Az előállítást a gyártási előiratnak megfelelően és a jó termelési gyakorlat betartásával kell végezni. A szükséges gyártásközi ellenőrzést biztosítani kell. Megfelelő technikai és/vagy szervezeti rendszabályokkal ki kell zárni a keresztszennyeződést és a keveredéseket. Az új előállítást vagy az előállítási folyamat lényeges módosítását validálni kell. Az előállítási folyamat kritikus pontjait rendszeresen revalidálni kell. Az előállítást kizárólag a jogszabályban előírt végzettségű szakemberek végezhetik és ellenőrizhetik. Az előállítás során a gépeket, edényeket és tartályokat megfelelő címkézéssel egyértelműen azonosíthatóvá kell tenni. Minden előállító részlegen a napi tevékenységről feljegyzést kell készíteni.
Minőség-ellenőrzés
11. Az előállítónak minőség-ellenőrzési részleget kell létesítenie és fenntartania. Ezt a részleget megfelelő képzettségű szakembernek kell irányítania és a többi részlegtől függetlennek kell lennie.
12. A minőség-ellenőrző részlegnek rendelkezni kell megfelelő személyi állománnyal, szükség szerint felszerelt laboratóriummal, mely lehetővé teszi az alapanyagok, a csomagolóanyagok, a gyártásközi és a késztermékek ellenőrzését. Külső laboratórium igénybevételét a minisztérium engedélyezi.
13. A végtermék ellenőrzése során, a forgalombahozatali engedélyezés előtt a minőség-ellenőrző részleg az analitikai vizsgálati eredményeken kívül egyéb lényeges adatokat is figyelembe vesz, úgy mint az előállítás körülményeit, a gyártásközi ellenőrzések eredményeit, a gyártási dokumentumok vizsgálatát és az egyéb előírások betartását, beleértve a végtermék végső csomagolását is.
14. A minőség-ellenőrző részlegnek gondoskodnia kell a jóváhagyott előírások betartatásáról. Kiértékeli a gyártási lapokat, felelős az anyagok és készítmények felszabadításáért vagy visszautasításáért. Folyamatosan figyelemmel kíséri a készítmény stabilitását, felelős a minőségi panaszok kivizsgálásáért is.
15. Minden gyártási tétel végtermékéből mintát kell venni, és azt a lejárati idő után egy év időtartamig, de legalább három évig meg kell őrizni. A felhasznált alapanyagokból az oldószerek, a gázok és a víz kivételével mintát kell venni, és azt a készítmények forgalomba kerülése utáni két évig meg kell őrizni. Amennyiben hosszabb időtartam van előírva a megőrzésre, úgy a mintákat ennek megfelelően kell megőrizni. A mintákat igény esetén a hatóságok rendelkezésére kell bocsátani.
Késztermékek
16. A késztermékeket az előállító cég termékei számára előírt módon kell raktározni.
17. Az egyes gyártási tételek kiszállításáról megfelelő nyilvántartást kell vezetni annak érdekében, hogy a gyártási tétel szükség esetén a forgalomból könnyen kivonható legyen. A hatóságokat azonnal értesíteni kell, ha egy vagy több gyártási tételt annak meg nem felelő volta miatt a forgalomból ki kell vonni.
Bérgyártás
18. Az állatgyógyászati készítmények bérgyártása során bármely gyártási művelet vagy az ahhoz kapcsolódó bármely részmunka kizárólag a szerződő felek - a bérgyártást végeztető és a gyártó - közötti, írásban foglalt szerződés alapján végezhető.
19. A szerződésnek tartalmaznia kell a felek kötelezettségeit, különös tekintettel a jó termelési gyakorlatnak a bérgyártást végző részéről történő betartását. A bérgyártást végzőnek kötelezettséget kell vállalnia arra, hogy felelős alkalmazottja minden egyes gyártási számú végtermék felhasználását teljes felelősséggel engedélyezi.
20. A bérgyártást végző a gyártás mások által történő elvégzésére kizárólag a bérgyártást végeztető írásos felhatalmazása alapján adhat megbízást.
Reklamáció és a törzskönyvezett állatgyógyászati készítmények visszavonása
21. Az előállítónak a készítményeivel kapcsolatos reklamációk nyilvántartására, a reklamációk kivizsgálására és szükség esetén a felhasználás alatt lévő készítmények gyors visszavonására egy nyilvántartási rendszert kell fenntartania. Az előállítónak minden minőségi kifogást nyilván kell tartania, és azt ki kell vizsgálnia. Minden olyan minőségi kifogásról, amely a készítmény felhasználásának korlátozását vagy annak visszavonását eredményezheti, az illetékes hatóságot értesítenie kell.
2. számú melléklet a 22/1996. (VII. 9.) FM rendelethez
Vizsgálati készítmények laboratóriumon kívüli gyakorlati kipróbálása
I.
A gyakorlati kipróbálás során tisztázni kell, hogy a vizsgált gyógyszerkészítmény rendelkezik-e az előállító által hirdetett hatással. Meg kell határozni állatfaj és korcsoport szerinti javallatát, ellenjavallatait és mellékhatásait.
A gyakorlati kipróbálási kérelemben fel kell tüntetni a készítmény nevét vagy ideiglenes jelzését, minőségi jellemzőit és azok meghatározására szolgáló vizsgálati módszereket, az előállító nevét, a készítmény összetételét, beleértve az alkalmazott segédanyagokat, a készítmény feltételezett hatását, az alkalmazás módját, alkalmazásával laboratóriumban elért eredményeket, és meg kell jelölni a kipróbálás tervezett időtartamát, a területet, a gazdaságot, az állatfajt, a kísérletbe vont állatok számát, továbbá a javasolt élelmezés-egészségügyi várakozási időt.
II.
Az előállító kötelezettségei a kipróbálás során
1. Az előállító csak az általa és az ÁOGYTI által ellenőrzött és megfelelőnek minősített kiszerelt készítményt adhat át gyakorlati kipróbálásra.
2. A kipróbálandó anyagot csak a gyakorlati kipróbáláshoz szükséges mennyiségben és díjtalanul, a miniszter által engedélyezett szervezeteknek küldheti meg, feltéve, hogy a szervezetek előzetes beleegyezését megszerezte. A gyakorlati kipróbálást a területileg illetékes Állomásnak előzetesen be kell jelenteni.
3. Köteles a már rendelkezésre álló vizsgálati eredményeket és a vizsgálati eljárások leírását a minisztérium rendelkezésére bocsátani.
4. Köteles a kijelölt intézménynek vagy gazdálkodó szervezetnek kipróbálásra megküldendő készítmény csomagolásán feltüntetni
a) az előállító nevét,
b) a készítmény nevét vagy ideiglenes jelölését,
c) a javasolt élelmezés-egészségügyi várakozási időt,
d) a hatóanyag és az alkalmazott segédanyag tartalmát,
e) a gyártási számát és tárolási utasítást,
f) az esetleges munkavédelmi előírást,
g) a készítmény ellenszerét.
5. A kipróbálás alatt lévő készítmény kiadásáról nyilvántartást kell vezetni, amelyben a készítmény nevét, gyártási számát, mennyiségét, előállításának és minősítésének idejét, a kipróbálást végző intézmény vagy gazdálkodó szervezet nevét, a készítményből részükre átadott mennyiséget és az átadás időpontját kell feltüntetni.
6. Ha a kipróbálást végző intézménnyel vagy gazdálkodó szervezettel másként nem állapodtak meg, az előállító viseli a kipróbálás költségét, valamint felel a kipróbálással kapcsolatos károkért.
A kipróbálást végző kötelezettségei
1. A gyakorlati kipróbálást az engedélyben meghatározott állatfajon, területen és határidőn belül kell elvégezni.
2. A kipróbálás során a következő adatokat kell feljegyezni:
a) a vizsgálatot végző neve, címe, működési területe,
b) a kezelés helye és időpontja, az állatok tulajdonosának neve és címe,
c) a kipróbálásba bevont állatok pontos száma, azonosítása: faj, tenyészet vagy törzs, kor, testtömeg, nem (ha nőstény, vemhes-e, szoptat-e; nőstény madarak esetében, hogy tojó-e stb.),
d) a tenyésztés és takarmányozás, a takarmányadalékok fajtája és mennyisége,
e) részletes kórtörténet, interkurrens betegség előfordulása és lefolyása,
f) a diagnózis és megállapításának módja,
g) a betegség tünetei,
h) a készítmény neve, gyártási száma, előállítója, adagolása, az alkalmazás módja, gyakorisága,
i) a kezelés időtartama és a kezelést követő megfigyelési idő,
j) kimutatás a vizsgálat alatt álló készítményen kívüli gyógyszerekről (név vagy összetétel, adagolás alkalmazás módja, ideje, milyen állaton vagy csoporton), amelyeket a vizsgálat idején alkalmaztak, akár a vizsgálatot megelőzően, akár azzal egy időben,
k) a klinikai kipróbálások minden eredménye (a kedvezőtlen és negatív eredménye is), a klinikai észlelések és azoknak laboratóriumi analíziseknek, élettani vizsgálatoknak az eredménye, amelyek az értékeléshez szükségesek. Farmakodinamikára, ártalmatlanságra és hatékonyságra vonatkozó megfigyelések (adat- és hatáskapcsolat),
l) farmakokinetikára vonatkozó vizsgálati eredményeket (felszabadulás abszorbció, eloszlás, biotranszformáció, kiürülés),
m) összehasonlító vizsgálatok azonos javallattal alkalmazott ismert készítményekkel,
n) az észlelt mellékhatásoknak minden jellegzetessége, akár káros a mellékhatás, akár nem,
o) az állatok teljesítményére irányuló hatás (pl. testtömeg-gyarapodás, tojásrakás, tejtermelés, reproduktív tevékenység),
p) következtetés levonása az egyedre, illetve az állományra vonatkozóan.
3. A kipróbálást végző felelős az élelmiszernek a kísérleti engedélyben foglaltaknak megfelelő felhasználásáért.
4. A kísérlet értékelésének tartalmaznia kell
a) kezelt állatok számát, faj, tenyészet vagy törzs, kor és nem szerinti felosztásban,
b) a kísérletből, illetve értékelésből kivont állatok számát, indoklását,
c) a kontroll állatok esetében azt, hogy
- egyáltalán nem kaptak kezelést,
- placebót kaptak,
- más, ismert hatású készítményt kaptak (név, összetétel, adag, alkalmazás módja és ideje),
d) az észlelt mellékhatások gyakorisága,
e) a teljesítményre (pl. testtömeg-gyarapodás, tojásrakás, tejtermelés, reproduktív funkció) gyakorolt hatásra vonatkozó megfigyelések,
f) az eredmények statisztikai értékelése, ha azt a vizsgálat megkívánja.
Végül a vizsgálónak általános érvényű következtetéseket kell levonni, kifejezve azt a véleményét, hogy a készítmény előírás szerint használva ártalmatlan-e, és hogy van-e gyógyhatása.
Az eredményeket a kísérlet vezetőjének, a kísérletet végzőknek és a felügyelő állatorvosnak kell aláírnia, és az illetékes állomással láttamoztatni kell.
3/a) számú melléklet a 22/1996. (VII. 9.) FM rendelethez
Adatlap az állatgyógyszer, gyógypremix, nem nutritív testidegen takarmánykiegészítő, állatgyógyászati homeopatiás készítmények forgalombahozatali engedélykérelméhez
(4 példányban, magyarul vagy angolul)
A) Általános adatok
A kérelem benyújtójának neve, címe:
A termék gyártójának neve, címe, külföldi gyártó esetén igazolás, hogy a gyártóhely hatóságilag engedélyezett és ellenőrzött:
A termék neve és hatóanyaga(i):
A termék külföldön jóváhagyott-e, igen/nem; mely országokban (importkészítmények esetében másolat az eredeti törzskönyvi és forgalombahozatali engedélyről):
Gyógyszerforma. A termék rövid leírása:
Állatfaj:
Javallat:
Alkalmazás:
Adagolás:
Csomagolás, kiszerelés:
Eltarthatóság:
Mellékhatások:
Más szerekkel való kölcsönhatás/összeférhetetlenség:
Ellenjavallatok:
Élelmezés-egészségügyi várakozási idő és a garantált maradékanyagszint:
Környezetvédelmi előírások (csomagolóanyagok kezelése):
Munkaegészségügyi előírások:
B) Analitika
A készítmény neve:
A készítmény komplett minőségi és mennyiségi összetétele:
Biológiai készítmények esetében értelemszerűen az azonosításra alkalmas jellemzők:
Rövid gyártástechnológia:
A termék előállításához felhasznált anyagok ellenőrzése:
Ható-, segéd- és vivőanyagok:
Gyógyszerkönyvben szereplő anyagok:
Gyógyszerkönyvben nem szereplő anyagok:
Gyártásközi ellenőrző vizsgálatok:
A végtermék ellenőrző vizsgálata:
Általános jellemzők: megjelenés, szemcseméret, forma, szín, szag, megkülönböztető jegyek stb. Gyógypremixek esetében azon tulajdonságok vizsgálata, amelyek homogén és stabil tápok előállítását biztosítják.
Hatóanyag(ok) azonosítása és mennyiségi meghatározása, vagy más jellegű ellenőrző vizsgálatok, az alkalmazott módszer leírásával kiegészítve (beleértve, ha szükséges, illetve a termék jellege megköveteli, biológiai és/vagy mikrobiológiai vizsgálatokat):
Segéd- és vivőanyag(ok) azonosítása és mennyiségi meghatározása (ha szükséges):
Stabilitási vizsgálatok, legalább három különböző gyártási számmal elvégezve, a forgalmazás során alkalmazott csomagolásban:
Esetleges bomlástermékek és szennyezők megnevezése:
A bevizsgált gyártási tételek száma:
Tárolási körülmények:
Alkalmazott vizsgálati módszerek:
Eltarthatóság:
Gyógypremixekből előállított tápok eltarthatósága:
Stabilitásra vonatkozó adatok a készítmény alkalmazása során (például ivóvízben történő alkalmazás esetén):
C) Toxikológiai és farmakológiai vizsgálatok
Toxikológiai vizsgálatok:
Akut toxicitás:
Szubakut toxicitás:
Krónikus toxicitás:
Toleranciavizsgálat a célállatfaj(ok)on:
Mutagenitási vizsgálat:
Karcinogenitási vizsgálat:
Embriotoxicitás:
Fertilitási és teratogenitási vizsgálatok:
Speciális toxikológiai vizsgálatok:
allergizáló hatás:
lokális irritáló hatás:
A toxikológiai vizsgálatok kísérleti elrendezésének indoklása:
Farmakodinámiás vizsgálatok:
Egyéb élettani vizsgálatok:
Interakció:
Farmakokinetika:
felszívódás [a hatóanyag(ok) szérumszintje(i), lokális kezelést célzó készítmények szisztémás felszívódása is]:
hatóanyag(ok) eloszlása a szervezetben:
biotranszformáció:
a hatóanyag(ok) és/vagy a metabolit(ok) kiválasztása:
passzázsvizsgálat, rezisztencia kialakulásának vizsgálata:
D) Gyakorlati alkalmazása
Egyéni és csoportos klinikai vizsgálatok:
Mellékhatások és kölcsönhatások:
E) Közegészségügyi vonatkozások
Maradékanyag-vizsgálatok valamennyi, az indikációban szereplő élelmiszertermelő fajon:
A vizsgálati módszer leírása, megbízhatóságának és érzékenységének feltüntetésével:
Maradékanyagok hatása az élelmiszerek minőségére és feldolgozhatóságára:
A maradékanyag-vizsgálat eredményei alapján a javasolt élelmezés-egészségügyi várakozási idő és indoklása (MRL értékek):
A készítménnyel közvetlen vagy közvetett (a kezelt állatok révén) kapcsolatban álló személyek esetleges veszélyeztetettségének ismertetése:
A készítményt kezelő személyekre vonatkozó elővigyázatosság és/vagy biztonsági szabályok leírása:
F) Ökológia
A termék környezetre gyakorolt hatása, lebomlása, a hatóanyag, illetve a metabolitok sorsa a természetben:
Hulladékok és csomagolóanyagok hatása a környezetre:
G)
Kiszerelési forma:
Csomagolás leírása:
Csomagolóanyag leírása:
Használati utasítás:
A beadványhoz csatolni kell
- a készítmény három különböző gyártási számú csomagolási egységét,
- ható-, segéd- és vivőanyagainak mintáját az ellenőrzéshez szükséges mennyiségben.
Négy példányban mellékelni kell:
- az eredeti használati utasítást,
- az eredeti címkét,
- a kiszereléshez felhasznált csomagolóanyagok (öntapadós címke, faltkarton),
- a magyar nyelvű használati utasítás szövegtervezetét.
3/b) számú melléklet a 22/1996. (VII. 9.) FM rendelethez
Adatlap az állatorvoslásban használatos oltó- és kórjelző anyagok forgalombahozatali engedélykérelméhez
(4 példányban, magyarul vagy angolul)
A kérelem benyújtójának neve, címe:
A termék gyártójának neve, címe:
A termék neve:
A termék külföldön jóváhagyott: igen/nem,
mely országokban:
eng. okirat másolatok:
A termék rövid leírása:
Javallat:
Alkalmazás:
Adagolás:
Csomagolás:
Eltarthatóság:
A készítmény mellékhatása:
Más szerekkel történő kölcsönhatás:
Ellenjavallat:
Várakozási idő:
Élelmezés-egészségügyi előírások, vagy az állatokat kezelő személyekre vonatkozó biztonsági szabályzatok:
Az összetevők és mennyiségi sajátosságai:
A készítmény gyártási eljárása:
A készítmény előállítására használt baktérium/vírustörzs izolálásának időpontja:
helye (intézet):
Az izolálás módja (anyag és módszer, átoltások száma):
Az izolált törzs azonosítására alkalmas biológiai, genetikai és egyéb jellemzők:
Az izolálást végző szakember neve, képzettsége, beosztása:
A készítmény gyártási módja:
A készítmény előállításához felhasznált anyagok ellenőrzése:
Hatóanyagok:
Gyógyszerkönyvben felsorolt anyagok (esetleges kiegészítő vizsgálatok):
Az anyag megnevezése:
Az anyag leírása:
Azonosítási módszer:
Sterilitási vizsgálat:
Vizsgálati módszer:
Egyéb összetevők:
Gyógyszerkönyvben felsorolt anyagok (esetleges kiegészítő vizsgálatok):
Gyógyszerkönyvben nem szereplő anyagok:
Az anyag leírása:
Azonosítási módszer:
Sterilitási vizsgálat:
Vizsgálati módszer:
Egyéb összetevők:
Gyártás közben végzett ellenőrző vizsgálatok:
A végtermék ellenőrző vizsgálata:
Sterilitási vizsgálat:
Ártalmatlansági vizsgálat (idegen kórokozó kizárására irányuló vizsgálatok):
Hatékonysági vizsgálat:
A készítmény klinikai (hatástani, dózishatástani) vizsgálata (laboratóriumi és üzemi kísérletek):
A kipróbálást irányító szakember neve, munkahelye, beosztása:
A készítmény vizsgálatának helye és időpontja:
A kísérletek és a kísérleti körülmények részletes leírása, az eredmények ismertetése és értékelése:
A termék toxikológiai, ártalmatlansági vizsgálata:
Akut toxicitás vizsgálata:
Szubakut toxicitás vizsgálata:
A krónikus toxicitás vizsgálata:
Teratológiai vizsgálatok:
Fertilitásra és utódokra gyakorolt hatások felderítésére irányuló vizsgálatok:
Mutagén és kancerogén tulajdonságokra irányuló vizsgálatok:
Mellékhatások:
Helyi reakciók:
A készítmény általános és helyi reziduális hatása:
Általános reakciók:
Az élelmezés-egészségügyi várakozási idő megállapítására irányuló vizsgálatok:
Összefoglaló és értékelő szakértői vélemény:
Eltarthatóság vizsgálata:
Tartósítás módja:
Eltarthatóság időtartama:
Eltartás módja (tárolási útmutató a felhasználó számára):
Az eltarthatósági kísérletek eredményei:
A készítmény és csomagolásának ökológiai vonatkozásai:
A készítmény kiszerelése:
Kiszerelési (csomagolási) mód:
Címke felirat:
A csomagoláshoz mellékelt használati utasítás teljes szövege:
Egyéb mellékletek (a törzskönyvi dokumentáció értékelését elősegítő egyéb csatolt mellékletek: tudományos publikációk, előadások újítási szabadalmi okmányok felsorolása):
3 db kiszerelési egység.
3/c) számú melléklet a 22/1996. (VII. 9.) FM rendelethez
Adatlap állatgyógyászati segédanyagok, állatgyógyászati gyógyhatású készítmények forgalombahozatali engedélykérelméhez
(4 példányban, magyarul vagy angolul)
Javasolt elnevezés:
Előállító neve és címe:
A készítményt előállító üzem (laboratórium) telephelye, engedélyszáma:
Az előállításért felelős személy neve, szakképzettsége, címe és telefonszáma:
A készítmény rövid leírása:
Mellékelt minta mennyisége:
Az adatlapot kitöltő felelős személy neve, címe, telefonszáma:
A készítmény összetétele:
Rövid technológiai leírás:
A kiindulási anyagok minősége:
A készítmény ártalmatlanságára és hatásosságára vonatkozó adatok, tapasztalatok és vizsgálatok rövid összefoglalása:
A csomagolás módja és a csomagolóanyag minőségének leírása:
A készítmény és csomagolásának ökológiai vonatkozásai:
A csomagolóanyagon megjelenő felirat terve:
Javasolt tárolási feltételek és megindokolt eltartási idő (stabilitási adatok):
Használati utasítás:
Egyéb közlendők:
3 db kiszerelési egység.
4. számú melléklet a 22/1996. (VII. 9.) FM rendelethez
Törzskönyvezett állatgyógyászati készítmények címkézése és használati utasítása
A készítmények csomagolási egységein a következő adatokat kell feltüntetni:
a) a készítmény neve:
b) a készítmény összetétele:
c) gyártási száma:
d) törzskönyvi szám, engedélyszám:
e) az előállító neve, telephelye:
f) javallat, állatfaj:
g) élelmezés-egészségügyi várakozási idő:
h) a lejárati idő:
i) tárolási utasítás:
j) "Csak állatgyógyászati célra!" felirat és álló kék kereszt,
k) rendelhetőség (vénymentes, vényköteles)
l) EAN-szám vagy -kód,
m) "Gyermekek elől elzárva tartandó!"
Az ampullán a következő adatokat kell feltüntetni:
a) a készítmény neve, alkalmazás módja:
b) a hatóanyag(ok) mennyisége:
c) a készítmény gyártási száma:
d) a lejárati idő:
e) A. U. V.
A használati utasításnak a következő adatokat kell tartalmaznia:
a) a gyártó neve és címe:
b) az állatgyógyászati készítmény neve, összetétele:
c) a készítmény javallatai, ellenjavallatai és mellékhatásai:
d) törzskönyvi szám, engedélyszám:
e) rendelhetőség (vényköteles, vénymentes):
f) az állatfaj(ok) adagolás és az alkalmazás módja:
g) élelmezés-egészségügyi várakozási idő:
h) munkavédelmi és környezetvédelmi rendszabályok:
Külföldi készítmény esetén magyar nyelvű használati utasítást kell mellékelni.
5. számú melléklet a 22/1996. (VII. 9.) FM rendelethez
Adatlap feltételezhetően az állatgyógyászati készítmények okozta nemkívánatos gyógyszerhatások bejelentésére
Lábjegyzetek:
[1] A 22/1996. (VII. 9.) FM rendelet 11. §-ának 2. bekezdése a 40/1998. (X. 21.) FVM rendelet 1. §-ának megfelelően módosított szöveg
[2] A 22/1996. (VII. 9.) FM rendelet 11. §-ának 3. bekezdését a 40/1998. (X. 21.) FVM rendelet 2. § 2. bekezdése hatályon kívül helyezte
[3] A 22/1996. (VII. 9.) FM rendelet 14. §-ának 2. bekezdése a 8/1998. (III. 18.) FM rendelet 1. §-ának megfelelően módosított szöveg


