7/2014. (I. 29.) EMMI rendelet
egyes gyógyszerészeti tárgyú és egyéb, a civil szervezetek támogatásával kapcsolatos rendeletek módosításáról
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés c) pontjában kapott felhatalmazás alapján, az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 41. § b) pontjában meghatározott feladatkörömben eljárva - az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 73. § b) pontjában meghatározott feladatkörében eljáró nemzetgazdasági miniszterrel egyetértésben -,
a 2. alcím, valamint a 8. és a 9. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés a) pontjában kapott felhatalmazás alapján, az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 41. § b) pontjában meghatározott feladatkörömben eljárva,
a 3. alcím tekintetében az egyesülési jogról, a közhasznú jogállásról, valamint a civil szervezetek működéséről és támogatásáról szóló 2011. évi CLXXV. törvény 73. § (2) bekezdés a), c), d) és e) pontjában, valamint az államháztartásról szóló 2011. évi CXCV. törvény 109. § (5) bekezdésében kapott felhatalmazás alapján, az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 41. § p) pontjában meghatározott feladatkörömben eljárva - az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 73. § b) pontjában meghatározott feladatkörében eljáró nemzetgazdasági miniszterrel egyetértésben -
a következőket rendelem el:
1. A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet módosítása
1. § A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet (a továbbiakban: R.) 2. § c) pontja helyébe a következő rendelkezés lép:
(E rendelet alkalmazásában:)
"c) hatóanyag: a Gytv. 1. § 38. pontjában ekként meghatározott fogalom;"
2. § Az R. 8. § (6) bekezdés e) pontja helyébe a következő rendelkezés lép:
[A referencia készítmény az a meghatározott (fix) támogatási csoportba tartozó gyógyszer, amely]
"e) csoporton belüli forgalmi részesedése a 10. § (4) bekezdése és a 10/A. § (2) bekezdése szerint megindult fixesítési eljárás kezdőnapját megelőző hét hónapon belül - ide nem értve a fixesítési eljárás kezdőnapját közvetlenül megelőző hónapot - a DOT tekintetében legalább két hónapban a 3%-ot, a 10/A. § szerinti eljárásban az 5%-ot elérte."
3. § Az R. 8. § (8) bekezdése helyébe a következő rendelkezés lép:
"(8) Ha a referencia készítmény forgalomba hozatali engedélyének jogosultja a megrendeléseket bizonyítottan, egy hónapon keresztül nem tudja teljesíteni, az OEP a készítményt a társadalombiztosítási támogatásból kizárja, és az adott készítmény a következő referencia ár meghatározását követő kilenc hónapban nem részesíthető társadalombiztosítási támogatásban."
4. § (1) Az R. 14. § (1) bekezdés e) pontja helyébe a következő rendelkezés lép:
(A gyógyszer befogadásának egyéb feltételei:)
"e) biológiai gyógyszer, hasonló biológiai gyógyszer esetén
ea) a Tfr. 2. § (2) bekezdés 15. pontja szerinti generikumnak nem minősülő hasonló biológiai gyógyszer a támogatásba befogadott referencia biológiai gyógyszer termelői áránál legalább 30%-kal alacsonyabb termelői áron, az ez után a támogatási rendszerbe kerülő második hasonló biológiai készítmény ehhez képest további legalább 10%-kal, a harmadik készítmény a másodikként belépő gyógyszerhez képest további legalább 10%-kal alacsonyabb termelői áron, minden további belépő a már befogadott legalacsonyabb termelői árú gyógyszernél alacsonyabb termelői áron kerülhet be a támogatási rendszerbe;
eb) ha a Tfr. szerinti referencia biológiai gyógyszer még nem részesül társadalombiztosítási támogatásban, de a Tfr. 2. § (2) bekezdés 15. pontja szerinti generikumnak nem minősülő hasonló biológiai gyógyszer már támogatott, akkor a már támogatott készítménnyel azonos referencia biológiai gyógyszerrel rendelkező második hasonló biológiai készítmény legalább 10%-kal alacsonyabb termelői áron, minden további belépő a már befogadott legalacsonyabb termelői árú gyógyszernél alacsonyabb termelői áron kerülhet be a támogatási rendszerbe;"
(2) Az R. 14. § (1) bekezdés k) pontja helyébe a következő rendelkezés lép:
(A gyógyszer befogadásának egyéb feltételei:)
"k) ha az e) és f) pont alapján az első generikum, illetve generikumnak nem minősülő hasonló biológiai gyógyszer a már elsőként a támogatási rendszerbe vont azonos hatóanyagú gyógyszer, illetve a támogatásba befogadott referencia biológiai gyógyszer termelői áránál legalább 60%-kal alacsonyabb áron került befogadásra, akkor az ezután a támogatási rendszerbe kerülő további gyógyszerek az első generikumnál, illetve hasonló biológiai gyógyszernél alacsonyabb áron kerülhetnek be a támogatási rendszerbe."
5. § Az R. 20. §-a a következő (3a) bekezdéssel egészül ki:
"(3a) Az (1) bekezdés szerinti kérelemhez - ha az kedvezményezetti státusz megítélésére is irányul - csatolni kell a Gyftv. 31/C. § (2) bekezdése szerinti nyilatkozatot."
6. § Az R. 22. § (1) bekezdése a következő e) ponttal egészül ki:
(Egyszerűsített eljárásrend alkalmazandó, amikor a kérelem)
"e) kedvezményezetti státusz megítélésére is"
(érkezett.)
7. § (1) Az R. 25. §-a a következő (11) bekezdéssel egészül ki:
"(11) A 3. számú melléklet EÜ70 21. pontja alapján 2014. február 1-jét megelőzően felírt vények 2014. február 1-jétől az egyes gyógyszerészeti tárgyú és egyéb, a civil szervezetek támogatásával kapcsolatos rendeletek módosításáról szóló 7/2014. (I. 29.) EMMI rendelet 3. melléklet 5. pontjával megállapított EÜ90 34. pont alapján válthatóak ki és számolhatóak el."
(2) Az R. 25. §-a a következő (12) bekezdéssel egészül ki:
"(12) A 3. számú mellékletnek az egyes gyógyszerészeti tárgyú és egyéb, a civil szervezetek támogatásával kapcsolatos rendeletek módosításáról szóló 7/2014. (I. 29.) EMMI rendelet 10. § b) pontjával hatályon kívül helyezett EÜ90 1/d. pontja alapján felírt vények 2014. április 30-ig válthatóak ki és számolhatóak el."
(3) Az R. 25. §-a a következő (13) bekezdéssel egészül ki:
"(13) A 3. számú melléklet EÜ90 4/f. pontja alapján felírt vények EÜ 90 százalékos támogatással 2014. április 30-ig válthatóak ki és számolhatóak el."
8. § Az R.
a) 2. § e) pontjában az "a Tfr." szövegrész helyébe az "az emberi alkalmazásra kerülő gyógyszerek forgalomba hozataláról szóló 52/2005. (XI. 18.) EüM rendelet (a továbbiakban: Tfr.)" szöveg,
b) 5. § (3) bekezdésében a "gyógyszerhatóanyag" szövegrész helyébe a "hatóanyag" szöveg,
c) 8. § (5b) bekezdésében a "10%-kal" szövegrész helyébe a "15%-kal" szöveg,
d) 9. § (4) bekezdés c) pontjában a "10%-kal" szövegrész helyébe a "15%-kal" szöveg,
e) 10. § (2) bekezdésében az "(1a)" szövegrész helyébe az "(1a) és az (1b)" szöveg,
f) 10/A. § (6) bekezdésében az "Amennyiben" szövegrész helyébe a "Hatóanyag fix csoport esetén, ha" szöveg,
g) 10/B. §-ában a "10/A. § (3) bekezdés" szövegrész helyébe a "10/A. § (2) bekezdése" szöveg,
h) 10/E. § (10) bekezdésében a "30%-kal" szövegrész helyébe az "50%-kal" szöveg, a "maximalizált" szövegrész helyébe a "maximált" szöveg,
i) 20. § (1) bekezdés a) pontjában a "megállapítása" szövegrész helyébe a "megállapítása, a kedvezményezetti státusz megítélése" szöveg
lép.
9. § (1) Az R. 1. számú melléklete az 1. melléklet szerint módosul.
(2) Az R. 2. számú melléklete a 2. melléklet szerint módosul.
(3) Az R. 3. számú melléklete a 3. melléklet szerint módosul.
(4) Az R. 3. számú melléklete a 4. melléklet szerint módosul.
(5) Az R. 3. számú melléklete az 5. melléklet szerint módosul.
(6) Az R. 4. számú melléklete a 6. melléklet szerint módosul.
(7) Az R. 6/a. számú melléklete a 7. melléklet szerint módosul.
10. § Hatályát veszti az R. 3. számú melléklet
a) EÜ70 21. és 23. pontja,
b) EÜ90 1/d. pontja,
c) EÜ90 4/f. pontja.
2. A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosítása
11. § (1) A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet (a továbbiakban: R2.) 1. melléklete helyébe a 8. melléklet lép.
(2) Az R2. 2. melléklete helyébe a 9. melléklet lép.
3. A Nemzeti Együttműködési Alappal kapcsolatos egyes kérdésekről szóló 5/2012. (II. 16.) KIM rendelet módosítása
12. § A Nemzeti Együttműködési Alappal kapcsolatos egyes kérdésekről szóló 5/2012. (II. 16.) KIM rendelet 34. §-a a következő (7) bekezdéssel egészül ki:
"(7) Az olyan pályázatot, amelyre vonatkozó támogatási döntés meghozatalára a Módr. hatálybalépésekor még nem került sor, a Módr. hatálybalépését megelőző napon hatályos 11. § (5) bekezdése alapján akkor lehet elutasítani, ha annak a Módr.-rel megállapított 11. § (4) bekezdése szerinti esetben helye van, a támogatási szerződés pedig csak akkor köthető meg az igényelt támogatás legalább ötven százalékának megfelelő támogatási összeggel, ha a támogatás igénylője vállalja, hogy a támogatás célját ekként is megvalósítja vagy legalább a megítélt támogatás és az igényelt támogatás kétharmada közötti különbözetet önrész formájában biztosítja."
4. Záró rendelkezések
13. § (1) Ez a rendelet - a (2)-(4) bekezdésben foglalt kivétellel - a kihirdetését követő napon lép hatályba.
(2) A 7. § (1) bekezdése, a 9. § (1)-(3) és (6) bekezdése, a 10. § a) pontja, a 11. §, az 1-3. melléklet, a 6. melléklet, valamint a 8. és a 9. melléklet 2014. február 1-jén lép hatályba.
(3) A 7. § (2) bekezdése, a 9. § (4) bekezdése, a 10. § b) pontja és a 4. melléklet 2014. március 1-jén lép hatályba.
(4) A 9. § (5) bekezdése, a 10. § c) pontja és az 5. melléklet 2014. május 1-jén lép hatályba.
Balog Zoltán s. k.,
emberi erőforrások minisztere
1. melléklet a 7/2014. (I. 29.) EMMI rendelethez
1. Az R. 1. számú mellékletében foglalt táblázat "B01AB" megjelölésű sora helyébe a következő rendelkezés lép:
| (TÁMOGATÁSI KATEGÓRIÁK | |||||||||
| NORMATÍV | |||||||||
| ATC | ATC MEGNEVEZÉS | 0% | 25% | 55% | 80% | EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KI- EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KÜLÖN- KERET) | |
| ÉRTÉK NÉLKÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | ||||||
| " | |||||||||
| B01AB | heparin csoport | X | X | X | X | X | |||
| " | |||||||||
2. Az R. 1. számú mellékletében foglalt táblázat a "B01AE" megjelölésű sorát követően a következő sorral egészül ki:
| (TÁMOGATÁSI KATEGÓRIÁK | ||||||||
| NORMATÍV | ||||||||
| ATC | ATC MEGNEVEZÉS | 0% | 25% | 55% | 80% | EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KI- EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KÜLÖN- KERET) |
| ÉRTÉK NÉLKÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| B01AF | direkt Xa faktor inhibitorok | X | X | |||||
| " | ||||||||
3. Az R. 1. számú mellékletében foglalt táblázat "B02AB" megjelölésű sora helyébe a következő rendelkezés lép:
| (TÁMOGATÁSI KATEGÓRIÁK | ||||||||
| NORMATÍV | ||||||||
| ATC | ATC MEGNEVEZÉS | 0% | 25% | 55% | 80% | EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KI- EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KÜLÖN- KERET) |
| ÉRTÉK NÉLKÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| B02AB | proteinase inhibitorok | X | ||||||
| " | ||||||||
4. Az R. 1. számú mellékletében foglalt táblázat a "B06AA" megjelölésű sorát követően a következő sorral egészül ki:
| (TÁMOGATÁSI KATEGÓRIÁK | ||||||||
| NORMATÍV | ||||||||
| ATC | ATC MEGNEVEZÉS | 0% | 25% | 55% | 80% | EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KI- EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KÜLÖN- KERET) |
| ÉRTÉK NÉLKÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| B06AC | herediter angioödéma gyógyszerei | X | X | |||||
| " | ||||||||
5. Az R. 1. számú mellékletében foglalt táblázat "M04AA" megjelölésű sora helyébe a következő rendelkezés lép:
| (TÁMOGATÁSI KATEGÓRIÁK | ||||||||
| NORMATÍV | ||||||||
| ATC | ATC MEGNEVEZÉS | 0% | 25% | 55% | 80% | EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KI- EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KÜLÖN- KERET) |
| ÉRTÉK NÉLKÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| M04AA | húgysavképződést gátló készítmények | X | X | |||||
| " | ||||||||
6. Az R. 1. számú mellékletében foglalt táblázat "M05BX" megjelölésű sora helyébe a következő rendelkezés lép:
| (TÁMOGATÁSI KATEGÓRIÁK | ||||||||
| NORMATÍV | ||||||||
| ATC | ATC MEGNEVEZÉS | 0% | 25% | 55% | 80% | EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KI- EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KÜLÖN- KERET) |
| ÉRTÉK NÉLKÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| M05BX | mineralizációra ható egyéb gyógyszerek | X | X | X | ||||
| " | ||||||||
7. Az R. 1. számú mellékletében foglalt táblázat az "N06B" megjelölésű sorát követően a következő sorral egészül ki:
| (TÁMOGATÁSI KATEGÓRIÁK | ||||||||
| NORMATÍV | ||||||||
| ATC | ATC MEGNEVEZÉS | 0% | 25% | 55% | 80% | EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KI- EMELT INDIKÁ- CIÓHOZ KÖ- TÖTT | KÜLÖN- KERET) |
| ÉRTÉK NÉLKÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| N06BA | Centrális hatású sympathomimeticumok | X | X | |||||
| " | ||||||||
2. melléklet a 7/2014. (I. 29.) EMMI rendelethez
1. Az R. 2. számú melléklete a következő EÜ100 8/d3. ponttal egészül ki:
"EÜ100 8/d3.
TÁMOGATOTT INDIKÁCIÓK:
Csontrendszert érintő események (patológiás csonttörés, a csontok besugárzása, gerincvelő kompresszió vagy csontműtét) megelőzése prosztata tumor csontáttéteiben szenvedő felnőtteknél progresszióig (csontszcintigráfia és CT-vel vagy MR-rel detektált változás), ha a betegnél az EÜ100 8/d2. pont alapján rendelhető készítmény
- dokumentáltan ellenjavallt vagy túlérzékenység miatt nem alkalmazható,
- alkalmazása során akut-fázis reakció alakul ki [a kezelés első 3 napján fellépő, lázzal (≥ 38 °C) kísért, hát- vagy ízületi vagy csontfájdalom formájában vagy állkapocs osteonecrosis],
- alkalmazása nem javasolt súlyos vesekárosodás (kreatinin-clearance < 30 ml/perc) vagy a kreatinin-clearance 30-60 ml/perc esetén, vagy az alkalmazási előírás alapján alkalmazandó csökkentett dózis ellenére romló vesefunkció esetén,
- legalább 3 hónapig történő alkalmazása során a betegség progrediál.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Klinikai onkológia | írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Sugártherápia | írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Urológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
C795, C61H0"
2. Az R. 2. számú melléklet EÜ100 28. pont "Kijelölt intézmények:" része helyébe a következő rendelkezés lép:
"Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Országos Korányi TBC és Pulmonológiai Intézet |
| Budapest | Semmelweis Egyetem Pulmonológia Klinika |
| Budapest | Semmelweis Egyetem I.-II. számú Gyermekgyógyászati Klinika |
| Debrecen | Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Tüdőgyógyászati Klinika |
| Debrecen | Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Gyermekgyógyászati Intézet |
| Deszk | Csongrád Megyei Mellkasi Betegségek Szakkórháza, I. sz. Tüdőgyógyászati Osztály |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Miskolc | Miskolci Semmelweis Kórház és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem Klinikai Központ, I. sz. Belgyógyászati Klinika, Tüdőgyógyászat |
| Pécs | Pécsi Tudományegyetem Klinikai Központ Gyermekgyógyászati Klinika |
| Törökbálint | Tüdőgyógyintézet Törökbálint |
| Szeged | Szegedi Tudományegyetem Általános Orvostudományi Kar Gyermekgyógyászati Klinika és Gyermek Egészségügyi Központ, Tüdőgyógyászati Tanszék |
"
3. Az R. 2. számú melléklet EÜ100 34/a. és EÜ100 34/b. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| " | |
| Budapest | Országos Klinikai és Idegtudományi Intézet |
| Budapest | Bajcsy-Zsilinszky Kórház és Rendelőintézet |
| " | |
4. Az R. 2. számú melléklet EÜ100 36/b. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| " | |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| Miskolc | Miskolci Semmelweis Kórház és Egyetemi Oktatókórház |
| Szombathely | Markusovszky Egyetemi Oktatókórház |
| " | |
5. Az R. 2. számú melléklet EÜ100 37/b. és EÜ100 37/c. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorral egészül ki:
| (Város | Intézmény neve) |
| " | |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| " | |
6. Az R. 2. számú melléklet EÜ100 38/b. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| " | |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| Tatabánya | Szent Borbála Kórház, Belgyógyászat Onko-Hematológia részlege |
| " | |
7. Az R. 2. számú melléklet EÜ100 41. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorral egészül ki:
| (Város | Intézmény neve) |
| " | |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| " | |
8. Az R. 2. számú melléklet EÜ100 51. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorral egészül ki:
| (Város | Intézmény neve) |
| " | |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| " | |
9. Az R. 2. számú melléklet EÜ100 53. pontja helyébe a következő rendelkezés lép:
"EÜ100 53/a.
TÁMOGATOTT INDIKÁCIÓK:
- Nagyon aktív relapszáló-remittáló sclerosis multiplex kezelésére monoterápiában, ha a betegek az alkalmazott immunmoduláns kezelésre nem megfelelően reagálnak (a natalizumab kezelést megelőző 1 évben legalább 1 shubbal, friss MRI felvételen legalább 9 T-hyperintenzív lézió vagy 1-nél több Gd halmozódással járó lézió meglétével jellemezhető a betegség aktivitása), rendszeres szakorvosi ellenőrzés mellett (PML-gyanú, neutralizáló antitestek megjelenése és perzisztálása, májfunkció ellenőrzése, hyperszenzitivitás), a secunder progresszív forma kialakulásáig
- Sclerosis multiplex kezelésére monoterápiában, ha a betegség kezdettől gyors és súlyos lefolyású (2 vagy több funkcióvesztést okozó relapszus fordult elő egy év alatt és friss MRI felvételen 1-nél több Gd dúsulással járó lézió vagy megnövekedett T2 góctérfogat), rendszeres szakorvosi ellenőrzés mellett (PML-gyanú, neutralizáló antitestek megjelenése és perzisztálása, májfunkció ellenőrzése, hyperszenzitivitás), a secunder progresszív forma kialakulásáig
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Neurológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
G35H0
Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Péterfy Sándor Utcai Kórház-Rendelőintézet és Baleseti Központ |
| Budapest | Semmelweis Egyetem, Neurológiai Klinika |
| Budapest | Szent Imre Kórház |
| Budapest | Szent János Kórház és Észak-budai Egyesített Kórházak |
| Budapest | Uzsoki Utcai Kórház |
| Budapest | Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet |
| Budapest | Országos Klinikai és Idegtudományi Intézet |
| Budapest | Bajcsy-Zsilinszky Kórház és Rendelőintézet |
| Debrecen | Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Neurológiai Klinika |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| Kecskemét | Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
| Nyíregyháza | Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem Klinikai Központ, Neurológiai Klinika |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Neurológiai Klinika |
| Veszprém | Csolnoky Ferenc Kórház |
| Zalaegerszeg | Zala Megyei Kórház |
| Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház |
EÜ100 53/b.
TÁMOGATOTT INDIKÁCIÓK:
- Nagyon aktív relapszáló-remittáló sclerosis multiplex kezelésére monoterápiában, ha a betegek az alkalmazott immunmoduláns kezelésre nem megfelelően reagálnak (a fingolimod kezelést megelőző 1 évben legalább 1 shubbal, MRI felvételen legalább 9 T-hyperintenzív lézió vagy 1-nél több Gd halmozódással járó lézió meglétével jellemezhető a betegség aktivitása), rendszeres szakorvosi ellenőrzés mellett (az első dózis bevétele után 6 órás megfigyelés, májfunkció és limfocitaszám ellenőrzése), a secunder progresszív forma kialakulásáig
- Sclerosis multiplex kezelésére monoterápiában, ha a betegség kezdettől gyors és súlyos lefolyású (2 vagy több funkcióvesztést okozó relapszus fordult elő egy év alatt és MRI felvételen 1-nél több Gd dúsulással járó lézió vagy megnövekedett T2 góctérfogat), rendszeres szakorvosi ellenőrzés mellett (az első dózis bevétele után 6 órás megfigyelés, májfunkció és limfocitaszám ellenőrzése), a secunder progresszív forma kialakulásáig
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Neurológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
G35H0
Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Péterfy Sándor Utcai Kórház-Rendelőintézet és Baleseti Központ |
| Budapest | Semmelweis Egyetem, Neurológiai Klinika |
| Budapest | Szent Imre Kórház |
| Budapest | Szent János Kórház és Észak-budai Egyesített Kórházak |
| Budapest | Uzsoki Utcai Kórház |
| Budapest | Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet |
| Budapest | Országos Klinikai és Idegtudományi Intézet |
| Budapest | Bajcsy-Zsilinszky Kórház és Rendelőintézet |
| Debrecen | Debreceni Egyetem Orvos- és Egészségtudományi Centrum, Neurológiai Klinika |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| Kecskemét | Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
| Nyíregyháza | Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem Klinikai Központ, Neurológiai Klinika |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Neurológiai Klinika |
| Veszprém | Csolnoky Ferenc Kórház |
| Zalaegerszeg | Zala Megyei Kórház |
| Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház |
"
10. Az R. 2. számú melléklet EÜ100 56. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| " | |
| Tatabánya | Szent Borbála Kórház, Belgyógyászat Onko-Haematológiai részlege |
| Szombathely | Markusovszky Egyetemi Oktatókórház |
| " | |
11. Az R. 2. számú melléklet
a) EÜ100 8/t., 34/a., 34/b., 35., 36/a., 37/a., 37/b., 37/c. és 41. pontjában a "Veszprém Megyei Csolnoky Ferenc Kórház Nonprofit Zrt." szövegrész helyébe a "Csolnoky Ferenc Kórház" szöveg,
b) EÜ100 8/t., 9/b., 23/a., 34/a., 34/b., 36/a., 36/c. és 37/a. pontjában a "Kaposi Mór Oktató Kórház" szövegrész helyébe a "Somogy Megyei Kaposi Mór Oktató Kórház" szöveg,
c) EÜ100 8/t., 23/a., 30/a., 34/a., 34/b., 36/a., 37/a., 39/a. és 39/b. pontjában a "Fejér Megyei Szent György Kórház" szövegrész helyébe a "Fejér Megyei Szent György Egyetemi Oktató Kórház" szöveg,
d) EÜ100 8/t, 9/b., 23/a., 30/a., 34/a., 34/b., 36/a., 36/c, 37/a., 39/a. és 39/b. pontjában a "Jósa András Oktató Kórház Nonprofit Kft." szövegrész helyébe a "Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház" szöveg,
e) EÜ100 8/t., 23/a., 34/a., 34/b., 36/a., 37/a., 41., 42. és 51. pontjában a "Bács-Kiskun Megyei Kórház" szövegrész helyébe a "Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza" szöveg,
f) EÜ100 8/t., 23/a., 34/a., 34/b., 36/a. és 37/a. pontjában a "Pándy Kálmán Megyei Kórház" szövegrész helyébe a "Békés Megyei Pándy Kálmán Kórház" szöveg,
g) EÜ100 9/b. pontjában a "Pest Megyei Tüdőgyógyintézet" szövegrész helyébe a "Tüdőgyógyintézet Törökbálint" szöveg,
h) EÜ100 34/a. és 34/b. pontjában a "Jahn Ferenc Dél-Pesti Kórház" szövegrész helyébe a "Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet" szöveg,
i) EÜ100 36/a. és 36/c. pontjában a "Miskolci Semmelweis Ignác Egészségügyi Központ és Egyetemi Oktató Kórház Nonprofit Kft." szövegrész helyébe a "Miskolci Semmelweis Kórház és Egyetemi Oktatókórház" szöveg
lép.
3. melléklet a 7/2014. (I. 29.) EMMI rendelethez
1. Az R. 3. számú melléklet EÜ70 24. pont "Kijelölt intézmények:" részében foglalt táblázat a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| " | |
| Gyula | Békés Megyei Pándy Kálmán Kórház |
| Kaposvár | Somogy Megyei Kaposi Mór Oktató Kórház |
| " | |
2. Az R. 3. számú melléklete a következő EÜ70 25. ponttal egészül ki:
"EÜ70 25.
TÁMOGATOTT INDIKÁCIÓK:
Krónikus hyperurikaemia kezelésére dokumentált allopurinol intolerancia vagy kontraindikáció esetén, olyan állapotokban, amikor a húgysav szövetekben történő lerakódása már bekövetkezett (beleértve tophusok és/vagy arthritis urica fennállását vagy kórelőzményét).
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Klinikai onkológia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Nefrológia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia és traumatológia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Reumatológia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
E79; M10"
3. Az R. 3. számú melléklete a következő EÜ70 29. ponttal egészül ki:
"EÜ70 29.
TÁMOGATOTT INDIKÁCIÓK:
6 éves vagy idősebb gyermekeknél és serdülőknél, akiknél a DSM-IV kritériumai vagy a BNO-10 irányelvei alapján felállított hiperaktivitás-figyelemzavar szindróma (ADHD), illetve hiperkinetikus zavar diagnózis szerint gyógyszeres kezelésre van szükség.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Gyermek- és ifjúságpszichiátriai járóbeteg szakrendelés | Gyermek- és ifjúságpszichiátria | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
F90"
4. Az R. 3. számú melléklete a következő EÜ90 22/b. ponttal egészül ki:
"EÜ 90 22/b.
TÁMOGATOTT INDIKÁCIÓK:
Nyílt-zugú glaukoma kezelésére olyan betegek részére, akiknél a 22/a. pontban felsorolt gyógyszerekkel szemben orvosilag dokumentált konzerválószer intolerancia áll fenn.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Szemészet | javasolhat és írhat |
| Megkötés nélkül | Szemészet | írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
H4010"
5. Az R. 3. számú melléklete a következő EÜ90 34. ponttal egészül ki:
"EÜ90 34.
TÁMOGATOTT INDIKÁCIÓK:
- ECHO ultrahang vizsgálattal bizonyított szisztolés diszfunkcióval társuló, NYHA II-IV stádiumú, krónikus szívelégtelenségben szenvedő olyan betegeknél, akiknek sinus ritmusuk van, és akiknek a szívfrekvenciája ≥75/perc, béta-blokkolót is magába foglaló standardkezelés mellett, vagy olyan esetekben, amikor a béta-blokkolók alkalmazása ellenjavallt vagy a beteg nem tolerálja azt
- Invazív vagy non-invazív módszerekkel igazolt krónikus stabil angina pectoris tüneti kezelésére sinus ritmusban, ha kombinált antianginás kezelés ellenére tachycardia okozta recurrens angina fennáll béta-blokkolót is magába foglaló standardkezelés mellett, vagy olyan esetekben, amikor a béta-blokkolók alkalmazása ellenjavallt vagy a beteg nem tolerálja azt
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet | Kardiológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I5092, I5093, I5094, I2080"
6. Az R. 3. számú melléklet
a) EÜ70 24. pontjában a "Bács-Kiskun Megyei Kórház" szövegrész helyébe a "Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza" szöveg, a "Jósa András Oktató Kórház Nonprofit Kft." szövegrész helyébe a "Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház" szöveg, a "Fejér Megyei Szent György Kórház" szövegrész helyébe a "Fejér Megyei Szent György Egyetemi Oktató Kórház" szöveg,
b) EÜ90 l/e. pontjában az "egy hónapos" szövegrészek helyébe a "három hónapos" szöveg,
c) EÜ90 22. pont megjelölése helyébe az "EÜ90 22/a." megjelölés
lép.
4. melléklet a 7/2014. (I. 29.) EMMI rendelethez
Az R. 3. számú melléklete a következő EÜ90 l/f. ponttal egészül ki:
"EÜ90 l/f.
TÁMOGATOTT INDIKÁCIÓK:
A legutóbbi Magyar Kardiovaszkuláris Terápiás Konszenzus Konferencia terápiás ajánlása alapján igen nagy kardiovaszkuláris kockázatú hyperlipidaemiás, veseelégtelenségben szenvedő (30 ml/perc alatti GFR), illetve dializált beteg számára, akinél atorvastatinnal vagy simvastatinnal folytatott három hónapos kezelést követően laborkontroll alapján nem sikerült a kívánt célérték (LDL 1,8 mmol/l, össz. Chol. 3,5 mmol/l) elérése. Az ezetimibe hatóanyagot tartalmazó kombinációs készítmény alkalmazása javasolt akkor is, ha bizonyított mellékhatás miatt csak kisebb adag sztatin szedése lehetséges, amely mellett nem sikerült a célérték elérése.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Belgyógyászat | javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Nefrológia | javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Kardiológia | javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Neurológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
E780, E782, E784, E785"
5. melléklet a 7/2014. (I. 29.) EMMI rendelethez
Az R. 3. számú melléklete a következő EÜ70 26-28. ponttal egészül ki:
"EÜ70 26.
TÁMOGATOTT INDIKÁCIÓK:
Stroke és szisztémás embolizáció megelőzésére nem billentyű eredetű pitvarfibrillációban szenvedő felnőtt betegeknél, ha 6 hónapot meghaladó K-vitamin antagonista (acenocumarol és/vagy warfarin) kezelés során a mért INR értékek kevesebb mint 60 %-a esik terápiás tartományba (INR 2 és 3 közé)
- korábbi stroke, vagy tranziens ischaemias attack (TIA), vagy szisztémás embolizáció esetén, vagy a következő kockázati tényezők közül legalább kettő fennállása esetén:
- bal kamrai ejekciós frakció < 40%,
- tünetekkel járó szívelégtelenség ≥ New York Heart Association (NYHA) II. stádium,
- életkor ≥ 75 év,
- életkor ≥ 65 év, a következők valamelyikével: diabetes mellitus, koszorúér-betegség vagy hypertonia
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Kardiológia | javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Neurológia | javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Haematológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I48
EÜ70 27.
TÁMOGATOTT INDIKÁCIÓK:
Vénás thromboemboliás esemény elsődleges megelőzése céljából elektív, teljes csípőízületi endoprotézis esetén maximum 30 napig, teljes térdízületi endoprotézis esetén maximum 15 napig, felnőtt korú betegek részére
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Ortopédia és traumatológia | írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Traumatológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
Z298
EÜ70 28.
TÁMOGATOTT INDIKÁCIÓK:
Vénás thromboembolia másodlagos megelőzésére, ha az orális K-vitamin antagonisták (acenocumarol, warfarin) ellenjavalltak
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Belgyógyászat | javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Haematológia | javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Klinikai onkológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
Z298"
6. melléklet a 7/2014. (I. 29.) EMMI rendelethez
1. Az R. 4. számú melléklet 1. pont e) alpontja helyébe a következő rendelkezés lép:
(A veleszületett vérzékenység kezelésére:)
"e) külföldi plazmából előállításra kerülő, hemophilia A kezelésére szolgáló nagytisztaságú nem albuminnal stabilizált VIII. faktor koncentrátum,"
2. Az R. 4. számú melléklet 1. pont g) alpontja helyébe a következő rendelkezés lép:
(A veleszületett vérzékenység kezelésére:)
"g) recombináns technológiával előállított 3. generációs teljes molekulaméretű VIII. faktor koncentrátum,"
3. Az R. 4. számú melléklet 1. pontja a következő r) alponttal egészül ki:
(A veleszületett vérzékenység kezelésére:)
"r) recombináns technológiával előállított 3. generációs B-domain-depletált VIII. faktor koncentrátum."
4. Az R. 4. számú mellékletében a "gyógyszerhatóanyagok" szövegrészek helyébe a "hatóanyagok" szöveg lép.
7. melléklet a 7/2014. (I. 29.) EMMI rendelethez
1. Az R. 6/a. számú melléklet 2.12. pontjában foglalt táblázat a "Norvégia" megjelölésű sorát követően a következő sorral egészül ki:
| [Ország | Név | Kisze- relési egység | Ható- anyag- tartalom/ kisze- relési egység** | Össz- ható- anyag- tartalom | Forga- lomba kerülés éve | Jelenlegi termelői/ EGT-n kívüli ország- ból történő behozatal esetén import beszer- zési ár* | Támo- gatás mértéke % | Termelői áron számított forga- lom (a kérelem beadását megelőző naptári év alapján) | Forgal- mazott meny- nyiség (doboz)] |
| " | |||||||||
| Horvátország | |||||||||
| " | |||||||||
2. Az R. 6/a. számú melléklete a következő 2.19. ponttal egészül ki:
| "2.19. Kedvezményezetti státusszal történő befogadást kér: | |||
| igen | nem" | ||
3. Az R. 6/a. számú melléklet 5. pontja helyébe a következő rendelkezés lép:
| "5. Az Emberi Erőforrások Minisztériuma szakmai irányelve az egészség-gazdaságtani elemzések készítéséhez (2013. EüK. 3. szám EMMI közlemény szerint) elkészített magyar nyelvű, illetve magyar adaptációjú technológia elemzés fő megállapításai (Az elemzésben hivatkozott cikkek másolatainak csatolása szükséges): |
| .................................................................................................................................................... |
| ............................................................................................................... |
4. Az R. 6/a. számú melléklet 2.12. pontjában
a) a "Még nem támogatott hatóanyagot tartalmazó készítmény forgalmazója tölti ki!" szövegrész helyébe az "A biztonságos és gazdaságos gyógyszer- és gyógyászatisegédeszköz-ellátás, valamint a gyógyszerforgalmazás általános szabályairól szóló 2006. évi XCVIII. törvény 29. § (3) bekezdés a)-f) és i) pontja szerint benyújtott kérelmek esetén töltendő ki:" szöveg,
b) foglalt táblázatban a "Támogatás mértéke %" szövegrész helyébe a "Támogatás mértéke a kérelmezett indikációban %" szöveg,
c) foglalt táblázatot követő végjegyzetben a "megelőző hónap 15. napján hivatalos MNB deviza középárfolyamon" szövegrész helyébe a "megelőző hat hónap hivatalos napi MNB deviza középárfolyamon számolt számtani átlaga" szöveg
lép.
8. melléklet a 7/2014. (I. 29.) EMMI rendelethez
"1. melléklet a 31/2010. (V. 13.) EüM rendelethez
A krónikus myeloid leukémia kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések (C00-C97)
Krónikus myeloid leukémia (C9210)
2. Kórkép leírása
2.1. A krónikus myeloid leukémia (CML) idült, malignus myeloproliferatív betegség, klonális megbetegedés. Genetikai oka a 9. és 22. kromoszóma hosszú karjai közti reciprok transzlokáció (Philadelphia kromoszóma, Ph kromoszóma) következtében a 22. kromoszómán létrejövő bcr/abl fúziós gén. A Philadelphia kromoszóma bcr/abl fúziós génje egy kóros, konstitutív protein kináz aktivitással rendelkező BCR/ABL fúziós fehérjét kódol, mely megváltoztatja a sejtproliferációt, és túlélést kontrolláló, sejten belüli jelátviteli utakat úgy, hogy ez a leukémiás sejteknek túlélési előnyt jelent a mutációt nem hordozó, ép sejtekhez képest.
2.2. A krónikus myeloid leukémiának három, jól elkülöníthető fázisát különböztethetjük meg:
2.2.1. A krónikus fázisban a blastsejtek előfordulása a vérben és a csontvelőben kisebb, mint 15%. Ezzel egyidejűleg a basophil sejtek előfordulása a perifériás vérképben kisebb, mint 20%, és a thrombocytaszám nagyobb 100 x 10^9/l-nél.
2.2.2. Az akcelerált fázisban a blastsejtek előfordulása a vérben vagy a csontvelőben nagyobb vagy egyenlő, mint 15%, de kisebb, mint 30%. Ezen felül a blastsejtek és promyelocyták együttes előfordulása a vérben vagy a csontvelőben nagyobb vagy egyenlő, mint 30% (de a blastsejtek száma alacsonyabb 30%-nál). A basophil sejtek előfordulása a perifériás vérképben 20% vagy annál nagyobb és a thrombocytaszám kisebb, mint 100 x 10A9/l a terápiától függetlenül.
2.2.3. A blastos krízis során a blastsejtek száma a vérben vagy a csontvelőben 20% vagy annál nagyobb, és a hepatosplenomegalián kívül más extramedulláris betegség is fennáll.
2.3. A WHO 2002-es klasszifikációja szerint CML-nek csak az a betegség nevezhető, ahol a Ph kromoszóma vagy a bcr/abl fúziós gén kimutatható.
3. Finanszírozás rendje, finanszírozási algoritmus
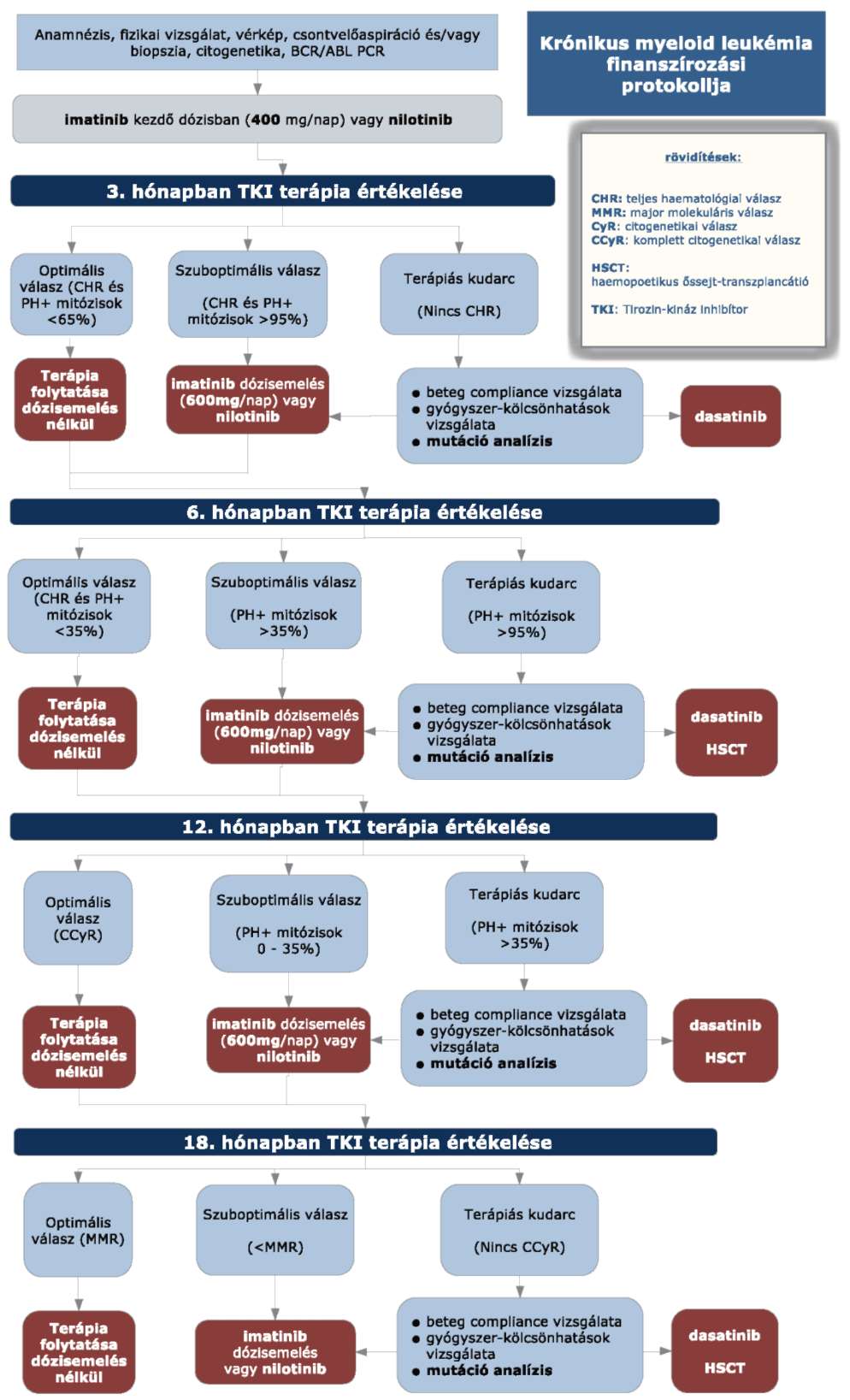
3.1. Újonnan diagnosztizált beteg esetében a kezdő terápia imatinib (400mg/nap dózisban) vagy nilotinib (600mg/nap dózisban). A kezelés során imatinib terápiáról nilotinib terápiára váltás a terápia értékelését követően minden esetben lehetséges. Dasatinib terápiára váltás csak terápiás kudarc esetén az imatinib vagy nilotinib rezisztenciát kimerítő kritériumok alapján (terápiás kudarc + mutáció analízis) lehetséges.
3.2. Imatinib dózisemelések: imatinib terápia esetén, ha a terápia értékelésekor szuboptimális válasz állapítható meg, 600 mg emelt dózisú imatinib terápiára váltás az imatinib rezisztenciát kimerítő kritériumok alapján lehetséges.
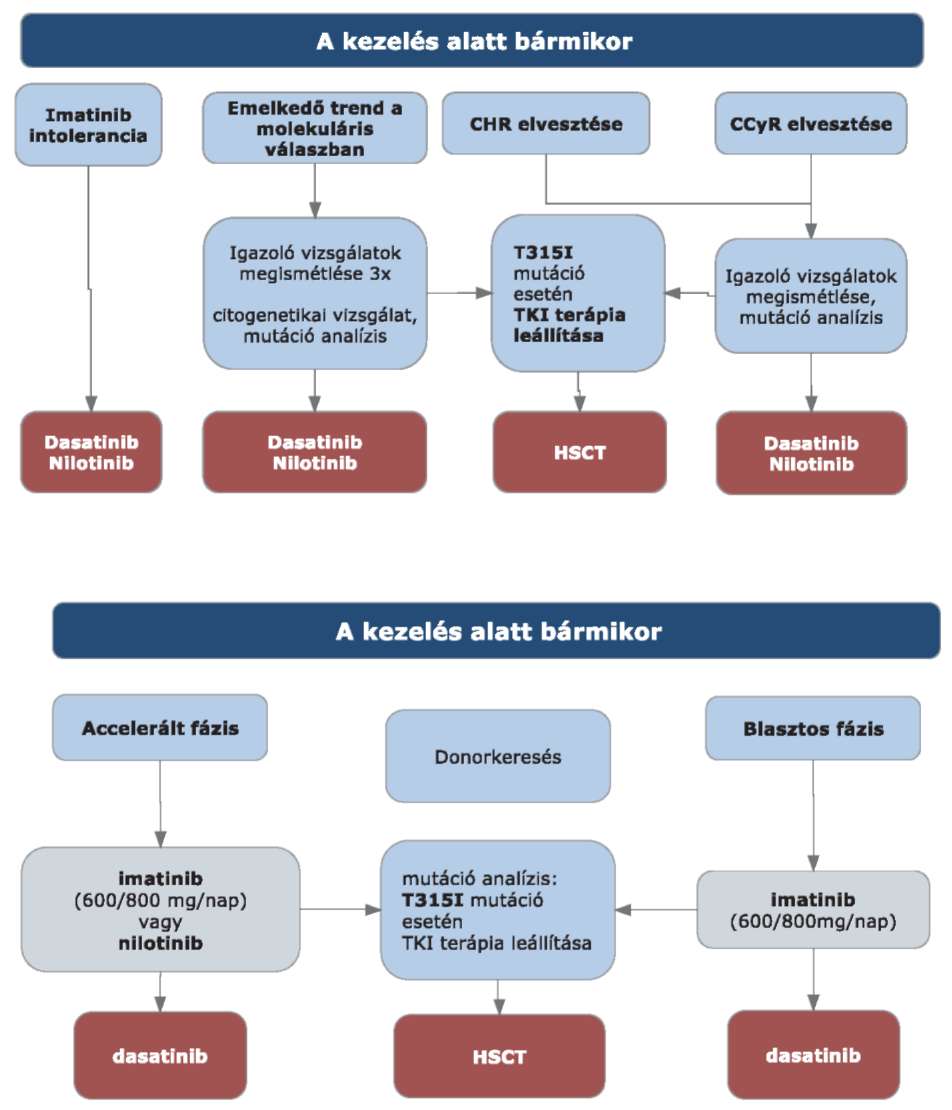
3.3. A szuboptimális választ követő 3 hónap emelt dózisú (600 mg) imatinib kezelést követő ismételt szuboptimális válasz esetén dasatinib terápiára váltás az imatinib vagy nilotinib rezisztenciát kimerítő kritériumok alapján (terápiás kudarc + mutáció analízis) lehetséges.
3.4. Igazolt T315I mutáció esetén a TKI terápia elhagyása szükséges.
3.5. Intoleranciáról abban az esetben beszélünk, ha a MCyR nélküli betegeknél a perzisztens 3-as vagy 4-es fokozatú mellékhatás, illetve a perzisztens 2-es fokozatú, TKI terápiával összefüggő mellékhatás több mint 1 hónap időtartamú és több mint háromszor jelentkezik újra úgy, hogy a TKI terápia dózisának redukciója szükséges.
3.6. Intolerancia krónikus fázisban: TKI terápiával összefüggő, 3-as vagy magasabb fokozatú nem hematológiai toxicitás előfordulása, vagy bármilyen, TKI terápiával összefüggő 4-es fázisú hematológiai toxicitás, ami 7 napnál tovább tart.
3.7. Imatinib intolerancia előrehaladott CML fázisokban: imatinib dózis csökkentésének szükségessége 400 mg/nap alá, vagy imatinib adagolásának felfüggesztése gyógyszerrel összefüggő toxicitás miatt.
3.8. A HSCT egyedi mérlegelés alapján történik az életkor, a transzplantációs rizikó és a CML rizikója alapján.
3.9. A kezelőorvos felterjesztését követően az Országos Felnőtt Hemopoetikus Őssejt-transzplantációs Bizottság hozza meg a döntést.
3.10. A kezelésre adott válaszok definícióit, az egyes időpontban történő vizsgálatokat és a kezelés értékelését a következő három táblázat tartalmazza.
3.10.1. A krónikus myeloid leukémia kezelésére adott válasz:
| A | B | C | |
| 1 | Komplett hematológiai válasz (CHR) * | Cytogenetikai válasz (CyR) | Molekuláris válasz (MoR) |
| 2 | Thrombocytaszám: <450,000/microL | Nincs válasz: Ph+ sejtek száma >95% | Komplett válasz: BCR-ABL negatív |
| 3 | Fvs <10,000/microL | Minimális válasz: Ph+ sejtek száma 66-95% közötti | Major válasz: standardhoz képest legalább három log redukció |
| 4 | Kvalitatív vérkép: nincsenek éretlen granulocyták, baso:<5% | Minor válasz: Ph+ sejtek száma 36-65% közötti | |
| 5 | Lép nem tapintható | Parciális válasz: Ph+ sejtek száma 1-35% közötti | |
| 6 | * minden paraméternek együttesen kell jelen lennie | Komplett válasz: Ph+ sejtek száma 0% |
3.10.2. A TKI kezelések terápiás válaszainak értékeléséhez szükséges vizsgálatok:
| A | B | ||
| 1 | Diagnózis megállapításától eltelt idő | Vizsgálatok | |
| 2 | diagnózis felállítása (0. hónap) | csontvelői metafázis vizsgálat (sikertelenség esetén FISH és citogenetika ismétlés) | bcr/abl töréspont vizsgálat, bcr/abl mRNS expressziós szint meghatározás (RQ-PCR periféria) |
| 3 | 3 hónap | csontvelői metafázis vizsgálat | sikertelenség esetén FISH és citogenetika ismétlés |
| 4 | 6 hónap | citogenetika | sikertelenség esetén FISH és RQ-PCR |
| 5 | 12 hónap | citogenetika | RQ-PCR - amint CCyR kialakult, utána 3 havonta MMR-ig, majd 6 havonta |
| 6 | 18 hónap | citogenetika (csak ha még nem volt CCyR) | RQ-PCR; non CCyR: mutáció keresés, ismételt vizsgálatok |
| 7 | minden terápiaértékelésnél: | fizikális vizsgálat | vérkép |
3.10.3. A lehetséges terápiás válaszok értékelése:
| A | B | C | D | |
| 1 | Diagnózis megállapításától eltelt idő | Célkitűzés | Szuboptimális válasz | Kudarc |
| 2 | 3 hónap | komplett hematológiai remisszió (CHR) és Ph+ < 65% | Ph+ > 95% | nincs komplett hematológiai remisszió |
| 3 | 6 hónap | Ph+ ≤ 35% | Ph+ > 35% | Ph+ >95% |
| 4 | 12 hónap | komplett cytogenetikai válasz (CCyR) | Ph+ 1-35% | Ph+ >35% |
| 5 | 18 hónap | major molekuláris válasz (MMR) | <MMR | <CCyR |
| 6 | bármikor | - | nem alakul ki MMR | a hematológiai vagy cytogenetikai remisszió elveszítése |
4. A krónikus myeloid leukémia finanszírozásának ellenőrzési sarokpontjai
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. Szakmai ellenőrzési pontok
4.2.1. A diagnózis kritériumainak rögzítése (BNO: C9210)
Philadelphia kromoszóma pozitivitás (Ph+), vagy bcr/abl pozitivitás igazolása
4.2.2. A betegség és a kezelés monitorizálásának ellenőrzése
4.2.2.1. Kezelésre adott válasz meghatározása, annak megfelelő dokumentálása
4.2.2.2. Remisszió, relapszus, intolerancia megfelelő dokumentálása
4.3. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
4.3.1. A területre fordított közkiadások alakulása, monitorozása
4.3.2. A finanszírozási algoritmus szerint kezelt betegek aránya
5. A finanszírozás szempontjából lényeges finanszírozási kódok
5.1. A releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | C9210 | Krónikus myeloid leukémia |
5.2. A releváns fekvőbeteg-szakellátási kódok (HBCS és beavatkozás)
| A | B | |
| 1 | HBCs | HBCs megnevezés |
| 2 | 770C | Lymphoma, nem akut leukémia, legalább 14E szűrt vagy besugárzott vérkészítmény adásával |
| 3 | 54100 | Felnőtt allogén csontvelő transzplantáció |
| 4 | 959F | Rosszindulatú daganat kemoterápiája "F" |
| 5 | 959G | Rosszindulatú daganat kemoterápiája "G" |
5.3. A releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | L01XE01 | Imatinib |
| 3 | L01XE06 | Dasatinib |
| 4 | L01XE08 | Nilotinib |
6. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
CHR: Teljes hematológiai válasz
CyR: Citogenetikai válasz
CCyR: Komplett citogenetikai válasz
HBCS: Homogén betegségcsoport
HSCT: Haemopoetikus őssejt-transzplantáció
MMR: Major molekuláris válasz
TKI: Tirozin-kináz gátló"
9. melléklet a 7/2014. (I. 29.) EMMI rendelethez
"2. melléklet a 31/2010. (V. 13.) EüM rendelethez
A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések (C00-C97)
Vese rosszindulatú daganatai:
Világossejtes daganatok
1/A. Fogalmak, rövidítések
ATC Anatomical Therapeutic Chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
BSC Best supportive care
CT Komputer tomográfia
EAU European Association of Urology
ECOG Eastern Cooperative Oncology Group
GFR Glomerulus filtráció arány
HBCS Homogén betegségcsoport
OENO Orvosi eljárások nemzetközi osztályzása
NCCN National Comprehensive Cancer Network
NYHA New York Heart Association
LDH Laktát-dehidrogenáz
RCC Vesesejtes carcinoma
UH Ultrahang
UICC International Union Against Cancer
TNM Tumor, node, metastasis (tumor, nyirokcsomó, metasztázis)
2. A kórkép leírása
A vese rosszindulatú daganatainak előfordulási gyakorisága az utóbbi évtizedekben lassan emelkedik. 2002-ről 2006-ra a Magyar Rákregiszter adatai alapján a prevalencia 1875-ről 2025-re emelkedett. Leggyakrabban 45-70 éves életkor között fordulnak elő, de egyre gyakrabban jelentkezik fiatalabb életkorban. A férfi-nő arány 3:2.
A malignus vesedaganatok között a leggyakoribb a világossejtes carcinoma (RCC). A vesekéregben alakul ki, a proximális kanyarulatos csatornákat bélelő sejtekből. A vesesejtes ráknak 5 fő altípusa különböztethető meg, amelyek közül a leggyakoribb a világos sejtes veserák (az esetek 75-80%-a). A papilláris carcinoma I-II. 12-14%-ban, a cromophob carcinoma 4-6%-ban, az oncocyter típusú vesesejtes rák 2-4%-ban, míg a Bellini-féle carcinoma 1%-ban figyelhető meg. A szövettani diagnózis ismerete mindig kötelező. A tumor terjedése részben lokálisan, részben pedig a nyirok- és vérerek útján történik.
A betegség etiológiája pontosan még nem ismert, de mind a hazai, mind a jelentősebb nemzetközi szakmai társaságok kiemelik a dohányzás szerepét az RCC kialakulásában (2A evidencia szint). A szakmai evidenciák alapján az elhízás, kávéfogyasztás, állati zsiradékok fogyasztása is komoly rizikófaktornak tekinthető. Felfedezéskor 60-70%-ban szervre lokalizált, 5-10%-ban lokálisan előrehaladott, 15-20%-ban távoli áttétet képez. Relapszus a korai I-II klinikai stádiumban előfordul.
A vesedaganatok stádiumbeosztása során a következő TNM klasszifikációt alkalmazzuk:
2.1. TNM klinikai klasszifikáció, primer tumor
| T | Primer tumor |
| TX | Primer tumor nem ítélhető meg |
| TO | Primer tumor nem mutatható ki |
| T1 | A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában maximum 7 cm |
| T1a | 4 cm-es vagy kisebb tumor |
| T1b | 4 cm-nél nagyobb, 7 cm-nél nem nagyobb tumor |
| T2a | A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t, de 10 cm-nél nem nagyobb |
| T2b | A tumor 10 cm-nél nagyobb, de a vese anatómai határait nem haladja meg |
| T3 | A tumor ráterjed a nagyobb vénákra [vena renális(ok)], vagy közvetlenül infiltrálja a mellékvesét vagy a perirenalis (más szóval perinephriticus) szöveteket, de nem terjed túl a Gerota-fascián |
| pT3a: a daganat szabad szemmel látható módon a v. renalis-ban, vagy annak nagy szegmentális ágaiban terjed (szövettan: a vénának van izmos fala), vagy a perinephricus és/vagy a vesemedencei zsírszövetbe terjed; pT3b: a daganat szabad szemmel észlelhetően beterjed a v. cava-ba, de a növedék nem haladja meg a rekeszizom szintjét; pT3c: a daganat szabad szemmel észlelhetően beterjed a v. cava-ba, és a növedék a rekeszizom vonalát meghaladja, vagy a tumor beszűri a v. cava falát. | |
| T4 | pT4 stádium: a tumor túlterjed a Gerota-fascián vagy folyamatos terjedés révén beszűri a mellékvesét. |
Forrás: EAU Guidelines, renal cell carcinoma, 2013; Pathológiai irányelv 2010
2.2. TNM klinikai klasszifikáció, regionális nyirokcsomó
| N | Regionális nyirokcsomók |
| NX | Regionális nyirokcsomóáttét nem igazolható |
| N0 | Nincs regionális nyirokcsomóáttét |
| N1 | Metastasis szoliter regionális nyirokcsomóban |
| N2 | Metastasis egynél több regionális nyirokcsomóban |
2.3. TNM klinikai klasszifikáció, Távoli áttétek
| M | Távoli áttétek |
| MO | Távoli áttét nincs |
| Ml | Távoli áttét(ek) |
Forrás: EAU Guidelines, renal cell carcinoma 2013
2.4. G Szövettani grading, Fuhrman szerinti felosztás
| G | Szövettani grading |
| Sejtmag mérete, Sejtmag alakja, Nucleolus | |
| G1 | Jól differenciált, kicsi (10 μm) Szabályos, Nem észlelhető |
| G2 | Mérsékelten differenciált, kicsi; valamivel nagyobb (15 μm) szabálytalan, 40x nagyításnál megfigyelhető |
| G3 | Gyengén differenciált, közepesen nagy (20 μm) szabálytalan, 10x nagyításnál megfigyelhető |
| G4 | Differenciálatlan, nagy (>20 μm) bizarr, feltűnő |
Forrás: EAU Guidelines, Renal cell carcinoma 2013, Pathológiai irányelv 2010
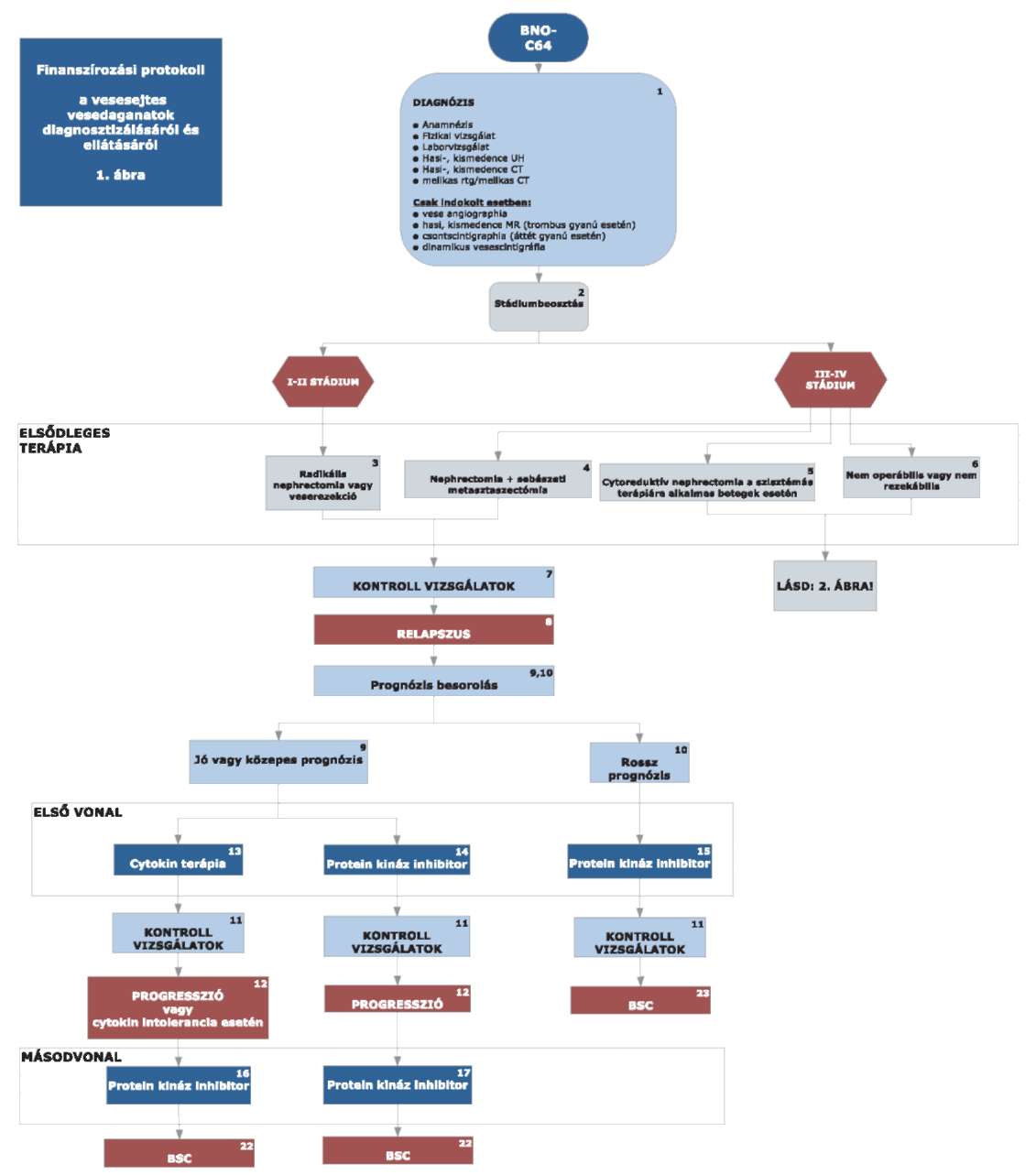
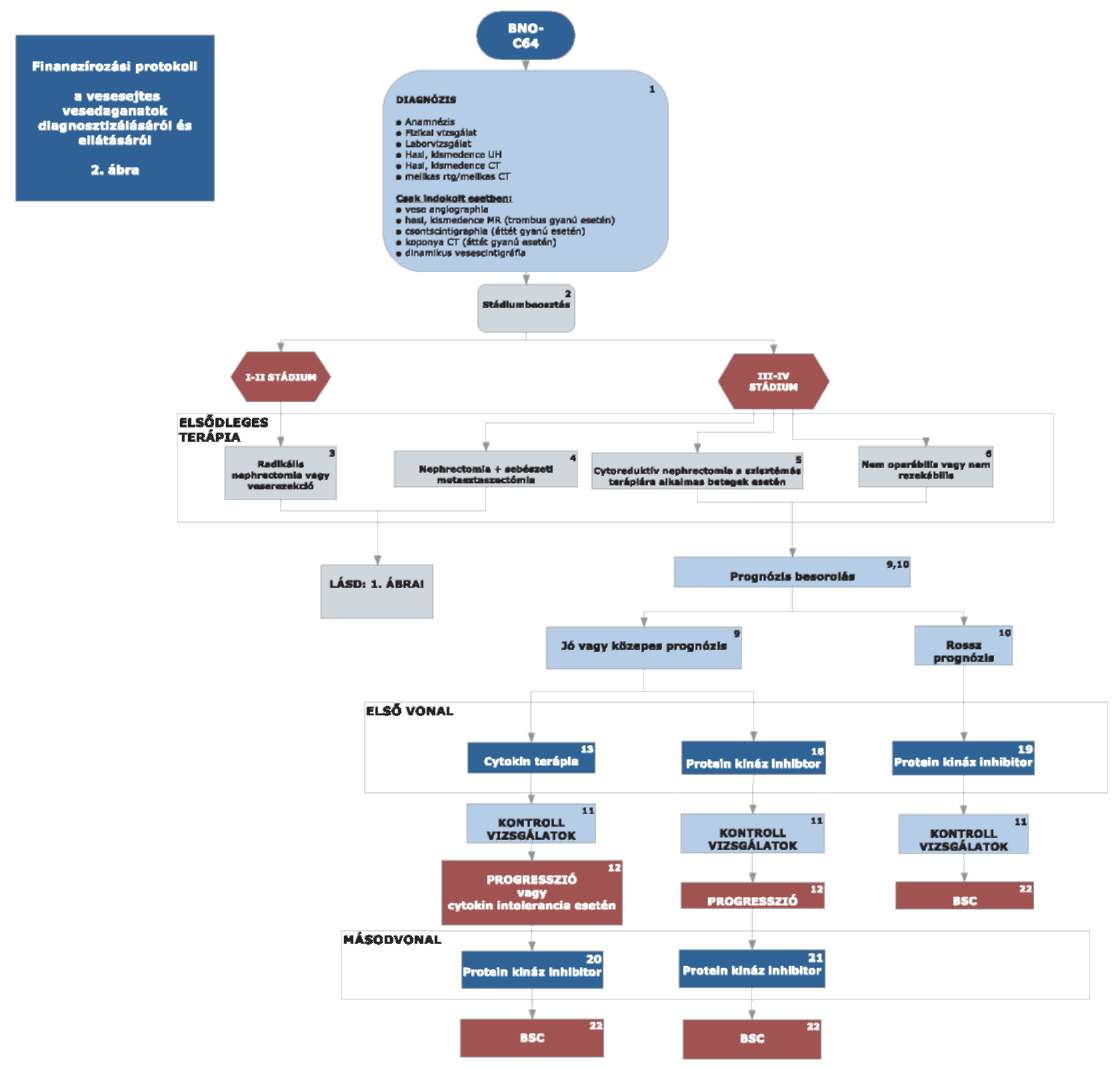
4,5: IV. stádiumban nephrectomia, ha a beteg jó általános állapotú.
5,6: pT3-pT4 indokolt eseteiben (tumor műtéti sérülése); nem műthető csontáttét esetén irradiatió.
Csak azon III-IV stádiumú betegeknél, akiknél cytoreduktív nephrectomiat alkalmaztak, avagy nem operábilisek vagy daganatuk nem rezekeábilis kezdhető meg azonnal az elsővonalas tirozin kináz gátó vagy cytokin terápia (jó vagy közepes prognózis esetén) vagy temsirolimus terápia (rossz prognózis esetén). Egyéb esetekben a relapszus igazolását követően adhatóak a fent említett készítmények.
7,11: Kontrollvizsgálat
Alacsony kockázatú beteg esetén:
Radikális nephrectomia vagy parcialis nephrectomia után: 6, 24, 48 hónap után ultrahang, 1 év, 3 év, 5 év után hasi CT, valamint laborvizsgálatok, mellkas Rtg, indokolt esetben mellkas CT, 5 év után nincs további vizsgálat.
Közepes kockázatú beteg esetén:
Radikális nephrectomia, parciális nephrectomia, cryoterápia, radiofrekvenciás tumorkezelés után: 6, 24, 48, 60 hónap után CT, 12, 36 hónapban ultrahang javasolt és laborvizsgálatok, mellkas Rtg, indokolt esetben mellkas CT, 5 év után kétévente hasi CT vizsgálat.
Magas kockázatú beteg esetén:
Radikális nephrectomia, parciális nephrectomia, cryoterápia, radiofrekvenciás tumorkezelés után 6, 12, 24, 36, 48, 60 hónapban kontroll CT, laborvizsgálatok, mellkas Rtg, indokolt esetben mellkas CT, 5 év után kétévente CT vizsgálat.
A kontroll vizsgálat során fizikális vizsgálatot, teljes labort, mellkas Rtg, hasi-kismedencei ultrahang vizsgálatot kell végezni. Ha indokolt mellkas CT, hasi, kismedencei CT/MR javasolt.
8: A relapszust minden esetben igazolni kell (valamely képalkotó és szövettani eljárással) és dokumentálni szükséges.
9: Lokális recidíva esetén, ha technikailag lehetséges, sebészi eltávolítás szükséges.
Jó vagy közepes prognózis esetén sunitinib vagy pazopanib vagy cytokin alapú első vonalbeli kezelés javasolt.
A jó vagy közepes prognózis a következő kritériumok alapján határozható meg:
- LDH a normál érték másfélszerese alatt van,
- a hemoglobin a normál értéken vagy afelett van,
- a korrigált kalcium szint kisebb, mint 10 mmol/l,
- a diagnózistól az első kezelésig eltelt idő több, mint egy év,
- az ECOG performance status 0, 1 (≈ Karnofsky score ≥ 80).
Ha a felsorolt kockázati tényezők közül legfeljebb 2 fennáll, akkor jó vagy közepes kockázatú csoportba sorolható a beteg.
10: Rossz prognózisú eset az, ha az előző pontban ismertetett kockázati tényezők közül legalább három nem teljesül, ekkor temsirolimus terápia javasolt.
12: A progressziót minden esetben igazolni kell (labor vizsgálattal és valamely képalkotó és szövettani eljárással) és dokumentálni szükséges.
13: Alkalmazható cytokin terápia:
interferon alfa-2
14: Alkalmazható protein kináz inhibitor(ok):
sunitinib
pazopanib
15: Alkalmazható protein kináz inhibitor(ok):
temsirolimus
16: Alkalmazható protein kináz inhibitor(ok):
sorafenib
pazopanib
axitinib
sunitinib
17: Alkalmazható protein kináz inhibitor(ok):
axitinib:
kizárólag sunitinib kezelést követően adható olyan esetekben, amikor a beteg a legkorábban a második sunitinib kezelési ciklust követően végzett képalkotó eljárással dokumentáltan reagált a sunitinib kezelésre.
everolimus:
sunitinib és pazopanib kezelést követően egyaránt adható, sunitinib kezelésre nem reagáló betegnek kizárólag everolimus adható.
18: Alkalmazható protein kináz inhibitor(ok):
sunitinib
pazopanib
19: Alkalmazható protein kináz inhibitor(ok):
temsirolimus
20: Alkalmazható protein kináz inhibitor(ok):
sorafenib
pazopanib
axitinib
sunitinib
21: Alkalmazható protein kináz inhibitor(ok):
axitinib:
kizárólag sunitinib kezelést követően adható olyan esetekben, amikor a beteg a legkorábban a második sunitinib kezelési ciklust követően végzett képalkotó eljárással dokumentáltan reagált a sunitinib kezelésre.
everolimus:
sunitinib és pazopanib kezelést követően egyaránt adható, sunitinib kezelésre nem reagáló betegnek kizárólag everolimus adható.
22: Az előbb felsorolt terápiák hatástalansága esetén és/vagy ha a terápiákra alkalmatlan a beteg, akkor a szakmai irányelvben megfogalmazott legjobb tüneti és palliatív ellátás alkalmazandó. Opcionálisan alkalmazható medroxyprogesterone palliatív kezelésként.
Az utánkövetés a 7, 11 pontban leírtak szerint történik.
A betegek terápiájában harmadvonalban finanszírozott gyógyszerkészítmény nincsen. A készítmények együtt nem adhatók.
3. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
2. Betegadatok (online TAJ ellenőrzés)
3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
Szakmai ellenőrzési pontok
1. A diagnózis kritériumainak felállítása megfelelő volt-e?
2. A tumor invazivitásának ellenőrzése megtörtént-e?
3. Az utánkövetés a megfelelő időben megtörtént-e, és ezen minden szükséges vizsgálatot elvégeztek-e?
4. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
A finanszírozási eljárásrend hatását a következő indikátorok mérik.
- A területre fordított közkiadások alakulása.
- A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
5. A finanszírozás szempontjából lényeges finanszírozási kódok
5.1. Releváns BNO kódok
| BNO | BNO megnevezése |
| C64H0 | A vese rosszindulatú daganata, kivéve a vesemedencét |
5.2. Releváns OENO kódok
| OENO | OENO megnevezése |
| 11041 | Vizsgálat |
| 36135 | Vese UH vizsgálata |
| 36130 | Hasi, kismedencei UH (áttekintő, komplex) UH vizsgálat |
| 34450 | Teljes has CT vizsgálata natív |
| 31310 | Mellkasfelvétel, AP/PA |
| 31311 | Mellkasfelvétel, oldalirányú |
| 31312 | Mellkasfelvétel, kétirányú |
| 31380 | Mellkasfelvétel, célzott |
| 3617D | Duplex UH, vese |
| 34454 | Teljes has és medence CT vizsgálata natív és iv. kontrasztanyag adását követőleg |
| 34442 | Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 34935 | Teljes has MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 3532G | Vese angioszcintigráfia (indokolt esetben) |
| 3533A | 3 fázisú csontszcintigráfia (indokolt esetben) |
| 34410 | Agykoponya natív CT vizsgálata (agyi metasztázis tünetek esetén) |
| 35240 | Vese szcintigráfia |
5.3. Releváns HBCS kódok
| HBCS | HBCS megnevezése |
| 566C | Vese, ureter, húgyhólyag jelentős műtétei daganat miatt |
| 577B | Vese-, húgyúti daganatok |
| 9430 | Sugárterápia |
| 608Z | Vese-, húgyutak műtétei (kivéve: jelentős műtétek) súlyos társult betegséggel |
5.4. ATC kódok
| ATC | ATC megnevezése |
| L01XE05 | sorafenib |
| L01XE04 | sunitinib |
| L01XE09 | temsirolimus |
| L03AB04 | interferon alfa-2 |
| L01XE10 | everolimus |
| L01XE11 | pazopanib |
| L01XE17 | axitinib |
"


