55/2021. (XII. 22.) EMMI rendelet
az egyes gyógyszerek társadalombiztosítási támogatásáról szóló miniszteri rendeletek módosításáról
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (4) bekezdés k) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 92. § (1) bekezdés 2. pontjában meghatározott feladatkörömben eljárva,
a 2. alcím, valamint a 2-4. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés c) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 92. § (1) bekezdés 2. pontjában meghatározott feladatkörömben eljárva - a Kormány tagjainak feladat-és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 64. § (1) bekezdés 2. pontjában meghatározott feladatkörében eljáró pénzügyminiszterrel egyetértésben -,
a 3. alcím, valamint az 5-14. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés a) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 92. § (1) bekezdés 2. pontjában meghatározott feladatkörömben eljárva
a következőket rendelem el:
1. Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet módosítása
1. § Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet (a továbbiakban: R1.) 1/A. számú melléklete az 1. melléklet szerint módosul.
2. § Az R1. a következő 27. §-sal egészül ki:
"27. § (1) E rendeletnek az egyes gyógyszerek társadalombiztosítási támogatásáról szóló miniszteri rendeletek módosításáról szóló 55/2021. (XII. 22.) EMMI rendelet (a továbbiakban: Módr4.) 1. §-ával módosított 1/A. számú mellékletében foglalt rendelkezéseit azon hatóanyagok vonatkozásában, amelyek a Módr4. hatálybalépése előtt nem tartoztak a tételes elszámolás alá eső hatóanyagok körébe, az érintett hatóanyag természetben történő biztosítása érdekében lefolytatott eredményes közbeszerzési eljárás eredményeként megkötésre kerülő szerződés hatálybalépésétől, de legkésőbb a Módr4. hatálybalépését követő harmadik hónap első napjától kell alkalmazni.
(2) Az 1/A. számú mellékletben foglalt azon hatóanyagokat tartalmazó gyógyszereknek a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 26. § (1) bekezdés c) pontja szerinti kiadására, amelyek a Módr4. hatálybalépése előtt nem tartoztak a tételes elszámolás alá eső hatóanyagok körébe, a Módr4. hatálybalépését követő harmadik hónap utolsó napjáig kerülhet sor."
2. A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESzCsM rendelet módosítása
3. § (1) A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESzCsM rendelet (a továbbiakban: R2.) 1. számú melléklete a 2. melléklet szerint módosul.
(2) Az R2. 2. számú melléklete a 3. melléklet szerint módosul.
(3) Az R2. 3. számú melléklete a 4. melléklet szerint módosul.
(4) Az R2. 4. számú melléklete az 5. melléklet szerint módosul.
3. A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosítása
4. § (1) A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet (a továbbiakban: R3.) 5. melléklete a 6. melléklet szerint módosul.
(2) Az R3. 9. melléklete a 7. melléklet szerint módosul.
(3) Az R3. 10. melléklete a 8. melléklet szerint módosul.
(4) Az R3. 11. melléklete a 9. melléklet szerint módosul.
(5) Az R3. 14. melléklete a 10. melléklet szerint módosul.
(6) Az R3. 19. melléklete a 11. melléklet szerint módosul.
(7) Az R3. 31. melléklete a 12. melléklet szerint módosul.
(8) Az R3. 37. melléklete a 13. melléklet szerint módosul.
(9) Az R3. 38. melléklete a 14. melléklet szerint módosul.
(10) Az R3. 40. melléklete a 15. melléklet szerint módosul.
4. Záró rendelkezések
5. § Ez a rendelet a kihirdetése hónapját követő hónap első napján lép hatályba.
Dr. Kásler Miklós s. k.,
emberi erőforrások minisztere
1. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R1. 1/A. számú melléklet 2/a. pont "TÁMOGATOTT INDIKÁCIÓK" megjelölésű része helyébe a következő rendelkezés lép:
"Felnőttkori súlyos (18 éves kor felett, Mayo score > 9) colitis ulcerosa kezelésére, a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján, amennyiben adekvát immunszupresszió mellett (legalább 2 mg/ttkg vagy a legnagyobb tolerálható dózisú azathioprin) igazolt szisztémás szteroidfüggőség (3 hónapon túl szisztémásan > 10 mg/nap prednisolon ekvivalens dózis) esetén a szteroid adagjának csökkenésekor relapszus (endoszkópos Mayo subscore ≥ 2) igazolható, vagy 3 hónapon át tartó adekvát hagyományos (szteroid indukciós, majd 3 hónapos fenntartó immunszuppresszív) kezelésre nem reagáló súlyos betegségformában (Mayo score > 9 és endoszkópos Mayo subscore ≥ 2), három hónapig, ezt követően kizárólag megfelelő válaszkészség esetén (Mayo score minimum 3 pontos csökkenése). Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó), stabil remisszió esetén a kezelés felfüggeszthető. Akut lefolyású, fulmináns forma, fenyegető colectomia esetén a finanszírozási eljárásrendekről szóló miniszteri rendelet alapján adható."
2. Az R1. 1/A. számú melléklet 2/a. pontjának "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorokkal egészül ki:
"06070 tofacitinib
06056 ustekinumab"
3. Az R1. 1/A. számú melléklet 4. pontjának "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorral egészül ki:
"06070 tofacitinib"
4. Az R1. 1/A. számú melléklet 5. pontjának "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorokkal egészül ki:
"06050 certolizumab-pegol
06083 rizankizumab"
5. Az R1. 1/A. számú melléklet 6/a1. pontjának "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorral egészül ki:
"06084 upadacitinib"
6. Az R1. 1/A. számú melléklet 7/a. pontjának az "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorral egészül ki:
"06082 pomalidomid"
7. Az R1. 1/A. számú melléklet 7/b9. pontjának a "TÁMOGATOTT INDIKÁCIÓK" megjelölésű része helyébe a következő rendelkezés lép:
"17p delécióval vagy TP53 mutációval rendelkező, vagy IGVH mutációval nem rendelkező allogén transzplantációra alkalmatlan krónikus lymphoid leukemiaban szenvedő betegek esetén, valamint azon betegek részére, akiknél legalább két immunokemoterápiás kezelést követően a relapszus vagy progresszió 12 hónapon belül következik be."
8. Az R1. 1/A. számú melléklet 7/b13. pontjának a "TÁMOGATOTT INDIKÁCIÓK:" megjelölésű része a következő sorral egészül ki:
"- Obinutuzumabbal kombinálva, korábban nem kezelt krónikus lymphoid leukaemiában (CLL) szenvedő felnőtt betegek kezelésére."
9. Az R1. 1/A. számú melléklete a következő 7/b14. ponttal egészül ki:
"7/b14. pont
TÁMOGATOTT INDIKÁCIÓK:
Akut lymphoblastos leukaemia (ALL) kezelésére antineoplasztikus kombinált terápia részeként gyermekgyógyászati betegek (születéstől 18 éves korig) és felnőtt betegek számára.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06081 pegaszpargáz
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
2877 Heim Pál Országos Gyermekgyógyászati Intézet
2878 Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház"
10. Az R1. 1/A. számú melléklete a következő 7/b15. ponttal egészül ki:
"7/b15. pont
TÁMOGATOTT INDIKÁCIÓK:
Felnőttek részére kiújuló vagy nem reagáló klasszikus Hodgkin-lymphoma (cHL) kezelésére autológ őssejt-transzplantációt (ASCT) és brentuximab-vedotinnal végzett kezelést követően.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06024 nivolumab
06025 pembrolizumab
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
2878 Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház"
11. Az R1. 1/A. számú melléklete a következő 8/a9. ponttal egészül ki:
"8/a9. pont
TÁMOGATOTT INDIKÁCIÓK:
Lokálisan előrehaladott vagy metasztatikus, epidermális növekedési faktor receptor (EGFR) T790M mutáció-pozitív, nem-kissejtes tüdőkarcinómában (NSCLC) szenvedő felnőtt betegek kezelésére, akik korábban EGFR-TK kezelésben részesültek, másod-, illetve többedvonalas terápiaként a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend szerint.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06049 osimertinib
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1301 Koch Róbert Kórház és Rendelőintézet, Edelény
1484 Csongrád Megyei Mellkasi Betegségek Szakkórháza, Deszk
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1663 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2073 Tüdőgyógyintézet, Törökbálint
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2601 Veszprém Megyei Tüdőgyógyintézet, Farkasgyepű
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2897 Országos Korányi Pulmonológiai Intézet
2899 Mátrai Gyógyintézet
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház"
12. Az R1. 1/A. számú melléklete a következő 8/a10. ponttal egészül ki:
"8/a10. pont
TÁMOGATOTT INDIKÁCIÓK:
Lokálisan előrehaladott, nem reszekálható, nem-kissejtes tüdőkarcinómában (NSCLC) szenvedő felnőtt betegek kezelésére, akiknek a daganatában a tumorsejtek ≥ 1%-a PD-L1 (Programmed death-ligand 1)-expressziót mutatnak, és akiknek a betegsége a platina-alapú kemoirradiáció után nem progrediált.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06048 durvalumab
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1301 Koch Róbert Kórház és Rendelőintézet, Edelény
1484 Csongrád Megyei Mellkasi Betegségek Szakkórháza, Deszk
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1663 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2073 Tüdőgyógyintézet, Törökbálint
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2601 Veszprém Megyei Tüdőgyógyintézet, Farkasgyepű
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2897 Országos Korányi Pulmonológiai Intézet
2899 Mátrai Gyógyintézet
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház"
13. Az R1. 1/A. számú melléklete a következő 8/a11. ponttal egészül ki:
"8/a11. pont
TÁMOGATOTT INDIKÁCIÓK:
Lokálisan előrehaladott vagy metasztatikus, epidermális növekedési faktor receptor (EGFR) és Anaplasticus lymphoma-kináz (ALK) mutációt nem hordozó, nem-kissejtes tüdőkarcinómában (NSCLC) szenvedő felnőtt betegek első vonalbeli kezelésére, a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend szerint.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06025 pembrolizumab
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1301 Koch Róbert Kórház és Rendelőintézet, Edelény
1484 Csongrád Megyei Mellkasi Betegségek Szakkórháza, Deszk
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1663 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2073 Tüdőgyógyintézet, Törökbálint
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2601 Veszprém Megyei Tüdőgyógyintézet, Farkasgyepű
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2897 Országos Korányi Pulmonológiai Intézet
2899 Mátrai Gyógyintézet
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház"
14. Az R1. 1/A. számú melléklete a következő 8/d4. ponttal egészül ki:
"8/d4. pont
TÁMOGATOTT INDIKÁCIÓK:
Definitív lokális terápiával nem kezelhető, lokálisan előrehaladott vagy metasztatikus fej-nyaki laphámsejtes karcinómában (SCCHN) szenvedő, stabil, jó általános állapotú (ECOG 0-1) felnőtt betegek kezelésére, akik az elsővonalas platina alapú terápia mellett 6 hónapon belül progrediáltak.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06024 nivolumab
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1487 Dr. Bugyi István Kórház, Szentes
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház
R787 Debreceni Egyetem Kenézy Gyula Egyetemi Kórház"
15. Az R1. 1/A. számú melléklete a következő 8/h. ponttal egészül ki:
"8/h pont
TÁMOGATOTT INDIKÁCIÓK:
Felnőttek irreszekábilis vagy metasztatikus, konvencionális SSA kezelés után radiológiai progressziót mutató, jól differenciált (G1 és G2), szomatosztatin-receptor-pozitív gasztroentero-pankreatikus neuroendokrin tumorainak (GEP-NET) kezelésére, onkoteam döntés alapján.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06045 lutécium (177Lu)-oxodotreotid
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
2894 Debreceni Egyetem Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
N595 Markusovszky Egyetemi Oktatókórház, Szombathely"
16. Az R1. 1/A. számú melléklete a következő 14/a. ponttal egészül ki:
"14/a pont
TÁMOGATOTT INDIKÁCIÓK:
A nyirokcsomókat érintő vagy metasztatikus melanomában szenvedő, teljes tumorreszekción átesett felnőttek adjuváns kezelésére.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06024 nivolumab
06025 pembrolizumab
06019 dabrafenib
06007 trametinib
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
N595 Markusovszky Egyetemi Oktatókórház, Szombathely"
2. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R2 1. számú mellékletében foglalt táblázat a J05AH sort követően a következő sorral egészül ki:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIÁK | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓHOZ KÖTÖTT | KIEMELT INDI- KÁCIÓHOZ KÖTÖTT | KÜLÖNKERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉRTÉK NÉLKÜL | ÁTLAGON ALULI | ÁTLAGOS | ÁTLAGON FELÜLI | |||||
| J05AJ | integráz inhibitorok | X | X | |||||
2. Az R2 1. számú mellékletében foglalt táblázat az L01DC sort követően a következő sorokkal egészül ki:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIÁK | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓHOZ KÖTÖTT | KIEMELT INDI- KÁCIÓHOZ KÖTÖTT | KÜLÖNKERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉRTÉK NÉLKÜL | ÁTLAGON ALULI | ÁTLAGOS | ÁTLAGON FELÜLI | |||||
| L01E | PROTEIN KINÁZ INHIBITOROK | |||||||
| L01EA | BCR-ABL tirozin-kináz gátlók | X | X | |||||
| L01EB | Epidermalis növekedési faktor (EGRF) tirozinkináz jelátvitelgátlók | X | X | |||||
| L01EC | B-Raf szerin-treonin-kináz (BRAF) gátlók | X | X | |||||
| L01ED | Anaplasztikus lymphomakináz(ALK) gátlók | X | X | |||||
| L01EE | Mitogén-aktivált proteinkináz (MEK) gátlók | X | X | |||||
| L01EF | Cyclin-függő kináz (CDK) gátlók | X | X | |||||
| L01EG | mTOR(mammalian target of rapamycin)-kináz gátlók | X | X | |||||
| L01EH | Humán epidermális növekedési faktor 2-es típusú receptor (HER2) tirozinkináz gátlók | X | X | |||||
| L01EJ | Janus kináz (JAK) gátlók | X | X | |||||
| L01EK | Vascularis endothelialis növekedési faktor receptor (VEGFR) tirozinkináz gátlók | X | X | |||||
| L01EL | Bruton-féle tirozinkináz (BTK) gátlók | X | X | |||||
| L01EX | Egyéb protein-kináz gátlók | X | X | |||||
3. Hatályát veszti az R2. 1. számú melléklet "L01XE" megjelölésű sora.
3. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R2. 2. számú melléklet EÜ100 28. pontjában foglalt "Kijelölt intézmények:" táblázata a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| Gyula | Gyula - Békés Megyei Központi Kórház |
| Szolnok | Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
| Szombathely | Markusovszky Egyetemi Oktatókórház |
2. Az R2. 2. számú melléklet EÜ100 51. pontjában foglalt "Kijelölt intézmények:" táblázata a következő sorral egészül ki:
| (Város | Intézmény neve) |
| Veszprém | Csolnoky Ferenc Kórház |
3. Az R2. 2. számú melléklet EÜ100 62. pontjában foglalt "Kijelölt intézmények:" táblázata a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| Gyula | Békés Megyei Központi Kórház |
| Szolnok | Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
4. Az R2. 2. számú melléklet EÜ100 65. pontjában foglalt "Kijelölt intézmények:" táblázata a következő sorral egészül ki:
| (Város | Intézmény neve) |
| Debrecen | Debreceni Egyetem Kenézy Gyula Egyetemi Kórház, Neurológiai Osztálya |
| Nyíregyháza | Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház, nyíregyházi Neurológiai Osztály |
5. Az R2. 2. számú melléklet EÜ100 66. pontjában foglalt "Kijelölt intézmények:" táblázata a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| Budapest | Semmelweis Egyetem I-II. sz. Gyermekgyógyászati Klinika |
| Debrecen | Debreceni Egyetem Klinikai Központ, Gyermekgyógyászati Intézet |
| Pécs | Pécsi Tudományegyetem Klinikai Központ, Gyermekgyógyászati Klinika |
| Szeged | Szegedi Tudományegyetem Általános Orvostudományi Kar Gyermekgyógyászati Klinika és Gyermek Egészségügyi Központ, Tüdőgyógyászati Tanszék |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
| Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház Pulmonológia |
6. Az R2. 2. számú melléklet EÜ100 71. pontjában foglalt "Kijelölt intézmények:" táblázata a következő sorokkal egészül ki:
| (Város | Intézmény neve) |
| Debrecen | Kaáli Ambuláns Nőgyógyászati Intézet Kft. |
| Miskolc | Kaáli Ambuláns Nőgyógyászati Intézet Kft. |
| Pécs | Pannon Reprodukciós Intézet és Szolgáltató Kft. |
| Szeged | Kaáli Ambuláns Nőgyógyászati Intézet Kft. |
7. Az R2. 2. számú melléklet EÜ100 66. pontjában foglalt "Kijelölt intézmények:" táblázatában a "Csongrád Megyei Mellkasi Betegségek Szakkórháza, I. sz. Tüdőgyógyászati Osztály" szövegrész helyébe a "Csongrád Megye Mellkasi Betegségek Szakkórháza" szöveg lép.
8. Az R2. 2. számú mellékletének EÜ100 71. pontjában az "ELFOGADHATÓ BNO KÓDOK (beleértve az összes azonosan kezdődő kódot): N97" szövegrész helyébe az "ELFOGADHATÓ BNO KÓDOK (beleértve az összes azonosan kezdődő kódot): N46, N97" szöveg lép.
9. Az R2 2. számú melléklete a következő EÜ100 72. ponttal egészül ki:
"EÜ100 72.
TÁMOGATOTT INDIKÁCIÓK:
Citarabinnal és daunorubicinnel kombinálva olyan korábban nem kezelt, kedvező és intermedier prognózisú genetikai csoportban tartozó, de novo, CD33-pozitív akut myeloid leukaemiában szenvedő 15 év feletti betegeknél alkalmazható, akik alkalmasak kuratív célzatú indukciós kezelésre.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Hematológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
C920
Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet |
| Budapest | Semmelweis Egyetem |
| Debrecen | Debreceni Egyetem Klinikai Központ |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Kaposvár | Somogy Megyei KaposiMór Oktató Kórház |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
| Nyíregyháza | Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
| Szombathely | Markusovszky Egyetemi Oktatókórház" |
"
10. Az R2 2. számú melléklete a következő EÜ100 73. ponttal egészül ki:
"EÜ100 73.
TÁMOGATOTT INDIKÁCIÓK:
Újonnan diagnosztizált, FLT3-mutáció-pozitív, akut myeloid leukaemiában (AML) szenvedő felnőtt betegek kezelésére, standard daunorubicin és citarabin indukciós és nagy dózisú citarabin konszolidációs kemoterápiával kombinálva, amelyet a teljes választ adó betegeknél egy monoterápiában adott midosztaurin fenntartó kezelés követ.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Hematológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
C920
Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet |
| Budapest | Semmelweis Egyetem |
| Debrecen | Debreceni Egyetem Klinikai Központ |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Kaposvár | KaposiMór Oktató Kórház |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
| Nyíregyháza | Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
| Szombathely | Markusovszky Egyetemi Oktatókórház" |
"
11. Az R2 2. számú melléklete a következő EÜ100 74. ponttal egészül ki:
"EÜ100 74.
TÁMOGATOTT INDIKÁCIÓK:
Allogén vérképző őssejt-átültetést követően, CMV-szeropozitív [R+], cytomegalovirus reaktiváció és betegség megelőzésére nagykockázatú betegek számára a transzplantációt követő +100. napig
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Hematológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
Z9483; C92, C91
Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Dél-pesti Centrumkórház - Országos Hematológiai és Infektológiai Intézet |
| Debrecen | Debreceni Egyetem Klinikai Központ" |
"
12. Az R2 2. számú melléklete a következő EÜ100 75. ponttal egészül ki:
"EÜ100 75.
TÁMOGATOTT INDIKÁCIÓK:
A Kormány által meghatározott egészségügyi veszélyhelyzet idején, a veszélyhelyzeti eljárásrendben foglaltak szerint
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| az egészségügyért felelős miniszter | megkötés nélkül | írhat |
| eljárásrendjében meghatározott | ||
| intézmény |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
Z"
4. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R2. 3. számú melléklet EÜ70 13. pontjának "A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK" része a következő sorral egészül ki:
| (MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG:) |
| "Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet | Geriátria | javaslatra írhat" |
2. Az R2. 3. számú melléklet EÜ70 30. pontjában foglalt "Kijelölt intézmények:" táblázata a következő sorral egészül ki:
| (Város | Intézmény neve) |
| Budapest | Uzsoki Utcai Kórház |
3. Az R2 3. számú melléklet Eü70 24. pontja helyébe a következő rendelkezés lép:
"EÜ70 24.
TÁMOGATOTT INDIKÁCIÓK
Acut coronaria syndromás betegek alcsoportjai (instabil anginás diabetes mellitusos betegek; valamennyi nem ST elevációs infarctuson és ST elevációs infarctuson átesett beteg) közül mindazoknál, akiknél percutan coronaria intervenció és stent beültetés történt, és clopidogrel allergia vagy laboratóriumilag igazolt non-reszponzió vagy igazolt diabetes mellitus áll fenn vagy stent trombózist szenvedett el, egy éven keresztül.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Kardiológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I20.0-I22.9; Z95.5
Kijelölt intézmények:
| Város | Intézmény neve |
| Balatonfüred | Állami Szívkórház |
| Budapest | Bajcsy-Zsilinszky Kórház és Rendelőintézet |
| Budapest | Semmelweis Egyetem |
| Budapest | Gottsegen György Országos Kardiológiai Intézet |
| Budapest | Magyar Honvédség Egészségügyi Központ |
| Budapest | Betegápoló Irgalmas Rend Kórház |
| Debrecen | Debreceni Egyetem Klinikai Központ |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Gyula | Békés Megyei Központi Kórház |
| Kaposvár | Somogy Megyei KaposiMór Oktató Kórház |
| Kecskemét | Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
| Nyíregyháza | Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem Klinikai Központ |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
| Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház |
| Szolnok | Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
| Szombathely | Markusovszky Egyetemi Oktatókórház |
| Zalaegerszeg | Zala Megyei Kórház |
| Budapest | Uzsoki Utcai Kórház |
"
4. Az R2. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része a következő EÜ 70 31. ponttal egészül ki:
"EÜ70 31.
TÁMOGATOTT INDIKÁCIÓK:
Vashiány kezelése (anémiával vagy anélkül) olyan krónikus szívelégtelenségben szenvedő NYHA II-III stádiumú betegeknél, akiknél a bal kamrai ejekciós frakció (EF) értéke < 45%.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Kardiológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I5092, I5093
Kijelölt intézmények:
| Város | Intézmény neve |
| Balatonfüred | Állami Szívkórház |
| Budapest | Bajcsy-Zsilinszky Kórház és Rendelőintézet |
| Budapest | Semmelweis Egyetem |
| Budapest | Gottsegen György Országos Kardiológiai Intézet |
| Budapest | Magyar Honvédség Egészségügyi Központ |
| Budapest | Betegápoló Irgalmas Rend Kórház |
| Debrecen | Debreceni Egyetem Klinikai Központ |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Gyula | Békés Megyei Központi Kórház |
| Kaposvár | Somogy Megyei KaposiMór Oktató Kórház |
| Kecskemét | Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
| Nyíregyháza | Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem Klinikai Központ |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
| Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház |
| Szolnok | Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
| Szombathely | Markusovszky Egyetemi Oktatókórház |
| Zalaegerszeg | Zala Megyei Kórház |
"
5. Az R2. 3. számú melléklet EÜ90 26. pont "A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK" része a következő sorokkal egészül ki:
| (MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG:) |
| "Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet | Geriátria | javaslatra írhat |
| Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet | Arc-, állcsont- és szájsebészet | javasolhat és írhat" |
6. Az R2. 3. számú melléklet EÜ90 33. pont "TÁMOGATOTT INDIKÁCIÓK" része helyébe az alábbi rendelkezés lép:
"TÁMOGATOTT INDIKÁCIÓK:
Közepesen súlyos/súlyos tünetekkel járó méhfibrómák időszakos kezelésére olyan menopauzát el nem ért felnőtt nők esetében, akik számára a méhfibróma embolizációja és/vagy a műtéti kezelési lehetőségek nem megfelelőek, vagy azok kudarcot vallottak."
5. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
Az R2. 4. számú melléklet 1. pontja helyébe a következő rendelkezés lép:
"(Az alábbi indikációs területeken beszerezhető hatóanyagok köre:
1. A veleszületett vérzékenység kezelésére:)
1.1) antithrombin III. koncentrátum,
1.2) hazai plazmából előállított nagytisztaságú VIII. faktor koncentrátum,
1.3) részben hazai plazmából előállításra kerülő, külföldön feldolgozott nagytisztaságú VIII. faktor koncentrátum, ITI kezelésre alkalmas von Willebrand faktor tartalommal,
1.4) külföldi plazmából előállításra kerülő, haemophilia A kezelésére szolgáló nagytisztaságú VIII. faktor koncentrátum, ITI kezelésre alkalmas von Willebrand faktor tartalommal,
1.5) külföldi plazmából előállításra kerülő, hemophilia A kezelésére szolgáló nagytisztaságú nem albuminnal stabilizált VIII. faktor koncentrátum,
1.6) recombináns technológiával előállított 2. generációs VIII. faktor koncentrátum,
1.7) recombináns technológiával előállított 3. generációs teljes molekulaméretű VIII. faktor koncentrátum,
1.8) nagy von Willebrand faktor tartalmú nagytisztaságú, plazma eredetű VIII. faktor koncentrátum, amely mérsékelt súlyosságú von Willebrand betegség, haemophilia A, immuntolerancia indukciós kezelésére alkalmas,
1.9) von Willebrand betegség kezelésére szolgáló, nagy von Willebrand faktor tartalmú plazma eredetű von Willebrand faktor/VIII. faktor készítmény,
1.10) von Willebrand betegség kezelésére szolgáló, kiegyensúlyozott von Willebrand/VIII. faktor tartalmú plazma eredetű von Willebrand faktor/VIII. faktor készítmény,
1.11) eptacog alfa (aktivált) (rekombináns aktivált VII. koagulációs faktor),
1.12) aktivált prothrombin komplex koncentrátum (VIII. koagulációs faktor inhibitor "bypassing" aktivitású készítmény),
1.13) hazai plazmából előállított nagytisztaságú plazma eredetű IX. faktor készítmény,
1.14) nagytisztaságú import IX. faktor készítmény,
1.15) prothrombin komplex koncentrátum ismert VIIF aktivitással,
1.16) szöveti ragasztóanyagok (humán kétkomponensű fibrin fehérjeragasztó koncentrátum),
1.17) fibrinogén koncentrátum (I koagulációs faktor),
1.18) recombináns technológiával előállított 3. generációs B-domain-depletált VIII. faktor koncentrátum,
1.19) recombináns technológiával előállított 1. generációs VIII. faktor koncentrátum,
1.20) recombináns technológiával előállított 3. generációs B-domain rövidített, teljesen tirozin-szulfatált VIII. faktor koncentrátum, korábban már kezelt, ún. PTP betegek részére,
1.21) recombináns technológiával humán sejtvonalon előállított természetes, kémiai módosítás nélküli 4. generációs B-domain rövidített VIII. faktor koncentrátum.
1.22) rekombináns technológiával, humán sejtvonalon előállított, 4. generációs, elnyújtott felezési idejű VIII. faktor koncentrátum, Fc fúziós fehérje,
1.23) rekombináns technológiával, humán sejtvonalon előállított, elnyújtott felezési-idejű IX. faktor koncentrátum, Fc fúziós fehérje.
1.24) emicizumab (FVIII elleni inhibitorral rendelkező betegek kezelésére szolgáló monoklonális antitest).
1.25) Rekombináns technológiával előállított, rövidített B doménnel, magas von Willebrand faktor affinitással rendelkező, kovalens kötéssel kapcsolt, egyláncú, igazolt fél élettartam-előnnyel rendelkező, 3. generációs VIII-as faktor koncentrátum.
1.26) Helyspecifikusan glikopegilált, elnyújtott félélettartamú, 3. generációs rekombináns IX. faktor készítmény
1.27) Helyspecifikusan, 60 kDa molekulatömegű polietilén-glikol oldallánc kovalens kötésével módosított, elnyújtott félélet-idejű harmadik generációs, rekombináns VIII. faktor készítmény"
6. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R3. 5. számú melléklet 5.3. pontja a következő 5.3.3. sorral egészül ki:
"5.3.3. safinamide."
2. Az R3. 5. számú melléklet 9.3. pontja helyébe a következő rendelkezés lép:
"9.3. Finanszírozott hatóanyagok Magyarországon
| A | B | |
| 1 | ATC | Hatóanyag |
| 2 | N04AA02 | biperiden |
| 3 | N04AA04 | prociklidin |
| 4 | N04BA02 | levodopa és decarboxylasegátló |
| 5 | N04BA03 | levodopa, decarboxylasegátló és COMT gátló |
| 6 | N04BB01 | amantadin |
| 7 | N04BC04 | ropinirol |
| 8 | N04BC05 | pramipexol |
| 9 | N04BC07 | apomorfin-hidroklorid-hemihidrát |
| 10 | N04BC09 | rotigotine |
| 11 | N04BD01 | selegilin |
| 12 | N04BD02 | rasagiline |
| 13 | N04BD03 | safinamide |
| 14 | N04BX02 | entacapone" |
"
7. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R3. 9. melléklet 6. pontja helyébe a következő rendelkezés lép:
"6. Colitis ulcerosa biológiai kezelése
6.1. Indukciós kezelés súlyos, aktív colitis ulcerosában: a hagyományos terápiára nem reagáló, illetve a felnőttkori, súlyos (18 éves kor felett, Mayo score ≥ 9) colitis ulcerosa kezelésére vonatkozik.
6.1.1. Hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy intoleráns, immunszuppresszív szer mellett szteroid dependens, vagy immunszuppresszív szerre intoleráns, közepesen súlyos, krónikusan aktív colitis ulcerosában 5 mg/ttkg infliximab kezelés (a 0., 2. és 6. héten) vagy szubkután adalimumab terápia (0. héten 160 mg, 2. héten 80 mg, majd 2 hetente 40 mg sc. 3 hónapig).
6.1.2. Súlyos, fulmináns, 5 napos intravénás szteroid kezelésre nem reagáló colitis ulcerosában, amennyiben colectomia szükségessége fenyeget, a műtéti kezelés előtt egy alkalommal megkísérelhető az 5 mg/ttkg dózisú IFX kezelés. Hatékonyság esetén a teljes indukciós kezelést (5 mg/ttkg IFX parenterálisan a 2. héten és 6. héten) alkalmazni kell. Adalimumab, ustekinumab és vedolizumab ebben a betegcsoportban nem alkalmazható. Tofacitinib esetén a rutinszerű alkalmazás nem javasolt.
6.1.3. Vedolizumab indukciós kezelés indikált hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy immunszuppresszív szer mellett szteroid dependens, vagy anti-TNF-a szerre nem reagáló közepesen súlyos, krónikusan aktív colitis ulcerosában (testtömegtől függő intravénás dózist követően a 8. héten 1 adag subcutan injekció).
6.1.4. Usztekinumab indukciós kezelés indikált hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy immunszuppresszív szer mellett szteroid dependens, vagy anti-TNF-a szerre nem reagáló közepesen súlyos, krónikusan aktív colitis ulcerosában (16. hétre klinikai remisszió).
6.1.5. Tofacitinib indukciós kezelés indikált hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy immunszuppresszív szer mellett szteroid dependens, vagy anti-TNF-a szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában. (Az ajánlott bevezető dózis 8 hétig naponta kétszer 10 mg szájon át adva. Azoknál a betegeknél, akiknél a 8. hétre nem alakul ki megfelelő terápiás előny, a naponta kétszer 10 mg-os bevezető adag alkalmazása további 8 hétre kiterjeszthető (ez összesen 16 hetet jelent), amelyet naponta kétszer 5 mg fenntartó adag követ. A tofacitinib bevezető kezelést abba kell hagyni azoknál a betegeknél, akiknél a 16. hétig nem alakulnak ki a terápiás előnyre utaló bizonyítékok.)
6.2. A biológiai indukciós kezelés hatékonyságának ellenőrzése colitis ulcerosában
A komplett indukciós kezelés hatékonyságának felmérésére a részleges Mayo-score javasolt.
6.2.1. Szteroid dependens colitis ulcerosa esetén alkalmazott infliximab, adalimumab, vedolizumab, usztekinumab vagy tofacitinib kezelés hatékonynak tekinthető, ha változatlanul kielégítő klinikai státusz mellett a szteroid kezelés legalább 3 hónapon át elhagyhatóvá vált. Törekedni kell a nyálkahártya gyógyulás elérésére.
6.2.2. Szteroid rezisztens (nem fulmináns) colitis ulcerosa esetében a hatékonyság felmérésére a 12. héten alkalmazott, Mayo-subscore (endoszkópos vizsgálat nélkül) legalább 3 pontos csökkenése javasolt."
2. Az R3. 9. melléklet 7. pont 7.4. alpontja helyébe a következő rendelkezés lép:
"7.4. Az usztekinumabbal történt indukciós kezelés által elért adekvát klinikai választ követően indokolt usztekinumab fenntartó terápia, alkalmazása 8 hetenként vagy 12 hetenként történhet. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok alapján pontosan nem meghatározott. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) remisszió esetén a kezelés felfüggeszthető. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben, ismételt terápiás lehetőségként alkalmazható."
3. Az R3. 9. melléklet 7. pontja a következő 7.5. és 7.6. alponttal egészül ki:
"7.5. A tofacitinibbel történt indukciós kezelés által elért remissziót követően indokolt tofactinib fenntartó terápia alkalmazása a 16. héttől. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok alapján pontosan nem meghatározott. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) remisszió esetén a kezelés felfüggeszthető. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben, ismételt terápiás lehetőségként alkalmazható.
7.6. Amennyiben a relapszus a kezelés felfüggesztése után 6 hónapon belül lép fel, reindukciós kezelés sem infliximab, sem adalimumab, sem vedolizumab, sem usztekinumab, sem tofacitinib esetén nem indokolt, a fenntartó kezelés folytatása javasolt, de a biológiai terápia újraindítása előtt a relapszus klinikai képét utánzó esetleges egyéb okok kizárása (pl. infekció, szövődmények stb.) szükséges."
4. Az R3. 9. melléklet 8. pontja helyébe a következő rendelkezés lép:
"8. Különleges megfontolások a biológiai kezeléshez
8.1. A készítményválasztás kérdése:
Az infliximab bizonyítottan hatásos terápia refrakter indeterminált colitis és pouchitis eseteiben is. Az anti-TNF-a készítmények és más immunszuppresszáns szerek (pl. azathioprin vagy szteroid) kombinált alkalmazása a mellékhatások gyakoribb előfordulása miatt (pl. fertőzéses szövődmények) a kockázat és előny mérlegelése után lehetséges.
Az anti-TNF-a szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában kezdhető meg a vedolizumab vagy tofacitinib kezelés.
8.2. Dózismódosítás
Az aktív colitis ulcerosa esetén alkalmazott infliximab kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban. Rendelkezésre állnak irodalmi adatok a 10 mg/ttkg és a 4 hetente 5 mg/ttkg dózis hatékonyságáról is.
Az aktív colitis ulcerosa esetén alkalmazott adalimumab kezelés esetében hatékony indukciós kezelést követően 2 hetente 40 mg dózisban. Adalimumab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé, de azon betegeknél, akiknél csökken a terápiás hatás, lehetőséget ad a 40 mg-os dózis hetenként történő alkalmazására. Ilyenkor amennyiben lehetséges, a hatásvesztés okának tisztázása javasolt.
Vedolizumab: Közepesen súlyos-súlyos, aktív colitis ulcerosa esetében hatékony indukciós kezelést követően a 8 hetente, 300 mg-os adagokra kezdetben reagáló, remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén az infúziók közötti időintervallum négy hétre csökkenthető. Ilyenkor - amennyiben lehetséges - a hatásvesztés okának tisztázása javasolt.
Usztekinumab: A kezelés abbahagyása mérlegelendő azoknál a betegeknél, akik 16 héttel az intravénás és subcutan indukciós dózis után, vagy a 8 hetenkénti fenntartó adagolásra történő átállítás után 16 héttel nem mutatnak a kedvező terápiás hatásra utaló bizonyítékot. A kezelés alatt az immunmodulátorok és/vagy kortikoszteroidok adása folytatható.
Tofacitinib: A fenntartó kezeléshez nem ajánlott a napi kétszeri 10 mg tofacitinib alkalmazása azoknál a colitis ulcerosában szenvedő betegeknél, akiknél ismerten fennállnak a vénás thromboembolia (VTE) kockázati tényezői, kivéve akkor, ha nem áll rendelkezésre megfelelő alternatív kezelési mód. Azoknál a colitis ulcerosában szenvedő betegeknél, akiknél nem áll fenn a VTE kialakulásának fokozott kockázata, meg lehet fontolni a napi kétszer 10 mg-os tofacitinib-dózis alkalmazását abban az esetben, ha a beteg terápiás válasz gyengülését tapasztalja a napi kétszer 5 mg tofacitinib alkalmazásakor, és nem reagál a colitis ulcerosa kezeléséhez rendelkezésre álló alternatív lehetőségekre, pl. a tumornekrózisfaktor-gátló (TNF-inhibitor) kezelésre. A napi kétszer 10 mg-os tofacitinib-dózist fenntartó kezelésként csak a lehető legrövidebb ideig szabad alkalmazni. A terápiás válasz fenntartásához szükséges legkisebb hatásos dózist kell alkalmazni.
8.3. Készítményváltás
A biológiai kezelés során a terápiás válasz elégtelensége vagy a válasz elvesztése után másik szerre való váltás megengedett. Jelenleg két anti-TNF-a és egy integrin-antagonista készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás hatástani csoporton belül vagy azok között, bármely hatóanyag egyszeri alkalmazásával javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (pl. fertőzések) kizárása.
Az anti-TNF-a szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában kezdhető meg a vedolizumab vagy a tofacitinib kezelés."
5. Az R3. 9. melléklet 13. pont 13.2. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"13.2. A releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | szulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | A07EC02 | mesalazin | DMARD | Betegségmódosító szerek |
| 4 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 5 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 6 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 7 | L04AA33 | vedolizumab | BRMD | Biológiai terápia eszközei |
| 8 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 9 | L04AC05 | usztekinumab | BRMD | Biológiai terápia eszközei |
| 10 | L04AA29 | tofacitinib | BRMD | Biológiai terápia eszközei |
| 11 | H02AB01 | betamethason | Szteroid | Szteroid gyógyszerek |
| 12 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 13 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 14 | H02AB09 | hidrokortizon | Szteroid | Szteroid gyógyszerek |
| 15 | A07EA06 | budesonid | Szteroid | Szteroid gyógyszerek |
"
8. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R3. 10. melléklet 6. pont 6.3.3. alpontja helyébe a következő rendelkezés lép:
"6.3.3. TNF-alfa gátlók: adalimumab, etanercept, infliximab, certolizumab-pegol (az alkalmazott támogatási kategória figyelembevételével)"
2. Az R3. 10. melléklet 6. pont 6.3.4. alpontja helyébe a következő rendelkezés lép:
"6.3.4. Interleukin-inhibitor: usztekinumab, ixekizumab, szekukinumab, guszelkumab, rizankizumab"
3. Az R3. 10. melléklet 8. pont 8.2. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"8.2. Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC-kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 3 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 4 | D05BB02 | acitretin | Retinoid | Antipsoriatikus szisztémás szer |
| 5 | L04AB01 | etanercept | BRMD | Biológiai terápia eszközei |
| 6 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 8 | L04AC05 | usztekinumab | BRMD | Biológiai terápia eszközei |
| 9 | L04AC10 | szekukinumab | BRMD | Biológiai terápia eszközei |
| 10 | L04AC13 | ixekizumab | BRMD | Biológiai terápia eszközei |
| 11 | L04AC16 | guszelkumab | BRMD | Biológiai terápia eszközei |
| 12 | L04AB05 | certolizumab-pegol | BRMD | Biológiai terápia eszközei |
| 13 | L04AC18 | rizankizumab | BRMD | Biológiai terápia eszközei |
"
9. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R3. 11. melléklet 4. pont 4.5. alpontja helyébe a következő rendelkezés lép:
"4.5. Célzott szintetikus DMARD
JAK gátlók: baricitinib, tofacitinib, upadacitinib"
2. Az R3. 11. melléklet 7. pont 7.2.6.7. alpontja helyébe a következő rendelkezés lép:
"7.2.6.7. Célzott szintetikus DMARD terápia (JAK gátlók): baricitinib, tofacitinib, upadacitinib"
3. Az R3. 11. melléklet 9. pont 9.2. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"9.2. Táblázat: Releváns ATC kódok
| A | B | C | D | |
| ATC kód | Hatóanyag | Kategória | Megjegyzés | |
| 1 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 2 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 3 | L04AA13 | LEF | DMARD | Betegségmódosító szerek |
| 4 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 5 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 6 | P01BA01 | chloroquin | DMARD | Betegségmódosító szerek |
| 7 | L04AB01 | etanercept | TNF alfa gátló | Biológiai terápia eszközei |
| 8 | L04AA24 | abatacept | CTLA-4 analóg | Biológiai terápia eszközei |
| 9 | L04AA29 | tofacitinib | JAK gátló | Betegségmódosító szerek |
| 10 | L04AA37 | baricitinib | JAK gátló | Betegségmódosító szerek |
| 11 | L04AA44 | upadacitinib | JAK gátló | Betegségmódosító szerek |
| 12 | L04AB02 | infliximab | TNF alfa gátló | Biológiai terápia eszközei |
| 13 | L04AB04 | adalimumab | TNF alfa gátló | Biológiai terápia eszközei |
| 14 | L04AB06 | golimumab | TNF alfa gátló | Biológiai terápia eszközei |
| 15 | L04AB05 | certolizumab-pegol | TNF alfa gátló | Biológiai terápia eszközei |
| 16 | L04AC07 | tocilizumab | IL-6 R gátló | Biológiai terápia eszközei |
| 17 | L04AC14 | sarilumab | IL-6 R gátló | Biológiai terápia eszközei |
| 18 | L01XC02 | rituximab | B sejt gátló | Biológiai terápia eszközei |
| 19 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 20 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 21 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 22 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
"
10. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
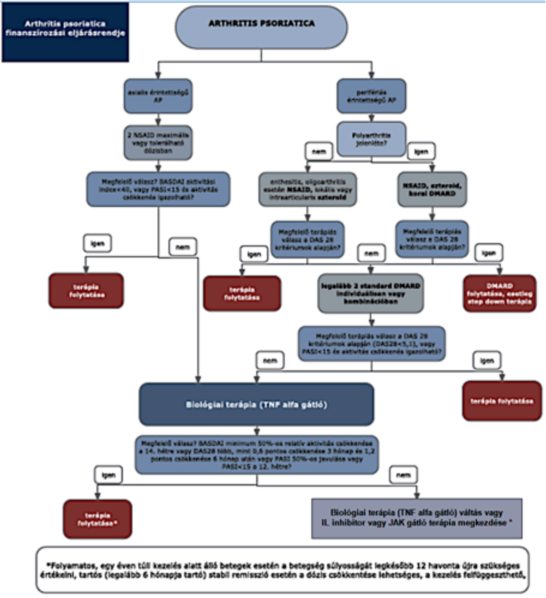
1. Az R3. 14. melléklet 3. pontja helyébe a következő rendelkezés lép:
"3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
"
2. Az R3. 14. melléklet 4. pont 4.6. alpontja helyébe a következő rendelkezés lép:
"4.6. A biológiai terápiás kezelés további folytatásának kritériumai:
4.6.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-a terápiára történő váltás (switch), IL inhibitor vagy JAK gátló terápia megkezdése megengedett.
4.6.2. Az anti-TNF-a terápia dózisának emelése a forgalomba hozatali engedélyben meghatározott induló dózishoz képest nem javasolt.
4.6.3. Csak szakavatott és a terápia-alkalmazásban jártas kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-a, és az IL inhibitor és JAK gátló terápia indikálása és alkalmazása."
3. Az R3. 14. melléklet 6. pontja a következő 6.2.5.5. alponttal egészül ki:
"6.2.5.5. JAK-gátló: tofacitinib"
4. Az R3. 14. melléklet 8. pont 8.2. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"8.2. táblázat: Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 4 | L04AA13 | LEF | DMARD | Betegségmódosító szerek |
| 5 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 6 | L04AB01 | etanercept | TNF-alfa gátló | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 8 | L04AB02 | infliximab | TNF-alfa gátló | Biológiai terápia eszközei |
| 9 | L04AB06 | golimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 10 | L04AC10 | szekukinumab | IL-inhibitor | Biológiai terápia eszközei |
| 11 | L04AC13 | ixekizumab | IL-inhibitor | Biológiai terápia eszközei |
| 12 | L04AA29 | tofacitinib | JAK gátló | Betegségmódosító szerek |
| 13 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 14 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 15 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 16 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
"
11. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R3. 19. melléklet 4. pont 4.3. alpontjában a "myeloma multiplex második és többedik relapszusa" ábra helyébe a következő rendelkezés lép:
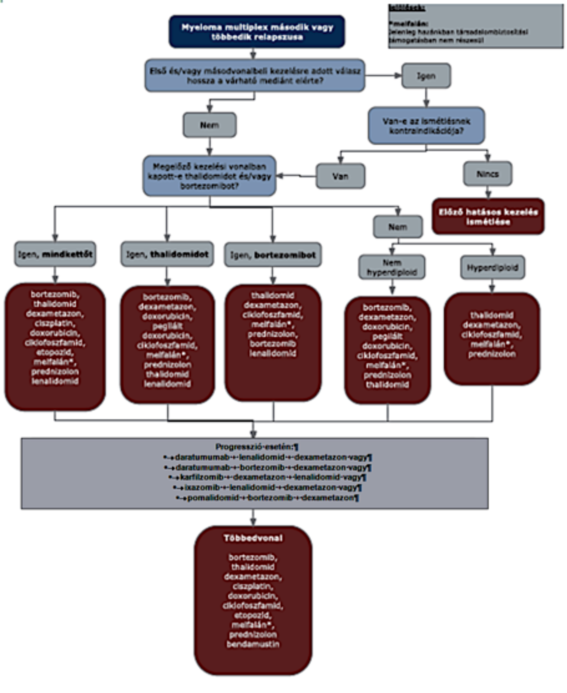
2. Az R3. 19. melléklet 4. pont 4.3.6 alpontja helyébe a következő rendelkezés lép:
"4.3.6. A pomalidomid+bortezomib+dexametazon kombináció ECOG 0-1 státuszú betegeknek adható harmad vagy negyedvonalban, akik korábban már legalább egy, lenalidomidot tartalmazó kezelésben részesültek. A terápia hatásosságát 6 ciklust követően szükséges értékelni. A 6. ciklus után komplett remisszióba kerülő betegek esetén folytatható finanszírozottan a kezelés progresszióig, de legfeljebb 12 hónapig."
3. Az R3. 19. melléklet 4. pontja a következő 4.3.7. alponttal egészül ki:
"4.3.7. A jelen finanszírozási eljárásrend az őssejt-transzplantáció finanszírozásának részletes szabályaira nem terjed ki."
4. Az R3. 19. melléklet 7. pont 7.3. alpontjában szereplő táblázat a következő sorral egészül ki:
| (A | B | |
| 1 | ATC | ATC megnevezés) |
| 17 | L04AX06 | pomalidomid |
12. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R3. 31. melléklet 3. pont 3.4. alpontja helyébe a következő rendelkezés lép:
"3.4. A sclerosis multiplex progressziójának/aktivitásának csökkentését célzó gyógyszeres kezelés algoritmusa
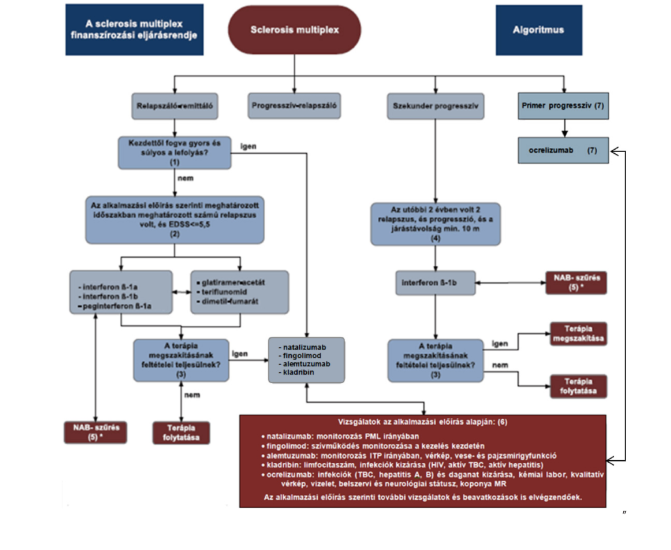
"
2. Az R3. 31. melléklet 3. pontja a következő 3.5.6.5. alponttal egészül ki:
"3.5.6.5. Ocrelizumab: a kezelés megkezdése előtt akut hepatitis A és B, TBC, aktív daganatos betegség kizárása, kémiai labor, kvalitatív vérkép és vizeletvizsgálat, akut infekció kizárása. A kezelés során monitorozás: kémiai labor, kvalitatív vérképvizsgálat, belszervi és neurológiai vizsgálat, koponya MR. Az alkalmazási előírás szerinti további vizsgálatokat és beavatkozásokat is el kell végezni."
3. Az R3. 31. melléklet 3. pontja a következő 3.5.7. alponttal egészül ki:
"3.5.7. (7) Primer progresszív SM-ben:
3.5.7.1. A primer progresszív kórforma igazolása:
3.5.7.1.1. Klinikai megjelenés: kezdetektől progresszív neurológiai tünetek, amelyek SM gyanúját keltik.
3.5.7.1.2. Diagnosztikus kritériumok:
a) a tünetek 1 éves folyamatos progressziója és
b) 2 feltétel teljesülése a következőkből:
ba) pozitív koponya MR: 9 T2-lézió vagy 4 vagy több T2-lézió pozitív VEP-pel
bb) pozitív gerincvelő MR: 2 T2-lézió
bc) pozitív likvorvizsgálati eredmény.
3.5.7.2. Primer progresszív SM-ben ocrelizumab alkalmazásának feltételei:
3.5.7.2.1. A beteg állapota a terápia megkezdésekor a Kiterjesztett Rokkantsági Állapot Skála szerint 3 és 6,5 közötti (EDSS: 3 - 6,5).
3.5.7.2.2. Az ocrelizumab-kezelés mindaddig folytatható, amíg a beteg kézfunkciója megtartott (EDSS: 7 - 7,5)"
4. Az R3. 31. melléklet 6. pont 6.4. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"6.4. táblázat: Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | H02AB04 | metilprednizolon |
| 3 | L03AB07 | interferon béta-1a |
| 4 | L03AB08 | interferon béta-1b |
| 5 | L03AB13 | peginterferon-béta-1a |
| 6 | L03AX13 | glatiramer-acetát |
| 7 | L04AA23 | natalizumab |
| 8 | L04AA27 | fingolimod |
| 9 | L04AA31 | teriflunomid |
| 10 | L04AA34 | alemtuzumab |
| 11 | L04AA36 | ocrelizumab |
| 12 | L04AA40 | kladribin |
| 13 | L04AX01 | azatioprin |
| 14 | L04AX07 | dimetil-fumarát |
| 15 | M03BX01 | baclofen |
| 16 | M03BX02 | tizanidin |
| 17 | M03BX04 | tolperison |
| 18 | N04BB01 | amantadin |
"
13. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
1. Az R3. 37. melléklet 2. pontja helyébe a következő rendelkezés lép:
"2. A kórkép leírása
Az asthma bronchiale a légutak krónikus gyulladásos megbetegedése. A patomechanizmus fő tényezői a gyulladás, a légutak strukturális átalakulása és a bronchiális hiperreaktivitás. A légutak obstrukcióval reagálnak nem specifikus stimulusokra. Klinikailag rendszeresen jelentkeznek nehézlégzéssel, mellkasi feszüléssel, köhögéssel járó epizódok leginkább éjszaka vagy kora reggel. A panaszok hátterében álló változó mértékű légúti szűkület spontán vagy megfelelő farmakoterápia hatására többnyire reverzibilis. Bármely súlyossági fokozatban felléphet exacerbáció, ami a jellemző tünetek (nehézlégzés, köhögés, sípoló légzés, mellkasi feszülés) fokozódása, illetve e fokozott tünetek kombinációja. Az asthma multifaktoriális etiológiájú kórkép, kialakulásában genetikai és környezeti tényezők játsszák a fő szerepet. Az európai országokban az asthma prevalenciája 5-10% körül mozog. Magyarországon a pulmonológiai szakellátásban mintegy 300 ezer beteget tartanak nyilván, az új megbetegedések száma évente 10-20 ezer. A betegség ellátása komoly terhet ró a betegre és a társadalomra egyaránt. Az asthma klinikai manifesztációi adekvát gyógyszeres kezeléssel és megfelelő gondozással jól kontrollálhatók, de maga a betegség nem gyógyítható.
A jelen finanszírozási eljárásrend hatálya a felnőttkori asthma bronchiale diagnosztikájára, valamint gyógyszeres kezelésére terjed ki."
2. Az R3. 37. melléklet 3. pontja helyébe a következő rendelkezés lép:
"3. A finanszírozás rendje, a finanszírozási algoritmus
3.1. Az asthma bronchiale diagnosztikájának algoritmusa
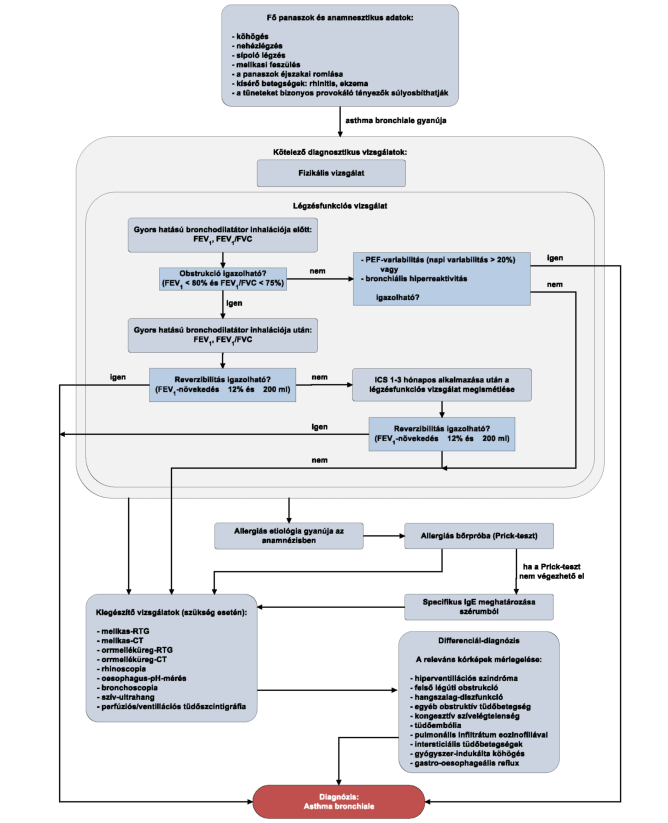
Szisztémás antihisztamin-kezelés alatt az allergiás bőrpróba helyett nem végezhető specifikus IgE-meghatározás. A szisztémás antihisztamin-kezelés felfüggesztése után 1 héttel az allergiás bőrpróba elvégezhető."
3. Az R3. 37. melléklet 4. pontja helyébe a következő rendelkezés lép:
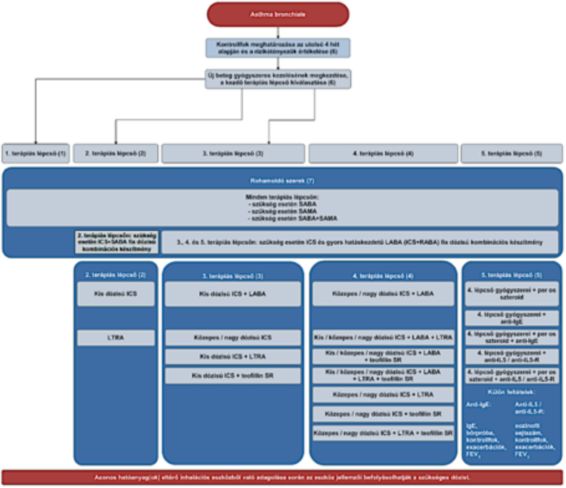
"4. Az asthma bronchiale gyógyszeres kezelésének finanszírozási algoritmusa
"
4. Az R3. 37. melléklet 4. pont 4.1. alpont (5)-(7) pontja helyébe a következő rendelkezések lépnek:
"(5) 5. terápiás lépcső.
a) A választható kezelések:
aa) a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal
ab) perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése anti-IgE-vel
ac) perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal és anti-IgE-vel
ad) perzisztáló súlyos eozinofil asthmában a 4. lépcső szerinti kezelés kiegészítése anti-IL5 vagy anti-IL5-R készítménnyel
ae) perzisztáló súlyos eozinofil asthmában a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal és anti-IL5 vagy anti-IL5-R készítménnyel.
b) Az anti-IgE adásának további feltételei:
ba) IgE-szint > 76 NE/ml és az IgE-szint nem haladja meg az alkalmazási előírás szerinti maximális értéket
bb) perenniális inhalatív allergénnel szembeni pozitív bőrpróba vagy specifikus IgE kimutatása a szérumban
bc) szisztémás szteroid tartós alkalmazása ellenére az asthma nem kontrollált vagy nagy dózisú ICS+LABA alkalmazása ellenére gyakoriak a szisztémás szteroidot igénylő exacerbációk (≥ 4/év)
bd) FEV1 < ref. 80%-a
be) az anti-IgE-kezelés megkezdését követően évente értékelni kell a kezelés hatását, és az anti-IgE-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő vagy a korábban alkalmazott tartós fenntartó szisztémás szteroidkezelés dózisa az anti-IgE-kezelés megkezdése előtti dózis 50%-ára vagy az alá csökkent.
c) Valamennyi anti-IL5/anti-IL5-R adásának további feltételei:
ca) laboratóriumi vérképvizsgálat által kimutatott perifériás eozinofil sejtszám a terápia megkezdése előtt a készítmény alkalmazási előírásában definiáltnak megfelel, de legalább 300 sejt/μl
cb) tartós szisztémás szteroid kezelés ellenére az asthma nem kontrollált, vagy az elmúlt 12 hónapban legalább 4 szisztémás szteroid kezelést igénylő asthma exacerbáció alakult ki
cc) nagydózisú ICS+LABA fenntartó terápia legalább 6 hónapos rendszeres használata ellenére FEV1 < 80% és nem kontrollált asthma áll fenn
cd) FEV1 < ref. 80%-a
ce) az anti-IL5/anti-IL5-R-kezelés megkezdését követően évente értékelni kell a kezelés hatását és az anti-IL5/ anti-IL5-R-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő vagy a korábban alkalmazott tartós fenntartó szisztémás szteroidkezelés dózisa az anti-IL5/anti-IL5-R-kezelés megkezdése előtti dózis 50%-ára vagy az alá csökkent.
cf) ha az anti-IL5/anti-IL5-R-kezelés az évenkénti értékelés alapján tovább nem folytatható, úgy az anti-IL5/anti-IL5-R-kezelés másik anti-IL5/anti-IL5-R hatóanyaggal sem folytatható.
d) A benralizumab alkalmazásának - a valamennyi anti-IL5/anti-IL5-R adására vonatkozó feltételek melletti - további feltételei:
da) a benralizumab-kezelés megkezdése után 6 hónappal értékelni kell a kezelés hatását és a benralizumab-kezelés kizárólag akkor folytatható, ha a FEV1 a kezelés első 6 hónapja során bármikor legalább 100 ml-rel nagyobb volt, mint a benralizumab-kezelés megkezdésekor, és a kezelés első 6 hónapja során szisztémás szteroidot igénylő exacerbáció legfeljebb 1 alkalommal fordult elő
db) ha a benralizumab-kezelés az első 6 hónap értékelése alapján tovább nem folytatható, úgy az anti-IL5/anti-IL5-R-kezelés másik anti-IL5/anti-IL5-R hatóanyaggal sem folytatható.
e) Anti-IgE és anti-IL5/anti-IL5-R egyidejűleg nem alkalmazható.
(6) Újonnan diagnosztizált betegnél meg kell állapítani az asthma kontrollfokát az utolsó 4 hét alapján és a rizikótényezők fennállását vagy hiányát. A gyógyszeres kezelés a kontrollfokhoz és a rizikóbecsléshez igazodó terápiás lépcsőn kezdhető meg.
a) Új beteg gyógyszeres kezelését az 1. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma kontrollált, és a nappali tünetek jelentkezése nem gyakoribb havi 2 alkalomnál, és nincs exacerbációs rizikó.
b) Új beteg gyógyszeres kezelését a 2. terápiás lépcsőn kell elkezdeni, ha az utolsó 4 hét vonatkozásában:
ba) az asthma kontrollált, de a kezelés 1. terápiás lépcsőn való elkezdésének feltételei nem teljesülnek;
bb) az asthma részben kontrollált és nincs exacerbációs rizikótényező.
c) Új beteg gyógyszeres kezelését a 3. terápiás lépcsőn kell elkezdeni, ha az utolsó 4 hét vonatkozásában:
ca) az asthma nem kontrollált;
cb) az asthma részben kontrollált és van exacerbációs rizikótényező.
(7) Rohamoldó szerek.
a) Minden terápiás lépcsőn (1., 2., 3., 4., 5.) használhatók szükség esetén:
aa) választandó kezelés a SABA
ab) ha a SABA kontraindikált vagy vele szemben intolerancia lép fel, választható a SAMA
ac) ha a SABA nem eredményezett megfelelő hörgtágítást, választható a SABA+SAMA.
b) A 2. terápiás lépcsőn használhatók szükség esetén:
ba) választható kezelés az ICS+SABA fix dózisú kombinációs készítmény.
c) A 3., 4., és 5. terápiás lépcsőn használhatók szükség esetén:
ca) amennyiben a beteg a 3., 4. vagy 5. terápiás lépcsőn ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítményt használ fenntartó terápiaként, és e készítmény alkalmazási előírásában a javallatok között szerepel a rohamoldóként történő, szükség szerinti alkalmazás is, úgy ez a készítmény - az alkalmazási előírásnak megfelelően - használható rohamoldó szerként is."
5. Az R3. 37. melléklet 4. pont 4.2. és 4.3. alpontjai helyébe a következő rendelkezések lépnek:
"4.2. Amennyiben az alkalmazott hatóanyagú készítmény kontraindikált, vagy az alkalmazási előírás szerinti dózisban vele szemben intolerancia (tolerálhatatlan mellékhatás) lép fel, akkor azt - a kezelőorvos mérlegelése és döntése alapján - úgy lehet tekinteni, mintha az érintett hatóanyagcsoporttal a megfelelő dózisban folytatott terápia - a megfelelő eredmény nélkül - megtörtént volna. Ilyen esetben ugyanakkor - a kezelőorvos mérlegelése és döntése alapján - lehetőség van az érintett hatóanyagcsoporton belül másik készítmény alkalmazására is.
4.3. Az inhalációs szteroidok becsült ekvivalens napi adagjai
| A | B | C | D | |
| 1 | Hatóanyag | Alacsony napi dózis (µg) | Közepes napi dózis (µg) | Magas napi dózis (µg) |
| 2 | beclometason-dipropionát (CFC) | 200-500 | >500-1000 | >1000 |
| 3 | beclometason-dipropionát (HFA és DPI) | 100-200 | >200-400 | >400 |
| 4 | budesonid (DPI) | 200-400 | >400-800 | >800 |
| 5 | ciclesonid (HFA) | 80-160 | >160-320 | >320 |
| 6 | fluticason-propionát (DPI) | 100-250 | >250-500 | >500 |
| 7 | fluticason-propionát (HFA) | 100-250 | >250-500 | >500 |
| 8 | fluticason-propionát (Axahaler) * | 50-125 | >125-250 | >250 |
| 9 | fluticason-furoát ** | 100 | 100-200 | 200 |
| 10 | budesonid (Axahaler) *** | 120-240 | 240-480 | >480 |
Az ICS-ot tartalmazó kezelést elrendelő orvos feladata, hogy a dózisekvivalenciát a hatályos szakmai irányelv és az alkalmazási előírás alapján ellenőrizze, az előírt dózist pedig szükség esetén módosítsa.
* Fluticason Axahaler: a DPI inhalációs eszközök közül Axahaler esetében a fluticason-propionát ekvivalens dózisa a Diskus-ból adott dózis 50%-a.
** Naponta egyszer alkalmazandó, vilanterollal fix kombinációban.
*** Budesonid Axahaler: a DPI inhalációs eszközök közül Axahaler esetében a budesonid ekvivalens dózisa a Turbuhalerből/Easyhalerből adott dózis 75%-a."
6. Az R3. 37. melléklet 4. pont 4.5. alpontjában foglalt táblázat C:3 mezője helyébe a következő mező lép:
| (C) | |
| (3) | mondattöredékek |
7. Az R3. 37. melléklet 6. pontja helyébe a következő rendelkezés lép:
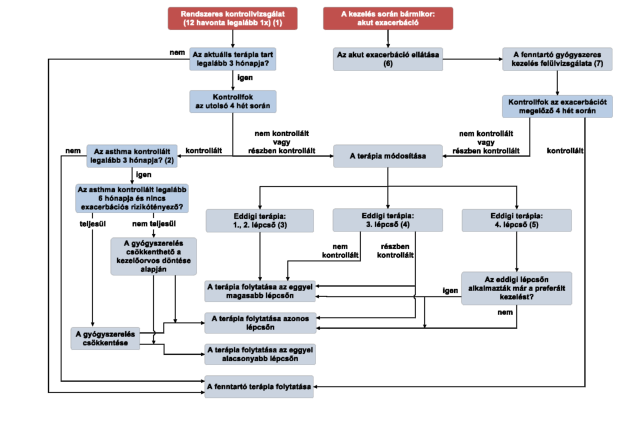
"6. Az asthma bronchiale gyógyszeres kezelése kontrollfokhoz történő igazításának algoritmusa
A gyógyszeres kezelés kontrollfokhoz történő igazításának algoritmusában (6. pont) szereplő döntések tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) Minden betegnek 12 havonta legalább egyszer részt kell vennie szakorvosi kontrollvizsgálaton.
(2) a) Ha a legalább 3 hónapja alkalmazott gyógyszeres kezeléssel az asthma legalább 3 hónapja kontrollált, a kezelőorvos döntése alapján meg lehet kísérelni a gyógyszerelés csökkentését.
b) Ha az asthma legalább 6 hónapja kontrollált és nincs exacerbációs rizikótényező, meg kell kísérelni a gyógyszerelés csökkentését egy olyan időpontban, amikor nem zajlik légúti infekció, a beteg nem terhes és nem tervez utazást.
c) A gyógyszerelés csökkenthető a dózis csökkentésével vagy egy gyógyszer elhagyásával. Ennek megfelelően a terápia folytatható az azonos vagy az eggyel alacsonyabb lépcsőn.
d) A 2. lépcsőn adott kisdózisú ICS monoterápia elhagyása nem javasolt, kivéve olyan esetben, amikor ez az asthma diagnózis megerősítéséhez szükséges.
(3) Ha az 1. vagy a 2. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, az eggyel magasabb lépcsőn folytatható a kezelés.
(4) Ha a 3. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. lépcsőn folytatható a kezelés. Ha az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, a kezelőorvos döntése szerint vagy a 4. lépcsőn vagy a 3. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(5) Ha a 4. lépcső szerinti, legalább 3 hónapig alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, és a preferált kezelést (közepes/nagy dózisú ICS+LABA) már alkalmazták legalább 3 hónapig, a kezelőorvos döntése szerint vagy az 5. lépcsőn vagy a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés. Ha a 4. terápiás lépcsőn a preferált kezelést még nem alkalmazták legalább 3 hónapig, a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(6) Akut exacerbáció fellépése esetén annak ellátására külön szabályok vonatkoznak (az 5. pont szerinti ábra és a 4.5. pont szerinti táblázat).
(7) Akut exacerbáció kezelését és lezajlását követően felül kell vizsgálni a fenntartó gyógyszeres kezelést. E felülvizsgálat során meg kell állapítani az exacerbációt közvetlenül megelőző, az exacerbációtól még mentes 4 hetes időszakra vonatkozó kontrollfokot. Ha a megelőző 4 hét során az asthma kontrollált volt, úgy az exacerbációt követően a korábbi fenntartó gyógyszeres kezelés folytatandó. Ha a megelőző 4 hét során az asthma nem kontrollált vagy részben kontrollált volt, úgy az exacerbációt követően a (3), (4), (5) pont szerint fokozható a gyógyszeres kezelés."
8. Az R3. 37. melléklet 9. pont 9.4. alpontja helyébe a következő rendelkezés lép:
"9.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezése |
| 2 | H02AB04 | metilprednizolon |
| 3 | H02AB06 | prednizolon |
| 4 | R03AC02 | salbutamol |
| 5 | R03AC12 | salmeterol |
| 6 | R03AC13 | formoterol |
| 7 | R03AK06 | salmeterol és fluticasone |
| 8 | R03AK07 | formoterol és budesonide |
| 9 | R03AK08 | formoterol és beclometasone |
| 10 | R03AK10 | vilanterol és fluticasone-furoate |
| 11 | R03AK12 | salmeterol és budesonide |
| 12 | R03AK13 | salbutamol és beclometasone |
| 13 | R03AL01 | fenoterol és ipratropium-bromide |
| 14 | R03BA02 | budesonide |
| 15 | R03BA05 | fluticasone |
| 16 | R03BA08 | ciclesonid |
| 17 | R03BB01 | ipratropium-bromide |
| 18 | R03DA04 | teofillin |
| 19 | R03DC03 | montelukast |
| 20 | R03DX05 | omalizumab |
| 21 | R03DX08 | reslizumab |
| 22 | R03DX09 | mepolizumab |
| 23 | R03DX10 | benralizumab |
"
9. Az R3. 37. melléklet 10. pontja helyébe a következő rendelkezés lép:
"10. Fogalmak, rövidítések
| BNO: | Betegségek NemzetköziOsztályozása |
| OENO: | OrvosiEljárások NemzetköziOsztályozása |
| HBCS: | Homogén betegségcsoport |
| ATC: | Anatomical, therapeutic, chemical klasszifikáció |
| FEV: | Forced exspiratory volume (erőltetett kilégzési térfogat) |
| FEV1: | Forced exspiratory volume in one second (erőltetett kilégzési térfogat 1 másodperc alatt) |
| FVC: | Forced vital capacity (erőltetett vitálkapacitás) |
| PEF: | Peak exspiratoryflow (kilégzési csúcsáramlás) |
| SABA: | Short-acting ß2-agonist (rövid hatású ß2-agonista) |
| LABA: | Long-acting ß2-agonist (hosszú hatású ß2-agonista) |
| RABA: | Rapid-acting ß2-agonist (gyors hatású ß2-agonista) |
| SAMA: | Short-acting muscarinic antagonist (rövid hatású muszkarinerg-antagonista) |
| LAMA: | Long-acting muscarinic antagonist (hosszú hatású muszkarinerg-antagonista) |
| ICS: | Inhaled corticosteroid (inhalációs kortikoszteroid) |
| LTRA: | Leukotrién-receptor-antagonista |
| TeofillinSR: | Hosszú hatású teofillin |
| Anti-IgE | Anti-immunglobulin-E |
| Anti-IL5 | Interleukin-5-gátló |
| Anti-IL5-R | Interleukin-5-receptor-gátló |
| DPI: | Dry powder inhaler (szárazpor-inhalátor) |
| CFC | Kloro-fluoro-karbon hajtógáz |
| HFA | Hidro-fluoro-alkán hajtógáz |
| PaO2: | Artériás vér parciális oxigén-nyomása |
| PaCO2: | Artériás vér parciális széndioxid-nyomása |
| SaO2: | Artériás vér oxigén-telítettsége |
"
14. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
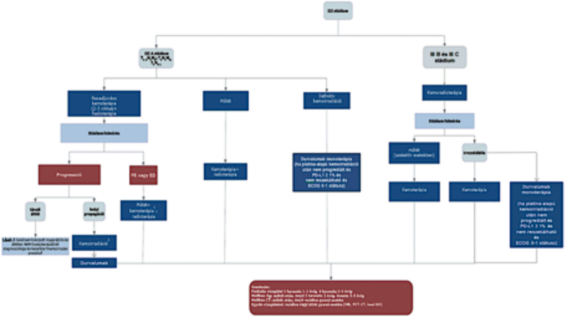
1. Az R3. 38. melléklet 3. pont 3.4. alpontja helyébe a következő rendelkezés lép:
"3.4. A III stádium ellátása
"
2. Az R3. 38. melléklet 6. pont 6.4. alpontja helyébe a következő rendelkezés lép:
"6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC kód | Hatóanyag |
| 2 | L01XA02 | carboplatin |
| 3 | L01XA01 | cisplatin |
| 4 | L01AA01 | cyclophosphamid |
| 5 | L01CD02 | docetaxel |
| 6 | L01DB03 | epirubicin |
| 7 | L01CB01 | etoposide |
| 8 | L01BC05 | gemcitabine |
| 9 | L01AA06 | ifosfamide |
| 10 | V03AF01 | mesna |
| 11 | L01CD01 | paclitaxel |
| 12 | L01CA04 | vinorelbin |
| 13 | L01XC28 | durvalumab |
"
15. melléklet az 55/2021. (XII. 22.) EMMI rendelethez
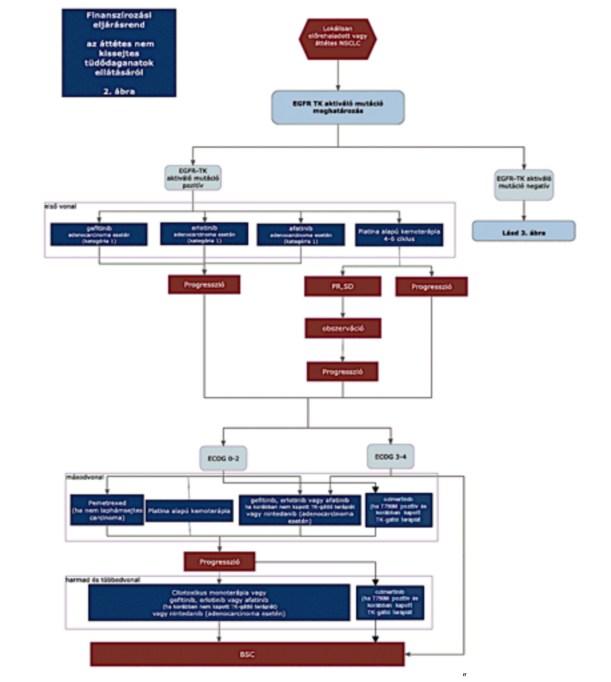
1. Az R3. 40. melléklet 3. pont 3.2. alpontja helyébe a következő rendelkezés lép:
"3.2. A nem-kissejtes tüdődaganat ellátása EGFR-TK aktiváló mutáció pozitív betegeknél
"
2. Az R3. 40. melléklet 3. pont 3.5. alpontja helyébe a következő rendelkezés lép:
"3.5. Megjegyzés:
A pemetrexed, bevacizumab, gefitinib, erlotinib, afatinib, nintedanib, pembrolizumab, nivolumab, atezolizumab, alectinib, crizotinib, osimertinib tételes elszámolás alá eső hatóanyagok, a támogatott indikációk az alábbiak:"
3. Az R3. 40. melléklet 3. pont 3.5.7. alpontja helyébe a következő rendelkezés lép:
"3.5.7.
3.5.7.1. Pembrolizumab: Lokálisan előrehaladott vagy metasztatikus, nem kissejtes tüdő adenocarcinomában szenvedő, jó általános állapotú (ECOG 0-1), KRAS mutáns, vagy EGFR és ALK pozitivitást nem mutató felnőtt betegek első-, másod- vagy harmadvonalban történő kezelésére, akiknél a daganat esetében igazoltan erős PD-L1 expresszió mutatható ki (TPS ≥ 50%). Laphámsejtes carcinoma esetén első- és másodvonalban alkalmazható igazoltan erős PD-L1 expresszió esetén (TPS ≥ 50%). A fenti indikációkban történő alkalmazás feltétele az, hogy a beteg korábban nem kapott immunterápiát.
3.5.7.2. Pembrolizumab: Lokálisan előrehaladott vagy metasztatikus, epidermális növekedési faktor receptor (EGFR) és anaplasticus lymphoma-kináz (ALK) mutációt nem hordozó, nem-kissejtes tüdőkarcinómában (NSCLC) szenvedő felnőtt betegek első vonalbeli kezelésére pemetrexeddel és platina alapú kemoterápiával kombinációban, illetve laphámsejtes indikáció esetén karboplatinnal és/vagy paklitaxel vagy nab-paklitaxel-tartalmú kemoterápiával kombinációban."
4. Az R3. 40. melléklet 3. pont 3.5. alpontja a következő 3.5.12. ponttal egészül ki:
"3.5.12. Ozimertinib: Lokálisan előrehaladott vagy metasztatikus, epidermalis növekedési faktor-receptor (EGFR) T790M mutáció-pozitív, nem kissejtes tüdőkarcinómában (NSCLC) szenvedő felnőtt betegek kezelésére, akik korábban EGFR-TKI kezelést kaptak, másod-, illetve többedvonalas terápiaként."
5. Az R3. 40. melléklet 4. pont 4.2. alpont 4.2.3. pontja helyébe a következő rendelkezés lép:
"4.2.3. Megfelelően igazolták-e az EGFR-TK, az ALK és a T790M mutációt?"
6. Az R3. 40. melléklet 6. pont 6.4. alpontja helyébe a következő rendelkezés lép:
"6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC kód | ATC megnevezés |
| 2 | L01XA02 | carboplatin |
| 3 | L01XA01 | cisplatin |
| 4 | L01AA01 | cyclophosphamid |
| 5 | L01CD02 | docetaxel |
| 6 | L01CB01 | etoposide |
| 7 | L01BC05 | gemcitabine |
| 8 | L01AA06 | ifosfamide |
| 9 | V03AF01 | mesna |
| 10 | L01CD01 | paclitaxel |
| 11 | L01BA04 | pemetrexed |
| 12 | L01CA04 | vinorelbine |
| 13 | L01XC07 | bevacizumab |
| 14 | L01XC17 | nivolumab |
| 15 | L01XC18 | pembrolizumab |
| 16 | L01XC | atezolizumab |
| 17 | L01XE02 | gefitinib |
| 18 | L01XE03 | erlotinib |
| 19 | L01XE13 | afatinib |
| 20 | L01XE31 | nintedanib |
| 21 | L01XE16 | crizotinib |
| 22 | L01XE36 | alectinib |
| 23 | L01XE35 | ozimertinib |
"


