31976L0372[1]
A Bizottság hetedik irányelve (1976. március 1.) a takarmányok hatósági ellenőrzésére szolgáló közösségi analitikai módszerek meghatározásáról
A BIZOTTSÁG HETEDIK IRÁNYELVE
(1976. március 1.)
a takarmányok hatósági ellenőrzésére szolgáló közösségi analitikai módszerek meghatározásáról
(76/372/EGK)
AZ EURÓPAI KÖZÖSSÉGEK BIZOTTSÁGA,
tekintettel az Európai Gazdasági Közösséget létrehozó szerződésre,
tekintettel a legutóbb a csatlakozási okmánnyal ( 1 ) módosított, a takarmányok hatósági ellenőrzésénél alkalmazandó közösségi mintavételi és analitikai módszerek bevezetéséről szóló, 1970. július 20-i tanácsi irányelvre ( 2 ) és különösen annak 2. cikkére,
mivel az említett irányelv előírja, hogy a takarmányok hatósági ellenőrzését, amelynek célja a takarmányok minőségére és összetételére vonatkozó törvényi, rendeleti és közigazgatási rendelkezésekből eredő követelmények betartásának ellenőrzése, közösségi mintavételi és analitikai módszerek alkalmazásával kell végrehajtani;
mivel az 1971. június 15-i 71/250/EGK ( 3 ), az 1971. november 18-i 71/393/EGK ( 4 ), az 1972. április 27-i 72/199/EGK ( 5 ), az 1972. december 5-i 73/46/EGK ( 6 ), az 1974. március 25-i 74/203/EGK ( 7 ) és az 1974. december 20-i 75/84/EGK ( 8 ) bizottsági irányelv már számos közösségi analitikai módszert meghatározott; mivel az azóta eltelt időben, az adott területen elért fejlődés következtében tanácsos egy hetedik módszersorozat elfogadása;
mivel az ezen irányelvben előírt intézkedések összhangban vannak a Takarmányok Állandó Bizottsága véleményével,
ELFOGADTA EZT AZ IRÁNYELVET:
1. cikk
A tagállamok előírják, hogy a takarmányok hatósági ellenőrzésére szolgáló, a takarmányok aflatoxin B1 tartalmára vonatkozó analitikai vizsgálatokat az e rendelet mellékletében leírt módszerek szerint kell végrehajtani.
2. cikk
A tagállamok legkésőbb 1976. október 1-jéig hatályba léptetik azokat a törvényi, rendeleti és közigazgatási rendelkezéseket, amelyek szükségesek ahhoz, hogy ennek az irányelvnek megfeleljenek. Erről haladéktalanul tájékoztatják a Bizottságot.
3. cikk
Ennek az irányelvnek a tagállamok a címzettjei.
MELLÉKLET
AZ AFLATOXIN B1 MEGHATÁROZÁSA
A. EGYDIMENZIÓS VÉKONYRÉTEG-KROMATOGRÁFIÁS MÓDSZER
1. Cél és alkalmazási terület
Ez a módszer lehetővé tesz az aflatoxin B1 szintjének meghatározását a nyersanyagokban és egynemű takarmányokban. Ezt a módszert nem lehet alkalmazni citrusgyümölcsökből készült pép jelenlétében. A meghatározás alsó méréshatára 0,01 mg/kg (10 ppb).
Ha a meghatározást interferáló anyagok jelenléte hátráltatja, akkor a B. módszer (nagy hatékonyságú folyadékkromatográfia) alkalmazásával meg kell ismételni az analízist.
2. Vizsgálati alapelv
A mintát kloroformmal extraháljuk. A kivonatot szűrjük, egy aliquot részét kivesszük és szilikagél oszlopkromatográfiával tisztítjuk. Az eluátumot bepároljuk, és a maradékot meghatározott térfogatú kloroformban, vagy benzol és acetonitril keverékében visszaoldjuk. Ezen oldat egy aliquot részén vékonyréteg-kromatográfiát (TLC) végzünk. Az aflatoxin B1 mennyiségét a kromatogram UV-fénnyel történő megvilágítása mellett, vizuálisan vagy fluorodenzitométerrel, ismert mennyiségű standard aflatoxin B1-el történő összehasonlítás alapján határozzuk meg. A takarmányból extrahált aflatoxin B1 azonosítását a jelzett módszerrel kell megerősíteni.
3. Reagensek
Megjegyzés: Ha nincs másképp jelölve, minden reagens "analitikai tisztaságúnak".
3.1. Aceton.
3.2. 0,5-1,0 %, 96 %-os (v/v) etanollal stabilizált kloroform.
3.3. n-Hexán.
3.4. Metil-alkohol.
3.5. Víz- és peroxidmentes dietil-éter.
3.6. Benzol és acetonitril 98/2 (v/v) arányú keveréke.
3.7. Kloroform (3.2.) és metil-alkohol (3.4.) 97/3 (v/v) arányú keveréke.
3.8. Szilikagél oszlopkromatográfiás célra, 0,05-0,20 mm közötti részecskemérettel.
3.9. Előzetesen kloroformmal zsírtalanított hidrofil gyapot vagy üvegvatta.
3.10. Vízmentes, granulált nátrium-szulfát.
3.11. Inert gáz, pl. nitrogén.
3.12. 1 N sósav.
3.13. 50 %-os (v/v) kénsav.
3.14. Kieselguhr (hyflosupercel), savval mosva.
3.15. Szilikagél G-HR vagy ezzel egyenértékű a vékonyréteg-kromatográfiához.
3.16. A 7. pontban leírtak szerint elkészített és ellenőrzött standard oldat, amely kloroform (3.2.) vagy benzol/acetonitril keverék (3.6.) 1 milliliterében körülbelül 0,1 μg aflatoxin B1-et tartalmaz.
3.17. Minőségi vizsgálat céljára szolgáló standard oldat, amely kloroform (3.2.) vagy benzol/acetonitril keverék (3.6.) 1 milliliterében körülbelül 0,1 μg aflatoxin B1-et vagy B2-t tartalmaz. A megadott koncentráció iránymutatásul szolgál. A koncentrációt úgy kell beállítani, hogy mindkét aflatoxin fluoreszcencia-intenzitása azonos legyen.
3.18. Futtató oldószerek:
3.18.1. Kloroform (3.2.)/aceton (3.1.): 9/1 (v/v), telítetlen kád;
3.18.2. Dietil-éter (3.5.)/metil-alkohol (3.4.)/víz: 96/3/1 (v/v/v), telítetlen kád;
3.18.3. Dietil-éter (3.5.)/metil-alkohol (3.4.)/víz: 94/4,5/1,5 (v/v/v), telített kád;
3.18.4. Kloroform (3.2.)/metil-alkohol (3.4.): 94/6 (v/v), telített kád;
3.18.5. Kloroform (3.2.)/metil-alkohol (3.4.): 97/3 (v/v), telített kád.
4. Eszközök
4.1. Daráló-keverő.
4.2. Rázógép vagy mágneses keverő.
4.3. Redős szűrőpapírok, Schleicher és Schüll No. 588 vagy azzal egyenértékű, átmérő: 24 cm.
4.4. Üvegcső a kromatográfiához (belső átmérő: 22 mm, hosszúság: 300 mm), PTFE csappal és 250 ml-es tárolótartállyal.
4.5. Rotációs vákuum-bepárló, 500 ml-es gömblombikkal.
4.6. 500 ml-es Erlenmeyer-lombikok, csiszolt üvegdugóval.
4.7. Vékonyréteg-kromatográfiás (TLC) felszerelés.
4.8. 200×200 mm-es üveglemezek a TLC-hez a következők szerint előkészítve (a megadott mennyiségek öt lemez bevonásához elegendőek). Helyezzünk 30 g szilikagél G-HR-t (3.15) egy Erlenmeyer-lombikba. Adjunk hozzá 60 ml vizet, zárjuk le és rázzuk egy percig. Terítsük szét a szuszpenziót a lemezeken úgy, hogy egy egyenletes, 0,25 mm vastag réteget kapjunk. Hagyjuk a levegőn száradni, majd tároljuk szilikagélt tartalmazó exszikkátorban. Felhasználáskor egy órán át 110 °C-os kemencében tartva, aktiváljuk a lemezeket.
A gyárilag kent kész lemezek akkor megfelelők, ha a fenti eljárás szerint elkészített lemezekéhez azonos eredményeket adnak.
4.9. Hosszú hullámhosszú (360 nm) UV-lámpa. A sugárzás intenzitása olyan legyen, hogy egy 1 ng-os aflatoxin B1 foltot a lámpától 10 centiméterre lévő TLC lemezen egyértelműen meg lehessen különböztetni.
4.10. 10 ml-es osztott kémcsövek polietilén dugóval.
4.11. UV spektrofotométer.
4.12. Fluorodenzitométer (nem feltétlenül szükséges).
5. A vizsgálat módja
5.1. A minta előkészítése (lásd az "Észrevételek" című C. rész 1. pontjában)
Őröljük a mintát olyan finomságúra, hogy az teljes mennyiségben átmenjen egy 1 mm szemnagyságú szitán (az ISO R 565 ajánlás szerint).
5.2. Extrahálás
Helyezzünk 50 g őrölt, homogenizált mintát egy 500 ml-es Erlenmeyer-lombikba (4.6.). Adjunk hozzá 25 g Kieselguhr-t (3.14.), 25 ml vizet és 250 ml kloroformot (3.2.). Zárjuk le a lombikot, rázzuk vagy keverjük 30 percig a készülékkel (4.2.), és szűrjük át egy redős szűrőpapíron (4.3.). Öntsük el a szűrlet első 10 ml-ét, majd gyűjtsünk össze 50 ml szűrletet.
5.3. Tisztítás oszlopkromatográfiával
A kromatográfiás oszlop (4.4.) alsó végébe helyezzünk egy gyapot- vagy üvegvatta dugót (3.9.), töltsük fel az oszlopot kétharmad részig kloroformmal (3.2.) és adjunk hozzá 5 g nátrium-szulfátot (3.10.).
Ellenőrizzük, hogy a nátrium-szulfát réteg felszíne egyenes-e, majd kis adagokban adjunk hozzá 10 g szilikagélt (3.8.). Minden egyes adag hozzáadása után óvatosan keverjük meg, hogy eltávolítsuk a levegőbuborékokat. Hagyjuk állni 15 percig, azután óvatosan adjunk hozzá 15 g nátrium-szulfátot (3.10.). Hagyjuk a folyadékot lefolyni, amíg az éppen a nátrium-szulfát réteg felszíne fölé ér.
Keverjük össze az 5.2. pontban nyert kivonat 50 milliliterét 100 ml n-Hexánnal (3.3.) és az elegy teljes mennyiségét vigyük fel az oszlopra. Hagyjuk a folyadékot lecsöpögni, amíg az éppen a nátrium-szulfát réteg felszínéhez ér. Öntsük el a mosófolyadékot. Ezután adjunk hozzá 100 ml dietil-étert (3.5.), és ismét hagyjuk lecsöpögni, amíg a nátrium-szulfát réteg felszínéhez ér. A fenti műveletek alatt figyeljünk arra, hogy az áramlási sebesség percenként 8-12 ml legyen és, hogy az oszlop ne száradjon ki. Öntsük el a mosófolyadékot. Ezután mossuk az oszlopot 150 ml kloroform/metil-alkohol keverékkel (3.7.), és gyűjtsük össze az eluátum teljes mennyiségét.
50 °C-ot meg nem haladó hőmérsékleten, inertgáz-áramban (3.11.), rotációs bepárlóval (4.5.), pároljuk az eluátumot majdnem szárazra. A maradékot teljes mennyiségben kloroform (3.2.) vagy a benzol/acetonitril keverék (3.6.) segítségével helyezzük át egy 10 ml-es osztott kémcsőbe (4.10.). Koncentráljuk az oldatot inertgáz-áram alatt, majd töltsük fel 2 ml-re kloroformmal (3.2.) vagy a benzol/acetonitril keverékkel (3.6.).
5.4. Vékonyréteg-kromatográfia
A standard oldat és a kivonat alábbiakban feltűntetett mennyiségeit cseppentsük a VRK lemezre (4.8.) úgy, hogy a foltok az alsó szélétől 2 cm-re és egymástól 2 cm-re legyenek:
- 10, 15, 20, 30 és 40 μl standard aflatoxin B1 oldat (3.16.),
- az 5.3. pontban nyert kivonatból 10 μl és, ugyanarra a pontra, a standard oldatból (3.16.) 20 μl,
- az 5.3. pont szerint nyert kivonatból 10 és 20 μl.
Futtassuk a kromatogramot sötétben a futtató oldószerek (3.18.) egyikével. Az oldószert előre ki kell választani, 25 μl kvalitatív standard oldat (3.17.) lemezre helyezése után, annak ellenőrizésével, hogy a futtatás során az aflatoxin B1 és B2 teljesen különválik-e.
Hagyjuk az oldószereket sötétben elpárologni, azután világítsuk meg a lemezt UV-fénnyel 10 cm-re helyezve a lámpától (4.9.). Az aflatoxin B1 foltok kéken fluoreszkálnak.
5.5. Mennyiségi meghatározások
A meghatározást vizuálisan vagy fluorodenzitométerrel végezzük a következők szerint.
5.5.1. Vizuális mérések
Határozzuk meg a kivonatban lévő aflatoxin B1 mennyiségét úgy, hogy a kivonatfoltok fluoreszcenciájának erősségét összevetjük a standardoldat-foltok egyikénél mért fluoreszcencia erősségével. Szükség esetén interpoláljunk. A kivonat és a standardoldat egymásra helyezésével kapott fluoreszcenciának erősebbnek kell lennie, mint a 10 μl kivonatfolt által adott fluoreszcencia és nem szabad, hogy egynél több folt legyen látható. Ha a kivonat 10 μl-ének fluoreszcenciája erősebb, mint a 40 μl standardoldaté, akkor ismételjük meg a vékonyréteg-kromatográfiás vizsgálatot kloroformmal (3.2.) vagy a benzol/acetonitril keverékkel (3.6.), 10- vagy 100-szorosára hígított kivonatot használva.
5.5.2. Fluorodenzitométeres mérések
Mérjük meg az aflatoxin B1 foltok fluoreszcenciájának erősségét a fluorodenzitométerrel (4.12.), 365 nm gerjesztési és 443 nm emissziós hullámhosszon. Határozzuk meg a kivonatfoltokban lévő aflatoxin B1 mennyiségét úgy, hogy fluoreszcenciájának erősségét összevetjük a standard aflatoxin B1 foltok fluoreszcenciájának erősségével.
5.6. Az aflatoxin B1 azonosításának megerősítése
Az alábbiakban leírt eljárással erősítsük meg a kivonatban lévő aflatoxin B1 azonosítását.
5.6.1. Kénsavas kezelés
Permetezzünk kénsavat (3.13.) az 5.4. pont szerint nyert kromatográfiás lemezre. UV-fény alatt, az aflatoxin B1 foltok fluoreszcenciája kékről sárgára kell, hogy változzon.
5.6.2. Kétdimenziós kromatográfia aflatoxin B1-hemiacetál (aflatoxin B2a) képzéssel
Megjegyzés:
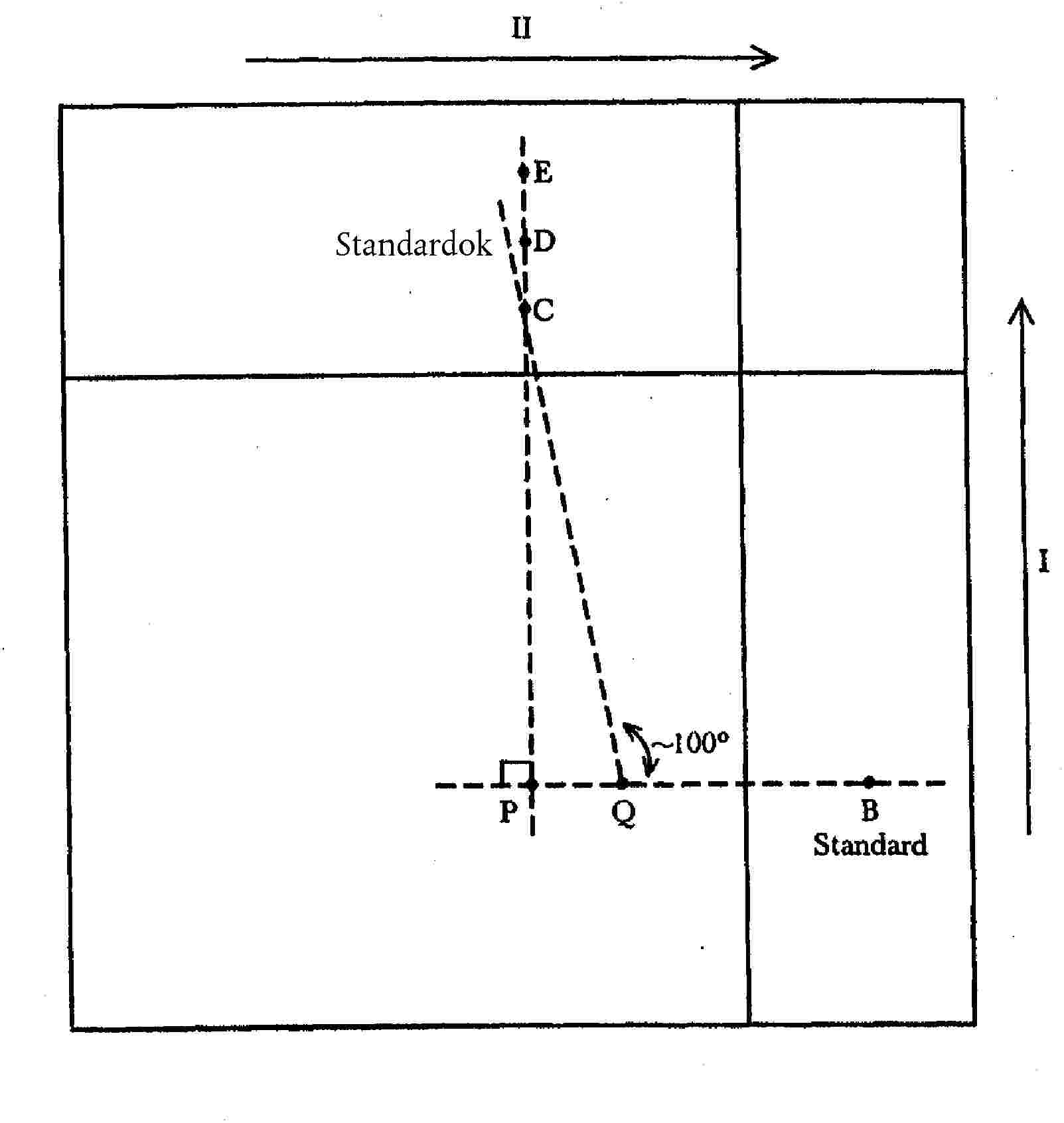
Az alábbiakban leírt műveleteket a 3. ábrán látható diagram pontos követésével kell elvégezni.
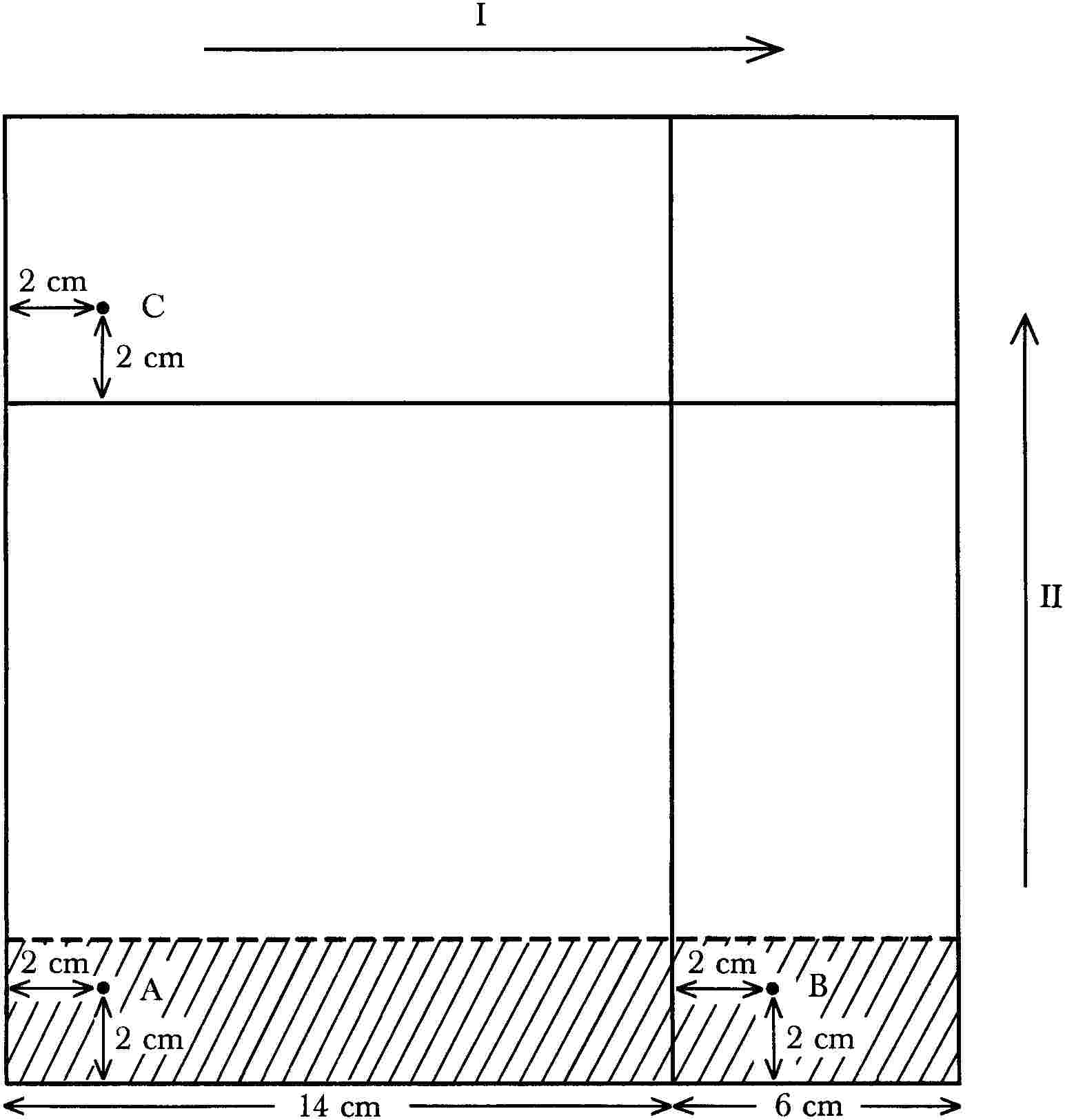
5.6.2.1. Az oldatok felvitele
A lemez (4.8.) két szomszédos oldalával párhuzamosan húzzunk két egyenes vonalat (6 centiméterre a szélektől), melyek az oldószerfront migrációs határaként szolgálnak. Kapilláris pipettával vagy mikrofecskendővel cseppentsük fel a következő oldatokat a lemezre:
- az A. pontra: az 5.3. pont szerint nyert, tisztított kivonatot, amely körülbelül 2,5 nm aflatoxin B1-et tartalmaz,
- a B. és C. pontra: a standardoldatból (3.16.) 25 μl-t.
5.6.2.2. Futtatás
A futtató oldószer használatával (3.18.1.) (1 centiméteres réteg telítetlen kádban) sötétben futtassuk a kromatogramot az I. irányba, amíg az oldószerfront eléri az oldószer határvonalát.
Vegyük ki a lemezt a tartályból, és sötétben, szobahőmérsékleten hagyjuk száradni öt percig. Azután permetezzük be sósavval (3.12.) 2,5 cm széles sávban az A. és B. pontok területét (a 3. ábrán a besatírozott terület jelzi), amíg elsötétedik úgy, hogy a lemez többi részét egy üveglappal védjük. Hagyjuk reagálni sötét helyen 10 percig, és szobahőmérsékleten levegőáramban szárítsuk meg.
Ezután a futtató oldószer használatával (3.18.1.) (1 centiméteres réteg telítetlen tartályban) sötétben futassuk a kromatogramot a II. irányba, amíg az oldószerfront eléri az oldószer határvonalát. Vegyük ki a lemezt a kádból, és hagyjuk megszáradni szobahőmérsékleten.
5.6.2.3. A kromatogram értelmezése
Vizsgáljuk meg a kromatogramot UV-fényben (4.9.), és ellenőrizzük a következők megjelenését.
a) A C. ponton felvitt standardoldatból származó aflatoxin B1 kéken fluoreszkáló foltjának megjelenése (migráció az I. irányba).
b) A B. ponton felvitt standardoldatból származó, (sósavval) el nem reagált aflatoxin B1 kéken fluoreszkáló foltjának és az ugyanonnan származó aflatoxin B1-hemiacetál erősebb kéken fluoreszkáló foltjának megjelenése (migráció a II. irányba).
c) A A.. ponton felvitt mintakivonatból származó, a b) pontban leírtakkal megegyező foltok megjelenése. E foltok elhelyezkedését egyrészt az aflatoxin B1-nek az A. pontból az I. irányba történt migráció távolsága (megegyezik a C. ponton felvitt standard migrációs távolsággal), másrészt az onnan az aflatoxin B1-hemiacetál által a II. irányba tett migráció távolsága (megegyezik a B. ponton felvitt standard migrációs távolsággal) határozza meg. A kivonatból, illetve a B. ponton felvitt standardból származó hemiacetál-foltok fluoreszcencia-intenzitásának egyeznie kell.
6. Az eredmény kiszámítása
6.1. A vizuális mérések esetén
A minta μg/kg-ban kifejezett aflatoxin B1 tartalma (ppb) a következő képlettel számítható ki:
ahol:
Az Y és az X az aflatoxin B1 standardoldat (3.16.), illetve azonos fluoreszcencia-intenzitású kivonat μl-ben kifejezett térfogata;
S = a standardoldat aflatoxin B1 koncentrációja μg/ml-ben (3.16.);
V = a kivonat végtérfogata μl-ben, figyelembe véve a szükségessé vált hígításokat;
W = az oszlopkromatográfiával tisztított kivonat térfogatának megfelelő minta tömege grammban.
6.2. A fluorodenzitometriás mérések esetén
A minta μg/kg-ban kifejezett aflatoxin B1 tartalma a következő képlettel számítható ki:
ahol:
Y = a lemezre felvitt kivonat térfogata μl-ben (10 vagy 20 μl);
S = a kivonat foltjában lévő aflatoxin B1, a mérések alapján kiszámított mennyisége ng-ban kifejezve (az alkalmazott Y mennységgel arányos),;
V = a kivonat végtérfogata μl-ben, figyelembe véve a szükségessé vált hígításokat;
W = az oszlopkromatográfiával tisztított kivonat térfogatának megfelelő minta tömege grammban.
7. A standardoldat (3.16.) elkészítése és vizsgálata
7. 1 Az aflatoxin B1 koncentrációjának meghatározása
Készítsünk egy 8-10 μg/ml koncentrációjú aflatoxin B1 standardoldatot kloroformban (3.2.) vagy a benzol/acetonitril keverékben (3.6.). Spektrofotométerrel (4.11.) határozzuk meg az abszorpciós spektrumot 330 és 370 nm között.
Mérjük meg az optikai sűrűséget (A.) a kloroform oldat esetében 363 nm-nél, a benzol/acetonitril keverékkel készült oldat esetében 348 nm-nél.
Az oldat aflatoxin B1, μg/ml-ben kifejezett koncentrációja az alábbi képletekkel számítható ki:
kloroformoldat esetében:;
benzol/acetonitril keverék oldata esetében:.
Fénytől elzárva hígítsuk fel úgy, hogy egy körülbelül 0,1 μg/ml koncentrációjú aflatoxin B1 standard munkaoldatot kapjunk. Hűtőben tárolva 4 °C-on, ez az oldat két hétig marad stabil.
7. 2 A kromatográfiás tisztaság vizsgálata
Vigyünk egy lemezre (4.8.) 5 μl, 8-10 μg/ml koncentrációjú aflatoxin B1 standardoldatot (7.1.). Futtassuk a kromapogramot az 5.4. pontban leírtak szerint. UV-fényben a kromatogram csak egy foltot mutathat, és az eredeti felviteli zónában nem szabad fluoreszcenciát észlelnünk.
8. Ismételhetőség
Ugyanazon a mintán, ugyanazon analitikus által végzett két párhuzamos meghatározás eredménye közötti különbség nem haladhatja meg:
- a legmagasabb eredmény 25 %-át, 10-20 μg/kg aflatoxin B1 tartalom esetén,
- abszolút értékben az 5 μg-t, 20-50 μg/kg aflatoxin B1 tartalom esetén,
- a legmagasabb eredmény 10 %-át, 50 μg/kg-nál magasabb aflatoxin B1 tartalom esetén.
9. Reprodukálhatóság
Lásd a "Észrevételek" C. részének 2. pontjában.
B. AFLETOXIN B1 MEGHATÁROZÁSA. FOLYADÉKKROMATOGRÁFIÁS MÓDSZER
1. Cél és alkalmazási terület
A jelen módszer alkalmas aflatoxin B1 meghatározására takarmányokban, beleértve a citrusgyümölcsökből készült pépet tartalmazó takarmányt is. A kimutatás alsó határa 0,001 mg/kg.
2. A módszer elve
A mintát kloroformmal extraháljuk. A kivonatot leszűrjük, és egy meghatározott részét először Florisil, majd C18 SPE oszlopon tisztítjuk. Az elválasztás és a meghatározás nagy teljesítményű folyadékkromatográfiával (HPLC), fordított fázisú C18 oszlopon történik, vízben oldott jóddal végzett elválasztás utáni származékképzés és fluoreszcens detektálás alkalmazásával.
Megjegyzés:
A mikotoxinok erősen mérgező anyagok. A műveleteket e célra kijelölt elszívófülkében kell végezni. Különleges óvintézkedésekre van szükség, amikor a toxinok száraz állapotban vannak, és ebből következően hajlamosak a munkaterületen való szétszóródásra.
3. Reagensek
3.1. Kloroform, 0,5-1 tömeg % etanollal stabilizálva (Lásd a »Megjegyzések« 10.2. szakaszát.)
3.2. Metanol, HPLC tisztaságú, a 3.6. szerinti mobil fázis elkészítéséhez
3.3. Aceton
3.4. Acetonitril, HPLC tisztaságú
3.5. Oldószerelegyek: felhasználás előtt egy nappal készítendő, vagy az oldószerből a levegőt ultrahangos rázatással kell eltávolítani.
3.5.1. Aceton és víz 98:2 arányú elegye
3.5.2. Víz és metanol 80:20 arányú elegye
3.5.3. Víz és aceton 85:15 arányú elegye
3.6. Eluens oldat HPLC-hez
Víz, metanol és acetonitril 130:70:40 arányú elegye.
Megjegyzés: A rendelkezésre álló HPLC oszlop tulajdonságaitól függően szükségessé válhat a mobil fázis összetételének változtatása.
3.7. Telített jódoldat: Adjunk 2 g jódot 400 ml vízhez. Keverjük legalább 90 percig, majd szűrjük le membránszűrőn (4.15.) keresztül. A fény okozta bomlás elkerülése végett az oldatot fénytől védve tartjuk.
3.8. Savval mosott Celite 545 vagy azzal egyenértékű adszorbens.
3.9. Florisil SPE oszlop (Waters-SEP-PAK vagy azzal egyenértékű).
3.10. C18 SPE oszlop (Waters-SEP-PAK vagy azzal egyenértékű).
3.11. Inert gáz, pl. nitrogén.
3.12. Aflatoxin B1 standardoldat, 10 μg/ml koncentrációjú. Az oldat koncentrációját az alábbiak szerint ellenőrizzük: Vegyük fel az oldat spektrumát 330 és 370 nm között spektrofotométerrel (4.23.). Mérjük az abszorbanciát (A) a maximumhelyen, 363 nm-en. Az aflatoxin B1-oldat koncentrációját az alábbi képlet segítségével számítjuk ki és mikrogramm/ml-ben kapjuk meg:
3.12.1. Aflatoxin B1 kloroformos standard törzsoldat
Az aflatoxin B1 standardoldat (3.12.) 2,5 ml-ét kvantitatíve vigyük át egy 50 ml-es mérőlombikba és kloroformmal (3.1.) állítsuk jelre az oldat térfogatát. Ezt az oldatot hűvös (4 °C), sötét helyen, jól lezárva és alufóliába csomagolva tároljuk.
3.13. Aflatoxin B1 HPLC kalibrálóoldatok
Megjegyzés:
Az oldatok készítéséhez savval mosott üvegárut (lásd 4. Eszközök) használjunk.
3.13.1. 4 ng/ml-es kalibrálóoldat
A mérőlombikban lévő standard törzsoldatot (3.12.1.) alumíniumfóliába csomagolva állni hagyjuk addig, míg szobahőmérsékletűre melegszik (néhány órát). A törzsoldat 400 μl-ét (200 ng aflatoxin B1-et) 50 ml-es mérőlombikba visszük át, és inertgáz- (3.11.) áramban szárazra pároljuk.
Az így nyert maradékot kb. 20 ml víz/aceton elegyben (3.5.3.) oldjuk, víz/aceton eleggyel jelig töltjük a lombikot, és jól összerázzuk.
3.13.2. 3 ng/ml-es kalibrálóoldat
A kalibráló oldat (3.13.1.) 7,5 ml-ét kvantitatíve 10 ml-es mérőlombikba visszük át, jelig töltjük a víz/aceton eleggyel (3.5.3.), és jól összerázzuk.
3.13.3. 2 ng/ml-es kalibrálóoldat
A kalibrálóoldat (3.13.1.) 25 ml-ét kvantitatíve 50 ml-es mérőlombikba visszük át, jelig töltjük a víz/aceton eleggyel (3.5.3.), és jól összekeverjük.
Ez az oldat lesz az összehasonlító (referencia-) standard is, amelyet a HPLC vizsgálat során ismételten kell a rendszerbe injektálni.
3.13.4. 1 ng/ml-es stabilizálóoldat
A kalibrálóoldat (3.13.1.) 2,5 ml-ét kvantitatíve 10 ml-es mérőlombikba visszük át, jelig töltjük a víz/aceton eleggyel (3.5.3.), és jól összerázzuk.
3.14. 1 ml kloroformban oldott, 1 μg aflatoxin B1-et, 0,5 μg aflatoxin B2-t, 1 μg aflatoxin G1-et, és 0,5 μg aflatoxin G2-t tartalmazó ampulla.
3.14.1. Kromatográfiás tesztoldat
Az ampulla (3.14.) tartalmát vigyük át üvegdugós kémcsőbe vagy csavaros tetővel ellátott fiolába. Az oldat 40 μl-ét vigyük savval mosott üvegdugós kémcsőbe (4.21.). Inertgázáramban párologtassuk el a kloroformot, és a maradékot oldjuk újra 10 ml víz/aceton elegyben (3.5.3.).
3.15. A megerősítő teszt vegyszerei
3.15.1. Nátrium-klorid, telített oldat
3.15.2. Nátrium-szulfát, vízmentes, granulált
4. Eszközök
Figyelmeztetés: Vizes aflatoxinoldatok esetében a savval át nem mosott üvegedényzet veszteséget okozhat. Különös gonddal kell ügyelni az új és az egyszer használatos üvegárukra, mint az automata injektor mintatartó fiolái és Pasteur-pipetták. Ezért az aflatoxin vizes oldatával kapcsolatba kerülő laboratóriumi üvegedényzetet néhány órára híg savba (pl. 2 mol/l koncentrációjú kénsavba) kell áztatni, majd desztillált vízzel alaposan kiöblíteni a savnyomok eltávolítására (legalább háromszor öblítsünk, és az öblítővizet pH-papírral ellenőrizzük). Ezt a műveletet el kell végezni a vákuumbepárlóhoz használt gömblombikkal (4.4.), a mérőlombikokkal, mérőedényekkel, a kalibrálóoldatok és mérésre előkészített oldatok tárolására használt kémcsövekkel és fiolákkal is.
4.1. Őrlő-homogenizáló berendezés.
4.2. 1,0 mm lyukbőségű szita (ISO R565).
4.3. Mechanikai rázógép.
4.4. Rotációs vákuumlepárló, 150-250 ml-es gömblombikkal felszerelve.
4.5. HPLC készülék.
4.6. HPLC analitikai oszlop, 3 μm vagy 5 μm C18 töltettel.
4.7. Pulzálásmentes szivattyú a post-column jódreagens szállítására.
4.8. Zéró holttérfogatú Valco T idom, rozsdamentes acélból (1/16' × 0,75 mm).
4.9. Spirális reaktor; teflon vagy rozsdamentes acél. Az 5 μm vagy 3 μm töltetméretű HPLC oszlopokhoz a 3 000 mm × 0,5 mm és 5 000 × 0,5 mm közötti méretek bizonyultak a legcélszerűbbnek.
4.10. 60 °C-ra beállított, 0,1 °C-os pontossággal szabályozható termosztát.
4.11. Fluoreszcens detektor, gerjesztési hullámhossz 365 nm, emissziós hullámhossz 435 nm (szűrős készülékeknél emissziós hullámhossz > 400 nm). Alkalmas legyen legalább 0,05 ng aflatoxin B1 kimutatására.
4.12. Rekorder.
4.13. Integrátor (nem feltétlenül szükséges).
4.14. Redős szűrőpapír, átmérő: 24 cm, Macherey-Nagel 617 1/4 vagy azzal egyenértékű.
4.15. Membránszűrő, 0,45 μm pórusméretű, Millipore HAWP 04700 vagy azzal egyenértékű.
4.16. 500 ml-es üvegdugós Erlenmeyer-lombik.
4.17. Üvegoszlop (belső átmérő körülbelül 1 cm, hosszúság körülbelül 30cm, Luer véggel éllátva.
4.18. Luer(R) kloroformmal szemben ellenálló csap (pl. Bio-Rad 7328017, Analytichem A1 6078, J.T.Baker 4514 vagy ezekkel egyenértékű).
4.19. Vegyszereknek ellenálló fecskendő, 10 ml-es, Luer csatlakozó résszel.
4.20. 250 μl-es, HPLC injektáláshoz alkalmas fecskendő (lásd 4.5.).
4.21. 100 μl-es mikrofecskendő a kalibrálóoldatok készítéséhez.
4.22. 10 ml-es üvegdugós kalibrált kémcsövek.
4.23. Spektrofotométer, amely alkalmas a spektrum UV tartományában mérések elvégzésére.
4.24. A megerősítő vizsgálathoz (6) szükséges felszerelés.
4.23.1. Savval öblített 100 ml-es rázótölcsér tefloncsappal.
4.23.2. Fűtőblokk, 40-50 °C közti hőmérséklettel.
5. Vizsgálat
5.1. A minta előkészítése
Daráljuk meg a jól homogenizált mintát úgy, hogy áthulljon az 1 mm lyukbőségű szitán (4.2.), majd újból homogenizáljuk.
5.2. Bemérés
Az előkészített vizsgálati mintából 50 g-ot az Erlenmeyer-lombikba mérünk.
5.3. Extrakció
Adjunk 25 g Celitet (3.8.), 250 ml kloroformot (3.1.) és 25 ml vizet a bemért vizsgálati mintához az Erlenmeyer-lombikba.Dugaszoljuk be a lombikot, rázassuk a rázógépen (4.3.) 30 percig. Szűrjük át redős szűrőpapíron (4.14.). Gyűjtsünk össze 50 ml szűrletet. Ha szükséges, hígítsuk a szűrletet kloroformmal úgy, hogy az aflatoxin B1 koncentrációja a 4 ng/ml-t ne haladja meg.
5.4. Tisztítás (Az eljárást jelentősebb megszakítás nélkül kell elvégezni.)
Figyelmeztetés:
- Azt a laboratóriumot, ahol a vizsgálatot végzik, megfelelően védeni kell a természetes fénytől. Ennek megfelelő eszközei az alábbiak:
-
i. UV fényt elnyelő fólia az ablakokon, azzal kombinálva, hogy az ablakot direkt napfény nem éri;
ii. függönyök vagy redőnyök és mesterséges fény (fluoreszcens csövek megfelelőek).
- Az aflatoxint tartalmazó oldatokat a lehető legjobban védeni kell a fénytől (sötét helyen tartjuk, alufóliába burkoljuk).
5.4.1. Tisztítás Florisil SEP-PAK oszlopon
5.4.1.1. Az oszlopkészlet előkészítése
Tegyünk a Florisil-készlet rövidebb végére (3.9.) zárósapkát (4.18.) (lásd az 1. ábrát). Mossuk a készletet és távolítsuk el a segédletet 10 ml kloroformmal (3.1.) és egy fecskendő (4.19.) használatával fecskendezzünk át gyorsan 8 ml-t a zárósapkán. Csatlakoztassuk a készlet hosszabb szárát az üvegoszlophoz (4.17.), és a maradék 2 ml kloroformot fecskendezzük be az oszlopba a készleten keresztül. Zárjuk a zárósapkát. Húzzuk ki a fecskendőt.
5.4.1.2. Tisztítás
Adjuk az 5.3. szerint gyűjtött szűrletet az összeállított oszlopkészletbe és öntsük el. Öblítsük 5 ml kloroformmal (3.1.), majd 20 ml metil-alkohollal (3.2.). Öntsük el az eluátumot. E műveletek alatt biztosítsuk, hogy az oszlopkészlet-szerelék nem szárad ki.
Ezután mossuk az aflatoxin B1-et 40 ml aceton/víz keverékkel (3.5.1.), és gyűjtsük össze az eluátum teljes mennyiségét a rotációs bepárló gömblombikjába (4.4.). Koncentráljuk az eluátumot a rotációs bepárlón 40-50 °C között, amíg több aceton már nem desztillálódik. (Megjegyzés: Ekkorra körülbelül 0,5 ml folyadék marad a lombikban. Kísérletek kimutatták, hogy a további párologtatás nem káros, és amikor 0,5 ml folyadék marad, abban már nincs jelentős mennyiségű aceton. Az acetonmaradék az aflatoxin B1 elvesztéséhez vezethet a C18 készletben.) Adjunk hozzá 1 ml metil-alkoholt (3.2.), keverjük fel, hogy az aflatoxin B1 a lombik oldalán feloldódjon, adjunk hozzá 4 ml vizet és keverjük össze. Válasszuk le a készletet és dobjuk el. Öblítsük vízzel az üvegoszlopot és tartsuk vissza a C18 tisztítási lépéshez.
5.4.2. Tisztítás C18-as SPE oszlopon
5.4.2.1. Az oszlopkészlet összeállításának előkészítése.
Csatlakoztassunk egy zárósapkát (4.18.) a C18-készlet rövidebb végére (3,10) (lásd az 1. ábrát). Töltsük fel a készletet és távolítsunk el minden levegőt a zárósapkán 10 ml metil-alkohol gyors átfecskendezésével (4.19.). A készletben az egyébként szürke háttér előtt a légbuborékok világos pettyekként láthatók. Vegyünk 10 ml vizet és 8 ml-t nyomjunk át a készleten. (Kerüljük a levegő készletbe történő bejutását, amikor a metil-alkoholról vízre váltunk.) Csatlakoztassuk a készlet hosszabb szárát az üvegoszlophoz (4.17.), és a maradék 2 ml vizet fecskendezzük be az oszlopba a készleten keresztül. Zárjuk a zárósapkát. Húzzuk ki a fecskendőt.
5.4.2.2. Tisztítás
Vigyük fel az 5.4.1.2. pontban nyert kivonat teljes mennyiségét az üvegoszlopba (4.17.), öblítsük a lombikot kétszer 5 ml víz/metil-alkohol keverékkel (3.5.2.) és folyassuk el. E műveletek alatt biztosítsuk, hogy az oszlopkészlet-szerelék nem szárad ki. Ha légbuborékok fejlődnek a szűkületben a készlet mellett, állítsuk meg a folyamatot, és csapoljuk meg az üvegoszlop tetejét a légbuborékok eltávolítására. Majd folytassuk. Mossuk 25 ml víz/metil-alkohol keverékkel. Öntsük el az eluátumot. Ezután mossuk az aflatoxin B1-et 50 ml víz/aceton keverékkel (3.5.3.), és gyűjtsük össze az eluátum teljes mennyiségét egy 50 ml-es gömblombikba (4.4.). Öntsük fel a jelzésig vízzel és keverjük össze. A kapott vizsgálati oldatot használjuk a kromatográfiához (5.5.).
Rendesen nem szükséges a végső kivonat szűrése a HPLC előtt. Ha szükségesnek tartott, ne használjunk cellulózszűrőt, mert az aflatoxin B1 eltűnését okozhatják. A teflonszűrők elfogadhatók.
5.5. Nagy hatékonyságú folyadékkromatográfiás mérés
(Lásd a 2. ábrát a felszerelés összeállításához) Biztosítsunk elegendő időt a műszerek kondicionálására és stabilizálására.
1. megjegyzés
A mobil fázis és a származékképző reagens áramlási sebességének értékei csak tájékoztató jellegűek. Ezeket a paramétereket az analitikai oszlop jellemzőitől függően szükség szerint változtatni lehet.
2. megjegyzés
Az aflatoxin B1 detektorjelének nagysága függ a hőmérséklettől, ezért annak folyamatos változását figyelembe kell venni (lásd a 3. ábrát). Azonos mennyiségű, aflatoxin B1 referencia kalibrálóoldat (3.13.3.) rendszeres időközönként történő injektálásával (pl. minden harmadik injektálás) a referencia kalibrálóoldatok között injektált aflatoxin B1 csúcs alatti területeit korrigálhatjuk, ha az átlagos értéket vesszük figyelembe a kiértékelésnél, feltéve hogy az egymást követő referencia kalibrálóstandardok által adott detektorjel között a különbség nagyon kicsi (< 10 %). Ezért az injektálásokat lehetőség szerint megszakítás nélkül kell végezni. Ha a mérést meg kell szakítani, akkor a megszakítás előtti utolsó és a megszakítás utáni első injektálás referencia kalibrálóoldat (3.13.3.) legyen. Mivel a kalibrációs görbe lineáris és áthalad a nullán, a mintakivonatban található aflatoxin B1 mennyiségét közvetlenül a megfelelő szabványokra utalással határozzák meg.
5.5.1. A HPLC pumpa beállítása
Állítsuk be a HPLC pumpát (4.5.) úgy, hogy a mobil fázis (3.6.) áramlási sebessége 5 μm-es analitikai oszlop esetén 0,5 ml/perc, 3 μm-es oszlop esetén 0,3 ml/perc legyen.
5.5.2. A származékképző reagens pumpájának beállítása
A pumpát (4.7.) úgy állítsuk be, hogy a telített vizes jódoldat (3.7.) áramlási sebessége 0,2 és 0,4 ml/perc között legyen. Irányelvnek tekinthető, hogy a mobil fázis 0,5 ml/perces áramlási sebességéhez 0,4 ml/perc reagens áramlási sebességet, a 0,3 ml/perces áramlási sebességhez pedig 0,2 ml/perc reagens áramlási sebességet célszerű beállítani.
5.5.3. Fluoreszcens detektor
A fluoreszcens detektort (4.11.) állítsuk 365 nm gerjesztési és 435 nm emissziós hullámhosszra (szűrős műszereknél: > 400 nm). A detektorleosztást úgy állítsuk be, hogy a rekorderen 1 ng aflatoxin B1-nek a teljes rekorderkitérés 80 %-a feleljen meg.
5.5.4. Injektor
Valamennyi oldatból 250 μl-es mennyiségeket injektáljunk az injektor gyártója által kiadott használati utasítás szerint.
5.5.5. A kromatográfiás elválasztás ellenőrzése
A kromatográfiás tesztoldatot (3.14.1.) a készülékbe injektáljuk.
5.5.6. A rendszer stabilitásának ellenőrzése
Minden vizsgálatsorozatot megelőzően addig injektáljuk az összehasonlító standardot (3.13.3.), amíg stabil csúcs alatti területeket kapunk. (Megjegyzés: Az egymást követő aflatoxin B1-injektálások által adott detektorjel nem különbözhet 6 %-nál nagyobb értékkel.) Ezután késedelem nélkül végezzük el a linearitás ellenőrzését (5.5.7.).
5.5.7. A linearitás ellenőrzése
Injektáljuk az aflatoxin B1 kalibrálóoldatokat (3.13.1.-3.13.4.). Minden harmadik injektálás a referencia kalibrálóoldat (3.13.3.) legyen, hogy a detektorjel folyamatos változását (drift) korrigálni lehessen. (Megjegyzés: A referencia kalibrálóoldatra kapott detektorjel változása 90 perc alatt nem haladhatja meg a 10 %-ot.) Korrigáljuk a detektorjel folyamatos változását a 7. szakaszban megadott képlet szerint. A kalibrációs görbének lineárisnak kell lennie, és át kell haladnia az origón a becsült Y érték kétszeres standardhibáján belül. A kapott értékek a nominális értéktől nem különbözhetnek 3 %-ot meghaladó mértékben. Ha ezek a követelmények teljesülnek, késedelem nélkül folytassuk a munkát. Ha a követelmények nem teljesülnek, azonosítsuk és szüntessük meg a hibaforrást, mielőtt továbbhaladnánk.
5.5.8. A mintaextraktok injektálása
Injektáljuk a tisztított mintakivonatokat (5.4.2.2.). Minden második injektálás után ismételjük meg az összehasonlító standard (3.13.3.) injektálását a következő sorrendben: referencia kalibrálóoldat, extrakt, extrakt, referencia kalibrálóoldat, extrakt, extrakt, referencia kalibrálóoldat stb.
6. Megerősítő teszt
6.1. Az extrakt (5.4.2.2.) további kezelése
Az 5.4.2.2. szerinti előkészített extrakthoz adjunk 5 ml nátrium-klorid-oldatot (3.15.1.). Extraháljunk háromszor 2 ml kloroformmal (3.1.), mindannyiszor 1-1 percig rázva a választótölcsérben (4.24.1.). Az egyesített kloroformos extraktot töltsük kb. 1 g nátrium-szulfátra (3.15.2.) egy 10 ml-es kémcsőbe. Használhatunk kis (4 cm átmérőjű) tölcsért, amelynek nyakába kis gyapotvatta dugóra helyeztük a kb.
1 g mennyiségű nátrium-szulfátot. Mossuk át a nátrium-szulfát-réteget néhány ml kloroformmal, és gyűjtsük a mosófolyadékot ugyanabba a kémcsőbe. Pároljuk a kloroformos extraktot szárazra ugyanabban a kémcsőben a fűtőblokk (4.24.2.) alkalmazásával, a maradékot oldjuk vissza 1 ml kloroformban.
6.2. Származékkészítés és vékonyréteg-kromatográfia
Lásd a 76/372/EGK tanácsi irányelv mellékletében az »A« módszer 5.6.2. pontját.
7. Az eredmények kiszámítása
Számítsuk a mintában lévő aflatoxin B1-tartalmat (μg/kg) az alábbi képlettel:
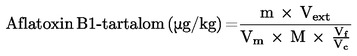
ahol
m =
az aflatoxin B1 mennyisége ng-ban, amelyet a minta aflatoxin B1 csúcsa alapján a következőképpen számítunk ki:
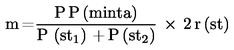
Pminta = a minta aflatoxin B1 csúcsának területe
P(st1) = a mintát megelőző referencia kalibrálóoldat (3.13.3.) injektáláskor kapott aflatoxin B1 csúcs alatti területe
P(st2) = a mintát követő referencia kalibrálóoldat (3.13.3.) injektáláskor kapott aflatoxin B1 csúcs alatti területe
r(st) = a referencia kalibrálóoldatban (3.13.3.) injektált aflatoxin B1 mennyisége
Vm = az injektált minta kivonat térfogata, ml
Vext = az előkészített mintakivonat végtérfogata, figyelembe véve az esetleges hígításokat (5.3.), ml
M = a minta tömege, g
Vf = a Florisil patronra felvitt szűrlet térfogata (5.4.1.2.), ml
Vc = a minta extrahálásához felhasznált kloroform térfogata, ml
Ha az ezen leírásban leírt eljárást követjük, a fenti képlet az alábbiakra egyszerűsíthető:
aflatoxin B1-tartalom, μg/kg = 20 × m
7.1. A számítást a lemért csúcsmagasságok alapján is el lehet végezni.
8. Ismételhetőség
Lásd 10.1.
9. Reprodukálhatóság
Lásd 10.1.
10. Megállapítások
10.1. Pontosság
Egy keveréktakarmányon végzett nemzetközi körvizsgálat ( 9 ) az ismételhetőségre és reprodukálhatóságra az 1. táblázatban megadott eredményeket adta. Az ismételhetőség (R) az itt használt fogalommeghatározás szerint azt a legnagyobb viszonyszámot jelenti, amely ugyanazon mintán, ugyanabban a laboratóriumban, hasonló körülmények között kapott két eredmény összehasonlításában 95 %-os valószínűségi szinten nem minősül szignifikánsnak. A reprodukálhatóság fogalommeghatározása a fentiekhez hasonló, de két különböző laboratóriumban kapott eredmény összehasonlítására vonatkozóan. Az ISO 3534-1977, 2.35 ( 10 ) és a 89/610/EGK ( 11 ) bizottsági határozat értelmében az r és R értékeket az 1. táblázat variációs koefficiensként kifejezve is feltünteti.
1. táblázat
Ismételhetőség és reprodukálhatóság
(15 laboratórium eredményei alapján)
| Szint | r | R | CVr (1) | CVR |
| (μg/kg) | (%) | (%) | ||
| 8–14 | 1,4 | 1,7 | 11 | 18 |
| (1) CV = a változatok együtthatója | ||||
10.2. A kloroform (3.1.) stabilitása
A Florisil SPE oszlop adszorpciós jellemzői változhatnak, ha nem etanolt használnak stabilizátorként. Ha az előírt kloroform nem áll rendelkezésre, az adszorpciós tulajdonságokat a 10.3.-mal összhangban ellenőrizni kell.
10.3. Validálás
A módszer helyes alkalmazásáról hiteles anyagmintákon végzett ismételt vizsgálatokkal kell meggyőződni. Ha ilyenek nem állnak rendelkezésre, akkor fortifikált aflatoxinmentes mintákon végzett visszanyerési kísérletekkel kell ellenőrizni a módszer működését. Az eredmények átlagának eltérése a valós értéktől -20 és +10 % közé essen (a valós érték %-ában kifejezve).
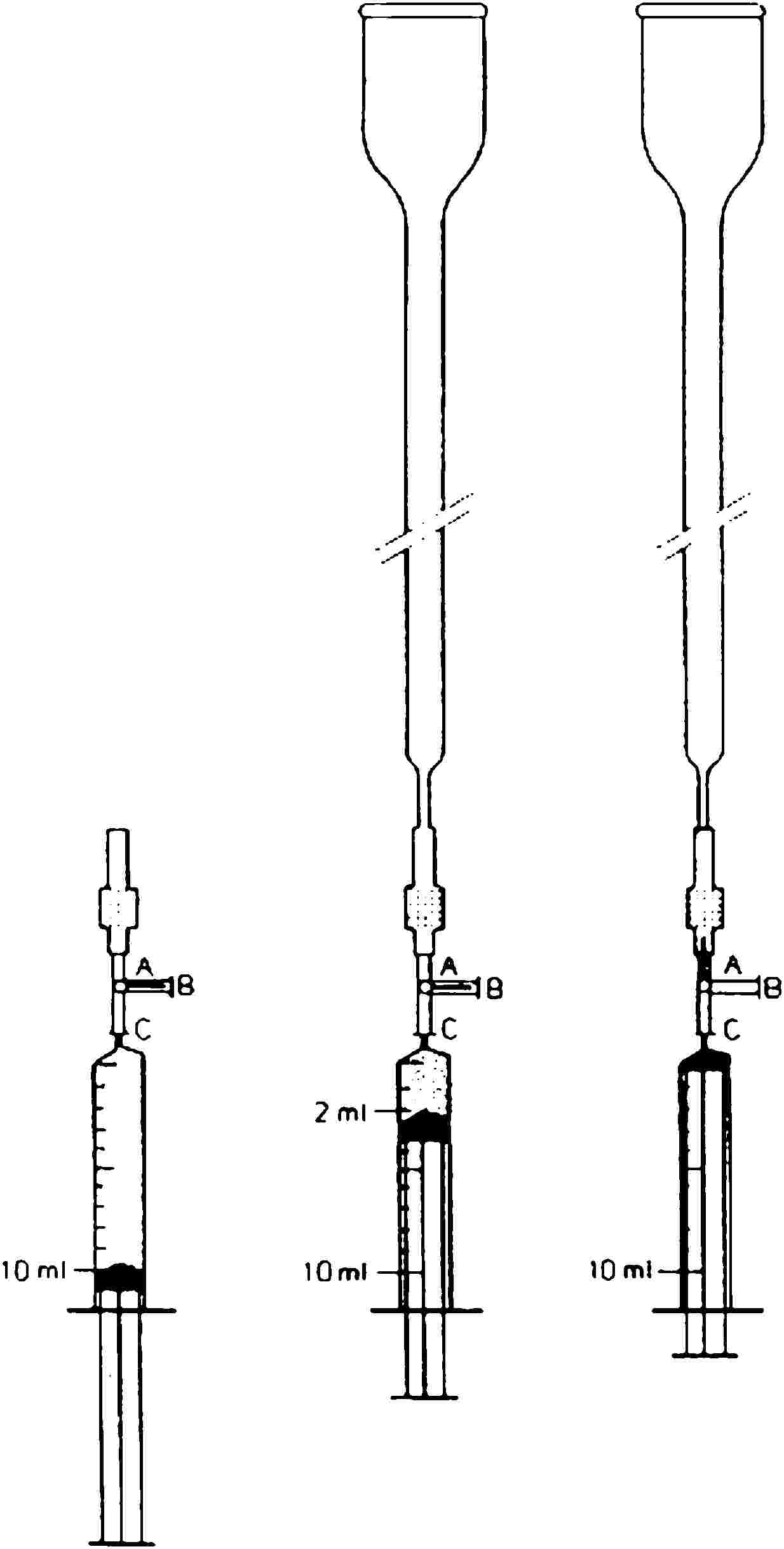
1. ábra: Oszlopkészlet összeszerelése
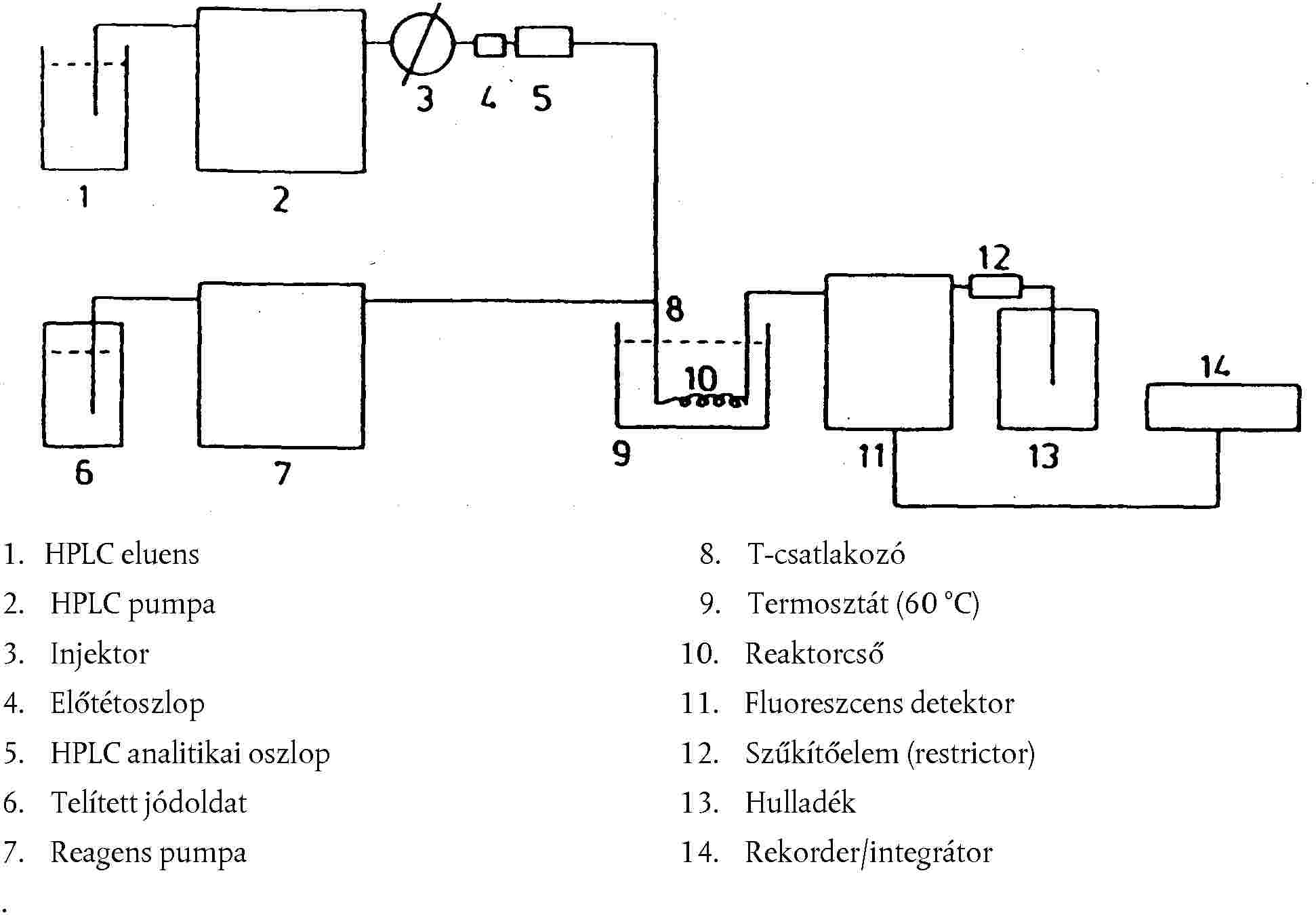
2. ábra: A jóddal végzett származékképzéssel történő folyadékkromatográfiás meghatározás rendszerének folyamatábrája
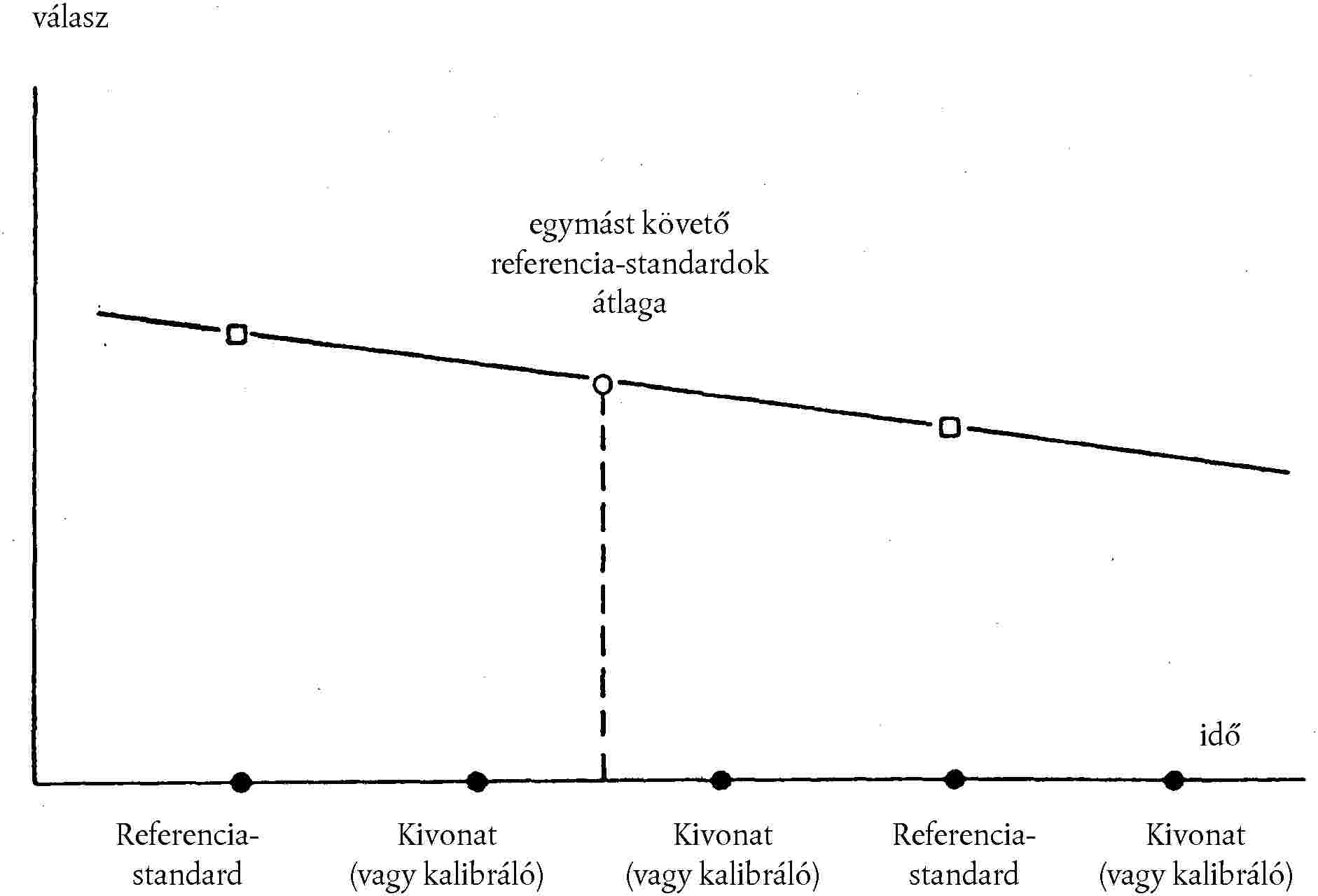
3. ábra: A hőmérséklet-változás figyelembevétele az aflatoxin B1 válaszban referencia kalibrálóoldat (3.13.3.) rendszeres időközönként történő injektálásával
C. AZ A. ÉS B. MÓDSZERRE VONATKOZÓ ÉSZREVÉTELEK
1. Zsírtalanítás
Az 5 % nál több zsírt tartalmazó mintákat az 5.1. pontban leírt előkészítés után petroléterrel (fp 40-60 oC) zsírtalanítani kell.
Ilyen esetekben az analízis eredményét a nem zsírtalanított minta tömegére vonatkozóan kell kifejezni.
2. Az A. módszer eredményeinek reprodukálhatósága
Az eredmények reprodukálhatóságának, vagyis az azonos mintából, két vagy több laboratórium által kapott eredmények közötti eltérés becsült értékei a következők:
A középérték ± 50 %-a, ha aflatoxin B1 - re kapott középérték 10 - 20 μg/kg közé esik;
± 10 μg/kg az aflatoxin B1 középérték, ha 20 - 50 μg/kg közé esik;
a középérték ± 20 %-a, ha az aflatoxin B1 középérték több, mint 50 μg/kg.
A melléklet függeléke
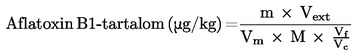
1. ábra
2. ábra
3. ábra
( 1 ) HL L 73., 1972.3.27., 14. o.
( 2 ) HL L 170., 1970.8.3., 2. o.
( 3 ) HL L 155., 1971.7.12., 13. o.
( 4 ) HL L 279., 1971.12.20., 7. o.
( 5 ) HL L 123., 1972.5.29., 6. o.
( 6 ) HL L 83., 1973.3.30., 21. o.
( 7 ) HL L 108., 1974.4.22., 7. o.
( 8 ) HL L 32., 1975.2.5., 26. o.
( 9 ) Egmond, H. P. van Heisterkamp, S. H. és Paulsch, W. E. (1991), Food additives and Contaminants 8, 17-29.
( 10 ) ISO 3534-1977.
( 11 ) HL L 351., 1989.12.2., 39. o.
Lábjegyzetek:
[1] A dokumentum eredetije megtekinthető CELEX: 31976L0372 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:31976L0372&locale=hu Utolsó elérhető, magyar nyelvű konszolidált változat CELEX: 01976L0372-19940503 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:01976L0372-19940503&locale=hu


