47/2011. (VII. 27.) NEFMI rendelet
az egyes egészségügyi tárgyú miniszteri rendeletek módosításáról
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés c) pontjában kapott felhatalmazás alapján az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 41. § b) pontjában meghatározott feladatkörömben eljárva - az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 73. § b) pontjában meghatározott feladatkörében eljáró nemzetgazdasági miniszterrel egyetértésben -,
a 9-10. § tekintetében a biztonságos és gazdaságos gyógyszer- és gyógyászatisegédeszköz-ellátás, valamint a gyógyszerforgalmazás általános szabályairól szóló 2006. évi XCVIII. törvény 77. § (2) bekezdés i) pontjában kapott felhatalmazás alapján az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 41. § d) pontjában meghatározott feladatkörömben eljárva,
a 11. § tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés a) pontjában kapott felhatalmazás alapján az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 41. § b) pontjában meghatározott feladatkörömben eljárva,
a 12. § tekintetében a sportról szóló 2004. évi I. törvény 79. § (6) bekezdésében kapott felhatalmazás alapján, az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 41. § k) pontjában meghatározott feladatkörömben eljárva - az egyes miniszterek, valamint a Miniszterelnökséget vezető államtitkár feladat- és hatásköréről szóló 212/2010. (VII. 1.) Korm. rendelet 73. § c) pontjában meghatározott feladatkörében eljáró nemzetgazdasági miniszterrel egyetértésben -
a következőket rendelem el:
1. § A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet (a továbbiakban: R1.) 5. § (2) bekezdése helyébe a következő rendelkezés lép:
"(2) Az egyes indikációs pontokhoz tartozó kijelölt intézmények megjelölését az OEP javaslata alapján a 2. és 3. számú melléklet, valamint az egészségbiztosításért felelős miniszter tájékoztatója tartalmazza. A kijelölt intézmények listáját az OEP is közzéteszi a honlapján."
2. § (1) Az R1. 8. § (2) bekezdése helyébe a következő rendelkezés lép:
"(2) Hatóanyag alapú fix csoportba vonhatóak az azonos hatóanyagú, azonos alkalmazási módú, azonos hatáserősségű és hatástartamú gyógyszerek. A hatóanyag alapú fix csoport megképezhető minden olyan esetben, amikor
a) a fenti feltételeknek megfelelő legalább két egyenértékű készítmény van, és
b) a (6) bekezdésben foglaltak alapján referenciakészítményi státuszt megszerző gyógyszer nem a legmagasabb NTK-jú termék, és
c) az utolsó alkalommal meghatározott referencia ár közzétételét megelőző hat hónapot vizsgálva az adott csoportba vonható gyógyszerek féléves
ca) összforgalmi részesedése minden támogatási jogcímet figyelembe véve a 250 000 DOT-ot, vagy
cb) támogatás kiáramlása minden támogatási jogcímet figyelembe véve a 100 millió forintot
meghaladja."
(2) Az R1. 8. § (5) bekezdése helyébe a következő rendelkezés lép:
"(5) A referencia készítmény ATC besorolása alapján az 1. számú melléklet szerinti, az adott hatóanyagot tartalmazó ATC-re megállapított százalékos támogatásban részesül. A referencia készítmény - referencia státusz megszerzésekori - közfinanszírozás alapjául elfogadott ára az adott csoportban a referencia ár. A referencia árnál alacsonyabb napi terápiás költségű gyógyszerek támogatásának mértéke megegyezik a referencia árhoz nyújtott százalékos támogatás mértékével."
(3) Az R1. 8. §-a a következő (5a)-(5c) bekezdéssel egészül ki:
"(5a) A 10. § szerinti eljárás során képzett támogatási csoportba tartozó, a referencia árnál magasabb napi terápiás költségű gyógyszerek támogatása a referencia árhoz nyújtott támogatás fix összege.
(5b) A 10/A. § szerinti eljárás során képzett támogatási csoportba tartozó, a referenciagyógyszer napi terápiás költségét legfeljebb 5%-kal meghaladó napi terápiás költségű gyógyszer támogatása a referencia árhoz nyújtott támogatás fix összege.
(5c) A 10/A. § szerinti eljárás során meghatározott, napi terápiás költségük alapján preferált referencia ársávba nem tartozó készítmények társadalombiztosítási támogatásának számítása a támogatási kategória változatlanul hagyása mellett a 8. § szerinti számítási módszerrel, de a referenciagyógyszer árához nyújtott támogatás összegénél 15%-kal alacsonyabb támogatási összeg alkalmazásával kerül megállapításra."
(4) Az R1. 8. § (6) bekezdés e) pontja helyébe a következő rendelkezés lép:
[A referencia készítmény az a meghatározott (fix) támogatási csoportba tartozó gyógyszer, amely]
"e) csoporton belüli forgalmi részesedése a 10. § (4) bekezdése szerint megindult fixesítési eljárás kezdőnapját megelőző hét hónapot vizsgálva - ide nem értve a fixesítési eljárás kezdőnapját közvetlenül megelőző hónapot - két egymást követő hónapban a DOT tekintetében az 1%-ot elérte támogatási jogcímenként."
3. § (1) Az R1. 9. § (4) bekezdés b) pontja helyébe a következő rendelkezés lép:
(A terápiás fix elven működő támogatás számítása az alábbiak szerint történik:)
"b) a 10. § szerinti eljárás során és a 10/A. § szerinti eljárás során kiemelt és emelt támogatási kategóriában az 5. számú melléklet 1.1. bekezdés a) pontja alapján meghatározott napi terápiás költség átlagánál (NTKÁ) magasabb napi terápiás költségű készítmények az adott csoport átlagos napi terápiás költségéhez rendelt támogatási értéke (NTKÁT) alapján meghatározott összeget kapják támogatás értékéül az alábbiak szerint:
támogatási érték = NTKÁT x adott kiszerelés DOT értéke;"
(2) Az R1. 9. § (4) bekezdése a következő c)-d) ponttal egészül ki:
(A terápiás fix elven működő támogatás számítása az alábbiak szerint történik:)
"c) a b) pontban foglaltakon túl a 10/A. § szerinti eljárás során az 5. számú melléklet 1.1. bekezdés a) pontja alapján meghatározott napi terápiás költség átlagánál (NTKÁ) legfeljebb 10%-kal magasabb napi terápiás költségű készítmények az adott csoport átlagos napi terápiás költségéhez rendelt támogatási értéke (NTKÁT) alapján meghatározott összeget kapják támogatás értékéül az alábbiak szerint:
támogatási érték = NTKÁT x adott kiszerelés DOT értéke;
d) a 10/A. § szerinti eljárás során kialakított, napi terápiás költségük alapján preferált referencia ársávba nem tartozó készítmények társadalombiztosítási támogatásának számítása a támogatási kategória változatlanul hagyása mellett az 5. számú melléklet szerinti számítási módszerrel, de az 5. számú melléklet 1.1. bekezdés a) pontja alapján meghatározott napi terápiás költség átlagával (NTKÁ) egyenlő napi terápiás költségű gyógyszerekhez nyújtott támogatás összegénél 15%-kal alacsonyabb támogatási összeg alkalmazásával kerül megállapításra."
4. § (1) Az R1. 10. §-a a következő (1a)-(1b) bekezdéssel egészül ki:
"(1a) Azon fix csoportok esetén, amelyek az első fixesítési eljárást követően legalább 3 alkalommal már kialakításra kerültek, a fix csoportok képzésére a 10/A. § szerint félévente kerül sor.
(1b) A fix csoportok képzésére az (1a) bekezdésben foglaltakon túl minden más esetben - a (2)-(6) bekezdésben foglaltak szerint - negyedévente kerül sor."
(2) Az R1. 10. § (2) bekezdése helyébe a következő rendelkezés lép:
"(2) Az OEP az (1a) bekezdésben foglaltakon túl minden más esetben - a (4)-(6) bekezdésben foglaltak alapján -minden naptári negyedévben kialakítja az adott fix csoportot."
(3) Az R1. 10. § (4)-(5) bekezdése helyébe a következő rendelkezés lép:
"(4) A (2) bekezdésben foglalt fix csoport kialakításának keretében az OEP minden naptári negyedév első napját megelőző második hónap 1. napján értesíti az adott fix csoportban lévő termékek forgalomba hozatali engedélyének jogosultját, forgalmazóját, hogy hivatalból eljárást indított, és felhívja az ügyfeleket, hogy amennyiben az (1) bekezdés szerint közzétett árhoz képest árváltoztatással kívánnak élni, úgy azt minden naptári negyedév első napját megelőző második hónap 20. (február, május, augusztus, november) napjáig van lehetőségük az OEP honlapján működtetett nyilvántartásba felvezetni. A megtett árajánlatok az árváltoztatásra nyitva álló határidő lejártát követő első munkanapon válnak nyilvánossá. Ezt követően az OEP öt munkanapon belül honlapján közzéteszi a referencia készítményt - amennyiben a 8. § (6) bekezdés e) pontja szerinti forgalmi részesedést elérő több készítményre azonos NTK-t határoznak meg a forgalomba hozatali engedélyek jogosultjai, valamennyi azonos NTK-jú készítmény referencia termék lesz -, annak támogatását, a csoportban lévő valamennyi további gyógyszer közfinanszírozás alapjául elfogadott árához nyújtott fix összegű támogatásának összegét.
(5) Amennyiben a (4) bekezdésben foglalt eljárás keretében valamely, az adott fix csoportba tartozó termék a Gyftv. 31. § (1) bekezdés h)-i) pontja alapján kizárásra kerülne, ezen gyógyszerek forgalomba hozatali engedélyének jogosultja, forgalmazója a naptári negyedév első napját megelőző hónap 10. napjáig további árcsökkentéssel élhet a kizárás elkerülése érdekében azzal, hogy ezen árcsökkentési ajánlat a referencia készítmény státuszát, illetve a referencia árat nem befolyásolja."
5. § Az R1. 10/A. §-a helyébe a következő rendelkezés lép, egyidejűleg a következő 10/B-10/D. §-sal egészül ki:
"10/A. § (1) Az OEP - a (2)-(5) bekezdésben foglaltak alapján - minden naptári félévben újraképzi az adott fixesítés kezdőnapjától számítva legalább egy éve már kialakításra került hatóanyag alapú és terápiás fix csoportokat, és meghatározza az április 1-jétől, és október 1-jétől fél éves időszakban érvényes preferált referencia ársávba tartozó készítmények körét.
(2) Az (1) bekezdésben foglalt fix csoport kialakításának keretében az OEP február 1-jén és augusztus 1-jén értesíti az adott fix csoportban lévő termékek forgalomba hozatali engedélyének jogosultját, forgalmazóját, hogy hivatalból eljárást indított, és felhívja az ügyfeleket, hogy amennyiben a 10. § (1) bekezdése szerint közzétett árhoz képest árváltoztatással kívánnak élni, úgy azt február és augusztus 20. napjáig van lehetőségük az OEP honlapján működtetett nyilvántartásba felvezetni. A megtett árajánlatok az árváltoztatásra nyitva álló határidő lejártát követő első munkanapon válnak nyilvánossá. Ezt követően az OEP öt munkanapon belül honlapján közzéteszi a referencia készítményt - amennyiben a 8. § (6) bekezdés e) pontja szerinti forgalmi részesedést elérő több készítményre azonos NTK-t határoznak meg a forgalomba hozatali engedélyek jogosultjai, valamennyi azonos NTK-jú készítmény referencia termék lesz -, annak támogatását, a csoportban lévő valamennyi további gyógyszer közfinanszírozás alapjául elfogadott árához nyújtott fix összegű támogatásának összegét.
(3) A preferált referencia ársáv alapjául
a) hatóanyag alapú fix csoport esetén az (1)-(2) bekezdés szerinti eljárás során kialakult referencia ár,
b) normatív támogatási kategóriájú terápiás fix csoport esetén a referencia ár szolgál.
(4) Amennyiben a (2) bekezdésben foglalt eljárás keretében valamely, az adott fix csoportba tartozó termék a Gyftv. 31. §-a (1) bekezdés h)-i) pontja alapján kizárásra kerülne, ezen gyógyszerek forgalomba hozatali engedélyének jogosultja, forgalmazója március, illetve szeptember 10. napjáig további árcsökkentéssel élhet a kizárás elkerülése érdekében azzal, hogy ezen árcsökkentési ajánlat a referencia készítmény státuszát, a referencia árat, illetve a preferált referencia ársávba tartozó készítmények körét nem befolyásolja.
(5) A (4) bekezdésben foglaltakat követően az OEP a Gyftv. és e rendelet szabályai szerint meghatározza a referencia készítményt, annak támogatását, a csoportban lévő valamennyi további gyógyszer közfinanszírozás alapjául elfogadott árához nyújtott fix összegű támogatás mértékét, a preferált referencia ársávba tartozó készítmények körét és ezen adatokat közzéteszi honlapján. A preferált referencia ársávba tartozó készítményeket az OEP a honlapján lévő gyógyszertörzsben is megjelöli.
(6) Amennyiben a gyógyszer forgalomba hozatali engedélyének jogosultja, gyógyszer-nagykereskedő, gyógyszertár, egészségügyi szolgáltató, illetve az ezeket ellenőrző hatóság igazolt - OEP részére megtett - jelzése alapján a folyamatos betegellátás a fixesítési eljárást követően a preferált referencia ársávba tartozó készítményekkel nem biztosítható, betegellátási érdekből a következő fixesítési eljárás lefolytatásig a fix csoportban lévő, de preferált referencia ársávba nem tartozó, legalacsonyabb napi terápiás költséggel rendelkező készítmények közül azon készítmények, melyek forgalmi részesedése együttesen az intézkedést megelőző 4 hónap átlagában DOT tekintetében az 1%-ot eléri, a csoportra jellemző százalékos támogatásban, de legfeljebb a csoport referenciagyógyszeréhez nyújtott támogatási összegben részesülnek.
(7) A gyógyszer forgalomba hozatali engedélyének jogosultja a preferált referencia ársávba tartozó készítmények körének (1) bekezdés szerinti meghatározásakor az adott gyógyszer vonatkozásában nyilatkozni köteles az OEP felé, hogy a gyógyszerrel való folyamatos betegellátást biztosítja.
10/B. § A több hatóanyagot is tartalmazó, fix csoportba vonható orális készítmények támogatását az OEP a 10. § vagy a 10/A. § szerinti eljárás keretében a 14. § (2) bekezdésben lévő szempontok alapján felülvizsgálja. A több hatóanyagot is tartalmazó, fix csoportba nem vonható orális készítmények támogatását az OEP a 10/A. §-ban szereplő eljárással egyidőben félévente a 14. § (2) bekezdés szempontjai alapján felülvizsgálja. Az OEP a több hatóanyagot is tartalmazó orális készítményeknek a 14. § (2) bekezdése szerint megállapított új támogatását a 10. § (4) bekezdése, illetve a 10/A. § (3) bekezdés szerinti közzététellel egyidőben teszi közzé.
10/C. § Az OEP minden naptári negyedév 1. napján honlapján közzéteszi a fél évvel később bevezetni tervezett terápiás fix csoportokat (négyszintű ötjegyű ATC csoportokat), az esetlegesen létrehozandó alcsoportokat és a hozzájuk tartozó maximális százalékos mértékeket, mely közleményre az érintett gyógyszer forgalomba hozatali engedélyének jogosultja, forgalmazója egy alkalommal tíz napon belül észrevételt tehet.
10/D. § (1) A 10. § (1) bekezdése szerint közzétett árakra bármelyik fix csoportban lévő gyógyszer forgalomba hozatali engedélyének jogosultja, forgalmazója bármikor tehet árcsökkentési ajánlatot.
(2) Azon árcsökkentési ajánlatok, melyek a tárgyhónap 10. napjáig beérkeznek a következő hónap első napjával érvénybe lépnek azzal, hogy a meglévő referencia árat, a preferált referencia ársávba tartozó készítmények körét a fix csoportképzés 10. § (4)-(6), és a 10/A. § (2)-(4) bekezdés szerinti lefolytatásáig nem befolyásolják."
6. § Az R1. 14. §-a helyébe a következő rendelkezés lép:
"14. § (1) A gyógyszer befogadásának egyéb feltételei:
a) új csomagolás az előző csomagolással azonos termelői áron vagy import beszerzési áron (a továbbiakban együtt: termelői ár) és azonos támogatási mértékkel fogadható be;
b) új kiszerelés a már támogatott azonos márkanevű készítmény azonos vagy alacsonyabb termelői áron számított egységnyi hatóanyag árán fogadható be;
c) új hatáserősség a már támogatott azonos márkanevű készítmény azonos vagy alacsonyabb termelői áron számított egységnyi hatóanyag árán fogadható be;
d) új gyógyszerforma az azonos alkalmazási módú azonos márkanevű gyógyszerek napi terápiás költségen vagy alacsonyabb áron fogadható be;
e) termelői ára a Tfr. 2. § (2) bekezdés 15. pontja szerinti generikumnak nem minősülő hasonló biológiai készítmény termelői áránál legalább 30%-kal alacsonyabb legyen; az ez után a támogatási rendszerbe kerülő második készítmény ehhez képest további legalább 10%-kal, a harmadik készítmény a másodikként belépő gyógyszerhez képest további legalább 10%-kal alacsonyabb termelői áron; a további belépők a már befogadott legalacsonyabb termelői árú gyógyszernél alacsonyabb termelői áron kerülhetnek be a támogatási rendszerbe;
f) termelői ára az elsőként a támogatási rendszerbe vont azonos hatóanyagú és azonos alkalmazási módú gyógyszer termelői áránál legalább 40%-kal alacsonyabb legyen; az ez után a támogatási rendszerbe kerülő második készítmény ehhez képest további legalább 20%-kal, a harmadik készítmény a másodikként belépő gyógyszerhez képest további legalább 10%-kal alacsonyabb termelői áron; a további 3 belépő az utolsó belépőhöz képest 5%-kal alacsonyabb termelői áron; ezt követően a már befogadott legalacsonyabb termelői árú gyógyszernél alacsonyabb termelői áron kerülhetnek be a támogatási rendszerbe;
g) több hatóanyagot is tartalmazó orális gyógyszerformájú készítmény a támogatásba akkor fogadható be egyszerűsített eljárással, ha a kombinációs készítmény valamennyi monokomponense támogatott, és
ga) fogyasztói ára nem haladja meg az azonos forgalomba hozatali engedély jogosult által forgalmazott monokomponenseket tartalmazó, a kombinációs készítmény hatáserősségéhez és kiszereléséhez legközelebb álló hatáserősségű és kiszerelésű már támogatott formájának fogyasztói áron számolt egységnyi hatóanyagárának a monokomponens kombinációban lévő hatóanyagmennyiségére számított összegét, vagy
gb) amennyiben nincs azonos forgalomba hozatali engedély jogosult által forgalmazott, az adott monokomponenst tartalmazó készítmény, fogyasztói ára nem haladja meg a monokomponenseket tartalmazó, a kombinációs készítmény hatáserősségéhez és kiszereléséhez legközelebb álló hatáserősségű és kiszerelésű, legalacsonyabb napi terápiás költségű már támogatott formájának fogyasztói áron számolt egységnyi hatóanyagárának a monokomponens kombinációban lévő hatóanyagmennyiségére számított összegét;
h) az orális kombinációs készítmények támogatása nem haladhatja meg a termék hatáserősségéhez és kiszereléséhez legközelebb álló hatáserősségű és kiszerelésű monokomponensek támogatásának a monokomponens kombinációban lévő hatóanyagmennyiségére számított összegét, amennyiben mindegyik monokomponens támogatott;
i) a g) pont szerinti befogadások esetén az OEP a határozatában megjelöli a közfinanszírozás alapjául elfogadott ár és a támogatási összeg számítása során figyelembe veendő készítményeket és fix csoportokat;
j) amennyiben az e) és f) pont alapján az első generikum a már elsőként a támogatási rendszerbe vont azonos hatóanyagú gyógyszer termelői áránál legalább 60%-kal alacsonyabb áron került befogadásra, úgy az ez után a támogatási rendszerbe kerülő további gyógyszerek az első generikumnál alacsonyabb áron kerülhetnek be a támogatási rendszerbe.
(2) Gyógyszer támogatásának egyéb feltételei:
a) az orális kombinációs készítmények támogatása nem haladhatja meg a termék hatáserősségéhez és kiszereléséhez legközelebb álló hatáserősségű és kiszerelésű monokomponensek támogatásának a monokomponens kombinációban lévő hatóanyagmennyiségére számított összegét, amennyiben mindegyik monokomponens támogatott;
b) az OEP határozatában megjelöli a támogatási összeg számítása során figyelembe vett készítményeket és fix csoportokat."
7. § Az R1. a következő 24/A. §-sal egészül ki:
"24/A. § Az egyes egészségügyi tárgyú miniszteri rendeletek módosításáról szóló 47/2011. (VII. 27.) NEFMI rendelettel megállapított 1-3. számú mellékletben foglaltakat azzal kell alkalmazni, hogy a 2011. augusztus 1. napját megelőzően felírt vényekre a gyógyszerek kiválthatóak és az így beváltott vények elszámolhatóak a 2011. július 31-én hatályos szabályok szerint."
8. § (1) Az R1. 1. számú melléklete az 1. melléklet szerint módosul.
(2) Az R1. 2. számú melléklete a 2. melléklet szerint módosul.
(3) Az R1. 3. számú melléklete a 3. melléklet szerint módosul.
(4) Az R1. 5. számú melléklete a 4. melléklet szerint módosul.
9. § A gyógyszerrendeléshez használandó számítógépes program minősítésének szabályairól szóló 53/2007. (XII. 7.) EüM rendelet (a továbbiakban: R2.) 2. § d) pontja helyébe a következő rendelkezés lép:
(E rendelet alkalmazásában:)
"d) napi terápiás költség (NTK): a törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet (a továbbiakban: R.) 2. § u) pontja szerinti fogalom;"
10. § Az R2. 4. § (1) bekezdése a következő i) ponttal egészül ki:
(A szoftvernek alkalmasnak kell lennie a külön jogszabály szerinti, tartalmilag szabályos vény kinyomtatására álló és fekvő helyzetben egyaránt. Alkalmasnak kell továbbá lennie:)
"i) az R. alapján naptári félévente meghatározott preferált referencia ársávba tartozó termékek megjelenítésére."
11. § (1) A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet (a továbbiakban: R3.) 12. melléklete az 5. melléklet szerint módosul.
(2) Az R3. 16. melléklete a 6. melléklet szerint módosul.
12. § A látvány-csapatsportok támogatásával összefüggő sportfejlesztési program jóváhagyására és a támogatási igazolás kiadására irányuló hatósági eljárásban fizetendő igazgatási szolgáltatási díjról szóló 39/2011. (VI. 30.) NEFMI rendelet 3. § (1) bekezdés b) pontja helyébe a következő rendelkezés lép:
(Ha az 1. §-ban meghatározott kérelem benyújtója)
"b) a sport stratégiai fejlesztését szolgáló, a költségvetési törvényben meghatározott állami sportcélú támogatás felhasználásában döntéshozatali jogkörrel rendelkező és a támogatást folyósító sportköztestület, akkor az igazgatási szolgáltatási díjat a Nemzeti Sport Intézet, mint a díj beszedésére jogosult szervezet 10032000-00294762-30000003 számú fizetési számlája javára kell megfizetni."
13. § Az R1.
a) 2. § f) pontjában az "az Országos Gyógyszerészeti Intézet (a továbbiakban: OGYI)" szövegrész helyébe az "a Gyógyszerészeti és Egészségügyi Minőség- és Szervezetfejlesztési Intézet (a továbbiakban: GYEMSZI)" szöveg;
b) 2. § o) pontjában az "az Egészségügyi Stratégiai Kutatóintézet (a továbbiakban: ESKI)" szövegrész helyébe az "a GYEMSZI" szöveg;
c) 2. § r) pontjában az "az OGYI" szövegrész helyébe az "a GYEMSZI" szöveg;
d) 5/C. § (3) bekezdésében és (5) bekezdés c) pontjában az "az ESKI és a terápiás terület szerint illetékes szakmai kollégiumok" szövegrész helyébe az "a GYEMSZI és az egészségügyi szakmai kollégium" szöveg;
e) 5/D. § (2) bekezdésében az "Az ESKI" szövegrész helyébe az "A GYEMSZI" szöveg;
f) 6. § (4) bekezdésében a "8-10. §-ok" szövegrész helyébe a "8-10/A. §", a "8. § (5) bekezdése" szövegrész helyébe a "8. § (5)-(5c) bekezdése" szöveg;
g) 11. §-ában az "illetékes szakmai kollégium" szövegrész helyébe az "egészségügyi szakmai kollégium" szöveg;
h) 12. § (2) bekezdésében az "az illetékes szakmai kollégiumok" szövegrész helyébe az "az egészségügyi szakmai kollégium" szöveg;
i) 14/A. §-ában a "14. § g)-h) pontjának" szövegrész helyébe a "14. § (1) bekezdés e)-f) pontjának" szöveg;
j) 19. § (2) bekezdésében az "az ESKI" szövegrész helyébe az "a GYEMSZI és az egészségügyi szakmai kollégium" szöveg;
k) 22. § (1) bekezdés c) pontjában a "14. § i) pontja" szövegrész helyébe a "14. § (1) bekezdés g) pontja" szöveg
lép.
14. § Hatályát veszti az R1. 10. § (3), (7) és (8) bekezdése.
15. § (1) Ez a rendelet - a (2) bekezdésben foglalt kivételekkel - a kihirdetést követő napon lép hatályba.
(2) A 8. § (1)-(3) bekezdése, a 11. §, az 1-3. melléklet és az 5-6. melléklet 2011. augusztus 1-jén lép hatályba.
(3) Ez a rendelet 2011. augusztus 2-án hatályát veszti.
Dr. Réthelyi Miklós s. k.,
nemzeti erőforrás miniszter
1. melléklet a 47/2011. (VII. 27.) NEFMI rendelethez
1. Az R1. 1. számú melléklete az L02BG pontot követően a következő L02BX ponttal egészül ki:
| ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIÁK | ||||||
| NORMATÍV | EMELT INDIKÁ- CIÓHOZ KÖTÖTT | KIEMELT INDIKÁ- CIÓHOZ KÖTÖTT | KÜLÖN KERET | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉRTÉK NÉLKÜL | ÁTLAGON ALULI | ÁTLAGOS | ÁTLAGON FELÜLI | |||||
| L02BX | egyéb hormonantagonisták és rokon anyagok | X | ||||||
2. Az R1. 1. számú melléklet B02BX pontja helyébe a következő rendelkezés lép:
| ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIÁK | ||||||
| NORMATÍV | EMELT INDIKÁ- CIÓHOZ KÖTÖTT | KIEMELT INDIKÁ- CIÓHOZ KÖTÖTT | KÜLÖN KERET | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉRTÉK NÉLKÜL | ÁTLAGON ALULI | ÁTLAGOS | ÁTLAGON FELÜLI | |||||
| B02BX | egyéb systemás haemostaticumok | X | X | X | ||||
3. Az R1. 1. számú melléklet C10AA pontja helyébe a következő rendelkezés lép:
| ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIÁK | ||||||
| NORMATÍV | EMELT INDIKÁ- CIÓHOZ KÖTÖTT | KIEMELT INDIKÁ- CIÓHOZ KÖTÖTT | KÜLÖN KERET | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉRTÉK NÉLKÜL | ÁTLAGON ALULI | ÁTLAGOS | ÁTLAGON FELÜLI | |||||
| C10AA | Hmg CoA reductase gátlók | X | X | |||||
2. melléklet a 47/2011. (VII. 27.) NEFMI rendelethez
1. Az R1. 2. számú melléklet EÜ100 26/b. pontja helyébe a következő szöveg lép:
"EÜ100 26/b.
TÁMOGATOTT INDIKÁCIÓK:
- Juvenilis idiopáthiás arthritis poliartikuláris típusainak kezelésére - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási protokoll alapján
- Megfelelő válaszkészség esetén (Giannini javulási kritérium mértéke 30%-nál magasabb) az aktivitás rendszeres kontrollja mellett a remisszió fennállásáig - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási protokoll alapján
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Reumatológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
M0800"
2. Az R1. 2. számú melléklet EÜ100 28. pontja helyébe a következő szöveg lép:
"EÜ100 28.
TÁMOGATOTT INDIKÁCIÓK:
- 12 évesnél idősebb allergiás etiológiájú (IgE szintjük >76 IU/ml, bőrpróbával, in vitro meghatározással szérumukban specifikus IgE detektálható környezeti, inhalativ perenniális allergén/ek ellen) súlyos, asthma bronchialeban (FEV1P<80%) szenvedő betegek részére kiegészítő kezelésként, akiknek asthmája tartós szisztémás szteroid kezelés mellett nem kontrollált vagy nagy dózisú inhalációs szteroid és hosszú hatású beta-2-agonista terápia ellenére gyakoriak (dokumentáltan legalább 4/év) a szisztémás szteroid kezelésre szoruló exacerbációik. A terápia eredményességét a terápia megkezdése után négyhavonta az asthma-kontroll mértékének ellenőrzésével dokumentáltan értékelni kell, a terápia csak abban az esetben folytatható, ha a szteroid kezelésre szoruló exacerbációk száma legalább a felére csökken és a nem kontrollált asztma részlegesen kontrollálttá vagy kontrollálttá válik.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Tüdőgyógyászat | Javasolhat és írhat |
| Kijelölt intézmény | Gyermektüdőgyógyászat | Javasolhat és írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Gyermektüdőgyógyászat | javaslatra írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Tüdőgyógyászat | javaslatra írhat |
| SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 4 hónap | ||
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
J4500"
3. Az R1. 2. számú melléklet EÜ100 38/b. pontja helyébe a következő rendelkezés lép:
"EÜ100 38/b.
TÁMOGATOTT INDIKÁCIÓK:
- Krónikus vastúlterhelés kezelése 6 éves és idősebb, béta-thalassaemia majorban szenvedő betegnek, aki több mint 7 ml/kg/hónap vörösvértest-koncentrátumot kap, amennyiben a deferoxamin-kezelés ellenjavallt vagy elégtelen
- A 2-5 év közötti beteg számára, akinél a vastúlterhelés nem transzfúziós okú, hanem a vérszegénységgel együtt járó tartós haemolysis miatt alakul ki, amennyiben a deferoxamin-kezelés ellenjavallt vagy elégtelen
- A nagy mennyiségű (<7 ml/tskg/hó-t elérő vagy meghaladó) vörösvértest-koncentrátumot igénylő, transzplantációs listára került myelodysplasia (MDS) szindrómás beteg részére, haemosiderosis kivédése céljából, amennyiben a deferoxamin-kezelés ellenjavallt vagy elégtelen
- Nemzetközi prognosztikai index alapján kedvező prognózisú (a várható élettartama 3 évnél hosszabb) gyakori transzfúziót (<7ml/ttkg/hó vörösvértest koncentrátum) kapó MDS-ben szenvedő betegek részére, ahol a csontvelői myeloblaszt arány nem haladhatja meg az 10%-ot, s a cytogenetikai vizsgálat eredménye normális vagy abban kedvező eltérések vannak (nem támogathatók az 5 és 7 chromosoma vesztéssel járó esetek), a kezelést 2000 ng/ml-es ferritin szint elérésekor lehet elkezdeni
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ
ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Haematológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
D46, D4690, D5610"
4. Az R1. 2. számú melléklet EÜ100 39/a. pontja helyébe a következő rendelkezés lép:
"EÜ100 39/a.
TÁMOGATOTT INDIKÁCIÓK:
- Végstádiumú veseelégtelenség fenntartó dialízisterápiája során kialakult szekunder hyperparathyreosis kezelése, amennyiben a beteg szérum iPTH 500-800 pg/ml között van, és a konvencionális aktív D-vitamin kezelést dokumentáltan meg kellett szakítani a szérum kalciumszint normál szint fölé emelkedése miatt (Ca>2,4 mmol/l) vagy normokalcaemia esetén (Ca<2,4 mmol/l), ha a szérum iPTH>800 pg/ml és a mellékpajzsmirigy sebészeti eltávolítása kontraindikált
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ
ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Nephrológia | javasolhat és írhat |
| Kijelölt intézmény | Nephrológia | javaslatra írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
E2110"
5. Az R1. 2. számú melléklete a következő EÜ100 55. ponttal egészül ki:
"EÜ100 55.
TÁMOGATOTT INDIKÁCIÓK:
- Súlyos tünetekkel járó (vérvizelés, súlyos vizelési panaszok, klinikailag bizonyítottan az alapbetegséggel összefüggő csontfájdalmak), lokálisan előrehaladott vagy áttétes hormondependens prostatarák kezelésére (Gleason score: >3-4, TNM klasszifikáció: N0-1, M0-1) onkoteam (urológus, klinikai onkológus, sugárterápiás szakorvos) dokumentált javaslata alapján, egyidejű antiandrogén terápia mellőzésével
- Hormondependens prostatarák sugárterápiája esetén adjuvans és neoadjuvans formában onkoteam (urológus, klinikai onkológus, sugárterápiás szakorvos) dokumentált javaslata alapján, egyidejű antiandrogén terápia mellőzésével
- Radikális prostatectomiát követő relapsusok kezelésére onkoteam (urológus, klinikai onkológus, sugárterápiás szakorvos) dokumentált javaslata alapján, egyidejű antiandrogén terápia mellőzésével
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ
ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Urológia | írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Klinikai onkológia | írhat |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Sugárterápia | írhat |
ELFOGADHATÓ BNO KÓDOK (beleértve az összes azonosan kezdődő kódot):
C61"
6. Az R1. 2. számú melléklete a következő EÜ100 56. ponttal egészül ki:
"EÜ100 56.
TÁMOGATOTT INDIKÁCIÓK:
- Súlyos, krónikus immun (idiopátiás) trombocytopeniás purpurában (ITP) (BNO D6930) szenvedő felnőtt betegek részére (vérlemezke-szám 30x109/l alatt van és fokozott a vérzési rizikó), ha a korábbi gyógyszeres (pl.: kortikoszteroiddal vagy immunglobulinnal végzett) terápiára tartósan nem reagált és azt követő splenectomiára refrakterré vált vagy ha a splenectomia dokumentáltan (hematológus-sebész-aneszteziológus team véleménye alapján) ellenjavallt, a kezelést fel kell függeszteni, ha a vérlemezkeszám négyheti, maximális heti adag (10 μg/ttkg) mellett sem éri el a klinikailag jelentős vérzés elkerüléséhez szükséges szintet
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Haematológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
D6930 Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Honvédkórház - Állami Egészségügyi Központ I. Belgyógyászati Osztály |
| Budapest | Főv. Önk. Egyesített Szent István és Szent László Kórház-Rendelőintézet Haematológiai és Csontvelőtranszplantációs Osztály, I. Belgyógyászat |
| Város | Intézmény neve |
| Budapest | Semmelweis Egyetem I. sz. Belgyógyászati Klinika |
| Debrecen | Debreceni Egyetem Orvos- és Egészségtudományi Centrum Belgyógyászati Intézet |
| Győr | Petz Aladár Megyei Oktató Kórház II. sz. Belgyógyászat-Haematológiai Osztály |
| Pécs | Pécsi Tudományegyetem Orvos- és Egészségtudományi Centrum I. sz. Belgyógyászati Klinika |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ II. sz. Belgyógyászati Klinika |
"
7. Az R1. 2. számú melléklete a következő EÜ100 57. ponttal egészül ki:
"EÜ100 57.
TÁMOGATOTT INDIKÁCIÓK:
- A Mabthera kemoterápiával kombinálva javasolt relapszusos/refrakter chronicus lymphocytás leukémiában szenvedő betegek kezelésére, összesen 6 cikluson keresztül
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ
ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Haematológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
C911
Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Honvédkórház - Állami Egészségügyi Központ |
| Budapest | Főv. Önk. Egyesített Szent István és Szent László Kórház-Rendelőintézet |
| Budapest | Főv. Önk. Heim Pál Gyermekkórház |
| Budapest | Főv. Önk. Szent János és Észak-budai Egyesített Kórházai |
| Budapest | Országos Onkológiai Intézet |
| Budapest | Semmelweis Egyetem I-II-III. sz. Belgyógyászati Klinika, I-II. sz. Gyermekgyógyászati Klinika |
| Debrecen | Debreceni Egyetem Orvos- és Egészségtudományi Centrum Gyermekklinika Onkohaematológia Osztály, II. sz. Belgyógyászati Klinika Haematológiai Tanszék |
| Eger | Markhot Ferenc Kórház Egészségügyi Szolgáltató Nonprofit Kiemelkedően Közhasznú Kft. |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Gyula | Békés Megyei Képviselő-testület Pándy Kálmán Kórháza |
| Kaposvár | Kaposi Mór Oktató Kórház |
| Kecskemét | Bács-Kiskun Megyei Önkormányzat Kórháza |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
| Miskolc | Miskolci Semmelweis Ignác Egészségügyi Központ és Egyetemi Oktató Kórház Nonprofit Kft. |
| Nyíregyháza | Jósa András Oktató Kórház Egészségügyi Szolgáltató Nonprofit Kft. |
| Pécs | Pécsi Tudományegyetem Klinikai Központ Gyermekgyógyászati Klinika Onkológiai Osztály, I. sz. Belgyógyászati Klinika |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ Gyermekgyógyászati Klinika Onkológiai Osztály, II. sz. Belgyógyászati Klinika és Kardiológiai Központ |
| Székesfehérvár | Fejér Megyei Szent György Kórház |
| Szekszárd | Tolna Megyei Önkormányzat Balassa János Kórháza |
| Szolnok | Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
| Szombathely | Vas Megyei Markusovszky Kórház Nonprofit Zrt. |
| Tatabánya | Komárom-Esztergom Megyei Önkormányzat Szent Borbála Kórháza |
| Veszprém | Veszprém Megyei Csolnoky Ferenc Kórház Nonprofit Zrt. |
| Zalaegerszeg | Zala Megyei Kórház |
"
3. melléklet a 47/2011. (VII. 27.) NEFMI rendelethez
1. Az R1. 3. számú melléklet "Eü 50 százalékos támogatási kategória" része EÜ50 7. pontja a
| "Megkötés nélkül | Ortopédia-traumatológia | írhat" |
sort követően a
| "Megkötés nélkül | Ortopédia | írhat |
| Megkötés nélkül | Traumatológia | írhat" |
| sorokkal egészül ki. |
2. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/a1. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat" |
sorokkal egészül ki.
3. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/a2. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat" |
sorokkal egészül ki.
4. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/a3. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | írhat" |
sorokkal egészül ki.
5. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/a4. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat" |
sorokkal egészül ki.
6. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/b1. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat" |
sorokkal egészül ki.
7. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/b2. pontja a
| "Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | írhat" |
sorokkal egészül ki.
8. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/b3. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat" |
sorokkal egészül ki.
9. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része EÜ70 9/c1. pontja helyébe a következő rendelkezés lép:
"EÜ70 9/c1.
TÁMOGATOTT INDIKÁCIÓK:
- Osteoporosissal élő (T-score < -2,5 SD) férfiaknak a megfelelő gyógyszeres kalcium és D-vitamin bevitel (amennyiben nem kontraindikált) biztosításával együtt
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Endokrinológia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Reumatológia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat |
| Menopauza és osteoporózis járóbeteg-szakrendelés | Belgyógyászat | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot):
M80, M81, M82"
10. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része a következő EÜ70 23. ponttal egészül ki:
"EÜ70 23.
TÁMOGATOTT INDIKÁCIÓK:
- Az alapbetegség miatti tünetekkel járó paroxizmális pitvarfibrillációban szenvedő, stabil haemodinamikai állapotú, legfeljebb NYHA II. stádiumban lévő, ejectiós fractio (EF) > 35% értékű, felnőtt beteg részére a pitvarfibrilláció kiújulásának megakadályozására, a béta-blokkolón kívül legalább egy másik antiaritmiás szer (propafenon vagy sotalol) dokumentált terápiás hatástalansága vagy intoleranciája esetén, az alkalmazási előírás alapján;
- Perzisztens pitvarfibrillációban szenvedő, stabil haemodinamikai állapotú, legfeljebb NYHA II. stádiumban lévő, ejectiós fractio (EF) > 35% értékű, felnőtt beteg részére, a kamrai frekvencia csökkentésére, a béta-blokkolón kívül legalább egy másik antiaritmiás szer (propafenon vagy sotalol) dokumentált terápiás hatástalansága vagy intoleranciája esetén, az alkalmazási előírás alapján.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Kardiológia | javasolhat és írhat |
| Megkötés nélkül | Kardiológia | írhat |
| Háziorvos | megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I48H0"
11. Az R1. 3. számú melléklet "Eü 70 százalékos támogatási kategória" része a következő EÜ70 24. ponttal egészül ki:
"EÜ70 24.
TÁMOGATOTT INDIKÁCIÓK:
- Acut coronaria syndromás betegek alcsoportjai (instabil anginás diabetes mellitusos betegek; valamennyi nem ST elevációs infarctuson és ST elevációs infarctuson átesett beteg) közül mindazoknál, akiknél percutan coronaria intervenció és stent beültetés történt, kórelőzményükben stroke vagy transiens ischaemiás attack (TIA) nem szerepel és clopidogrel allergia vagy laboratóriumilag igazolt non-reszponzió fennáll, egy éven keresztül.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ
ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmény | Kardiológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE:12 hónap
ELFOGADHATÓ BNO KÓDOK (beleértve az összes azonosan kezdődő kódot): I20.0-I22.9; Z95.5 Kijelölt intézmények:
| Város | Intézmény neve |
| Balatonfüred | Állami Szívkórház |
| Budapest | Főv. Önk. Bajcsy-Zsilinszky Kórháza |
| Budapest | Semmelweis Egyetem |
| Budapest | Gottsegen György Országos Kardiológiai Intézet |
| Budapest | Honvédkórház - Állami Egészségügyi Központ |
| Budapest | Budai Irgalmasrendi Kórház |
| Debrecen | Debreceni Egyetem, Orvos- és Egészségtudományi Centrum |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Kecskemét | Bács-Kiskun Megyei Önkormányzat Kórháza |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház |
| Nyíregyháza | Nyíregyháza, Jósa András Oktató Kórház Nonprofit Kft. |
| Pécs | Pécsi Tudományegyetem Klinikai Központ |
| Szeged | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
| Székesfehérvár | Fejér Megyei Szent György Kórház |
| Szolnok | Megyei Hetényi Géza Kórház-Rendelőintézet |
| Szombathely | Markusovszky Kórház Zrt. |
| Zalaegerszeg | Zala Megyei Kórház |
12. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" rész EÜ90 4/a. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | írhat" |
sorokkal egészül ki.
13. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" rész EÜ90 4/b. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | írhat" |
sorokkal egészül ki.
14. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" rész EÜ90 4/c. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat" |
sorokkal egészül ki.
15. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" rész EÜ90 4/f. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | írhat" |
sorokkal egészül ki.
16. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" rész EÜ90 13. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | írhat" |
sort követően a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | írhat" |
sorokkal egészül ki.
17. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" rész EÜ90 25. pontja a
| "Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | javasolhat és írhat" |
sort követően a
| "Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet | Ortopédia | javasolhat és írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | javasolhat és írhat" |
sorokkal egészül ki.
18. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" rész EÜ90 29. pontja helyébe a következő rendelkezés lép:
"EÜ90. 29.
TÁMOGATOTT INDIKÁCIÓK:
- Osteoporoticus csigolyatörések szekunder prevenciója céljából, nőknek (a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási protokoll alapján) és férfiaknak, legalább egy típusos osteoporoticus csonttörési eseményt követően, amennyiben a beteg törzsi csontok ásványianyag tartalmának fotonabszorpciós vizsgálatával igazolt BMD értéke -4,0 SD T-score alatti, a megfelelő gyógyszeres kalcium és D-vitamin bevitel (amennyiben nem kontraindikált) biztosításával, legfeljebb 18 hónapig az alkalmazási előírásban meghatározott indikációban
- Osteoporoticus csigolyatörések szekunder prevenciója céljából, nőknek (a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási protokoll alapján) és férfiaknak, legalább két típusos osteoporoticus csonttörési eseményt követően, amennyiben a beteg törzsi csontok ásványianyag tartalmának fotonabszorpciós vizsgálatával igazolt BMD értéke -3,0 SD T-score alatti, a megfelelő gyógyszeres kalcium és D-vitamin bevitel (amennyiben nem kontraindikált) biztosításával, legfeljebb 18 hónapig az alkalmazási előírásban meghatározott indikációban
- Osteoporoticus csigolyatörések szekunder prevenciója céljából nőknek, legalább egy típusos osteoporoticus csonttörési eseményt követően, amennyiben a beteg törzsi csontok ásványianyag tartalmának fotonabszorpciós vizsgálatával igazolt BMD értéke -3,0 SD T-score alatti, és az Eü 70 százalékos támogatási kategória EÜ70 9b/1. vagy EÜ70 9b/2. vagy EÜ70 9b/3. pontjában meghatározott kezelés legalább 12 hónapon át történő alkalmazása eredménytelen (a T-score értéke csökken), vagy a kezeléssel szemben dokumentált intolerancia lép fel, vagy a kezelés ellenjavallt, a megfelelő gyógyszeres kalcium és D-vitamin bevitel (amennyiben nem kontraindikált) további biztosításával, legfeljebb 18 hónapig az alkalmazási előírásban meghatározott indikációban - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási protokoll alapján
- Osteoporoticus csigolyatörések szekunder prevenciója céljából férfiaknak, legalább egy típusos osteoporoticus csonttörési eseményt követően, amennyiben a beteg törzsi csontok ásványianyag tartalmának fotonabszorpciós vizsgálatával igazolt BMD értéke -3,0 SD T-score alatti és az Eü 70 százalékos támogatási kategória 9c/1. pontjában meghatározott kezelés legalább 12 hónapon át történő alkalmazása eredménytelen (a T-score értéke csökken), vagy a kezeléssel szemben dokumentált intolerancia lép fel, vagy a kezelés ellenjavallt, a megfelelő gyógyszeres kalcium és D-vitamin bevitel (amennyiben nem kontraindikált) további biztosításával az alkalmazási előírásban meghatározott indikációban
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ
ELŐÍRÁSOK:
| MUNKAHELY: | JOGOSULTSÁG: | SZAKKÉPESÍTÉS: |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Endokrinológia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Reumatológia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia-traumatológia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Ortopédia | írhat |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Traumatológia | írhat |
| Menopauza és osterporózis járóbeteg szakrendelés | Belgyógyászat | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
M80, M82"
19. Az R1. 3. számú melléklet "Eü 90 százalékos támogatási kategória" része a következő EÜ90 32. ponttal egészül ki:
"EÜ90 32.
TÁMOGATOTT INDIKÁCIÓK:
- Tüneti szerekkel nem befolyásolható, szövettanilag igazolt kollagén colitisben, napi 9 mg-s adagban 8 hétig, hisztológiai vizsgálattal igazolt remisszió esetén a kezelés tovább folytatható tünetektől függően lehetőleg csökkentett adagban (3-6 mg/nap)
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ
ELŐÍRÁSOK:
| Munkahely | Szakképesítés | Jogosultság |
| Járóbeteg szakrendelés/Fekvőbeteg gyógyintézet | Gastroenterológia | írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot): K529"
20. Hatályát veszti a 3. számú melléklet "Eü 90 százalékos támogatási kategória" részének EÜ90 1/f. pontja.
4. melléklet a 47/2011. (VII. 27.) NEFMI rendelethez
1. Az R1. 5. számú melléklet 1.1. pontja felvezető szövegében az "(OGYI) Bizottság)" szövegrész helyébe a "(GYEMSZI)" szöveg lép.
2. Az R1. 5. számú melléklet 1.1. pont a) alpontjában a "minimum 50%-ig terjedő" szövegrész helyébe a "minimum 40%-ig terjedő" szöveg lép.
3. Az R1. 5. számú melléklet 1.1. pont b) alpontjában az "az illetékes szakmai kollégium" szövegrész helyébe az "az egészségügyi szakmai kollégium" szöveg lép.
4. Az R1. 5. számú melléklet 1.2. pont e) alpontjában a "három" szövegrész helyébe a "két" szöveg lép.
5. Hatályát veszti az R1. 5. számú melléklet 1.2. pont b) alpontja.
5. melléklet a 47/2011. (VII. 27.) NEFMI rendelethez
1. Az R3.12. mellékletének 3. pontja helyébe a következő rendelkezés lép:
"3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
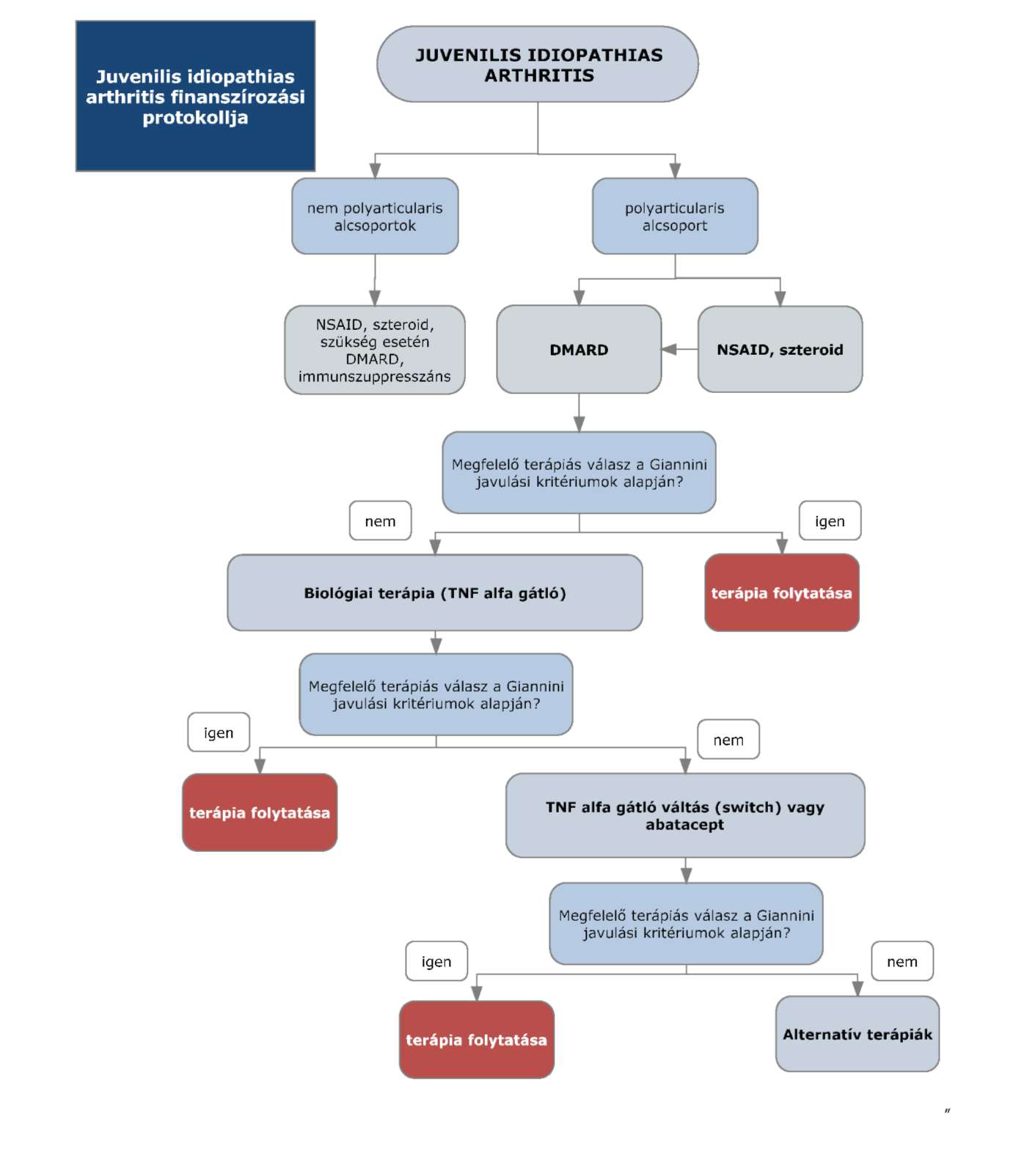
"
2. Az R3. 12. mellékletének 4. pont 4.2. megjelölésű pontja a következő 4.2.5. alponttal egészül ki:
"4.2.5. TNF gátló hatástalanság esetén szelektív immunszuppresszáns terápia (abatacept) (2. és 3. reumatológiai szint: biológiai terápiás centrumok)"
3. Az R3. 12. mellékletének 9. pont 9.2. pontban szereplő táblázat a következő 19. sorral egészül ki:
| 19 | L04AA24 | abatacept | BRMD | Szelektív immunszuppresszánsok |
6. melléklet a 47/2011. (VII. 27.) NEFMI rendelethez
1. Az R3. 16. melléklet 4.5.-4.7. pontok helyébe a következő rendelkezések lépnek és egyidejűleg a következő 4.8.-4.9. pontokkal egészül ki:
"4.5. Denoszumab
A denoszumab használata alternatív lehetőségként jön szóba osteoporoticus csonttörés szekunder prevenciójában, típusos osteoporoticus csonttörést követően, postmenopausás nőbetegeknél, akiknél a törzsi csontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -2,5 SD T-score alatti, amennyiben a biszfoszfonát kezelés ellenjavallt, vagy azzal szemben dokumentált intolerancia lép fel, vagy a legalább 12 hónapon át történő alkalmazása nem volt eredményes (T-score értéke csökken, illetve újabb osteoporoticus törés következik be).
4.6. Teriparatid
4.6.1. A teriparatid humán rekombináns parathormon, erős csontépítő hatása van. Klinikai vizsgálatok szerint mind a csigolyatörések (65%), mind a non-vertebrális törések (53%) relatív kockázatát csökkenti. Fokozott csont-sarcoma kockázata esetén kontraindikált (Paget-kór, korábbi csontbesugárzás, ismeretlen eredetű alkalikus foszfatáz szint emelkedés). Alkalmazása férfiak és postmenopausás nők csontritkulás okozta kóros csonttörésének szekunder prevenciójában egyaránt támogatott. A teriparatid elsőként választható osteoporoticus törések szekunder prevenciójában, amennyiben a törzsi csontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -4,0 SD T-score alatti, egynél több típusos törési esemény esetén pedig már -3,0 SD T-score alatti BMD értéktől alkalmazható. Amennyiben a törzsi csontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -3,0 SD T-score alatti, és egy típusos osteoporoticus törési eseményt szenvedett el a beteg, a teriparatid terápia akkor választható, ha más (biszfoszfonáttal vagy stroncium-raneláttal vagy raloxifennel vagy denoszumabbal végzett) megelőző - legalább 12 hónapon át tartó - kezelés hatástalan, vagy azzal szemben intolerancia lép fel, vagy a kezelés ellenjavallt.
4.6.2. Teriparatid esetén 18 hónapos kezelést támogat az egészségbiztosító.
4.7. Parathyreoid hormon
4.7.1. Fokozott csont-sarcoma kockázata esetén kontraindikált (Paget-kór, korábbi csontbesugárzás, ismeretlen eredetű alkalikus foszfatáz szint emelkedés). Alkalmazása férfiak és postmenopausás nők csontritkulás okozta kóros csonttörésének szekunder prevenciójában egyaránt támogatott. A parathyreoid hormon elsőként választható osteoporoticus törések szekunder prevenciójában, amennyiben a törzsi csontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -4,0 SD T-score alatti, egynél több típusos törési esemény esetén pedig már -3,0 SD T-score alatti BMD értéktől alkalmazható. Amennyiben a törzsi csontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -3,0 SD T-score alatti, és egy típusos osteoporoticus törési eseményt szenvedett el a beteg, a parathyreoid terápia akkor választható, ha más (biszfoszfonáttal vagy stroncium-raneláttal vagy raloxifennel vagy denoszumabbal végzett) megelőző - legalább 12 hónapon át tartó - kezelés hatástalan, vagy azzal szemben intolerancia lép fel, vagy a kezelés ellenjavallt.
4.7.2. Parathyreoid hormon kezelés esetén 18 hónapos kezelést támogat az egészségbiztosító.
4.8. Gyógyszer intolerancia meghatározása
4.8.1. A társadalombiztosítási támogatás szempontjából bármely orális biszfoszfonáttal szembeni intolerancia alatt az olyan, megfelelő kezeléssel nem kontrollálható, folyamatosan fennálló, felső gastrointestinális traktust érintő zavarokat (gyulladás, fekély) kell érteni, amelyek miatt az alkalmazási leirat szerinti szabályos kezelés kivitelezése, vagy a terápia folytatása meghiúsulhat. A gastrointestinális mellékhatás az orális biszfoszfonátok jellemzője. Akiknél az oesophagus rendellenességei vagy egyéb olyan állapotok állnak fenn, melyek a nyelőcső kiürülését késleltetik (például strictura vagy achalasia), továbbá ha a beteg képtelen arra, hogy legalább 30 percig álljon, vagy üljön, azoknál a betegeknél az orális biszfoszfonátokkal való kezelés kontraindikált, helyette parenterális biszfoszfonáttal vagy stroncium-raneláttal vagy denoszumabbal ajánlott a kezelést végezni.
4.8.2. Az orális biszfoszfonátok alkalmazása viszonylag összetett. Nagy pohár (1-2 dl) vízzel kell bevenni, éhgyomorra, függőleges testhelyzetben, ezt követően még minimum 30 percig függőleges testhelyzetben kell maradni, ételt, folyadékot, más gyógyszert, vitamint stb. ezen idő alatt nem fogyaszthat a beteg. Az orális ibandronátot havonta egyszer kell a betegnek bevenni, míg az alendronát és rizedronát esetén heti egyszeri alkalmazás szükséges. Az orális biszfoszfonátok alkalmazása kapcsán levonható a következtetés, hogy az esetek többségében az oesophagitis kivédése az alkalmazási leirat pontos betartásával lehetséges. A beteg terápiában való együttműködése nem csupán az esetlegesen fellépő gyógyszer-mellékhatások függvénye, hanem kiemelt jelentőséggel bír a kezelőorvos részéről a beteg megfelelő tájékoztatása és felkészítése, hogy a kezelés megfelelően kivitelezett és eredményes legyen. 4.9. A kezelés időtartama
4.9.1. A modern terápiás irányelvek szerint elsősorban a magas kockázatú betegek gyógyszeres kezelése preferált, bizonyítottan töréspreventív szerekkel. További alapelv, hogy a kezelést monoterápiában szükséges adni, kalcium és D-vitamin kiegészítéssel. Egyéb gyógyszerkombinációtól nem várható további denzitásnövelés, de a mellékhatások előfordulása gyakoribbá válhat. A kezelés időtartamára vonatkozóan nincs még tudományosan kellően megalapozott, egységes álláspont. A gyógyszeres kezeléstől alapvetően azt várjuk, hogy a csontvesztés üteme lassuljon, megálljon, és ezáltal a csonttörés kockázata csökkenjen.
4.9.2. Az optimális kezelési eredmény az, ha a terápia első 2-3 évében a trabecularis csontdenzitás 7-10%-kal nő, mert ez a törési rizikót felére csökkenti.
4.9.3. Vizsgálatok szerint már 12 hónapos alendronát kezelés statisztikailag szignifikáns javulást eredményezett a betegek állapotában. Ennél rövidebb kezelési időszak alatt a terápia hatásosságát megítélni nem lehet. Kontrollált vizsgálatok szerint tízéves alendronát kezelés során a csontsűrűség-nyereség megközelítette a 15%-ot. Más vizsgálatok arra világítottak rá, hogy a csípőtörések gyakorisága nem nőtt azoknál a nőknél, akik 5 éves alendronát kezelés után 5 évig placebót szedtek, azokhoz képest, akik 10 éves alendronát kezelésben részesültek, de a csigolyatörések gyakorisága nőtt. A 80 év feletti női populációban pedig megkérdőjeleződött a gyógyszerek hatásossága."
2. Az R3.16. melléklet 5. pontja helyébe a következő rendelkezés lép:
"5. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
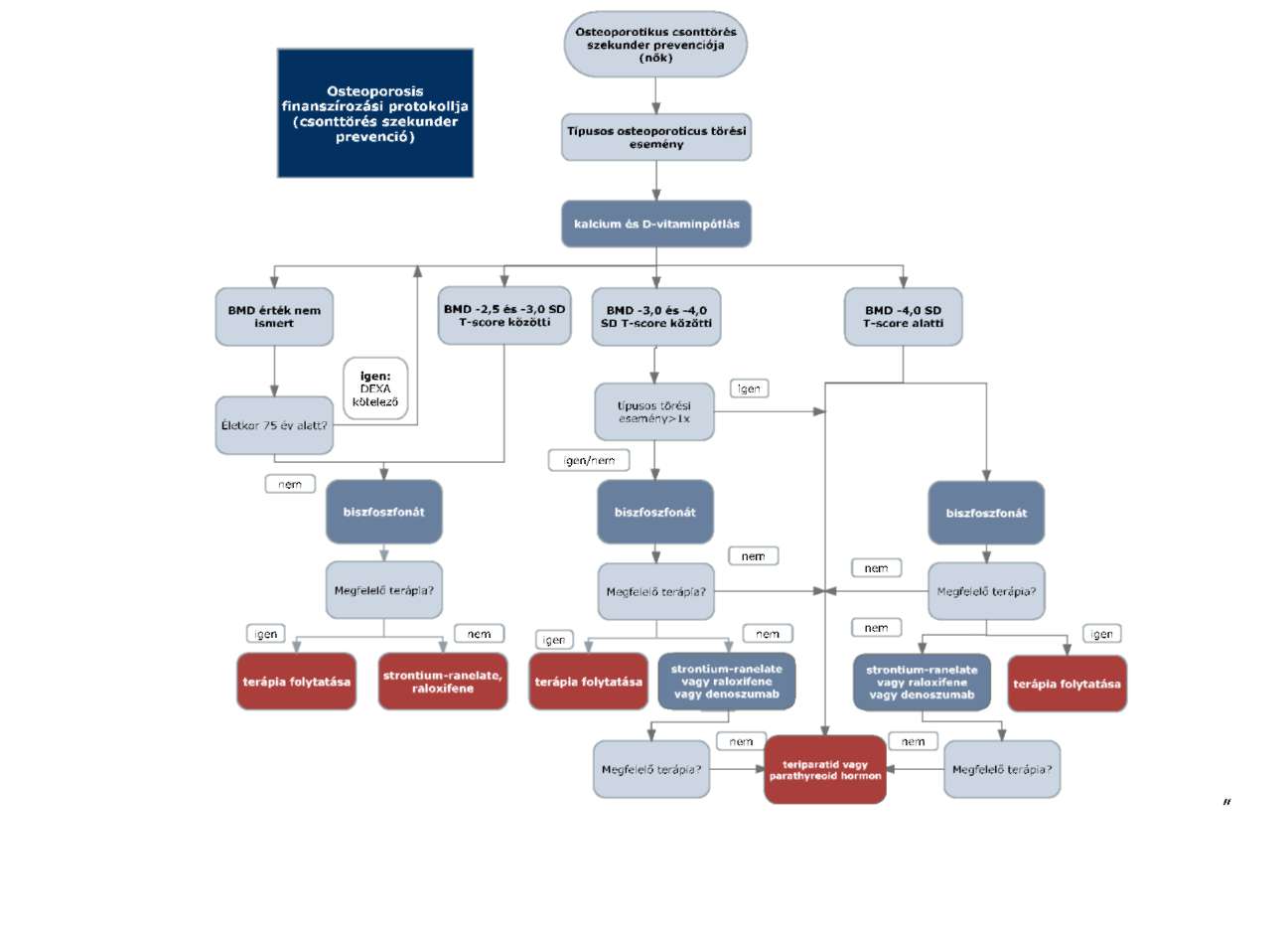
3. Az R3. 16. melléklet 7. pont 7.3. alpont szerinti táblázat 13-14. pontjai helyébe a következő rendelkezés lép, és egyidejűleg a következő 15-16. sorokkal egészül ki:
| 13 | M05BX04 | Denoszumab |
| 14 | G03XC01 | Raloxifen |
| 15 | H05AA02 | Teriparatid |
| 16 | H05AA03 | Parathyreoid hormon |


