32011D0884[1]
2011/884/EU: A Bizottság végrehajtási határozata ( 2011. december 22. ) a Kínából származó rizstermékekben előforduló, nem engedélyezett, géntechnológiával módosított rizsre vonatkozó szükségintézkedésekről és a 2008/289/EK határozat hatályon kívül helyezéséről
A BIZOTTSÁG VÉGREHAJTÁSI HATÁROZATA
(2011. december 22.)
a Kínából származó rizstermékekben előforduló, nem engedélyezett, géntechnológiával módosított rizsre vonatkozó szükségintézkedésekről és a 2008/289/EK határozat hatályon kívül helyezéséről
(EGT-vonatkozású szöveg)
(2011/884/EU)
AZ EURÓPAI BIZOTTSÁG,
tekintettel az Európai Unió működéséről szóló szerződésre,
tekintettel az élelmiszerjog általános elveiről és követelményeiről, az Európai Élelmiszer-biztonsági Hatóság létrehozásáról és az élelmiszerbiztonságra vonatkozó eljárások megállapításáról szóló, 2002. január 28-i 178/2002/EK európai parlamenti és tanácsi rendeletre ( 1 ) és különösen annak 53. cikke (1) bekezdésére,
mivel:
(1) A géntechnológiával módosított élelmiszerekről és takarmányokról szóló, 2003. szeptember 22-i 1829/2003/EK európai parlamenti és tanácsi rendelet ( 2 ) 4. cikkének (2) bekezdése és 16. cikkének (2) bekezdése arról rendelkezik, hogy géntechnológiával módosított élelmiszer vagy takarmány nem hozható forgalomba az Unió piacán az említett rendeletnek megfelelően megadott engedély nélkül. Szintén e rendelet 4. cikkének (3) bekezdése és 16. cikkének (3) bekezdése írja elő, hogy géntechnológiával módosított élelmiszert vagy takarmányt csak akkor lehet engedélyezni, ha kérelmezője megfelelő és kielégítő mértékben bizonyította, hogy a termék nem gyakorol kedvezőtlen hatást az emberi egészségre, az állati egészségre vagy a környezetre, nem téveszti meg a fogyasztót vagy a felhasználót, és nem különbözik a helyettesíteni kívánt élelmiszertől vagy takarmánytól olyan mértékben, hogy normál fogyasztása táplálkozási szempontból káros legyen az emberre vagy állatra nézve.
(2) 2006 szeptemberében Kínából származó vagy onnan feladott, nem engedélyezett, géntechnológiával módosított "Bt 63" rizzsel szennyezett rizskészítményeket találtak az Egyesült Királyságban, Franciaországban és Németországban, és erről értesítették az élelmiszer- és takarmánybiztonsági riasztási rendszert (RASFF-rendszer). Annak ellenére, hogy a kínai hatóságok az említett, géntechnológiával módosított szervezet (GMO) jelenlétének ellenőrzését célzó intézkedéseket jelentettek be, a továbbiakban is több, a géntechnológiával módosított "Bt 63" rizs jelenlétére vonatkozó riasztást jelentettek.
(3) Tekintettel a riasztások folytatódására és a Kínából származó vagy ott feladott termékekben a nem engedélyezett, géntechnológiával módosított "Bt 63" rizs előfordulásának kizárására vonatkozó, megfelelő garanciák biztosításának hiányára a kínai hatóságok részéről, elfogadták a 2008/289/EK bizottsági határozatot ( 3 ), amely sürgősségi intézkedéseket vezetett be a nem engedélyezett "Bt 63" GMO rizstermékekben való előfordulására vonatkozóan. Az említett határozat előírja, hogy forgalomba hozatalt megelőzően a gazdasági szereplők az érintett tagállam illetékes hatóságának olyan analitikai jelentést nyújtsanak be, amely bizonyítja, hogy a rizsszállítmány nem szennyeződött géntechnológiával módosított "Bt 63" rizzsel. Emellett az említett határozat arról is rendelkezett, hogy a tagállamoknak megfelelő intézkedéseket kell tenniük, szúrópróbaszerű mintavételt és olyan vizsgálatot is beleértve, amelyet az ott leírt specifikus módszer szerint végeznek el a behozatalra bemutatott vagy már forgalomba hozott termékek vonatkozásában.
(4) 2010 márciusában Németország értesítette az RASFF-rendszert a "Kefeng 6" nevű GMO-hoz hasonló tulajdonságú, rovarokkal szembeni ellenállóképességet kódoló, nem engedélyezett genetikus elemeket tartalmazó új rizsfajták jelenlétéről. Ezt követően több hasonló bejelentés érkezett, és ezek a "Kefeng 6" mellett más, rovarokkal szemben rezisztens rizsfajta jelenlétére vonatkoztak, amely a "Kemingdao 1" (a továbbiakban: KMD1) GMO-hoz hasonló genetikai elemeket tartalmaztak. A "Kefeng 6" és a KMD1 sem az Unióban, sem Kínában nem engedélyezett.
(5) Az RASFF-rendszernek küldött valamennyi bejelentésről értesítették az érintett kínai hatóságokat, továbbá a Bizottság 2010 júniusában és 2011 februárjában írt a hatóságoknak, a növekvő számú bejelentések kezelésére irányuló intézkedést sürgetve.
(6) Az Élelmiszerügyi és Állategészségügyi Hivatal 2008 októberében Kínában vizsgálatot folytatott a 2008/289/EK határozat végrehajtásának értékelése céljából, majd ezt 2011 márciusában újabb ellenőrző látogatás követte. A 2008. évi ellenőrző látogatás következtetései és a 2011. évi ellenőrző látogatás első megállapításai bizonytalanságot jeleztek azzal kapcsolatban, hogy a Kínából származó vagy ott feladott rizstermékeket milyen mértékben szennyezhették géntechnológiával módosított rizsfajták, melyek a szennyező fajták, illetve hányfajta, géntechnológiával módosított rizs szennyezte a termékeket, és arra a következtetésre jutottak, hogy ezért nagy a kockázata annak, hogy az ilyen rizstermékekben továbbra is előfordulhatnak nem engedélyezett GMO-k.
(7) Az Élelmiszerügyi és Állategészségügyi Hivatal 2008. és 2011. évi ellenőrző látogatásai megállapításait és a nem engedélyezett, géntechnológiával módosított rizzsel kapcsolatos eseményekre vonatkozó RASFF-bejelentések számát figyelembe véve a 2008/289/EK határozatban előírt intézkedéseket megfelelően meg kell erősíteni annak megakadályozása céljából, hogy szennyezett termék kerüljön az uniós piacra. Ezért e határozattal fel kell váltani a 2008/289/EK határozatot.
(8) Figyelembe véve azt a tényt, hogy az Unóban semmilyen, géntechnológiával módosított rizsterméket nem engedélyeznek, helyénvaló kiterjeszteni a 2008/289/EK határozatban előírt intézkedések hatályát - amely a "Bt 63", géntechnológiával módosított rizsre korlátozódik - a Kínából származó vagy ott feladott rizstermékekben talált valamennyi, géntechnológiával módosított szervezetre. Fenn kell tartani a 2008/289/EK határozattal létrehozott, a mintavételre és az elemzésre vonatkozó, azt bizonyító analitikai jelentés benyújtásával kapcsolatos kötelezettséget, hogy a termék nem tartalmaz géntechnológiával módosított rizst. Ugyanakkor helyénvaló megerősíteni a tagállami ellenőrzéseket gyakoribb mintavétellel és elemzéssel, amelynek a Kínából származó rizstermékek szállítmányának 100 %-ára ki kell terjednie, továbbá az élelmiszer- és takarmányipari vállalkozók számára be kell vezetni azt a kötelezettséget, hogy a szállítmány fizikai megérkezésére vonatkozóan előzetesen jelentsék annak várható napját, időpontját és helyét.
(9) A mintavételi módszerek kulcsfontosságú szerepet játszanak a reprezentatív és összehasonlítható eredmények elérésében; ennélfogva helyénvaló a mintavétel és az elemzés közös protokolljának kidolgozása annak igazolására, hogy az adott termék nem tartalmaz géntechnológiával módosított rizst. Az ömlesztett mezőgazdasági termékekre vonatkozó mintavételi eljárások elveit az 1830/2003/EK rendelettel összefüggésben a géntechnológiával módosított szervezetek és a géntechnológiával módosított szervezetekből előállított anyagok vagy ezen termékekből történő mintavételre és kimutatásra vonatkozó technikai iránymutatásról szóló, 2004. október 4-i 2004/787/EK bizottsági ajánlás ( 4 ) tartalmazza, előrecsomagolt élelmiszer esetében pedig a CEN/TS 15568 vagy azzal egyenértékű szabványok. A takarmányok vonatkozásában ezeket az elveket a takarmányok hatósági ellenőrzése során alkalmazott mintavételi és vizsgálati módszerek megállapításáról szóló, 2009. január 27-i 152/2009/EK bizottsági rendelet ( 5 ) tartalmazza.
(10) A potenciálisan géntechnológiával módosított rizs előfordulási gyakoriságára, a validált kimutatási módszerek és a megfelelő minőségű és mennyiségű kontrollminták hiányára tekintettel, valamint az ellenőrzések elősegítése érdekében helyénvaló a 2008/289/EK határozatban előírt mintavételi és vizsgálati módszer helyett a II. mellékletben szereplő vizsgálati szűrési módszereket alkalmazni.
(11) A javasolt új vizsgálati szűrési módszereknek a 2004/787/EK ajánláson kell alapulniuk. Mindenekelőtt figyelembe kell venni azt, hogy a jelenleg elérhető módszerek minőségi jellegűek, továbbá egy nem engedélyezett GMO kimutatását célozzák, amelyre mintavétel és vizsgálat tekintetében nem vonatkozik megengedett határérték.
(12) A Közös Kutatóközponton belül működő, a géntechnológiával módosított élelmiszereket és takarmányokat vizsgáló európai referencialaboratórium (EU-RL GMFF) megvizsgálta és megerősítette a géntechnológiával módosított rizs kimutatására javasolt szűrőmódszerek alkalmasságát.
(13) A nem engedélyezett rizst tartalmazó termékek forgalomba hozatalának megakadályozásához szükséges mintavétel és kimutatás céljából szükséges, hogy mind a gazdasági szereplők, mind a hatósági szolgálatok kövessék a II. mellékletben bemutatott mintavételi és vizsgálati módszereket. Mindenekelőtt fontos, hogy figyelembe vegyék az e módszerek alkalmazásával kapcsolatban a géntechnológiával módosított élelmiszereket és takarmányokat vizsgáló európai referencialaboratórium által nyújtott iránymutatást.
(14) Az I. mellékletben felsorolt, Kínából származó vagy ott feladott rizstermékek csak akkor bocsáthatók szabad forgalomba, ha azokat a Kínai Népköztársaság Behozatali-Kiviteli Vizsgálati és Karanténhivatala (AQSIQ) által az e határozat III. és IV. mellékletében meghatározott mintáknak megfelelően kiállított vizsgálati jelentés és egészségügyi bizonyítvány kíséri.
(15) Az ellenőrző intézkedések folyamatos értékelésének biztosítása érdekében helyénvaló bevezetni a tagállamok számára azt a kötelezettséget, hogy rendszeresen jelentést tegyenek a Bizottságnak a Kínából származó vagy ott feladott rizstermékek szállítmányaira vonatkozó hatósági ellenőrzésekkel kapcsolatban.
(16) Az e határozatban előírt intézkedéseknek arányosaknak kell lenniük, csak a feltétlenül szükséges mértékben korlátozhatják a kereskedelmet, és az intézkedések csak a Kínából származó vagy ott feladott olyan termékekre vonatkozhatnak, amelyek esetében valószínűsíthető, hogy nem engedélyezett, géntechnológiával módosított rizzsel szennyeződtek. Mivel azon termékek skálája, amelyek nem engedélyezett, géntechnológiával módosított rizzsel szennyeződhettek, igen széles, az intézkedéseket helyénvaló valamennyi olyan élelmiszerre és takarmányra kiterjeszteni, amelyek összetevőik közt rizst tartalmaznak. Ugyanakkor néhány termék esetében előfordulhat az is, hogy tartalmaznak rizst, van rizsösszetevőjük, vagy rizsből készülnek, de az is, hogy nem. Ezért célszerűnek tűnik annak lehetővé tétele, hogy a gazdasági szereplők egyszerű nyilatkozatot adhassanak ki arra vonatkozóan, hogy a termék nem tartalmaz rizst, illetve nem rizsből áll vagy nem abból készült, és ezáltal elkerülhetővé válik a kötelező vizsgálat és igazolás.
(17) A rizstermékek nem engedélyezett, géntechnológiával módosított rizzsel való szennyezettségére vonatkozó helyzetét hat hónapon belül felül kell vizsgálni annak értékelésére, hogy az e határozat által előírt intézkedések továbbra is szükségesek-e.
(18) Az e határozatban előírt intézkedések összhangban vannak az Élelmiszerlánc- és Állategészségügyi Állandó Bizottság véleményével,
ELFOGADTA EZT A HATÁROZATOT:
1. cikk
Hatály
(1) Ez a határozat az I. mellékletben felsorolt, Kínából származó vagy ott feladott termékekre vonatkozik.
(2) A tagállamok e határozat II. mellékletével összhangban szúrópróbaszerű fizikai ellenőrzéseket végezhetnek a Kínából származó vagy ott feladott, az (1) bekezdésben nem említett olyan élelmiszereken és takarmányokon, amelyek rizst tartalmazhatnak, rizs összetevőjük lehet, vagy rizsből készültek, hogy biztosítsák az 1829/2003/EK rendelet 4. cikke (3) bekezdésének és 16. cikke (3) bekezdésének való megfelelést.
(3) Ez a határozat nem alkalmazandó az (1) bekezdésben említett olyan élelmiszerek és takarmányok szállítmányaira, amelyeket magánszemély általi kizárólagos fogyasztásra és használatra szántak. Kétség esetén a bizonyítási kötelezettség a szállítmány címzettjét terheli.
2. cikk
Fogalommeghatározások
(1) E határozat alkalmazásában a 178/2002/EK rendelet 2. és 3. cikkében, a takarmány- és élelmiszerjog, valamint az állat-egészségügyi és az állatok kíméletére vonatkozó szabályok követelményeinek történő megfelelés ellenőrzésének biztosítása céljából végrehajtott hatósági ellenőrzésekről szóló, 2004. április 29-i 882/2004/EK európai parlamenti és tanácsi rendelet ( 6 ) 2. cikkében, valamint bizonyos nem állati eredetű takarmányok és élelmiszerek behozatalára vonatkozó fokozott hatósági ellenőrzésekről szóló 669/2009/EK bizottsági rendelet ( 7 ) 3. cikkének b) és c) pontjában szereplő fogalommeghatározások alkalmazandók.
(2) E határozat alkalmazásában továbbá:
a) tétel : elkülöníthető és pontosan meghatározott anyagmennyiség;
b) egyedi minta : a tétel teljes mélységében az egyes külön mintavételi pontokon (statikus mintavétel) vagy a termékáramból egy meghatározott időszak alatt (ömlesztettáru-mintavétel) vett kis, egyforma termékmennyiség;
c) nyers minta : az egy adott tételből vett egyedi minták egyesítése és összekeverése által nyert mennyiség;
d) laboratóriumi minta : a nyers mintából laboratóriumi ellenőrzés és vizsgálat céljára kivett mennyiség;
e) analitikai minta : homogenizált laboratóriumi minta, amely vagy az egész laboratóriumi mintából, vagy pedig annak egy reprezentatív részéből áll.
3. cikk
Előzetes értesítés
(1) A takarmány- és élelmiszer-ipari vállalkozók vagy képviselőik előzetes értesítést küldenek a szállítmány kijelölt beléptetési helyre történő fizikai megérkezésének várható napjáról és időpontjáról, valamint a szállítmány jellegéről az állat-egészségügyi határállomáson vagy a kijelölt beléptetési ponton működő illetékes hatóságoknak. Az említett gazdasági szereplőknek a termék rendeltetését (élelmiszer vagy takarmány) is fel kell tüntetniük.
(2) Az érintett gazdasági szereplő az értesítés céljából kitölti a 669/2009/EK rendelet II. mellékletében található közös beléptetési okmány, vagy a 136/2004/EK bizottsági rendelet ( 8 ) 2. cikkében előírt közös állat-egészségügyi beléptetési okmány megfelelő részeit, és azt a szállítmány fizikai megérkezése előtt legalább egy munkanappal eljuttatja - értelemszerűen - vagy az állat-egészségügyi határállomáson vagy a kijelölt beléptetési ponton működő illetékes hatóságoknak.
(3) Az (1) és (2) bekezdés nem alkalmazandó az I. mellékletben említett olyan termékekre, amelyek nem tartalmaznak rizst, nincs rizs összetevőjük, illetve nem abból készültek.
4. cikk
Behozatali feltételek
(1) Minden egyes, az 1. cikkben említett szállítmányt minden egyes tétel esetében vizsgálati jelentés, valamint a III. és IV. mellékletben található mintáknak megfelelő, a Kínai Népköztársaság Behozatali-Kiviteli Vizsgálati és Karanténhivatala (AQSIQ) meghatalmazott képviselője által kitöltött, aláírt és ellenőrzött egészségügyi bizonyítvány kísér. A vizsgálati jelentést és az egészségügyi bizonyítványt az importáló tagállam valamely hivatalos nyelvén vagy olyan más nyelven kell kiállítani, amelyet az érintett tagállam illetékes hatóságai elfogadnak.
(2) Amennyiben az I. mellékletben említett termék nem tartalmaz rizst, nincs ilyen összetevője, illetve nem abból készült, akkor a vizsgálati jelentést és az egészségügyi bizonyítványt felválthatja a szállítmányért felelős takarmány- és élelmiszer-ipari vállalkozótól származó nyilatkozat, amelyben a vállalkozó igazolja, hogy az élelmiszer, illetve a takarmány nem tartalmaz rizst, nincs ilyen összetevője, illetve nem abból készült. Ezt a nyilatkozatot az importáló tagállam valamely hivatalos nyelvén vagy olyan más nyelven kell kiállítani, amelyet az érintett tagállam illetékes hatóságai elfogadnak.
(3) Az (1) bekezdésben említett vizsgálati jelentés céljára végzett mintavételt és vizsgálatot a II. mellékletnek megfelelően kell elvégezni.
(4) Az egyes szállítmányokat az egészségügyi bizonyítványon feltüntetett kóddal azonosítják. A szállítmányban lévő minden egyes zsákot vagy egyéb csomagolási formát ezzel a kóddal kell azonosítani.
5. cikk
Hatósági ellenőrzések
(1) A 4. cikkben előírt behozatali feltételek teljesítésének szavatolása érdekében az 1. cikkben említett termékek minden egyes szállítmányával kapcsolatos okmányok ellenőrzését el kell végezni.
(2) Ha a 4. cikk (2) bekezdésében említettektől eltérő termékek szállítmányát nem kíséri a 4. cikkben előírt egészségügyi bizonyítvány és vizsgálati jelentés, a szállítmányt vissza kell küldeni a származási országba, vagy meg kell semmisíteni.
(3) Ha a szállítmányt a 4. cikkben előírt bizonyítványminta és vizsgálati jelentés kíséri, az illetékes hatóság a II. mellékletnek megfelelően 100 %-os gyakorisággal mintát vesz vizsgálat céljára a nem engedélyezett GMO előfordulásának kimutatása érdekében. Amennyiben a szállítmány több tételből áll, minden egyes tételt mintavételnek és vizsgálatnak kell alávetni.
(4) Az illetékes hatóság a fizikai ellenőrzés eredményének rendelkezésre állását megelőzően is engedélyezheti a szállítmány továbbszállítását. Ebben az esetben a szállítmány a fizikai ellenőrzés eredményének rendelkezésre állásáig az illetékes hatóság folyamatos felügyelete alatt marad.
(5) Az (1)-(4) bekezdésben meghatározott ellenőrzések befejezése után az illetékes hatóság:
a) kitölti a közös beléptetési okmány 2. részének megfelelő részeit, vagy - ha alkalmazandó - a közös állat-egészségügyi beléptetési okmányt; és az illetékes hatóság felelős tisztviselője lepecsételi és aláírja az okmány eredeti példányát;
A közös beléptetési okmány, illetve adott esetben a közös állat-egészségügyi beléptetési okmány kitöltésére csak a (3) bekezdésben említett vizsgálat eredményének rendelkezésére állását követően kerülhet sor.
b) másolatot készít a közös beléptetési okmány, illetve adott esetben a közös állat-egészségügyi beléptetési okmány aláírt és lepecsételt példányából, és azt megőrzi.
A közös beléptetési okmány, illetve adott esetben a közös állat-egészségügyi beléptetési okmány a szállítmány kísérő okmányai közé tartozik, amíg a szállítmány az említett okmányokban megjelölt végcéljához meg nem érkezik.
(6) A szállítmányok szabad forgalomba bocsátása csak akkor lehetséges, ha a II. mellékletnek megfelelően elvégzett mintavételt és vizsgálatokat követően az érintett szállítmány valamennyi tétele az uniós jogszabályoknak megfelelőnek tekinthető. Ugyanez érvényes az 1. cikk (2) bekezdése szerinti szúrópróba-vizsgálatnak alávetett szállítmányokra is.
6. cikk
Jelentéstétel a Bizottságnak
(1) A tagállamok háromhavonta jelentést készítenek, amelyben beszámolnak az előző három hónapban az 1. cikkben említett termékek szállítmányain elvégzett összes analitikai vizsgálat eredményeiről.
Ezeket a jelentéseket az adott három hónapos időszakot követő hónapban - áprilisban, júliusban, októberben és januárban - kell benyújtani a Bizottságnak.
(2) A jelentésnek tartalmaznia kell a következőket:
a) a vizsgálathoz szükséges mintavételbe bevont szállítmányok száma;
b) az 5. cikkben előírt ellenőrzések eredménye;
c) az egészségügyi bizonyítvány vagy vizsgálati jelentés hiánya miatt elutasított szállítmányok száma.
7. cikk
A szállítmány részekre bontása
A szállítmányok nem bonthatók részekre mindaddig, amíg az illetékes hatóságok nem végezték el a hatósági ellenőrzést.
Amennyiben a hatósági ellenőrzést követően a szállítmányt részekre bontják, a szállítmány minden egyes megbontott részét az egészségügyi bizonyítvány és a vizsgálati jelentés hiteles másolatának kell kísérnie.
8. cikk
Költségek
Minden, a hatósági ellenőrzésből fakadó költséget - beleértve a mintavételt, analízist, tárolást és a megfelelés hiánya következtében hozott intézkedéseket - a takarmány- és élelmiszer-ipari vállalkozó visel.
9. cikk
Átmeneti rendelkezések
A tagállamok az I. mellékletben felsorolt és a Kombinált Nómenklatúra szerinti 1905 90 60, 1905 90 90 és 2103 90 90 kódnak megfelelő termékek kivételével 2013. augusztus 5-ig engedélyezik az 1. cikk (1) bekezdésében említett termékekből álló olyan szállítmányok behozatalát, amelyek fizikai belépése az Unió területére 2013. július 4. előtt történt meg, még abban az esetben is, ha a közös beléptetési okmányt nem adták át az illetékes hatóságnak a 3. cikk (2) bekezdésében előírtaknak megfelelően legalább egy munkanappal a szállítmány fizikai beérkezése előtt, amennyiben az érintett szállítmányok megfelelnek a 3. cikkben részletezett egyéb követelményeknek.
A tagállamok 2013. október 5-ig engedélyezik az I. mellékletben felsorolt és a Kombinált Nómenklatúra szerinti 1905 90 60, 1905 90 90 és 2103 90 90 kódnak megfelelő termékek azon szállítmányainak behozatalát, amelyek nem felelnek meg a 3. és 4. cikkben előírt feltételeknek, amennyiben az illetékes hatóság elvégezte az 5. cikk (3) bekezdésében előírt mintavételeket és elemzéseket.
10. cikk
Az intézkedés felülvizsgálata
Az e határozatban foglalt intézkedéseket rendszeresen felül kell vizsgálni, szükség esetén figyelembe véve a Kínából származó vagy ott feladott termékekben megtalálható nem engedélyezett GMO-kkal kapcsolatos új fejleményeket, illetve a határozatban említett mintavételi és elemzési módszerekkel kapcsolatos tudományos és technikai fejlődést.
11. cikk
Hatályon kívül helyezés
A 2008/289/EK határozat hatályát veszti.
A hatályon kívül helyezett határozatra történő hivatkozást az e határozatra történő hivatkozásként kell értelmezni.
12. cikk
Hatálybalépés
Ez a határozat az Európai Unió Hivatalos Lapjában történő kihirdetését követő huszadik napon lép hatályba.
I. MELLÉKLET
TERMÉKLISTA
| Termék | KN-kód |
| Hántolatlan nyers rizs | 1006 10 |
| Előmunkált (barna) rizs | 1006 20 |
| Félig vagy teljesen hántolt rizs polírozva vagy fényezve is | 1006 30 |
| Törmelék rizs | 1006 40 00 |
| Rizsliszt | 1102 90 50 |
| Durva őrlemény és dara rizsből | 1103 19 50 |
| Labdacs (pellet) rizsből | 1103 20 50 |
| Pelyhesített rizs | 1104 19 91 |
| Lapított vagy pelyhesített gabonaféle (zab, búza, rozs, kukorica, árpa és pelyhesített rizs kivételével) | 1104 19 99 |
| Rizskeményítő | 1108 19 10 |
| Élelmiszer-készítmény gyermekek számára, a kiskereskedelemben szokásos módon kiszerelve | 1901 10 00 |
| Nem főtt tészta, nem töltve vagy másképp nem elkészítve, tojástartalommal | 1902 11 00 |
| Nem főtt tészta, nem töltve vagy másképp nem elkészítve, tojástartalom nélkül | 1902 19 |
| Töltött tészta főzve vagy másképp elkészítve is | 1902 20 |
| Egyéb tészta (a „nem főtt tészta, nem töltve vagy másképp nem elkészítve” és a „töltött tészta főzve vagy másképp elkészítve is” termékeken kívüli tészta) | 1902 30 |
| Gabonából vagy gabonatermékekből puffasztással vagy pirítással előállított, elkészített élelmiszer rizsből | 1904 10 30 |
| Pirítatlan gabonapehely alapú, müzli típusú készítmény | 1904 20 10 |
| Pirítatlan gabonapehelyből vagy pirítatlan és pirított gabonapehely vagy puffasztott gabona keverékéből előállított élelmiszer rizsből (a pirítatlan gabonapehely alapú, müzli típusú készítmény kivételével) | 1904 20 95 |
| Másutt nem említett, előfőzött vagy másképp elkészített rizs (a liszt, a dara és a durva őrlemény, valamint a puffasztással vagy pirítással előállított élelmiszer vagy a pirítatlan gabonapehelyből vagy pirítatlan és pirított gabonapehely vagy puffasztott gabona keverékéből előállított élelmiszer kivételével) | 1904 90 10 |
| Rizspapír | korábbi 1905 90 20 |
| Keksz (biscuit) | 1905 90 45 |
| Extrudált vagy puffasztott termék, ízesített vagy sózott | 1905 90 55 |
| Extrudált vagy puffasztott termék, édesített (pl. gyümölcstorta, mazsolás kalács, panettone, habcsók, gyümölcskenyér, croissant és egyéb pékáruk) | 1905 90 60 |
| Extrudált vagy puffasztott termék, nem édesített, nem ízesített és nem sózott (pl. pizza, quiche és egyéb nem édesített pékáruk) | 1905 90 90 |
| Mártás (szósz) és egyéb készítmény; ételízesítő keverék | 2103 90 90 |
| A rizs szitálásából, őrléséből vagy egyéb megmunkálása során keletkező korpa, korpás liszt és más maradék, labdacs (pellet) alakban, legfeljebb 35 tömegszázalék keményítőtartalommal | 2302 40 02 |
| A rizs szitálásából, őrléséből vagy egyéb megmunkálása során keletkező korpa, korpás liszt és más maradék, labdacs (pellet) alakban, a legfeljebb 35 tömegszázalék keményítőtartalommal rendelkező rizs kivételével | 2302 40 08 |
II. MELLÉKLET
Mintavételi és analitikai módszerek a Kínából származó rizstermékekben előforduló nem engedélyezett, géntechnológiával módosított szervezetekre vonatkozó hatósági ellenőrzéshez
1. Általános rendelkezések
Az annak a hatósági ellenőrzésére szánt mintákat, hogy a rizstermékek nem tartalmaznak géntechnológiával módosított szervezetet, az e mellékletben ismertetett módszerek szerint kell vételezni. Az így vételezett nyers mintákat reprezentatívnak kell tekinteni a mintavétel forrásául szolgáló tételekre nézve.
2. Mintavétel
2.1. Ömlesztett árutételek mintavétele és az analitikai minta elkészítése
A nyers minták összeállításához és az analitikai minták elkészítéséhez szükséges egyedi minták számát a 2004/787/EK ajánlásnak és a 152/2009/EK rendeletnek megfelelően kell meghatározni. A laboratóriumi minta nagysága 2,5 kg, de feldolgozott élelmiszer vagy takarmány esetében 500 g-ra csökkenthető. A 882/2004/EK rendelet 11. cikke (5) bekezdésének alkalmazásában a nyers mintából második laboratóriumi mintát kell összeállítani.
2.2. Mintavétel előrecsomagolt élelmiszer és takarmány esetében
A nyers minták összeállításához és az analitikai minták elkészítéséhez szükséges egyedi minták számát a CEN/TS 15568:2007 szabványnak vagy azzal egyenértékű előírásnak megfelelően kell meghatározni. A laboratóriumi minta nagysága 2,5 kg, de feldolgozott élelmiszer vagy takarmány esetében 500 g-ra csökkenthető. A 882/2004/EK rendelet 11. cikke (5) bekezdésének alkalmazásában a nyers mintából második laboratóriumi mintát kell összeállítani.
3. A laboratóriumi minta elemzése
A származási helyen végzett laboratóriumi vizsgálatot kijelölt AQSIQ-laboratóriumban kell végezni, valamint az Unióban történő szabad forgalomba bocsátást megelőzően egy, az adott tagállam által kijelölt hatósági ellenőrző laboratóriumban. A szűrővizsgálatokat valós idejű PCR-alapú módszerrel kell elvégezni a géntechnológiával módosított élelmiszereket és takarmányokat vizsgáló európai referencialaboratórium ( 9 ) által közzétett módszer szerint legalább az alábbi genetikai elemek tekintetében: CAMV (karfiol-mozaikvírus) 35S promótere, az Agrobacterium tumefaciens NOS (nopalin-szintáz) génterminátora és a Bacillus thuringiensisból származó CryIAb, CryIAc és/vagy CryIAb/CryIAc manipulált formái.
Rizsszemminták esetében a kijelölt ellenőrző laboratórium a homogenizált laboratóriumi mintából négy, egyenként 240 gramm (10 000 rizsszemnek megfelelő) mennyiségű vizsgálati mintát vesz. A négy analitikai mintát meg kell őrölni, és külön tovább kell elemezni. Minden egyes vizsgálati minta esetében két extrakciót kell végezni. Minden egyes extrakció esetében minden, géntechnológiával módosított genetikai elem vonatkozásában el kell végezni egy PCR-vizsgálatot az alábbi 4. pontban ismertetett szűrési módszereknek megfelelően.
A feldolgozott élelmiszerek (pl. liszt, tésztafélék vagy keményítő) esetében a homogenizált laboratóriumi mintából 125 g mennyiségű vizsgálati minta készíthető. Ezt az analitikai mintát meg kell őrölni, a mintából két extrakciót kell venni, és minden egyes extrakció esetében minden, géntechnológiával módosított genetikai elem vonatkozásában el kell végezni egy PCR-vizsgálatot a 4. pontban ismertetett szűrési módszereknek megfelelően.
A szállítmány nem megfelelőnek minősül, ha a géntechnológiával módosított szervezeteket vizsgáló európai referencialaboratórium elentésében szereplő iránymutatások alapján a szállítmány legalább egy analitikai mintájában legalább egy, géntechnológiával módosított genetikai elem kimutatható.
4. A következő vizsgálati módszerek alkalmazására kerül sor:
a) a CAMV (karfiol-mozaikvírus) 35S promótere és az Agrobacterium tumefaciens NOS (nopalin-szintáz) génterminátora szűrésére:
ISO 21570: 2005 Analitikai módszerek a géntechnológiával módosított szervezetek és az ezeket tartalmazó termékek kimutatására. Nukleinsav-alapú kvantitatív módszerek, B1. melléklet;
H.-U. Waiblinger et al., (2008) "Validation and collaborative study of a P35S and T-nos duplex real-time screening method to detect genetically modified organisms in food products" Eur. Food Res. and Technol., 226. kötet, 1221-1228. o.;
E. Barbau-Piednoir et al., (2010) "SYBR®Green qPCR screening methods for the presence of »35S promoter« and »NOS terminator« elements in food and feed products" Eur. Food Res. and Technol., 230. kötet, 383-393. o.; - Reiting R, Broll H, Waiblinger HU, Grohmann L (2007), "Collaborative study of a T-nos real-time PCR method for screening of genetically modified organisms in food products" J Verbr Lebensm 2:116-121. o.;
b) A Bacillus thuringiensisból származó CryIAb, CryIAc és/vagy CryIAb/CryIAc manipulált formái szűrésére:
E. Barbau-Piednoir et al., (in press) "Four new SYBR®Green qPCR screening methods for the detection of Roundup Ready®, LibertyLink® and CryIAb traits in genetically modified products" Eur. Food Res. and Technol DOI 10.1007/s00217-011-1605-7.
Azt követően, hogy az uniós referencialaboratórium e módszerek specifikusságát a kínai rizsminták nagyszámú variánsain ellenőrizte, a módszer megfelelőnek tekinthető az ismertetett szűrési célokra.
5. A fenti szűrési módszerek alkalmazásakor figyelembe kell venni a géntechnológiával módosított szervezeteket vizsgáló európai referencialaboratórium által közzétett, iránymutatásokat tartalmazó dokumentációt.
III. MELLÉKLET
EGÉSZSÉGÜGYI BIZONYÍTVÁNYMINTA
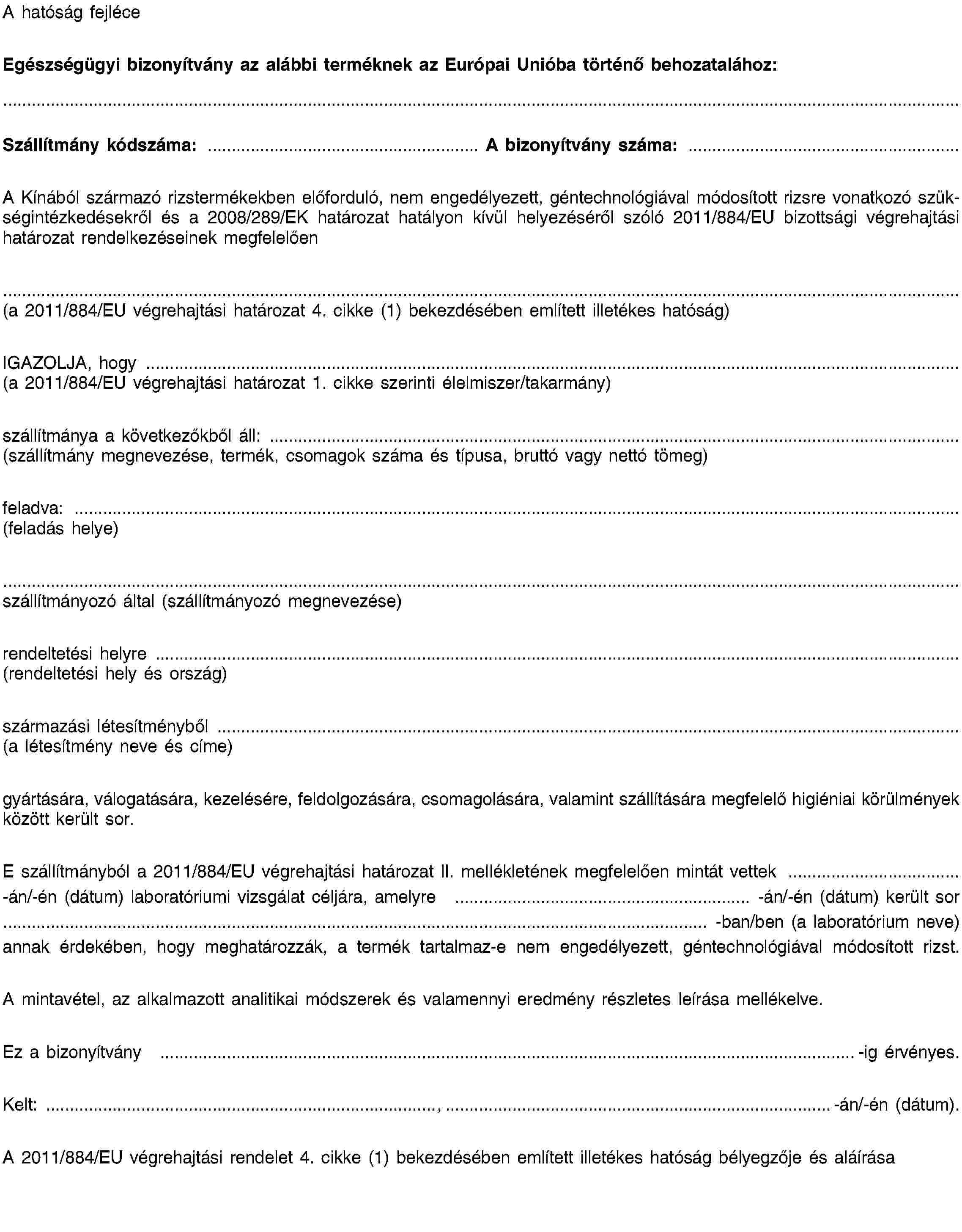
IV. MELLÉKLET
A VIZSGÁLATI JELENTÉS MINTÁJA
Megjegyzés: kérjük, minden egyes vizsgált minta vonatkozásában állítsa össze a mellékletet
| A jelentésben szereplő paraméter | Benyújtott információk |
| A vizsgálatot végző laboratórium neve és címe (1) | |
| A vizsgálati jelentés azonosító kódja (1) | <<000>> |
| A laboratóriumi minta azonosító kódja (1) | <<000>> |
| A laboratóriumi minta mérete (1) | X kg |
| Minta szétválasztása esetén: a vizsgálati minták száma és mérete | Y g mennyiségű X vizsgálati minta |
| A vizsgált tesztadagok száma és mérete (1) | X tesztadag Y mg mennyiségben |
| A vizsgált DNS teljes mennyisége (1) | X ng/PCR |
| A következőkre vizsgált DNS-szekvenciák (1): | Az alábbiak mindegyike esetében kérjük, tüntessen fel referenciát az alkalmazott módszer és a kapott átlagos Ct-szám tekintetében Rizsmarker: 35S promóter: NOS terminátor: CryIAb/CryIAc: |
| Más, a következőkre vizsgált szekvenciák: | Validálási státus: (pl. laboratóriumközi validálás, belső validálás [kérjük, tüntesse fel, mely szabványt vagy iránymutatást alkalmazták]) A kimutatott DNS-szekvenciák leírása (referencia + célgének): A módszer specifikussága (szűrés, konstrukcióspecifikus vagy eseményspecifikus): Abszolút érzékelési határ (a másolatok száma): Gyakorlati érzékelési határ (a vizsgált mintához kapcsolódó érzékelési határ), amennyiben megállapításra került: |
| A cél-DNS tekintetében a pozitív kontroll leírása és referenciaanyagok leírása (1) | A pozitív kontrollok és referenciaanyagok forrása és jellege (pl. plazmid, genomikus DNS, CRM …) |
| Információ a pozitív kontrollról (1) | Kérjük, tüntesse fel a vizsgált pozitív kontroll és a kapott átlagos Ct-szám mennyiségét (ng DNS) |
| Megjegyzések | |
| (1) A mezők kitöltése kötelező | |
( 1 ) HL L 31., 2002.2.1., 1. o.
( 2 ) HL L 268., 2003.10.18., 1. o.
( 3 ) HL L 96., 2008.4.9., 29. o.
( 4 ) HL L 348., 2004.11.24., 18. o.
( 5 ) HL L 54., 2009.2.26., 1. o.
( 6 ) HL L 165., 2004.4.30., 1. o.
( 7 ) HL L 194., 2009.7.25., 11. o.
( 8 ) HL L 21., 2004.1.28., 11. o.
Lábjegyzetek:
[1] A dokumentum eredetije megtekinthető CELEX: 32011D0884 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:32011D0884&locale=hu Utolsó elérhető, magyar nyelvű konszolidált változat CELEX: 02011D0884-20130704 - https://eur-lex.europa.eu/legal-content/HU/ALL/?uri=CELEX:02011D0884-20130704&locale=hu


