59/2015. (XII. 30.) EMMI rendelet
egyes egészségbiztosítási tárgyú miniszteri rendeletek módosításáról
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (4) bekezdés k), l) és m) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 48. § 2. pontjában meghatározott feladatkörömben eljárva,
az 1. § (5) és (7) bekezdése, valamint az 5. és 7. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés d) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 48. § 2. pontjában meghatározott feladatkörömben eljárva - a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 90. § 2. pontjában meghatározott feladatkörében eljáró nemzetgazdasági miniszterrel egyetértésben -,
a 2. alcím és a 3-44. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés a) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 48. § 2. pontjában meghatározott feladatkörömben eljárva,
a 3-5. alcím és a 45-52. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés f) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 152/2014. (VI. 6.) Korm. rendelet 48. § 2. pontjában meghatározott feladatkörömben eljárva
a következőket rendelem el:
1. Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet módosítása
1. § (1) Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet (a továbbiakban: R1.) 1. számú melléklete helyébe az 1. melléklet lép.
(2) Az R1. 1/A. számú melléklete a 2. melléklet szerint módosul.
(3) Az R1. 2. számú melléklete a 3. melléklet szerint módosul.
(4) Az R1. 4. számú melléklete a 4. melléklet szerint módosul.
(5) Az R1. 8. számú melléklete helyébe az 5. melléklet lép.
(6) Az R1. 10. számú melléklete a 6. melléklet szerint módosul.
(7) Az R1. 16. számú melléklete a 7. melléklet szerint módosul.
2. § Az R1.
a) 2. §-ában a "jegyzékét" szövegrész helyébe a "jegyzékét, kódját, valamint az elszámolásra jogosult intézetek körét" szöveg,
b) 2/E. § (2) bekezdésében a "3 napon belül" szövegrész helyébe a "3 munkanapon belül" szöveg
lép.
2. A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosítása
3. § A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet (a továbbiakban: R2.) 4. § (3) és (4) bekezdése helyébe a következő rendelkezések lépnek:
"(3) Az oszteoporózis következtében kialakuló csonttörés primer prevenciójának finanszírozási eljárásrendjét a 15. melléklet tartalmazza.
(4) Az oszteoporózis következtében kialakuló csonttörés szekunder prevenciójának finanszírozási eljárásrendjét a 16. melléklet tartalmazza."
4. § Az R2. 5. §-a helyébe a következő rendelkezés lép:
"5. § (1) A myeloma multiplex kezelésének finanszírozási eljárásrendjét a 19. melléklet tartalmazza.
(2) A stroke elsődleges megelőzésének finanszírozási eljárásrendjét a 20. melléklet tartalmazza.
(3) Az újabb stroke megelőzésének finanszírozási eljárásrendjét a 21. melléklet tartalmazza.
(4) Az ischaemias stroke-ot elszenvedett, thrombolysisre alkalmas betegek ellátásának finanszírozási eljárásrendjét a 22. melléklet tartalmazza.
(5) A gyomordaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 23. melléklet tartalmazza.
(6) Az ST elevációval nem járó myocardialis infarktus és az instabil angina diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 24. melléklet tartalmazza.
(7) A stabil angina pectoris diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 25. melléklet tartalmazza.
(8) A nem-seminoma típusú heredaganatok kezelésének finanszírozási eljárásrendjét a 26. melléklet tartalmazza.
(9) A seminoma típusú heredaganatok kezelésének finanszírozási eljárásrendjét a 27. melléklet tartalmazza.
(10) A húgyhólyagrák diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 28. melléklet tartalmazza.
(11) A prosztata daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 29. melléklet tartalmazza.
(12) A szkizofrénia antipszichotikus gyógyszeres kezelésének finanszírozási eljárásrendjét a 30. melléklet tartalmazza.
(13) A sclerosis multiplex diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 31. melléklet tartalmazza.
(14) A sigma és colon daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 32. melléklet tartalmazza.
(15) A rectum daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 33. melléklet tartalmazza.
(16) A szénhidrát-anyagcsere rendezése 2-es típusú cukorbetegségben nem terhes felnőttekben finanszírozási eljárásrendjét a 34. melléklet tartalmazza.
(17) A gyermekkori asthma bronchiale diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendjét a 35. melléklet tartalmazza.
(18) A krónikus obstruktív tüdőbetegség (COPD) diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendjét a 36. melléklet tartalmazza.
(19) Az asthma bronchiale diagnosztikája és gyógyszeres kezelése felnőttkorban finanszírozási eljárásrendjét a 37. melléklet tartalmazza.
(20) Korai és helyileg kiterjedt (nem távoli áttétes) nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 38. melléklet tartalmazza.
(21) Az ST-elevációval járó akut myocardiális infarktus diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 39. melléklet tartalmazza.
(22) Lokálisan kiterjedt inoperábilis és áttétes nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 40. melléklet tartalmazza.
(23) A kissejtes tüdődaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 41. melléklet tartalmazza."
5. § (1) Az R2. 3. melléklete helyébe a 8. melléklet lép.
(2) Az R2. 4. melléklete helyébe a 9. melléklet lép.
(3) Az R2. 5. melléklete helyébe a 10. melléklet lép.
(4) Az R2. 6. melléklete helyébe a 11. melléklet lép.
(5) Az R2. 7. melléklete helyébe a 12. melléklet lép.
(6) Az R2. 8. melléklete helyébe a 13. melléklet lép.
(7) Az R2. 9. melléklete helyébe a 14. melléklet lép.
(8) Az R2. 10. melléklete helyébe a 15. melléklet lép.
(9) Az R2. 11. melléklete helyébe a 16. melléklet lép.
(10) Az R2. 12. melléklete helyébe a 17. melléklet lép.
(11) Az R2. 13. melléklete helyébe a 18. melléklet lép.
(12) Az R2. 14. melléklete helyébe a 19. melléklet lép.
(13) Az R2. 15. melléklete helyébe a 20. melléklet lép.
(14) Az R2. 16. melléklete helyébe a 21. melléklet lép.
(15) Az R2. 18. melléklete helyébe a 22. melléklet lép.
(16) Az R2. a 23. melléklet szerinti 20. melléklettel egészül ki.
(17) Az R2. a 24. melléklet szerinti 21. melléklettel egészül ki.
(18) Az R2. a 25. melléklet szerinti 22. melléklettel egészül ki.
(19) Az R2. a 26. melléklet szerinti 23. melléklettel egészül ki.
(20) Az R2. a 27. melléklet szerinti 24. melléklettel egészül ki.
(21) Az R2. a 28. melléklet szerinti 25. melléklettel egészül ki.
(22) Az R2. a 29. melléklet szerinti 26. melléklettel egészül ki.
(23) Az R2. a 30. melléklet szerinti 27. melléklettel egészül ki.
(24) Az R2. a 31. melléklet szerinti 28. melléklettel egészül ki.
(25) Az R2. a 32. melléklet szerinti 29. melléklettel egészül ki.
(26) Az R2. a 33. melléklet szerinti 30. melléklettel egészül ki.
(27) Az R2. a 34. melléklet szerinti 31. melléklettel egészül ki.
(28) Az R2. a 35. melléklet szerinti 32. melléklettel egészül ki.
(29) Az R2. a 36. melléklet szerinti 33. melléklettel egészül ki.
(30) Az R2. a 37. melléklet szerinti 34. melléklettel egészül ki.
(31) Az R2. a 38. melléklet szerinti 35. melléklettel egészül ki.
(32) Az R2. a 39. melléklet szerinti 36. melléklettel egészül ki.
(33) Az R2. a 40. melléklet szerinti 37. melléklettel egészül ki.
(34) Az R2. a 41. melléklet szerinti 38. melléklettel egészül ki.
(35) Az R2. a 42. melléklet szerinti 39. melléklettel egészül ki.
(36) Az R2. a 43. melléklet szerinti 40. melléklettel egészül ki.
(37) Az R2. a 44. melléklet szerinti 41. melléklettel egészül ki.
3. Az Egészségbiztosítási Alap terhére finanszírozható járóbeteg-szakellátási tevékenységek meghatározásáról, az igénybevétel során alkalmazandó elszámolhatósági feltételekről és szabályokról, valamint a teljesítmények elszámolásáról szóló 9/2012. (II. 28.) NEFMI rendelet módosítása
6. § (1) Az Egészségbiztosítási Alap terhére finanszírozható járóbeteg-szakellátási tevékenységek meghatározásáról, az igénybevétel során alkalmazandó elszámolhatósági feltételekről és szabályokról, valamint a teljesítmények elszámolásáról szóló 9/2012. (II. 28.) NEFMI rendelet (a továbbiakban: R3.) 2. melléklete a 45. melléklet szerint módosul.
(2) Az R3. 3. melléklete a 46. melléklet szerint módosul.
4. A gyógyító-megelőző ellátás jogcímén az Egészségbiztosítási Alap terhére finanszírozható homogén betegségcsoportok kódolási és besorolási szabályairól szóló 10/2012. (II. 28.) NEFMI rendelet módosítása
7. § (1) A gyógyító-megelőző ellátás jogcímén az Egészségbiztosítási Alap terhére finanszírozható homogén betegségcsoportok kódolási és besorolási szabályairól szóló 10/2012. (II. 28.) NEFMI rendelet (a továbbiakban: R4.) 2. melléklete a 47. melléklet szerint módosul.
(2) Az R4. 4. melléklete a 48. melléklet szerint módosul.
5. Az Egészségbiztosítási Alapból a 959A-L, valamint 9511-9515 homogén betegségcsoportok szerint finanszírozott daganatellenes terápiákról szóló 11/2012. (II. 28.) NEFMI rendelet módosítása
8. § (1) Az Egészségbiztosítási Alapból a 959A-L, valamint 9511-9515 homogén betegségcsoportok szerint finanszírozott daganatellenes terápiákról szóló 11/2012. (II. 28.) NEFMI rendelet (a továbbiakban: R5.) 1. melléklete a 49. melléklet szerint módosul.
(2) Az R5. 2. melléklete az 50. melléklet szerint módosul.
(3) Az R5. 3. melléklete az 51. melléklet szerint módosul.
(4) Az R5. 4. melléklete az 52. melléklet szerint módosul.
6. Záró rendelkezések
9. § Ez a rendelet a kihirdetését követő hónap első napján lép hatályba.
Balog Zoltán s. k.,
emberi erőforrások minisztere
1. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"1. számú melléklet a 9/1993. (IV. 2.) NM rendelethez
Tételes elszámolás alá eső egyszerhasználatos eszközök és implantátumok jegyzéke, kódja, valamint az elszámolásra jogosult intézetek köre
1. 01000 Gerinc belső fixációs implantátum
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A3 Budai Egészségközpont Kft.
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
2. 01001 HALO készülék
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0402 Dr. Réthy Pál Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1701 Tolna Megyei Balassa János Kórház
2001 Zala Megyei Kórház
2002 Kanizsai Dorottya Kórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
3. 01010 Scoliosis implantátum
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A3 Budai Egészségközpont Kft.
4. 01050 Közép- és belsőfül hallásjavító implantátum és processzor
Elszámolásra jogosult intézetek:
0122 Heim Pál Gyermekkórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
5. 01062 Érprotézisek gyűrűs vagy külső spirál erősítéssel (egyenes protézis, Y protézis)
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1201 Szent Lázár Megyei Kórház
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1701 Tolna Megyei Balassa János Kórház
2001 Zala Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0101 Szent Imre Kórház
0118 Uzsoki utcai Kórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
0702 Szent Pantaleon Kórház - Rendelőintézet Dunaújváros
10E8 Szent Margit Kórház
1011 Markhot Ferenc Oktatókórház és Rendelőintézet
13B2 Toldy Ferenc Kórház és Rendelőintézet
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
6. 01063 Érprotézis dialízis shunt készítéséhez
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
2001 Zala Megyei Kórház
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
7. Keringéstámogató eszközök
7/a. 01080 Felnőtt szívműtétekhez használt szívstabilizátor és tartozékai vagy oxigenátor csőkészlettel
Elszámolásra jogosult intézetek:
2001 Zala Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
7/b. 01081 Gyermek szívműtétekhez használt szívstabilizátor és tartozékai vagy oxigenátor csőkészlettel
Elszámolásra jogosult intézetek:
0162 Gottsegen György Országos Kardiológiai Intézet
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
7/c. 01504 Rövidtávú keringéstámogató eszközök és tartozékai (IABP)
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
7/d. 01521 Hosszútávú keringéstámogató eszközök és tartozékai (műszív)
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológiai Intézet
7/e. 01523 Középtávú keringéstámogató eszközök és tartozékai (ECMO)
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológiai Intézet
8. 01090 Pacemakerek, implantálható kardioverter-defibrillátorok és elektrodáik
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1101 Szent Borbála Kórház, Tatabánya
1801 Markusovszky Egyetemi Oktatókórház
9. 01110 Szívbillentyűk (mű, biológiai)
Elszámolásra jogosult intézetek:
2001 Zala Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
10. Kardiológiai ablációs és elektroanatómiai térképező katéterek
10/a. 01123 Kardiológiai ablációs katéterek
Elszámolásra jogosult intézetek:
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
10/b. 01124 Kardiológiai elektroanatómiai térképező katéter
Elszámolásra jogosult intézetek:
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
11. 01130 Ventriculo-atrialis shunt, ventriculo-peritonealis shunt, lumbo-peritonealis shunt
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
12. 01140 Peritoneo-venosus shunt
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
0122 Heim Pál Gyermekkórház
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
13. 01150 Transjuguláris, intrahepatikus porto-cavalis shunt (TIPS)
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
14. 0117A Sűrűfonatú öntáguló intracranialis stent
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
15. 01204 Orbitális implantátum
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0140 Semmelweis Egyetem
16. 01310 Felszínpótló csípőízületi protézis
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
17. 01323 Felszínpótló bokaízületi protézis
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
18. Maxillo-faciális belső fixációs eszközök és helyreállító protesisek, ideértve a CAD-CAM eljárással tervezett koponya- és arccsontpótlást is
18/a. 01338 Maxillo-faciális belső fixációs eszközök
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0402 Dr. Réthy Pál Kórház Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
2001 Zala Megyei Kórház
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
18/b. 01340 CAD-CAM eljárással tervezett koponya- és arccsontpótló eszközök
Elszámolásra jogosult intézetek:
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0163 Országos Klinikai Idegtudományi Intézet
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
18/c. 01343 Maxillo-faciális helyreállító protézisek
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
19. 01339 Gyógyszerkibocsátó coronaria stent
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
20. 01346 Implantálható tartós ér- és epiduralis katéter
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
21. 01349 Mamma protézis
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1701 Tolna Megyei Balassa János Kórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0101 Szent Imre Kórház
0118 Uzsoki utcai Kórház
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
01E8 Szent Margit Kórház
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
22. 01350 Tissue expander, extender
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1701 Tolna Megyei Balassa János Kórház
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0101 Szent Imre Kórház
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
01E8 Szent Margit Kórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
23. 01351 Mély-rectum és nyelőcső műtétek során használt anastomosis-varrógépek és tárak
Elszámolásra jogosult intézetek:
0302 Bajai Szent Rókus Kórház
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0402 Dr. Réthy Pál Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0602 Csongrád Megyei Egészségügyi Ellátó Központ Hódmezővásárhely - Makó
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1102 Vaszary Kolos Kórház, Esztergom
1101 Szent Borbála Kórház, Tatabánya
1202 Dr. Kenessey Albert Kórház-Rendelőintézet
1201 Szent Lázár Megyei Kórház
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1402 Siófoki Kórház-Rendelőintézet
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1701 Tolna Megyei Balassa János Kórház
1912 Magyar Imre Kórház
1903 Gróf Esterházy Kórház és Rendelőintézet Szakrendelő
2001 Zala Megyei Kórház
2002 Kanizsai Dorottya Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0101 Szent Imre Kórház
0121 Károlyi Sándor Kórház
0118 Uzsoki utcai Kórház
0643 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
0702 Szent Pantaleon Kórház - Rendelőintézet, Dunaújváros
01E8 Szent Margit Kórház
1703 Dombóvári Szent Lukács Kórház
1011 Markhot Ferenc Oktatókórház és Rendelőintézet
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
0306 Kiskunhalasi Semmelweis Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
24. 0135C Nyílt tüdőműtét során használt varrógépek és tárak
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0122 Heim Pál Gyermekkórház
0940 Debreceni Egyetem Klinikai Központ
0156 Országos Korányi TBC és Pulmonológiai Intézet
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
1801 Markusovszky Egyetemi Oktatókórház
25. 0135E Egyszer használatos eszköz vacuum core biopszia (VCB) Mammotome-hoz
Elszámolásra jogosult intézetek:
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
26. 0135F Video-thoracoscopos mellkasi (VATS) műtétek során használt varrógépek és tárak
Elszámolásra jogosult intézetek:
0154 Országos Onkológiai Intézet
0156 Országos Korányi TBC és Pulmonológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Debreceni Egyetem Klinikai Központ
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1801 Markusovszky Egyetemi Oktatókórház
27. 0135G Kolorectalis laparoszkopós bélműtétek során használt varrógépek, tárak és kiegészítő eszközök
Elszámolásra jogosult intézetek:
1701 Tolna Megyei Balassa János Kórház
0301 Bács-Kiskun Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1901 Csolnoky Ferenc Kórház
0643 Debreceni Egyetem Klinikai Központ
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0901 Kenézy Gyula Kórház és Rendelőintézet
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
1309 Pest Megyei Flór Ferenc Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0140 Semmelweis Egyetem, Budapest
1401 Somogy Megyei Kaposi Mór Oktató Kórház
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1101 Szent Borbála Kórház
0101 Szent Imre Kórház
0118 Uzsoki utcai Kórház
2001 Zala Megyei Kórház
1202 Dr. Kenessey Albert Kórház-Rendelőintézet
28. 0135K Húgyhólyag laparoszkopós bélműtétek során használt varrógépek, tárak és kiegészítő eszközök
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem, Budapest
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Debreceni Egyetem Klinikai Központ
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1801 Markusovszky Egyetemi Oktatókórház
29. 01360 Injektálható implantátum a vesico-ureterális reflux és az inkontinencia kezeléséhez
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
30. 01370 Végtagmegőrző endoprotézis (rosszindulatú alapbetegség kezelésében)
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
31. Biológiai implantátum (konzerv csont, porc, ín, szaruhártya, keratinocyta, egyéb)
31/a. 01401 Biológiai implantátum (konzerv csont)
Elszámolásra jogosult intézetek:
0242 Pécsi Tudományegyetem Klinikai Központ
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0140 Semmelweis Egyetem, Budapest
31/b. 01402 Biológiai implantátum (porc)
Elszámolásra jogosult intézetek:
0242 Pécsi Tudományegyetem Klinikai Központ
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0140 Semmelweis Egyetem, Budapest
31/c. 01403 Biológiai implantátum (ín)
Elszámolásra jogosult intézetek:
0242 Pécsi Tudományegyetem Klinikai Központ
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0140 Semmelweis Egyetem, Budapest
31/d. 01404 Biológiai implantátum (szaruhártya)
Elszámolásra jogosult intézetek:
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház
31/e. 01405 Biológiai implantátum (keratinocyta)
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
31/f. 01407 Biológiai implantátum (konzervált amnion)
Elszámolásra jogosult intézetek:
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
31/g. 01409 Biológiai implantátum, egyéb (kivétel: csont, porc, ín szaruhártya, keratinocyta)
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
32. 01501 Aorta stent-graftok
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
33. 01502 Szembetegségek kezeléséhez szükséges Ruthenium applikátor
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
34. 01503 Műanyag keratoprotézis
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
35. 01505 Percután rádiófrekvenciás máj-tumor ablációs eszköz
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
2001 Zala Megyei Kórház
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0101 Szent Imre Kórház
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
36. 01506 Baclofen-pumpa
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
37. 01507 Légúti stentek
Elszámolásra jogosult intézetek:
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0156 Országos Korányi TBC és Pulmonológiai Intézet
38. Neuropacemaker
38/a. 01508 Mély agyi stimulátor (pacemaker)
38/b. 01520 Gerincvelői stimulátor (pacemaker)
Elszámolásra jogosult intézetek:
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent Györgyi-Albert Klinikai Központ
39. Urethra stent, ureter stent
39/a. 01509 Urethra stent
Elszámolásra jogosult intézetek:
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
39/b. 01514 Ureter stent
Elszámolásra jogosult intézetek:
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
40. 01510 Hereprotézis
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
41. Égési sérültek ellátásához használt bőrpótló készítmények
41/a. 01515 Égési sérültek ellátásához használt Alloderm bőrpótló készítmény
Elszámolásra jogosult intézetek:
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
41/b. 01516 Égési sérültek ellátásához használt Integra bőrpótló készítmény
Elszámolásra jogosult intézetek:
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
42. 01517 Vékonybél endoszkópos kapszula
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1102 Vaszary Kolos Kórház, Esztergom
1401 Somogy Megyei Kaposi Mór Oktató Kórház
0122 Heim Pál Gyermekkórház
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
43. Antiglaucoma implantátum
43/a. 01518 Antiglaucoma shunt implantátum
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
43/b. 01519 Antiglaucoma fascia lata implantátum
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
44. 01600 Beültethető szívmonitor
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1101 Szent Borbála Kórház, Tatabánya
1801 Markusovszky Egyetemi Oktatókórház
45. 01700 Radioterápia során fellépő orális mucositis gyógyítására és megelőzésére alkalmas bevonószer
Elszámolásra jogosult intézetek:
0118 Uzsoki utcai Kórház
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0643 Debreceni Egyetem Klinikai Központ
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház"
2. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
1. Az R1. 1/A. számú melléklet 1/a1., 1/a2. és 2/a. pont "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a "0242" megjelölésű sort követően a következő sorral egészül ki:
"0301 Bács-Kiskun Megyei Kórház, Kecskemét"
2. Az R1. 1/A. számú melléklet 1/b1. és 12. pont "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a "0122" megjelölésű sort követően a következő sorral egészül ki:
"0123 Magyarországi Református Egyház Bethesda Gyermekkórháza, Budapest"
3. Az R1. 1/A. számú melléklet 8/e2.1. pont "TÁMOGATOTT INDIKÁCIÓK:" része helyébe a következő rendelkezés lép:
"TÁMOGATOTT INDIKÁCIÓK:
Onkológiai sebészeti szakvéleménnyel igazoltan inoperálibilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kezelésére, FOLFOX vagy FOLFIRI kemoterápiával kombinálva, azon egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettséggel rendelkező betegeknél, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.1. pont szerint folytatható az ellátás."
4. Az R1. 1/A. számú melléklet 8/e2.2. pont "TÁMOGATOTT INDIKÁCIÓK:" része helyébe a következő rendelkezés lép:
"TÁMOGATOTT INDIKÁCIÓK:
Onkológiai sebészeti szakvéleménnyel igazoltan inoperálibilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére azon egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettséggel rendelkező betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.2. pont szerint folytatható az ellátás."
5. Az R1. 1/A. számú melléklet 8/e2.3. pont "TÁMOGATOTT INDIKÁCIÓK:" része helyébe a következő rendelkezés lép:
"TÁMOGATOTT INDIKÁCIÓK:
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére az egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettség esetén azon betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.3. pont szerint folytatható az ellátás."
6. Az R1. 1/A. számú melléklet
a) 6/c. pont "TÁMOGATOTT INDIKÁCIÓK:" részében a "RoActemra" szövegrész helyébe a "tocilizumab" szöveg,
b) 8/e3.1., 8/e3.2., 8/e3.3. pont "TÁMOGATOTT INDIKÁCIÓK:" részében a "3 ciklust követően" szövegrész helyébe a "8 hét után elvégzett" szöveg
lép.
3. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
1. Az R1. 2. számú melléklet "A járóbeteg-szakellátás tevékenységi kódjai" megjelölésű része a "43593" megjelölésű sort követően a következő sorral egészül ki:
| (Kód | Index | Tevékenység megnevezése | Pont) |
| "43594 | Meningococcus elleni vaccinatio | 72" |
2. Az R1. 2. számú melléklet "A járóbeteg-szakellátás tevékenységi kódjai" megjelölésű rész "99930" megjelölésű sora helyébe a következő sor lép:
| (Kód | Index | Tevékenység megnevezése | Pont) |
| "99930 | 31 | Kiegészítő pont onkológiai indikációjú CT, MR diagnosztika 14 napon belül történő elvégzése és rosszindulatú daganatos kórkép igazolódása esetén | 10000" |
3. Az R1. 2. számú melléklet "A járóbeteg-szakellátásban használt index/* jelzésű eljárások az alábbi intézetekben végezhetők, a szakmai feltételektől és igényektől függően az OEP-pel kötött szerződésben meghatározott mennyiségi korlátozással" megjelölésű rész 1 pont "0607" megjelölésű sora helyébe a következő sor lép:
| "0643 | Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ" |
4. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az R1. 4. számú melléklet 125/f. pontja a "71841" megjelölésű sort követően a következő sorral egészül ki:
| "79981 | Kemoterápia, KAB protokoll szerint (01. fázis)" |
5. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"8. számú melléklet a 9/1993. (IV. 2.) NM rendelethez
Nagy értékű, országosan nem elterjedt műtéti eljárások, beavatkozások díjtételei
| 1. | OENO | Megnevezés | Díjtétel (E Ft) |
| 25510 | Cadaver donor vércsoport és virológiai vizsgálatai | 81,3 |
Elszámolásra jogosult intézetek:
0164 Országos Vérellátó Szolgálat
| 2. | OENO | Megnevezés | Díjtétel (E Ft) |
| 26450 | Cadaver donor immunológiai (HLA) vizsgálatai | 120 |
Elszámolásra jogosult intézetek:
0164 Országos Vérellátó Szolgálat
| 3. | OENO | Megnevezés | Díjtétel (E Ft) |
| 35950 | Agy PET/CT vizsgálata | 192 | |
| 35960 | Egésztest PET/CT vizsgálata | 192 | |
| 35970 | Egy testtájék PET/CT vizsgálata | 105 |
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
3400 ScanoMed Orvosi, Diagnosztikai, Kutató és Oktató Kft.
01A2 Pozitron-Diagnosztika Kft.
1409 Kaposvári Egyetem
A PET/CT vizsgálatért járó finanszírozási díj az alábbi indikációkban számolható el:
| Indikáció megnevezése | BNO csoport | ||||
| Fej és nyaki neopláziák | C00-C14, C30-C32 | ||||
| Az agy és gerincvelő rosszindulatú és ismeretlen viselkedésű daganatai | C70-72, D42-D43 | ||||
| Pajzsmirigyrák | C73H0 | ||||
| Szoliter pulmonális nodulus differenciál- diagnosztika* | R91H0 | ||||
| Nem-kissejtes tüdőrák (NSCPC) | C34 | ||||
| Nyelőcsőrák | C15 | ||||
| Colorectalis carcinoma | C18-C21 | ||||
| Lymphoma** | C81-C83, C8510-C8590 | ||||
| Melanoma malignum | C43 | ||||
| Emlőrák | C50 | ||||
| Méhnyakrák | C53 | ||||
| Epilepszia műtét előtti kivizsgálása 18 év alatt*** | G4000, G4030 | ||||
| Tüdőtranszplantáció előtti kivizsgálás 50 év felett**** | D86.0; D86.1; D86.2; D86.8; D86.9; J47; I27.0; I27.8; J84.1; J84.8; J84.9; E84.0; E84.1; E84.8; E84.9; J44.0; J44.1; J44.8; J44.9; Q21.80 | ||||
| * Csak abban az esetben, ha biopszia nem végezhető és más módszerrel a diagnózis nem tisztázható | |||||
| ** Non-Hodgkin lymphomáknál csak az agresszív típus esetében | |||||
| *** Csak abban az esetben, ha a betegség terápiarezisztens, a góc egyéb módon (MR) nem diagnosztizálható és a beteg műtétre vár | |||||
| **** aTüdő Transzplantációs Bizottság támogató javaslata szükséges | |||||
| 4. | OENO | Megnevezés | Díjtétel (E Ft) | ||
| 53350 | Tüdőátültetés | 20 000 | |||
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
| 5. | OENO | Megnevezés | Díjtétel (E Ft) |
| 53500 | Transzkatéteres szívbillentyű beültetés, szívbillentyűvel együtt | 5 000 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológiai Intézet
| 6. | OENO | Megnevezés | Díjtétel (E Ft) |
| 53750 | Szívátültetés | 16 000 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológia Intézet
| 7. | OENO | Megnevezés | Díjtétel (E Ft) |
| 53753 | Műszív beültetés | 425 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológia Intézet
| 8. | Csontvelő transzplantáció | ||
| OENO | Megnevezés | Díjtétel (E Ft) | |
| 54100 | Felnőtt allogén csontvelő transzplantáció | 24 045 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
| OENO | Megnevezés | Díjtétel (E Ft) | |
| 54101 | Felnőtt autológ csontvelő transzplantáció | 12 560 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
| OENO | Megnevezés | Díjtétel (E Ft) | |
| 54102 | Gyermek allogén csontvelő transzplantáció | 24 948 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
| OENO | Megnevezés | Díjtétel (E Ft) | |
| 54103 | Gyermek autológ csontvelő transzplantáció | 15 480 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
| 9. | OENO | Megnevezés | Díjtétel (E Ft) |
| 54104 | Unrelated, azaz idegen donortól származó csontvelő transzplantáció kiegészítő díja | 2 453 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
| 10. | OENO | Megnevezés | Díjtétel (E Ft) |
| 54105 | Őssejt szelekció | 2 453 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
| 11. | OENO | Megnevezés | Díjtétel (E Ft) |
| 55002 | Albuminkezelésen alapuló szupportív májpótló kezelés | 552 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
| 12. | OENO | Megnevezés | Díjtétel (E Ft) |
| 55040 | Májátültetés | 16 000 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
| 13. | OENO | Megnevezés | Díjtétel (E Ft) |
| 55285 | Kombinált hasnyálmirigy- és veseátültetés | 9 200 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
| OENO | Megnevezés | Díjtétel (E Ft) | |
| 14. | Veseátültetés | ||
| 55551 | Veseátültetés halottból | 4 200 | |
| 55553 | Veseátültetés élőből |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
| 15. | OENO | Megnevezés | Díjtétel (E Ft) |
| 5812J | Kiterjesztett gerincműtét | 2 500 |
Elszámolásra jogosult intézetek:
01A3 Budai Egészségközpont
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kiterjesztett gerincműtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Progresszív súlyos (65 fokot meghaladó), keringési és légzési elégtelenséghez vezető, mellkasi deformitással járó gerincgörbületek műtéti kezelése, intenzív ellátása.
Malignus gerincdaganat kiterjesztett műtétei, csigolyatest eltávolítással "en block" rezekcióval és tumorprotézis beültetésével, mely magában foglalja a teljes intenzív ellátást is.
A cervicothoracalis átmenet komplex elölről-hátulról történő rögzítése clavicula resectioval, illetve sternum felezéssel.
A nyaki gerinc elülső, 3 szegmentumot meghaladó rögzítése (törés, tumor vagy degeneratív megbetegedések miatt).
| 16. | OENO | Megnevezés | Díjtétel (E Ft) |
| 5812K | Kombinált ventro-dorsalis gerincműtét | 5 000 |
Elszámolásra jogosult intézetek:
01A3 Budai Egészségközpont
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kombinált ventro-dorsalis gerincműtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Progresszív súlyos (65 fokot meghaladó), keringési és légzési elégtelenséghez vezető, mellkasi deformitással járó gerincgörbületek kombinált ventro-dorsalis több ülésben elvégzett műtéti definitív korrekciója és stabilizációja, amely magában foglalja a release műtétet követő HALO extenziót, az 5 napot meghaladó intenzív ellátást.
Primer malignus gerincdaganat miatt több ülésben elvégzett kombinált ventro-dorsalis műtét, csigolyatest eltávolítással "en block" rezekcióval és tumorprotézis beültetésével, mely magában foglalja a teljes intenzív ellátást is.
Spinális infekció miatt ventro-dorsalis több ülésben elvégzett speciális műtét, mely magában foglalja a teljes intenzív ellátást is.
| 17. | OENO | Megnevezés | Díjtétel (E Ft) |
| 5812L | Kiterjesztett idegsebészeti műtétek | 2 500 |
Elszámolásra jogosult intézetek:
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kiterjesztett idegsebészeti műtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Szelektív dorsalis rhizotomia (SDR) intraoperatív elektrofiziológiai monitorozással.
Az intramedullaris daganatok intraoperatív elektrofiziológiai monitorozással végzett totális eltávolítása (legalább 90%-os eltávolítás).
Az agytörzsi és axialis daganatok funkcionális MR-en és tractográfiás vizsgálaton alapuló navigációval történő totális eltávolítása (legalább 90%-os eltávolítás).
A paranasalis sinusokba, illetve az arckoponyára is terjedő kombinált transcranialis és transfacialis behatolást egyaránt igénylő egy ülésben végzett műtétek.
A clivus, illetve a clivus régió tumorainak transoralis, illetve transnasalis totális resectioja (legalább 90%-os eltávolítás).
Plexus sérültek gerincvelői ideg reimplantációja autograft használatával 3 hónapon belül.
| 18. | OENO | Megnevezés | Díjtétel (E Ft) |
| 5812M | Kombinált idegsebészeti műtétek | 5 000 |
Elszámolásra jogosult intézetek:
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kombinált idegsebészeti műtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Több ülésben végzett szelektív dorsalis rhizotomia (SDR) intraoperatív elektrofiziológiai monitorozással, ortopédiai kiegészítő műtétekkel.
Az óriás aneurysmák transcranialis úton való lezárása hypothermiában szívmegállítás mellett.
Az óriás aneurysmák transcranialis ellátása egy ülésben végzett bypass műtéttel és ha szükséges, endovascularis intervencióval.
A craniocervicalis átmenet HALO-ban, egy ülésben történő complex rögzítése (transorális dens resectio + hátsó stabilizálás).
Súlyos craniostenosis miatt végzett rekonstrukciós műtét.
| OENO | Megnevezés | Díjtétel (E Ft) | |
| 19. | Terápiás aferezis, haemaferezis | 215 | |
| 88571 | Plazmaferesis, kézi | ||
| 88573 | Erythrocytaferesis, gépi | ||
| 88574 | Erythrocytaferesis, kézi, 2 E | ||
| 88575 | Leukaferesis I. (10-15 liter vérvolumen) |
| 88576 | Leukaferesis II. (15-20 liter vérvolumen) | ||
| 88577 | Lymphocytaferesis | ||
| 88578 | PBSC aferesis | ||
| 88579 | Thrombocytaferesis, gépi | ||
| 88580 | Plazmacsere I. (40 ml/kg, subst. FFP + Albumin) | ||
| 88581 | Plazmacsere II. (60 ml/kg, subst. Albumin + HES) | ||
| 88582 | Plazmacsere III. (40 ml/kg, subst. Albumin + HES) | ||
| 88583 | Kryoferesis (subst. autológ kryo felülúszó) | ||
| 88587 | Szelektív plazmaferezis | 215 |
Elszámolásra jogosult intézetek:
0101 Szent Imre Kórház
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0140 Semmelweis Egyetem
0164 Országos Vérellátó Szolgálat
0242 Pécsi Tudományegyetem Klinikai Központ
0301 Bács-Kiskun Megyei Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0940 Debreceni Egyetem Klinikai Központ
10E8 Szent Margit Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0633 SZOTE Gyermekművese Állomásért Alapítvány
2220 HAEMOBIL Kft.
2239 FRESENIUS MEDICAL CARE Dialízis Center Kft.
| 20. | OENO | Megnevezés | Díjtétel (E Ft) |
| 88584 | Fotoferezis | 310 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0140 Semmelweis Egyetem
0940 Debreceni Egyetem Klinikai Központ"
6. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az R1. 10. számú mellékletében foglalt táblázat 1. pont "Elszámolható HBCs csoportok:" megjelölésű oszlopában a "959A-L" szövegrész helyébe a "959A-L, 9511-9515" szöveg lép.
7. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
1. Az R1. 16. számú mellékletében foglalt táblázat a következő 6. sorral egészül ki:
| [Ellátási forma megnevezése | Havi fix összegű díjazás mértéke (Ft/hó)] | |
| " | ||
| 6. | Gyermek fül-orr-gégészeti sürgősségi centrum | 3 000 000 |
| " | ||
2. Az R1. 16. számú mellékletének végjegyzete a következő mondattal egészül ki:
"A 6. pont szerinti fix díjra a Heim Pál Gyermekkórház jogosult."
8. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"3. melléklet a 31/2010. (V. 13.) EüM rendelethez
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Daganatos megbetegedések (C00-C97)
1.1.1. Vese rosszindulatú daganatai
1.1.1.1. Nem világossejtes daganatok
2. A kórkép leírása
2.1. A vese rosszindulatú daganatainak előfordulási gyakorisága az utóbbi évtizedekben lassan emelkedik. A Magyar Rákregiszter adatai alapján 2012-ben 1384 új megbetegedés fordult elő. Leggyakrabban 45-70 éves életkor között jelentkezik, de egyre gyakoribb fiatalabb életkorban is.
A malignus vesedaganatok között a leggyakoribb a vesesejtes carcinoma (RCC), mely a vesekéregben alakul ki, a proximális kanyarulatos csatornákat bélelő sejtekből. A vesesejtes ráknak 5 fő altípusa különböztethető meg, amelyek közül a leggyakoribb a világos sejtes veserák (az esetek 75-80%-a). A papilláris carcinoma I-II 12-14%-ban, a cromophob carcinoma 4-6%-ban, az oncocyter típusú vesesejtes rák 2-4%-ban, míg a Bellini-féle carcinoma 1%-ban figyelhető meg. A szövettani diagnózis ismerete mindig kötelező. A tumor terjedése részben lokálisan, részben pedig a nyirok- és vérerek útján történik.
A betegség etiológiája pontosan még nem ismert, de mind a hazai, mind a jelentősebb nemzetközi szakmai társaságok kiemelik a dohányzás szerepét az RCC kialakulásában (2A evidencia szint). A szakmai evidenciák alapján az elhízás, a kávéfogyasztás és az állati zsiradékok fogyasztása is komoly rizikófaktornak tekinthető. Felfedezéskor 60-70%-ban szervre lokalizált, 5-10%-ban lokálisan előrehaladott, 15-20%-ban távoli áttétet képez. Relapszus a korai I-II klinikai stádiumban is előfordul.
2.2. A vesedaganatok stádium beosztása során a következő TNM klasszifikációt alkalmazzuk:
2.2.1. TNM klinikai klasszifikáció, primer tumor
| T | Primer tumor |
| TX | Primer tumor nem ítélhető meg |
| T0 | Primer tumor nem mutatható ki |
| T1 | A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában maximum 7 cm |
| T1a | 4 cm-es vagy kisebb tumor |
| T1b | 4 cm-nél nagyobb, 7 cm-nél nem nagyobb tumor |
| T2 | A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t |
| T2a | A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t, de 10 cm-nél nem nagyobb |
| T2b | A tumor 10 cm-nél nagyobb, de a vese anatómai határait nem haladja meg |
| T3 | A tumor ráterjed a nagyobb vénákra [venarenalis(ok)], infiltrálja a perirenalis (más szóval perinephricus) szöveteket, de nem terjed túl a Gerota-fascián és nem infiltrálja a mellékvesét |
| pT3a | A daganat szabad szemmel látható módon a v. renalis-ban, vagy annak nagy szegmentális ágaiban terjed (szövettan: a venának van izmos fala), vagy a perinephricus, illetve a vesemedencei zsírszövetbe terjed |
| pT3b | A daganat szabad szemmel észlelhetően beterjed a v. cava-ba, de a növedék nem haladja meg a rekeszizom szintjét |
| pT3c | A daganat szabad szemmel észlehetően beterjed a v. cava-ba, és a növedék a rekeszizom vonalát meghaladja, vagy a tumor beszűri a v. cava falát |
| pT4 | A tumor túlterjed a Gerota-fascián (ideértve, ha közvetlen terjedés révén beszűri a mellékvesét) |
2.2.2. TNM klinikai klasszifikáció, Regionális nyirokcsomó
| N | Regionális nyirokcsomók |
| NX | Regionális nyirokcsomóáttét nem igazolható |
| N0 | Nincs regionális nyirokcsomóáttét |
| N1 | Metastasis szoliter regionális nyirokcsomóban |
| N2 | Metastasis egynél több regionális nyirokcsomóban |
2.2.3. TNM klinikai klasszifikáció, Távoli áttétek
| M | Távoli áttétek |
| M0 | Távoli áttét nincs |
| M1 | Távoli áttét(ek) |
2.2.4. G Szövettani grading
| G | Szövettani grading | |||
| Fuhrmann Grádus | Sejtmag mérete | Sejtmag alakja | Nucleolus | |
| G1 | Jól differenciált | Kicsi (10 um) | Szabályos | Nem észlelhető |
| G2 | Mérsékelten | Kicsi; valamivel | Szabálytalan | 40x nagyításnál |
| differenciált | nagyobb (15 um) | megfigyelhető | ||
| G3 | Gyengén differenciált | Közepesen nagy (20 | Szabálytalan | 10x nagyításnál |
| um) | megfigyelhető | |||
| G4 | Differenciálatlan | IV Nagy | Bizarr | Feltűnő |
3. Finanszírozás rendje, finanszírozási algoritmus
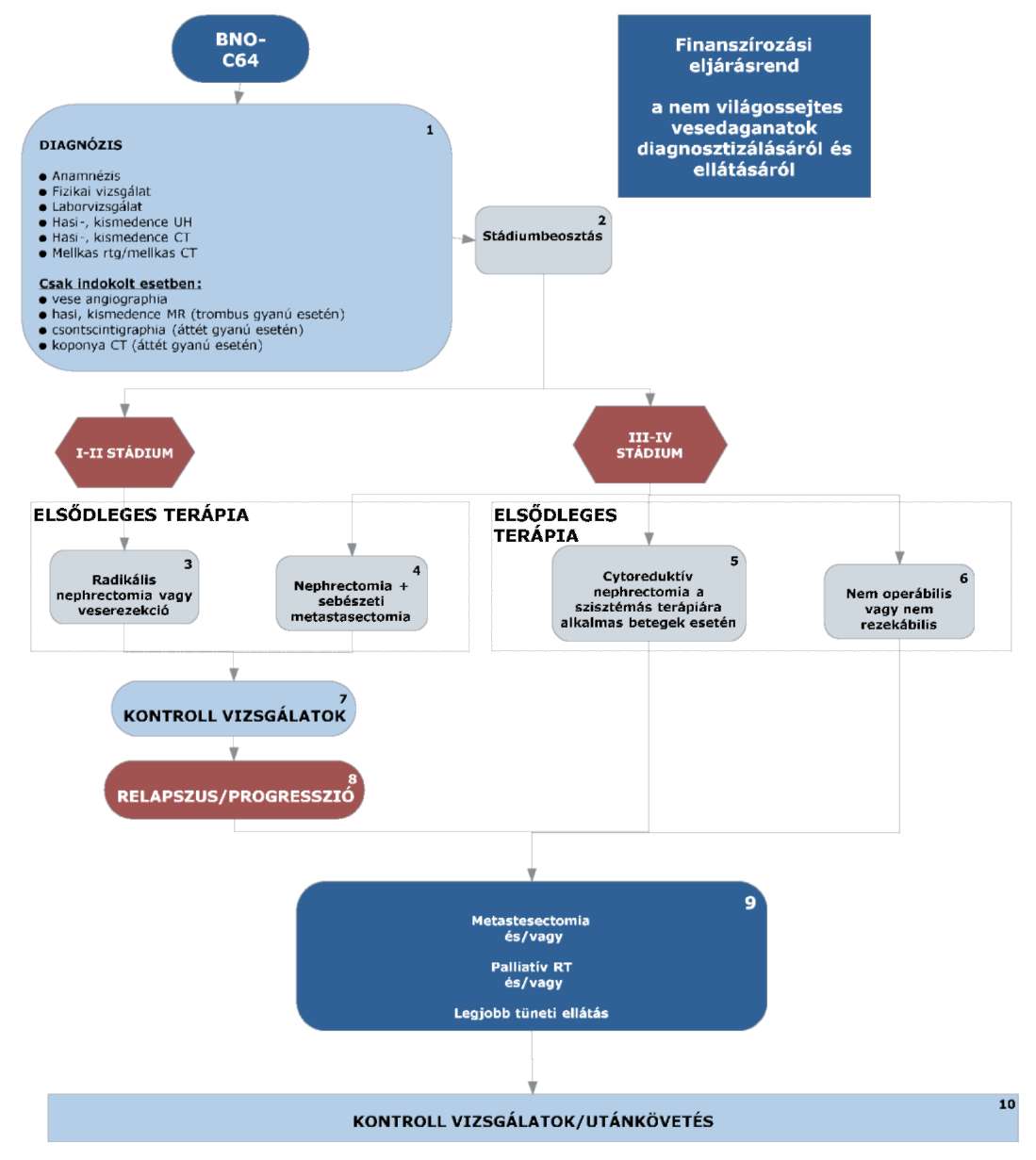
3.1. (4, 5): IV. stádiumban nephrectomia, ha a beteg jó általános állapotú.
3.2. (5, 6): pT3-pT4 indokolt eseteiben (tumor műtéti sérülése) posztoperatív irradiatió; nem műthető csontáttét esetén RANK ligand gátló vagy bisfosfonat kezelés, indokolt esetben irradiatió javasolt.
3.3. (7, 10): Kontroll vizsgálat az I-II stádiumban az első két évben legalább 6 havonta, majd a 3-5. évig legalább évente esedékes. A kontroll vizsgálat során fizikális vizsgálat, teljes labor, mellkas RTG, hasi-kismedencei UH vizsgálat végzendő. Amennyiben indokolt, mellkas CT, hasi, kismedencei CT/MR javasolt.
3.4. (8): A relapszust minden esetben igazolni kell (valamely képalkotó eljárással) és dokumentálni szükséges.
3.5. (9): Lokális recidíva esetén, amennyiben technikailag lehetséges, sebészi eltávolítás javasolt.
Irrezekábilis esetekben, ha korábban nem volt sugárkezelés, irradiatió szóba jön.
A radioterápia a szakma szabályai szerint történik.
3.6. (10): Az utánkövetés a 3.3. pontban leírtak szerint történik.
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. A finanszírozási ellenőrzés során elsődlegesen azt vizsgáljuk, hogy a kezelő orvosok betartják-e a kihirdetett finanszírozási rendet, különös tekintettel a következő főbb sarokpontokra:
4.1.1. A szövettani típus megfelelően dokumentált?
4.1.2. Stádiumbeosztásra vonatkozó adatok megtalálhatóak-e?
4.1.3. A relapszus/progesszió igazolt és megfelelően dokumentált?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A finanszírozási eljárásrend hatását a következő indikátorokkal kívánjuk mérni:
5.1.1. A területre fordított közkiadások alakulása.
5.1.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | C64H0 | A vese rosszindulatú daganata, kivéve a vesemedencét |
6.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 11041 | Vizsgálat |
| 3 | 36135 | Vese UH vizsgálata |
| 4 | 36130 | Hasi, kismedencei UH (áttekintő, komplex) UH vizsgálat |
| 5 | 34450 | Teljes has CT vizsgálata natív |
| 6 | 31310 | Mellkasfelvétel, AP/PA |
| 7 | 31311 | Mellkasfelvétel, oldalirányú |
| 8 | 31312 | Mellkasfelvétel, kétirányú |
| 9 | 31380 | Mellkasfelvétel, célzott |
| 10 | 3617D | Duplex UH, vese |
| 11 | 34454 | Teljes has és medence CT vizsgálata natív és iv. kontrasztanyag adását követőleg |
| 12 | 34442 | Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 13 | 34935 | Teljes has MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 14 | 3532G | Vese angioszcintigráfia (indokolt esetben) |
| 15 | 3533A | 3 fázisú csontszcintigráfia (indokolt esetben) |
| 16 | 34410 | Agykoponya natív CT vizsgálata |
| 17 | 34411 | Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
| 18 | 34412 | Agykoponya CT vizsgálat natív plusz iv. kontrasztanyag adását követőleg |
| 19 | 14810 | Biopsia parietis abdominis |
| 20 | Laborvizsgálatok |
6.3. Releváns kemoterápiás protokollok
| A | B | |
| 1 | Kód | Kemoterápiás protokoll megnevezése |
| 2 | 7051 | Kemoterápia, GEM+CDDP I. protokoll szerint |
| 3 | 7316 | Kemoterápia, VIP/J Carboplatinnal protokoll szerint |
| 4 | 7317 | Kemoterápia, CMV protokoll szerint |
| 5 | 7318 | Kemoterápia, INF-alfa+IL2+5FU protokoll szerint |
| 6 | 7320 | Kemoterápia, GEM+CBP/C protokoll szerint |
| 7 | 7727 | Kemoterápia, SIVD2+dexrazoxane protokoll szerint 18 év alatt |
| 8 | 7728 | Kemoterápia, SCErV+dexrazoxane protokoll szerint 18 év alatt |
| 9 | 7729 | Kemoterápia, WTVAER+dexrazoxane protokoll szerint 18 év alatt |
| 10 | 7744 | Kemoterápia, WTVER+dexrazoxane protokoll szerint 18 év alatt |
| 11 | 7913 | Immunterápia, VBL+interferon protokoll szerint |
| 12 | 7948 | Kemoterápia, SV protokoll szerint 18 év alatt |
| 13 | 7949 | Kemoterápia, SVA protokoll szerint 18 év alatt |
| 14 | 7950 | Kemoterápia, SIVA2 protokoll szerint 18 év alatt |
| 15 | 7951 | Kemoterápia, SIVD2 protokoll szerint 18 év alatt |
| 16 | 7952 | Kemoterápia, SIVA3 protokoll szerint 18 év alatt |
| 17 | 7953 | Kemoterápia, SCErV protokoll szerint 18 év alatt |
| 18 | 7954 | Kemoterápia, SI3VE protokoll szerint 18 év alatt |
| 19 | 7955 | Kemoterápia, SICARE5 protokoll szerint 18 év alatt |
| 20 | 7956 | Kemoterápia, WV protokoll szerint 18 év alatt |
| 21 | 7957 | Kemoterápia, WVAct protokoll szerint 18 év alatt |
| 22 | 7958 | Kemoterápia, WTVA5 protokoll szerint 18 év alatt |
| 23 | 7959 | Kemoterápia, WTVA5V protokoll szerint 18 év alatt |
| 24 | 7960 | Kemoterápia, WTVER protokoll szerint 18 év alatt |
| 25 | 7961 | Kemoterápia, WTVAER protokoll szerint 18 év alatt |
6.4. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 566B | Vese, ureter, húgyhólyag jelentős műtétei daganat miatt, cystectomiaval és hó- |
| lyagpótlással | ||
| 3 | 566C | Vese, ureter, húgyhólyag jelentős műtétei daganat miatt |
| 4 | 577B | Vese-, húgyúti daganatok |
| 5 | 9430 | Sugárterápia |
| 6 | 608Z | Vese-, húgyutak műtétei (kivéve: jelentős műtétek) súlyos társult betegséggel |
| 7 | 610Z | Vese-, húgyúti betegségek (kivéve: veseelégtelenség, a vese, húgyutak egyéb belgyógyászati betegségei cytostatikus vagy cyclosporin kezeléssel) |
| 8 | 959A-959H, 959 J | Rosszindulatú daganat kemoterápiája "A"-"H" és "J" |
7. Rövidítések
BNO Betegségek nemzetközi osztályozása
BSC Best supportive care
HBCS Homogén betegségcsoport
EAU European Association of Urology
OENO Orvosi eljárások nemzetközi osztályzása
RCC Vesesejtes rák
RTG Röntgen
TNM Tumor, node, metastasis (tumor, nyirokcsomó, metasztázis)"
9. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"4. melléklet a 31/2010. (V. 13.) EüM rendelethez
A kemoterápia következtében kialakuló anémia kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések
Az indikációs körbe került rosszindulatú daganatok: C34, C50, C56, C57, C62, C82, C83, C84, C85, C88, C90, C91
2. Kórkép leírása
A daganatos betegek körében 30-90%-os gyakoriságú kísérő tünet az anémia. Az ok részben a betegség jellege, részben az alapbetegségre alkalmazott terápia. A vérszegénység egyfelől a betegek életminőségét ronthatja jelentősen, másrészről befolyásolja a daganatellenes kezelés eredményességét.
2.1. Onkológiai kórképek során kialakult anémia etiológiája
2.1.1. A daganatos betegségek során kialakult anémia számos kórfolyamatra vezethető vissza:
2.1.1.1. daganatsejtek által kiváltott fokozott makrofág-aktiváció és következményes vörösvértest pusztulás,
2.1.1.2. bizonyos citokinek gátolják a vesében az eritropoetin termelést,
2.1.1.3. a csontvelő tumoros infiltrációja (NICHE),
2.1.1.4. a daganatsejtekből vasraktározást fokozó, csökkent vörösvérsejt termelést és rövidülő vörösvérsejt élettartamot okozó citokinek kibocsátása,
2.1.1.5. a beteg étvágyának csökkenése, emiatt bizonyos anyagok csökkent bevitele (pl: vas, folsav hiány),
2.1.1.6. vérvesztés, mely akár a tumorból, akár pedig a tumorba irányulhat,
2.1.1.7. hemolízis mechanikus (pl. DIC: fragmentációs) vagy immunológiai tényezők miatt.
2.1.2. A kemoterápiás készítmények a következő mechanizmuson keresztül okozhatnak anémiát:
2.1.2.1. direkt myeloszupresszív hatás a vörösvértest termelés gátláson keresztül,
2.1.2.2. a vesetubulusok direkt szövet károsodása során, ami az EPO termelést tovább csökkenti,
2.1.2.3. gyógyszer okozta hemolízis.
2.1.3. Egyes kemoterápiás készítmények anémiát okozó hatása még kifejezettebb. Ezek a platina-tartalmú kemoterápiák, melyeket leginkább ovarium, tüdő, fej-nyaki daganatokban alkalmaznak. Valószínűleg a tüdő és nőgyógyászati tumorokban nagyobb arányban előforduló anémia is a betegségre adott kemoterápia platina tartalmával függ össze. Az anémia objektív tünete lehet a tartós gyors szívverés, szédülés, gyors, felületes, nehézlégzés, fejfájás, személyiségváltozás, depresszió. A súlyos, pihenésre nem javuló kimerültség talán a legjellemzőbb és leggyakrabban elforduló szubjektív tünet, mely a betegek mindennapi életvitelét a leginkább ronthatja. A kimerültségnek egyéb okai is lehetnek: radioterápia, alapbetegség, szorongás, depresszió. Az alacsony haemoglobin szint az alkalmazott kemoterápia hatékonyságát csökkenti, így a várható túlélésre is kihat. Az anémia kezelése az onkológiai terápia fontos része. A daganatos betegségek okozta vérszegénység kezelésében a vörösvérsejt transzfúzió és a rekombináns DNS technológiával előállított ESA készítmények állnak rendelkezésre.
2.2. A kezelés megválasztásánál mérlegelendő szempontok
2.2.1. Transzfúzió
2.2.1.1. a rendelkezésre álló mennyiség szűkössége, kiszámíthatatlan volta,
2.2.1.2. transzfúziós reakciók: korai, késői, immunológiai és nem immunológiai okok,
2.2.1.3. vércsoport tévesztés veszélye,
2.2.1.4. vérátömlesztéssel átvihető betegségek potenciális veszélye.
2.2.2. A transzfúziós kezelés előny és hátrány mérlegelése
| A | B | |
| 1 | Előny | Hátrány |
| 2 | gyors haemoglobin emelkedés | transzfúziós reakciók |
| 3 | gyorsan csökken a beteg kimerültség érzése | kongesztív szívelégtelenség |
| 4 | fertőzések átvitele | |
| 5 | vastúlterhelés | |
| 6 | fokozott thromboemboliás készség | |
| 7 | csökkenő túlélés |
2.2.3. Eritropoetin készítmények
Az eritropoetin glikoprotein típusú differenciáló, mitózis-stimuláló hormon. 2-3 hét késés tapasztalható az eritropoetin alkalmazása és az eritropoetin-indukálta vörösvérsejtek megjelenése között.
2.2.4. Eritropoetin alkalmazásának előnyei és lehetséges hátrányai
| A | B | |
| 1 | Előny | Hátrány |
| 2 | transzfúziós igény csökken | thrombotikus szövődmények |
| 3 | fokozatosan csökken a beteg kimerültség érzése | csökken a túlélés |
| 4 | a tumor progressziójáig eltelt idő csökken | |
| 5 | hipertenzió/zavartság | |
| 6 | tiszta vörösvérsejt aplázia (PRCA) |
Az eritropoetin készítmények alkalmazása során multicentrikus vizsgálatok súlyos, az életet megrövidítő és kevésbé súlyos mellékhatásokról számoltak be. Nem bizonyított, de kizárni sem lehet biztonsággal, hogy az ESA készítmények a kissejtes tüdőrák kivételével gyorsíthatják a tumorok progresszióját. Egyéb mellékhatásokat is okozhat az eritropoetin kezelés, mint a hányinger, hasmenés, hányás; influenzaszerű tüneteket szintén leírtak. A törzskönyvi indikációs feltételek szigorú betartása, a betegek szoros monitorozása a mellékhatások előfordulásának csökkentése miatt elengedhetetlen.
3. Finanszírozás rendje, finanszírozási algoritmus
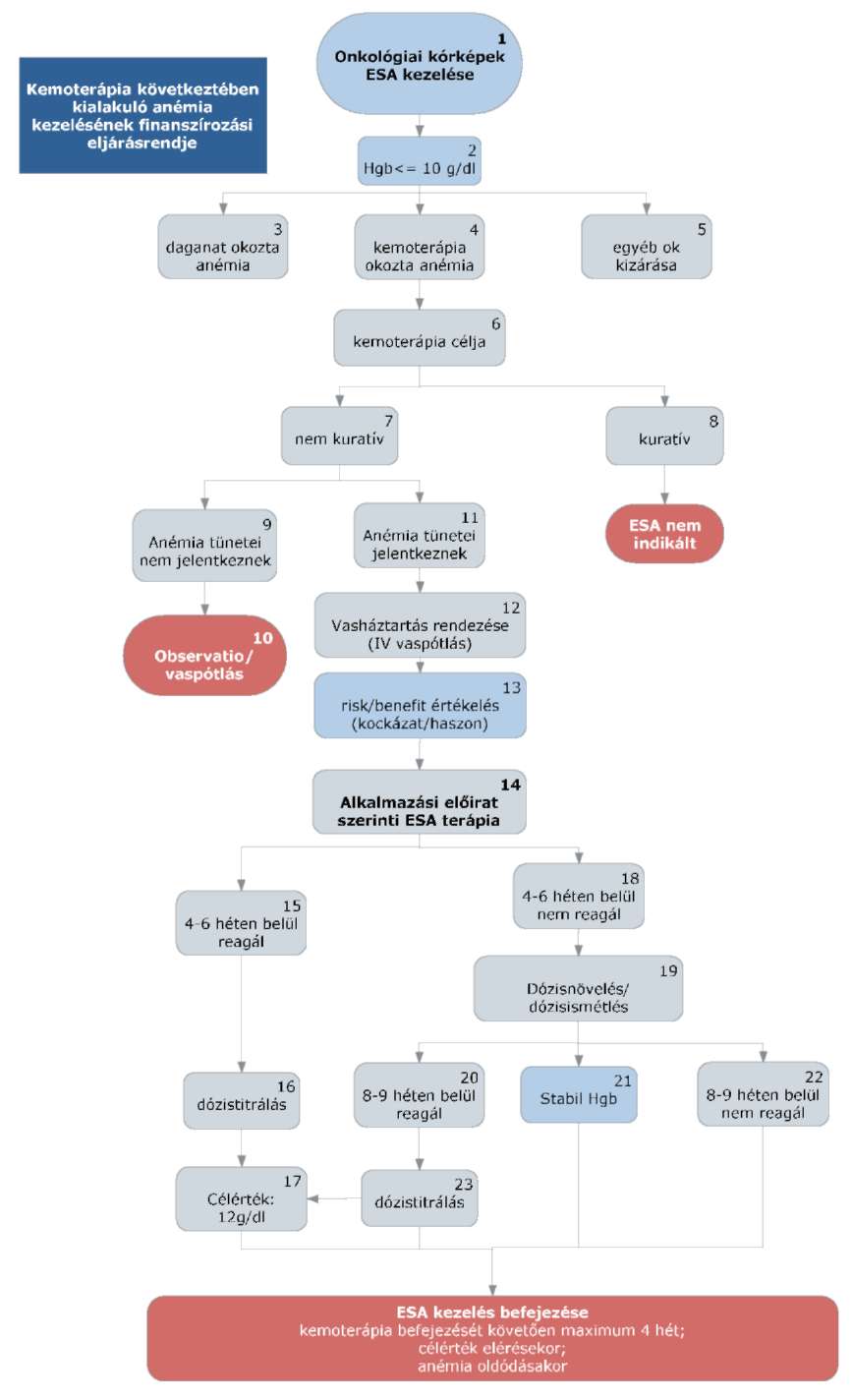
3.1. A finanszírozási algoritmus részletezése
(1) : Az ESA terápia az alábbi tumoros kórképek kezelése során alkalmazható: BNO: C62, C50, C34, C82-85, 88, 90-91, C56-57.
(2) : A beteg szérum Hgb szintje 10 g/dl vagy ez alatt kell, hogy legyen az ESA terápia megkezdése előtt.
3.1.1. A kezelés megkezdése előtt az anémia etiológiájának vizsgálata szükséges. Ennek során első lépésben a vérszegénység jellemzésére (retikulocitaszám és átlagos vörösvérsejt térfogat: MCV), majd a potenciálisan korrigálható etiológia tisztázására kerül sor. Az ESA készítmények kizárólag kemoterápia okozta anémia (4) kezelésére használhatók. Egyéb okok: daganat okozta (3) és egyéb más ok, pl. sugárterápia (5) miatti anémia kezelésére nincs törzskönyvezve.
3.1.2. Az alkalmazott kemoterápia célja
(6): Az ESA terápia kizárólag nem kuratív (7) céllal alkalmazott kemoterápia mellett adható.
Kuratív (8) célú kemoterápia mellett nem finanszírozott az ESA terápia. A kemoterápia célját a kezelőorvos dönti el, azonban a hererák, korai emlőtumor, a korai nem kissejtes tüdőrák primer és adjuváns kemoterápiája, a Hodgkin kór és agresszív non-Hodgkin lymphomák kezelése kuratív célúnak tekintendő, amíg az ellenkezője nem bizonyosodik be. Az ESA kezelés független indikációja a krónikus veseelégtelenség, melynek jelenléte esetén a kuratív kemoterápia időszakában is indikált lehet a szigorúan monitorozott ESA alkalmazás. Ilyenkor a kezelés beadását követően, a vesebetegség esetére vonatkozó alkalmazási előirat szerint használandó.
3.1.3. Tünetek vizsgálata
ESA kezelés során tünetekkel járó vérszegénység esetében a hemoglobin érték 8-10 g/dl, tünetmentes, stabil állapotú betegek esetében 7-9 g/dl szinten tartandó (11).
Objektív tünetek lehetnek: perifériás ödéma, tachycardia, tachypnoe. Szubjektív tünetek: mellkasi fájdalom, terhelésre jelentkező dyspnoe, fáradtság érzés, szédülés, gyengeség, fülzúgás.
(9): Amennyiben a betegnél még nem jelentkeznek tünetek és a vérszegénység nem éri el a 7 g/dl hemoglobin szintet, obszerváció és szükség szerint vaspótlás (10) javasolt.
3.1.4. Vasháztartás rendezése
(12) : Az ESA terápia bevezetése előtt a beteg vasháztartását rendezni kell, és ezt a betegdokumentációban is rögzíteni szükséges. Ez történhet orális vagy parenterális vaskészítményekkel egyaránt. Mikrocitás anémia (MCV< 80 fl) esetén kötelező, egyébként ajánlott a vasháztartás vizsgálata (ferritin, transzferrin szaturáció). Abszolút vashiányra utal, ha a szérum ferritin koncentráció <30 ng/ml, transzferrin szaturáció <15%. Funkcionális vashiányra utal, ha a ferritin koncentráció ≤ 800 ng/ml és a transzferrin szaturáció <50%. Abszolút vashiányban intravénás vaskezelés szükséges, funkcionálisban az ESA kezelés mellett a vaspótlás megfontolandó. Elvethető a vashiány, ha a ferritin > 800 ng/ml vagy a transzferrin szaturáció ≥ 20%.
3.1.5. Előny és kockázat (risk/benefit) mérlegelése
(13) : Az ESA terápia megkezdése csak a beteggel való közös döntés eredménye lehet. A beteget teljes körűen tájékoztatni kell a kezelés céljáról, a várható eredményekről és a kockázatokról. Általános beteg tájékoztatás során ki kell térni az ESA kezelés lehetséges mellékhatásaira. Fontos mérlegelési szempont a vérszegénység rendezésére rendelkezésre álló idő (gyorsan rendezendő esetben transzfúzió, megfelelő kritériumok esetében lassan is rendezhető esetben ESA adása jön szóba) és a transzfúzió adásával járó volumenterhelés.
3.1.6. ESA terápia megkezdése
(14) : A fenti feltételek szerint az ESA terápia elkezdhető a készítmények alkalmazási előirataiban foglalt dozírozás szerint.
3.1.7. ESA terápia eredményességének megítélése a haematológiai paraméterek mentén
(15) : Reagál: a szérum Hgb szint változás nagyobb, mint 1 g/dl vagy a retikulocitaszám nagyobb, mint 40 000 sejt/µl 4-6 hetes ESA terápiát követően. A 4 hét az epoetin alfa, a 6 hét a darbepoetin alfa készítményre vonatkozik. A dózistitrálás alapja a Hgb célérték fenntartása, vagyis a lehető legalacsonyabb dózisra kell a beteget beállítani, amivel még a célérték fenntartható (16-17).
(18): Nem reagál: a fenti paraméterek nem teljesülnek 4-6 hét kezelést követően. Ebben az esetben dózisemelés/dózisismétlés lehetséges (19) a gyógyszerek alkalmazási leiratai szerint, majd a hematológiai paraméterek újraértékelése következik a 8-9. héten.
3.1.8. Terápia befejezése
(20) : Amennyiben az emelt dózissal 8-9 héten belül reagál (fenti kritériumok szerint), dózistitrálás (23), amennyiben szükséges, majd a célérték elérésekor (17), illetve a terápiás idő leteltével a kezelés befejezése.
(21) : Amennyiben a dózisemeléssel/ismétléssel stabilan tartható a beteg haemoglobin szintje, a gyógyszeres terápia folytatható az algoritmusban meghatározott feltételekig.
(22) : Amennyiben 8-9 hetes kezelést követően, dózisemelés/ismétlés mellett sem történt haematológiai válaszreakció, a kezelés felfüggesztése indokolt.
3.1.9. Az ESA kezelés befejezése: a kemoterápiás kezelést követő maximum 4. hétig; a célérték elérésekor (célérték tartása), illetve az anémia oldódásakor. A célérték elérésekor vagy annak közelében a szerek törzskönyvében előírt dózisredukcióra, a célérték meghaladásakor a kezelés felfüggesztésére lehet szükség.
4. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
4.1. Az adott indikációs körben és feltételek mellett alkalmazták-e az ESA készítményeket?
4.2. A szérum Hgb szint 10 g/dl vagy ez alatti volt a terápia megkezdésekor?
4.3. A terápia megkezdése előtt a beteg vasháztartását rendezték? (A vaspótlás szükségességét a microcytás anémia kifejezetten valószínűsíti.)
4.4. Nem kuratív céllal alkalmazott kemoterápia mellett adták-e a készítményeket? (Erről a kezelőorvos nyilatkozata szükséges.)
4.5. Az ESA terápia felfüggesztése az eljárásrend szerint, a hematológiai paraméterek mentén történt?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. A releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | C62 | Heretumor |
| 3 | C50 | Emlődaganat |
| 4 | C34 | Tüdődaganat |
| 5 | C82-85 | Malignus lymphoma |
| 6 | C88 | Malignus lymphoma |
| 7 | C90-91 | Malignus lymphoma / myeloma |
| 8 | C56-57 | Ovarium tumor |
6.2. A releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 11301 | Kontrollvizsgálat, konzílium |
| 4 | 29000 | Szövettani vizsgálat szokásos feldolgozási módszerrel |
| 5 | 29050 | Szövettani vizsgálat immunhisztokémiai reakció alkalmazása esetén |
| 6 | 14251 | Biopsia medullae ossealis crista ossis ilei |
| 7 | 3523B | Áttekintő csontszcintigráfia |
| 8 | 2640N | CD sejtszám meghatározása, antigénenként, áramlási citométerrel, egyéb fluorop |
| 9 | 2640L | CD sejtszám meghatározása, antigénenként, áramlási citométerrel, FITC-el jelöl |
| 10 | 2640M | CD sejtszám meghatározása, antigénenként, áramlási citométerrel, phycoerithrei |
| 11 | 66343 | Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpenzió |
| 12 | 66290 | Vörösvérsejt koncentrátum határréteg szegény, reszuszpendált, szerelékkel |
| 13 | 64125 | Vörösvérsejt koncentrátum zárt rendszerben mosott, fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
| 14 | 66290 | Vörösvérsejt koncentrátum határréteg szegény, reszuszpendált, szerelékkel |
| 15 | 66343 | Vörösvérsejt koncentrátum, zárt rendszerben, szűrt és mosott kb. 50 ml, adenin tartalmú oldatban, reszuszpendált, szerelékkel |
| 16 | 66344 | Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, kb. 50 ml, adenin tartalmú oldatban, reszuszpendált, szerelékkel |
| 17 | 66348 | Vörösvérsejt koncentrátum, 1 E gépi aferezis, adenin tartalmú oldatban reszuszpendált, szerelékkel |
| 18 | 66992 | Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, mosott fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
| 19 | 66993 | Vörösvérsejt koncentrátum, fagyasztott, -196 °C, felolvasztott, szerelékkel |
| 20 | 69971 | Vörösvérsejt koncentrátum, szűrt, fagyasztott, -196 °C, szerelékkel |
| 21 | 69972 | Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpendált, szerelékkel |
| 22 | 64125 | Vörösvérsejt koncentrátum, zárt rendszerben mosott, fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
| 23 | 37008 | Konformális besugárzás kiegészítő pontja |
| 24 | 37220 | Lineáris accelerátor, foton 16 MV és a felett, egy mező |
| 25 | 37210 | Lineáris accelerátor, foton 7-15 MV és a felett, egy mező |
| 26 | 37200 | Lineáris accelerátor, foton 6 MV-ig, egy mező |
| 27 | 37007 | Irreguláris mezős besugárzás kiegészítő pontja, egy mező |
| 28 | 3586A | Pótlék: egy testtájék kiegészítő SPECT vizsgálat |
| 29 | 28939 | Fluoreszcencia insitu hibridizáció (FISH) humán betegségekben |
| 30 | 26625 | CA 125 |
| 31 | 29400 | Diagnosztikus aspirációs/exfoliatív citológiai vizsgálat a szokásos feldolgozási módszerrel |
| 32 | 36130 | Hasi (áttekintő, komplex) UH vizsgálat |
| 33 | 31312 | Mellkasfelvétel, kétirányú |
| 34 | 31310 | Mellkasfelvétel, AP/PA |
6.3. A releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 492C | Szubtotális emlőeltávolítás rosszindulatú daganat miatt, társult betegséggel |
| 3 | 491B | Teljes emlőeltávolítás rosszindulatú daganat miatt, társult betegség nélkül |
| 4 | 491A | Teljes emlőeltávolítás rosszindulatú daganat miatt, társult betegséggel |
| 5 | 506A | Rosszindulatú emlődaganatok társult betegséggel |
| 6 | 506B | Rosszindulatú emlődaganatok társult betegség nélkül |
| 7 | 6140 | Here műtétei malignus betegségek miatt |
| 8 | 621A | Férfi reproduktív rendszer rosszindulatú daganatai társult betegséggel |
| 9 | 621B | Férfi reproduktív rendszer rosszindulatú daganatai társult betegség nélkül |
| 10 | 945A | Non-Hogdkin lymphoma, nem akut leukémia kemoterápiája 18 év felett |
| 11 | 771D | Lymphoma, nem akut leukémia 18 év felett |
| 12 | 944C | Hodgkin-kór, Non-Hogdkin lymphoma, nem akut leukémia kemoterápiája 18 év felett, legalább |
| 14E szűrt és besugárzott vérkészítmény adás | ||
| 13 | 6420 | Uterus,adnex műtétei malignitás miatt |
| 14 | 657A | Női reproduktív rendszer rosszindulatú daganatai társult betegséggel |
| 15 | 657B | Női reproduktív rendszer rosszindulatú daganatai társult betegség nélkül |
| 16 | 6520 | Női reproduktív rendszer egyéb műtétei |
| 17 | 1460 | Légzőszervi daganatok |
6.4. A releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | B03XA01 | Eritropoietin, epoetin alfa, epoetin theta, epoetin zéta |
7. Rövidítések
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
ESA: Erythropoesis stimulating agens (EPO készítmények gyűjtőfogalom)
HBCS: Homogén betegségcsoport
OENO: Orvosi eljárások nemzetközi osztályozása"
10. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"5. melléklet a 31/2010. (V. 13.) EüM rendelethez
A Parkinson betegségcsoport diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Neurodegeneratív megbetegedések:
1.1. G20HO Parkinson-kór
1.2. G2110 Egyéb, gyógyszer-indukálta másodlagos parkinsonismus
1.3. G2120 Más külső tényező okozta másodlagos parkinsonismus
1.4. G2130 Agyvelőgyulladás utáni parkinsonismus
1.5. G2180 Egyéb másodlagos parkinsonismus
1.6. G2190 Másodlagos parkinsonizmus k.m.n.
2. Fogalmak
2.1. A szintű bizonyíték: Az adott beavatkozás hatásossága egyértelműen bizonyított ("hatásos"). Azaz: legalább egy I. szintű vagy legalább két II. szintű vizsgálat egybehangzó eredménye támasztja alá.
2.2. B szintű bizonyíték: Az adott beavatkozás hatásossága valószínűen hatásos. Azaz: legalább egy II. szintű vagy legalább három III. szintű vizsgálat egybehangzó eredménye támasztja alá.
2.3. C szintű bizonyíték: Az adott beavatkozás hatásossága/nem hatásossága lehetséges. Azaz legalább két III. szintű vizsgálat meggyőző és egybehangzó eredménye támasztja alá.
2.4. Bradykinézia/hypokinézia: A mozgás sebességének, amplitúdójának csökkenése, a mozgás indítás és leállítás és a program váltás megnehezülése. A Parkinson-kór diagnózisának egyik alappillére.
2.5. Disztónia: Akarattól független izom összehúzódás, amely tartászavart hoz létre (pl. tortikollis, OFF-disztónia: az öregujj dorzalflexiója, stb.), gyakran komoly fájdalommal jár, diszkinézissel ötvöződhet.
2.6. Diszkinézis: akarattól független, ismétlődő, irreguláris izommozgás (pl. a végtagokban korea, a törzsön atetózis formájában, disztóniával ötvöződhet).
2.7. Életminőség: A beteg utóbbi 3 életévére vonatkozóan, a személyére szabott kezelés megítélésére kialakított fogalom. A beteg állapotának önértékelő teszt segítségével való értékelését teszi lehetővé, értékes módon kiterjeszti a célzott anamnézis felvételének értelmét, célszerűen egészíti ki az UPDRS, illetve az MDS-UPDRS skálákat. Hazánkban több teszt is validált, alkalmazható (pl. PDQ-39).
2.8. Ergot derivátum: Növényből kivont dopamin agonista hatású gyógyszerkészítmény. Retroperitoneális, pleuropulmonális és kardiális valvuláris fibrózist okozhat. Alkalmazása során félévenként transztorakális szív ultrahang vizsgálat kötelező.
2.9. Fluktuáció: A betegség súlyosbodása során a korábban egész nap hatásos gyógyszeres kezelés hatása egyenetlenné válik. Az egyik típusa a hatáscsökkenés-dózis lecsengés (Wearing-off, WO) és a rossz mozgásteljesítménnyel járó állapot (OFF), melyhez disztónia kapcsolódhat, a másik a dózis időbeli csúcshatásához kapcsolódó, akarattól független mozgások (csúcsdózis diszkinézia, ON-diszkinézia). A kórlefolyás során a WO és az OFF általában megelőzi a csúcsdózis diszkinézia jelentkezését. A fluktuáció a kétféle állapot egymást követő váltakozását jelenti. A fluktuáció kialakulásában a kezelés kizárólagos szerepe egyértelműen nem bizonyított.
2.10. Freezing: "Lefagyás". A mozgás, a mozgáskoordináció hirtelen, váratlan zavara, leállása.
2.11. Késői Parkinson-kór/betegség: Késői Parkinson-kórról a motoros komplikációk megjelenése után beszélünk.
2.12. Komorbid betegségek: A Parkinson-kórhoz kapcsolódó bármely betegség. A betegség lefolyása során bármikor fontos ezek felismerése és mérlegelésük a terápiában. Különösen fontos a pszichiátriai betegségek elkülönítése és kezelése.
2.13. Komplex nem-motoros tüneti szindróma: A motoros tüneteket több évvel megelőző tünetegyüttes, amely a betegség megjelenésére utal/prognosztizálja: székrekedés, szaglászavar, hangulati élet elcsendesedése - hangulatzavar, alvászavar, nyálfolyás, vizelettartási zavar, egyoldali vállfájdalom, szürkületi látás problémák.
2.14. Motoros tünetek: A bazális ganglionok működészavara által kiváltott mozgató rendszeri tünetek. Ezek a Brit Agybank kritériumrendszere alapján meghatározott fő mozgás zavar típusok és a hozzájuk kapcsolódó másodlagos mozgatórendszeri tünetek együttesen.
2.15. Nem motoros tünetek: A beteg életminőségét a motoros tüneteknél is markánsabban meghatározó összes eltérés: kognitív, hangulati, magatartási, érzőrendszeri, fájdalmi, autonóm idegrendszeri, gasztrointesztinális jellegű panaszcsoportok és vizsgálható eltérések. Ezek egy része megelőzi a motoros tüneteket. Számuk szaporodik a betegség lefolyása során, és a motoros fluktuációkhoz kapcsolódva még erőteljesebbek lesznek.
2.16. Nyugalmi tremor: A végtagok, az ajak, a nyelv, a szempilla oszcilláló, ritmusos, akarattól független mozgása, amely a testrész akaratlagos innervációtól mentes állapotában észlelhető, és akaratlagos mozgás során megszűnik. A Parkinson-kór diagnózisának másik, lehetséges motoros alappillére. A betegek egy részében mozgásra aktiválódó végtag komponensek lehetnek.
2.17. On-off jelenség: Motoros komplikáció. A gyógyszeres kezelés hatására csökkennek a Parkinson-kór tünetei, azonban a hatóanyag koncentrációja az agyban nem állandó. Amikor a szint alacsony, a tünetek erősebbek (off fázis). Az off és on fázis váltakozása jelenleg együtt jár a Parkinson-kórral, és a hosszú távú levodopa kezelés után az ingadozás kiszámíthatatlanabbá válik.
2.18. Parkinsonizmusok: A Parkinson-kórtól (betegségtől) elkülöníthető, de hasonló tünetekkel rendelkező kórismék.
2.19. Parkinson-kór (PK): A hazai szakmai nyelvhasználat alapján az (Idiopátiás) Parkinson-szindróma, amely az eljárásrendben részletesen leírásra került, amely a leírásra kerülő terápiákkal tünetileg egyértelműen kezelhető (angolszász forrásokban: Parkinson's Disease).
2.20. Parkinson-kór előrehaladott szakasza: A motoros komplikációk azon szakasza, mely során a beteg életminősége nem tartható fenn a komplex gyógyszeradagolás egyénre szabott módszereivel, a súlyos tünetek és az állapot kifejezett, permanens változékonysága csak speciális kezelési eljárások alkalmazásával biztosítható. Ez a szakasz a beteg haláláig tart. A kezelés indikációja, esetleges leállítása a beteg belegyezése és neurológus által vezetett munkacsoport döntésén alapszik.
2.21. Parkinson-kór korai szakasza: A motoros tünetek megjelenésétől a motoros fluktuációk megjelenéséig (diagnosztikus kritériumok alapján felállított diagnózis).
2.22. Parkinson-kór motoros komplikációk szakasza: A motoros fluktuációk kezdetétől a betegség előrehaladott fázisán át a beteg haláláig tartó szakasz.
2.23. Parkinson-szindrómák (PSZ): Ezen betegségekben a Parkinson-kórra jellemző neurológiai gócjelekhez (parkinzonizmus tünetei) egyéb, a beteg sorsát döntően meghatározó neurológiai eltérések kapcsolódnak a betegség kezdetétől, máskor későbbi szakaszában. Ezen betegségek patomechanizmusa egyes esetekben teljesen eltér a Parkinson-kórban ismertektől. Ezen betegségek tünetei kismértékben vagy nem reagálnak a klasszikus dopaminerg terápiára.
2.24. RBD (REM alvás magatartás zavar): Az alvás REM fázisát nem a szokásos tónustalanság jellemzi, hanem folyamatos mozgások, testhelyzetváltozások, hangadás, kiabálás, ágyról való leesés, ágynemű összegyűrése és az ezzel járó kellemetlen tartalmú álmok.
2.25. Rigor: Az izomzat nyugalomban is fennálló, sokszor fájdalmas feszülése, amely egyaránt érinti a végtagok agonista és antagonista izmait. A Parkinson-kór diagnózisának másik alappillére lehet.
2.26. Tremor: Nyugalmi remegés. A Parkinson-kór motoros alaptünete.
2.27. Wearing-off állapot: A dopaminerg gyógyszerhatás (levodopa, dopamin agonista) visszatérő, gyógyszerbevételektől függő formája és a hatástalanság megjelenését jelenti: a már hatékonyan kezelt motoros és nem-motoros tünetek igen kifejezetten visszatérnek. Hatáscsökkenés esetén egyenletesen, míg dózisvégi csökkenés esetén a következő bevett gyógyszer adag hatása jelentkezéséig. Különleges OFF-állapotok is vannak: a hatáskésés (Delayed-ON): a "szokásos" idő elmúltával nem jelentkezik a hatás, csak később; hatás elmaradás (No-ON): a gyógyszerbevétel ellenére nincs hatás.
2.28. "Red Flag": Olyan panasz és neuropsychiátriai jelenség, gócjel, amely a betegség korai szakaszában jelzi a vizsgálónak, hogy Parkinson-szindróma valószínű és nem Parkinson-kór.
3. Kórkép leírása
3.1. A Parkinson-kór gyakori, progresszív neurodegeneratív betegség, amelyben az idegrendszerben a substantia nigra dopaminerg neuronjainak degenerációja miatt a dopamin-szint leesik. A dopamin a szervezetben a neuronok közötti ingerület-átvitelért felelős, így a szint csökkenése az idegsejtek közötti kommunikációt akadályozza.
3.2. A Parkinson-kór a mozgászavarokhoz tartozó neuropsychiátriai betegség. A betegség diagnózisa ma is klinikai és két ún. pillértüneten nyugszik: az egyik mindenképpen a bradykiézia/hypokinézia (a mozgás program lassúsága), míg a másik pillértünet lehet a rigor (merevség) vagy a nyugalmi tremor (végtag, ajak, pilla akarattól független, azaz nyugalmi ritmikus mozgása), vagy mind a kettő. A negyedik főtünet a betegség előrehaladott szakaszában jelentkezik, ez a tartási instabilitás. Előfordulhat a betegség kezdetén tremor domináns klinikai forma, ennek diagnózisa nehezebb.
3.3. Parkinson-kórban a motoros tüneteken kívül nagy jelentőségük van a nem-motoros tüneteknek is: pszichológiai problémák, demencia, a későbbiekben autonóm zavarok. A betegség előrehaladott fázisban komoly fogyatékossághoz, rokkantsághoz vezet, nagymértékű életminőség-csökkenést okoz.
3.4. A Parkinson-kór prevalenciája 200-400 fő/100 000 lakosra, Magyarországon a betegszám megközelítőleg 20 000 fő, a betegek 50-70%-a áll kezelés alatt. Jelenleg az évi incidencia 8-10/100 000 lakos, de az arány folyamatosan növekszik.
4. Finanszírozás rendje, finanszírozási algoritmus
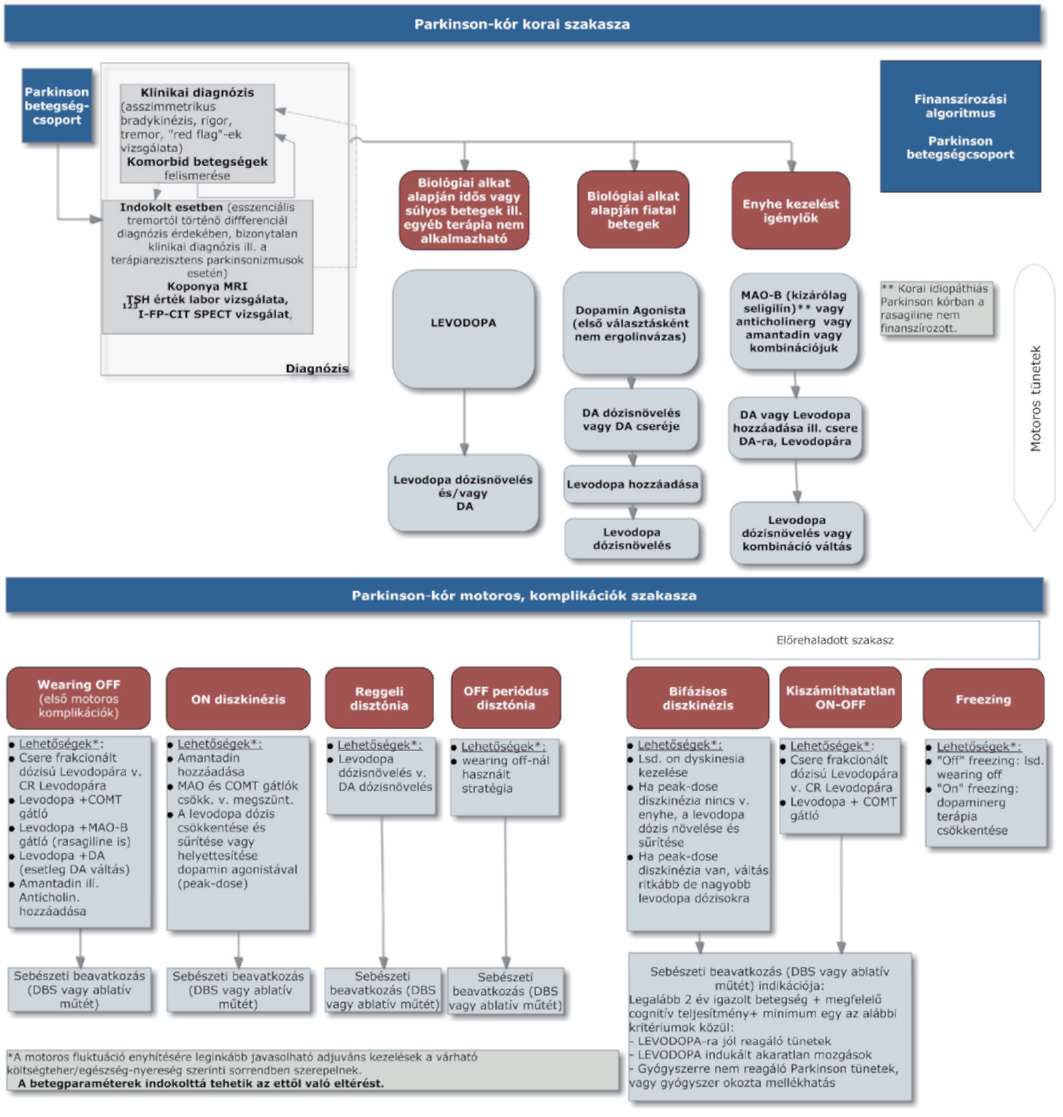
5. A Parkinson betegség ellátására vonatkozó emelt, indikációhoz kötött támogatás:
5.1. EÜ90 6/a. Támogatott indikációk:
Parkinson-kór és Parkinson-szindróma (másodlagos parkinsonismus) kezelésére - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.1.1. amantadine
5.1.2. biperiden
5.1.3. levodopa, benserazide hydrochloride
5.1.4. procyclidine
5.1.5. selegiline
5.2. EÜ90 6/b. Támogatott indikációk:
Parkinson-kór esetén, az alkalmazási előírásban szereplő monoterápiában, L-DOPA és selegilinnel, illetve amantadinnal való kombinált kezelésben kiegészítő kezelésként is, ha súlyos motoros fluktuáció jelentkezik - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.2.1. pramipexole
5.2.2. rasagiline
5.2.3. ropinirole
5.2.4. rotigotine
5.3. EÜ90 6/c. Támogatott indikációk:
Parkinson-kórban kialakuló motoros fluktuáció minden esetében - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.3.1. entacapone
5.3.2. levodopa, carbidopa, entacapone
6. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
6.2. Betegadatok (online TAJ ellenőrzés)
6.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7. Szakmai ellenőrzési pontok
7.1. A klinikai diagnózis felülvizsgálata rendszeres időközönként, fél-egyévente történik.
7.2. A diagnózis klinikai szempontrendszer szerint történik, MRI, PET-CT és CT Parkinson-szindróma differenciál diagnózisában nem kötelező, de indokolt lehet, agyi SPECT csak indokolt esetben (fent meghatározott) végzendő.
7.3. A gyógyszeres kezelés akkor kezdődhet, ha a klinikai diagnózis megszületett. A Parkinsonos tünetek egységes rendszer alapján értékelhetőek. Az UPDRS (Unified Parkinson's Disease Rating Scale) vagy az ebből továbbfejlesztett MDS-UPDRS (Movement Disorders Society Unified Parkinson's Disease Rating Scale) skála lehetőséget ad erre.
7.4. Anticholinerg és amantadin korai Parkinson-kórban első választású terápiaként nem alkalmazható, kivéve, ha a beteg egyéb, gyógyszer-indukálta másodlagos parkinsonismusban szenved. Ekkor anticholinerg szer adható. COMT gátló csak a fluktuációk kezdetétől adható.
7.5. Neuroprotektív céllal csak klinikai vizsgálat keretében kezelhetők a betegek.
7.6. A motoros komplikációk klinikai megállapítása után (Parkinson skálák) a beteg adjuváns terápiában részesül. Az adjuváns terápia a motoros komplikációk jellegétől és mértékétől függ.
7.7. Az ún. előrehaladott kezelési lehetőségek, mint műtéti beavatkozás csak speciális (fent meghatározott) esetekben indokolt.
7.8. Minden beteg számára hozzáférhető kell, hogy legyen a fizioterápiás kezelés, a pszichológiai és szociális kezelés/gondozás.
7.9. A Parkinson-kór diagnózisának felállításától kezdve a betegek kezelésben részesülnek a nem-motoros tünetek kontrollálására.
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása.
8.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. A releváns BNO kódok
| A | B |
| 1 | BNO | BNO megnevezés |
| 2 | G20H0 | Parkinson-kór |
| 3 | G2110 | Egyéb, gyógyszer-indukálta másodlagos parkinsonismus |
| 4 | G2120 | Más külső tényezők okozta másodlagos parkinsonismus |
| 5 | G2130 | Agyvelőgyulladás utáni parkinsonismus |
| 6 | G2180 | Egyéb másodlagos parkinsonismus |
| 7 | G2190 | Másodlagos parkinsonismus k.m.n. |
| 8 | Y4670 | Antiparkinson gyógyszerek |
9.2. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezése |
| 2 | N04* | Anti-parkinson gyógyszerek |
| 3 | N04A* | Anticholinergek |
| 4 | N04AA | Tercier aminok |
| 5 | N04B* | Dopaminergek |
| 6 | N04BA | Dopa és dopa derivátumok |
| 7 | N04BB | Adamantane derivátumok |
| 8 | N04BC | Dopamin agonisták |
| 9 | N04BD | MAO-B gátlók |
| 10 | N04BX | Egyéb dopaminergek (COMT-gátlók) |
9.3. Finanszírozott hatóanyagok Magyarországon
| A | B | |
| 1 | ATC | Hatóanyag |
| 2 | N04AA02 | biperiden |
| 3 | N04AA04 | prociklidin |
| 4 | N04BA02 | levodopa és decarboxylase gátló |
| 5 | N04BA03 | levodopa, decarboxylase gátló és comt gátló |
| 6 | N04BB01 | amantadin |
| 7 | N04BC04 | ropinirol |
| 8 | N04BC05 | pramipexol |
| 9 | N04BC09 | rotigotine |
| 10 | N04BD01 | selegilin |
| 11 | N04BD02 | rasagiline |
| 12 | N04BX02 | entacapone |
10. Rövidítések
ATC Gyógyszerek anatómiai, terápiás, illetve kémiai osztályozása
BNO Betegségek nemzetközi osztályozása"
11. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"6. melléklet a 31/2010. (V. 13.) EüM rendelethez
A hepatitis B vírus okozta krónikus májgyulladás diagnosztikájának és terápiájának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Idült vírusos B-típusú hepatitis d-ágenssel (B1800)
Idült vírusos B-típusú hepatitis d-ágens nélkül (B1810)
2. Kórkép leírása
2.1. Járványtan
2.1.1. Kórokozója a hepatitis B vírus, a Hepadnaviridae család tagja, mely egy DNS vírus. A fertőzést követően az esetek túlnyomó többségében (70%) tünetmentes infekció zajlik, tünetek csupán 30%-ban alakulnak ki. A fertőzött felnőttek 5-10%-ában jön létre chronicus fertőzés. Hazánkban kb. 7-15 000 beteg szorulhat ténylegesen kezelésre.
2.1.2. A kórkép jelentőségét az adja, hogy a vírus általában parenterálisan terjed, fertőzött vér és vérkészítmények útján. A donorvér rutinszerű szűrése jelentősen csökkentette a fertőzések átvitelét, de a kábítószer élvezők által közösen használt injekciós tűk még mindig komoly veszélyt jelentenek. A fertőzés kockázata nagyobb haemodyalizált betegeken, onkológiai betegeken és vérrel érintkezésbe kerülő kórházi dolgozókon. A fertőzés a parenterális úton kívül más módon is terjedhet, hetero- és homoszexuális érintkezéssel, valamint zárt intézményekben (pl. börtönök). A fertőzés reservoirjai világszerte az idült HBV hordozók. A fertőzés prevalenciája földrajzi és más tényezőktől függően jelentősen eltérő lehet (0,5%-10%), Távol-Keleten akár a 10%-ot is meghaladja. A vertikális transzmisszió különösen ezeken a vidékeken fordul elő.
2.2. Diagnózis felállítása
A diagnosztikában az anamnézis felvétel, valamint a fizikális vizsgálat mellett nagy jelentősége van a labor diagnosztikának. A beteg általános tünetekkel keresi fel háziorvosát: fáradékonyság, gyengeség, émelygés, hányinger, láz, urticaria-szerű kiütések, ízületi fájdalmak, jobb bordaív alatti nyomás, feszülés, sötét vizelet. A labor diagnosztika magában foglalja a hagyományos "máj-panel" vizsgálatokat, a háromféle antigén-antitest rendszer (Hbe, Hbs, Hbc) kimutatását, valamint magának a vírusnak a jelenlétét, illetve a vírus kópiaszám kimutatását is. Ez utóbbi igen érzékeny PCR technikával történik. A vírus kópiaszámának az ismerete alapvető a terápia eldöntése, valamint a beteg monitorozása szempontjából.
2.3. Klinikai lefolyás
A betegnél a tünetek jelentkezését követően icterus alakul ki. Az esetek túlnyomó többségében a vírus eliminálódik a májból kiterjedt májsejt destrukció nélkül is. A HbsAg és a HbeAg eltűnését követően magastiterű antitest szintek detektálhatók, de a HBV DNS alacsony szinten még hosszú ideig kimutatható. Persistáló vírusinfekció esetén a vírusprodukció folytatódik, gyakran életfogytiglan, de krónikus fertőzés esetén a viraemia mértéke alacsonyabb szinten marad. Szintje az idő múlásával fokozatosan csökken és seroconversio is bekövetkezhet. Ennek éves gyakoriságát az érintett populációban kb. 5-10%-ra becsülik. Tartós HBV hordozás a primer hepatocellularis carcinoma (HCC) kialakulásának gyakoriságát a százszorosára növeli az átlagos populációhoz képest. A Hbe Ag pozitív csoportban a HCC kialakulásának gyakorisága még nagyobb.
3. Terápia
A kezelés legfontosabb célja a viraemia csökkentése, illetve megszüntetése, a vírusreplikáció gátlása és a májkárosodás javítása, illetve gyógyítása. A vírus folyamatos jelenléte esetén sokkal nagyobb a kockázata a chronicus hepatitis, cirrhosis, illetve a hepatocellularis carcinoma kialakulásának. Leginkább veszélyeztetettek a HbeAg pozitív, valamint a HbeAg negatív, de magas vírus titerű betegek. A terápia eredményességét a HbeAg eliminálása és a keringésben kimutatható vírusok számának csökkenése, illetve seroconversio kialakulás (anti-Hbe antitestek kialakulása) jelzi.
4. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
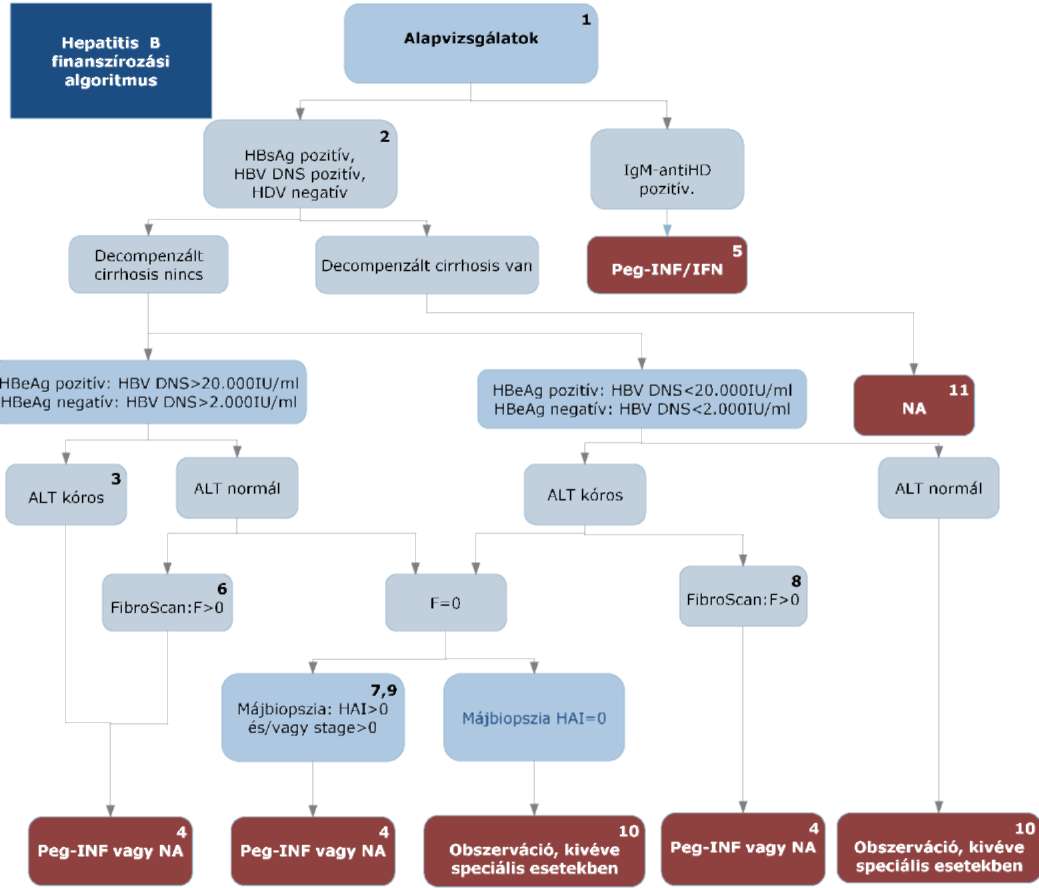
4.1. A finanszírozási algoritmus részletezése
4.1.1. A diagnózis felállítása (1)
4.1.1.1. Anamnézis felvétele.
4.1.1.2. Fizikális vizsgálat.
4.1.1.3. Labordiagnosztika.
4.1.1.4. A laborvizsgálatok eredményei alapján kerül a beteg terápiára vagy megfigyelésre.
4.1.1.5. Az alapellátás feladata a májbetegség felismerése és a HBV markerek (HBsAg, anti-HBs és anti-HBc) vizsgálata (utóbbiak elvégzése májkárosodás észlelésekor vagy rizikócsoportokban célszerű). A betegek szakellátása hepatológiai centrumokban összpontosul.
4.1.1.6. Klinikai vizsgálatok alapján krónikus B hepatitisben a GPT/ALT normál értékének felső határa férfiaknál 30 U/l, nőknél 19 U/l. Ennek a határértéknek a figyelembe vétele követendő a terápiás döntésnél. A májbetegség súlyosságának a felméréséhez egyéb biokémiai vizsgálatok (AST/GOT, GGT, ALP, se. albumin, bilirubin), prothrombin, teljes vérkép és hasi UH szükséges.
4.1.2. A kezelést eldöntő vizsgálatok:
4.1.2.1. HBV-DNS mennyiségi PCR.
4.1.2.2. HBeAg, anti-HDV pozitivitás esetén antiIgM-antiHDV, illetve HDV Ag.
4.1.2.3. Májbiopsia HAI>1, illetve stage>1, illetve tranziens elasztográfia (FibroScan) liver stiffness (LS)≥6,0 KPa.
4.1.2.4. Cirrhosis bármely stádiuma: HBV-DNS pozitivitás esetén a vírus titertől és a GPT/ALT-től függetlenül kezelendő.
4.1.2.5. Immunsszupprimált, szervtranszplantált beteg (lásd speciális betegségcsoportok címszó alatt).
4.1.2.6. Biológiai terápia (különösen rituximab) előtt és csontvelő transzplantált betegben, ha a beteg antiHBc pozitív, akkor HBV DNS javasolt és pozitív lelet esetén kezelendő (lásd speciális betegcsoportok címszó alatt).
4.1.2.7. Cirrhosis Child A stádiuma: HDV Ag vagy anti-IgM-antiHDV pozitivitás esetén a GPT/ALT-től függetlenül HBV-DNS negativitás esetén is IFN-nal kezelendő.
Megjegyzés: IgM-antiHDV pozitivitás HBV-DNS negativitás esetén is a kezelés indikációja!
4.1.3. Differenciáldiagnosztika: HBeAg, anti-HBe; totál anti-HD; anti-HCV, anti-HIV 1;2, és a társbetegségek (autoimmun, alkoholos, metabolikus májbetegség steatosissal) vizsgálata. Ezek eredménye a kezelési tervet befolyásolhatja.
4.1.4. A kezelés feltételei
4.1.4.1. Kontraindikácó hiánya.
4.1.4.2. A beteg dokumentált beleegyező nyilatkozata. A kezelés megkezdése előtt a beteget részletesen tájékoztatni szükséges.
4.1.5. Terápia
(2) : HBV-DNS mennyiségi real-time PCR meghatározása az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet mellékletében nevesített, akkreditált molekuláris diagnosztikai laboratóriumban végezhető, CE jelzésű teszttel, IU/ml egységben kifejezve. Ugyanazt a tesztet kell a diagnózis felállításához és a terápia követéséhez használni, hogy értékelhető és összehasonlítható legyen a kezelés hatékonysága. (HBV DNS kvalitatív meghatározásának nincs indikációja!)
(3) : Hat hónapon belül 3 alkalommal a határértéket meghaladó GPT/ALT érték vagy ha a fertőzöttség igazolhatóan 6 hónapnál régebben fennáll, akkor a kezelés megkezdése előtti egyetlen határértéket meghaladó GPT/ALT érték, illetve szövettanilag igazolt krónikus hepatitis, hisztológiai aktivitással (HAI>1), illetve fibrosissal (F>1), illetve tranziens elasztográfia (FibroScan) liver stiffness (LS)≥ 6,0 KPa. Konzekvensen emelkedett GPT/ALT és HBeAg pozitív esetben 20 000 IU/ml, anti-HBe pozitív esetben 2 000 IU/ml feletti HBV-DNS titer esetén a májbiopsiától és a non-invazív fibrosis meghatározástól el lehet tekinteni.
GPT/ALT emelkedett értéke az aktív hepatitis fennállását támogatja, de a fertőzés immuntoleráns fázisában perzisztálóan normál az értéke, és a HBeAg negatív betegek egy részében is intermittáló a szintje. Hosszú távú követés alatti változása a terápiás protokoll megtervezésében döntő fontosságú.
4.1.6. A kezelést meghatározó eredmények:
(3): HBeAg pozitív, HBV-DNS 20 000 IU/ml (2x104 IU/ml = 105 copia/ml) felett, GPT/ALT emelkedett, vagy
(3): HBeAg negatív, HBV-DNS 2 000 IU/ml (2x103 IU/ml) felett, GPT/ALT emelkedett
4.1.6.1. ha a GPT/ALT normális: tranziens elasztográfia (Fibroscan)- liver stiffness (LS)≥ 6,0 KPa, (6) illetve májbiopsia HAI>1, illetve stage>1 (7), valamint
4.1.6.2. ha a HBV-DNS fentinél alacsonyabb, de GPT/ALT emelkedett: tranziens elasztográfia (Fibroscan)- liver stiffness (LS)≥ 6,0 KPa, (8) vagy májbiopsia HAI>1, illetve stage>1 (9), a kezelés megkezdése indokolt (4).
4.1.6.3. Ha a HBV-DNS a fentieknél alacsonyabb és a GPT/ALT normális: nem kezelendő, obszerválandó, (10) kivételeket lásd speciális betegcsoportok címszó alatt.
4.1.7. Szupportív terápia: diétás étrend, alkohol megvonása, hepatotoxikus szerek kerülése.
A kezelés előtt vagy alatt hepatitis A ellen vakcináció javasolt.
4.1.8. INF készítmények (5)
4.1.8.1. Peg-INF készítmények: PEGASYS 135, 180 MIKROGRAMM (PegINF-alfa 2a)
4.1.8.1.1. Adag: 180 µg/hét monoterápia.
4.1.8.1.2. A kezelés időtartama általában 1 év.
4.1.8.1.3. IgM-antiHDV pozitív esetekben a kezelés időtartama másfél év.
4.1.8.1.4. Beszűkült veseműködés esetén a peginterferon alfa-2a adagja heti 135 µg.
4.1.8.1.5. A választható gyógyszerek rendelésének egyes szempontjait és a kontraindikációkat részletesen az alkalmazási előiratok ismertetik, amelyek minden esetben kiegészítik a jelen eljárásrendben foglaltakat.
4.1.8.2. Standard INF-k
Alternatíva 18 év alatti életkorban, alacsony fvs, illetve thrombocyta szám mellett, anamnézisben cytopenia esetén hetente 3x5-6 ME/m2 (9-10 ME) standard INFalfa-2a vagy alfa-2b.
4.1.8.3. PEG-IFN kezelés során a kezelés 24. hetében, a kezelés végén, a kezelés befejezése utáni 24. héten, valamint a kezelés alatt jelentkező GPT/ALT emelkedés esetén HBV-DNS vizsgálat (real-time mennyiségi PCR) ajánlott.
4.1.8.4. A PCR vizsgálat mellett a HBs antigén titer monitorozása javasolt.
4.1.8.5. HBe pozitív esetekben a kezelés 24. és 48. hetében HBe, illetve anti-HBe meghatározás.
4.1.9. A terápia eredményességének megítélése PEG-INF kezelés során:
4.1.9.1. Részleges virológiai válasz: HBV DNS titer csökkenés > 1 log10, de > 2 000 IU/ml a kezelés 24. hetében.
4.1.9.2. Áttörés (breakthrough): Viraemia újbóli megjelenése vagy a vírustiter legalább 1 log10 emelkedése (NA-ra váltás javasolt).
4.1.10. Nukleozid analógok (NA)
4.1.10.1. Az NA készítmények rendelésének feltételei
4.1.10.1.1. 12 hónapos INF kezelésre nem reagáló beteg.
4.1.10.1.2. INF kezelésre reagáló, de relapsust mutató beteg.
4.1.10.1.3. HBeAg negatív, de HBV-DNS pozitív, anti-HBc-IgM negatív krónikus hepatitis (pre-core mutáns).
4.1.10.1.4. Biológiai terápia előtt és csontvelő transzplantált betegben.
4.1.10.1.5. Önállóan első szerként vagy gyógyszer-rezisztencia kialakulásakor második készítményként, utóbbi esetben kombinációban is.
4.1.10.1.6. Szervtranszplantált HBsAg, illetve HBV-DNS pozitív beteg.
4.1.10.1.7. HBV-fertőzött transplantált beteg profilaktikus kezelése.
4.1.10.1.8. Immunszuppresszív vagy kemoterápiában részesülő HBsAg, illetve HBV-DNS pozitív beteg.
4.1.10.1.9. HBV okozta cirrhosis bármely stádiuma.
4.1.10.1.10. INF bármely okból ellenjavallt.
4.1.10.1.11. IgM-antiHDV negatív.
4.1.10.2. Az NA kezelés megkezdése után 12 héttel és 24 héttel, majd félévenként, valamint a kezelés alatt jelentkező GPT/ALT emelkedés esetén HBV-DNS vizsgálat (real-time mennyiségi PCR) ajánlott.
4.1.10.2.1. Cirrhosis betegekben szóba jön a háromhavonta végzett kontroll.
4.1.10.2.2. Viraemia újbóli megjelenése vagy a titer 1 log emelkedése, illetve jelentős GPT/ALT emelkedés gyógyszer rezisztens mutációra utal. Ilyenkor rezisztencia meghatározás ajánlott. Mutáns megjelenésekor gyógyszerváltás indokolt azon esetekben is, ha a mutáció direkt kimutatására nincs mód.
4.1.10.2.3. HBe pozitív esetekben a kezelés alatt félévente HBe, illetve anti-HBe meghatározás javasolt.
4.1.10.3. A terápia eredményességének megítélése NA kezelés során:
4.1.10.3.1. Primer nonresponder: A kiindulási vírustiter csökkenése a 12. hétre <1 log10. (NA váltás vagy NA kombináció adása javasolt).
4.1.10.3.2. Részleges virológiai válasz: Detektálható HBV DNS szint a kezelés alatt. (NA váltás vagy NA kombináció adása javasolt).
4.1.10.3.3. Áttörés (breakthrough): Viraemia újbóli megjelenése vagy a vírustiter legalább 1 log10 emelkedése. (NA váltás vagy NA kombináció adása javasolt).
4.1.11. Az NA készítmények
4.1.11.1. Lamivudin
4.1.11.1.1. Alkalmazása során igen nagy arányban fordul elő rezisztencia, különösen, ha monoterápiában alkalmazzák. Emiatt a lamivudin csak olyan esetekben indítható, amennyiben más kezelési mód nem áll rendelkezésre vagy ellenjavallt.
4.1.11.2. Kezelési mód:
4.1.11.2.1. HBe-Ag pozitív és negatív krónikus B hepatitis: napi 1x100 mg.
4.1.11.2.2. Beszűkült veseműködés esetén a GFR-től függően dóziscsökkentés vagy váltás (entecavir önmagában) javasolt.
4.1.11.2.3. HBV DNS titer emelkedése + GPT/ALT emelkedése esetén hatékony másik nukleoz(t)id készítményre (adefovir dipivoxil hozzáadása vagy entecavir, tenofovir önmagában) váltás szükséges.
4.1.11.3. A kezelés időtartama:
4.1.11.3.1. HBe-Ag pozitív esetben az anti-HBe szerokonverzió után minimum 6 hónapig.
4.1.11.3.2. HBe-Ag negatív esetben a HBsAg/HBV DNS eltűnése, illetve az anti-HBs megjelenése után minimum 6 hónapig.
4.1.11.3.3. A már lamivudin kezelésben részesülő (nem dekompenzált májbetegségben szenvedő) betegek esetében az NA váltás, illetve kombináció - igazolt lamivudin rezisztencia esetén túl - azokban az esetekben indokolt, ha a lamivudin kezelés effektusa nem megfelelő, azaz:
- a lamivudin kezelés alatt korábban negatív HBV DNS (<12 IU/ml) pozitívvá válik, vagy
- a lamivudin kezelés alatt a HBV DNS titer 1 log10 (egy nagyságrenddel) nő, vagy
- a lamivudin kezelés során a HBV DNS titer > 2 000 IU/ml, vagy
- a lamivudin kezelés alatt a HBV DNS nem negatív (> 12 IU/ml) és a GPT/ALT kóros.
4.1.12. Adefovir dipivoxil
4.1.12.1. A tenofovirnál kevésbé hatékony készítmény, rezisztencia kialakulása viszont gyakoribb. Lamivudin rezisztencia esetén lamivudinnal kombinációban ajánlott.
4.1.12.2. Kezelési mód:
4.1.12.2.1. 1x10 mg naponta.
4.1.12.2.2. Beszűkült vesefunkciók esetén a dózis a gyógyszer alkalmazási előiratában megadott séma szerint csökkentendő. (Adefovir rezisztencia esetén tenofovirra váltás javasolt a mutációtól függően kombinációban lamivudinnal, entecavirral).
4.1.13. Entecavir
4.1.13.1. Az egyik leghatásosabb NA, a rezisztencia kialakulásának esélye csekély.
4.1.13.2. Kezelési mód:
4.1.13.2.1. Nukleozid naiv betegnek 1x0,5 mg naponta.
4.1.13.2.2. Lamivudin rezisztens vírus: napi 1x1,0 mg.
4.1.13.2.3. Beszűkült vesefunkciók esetén elsősorban javasolt NA, szükség esetén a gyógyszer alkalmazási előiratában megadott séma szerint csökkentett dózisban.
4.1.14. Tenofovir
4.1.14.1. Az egyik leghatásosabb NA, rezisztencia kialakulásával ritkán kell számolni.
4.1.14.2. Kezelési mód:
4.1.14.2.1. Napi adagja 1x245 mg.
4.1.14.2.2. Lamivudin és adefovir rezisztens vírus esetén is ajánlott.
4.1.15. A kezelés befejezése:
4.1.15.1. A kezelés befejezésekor vérkép, májfunkciók, HBV-DNS vizsgálat szükséges.
4.1.15.2. Emellett:
4.1.15.2.1. korábban HBeAg pozitív esetben a HBeAg/anti-HBe vizsgálat megismétlése javasolt,
4.1.15.2.2. korábban HBeAg negatív esetben a HBsAg/anti-HBs vizsgálat megismétlése javasolt,
4.1.15.2.3. hat hónappal később vérkép, májfunkciók, HBV DNS, HBsAg vizsgálat szükséges.
4.1.16. Speciális betegcsoportok:
4.1.16.1. Kompenzált cirrhosis
Alpha-INF (standard vagy pegilált alpha 2a) vagy NA adható. Utóbbiak közül különösen az entecavir vagy a tenofovir ajánlott, az igen ritkán kialakuló rezisztencia miatt. Az NA kezelés a beteg élete végéig folytatandó.
4.1.16.2. Dekompenzált cirrhosis
Hatásos NA-t kell adni, mely esetében kicsi a rezisztencia kialakulásának az esélye (entecavir vagy tenofovir).
(11) Az NA kezelés a beteg élete végéig folytatandó.
4.1.16.3. Májtranszplantált betegek
A transzplantáció előtt minden HBsAg pozitív betegnek olyan, hatásos NA-t kell adni, amely esetében kicsi a rezisztencia kialakulásának esélye (entecavir, tenofovir). A kezelés a beteg élete végéig folytatandó.
A gyógyszerkészítmények alkalmazásánál figyelemmel kell lenni az egyes készítmények Alkalmazási előírásában foglaltakra.
HBsAg negatív/ anti-HBc pozitív szerostátuszú májdonor recipiensei
A javasolt profilaxis a transzplantáció után:
| A | B | |
| 1 | Recipiens | Profilaxis |
| 2 | HBsAg poz | HBIG + entecavir |
| 3 | anti-HBs poz és anti-HBc poz | nem szükséges |
| 4 | anti-HBs neg és anti-HBc poz | entecavir |
| 5 | anti-HBs poz és anti-HBc neg (sikeresen oltott) | entecavir |
| 6 | anti-HBs neg és anti-HBc neg (naiv) | entecavir |
HBIG: HBV immunglobulin
HBsAg negatív/anti-HBc pozitív donorból származó vesegraft recipiensei
HBsAg negatív/anti-HBc pozitív donorból HBsAg negatív/anti-HBc pozitív, valamint a HBsAg negatív/anti-HBc negatív recipiensbe végezhető veseátültetés, amennyiben mind a donor, mind a recipines anti-HBs titere nagyobb, mint 100 mIU/ml. Ezekben az esetekben a recipiens legalább 6 hónapos NA kezelése szükséges. Az entecavir alkalmazása indokolt.
Rendszeres HBV szerológiai és PCR vizsgálata javasolt:
HBV szerológia a transzplantáció után 3, majd 6 hónappal, ezt követően félévente, a HBV DNS PCR a transzplantáció után 6 hónappal, majd évente, illetve a HBV fertőzés reaktiválódásának gyanúja esetén soron kívül is.
4.1.16.4. HBV-HIV koinfekció
Az indikáció megegyezik a HIV negatív betegek esetében leírtakkal. Az esetek többségében a HIV és a HBV egyidejű, de novo kezelése javasolt: tenofovir és emtricitabin, továbbá egy harmadik, HIV ellen hatásos készítmény adásával.
Ha a HIV fertőzés kezelése előtt alkalmazunk HBV elleni kezelést, a HIV-re bizonyított hatással nem rendelkező adefovir vagy telbivudin választandó.
A HIV és HBV elleni hatással is rendelkező lamivudin, entecavir és tenofovir monoterápiában ellenjavallt ezekben az esetekben.
4.1.16.5. HBV-HCV koinfekció
HBV DNS általában negatív vagy alacsony titerű. A kezelés megegyezik a krónikus C hepatitis (monoinfekció) esetén leírtakkal, a várható SVR arány is hasonló. A HCV fertőzés sikeres kezelése után számolni kell a HBV reaktiválódásával, ezért ilyenkor NA adása javasolható.
4.1.16.6. Fulmináns vagy fenyegető fulmináns akut B hepatitis
NA alkalmazása előnyös lehet. A krónikus B hepatitishez hasonlóan a hatásosabb készítmények (entecavir, tenofovir) preferálandók, melyek esetében a rezisztencia kialakulásának esélye csekély. A kezelés optimális időtartama nem ismert, de a HBsAg - anti-HBs szerokonverzió után még legalább 3 hónapig, ennek hiányában a HBe - anti-HBe szerokonverzió után még legalább 6 hónapig javasolt a terápia folytatása.
4.1.16.7. Gyermekek
Csak a hagyományos alphaINF, a lamivudin és az adefovir hatásossága és biztonságossága bizonyított.
4.1.16.8. Egészségügyi dolgozók
HBsAg pozitivitás és HBV DNS>2 000 IU/ml esetén Peg-INFalfa 2a vagy olyan hatásos NA adása javasolt, melyek esetében a rezisztencia kialakulásának esélye csekély (entecavir vagy tenofovir).
4.1.16.9. Terhesség
A lamivudin, az adefovir és az entecavir az FDA osztályozása szerint C kategóriájú készítmények, a tenofovir a B kategóriába tartozik. Szülés után a HBsAg pozitív nők szoros obszervációja indokolt az akut exacerbáció kockázata miatt.
4.1.16.10. Kemoterápia, immunszuppresszív vagy biológiai kezelésben részesülő betegek
Minden fenti kezelésre szoruló beteg esetében el kell végezni a HBsAg és az anti-HBc meghatározását. Ezek pozitivitása esetén hepatologiai konzílium javasolt.
A szeronegatív betegeket aktív immunizációban kell részesíteni. A HBsAg pozitív betegeknek a HBV DNS titertől függetlenül a tervezett kezelés megkezdése előtt el kell kezdeni az NA adását. Entecavir vagy tenofovir adása javasolt.
Az NA kezelést a kemo-, biológiai vagy immunszuppresszív terápia befejezése után még egy évig kell folytatni. Anti-HBc pozitivitás esetén HBV DNS meghatározás szükséges, pozitivitás esetén NA kezelés indokolt.
Anti-HBc pozitív, de HBsAg és HBV DNS negatív betegek esetében szoros obszerváció szükséges: GPT/ALT és HBV DNS monitorozás, reaktiváció esetén NA-t kell adni.
4.1.16.11. Dializált és veseátültetés után levő betegek
NA kezelés indokolt. A veseátültetésen átesett betegek esetében az optimális NA az entecavir.
4.1.16.12. Extrahepatikus manifesztációk
Az antivirális kezelés javasolt (INF vagy NA). Az indikáció és a kezelés módja megegyezik a korábban leírtakkal. Speciális esetekben az NA kezelés kiegészítése plasmapheresissel növelheti a hatékonyságot.
5. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
5.1. A kezelés megkezdése előtti diagnosztikus vizsgálatokat elvégezték és megfelelően dokumentálták?
5.2. A mennyiségi PCR vizsgálatot minden (várhatóan terápiára kerülő) betegnél elvégezték?
5.3. A terápia előtt a betegeket teljes körűen tájékoztatták a kezelés várható kimeneteléről, valamint az esetleges mellékhatásokról?
5.4. A gyógyszerválasztás orvosszakmailag indokolt, a finanszírozási eljárásrendnek megfelelően történt?
5.5. A gyógyszerváltás ténye orvosszakmailag megfelelően alátámasztott és dokumentált?
5.6. A kezelés során szükséges kontroll vizsgálatokat elvégezték és ezek eredményei megfelelően dokumentáltak?
6. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
6.1. A területre fordított közkiadások alakulása.
6.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
7. A finanszírozás szempontjából lényeges kódok
7.1. A releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | B1800 | Idült vírusos B-típusú hepatitis d-ágenssel |
| 3 | B1810 | Idült vírusos B-típusú hepatitis d-ágens nélkül |
7.2. A releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 88460 | Vérvétel |
| 4 | 99910 | Kiegészítő pont veszélyeztető beteg ellátásáért |
| 5 | 28014 | Vérkép automatával IV. |
| 6 | 24600 | Aszpartát-amino-transzferáz (ASAT, GOT)meghatározása |
| 7 | 24610 | Alanin-amino-transzferáz (ALAT, SGPT) meghatározása |
| 8 | 24640 | Gamma-glutamil-transzferáz meghatározása |
| 9 | 24720 | Alkalikus foszfatáz meghatározása |
| 10 | 24741 | Pszeudo-kolineszteráz meghatározása |
| 11 | 21020 | Összfehérje meghatározása szérumban |
| 12 | 21040 | Albumin meghatározása szérumban, festékkötő módszerrel |
| 13 | 21310 | Glükóz meghatározása |
| 14 | 21420 | Összkoleszterin meghatározása |
| 15 | 21411 | Trigliceridek meghatározása |
| 16 | 21150 | Összes bilirubin meghatározása szérumban |
| 17 | 21151 | Konjugált bilirubin meghatározása szérumban |
| 18 | 28620 | Prothrombin meghatározása |
| 19 | 21120 | Karbamid meghatározása szérumban |
| 20 | 21140 | Kreatin meghatározása |
| 21 | 2627T | Hepatitis C vírus AT kimutatása |
| 22 | 2639A | HBsAg AG kimutatása |
| 23 | 2639B | HBsAg konfirmációja |
| 24 | 2639E | HBeAg AG kimutatása |
| 25 | 2627R | Anti-HBc AT kimutatása |
| 26 | 2627S | Anti-Hbe AT kimutatása |
| 27 | 24060 | TSH meghatározása (Thyreoidea-Stimuláló Hormon) |
| 28 | 2627Q | Anti-Hbs AT kimutatása |
| 29 | 29950 | DNS kivonása biológiai mintából |
| 30 | 28938 | Oligonucleotid hibridizáció membráncsíkon próbapáronként |
| 31 | 28920 | Polimeráz láncreakció (PCR) egy mintában primer páronként |
| 32 | 2627W | Vírus ellenes AT meghatározása ELISA módszerrel |
| 33 | 2639L | Hepatitis B vírus mennyiségi meghatározása bDNS módszerrel |
| 34 | 25572 | Hepatitis B vírus gyógyszer-rezisztens mutánsainak meghatározása PCR alapú módszerrel |
| 35 | 2627U | Hepatitis-D vírus AT kimutatása |
| 36 | 2661H | Thyreoidea-peroxidáz elleni antitest meghatározása |
| 37 | 29000 | Szövettani vizsgálat a szokásos feldolgozási módszerrel |
| 38 | 36130 | Hasi (áttekintő, komplex) UH vizsgálat |
| 39 | 3613D | Tranziens elasztográfia |
| 40 | 81581 | UH vezérelt májbiopsia |
| 41 | 81580 | Aspiratio hepatis |
| 42 | 92231 | Immunmoduláció |
| 43 | 91311 | Krónikus beteg dietetikai alapoktatása (gastroenterológiai, nephrológiai, onkológiai vagy 2. típusú diabeteses betegnél) |
7.3. A releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 351B | Májbetegségek, kivéve rosszindulatú daganatok, cirrhosis |
7.4. A releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | L03AB05 | INF-alfa 2b |
| 3 | L03AB11 | peginterferon-alfa 2a |
| 4 | L03AB04 | INF-alfa 2a |
| 5 | J05AF05 | lamivudin |
| 6 | J05AF10 | entecavir |
| 7 | J05AF08 | adefovir dipivoxil |
| 8 | J05AF07 | tenofovir disoproxil |
8. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
HBCS: Homogén betegségcsoport
OENO: Orvosi eljárások nemzetközi osztályozása
HBV DNS: Hepatitisz B vírus DNS
HDV: Hepatitisz D vírus
HBsAg: Hepatitisz B vírus felületi antigén
HBeAg: Hepatitisz B vírus 'e' antigén
IgM-antiHD: Hepatitisz D vírus elleni IgM típusú ellenanyag
INF: Interferon
Peg-INF: Pegilált interferon
ALT: Alanin aminotranszferáz
HAI: Hisztológiai aktivitási index
NA: Nukleoz(t)id analóg
PCR: Polymerase Chain Reaction
HCC: HepatoCelluláris Carcinoma"
12. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"7. melléklet a 31/2010. (V. 13.) EüM rendelethez
A felnőttkori luminális Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Felnőttkori Crohn-betegség (luminális)
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl.: szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a szövődmények kialakulása, ezáltal a műtéti kezelés elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel nem tudjuk megváltoztatni. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroid mentes-remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A Crohn-betegség aktivitása
A Crohn-betegség súlyosságának megítélésére az eltérő betegségtípusok esetén más-más mérőszámok alkalmasak. Gyulladásos típusú betegségben a CDAI (Crohn's Disease Activity Index) a legelterjedtebben alkalmazott aktivitási index. A CDAI alapján történő besorolást és az annak megfelelő klinikai állapotot táblázatban részletezzük. A kezelést hatékonynak tekintjük (klinikai válasz), ha a CDAI 70 ponttal csökken, 150 pont alatt remisszióról beszélünk. A csak a felső gastrointestinalis traktust érintő luminalis Crohn-betegség esetén a CDAI nem minden esetben alkalmas a klinikai állapot megítélésére. A műtéti beavatkozás során esetleg kialakított hasfali vendégnyílás (stoma) a székletszám változásán keresztül befolyásolja a CDAI értékét, így ilyenkor az csak becsülhető.
2.2. A szteroid kezelés fő problémái
2.2.1. Szteroid refrakter IBD: ha legalább 0,75 mg/ttkg prednisolon mellett Crohn-betegség esetén 4 hét kezelés után is aktív a betegség.
2.2.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
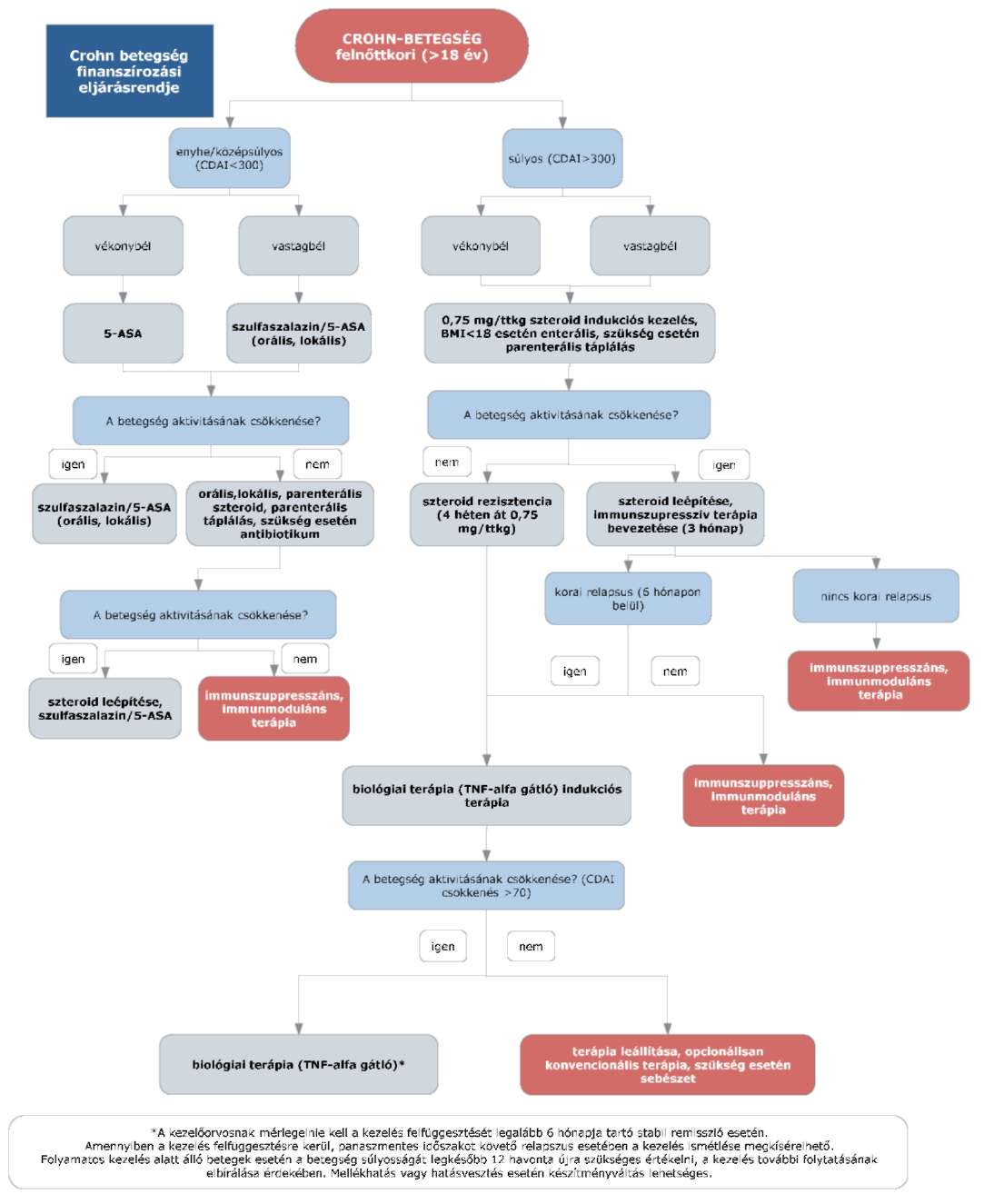
4. A felnőttkori Crohn-betegség gyógyszeres kezelési algoritmusa
4.1. Enyhe esetben alapellátásban terminális ileum érintettsége esetén 5-ASA, illetve budesonid, colon érintettsége esetén sulphasalazin kezelés megpróbálható,
4.2. kezdeti szteroid kezelés 3 hónapig,
4.3. korai immunszuppresszív terápia,
4.4. negyedik vonalban: biológiai terápia (biológiai terápia alkalmazására kijelölt intézmények); valamelyik TNF-α gátló alkalmazása: infliximab (az alkalmazott támogatási kategória figyelembevételével); adalimumab.
5. A Crohn-betegség biológiai kezelése
5.1. Indukciós kezelés gyulladásos típusú Crohn-betegségben (luminális): anti-TNF-α indukciós kezelés indikált bármely lokalizációban lévő középsúlyos-súlyos Crohn-betegségben (EL1a, RGB), ha az szteroid refrakter, vagy immunszuppresszáns kezelés mellett szteroid dependencia alakul ki, vagy immunszuppresszáns kezelésre a beteg intoleráns.
5.2. A Magyarországon jelenleg engedélyezett készítmények közül:
5.2.1. Infliximab (IFX) esetében: 5mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. Az indukciós kezelést követően 6 héten belül nem reagáló betegek további IFX-kezelését nem támasztják alá a rendelkezésre álló adatok.
5.2.2. Adalimumab (ADA) esetében: 80 mg a 0. héten, majd 40 mg a 2. héten. Ha hamarabb szükséges elérni a terápiás hatást, akkor a készítmény alkalmazható a 0. héten 160 mg (a dózis beadható 4 injekcióban egyetlen napon, vagy napi 2 injekcióban két egymást követő napon), a 2. héten 80 mg dózisban annak tudatában, hogy az indukciós kezelés során nagyobb a mellékhatások kockázata.
5.3. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése Crohn-betegségben
5.3.1. Luminalis Crohn-betegség estében az indukciós kezelést követő (12-14. hét) legalább 70 pontos CDAI esés (reagálás) vagy a CDAI 150 pont alá esése esetében (remisszió) az indukciós kezelést hatékonynak tekintjük.
5.3.2. Szteroid dependens kórforma esetében az anti-TNF-a kezelést hatékonynak tekintjük, ha az indukciós kezelés végére a szteroid dózisa legalább a felére csökkenthető. Kombinált kórformákban bármely fenti kritérium teljesítése esetében indokolt a fenntartó kezelés.
6. Fenntartó kezelés felnőttkori Crohn-betegségben (luminális)
6.1. Megfelelő válaszkészség (3 hónap alatt CDAI minimum 70 pontos csökkenése) esetén fenntartó kezelés folytatható önmagában vagy immunszuppresszív terápiával együtt. Extraintesztinális manifesztáció esetében a sikeresség elbírálásában a klinikai jelek javulása a mérvadó (EL3, RG C).
6.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban.
6.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
7. Különleges megfontolások az anti-TNF-α kezeléshez
7.1. Készítményválasztás
Luminalis Crohn-betegség esetén a két hasonló támadáspontú szert összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Az anti-TNF-α készítmények és immunszuppresszáns szerek (pl.: azathioprin) kombinált alkalmazása előnyös lehet a hatékonyság szempontjából, de a kombinált immunszupresszió esetén gyakoribb mellékhatások (pl.: fertőzések) megjelenésével kell számolnunk, így minden esetben a kockázat és az előny gondos mérlegelése mellett lehetséges.
7.2. Dózismódosítás
7.2.1. Infliximab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile), abscessus, műtétet igénylő szűkület kizárása.
7.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.3. Készítményváltás: anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (elsősorban infekció, abscessus, műtétet igénylő szűkület) kizárása.
8. Szövődmények monitorozása, ellenőrzése
8.1. Opportunista infekciók
8.2. Malignus betegségek
8.3. Neurológiai eltérések
8.4. Secunder autoimmun betegségek
9. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
9.1. Evidencia szint* (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c "Outcomes" research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
* Terápiás tanulmány alapja
9.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
10. Luminalis Crohn-betegség kiterjedés és aktivitás szerint
10.1. Ileocoecalis Crohn-betegség
(5A) Enyhén aktív (CDAI: 151-220)
Enyhe tünetek, kezelés nem szükséges (EL5, RG D)
Mesalazin - értéke korlátozott (EL1a, RG B)
Budesonid 9 mg/nap (EL2a, RG B)
Antibiotikum nem ajánlott (EL1b, RG A)
(5B) Közepesen aktív (CDAI: 221-450)
Budesonid 9 mg/nap (EL1a, RG A)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Antibiotikum (septicus esetben) (EL5, RG D)
AZA/6-MP vagy MTX (EL1b, RG B)
Anti-TNF-α (CDAI>300 esetén finanszírozott) (EL1b, RG B): változatlan aktivitás esetén, vagy szteroid - refrakter, dependens, intoleráns esetben
(5C) Súlyosan aktív (CDAI: >450)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
Relapszus esetén anti-TNF-α (EL1a, RG B csak infliximab): immunmodulátorral vagy nélküle
A sebészi megoldás alternatíva lehet (EL5 RG D)
10.2. Vastagbél Crohn-betegség
(5D) Enyhén aktív (CDAI: 151-220)
Sulfasalazin (EL1b, RG A)
Oralis szteroid (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
(5D) Közepes vagy súlyosan aktív (CDAI>220)
Relapszus esetén anti-TNF-α (CDAI>300 esetén finanszírozott): immunmodulátorral vagy nélküle (EL1a, RG B csak infliximab)
A sebészi megoldás alternatíva lehet (EL5, RG D)
10.3. Kiterjedt vékonybél Crohn-betegség
(5E) Enyhén aktív (CDAI: 151-220)
Orális szteroid és AZA/6-MP vagy MTX (EL5, RG D)
(5E) Közepes vagy súlyosan aktív (CDAI > 220)
Relapszus esetén anti-TNF-α (CDAI>300 esetén finanszírozott): immunmodulátorral, vagy nélküle (EL5, RG D)
Hyperalimentáció (EL4, RG C)
Sebészi megoldás alternatíva lehet
10.4. Várhatóan rossz prognózisú klinikai képpel járó eset
Korai AZA/6-MP/MTX, illetve anti-TNF-α terápia: [fiatalkori kezdet (<40 év) és perianalis CD] (EL5 RG D)
10.5.10.5. Nyelőcső, illetve gastroduodenalis Crohn-betegség
(5G) Enyhén aktív
PPI kezelés (EL5, RG D)
Oral szteroid + PPI (EL4, RG C)
Oral szteroid + PPI + AZA vagy MTX (EL4, RG D)
(5G) Közepes/súlyos aktivitásban/refrakter esetben
Anti-TNF-α (szteroid refrakter esetben finanszírozott) (EL4, RG D)
Obstructio esetén dilatáció/sebészi megoldás (EL4, RG C)
11. Aktivitási score-ok gyulladásos bélbetegségben
11.1. CDAI score (Best és mtsi, Gut, 1979).
| A | B | C | D | |
| 1 | Jellemző | Pontszám (egy hétre) | Súlyszám | Részösszeg |
| 2 | folyékony vagy rendkívül híg székürítés száma a megelőző 7 napon | x2 | = | |
| 3 | A hasi fájdalom/görcsök intenzitása (a megfelelő 7 nap pontszámai összesen) 0=nem volt 1=enyhe 2=közepes 3=heves | x5 | = | |
| 4 | Általános közérzet (a megfelelő 7 nap pontszámai összesen) 0=általában jó 1=átlag alatti 2=rossz 3=rendkívül rossz 4=szörnyű | x7 | = | |
| 5 | Crohn-betegséggel összefüggő tünetek száma: A=arthritis/ízületi fájdalom B=iritis/uveitis C=erythema nodosum/pyoderma/stomatitis D=fissura ani, fisztula/abscessus perianalis E=egyéb fistula F=37,8°C feletti láz a megelőző 7 napban | x20 | ||
| 6 | Hasmenés elleni gyógyszeres kezelés (pl. loperamid, diphenoxylat, opiátok) 0=nem 1=igen | x30 | ||
| 7 | Hasi terime 0=nincs 2=bizonytalan 5=egyértelmű | x10 | ||
| 8 | Hematokrit Férfiak (47 - Htk) = pontszám Nők (42 - Htk) = pontszám | X6 | ||
| 9 | Aktuális testsúly (ATS): Rendes testsúly: | x1 | ||
| 10 | (Rendes testsúly - ATS)/ rendes testúly x 100%=pont | |||
| 11 | Összesen: |
12. Gyulladásos típusú Crohn-betegség klinikai súlyosságának meghatározása
12.1. Enyhe-középsúlyos betegség: járóbeteg, láztalan, hasi fájdalom nem jelentős, súlyvesztés nem haladja meg az eredeti testsúly 10%-át; nincsen hasi izomvédekezés, tapintható szövetmassza vagy kiszáradás jelei. (CDAI 150-220)
12.2. Középsúlyos-súlyos beteg: az a beteg, aki az enyhe-középsúlyos betegségre indikált gyógyszerekre nem reagál, lázas, testsúlyvesztése jelentős (>10%), hasi fájdalma van, sipolyképződéssel járó betegsége van, időszakosan hányinger vagy hányás gyötri (mely még nem utal bélelzáródásra), vérszegénysége jelentős. (CDAI: 220-450)
12.3. Súlyos-fulmináns betegség: szájon át alkalmazott szteroid, illetve immunszupprimáló kezelésre nem reagáló beteg, magas lázzal, gyakori hányással, bélelzáródásra utaló egyéb tünetekkel, hasi izomvédekezéssel, jelentős fogyással vagy hasi tályogra utaló klinikai jellel. (CDAI>450)
13. Az indikációk definiálása
13.1. Klasszikus terápia rezisztens Crohn-betegség (3 hónapon keresztül szteroid és optimalizált dózisú immunszuppresszánsra nem reagáló beteg).
13.2. Szteroid függő Crohn-betegség (a szakmai ajánlások szerinti fokozatos szteroid leépítés során egymást követő 2 alkalommal a betegség aktivitása ismét súlyossá válik).
13.3. Akut, terápia rezisztens Crohn-betegség [4 hét teljes dózisú szteroidra nem reagáló beteg, a betegség aktivitása mindvégig súlyos (CDAI>300), immunszuppresszáns terápia megkezdésére nincs idő, hiszen a készítmények 8-12 hét alatt érik el a terápiás hatást].
14. A Crohn-betegség betegnaplójának adatai
14.1. Általános adatok (név, TAJ-szám, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
14.2. Laza, hasmenéses székletek számának napi bontásban és összesítve, 7 napra történő feltüntetése
14.3. A hasi fájdalom mértékének napi bontásban és összesítve, 7 napra történő feltüntetése (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
14.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
14.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
14.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
14.7. Aktuális testsúly (kg)
15. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
15.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
15.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
15.1.2. Betegadatok (online TAJ ellenőrzés)
15.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
15.2. Szakmai ellenőrzési pontok
Klinikai súlyosság meghatározása egy rögzítést megelőző héten vezetett betegnapló alapján számított Crohn-betegség aktivitási index (CDAI) (kivéve kizárólag felső gastrointestinalis érintettség és sztómával élő beteg esetén, utóbbi esetekben szteroid függőség vagy rezisztencia esetén a szteroid dózis legalább 50%-os csökkenése az ellenőrzés szempontja, de sztómával élő beteg esetén a székletszámot nem tartalmazó CDAI rögzítése is szükséges!).
15.2.1. Inaktív betegség: CDAI≤150
15.2.2. Enyhe betegség: 150 <CDAI≤220
15.2.3. Közepesen súlyos: 220<CDAI≤300
15.2.4. Súlyos: 300<CDAI≤450
15.2.5. Nagyon súlyos: CDAI>450
15.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
15.3.1. TBC kizárása (mellkas RTG)
15.3.2. Egyéb akut és krónikus fertőzések kizárása (pl.: hepatitis B és C)
15.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok alapján)
15.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
15.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
15.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
15.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
15.4.2. 3 havonta: aktivitási index (CDAI meghatározása és dokumentálása)
15.4.3. szteroid refrakter esetben, kizárólag felső gastrointestinalis érintettség esetén a szteroid dózisának legalább 50%-os csökkentése az indukciós kezelés végéig
15.4.4. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
15.4.5. 9 hónap óta tartó fenntartó kezelés után, újabb 6 hónapnál hosszabb teljes remisszió (CDAI alacsonyabb, mint 150 pont három egymást követő meghatározás alkalmával) esetén a kezelés felfüggesztése mérlegelésének dokumentálása
15.4.6. 9 hónap óta tartó fenntartó kezelés után, a kezelés tartós folytatása esetén 12 havonta ellenőrző képalkotó vizsgálat (MR vagy endoszkópia, indokolt esetben CT) dokumentálása, valamint 12 havonta hepatitis B és C szűrés, hepatitis B vaccinatio esetén annak dokumentálása
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
15.5. Megjegyzés
15.5.1. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
15.5.2. TNF alfa gátlók: adalimumab, infliximab
16. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
16.1. A területre fordított közkiadások alakulása, monitorozása.
16.2. A helyes, finanszírozási algoritmus szerint kezelt betegek aránya.
17. A finanszírozás szempontjából lényeges finanszírozási kódok
17.1. A releváns BNO kódok
| A | B | |
| 1 | Kód | Elnevezés |
| 2 | K5001 | Terápiarezisztens vékonybél Crohn-betegség |
| 3 | K5011 | Terápiarezisztens vastagbél Crohn-betegség |
| 4 | K5081 | Terápiarezisztens vastag- és vékonybél Crohn-betegség |
| 5 | K5012 | Vastagbél Crohn-betegség fisztulával |
| 6 | K5082 | Vékony- és vastagbél Crohn-betegség fisztulával |
17.2. A releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | A07EC02 | mesalasin | DMARD | Betegségmódosító szerek |
| 4 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 5 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 6 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 7 | H02AB01 | betamethason | Szteroid | Szteroid gyógyszerek |
| 8 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 9 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 10 | H02AB09 | hidrokortizon | Szteroid | Szteroid gyógyszerek |
| 11 | A07EA06 | budesonid | Szteroid | Szteroid gyógyszerek |
18. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása"
13. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"8. melléklet a 31/2010. (V. 13.) EüM rendelethez
A felnőttkori fisztulázó Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Felnőttkori fisztulázó Crohn-betegség
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl.: szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Perianalis fistulák kezelésében a szisztémás szteroid kezelés nem indokolt. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtét elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel bizonyosan nem tudjuk megváltoztatni. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a fisztulázó Crohn-betegség esetén a fistulák záródása, párhuzamos luminalis érintettség esetén a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroid mentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A felnőttkori fisztulázó Crohn-betegség aktivitása
A perianalis sipollyal járó betegségformák súlyosságának meghatározására a PDAI (Perianal disease Activity Index) alkalmas (EL5, RG D). PDAI 3 pontos csökkenésekor hatékonynak tartjuk a kezelést (klinikai választ), a remissziót a PDAI alapján a szakirodalom nem definiálja, azonban a sipolyváladékozás teljes megszűnése remissziónak tekinthető (EL2b, RG D). Crohn-betegséghez kapcsolt enterocutan vagy rectovaginalis sipolyok esetén részleges remissziónak tekinthető, ha a kezelés kezdetén aktív fisztulák váladékozása 3 hétnél hosszabb kezelést követően több, mint 50%-kal csökken két egymást követő kontroll vizsgálat során. A sipolyváladékozás teljes megszűnése 2 egymást követő kontroll vizsgálat alkalmával remissziónak tekinthető.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
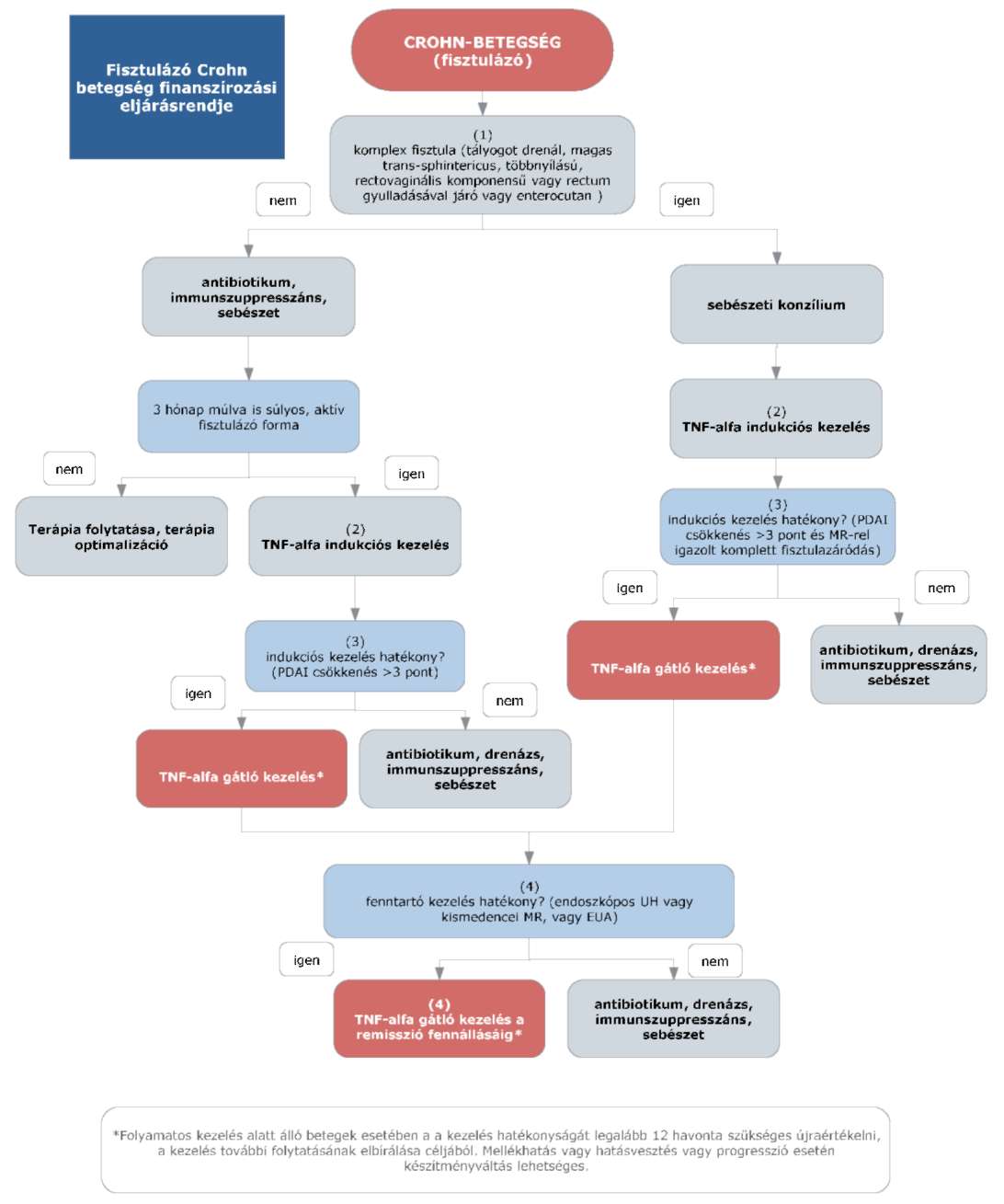
4. A felnőttkori fisztulázó Crohn-betegség biológiai kezelése
4.1. Indukciós kezelés sipolyozó Crohn-betegségben
Komplex perianális (több sipolynyílású, magas transphinctericus vagy tályoggal szövődött, gyulladt rectum nyálkahártya mellett kialakuló, vagy rectovaginalis helyzetű) vagy enterocutan fisztula esetén második vonalban [antibiotikum és azathioprin kezelés elégtelensége (PDAI >4) vagy intoleranciája esetén] indikált az anti-TNF-α kezelés (EL1a, RGB). Fisztulázó betegségtípusban az első vonalbeli kezelésnek nem része a szisztémás szteroidok alkalmazása. A tályogot drenáló fisztula anti-TNF-α kezelése csak a tályog drenálása (seton behelyezése) után kezdhető meg.
4.2. A Magyarországon jelenleg engedélyezett készítmények közül:
4.2.1. Infliximab esetében: 5 mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. A 10-12. hétig nem reagáló betegek további infliximab kezelését nem támasztják alá a rendelkezésre álló adatok.
4.2.2. Az adalimumab törzskönyvi indikációja nem emeli ki a fisztulával járó Crohn-betegség kezelését, azonban nem is tiltja.
4.3. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése fisztulázó Crohn-betegségben
Fisztulázó kórforma esetében hatékony a kezelés, ha megfelelő fisztula-gyógyulás (PDAI csökkenés>3 pont, vagy ha a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése) igazolható.
5. Fenntartó kezelés fisztulázó Crohn-betegségben
5.1. Megfelelő válaszkészség (3 hónap alatt a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése vagy a PDAI>3 pontos csökkenése) esetén fenntartó kezelés folytatása javasolt önmagában vagy immunszuppresszív terápiával együtt.
5.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban.
5.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
6. Különleges megfontolások az anti-TNF-α kezeléshez
6.1. Készítményválasztás
Luminalis Crohn-betegség esetén a két hasonló támadáspontú szer összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Sipolyozó betegségformában az IFX EL1b, RG A erősségű, az ADA EL1b, RG B erősségű ajánlással alkalmazható. Kombinált immunszupresszió esetén gyakoribb infekciós mellékhatások megjelenésével kell számolnunk.
6.2. Dózismódosítás
6.2.1. Infliximab: Fisztula-képződéssel járó aktív Crohn-betegség esetén alkalmazott IFX kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente. Ilyenkor fontos azonban a hatásvesztés okának tisztázása abscessus, műtétet igénylő szűkület kizárása.
6.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, abscessus, műtétet igénylő szűkület kizárása.
6.3. Készítményváltás
Anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén egy másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (abscessus, műtétet igénylő szűkület) kizárása.
7. Szövődmények monitorozása, ellenőrzése
7.1. Opportunista infekciók
7.2. Malignus betegségek
7.3. Neurológiai eltérések
7.4. Secunder autoimmun betegségek
8. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
8.1. Evidencia szint* (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c "Outcomes" research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
* Terápiás tanulmány alapja
8.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
9. Fisztulázó Crohn-betegség kezelésének finanszírozott terápiás alkalmazásai
(9F) 1. perianalis tályog = sebészi megoldás (EL5, RG D)
9.1. Fisztula jellege szerint:
9.1.1. Egyszerű fisztula
9.1.2. Összetett fisztula rendszer
9.1.3. Kimenetel-fisztula
9.1.4. Rectovaginalis fisztula
9.2. Egyszerű fisztula
(9G) A fisztula csak panaszok esetén kezelendő
Panaszok esetén seton vagy fistulotomia (EL3, RG D)
Metronidazol és ciprofloxacin kezelés (EL3, RG D)
9.3. Összetett fisztularendszer
(9H) Összetett (komplex fisztula)
Sebészi seton ellátás javasolt (EL4, RG D)
Eltávolítása a kezelés sikerétől függ
(9I) Komplex kezelés
Az aktív luminalis Crohn-betegség kezelése szükséges a sebészi ellátás mellett (EL5, RG D)
(9J) Összetett (komplex fisztula)
Antibiotikum és AZ/6-MP az első terápia a sebészi ellátás mellett (EL4, RG D)
(9K) Második vonal
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Mindkét szer a második vonalban (EL1b, RG B)
9.4. Kimenetel-fisztula
(9L) Terápiás hatékonyság és mérése
Váladékozás csökkenése (50%) (EL2b, RG D)
Quantitatív - PDAI (EL5, RG D)
Váladékozás csökkenése (50%) és kismedence MRI vizsgálat (EL2b, RG D)
(9M) Terápia vezetése
AZA/6-MP (EL2b, RG C)
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Seton drain (EL4 RG D)
Drainage és gyógyszeres kombináció (EL3 RG C)
Bármelyik fenntartó kezelés legalább 1 évig szükséges (EL1b, RG A)
(9N) Hatástalanság
Hatástalan anti-TNF-α esetén tacrolimus vagy (EL1b, RG B) AZA/MTX és
antibiotikum (EL5, RG D)
Refrakter esetben diverzió (EL4, RG C)
Proctectomia az utolsó lépés (EL5, RG D)
(9O) Ellátás
Egyszerű anal-introital, tünet nélküli fistula nem kíván kezelést (EL5, RG D)
9.5. Rectovaginalis
(9P) Rectovaginalis fisztula
Tünettel járó esetben sebészeti kezelés előtt, aktív Crohn-betegségben (különösen a rectalis), előtte kezelendő
(EL5, RG D)
9.6. Fisztula aktivitásának mérése szerint
9.6.1. Váladékozás mértéke alapján: Fisztula hozamának csökkenése 50%-kal
9.6.2. Összetett pontszám alapján: Perianal Disease Activity Index (PDAI)
10. Aktivitási score fisztulázó Crohn-betegségben
10.1. Sipolyozó Crohn-betegség súlyosságának meghatározása (PDAI) (Irvine és mtsi, Journal of Clinical Gastroenterology, 1995)
| A | B | |
| 1 | Fisztula hozama | |
| 2 | nem váladékozik | 0 |
| 3 | kis nyákos váladékozás | 1 |
| 4 | közepes nyákos vagy gennyes váladékozás | 2 |
| 5 | jelentős váladékozás | 3 |
| 6 | fekulens váladékozás | 4 |
| 7 | Fájdalom / aktivitás korlátozottsága | |
| 8 | tevékenységben nem korlátoz | 0 |
| 9 | enyhe diszkomfort, korlátozottság nélkül | 1 |
| 10 | közepes diszkomfort, bizonyos tevékenységek gátoltak | 2 |
| 11 | jelentős diszkomfort, jelentős korlátozottság | 3 |
| 12 | súlyos fájdalom és korlátozottság | 4 |
| 13 | Szexuális aktivitás korlátozottsága | |
| 14 | nincs korlátozottság | 0 |
| 15 | enyhe korlátozottság | 1 |
| 16 | közepes korlátozottság | 2 |
| 17 | jelentős korlátozottság | 3 |
| 18 | szexuális funkciók gátoltak | 4 |
| 19 | Perianalis betegség típusa | |
| 20 | nincs perianális megjelenés/skin tag | 0 |
| 21 | fissura vagy "mucosal tear" | 1 |
| 22 | kevesebb, mint 3 fisztula | 2 |
| 23 | több, mint 3 fisztula | 3 |
| 24 | sphincterkárosodás vagy jelentős perianalis hámhiány | 4 |
| 25 | Beszűrtség foka | |
| 26 | nincs beszűrtség | 0 |
| 27 | minimális beszűrtség | 1 |
| 28 | közepes beszűrtség | 2 |
| 29 | jelentős beszűrtség | 3 |
| 30 | tályog | 4 |
11. A Crohn-betegség betegnaplójának adatai
11.1. Általános adatok (név, TAJ-szám, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
11.2. Laza, hasmenéses székletek számának napi bontásban és összesítve, 7 napra történő feltüntetése
11.3. A hasi fájdalom mértékének napi bontásban és összesítve, 7 napra történő feltüntetése (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
11.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
11.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
11.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
11.7. Aktuális testsúly (kg)
12. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
12.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
12.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
12.1.2. Betegadatok (online TAJ ellenőrzés)
12.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
12.2. Szakmai ellenőrzési pontok
12.2.1. A diagnózis kritériumainak rögzítése (BNO: K5012, K5082)
12.2.1.1. A fisztula típusának meghatározása a fizikális status, endoszkópos lelet és a kismedencei képalkotók (MR vagy rectalis UH) vagy EUA (anesztéziában végzett rectalis vizsgálat) alapján
12.2.1.2. Súlyosság meghatározása az alábbi kritériumok alapján (PDAI: perianalis betegség aktivitási index, 0-12)
12.2.1.3. Az indukciós kezelés hatásosságának rögzítése (PDAI csökkenés>3)
12.2.1.4. A 12.2.1.1. pontban felsorolt diagnosztikai módszerekkel igazolt remisszióig
12.2.2. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
12.2.2.1. TBC kizárása (mellkas RTG)
12.2.2.2. Egyéb akut és krónikus fertőzések kizárása (pl.: hepatitis B és C szűrés)
12.2.2.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok alapján)
12.2.2.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
12.2.2.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
12.2.2.6. Labor: rutin
12.2.3. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
12.2.3.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
12.2.3.2. 3 havonta: aktivitási index (PDAI meghatározása és dokumentálása)
12.2.3.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
Megjegyzés
12.2.3.4. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át.
12.2.3.5. TNF alfa gátlók: adalimumab, infliximab (az alkalmazott támogatási kategória figyelembevételével).
12.2.3.6. Egy éven túli fenntartó kezelés feltétele az MR vagy rectalis UH vagy EUA vizsgálattal igazolt komplett fisztula-záródás.
13. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
13.1. A területre fordított közkiadások alakulása, monitorozása
13.2. A finanszírozási algoritmus szerint kezelt betegek aránya
14. A finanszírozás szempontjából lényeges finanszírozási kódok
14.1. A releváns BNO kódok
| A | B | |
| 1 | Kód | Elnevezés |
| 2 | K5001 | Terápiarezisztens vékonybél Crohn-betegség |
| 3 | K5011 | Terápiarezisztens vastagbél Crohn-betegség |
| 4 | K5081 | Terápiarezisztens vastag- és vékonybél Crohn-betegség |
| 5 | K5012 | Vastagbél Crohn-betegség fisztulával |
| 6 | K5082 | Vékony- és vastagbél Crohn-betegség fisztulával |
14.2. A releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | A07EC02 | mesalazin | DMARD | Betegségmódosító szerek |
| 4 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 5 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 6 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 7 | H02AB01 | betamethason | Szteroid | Szteroid gyógyszerek |
| 8 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 9 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 10 | H02AB09 | hidrokortizon | Szteroid | Szteroid gyógyszerek |
| 10 | A07EA06 | budesonid | Szteroid | Szteroid gyógyszerek |
15. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása"
14. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"9. melléklet a 31/2010. (V. 13.) EüM rendelethez
A colitis ulcerosa diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Colitis ulcerosa
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa (CU) és a Crohn-betegség (CD) a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A colitis ulcerosa a vastagbél nyálkahártyájának fekélyes gyulladása, mely a rectumtól kezdve különböző hosszúságban érintheti a vastagbelet, ritkán a terminális ileumot ("back wash ileitis"). A colitis ulcerosa természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll, az esetek egy részében az aktivitás folyamatos. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid, és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtéti kezelés elkerülése. Colitis ulcerosában gyakoriak a relapszusok, a betegség proximális irányban kiterjedtebbé válhat, az egész vastagbelet érintő esetek 10-20%-ában dysplasia, carcinoma alakul ki. A betegek 10-25%-a proctocolectomiára szorul. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma terápiás cél a klinikai, endoszkópos és szövettani remisszió (nyálkahártya-gyógyulás) elérése, a szteroid mentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. Colitis ulcerosa aktivitása
A Colitis ulcerosa betegség aktivitását a jelenlegi eljárásrend a részleges Mayo-score meghatározásával követi. A Mayo score alapján a betegség inaktív 0-3 pont között, 4-6 pont között enyhe aktivitású, 7-9 pont között közepes aktivitású, a 9-nél nagyobb Mayo score-ral rendelkező beteget pedig súlyos állapotúnak tekintjük.
2.1.1. Mayo score alapján a colitis ulcerosa klinikai súlyosságának meghatározása
inaktív colitis ulcerosa: 0-3 pont között
enyhe colitis ulcerosa: 4-6 pont között
közepes colitis ulcerosa: 7-9 pont között
súlyos colitis ulcerosa: 9 pont felett
2.1.2. Mayo Score (Disease Activity Index) (Schroeder és mtsi., New England Journal of Medicine, 1987). A részleges Mayo-score az endoszkópos subscore-t nem tartalmazza.
| A | B | C | D | E | |
| 1 | 0 | 1 | 2 | 3 |
| 2 | Székletszám | Normál | 1-2/nap >normál | 3-4/nap >normál | 5/nap >normál |
| 3 | Rectalis vérzés | Nincs | Vércsíkok | Egyértelmű | Többségében vér |
| 4 | Nyálkahártya | Normál | Enyhén sérülékeny | Közepesen sérülékeny | Spontán vérzések |
| 5 | Orvos általános megítélése | Normál | Enyhe | Közepes | Súlyos |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
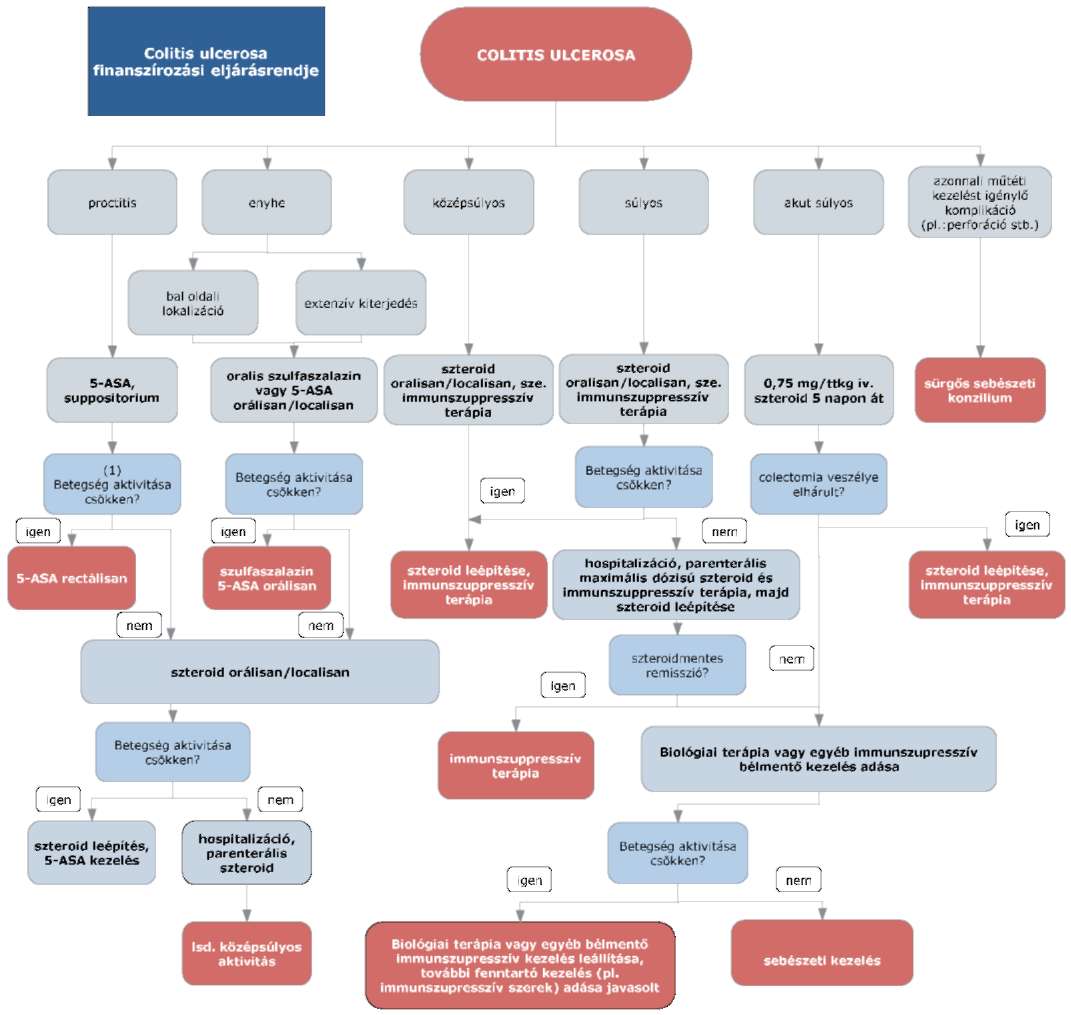
4. A Colitis ulcerosa betegnaplójának adatai
4.1. Általános adatok (név, TAJ-szám, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
4.2. Székletek számának napi bontásban és átlagolva, 7 napra történő feltüntetése
4.3. Véres széklet számának napi bontásban és átlagolva, 7 napra történő feltüntetése
5. Szteroid kezelés fő problémái
5.1. Szteroid refrakter gyulladásos bélbetegség (IBD): akut, súlyos colitis ulcerosa esetében teljes dózisú parenterális szteroid kezelés ellenére 5 nap után is aktív a betegség.
5.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
6. Colitis ulcerosa biológiai kezelése
6.1. Indukciós kezelés súlyos, aktív colitis ulcerosában
6.1.1. Hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy intoleráns, immunszuppresszív szer mellett szteroid dependens, vagy immunszuppresszív szerre intoleráns, közepesen súlyos, krónikusan aktív colitis ulcerosában 5 mg/ttkg IFX kezelés (a 0., 2. és 6. héten) vagy subcutan adalimumab terápia (0. héten 160 mg, 2. héten 80 mg, majd 2 hetente 40 mg sc. 3 hónapig) javasolt.
6.1.2. Súlyos, fulmináns, 5 napos intravénás szteroid kezelésre nem reagáló colitis ulcerosában a műtéti kezelés előtt megkísérelhető az 5 mg/ttkg dózisú IFX kezelés. Hatékonyság esetén a teljes indukciós kezelést (5 mg/ttkg IFX parenterálisan a 2. héten és 6. héten) alkalmazni kell.
6.2. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése colitis ulcerosában
A komplett indukciós kezelés hatékonyságának felmérésére a részleges Mayo-score javasolt.
6.2.1. Szteroid dependens colitis ulcerosa esetén alkalmazott infliximab kezelés hatékonynak tekinthető, ha változatlanul kielégítő klinikai státusz mellett a szteroid kezelés legalább 3 hónapon át elhagyhatóvá vált.
6.2.2. Szteroid rezisztens (nem fulmináns) colitis ulcerosa esetében a hatékonyság felmérésére a 12. héten alkalmazott, Mayo-subscore (endoszkópos vizsgálat nélkül) legalább 3 pontos csökkenése javasolt.
7. Fenntartó kezelés colitis ulcerosában
7.1. Az infliximabbal történt indukciós kezelés által elért remissziót követően indokolt infliximab fenntartó terápia alkalmazása a 14. héttől 5 mg/ttkg dózisban 8 hetente. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok szerint pontosan nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza kiemelt indikációhoz kötött társadalombiztosítási támogatással, az alkalmazott támogatási kategória figyelembevételével. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.2. Az adalimumabbal történt indukciós kezelés által elért remissziót követően indokolt adalimumab fenntartó terápia alkalmazása a 12. héttől subcutan 40 mg dózisban 2 hetente. A fenntartó kezelés hossza nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza kiemelt indikációhoz kötött társadalombiztosítási támogatással. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.3. Amennyiben a relapszus a kezelés felfüggesztése után 6 hónapon belül lép fel, reindukciós kezelés sem infliximab, sem adalimumab esetén nem indokolt, a fenntartó kezelés folytatása javasolt, de a biológiai terápia újraindítása előtt a relapszus klinikai képét utánzó esetleges egyéb okok kizárása (pl.: infectio, szövődmények, stb.) szükséges!
8. Különleges megfontolások az anti-TNF-α kezeléshez
8.1. A készítményválasztás és készítményváltás kérdése:
Az infliximab bizonyítottan hatásos terápia refrakter indeterminált colitis és pouchitis eseteiben is. Az anti-TNF-a készítmény és más immunszuppresszáns szerek (pl. azathioprin vagy szteroid) kombinált alkalmazása a mellékhatások gyakoribb előfordulása miatt (pl.: fertőzéses szövődmények) a kockázat és előny mérlegelése után lehetséges.
8.2. Dózismódosítás
Az aktív colitis ulcerosa esetén alkalmazott infliximab kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban. Infliximab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé.
Ilyenkor amennyiben lehetséges, a hatásvesztés okának tisztázása javasolt.
Az aktív colitis ulcerosa esetén alkalmazott adalimumab kezelés esetében hatékony indukciós kezelést követően 2 hetente 40 mg dózisban. Adalimumab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé, de azon betegeknél, akiknél csökken a terápiás hatás, lehetőséget ad a 40 mg-os dózis hetenként történő alkalmazására. Ilyenkor amennyiben lehetséges, a hatásvesztés okának tisztázása javasolt.
Készítményváltás: anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (pl. fertőzések) kizárása.
9. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható készítmények:
Salazopyrin intolerancia, illetve jelentős szisztémás szteroid mellékhatás esetén az életkorra vonatkozó indikációs megkötések és az adott készítmény alkalmazási előírásában szereplő javallatok figyelembe vételével: budesonid, mesalazin hatóanyagú készímények (Eü90, 11/b).
10. Szövődmények monitorozása, ellenőrzése
10.1. Opportunista infekciók
10.2. Malignus betegségek
10.3. Neurológiai eltérések
10.4. Indukált autoimmun kórképek
11. A felnőttkori colitis ulcerosa finanszírozásának ellenőrzési kritériumai
11.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
11.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
11.1.2. Betegadatok (online TAJ ellenőrzés)
11.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
11.2. Szakmai ellenőrzési pontok
A diagnózis kritériumainak rögzítése (BNO: K5180, K5190) klinikai tünetek és endoszkópos lelet alapján. A betegség klinikai tüneteinek és aktivitásának meghatározása (a vizitet megelőző egy héten át vezetett betegnapló alapján) és dokumentálásának ellenőrzése (Mayo score).
11.2.1. Klinikai tünetek Mayo kritériumok alapján: Mayo score maximum 12 pont
11.2.2. Enyhe colitis ulcerosa (Mayo score ≤6)
11.2.3. Közepesen súlyos colitis ulcerosa (6< Mayo score ≤9)
11.2.4. Súlyos colitis ulcerosa (Mayo score >9)
11.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
11.3.1. TBC kizárása (mellkas RTG)
11.3.2. Egyéb akut és krónikus fertőzések kizárása (pl.: hepatitis B és C szűrés)
11.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok alapján)
11.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
11.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
11.3.6. Labor: rutin
11.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
11.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
11.4.2. 3 havonta: aktivitási index (endoscopia nélküli Mayo subscore meghatározása és dokumentálása)
11.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
11.5. Megjegyzés
11.5.1. Súlyos: Mayo score 9
11.5.2. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
11.5.3. Fenyegető colectomia esetén sebészeti konzílium szükséges
11.5.4. Legalább 2 mg/ttkg dózisú, vagy a legnagyobb tolerálható dózisú AZA mellett szisztémás szteroid igény 3 hónapon át (10 mg prednisolon equivalens szteroid dózis alatt Mayo≥9 és Mayo≥2 endoszkópos subscore)
11.5.5. Mayo score csökkenése minimum 3 ponttal
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
12. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
12.1. A területre fordított közkiadások alakulása, monitorozása.
12.2. A finanszírozási algoritmus szerint kezelt betegek aránya.
13. A finanszírozás szempontjából lényeges finanszírozási kódok
13.1. A releváns BNO kódok
| A | B | |
| 1 | Kód | Elnevezés |
| 2 | K5180 | Colitis ulcerosa egyéb |
| 3 | K5190 | Colitis ulcerosa k.m.n. |
13.2. A releváns ATC kódok
| 1 | A | B | C | D |
| ATC kód | Hatóanyag | Kategória | Megjegyzés | |
| 2 | A07EC01 | szulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | A07EC02 | mesalazin | DMARD | Betegségmódosító szerek |
| 4 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 5 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 6 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 8 | H02AB01 | betamethason | Szteroid | Szteroid gyógyszerek |
| 9 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 10 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 11 | H02AB09 | hidrokortizon | Szteroid | Szteroid gyógyszerek |
| 12 | A07EA06 | budesonid | Szteroid | Szteroid gyógyszerek |
14. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása"
15. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"10. melléklet a 31/2010. (V. 13.) EüM rendelethez
A plakkos psoriasis diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Plakkos psoriasis
2. A kórkép leírása
A psoriasis krónikus gyulladásos bőrbetegség, mely többnyire jól körülírt területen erythemas papulosus, plakkos elváltozással jár. Számos betegnél ízületi érintettség is diagnosztizálható. A betegség jellemzője, hogy a betegek jelentős része állandó kiterjedt bőrtünetektől szenved. Hasonlóan az AP-hoz, a betegek funkcionális képessége, életminősége, általános egészségi állapota rendkívül kedvezőtlen. Az európai országokban a megbetegedés az össznépesség mintegy 1,4-2%-át érinti.
2.1. Autoimmun gyulladásos bőrgyógyászati betegségek: psoriasis
A psoriasis kezelését alapvetően a bőrtünetek kiterjedtsége, lokalizációja és jellege, illetve az egyéb kísérő tünetek (arthritis) jelenléte határozza meg. A kezelést elsősorban a rendelkezésre álló lokális, szisztémás és fototerápia jelenti. A kis kiterjedésű betegség esetén (a testfelület kevesebb, mint 10%-a) a lokális kezelés preferálható. A nagyobb kiterjedésű psoriasisban (BSAI≥10, a testfelület több mint 10%-a) a fototerápia és a szisztémás kezelés (metotrexát, cyclosporin, retinoidok) alkalmazása kerül előtérbe. A súlyos szisztémás kezelésre nem reagáló, továbbra is aktív kórfolyamatokban, illetve azokban az esetekben, amikor intolerancia, illetve a beteg egészségi állapotát veszélyeztető súlyos mellékhatás miatt a standard szisztémás kezelés kontraindikált, biológiai terápia alkalmazása indokolt. A biológiai terápia standard kezeléssel szembeni hosszú távú veszélyei és előnyei jelenleg csak részben ismertek.
2.2. A plakkos psoriasis aktivitása
A biológiai terápia indikációjának felállításakor a betegség súlyosságát és az életminőségre gyakorolt hatását definiálni kell. A krónikus súlyos plakkos psoriasisban a szakmai irányelv a "psoriasis kiterjedési és súlyossági indexet" (PASI, értéke 0-72 között) javasolja a betegség súlyosságának megítélésére. Amennyiben a PASI nem meghatározható (pl. erythrodermiás vagy pustulosus psoriasis), az érintett "testfelszín százalékban kifejezett értéke" (BSA) a mérvadó. A 10% feletti érték súlyos betegségként definiálható. A "Bőrgyógyászati Életminőségi Index" (DLQI, értéke 0-30 között) a bőrbetegségek által okozott életminőségbeli eltérések mérésére alkalmas mérőszám, ahol a 10 feletti érték már igen kifejezett életminőségbeli romlást jelez.
2.3. A betegség aktivitásának meghatározása és dokumentálásának ellenőrzése
2.3.1. Klinikai tünetek súlyossága
2.3.2. PASI "psoriasis kiterjedési és súlyossági index" (értéke 0-72 között)
2.3.3. BSA "testfelszín százalékban kifejezett értéke" (súlyos 10% felett)
2.3.4. DLQI "Bőrgyógyászati Életminőségi Index" (értéke 0-30 között)
2.3.5. Ízületi érintettség esetén: DAS 28, BASDAI index meghatározása
2.4. A diagnózis kritériumainak rögzítése (BNO: L4003, L4004, L4005, L4090)
2.4.1. PASI, BSA, DLQI dokumentálása
2.4.2. Reumatológus konzílium dokumentálása ízületi érintettség esetén
2.4.3. Perifériás ízületi érintettség esetén: DAS28 aktivitási index dokumentálása
2.4.4. Axiális ízületi érintettség esetén: BASDAI index dokumentálása
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
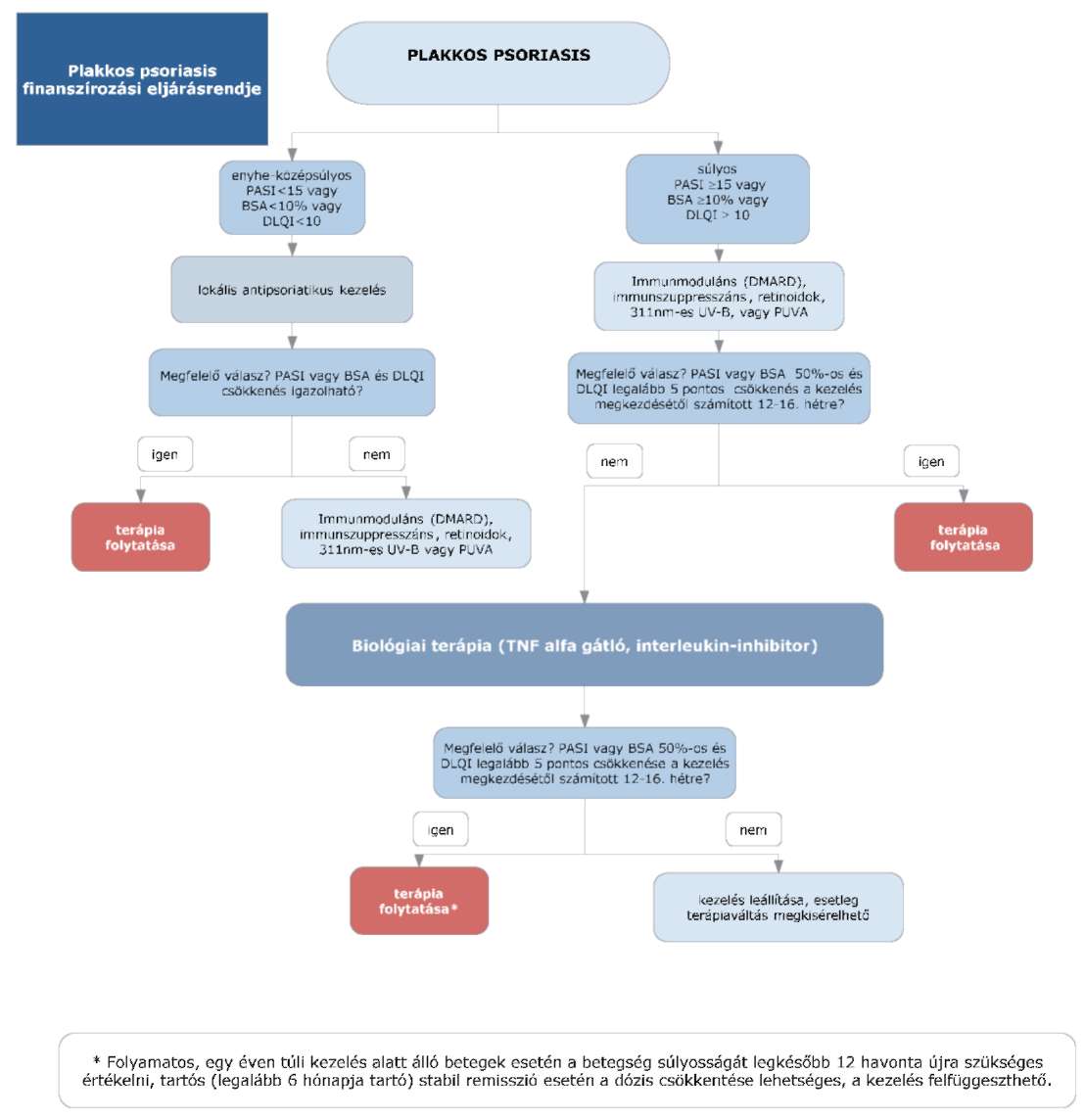
4. A plakkos psoriasis kezelése
Standard szisztémás kezelési módszerek alatt a következőket értjük: acitretin, ciclosporin, metotrexát, szűk spektrumú ultraibolya (UV) B, és psoralen + UVA fotokemoterápia. Standard kezelési módszerekre nem reagáló eset: nem kielégítő klinikai javulás (kevesebb mint 50%-os PASI vagy BSA javulás a kiindulási értékhez képest, és a DLQI kevesebb mint 5 pontos javulása) a következő kezelési módszerekkel végzett legalább 3 hónapig tartó terápiás dózisú kezelés után: cyclosporin 2,5-5,0 mg/tskg/nap, vagy metotrexát egyszer 15 mg/hét (max. 25-30 mg), vagy acitretin 25-50 mg/nap, vagy szűkspektrumú UVB vagy PUVA (klinikai javulás hiánya, gyors recidíva vagy a maximálisan ajánlott dózisok elérése - PUVA: 150-200 kezelés, UVB: 350 kezelés).
4.1. Biológiai terápia: indukciós kezelés súlyos, aktív plakkos psoriasisban
4.1.1. A kezelés előtt rögzíteni kell:
4.1.1.1. PASI "psoriasis kiterjedési és súlyossági indexet" (értéke 0-72 között)
4.1.1.2. BSA "testfelszín százalékban kifejezett értéke" erythrodermiás vagy pustulosus psoriasis esetén
4.1.1.3. DLQI "Bőrgyógyászati Életminőségi Index" (értéke 0-30 között)
4.2. TNF-alfa vagy interleukin-inhibitor gátló terápia felnőttkori súlyos plakkos psoriasisban javasolt, amennyiben az alábbi kritériumok együttesen teljesülnek:
4.2.1. súlyos psoriasis fennállása esetén, amennyiben a teljes PASI nagyobb, mint 15 és a DLQI nagyobb, mint 10, és
4.2.2. legalább 3 hónapig tartó, standard szisztémás kezelés (metotrexát, cyclosporin, retinoid és PUVA) ellenére a betegség továbbra is súlyos, azaz PASI nagyobb, mint 15 és a DLQI nagyobb, mint 10, vagy a szisztémás kezeléssel szemben dokumentált intolerancia vagy kontraindikáció áll fenn.
4.3. Az anti-TNF-alfa és az interleukin-inhibitor indukciós kezelés hatékonyságának ellenőrzése plakkos psoriasis kezelésében
A kezelés 12-16. hetében meg kell határozni a PASI index összetevőit. Amennyiben a 12-16. hétre nem következik be PASI érték 50%-os javulása, illetve a DLQI 5 pontos, vagy annál nagyobb mérvű csökkenése, vagy súlyos mellékhatások lépnek fel, az elsőként választott biológiai kezelést le kell állítani. Bármely biológiai készítménnyel történő kezelés leállítása esetén másik biológiai válaszmódosító szer alkalmazása megkísérelhető, amennyiben egyéb kontraindikáció nem áll fenn.
4.4. Fenntartó kezelés plakkos psoriasis biológiai kezelésében
A kezelés további folytatásának eldöntése céljából háromhavonta rögzíteni kell:
4.4.1. PASI "psoriasis kiterjedési és súlyossági index" (értéke 0-72 között)
4.4.2. BSA "testfelszín százalékban kifejezett értéke" erythrodermiás vagy pustulosus psoriasis esetén
4.4.3. DLQI "Bőrgyógyászati Életminőségi Index" (értéke 0-30 között)
4.4.4. Folyamatos egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.5. Az anti-TNF-alfa és az interleukin-inhibitor kezelés további folytatásának kritériumai
4.5.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-α vagy IL inhibitor terápiára történő váltás (switch) megengedett.
4.5.2. Az anti-TNF-α terápia nem folytatható, amennyiben anti-TNF-α terápia ellenére 6 hónap alatt megfelelő terápiás válasz nem volt elérhető: primer hatástalanság.
4.5.3. Anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett: szekunder hatástalanság.
4.5.4. Az anti-TNF-α terápia dózisának emelése a forgalomba hozatali engedélyben induló dózishoz képest nem javasolt.
4.5.5. A kijelölt intézmények szakavatott és a biológiai terápia alkalmazásában jártas bőrgyógyász szakorvosainak a kompetenciája az anti-TNF-α és IL-inibitor terápia indikálása és alkalmazása.
4.5.6. Az interleukin-inhibitor terápia társadalombiztosítási támogatással történő alkalmazása az anti-TNF-α terápia alkalmazásának feltételeivel azonos.
4.6. Biológiai terápiát megelőzően elvégzendő vizsgálatok
4.6.1. Teljes vérkép
4.6.2. Vizelet
4.6.3. Elektrolitok
4.6.4. Májfunkciós értékek
4.6.5. Vesefunkció
4.6.6. Antinukleáris antitestek
4.6.7. Anti-DNS
4.6.8. VVT-süllyedés, CRP
4.6.9. Hepatitis B és C vírus szerológia (esetleg hepatitis E)
4.6.10. HIV teszt
4.6.11. Terhességi teszt nőknél
4.6.12. Kétirányú mellkasröntgen, vagy Mantoux próba (kérdéses esetben pulmonológus konzílium)
4.6.13. Testsúly/testmagasság
5. Szövődmények monitorozása, ellenőrzése TNF-alfa gátló és interleukin-inhibitor kezelés alkalmazása esetén
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel, az egyéni rizikófaktorok felmérésével és figyelembevételével.
5.1.2. Különös gondot kell fordítani a
5.1.2.1. tuberculosis kizárására (mellkas röntgen),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a látens TBC veszélye, gátlószeres kezelés mellett adható a biológiai kezelés.
5.1.3. A kezelés időtartama alatt félévente-évente mellkas röntgen szükséges.
5.1.4. A biológiai terápia kezdetekor a latens és aktiv tuberculosis felismeréséhez szükséges vizsgálatokról, illetve a biológiai kezelés során a tuberculosis monitorizálásáról a szakmai irányelvek rendelkeznek.
5.1.5. Krónikus vírushepatitis sem jelent abszolút kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.2. Malignus betegségek
5.2.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.2.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.3. Neurológiai eltérések
5.3.1. Nervus opticus neuritis
5.3.2. Demyelinizációs kórképek
5.4. Egyéb mellékhatások
5.4.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.4.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
6. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1.1. Kompetencia szint: kijelölt intézmény, eszközellátottság (UV), szakorvosi kompetencia
6.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. A diagnózis kritériumainak rögzítése (BNO: L4003, L4004, L4005)
6.2.1.1. A betegség aktivitásának és súlyosságának dokumentálása
6.2.1.2. Klinikai tünetek súlyossága
6.2.1.3. PASI "psoriasis kiterjedési és súlyossági index" (értéke 0-72 között)
6.2.1.4. BSA "testfelszín százalékban kifejezett értéke" (súlyos 10% felett)
6.2.1.5. DLQI "Bőrgyógyászati Életminőségi Index" (értéke 0-30 között)
6.2.1.6. Reumatológus konzílium dokumentálása (ízületi érintettség esetén)
6.2.1.7. Perifériás ízületi érintettség esetén: DAS28 aktivitási index dokumentálása
6.2.1.8. Axiális ízületi érintettség esetén: BASDAI index dokumentálása
6.2.2. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
6.2.2.1. TBC kizárása (mellkas RTG, esetleg Mantoux próba)
6.2.2.2. Fertőzések kizárása
6.2.2.3. Demyelinizációs betegség kizárása, autoimmun betegség (pl. SLE) kizárása
6.2.2.4. Terhesség kizárása
6.2.2.5. Szociális körülmény alkalmatlansága
6.2.2.6. Labor [rutin, immun (ANA, ANF)]
6.2.3. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
6.2.3.1. Indukciós kezelés alatt havonta: labor (We, FVS, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K, vizelet)
6.2.3.2. Fenntartó kezelés alatt 1-3 havonta klinikai szituációtól függően: labor (We, FVS, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K, vizelet)
6.2.3.3. Az indukciós kezelés hatásának felmérésére a kezelés 12-16. hetében, majd 3 havonta: aktivitási index (PASI, BSA, DLQI)
6.2.3.4. 6-12 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
6.2.3.5. Tartósan 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e
6.3. Megjegyzés
6.3.1. Standard szisztémás terápiák: immunmoduláns, immunszuppresszáns kezelések: metotrexát, cyclosporin A, terápiás dózisban
6.3.2. Retinoidok: acitretin
6.3.3. TNF-alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével)
6.3.4. Interleukin-inhibior: usztekinumab
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A területre fordított közkiadások alakulása.
7.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | L4050 | Arthropathiás psoriasis (M07.0-M07.3*, M09.0*) |
| 3 | L4003 | Psoriasis vulgaris, kp.súlyos (PASI-SCORE 11-18) |
| 4 | L4004 | Psoriasis vulgaris, súlyos (PASI-SCORE 19-30) |
| 5 | L4005 | Psoriasis vulgaris, nagyon súlyos (PASI-SCORE 31-44) |
| 6 | L4090 | Psoriasis k.m.n. |
8.2. Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC-kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 3 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 4 | D05BB02 | acitretin | Retinoid | Antipsoriatikus szisztémás szer |
| 5 | L04AB01 | etanercept | BRMD | Biológiai terápia eszközei |
| 6 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 8 | L04AC05 | usztekinumab | BRMD | Biológiai terápia eszközei |
9. Fogalmak, rövidítések
ALAT Alanin-aminotranszferáz
ASAT Aszpartát-aminotranszferáz
ATC Anatomical Therapeutic Chemical klasszifikáció
BASDAI Bath Ankylosing Spondylitis Disease Activity Index
BNO Betegségek nemzetközi osztályozása
BSA Body surface area
CRP C-reaktív protein
DAS28 Disease Activity Score
DMARD Disease-modifying antirheumatic drugs
DLQI Dermatology Life Quality Index
FVS Fehérvérsejtszám szám
GGT Gamma-glutamil-transzferáz
K Kálium
Karb Karbamid-nitrogén
Kreat Kreatinin
Na Nátrium
PASI Psoriasis kiterjedési és súlyossági index
PUVA Psoralen + ultraviola sugárzás A
RTG Röntgen
SLE Szisztémás lupus erythematosus
TBC Tüdőtuberkolózis
TNF Tumor necrosis factor
tskg Testsúly kilogramm
UVA Ultraviola sugárzás A
UVB Ultraviola sugárzás B
We Vörösvértest-süllyedés"
16. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"11. melléklet a 31/2010. (V. 13.) EüM rendelethez
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Rheumatoid arthritis (C00-C97)
2. A kórkép leírása
A rheumatoid arthritis (RA) krónikus, progresszív sokízületi gyulladással járó betegség. A betegség feltételezhetően autoimmun eredetű. A rheumatoid arthritis sújtotta betegek jelentős része állandó gyulladásos fájdalomtól szenved. A hagyományos betegségmódosító gyógyszerek a betegek jelentős részénél, főleg a hevesebb, súlyosabb eseteknél hatástalanok (non-responder, refrakter esetek). A magasabb gyulladásos aktivitás, a koraibb ízületi károsodás és a funkcionális kiesés, valamint az életminőség csökkenése szorosan összefüggenek. A rheumatoid arthritist nagyfokú gyulladás, következményes ízületi destrukció jellemzi. Kulcs-citokinjei a tumor-nekrózis faktor-alfa (TNF), interleukin-1, interleukin-6 és a RANK-ligand (RANKL). A biológiai terápia irányulhat a TNF gátlására, valamint célpontjai lehetnek a gyulladásos válaszban szereplő sejtek (T és B limfociták, antigén-prezentáló sejtek) felszíni markerei, amelyek blokkolása útján a T sejt aktiválódása (ko-stimuláció molekulái, CD28-CD80/CD86) meggátolható, illetve maga a sejt eliminálható (B sejt CD 20-marker).
2.1. A rheumatoid arthritis aktivitása
Az anatómiai károsodás a gyulladás következménye, a közvetlen cél ennek mérséklése. A gyulladás aktivitásának mérésére a napi gyakorlatban az Amerikai Reumatológus Társaság által összeállított "core set" szerint vizsgáljuk a duzzadt és nyomásérzékeny ízületek számát, az akut fázis proteinek termelődését jelző CRP-szintet vagy vörösvértest-süllyedést (a CRP érzékenyebb, de drágább), 10 cm-es VAS mérve a fájdalom intenzitását, valamint a beteg és az orvos globális véleményét a betegség aktivitásáról. Ezen paraméterek egy részéből egy összetett index, ún. betegség aktivitási score (DAS) képezhető.
A gyakorlatban a 28 ízület vizsgálatával nyert DAS 28-at alkalmazzuk. A DAS 28 esetében 3,2 alatt beszélünk mérsékelt, 3,2 és 5,1 között közepes és e felett magas gyulladásos aktivitásról. A bázisterápiás gyógyszerek adagjának titrálásával vagy több gyógyszer kombinálásával lehetőség szerint a DAS 28-at 3,2 alá kell szorítanunk. Az optimális eredmény természetesen a teljes remisszió elérése lenne, ez a DAS 28 esetében 2,6 alatti értéket jelent. A DAS szoros kontrolljával végzett, ez által irányított kezelés bizonyítottan eredményesebben mérsékli az anatómiai károsodás ütemét, mint a betegek hagyományos gondozása.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
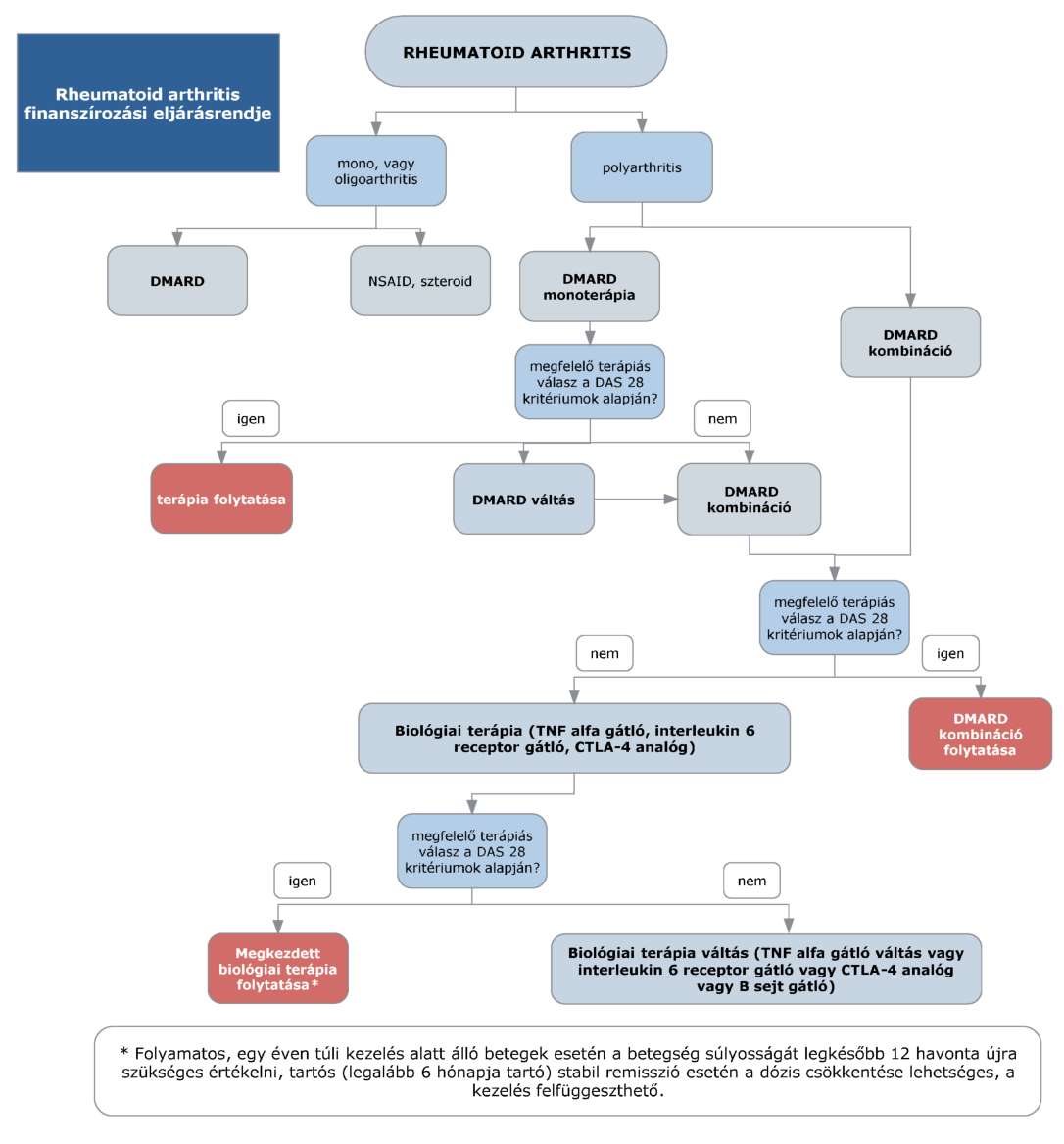
4. A rheumatoid arthritis gyógyszeres kezelési algoritmusa
Az algoritmus általánosságban mindegyik arthritis típusban alkalmazható, a speciális szempontok figyelembevételével.
4.1. Tüneti kezelés (analgetikum, NSAID) (alapellátás + mindhárom progresszivitási szint)
4.2. Kezdeti szteroid kezelés (6 hónapig adható, lásd alább) (mindhárom reumatológiai szint)
4.2.1. ilyenkor betegségmódosító hatása van
4.2.2. infekció, szeptikus arthritis kizárása szükséges
4.3. Korai betegségmódosító terápia (mindhárom reumatológiai szint) optimálisan a folyamat első 3 hónapján belül
4.3.1. DMARD kombináció
4.3.1.1. a betegség aktivitásától függő DMARD kombináció
vagy
4.3.2. DMARD monoterápia
4.3.2.1. a methotrexat (MTX) az első választandó szer (kivétel: intolerancia, kontraindikációk)
4.3.2.2. ritka (mérsékelt aktivitás) esetben SSZ, chloroquin (CQ) is alkalmazható
4.3.2.3. MTX ineffektivitás, intolerancia esetén SSZ, LEF (LEF)
4.3.2.4. cyclosporin A (CsA), CQ, AZA
4.3.2.5. speciális esetben (vasculitis) CPH
4.4. Biológiai terápia (2. és 3. reumatológiai szint: biológiai terápia alkalmazására kijelölt intézmények)
4.4.1. valamelyik TNF-gátló (infliximab, etanercept, adalimumab, golimumab, certolizumab-pegol)
4.4.2. interleukin-6 receptor gátló (tocilizumab)
4.4.3. CTLA-4 analóg (abatacept)
4.4.4. 3 hónapig alkalmazott teljes dózisú vagy tolerálható dózisú DMARD kombinációs kezelés hatástalansága esetén engedélyezett társadalombiztosítási támogatással
4.5. Autológ őssejttranszplantáció (opcionálisan, nem rutinszerű)
5. Rheumatoid arthritis biológiai kezelése
5.1. A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
5.2. Indukciós és fenntartó kezelés súlyos rheumatoid arthritis esetén
5.2.1. Újonnan diagnosztizált aktív rheumatoid arthritis esetén elsőként választandó a DMARD monoterápia, alkalmazása javasolt gyors dózisemeléssel a megfelelő klinikai hatás eléréséig, vagy kombinációs terápia (beleértve a methotrexátot és legalább egy másik DMARD készítményt és rövid idejű kortikoszteroidot együttesen) a tünetek megjelenésétől számítva a lehető legrövidebb időn belül (<3 hónap).
5.2.2. Súlyos, aktív rheumatoid arthritis esetén az anti-TNF-α terápia (infliximab, etanercept, adalimumab, golimumab, certolizumab pegol) vagy interleukin-6 receptor gátló (tocilizumab), CTLA-4 analóg (abatacept) terápia alkalmazható azon betegek számára, akiknél az alábbi kritériumok együttesen teljesülnek:
5.2.2.1. RA diagnózisa: több, mint 4 ACR kritérium együttesen van jelen az alábbiak közül legalább 3 hónapja:
5.2.2.1.1. Reggeli ízületi merevség (>1óra)
5.2.2.1.2. Három vagy több ízületi régió gyulladása
5.2.2.1.3. A kéz ízületeinek gyulladása legalább egy régióban
5.2.2.1.4. Szimmetrikus ízületi gyulladás
5.2.2.1.5. Rheumatoid csomók
5.2.2.1.6. Radiológiai elváltozások: eróziók, sávos dekalcifikáció a kézfelvételen
5.2.2.1.7. Rheumatoid faktor jelenléte a szérumban
5.2.2.2. 1 hónap eltéréssel legalább két alkalommal DAS 28 aktivitási index 5,1-nél nagyobb,
5.2.2.3. legalább 3 hónapig tartó DMARD kombinációban történő alkalmazás ellenére megfelelő terápiás válasz nem volt elérhető (DAS 28 aktivitási index 5,1-nél nagyobb),
5.2.2.4. a methotrexat (hacsak nem kontraindikált) alkalmazásra került a DMARD kombináció részeként,
5.2.2.5. a megfelelő DMARD kombinációs terápia ideje minimum 3 hónap, ebből legalább 2 hónap standard dózisban, hacsak a dózisemelés toxicitás miatt nem kivitelezhető.
5.2.3. Az indukciós anti-TNF-α terápiát követően legalább 3 havonta szükséges a DAS 28 index értékelése.
5.2.3.1. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető. A biológiai terápia leépítése a hagyományos DMARD terápia folytatása mellett javasolt.
5.2.4. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek (DAS 28 nem javult legalább 1,2 ponttal), másik anti-TNF-α terápiára történő váltás (switch), IL6 receptor gátló (tocilizumab), CTLA-4 analóg (abatacept) vagy B sejt gátló (rituximab) kezelés megengedett. Switch-et követően, hatástalanság esetén további TNF-α gátló szerre nem érdemes váltani.
5.2.5. Az anti-TNF-α terápia nem folytatható, amennyiben anti-TNF-α terápia ellenére 6 hónap alatt megfelelő terápiás válasz nem volt elérhető (DAS 28 nem javult legalább 1,2 ponttal): primer hatástalanság.
5.2.6. Anti-TNF-α kezelés során a terápiás válasz elvesztése után vagy intolerancia esetén másik szerre való váltás megengedett: szekunder hatástalanság.
5.2.7. Az interleukin-6 receptor gátló (tocilizumab) és a CTLA-4 analóg (abatacept) terápiák alkalmazásának feltételei megegyeznek az anti-TNF-α terápia alkalmazásának feltételeivel.
5.2.8. B sejt gátló (rituximab) terápia methotrexattal kombinálva azon súlyos, aktív rheumatoid arthritisben szenvedő betegek kezelésében javasolt, akiknél TNF-α terápiára nem alakult ki megfelelő terápiás válasz vagy intolerancia jelentkezett.
5.2.9. B sejt gátló (rituximab) terápia methotrexattal kombinálva mindaddig folytatandó, amíg a megfelelő terápiás válasz fennáll. A megfelelő válasz kritériuma a következő: a betegség aktivitási index (DAS 28) javulás legalább 1,2 a kiindulási értékhez képest. Fenntartó terápia minimum 6 hónap múlva alkalmazható ismételten.
5.2.10. Az RA kezelésében az anti-TNF-α terápia és az interleukin-6 receptor gátló terápiák dózisának emelése csak az alkalmazási előírásokban foglaltak szerint javasolt.
5.2.11. A kijelölt centrumban, RA kezelésében jártas, megfelelő tapasztalattal rendelkező reumatológus szakorvos kompetenciája az anti-TNF-α, az interleukin-6 receptor gátló és a B sejt gátló (rituximab) terápia indikálása és alkalmazása.
6. Szövődmények monitorozása, ellenőrzése TNF-α gátló kezelés és az interleukin-6 receptor gátló terápiák alkalmazása esetén
6.1. Opportunista infekciók
6.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
6.1.2. Különös gondot kell fordítani
6.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux);
6.1.2.2. további, krónikus bakteriális infekció kizárására;
6.1.2.3. 5 éven belüli malignus betegség kizárására;
6.1.2.4. a fizikális vizsgálatra;
6.1.2.5. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
6.1.2.6. A kezelés időtartama alatt
6.1.2.6.1. félévente mellkas röntgen szükséges,
6.1.2.6.2. tuberculosis monitorizálása (latens TBC esetén),
6.1.2.6.3. hepatitis B szerológiai szűrés a kockázatos betegek esetében.
6.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
6.3. Malignus betegségek
6.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
6.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
6.4. Neurológiai eltérések
6.4.1. Nervus opticus neuritis
6.4.2. Demyelinizációs kórképek
6.5. Kardiális állapot
6.5.1. NYHA III-IV. stádiumú kardiális elégtelenség esetén biológiai terápia nem indítható. A kezelés során a kardiális elégtelenség monitorozása szükséges.
6.6. Graviditás
6.6.1. A beteg figyelmét fel kell hívni a teratogén kockázatra és ezért az effektív antikoncepció szükségességére.
6.7. Egyéb mellékhatások
6.7.1. Infúziós/injekciós helyi reakciókkal kell számolni.
6.7.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
7.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
7.1.2. Betegadatok (online TAJ ellenőrzés)
7.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7.2. Szakmai ellenőrzési pontok
7.2.1. A diagnózis kritériumainak rögzítése (BNO: M06.9)
7.2.2. 4 ACR kritérium együttes jelenléte az alábbiak közül:
7.2.2.1. Reggeli ízületi merevség (>1 óra)
7.2.2.2. Három vagy több ízületi régió gyulladása
7.2.2.3. A kéz ízületeinek gyulladása legalább egy régióban
7.2.2.4. Szimmetrikus ízületi gyulladás
7.2.2.5. Rheumatoid csomók
7.2.2.6. Radiológiai elváltozások: eróziók, sávos dekalcifikáció a kézfelvételen
7.2.2.7. Rheumatoid faktor jelenléte a szérumban (RF faktor) (Labor)
7.2.3. A betegség aktivitásának meghatározása (aktivitási index DAS 28) és dokumentálásának ellenőrzése
7.2.3.1. súlyos: 5,1 felett a DAS 28 aktivitási index (módosított Disease Activity Score)
7.2.3.2. középsúlyos: 5,1 és 3,2 között a DAS 28 aktivitási index
7.2.3.3. enyhe: 3,2 alatt a DAS 28 aktivitási index
7.2.4. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
7.2.4.1. TBC kizárása (mellkas RTG)
7.2.4.2. Fertőzések kizárása
7.2.4.3. Malignus betegség kizárása
7.2.4.4. Demyelinizációs betegség, SLE kizárása anamnesztikus adatok, klinikum alapján
7.2.4.5. Terhesség kizárása
7.2.4.6. Kongesztív szívelégtelenség kizárása (NYHA III-IV.)
7.2.4.7. Labor (rutin, immun): (RF, anti-CCP, ANA)
7.2.5. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
7.2.5.1. Indukciós kezelés alatt havonta, fenntartó kezelés alatt 3 havonta: labor (We, Fvs, CRP opcionális, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
7.2.5.2. 3 havonta: aktivitási index (DAS 28)
7.2.5.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
7.2.5.4. Tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
7.2.6. Megjegyzés
7.2.6.1. Elfogadott DMARD terápiák: metothrexat (MTX), LEF (LEF), SSZ, cyclosporin. A CsA, chloroquin (CQ), AZA speciális esetben (vasculitis) CPH alkalmazásakor a forgalomba hozatali engedély indikációit szükséges figyelembe venni
7.2.6.2. Elfogadott DMARD kombinációk: bármely szakmailag elfogadott DMARD kombináció alkalmazható
7.2.6.3. TNF alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével), golimumab, certolizumab pegol
7.2.6.4. Interleukin-6 receptor gátló: tocilizumab
7.2.6.5. B sejt gátló: rituximab
7.2.6.6. CTLA-4 analóg: abatacept
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása, monitorozása.
8.2. A finanszírozási algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Táblázat: Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | M0500 | Felty-syndroma |
| 3 | M0510 | Rheumatoid tüdőbetegség (J99.0*) |
| 4 | M0520 | Rheumatoid érgyulladás |
| 5 | M0530 | Rheumatoid arthritis más szervek és szervrendszerek érintettségével |
| 6 | M0580 | Egyéb seropositiv rheumatoid arthritis |
| 7 | M0590 | Seropositiv rheumatoid arthritis, k.m.n. |
| 8 | M0600 | Seronegativ rheumatoid arthritis |
| 9 | M0610 | Felnőttkori kezdetű Still-betegség |
| 10 | M0630 | Rheumatoid csomó |
| 11 | M0640 | Gyulladásos polyarthropathia |
| 12 | M0620 | Rheumatoid bursitis |
| 13 | M0680 | Egyéb, meghatározott rheumatoid arthritis |
| 14 | M0690 | Rheumatoid arthritis, k.m.n. |
9.2. Táblázat: Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 4 | L04AA13 | LEF | DMARD | Betegségmódosító szerek |
| 5 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 6 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 7 | P01BA01 | chloroquin | DMARD | Betegségmódosító szerek |
| 8 | L04AB01 | etanercept | TNF alfa gátló | Biológiai terápia eszközei |
| 9 | L04AA24 | abatacept | CTLA-4 analóg | Biológiai terápia eszközei |
| 10 | L04AB02 | infliximab | TNF alfa gátló | Biológiai terápia eszközei |
| 11 | L04AB04 | adalimumab | TNF alfa gátló | Biológiai terápia eszközei |
| 12 | L04AB06 | golimumab | TNF alfa gátló | Biológiai terápia eszközei |
| 13 | L04AB05 | certolizumab-pegol | TNF alfa gátló | Biológiai terápia eszközei |
| 14 | L04AC07 | tocilizumab | IL-6 R gátló | Biológiai terápia eszközei |
| 15 | L01XC02 | rituximab | B sejt gátló | Biológiai terápia eszközei |
| 16 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 17 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 18 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 19 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
10. Fogalmak, rövidítések
RA Rheumatoid arthritis
ATC Anatomical therapeutic chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
ACR American College of Rheumatology
DAS Disease activity score
VAS Vizuális analóg skála
DMARD Disease modifying antirheumatic drug
TNF Tumor nekrózis faktor
CRP C-reaktív protein
MTX Methotrexat
CsA ciklosporin A
LEF Leflunomid
SSZ Szulfaszalazin
CQ Chloroquin
CPH Cyclophosphamid
AZA Azathioprin
NSAID Non-steroid anti-inflammatory drug"
17. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"12. melléklet a 31/2010. (V. 13.) EüM rendelethez
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Juvenilis idiopathias arthritis
2. A kórkép leírása
A 16 éves kor előtt kezdődő, legalább 6 hete fennálló, legalább 1 ízületet érintő, ismeretlen eredetű, vagyis egyéb okkal nem magyarázható ízületi gyulladás esetén beszélünk juvenilis idiopathiás arthritisről (JIA).
2.1. A betegség felosztása
2.1.1. Szisztémás forma
2.1.2. Oligoarticularis forma
2.1.3. Polyarticularis lefolyású forma - rheumatoid factor pozitív
2.1.4. Polyarticularis lefolyású forma - rheumatoid factor negatív
2.1.5. Arthritis psoriatica
2.1.6. Enthesitishez kapcsolódó arthritis
2.1.7. Nem besorolható
2.2. A főbb klinikai formák közül a polyarticularis JIA-ban (30%) 5 vagy több ízületet érintő, általában szimmetrikus polyarthritis (kéz és láb kisízületek, nyaki gerinc érintettsége) jelentkezik, az esetek egyharmadában rheumatoid faktor pozitivitással. A lány-fiú arány 3:1. Az oligoarticularis JIA (50%) általában az alsó végtagok nagyízületeit (típusosan térdet, bokát) érintő, aszimmetrikus, rheumatoid faktor negatív oligoarthritis. Ebben a formában fordul elő leggyakrabban chronicus uveitis, különösen antinukleáris antitest jelenlétében. Leggyakrabban 1 és 4 éves kor között jelentkezik, lányoknál gyakoribb (4:1).
A szisztémás JIA (10%) lázzal, szisztémás tünetekkel (naponta visszatérő magas láz, tranziens erythemas maculosus kiütések, generalizált lymphadenopathia, hepatosplenomegalia, pericarditis) jár. A betegség extrém ritka 6 hónapos kor előtt, leggyakoribb 1-4 éves kor között, de bármely életkorban megjelenhet, fiúkat és lányokat egyenlő arányban érint.
A juvenilis arthritis psoriatica sokféle klinikai megjelenést mutathat, típusos a kis- és nagyízületeket aszimmetrikusan érintő oligo- vagy polyarthritis, a DIP ízületi érintettség, illetve a kolbászujj jelenség. Psoriasisos köröm jelenségek (Beau-pontok, onycholysis), illetve elsőfokú rokon psoriasisa a családi anamnézisben segít a diagnózis felállításában. Az enthesitishez kapcsolódó formában a betegek jelentős részénél sacroileitis alakul ki, esetenként gerinc érintettséggel, gyakori HLA-B27 asszociációval. A psoriasis itt kizáró kritérium.
2.3. A juvenilis idiopathias arthritis aktivitását Giannini javulási kritériumai szerint az alábbi paraméterek alapján értékeljük:
2.3.1. aktív ízületek száma
2.3.2. mozgáskorlátozott ízületek száma
2.3.3. az orvos általános értékelése a betegség aktivitásáról (VAS)
2.3.4. a beteg vagy a szülő / törvényes képviselő általános értékelése a betegség aktivitásáról (VAS)
2.3.5. CHAQ (Childhood Health Assessment Questionnaire)
2.3.6. We (mm/h)
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
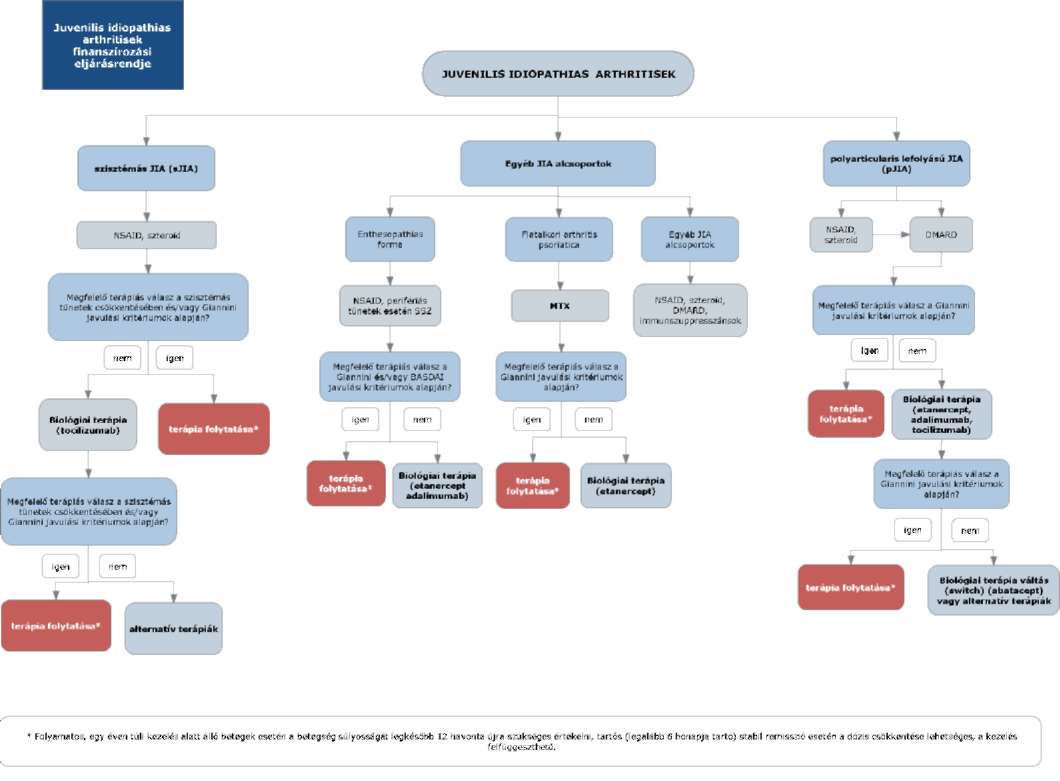
4. A juvenilis idiopathias arthritis gyógyszeres kezelési algoritmusa
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
4.1. Szisztémás JIA (sJIA)
4.1.1. tüneti kezelés: analgetikum, NSAID
4.1.2. szteroid kezelés
4.1.3. infekció, szeptikus arthritis kizárása szükséges
4.1.4. biológiai terápia: NSAID és szisztémás szteroid kezelés hatástalansága esetén: tocilizumab (2. és 3. reumatológiai szint: biológiai terápiás centrumok)
4.2. Polyarticularis lefolyású JIA (pJIA)
4.2.1. tüneti kezelés (analgetikum, NSAID) (alapellátás + mindhárom progresszivitási szint) (a folyamat kezdetén maximum 2-3 hónapig, illetve később fellángolás esetén rövid ideig)
4.2.2. szteroid kezelés (mindhárom reumatológiai szint)
4.2.3. betegségmódosító terápia (mindhárom reumatológiai szint)
4.2.3.1. A methotrexat (MTX) az első választandó szer (kivétel: intolerancia). A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
4.2.3.2. Ritka (nagyon enyhe) esetben szulfaszalazinnal (SSZ) is indíthatunk. A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
4.2.4 Betegségmódosító terápia hatástalansága esetén biológiai terápia (2. és 3. reumatológiai szint: biológiai terápiás centrumok) - TNF-alfa gátló (etanercept vagy adalimumab) vagy IL-6 receptor-antagonista (tocilizumab).
4.2.5. Legalább egy TNF-alfa gátló hatástalansága esetén CTLA-4 analóg (abatacept) (2. és 3. reumatológiai szint: biológiai terápiás centrumok).
4.3. Egyéb JIA alcsoportok
4.3.1. tüneti kezelés (analgetikum, NSAID)
4.3.2. szteroid kezelés
4.3.3. betegségmódosító terápia (DMARD: pl. MTX, SSZ, immunszuppresszánsok)
4.3.4. biológiai terápia (etanercept)
4.3.5. A kezelések alkalmazása a diagnosztizált egyes alcsoportok (enthesopathiás forma, fiatalkori arthritis psoriatica, egyéb alcsoportok) szerint történik. (Lsd. 3. pont folyamatábra)
5. Indukciós és fenntartó kezelés súlyos juvenilis idiopathias arthritis esetén
5.1. Juvenilis idiopathias arthritis esetén biológiai terápia (etanercept, adalimumab vagy tocilizumab) indítható, ha a betegség poliartikuláris formája áll fenn, és a beteg legalább 3 hónapig adott 15 mg/m2/hét methotrexát kezelés ellenére aktív, azaz 5 vagy több ízület duzzadt és 3 vagy több ízület mozgáskorlátozott, fájdalmas, érzékeny, illetve a beteg állapota 0,25 mg/kg/nap vagy ennél nagyobb szteroid adag mellett is a fentiek szerint aktív. Indokolt a biológiai terápia akkor is, ha a felsorolt kezelések toxikusnak bizonyultak vagy nem tolerálhatók.
5.2. Biológiai terápia (tocilizumab) indítható a betegség szisztémás formájában, ha nem-szteroid gyulladásgátló vagy szisztémás szteroid adására nincs kellő terápiás válasz a szisztémás tünetek csökkenése (vörösvérsejt süllyedés, CRP, láz) és /vagy a Giannini kritériumok alapján.
5.3. Biológiai terápia indítható a juvenilis arthritis psoriatica (etanercept) és az enthesopathiás formák (etanercept vagy adalimumab) esetén is, ha az előbbi esetében methotrexatra, utóbbi esetében axiális érintettség esetén nem-szteroid gyulladásgátló kezelésre, perifériás tünetek esetén szulfaszalazinra nincs kielégítő terápiás válasz a Giannini kritériumok alapján a 3. hónapban esedékes értékeléskor.
5.4. Különös figyelemmel kell lenni minden esetben a készítmények alkalmazási előírásában szereplő indikációs területekre és az életkorra vonatkozó előírásokra. Biológiai terápia esetén a dózis emelése csak az alkalmazási előírásokban foglaltak szerint javasolt.
5.5. Csak a gyermekkori reumatológiai betegségek diagnosztizálásában és kezelésében jártas reumatológus szakorvosok kompetenciája a biológiai terápia indikálása és alkalmazása gyermekgyógyász konzíliárus bevonásával.
5.6. A Giannini javulási kritériumok összetevőit meg kell határozni a kezelés kontrollja során. Megfelelő válaszkészség esetén (Giannini javulási kritérium mértéke 30%-nál magasabb, vagyis legalább 3 paraméterben a javulás eléri a 30%-ot és csak egy paraméterben haladja meg a romlás a 30%-ot) az aktivitás rendszeres kontrollja mellett a remisszió fennállásáig folytatható a terápia.
5.7. Az sJIA tocilizumab kezelésénél az általános klinikai tüneteket is figyelembe kell venni (Giannini kritériumok mellett láz hiánya, gyulladásos laborparaméterek normalizálódása).
Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
5.8. A 18. életév betöltése után, amennyiben a betegség lefolyása kimeríti bármely felnőttkori krónikus arthritis klasszifikációját, a felnőttkori besorolás alkalmazandó és a diagnózis módosítandó.
6. Szövődmények monitorozása, ellenőrzése
6.1. Opportunista infekciók
6.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
6.1.2. Különös gondot kell fordítani
6.1.2.1. a tuberculosis kizárására a kezelés megkezdése előtt és a kezelés időtartama alatt a szakmai irányelvben foglaltak szerint,
6.1.2.2. a fizikális vizsgálatra,
6.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
6.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
6.3. Malignus betegségek
6.3.1. malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott,
6.3.2. az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
6.4. Neurológiai eltérések
6.4.1. Nervus opticus neuritis
6.4.2. Demyelinizációs kórképek
6.5. Egyéb mellékhatások
6.5.1. Infúziós/injekciós helyi reakciókkal kell számolni.
6.5.2. Autoantitestek, főleg a kiméra, infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
7.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
7.1.2. Betegadatok (online TAJ ellenőrzés)
7.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7.2. Szakmai ellenőrzési pontok
7.2.1. A diagnózis kritériumainak rögzítése (BNO: M08.0)
7.2.1.1. 16 éves kor alatt
7.2.1.2. legalább 1 ízület érintett
7.2.1.3. az ízületi gyulladás tünetei legalább 6 hete fennállnak
7.2.1.4. egyéb, ismerten ízületi gyulladást okozó betegség kizárható
7.2.1.5. a 7 alcsoport valamelyikének meghatározása
7.2.1.6. radiológiai elváltozások identifikálása vagy kizárása (RTG)
7.2.1.7. rheumatoid faktor jelenléte a szérumban (RF faktor) (egyéb labor)
7.2.2. A betegség aktivitásának meghatározása (Giannini kritériumok) és dokumentálásának ellenőrzése
7.2.2.1. az orvos véleménye a betegségről (vizuális analóg skálával, VAS)
7.2.2.2. a beteg vagy szülő / törvényes képviselő véleménye a beteg állapotáról (VAS)
7.2.2.3. a gyermekkorra adaptált Health Assessment Questionnaire (CHAQ) értéke
7.2.2.4. a gyulladt ízületek száma
7.2.2.5. a mozgáskorlátozott ízületek száma
7.2.2.6. vörösvértest-süllyedés, illetve CRP
7.2.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
7.2.3.1. TBC kizárása
7.2.3.2. fertőzések kizárása
7.2.3.3. demyelinizációs betegség, SLE kizárása az anamnesis és klinikum alapján
7.2.3.4. labor (rutin, immun: RF, anti-CCP, ANA)
7.2.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
7.2.4.1. havonta: labor (Wgr, Fvs, CRP opcionális, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
7.2.4.2. 3 havonta: aktivitási index (Giannini)
7.2.4.3. TBC kizárása
7.2.4.4. tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
7.2.5. Megjegyzés
7.2.5.1. Elfogadott DMARD terápiák esetén a forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
7.2.5.2. TNF alfa gátlók: etanercept, adalimumab.
7.2.5.3. IL-6 receptor antagonista: tocilizumab.
7.2.5.4. Giannini 30% javulás: értékelhető javulásról akkor beszélünk, ha legalább 3 paraméterben a javulás eléri a 30%-ot és csak egy paraméterben haladhatja meg a romlás a 30%-ot.
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása.
8.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Releváns BNO kódok
| A | B | |
| 1 | Kód | BNO megnevezése |
| 2 | M0800 | Fiatalkori reumás ízületi gyulladás |
| 3 | M0810 | Fiatalkori spondylitis ankylopoetica |
| 4 | M0820 | Szisztémás kezdetű juvenilis arthritis |
| 5 | M0830 | Fiatalkori seronegativ polyarthritis |
| 6 | M0840 | Kevés ízületet érintő fiatalkori ízületi gyulladás |
| 7 | M0880 | Egyéb fiatalkori ízületi gyulladás |
| 8 | M0890 | Fiatalkori ízületi gyulladás, k.m.n. |
| 9 | M0900 | Fiatalkori ízületi gyulladás psoriasisban |
9.2. Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 4 | L04AA13 | leflunomid | DMARD | Betegségmódosító szerek |
| 5 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 6 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 7 | P01BA01 | chloroquin | DMARD | Betegségmódosító szerek |
| 8 | L04AB01 | etanercept | TNF-alfa gátló | Biológiai terápia eszközei |
| 9 | L04AA24 | abatacept | CTLA-4 analóg | Biológiai terápia eszközei |
| 10 | L04AB04 | adalimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 11 | L04AC07 | tocilizumab | IL-6 RA | Biológiai terápia eszközei |
| 12 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 13 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 14 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 15 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
10. Fogalmak, rövidítések
| A | B | |
| 1 | Rövidítés | Megnevezés |
| 2 | JIA | Juvenilis idiopathiás arthritis |
| 3 | ATC | Anatomical therapeutic chemical klasszifikáció |
| 4 | BNO | Betegségek nemzetközi osztályozása |
| 5 | VAS | Vizuális analóg skála |
| 6 | CHAQ | Childhood health assessment questionnaire |
| 7 | DMARD | Disease modifying antirheumatic drug |
| 8 | TNF | Tumor nekrózis faktor |
| 9 | CRP | C-reaktív protein |
| 10 | MTX | Methotrexat |
| 11 | SSZ | Szulfaszalazin |
| 12 | NSAID | Non-steroid anti-inflammatory drug |
"
18. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"13. melléklet a 31/2010. (V. 13.) EüM rendelethez
A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Spondylitis ankylopoetica
2. A kórkép leírása
2.1. A spondylitis ankylopoetica (SPA) meghatározás szerint a gerinc ízületeit érintő, ismeretlen eredetű, következményes elcsontosodással járó gyulladás. A gyulladás a tőízületeket, perifériás ízületeket és az íntapadási helyeket is érintheti. Jellemző a folyamatos, éjszaka fokozódó gerinc- (keresztcsonti, derék-, hát-, majd nyak-) fájdalom, a következményes ankylosis miatt a gerinc mozgásainak beszűkülése. Gerincérintettségen szimmetrikus sacroileitist és spondylitist értünk, perifériás formában a tőízületeken (csípő, váll) kívül a térdek, bokák, kézízületek érintettek leggyakrabban. Az extraskeletális tünetek közül a szem (anterior uveitis), szív-érrendszer (aortitis, aorta insufficientia, ingerületvezetési block), tüdő (kevert ventillációs zavar, felső lebeny fibrosis), amyloidosis emelhetők ki. Az örökletesség mértéke 72%, főleg a HLA-B27 génnek van jelentősége. A betegség férfiak között 4-5-ször gyakrabban fordul elő. A kezdet többnyire a 15-30 éves korra esik. Az esetek 70%-ában csak a gerinc és a tőízületek (sacroiliacalis ízületek, csípők) érintettek, 30%-ban perifériás érintettség (általában alsó végtagi mono- vagy oligoarthritis, enthesitis, illetve dactylitis) áll fenn. A betegség lefolyására jellemző, hogy viszonylag fiatal korban kezdődik és korán irreverzibilis ízületi károsodásokkal jár, melyek a tanulást, a szociális beilleszkedést és a munkavállalást is megnehezítik.
2.2. Az SPA terápiája elsősorban tüneti (NSAID, gyógytorna, pszicho-szociális támogatás). A biológiai terápia révén a tüneteket hatékonyan befolyásoló, a progressziót csökkentő, a betegség kimenetelét kedvezőbben befolyásoló kezelés áll rendelkezésre. A biológiai terápia csak azon betegek esetében kezdhető el, akiknél a módosított New York-i klasszifikációs kritériumok szerint a biztos diagnózis fennállása igazolt, radiológiailag legalább 2-es stádiumú bilaterális, vagy 3-as, 4-es stádiumú unilaterális sacroileitis, és legalább 3 hónapja háti fájdalom, frontális és sagittalis síkban beszűkült gerinc-, illetve beszűkült légzőmozgás áll fenn. A biológiai terápia elkezdésének további feltétele az adekvát gyógyszeres kezelés ellenére igazoltan fennálló aktív betegség. Adekvát gyógyszeres kezelésről akkor beszélhetünk, ha legalább két különböző, nem szteroid gyulladásgátló maximális vagy tolerálható dózisban történő, legalább 4 hétig tartó adagolása ellenére a betegség aktivitása nem csökken. Amennyiben a beteg fő panasza az SPA-hoz tartozó perifériás ízületi gyulladás, akkor további feltétel, hogy enthesitis, oligoarthritis esetében lokális vagy intraarticularis kortikoszteroid kezelés, polyarthritis esetében a rheumatoid arthritis kezelésében alkalmazott DMARD (elsősorban a szulfaszalazin megfontolandó szer) legalább négy hónapos gyógyszeres terápia ellenére is az aktív betegség fennálljon.
2.3. A betegség aktivitását a BASDAI index-szel határozzuk meg. Aktívnak tekinthető azon, SPA-ban szenvedő beteg, akinek a BASDAI indexe (0-100) több mint 40. A sacroiliacalis ízületek MR vizsgálata a betegség korai diagnózisának, tudományos vizsgálatokban az aktivitásának, a hagyományos RTG felvétel a betegség radiológiai progressziójának megítélését teszik lehetővé. Perifériás érintettségű SPA aktivitását a DAS 28 index-szel határozhatjuk meg.
2.4. A terápia további alkalmazásának eldöntése céljából a biológiai terápia hatásosságát és biztonságosságát rendszeresen ellenőrizni kell. A terápia hatásosnak tekinthető, amennyiben a megkezdett kezelést követő 12-14. hétre legalább 50%-os relatív BASDAI index csökkenés vagy az index 20 mm abszolút csökkenése igazolható. Amennyiben ez a feltétel nem teljesül, akkor a biológiai terápiát az adott készítménnyel nem lehet tovább folytatni. A BASDAI indexet a kezelés folyamán két-három havonta szükséges ellenőrizni. Ha legalább két egymást követő alkalommal az eredmény a 12-14. héten elért javuláshoz képest romlik (az index érték emelkedik), a kezelést szintén meg kell szakítani.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
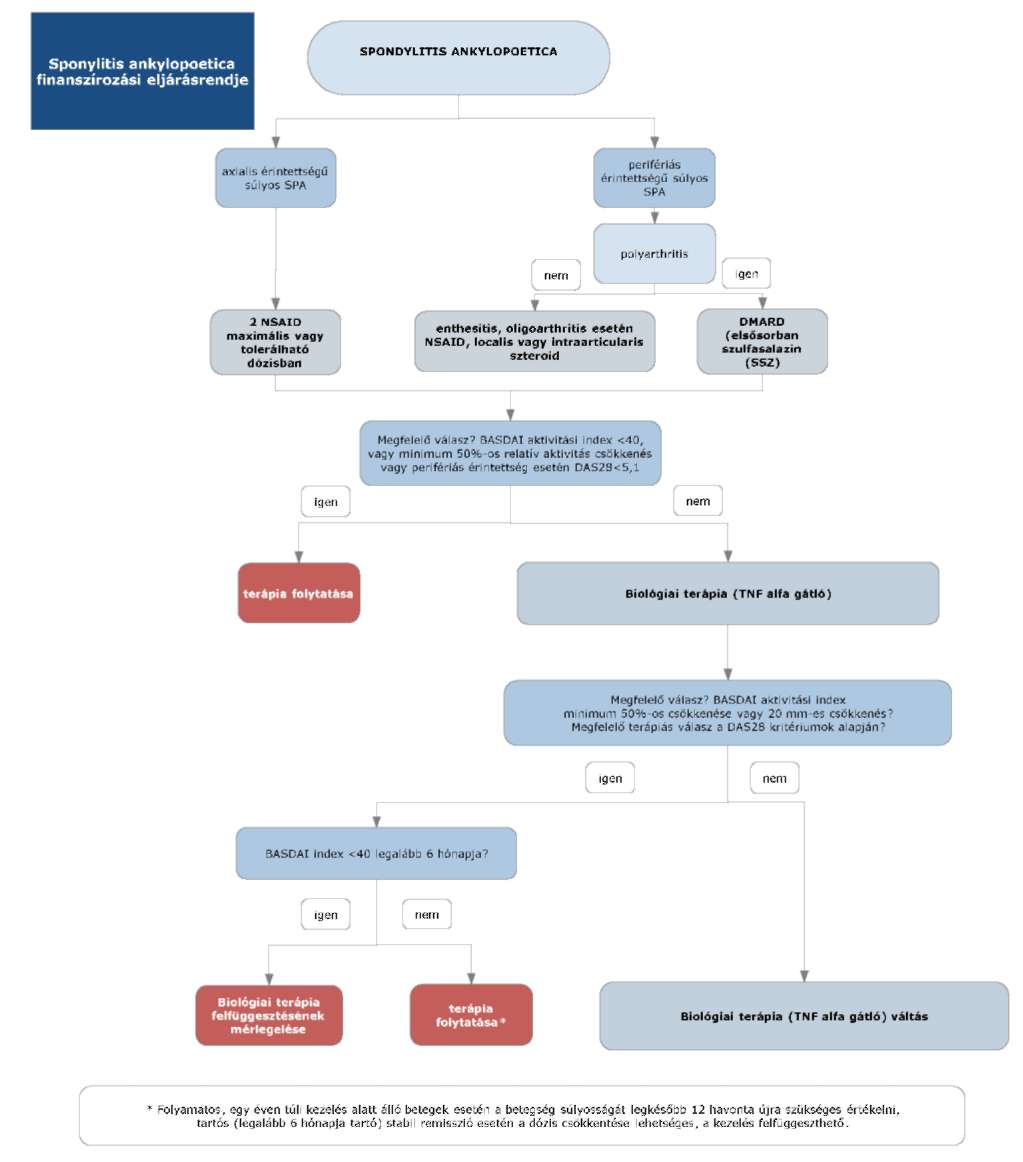
4. A finanszírozási eljárásrend részletezése
4.1. A spondylitis ankylopoetica gyógyszeres kezelési algoritmusa
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
4.1.1. Tüneti kezelés (NSAID analgetikum) (alapellátás + mindhárom progresszivitási szint) tartósan vagy fellángolás esetén rövid ideig
4.2. Perifériás érintettségű SPA
4.2.1. NSAID
4.2.2. Lokális, illetve szükség szerint intraarticularis szteroid kezelés (minimum 2 alkalommal) (mindhárom reumatológiai szint)
4.2.3. Infekció, szeptikus arthritis kizárása szükséges
4.2.4. Korai betegségmódosító terápia (mindhárom reumatológiai szint) (perifériás érintettség esetén jön szóba)
4.2.5. Optimálisan a folyamat első 3 hónapján belül
4.2.6. SSZ az elsőként javasolható szer (kivétel: intolerancia, kontraindikáció)
4.3. Axiális érintettségű SPA
4.3.1. NSAID készítmény alkalmazása, legalább 2 különböző készítmény maximális vagy tolerálható dózisban legalább 4 hétig
4.4. Biológiai terápia
4.4.1. Perifériás érintettségű súlyos SPA során DMARD (elsősorban szulfaszalazin) terápia, illetve súlyos axialis érintettségű SPA-ban alkalmazott legalább 2 NSAID hatástalansága esetén: biológiai terápia (2. és 3. reumatológiai szint: biológiai terápia alkalmazására kijelölt intézmény).
4.4.2. Valamelyik TNF-α gátló: infliximab (az alkalmazott támogatási kategória figyelembevételével), etanercept; adalimumab; golimumab.
4.5. Indukciós kezelés súlyos spondylitis ankylopoetica esetén
4.5.1. A kezelés előtt rögzíteni kell:
4.5.1.1. A BASDAI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egyhónapos időközzel.
4.6. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése spondylitis ankylopoetica kezelésében
4.6.1. A kezelés 12-14. hetében meg kell határozni a BASDAI index összetevőit. Amennyiben a kiindulási értékhez képest legalább 50%-kal vagy 20 mm-rel nem javult az index átlaga, a biológiai terápia az adott készítménnyel nem folytatható. A BASDAI indexet a kezelés folytatása során legalább két-három havonta mérni kell.
4.6.2. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.6.3. Csak szakavatott és a terápia alkalmazásában jártas, kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α terápia indikálása és alkalmazása.
5. Szövődmények monitorozása, ellenőrzése
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
5.1.2. Különös gondot kell fordítani
5.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
5.1.3. A kezelés időtartama alatt félévente mellkas röntgen szükséges.
5.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.3. Malignus betegségek
5.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.3.3. Malignus folyamat esetén 10 éves túlélést követően kezdhető biológiai terápia. A bőr basaliomája esetén a várakozási idő 5 év.
5.4. Neurológiai betegségek (fennállásuk esetén a biológiai terápia kontraindikált)
5.4.1. Nervus opticus neuritis
5.4.2. Demyelinizációs kórképek
5.5. Kardiális állapot
5.5.1. NYHA III-IV. stádiumú kardiális elégtelenség esetén biológiai terápia nem indítható.
5.5.2. A kezelés során a kardiális elégtelenség monitorozása szükséges.
5.6. Graviditás
5.6.1. A beteg figyelmét fel kell hívni a teratogén kockázatra és ezért az effektív antikoncepció szükségességére.
5.7. Egyéb mellékhatások
5.7.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.7.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
6. Fenntartó kezelés spondylitis ankylopoetica biológiai kezelésében
6.1. A kezelés további folytatása során legalább két-három havonta rögzíteni kell a BASDAI indexet, amennyiben a paraméterek két egymást követő alkalommal sem érik el a 12-14. héten már elért legalább 20 mm-es csökkenést vagy 50%-os javulást (ami a folytatás feltétele), akkor a kezelést hatástalanság miatt abba kell hagyni.
7. Laboratóriumi vizsgálatok: célja az egyéb, a biológiai terápiákkal párhuzamosan felírt betegségmódosító gyógyszerek hatásvizsgálata.
7.1. Mielőtt megkezdjük a terápiát, vizsgálni kell:
7.1.1. teljes vérképet
7.1.2. vizeletet
7.1.3. elektrolitokat
7.1.4. májfunkciós értékeket
7.1.5. antinukleáris antitesteket (ANA)
7.1.6. anti-DNS-t
7.1.7. hepatitis szerológiát
8. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
8.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
8.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
8.1.2. Betegadatok (online TAJ ellenőrzés)
8.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
8.2. Szakmai ellenőrzési pontok
8.2.1. A biológiai terápia elkezdéséhez szükséges kritériumok rögzítése (BNO: M45.H0)
8.2.1.1. 2-es stádiumú bilateralis vagy
8.2.1.2. 3-as, 4-es stádiumú unilateralis sacroiletitis (radiológiai vizsgálat)
8.2.1.3. legalább 3 hónapja mozgásra mérséklődő háti fájdalom
8.2.1.4. frontális (nem mérhető objektíven) és szagittális síkban beszűkült gerincmozgás
8.2.1.5. beszűkült légzőmozgás
8.2.2. A betegség aktivitásának meghatározása (BASDAI INDEX 0-100) és dokumentálásának ellenőrzése
8.2.2.1. BASDAI index (0-100) több, mint 40
8.2.2.2. klinikai tünetek súlyossága
8.2.2.3. akut fázis fehérjék magas szintje (laborvizsgálat)
8.2.2.4. gyors radiológiai progresszió (RTG felvétel)
8.2.2.5. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel opcionális)
8.2.2.6. tartós 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
9. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
9.1. A területre fordított közkiadások alakulása.
9.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
10. A finanszírozás szempontjából lényeges finanszírozási kódok
10.1. Releváns BNO kódok
| A | B | |
| 1 | Kód | BNO megnevezése |
| 2 | M0810 | Fiatalkori spondylitis ankylopoetica |
| 3 | M45H0 | Spondylitis ankylopoetica |
10.2. Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | L04AB02 | infliximab | TNF-alfa gátló | Biológiai terápia eszközei |
| 4 | L04AB01 | etanercept | TNF-alfa gátló | Biológiai terápia eszközei |
| 5 | L04AB04 | adalimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 6 | L04AB06 | golimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 7 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 8 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 9 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 10 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
11. Fogalmak, rövidítések
| A | B | |
| 1 | Rövidítés | Megnevezés |
| 2 | SPA | Spondylitis ankylopoetica |
| 3 | ATC | Anatomical Therapeutic Chemical klasszifikáció |
| 4 | BNO | Betegségek nemzetközi osztályozása |
| 5 | DAS | Disease activity score |
| 6 | BASDAI | Bath ankylosing spondylitis disease activity index |
| 7 | DMARD | Disease modifying antirheumatic drug |
| 8 | TNF | Tumor nekrózis faktor |
| 9 | SSZ | Szulfaszalazin |
| 10 | NSAID | Non-steroid anti-inflammatory drug |
"
19. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"14. melléklet a 31/2010. (V. 13.) EüM rendelethez
Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Arthritis psoriatica
2. A kórkép leírása
2.1. Az arthritis psoriatica (AP) egy krónikus szisztémás gyulladásos reumatológiai megbetegedés, mely a bőr psoriasisos elváltozásával társul. Az arthritis többnyire aszimmetrikus és jellemző a disztális interphalangeális ízületek érintettsége, az ujjak kolbászszerű duzzanata (dactylitis). A betegség bármely perifériás ízületet, a gerinc kisízületeit, a sacroiliacalis ízületeket és a szalagtapadási helyeket (enthesis) érintheti. Extraskeletalis érintettség (szem, szív-érrendszer, tüdő) előfordulhat. A kórkép diagnosztikája, kezelése és a betegség nyomon követése a bőrgyógyász és a reumatológus szakorvost egyaránt érinti. Az AP kórisméjét az elfogadott kritériumrendszerrel (Moll-Wright, CASPAR) igazolni kell.
2.2. Az arthritis psoriatica aktivitása
2.2.1. Az arthritis psoriaticában szenvedő beteg perifériás túlsúlyú arthritisének értékelésére a DAS 28 index, axiális érintettség aktivitásának mérésére a BASDAI index alkalmazható. A bőrérintettség kiterjedésének és súlyosságának értékelésére plakkos psoriasisban a PASI score elfogadott.
2.2.2. Axiális érintettség esetén a betegség aktivitását a BASDAI index-szel határozzuk meg. Aktív, súlyosnak tekinthető azon arthritis psoriaticában szenvedő beteg, akinek a BASDAI index (0-100) átlaga több mint 40, és az axiális érintettség fennállását radiológiai vizsgálatokkal igazolták. A sacroiliacalis ízületek MR vizsgálata a betegség aktivitásának, a hagyományos RTG felvétel a betegség radiológiai progressziójának megítélését teszik lehetővé.
2.2.3. Perifériás érintettség esetén a betegség aktivitását DAS 28 index-szel határozzuk meg. Súlyos, aktívnak tekinthető azon arthritis psoriaticában szenvedő beteg, akinek a DAS 28 értéke nagyobb, mint 5,1.
2.2.4. Bőrérintettség súlyosságának megítélésére a PASI index alkalmazható. A bőrtünetek kiterjedtsége, lokalizációja és jellege alapján enyhe vagy középsúlyos psoriasisról beszélünk, amennyiben a PASI<15. Nagyobb kiterjedésű elváltozásról akkor beszélünk, ha a PASI>15. Nagyon ritkán bőrtünet nélkül is előfordulhat arthritis psoriatica.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
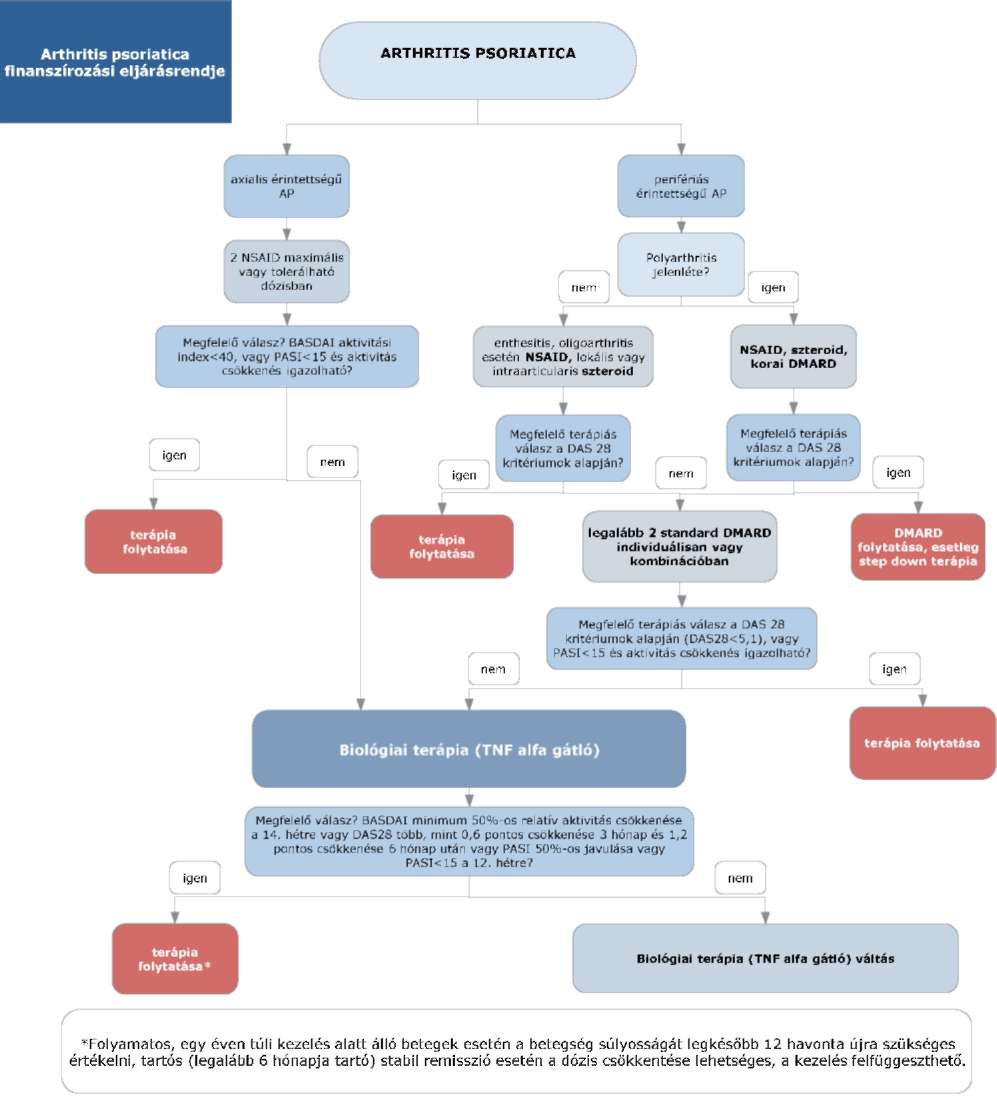
4. Az arthritis psoriatica kezelése
4.1. A psoriasis kezelése a bőrgyógyász, az arthritis kezelése a reumatológus feladata, ezért az arthritis psoriatica kezelésében a két szakma képviselőinek együttműködése szükséges. Az arthritis psoriatica kezelése kezdetben nem-szteroid gyulladáscsökkentők, esetleg kis dózisú szteroid adása, ezek eredménytelensége esetén betegségmódosító gyógyszerek (DMARD) bevezetése. Ma perifériás érintettségű arthritis psoriaticában a methotrexat az első DMARD választás, a LEF, ciklosporin A (CsA) és SSZ is alkalmazható. (A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.)
4.2. A terápia további alkalmazásának eldöntése céljából a terápia hatásosságát rendszeresen ellenőrizni kell. A betegség jellegéből kifolyólag az érintettségtől függően a reumatológiában alkalmazott score-ok (axiális érintettség esetén BASDAI, perifériás érintettség esetén DAS 28) használhatóak a betegség súlyosságának megállapításához. Súlyos bőrérintettség esetén a PASI score felvétele elengedhetetlen, értékét a PASI mérésében gyakorlott személy (bőrgyógyász, de akár reumatológus vagy képzett asszisztens) állapíthatja meg.
4.3. Az arthritis psoriatica biológiai kezelése
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
4.3.1. Indukciós kezelés súlyos, aktív arthritis psoriaticában
4.3.2. Axiális érintettség esetén a kezelés előtt rögzíteni kell:
4.3.2.1. A BASDAI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel.
4.3.3. Axiális érintettség esetén biológiai terápia indokolt, amennyiben
4.3.3.1. a Bath ankylosing spondylitis disease activity index (BASDAI) nagyobb, mint 40 és
4.3.3.2. súlyos bőrérintettség esetén a PASI nagyobb, mint 15
4.3.3.3. konvencionális, legalább 3 hónapig tartó, legalább 2 nonszteroid (NSAID) gyulladáscsökkentő terápia maximális vagy tolerálható dózisban történő alkalmazása ellenére a betegség aktivitásában megfelelő terápiás válasz nem volt elérhető.
4.3.4. Perifériás érintettség esetén a kezelés előtt rögzíteni kell:
4.3.4.1. a DAS 28 index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel. A biológiai terápia indításakor a lemért paramétereket rögzíteni szükséges.
4.3.5. Perifériás érintettség esetén biológiai terápia indokolt, amennyiben:
4.3.5.1. a DAS 28 nagyobb, mint 5,1 és legalább 3 hónapig tartó, 2 konvencionális standard DMARD vagy legalább 3 hónapig tartó DMARD kombinációs terápia ellenére megfelelő javulás, aktivitáscsökkenés nem volt regisztrálható.
4.3.6. Súlyos bőrérintettség esetén a PASI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel. A biológiai terápia indításakor a lemért paramétereket rögzíteni szükséges.
4.3.7. Súlyos bőrérintettség esetén biológiai terápia indokolt, amennyiben:
4.3.7.1. súlyos bőrérintettség esetén (PASI nagyobb, mint 15) biológiai terápia bőrgyógyászati javallatra is indokolt a psoriasis finanszírozási eljárásrendje szerint. Amennyiben mind az ízületi aktivitás, mind a psoriasis kiterjedése és súlyossága alapján biológiai kezelés bevezetése indokolt, a reumatológus és a bőrgyógyász szakorvos dokumentált közös döntése alapján indul, majd követendő nyomon a biológiai kezelés.
4.4. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése arthritis psoriatica kezelésében
4.4.1. Axiális érintettség
4.4.1.1. A kezelés 14. hetében meg kell határozni a BASDAI index összetevőit. Amennyiben a kiindulási értékhez képest legalább 50%-kal vagy 20 mm-rel nem javult az index átlaga, a biológiai terápia nem folytatható.
4.4.2. Perifériás érintettség
4.4.2.1. A terápia hatásosságának értékelésére szintén a gyulladásos aktivitás objektív és nemzetközileg elfogadott mértékeként a DAS 28 rendszer alkalmazása javasolt. A válaszkészség mértékét az EULAR javulási kritériumai szerint kell meghatározni. A gyulladásos aktivitás értékelése és a mellékhatások regisztrálása háromhavonta szükséges.
4.4.2.2. Elsődleges hatástalanság: ha a TNF-α gátlás során a javulás a kezelés 3. hónapjában kisebb, mint 0,6 DAS 28 pont, a kezelés 6. hónapjában kisebb, mint 1,2 DAS 28 pont.
4.4.2.3. Másodlagos, "szerzett" rezisztencia: ha a korábban hatásos biológiai kezelés (a DAS 28 index csökkenése 3 hónap után minimum 0,6 és 6 hónap után minimum 1,2 pont) után az aktivitás ismét megemelkedik (a DAS 28 a kiindulási értékhez képest kevesebb, mint 1,2 ponttal alacsonyabb).
4.4.3. Súlyos bőrérintettség
4.4.3.1. A terápia hatásosságának értékelésére szintén a gyulladásos aktivitás objektív és nemzetközileg elfogadott mértékeként a PASI alkalmazása javasolt.
4.4.3.2. Nem megfelelő terápiás válaszról beszélünk akkor, ha a 12. hétre nem következik be PASI<15 vagy a PASI érték minimum relatív 50%-os javulása.
4.5. Fenntartó kezelés az arthritis psoriatica biológiai kezelésében
4.5.1. A kezelés további folytatásának eldöntése céljából háromhavonta rögzíteni kell a BASDAI (axiális érintettség esetén), DAS 28 (perifériás érintettség esetén), PASI (súlyos bőrérintettség esetén) indexeket. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.6. Az anti-TNF-α kezelés további folytatásának kritériumai:
4.6.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-α terápiára történő váltás (switch) megengedett.
4.6.2. Az anti-TNF-α terápia dózisának emelése a forgalomba hozatali engedélyben meghatározott induló dózishoz képest nem javasolt.
4.6.3. Csak szakavatott és a terápia-alkalmazásban jártas kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α terápia indikálása és alkalmazása.
4.7. Laboratóriumi vizsgálatok: célja az egyéb, a biológiai terápiákkal párhuzamosan felírt betegségmódosító gyógyszerek hatásvizsgálata. Mielőtt a terápia megkezdődik, vizsgálni kell:
4.7.1. We/CRP-t,
4.7.2. teljes vérképet,
4.7.3. vizeletet,
4.7.4. elektrolitokat,
4.7.5. májfunkciós értékeket,
4.7.6. antinukleáris antitesteket (ANA),
4.7.7. anti-DNS-t.
5. Szövődmények monitorozása, ellenőrzése
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
5.1.2. Különös gondot kell fordítani
5.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
5.1.3. A kezelés időtartama alatt félévente mellkas röntgen szükséges.
5.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel, és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.3. Malignus betegségek
5.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.4. Neurológiai eltérések
5.4.1. Nervus opticus neuritis
5.4.2. Demyelinizációs kórképek
5.5. Egyéb mellékhatások
5.5.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.5.2. Autoantitestek, főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
6. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1.1. Kompetencia szint: intézményi, szakorvosi kompetencia ellenőrzése
6.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. A diagnózis kritériumainak rögzítése (BNO: L40.5, M07.0-M07.3)
6.2.1.1. Moll-Wright vagy CASPAR kritériumok alapján
6.2.1.2. Perifériás érintettség: DAS 28 aktivitási index dokumentálása
6.2.1.3. Axiális érintettség: BASDAI index dokumentálása
6.2.1.4. Dermális érintettség: PASI index dokumentálása
6.2.2. A betegség aktivitásának meghatározása és dokumentálásának ellenőrzése
6.2.2.1. BASDAI index (0-100) átlaga több mint 40 (axiális érintettség esetén) vagy
6.2.2.2. DAS 28 index nagyobb mint 5,1 (perifériás érintettség esetén) vagy
6.2.2.3. PASI index nagyobb mint 15 (súlyos bőrérintettség esetén)
6.2.2.4. klinikai tünetek súlyossága
6.2.2.5. akut fázis fehérjék magas szintje (laborvizsgálat)
6.2.2.6. gyors radiológiai progresszió (RTG felvétel)
6.2.2.7. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel opcionálisan)
6.2.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
6.2.3.1. TBC kizárása (mellkas RTG)
6.2.3.2. Fertőzések kizárása
6.2.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok és klinikum alapján)
6.2.3.4. Terhesség kizárása
6.2.3.5. Életvitel módja (fertőzésveszély)
6.2.3.6. NYHA III-IV. stádiumú szívelégtelenség
6.2.3.7. Malignus betegség 10 éven belül (kivéve basalioma: 5 éven belül)
6.2.3.8. Labor: rutin
6.2.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
6.2.4.1. Indukciós kezelés alatt havonta, fenntartó kezelés alatt 3 havonta: WE, CRP (opcionális), vérkép, GOT, GPT, GGT, CN, Kreat, ionok, vizelet vizsgálat javasolt
6.2.4.2. 3 havonta: aktivitási index (BASDAI vagy DAS 28 vagy PASI index meghatározása és dokumentálása)
6.2.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
6.2.4.4. Tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
6.2.5. Megjegyzés
6.2.5.1. Elfogadott DMARD terápiák: methotrexat (MTX), LEF, SSZ, cyclosporin A (CsA), a készítmények forgalomba hozatali engedélyében szereplő indikációkat figyelembe kell venni
6.2.5.2. Elfogadott DMARD kombinációk: MTX intolerancia esetén bármely elfogadott DMARD kombináció alkalmazható
6.2.5.3. TNF alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével), golimumab
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A területre fordított közkiadások alakulása, monitorozása.
7.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. táblázat: Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | M0700 | Distalis interphalangealis ízületet érintő arthropathia psoriatica |
| 3 | M0710 | Arthritis mutilans (L40.5+) |
| 4 | M0720 | Spondylitis psoriatica (L40.5+) |
| 5 | M0730 | Egyéb psoriasisos arthropathiák (L40.5+) |
8.2. táblázat: Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 4 | L04AA13 | LEF | DMARD | Betegségmódosító szerek |
| 5 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 6 | L04AB01 | etanercept | TNF-alfa gátló | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 8 | L04AB02 | infliximab | TNF-alfa gátló | Biológiai terápia eszközei |
| 9 | L04AB06 | golimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 10 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 11 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 12 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 13 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
9. Fogalmak, rövidítések
AP Arthritis psoriatica
ATC Anatomical therapeutic chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
EULAR European League Against Rheumatism
DAS Disease activity score
BASDAI Bath ankylosing spondylitis disease activity index
PASI Psoriasis area and severity index
DMARD Disease modifying antirheumatic drug
TNF Tumor nekrózis faktor
CRP C-reaktív protein
MTX Methotrexat
CsA Ciklosporin A
LEF Leflunomid
SSZ Szulfaszalazin
NSAID Non-steroid anti-inflammatory drug"
20. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"15. melléklet a 31/2010. (V. 13.) EüM rendelethez
Oszteoporózis következtében kialakuló csonttörés primer prevenciójának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Oszteoporózis patológiás csonttörés nélkül (M81.0 - M81.9)
1.2. Oszteoporózis máshova osztályozott betegségekben (M82.0, M82.1, M82.8)
2. A kórkép leírása
2.1. Az oszteoporózis (csontritkulás) a csontváz generalizált, progresszív metabolikus megbetegedése, amelyben csontszövet szerves és szervetlen állományának arányos fogyása, ezáltal a csonttömeg megfogyatkozása, a csont finomszerkezetének károsodása és a csontminőség romlása a csont teherbíró képességének és rugalmasságának csökkenéséhez, fokozott törékenységhez vezet. Emiatt a csonttörések gyakoribbá válnak, mivel az oszteoporózisos csont eltörésének kockázata már kis erőbehatás esetén is fokozott. Az oszteoporózis következtében kialakult csípőtáji törés vagy combnyak-törés közvetlen életveszélyt jelenthet, de az egyéb csonttörések is jelentős mértékben ronthatják az életminőséget és fokozzák a mortalitást. A csonttörések idős korban egyre gyakoribbak, így jelentős népegészségügyi problémát és társadalmi költséget jelentenek. Nőknél, posztmenopauzában kezdetben a trabekuláris csontvesztés dominál, melyhez az életkor előrehaladtával kortikális csontvesztés társul.
2.2. Az oszteoporózis következtében fellépő csonttörések típusos helyei kezdetben:
2.2.1. a csigolyák és
2.2.2. az orsócsont disztális vége, majd idősebb korban válnak egyre gyakoribbá
2.2.3. a felkarcsont proximális törései és
2.2.4. a csípőtáji törések.
2.3. Ugyanakkor a klinikai gyakorlatban a csontváz bármely részén kis erőbehatásra bekövetkező csonttörés - lokalizációtól függetlenül - típusos oszteoporotikus törésnek minősül.
2.4. Legtöbbször a betegség involúciós (posztmenopauzális és szenilis) formáival találkozhatunk, de egyre nő a szekunder oszteoporózisok előfordulása is, amelyeket más szervek betegségei vagy gyógyszerek okoznak.
2.5. Az oszteoporózis népbetegség, az Európai Vertebralis Osteoporosis Tanulmány (EVOS) szerint hazánkban megközelítőleg 600 ezer nőt és 300 ezer férfit érint az 50 év feletti korosztályban. Más nemzetközi adatok szerint Európában az 50 éven felüli nők között 2-ből 1, a férfiak között 5-ből 1 szenved oszteoporózisban. A csontritkulás klinikai jelentőségét a kóros csonttörés és annak szövődményei adják, azon belül is a legnagyobb jelentőségűek a csípőtáji törések. Egyes felmérések szerint a csípőtáji töröttek több mint 30%-a a fraktúra utáni első évben meghal, mintegy fele élete végéig ellátási segítségre szorul, s csupán minden ötödik beteg gyógyul teljesen. A csigolyatörések zöme fokozatosan keletkezik, és sokáig rejtve marad, csupán az esetek tizede kerül azonnal észlelésre.
2.6. Az oszteoporózis terápiája alapvetően a törések megelőzésére irányul. Az oszteoporózis multifaktoriális betegség, de az egyes tényezők egymáshoz való viszonya még kevéssé tisztázott. Mind az oszteoporózis, mind az oszteoporózisos csonttörés kialakulásának kockázatát több tényező növelheti, egyes tényezők mindkettőt. A terápiát igénylő betegek a csonttörés rizikófaktorainak és a csont-denzitás meghatározása alapján azonosíthatóak be.
2.7. A legfontosabb validált törési rizikótényező az életkor. A 80 év feletti populációban történik a csonttörések 25%-a. A másik legfontosabb kockázati tényező a csökkent ásványi csonttömeg. Az oszteoporózis további legfontosabb rizikófaktorai a női nem, a kis testtömeg vagy 10%-nál több testtömeg elvesztése, tartós immobilizáció, korábbi oszteoporotikus csonttörés, oszteoporózisra pozitív családi anamnézis, kollagén keresztkötés magas szérum (vizelet) szintje, szteroidok tartós szedése, dohányzás, alkoholizmus, reumatoid arthritis. Ezek a rizikófaktorok nőknél a posztmenopauzás életszakaszban a legjelentősebbek, de nem egyformán hangsúlyosak.
2.8. Az oszetoporotikus törések kockázati tényezőit az alábbi táblázat foglalja össze.
2.8.1. Egy csigolya kompressziója (több mint 25%-os magasságcsökkenése)
2.8.2. Többszörös csigolyakompresszió
2.8.3. Bármilyen korábbi oszteoporotikus törés
2.8.4. 65 év feletti életkor
2.8.5. Szekunder hyperparathyreosishoz vezető kórképek
2.8.6. Hypogonadismus
2.8.7. Tartós (három hónapot meghaladó) oralis glükokortikoid (több mint napi 7,5 mg prednizolonnal ekvivalens) kezelés
2.8.8. Cushing szindróma
2.8.9. Szubklinikus hypercortisolismus
2.8.10. Primer hyperparathyreosis
2.8.11. Glitazon kezelés
2.8.12. Non-vertebrális törés 50 év felett
2.8.13. Aromatáz inhibitor kezelés
2.8.14. Androgéndeprivációs kezelés
2.8.15. Reumatoid arthritis
2.8.16. Spondylarthritis ankylopoetica
2.8.17. Proximális femurtörés a szülőknél
2.8.18. Soványság (BMI kevesebb mint 20 kg/m2)
2.8.19. Dohányzás
2.8.20. Többszörös esés
2.8.21. Immobilizáció
2.8.22. Epilepsia (antiepileptikus kezelés)
2.8.23. Gyomor-, bélresectio
2.8.24. Diabetes mellitus (1. és 2. típus)
2.8.25. TSH szintje alacsonyabb, mint 0,3 mU/l
2.8.26. Elesési kockázatot növelő gyógyszerek szedése (szedatívumok, antidepresszánsok, neuroleptikumok, orthostatist okozó gyógyszerek)
2.8.27. Kezeletlen korai (45 éves kor előtt kezdődő) menopauza
2.8.28. Minimum 4 egység alkohol fogyasztása naponta (1 alkohol egység 8-10 g alkoholt jelent, ami szeszes italban kifejezve 1 pohár sör, 1 dl bor, 2 cl rövidital)
2.8.29. Csípőtörés a szülői anamnézisben
2.8.30. Fokozott csontturnover
2.9. Az Egészségügyi Világszervezet (WHO) munkacsoportja validált kockázati tényezők alapján egy rizikóbecslő rendszert alakított ki, amely integrálja a páciens egyes kockázati tényezőivel kapcsolatos veszélyeztetettségét, és megadja az oszteoporotikus törés 10 éves valószínűségét. A FRAX® (Fracture Risk Assessment Tools) a combnyak BMD, a kor, a nem, a BMI, az előző törések, a családban korábban előfordult csípőcsont-törés, dohányzás, alkoholfogyasztás, glükokortikoid kezelés, rheumatoid arthritis, illetve szekunder osteoporosis megléte alapján ország specifikusan becsüli meg a rizikót. A FRAX-modellt több tízezer európai, amerikai, ázsiai és ausztrál beteg csont-sűrűségi és törési adatainak feldolgozásával fejlesztették ki. A számítógépes algoritmus az interneten bárki számára hozzáférhető (http://www.shef.ac.uk/FRAX), és az adott ország törési statisztikáinak felhasználásával kiszámítható az adott beteg törési kockázata. A FRAX a magyar betegek vonatkozásában hazai adatok alapján végzi a számítást.
2.10. Az oszteoporózis kezelésének és a kóros csonttörések megelőzésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai aktivitás. Szükség esetén gyógyszeres terápiával lehet a csontritkulás folyamatát gátolni.
2.11. Primer prevenció alatt azon posztmenopauzás nők és 55 év feletti férfiak kezelése értendő, akiknek fokozott kockázatuk van kóros csonttörésre, és a gyógyszeres kezeléssel ez a kockázatuk csökkenthető.
2.12. Jelen finanszírozási eljárásrend a posztmenopauzás nők és 55 év feletti férfiak oszteoporózis miatt kialakuló csonttörésének primer megelőzését célzó kezelését határozza meg, nem foglalja magába a csontritkulást szűrő programokat.
3. Diagnosztika
3.1. Az ásványi csonttömeg denzitometriás módszerekkel pontosan megmérhető. A mért csontsűrűséget (BMD, bone mineral density, g/cm2) az egészséges fiatalok átlagértékéhez, a csúcs-csonttömeghez (PBM, peak bone mass) hasonlítják, és a különbséget a fiatal populáció normál értékének szórásában (SD) fejezik ki (T-score). Leggyakrabban az alacsony energiájú röntgensugárzással végzett képalkotó eljárást (DEXA; Dual Energy X-Ray Absorptiometry) használják. Ezen kívül alkalmazzák az ultrahangos csontsűrűség mérést és a kvantitatív komputertomográfiát is, az előbbi társadalombiztosítás által nem támogatott, utóbbit csak kutatásokhoz kapcsolódóan jelentik az engedéllyel rendelkező szolgáltatók. A javasolt mérési helyek elsősorban az ágyéki gerinc, csípőtájék, további lehetőség az alkar, sarok és kézujjak.
3.2. Az oszteoporózis diagnózis felállításának alapvető feltétele a T-score érték meghatározása. Az oszteoporózist azoknál jelenthetjük ki, akiknél ez az érték -2,5-nél kisebb. Az Egészségügyi Világszervezet ajánlása szerint az alábbi diagnosztikus kategóriákat állíthatjuk fel a T-score értéke alapján:
3.2.1. T-score nagyobb, mint -1,0 SD = egészséges csontozat
3.2.2. T-score -1,0 és -2,5 SD közötti = oszteopénia
3.2.3. T-score kisebb, mint -2,5 SD = oszteoporózis
3.2.4. T-score kisebb, mint -2,5 SD és legalább egy oszteoporózis miatti csonttörés = súlyos oszteoporózis
3.3. Oszteoporózis esetén a csontsűrűség törzscsontokon való mérését a társadalombiztosítás finanszírozza. A diagnosztikus eljárás a 3570C Csontsűrűség mérése törzscsontokon (törzsi csontok ásványianyag tartalmának fotonabsorptiós meghatározása) OENO kóddal jelenthető. A vizsgálat oszteoporózis esetén 12 havonta egyszer számolható el -2,5 vagy kisebb (rosszabb) T-score érték melletti specifikus törés prevenciós gyógyszeres kezelés esetén.
3.4. A végtagcsontokon történő csontsűrűség mérést a társadalombiztosítás kizárólag thyreotoxcosis és primer hyperparathyreosis esetén finanszírozza, melyet a közfinanszírozott szolgáltatók a 3570A Csontsűrűség mérése végtagcsontokon [bármely végtagcsont (alkar, sarok, tibia, stb.) ásványianyag tartalmának fotonabsorptiós meghatározása] OENO kóddal jelenthetnek.
3.5. A kvantitatív CT-vel történő csontsűrűség mérés közfinanszírozásba nem befogadott eljárás, de az engedélyezett orvosbiológiai kutatásokhoz kapcsolódóan a 3570D Csontsűrűség mérése pQCT-vel (végtagcsontok ásványianyag tartalmának meghatározása quantitativ computer tomographiával) OENO kódon jelenteni kell az Országos Egészségbiztosítási Pénztár felé.
3.6. A kezelőorvos számára a laboratóriumi vizsgálatok (Ca, P, PTH, D-vitamin, TSH) a csökkent BMD kóreredetének elkülönítésében, a csont-turnover markereinek (a reszorpció és formáció biomarkerei, elsősorban a szérum és vizelet kollagén keresztkötést tartalmazó peptidjeinek és csontspecifikus alkalikus foszfatáznak) a meghatározása a terápia-választásban segíthetnek.
4. Terápia
4.1. Kalcium és D-vitaminpótlás
4.1.1. A primer prevencióban az oszteoporózis kezelésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai mozgás. Epidemiológiai vizsgálatok bizonyítják, hogy az adekvát kalcium- és D-vitamin bevitel gyermekeknél a csúcs-csonttömeg kialakulásában, időseknél a csontvesztés megelőzésében és a törési, illetve az esési kockázat csökkentésében játszik szerepet.
4.1.2. A fizikai aktivitás stimulálja az oszteoblasztokat, továbbá az izomerő javulásával az elesések száma is csökken. Preventív céllal, illetve oszteopénia eseteiben a rendszeres megfelelő intenzitású és frekvenciájú testedzés ajánlott. Ez a gyakorlatban minimum heti háromszori alkalommal végzett aerobik jellegű, ütközéssel járó mozgásformát jelent. A nagyobb csontmennyiség kialakulását elsősorban a pubertás kor előtt elkezdett fizikai aktivitás segíti elő a terhelésnek kitett csontokon.
4.1.3. Fontos prevenciós tényező az immobilizáció kerülése, az immobilitás megszüntetése lehetőség szerint 7 napon belül, továbbá az eséskockázat csökkentése. Ez utóbbi alatt elsősorban a beteg környezetének a botlások, elcsúszások elkerülése miatti akadálymentesítését, illetve fokozott esési kockázat esetén az egyéb (pl. esési kockázatokhoz vezető gyógyszeres kezelés) okok feltárását és életmódbeli változtatással annak elkerülését értjük (pl. megfelelő szemüveg viselése, altató korai bevételének kerülése, stb.). Az életkörülmények célszerű átalakítása önmagában 50%-kal csökkenti a törési kockázatot. Prevenciós hatása van még a napi minimum 30 perc szabad levegőn eltöltött időnek, napfény expozícióval, a megfelelő kalória-, kalcium-, B12 vitamin- és folsavbevitelnek, továbbá a dohányzás elhagyásának.
4.1.4. A megfelelő kalcium bevitel elengedhetetlenül fontos a normális növekedéshez, a maximális csúcs csonttömeg kialakulásához, valamint a felnőttkori csontanyagcsere egyensúlyának fenntartásához. A javasolt napi kalcium bevitel napi 1000 mg, de legfeljebb 1200 mg. A kalcium bevitel további fokozása káros következményekkel járhat, napi 2000 mg felett fokozódik a törések gyakorisága, férfiak esetében 1300-1500 mg felett fokozódik a prostata carcinoma incidenciája. Magyarországon egy felnőtt személy átlagos napi kalcium fogyasztása 400-600 mg közötti. Célszerű az ajánlott mennyiségeket étel formájában elfogyasztani, de ha természetes formában nem elégséges a kalcium bevitel, azt gyógyszeresen ki kell egészíteni. A gyógyszeres kalcium pótlásnál előnyben részesítendők a citrát sók. A citrát só előnye a pH-független felszívódás, a nagyobb biohasznosulás, a gastrointestinalis mellékhatások hiánya, illetve a citrát vizelettel történő ürülése során a kalcium vesekövesség elleni védelem. Meta-analízisek csökkent törési arányt mutattak ki olyan betegekben, akik legalább 80%-ban betartották a kalciumpótlás előírásait.
4.1.5. A D-vitaminhiány gyakorisága az életkor előrehaladtával párhuzamosan folyamatos növekedést mutat. A 65 év feletti lakosságnak legalább harmada D-vitaminhiányban szenved. Már a mérsékelt D-vitaminhiány csontritkulást okozhat. Kifejezett D-vitaminhiányról beszélünk, ha a szérum 25-OH-D-vitamin szint 12-15 ng/ml alatt van, idősek esetén azonban már a 25 ng/ml alatti érték is csontvesztéshez vezethet. Kimutatható, hogy a legalább napi 700-800 NE D-vitamin bevitele már segít megelőzni az idősebbek csípőtöréseit. Szakmai konszenzus alapján a megfelelő D-vitaminpótlás 800-2000 NE D3 vitamin naponta vagy ekvivalens dózisok hetente-többhetente. D-vitaminpótlás során rendszeresen kell ellenőrizni (1., 3., 6. hónapban, majd évente, illetve dózisváltáskor) a szérum kalcium szintjét és a vizelet kalciumürítést.
4.1.6. Kalcium és D-vitamin bevitel kiegészítő pótlása a társadalombiztosítás által akkor támogatott, ha a dokumentáltan gondozott posztmenopauzás nő vagy 55 év feletti férfi beteg oszteoporózisa igazolódott (BMD -2,5 SD T-score alatti), vagy nála a fokozott töréskockázati tényezőkből legalább három egyidejűleg bizonyítottan fennáll, vagy a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%). A szükséges kalcium és D-vitaminbevitel, amennyiben nincs ellenjavallata, az oszteoporózis terápiájának folyamatos követelménye, ugyanúgy a megfelelő életvitel kialakítása.
4.2. Biszfoszfonátok
4.2.1. A gyógyszeres terápia megválasztásánál fontos szempont, hogy a negatív csonthatások elkerülésére csak a valóban szükséges gyógyszerek szükséges és elegendő mennyiségű szedése történjen meg. A kezelés finanszírozási lépéseinek megválasztásánál az adott készítmény alkalmazási előiratát figyelembe kell venni.
4.2.2. A csontritkulás okozta kóros csonttörések primer és szekunder prevenciójában egyaránt az első választandó gyógyszerhatóanyag-csoport a biszfoszfonátok. A biszfoszfonátok erősen kötődnek a csontszövethez és gátolják az oszteoklasztok aktivitását, és azok apoptózisát okozzák, ezzel erősen gátolva a csontreszorpciót. A klinikai vizsgálatok bizonyítékai alapján, mind a vertebrális, mind a nem-vertebrális csonttöréseket csökkentő hatásuk miatt, első választandó szerként - megfelelő kalcium- és D-vitaminbevitel mellett - ajánlják az alendronátot, risedronátot és ibandronátot.
4.2.3. Az orális biszfoszfonátok kiváló klinikai hatása ellenére a betegek rövid- és hosszú távú együttműködési készsége is alacsonynak bizonyult, sokszor nem az előírás és az orvosi utasítás szerint szedik az orvosságot (rossz compliance), és elhagyják a krónikus betegségre rendelt, hosszú ideig szedendő gyógyszert (rossz perzisztencia).
4.2.4. Az együttműködést rontja a számos, gyógyszerbevétellel kapcsolatos kellemetlen előírás (a gyógyszert éhgyomorra, sima vízzel, álló, vagy egyenesen ülő helyzetben kell bevenni, utána egy ideig nem szabad lefeküdni, enni vagy inni), amely a felső gasztrointesztinális mellékhatások elkerülését és a megfelelő felszívódást biztosítja. Felmérések szerint az oszteoporózis kezelésének első évében a betegek mintegy fele, a harmadik év végére négyötöde nem megfelelően együttműködő. Az alacsony együttműködési készség nagyobb törésszámot eredményezett.
4.2.5. Társadalombiztosítási támogatással adhatók az orális biszfoszfonátok oszteoporotikus csonttörések primer prevenciója céljából azoknak az igazolt oszteoporózissal élő (BMD érték -2,5 SD T-score alatti), de oszteoporotikus csonttörést nem szenvedett posztmenopauzás nő vagy 55 év feletti férfi betegeknek, akiknek a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%). A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.6. A különböző hatóanyagok és kiszerelési formák közötti választás alapvetően a kezelőorvos egyéni mérlegelésének és szakmai döntésének tárgya, szem előtt tartva a terápia célját és a várható hatékonyságot, továbbá a terápia tolerálhatóságát; függ az adott beteg paramétereitől és az orvos tapasztalataitól. A készítmények alkalmazása során a maxillo-faciális régióban ritkán (1% alatt) csontnekrózis fordulhat elő, különösen egyes gyógyszerkölcsönhatások (pl. sztatin, szteroidok, egyes hormonkészítmények) miatt. Ezért a gyógyszerkészítmény alkalmazásának megkezdése előtt fogorvosi kivizsgálás és szükség szerinti kezelés elvégzése javasolt.
4.2.7. A költséghatékony kezelés követelményét szem előtt tartva törekedni kell az orális kezelésre, ugyanakkor figyelembe kell venni azokat a körülményeket (például nem megfelelően együttműködő beteg), melyek esetén a parenterális kezelés választása a célravezetőbb.
4.2.8. Az eddigi vizsgálatok szerint a parenterális biszfoszfonátok közül mind a zoledronát (5 mg/év) mind a ibandronát (3 mg/negyedév) hatékony a csontsűrűség javításában és a törési kockázat csökkentésében.
4.2.9. Társadalombiztosítási támogatással adhatók a parenterális biszfoszfonátok oszteoporotikus csonttörések primer prevenciója céljából azoknak az igazolt oszteoporózissal élő (BMD érték -2,5 SD T-score alatti), de oszteoporotikus csonttörést nem szenvedett posztmenopauzás nő vagy 55 év feletti férfi betegeknek, akiknek a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%), de az orális biszfoszfonát kezelés ellenjavallt vagy dokumentált intolerancia vagy a kezelést hátrányosan befolyásoló egyéb tényező miatt nem folytatható. A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.10. A biszfoszfonátok alkalmazásánál különösen fontos a megfelelő kalcium és D-vitamin szint fenntartása, a másodlagos PTH-emelkedés kivédésére, illetve a megfelelő hatásosság biztosítására.
4.3. Stroncium ranelát
4.3.1. A stroncium ranelát csökkenti a csontreszorpciót és egyben serkenti a csontképződést, a klinikai vizsgálatok szerint mind a csigolyatörések, mind a csípőtáji törések kockázatát csökkenti.
4.3.2. A stroncium ranelát használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés primer prevenciójában, társadalombiztosítási támogatással alkalmazható azoknál a posztmenopauzás nő vagy 55 év feletti férfi betegeknél, akiknek az oszteoporózisa igazolt (BMD értéke -2,5 SD T-score alatti), és FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%), amennyiben a biszfoszfonát kezelés ellenjavallt, vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve oszteoporotikus csonttörés történt).
4.4. Denoszumab
4.4.1. A denoszumab monoklonális RANKL ellen ható antitest, a csontreszorpciót a RANK ligand gátlás útján célzottan csökkenti, hat a csontlebontás folyamatára, jelentősen növeli a csontdenzitást, és csökkenti mind a vertebrális, mind a nem-vertebrális csonttörések kockázatát. A denoszumab a csont trabekuláris és kortikális állományát is erősíti. A denoszumab terpápiás költsége miatt a finanszírozási rendben jelenleg a stroncium raneláttal esik egy kategóriába.
4.4.2. A denoszumab használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés primer prevenciójában, társadalombiztosítási támogatással alkalmazható azoknál a posztmenopauzás nő vagy 55 év feletti férfi betegeknél, akiknek az oszteoporózisa igazolt (BMD értéke -2,5 SD T-score alatti), és FRAX alapján számított 10 éves törési kockázata magas (általános>20% illetve csípő>3%), amennyiben a biszfoszfonát kezelés ellenjavallt, vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve oszteoporotikus csonttörés történt).
4.4.3. A raloxifen és teriparatid oszteoporotikus csonttörés primer prevenciójában való alkalmazását a társadalombiztosítás nem támogatja.
4.5. Gyógyszer intolerancia meghatározása
4.5.1. A társadalombiztosítási támogatás szempontjából bármely orális biszfoszfonáttal szembeni intolerancia alatt értjük az olyan, megfelelő kezeléssel nem kontrollálható, folyamatosan fennálló, felső gasztrointesztinális traktust érintő zavarokat (gyulladás, fekély), melyek miatt az alkalmazási leirat szerinti szabályos kezelés kivitelezése vagy a terápia folytatása meghiúsulhat. A gasztrointesztinális mellékhatások az orális biszfoszfonátok jellemzői. Akiknél a nyelőcső rendellenességei vagy egyéb olyan állapotok állnak fenn, melyek a nyelőcső kiürülését késleltetik (pl. srtictura vagy achalasia), továbbá, ha a beteg képtelen arra, hogy legalább 30 percig álljon, vagy üljön, azoknál a betegeknél az orális biszfoszfonátokkal való kezelés kontraindikált, helyette parenterális biszfoszfonáttal vagy stroncium raneláttal ajánlott a kezelést végezni.
4.5.2. Az orális biszfoszfonátok alkalmazása viszonylag összetett. Nagy pohár (1-2 dl) vízzel kell bevenni, éhgyomorra, függőleges testhelyzetben, ezt követően még minimum 30 percig függőleges testhelyzetben kell maradni, ételt, folyadékot, más gyógyszert, vitamint, stb. ezen idő alatt nem fogyaszthat a beteg. Az orális ibandronátot havonta egyszer kell a betegnek bevennie, míg az alendronát és rizedronát alkalmazása esetén heti egyszeri alkalmazás szükséges. Az orális biszfoszfonátok alkalmazása kapcsán levonható a következtetés, hogy az esetek többségében a nyelőcső gyulladás kivédése az alkalmazási leirat pontos betartásával lehetséges. A beteg terápiában való együttműködése nem csupán az esetlegesen fellépő gyógyszer-mellékhatások függvénye, hanem kiemelt jelentőséggel bír a kezelőorvos részéről a beteg megfelelő tájékoztatása és felkészítése, hogy a kezelés megfelelően kivitelezett és eredményes legyen.
4.6. A kezelés időtartama
4.6.1. A modern terápiás irányelvek szerint elsősorban a magas kockázatú betegek gyógyszeres kezelése preferált, bizonyítottan törésmegelőző szerekkel. További alapelv, hogy a kezelést monoterápiában szükséges adni, a szükséges kalcium és D-vitaminpótlással. Egyéb gyógyszerkombinációtól nem várható további denzitásnövelés, de a mellékhatások előfordulása gyakoribbá válhat. A kezelés időtartamára vonatkozóan nincs még tudományosan kellően megalapozott, egységes álláspont. A gyógyszeres kezeléstől alapvetően azt várjuk, hogy a csontvesztés üteme lassuljon, megálljon, és ezáltal a csonttörés kockázata csökkenjen.
4.6.2. Az optimális kezelési eredmény az, ha a terápia első 2-3 évében a trabekuláris csontdenzitás 7-10%-kal nő, mert ez a törési rizikót felére csökkenti.
4.6.3. Vizsgálatok szerint már 12 hónapos kezelés statisztikailag szignifikáns javulást eredményez a betegek állapotában, ezért ennél rövidebb kezelési időszak alatt a terápia hatásosságát megítélni nem lehet.
4.6.4. A betegek állapotának kontrollálásában (oszteodenzitometria, labor-, röntgenvizsgálat, kockázat újraértékelés, stb.) a szakmai irányelvek szerint kell eljárni.
4.6.5. Biszfoszfonát kezeléseknél figyelembe kell venni, hogy a biszfoszfonátok lassan távoznak a csontszövetből, azaz hatásuk tartósan megmarad, ezért a megtartott-növekvő denzitás mellett, csonttörések hiányában három év után a terápia szüneteltetését, illetve öt év után a befejezését mérlegelni kell. A csípőtörések gyakorisága tíz év alatt nem nőtt azoknál a betegeknél, akik öt év után nem kaptak biszfoszfonátot azokhoz képest, akik végig szedték a vizsgált időszakban a gyógyszert.
4.7. Hatástalanság
4.7.1. A szakmai ajánlások alapján akkor mondhatjuk ki a kezelés hatástalanságát, ha minimum 12 hónapos kezelés ellenére a kontrollvizsgálat során 5%-os denzitáscsökkenést mérünk, illetve a kezelés ellenére oszteoporotikus csonttörés történik.
5. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
5.1. Az algoritmus posztmenopauzás nők és 55 év feletti férfiak oszteoporotikus csonttörését megelőző kezelésének sémáját mutatja be.
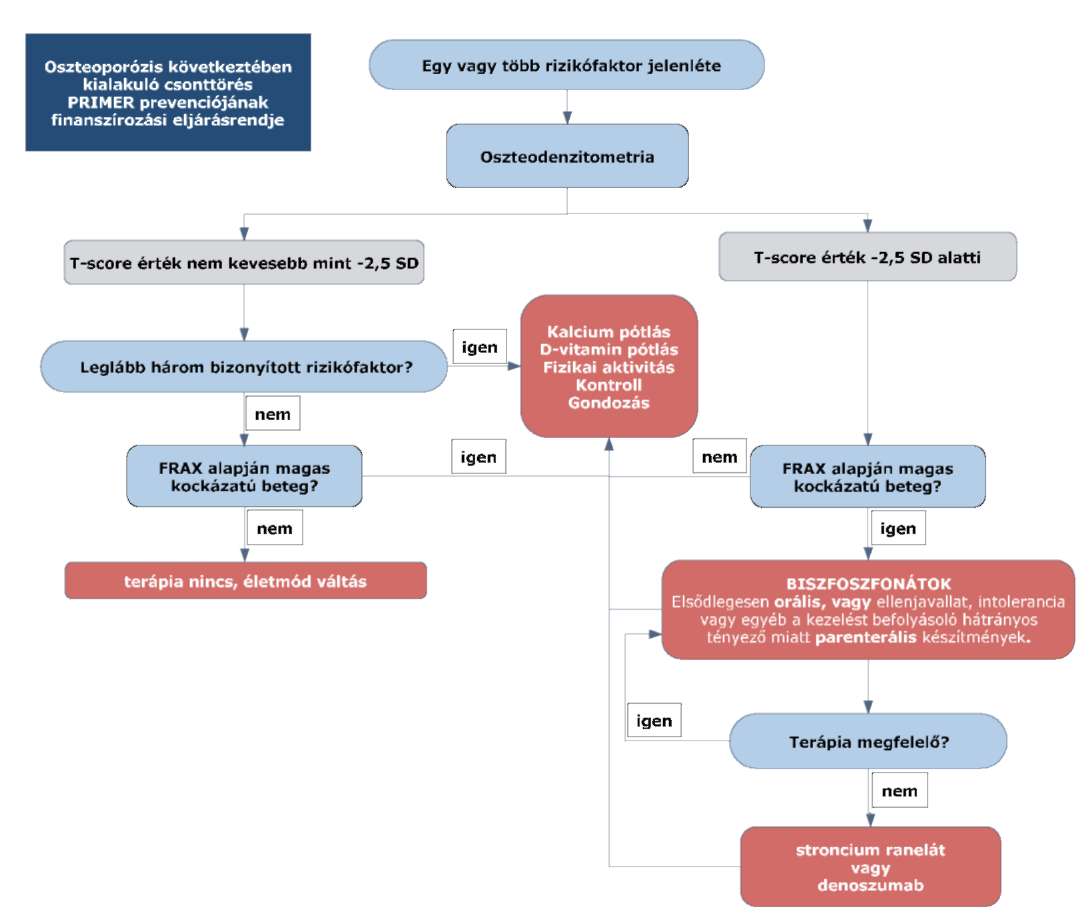
6. Az oszteoporózis prevenciós terápia finanszírozási és ellenőrzési kritériumai
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
A finanszírozó informatikai úton, folyamatba épített ellenőrzésként vizsgálja az elszámolásokat, hogy az alkalmazott diagnosztika és terápia az eljárásrenddel összhangban van-e.
6.1.1. Kompetencia szint: szakrendelés, szakorvosi kompetencia ellenőrzése
6.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.3. Jogszabályban rögzített indikációs terület (BNO) ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. Az egészségbiztosító - szükség esetén helyszíni ellenőrzés keretében - vizsgálja a terápiás döntések megalapozottságát, a szakmai dokumentációt
6.2.1.1. Szérum és vizelet kalcium meghatározása D-vitaminpótló terápia esetén
6.2.1.2. A csontok ásványianyag tartalmának fotonabszorpciós meghatározása
6.2.1.3. Rizikófaktorok megléte
6.2.1.4. Oszteoporotikus törések
6.2.1.5. Gyógyszerváltás indokoltsága (intolerancia, mellékhatás, hatástalanság)
6.2.1.6. Terápiás lépcsők betartása
6.2.1.7. Beteggondozás, terápia kontrollálása
6.3. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
6.3.1. A terápiás terültre fordított közkiadások alakulása, monitorozása
6.3.2. A finanszírozási eljárásrend szerint kezelt betegek aránya
6.3.3. Kezelés mellett bekövetkező törések monitorozása
7. A finanszírozás szempontjából lényeges finanszírozási kódok
7.1. táblázat: Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | M8100 | Postmenopausalis oszteoporózis |
| 3 | M8110 | Petefészek eltávolítás utáni oszteoporózis |
| 4 | M8120 | Inaktivitási oszteoporózis |
| 5 | M8130 | Sebészeti beavatkozást követő felszívódási zavar okozta oszteoporózis |
| 6 | M8140 | Gyógyszer indukálta oszteoporózis |
| 7 | M8141 | Gyógyszer indukálta oszteoporózis (glükokortikoidok) |
| 8 | M8142 | Gyógyszer indukálta oszteoporózis (antikonvulzánsok) |
| 9 | M8143 | Gyógyszer indukálta oszteoporózis (analógok) |
| 10 | M8144 | Gyógyszer indukálta oszteoporózis (szuppresszív dózisú tiroxin) |
| 11 | M8150 | Idiopathiás oszteoporózis |
| 12 | M8160 | Lokalizált oszteoporózis [Lequesne] |
| 13 | M8180 | Egyéb oszteoporózis |
| 14 | M8190 | Oszteoporózis, k.m.n. |
| 15 | M8191 | Krónikus májbetegség talaján kialakult oszteoporózis |
| 16 | M8192 | Törés prevenciós gyógyszeres kezelés -2,5 vagy kisebb (rosszabb) T-score érték mellett |
| 17 | M8200 | Oszteoporózis myelomamultiplexben (C90.0+) |
| 18 | M8210 | Oszteoporózis endocrin rendellenességekben (E00-E34+) |
| 19 | M8280 | Oszteoporózis egyéb, máshova osztályozott betegségekben |
| 20 | Z0000 | Vizsgálat, általános |
| 21 | Z0001 | Járóbeteg első szakorvosi ellátása a kórházi ápolást követően |
| 22 | Z0940 | Gondozás, követéses vizsgálat: töréskezelés után |
| 23 | Z0970 | Gondozás, követéses vizsgálat: más állapotok kombinált kezelése után |
| 24 | Z0980 | Gondozás, követéses vizsgálat: egyéb okból |
| 25 | Z5080 | Gondozás rehabilitációs eljárásokkal |
| 26 | Z5090 | Rehabilitáció és gondozás, k.m.n. |
| 27 | Z5180 | Orvosi ellátás |
| 28 | Z5190 | Orvosi ellátás, k.m.n. |
| 29 | Z8260 | Arthritis és más vázizom-kötoszöveti betegség a családi anamnesisben |
7.2. táblázat: Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 3570C | Csontsűrűség mérése törzscsontokon |
| 3 | 21510 | Összes kalcium meghatározása |
| 4 | 21512 | Ionizált kalcium meghatározása |
| 5 | 22300 | Kalcium meghatározása vizeletben |
7.3. táblázat: Releváns ATC kódok
| A | B |
| 1 | ATC | ATC megnevezése |
| 2 | A12AA | Kalcium |
| 3 | A12AA04 | Kalcium karbonát |
| 4 | A12AA19 | Kalcium citrát |
| 5 | A11CC05 | Kolekalciferol |
| 6 | M05BA04 | Alendronát |
| 7 | M05BA06 | Ibandronát |
| 8 | M05BA07 | Rizedronát |
| 9 | M05BA08 | Zoledronát |
| 10 | M05BB | Biszfoszfonátok, kombinációk |
| 11 | M05BB04 | Risedronic acid, calcium and colecalciferol, sequential |
| 12 | M05BB07 | Risedronsav és colecalciferol |
| 13 | M05BB03 | Alendronát és kolekalciferol |
| 14 | M05BX03 | Stroncium ranelát |
| 15 | M05BX04 | Denoszumab |
8. Fogalmak, rövidítések
ATC Anatomical Therapeutic Chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
HBCS Homogén betegségcsoport
OENO Orvosi eljárások nemzetközi osztályozása"
21. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"16. melléklet a 31/2010. (V. 13.) EüM rendelethez
Oszteoporózis következtében kialakuló csonttörés szekunder prevenciójának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Oszteoporózis patológiás töréssel (M80.0 - M80.9)
Oszteoporózis máshova osztályozott betegségekben (M82.0, M82.1, M82.8)
2. A kórkép leírása
2.1. Az oszteoporózis (csontritkulás) a csontváz generalizált, progresszív metabolikus megbetegedése, amelyben csontszövet szerves és szervetlen állományának arányos fogyása, ezáltal a csonttömeg megfogyatkozása, a csont finomszerkezetének károsodása és a csontminőség romlása a csont teherbíró képességének és rugalmasságának csökkenéséhez, fokozott törékenységhez vezet. Emiatt a csonttörések gyakoribbá válnak, mivel az oszteoporózisos csont eltörésének kockázata már kis erőbehatás esetén is fokozott. Az oszteoporózis következtében kialakult csípőtáji törés vagy combnyak-törés közvetlen életveszélyt jelenthet, de az egyéb csonttörések is jelentős mértékben ronthatják az életminőséget és fokozzák a mortalitást. A csonttörések idős korban egyre gyakoribbak, így jelentős népegészségügyi problémát és társadalmi költséget jelentenek. Nőknél, posztmenopauzában kezdetben a trabekuláris csontvesztés dominál, melyhez az életkor előrehaladtával kortikális csontvesztés társul.
2.2. Az oszteoporózis következtében fellépő csonttörések típusos helyei kezdetben
2.2.1. a csigolyák és
2.2.2. az orsócsont disztális vége, majd idősebb korban válnak egyre gyakoribbá
2.2.3. a felkarcsont proximális törései és
2.2.4. a csípőtáji törések.
2.3. Ugyanakkor a klinikai gyakorlatban a csontváz bármely részén kis erőbehatásra bekövetkező csonttörés - lokalizációtól függetlenül - típusos oszteoporotikus törésnek minősül.
2.4. Legtöbbször a betegség involúciós (posztmenopauzális és szenilis) formáival találkozhatunk, de egyre nő a szekunder oszteoporózisok előfordulása is, amelyeket más szervek betegségei vagy gyógyszerek okoznak. Az oszteoporózis népbetegség, az Európai Vertebralis Osteoporosis Tanulmány (EVOS) szerint hazánkban megközelítőleg 600 ezer nőt és 300 ezer férfit érint az 50 év feletti korosztályban. Más nemzetközi adatok szerint Európában az 50 éven felüli nők között 2-ből 1, a férfiak között 5-ből 1 szenved oszteoporózisban. A csontritkulás klinikai jelentőségét a kóros csonttörés és annak szövődményei adják, azon belül is a legnagyobb jelentőségűek a csípőtáji törések. Egyes felmérések szerint a csípőtáji töröttek több mint 30%-a a fraktúra utáni első évben meghal, mintegy fele élete végéig ellátási segítségre szorul, s csupán minden ötödik beteg gyógyul teljesen. A csigolyatörések zöme fokozatosan keletkezik, és sokáig rejtve marad, csupán az esetek tizede kerül azonnal észlelésre.
2.5. Az oszteoporózis terápiája alapvetően a törések megelőzésére irányul. Az oszteoporózis multifaktoriális betegség, de az egyes tényezők egymáshoz való viszonya még kevéssé tisztázott. Mind az oszteoporózis, mind az oszteoporózisos csonttörés kialakulásának kockázatát több tényező növelheti, egyes tényezők mindkettőt. A terápiát igénylő betegek a csonttörés rizikófaktorainak és a csont-denzitás meghatározása alapján azonosíthatóak be.
2.6. A legfontosabb validált törési rizikótényező az életkor. A 80 év feletti populációban történik a csonttörések 25%-a. A másik legfontosabb kockázati tényező a csökkent ásványi csonttömeg. Az oszteoporózis további legfontosabb rizikófaktorai a női nem, a kis testtömeg vagy 10%-nál több testtömeg elvesztése, tartós immobilizáció, korábbi oszteoporotikus csonttörés, oszteoporózisra pozitív családi anamnézis, kollagén keresztkötés magas szérum (vizelet) szintje, szteroidok tartós szedése, dohányzás, alkoholizmus, reumatoid arthritis. Ezek a rizikófaktorok nőknél a posztmenopauzás életszakaszban a legjelentősebbek, de nem egyformán hangsúlyosak.
2.7. Az oszteoporotikus törések kockázati tényezői:
2.7.1. Egy csigolya kompressziója (több mint 25%-os magasságcsökkenése)
2.7.2. Többszörös csigolyakompresszió
2.7.3. Bármilyen korábbi oszteoporotikus törés
2.7.4. 65 év feletti életkor
2.7.5. Szekunder hyperparathyreosishoz vezető kórképek
2.7.6. Hypogonadismus
2.7.7. Tartós (három hónapot meghaladó) oralis glükokortikoid (több mint napi 7,5 mg prednizolonnal ekvivalens) kezelés
2.7.8. Cushing szindróma
2.7.9. Szubklinikus hypercortisolismus
2.7.10. Primer hyperparathyreosis
2.7.11. Glitazon kezelés
2.7.12. Non-vertebrális törés 50 év felett
2.7.13. Aromatáz inhibitor kezelés
2.7.14. Androgéndeprivációs kezelés
2.7.15. Reumatoid arthritis
2.7.16. Spondylarthritis ankylopoetica
2.7.17. Proximális femurtörés a szülőknél
2.7.18. Soványság (BMI kevesebb mint 20 kg/m2)
2.7.19. Dohányzás
2.7.20. Többszörös esés
2.7.21. Immobilizáció
2.7.22. Epilepsia (antiepileptikus kezelés)
2.7.23. Gyomor-, bélresectio
2.7.24. Diabetes mellitus (1. és 2. típus)
2.7.25. TSH szintje alacsonyabb mint 0,3 mU/l
2.7.26. Elesési kockázatot növelő gyógyszerek szedése (szedatívumok, antidepresszánsok, neuroleptikumok, orthostatist okozó gyógyszerek)
2.7.27. Kezeletlen korai (45 éves kor előtt kezdődő) menopauza
2.7.28. Minimum 4 egység alkohol fogyasztása naponta (1 alkohol egység 8-10 g alkoholt jelent, ami szeszes italban kifejezve 1 pohár sör, 1 dl bor, 2 cl rövidital)
2.7.29. Csípőtörés a szülői anamnézisben
2.7.30. Fokozott csontturnover
2.8. Az Egészségügyi Világszervezet (WHO) munkacsoportja validált kockázati tényezők alapján egy rizikóbecslő rendszert alakított ki, amely integrálja a páciens egyes kockázati tényezőivel kapcsolatos veszélyeztetettségét, és megadja az oszteoporotikus törés 10 éves valószínűségét. A FRAX® (Fracture Risk Assessment Tools) a combnyak BMD, a kor, a nem, a BMI, az előző törések, a családban korábban előfordult csípőcsont-törés, dohányzás, alkoholfogyasztás, glükokortikoid kezelés, rheumatoid arthritis, illetve szekunder osteoporosis megléte alapján ország specifikusan becsüli meg a rizikót. A FRAX-modellt több tízezer európai, amerikai, ázsiai és ausztrál beteg csont-sűrűségi és törési adatainak feldolgozásával fejlesztették ki. A számítógépes algoritmus az interneten bárki számára hozzáférhető (http://www.shef.ac.uk/FRAX), és az adott ország törési statisztikáinak felhasználásával kiszámítható az adott beteg törési kockázata. A FRAX a magyar betegek vonatkozásában hazai adatok alapján végzi a számítást.
2.9. Az oszteoporózis kezelésének és a kóros csonttörések megelőzésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai aktivitás. Szükség esetén gyógyszeres terápiával lehet a csontritkulás folyamatát gátolni.
2.10. Primer prevenció alatt azon posztmenopauzás nők és 55 év feletti férfiak kezelését értjük, akik már legalább egy oszteoporotikus törésen átesetek, és fokozott kockázatuk van újabb kóros csonttörésre, és a gyógyszeres kezeléssel ez a kockázatuk csökkenthető.
2.11. Jelen finanszírozási eljárásrend a posztmenopauzás nők és 55 év feletti férfiak oszteoporózis miatt kialakuló csonttörésének szekunder megelőzését célzó kezelést határozza meg.
3. Diagnosztika
3.1. Az ásványi csonttömeg denzitometriás módszerekkel pontosan megmérhető. A mért csontsűrűséget (BMD, bone mineral density, g/cm2) az egészséges fiatalok átlagértékéhez, a csúcs-csonttömeghez (PBM, peak bone mass) hasonlítják, és a különbséget a fiatal populáció normál értékének szórásában (SD) fejezik ki (T-score). Leggyakrabban az alacsony energiájú röntgensugárzással végzett képalkotó eljárást (DEXA; Dual Energy X-Ray Absorptiometry) használják. Ezen kívül alkalmazzák az ultrahangos csontsűrűség mérést és a kvantitatív komputertomográfiát is, az előbbi társadalombiztosítás által nem támogatott, utóbbit csak kutatásokhoz kapcsolódóan jelentik az engedéllyel rendelkező szolgáltatók. A javasolt mérési helyek elsősorban az ágyéki gerinc, csípőtájék, további lehetőség az alkar, sarok és kézujjak.
3.2. Az oszteoporózis diagnózis felállításának alapvető feltétele a T-score érték meghatározása. Az oszteoporózist azoknál jelenthetjük ki, akiknél ez az érték -2,5-nél kisebb. Az Egészségügyi Világszervezet ajánlása szerint az alábbi diagnosztikus kategóriákat állíthatjuk fel a T-score értéke alapján:
3.2.1. T-score nagyobb, mint -1,0 SD = egészséges csontozat
3.2.2. T-score -1,0 és -2,5 SD közötti = oszteopénia
3.2.3. T-score kisebb, mint -2,5 SD = oszteoporózis
3.2.4. T-score kisebb, mint -2,5 SD és legalább egy oszteoporózis miatti csonttörés = súlyos oszteoporózis
3.3. Oszteoporózis esetén a csontsűrűség törzscsontokon való mérését a társadalombiztosítás finanszírozza. A diagnosztikus eljárás a 3570C Csontsűrűség mérése törzscsontokon (törzsi csontok ásványianyag tartalmának fotonabsorptiós meghatározása) OENO kóddal jelenthető. A vizsgálat oszteoporózis esetén 12 havonta egyszer számolható el -2,5 vagy kisebb (rosszabb) T-score érték melletti specifikus törés prevenciós gyógyszeres kezelés esetén.
3.3.1. A végtagcsontokon történő csontsűrűség mérést a társadalombiztosítás kizárólag thyreotoxcosis és primer hyperparathyreosis esetén finanszírozza, melyet a közfinanszírozott szolgáltatók a 3570A Csontsűrűség mérése végtagcsontokon [bármely végtagcsont (alkar, sarok, tibia stb.) ásványianyag tartalmának fotonabsorptiós meghatározása] OENO kóddal jelenthetnek.
3.3.2. A kvantitatív CT-vel történő csontsűrűség mérés közfinanszírozásba nem befogadott eljárás, de az engedélyezett orvosbiológiai kutatásokhoz kapcsolódóan a 3570D Csontsűrűség mérése pQCT-vel (végtagcsontok ásványianyag tartalmának meghatározása quantitativ computer tomographiával) OENO kódon jelenteni kell az Országos Egészségbiztosítási Pénztár felé.
3.3.3. A kezelőorvos számára a laboratóriumi vizsgálatok (Ca, P, PTH, D-vitamin, TSH) a csökkent BMD kóreredetének elkülönítésében, a csont-turnover markereinek (a reszorpció és formáció biomarkerei, elsősorban a szérum és vizelet kollagén keresztkötést tartalmazó peptidjeinek és csontspecifikus alkalikus foszfatáznak) a meghatározása a terápia-választásban segíthetnek.
4. Terápia
4.1. Calcium és D-vitaminpótlás
4.1.1. A primer prevencióban az oszteoporózis kezelésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai mozgás. Epidemiológiai vizsgálatok bizonyítják, hogy az adekvát kalcium- és D-vitamin bevitel gyermekeknél a csúcs-csonttömeg kialakulásában, időseknél a csontvesztés megelőzésében és a törési, illetve az esési kockázat csökkentésében játszik szerepet.
4.1.2. A fizikai aktivitás stimulálja az oszteoblasztokat, továbbá az izomerő javulásával az elesések száma is csökken. Preventív céllal, illetve oszteopénia eseteiben a rendszeres megfelelő intenzitású és frekvenciájú testedzés ajánlott. Ez a gyakorlatban minimum heti háromszori alkalommal végzett aerobik jellegű, ütközéssel járó mozgásformát jelent. A nagyobb csontmennyiség kialakulását elsősorban a pubertás kor előtt elkezdett fizikai aktivitás segíti elő a terhelésnek kitett csontokon.
4.1.3. Fontos prevenciós tényező az immobilizáció kerülése, az immobilitás megszüntetése lehetőség szerint 7 napon belül, továbbá az eséskockázat csökkentése. Ez utóbbi alatt elsősorban a beteg környezetének a botlások, elcsúszások elkerülése miatti akadálymentesítését, illetve fokozott esési kockázat esetén az egyéb (pl. esési kockázatokhoz vezető gyógyszeres kezelés) okok feltárását és életmódbeli változtatással annak elkerülését értjük (pl. megfelelő szemüveg viselése, altató korai bevételének kerülése, stb.). Az életkörülmények célszerű átalakítása önmagában 50%-kal csökkenti a törési kockázatot. Prevenciós hatása van még a napi minimum 30 perc szabad levegőn eltöltött időnek, napfény expozícióval, a megfelelő kalória-, kalcium-, B12 vitamin- és folsavbevitelnek, továbbá a dohányzás elhagyásának.
4.1.4. A megfelelő kalcium bevitel elengedhetetlenül fontos a normális növekedéshez, a maximális csúcs csonttömeg kialakulásához, valamint a felnőttkori csontanyagcsere egyensúlyának fenntartásához. A javasolt napi kalcium bevitel napi 1000 mg, de legfeljebb 1200 mg. A kalcium bevitel további fokozása káros következményekkel járhat, napi 2000 mg felett fokozódik a törések gyakorisága, férfiak esetében 1300-1500 mg felett fokozódik a prostata carcinoma incidenciája. Magyarországon egy felnőtt személy átlagos napi kalcium fogyasztása 400-600 mg közötti. Célszerű az ajánlott mennyiségeket étel formájában elfogyasztani, de ha természetes formában nem elégséges a kalcium bevitel, azt gyógyszeresen ki kell egészíteni. A gyógyszeres kalcium pótlásnál előnyben részesítendők a citrát sók. A citrát só előnye a pH-független felszívódás, a nagyobb biohasznosulás, a gastrointestinalis mellékhatások hiánya, illetve a citrát vizelettel történő ürülése során a kalcium vesekövesség elleni védelem. Meta-analízisek csökkent törési arányt mutattak ki olyan betegekben, akik legalább 80%-ban betartották a kalciumpótlás előírásait.
4.1.5. A D-vitaminhiány gyakorisága az életkor előrehaladtával párhuzamosan folyamatos növekedést mutat. A 65 év feletti lakosságnak legalább harmada D-vitaminhiányban szenved. Már a mérsékelt D-vitaminhiány csontritkulást okozhat. Kifejezett D-vitaminhiányról beszélünk, ha a szérum 25-OH-D-vitamin szint 12-15 ng/ml alatt van, idősek esetén azonban már a 25 ng/ml alatti érték is csontvesztéshez vezethet. Kimutatható, hogy a legalább napi 700-800 NE D-vitamin bevitele már segít megelőzni az idősebbek csípőtöréseit. Szakmai konszenzus alapján a megfelelő D-vitaminpótlás 800-2000 NE D3 vitamin naponta vagy ekvivalens dózisok hetente-többhetente. D-vitaminpótlás során rendszeresen kell ellenőrizni (1., 3., 6. hónapban, majd évente, illetve dózisváltáskor) a szérum kalcium szintjét és a vizelet kalciumürítést.
4.1.6. Kalcium és D-vitamin bevitel kiegészítő pótlása a társadalombiztosítás által akkor támogatott, ha a dokumentáltan gondozott posztmenopauzás nő vagy 55 év feletti férfi beteg oszteoporózisa igazolódott (BMD -2,5 SD T-score alatti), vagy nála a fokozott töréskockázati tényezőkből legalább három egyidejűleg bizonyítottan fennáll, vagy a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%) vagy típusos oszteoporotikus törést szenvedett el. A szükséges kalcium és D-vitaminbevitel, amennyiben nincs ellenjavallata, az oszteoporózis terápiájának folyamatos követelménye, ugyanúgy a megfelelő életvitel kialakítása.
4.2. Biszfoszfonátok
4.2.1. A gyógyszeres terápia megválasztásánál fontos szempont, hogy a negatív csonthatások elkerülésére csak a valóban szükséges gyógyszerek szükséges és elegendő mennyiségű szedése történjen meg. A kezelés finanszírozási lépéseinek megválasztásánál az adott készítmény alkalmazási előiratát figyelembe kell venni.
4.2.2. A csontritkulás okozta kóros csonttörések primer és szekunder prevenciójában egyaránt az első választandó gyógyszerhatóanyag-csoport a biszfoszfonátok. A biszfoszfonátok erősen kötődnek a csontszövethez és gátolják az oszteoklasztok aktivitását, és azok apoptózisát okozzák, ezzel erősen gátolva a csontreszorpciót. A klinikai vizsgálatok bizonyítékai alapján, mind a vertebrális, mind a nem-vertebrális csonttöréseket csökkentő hatásuk miatt, első választandó szerként - megfelelő kalcium- és D-vitaminbevitel mellett - ajánlják az alendronátot, risedronátot és ibandronátot.
4.2.3. Az orális biszfoszfonátok kiváló klinikai hatása ellenére a betegek rövid- és hosszú távú együttműködési készsége is alacsonynak bizonyult, sokszor nem az előírás és az orvosi utasítás szerint szedik az orvosságot (rossz compliance), és elhagyják a krónikus betegségre rendelt, hosszú ideig szedendő gyógyszert (rossz perzisztencia).
4.2.4. Az együttműködést rontja a számos, gyógyszerbevétellel kapcsolatos kellemetlen előírás (a gyógyszert éhgyomorra, sima vízzel, álló, vagy egyenesen ülő helyzetben kell bevenni, utána egy ideig nem szabad lefeküdni, enni vagy inni), amely a felső gasztrointesztinális mellékhatások elkerülését és a megfelelő felszívódást biztosítja. Felmérések szerint az oszteoporózis kezelésének első évében a betegek mintegy fele, a harmadik év végére négyötöde nem megfelelően együttműködő. Az alacsony együttműködési készség nagyobb törésszámot eredményezett.
4.2.5. Társadalombiztosítási támogatással adható orális biszfoszfonát oszteoporotikus csonttörések szekunder prevenciója céljából annak a posztmenopauzás nő vagy 55 év feletti férfi betegnek, aki típusos oszteoporotikus törést szenvedett el, és a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, csípő>3%) vagy az oszteoporózisa csontsűrűség vizsgálattal igazolt (BMD -2,5 SD T-score alatti). A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.6. A különböző hatóanyagok és kiszerelési formák közötti választás alapvetően a kezelőorvos egyéni mérlegelésének és szakmai döntésének tárgya, szem előtt tartva a terápia célját és a várható hatékonyságot, továbbá a terápia tolerálhatóságát; függ az adott beteg paramétereitől és az orvos tapasztalataitól. A készítmények alkalmazása során a maxillo-faciális régióban ritkán (1% alatt) csontnekrózis fordulhat elő, különösen egyes gyógyszerkölcsönhatások (pl. sztatin, szteroidok, egyes hormonkészítmények) miatt. Ezért a gyógyszerkészítmény alkalmazásának megkezdése előtt fogorvosi kivizsgálás és szükség szerinti kezelés elvégzése javasolt.
4.2.7. A költséghatékony kezelés követelményét szem előtt tartva törekedni kell az orális kezelésre, ugyanakkor figyelembe kell venni azokat a körülményeket (például nem megfelelően együttműködő beteg), melyek esetén a parenterális kezelés választása a célravezetőbb.
4.2.8. Az eddigi vizsgálatok szerint a parenterális biszfoszfonátok közül mind a zoledronát (5 mg/év) mind az ibandronát (3 mg/negyedév) hatékony a csontsűrűség javításában és a törési kockázat csökkentésében.
4.2.9. Társadalombiztosítási támogatással adhatók a parenterális biszfoszfonátok oszteoporotikus csonttörések szekunder prevenciója céljából annak a posztmenopauzás nő vagy 55 év feletti férfi betegnek, aki típusos oszteoporotikus törést szenvedett el, és FRAX alapján számított 10 éves törési kockázata magas (általános>20%, csípő>3%), vagy az oszteoporózisa csontsűrűség vizsgálattal igazolt (BMD -2,5 SD T-score alatti), de az orális biszfoszfonát kezelés ellenjavallt vagy dokumentált intolerancia vagy a kezelést hátrányosan befolyásoló egyéb tényező miatt nem folytatható. A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.10. Szekunder prevenció esetén tehát a beteg érdekében, kellő dokumentáltság mellett a biszfoszfonát kezelés megkezdhető csontsűrűség vizsgálat nélkül is, ha a FRAX alapján számított 10 éves törési kockázata magas. Az oszteoporózis mértékének megállapítására, illetve a beállított terápia hatásának későbbi megítélése érdekében a terápia megkezdésétől számított legfeljebb 4 hónapon belül a csontsűrűség mérést el kell végezni.
4.2.11. A biszfoszfonátok alkalmazásánál különösen fontos a megfelelő kalcium és D-vitamin-szint fenntartása, a másodlagos PTH-emelkedés kivédésére, illetve a megfelelő hatásosság biztosítására.
4.3. Stroncium ranelát
4.3.1. A stroncium ranelát csökkenti a csontreszorpciót és egyben serkenti a csontképződést, a klinikai vizsgálatok szerint mind a csigolyatörések, mind a csípőtáji törések kockázatát csökkenti.
4.3.2. A stroncium ranelát használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés szekunder prevenciójában, társadalombiztosítási támogatással alkalmazható annál a posztmenopauzás nő vagy 55 év feletti férfi betegnél, aki típusos oszteoporotikus törést szenvedett el, és vagy FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%), vagy az oszteoporózisa csontsűrűség vizsgálattal igazolt (BMD -2,5 SD T-score alatti), amennyiben a biszfoszfonát kezelés ellenjavallt, vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve újabb oszteoprotikus törés történt).
4.3.3. Szekunder prevenció esetén a stroncium ranelát terápia akkor kezdhető meg a T-score érték ismerete nélkül, ha a szakmai és finanszírozási szabályok szerint elsőként választott gyógyszer, azaz a biszfoszfonátok ellenjavalltak, és a FRAX alapján számított 10 éves törési kockázata magas.
Az oszteoporózis mértékének megállapítására, illetve a beállított terápia hatásának későbbi megítélése érdekében a terápia megkezdésétől számított legfeljebb 4 hónapon belül a csontsűrűség mérést el kell végezni.
4.4. Denoszumab
4.4.1. A denoszumab monoklonális RANKL ellen ható antitest, a csontreszorpciót a RANK ligand gátlás útján célzottan csökkenti, hat a csontlebontás folyamatára, jelentősen növeli a csontdenzitást, és csökkenti mind a vertebrális, mind a nem-vertebrális csonttörések kockázatát. A denoszumab a csont trabekuláris és kortikális állományát is erősíti. A denoszumab terpáiás költsége miatt a finanszírozási rendben jelenleg a stroncium raneláttal esik egy kategóriába.
4.4.2. A denoszumab használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés szekunder prevenciójában, társadalombiztosítási támogatással alkalmazható annál a posztmenopauzás nő vagy 55 év feletti férfi betegnél, aki típusos oszteoporotikus törést szenvedett el, és vagy FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%), vagy az oszteoporózisa csontsűrűség vizsgálattal igazolt (BMD -2,5 SD T-score alatti), amennyiben a biszfoszfonát kezelés ellenjavallt, vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve újabb oszteoprotikus törés történt).
4.4.3. Szekunder prevenció esetén a denoszumab terápia akkor kezdhető meg a T-score érték ismerete nélkül, ha a szakmai és finanszírozási szabályok szerint elsőként választott gyógyszer, azaz a biszfoszfonátok ellenjavalltak és a FRAX alapján számított 10 éves törési kockázata magas. Az oszteoporózis mértékének megállapítására, illetve a beállított terápia hatásának későbbi megítélése érdekében a terápia megkezdésétől számított legfeljebb 4 hónapon belül a csontsűrűség mérést el kell végezni.
4.5. Raloxifen
4.5.1. A raloxifen szelektív ösztrogénreceptor modulátor (SERM). Elsősorban a csigolyatörések előfordulását csökkenti. A raloxifen fokozza a vénás tromboembólia kialakulásának kockázatát.
4.5.2. A raloxifen használata alternatív lehetőségként jön szóba. Az oszteoporotikus csonttörés szekunder prevenciójában, társadalombiztosítási támogatással alkalmazható annál a posztmenopauzás nő vagy 55 év feletti férfi betegnél, aki típusos oszteoporotikus törést szenvedett el, és vagy FRAX alapján számított 10 éves törési kockázata magas (általános>20%, csípő>3%), vagy az oszteoporózisa csontsűrűség vizsgálattal igazolt (BMD -2,5 SD T-score alatti), amennyiben a biszfoszfonát kezelés ellenjavallt, vagy azzal szemben dokumentált intolerancia lép fel, vagy a biszfoszfonát legalább 12 hónapon át történő alkalmazása nem volt eredményes (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve újabb oszteoprotikus törés történt).
4.5.3. Szekunder prevenció esetén a raloxifen terápia akkor kezdhető meg a T-score érték ismerete nélkül, ha a biszfoszfonátok ellenjavalltak és a szakmai és finanszírozási szabályok szerint elsőként választott gyógyszer és a FRAX alapján számított 10 éves törési kockázata magas. Az oszteoporózis mértékének megállapítására, illetve a beállított terápia hatásának későbbi megítélése érdekében a terápia megkezdésétől számított legfeljebb 4 hónapon belül a csontsűrűség mérést el kell végezni.
4.6. Teriparatid
4.6.1. A teriparatid humán rekombináns parathormon, erős csontépítő hatása van. Klinikai vizsgálatok szerint mind a csigolyatörések, mind a non-vertebrális törések relatív kockázatát csökkenti. Fokozott csont-sarcoma kockázata esetén kontraindikált (Paget-kór, korábbi csontbesugárzás, ismeretlen eredetű alkalikus foszfatáz szintemelkedés).
4.6.2. Az oszteoporotikus csonttörés szekunder prevenciójában a teriparatid társadalombiztosítási támogatással kezelési alternatívaként annál a posztmenopauzás nő vagy 55 év feletti férfi betegnél alkalmazható, aki típusos oszteoporotikus törést szenvedett el, és a törzscsontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -3,0 SD T-score alatti, amennyiben más lehetséges (biszfoszfonáttal vagy strontium-ranelate-tal vagy raloxifennel vagy denoszumabbal végzett) megelőző, legalább 12 hónapon át tartó kezelés hatástalan (a BMD értéke a kiindulási értékhez képest legkevesebb 5%-kal csökkent, illetve újabb oszteoprotikus törés történt), vagy azzal szemben intolerancia lép fel, vagy a kezelés ellenjavallt.
4.6.3. A teriparatid elsőként választható oszteoporotikus törések szekunder prevenciójára annál a posztmenopauzás nő vagy 55 év feletti férfi betegnél, aki egynél több típusos oszteoporotikus törési eseményt szenvedett el, és a törzscsontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -3,0 SD T-score alatti.
4.6.4. A teriparatid elsőként választható oszteoporotikus törések szekunder prevenciójára annál a posztmenopauzás nő vagy 55 év feletti férfi betegnél, aki típusos oszteoporotikus törést szenvedett el, és a törzscsontok ásványianyag tartalmának fotonabszorpciós meghatározással igazolt BMD értéke -4,0 SD T-score alatti.
4.6.5. Az egészségbiztosító egy beteg esetén legfeljebb 18 havi teriparatid kezelést támogat, melyet legfeljebb 24 hónap alatt vehet igénybe a beteg. A kezelés megszakításának okát a kezelőorvosnak dokumentálnia kell. A kezelés nem ismételhető.
4.7. Gyógyszer intolerancia meghatározása
4.7.1. A társadalombiztosítási támogatás szempontjából bármely orális biszfoszfonáttal szembeni intolerancia alatt értjük az olyan, megfelelő kezeléssel nem kontrollálható, folyamatosan fennálló, felső gasztrointesztinális traktust érintő zavarokat (gyulladás, fekély), melyek miatt az alkalmazási leirat szerinti szabályos kezelés kivitelezése, vagy a terápia folytatása meghiúsulhat. A gasztrointesztinális mellékhatások az orális biszfoszfonátok jellemzői. Akiknél a nyelőcsőrendellenességei vagy egyéb olyan állapotok állnak fenn, melyek a nyelőcső kiürülését késleltetik (pl. srtictura vagy achalasia), továbbá, ha a beteg képtelen arra, hogy legalább 30 percig álljon, vagy üljön, azoknál a betegeknél az orális biszfoszfonátokkal való kezelés kontraindikált, helyette parenterális biszfoszfonáttal vagy stroncium raneláttal ajánlott a kezelést végezni.
4.7.2. Az orális biszfoszfonátok alkalmazása viszonylag összetett. Nagy pohár (1-2 dl) vízzel kell bevenni, éhgyomorra, függőleges testhelyzetben, ezt követően még minimum 30 percig függőleges testhelyzetben kell maradni, ételt, folyadékot, más gyógyszert, vitamint, stb. ezen idő alatt nem fogyaszthat a beteg. Az orális ibandronátot havonta egyszer kell a betegnek bevenni, míg az alendronát és rizedronát alkalmazása esetén heti egyszeri alkalmazás szükséges. Az orális biszfoszfonátok alkalmazása kapcsán levonható a következtetés, hogy az esetek többségében az nyelőcső gyulladás kivédése az alkalmazási leirat pontos betartásával lehetséges. A beteg terápiában való együttműködése nem csupán az esetlegesen fellépő gyógyszer-mellékhatások függvénye, hanem kiemelt jelentőséggel bír a kezelőorvos részéről a beteg megfelelő tájékoztatása és felkészítése, hogy a kezelés megfelelően kivitelezett és eredményes legyen.
4.8. A kezelés időtartama
A modern terápiás irányelvek szerint elsősorban a magas kockázatú betegek gyógyszeres kezelése preferált, bizonyítottan törésmegelőző szerekkel. További alapelv, hogy a kezelést monoterápiában szükséges adni, a szükséges kalcium és D-vitaminpótlással. Egyéb gyógyszerkombinációtól nem várható további denzitásnövelés, de a mellékhatások előfordulása gyakoribbá válhat. A kezelés időtartamára vonatkozóan nincs még tudományosan kellően megalapozott, egységes álláspont. A gyógyszeres kezeléstől alapvetően azt várjuk, hogy a csontvesztés üteme lassuljon, megálljon, és ezáltal a csonttörés kockázata csökkenjen.
4.8.1. Az optimális kezelési eredmény az, ha a terápia első 2-3 évében a trabekuláris csontdenzitás 7-10%-kal nő, mert ez a törési rizikót felére csökkenti.
4.8.2. Vizsgálatok szerint már 12 hónapos kezelés statisztikailag szignifikáns javulást eredményez a betegek állapotában, ezért ennél rövidebb kezelési időszak alatt a terápia hatásosságát megítélni nem lehet.
4.8.3. A beteg állapotának kontrollálásában (oszteodenzitometria, labor-, röntgenvizsgálat, kockázat újraértékelés stb.) a szakmai irányelvek szerint kell eljárni.
4.8.4. Biszfoszfonát kezeléseknél figyelembe kell venni, hogy a biszfoszfonátok lassan távoznak a csontszövetből, azaz hatásuk tartósan megmarad, ezért a megtartott-növekvő denzitás mellett, csonttörések hiányában három év után a terápia szüneteltetését, illetve öt év után a befejezését mérlegelni kell. A csípőtörések gyakorisága tíz év alatt nem nőtt azoknál a betegeknél, akik öt év után nem kaptak biszfoszfonátot, azokhoz képest, akik végig szedték a vizsgált időszakban a gyógyszert.
4.9. Hatástalanság
4.9.1. A szakmai ajánlások alapján akkor mondhatjuk ki a kezelés hatástalanságát, ha minimum 12 hónapos kezelés ellenére a kontrollvizsgálat során 5%-os denzitáscsökkenést mérünk, illetve a kezelés ellenére oszteoporotikus csonttörés történik.
5. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
5.1. Az algoritmus típusos oszteoporotikus csonttörésen átesett posztmenopauzás nők és 55 év feletti férfiak további kóros csonttörésének megelőzését célzó kezelésének sémáját mutatja be.
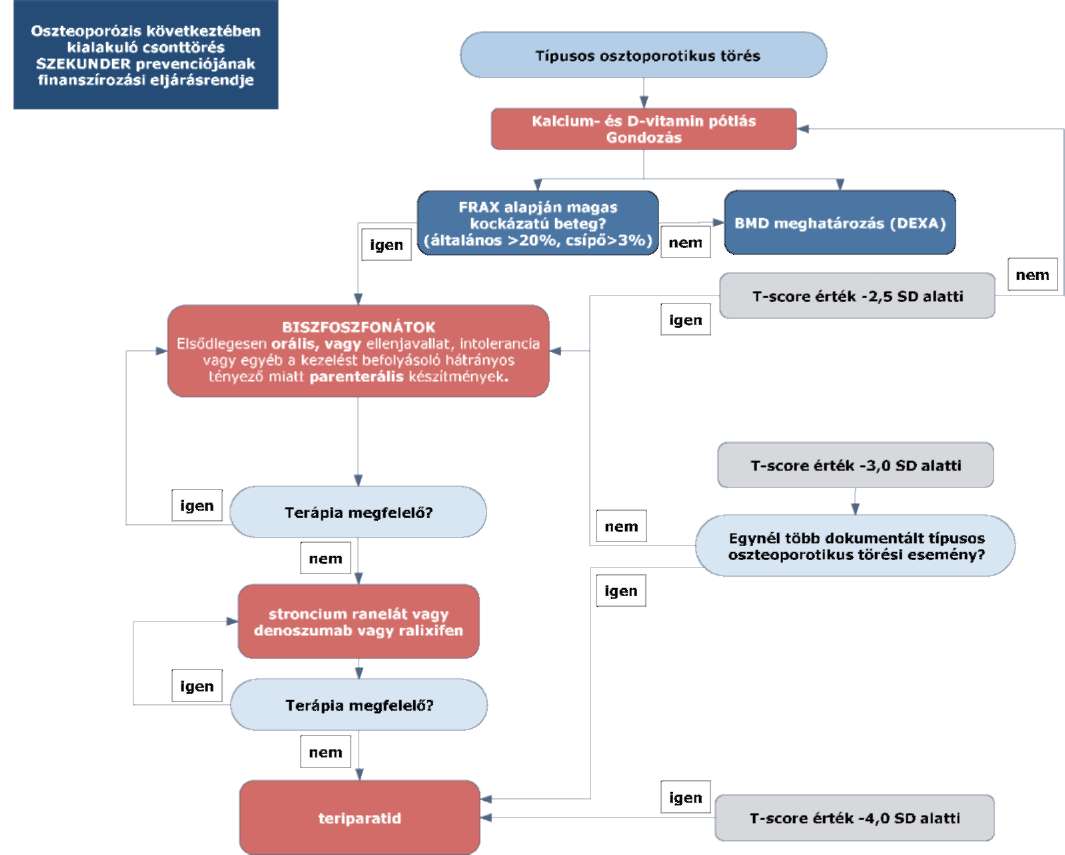
6. Az oszteoporózis prevenciós terápia finanszírozási és ellenőrzési kritériumai
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1.1. A finanszírozó informatikai úton, folyamatba épített ellenőrzésként vizsgálja az elszámolásokat, hogy az alkalmazott diagnosztika és terápia az eljárásrenddel összhangban van-e
6.1.1.1. Kompetencia szint: szakrendelés, szakorvosi kompetencia ellenőrzése
6.1.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.1.3. Jogszabályban rögzített indikációs terület (BNO) ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. Az egészségbiztosító - szükség esetén helyszíni ellenőrzés keretében - vizsgálja a terápiás döntések megalapozottságát, a szakmai dokumentációt
6.2.1.1. Szérum és vizelet kalcium meghatározása D-vitaminpótló terápia esetén
6.2.1.2. A csontok ásványianyag tartalmának fotonabszorpciós meghatározása
6.2.1.3. Rizikófaktorok megléte
6.2.1.4. Oszteoporotikus törések
6.2.1.5. Gyógyszerváltás indokoltsága (intolerancia, mellékhatás, hatástalanság)
6.2.1.6. 6. Terápiás lépcsők betartása
6.2.1.7. Beteggondozás, terápia kontrollálása
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A terápiás területre fordított közkiadások alakulása, monitorozása
7.2. A finanszírozási eljárásrend szerint kezelt betegek aránya
7.3. Kezelés mellett bekövetkező törések monitorozása
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. Releváns BNO kódok
| A | B | |
| 1 | BNO kód | BNO megnevezése |
| 2 | M8000 | Postmenopausalis osteoporosis pathologiás töréssel |
| 3 | M8010 | Petefészek eltávolítás utáni osteoporosis pathologiás töréssel |
| 4 | M8020 | Inaktivitási osteoporosis pathologiás töréssel |
| 5 | M8030 | Sebészeti beavatkozás ut. malabsorptiós osteoporosis pathologiás töréssel |
| 6 | M8040 | Gyógyszer-indukálta osteoporosis pathologiás töréssel |
| 7 | M8050 | Idiopathiás osteoporosis pathologiás töréssel |
| 8 | M8080 | Egyéb osteoporosispathologiás töréssel |
| 9 | M8090 | Nem meghatározott osteoporosis pathologiás töréssel, k.m.n. |
| 10 | M8091 | Krónikus májbetegség talaján kialakult osteoporosis, pathologiás töréssel |
| 11 | M8200 | Osteoporosis myeloma multiplexben (C90.0+) |
| 12 | M8210 | Osteoporosis endocrin rendellenességekben (E00-E34+) |
| 13 | M8280 | Osteoporosis egyéb, máshova osztályozott betegségekben |
| 14 | Z0000 | Vizsgálat, általános |
| 15 | Z0001 | Járóbeteg első szakorvosi ellátása a kórházi ápolást követően |
| 16 | Z0940 | Gondozás, követéses vizsgálat: töréskezelés után |
| 17 | Z0970 | Gondozás, követéses vizsgálat: más állapotok kombinált kezelése után |
| 18 | Z0980 | Gondozás, követéses vizsgálat: egyéb okból |
| 19 | Z5080 | Gondozás rehabilitációs eljárásokkal |
| 20 | Z5090 | Rehabilitáció és gondozás, k.m.n. |
| 21 | Z5180 | Orvosi ellátás |
| 22 | Z5190 | Orvosi ellátás, k.m.n. |
| 23 | Z8260 | Arthritis és más vázizom-kötoszöveti betegség a családi anamnesisben |
| 24 | M8000 | Postmenopausalis osteoporosispathologiás töréssel |
| 25 | M8010 | Petefészek eltávolítás utáni osteoporosis pathologiás töréssel |
| 26 | M8020 | Inaktivitási osteoporosis pathologiás töréssel |
| 27 | M8030 | Sebészeti beavatkozás ut. malabsorptiós osteoporosis pathologiás töréssel |
| 28 | M8040 | Gyógyszer-indukálta osteoporosis pathologiás töréssel |
| 29 | M8050 | Idiopathiás osteoporosis pathologiás töréssel |
8.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 3570C | Csontsűrűség mérése törzscsontokon |
| 3 | 21510 | Összes kalcium meghatározása |
| 4 | 21512 | Ionizált kalcium meghatározása |
| 5 | 22300 | Kalcium meghatározása vizeletben |
8.3. Releváns ATC kódok
| A | B |
| 1 | ATC | ATC megnevezése |
| 2 | A12AA | Kalcium |
| 3 | A12AA04 | Kalcium karbonát |
| 4 | A12AA19 | Kalcium citrát |
| 5 | A11CC05 | Kolekalciferol |
| 6 | M05BA04 | Alendronát |
| 7 | M05BA06 | Ibandronát |
| 8 | M05BA07 | Rizedronát |
| 9 | M05BA08 | Zoledronát |
| 10 | M05BB | Biszfoszfonátok, kombinációk |
| 11 | M05BB04 | Risedronic acid, calcium and colecalciferol, sequential |
| 12 | M05BB07 | Risedronsav és colecalciferol |
| 13 | M05BB03 | Alendronát és kolekalciferol |
| 14 | M05BX03 | Stroncium ranelát |
| 15 | M05BX04 | Denoszumab |
| 16 | G03XC01 | Raloxifen |
| 17 | H05AA02 | Teriparatid |
9. Fogalmak, rövidítések
ATC Anatomical Therapeutic Chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
HBCS Homogén betegségcsoport
OENO Orvosi eljárások nemzetközi osztályozása"
22. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"18. melléklet a 31/2010. (V. 13.) EüM rendelethez
A gyermekkori Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Gyermekkori Crohn-betegség.
2. A kórkép leírása
2.1. A gyulladásos bélbetegségek (a továbbiakban: IBD), azaz a colitis ulcerosa (a továbbiakban: UC) és a Crohn-betegség (a továbbiakban: CD) a fejlettebb országokban a rheumatoid arthritis (kb. a lakosság 1%-a) után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A különböző felmérések alapján megállapítható, hogy az IBD gyakorisága a fejlettebb országokban, beleértve Magyarországot is, kb. 0,5%. A CD olyan krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti. A betegségre a bél transzmurális gyulladása jellemző, gyakori a lefolyás során az intesztinális (pl.: szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. Az UC a rectumtól kezdve különböző hosszúságban érintheti a vastagbelet, ritkán a terminális ileumot ("back wash ileitis"). A gyermekkori UC-re - ellentétben a felnőttkori UC-vel - a legjellemzőbb a pancolitis, az esetek 60-80%-a ebbe a csoportba tartozik. Igen ritka a kizárólagos rektális érintettség. Összehasonlító vizsgálatok megállapították, hogy a gyermekkori IBD kiterjedése nagyobb, lefolyása súlyosabb, mint a felnőttekben. Figyelembe véve azt, hogy pl. egy 5 éves korban induló betegség esetén a gyermek 40 éves korára már 35 éve szenved a betegségben, sokkal nagyobb az esélye arra, hogy már számos műtéten átesett, és nála a szövődményes formák már jelen lesznek. Ezen kívül a növekedés, a pubertás elmaradása a felnőttkorban induló formát már nem érinti.
Összegezve: a gyermekkori CD-nek a felnőttkori CD-hez képest súlyosabb formában történő jelentkezése és a speciális, gyermekkorra jellemző sajátosságok miatt a gyermekekre adaptált kezelési finanszírozási eljárásrend kiemelten fontos tényező.
Mindkét betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapszusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll, az esetek kis részében az aktivitás folyamatos.
A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A hatás időtartama azonban viszonylag rövid, és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Kiemelésre érdemes, hogy jelenleg a gyermekkori CD legkorszerűbb kezelése a kizárólagos enterális táplálás (EEN: exclusive enteral nutrition). Mivel ennek a kezelésnek a hatékonysága megegyezik a szteroiddal, de nincs szignifikáns mellékhatása, mindenképpen elsőként választandó módszer. IBD-ben jelenleg a legfontosabb cél a mély remisszió (deep remission) elérése, vagyis az aktivitási index 10 alatt legyen (PCDAI<10) és ne legyen az endoszkópiás vizsgálatnál makroszkóposan látható fekély. Az EEN kezelés mellett gyakrabban látunk teljes mukózális gyógyulást (74%) a szteroid terápiához képest (33%).
Mai tudásunk szerint a gyulladásos bélbetegségeket meggyógyítani nem lehet, ezért hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtét elkerülése. A műtét azonban nem terápiás kudarc, hanem a kezelés része, így a szakmailag indokolt sebészeti beavatkozást el kell végezni. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel bizonyosan nem lehet megváltoztatni. CD-ben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, rezekciós műtét válik szükségessé.
Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Az új terápiás lehetőségek birtokában a terápiás célok is módosulnak. Ma cél a klinikai és endoszkópos (nyálkahártya-gyógyulás) remisszió elérése (mély remisszió), a szteroid mentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása és a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.2. Crohn-betegség aktivitása, kiemelve a gyermekkori CD speciális betegség aktivitási indexét
2.2.1. CD súlyosságának megítélésére az eltérő betegségtípusok esetén más-más mérőszámok alkalmasak. Gyulladásos típusú betegségben a PCDAI (Pediatric Crohn's Disease Activity Index) a legelterjedtebben alkalmazott aktivitási index. A kezelés hatékonynak tekinthető (klinikai válasz), ha a PCDAI minimum 50%-kal vagy 15 ponttal csökken és a PCDAI 30 pont alá süllyed. 10 pont alatt remisszióról beszélünk.
2.2.2. A perianalis sipollyal járó betegségformák súlyosságának meghatározására a PDAI (Perianal Disease Activity Index) alkalmas a felnőtteknél, de ez gyermekkorban nem használatos, mert olyan faktort is tartalmaz (pl. szexuális aktivitás), amely nem validált paraméter a gyermekkorban, így gyermekkorban az aktív fistulák számának követése javasolt.
2.2.3. A betegség aktivitásának (luminális) meghatározása (PCDAI: Pediatric Crohn-betegség aktivitási index) és dokumentálásának ellenőrzése
2.2.3.1. Inaktív betegség: PCDAI≤10
2.2.3.2. Közepesen súlyos: 10<PCDAI≤30
2.2.3.3. Súlyos: 30<PCDAI<100
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A gyermekkori Crohn-betegség gyógyszeres kezelési algoritmusa
4.1. Tüneti és gyulladáscsökkentő kezelés: Elsődlegesen: EEN (kizárólagos enterális táplálás, 6-8 hétig, 5-ASA, szulfaszalazin) (alapellátás + mindhárom szint).
4.2. Luminális esetekben: EEN (6-8 hétig), illetve, ha ez nem lehetséges, akkor kezdeti szteroid kezelés (1 mg/kg szteroid 2-4 hétig, majd fokozatos leépítés. A leépítéssel együtt a szteroid kezelés ne tartson tovább, mint 3 hónap).
4.3. Korai immunszuppresszív terápia (törzskönyvi indikációkra figyelve).
4.4. Negyedik vonalban: biológiai terápia (biológiai terápiás centrumok) TNF gátló: infliximab (az alkalmazott támogatási kategória figyelembevételével), adalimumab.
5. Gyermekkori Crohn-betegség biológiai kezelése
5.1. Indukciós kezelés gyermekkori Crohn-betegségben
5.2. Anti-TNF-α indukciós kezelés indikált bármely lokalizációban lévő súlyos luminális gyermekkori CD-ben (6-betöltött 18 éves korig) (PCDAI>30), ha az szteroid refrakter, vagy immunszuppresszáns kezelés mellett szteroid dependencia alakul ki, vagy immunszuppresszáns kezelésre a beteg intoleráns.
5.3. Anti-TNF-α indukciós kezelés indikált bármely lokalizációban lévő súlyos aktív fisztulázó gyermekkori Crohn-betegségben (6-betöltött 18 éves korig), amennyiben életminőséget nagymértékben rontó fisztula/fisztulák a hagyományos gyógykezelés (antibiotikum és immunszuppresszív terápia) ellenére nem javulnak.
5.4. A hazánkban jelenleg engedélyezett készítmények közül:
Infliximab (IFX) esetében: 5 mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. A rendelkezésre álló adatok nem támasztják alá a további infliximab-kezelést a terápia első 10 hetében nem reagáló gyermekeknél és serdülőknél.
Adalimumab (ADA) alkalmazásakor: 40 kg alatti betegeknél 40 mg a 0. héten, majd 20 mg a 2. héten. Ha hamarabb szükséges elérni a terápiás hatást, akkor a készítmény alkalmazható a 0. héten 80 mg, a 2. héten 40 mg dózisban annak tudatában, hogy az indukciós kezelés során nagyobb a mellékhatások kockázata. 40 kg feletti betegeknél 80 mg a 0. héten, majd 40 mg a 2. héten. Ha hamarabb szükséges elérni a terápiás hatást, akkor a készítmény alkalmazható a 0. héten 160 mg (a dózis beadható 4 injekcióban egyetlen napon, vagy napi 2 injekcióban két egymást követő napon), a 2. héten 80 mg dózisban annak tudatában, hogy az indukciós kezelés során nagyobb a mellékhatások kockázata.
5.5. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése gyermekkori Crohn-betegségben
5.5.1. Luminalis Crohn-betegség esetén az indukciós kezelést követő 6. héten (12. hét) legalább 50%-os vagy 15 pontos PCDAI csökkenés, és a PCDAI 30 pont alá esése esetében az indukciós kezelést hatékonynak tekintjük.
5.5.2. Fisztulázó kórforma esetében hatékony a kezelés, ha a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése igazolható.
5.5.3. Szteroid dependens kórforma esetében az anti-TNF-α kezelést hatékonynak tekintjük, ha az indukciós kezelés végére a szteroid dózisa legalább a felére csökkenthető. Kombinált kórformákban bármely fenti kritérium teljesítése esetében indokolt a fenntartó kezelés.
6. Fenntartó kezelés gyermekkori Crohn-betegségben
6.1. Megfelelő válaszkészség (3 hónap alatt) PCDAI minimum 50%-os vagy 15 pontos csökkenése, és a PCDAI 30 pont alá süllyedése, illetve fisztulával szövődött CD esetén drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése esetén fenntartó kezelés folytatása javasolt önmagában vagy immunszuppresszív terápiával együtt. A finanszírozó maximum egy éves biológiai terápiát finanszíroz. Relapszus esetén ismételt terápia megkísérelhető.
Amennyiben 6 hónapnál hamarabb lesz relapszus, akkor a fenntartó kezelési séma (8 hetente) javasolt. Ha ennél hosszabb idő telik el, akkor az indukciós sémát célszerű alkalmazni.
6.2. A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni.
7. Szövődmények monitorozása, ellenőrzése
7.1. Opportunista infekciók
7.2. Malignus betegségek
7.3. Neurológiai eltérések
7.4. Secundaer autoimmun betegségek
8. Crohn-betegség betegnapló
| 8.1. Név: TAJ: Diagnózis: Dátum: 20..........hó .....nap -tól .......hó .....nap-ig 8.2. Laza, hasmenéses székletek száma, naponta: | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | összesen | ||||
| 8.3. Hasi fájdalom mértéke, naponta: (0=nincs, 1=enyhe, 2=tűrhető, 3=erős) | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | összesen | ||||
| 8.4. Általános állapota, naponta: (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen) | |||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | összesen | ||||
| 8.5. Észlelt tünetek a héten: | (0=nem volt/nincs, | 1=volt/van) | |||||||||
| Szem tünet Bőr tünet Belső sipoly Végbél fisszúra, fisztula, tályog | Láz 37,5 fok felett Izületi fájdalom Száj-garat fekély Egyéb/megjegyzés | ||||||||||
| 8.6. A hasmenés miatt gyógyszert (bélmozgást csökkentő szerek) vett be a héten: | |||||||||||
| (0=nem, 1=igen) | |||||||||||
| 8.7. Aktuális testsúlya: ........ kg | |||||||||||
9. A gyermekkori Crohn-betegség finanszírozásának ellenőrzési kritériuma
9.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
9.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
9.1.2. Betegadatok (online TAJ ellenőrzés)
9.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
9.2. Szakmai ellenőrzési pontok
9.2.1. A diagnózis kritériumainak rögzítése (BNO: K5001, K5011, K5081), klinikai súlyosság meghatározása az alábbi kritériumok alapján (PCDAI: Pediatric Crohn-betegség aktivitási index, 0-100)
9.2.1.1. Hasi fájdalom, hasmenések száma, vér a székletben
9.2.1.2. Általános állapot
9.2.1.3. Láz, extraintestinalis manifesztáció (pl.: arthritis, uveitis)
9.2.1.4. Perirectalis elváltozás
9.2.1.5. Abdominalis terime
9.2.1.6. Súlycsökkenés, növekedési elmaradás
9.2.1.7. Haematokrit, albumin, süllyedés/CRP
9.2.2. A betegség aktivitásának meghatározása (PCDAI: Pediatric Crohn-betegség aktivitási index) és dokumentálásának ellenőrzése (fisztulázó formában: PDAI, illetve gyermekkorban az aktív fisztulák számának követése, a javulás rögzítése)
9.2.2.1. Inaktív betegség: PCDAI≤10
9.2.2.2. Közepesen súlyos: 10<PCDAI≤30
9.2.2.3. Súlyos: 30<PCDAI<100
9.2.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
9.2.3.1. TBC kizárása (mellkas RTG)
9.2.3.2. Egyéb akut és krónikus fertőzések kizárása (pl.: hepatitis B és C szűrés)
9.2.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok alapján)
9.2.3.4. Kardiológiai vizsgálat
9.2.3.5. Labor rutin, immun
9.2.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
9.2.4.1. 3 havonta: labor (Vérkép, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K, Ca, összfehérje, albumin, amiláz vagy lipáz)
9.2.4.2. 3 havonta: aktivitási index (PCDAI vagy az aktív fisztulák számának meghatározása és dokumentálása)
9.2.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
9.3. Megjegyzés
9.3.1. Fisztulázó Crohn-betegség esetén antibiotikum-terápia, drenázs és immunszuppresszív kezelés (1)
9.3.2. Immunszuppresszív, immunmoduláns terápia: kellő odafigyelést igényel a készítmények törzskönyvi indikációja gyermekek esetén (2)
9.3.3. TNF alfa gátlók: infliximab, adalimumab (3)
10. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
10.1. A területre fordított közkiadások alakulása.
10.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
11. A finanszírozás szempontjából lényeges finanszírozási kódok
11.1. Releváns BNO kódok
| 1 | A | B |
| BNO | BNO megnevezése | |
| 2 | K5001 | Terápiarezisztens vékonybél Crohn-betegség |
| 3 | K5011 | Terápiarezisztens vastagbél Crohn-betegség |
| 4 | K5081 | Terápiarezisztens vastag- és vékonybél Crohn-betegség |
| 5 | K5012 | Vastagbél Crohn-betegség fisztulával |
| 6 | K5082 | Vékony- és vastagbél Crohn-betegség fisztulával |
11.2. Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EA06 | budesonid | Szteroid | Szteroid gyógyszerek |
| 3 | A07EC01 | szulfasalazin | DMARD | Betegségmódosító szerek |
| 4 | A07EC02 | mesalazin | DMARD | Betegségmódosító szerek |
| 5 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 6 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 8 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 9 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 10 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
11.3. Tápszerek
| A | B | C | |
| 1 | ATC kód | Név | Hatóanyag |
| 2 | V06D | ALFARÉ | egyéb tápszerek |
| 3 | V06D | ELEMENTAL 028 EXTRA LIQUID (FLAVOURED) | egyéb tápszerek |
| 4 | V06D | MODULEN IBD | egyéb tápszerek |
| 5 | V06D | SURVIMED OPD | egyéb tápszerek |
| 6 | V06D | NUTRIDRINK | egyéb tápszerek |
| 7 | V06D | FRESENIUS ENERGY | egyéb tápszerek |
12. Rövidítések:
ATC Anatomical Therapeutic Chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
HBCS Homogén betegségcsoport
OENO Orvosi eljárások nemzetközi osztályzása"
23. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"20. melléklet a 31/2010. (V. 13.) EüM rendelethez
A stroke elsődleges megelőzésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Stroke/TIA primer prevenció (BNO: G45, I63)
2. A primer prevenció fontossága
2.1. A primer prevenciót más néven elsődleges megelőzésnek is nevezzük. Célja a betegség kifejlődésének megakadályozása. Történhet orvosi beavatkozással, de az egészségtudatos életmód kialakításának ösztönzése, az egészségre ártalmas hatások kiküszöbölése ugyanolyan fontos szerephez jut. Az agyérbetegségek (stroke) primer prevenciójakor az ischaemiás szívbetegségek, valamint a perifériás obliteratív betegségek megelőzéséről is beszélünk, hiszen a három kórforma patofiziológiai gyökere közös: az arteriosclerosis. A primer stroke-prevenció a primer vaszkuláris prevenció része.
2.2. Az elsődleges prevenció célja a tünetmentes lakosság körében a vaszkuláris, ezen belül a cerebrovaszkuláris kórállapotok megelőzése a kockázati tényezők felismerésével és kezelésével. Az elsődleges megelőzés stratégiája a teljes lakosságot elérő prevenciós stratégia, másodsorban a stroke kockázati tényezői által veszélyeztetett vagy fokozottan veszélyeztetett személyek felkutatása. Az egészséges életmód, a dohányzásmentesség, a normál tartományban lévő testtömeg index, minimális alkoholfogyasztás, a rendszeres testmozgás és az egészséges étkezés az ischaemias stroke kockázatcsökkenését eredményezi.
2.3. A primer stroke prevenció kiemelt területei:
2.3.1. Magas vérnyomás terápia
2.3.2. Cukorbetegség
2.3.3. Lipid csökkentő terápia
2.3.4. Thrombocytaaggregáció-gátló kezelés
2.3.5. Pitvarfibrilláció
2.3.6. Dohányzás elleni küzdelem
2.3.7. Alkohol fogyasztás mérséklése
2.3.8. Testtömeg kontroll
2.3.9. Fizikai aktivitás
2.3.10. Táplálkozás
2.3.11. Genetikai háttér
2.3.12. Ösztrogénpótló terápia postmenopauzában
2.4. Magas vérnyomás terápia
2.4.1. A magas vérnyomás csökkentése életmód-változtatással és egyénre szabott gyógyszeres terápiával ajánlott a 120/80 Hgmm-es célvérnyomás eléréséig. Amennyiben a vérnyomás értéke ezen életmódbeli változtatásokkal nem moderálható, akkor szükséges a gyógyszeres kezelés, amely a Magyar Hipertónia Társaság szakmai ajánlásai szerint történik. A vérnyomást rendszeresen ellenőrizni kell. Antihipertenzív gyógyszeres kezelés alkalmazása szükséges azon prehipertenzív (120-130/80-90 Hgmm) betegekben, akiknek kongesztív szívelégtelensége, myocardialis infarktusa, diabetes mellitusa vagy krónikus veseelégtelensége is van. A cerebrovaszkuláris kórképek szempontjából az izolált szisztolés hipertónia kezelése (szisztolés vérnyomás>140 Hgmm és diasztolés vérnyomás <90 Hgmm) kedvező hatású.
2.4.2. A vérnyomás nem gyógyszeres kezelésétől várható eredmények
| A | B | C | |
| 1 | A kezelés elemei | Ajánlás | Szisztolés vérnyomás csökkentése |
| 2 | Testsúlycsökkentés | Optimális BMI<25kg/m2 elérése vagy fenntartása | -5 és -20 Hgmm között/10 kg fogyás |
| 3 | Sófogyasztás csökkentése | Sófogyasztás (NaCl) csökkentése <6 gramm/nap | -2 és -8 Hgmm között |
| 4 | Mediterrán* étrend alapelveinek betartása | Zöldség, gyümölcs, zsírszegény tejtermékek fogyasztása, telített zsírok fogyasztásának csökkentése, K-, Ca-dús étrend | -8 és -14 Hgmm között |
| 5 | Rendszeres fizikai aktivitás | Rendszeres fizikai aktivitás (30-60 perc/nap) lehetőleg mindennap, az életkornak megfelelő szubmaximális** frekvencián | -4 és -9 Hgmm között |
| 6 | Alkoholfogyasztás moderálása | Nem több mint 2 ital/nap/férfi (25 gramm alkohol) vagy 1 ital/nap/nő (12,5 gramm alkohol) | -2 és -10 Hgmm között |
* DASH diéta: gyümölcsökben, zöldségekben, alacsony zsírtartalmú tejtermékekben gazdag étrend
** Szubmaximális frekvencia = 220-életkor (év) x 0,7
2.4.3. A vérnyomás kezelésének alapelvei:
2.4.4. Ajánlott célvérnyomás értékek hipertóniás betegnél:
| A | B | |
| 1 | Betegcsoport | Célvérnyomás érték (Hgmm) |
| 2 | Hipertóniás populáció (ajánlás: A) | <140/90 |
| 3 | Időskor, izolált szisztolés hipertónia | <140/90 |
| 4 | Diabetes, metabolikus szindrómás hipertóniás populáció | <130/80 |
| 5 | Stroke utáni állapot, igazolt koszorúér- betegség, krónikus vesebetegség | <130/80 |
| 6 | Nephropathia (hipertenzív, diabeteszes)* | <130/80 |
* 1 gramm feletti proteinuria esetén még kisebb lehet a célérték: <125/75 Hgmm
2.4.5. A szív és érrendszeri események veszélyével járó kockázati tényezők
| A | B | C | |
| 1 | Biológiailag meghatározott | Életmóddal összefüggő | Általános |
| 2 | - Magas vérnyomás - Dyslipidaemia - Kóros LDL-CH szint - Határérték alatti HDL-Ch-szint - Kóros trigliceridszint - Magas vércukorszint - Túlsúly/elhízás - Metabolikus szindróma | - Dohányzás - Étrend - Helytelen zsír- és zsírsavbevitel - Alacsony zöldség- gyümölcsfogyasztás - Túlzott alkoholfogyasztás - Mozgásszegény életmód | Nem befolyásolható - Életkor - Nem - Örökölt tényezők - Etnikum Befolyásolható - Iskolázottság - Jövedelem - Életkörülmények - Munkakörülmények - Pszichoszociális stressz |
2.5. Cukorbetegség
Nincs evidencia arra, hogy a vércukorellenőrzés javítása csökkentené a stroke előfordulását. Diabetes mellitus esetén a célvérnyomásérték 130/80 Hgmm vagy az alatti érték.
2.6. Lipidcsökkentő terápia
A lipidcsökkentő sztatin kezelés a stroke prevencióban az egyik legjelentősebb előrelépés az aszpirin és a vérnyomáscsökkentő terápia alkalmazása óta. Kiemelten kell figyelni a veszélyeztetett betegcsoportokat: még nem érbeteg cukorbetegek; tünetmentes nagy kockázatú egyének; koszorúérbetegek. A szérum koleszterinszintjét rendszeresen ellenőrizni kell. A célértékek elérése döntő fontosságú a hatékony prevenció érdekében. A lipid célértékeket az alábbi táblázat tartalmazza:
2.6.1. Kockázatbesorolás az VI. Magyar Kardiovascularis Konszenzus Konferencia ajánlása szerinti kockázati típusok és ennek megfelelő lipid célértékek:
| A | B | |
| 1 | KOCKÁZATBESOROLÁS | |
| 2 | Igen nagy kockázat | |
| 3 | - Akut súlyos állapotok: akut koronária szindróma, stroke, kritikus végtag ischaemia - * Klinikailag igazolt vagy invazív/nem invazív módszerrel dokumentált atheroszklerotikus koronária, cerebralis és perifériás érbetegség - Súlyos krónikus vesebetegség (GFR<30 ml/min/1,73m2 és proteinuria) - Diabetes mellitus (1-es és 2-es típus) és ≥ 1 nagy rizikófaktor (RF), illetve szervkárosodás | |
| - familiaris hypercholesterinaemia - SCORE≥ 10%/10 év | ||
| 4 | * Korábbi myocardialis infarktus, ischaemias stroke, TIA, aorta aneurizma, koronaria (PCI), CABG/carotis/perifériásrevaszkularizációs beavatkozás; koronaria angiográfia, UH, MR, CT, stressz-echokardiográfia, v. SPECT, carotis IMT, coronaria calcium score. RF: Nagy kockázati tényezők: életkor, dohányzás, hipertónia, magas koleszterin szint. | |
| 5 | Nagy kockázat | |
| 6 | - Kardiovaszkuláris tünetek nélküli szubklinikus ateroszklerózis - Nem invazív módszerrel kimutatott ateroszklerózis v. plakk (UH, MR, CT) - Boka-kar index ≤ 0,9 - Diabetes mellitus (1-es és 2-es típus) és 0-1 nagy rizikófaktor (RF) - Krónikus vesebetegség (eGFR 30-60 ml/min/1,73 m2, illetve proteinuria) - Familiaritás(korai CV-esemény, férfi <55 év, illetve nő< 65 év) - Egyes súlyos rizikófaktorok: (önállóan) - RR>180/110 Hgmm - Atherogén dyslipidaemia, egyéb familiaris atherogen dyslipidaemiák - Testtömegindex (BMI)> 40 kg/m2 - metabolikus szindróma - SCORE5-10%/10 év között | |
| 7 | Közepes kockázat | |
| 8 | - ≥ 2 nagy rizikófaktor (RF) - SCORE 1-5%/10 év között | |
| 9 | Kis kockázat | |
| 10 | - 0-1 nagy rizikófaktor (RF) - SCORE≤ 1,0%/10 év | |
| 11 | CÉLÉRTÉKEK LIPIDANYAGCSERÉBEN | |
| 12 | Igen nagy kockázat * (lásd kockázatbesorolás) | Nagy kockázat* (lásd kockázatbesorolás) |
| 13 | Koleszterin (Ch) < 3,5 mmol/l LDL-Ch < 1,8 mmol/l ** Non-HDL-Ch < 2,6 mmol/l Triglycerid < 1,7 mmol/l HDL-Ch > 1,0 mmol/l (férfi) > 1,3 mmol/l (nő) * Akut koronária szindróma, ischaemiás stroke és kritikus végtag ischaemia esetén a Ch értéktől függetlenül maximálisan tolerált adagú, nagy hatékonyságú statin (rosuvastatin, atorvastatin) kezelés javasolt. | Kolesztein Ch < 4,5 mmol/l LDL-Ch < 2,5 mmol/l ** Non-HDL-Ch < 3,3 mmol/l Triglicerid < 1,7 mmol/l HDL-Ch > 1,0 mmol/l (férfi) > 1,3 mmol/l nő) |
| 14 | A cél az LDL koleszterin csökkentése, amelyben a statinok preferálandók. Ha az LDL célérték statin monoterápiával nem érhető el, kombinációs antilipidaemiás kezelés javasolt ezetimib hozzáadásával. Hypertriglyceridaemia vagy atherogén dyslipidaemia társulása esetén a statinok kombinációja fibrát, esetleg omega -3 zsírsav alkalmazásával megfontolható. ** Non-HDL-Ch másodlagos cél lehet, célértékei 0,8 mmol/l-rel nagyobbak, mint az adott kategóriára előirányzott LDL-Ch célérték. |
2.6.2. Metabolikus szindróma
A metabolikus szindróma elnevezés több faktor gyakori együttes előfordulására utal. Ezek a centrális elhízás, a hipertónia, az alacsony HDL-koleszterin, az emelkedett triglicerid, az emelkedett vércukor.
A klinikai gyakorlatban az IDF (International Diabetes Federation) által megalkotott új definíció használható a metabolikus szindrómában szenvedő betegek felismerésére.
A diagnózis felállítható, ha a testsúlyfelesleg igazolható:
1. derékbőség ≥ 94 cm férfiaknál, ≥ 80 nőknél;
és az alábbiakból 2 vagy több egyszerre van jelen:
2. szérumtrigliceridszint ≥ 1,7 mmol/l, vagy emiatt specifikus kezelés;
3. HDL-koleszterin férfiaknál ≤ 1 mmol/l, illetve nőknél ≤ 1,3 mmol/l, vagy emiatt specifikus kezelés;
4. vérnyomás ≥130/85 Hgmm, vagy antihipertenzív kezelés;
5. vércukor ≥ 5,6 mmol/l vagy 2-es típusú diabetesz.
2.7. Thrombocytaaggreggáció-gátló kezelés
Első választandó szer az aszpirin. Az aszpirin ma elfogadott prevenciós dózisa: 75-150 mg/nap.
Thrombocytaaggregáció-gátló kezelés indokolt lehet pl.:
- diabetes mellitusban;
- ha beállított vérnyomás mellett a SCORE rizikó magas (>10%).
2.8. Pitvarfibrilláció (PF)
A pitvarfibrilláció a stroke erős, független rizikófaktora. A CHADS2-skála alkalmazásával a pitvarfibrilláló betegek stroke-veszélye mérhetővé válik, és segítségével megtervezhető az antikoaguláns kezelés.
2.8.1. A CHADS2-skála a pitvarfibrilláló betegek stroke-veszélyének mérésére:
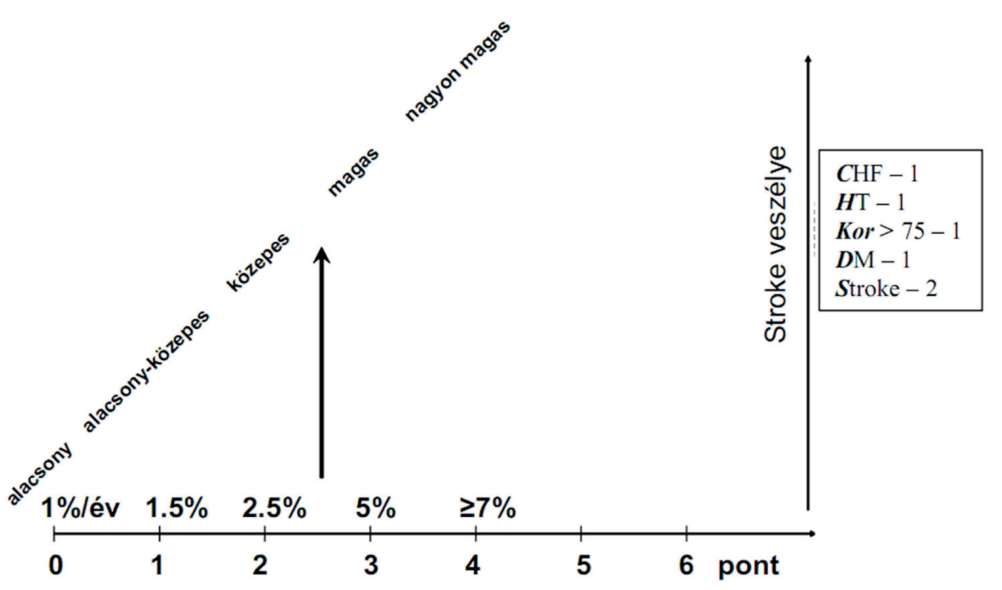
CHF: pangásos szívelégtelenség, HT: magas vérnyomás, életkor>75 felett. DM: diabetes mellitus 1 pontot, lezajlott stroke 2 pontot jelent. A nyíl azt jelzi, hogy ha a pontszám ≥2, a beteg antikoagulálandó. A % az éves stroke-veszélyt jelenti.
A CHADS2 szerint 0 vagy 1 pontot elérő betegeknél, vagy azoknál, akiknél a stroke kockázatának részletesebb értékelésére van szükség, átfogóbb, kockázati tényezőkön alapuló megközelítés alkalmazása ajánlott, amely kiterjed a thromboembólia további kockázati tényezőire is.
2.8.2. A stroke CHADS-VASC pontszám szerint megadott gyakorisága:
| A | B | C | |
| 1 | a) A stroke és a thromboembólia kockázati tényezői nonvalvuláris PF-ben | ||
| 2 | Major kockázati tényezők | "Klinikailag fontos, nem major" kockázati tényezők | |
| 3 | Korábbi stroke, TIA, illetve szisztémás embólia 75 év vagy magasabb életkor | Szívelégtelenség, illetve mérsékelt vagy súlyos bal kamrai szisztolés diszfunkció (pl. BKEF ≤40%) Hipertónia - diabetes mellitus Női nem - 65-74 év közötti életkor Érbetegség | |
| 4 | b) Egy CHA2DS2-VASc-nak rövidített pontozási rendszer formájában kifejezett, kockázati tényezőkön alapuló megközelítés (A maximális pontszám 9, mivel a kor 0, 1 vagy 2 pontot jelenthet) | ||
| 5 | Kockázati tényező | Pontszám | |
| 6 | Kongesztív szívelégtelenség/balkamra-diszfunkció | 1 | |
| 7 | Hipertónia | 1 | |
| 8 | 75 év feletti életkor | 2 | |
| 9 | Diabetes mellitus | 1 | |
| 10 | Stroke/TIA/tromboembólia | 2 | |
| 11 | Érbetegség | 1 | |
| 12 | 65-74 év közötti életkor | 1 | |
| 13 | Női nem | 1 | |
| 14 | Maximális pontszám | 9 | |
| 15 | c) A stroke CHA2DS2-VASc pontszám szerint megadott gyakorisága | ||
| 16 | CHA2DS2-VASC pontszám | Betegek (n=7329) | A strokekiigazított gyakorisága (%/év) |
| 17 | 0 | 1 | 0% |
| 18 | 1 | 422 | 1,3% |
| 19 | 2 | 1230 | 2,2% |
| 20 | 3 | 1730 | 3,2% |
| 21 | 4 | 1718 | 4,0% |
| 22 | 5 | 1159 | 6,7% |
| 23 | 6 | 679 | 9,8% |
| 24 | 7 | 294 | 9,6% |
| 25 | 8 | 82 | 6,7% |
| 26 | 9 | 14 | 15,2% |
2.8.3. A pitvarfibrilláló betegeknél stroke-prevenció céljából alkalmazott orális antikoaguláció klinikai folyamatábrája:
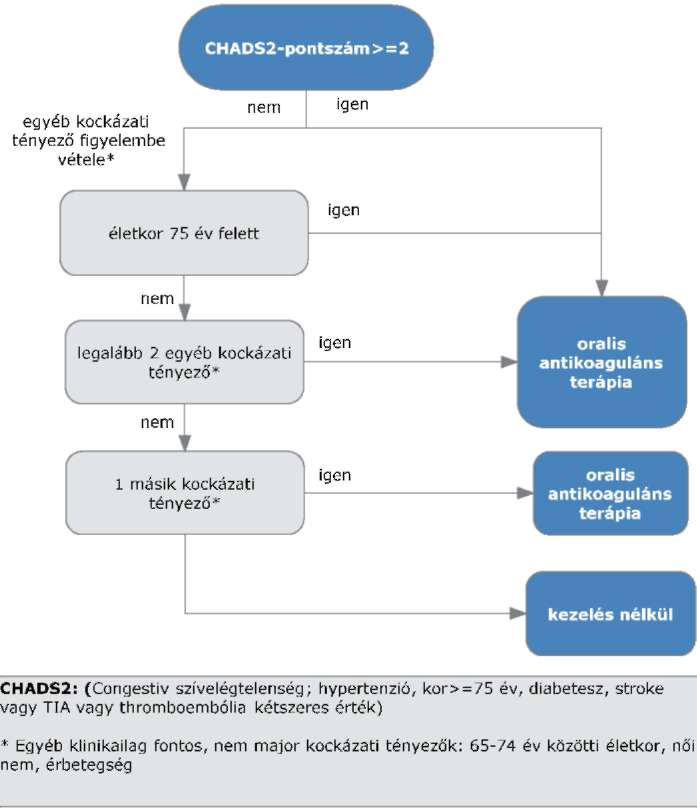
2.8.4. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható új típusú oralis antikoaguláns készítmények stroke és szisztémás embolizáció megelőzésére nem billentyű eredetű pitvarfibrillációban szenvedő felnőtt betegeknél, ha 6 hónapot meghaladó K-vitamin antagonista (acenocumarol, illetve warfarin) kezelés során a mért INR értékek kevesebb, mint 60%-a esik terápiás tartományba (INR 2 és 3 közé)
- korábbi stroke, vagy tranziens ischaemias attack (TIA), vagy szisztémás embolizáció esetén, vagy a következő kockázati tényezők közül legalább kettő fennállása esetén:
- bal kamrai ejekciós frakció < 40%,
- tünetekkel járó szívelégtelenség ≥ New York Heart Association (NYHA) II. stádium,
- életkor ≥ 75 év,
- életkor ≥ 65 év, a következők valamelyikével: diabetes mellitus, koszorúér-betegség vagy hypertonia:
dabigatran etexilate, rivaroxaban, apixaban (Eü70 26.).
2.8.5. Az a. carotisok állapotának megítélése
Több rizikófaktorral jelentkező betegek esetén mindenképpen indokolt a carotisok állapotát fizikális vizsgálat keretében is ellenőrizni és a carotisokra ráhallgatni még akkor is, ha a beteg tüneteket nem említ. Stenosisra a carotis feletti hallható systoles zörej utalhat. Tünetmentes betegeknél a carotis felett hallható zörej indokolja a betegek szakorvoshoz (neurológus, érsebész) irányítását alaposabb kivizsgálás céljából. A kivizsgálás során non-invazív vizsgálómódszerekkel szükséges megerősíteni az invazív beavatkozások szakmai indokoltságát:
2.8.5.1 a plaque szerkezetének a vizsgálata (UH),
2.8.5.2 a néma infarktusok kizárása (CT, MRI),
2.8.5.3 az intracranialis erek további (esetleg multiplex) stenosisának diagnosztizálása (CTA vagy MRA indokolt esetben DSA).
2.8.6. Invazív beavatkozások:
2.8.6.1 CEA (carotis endarterectomia)
Tünetmentes betegeknél, amennyiben a carotis szűkület súlyossága >70% és a stroke rizikó magas (UH-val igazolt instabil plaque), elsősorban CEA végzése javasolt, ha a várható élettartam legalább 3-5 év, a myocardialis infarctus és a halálozás kockázata alacsony. A műtét olyan intézményben vállalható, ahol a perioperatív stroke/halálozási ráta 3%-nál kisebb.
2.8.6.2 CAS (a. carotis stent)
Tünetmentes betegeknél - amennyiben a carotis szűkület súlyossága >70%, a plaque instabil - CAS választható a CEA kiváltására elsősorban a magas cardiovascularis rizikójú, illetve a műtét szempontjából kockázatos betegnél (pl.: korábbi műtét, thracheostoma, irradiatio, szöveti fibrosis stb.).
Mindkét beavatkozás után indokolt az azonos oldali, illetve ellenoldali carotisok ultrahang vizsgálattal való követése a rekonstrukció után 1 és 6 hónap múlva, majd 1, illetve 2 év múlva.
2.9. Dohányzás elleni küzdelem
A dohányzás mindkét nemnél az ischaemiás stroke kialakulásának független rizikófaktora.
A dohányzás fokozza az artériák merevségét, emeli a fibrinogénszintet, fokozza a thrombocyták aggregációját, csökkenti a HDL-koleszterin-szintet és növeli a hematokrit értéket. Kimutatták, hogy a dohányzás duplájára emeli az ischaemiás stroke kialakulásának a rizikóját. Azok, akik a dohányzásról leszoknak, 50%-kal csökkentik ezt a kockázatot. A passzív dohányzás is emelheti a stroke kockázatát. Ajánlott a dohányzásról való teljes leszokás.
2.10. Alkoholfogyasztás
A túlzott alkoholfogyasztás (>60 g/nap) növeli mind az ischaemia-s, mind a vérzéses stroke kialakulásának kockázatát. Ajánlott a túlzott alkoholfogyasztásról való leszokás. Kimutatták, hogy az alkohol fogyasztás mérséklésével 2-10 Hgmm közötti szisztolés vérnyomás csökkenést lehet elérni (ld. 2.4.2. táblázat)
2.11. Testtömeg kontroll (ld. 2.4.2.)
A magas testtömegindex (BMI≥25) fokozott stroke-kockázattal jár mindkét nemben, részben az ennek következtében kialakuló magas vérnyomás és diabetes mellitusnak köszönhetően. Az abdominalis elhízás a férfiaknál stroke-rizikófaktor. Kimutatták, hogy testsúlycsökkentéssel, az optimális BMI (<25kg/m2) elérésével és megtartásával 5-20 Hgmm/10 kg közötti szisztolés vérnyomás csökkenést lehet elérni (ld. 2.4.2. táblázat). A magas testtömeg-indexszel rendelkezők testsúlycsökkentő diétája feltétlenül ajánlott.
2.12. Fizikai aktivitás (ld. 2.4.2.)
Kimutatták, hogy a magas fizikai aktivitású egyének stroke-rizikója kisebb volt az alacsony aktivitásúakénál. Ez az összefüggés részben a mozgás testsúlyra, vérnyomásra, szérumkoleszterinre és glükóz toleranciára kifejtett jótékony hatásának köszönhető. A rendszeresen végzett szabadidős fizikai aktivitás (2-5 óra hetente) összefüggést jelez a felvételnél megfigyelt enyhébb tünetekkel járó ischaemiás stroke-kal és a jobb rövid távú kimenetellel. Kimutatták, hogy a rendszeres, hetente legalább 3-4 alkalommal végzett közepes intenzitású fizikai aktivitás (30-60 perc/nap), az életkornak megfelelő szubmaximális frekvencián [220-életkor(év) x 0,7] akár 4 és 9 Hgmm közötti szisztolés vérnyomás csökkenést eredményezhet (ld. 2.4.2. táblázat). A rendszeres fizikai aktivitás megtervezése - akár orvosi segítséggel is - feltétlenül szükséges.
2.13. Táplálkozás (ld. 2.4.2.)
Zöldség-, gyümölcs-, halfogyasztás
Megfigyelték, hogy a magas zöldség- és gyümölcsfogyasztás a stroke-rizikó csökkenését segíti elő. Az ischaemiás stroke kialakulásának rizikója kisebb volt azoknál, akik havonta legalább egyszer halat fogyasztottak. Kimutatták, hogy a sófogyasztás (NaCl) mérséklése (<6 gramm/nap) 2-8 Hgmm közötti szisztolés vérnyomás csökkenést eredményezhet. A mediterrán étrend alapelveinek betartása: zöldség, gyümölcs, zsírszegény tejtermékek fogyasztása, telített zsírok fogyasztásának csökkentése, K-, Ca-dús étrend pedig 8-14 Hgmm közötti szisztolés vérnyomás csökkenést eredményezhet (ld. 2.4.2. táblázat). Összefoglalva alacsony só-, alacsony telített zsírsav-, magas zöldség- és gyümölcstartalmú, rostokban gazdag diéta fogyasztása ajánlott.
2.14. Genetikai háttér szerepe
Az alábbi genetikai rendellenességek mellett fordulhat elő gyakrabban ischaemiás stroke: homocysteinuria, dyslipidaemia, Fabry-féle betegség, haemoglobinopathiák, polycythaemia, coagulopathiák.
A fenti kórállapotok orvos szakmai szempontok szerinti megfelelő kezelése kiemelten fontos.
2.15. Postmenopauzális ösztrogénpótló kezelés
A stroke kockázata nőknél hirtelen megemelkedik menopauzában. Kimutatták, hogy az egészséges nőknél végzett hormonpótlás az ischaemiás stroke rizikóját emeli. A stroke kockázata - vélhetően - csak a hosszú távú hormonpótló kezelés esetén növekszik (>5 év).
3. Az ellenőrzés alapját képező finanszírozás szempontból lényeges sarokpontok
A finanszírozási ellenőrzés során elsődlegesen azt vizsgáljuk, hogy a kezelő orvosok betartják-e a kihirdetett finanszírozási rendet, különös tekintettel a következő főbb ellenőrzési sarokpontokra, melyek természetesen az ellenőrzés céljának megfelelően változhatnak.
3.1. A hipertóniás betegek vérnyomáscsökkentő kezelésben részesülnek?
3.2. Antihipertenzív szerek bevezetése előtt a betegek rizikócsoportba sorolása megtörtént és dokumentált?
3.3. A betegdokumentáció alátámasztja, hogy a beteg vérnyomását kontrollálták?
3.4. A pitvarfibrilláló betegek antikoaguláns kezelésben részesülnek?
3.5. A betegek részesülnek lipid csökkentő terápiában, amennyiben a laborértékeik ezt alátámasztották?
3.6. A lipidcsökkentésben sztatint alkalmaztak?
4. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
4.1. A finanszírozási eljárásrend hatását a következő indikátorokkal kívánjuk mérni:
4.1.1. A területre fordított közkiadások alakulása.
4.1.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
4.2. Rövidtávon értékelhető mutatók:
4.2.1. Antithrombotikus terápiában részesült betegek aránya
4.2.2. Pitvarfibrilláló betegek esetében a CHADS2≥2 pontszám mellett antikoagulált, és a terápiás tartományban antikoagulált betegek aránya
4.2.3. Lipidcsökkentő terápiában részesült betegek aránya
4.2.4. A lipidcsökkentő terápia során sztatin kezelésben részesült betegek aránya
4.2.5. A vérnyomáscsökkentő terápiában részesült betegek aránya
4.3. Hosszútávon értékelhető mutatók:
4.3.1. Kockázati tényezők miatt gondozásba vett betegek számának alakulása
4.3.2. Cerebrovaszkuláris thrombotikus epizódok száma
4.3.3. Stroke után dependens (önálló életvitelében valamilyen formában segítségre szoruló) betegek számának alakulása
4.3.4. Stroke miatt meghalt betegek számának alakulása
5. A finanszírozás szempontjából lényeges finanszírozási kódok
Az alábbiakban felsoroljuk a fontosabb finanszírozási kódokat, tájékoztatási céllal.
5.1. Fontosabb BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | G4500 | Vertebrobasilaris syndroma |
| 3 | G4510 | Arteria carotis syndroma (féltekei) |
| 4 | G4520 | Többszörös és kétoldali praecerebralis arteria syndromák |
| 5 | G4530 | Amaurosis fugax |
| 6 | G4580 | Egyéb, átmeneti agyi ischaemiás attakok és rokon syndromák |
| 7 | G4590 | Átmeneti agyi ischaemiás attak (TIA) k.m.n. |
| 8 | I6300 | Agyi infarctus a praecerebralis ütőerek rögösödése miatt |
| 9 | I6310 | Agyi infarctus a praecerebralis ütőerek emboliája miatt |
| 10 | I6320 | Agyi infarctus a praecerebralis art. k.m.n. elzáródása-szűkülete miatt |
| 11 | I6330 | Agyi infarctus a cerebralis ütőerek rögösödése miatt |
| 12 | I6340 | Agyi infarctus a cerebralis ütőerek emboliája miatt |
| 13 | I6350 | Agyi infarctus a cerebralis art. k.m.n. elzáródása-szűkülete miatt |
| 14 | I6360 | Agyi infarctus az agyi visszerek nem suppurativ rögösödése miatt |
| 15 | I6380 | Agyi infarctus, egyéb |
| 16 | I6390 | Agyi infarctus, k.m.n. |
| 17 | E7800 | Tiszta hypercholesterinaemia |
| 18 | E7820 | Kevert hyperlipidaemia |
| 19 | E7840 | Egyéb hyperlipidaemia |
| 20 | E7850 | Hyperlipidaemia, k.m.n. |
| 21 | I48H0 | Pitvari fibrillatio és flutter |
5.2. Fontosabb OENO kódok:
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 11301 | Kontrollvizsgálat, konzílium |
| 4 | 88460 | Vérvétel |
| 5 | 28620 | Prothrombin meghatározása |
| 6 | 28610 | Thrombin idő meghatározása |
| 7 | 28621 | Aktivált parciális thromboplasztin idő |
| 8 | 3612D | Echocardiographia color Doppler |
| 9 | 12601 | EKG végtag és mellkaselvezetéssel |
| 10 | 3617A | Duplex UH, nyaki erek |
| 11 | 36112 | Nyaki erek UH vizsgálata |
| 12 | 3616C | Transcraniális Doppler vizsgálat |
| 13 | 34410 | Agykoponya natív CT vizsgálata |
| 14 | 34490 | CT angiográfia koponya |
| 15 | 34411 | Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
| 16 | 34915 | Agykoponya MR vizsgálat natív plusz iv. kontrasztanyag adását követőleg |
| 17 | 34948 | MR angiográfia, iv. kontrasztanyag adása nélkül |
| 18 | 34949 | MR angiográfia, iv. kontrasztanyag adásával |
| 19 | 33341 | Szelektív arteriographia - további ágak, áganként |
| 20 | 33351 | Szuperszelektív arteriographia - további ágak, áganként |
5.3. Fontosabb HBCs kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 01M015D | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, rt-PA kezeléssel |
| 3 | 01M015A | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, speciális kezeléssel |
| 4 | 01M015C | Cerebrovascularis betegségek speciális vizsgálatokkal igazolva |
| 5 | 01M015F | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, speciális kezelés nélkül 18 év felett |
| 6 | 01M0210 | Hypertensiv encephalopathia |
| 7 | 01M0160 | Átmeneti ischaemiás agyi keringészavar (TIA) |
| 8 | 01M0170 | Egyéb cerebrovascularis rendellenességek |
5.4. Fontosabb ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | B01AC04 | clopidogrel |
| 3 | B01AC05 | ticlopidin |
| 4 | B01AC06 | acetilszalicilsav |
| 5 | B01AC30 | thrombocyta aggregatiót gátlók kombinációi, kivéve heparin |
| 6 | B01AD02 | alteplase |
| 7 | C10AA01 | simvastatin |
| 8 | C10AA05 | atorvastatin |
| 9 | C10AA07 | rosuvastatin |
| 10 | C10AX09 | ezetimibe |
| 11 | C10BA02 | ezetimibe és simvastatin |
| 12 | C10BA05 | atorvasztatin és ezetimibe |
| 13 | C09A | ACE-inhibitorok önmagukban |
| 14 | C09B | ACE-inhibitorok kombinációban |
| 15 | C09CA | angiotensin II antagonisták önmagukban |
| 16 | C09D | angiotensin II antagonisták kombinációi |
| 17 | C07AB02 | metoprolol |
| 18 | C07AB07 | bisoprolol |
| 19 | C07AB12 | nebivolol |
| 20 | C07AG02 | carvedilol |
| 21 | C07BB07 | bisoprolol+thiazidok |
| 22 | C07FB02 | metoprolol+egyéb vérnyomáscsökkentők |
| 23 | B01AA03 | warfarin |
| 24 | B01AA07 | acenokumarol |
| 25 | B01AB04 | dalteparin |
| 26 | B01AB05 | enoxaparin |
| 27 | B01AB06 | nadroparin |
| 28 | B01AB12 | bemiparin |
| 29 | B01AE07 | dabigatran etexilate |
| 30 | B01AX06 | rivaroxaban |
| 31 | B01AF02 | apixaban |
6. Fogalmak, rövidítések:
ACE-gátlók: angiotenzin- konvertáló enzim gátlók
ASA: acetilszalicilsav
ARB: angiotenzin receptor blokkolók
CAS: a. carotis stent
CEA carotis endarterectomia
INR: Nemzetközi Normalizált Ráta
NOAC: novel oral anticoagulans
PF: pitvarfibrilláció
SR: lassú felszívódású készítmény
TIA: átmeneti agyi keringészavar (tranziens ischaemiás attak)"
24. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"21. melléklet a 31/2010. (V. 13.) EüM rendelethez
Az újabb stroke megelőzésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Ischaemiás stroke/TIA szekunder prevenció (BNO: G45, I63)
2. Kórkép leírása
2.1. A szekunder prevenció fontossága
2.2. Bevezetés
Az első stroke-ot követő korai időszakban az újabb stroke valószínűsége igen nagy. Legmagasabb az első évben: 10-12%; 2-5 éven belül 5-8%. A legmagasabb ismétlődési rizikóval az atherothromboticus stroke esetén kell számolni. Az agyérbetegséghez társuló rizikófaktorok jelentősen növelik az ismétlődés kockázatát.
2.3. A szekunder stroke prevenció kiemelt területei:
- Lipidcsökkentő terápia
- Antihipertenzív terápia
- Antithrombotikus terápia (thrombocyta aggregáció gátló kezelés; antikoaguláns kezelés)
- Carotis endarterectomia
- Dohányzás elleni küzdelem és az egyéb életmódbeli kockázati tényezők mérséklése
- Pitvarfibrilláció kezelése
2.3.1. Lipidcsökkentő terápia
Ischemiás stroke és TIA után minden beteg részesüljön lipidcsökkentő terápiában. Először választandó szer a sztatin. Mivel a post-stroke betegek igen nagy kockázatúak, a koleszterin célérték<3,5 mmol/l és az LDL-C< 1,8 mmol/l legyen. A célérték mellett az LDL-C több, mint 50%-os csökkentése is cél. A célérték elérésére sztatin, ezetimibe, fibrát, nikotinsav vagy a célérték el nem érése esetén a koleszterin felszívódást és szintézisét is gátló kombinációt kell alkalmazni.
2.3.1.1. A lipidcsökkentő terápia menete
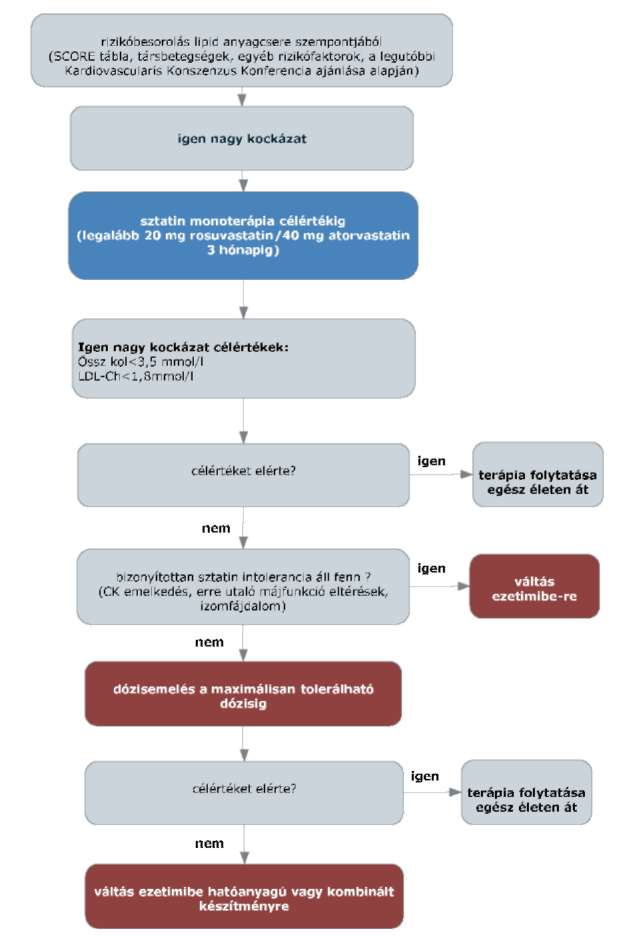
2.3.1.2. Az LDL-kolszterinszint emelkedéssel járó állapotokban első választandó szerek a sztatinok.
2.3.1.3. Emelt társadalombiztosítási támogatással adható készítmények:
Bizonyítottan cerebrovaszkuláris eseményen (TIA, stroke) átesett beteg számára, igen nagy kardiovaszkuláris rizikó és hyperlipidaemia esetén, ha legalább 20 mg rosuvastatinnal vagy legalább 40 mg atorvastatinnal folytatott három hónapos kezelést követően laborkontroll alapján nem sikerült a kívánt célérték elérése (LDL 1,8 mmol/l, össz. Chol. 3,5 mmol/l), vagy amennyiben bizonyíthatóan sztatin intolerancia (CK emelkedés, egyértelműen sztatin terápiára visszavezethető szignifikáns májfunkció eltérés) áll fenn. Az ezetimibe hatóanyagú készítmény alkalmazása javasolt akkor is, ha bizonyított mellékhatás miatt csak kisebb adag sztatin szedése lehetséges, amely mellett nem sikerült a célérték elérése: ezetimibe és ezetimibe hatóanyagú kombinációs készítmények.
2.3.2. Magas vérnyomás kezelése
A vérnyomás fokozatos csökkentése ajánlott minden stroke betegnél. A hirtelen csökkenő perfúziós nyomás miatt, súlyos nagyérszűkület vagy többszörös érszűkület fennállása esetén fokozódik a haemodinamikai stroke kockázata. A célvérnyomás legyen kevesebb, mint 140/90 Hgmm, ha ezt a beteg tolerálja. Még alacsonyabb érték elérésére kell törekedni (<130/80 Hgmm), ha a betegnek lacunaris stroke-ja volt és diabéteszben szenved. (A normális vérnyomás definíció szerint 120/80 Hgmm alatti érték).
A vérnyomáscsökkentő terápia megkezdésének ideális időpontja bizonytalan, de a kórházi elbocsátás előtt már szükséges megkezdeni.
Az alkalmazott gyógyszerkészítmények a betegek társbetegségeitől is függenek.
- Az ACEI (vagy ARB) + Ca-csatorna blokkoló [vagy diuretikum az idősebbekben (>65 év)] preferálandó, mivel a Ca-csatorna blokkoló és a diuretikum csökkenti a vérnyomás variabilitást.
- Stroke-ot követően kiemelten fontos a vérnyomás rendszeres ellenőrzése.
2.3.2.1. A vérnyomáscsökkentő terápia menete:
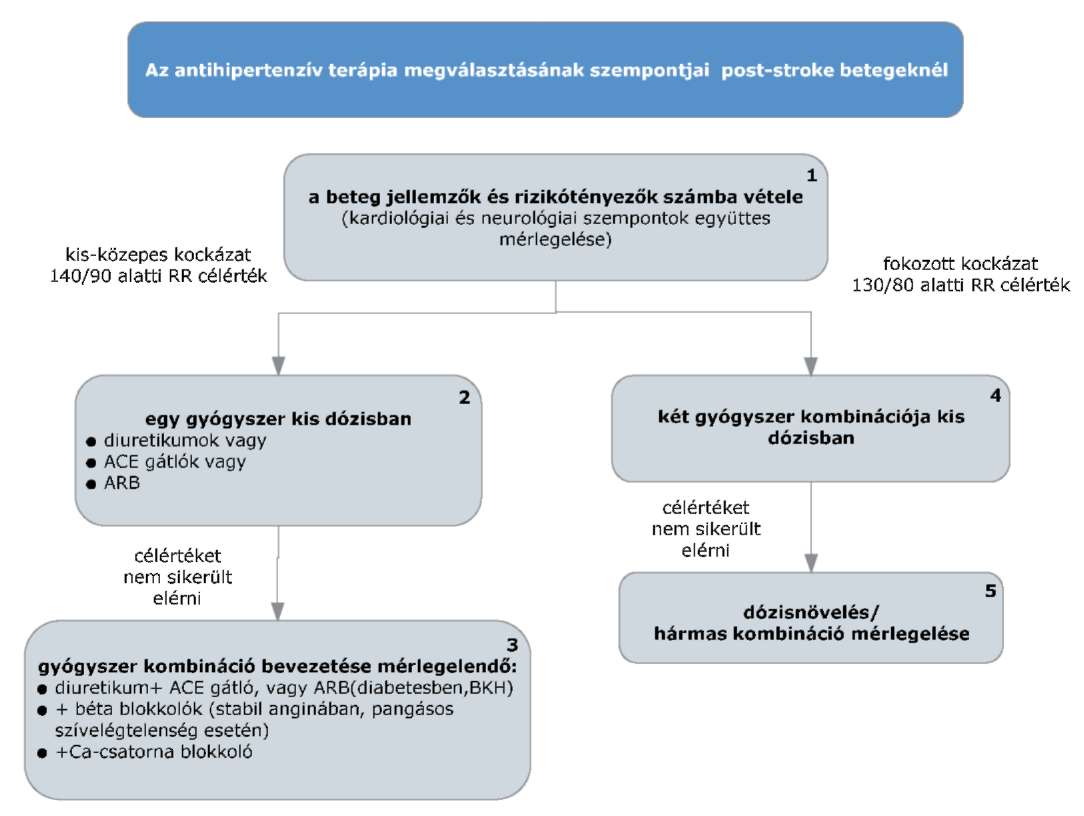
2.3.2.2. Fokozott kockázatot jelentő faktorok:
- Diabétesz egyidejű fennállása
- Dyslipidaemia (kóros LDL-Ch; HDL-Ch; TG szintek)
- "erős" dohányzás az anamnézisben
- metabolikus szindróma megléte
- kardiovaszkuláris betegség egyidejű fennállása (bal kamra hipertrófia, pangásos szívelégtelenség, pitvarfibrilláció, egyéb haemodinamikai zavar)
- túlsúly/elhízás
- túlzott alkoholfogyasztás
2.3.2.3. Kis-közepes kockázat: a fenti kockázati faktorok közül 1 vagy 2 egyidejű jelenléte esetén.
A betegek kezelése mindig individualis legyen. Figyelembe kell venni a speciális szempontokat (izolált szisztolés hipertónia, idős kor, lezajlott akut myocardialis infarktus stb.). Kis-közepes kockázat esetén az első választandó szer lehet a magányos diuretikum vagy ACE-gátló vagy ARB. Az ACE-gátló adása még a normotenziósokban is mérlegelendő. Akik nem tolerálják az ACE-gátlókat, azoknak szintén ARB adható, különösen, ha diabétesz vagy balkamra hipertrófia is jelen van.
Amennyiben a fenti célértéket nem sikerült egyetlen gyógyszerrel elérni, akkor kombinációs kezelést kell alkalmazni. Indokolt esetben lehet rögtön kombinációval kezdeni, de kerülni kell a hirtelen vérnyomásesést.
- a vérnyomáscsökkentő szerek bármely kombinációja választható, kivéve az ACE gátló és ARB együttes alkalmazását;
- kiegészíthetők Ca- csatorna blokkolóval vagy
- anyagcsere semleges diuretikummal vagy
- béta blokkolóval (stabil anginában, pangásos szívelégtelenség esetén vagy coronaria betegségben).
2.3.2.4. Fokozott kockázat: a fenti kockázati faktorok közül kettőnél több egyidejű jelenléte esetén.
A vérnyomás 130/80 Hgmm alatt legyen.
Fokozott kockázat esetén gyógyszer kombináció bevezetése szükséges kezdetben alacsony dózisban (egyénre szabott kombináció a Magyar Hypertónia Társaság ajánlása alapján). Amennyiben a célértéket nem sikerült elérni, hármas gyógyszer kombináció bevezetése szükséges egyénre szabott módon a Magyar Hypertónia Társaság ajánlása alapján.
2.3.3. Antithrombotikus terápia
2.3.3.1. Vérlemezkegátló kezelés
A másodlagos prevenció során az antiaggregációs kezelés kiemelten fontos. A stroke-ot követő hosszú távú antiaggregációs kezelés két és fél éves követési periódus alatt kb. 25%-kal csökkenti a nem fatális kimenetelű stroke és 36%-kal a súlyos vascularis események számát.
Ha az ischemiás stroke hátterében nincs kardiogén emboliaforrás, thrombocita-aggregáció gátlót, elsősorban ASA-t, vagy clopidogrelt vagy ASA/dipyridamol kombinációt kell adni.
2.3.3.2. Emelt társadalombiztosítási támogatással adható további készítmények:
Eü70 2/a2: Cerebrovascularis betegségek, perifériás artériás obstrukció secunder prevenciójára dokumentált ASA allergia, ASA rezisztencia, műszeres vizsgálattal igazolt ASA-non-responsio, valamint ASA alkalmazása mellett kialakult endoscoppal, vagy Weber-vizsgálattal igazolt gastrointestinalis vérzés, ASA-indukálta asthmaroham esetén: ticlopidine hatóanyagú készítmények.
Eü70 2/a3: Ischaemiás eredetű cerebrovascularis betegségek, instabil angina, non-QMI, NSTEMI, AMI, perifériás artériás obstrukció angiográfiával, vagy egyéb képalkotó vizsgálattal igazolt eseteiben, szekunder prevenció céljára, dokumentált ASA-allergia, ASA rezisztencia, műszeresen igazolt ASA-non-responsió, valamint ASA adása mellett kialakult endoscoppal vagy Weber-vizsgálattal igazolt gastrointestinalis vérzés, ASA-indukálta asthmaroham esetén: clopidogrel hatóanyagú készítmények.
Eü70 2/a1: Lezajlott tranziens ischemias attack (TIA), illetve stroke után halmozott atherothrombotikus rizikó esetén secunder stroke prevenció céljából: thrombocyta aggregatiót gátlók kombinációi, kivéve heparin.
A thrombocita-aggregáció gátló terápia mellett bekövetkező stroke esetén a patofiziológia és a beteg rizikófaktorai átértékelendőek, ennek megfelelően terápia módosítása válhat indokolttá.
2.3.3.3. Antikoaguláns kezelés
Az összes ischaemia-s stroke mintegy 20%-a kardiogén eredetű. A jelenleg érvényes protokollok alapján a kardiogén stroke-ban szenvedő betegeket antikoagulálni kell. Az optimális INR-tartomány: 2,0-3,0 azon betegeknél, akik K-vitamin antagonistát kapnak. Az oralis antikoagulánsok bevezetésének időpontja különböző lehet. TIA és kis stroke esetén azonnal kezdhető, kiterjedt lágyulás (az a. cerebri media ellátási területének több mint egy harmada) esetén kb. 2-4 hét várakozás indokolt. A terápia hosszát a beteg kockázati tényezői és az ellenjavallatok szabják meg.
2.3.3.3.1. Nem-valvuláris PF-fel asszociált ischaemias stroke esetén indikált az oralis antikoaguláció (INR 2,0-3,0). Az orális antikoagulálás nem ajánlott az olyan betegeknek, akik gyakran elesnek, rossz a compliance-ük, nem kontrollált epilepsziában szenvednek, valamint azoknak sem, akiknek gasztrointesztinális vérzésük volt. Az idős kor önmagában nem kontraindikálja az orális antikoagulálást.
2.3.3.3.2. Azon betegeknek, akiknek PF-hoz nem köthető kardioembóliás stroke-ja zajlott, antikoagulálás adása ajánlott (INR 2,0-3,0), ha a stroke ismétlődés kockázata nagy.
2.3.3.3.3. A nem-kardioembóliás ischaemiás stroke lezajlása után az antikoaguláció nem javasolt, kivéve egyes specifikus eseteket, mint pl. aorta atheroma, cervikális artéria disszekció, nyitott foramen ovale, melyhez korábban lezajlott mélyvénás trombózis (MVT) társul vagy nyitott foramen ovale és pitvari szeptális aneurizma együttes fennállása esetén.
2.3.3.4. Pitvarfibrilláció
A pitvarfibrilláció a stroke erős, független rizikófaktora. TIA-t vagy ischemiás stroke-ot szenvedett betegeket antikoagulálni kell.
Pitvarfibrillációban emelt társadalombiztosítási támogatással adható új típusú oralis antikoaguláns készítmények a vonatkozó Eü70 26. indikációs pont szerint:
Stroke és szisztémás embolizáció megelőzésére nem billentyű eredetű pitvarfibrillációban szenvedő felnőtt betegeknél, ha 6 hónapot meghaladó K-vitamin antagonista (acenocumarol, illetve warfarin) kezelés során a mért INR értékek kevesebb mint 60%-a esik terápiás tartományba (INR 2 és 3 közé)
- korábbi stroke, vagy tranziens ischaemias attack (TIA), vagy szisztémás embolizáció esetén, vagy a következő kockázati tényezők közül legalább kettő fennállása esetén:
- bal kamrai ejekciós frakció < 40%,
- tünetekkel járó szívelégtelenség ≥ New York Heart Association (NYHA) II. stádium,
- életkor ≥ 75 év,
- életkor ≥ 65 év, a következők valamelyikével: diabetes mellitus, koszorúér-betegség vagy hypertonia.
Vonatkozó hatóanyagok: dabigatran etexilate, rivaroxaban, apixaban (Eü70, 26).
Néhány kiemelt betegcsoport:
2.3.3.5. Antikoaguláns terápia reumás eredetű mitralis billentyű betegségben:
A billentyűbetegség okozta agyi embolizáció veszélye a billentyűbetegség jellegétől és súlyosságától függ. A magas rizikócsoportba tartozó betegeket antikoagulálni kell.
A mitralis stenosisban előforduló bármely eredetű pitvarfibrilláció a kardioemboliás stroke fő oka, bár mitralis stenosisban más tényezők is növelik a stroke kockázatát, ilyen pl. idős kor, megnagyobbodott balpitvar, csökkent bal kamrai kiáramlás, és korábbi embóliás esemény.
Ischaemiás stroke-on vagy TIA-n átesett betegnek, akinek rheumás eredetű mitralis billentyű betegsége van és pitvarfibrillál, hosszútávú K-vitamin antagonista kezelésben kell részesülnie, ahol a kívánatos INR célérték 2,5 (2,0-3,0). Amennyiben a beteg megfelelően beállított K-vitamin antagonista kezelés mellett szenved el ismételt stroke-ot, aspirin hozzáadása mérlegelendő.
2.3.3.6. Antikoaguláns terápia cardiomyopathiás betegek esetén:
Mind az ischaemiás, mind a nem ischaemiás eredetű cardiomyopathia magas stroke rizikót jelent. Egy vizsgálat szerint azon betegkörben, ahol az EF≤ 35%, sinus ritmus fennállása esetén a stroke incidenciája 3,9% volt.
Ischaemiás stroke-on vagy TIA-n átesett, sinus ritmusban lévő betegnek, ha bal pitvari vagy bal kamrai thrombust jelez az echokardiográfia vagy más képalkotó vizsgálat, K-vitamin antagonistával történő antikoaguláció javasolt legkevesebb 3 hónapig.
2.3.3.7. Antikoaguláns terápia bal kamrai thrombussal szövődött akut szívizom infarctusban
Mellsőfali szívizom infarktust elszenvedett betegek, akiknél az EF<40% és mellsőfali-csúcsi mozgászavart detektáltak, nagy kockázatúak bal kamrai trombus kialakulása szempontjából. A vizsgálatok kimutatták, hogy mellsőfali szívizom infarktust elszenvedett betegek 15%-ában fordult elő fali trombus. STEMI esetén, ha az EF< 40%, ez az érték már 27% volt.
Ischaemiás stroke-ot vagy TIA-t elszenvedett betegnél akut szívizom infarctust komplikáló bal kamrai fali thrombus kialakulása esetén, amit echokardiográfiás vagy egyéb leképező eszköz igazolt, a legtöbb esetben 3 hónapon át K-vitamin antagonista szer adása javasolt (INR célérték 2,5 [2,0-3,0]).
2.3.3.8. Műbillentyűvel élő betegek antithrombotikus kezelése:
Mechanikus műbillentyűvel élő betegek magas kockázatúak a thromboemboliás események bekövetkezése szempontjából. Az INR célérték függ a mechanikus műbillentyű típusától, helyétől és egyéb tényezőktől. Intenzívebb terápia indokolt mitralis pozícióba helyezett mechanikus műbillentyű esetén, mint aorta pozícióban lévőnél, függetlenül attól, hogy volt-e megelőző embolizációs esemény. Ha mechanikus műbillentyű miatt alkalmazott K-vitamin antagonista kezelés ellenére stroke alakul ki, az antikoaguláns kezelés aszpirin adásával egészíthető ki.
Az INR célérték mechanikus aorta műbillentyű esetében 2,5 (2,0-3,0 között), mechanikus mitrális műbillentyű esetében 3,0 (2,5-3,5 között).
2.3.3.9. Az orális antikoagulálás felfüggesztése indokolt olyan betegeknél, akik gyakran elesnek, rossz az együttműködésük (demensek, a hozzátartozó nem biztosítja a pontos gyógyszerelést), a vérvizsgálatok ellenőrzése nem megoldható, nem kontrollált epilepsziában szenvednek, valamint azoknál, akiknek gastrointestinalis vérzésük volt. Ebben az esetben thrombocytaaggregáció-gátló kezelést kell alkalmazni. Az idős kor önmagában nem kontraindikálja az orális antikoagulálást.
2.3.3.10. Az antikoaguláns terápia tervezésénél minden esetben alaposan mérlegelni kell a thromboembóliás és vérzéses szövődmények kockázatát.
2.3.4. Carotis endarterectomia másodlagos stroke prevencióként
Minor stroke vagy TIA után a carotis dezobliteráció hatásos rizikócsökkentő beavatkozás, ha a stroke-kal azonos oldali arteria carotis interna szűkülete 70-99% közötti. Súlyos stroke vagy elzáródás esetén a carotis megnyitása nem jön szóba.
A dezobliteráció csak akkor jön szóba, ha TIA zajlott le és a betegnek enyhe tünetei vannak, olyan ellátó intézményben, ahol a 30 napos periproceduralis morbiditás/mortalitás dokumentáltan 6% alatti. A stroke-ot követően a carotis rekonstrukció 2 héten belül történjen meg ér- vagy idegsebészeten!
A dezobliteráció módját (stent/endarterectomia) az alábbi szempontok szerint kell megválasztani:
- A korábbi prospektív, multicentrikus és randomizált vizsgálatok szerint 70 év felett a carotis endarterectomia szövődményrátája kisebb, mint a stent kezelésé, viszont 70 év alatt a CEA és stent szövődményrátája között nincs szignifikáns különbség.
- A dezobliteráció módjának kiválasztása előtt vizsgálni kell a szűkületet okozó plaque ultrahang-jellegzetességeit (lebegő thrombus, fekélyes, inhomogén plaque esetén a stent fokozott emboliaveszéllyel jár).
- A beavatkozás módjára (stent vagy CEA) a beteg neurológiai statusának, a szűkület súlyosságának, a plaque ultrahang jellemzőinek és egyéb, a beavatkozást befolyásoló tényezők figyelembevételével (pl. társult betegségek) a vascularis betegségek területén jártassággal rendelkező neurológus tegyen javaslatot.
- De stent a választandó beavatkozás CEA-t követően diagnosztizált restenosis esetén, postirradiációs stenosis kialakulásakor vagy sebészileg nem hozzáférhető plaque eseteiben.
2.3.4.1. Carotis endarterectomia vagy stent az újabb stroke megelőzésére:
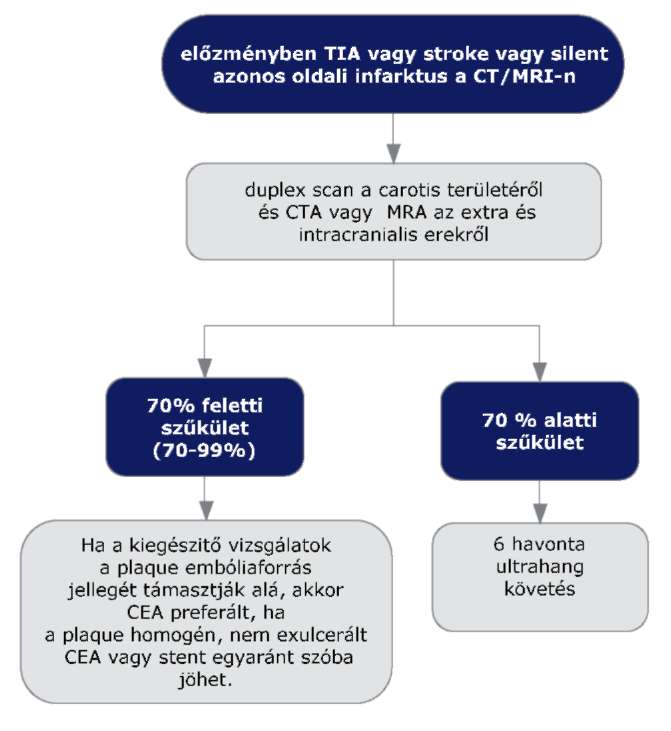
2.3.5. Dohányzás elleni küzdelem
A dohányzás mindkét nemnél az ischaemia-s stroke kialakulásának független rizikófaktora. Kimutatták, hogy a dohányzás duplájára emeli az ischaemiás stroke kialakulásának a rizikóját. Azok, akik a dohányzásról leszoknak, 50%-kal csökkentik ezt a kockázatot. A munkahelyek dohányfüst-mentesítése jelentős egészségügyi és gazdasági előnnyel járna, hiszen a passzív dohányzás is emelheti a stroke kockázatát. Ajánlott a dohányzásról való teljes leszokás.
3. Az ellenőrzés alapját képező finanszírozás szempontból lényeges sarokpontok
A finanszírozási ellenőrzés során elsődlegesen azt vizsgáljuk, hogy a kezelő orvosok betartják-e a kihirdetett finanszírozási rendet, különös tekintettel a következő főbb ellenőrzési sarokpontokra, melyek természetesen az ellenőrzés céljának megfelelően változhatnak.
3.1. Történt-e 24 órán belül agyi CT vagy MRI vizsgálat?
3.2. A stroke-ot/TIA-t szenvedett betegeknek javasoltak-e lipidcsökkentő sztatin terápiát?
3.3. Vizsgálták a sztatin intoleranciát?
3.4. A stroke-ot/TIA-t szenvedett betegeknek javasoltak-e vérnyomáscsökkentő kezelést?
3.5. Ha a vérnyomáscsökkentés eredménytelennek bizonyult, javasoltak-e kombinált vérnyomáscsökkentő kezelést?
3.6. A kardiogén stroke-ot/TIA-t szenvedett betegeknek javasoltak-e antikoaguláns terápiát?
3.7. A stroke-ot/TIA-t szenvedett diagnosztizált carotis stenosis betegnél mérlegelték-e a dezobliterációt és annak formáját?
4. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
A finanszírozási eljárásrend hatását a következő indikátorokkal kívánjuk mérni:
4.1. A területre fordított közkiadások alakulása.
4.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
4.3. Rövidtávon értékelhető mutatók:
4.3.1. Lipidcsökkentő (sztatin) terápiában részesülő betegek aránya (jó, ha nagyobb, mint 60%)
4.3.2. Vérnyomáscsökkentő terápiában részesülő betegek aránya (jó, ha nagyobb, mint 80%)
4.3.3. Vérlemezkegátló terápiában részesülő betegek aránya (jó, ha nagyobb, mint 70%)
4.3.4. Pitvarfibrilláló betegek antikoaguláns kezelésének aránya (jó, ha nagyobb, mint 80%)
4.3.5. Carotis reconstrukcióra szoruló betegek esetében a 2 héten belül elvégzett beavatkozások aránya jó, ha nagyobb, mint 80%)
4.4. Hosszútávon értékelhető mutatók:
4.4.1. Cerebrovaszkuláris thrombotikus eseményből származó halálesetek száma
4.4.2. Stroke után független életvezetés (mRankin 0-2)
4.4.3. Gondozási napló használata (papíralapon vagy elektronikusan a gondozott betegek hány %-ánál vezetnek rendszeresen gondozási protokollt?)
4.4.4. A gondozási lapnak követnie kell a beteg neurológiai statusának alakulását (pl. NIHSS, mRankin), a vérnyomást, a lipid értékeket, a vércukor és az ezekkel összefüggő terápiás rezsimek létét vagy hiányát (vérnyomáscsökkentő, sztatin, vérlemezkegátló vagy antikoaguláns kezelés stb.).
5. A finanszírozás szempontjából lényeges finanszírozási kódok
Az alábbiakban felsoroljuk a fontosabb finanszírozási kódokat, tájékoztatási céllal.
5.1. Fontosabb BNO kódok:
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | G4500 | Vertebrobasilaris syndroma |
| 3 | G4510 | Arteria carotis syndroma (féltekei) |
| 4 | G4520 | Többszörös és kétoldali praecerebralis arteria syndromák |
| 5 | G4530 | Amaurosis fugax |
| 6 | G4580 | Egyéb, átmeneti agyi iszkémiás attakok és rokon syndromák |
| 7 | G4590 | Átmeneti agyi iszkémiás attak (TIA) k.m.n. |
| 8 | I6300 | Agyi infarctus a praecerebralis ütőerek rögösödése miatt |
| 9 | I6310 | Agyi infarctus a praecerebralis ütőerek emboliája miatt |
| 10 | I6320 | Agyi infarctus a praecerebralis art. k.m.n. elzáródása-szűkülete miatt |
| 11 | I6330 | Agyi infarctus a cerebralis ütőerek rögösödése miatt |
| 12 | I6340 | Agyi infarctus a cerebralis ütőerek emboliája miatt |
| 13 | I6350 | Agyi infarctus a cerebralis art. k.m.n. elzáródása-szűkülete miatt |
| 14 | I6360 | Agyi infarctus az agyi visszerek nem suppurativ rögösödése miatt |
| 15 | I6380 | Agyi infarctus, egyéb |
| 16 | I6390 | Agyi infarctus, k.m.n. |
| 17 | E7800 | Tiszta hypercholesterinaemia |
| 18 | E7820 | Kevert hyperlipidaemia |
| 19 | E7840 | Egyéb hyperlipidaemia |
| 20 | E7850 | Hyperlipidaemia, k.m.n. |
| 21 | I48H0 | Pitvari fibrillatio és flutter |
5.2. Fontosabb OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 11301 | Kontrollvizsgálat, konzílium |
| 4 | 88460 | Vérvétel |
| 5 | 28620 | Prothrombin meghatározása |
| 6 | 28610 | Thrombin idő meghatározása |
| 7 | 28621 | Aktivált parciális thromboplasztin idő |
| 8 | 3612D | Echocardiographia color Doppler |
| 9 | 12601 | EKG végtag és mellkaselvezetéssel |
| 10 | 3617A | Duplex UH, nyaki erek |
| 11 | 36112 | Nyaki erek UH vizsgálata |
| 12 | 3616C | Transcraniális Doppler vizsgálat |
| 13 | 34410 | Agykoponya natív CT vizsgálata |
| 14 | 34490 | CT angiográfia koponya |
| 15 | 34411 | Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
| 16 | 34915 | Agykoponya MR vizsgálat natív plusz iv. kontrasztanyag adását követőleg |
| 17 | 34948 | MR angiográfia, iv. kontrasztanyag adása nélkül |
| 18 | 34949 | MR angiográfia, iv. kontrasztanyag adásával |
| 19 | 33341 | Szelektív arteriographia - további ágak, áganként |
| 20 | 33351 | Szuperszelektív arteriographia - további ágak, áganként |
5.3. Fontosabb HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 01M015D | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, rt-PA kezeléssel |
| 3 | 01M015A | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, speciális kezeléssel |
| 4 | 01M015C | Cerebrovascularis betegségek speciális vizsgálatokkal igazolva |
| 5 | 01M015F | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, Speciális kezelés nélkül 18 év felett |
| 6 | 01M0210 | Hypertensiv encephalopathia |
| 7 | 01M0160 | Átmeneti iszkémiás agyi keringészavar (TIA) |
| 8 | 01M0170 | Egyéb cerebrovascularis rendellenességek |
5.4. Fontosabb ATC kódok
| A | B |
| 1 | ATC | ATC megnevezés |
| 2 | B01AC04 | clopidogrel |
| 3 | B01AC05 | ticlopidin |
| 4 | B01AC06 | acetilszalicilsav |
| 5 | B01AC30 | thrombocyta aggregatiót gátlók kombinációi |
| 6 | B01AD02 | alteplase |
| 7 | B01AX06 | rivaroxaban |
| 8 | C10AA01 | simvastatin |
| 9 | C10AA05 | atorvastatin |
| 10 | C10AA07 | rosuvastatin |
| 11 | C10AX09 | ezetimibe |
| 12 | C10BA05 | atorvasztatin és ezetimibe |
| 13 | C09A | ACE-inhibitorok önmagukban |
| 14 | C09B | ACE-inhibitorok kombinációban |
| 15 | C09CA | angiotensin II antagonisták önmagukban |
| 16 | C09D | angiotensin II antagonisták kombinációi |
| 17 | C07AB02 | metoprolol |
| 18 | C07AB07 | bisoprolol |
| 19 | C07AB12 | nebivolol |
| 20 | C07AG02 | carvedilol |
| 21 | C07BB07 | bisoprolol+thiazidok |
| 22 | C07FB02 | metoprolol+egyéb vérnyomáscsökkentők |
| 23 | B01AA03 | warfarin |
| 24 | B01AA07 | acenokumarol |
| 25 | B01AB04 | dalteparin |
| 26 | B01AB05 | enoxaparin |
| 27 | B01AB06 | nadroparin |
| 28 | B01AB12 | bemiparin |
| 29 | B01AE07 | dabigatran etexilate |
| 30 | B01AX06 | rivaroxaban |
| 31 | B01AF02 | apixaban |
6. Fogalmak, rövidítések
ACE-gátlók: angiotenzin-konvertáló enzim gátlók
ARB: angiotenzin receptor blokkolók
ASA: acetilszalicilsav
CEA: carotis endarterectomia
EF: ejekciós frakció
INR: Nemzetközi Normalizált Ráta
KVA: K-vitamin antagonista
MVT: mélyvénás thrombózis
NYHA: New York Heart Association
PF: pitvarfibrilláció
TIA: átmeneti agyi keringészavar (tranziens ischaemiás attak)"
25. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"22. melléklet a 31/2010. (V. 13.) EüM rendelethez
Ischaemias stroke-ot elszenvedett, thrombolysisre alkalmas betegek ellátásának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegségcsoport megnevezése
A stroke/TIA diagnosztikája és kezelése (BNO: G45, I63)
2. A kórkép leírása
A központi idegrendszert (KIR) érő infarctus, definíció szerint, agyi, gerincvelői vagy retinális sejtek ischaemia miatti pusztulását jelenti. A sejtpusztulást neuropathológiai, képalkotó, illetve klinikai bizonyíték igazolja.
A központi idegrendszeri infarktusnak többféle klinikai megjelenési formája ismert: az ischaemiás stroke elnevezés alatt specifikusan olyan KIR-i infarctust értünk, amit észlelhető klinikai tünetek kísérnek, míg a "csendes" (silent) infarctus, definíció szerint, nem okoz felismerhető klinikai tüneteket vagy panaszokat.
Transiens ischemiás attack (TIA) a neurológiai működés olyan átmeneti zavara, melyet körülírt agyi, gerincvelői vagy retina ischemia okoz, acut infarctus kialakulása nélkül.
A világ fejlett országaiban a stroke a mortalitási és morbiditási statisztikák előkelő helyén áll. Hazánkban a stroke szintén kiemelt fontosságú népegészségügyi problémát jelent, ugyanis gazdasági terhe az összes betegség között a legnagyobb. A leggyakoribb olyan betegség, amely a független életvitelt lehetetlenné teszi. A patomechanizmus alapján a heveny agyi katasztrófák kb. 80%-át ischaemiás eredetű kórképek adják (nagy artériás-kis artériás thrombosis, agyi embolizáció, haemodinamikai stroke) és kb. 20%-ban pedig vérzéses kóreredet (intracerebralis vagy subarachnoidealis vérzés) áll a tünetek hátterében.
Az ischaemiás stroke betegek sikeres kezelésében jelentős tényező az időfaktor, mert valódi siker az "időablakon" belül megkezdett speciális kezeléssel érhető el. Az időablak meglehetősen szűk (4,5 óra), ami a tünetek megjelenése és a beavatkozás megkezdéséig eltelt időt (iv. thrombolysis, rt-PA kezelés) foglalja magában. Az ischaemiás stroke betegek ellátásában két kritikus időszakot különböztetünk meg.
2.1. A stroke kialakulása és a beteg speciális ellátóhelyre kerülése közötti idő: "stroke-to-door" időtartam
Ennek a szakasznak a hossza több szereplőn múlik: beteg, a beteg mellett élő családtagok, esetleg idegen járókelők, mentőszállítás, diszpécser. A cél az, hogy a kezdeti alarmírozó tünetek mihamarabb felismerésre kerüljenek. Kiemelendő a mentés irányítás, az ügyeleti ellátás, a háziorvos szerepe, valamint elengedhetetlen a társadalom széles rétegeinek szervezett oktatása.
2.2. A beteg kórházba kerülése és a speciális beavatkozás megkezdéséig eltelt idő: "door-to-needle" időtartama (lehetőleg < 60 perc)
Ezen időtartam teendői már a legtöbb helyen kórházi protokollban leírtak szerint történnek. Az ellátási láncolat bármely pontján bekövetkező késlekedés a stroke kimenetelét súlyosbíthatja, a kórkép halálozási arányát jelentősen növelheti. A betegutak átgondolása azért is indokolt, hiszen hazánkban az egészségügyi ellátásban jelentős területi különbségek mutatkoznak. A jelen finanszírozási eljárásrend célja, hogy a stroke betegek kezelése mihamarabb megkezdődjön a tünetek korai felismerése révén, és a betegek az időablakon belül megkaphassák az orvosilag indokolt terápiát és megfelelő gyógyintézeti ellátásban részesülhessenek.
2.3. Stroke/TIA finanszírozási eljárásrend: STROKE-TO-DOOR szakasz
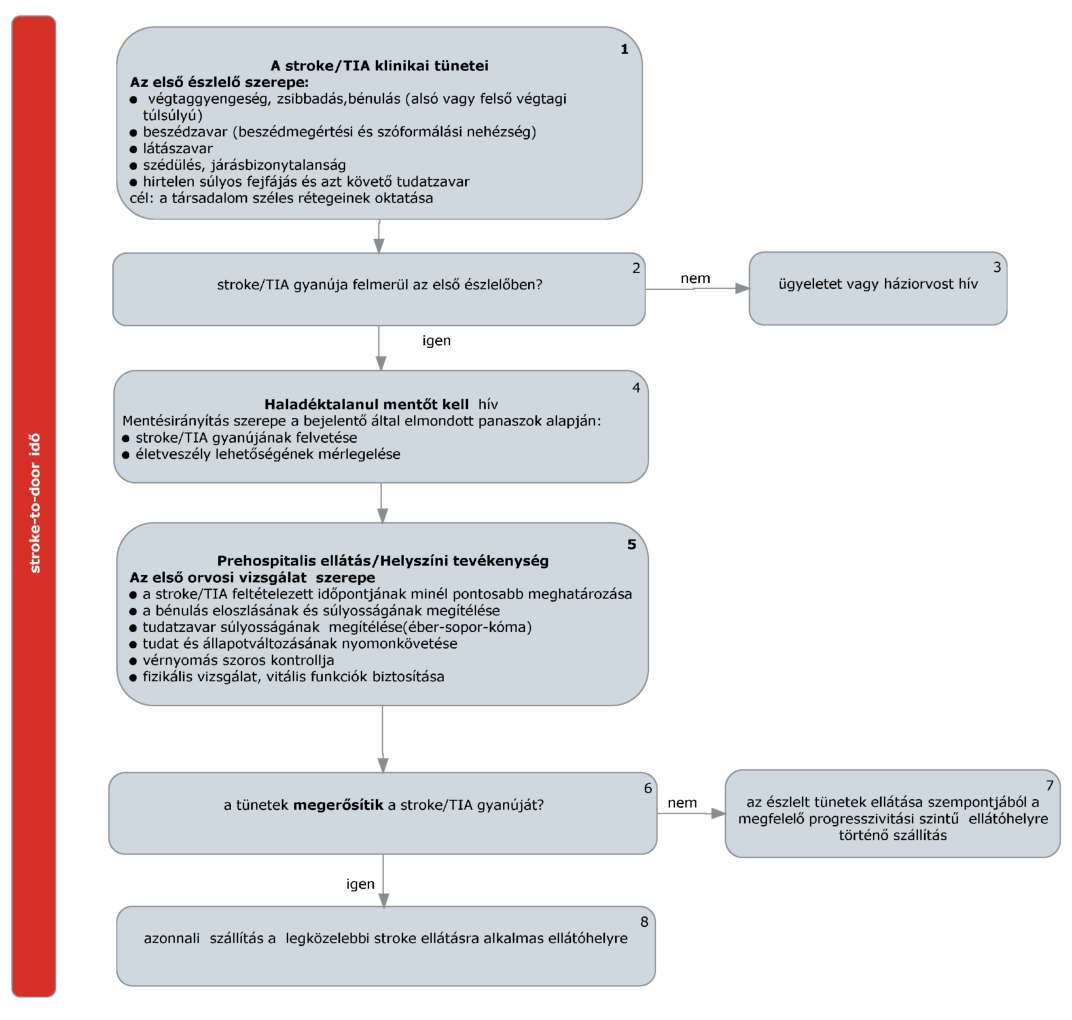
Az algoritmusban szereplő ellátási lépcsők tartalmát és a vonatkozó feltételeket az alábbiak részletezik:
2.3.1. Az első észlelő szerepe a klinikai tünetek felismerése (1):
2.3.1.1. Végtaggyengeség, zsibbadás, bénulás (alsó vagy felső végtagi túlsúlyú)
2.3.1.2. Beszédzavar (beszédmegértési és szóformálási nehézségek)
2.3.1.3. Látászavar
2.3.1.4. Szédülés, járásbizonytalanság
2.3.1.5. Hirtelen súlyos fejfájás és azt követő tudatzavar
2.3.1.6. Cél: a társadalom széles körű oktatása (szervezett felvilágosító tevékenység)
2.3.2. A stroke/TIA-ra utaló fenyegető tünetek felismerése (2) kulcsfontosságú a betegek további sorsának alakulásában. A betegek eredményes gyógyítása csak meghatározott időablakon belül lehetséges, vagyis a kórkép terápiájában az időveszteség minimalizálása a cél.
2.3.3. Amennyiben az első észlelő nem gyanakszik stroke/TIA-ra és a háziorvost vagy az ügyeletet értesíti, az a stroke-os beteg szempontjából már időveszteséget jelenthet. (3)
2.3.4. Stroke/TIA-ra utaló, illetve figyelmeztető jelek esetén haladéktalanul mentőt kell hívni (4)! A mentőknek a stroke-os eseteket prioritásként kell kezelniük.
2.3.4.1. Mentésirányítás szerepe a bejelentő által elmondott panaszok alapján:
2.3.4.1.1. A stroke/TIA gyanújának felvetése
2.3.4.1.2. Életveszély lehetőségének mérlegelése
2.3.4.2. Stroke/TIA gyanúja esetén - azonnali helyszíni beavatkozás szükségességét mérlegelve - mentőgépkocsi azonnali indítása indokolt.
2.3.5. Prehospitalis ellátás, helyszíni tevékenység (5)
2.3.5.1. A helyszíni vizsgálat alapvető célja:
2.3.5.1.1. A szélütés időpontjának lehető legpontosabb meghatározása
2.3.5.1.2. A bénulás eloszlásának és súlyosságának megítélése
2.3.5.1.3. Tudatzavar súlyosságának megítélése (éber-sopor-kóma)
2.3.5.1.4. Tudat változásnak nyomonkövetése
2.3.5.1.5. Vérnyomás szoros kontrollja (vérnyomáscsökkentés csak extrém magas 220/120 Hgmm esetén jön szóba)
2.3.5.2. Cél, hogy a beteg késlekedés nélkül stroke ellátásra/lysisre is alkalmas ellátóhelyre kerüljön.
2.3.5.3. Anamnézis, heteroanamnézis:
2.3.5.3.1. korábbi hasonló panaszok
2.3.5.3.2. korábbi betegségek
2.3.5.3.3. allergia
2.3.5.3.4. aktuális gyógyszerek
2.3.5.4. Inspekció, fizikális vizsgálat:
2.3.5.4.1. arc aszimmetria vizsgálat
2.3.5.4.2. végtagok poziciójának értékelése (kar süllyedése)
2.3.5.4.3. beszédzavar megítélése (aphasia, dysarthria)
2.3.5.4.4. szem (anisocoria, szemmozgások megítélése), száj (nyelv helyzete, gyógyszermaradék a szájban, ajakcianózis)
2.3.5.4.5. has vizsgálata (érzékenység, fájdalom, perisztaltika vizsgálata, akut has)
2.3.5.4.6. testhelyzet értékelése [saját és kóros reflexek vizsgálata (Babinski)]
2.3.5.4.7. izomerő (parézis súlyossága, eloszlása) vizsgálata
2.3.5.4.8. pulzus
2.3.5.4.9. testhőmérséklet
2.3.5.4.10. a beteg állapotváltozása a vizsgálat alatt
2.3.5.5. Vitális funkciók biztosítása, monitorozása:
2.3.5.5.1. légútbiztosítás
2.3.5.5.2. pozícionálás
2.3.5.5.3. vénabiztosítás
2.3.5.5.4. vérnyomás intermittáló mérése a szállításig
2.3.5.5.5. EKG
2.3.5.5.6. vércukor gyorsteszt
2.3.6. A tünetek összességében történő értékelése a stroke gyanúját megerősítik vagy elvetik (6)
2.3.7. Amennyiben nem igazolódik a stroke, az észlelt tünetek alapján felállított diagnózisnak megfelelő progresszivitási szintű ellátóhelyre kell a beteget szállítani (7)
2.3.8. Amennyiben megerősítést nyer a stroke/TIA gyanúja a tünetek és a betegvizsgálat kapcsán, a beteget mihamarabb - időablaktól függetlenül - stroke ellátásra alkalmas intézménybe kell szállítani. (8)
2.3.8.1. Diszpécser szerepe:
2.3.8.1.1. mentőgépkocsi lysisre alkalmas osztályra irányítása
2.3.8.1.2. a stroke osztály értesítése, a beteg tudatállapotának, parézis súlyosságának szóbeli közlése és írásbeli rögzítése, azonosító adatainak közlése (név, születési dátum, TAJ szám)
2.3.8.2. A Stroke centrumok személyi és tárgyi minimum-követelmény rendszere [az egészségügyi szolgáltatások nyújtásához szükséges szakmai minimumfeltételekről szóló 60/2003. (X. 20.) ESZCSM rendelet szerint]:
2.3.8.2.1. intenzív vagy szubintenzív osztályos háttér (a mindenkori minimumfeltételeknek megfelelően)
2.3.8.2.2. agyérbetegek ellátásában jártas neurológus (Magyarországon: többéves, neurológiai osztályon szerzett vascularis neurológiai tapasztalat, thrombolysis-tanfolyam elvégzése javasolt)
2.3.8.2.3. 24 órán keresztül elérhető akut CT-vizsgálati lehetőség (lehetőleg angiográfiára alkalmas CT)
2.3.8.2.4. nem invazív vérnyomás-, hőmérséklet-, oxigénszaturáció-, EKG-monitorozás
2.3.8.2.5. 24 órán keresztül elérhető laborvizsgálati lehetőség, haemostasislaboratórium
2.3.8.2.6. carotis duplex UH, szükség esetén betegágy melletti vizsgálati lehetőséggel
2.3.8.2.7. transcranialis Doppler-vizsgálat a betegágy melletti vizsgálati lehetőséggel
2.3.8.2.8. az intézetben szívultrahang végzésére alkalmas háttér
2.3.8.2.9. gyógytornász
2.3.8.2.10. logopédus
2.3.8.2.11. elérhető pszichológus
2.3.8.2.12. írásban kidolgozott helyi stroke-protokoll
2.3.8.2.13. kardiológiai, belgyógyászati, idegsebészeti, vascularis sebészeti, endovascularis konzultációk lehetősége
2.3.8.3. Első szintű stroke centrum (thrombolysisre akkreditált osztályok): szisztémás thrombolysisre alkalmas, maximum egyórás mentőszállítással elérhető. Rendelkezniük kell a következőkkel:
2.3.8.3.1. speciálisan képzett személyzet
2.3.8.3.2. intenzív részleg
2.3.8.3.3. 24 órán át elérhető CT
2.3.8.3.4. 24 órán át rendelkezésre álló alvadási paramétereket mérni képes labor
2.3.8.3.5. nyaki duplex ultrahang,
2.3.8.3.6. transcranialis doppler ultrahang
2.3.8.3.7. szívultrahang készülék
2.3.8.4. Második szintű stroke centrum: (klinikák, megyei kórházak)
2.3.8.4.1. Rendelkezniük kell a fentieken túl a következőkkel: CT-angiográfia, MR-angiográfia, digitális szubtrakciós angiográfia (DSA)
2.4. Stroke finanszírozási eljárásrend: DOOR-TO-NEEDLE szakasz
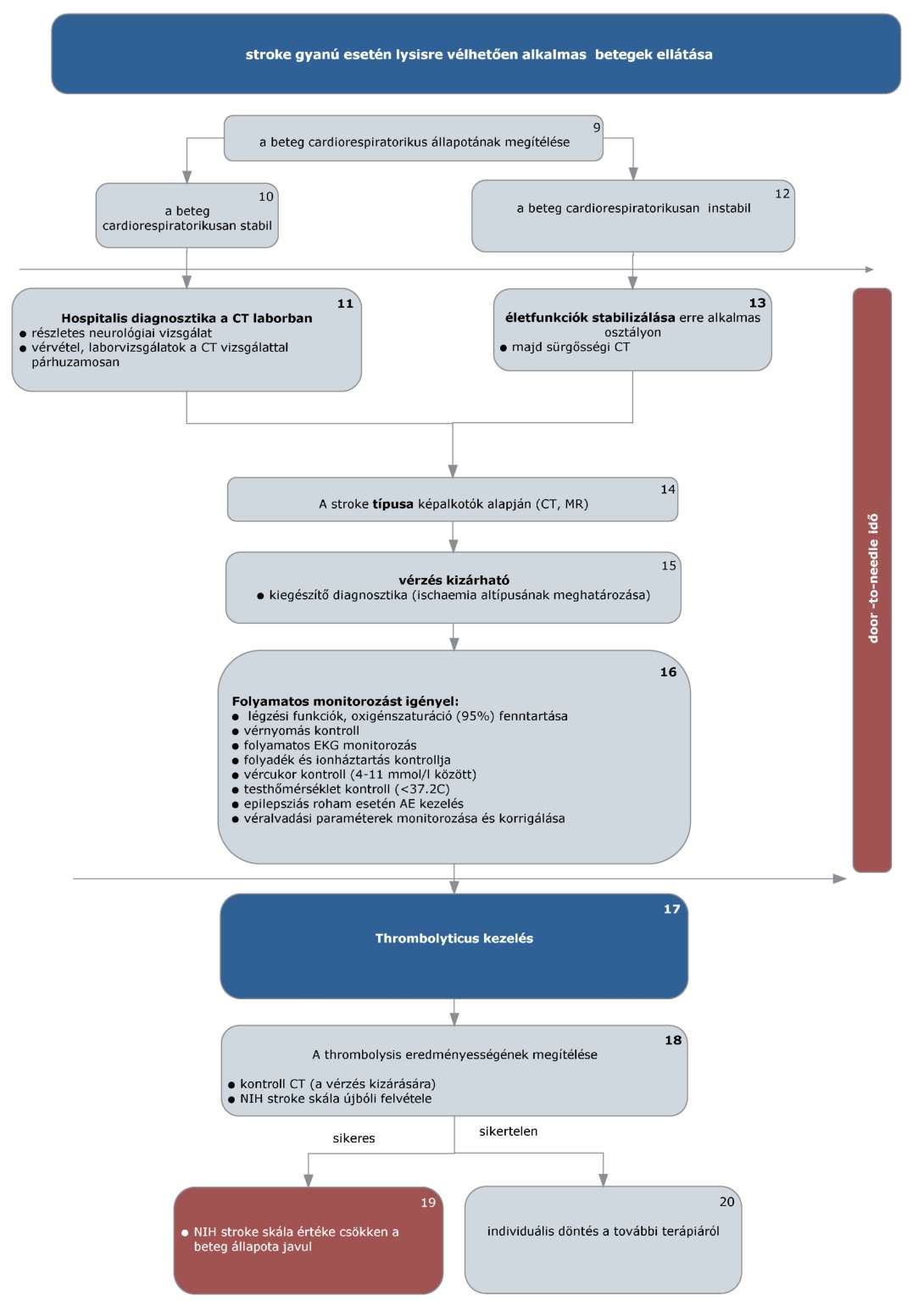
Az algoritmusban szereplő diagnosztikus és terápiás lépcsők tartalmát az alábbiak részletezik:
2.4.1. A betegek további sorsa függ attól is, hogy állapotuk cardiorespiratorikus szempontból mennyire tekinthető stabilnak a vitális paraméterek alapján (vérnyomás, oxigén szaturáció, fullad-e, van-e tüdőödémája). Ezt már a kórházba érkezés előtt el kell dönteni. (9)
2.4.2. Amennyiben a beteg stabil cardiorespiratorikus állapotban van (10), késlekedés nélkül el kell végezni a CT vizsgálatot.
2.4.3. Amennyiben a beteg általános állapotát stabilizálni kell, azt a kórház egy arra alkalmas osztályán kell megtenni, majd ezt követően kell küldeni CT vizsgálatra. (12) (13)
2.4.4. Hospitális diagnosztika lehetőség szerint a CT laboratóriumban vagy sürgősségi osztályon (11)
Éber tudatú, cardiorespiratoricusan stabil állapotú beteget lehetőleg egyenesen a CT-be kell szállítani, ott történjen a neurológiai vizsgálat is!
2.4.4.1. Részletes neurológiai vizsgálat (és NIH stroke skála felvétele)
2.4.4.1.1. tarkókötöttség megítélése (subarachnoidális vérzésre utalhat)
2.4.4.1.2. látótér vizsgálat; anisocoria a szemgolyók pozíciójának, mozgásának megítélése
2.4.4.1.3. szemfenék vizsgálata
2.4.4.1.4. arc aszimmetria vizsgálata
2.4.4.1.5. nyelv, garat, lágyszájpad-reflexek vizsgálata
2.4.4.1.6. hallgatózás a carotisok felett
2.4.4.1.7. izomerő (parézis súlyosságának és eloszlásának) vizsgálata
2.4.4.1.8. végtagok poziciójának értékelése (ha lehetőség van ülve, állva, járva vizsgálni)
2.4.4.1.9. izomtónus megítélése
2.4.4.1.10. érzészavar vizsgálata
2.4.4.1.11. saját- és kóros reflexek vizsgálata
2.4.4.1.12. éber betegnél végtagkoordináció vizsgálata
2.4.4.1.13. beszédzavar megítélése (dysarthria, aphasia)
2.4.4.1.14. neglect szindróma megítélése
2.4.4.1.15. orientáció értékelése
2.4.4.1.16. tudat értékelése
2.4.4.2. Kötelezően elvégzendő laborvizsgálatok
A vért a CT vizsgálat megkezdése előtt le kell venni a betegtől és továbbítani a laborba.
Laboratóriumi paraméterek:
2.4.4.2.1. vércukor (ágy melletti) meghatározása
2.4.4.2.2. nátrium-, kálium-, urea-, kreatininszint
2.4.4.2.3. szívizomelhalást jelző enzimek
2.4.4.2.4. teljes vérkép (thrombocyta szám)
2.4.4.2.5. INR, aktivált parciális tromboplasztinidő (APTI), fibrinogén koncentráció meghatározása
2.4.4.3. Gyógyszerek, amelyek befolyásolhatják a laboratóriumi paramétereket:
2.4.4.3.1. antikoagulánsok, thrombocyta-aggregáció gátlók, vérnyomáscsökkentő szerek, szénhidrát háztartást befolyásoló szerek
2.4.4.4. Betegségek, amelyek befolyásolhatják a laboratóriumi eredményeket:
2.4.4.4.1. diabetes mellitus, krónikus máj- és vesebetegségek, felszívódási zavarok, myocardialis infarktus, gastrointestinalis vagy húgyúti vérzés, trauma, műtét
2.4.4.5. Sürgős koponya CT
2.4.4.5.1. akut stroke-ban sürgősségi CT vizsgálat indokolt, mert a legfontosabb annak eldöntése, hogy vérzés vagy ischaemia okozza-e a tüneteket
2.4.5. A stroke két fő típusának megállapítása képalkotó módszerekkel (CT, MR) (14)
A stroke két fő típusa:
2.4.5.1. vérzéses eredet
2.4.5.2. ischaemias eredet (vérzés nem látható)
A két típus eldöntése azért fontos, mert a terápia menete alapvetően eltérő. A CT/MR vizsgálat a vérzéseknél azonnal ábrázolja az agyszövetbe jutott vért.
2.4.6. Amennyiben a CT lelet kizárta a vérzéses kóreredetet (15), az ischaemia altípusának meghatározása vagy pontosítása céljából további kiegészítő diagnosztikai vizsgálatok válhatnak szükségessé:
2.4.6.1. CT angiographia, MR angiographia: Intra- és extracranialis erek állapotának megítélésére
2.4.6.2. CTP: a keringési zavar kiterjedése
2.4.6.3. MRI súlyozott és CT-CTA-CTP: penumbra vizsgálata
2.4.7. A betegek szoros kontrollja kiterjed a vitális paraméterek és a neurológiai állapot folyamatos ellenőrzésére: (16)
2.4.7.1. Légzésfunkció, oxigénszaturáció fenntartása
2.4.7.2. Vérnyomás kontroll (vérnyomáskontrollra az első 24 órában csak akkor van szükség, ha az érték 220/120 Hgmm fölé emelkedik, akkor is csak 15%-kal szabad az értéket csökkenteni
2.4.7.3. 12 elvezetéses EKG, 24 órás Holter EKG-monitorozás, ha aritmiára van gyanú
2.4.7.4. Folyadék és ionháztartás vizsgálata és szüksége esetén kontrollja
2.4.7.5. Vércukor kontroll (4-11 mmol/l között)
2.4.7.6. Testhőmérséklet kontrollja (<37,2°C)
2.4.7.7. Epilepsziás roham esetén antiepilepsziás (AE) kezelés
2.4.7.8. Véralvadási paraméterek vizsgálata és szükség esetén kontrollja
2.4.7.9. NIH stroke skála felvétele (neurológus feladata)
2.4.8. A thrombolysis kezelésre alkalmas betegek beválasztási és abszolút és relatív kizárási kritériumai
2.4.8.1. Általános beválasztási és kizárási kritériumok a thrombolysis elvégzéséhez
| A | |
| 1 | Beválasztási kritériumok |
| 2 | A beteg tüneteinek kezdete és a kezelés megkezdése az előírt időablakon belül lehetséges vagy képalkotó módszerek eredményei a vérrögoldás eredményességét valószínűsítik. |
| 3 | Abszolút kizárási kritériumok |
| 4 | Stroke a megelőző 3 hónapban |
| 5 | Subarachoidealis vérzésre utaló tünetek |
| 6 | Nem komprimálható helyen artériapunkció történt a megelőző 7 napban |
| 7 | Intracranialis vérzés jelenleg vagy a kórtörténetben |
| 8 | Intracranialis malignus tumor vagy AV malformáció vagy aneurizma |
| 9 | Az elmúlt 6 hétben történt intracranialis vagy intraspinalis sebészi beavatkozás |
| 10 | Magas vérnyomás (>185 Hgmm systolés vagy > 110 Hgmm diasztolés) |
| 11 | Aktív belső vérzés |
| 12 | Akut vérzésesdiathesis* |
| 13 | 100 000/mm3 alatti thrombocyta szám ** |
| 14 | Heparin alkalmazása a stroke előtti 48 órán belül, ami kóros, a normál érték felső határát meghaladóan emelkedett aktivált parciális thromboplastin időt eredményez |
| 15 | Jelenleg zajló antikoaguláns terápia INR >1,7 vagy pTI> 15 sec |
| 16 | Jelenleg is folyó direkt thrombin inhibitor vagy direkt factor Xa inhibitor kezelés, ami megfelelően érzékeny laboratóriumi tesztek alkalmazásával kóros értékeket mutat az aktivált parcialis thromboplastin idő, az INR, a thrombocytaszám, thrombin idő tekintetében |
| 17 | Vércukor <2,7 mmol/l |
| 18 | CT több lebenyt érintő infarctust jelez (a hypodensitas kiterjedtebb, mint az agyfélteke 1/3-a) |
| 19 | Relatív kizárási kritériumok |
| 20 | Bizonyos körülmények között - a haszon és kockázat arányának gondos mérlegelését követően - egy vagy több relatív kontraindikáció fennállása ellenére alkalmazható fibrinolitikus terápia. Bármely alábbi relatív kontraindikáció esetén az iv. rtPA adásával elérhető hasznot és a beavatkozás kockázatát gondosan mérlegelni kell: |
| 21 | 14 napon belüli nagy sebészi beavatkozás |
| 22 | Gyorsan javuló vagy enyhe neurológiai tünetek (az aphasia nem enyhe tünet) |
| 23 | Terhesség esetén szisztémás lízis nem javasolt |
| 24 | A stroke kezdetén lezajlott epilepsiás roham utáni reziduális postictalis neurológiai tünetek |
| 25 | 21 napon belüli gastrointestinalis vagy húgyuti vérzés |
| 26 | 3 hónapon belül lezajlott akut szívizom infarctus |
* Azon betegeknél, akik a közelmúltban nem szedtek p.o. anticoagulans szert vagy nem kaptak heparint, az iv. rtPA kezelés az INR vagy a parcialis thromboplastin idő ismerete nélkül is elkezdhető. A vizsgálatot ugyanakkor sürgősséggel el kell végezni, és a thrombolízis kezelést azonnal meg kell szakítani, ha az INR>1,7, vagy a parciális thromboplastin idő kórosan emelkedett.
** Azon betegek esetében, akiknek a kórtörténetében nem szerepel thrombocytopenia, az iv. rtPA kezelés elindítható a thrombocytaszám ismerete nélkül is. A vizsgálatot mindazonáltal sürgősséggel el kell végezni, és amennyiben kiderül, hogy a thrombocytaszám <100 000/mm3, a kezelést azonnal meg kell szakítani.
2.4.8.2. 3-4,5 órán belül végzett iv. rtPA kezelés esetén további relatív kizárási kritériumok
| A | |
| 1 | Relatív kizárási kritériumok |
| 2 | A beteg több, mint 80 éves |
| 3 | Súlyos stroke (NIHSS< 25 pont) |
| 4 | Oralis anticoagulans kezelés, függetlenül az aktuális INR értéktől |
| 5 | Képalkotóval alátámasztott az MCA ellátási területének nagyobb, mint 1/3-t érintő ischaemias terület |
| 6 | A kórtörténetben egyidejűleg diabetes mellitus és korábbi stroke szerepel |
Minden más esetben az alkalmazott gyógyszerkészítmény Alkalmazási előiratában foglaltak az irányadók.
A beteg thrombolysis-re való alkalmasságáról minden esetben az ellátó stroke centrum illetékes szakorvosa dönt.
2.4.9. A thrombolysis folyamata:
2.4.9.1. Az indikációk és a kontraindikációk részletes mérlegelése után a lysisre alkalmas betegeknél a thrombolysis menete és módja:
2.4.9.1.1. Intravénás rt-PA (0,9 mg/ttkg, maximum 90 mg), a dózis első 10%-át bólusban beadva, a maradék pedig 60 perc alatt perfúzorban, az ischaemiás stroke-ot követő első 4,5 órán belül. A vérrög feloldódása a lízis első órájában a leggyakoribb.
2.4.9.1.2. Jelenleg az rt-PA kezelés intravénásan alkalmazva, 80 év alatt, 4,5 órás időablakon belül finanszírozott eljárás.
2.4.10. A thrombolysis folyamatának nyomon követésére és eredményességének megítélése alkalmas:
2.4.10.1. A vérrög feloldódása a lízis első órájában a leggyakoribb, a rekanalizáció követése 2 MHz-es transcranialis Doplerrel lehetséges (opcionális).
2.4.10.2. NIH stroke skála ismételt felvételével
További teendők (18):
2.4.10.3. A thrombolysist követő napon natív CT-vizsgálatot kell végezni a vérzéses szövődmény kizárására.
2.4.10.4. A kezelés hatékonyságának követésére a thrombolysis előtt és után (24 óra vagy az elbocsátás előtt) meg kell határozni a NIH stroke skála pontjait, valamint elbocsátáskor és a 3. havi kontrollnál a módosított Rankin-skálát is.
2.4.11. Sikeresnek mondható a thrombolysis, ha a beteg funkcionális állapota javul (NIHSS értéke csökken). (19)
2.4.12. Sikertelenség esetén a beteg további terápiáját individuálisan szükséges eldönteni a hatályos protokollok és jogszabályok alapján. (20)
2.4.13. Endovascularis kezelés végzendő, ha
2.4.13.1. Prestroke mRankin skála (mRS) 0 -1;
2.4.13.2. Akut ischemiás stroke után a beteg nem javult az iv. kezelés hatására;
2.4.13.3. A beteg tüneteit a carotis interna vagy az a. cerebri media M1 szakaszának elzáródása okozta;
2.4.13.4. A beteg 18 évesnél idősebb;
2.4.13.5. Az NIHSS skála nagyobb, mint 6;
2.4.13.6. A SPECT skála nagyobb, mint 6;
Az endovascularis kezelés (az ér pungálása) 6 órával a tünetek kezdete után megkezdhető.
3. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
A stroke betegek eredményes ellátása több egészségügyi szereplő összehangolt működésén múlik.
3.1. Fontosabb sarokpontok a kórházi ellátás során:
3.1.1. Közvetlenül a CT/MR laborban vizsgálják-e a betegeket? (Nemleges válasz nem zárja ki a finanszírozást, de mivel az időablak igen szűk, így éber, cardiorespiratoricusan stabil állapotú betegeknél magasabb színvonalú ellátást jelez, ha a beteg egyenesen a CT-be érkezik, és ott történik a neurológiai vizsgálat is.)
3.1.2. A beteg kórházba érkezésétől mennyi időn belül készül sürgősségi CT?
3.1.3. Az arra alkalmas betegeknél megtörténik-e az rt-PA kezelés?
3.1.4. A "door-to-needle" idő alakulása?
3.1.5. Megtörténik-e a kontroll CT a lysist követő 24 órán belül?
3.1.6. Létezik-e írásban lefektetett helyi stroke protokoll az ellátó centrumban?
3.1.7. Létezik-e leegyeztetett és írásba foglalt - a résztvevő szervek által egyaránt jóváhagyott - betegszállítási algoritmus?
3.1.8. A betegek kontrollvizsgálata megtörténik 3 hónap múlva?
3.1.9. Dokumentálják-e elbocsátáskor az mRankin skálát és a NIH értékét?
3.1.10. A 3 hónapos kontrollnál újból felveszik és rögzítik-e a fenti 2 skála értékét?
3.1.11. Sokszorosított NIH skála megléte az akut betegek kórrajzaiban (legalább 2).
3.2. Kiemelt /kötelező kritériumok:
3.2.1. Létezik-e írásban lefektetett helyi stroke protokoll az ellátó centrumban?
3.2.2. Létezik-e leegyeztetett és írásba foglalt - a résztvevő szervek által egyaránt jóváhagyott - betegszállítási algoritmus?
3.2.3. Dokumentálják-e elbocsátáskor az mRankin skálát és a NIH értékét?
3.2.4. Megtörténik-e a kontroll CT a lysist követő 24 órán belül?
3.2.5. A 3 hónapos kontrollnál újból felveszik és rögzítik-e a fenti 2 skála értékét?
4. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
4.1. A finanszírozási eljárásrend hatását a következő indikátorokkal kell mérni:
4.1.1. A területre fordított közkiadások alakulása.
4.1.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
4.2. Rövidtávon értékelhető mutatók:
4.2.1. "stroke-to- door" idő alakulása
4.2.2. közvetlenül a CT/MR laborban vizsgált betegek aránya
4.2.3. rt-PA kezelés aránya az arra alkalmas betegeknél
4.2.4. "door-to-needle" idő alakulása
4.2.5. lysisben részesült betegeknél a 24 órán belül elvégzett kontroll CT aránya
4.2.6. 30 napon belüli vagy kórházi mortalitás
4.3. Hosszútávon értékelhető mutatók:
Cerebrovaszkuláris thrombotikus eseményből származó:
4.3.1. Az elbocsátott betegek kontrollvizsgálaton történő megjelenése (évente 2x) (megfelelő legalább 50% felett)
4.3.2. stroke után dependens betegek számának alakulása (mRankin-skála szerinti megoszlás 0-1-2)
4.3.3. 90 napon belüli halálozás alakulása
5. A finanszírozás szempontjából lényeges finanszírozási kódok
5.1. Fontosabb BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | G4500 | Vertebrobasilaris syndroma |
| 3 | G4510 | Arteria carotis syndroma (féltekei) |
| 4 | G4520 | Többszörös és kétoldali praecerebralis arteria syndromák |
| 5 | G4530 | Amaurosis fugax |
| 6 | G4580 | Egyéb, átmeneti agyi ischaemiás attakok és rokon syndromák |
| 7 | G4590 | Átmeneti agyi ischaemiás attak (TIA) k.m.n. |
| 8 | I6300 | Agyi infarctus a praecerebralis ütőerek rögösödése miatt |
| 9 | I6310 | Agyi infarctus a praecerebralis ütőerek emboliája miatt |
| 10 | I6320 | Agyi infarctus a praecerebralis art. k.m.n. elzáródása-szűkülete miatt |
| 11 | I6330 | Agyi infarctus a cerebralis ütőerek rögösödése miatt |
| 12 | I6340 | Agyi infarctus a cerebralis ütőerek emboliája miatt |
| 13 | I6350 | Agyi infarctus a cerebralis art. k.m.n. elzáródása-szűkülete miatt |
| 14 | I6360 | Agyi infarctus az agyi visszerek nem suppurativ rögösödése miatt |
| 15 | I6380 | Agyi infarctus, egyéb |
| 16 | I6390 | Agyi infarctus, k.m.n. |
| 17 | E7800 | Tiszta hypercholesterinaemia |
| 18 | E7820 | Kevert hyperlipidaemia |
| 19 | E7840 | Egyéb hyperlipidaemia |
| 20 | E7850 | Hyperlipidaemia, k.m.n. |
| 21 | I10H0 | Magasvérnyomás-betegség (elsődleges) |
| 22 | I48H0 | Pitvari fibrillatio és flutter |
| 23 | I4200 | Dilatativ cardiomyopathia |
| 24 | E1040 | Insulin-dependens cukorbetegség idegrendszeri szövődményekkel |
| 25 | E1080 | Insulin-dependens cukorbetegség k.m.n. szövődményekkel |
| 26 | E1140 | Nem insulin-dependens cukorbetegség idegrendszeri szövődményekkel |
| 27 | E1180 | Nem-insulin-dependens cukorbetegség k.m.n. szövődményekkel |
5.2. Fontosabb OENO kódok:
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 11301 | Kontrollvizsgálat, konzílium |
| 4 | 88460 | Vérvétel |
| 5 | 28620 | Prothrombin meghatározása |
| 6 | 28610 | Thrombin idő meghatározása |
| 7 | 12031 | Afázia neurológiai vizsgálata |
| 8 | 3617A | Duplex UH, nyaki erek |
| 9 | 36112 | Nyaki erek UH vizsgálata |
| 10 | 3616C | Transcraniális Doppler vizsgálat |
| 11 | 3612D | Echocardiographia color Doppler |
| 12 | 12601 | EKG végtag és mellkaselvezetéssel |
| 13 | 33341 | Szelektív arteriographia - további ágak, áganként |
| 14 | 33351 | Szuperszelektív arteriographia - további ágak, áganként |
| 15 | 34410 | Agykoponya natív CT vizsgálata |
| 16 | 34411 | Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
| 17 | 34490 | CT angiográfia koponya |
| 18 | 34914 | Agykoponya natív MR vizsgálat |
| 19 | 34915 | Agykoponya MR vizsgálat natív plusz iv. kontrasztanyag adását követőleg |
| 20 | 34948 | MR angiográfia, iv. kontrasztanyag adása nélkül |
| 21 | 34949 | MRangiográfia, iv. kontrasztanyag adásával |
| 22 | 88162 | Recombinans szöveti plazminogén aktivátor (rtPA) kezelés (mg-ban) |
5.3. Fontosabb HBCs kódok:
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 01M015D | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, rt-PA kezeléssel |
| 3 | 01M015A | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, speciális kezeléssel |
| 4 | 01M015C | Cerebrovascularis betegségek speciális vizsgálatokkal igazolva |
| 5 | 01M015F | Cerebrovascularis betegségek (kivéve: TIA) praecerebralis elzáródással, Speciális kezelés nélkül 18 év felett |
| 6 | 01M0210 | Hypertensiv encephalopathia |
| 7 | 01M0160 | Átmeneti ischaemiás agyi keringészavar (TIA) |
| 8 | 01M0170 | Egyéb cerebrovascularis rendellenességek |
5.4. Fontosabb ATC kódok:
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | B01AC04 | clopidogrel |
| 3 | B01AC05 | ticlopidin |
| 4 | B01AC06 | acetilszalicilsav |
| 5 | B01AC30 | thrombocyta aggregatiót gátlók kombinációi, kivéve heparin |
| 6 | B01AD02 | alteplase |
| 7 | C10AA01 | simvastatin |
| 8 | C10AA05 | atorvastatin |
| 9 | C10AA07 | rosuvastatin |
| 10 | C10AX09 | ezetimibe |
| 11 | C10BA05 | atorvasztatin és ezetimibe |
| 12 | C09A | ACE-inhibitorok önmagukban |
| 13 | C09B | ACE-inhibitorok kombinációban |
| 14 | C09CA | angiotensin II antagonisták önmagukban |
| 15 | C09D | angiotensin II antagonisták kombinációi |
| 16 | C07AB02 | metoprolol |
| 17 | C07AB07 | bisoprolol |
| 18 | C07AB12 | nebivolol |
| 19 | C07AG02 | carvedilol |
| 20 | C07BB07 | bisoprolol+thiazidok |
| 21 | C07FB02 | metoprolol+egyéb vérnyomáscsökkentők |
| 22 | B01AA03 | warfarin |
| 23 | B01AA07 | acenokumarol |
| 24 | B01AB04 | dalteparin |
| 25 | B01AB05 | enoxaparin |
| 26 | B01AB06 | nadroparin |
| 27 | B01AB12 | bemiparin |
| 28 | B01AE07 | dabigatran etexilate |
| 29 | B01AX06 | rivaroxaban |
| 30 | B01AF02 | apixaban |
6. Fogalmak, rövidítések:
AE: antiepilepsziás pl. kezelés
ATC: Anatomical, therapeutic, chemical klasszifikáció
BNO: Betegségek Nemzetközi Osztályozása
CPSS: Cincinatti Prehospital Stroke Skála
HBCS: Homogén betegségcsoport
NIHSS: National Institute of Health Stroke Score
TIA: átmeneti agyi keringészavar (tranziens ischaemiás attak)
OENO: Orvosi Eljárások Nemzetközi Osztályozása
rt-PA: tissue-type plasminogen activator (alteplase)"
26. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"23. melléklet a 31/2010. (V. 13.) EüM rendelethez
A gyomordaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Daganatos megbetegedések
1.1.1. Rosszindulatú daganatos megbetegedések
1.1.1.1. A gyomor daganatai
2. A kórkép leírása
2.1.1. A gyomorrák előfordulása csökkenő tendenciát mutat, ami Magyarországon is megfigyelhető, csakúgy, mint Észak-Amerikában és Európában. Magyarországon a 6. leggyakoribb daganat. Leggyakrabban 55-75 éves korban fordul elő. Magyarországon férfiakban átlag 62, nőkben 67 éves korban észlelik. A fiatalabbakban jelentkező formák gyakran agresszívabbak.
2.1.2. Kialakulásában fontos szerep jut a környezeti tényezőknek, a táplálkozási szokásoknak és a fertőzésnek (Helicobacter pylori). Hajlamosító környezeti tényező a túlzott só és a füstölt ételek fogyasztása, nitrózó vegyületek szervezetbe való kerülése, valamint a dohányzás.
2.1.3. Premalignus állapotok a chronicus athrophiás gastritis intestinális metaplasiával, a gyomor hyperplastikus polypja, Menetrier-gastritis, chronicus recidivaló ulcus ventriculi, anaemia perniciosa és legalább 15 éve történt gyomor-reszekció az anamnézisben.
2.1.4. A gyomor daganatok egy részénél genetikai perdiszpozíció áll fenn, melyeknél családi halmozódás és domináns öröklés jellemző, mint a gastrointestinális polyposis, familiaris adenomatosus polyposis és a Peutz-Jeghers syndróma.
2.1.5. A gyomor daganatok hám eredetű és nem hám eredetűekre oszthatóak. A hám eredetű daganatok 95%-ban adenocarcinomák. A nem hámeredetű daganatok közül kiemelhető a neuroendocrin tumorok, lágyrész daganatok és a malignus lymphomák, melyek kezelése külön protokollok szerint történik.
2.1.6. A prognózis függ a diagnózis idején megállapított stádiumtól, a beteg általános állapotától, az alkalmazott kezelés típusától. A betegség minél korábbi stádiumban kerül felismerésre, a túlélés annál jobb. I stádiumban a betegek 80%-a, míg a II stádiumban a betegek 56%-a él legalább 5 évet. Az 5 éves túlélés III stádiumban 35-15%, míg a IV stádiumban távoli áttétek jelenléte esetén szerények a túlélési mutatók. A betegek kétharmada előrehaladott stádiumban kerül felismerésre.
2.1.7. A gyomorrákos betegek kb. 12-16%-ában kimutatható a humán epidermális növekedési faktor receptor 2 (HER2) fokozott expressziója a daganatsejtek felszínén (HER2-pozitív státusz). Ebben az esetben a tumor biológiai viselkedése agresszívabb, így rosszabb prognózisra lehet számítani. Randomizált, III. fázisú vizsgálatban (ToGA study) igazolták, hogy HER2-pozitív gyomorrákos betegeknél a HER2-gátló trastuzumab hozzáadása a ciszplatin-fluoropirimidin alapú kemoterápiához szignifikánsan növeli a túlélést. A trastuzumabbal kombinált kemoterápia így standard elsővonalbeli kezelés előrehaladott, HER2-pozitív gyomorrák esetén. A HER2-gátló terápiára alkalmas betegek szelekciójához szükséges, hogy valamennyi gyomorrákos betegnél (az emlőrákhoz hasonlóan) megtörténjen a HER2 státusz tesztelése. A biopsziával min. 5 helyről történő tumor mintavétel mellett igazolt HER2-pozitív státusz (IHC 3+ vagy FISH+ vagy IHC 2+ ÉS FISH+) kötelező feltétele a trastuzumab kezelésnek.
2.2. Stádiumbeosztás
A daganat differenciáltságának mértéke és a tumor kiterjedtsége alapján a következő beosztást fogalmazhatjuk meg:
2.3. TNM klinikai klasszifikáció, primer tumor
| T | Primer tumor | |
| Tx | Primer tumor nem ítélhető meg | |
| T0 | Primer tumor nem mutatható | |
| Tis | Carcinoma in situ: intraepithelialis tumor, a lamina propria infiltrációja nélkül | |
| T1 | A tumor infiltrálja a laminapropriat a muscularis mucosaet vagy a submucosát | |
| T1a | A tumor infiltrálja a lamina propriat vagy a muscularis mucosaet | |
| T1b | A tumor infiltrálja a submucosat | |
| T2 | A tumor infiltrálja a muscularis propriát | |
| T3 | A tumor beterjed a subserosaba | |
| T4 | A tumor áttöri a serosat és ráterjed a környező szervekre | |
| T4a | A tumor áttöri a serosat (visceralis peritoneum) |
| T4b | A tumor ráterjed a környező szervekre (lép, colontransversum, máj, rekesz, pancreas, hasfal, mellékvese, vese, vékonybél, retroperitoneum) |
2.4. TNM klinikai klasszifikáció, Regionális nyirokcsomó
| N | Regionális nyirokcsomók | |
| Nx | A regionális nyirokcsomók nem ítélhetők meg | |
| N0 | Nincs regionális nyirokcsomó áttét | |
| N1 | Áttét 1-2 regionális nyirokcsomóban | |
| N2 | Áttét 3-6 regionális nyirokcsomóban | |
| N3 | Áttét 7 vagy több regionális nyirokcsomóban | |
| N3a | Áttét 7-15 regionális nyirokcsomóban | |
| N3b | Áttét több mint 16 regionális nyirokcsomóban |
2.5. TNM klinikai klasszifikáció, Távoli áttétek
| M | Távoli áttétek | |
| M0 | Nincs távoli áttét | |
| M1 | Távoli áttét |
2.6. Szövettani grading
| G | Szövettani grading | |
| Gx | A differenciáltság foka nem állapítható meg | |
| G1 | Jól differenciált | |
| G2 | Mérsékelten differenciált | |
| G3 | Rosszul differenciált | |
| G4 | Differenciálatlan |
2.7. A gyomorrák stádiumbeosztása
| TNM státusz | Primer tumor | Nyirokcsomó érintettség | Távoli metasztázis |
| 0 stádium | Tis | N0 | M0 |
| IA stádium | T1 | N0 | M0 |
| IB stádium | T2 | N0 | M0 |
| T1 | N1 | M0 | |
| T3 | N0 | M0 | |
| IIA stádium | T2 | N1 | M0 |
| T1 | N2 | M0 | |
| T4a | N0 | M0 | |
| IIB stádium | T3 | N1 | M0 |
| T2 | N2 | M0 | |
| T1 | N3 | M0 | |
| T4a | N1 | M0 | |
| IIIA stádium | T3 | N2 | M0 |
| T2 | N3 | M0 | |
| T4b | N0 | M0 | |
| IIIB stádium | T4b | N1 | M0 |
| T4a | N2 | M0 | |
| T3 | N3 | M0 | |
| T4b | N2 | M0 | |
| IIIC stádium | T4b | N3 | M0 |
| T4a | N3 | M0 | |
| IV stádium | Bármely T | Bármely N | M1 |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
3.1. A gyomordaganat diagnosztikája
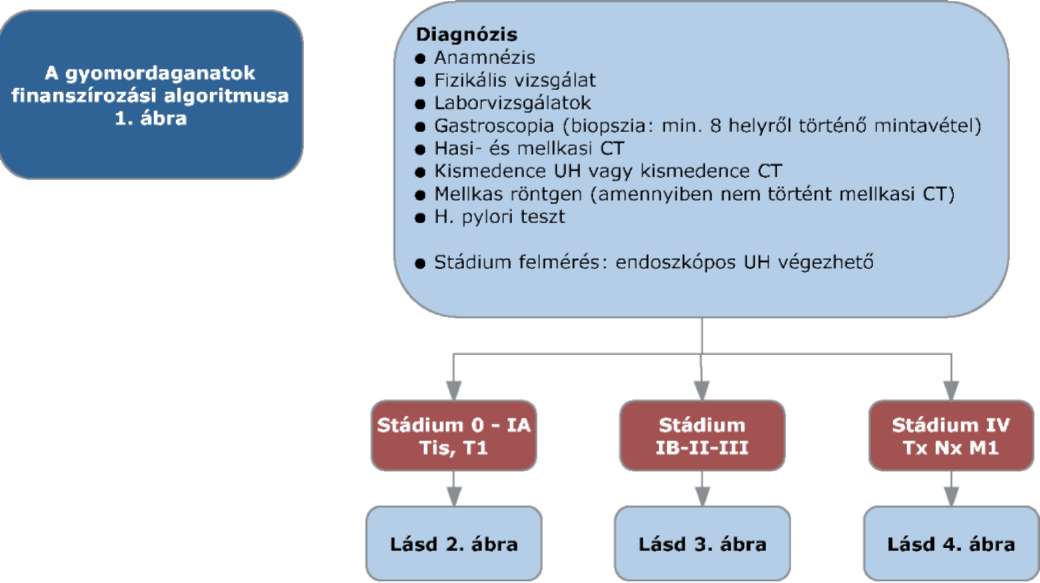
3.2. A gyomordaganat ellátása - Stádium 0-IA
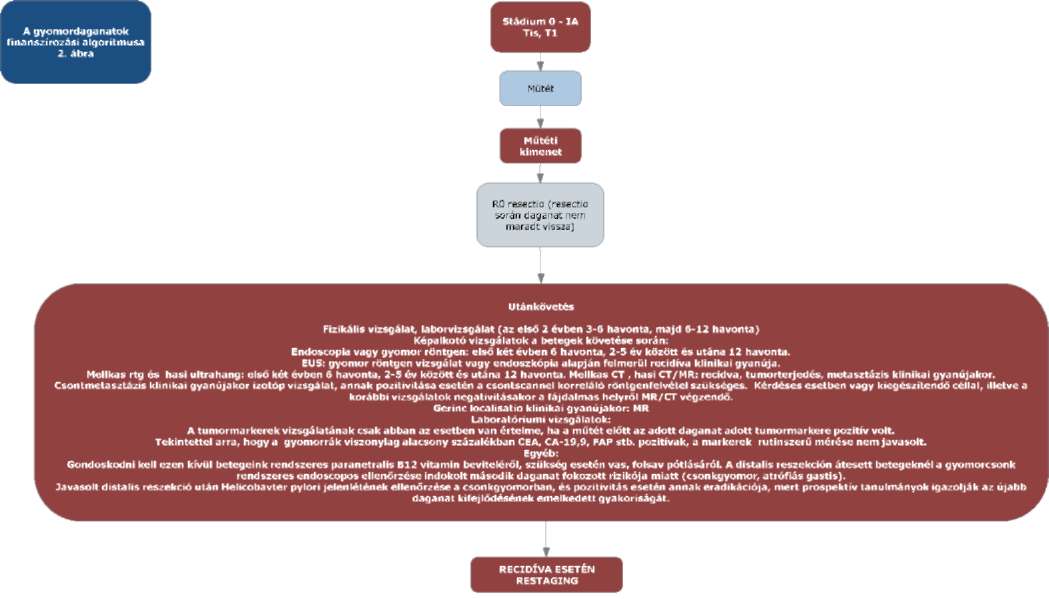
3.3. A gyomordaganat ellátása - Stádium IB-II-III
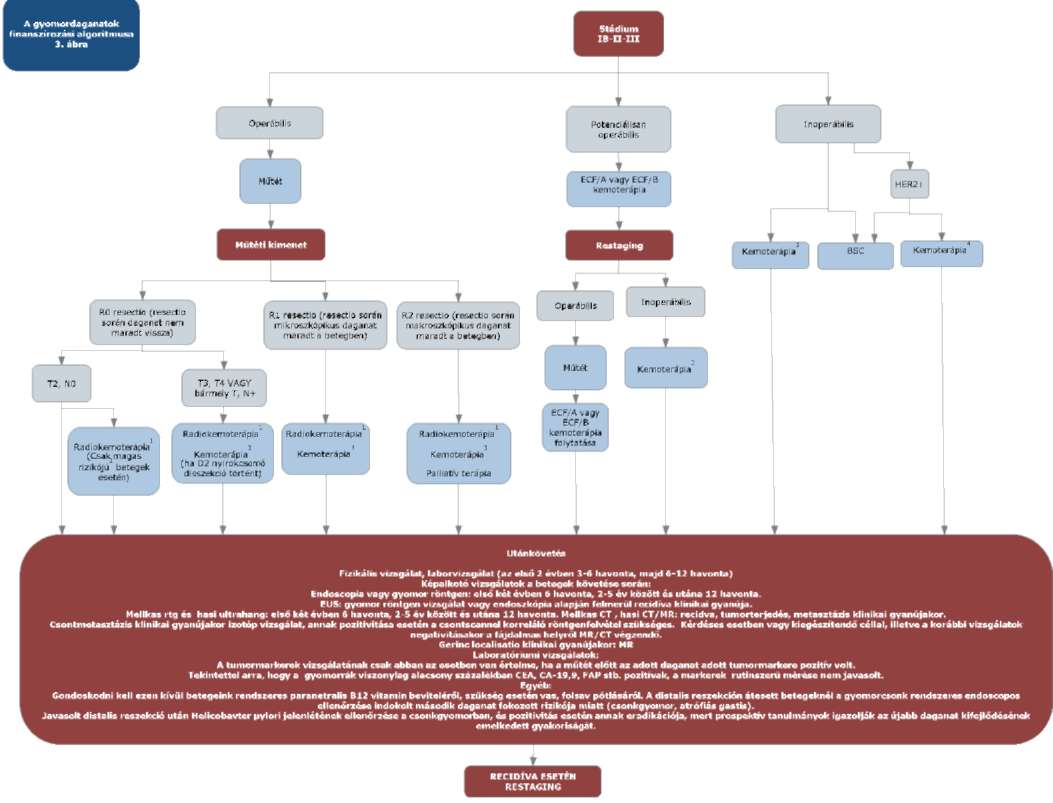
3.4. A gyomordaganat ellátása - Stádium IV
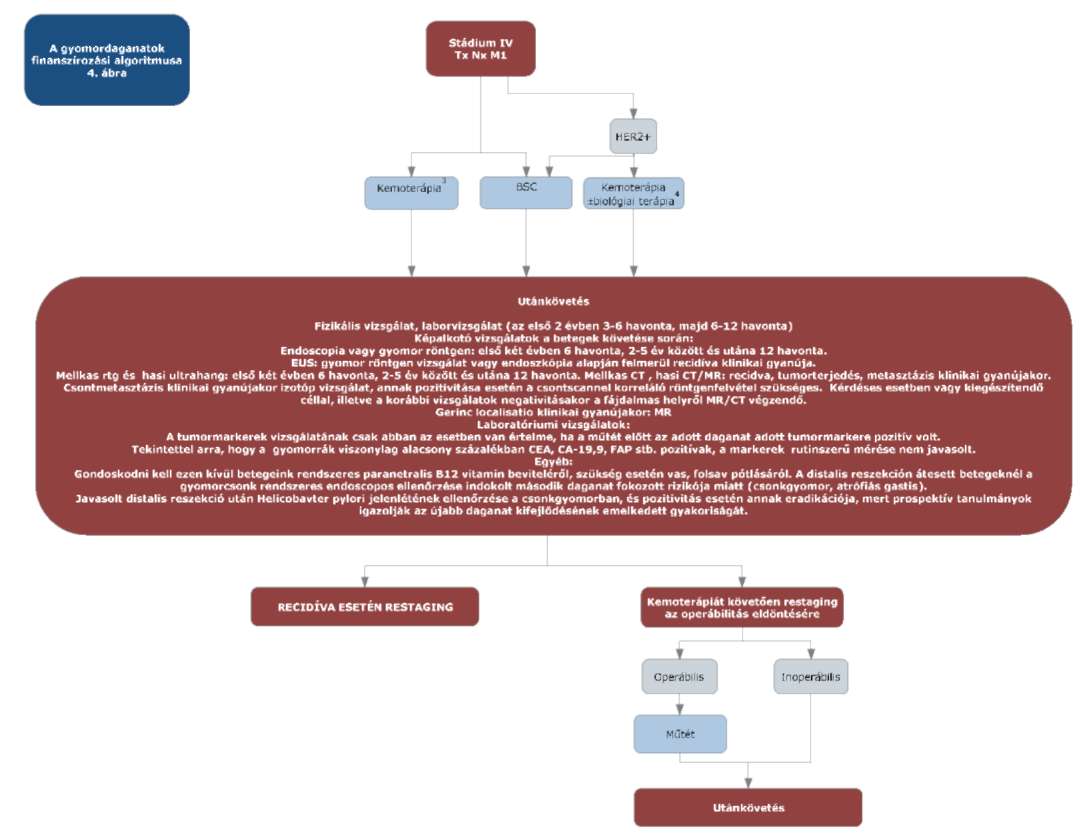
3.5. A finanszírozási algoritmusok részletezése
3.6. A gyomor daganatok diagnosztikai specifikumai a következők:
3.6.1. Fizikális vizsgálat: epigastrialis terime keresése, supraclavicularis nyirokcsomó (Virchow-csomó - kérdéses esetben UH, vagy CT), ascites, rectalis vizsgálattal, vérzés észlelése, illetve peritonealis metasztázis (Blumer - féle polctünet)
3.7. A gyomor daganatok kezelési specifikumai a következők:
3.7.1. radiokemoterápia alatt a következő protokollok számolhatóak el:
7427* Radiokemoterápia, gyomorrák esetén 5FU protokoll szerint
7575* Radiokemoterápia, nagydózisú CIFU (5FU) protokoll szerint
7577* Radiokemoterápia, MACDONALD (MAYO) protokoll szerint
3.7.2. magas kockázat kritériumai:
3.7.2.1. rosszul differenciált vagy magasabb grádusú daganat (G3, G4), vagy
3.7.2.2. limfovaszkuláris invázió, vagy
3.7.2.3. neurális invázió, vagy
3.7.2.4. 50 évnél alacsonyabb életkor.
3.7.3. kemoterápia alatt a következő protokollok számolhatóak el:
7027 Kemoterápia, CBP+5FU protokoll szerint
7030 Kemoterápia, EEP protokoll szerint
7031 Kemoterápia, ELF protokoll szerint
7033 Kemoterápia, FAM protokoll szerint
7034 Kemoterápia, FAMB protokoll szerint
7035 Kemoterápia, FAMTX protokoll szerint
7037 Kemoterápia, FEM/B protokoll szerint
7042 Kemoterápia, CDDP+5FU protokoll szerint
7092 Kemoterápia, CBP+VP protokoll szerint
7097 Kemoterápia, PE protokoll szerint
7141 Kemoterápia, FAM/C protokoll szerint
7207 Kemoterápia, módosított FAM protokoll szerint
7439 Kemoterápia, CX protokoll szerint
7440 Kemoterápia, ECX protokoll szerint
7498 Kemoterápia, TEY+CDDP protokoll szerint
7579 Kemoterápia, MMC+nagydózisú 5FU protokoll szerint
7581 Kemoterápia, CDDP+5FU+FOLIMAC II. protokoll szerint
7582 Kemoterápia, ECF/A protokoll szerint
7583 Kemoterápia, ECF/B protokoll szerint
7702 Kemoterápia, EEP+dexrazoxane protokoll szerint
7725 Kemoterápia, FEM/C+dexrazoxane protokoll szerint
7731 Kemoterápia, FEM/B+dexrazoxane protokoll szerint
7926 Kemoterápia, FEM/A protokoll szerint
7928 Kemoterápia, FEM/C protokoll szerint
7929 Kemoterápia, CDDP+5FU/B protokoll szerint
3.7.4. kemoterápia ± biológiai terápia alatt a következő protokollok számolhatóak el:
7298 Kemoterápia, CDDP+5FU+HER 3 heti telítő ciklus protokoll szerint
7299 Kemoterápia, CDDP+5FU+HER 3 heti fenntartó ciklus protokoll szerint
7497 Kemoterápia, HER kiegészítő monoterápia protokoll szerint
7599 Kemoterápia, CX+HER 3 heti telítő ciklus protokoll szerint
7600 Kemoterápia, CX+HER 3 heti fenntartó ciklus protokoll szerint
3.8. A gyomordaganatok hosszútávú utánkövetése:
3.8.1. Fizikális vizsgálat (az első 3 évben 4-6 havonta, majd évente)
3.8.2. Az algoritmusban megjelölt ellátáson felül:
3.8.2.1. Gondoskodni kell a betegek rendszeres parenteralis B12 vitamin beviteléről, szükség esetén vas, folsav pótlásáról. A distalis reszekción átesett betegeknél a gyomorcsonk rendszeres edoscopos ellenőrzése indokolt második daganat fokozott rizikója miatt (csonkgyomor, atrófiás gastritis).
3.8.2.2. Javasolt distalis rezekció után Helicobacter pylori jelenlétének ellenőrzése a csonkgyomorban, és pozitivitás esetén annak eradikációja.
3.8.2.3. Kemoterápia után restaging, operábilitás esetén műtét.
3.8.2.4. Recidíva esetén restaging!
4. A gyomordaganatok finanszírozásának ellenőrzési kritériumai
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. Szakmai ellenőrzési pontok
4.2.1. A diagnózis kritériumainak felállítása megfelelő volt-e?
4.2.2. Valóban a stadiumnak megfelelően zajlott a kezelés?
4.2.3. Műtétet követően, amennyiben T2, N0 állapot figyelhető meg, valóban csak a magas kockázatú betegek kaptak radioterápiát?
4.2.4. Az utánkövetés a megfelelő időben megtörtént-e, és az időszakos ellenőrző vizsgálatokat elvégezték-e?
4.2.5. Recidíva esetén volt-e restaging?
5. A finanszírozás-szakmai ellenőrzés alapját képező ellenőrzési sarkpontok
5.1. A finanszírozási ellenőrzés során elsődlegesen azt vizsgáljuk, hogy a kezelő orvosok betartják-e a kihirdetett finanszírozási rendet.
6. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
6.1. A területre fordított közkiadások alakulása.
6.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
7. A finanszírozás szempontjából lényeges finanszírozási kódok
7.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | C1600 | Gyomorszáj rosszindulatú daganata |
| 3 | C1610 | Gyomorfundus rosszindulatú daganata |
| 4 | C1620 | Gyomor corpus rosszindulatú daganata |
| 5 | C1630 | Antrum pylori rosszindulatú daganata |
| 6 | C1640 | Pylorus rosszindulatú daganata |
| 7 | C1650 | Gyomor kisgörbület rosszindulatú daganata, k.m.n. |
| 8 | C1660 | Gyomor nagygörbület rosszindulatú daganata, k.m.n. |
| 9 | C1680 | A gyomor átfedő elváltozása, rosszindulatú daganata |
| 10 | C1690 | Gyomor rosszindulatú daganata, k.m.n. |
7.2. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 7427 | Radiokemoterápia, gyomorrák esetén 5FU protokoll szerint |
| 3 | 7575 | Radiokemoterápia, nagydózisú CIFU (5FU) protokoll szerint |
| 4 | 7577 | Radiokemoterápia, MACDONALD (MAYO) protokoll szerint |
| 5 | 7027 | Kemoterápia, CBP+5FU protokoll szerint |
| 6 | 7030 | Kemoterápia, EEP protokoll szerint |
| 7 | 7031 | Kemoterápia, ELF protokoll szerint |
| 8 | 7033 | Kemoterápia, FAM protokoll szerint |
| 9 | 7034 | Kemoterápia, FAMB protokoll szerint |
| 10 | 7035 | Kemoterápia, FAMTX protokoll szerint |
| 11 | 7037 | Kemoterápia, FEM/B protokoll szerint |
| 12 | 7042 | Kemoterápia, CDDP+5FU protokoll szerint |
| 13 | 7092 | Kemoterápia, CBP+VP protokoll szerint |
| 14 | 7097 | Kemoterápia, PE protokoll szerint |
| 15 | 7141 | Kemoterápia, FAM/C protokoll szerint |
| 16 | 7207 | Kemoterápia, módosított FAM protokoll szerint |
| 17 | 7298 | Kemoterápia, CDDP+5FU+HER 3 heti telítő ciklus protokoll szerint |
| 18 | 7299 | Kemoterápia, CDDP+5FU+HER 3 heti fenntartó ciklus protokoll szerint |
| 19 | 7439 | Kemoterápia, CX protokoll szerint |
| 20 | 7440 | Kemoterápia, ECX protokoll szerint |
| 21 | 7497 | Kemoterápia, HER kiegészítő monoterápia protokoll szerint |
| 22 | 7579 | Kemoterápia, MMC+nagydózisú 5FU protokoll szerint |
| 23 | 7725 | Kemoterápia, FEM/C+dexrazoxane protokoll szerint |
| 24 | 7731 | Kemoterápia, FEM/B+dexrazoxane protokoll szerint |
| 25 | 7926 | Kemoterápia, FEM/A protokoll szerint |
| 26 | 7928 | Kemoterápia, FEM/C protokoll szerint |
| 27 | 7581 | Kemoterápia, CDDP+FU+FOLINAC II. protokoll szerint |
| 28 | 7582 | Kemoterápia, ECF/A protokoll szerint |
| 29 | 7583 | Kemoterápia, ECF/B protokoll szerint |
| 30 | 7599 | Kemoterápia, CX+HER 3 heti telítő ciklus protokoll szerint |
| 31 | 7600 | Kemoterápia, CX+HER 3 heti fenntartó ciklus protokoll szerint |
| 32 | 7702 | Kemoterápia, EEP+dexrazoxane protokoll szerint |
| 33 | 7929 | Kemoterápia, CDDP+5FU/B protokoll szerint |
| 34 | 7498 | Kemoterápia, TEY+CDDP protokoll szerint |
7.3. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | L01BC06 | capecitabin |
| 3 | V03AF03 | calcium folinat |
| 4 | V03AF02 | dexrazoxan |
| 5 | L01DB01 | doxorubicin |
| 6 | L01CB01 | etoposid |
| 7 | L01BC02 | fluorouracil |
| 8 | L01BA01 | Metotrexat |
| 9 | L01XC03 | trastuzumab |
8. Rövidítések
ATC Anatomical Therapeutic Chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
BSC Best supportive care, legjobb tüneti kezelés
CT Computer tomográfia
ESMO European Society for Medical Oncology
HBCS Homogén betegségcsoport
MRI Mágneses rezonancia vizsgálat
NCCN National Comprehensive Cancer Network
NICE National Intstitute of Clinical Excellence
OENO Orvosi eljárások nemzetközi osztályozása
PET Pozitron emisszios tomográfia
TNM Tumor, nyirokcsomó, metasztázis besorolás
UH Ultrahang
UIIC International Union Against Cancer
EUS Endoscopos ultrahang"
27. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"24. melléklet a 31/2010. (V. 13.) EüM rendelethez
Az ST elevációval nem járó myocardialis infarktus és az instabil angina diagnosztikájának és terápiájának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Az ST elevációval nem járó akut myocardiális infarktus (NSTEMI)
2. Kórkép leírása
2.1. Az akut szívizom infarctus (AMI) és az ischaemiás szívbetegség (ISZB) kezelése folyamatosan változik. A kezelések optimalizálása nemcsak a halálozást, hanem az életminőséget és munkaképességet is nagymértékben befolyásolja. Az utóbbi években a terápiás lehetőségek gyors ütemű bővülése a kiadások ugrásszerű gyors növekedését hozta, ami szükségessé teszi a terápiás területnek a betegek és a járulékfizetők érdekében történő finanszírozói szemlélettel történő elemzését, a különböző terápiás eljárások elérhetőségét az erőforrások végessége is limitálja. A költséghatékonyság egyre fontosabb szempont a terápiás stratégiák közötti választáskor.
2.2. Akut szívizom infarktus kifejezés mellett napjainkban az akut koronária szindróma (ACS) összefoglaló elnevezés terjedt el.
2.3. Az akut koronária szindróma EKG megjelenési forma alapján három főcsoportba sorolható:
2.3.1. ST-elevációval járó ACS,
2.3.2. ST-T rendellenességgel járó ACS, illetve
2.3.3. normál/bizonytalan EKG-val járó ACS.
2.4. EKG alapján az NSTEMI és IA kórképek között nem lehet egyértelmű különbséget tenni (2.7. ábra).
2.5. Biokémiai laborvizsgálatok elvégzését követően, nekroenzim (javasolhatóan Troponin) felszabadulás és kinetika alapján beszélhetünk a továbbiakban Troponin pozitivitással bíró ACS-ról (amennyiben ST-elevációval jár, akkor STEMI-ről; amennyiben ST-elevációval nem jár, akkor NSTEMI-ről), illetve normál Troponin szint mellett jelentkező Troponin negatív ACS-ról (instabil angina).
2.6. Az alábbi irányelvek a Troponin pozitivitással és az elektrokardiogramon (EKG) perzisztáló ST-elevációt nem mutató betegek (NSTEMI) ellátására vonatkoznak.
2.7. ACS felosztása (átalakított 2012. évi ESC ajánlás)
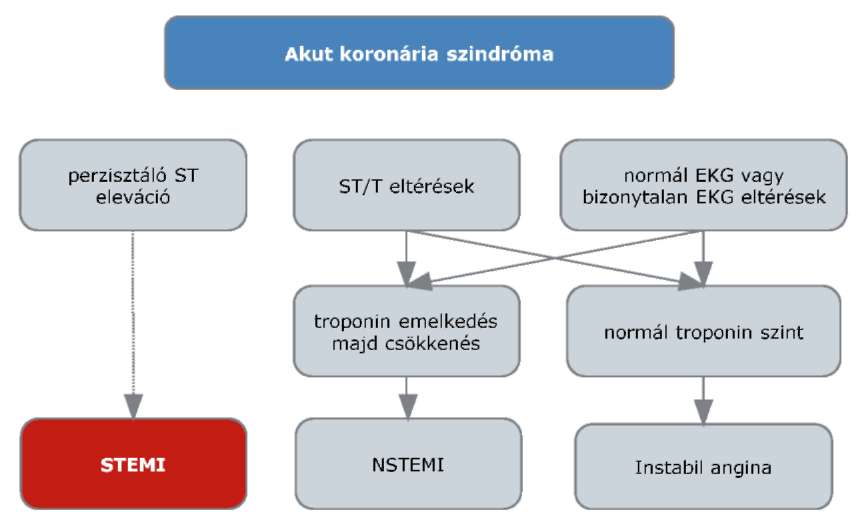
2.8. A folyamat patofiziológiai lényegét a szívizom megnövekedett oxigénigénye és a rendelkezésre álló kínálat közötti eltérés képezi. Az esetek többségében az ischaemia oka elsődlegesen a koszorúér-keringés elégtelensége (oxigénhiány), míg más esetekben az oxigénigény növekedése.
2.9. A következő felsorolt tényezők primer instabil állapotot okoznak: a koszorúér jelentős szűkülete és emellett előforduló dinamikus coronariaobstrukció (spazmus) vagy az artériafalban (atheroscleroticus plakkban) zajló gyulladásos folyamatok, valamint a megrepedt plakkokra tapadó thrombus.
2.10. Szekunder instabil állapotról akkor beszélünk, amikor az ischaemia hátterében valamilyen más kórfolyamat áll, mint láz, tachycardia, hyperthyreosis, anémia, valamint elégtelen koszorúér-áramlás hipotónia miatt.
3. NSTEMI és instabil angina finanszírozás rendje, finanszírozási algoritmus
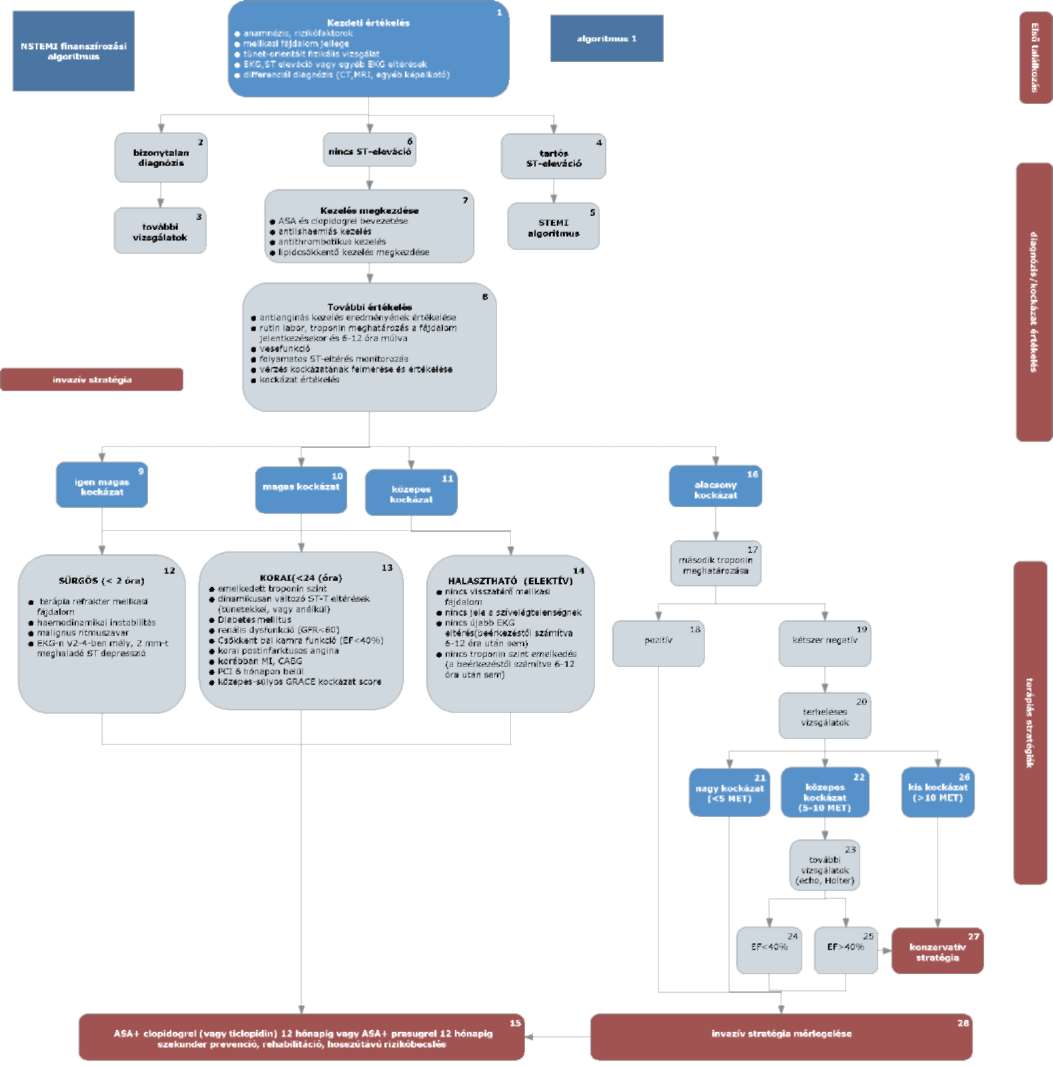
3.1. A finanszírozási algoritmus részletezése:
3.1.1. Kezdeti vizsgálatok: Instabil állapotra utal a nyugalmi, tartós (> 20 perc) mellkasi fájdalom, az új keletű típusos mellkasi fájdalom ("de novo" angina pectoris), és az egyre kisebb terhelésre jelentkező korábban stabil effort angina (crescendo angina), postinfarctusos angina. Panaszok coronaria eredetét erősíti: életkor, CV rizikófaktorok, kórtörténetben MI, PCI, ACBG. Az instabilitás jeleként kell értékelni, amennyiben a korábbi panaszok jellegében és erősségében, valamint a megszűnés módjában kedvezőtlen irányú változás következik be.
3.1.2. Fizikális vizsgálat: nincs jellegzetes fizikális lelet, ennek ellenére ebben a kórállapotban is gondosan elvégzendő a tünetorientált fizikális vizsgálat.
3.1.3. EKG: Az első észleléstől számított 10 percen belül. Leggyakrabban tranziens ST depresszió-, tranziens ST eleváció-, T hullám inverzió vagy pszeudonormalizáció. Fontos a panasz alatti és tünetmentes állapotban rögzített EKG-val, esetleg korábbi EKG-val való összehasonlítás. Amennyiben az EKG nem jellegzetes, sorozat EKG szükséges: 3 (6-9) és 24 óra múlva vagy azonnal, ha a mellkasi fájdalom ismét kialakul. A laterális infarktusok kimutatására V7-9 elvezetés, a jobb kamrai lokalizáció kimutatására a jobb oldali (V3R, V4R). Normál EKG nem zárja ki ischaemiás történés/progresszió lehetőségét!
3.1.4. Troponin meghatározás:
3.1.4.1. Központi laborban 60 percen belüli eredmény vagy "point of care" 0 és 6-9 órán belül.
3.1.4.2. High szenzitív (hs.) vagy ultra szenzitív troponin: 0 és 3 órán belül (releváns időben) negativ >95% predictív érték.
3.1.4.3. hs. Troponin T: 0 és 3 órán belül 100%-ban kizárja vagy megerősíti a NSTEMI diagnózisát (kivéve álpozitiv Troponin I okok).
3.1.4.4. Kardialis és nem kardialis eredetű NSTEMI-hez hasonló kórállapotok kizárása (differenciál diagnózis)
3.1.5. Kiegészítő diagnosztika lehetőségek:
3.1.5.1. Szükség esetén echocardiographia (falmozgászavar, balkamra diszfunkció, esetleges mechanikus szövődmények kimutatása).
3.1.5.2. MSCT ("triple rule out").
3.2. Amennyiben az előző vizsgálatok nem zárják ki egyértelműen az ACS lehetőségét (extrakardiális eredet), további kiegészítő vizsgálatok szükségesek.
3.3. Amennyiben az EKG tartós ST-elevációt (>20perc) mutat, a STEMI eljárásrend a mérvadó.
3.4. Mellkasi panaszokkal összefüggő Troponin pozitivitás, EKG ST-T eltérések esetén a NSTEMI eljárásrend a mérvadó (kivéve ST-eleváció).
3.5. A prehospitális sürgősségi ellátást követően gyógyszeres terápia megkezdése szükséges:
3.5.1. Nitroglycerin sublinqualisan vagy i.v. formában (sildenafil, vardenafil v. tadalafil szedése esetén kontraindikált), oxigén, fájdalomcsillapítás major analgetikummal.
3.5.2. nitroglycerin adása jobb kamrát is érintő lokalizáció esetén nem javasolt
3.5.3. clopidogrel + aszpirin kombinált adása (majd 12 hónapon keresztül történő folytatása)
3.5.4. antithrombotikus terápia (UFH i.v. aPTT 50-70 msec, enoxaparin 1 mg/tskg naponta 2x)
3.5.5. akut coronarographia-ra kerülő betegek esetében egyszeri nagydózisú clopidogrel adása szükséges (600 mg), amelyet 75 mg fenntartó dózissal kell folytatni
3.5.6. már a korai kórházi szakban szükséges a korai sztatin kezelés elkezdése
3.5.7. béta-receptor blokkolókat a kezelés megkezdésekor kell alkalmazni, egy időben az aszpirinnel, ha kontraindikáció nincs
3.5.8. már az első 24 órában ajánlott ACEI-kezelés csökkent bal kamra funkció (EF <40%) vagy szívelégtelenség esetén
3.5.9. ACEI intoleráns betegeknek ARB kezelés alkalmazása indokolt, amennyiben a szívelégtelenség vagy csökkent balkamra funkció (EF <40%) áll fenn
3.5.10. verapamil megfontolható szekunder prevenciós célzattal béta-receptor blokkoló kezelés abszolút kontraindikációja esetén, amennyiben a betegnek nincsen szívelégtelensége
3.6. A beteg kardiális kockázatának felmérése:
3.6.1. a megkezdett antianginás gyógyszeres kezelés eredményességének megítélése
3.6.2. labor (biomarkerek: a szívizomelhalás érzékeny markerei, quantitativ troponin meghatározás, hsCRP, NT pro BNP)
3.6.3. vesefunkció (GFR pontos meghatározása)
3.6.4. sorozat v. folyamatos ST-T monitorozás; ST depressio mértéke, kiterjedsége (két összetartozó elv. vagy több), ≥0,2 mV ST depressio 6x-s mortalitás növekedés vérzés kockázatának felmérése és értékelése (CRUSADE score alkalmazása)
3.6.5. rövid-középtávú rizikóbecslés szükséges (a GRACE score alkalmazása javasolt)
3.6.6. amennyiben nem a GRACE score alkalmazására kerül sor, egyéb nemzetközileg elfogadott, az intézmény által alkalmazott rizikóbecslés feltüntetése szükséges
3.7. A kockázatértékelés meghatározó a további terápia eldöntése céljából. A kockázatértékelés a kórtörténet, a tünetek, az EKG, a biomarkerszint alapján állapítható meg. Az ESC által ajánlott GRACE pontrendszerrel becsülhető meg a betegek kórházi, valamint a kórházi elbocsátást követő 6 hónap során bekövetkező halálozási rizikója. Nagy nemzetközi ACS populáción alapul, olyan egyszerű klinikai/EKG/labor adatokat használ, mint a kor, a szívfrekvencia, a systolés vérnyomás, a szérum kreatinin, a Killip-osztály a felvételkor, az ST depresszió, az emelkedett necroenzimek, illetve a keringésleállás ténye.
3.7.1. A beteg közepes vagy magas kockázatú csoportba sorolandó, ha az összesített GRACE pontszáma (>108) (ami a kórházi halálozási vagy MI rizikóra számolt közép szintű GRACE pontértéknek felel meg). Ilyen esetekben az invazív startégia a követendő. (Internetes hozzáférés: http://www.outcomes.org/grace)
3.8. Sürgős (<2 óra) invazív stratégia indokolt
3.8.1. V 2-4-ig mély ST depressio (mellkasi fájdalom mellett)
3.8.2. terápia refrakter mellkasi fájdalom és szívelégtelenség egyidejű megjelenése
3.8.3. haemodinamikai instabilitás
3.8.4. malignus kamrai ritmuszavar megjelenése
3.9. Korai (<24 óra) invazív stratégia indokolt
3.9.1. GRACE score >140 + legalább egy az alábbi magas rizikótényezők közül
3.9.1.1. jellegzetes troponin I, troponin T emelkedés/csökkenés dinamikus ST/T eltérések (tünetes vagy silent)
3.9.1.2. diabetes mellitus
3.9.1.3. csökkent balkamra-funkció (EF<40%)
3.9.1.4. renális dysfunctio (GFR<60)
3.9.1.5. korai postinfarktusos angina
3.9.1.6. anamnesisben korábban szívinfarktus vagy bypass műtét vagy 6 hónapon belüli PCI
3.9.2. <72 órán belül invaziv stratégia indokolt:
3.9.2.1. legalább egy a magas rizikók közül
3.9.2.2. visszatérő mellkasi fájdalom
3.10. Későbbre halasztható (elektív) invazív stratégia indokolt, ha:
3.10.1. nincs visszatérő mellkasi fájdalom
3.10.2. nincs jele a szívelégtelenségnek
3.10.3. nincs újabb EKG eltérés (a beérkezéstől számítva 6-12 óra után sem)
3.10.4. nincs troponin szint emelkedés (a beérkezéstől számítva 6-12 óra után sem)
3.11. PCI-t követően ASA+clopidogrel terápia legalább 1 évig.
3.11.1. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható készítmények a vonatkozó indikációs pontok szerint:
3.11.2. ST-eleváció nélküli akut coronaria szindrómában (instabil angina vagy NSTEMI/non-Q myocardialis infarctus) egy évig ASA-val kombinálva: clopidogrel hatóanyagú készítmények
3.11.3. Akut koronária szindróma (instabil angina, NSTEMI, STEMI) perkután endovasculáris intervencióját követően egy évig ASA-val kombinálva: clopidogrel hatóanyagú készítmények
3.11.4. Akut koronária szindróma (instabil angina, NSTEMI, STEMI), perkután endovasculáris intervencióját követően, amennyiben a clopidogrel terápia nem preferált: ticlopidine hatóanyagú készítmények
3.11.5. Az acut coronaria syndromás (NSTEMI-n) átesett betegek, akiknél percutan coronaria intervenció és stent beültetés történt, emellett kórelőzményükben stroke vagy transiens ischaemiás attack (TIA) nem szerepel és clopidogrel allergia vagy laboratóriumilag igazolt non-reszponzió vagy igazolt diabetes mellitus áll fenn vagy stent trombózist szenvedtek el, egy éven keresztül: prasugrel hatóanyag.
3.12. Kórházi halálozási vagy MI rizikóra számolt alacsony GRACE pontszám (<109) esetén (alacsony kockázatú beteg) további vizsgálatok elvégzése indokolt a kezelés irányának meghatározása céljából.
3.13. GRACE pontszám alapján alacsony kockázatú beteg esetében ismételt troponin meghatározása szükséges. Amennyiben az eredmény pozitív, coronarographia (és revaszkularizáció) elvégzése mérlegelendő.
3.14. GRACE pontszám alapján alacsony kockázatú beteg esetén ismételt troponin meghatározása szükséges. Amennyiben az eredmény negatív (2X), terheléses vizsgálatok elvégzése szükséges a beteg újbóli kockázatértékelése céljából.
3.15. A beteg nagy kockázatúnak minősíthető, amennyiben a terheléses vizsgálatokon 5 MET alatti teljesítménynél ischaemia provokálható. Ez esetben coronarographia (és revaszkularizáció) elvégzése mérlegelendő.
3.16. A beteg közepes kockázatúnak minősíthető, amennyiben a terheléses vizsgálatokon 5-10 MET közötti teljesítménynél ischaemia provokálható. Közepes kockázat mellett további vizsgálatok elvégzése szükséges.
3.17. Terheléses vizsgálat alapján közepes kockázat fennállása esetén további vizsgálatok elvégzése szükséges. Ultrahang vizsgálat a balkamra-funkció megítélése céljából (EF%), valamint Holter-vizsgálat malignus aritmia kimutatására.
3.18. Szívultrahang vizsgálattal igazolt csökkent balkamra-funkció (EF<40%) esetén vagy ha a Holter vizsgálat során malignus aritmia detektálható, akkor coronarographia (PCI) elvégzése mérlegelendő.
3.19. Szívultrahang vizsgálattal igazolt, jelentősen nem csökkent balkamra-funkció (EF>40%) esetén és ha a Holter vizsgálat során nincs malignus aritmia, akkor konzervatív terápia választható.
3.20. A beteg alacsony kockázatúnak minősíthető, amennyiben a terheléses vizsgálatokon csak 10 MET feletti teljesítmény mellett provokálható ischaemia.
3.21. Alacsony kockázat mellett konzervatív terápia választható (gyógyszeres terápia).
3.22. Perkután coronaria-intervenció (PCI) A perkután coronaria beavatkozások biztonsága és sikere ACS-ban lényegesen javult azóta, hogy kiterjedten alkalmazzák a stent kezelést és a hatékony thrombocyta-aggregáció gátlást.
4. NSTEMI kapcsán javasolt gyógyszeres terápiás javaslat:
4.1. A thrombotikus kockázat csökkentésére az aszpirin kezelést élethosszig kell folytatni.
4.2. Clopidogrel + aszpirin kombinált adása indokolt NSTEMI-t követően legfeljebb 12 hónapig.
4.3. Azoknak a betegeknek, akiknek anamnéziséban GI vérzés vagy fekély szerepel, PPI adása indokolt (kivéve omperazol).
4.4. Azon betegeknél, ahol az oralis antikoaguláció tiszta indikációja áll fenn (pitvafibrillatio CHA2DS2VASc-érték ≥2 vagy mechanikus műbillentyű hordozók), oralis antikoagulánst kell adni az antiaggregációs kezelés mellé. A stent implantációt követően a kötelező antikoaguláns indikáció miatt hármas kombinációjú (antikoaguláns+kettős antiaggregációs) antitrombotikus kezelésben részesülő betegeknél a kettős antiaggregációs kezelést a megengedett minimumra kell csökkenteni a vérzéses rizikó mérséklése érdekében. Amennyiben gyógyszerbevonatú stent (DES) kerül beültetésre, a kettős thrombocytaaggregáció-gátló + OAT kezelés minimális időtartama 6 hónap, egyes új generációs DES-ek esetében 3 hónap. Amennyiben nem gyógyszerbevonatú stent (BMS) kerül beültetésre, a kettős thrombocytaaggregáció-gátló + OAT kezelés minimális időtartama 1 hónap.
4.5. Már a korai kórházi szakban szükséges a magas dózisú sztatin kezelés elkezdése, ha nincsen kontraindikáció.
4.5.1. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható készítmények a vonatkozó indikációs pont szerint:
Kardiovaszkuláris betegségben (ACS, STEMI, nonSTEMI) igen nagy kardiovaszkuláris rizikó és hyperlipidaemia esetén, ha legalább 20 mg rosuvastatinnal vagy legalább 40 mg atorvastatinnal folytatott három hónapos kezelést követően laborkontroll alapján nem sikerült a kívánt célérték elérése (LDL 1,8 mmol/l, össz. Chol. 3,5 mmol/l), vagy amennyiben bizonyíthatóan sztatin intolerancia (CK emelkedés, egyértelműen sztatin terápiára visszavezethető szignifikáns májfunkció eltérés) áll fenn. Az ezetimibe hatóanyagú készítmény alkalmazása javasolt akkor is, ha bizonyított mellékhatás miatt csak kisebb adag sztatin szedése lehetséges, amely mellett nem sikerült a célérték elérése: ezetimibe és ezetimibe hatóanyagú készítmények.
4.6. Béta-receptor blokkolókat a kezelés megkezdésekor kell alkalmazni, ha nincsen kontraindikáció.
4.7. Már az első 24 órában ajánlott ACEI-kezelés csökkent bal kamra funkció (EF <40%), bizonyított szívelégtelenség, diabétesz és anterior infarktus esetén.
4.8. Eplerenon (NYHA III-IV és ha a EF <40%), ha nincs veseelégtelenség.
4.9. ACEI intoleráns betegeknek ARB kezelés alkalmazása indokolt, amennyiben szívelégtelenség vagy csökkent balkamra funkció (EF <40%) áll fenn.
4.10. A fizikai aktivitás fokozatos megkezdése szükséges ACS-t követően. A beteg funkcionális kapacitásának felmérése a kórházi elbocsátást követő 4-7 héten belül indokolt (terheléses EKG-val, vagy egyéb non-invazív teszttel az ischemia kimutatására). A szív- és érrendszeri állapot és a funkcionális fizikai kapacitás felmérése alapján a beteget tájékoztatni kell a fizikai aktivitás újrakezdésének időpontjáról, annak szintjéről, beleértve a fizikai tréninget, a munkát és a szexuális aktivitást is.
4.11. Rehabilitáció, élethosszig tartó szekunder prevenció, hosszú távú rizikóbecslés szükséges. A rizikófaktorok eliminálása (dohányzás, étrend, életmód), illetve adekvát kezelése (diabétesz, hipertónia) elengedhetetlen.
5. Az ellenőrzés alapját képező finanszírozás szempontból lényeges sarokpontok
5.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
5.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
5.1.2. Betegadatok (online TAJ ellenőrzés)
5.1.3. Jogszabályba foglalt adatszolgáltatási kötelezettség a Nemzeti Infarktus Regiszterben
5.2. Szakmai ellenőrzési pontok
5.2.1. A diagnózis kritériumainak rögzítése (BNO: M08.0)
5.2.1.1. anamnézis, rizikófaktorok
5.2.1.2. mellkasi panaszok jellege
5.2.1.3. EKG ST-T eltérések
5.2.1.4. troponin pozitivitás, amennyiben nincs sürgős szállítás
5.2.1.5. regionális falmozgás zavar detektálása, amennyiben nincs sürgős szállítás
5.2.2. A kórkép korai kezelésének megkezdése és dokumentálásának ellenőrzése
5.2.2.1. ASA+clopidogrel
5.2.2.2. ASA+prasugrel
5.2.2.3. sztatin kezelés
5.2.2.4. béta-blokkoló
5.2.2.5. ACE-gátló vagy ACE gátló intolerancia esetén ARB (csökkent balkamra funkció esetén)
5.2.3. A kezelés stratégiájához elengedhetetlen kockázat-besorolás ellenőrzése
5.2.3.1. GRACE-score alkalmazása
5.2.3.2. GRACE-score hiányában egyéb validált kockázat-besorolás alkalmazása
5.2.3.3. invazív stratégia megválasztásának kritériumai
5.2.3.4. CRUSADE-score alkalmazása
6. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
6.1. A területre fordított közkiadások alakulása.
6.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
7. A finanszírozási szempontból lényeges finanszírozási kódok
7.1. A releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | I2000 | Instabil angina pectoris |
| 3 | I2100 | Heveny elülső fali transmuralis szívizomelhalás |
| 4 | I2110 | Heveny alsó fali transmuralis szívizomelhalás |
| 5 | I2120 | Egyéb lokalizációjú heveny transmuralis szívizomelhalás |
| 6 | I2140 | Heveny subendocardialis szívizomelhalás |
| 7 | I2190 | Heveny szívizomelhalás, k.m.n. |
| 8 | I2191 | Heveny szívizomelhalás, k.m.n. Q hullám nélkül |
| 9 | I2200 | Ismétlődő elülső fali szívizomelhalás |
| 10 | I2210 | Ismétlődő inferior szívizomelhalás |
| 11 | I2280 | Ismétlődő szívizomelhalás egyéb lokalizációban |
| 12 | I2290 | Ismétlődő szívizomelhalás nem meghatározott helyen |
| 13 | I2490 | Heveny ischaemiás szívbetegség, k.m.n. |
7.2. A releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 12601 | EKG végtag és mellkaselvezetéssel |
| 4 | 3612D | Echocardiographia color Doppler |
| 5 | 3612A | Echocardiographia (M-mód, 2D) |
| 6 | 21082 | Kardiális troponinI meghatározása |
| 7 | 21083 | Kardiális troponin T meghatározása |
| 8 | 2489B | CK-MB koncentráció meghatározása immunmódszerrel |
7.3. A releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 2081 | AMI PCI-vel (egy vagy több stenttel) |
| 3 | 2082 | AMI PCI-vel, stent nélkül |
| 4 | 2221 | Instabil angina, Q hullám nélküli infarctus speciális intravénás thrombocyta aggregáció gátló kezeléssel |
| 5 | 2070 | AMI speciális kezelés nélkül |
| 6 | 177A | Coronaria bypass, katéterezéssel |
7.4. A releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | B01AC06 | acetilszalicilsav |
| 3 | B01AC04 | clopidogrel |
| 4 | B01AC22 | prasugrel |
| 5 | B01AC16 | eptifibatid |
| 6 | B01AC17 | tirofiban |
| 7 | B01AB05 | enoxaparin |
| 8 | B01AB06 | nadroparin |
| 9 | C10AA01 | simvastatin |
| 10 | C10AA05 | atorvastatin |
| 11 | C10AA07 | rosuvastatin |
| 12 | C10AX09 | ezetimibe |
| 13 | C10BA05 | atorvasztatin és ezetimibe |
| 14 | C09A | ACE-inhibitorok önmagukban |
| 15 | C09B | ACE-inhibitorok kombinációban |
| 16 | C09CA | angiotensin II antagonisták önmagukban |
| 17 | C09D | angiotensin II antagonisták kombinációi |
| 18 | C07AB02 | metoprolol |
| 19 | C07AB03 | atenolol |
| 20 | C07AB07 | bisoprolol |
| 21 | C07AB12 | nebivolol |
| 22 | C07AG02 | carvedilol |
| 23 | C07BB07 | bisoprolol+thiazidok |
| 24 | C07FB02 | metoprolol+egyéb vérnyomáscsökkentők |
8. Rövidítések
ACEI: angiotenzin-konvertáló enzim gátlók
ACBG: aorto-coronaria bypass graft
ACS: akut coronaria szindróma
ARB: angiotenzin receptor gátlók
CX: coronaria circumflexa (körbefutó coronaria ág)
CV: cardiovascularis
DES Gyógyszerkibocsátó stent (drug-eluting stent)
ESC: European Society of Cardiology
IA Instabil angina
ISZB (CAD): ischaemiás szívbetegség (coronary artery disease)
Killip kategóriák: a szívelégtelenség osztályozására használt kategória
LAD: left anterior descending (bal elülső leszálló coronaria ág)
MET: metabolikus ekvivalens
MI: myocardialis infarktus
MSCT: multi-slice CT
OAT: oralis antikoaguláns terápia
PCI: percutan coronaria intervenció"
28. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"25. melléklet a 31/2010. (V. 13.) EüM rendelethez
A stabil angina pectoris diagnosztikájának és terápiájának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Stabil angina pectoris
2. Kórkép leírása
2.1. A stabil angina pectoris az ischaemiás szívbetegségek leggyakoribb klinikai megnyilvánulási formája. Minden második ischaemiás szívbetegnél a szívizom vérellátási zavara a stabil angina pectoris klinikai tünet együttesét okozza. A patofiziológiai háttér ebben az esetben a szívizom oxigén igénye és a kínálat közötti -rövid ideig tartó - egyenlőtlenség. A szívizom ischaemiának számos következménye van, illetve lehet (diasztolés, majd szisztolés bal kamrai diszfunkció, perfúziós zavar, EKG eltérés, mellkasi fájdalom), ezek közül a mindennapi klinikai gyakorlatban a mellkasi fájdalom (diszkomfort) az, ami miatt a beteg legtöbbször orvoshoz fordul. Ezek a panaszok típusosan terhelés hatására jelentkeznek, a terhelés megszüntetésekor (nyugalomban) vagy sublinguális nitroglycerin hatására rövid idő alatt (néhány perc) megszűnnek.
2.1.1. Típusos angina pectorisról beszélünk ha:
2.1.1.1. a panaszt terhelés vagy emocionális stressz váltja ki,
2.1.1.2. a mellkasi panasz (fájdalom, illetve dyscomfort) retrosternalisan jelentkezik,
2.1.1.3. a panasz a terhelés megszüntetésére, illetve nitroglicerin hatására percek alatt megszűnik.
2.1.2. Atípusos angináról beszélünk, ha a fenti kritériumok szerint kettő, illetve extracardialis mellkasi panaszról, ha egy kritérium van jelen. Ugyancsak extracardialis jellegű a mellkasi panasz, ha a fent felsorolt jellemzők egyike sem szerepel a panaszok között.
2.1.3. Stabil angina pectorisról beszélünk, amennyiben a mellkasi panaszok többé-kevésbé azonos terhelésre jelentkeznek, a panasz erőssége és megszűnése is hasonló. A stabil angina pectoris előfordulásával kapcsolatban hazai epidemiológiai adatokkal nem rendelkezünk, de az irodalmi adatokat extrapolálva hazánkban 400 000 stabil angina pectorisban szenvedő betegre lehet számítani.
2.1.4. A stabil angina pectoris jó prognózisú betegség. Stabil anginás betegek között a hirtelen szívhalál és szívinfarktus éves gyakorisága 0,5-2,6% között van. A prognózist befolyásolja a koszorúerek anatómiai eltérésének súlyossága, a myocardium ischaemia jelenléte és nagysága vagy hiánya, a funkcionális vizsgálatok eredménye.
2.1.5. Az angina pectoris másik megjelenési formája az instabil angina pectoris, amelyre az alábbi körülmények esetén kell gondolni:
2.1.5.1. a típusos lokalizációban érzett mellkasi fájdalom nyugalomban jelentkezik, ideje némileg hosszabb, mint az effort stabil angina pectoris,
2.1.5.2. a korábban stabil angina pectoris jellege viszonylag gyorsan megváltozik: kisebb terhelésre jelentkezik, a mellkasi fájdalom intenzívebb, nehezebben, illetve lassabban szűnik meg, mint korábban,
2.1.5.3. instabil anginának tekintjük az újonnan fellépő, jelentős fizikai korlátozást okozó, típusos anginát az első jelentkezéstől számított 2 hónapon belül.
2.1.6. Az instabil angina pectoris diagnózisát és ellátását külön diagnosztikus és terápiás eljárásrend tárgyalja.
2.1.7. A stabil angina pectoris diagnózisának felállítása és a klinikai megítélés magában foglalja a panaszok kardiális eredetének igazolását, a tünetek extrakardiális eredetének kizárását, a társbetegségek vizsgálatát. A diagnózis felállítását követően, illetve azzal egy időben a beteg prognózisának megítélése is követelmény, mivel ezen tényezők alapján lehet eldönteni az invazív vizsgálatok indikációját, illetve kerül meghatározásra a kezelési stratégia (antiischaemiás kezelés, revaszkularizáció, több kezelési mód sequentiális alkalmazása). A stabil angina pectoris klinikai megítélését segíti a Kanadai Kardiovasculáris társaság (Canadian Cardiovascular Society) klasszifikációja, amely a panaszok 4 súlyossági fokát különíti el. A súlyossági beosztást a 2.1.8. alpontban foglalt táblázat tartalmazza.
2.1.8. Az angina pectoris súlyosságának megítélése a Kanadai Kardiovasculáris társaság (CCS) beosztása alapján
| A | B | |
| 1 | Class I. (CCS I.) | A szokásos fizikai tevékenység nem okoz panaszt. A szokásos aktivitásnál azonban nehezebb és tartósabb fizikai igénybevétel mellkasi fájdalmat vált ki. |
| 2 | Class II. (CCS II.) | A szokásos fizikai igénybevétel enyhe fokban korlátozott. Sietés, lépcsőn járás (egy emelet megtétele), étkezés utáni fizikai aktivitás mellkasi fájdalmat vált ki. |
| 3 | Class III. (CCS III.) | A szokásos fizikai aktivitás jelentős mértékben beszűkült. Normál tempóban történő járás, lassú tempóban emelkedőre menet, illetve sík talajon sétálás panaszt okoz. |
| 4 | Class IV. (CCS IV.) | Bármiféle fizikai aktivitás mellkasi fájdalmat okoz, illetve esetenként a panasz nyugalomban is előfordul. |
2.1.9. Pathomechanizmus
2.1.9.1. Az angina pectorist a myocardium rövid ideig tartó ischaemiája okozza. A myocardium ischaemiának számos következménye van, illetve lehet ("ischaemiás cascade") az ischaemiás mellkasi fájdalom ennek a folyamatnak egy viszonylag későn jelentkező tünete.
2.1.9.2. A myocardium ischaemia azonban mellkasi fájdalom nélkül is kialakulhat ("silent ischaemia"). A myocardium elégtelen vérellátása (ischaemia) akkor következik be, ha a szív oxigén igénye és az oxigén kínálat között discrepantia alakul ki.
2.1.9.3. Az oxigén igényt meghatározza a szívfrekvencia és a szisztolés vérnyomás. A két érték szorzata az ún. kettős szorzat: az ischaemiás küszöb egyik jellemzője. Az oxigén kínálatot a koszorúér keringés és a vér oxigénszállító kapacitása határozza meg.
2.1.9.4. Az ischaemiának lehet cardiális, illetve extracardialis oka. A leggyakoribb kardiális ok a koszorúerek keringést limitáló szűkülete, de ischaemiát okozhat ép koszorúerek mellett is az aorta stenosis vagy a hypertrofiás cardiomyopathia. Az extracardialis okok közül a leggyakoribb az anaemia, de hypertoniás krízist is kísérhet angina pectoris.
2.1.9.5. A pathomechanizmus egy speciális formája, amikor a koszorúér keringés vasospasmus következtében csökken kritikus szintre (Prinzmetal angina pectoris).
2.1.9.6. A vasospasmus jelentkezhet anatómiailag ép, illetve olyan éren, amelyen van organikus szűkület. Ez utóbbi esetben az ischaemia kialakulásában több pathogenetikai tényező szerepel.
3. A mellkasi panaszokkal jelentkező betegek megítélésének folyamatábrája
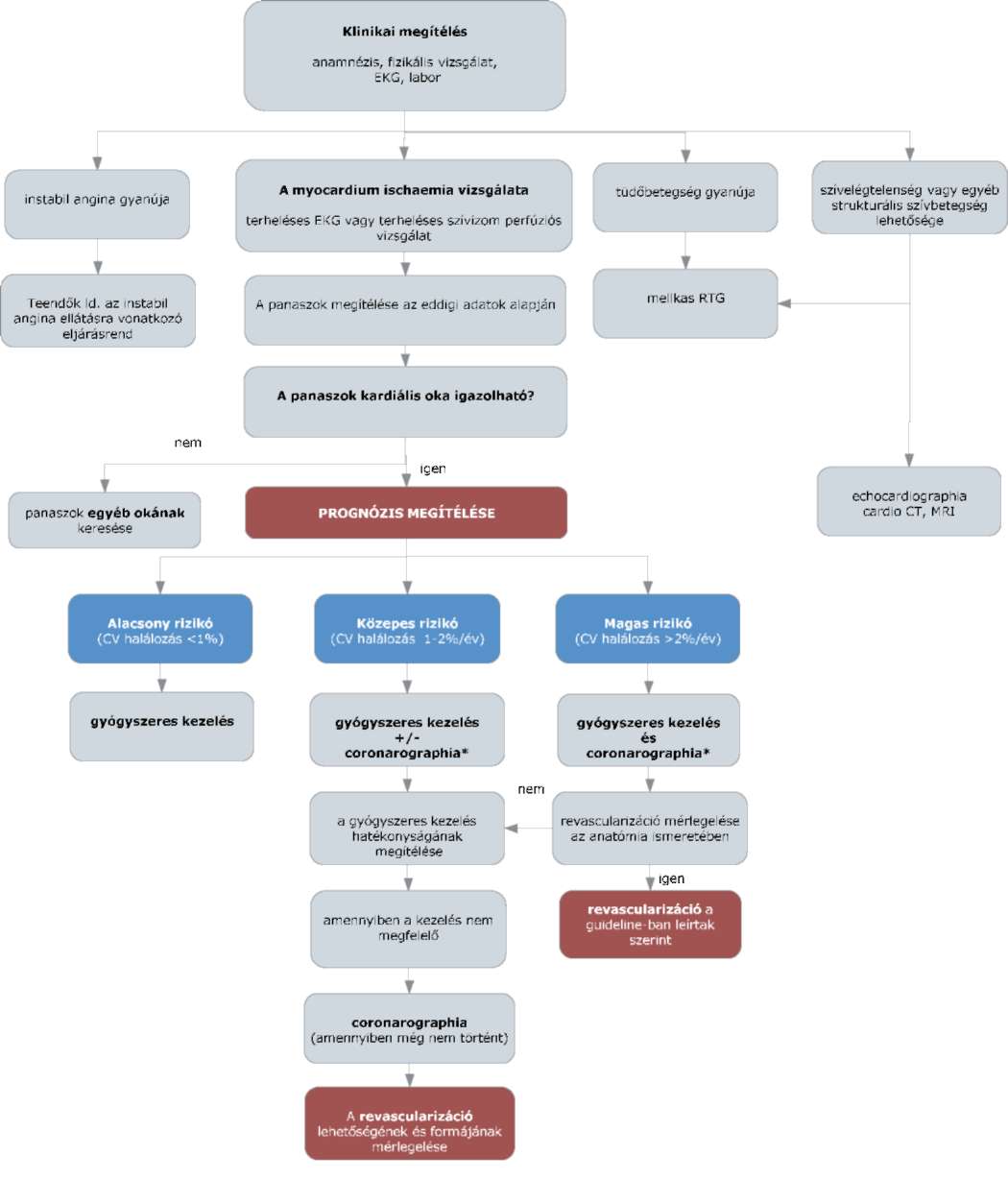
*A coronarographia elvégzése a panaszoktól és a klinikai megítéléstől függ.
3.1. A finanszírozási algoritmus részletezése
3.1.1. Anamnézis, fizikális vizsgálat
A részletes és pontos anamnézis a beteg megítélésének egyik legfontosabb eleme. Szükséges kitérni a családi anamnézisre, valamint a társbetegségekre is. A fizikális vizsgálat minden esetben elvégzendő, az esetek egy részében angina pectorist okozó egyéb strukturális szívbetegségre utaló eltérést lehet találni, más esetekben a panasz extracardialis magyarázatának lehetősége merül fel. Számos esetben a fizikális vizsgálat negatív.
3.1.2. EKG
3.1.2.1. Kötelezően elvégzendő:
3.1.2.1.1. beteg első vizsgálatakor és
3.1.2.1.2. amennyiben a beteg mellkasi fájdalmat érez.
Ez utóbbi esetben az EKG-t javasolt megismételni a panasz megszűnésekor. A nyugalmi 12 elvezetéses EKG stabil angina pectoris esetén a betegek 70%-ában szabályos. A kóros EKG többek között lezajlott myocardialis infarctusra utaló eltéréseket mutathat. Diagnosztikus jelentőségű lehet az EKG vizsgálat, amennyiben a panasz alatt és a tünetek megszűnését követően sikerül EKG-t készíteni. A reverzibilis ST-T eltérések valószínűsítik az ischaemiás szívbetegség diagnózisát. Amennyiben a panasz alatt az EKG nem változik, ez nem zárja ki a panaszok ischaemiás eredetét.
3.1.3. Laboratóriumi vizsgálatok
3.1.3.1. Kötelezően elvégzendő vizsgálatok: éhomi vércukor, lipidek (LDL, HDL, triglicerid), teljes vérkép (beleértve a Hb meghatározást), szérum kreatinin, Na, K, CRP.
3.1.3.2. A klinikai megítéléstől függően elvégzendő vizsgálatok: biomarkerek (magas szenzitivitású troponin), pajzsmirigy funkciós vizsgálatok.
3.1.3.3. Javasolt: a terheléses vércukor (OGT) vizsgálat, HgbA1c ismert diabetes esetén, kreatin kináz szint korai sztatin terápia esetén, valamit transzamináz szintek.
3.1.4. Terheléses EKG vizsgálat
Kötelezően elvégzendő: amennyiben a beteg panasza angina pectoris gyanúját kelti és a koszorúér betegség valószínűsége közepes vagy magas (3.1.4.1 táblázat), kivéve azon betegeket, akik egyéb okból nem terhelhetők, illetve az EKG nem teszi lehetővé annak terhelés során történő értékelését. A terheléses vizsgálatok kontraindikációit a 3.1.4.2. táblázat tartalmazza.
3.1.4.1. A koszorúér betegség valószínűsége
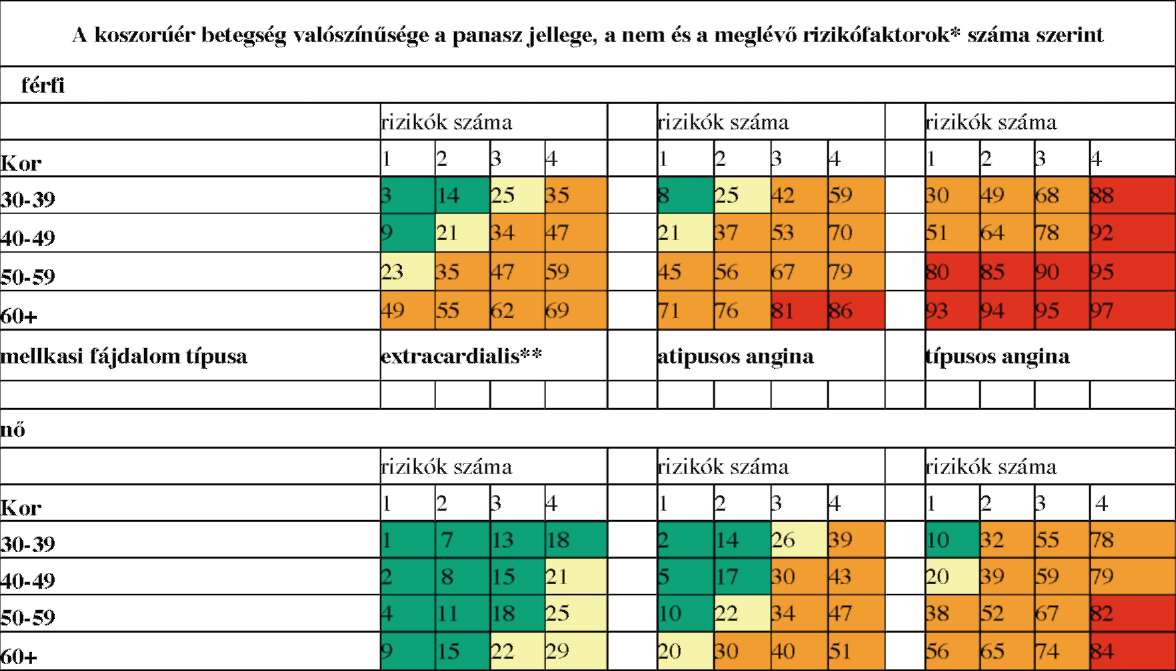

3.1.4.2. A terheléses vizsgálat kontraindikációi
| A | |
| 1 | Terheléses képalkotó vizsgálatok abszolút kontraindikációi |
| 2 | nem kontrollált hypertenzió: >200 Hgmm systolés, illetve 110 Hgmm diastolés |
| 3 | akut myocardiális infarctus vagy instabil angina |
| 4 | akut myocarditis vagy pericarditis |
| 5 | symptomás szívelégtelenség |
| 6 | szimptomás súlyos aorta stenosis |
| 7 | egyéb (pl. anaemia, hyper-hypokalaemia, lázas állapot, ismert súlyos gyulladásos kórkép) |
3.1.5. Terheléses képalkotó vizsgálatok
A terheléssel összekapcsolt myocardium perfúziós izotóp- és echocardiográfiás vizsgálatok alkalmazására kerül leggyakrabban sor. Amennyiben a fiziológiás viszonyokat leginkább megközelítő dinamikus terhelés valamilyen okból nem kivihető, farmakológiai terhelést szükséges végezni valamely képalkotó vizsgálat alkalmazása során. Ezen vizsgálómódszerek alkalmazására sokszor prognosztikai megítélés miatt is sor kerül. A terheléses vizsgálatok érzékenységét és fajlagosságát a 3.1.5.1 táblázatban foglaljuk össze.
3.1.5.1. A terheléses EKG és a terheléses képalkotó vizsgálatok érzékenysége és fajlagossága*
| A | B | C | |
| 1 | Érzékenység (%) | Fajlagosság (%) | |
| 2 | Terheléses EKG | 68 | 77 |
| 3 | Terheléses echo | 80-85 | 84-86 |
| 4 | Terheléses myocardium perfúziós izotóp vizsgálat | 85-90 | 70-75 |
* Az érzékenység és a fajlagosság értékei a coronarographia eredményéhez viszonyítva kerültek meghatározásra
3.1.5.2. A terheléses képalkotó vizsgálatok elvégzésének indikációi, amennyiben angina pectorisra utaló panaszok miatt történik a vizsgálat:
3.1.5.2.1. A nyugalmi EKG nem teszi lehetővé a terheléses EKG értékelését (Bal Tawara szárblokk, pacemaker ritmus, WPW syndroma, >1 mm ST depresszió a nyugalmi EKG-n).
3.1.5.2.2. Amennyiben a terheléses EKG nem diagnosztikus.
3.1.6. Holter vizsgálat
A Holter vizsgálat hasznos információt adhat, amennyiben az angina pectoris és ritmuszavar lehetősége merül fel, illetve vasospasticus anginára van gyanú. A Holter vizsgálat a silent epizódok felismerésére is alkalmas.
3.1.7. Echocardiográfia
Kötelezően elvégzendő vizsgálat az alábbi esetekben:
3.1.7.1. A hallgatózási lelet strukturális szívbetegség gyanúját kelti.
3.1.7.2. A beteg panaszai és/vagy a fizikális vizsgálat szívelégtelenségre utal.
3.1.7.3. Postinfarctusos betegek esetén.
3.1.7.4. Amennyiben az EKG-n Bal Tawara szárblokk, bal anterior hemiblokk, pathológiás Q hullám vagy egyéb jelentősen kóros eltérés látható.
3.1.8. Koronarográfia
3.1.8.1. A koronarográfia alapvető jelentőségű annak megítélésében, hogy a stabil angina pectoris hátterében milyen anatómiai eltérések állnak, van-e, és ha igen milyen mértékű és kiterjedésű koszorúér szűkülete van a betegnek. A koszorúér szűkület nem jelenti, hogy az adott elváltozás ischaemiát okoz, ennek megítélése a nem invazív vizsgálatok eredményének figyelembe vételével történhet. A koronarográfia során elvégzett speciális vizsgálatok [pl. frakcionált flow reserv (FFR)] teszik lehetővé az adott érszűkület funkcionális jelentőségének pontos megítélését. Az FFR vizsgálat eredménye alapján percután intervenció ad igazán optimális késői eredményt.
3.1.8.2. A koronarográfia indikációi:
3.1.8.2.1. Súlyos stabil angina pectoris (CCS III-IV), különösen ha a panaszok gyógyszeres kezeléssel nem, vagy nem a kívánt mértékben befolyásolhatók
3.1.8.2.2. Angina pectoris esetén, ha a nem invazív vizsgálatok közepes vagy magas rizikóra utalnak (ld. 3.1.4.1. táblázat)
3.1.8.2.3. Angina pectoris és szívelégtelenség együttes előfordulása esetén
3.1.8.2.4. Sikeres újraélesztés után
3.1.8.2.5. Ha a betegnél malignus arrhythmia lépett fel
3.1.8.2.6. Revaszkularizációs beavatkozás (CABG, PCI) után, ha a betegnél a beavatkozás után röviddel közepes vagy súlyos anginás panaszok lépnek fel
3.1.8.2.7. Olyan betegeknél, akiknél a nem invazív vizsgálatok nem egyértelműek és a közepes vagy magas kockázati csoportba tartoznak
3.1.8.2.8. PCI-t követően, amennyiben a betegnél nagy a restenosis rizikója és a beavatkozás prognosztikai szempontból fontos lokalizációban történt (pl. főtörzs, illetve anterior desecendens proximális szakaszán végzett PCI)
3.1.9. Kórházi elhelyezés, szakorvosi ellátás az angina pectoris különböző klinikai megjelenési formái esetén
A beteg tünetei és panaszai alapján a szakorvosi ellátás menedzsmentet a 3.1.9.1. táblázat tartalmazza:
3.1.9.1. A beteg panaszai alapján elvárt betegség menedzsment
| A | |||
| 1 | Elvárt betegség menedzsment | ||
| 2 | Klinikai kép | Ellátóhely | Ellátás ideje* |
| 3 | instabil angina | Kardiológiai Osztály Koronária Őrző (II. progresszivitási szint) Kardiológiai Osztály szívkatéteres lehetőséggel (IIa. progresszivitási szint) | azonnal |
| 4 | új keletű mellkasi panasz "de novo" angina | Kardiológiai szakrendelés Kardiológiai Osztály Koronária Őrző (II. progresszivitási szint) | 1-2 nap |
| 5 | ismert ISZB progrediáló anginás tünetek | Kardiológiai szakrendelés Kardiológiai Osztály Koronária Őrző (II. progresszivitási szint) | 1-2 nap |
| 6 | krónikus stabil angina | kardiológiai szakrendelés | 2 hét |
* Amennyiben a szakrendelésen a megjelölt időben az ellátás nem biztosítható, kórházi felvétel javasolt.
3.2. A stabil angina pectoris miatt kezelt betegek rizikó stratifikációja
A betegek ellátása, a különböző kezelési modalitások indikációja függ a beteg kockázatától, amely a panaszok súlyossága és a nem invazív vizsgálatok eredménye alapján kerül megállapításra. A terheléses EKG eredménye alapján első lépésben megbecsülhető az angiográfiával igazolt koszorúér betegség valószínűsége (3.2.1. táblázat). A terheléses EKG alapján meghatározható a beteg veszélyeztetettsége (rizikó klasszifikáció). A terhelhetőség alapján megállapítható rizikót a 3.2.2. táblázat mutatja. A terheléses képalkotó vizsgálatok alapján megállapítható kockázatbecslést a 3.2.3. táblázat mutatja.
3.2.1. A koszorúér betegség valószínűsége a terheléses EKG eredménye alapján
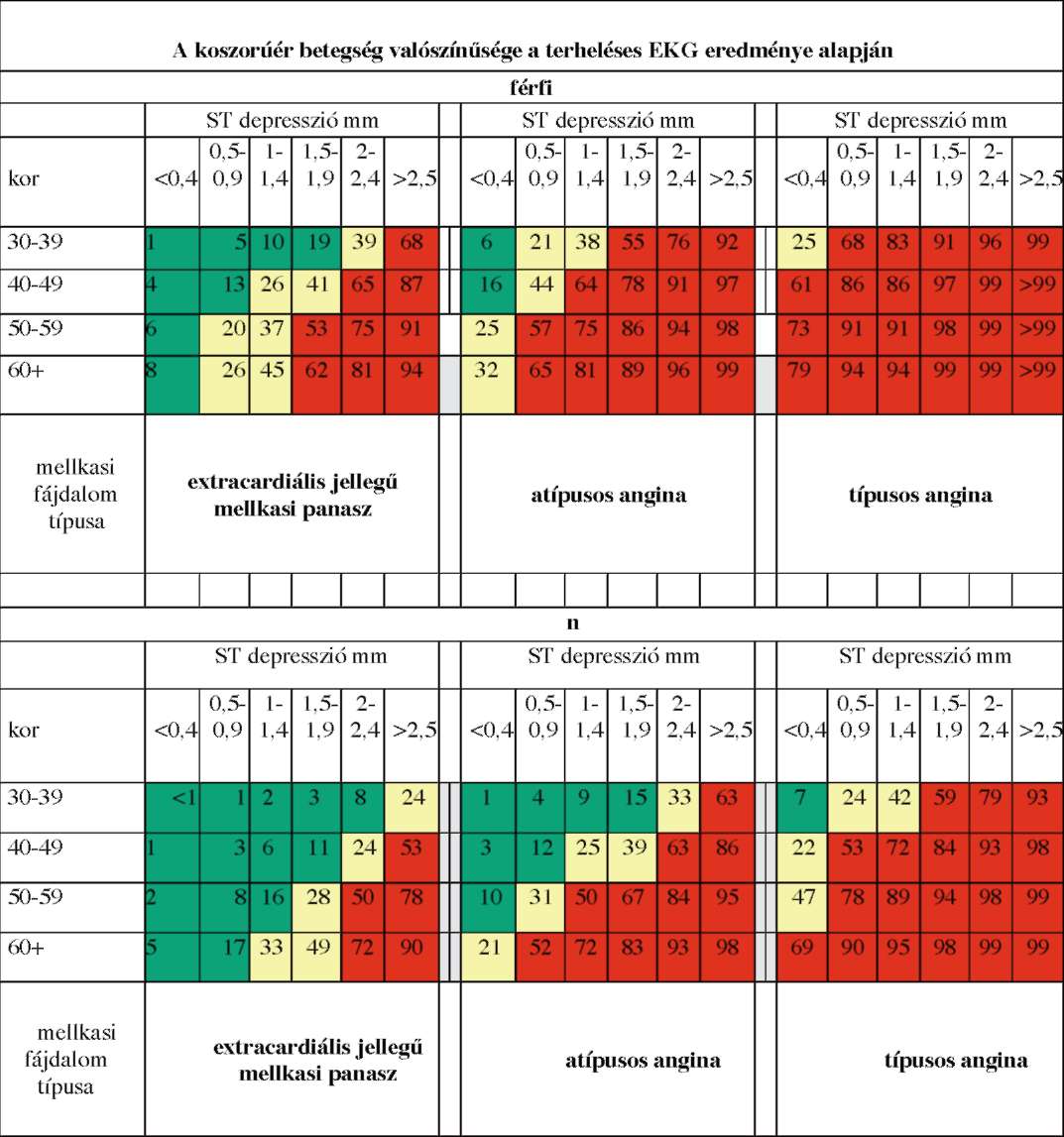
3.2.2. Kockázatfelmérés a terheléses EKG eredmény alapján
| A | B | ||
| 1 | Kockázatfelmérés: terheléses EKG vizsgálat | ||
| 2 | Elért maximális teljesítmény | rizikócsoport | |
| 3 | 10 MET felett | alacsony | |
| 4 | 5-9 MET | közepes |
| 5 | 5 MET alatt | magas |
3.2.3. A kerékpár ergometriás terhelés Watt értékeihez tartozó MET értékek
| A | B | |
| 1 | Watt | MET |
| 2 | 25 | 2 |
| 3 | 50 | 4 |
| 4 | 75 | 5 |
| 5 | 100 | 6 |
| 6 | 125 | 7,5 |
| 7 | Watt | MET |
| 8 | 150 | 8,5 |
| 9 | 175 | 10 |
| 10 | 200 | 11 |
3.2.4. Duke Treadmill Score számítása
| A | ||
| 1 | Duke Treadmill Score számítása | |
| 2 | Total score: Bruce protokoll szerint idő (sec) - 5x maximum ST deviáció (mm) - 4x angina index (0=angina nincs, 1=angina nem limitálva, 2=limitált angina) | |
| 3 | Duke Treadmill Score | rizikó csoport |
| 4 | ≤ -11 | magas |
| 5 | -10-től +4ig | közepes |
| 6 | ≥ +5 | alacsony |
Terheléses vizsgálat a Bruce protokoll szerint. A score értéke = terhelési idő - 5x legnagyobb ST eltérés (mm) -4x angina index. Angina index: 0 = nem jelentkezett angina, 1 = angina jelentkezett, de a terhelés megszakítását nem indokolta, 2 = a terhelés megszakítását indokló angina pectoris.
3.2.5. A betegek kockázatfelmérése a terheléses képalkotó vizsgálatok eredménye alapján
3.2.5.1. Terheléses echokardiográfia: kockázatfelmérés
| A | B | |
| Terheléses echokardiográfia: kockázatfelmérés | ||
| vizsgálati eredmény | rizikócsoport | |
| alacsony dózisú dopamin adása mellett extenzív falmozgászavar >2 szegmensben | magas | |
| (≤10 mg/kg/min) vagy alacsony szívfrekvencia mellett (<120/min) | ||
| enyhe/közepes fokú nyugalmi balkamra diszfunkció (LVEF: 35%-49% | közepes | |
| magasabb dózisú dopamin adása mellett ≤2 szegmensben mérsékelt fokú ischaemia falmozgászavarral | ||
| normális falmozgászavar, vagy nincs változás a nyugalmi falmozgászavarhoz képest | alacsony | |
3.2.5.2. Myocardiális perfúziós szcintigráfia: kockázatfelmérés
| A | B | |
| Myocardiális perfúziós szcintigráfia: kockázatfelmérés | ||
| vizsgálati eredmény | rizikócsoport | |
| terhelésre nagy kiterjedésű perfúziós zavar (kiváltképp anterior) | magas | |
| terhelésre közepes kiterjedésű több lokalizációban észlelt perfúziós zavar | ||
| nagy kiterjedésű fix perfúziós zavar és balkamra dilatáció | ||
| terhelésre közepes kiterjedésű perfúziós zavar és balkamra dilatáció | ||
3.2.5.3. Myocardiális perfúziós szcintigráfia: kockázatfelmérés
| A | B | |
| Myocardiális perfúziós szcintigráfia: kockázatfelmérés | ||
| enyhe/közepes fokú nyugalmi balkamra dysfunkció (EF: 35%- 49%) | közepes | |
| terhelésre közepes fokú perfúziós zavar balkamra dilatáció nélkül | ||
| normális vagy enyhe fokú myokardiális perfúzió zavar nyugalomban vagy terhelésre** | alacsony | |
| ** Amennyiben a betegnél magas rizikó igazolódott treadmill score alapján vagy a nyugalmi balkamra ejectiós frakció < 35%, a vizsgálat eredménye nem értékelhető | ||
3.3. A stabil angina pectoris gyógyszeres kezelése
3.3.1. A stabil angina pectoris miatt kezelt betegek kezelésének két fő célja van: a prognózis javítása és a tünetek megszüntetése vagy csökkentése. Nagy esetszámú, randomizált vizsgálatok igazolják, hogy stabil angina miatt kezelt betegeknél a megfelelő életmód és a gyógyszeres kezelés az elsőként választandó terápiás modalitás.
3.3.2. A prognózis javítása szempontjából a megfelelő életmód és az alábbi gyógyszeres kezelés együttes alkalmazása javasolt:
3.3.2.1. A megfelelő életmód szempontjából szükséges a dohányzás elhagyása, a mediterrán diéta és a rendszeres fizikai aktivitás.
3.3.2.2. Alacsony dózisú aszpirin kezelés. Napi 100 mg aszpirin - kontraindikáció hiányában - minden betegnél alkalmazandó. Tekintettel arra, hogy a nem steroid gyulladáscsökkentő kezelés (COX-2 gátlók) fokozzák a thrombotikus események rizikóját, ezen készítményeket - ha adásuk egyéb okból nem mellőzhető - mindig alacsony dózisú aszpirin készítménnyel együtt kell adni. A NSAID kezelés esetén ibuprofen vagy diclofenac helyett a naproxen részesítendő előnyben. Amennyiben a betegnél aspirin intolerencia áll fenn, akkor clopidogrel alkalmazandó.
3.3.2.3. Sztatin kezelés számos mechanizmus útján csökkenti a koszorúér betegek rizikóját, mind a primer, mind a secunder prevenció esetén. Az erőteljes (agresszív) statin kezelés eredményességét számos nagy esetszámú, randomizált vizsgálat igazolta. A célértékek egyre szigorúbbak. Minél alacsonyab LDL szintet sikerül elérni, annál jobb a betegek prognózisa.
3.3.2.4. ACE gátló/ACE gátló intolerancia esetén ARB kezelés bizonyítottan eredményes a cardiovascularis események megelőzése terén stabil koszorúér betegben. A hatásmechanizmus részben a vérnyomás csökkentésével, illetve egyéb - ettől független - hatásukkal magyarázható.
3.3.2.5. Béta blokkoló kezelés
3.3.3. A prognózis javítása céljából stabil angina pectoris kezelésekor az alábbi kezelést kell alkalmazni:
3.3.3.1. Aspirin 100 mg/nap minden beteg esetén, kivéve ha ellenjavallat áll fenn (pl. aktív gastrointestinalis vérzés). Intolarencia esetén clopidogrel.
3.3.3.2. Sztatin kezelés - lehetőleg nagydózisú - függetlenül a koleszterin szinttől.
3.3.3.3. ACE gátló /ACE gátló intolerancia esetén ARB kezelés, különösen ha a RAAS gátlásnak egyéb indoka is fennáll (magas vérnyomás, szívelégtelenség, bal kamra dysfunctio, diabetes). Az ACE gátló kezelés hasznos akkor is, ha csak koszorúér betegség áll fenn.
3.3.3.4. Béta blokkoló kezelés angina pectoris és szívelégtelenség együttes fennállásakor.
3.3.4. A panaszok és az ischaemiás események csökkentése érdekében alkalmazandó kezelés
3.3.4.1. Rövid hatású nitrát kezelés alkalmas az anginás panasz azonnali megszüntetésére és annak megelőzésére, ha a kiváltó ok ismert (pl. reggel elinduláskor jelentkező panasz, hideg levegő provokálta angina, stb.).
3.3.4.2. Hosszú hatású nitrát kezelés csökkenti az anginás epizódok gyakoriságát, növeli a terhelhetőséget. Tartós nitrát adása minden olyan stabil anginás beteg részére javasolt, aki gyors hatású nitroglicerinre jól reagál, és különösen előnyös anginához társuló balkamra-diszfunkció és szívelégtelenség esetén. A kezelést oly módon célszerű beállítani, hogy 8-10 órás nitrát mentes periódus legyen, ami megelőzi a nitrát tolerancia kialakulását.
3.3.4.3. Béta blokkoló kezelés csökkenti az anginás panaszok és az ischaemiás epizódok (silent ischaemia) gyakoriságát. Béta-1 szelektív, tartós hatású készítményeket javasolt alkalmazni, amelyek nagyon hatékonyan befolyásolják a panaszokat, javítják a terhelhetőséget. Vasospastikus angina esetén alkalmazása nem javasolt.
3.3.4.4. Calcium csatorna blokkolók hatékony antianginás, anti-ischaemiás gyógyszerek. Összehasonlító vizsgálatok adatai szerint hatékonyságuk megegyezik a béta blokkolóknál észlelt hatással. Hosszú hatású, II-III. generációs készítmények alkalmazása javasolt (felodipin, amlodipin). Szemben a béta blokkolókkal, vasospastikus anginában elsőként alkalmazandó gyógyszerek.
3.3.4.5. If csatorna blokkoló Ivabradine szelektíven a sinus csomóra ható készítmény. Szemben az eddig említett gyógyszerekkel, izoláltan csökkenti a szívfrekvenciát, oly módon, hogy a vérnyomást nem befolyásolja. Hatékony antianginás gyógyszer. Rendelhetősége szakorvosi javaslathoz kötött.
3.3.4.6. Anyagcsere szinten ható készítmények: Magyarországon a trimetazidine van forgalomban. Nem befolyásolja a vérnyomást és a szívfrekvenciát. Hemodinamikai hatású szerekkel kombinációban alkalmazhatók, ha a hemodinamikai szerek kombinált alkalmazása nem nyújt kellő terápiás eredményt. Rendelhetősége szakorvosi javaslathoz kötött.
3.4. A tünetek csökkentése céljából stabil angina pectoris kezelésekor az alábbi kezelést kell alkalmazni:
3.4.1. Akut tünetek megszüntetése és az ismert provokáló tényezők előtt rövid hatású nitroglycerin alkalmazandó.
3.4.2. Tartós hatású béta-1 blokkoló, amelynek adagját a maximálisan tolerálható dózisig kell feltitrálni.
3.4.3. Béta blokkoló intolerancia, illetve nem kellő hatékonyság esetén a kezelést calcium antagonistával (dihidropiridin típusú), illetve tartós hatású nitrát készítménnyel szükséges kiegészíteni.
3.4.4. Béta blokkoló intolerancia esetén vagy annak kiegészítése végett If csatorna blokkoló alkalmazandó.
3.4.5. A metabolikus hatású szerek alkalmazása mérlegelhető, amennyiben a fenti antianginás gyógyszerek nem eléggé hatékonyak.
3.5. Revascularizációs beavatkozások indikációja
A revaszkularizációs beavatkozásoknál is kettős cél érdekében került sor a kezelésre. A 3.5.1. táblázat tünteti fel a prognózis javítása, illetve a tünetek csökkentése miatt elfogadott indikációkat. A revaszkularizáció formája (PCI vagy CABG) a "heart team" döntésétől függően.
3.5.1. A revaszkularizációs beavatkozások indikációja stabil angina pectoris és silent ischaemia esetén
| A | B | |
| 1 | A beavatkozás indikációja a prognózis javítása | A főtörzs >50% szűkülete |
| 2 | Proximalis LAD szűkület (>50%)1 | |
| 3 | 2 VD2 vagy 3 VD és csökkent bal kamra funkció | |
| 4 | Kiterjedt bal kamrai ischaemia (>10%) | |
| 5 | Egyetlen vezető nativ ér, amelyen >50% szűkület van | |
| 6 | A beavatkozás indikációja a panaszok csökkentése | Életvitelt korlátozó angina vagy angina equivalens, amely gyógyszeres kezelésre nem vagy nem kellően reagál és 1 ér szignifikáns szűkülete |
| 7 | Diszpnoe/szívelégtelenség és a bal kamra kiterjedt ischaemiája (>10%), amelyet egy szignifikáns szűkületű ér (>50%) lát el |
1 Igazolni kell az anatómiai elváltozás funkcionális jelentőségét (frakcionált flow rezerv vizsgálat)
2 VD = vessel disease; érbetegség
3.6. Stabil angina pectoris gyógyszeres terápiájának finanszírozási algoritmusa
A stabil angina gyógyszeres kezelése 2 fontos célt szolgál: a koszorúér-betegség komplikációinak (myocardialis infarktus és hirtelen halál) megelőzése és az anginás panaszok csökkentése.
3.6.1. A stabil angina pectoris gyógyszeres terápiájának finanszírozási algoritmusa
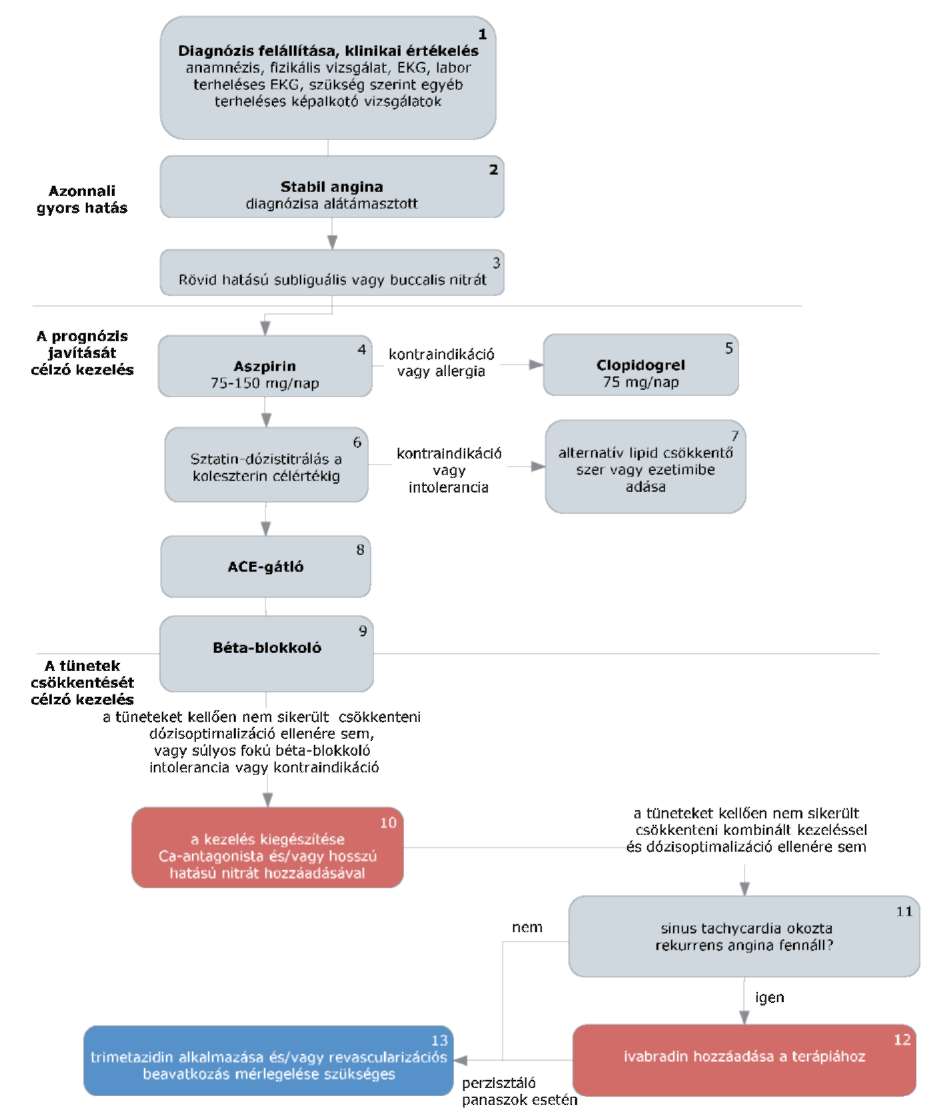
3.6.2. A finanszírozási algoritmus részletezése
3.6.2.1. Angina pectorisra utaló panaszok esetén a beteg mielőbbi kardiológiai szempontú klinikai megítélése szükséges a diagnózis felállítása, illetve a prognózis meghatározása céljából. A minimális diagnosztikus stratégia:
3.6.2.1.1. az anamnézist,
3.6.2.1.2. a fizikális vizsgálatot,
3.6.2.1.3. nyugalmi EKG-t és a
3.6.2.1.4. rizikófaktorok felmérését
foglalja magában.
3.6.2.2. Stabil angina diagnózisát és az ischaemiás szívbetegség (ISZB) súlyosságát a klinikai kép, rizikó stratifikáció alapján elvégzett diagnosztikus vizsgálatokkal szükséges igazolni az optimális gyógyszeres terápia beállítása céljából.
3.6.2.3. A tünetek azonnali megszüntetése céljából szükség szerint sublingualis vagy buccalis nitrát adható. Nemcsak a roham oldására, hanem a roham megelőzésére is használható az ismert kiváltó ok előtt profilaktikusan alkalmazva.
3.6.3. A betegek prognózisának a javítása érdekében végzett gyógyszeres kezelés:
3.6.3.1. Napi 75-150 mg aszpirin alkalmazása minden beteg számára indokolt, amennyiben nincs specifikus kontraindikáció (pl. aktív gastrointestinalis vérzés, aszpirinallergia vagy előzetes intolerancia).
3.6.3.2. Clopidogrel hatóanyag-tartalmú készítmény alkalmazása 75 mg/nap dózisban az aszpirinkezelés alternatívája stabil angina esetén, ha a beteg nem szedhet aszpirint (pl. aszpirinallergia).
3.6.3.3. Sztatin kezelés (első vonalban) minden stabil angina miatt kezelt beteg számára javasolt a lipidszinttől függetlenül.
3.6.3.4. Amennyiben a célértéket sztatinnal nem sikerült elérni, illetve sztatin intolerancia vagy kontraindikáció áll fenn, ezetimibe vagy más típusú lipidcsökkentő szer adása indokolt.
3.6.3.5. ACE-gátló kezelés javasolt minden igazolt koszorúérbetegnek, kifejezetten a következő társbetegségek esetében: hipertónia, szívelégtelenség, balkamra-dysfunkció, megelőző AMI balkamra-dysfunkcióval vagy diabetes mellitus.
3.6.4. A tünetek csökkentését célzó gyógyszeres kezelés:
3.6.4.1. Tartós béta blokkolóval történő kezelés indokolt stabil angina pectorisban, különösen ha az anginához szívelégtelenség társul, illetve postinfarktusos betegnél. Kontraindikáció hiányában elsőként választandó gyógyszerek: a stabil angina pectoris kezelésében valamennyi béta blokkoló hatékony megfelelő dózisban adva, azonban általában a napi 1x alkalmazott, hosszú hatású béta-1 szelektív készítményeket kell előnyben részesíteni az egyenletes terápiás hatás biztosítása miatt. A béta blokkolók optimális adagjának beállítását mindig individuálisan kell mérlegelni. Optimálisnak tekinthető, ha a beteg nyugalmi szívfrekvenciája 60/min.
3.6.4.2. Amennyiben a beteg panaszait nem sikerült csökkenteni dózisoptimalizáció ellenére sem vagy súlyos fokú béta blokkoló intolerancia vagy kontraindikáció lép fel, tartós hatású nitrát, illetve calcium csatorna blokkoló kezelés indokolt. A béta blokkolók leggyakoribb mellékhatása, melyek között enyhe formájú és súlyos életveszélyes tünetek is előfordulhatnak:
3.6.4.2.1. claudicatiós panaszok fokozódása és
3.6.4.2.2. impotencia
3.6.4.2.3. hideg végtag szindróma
3.6.4.2.4. szimptómás bradycardia
3.6.4.2.5. légúti panaszok fokozódása krónikus obstruktív légúti betegségben (béta-1 szelektív szereknél legkevésbé).
3.6.4.3. Amennyiben a klinikai tüneteket nem sikerült kellő mértékben csökkenteni a kombinált antianginás kezeléssel és dózisoptimalizáció ellenére sem, akkor az angina hátterében felmerülhet sinus tachycardia fennállása.
3.6.4.4. Amennyiben igazolódik a sinus tachycardia okozta recurrens angina, ivabradin hozzáadása az addigi terápiához indokolt.
3.6.4.5. Amennyiben nem igazolódik a sinus tachycardia okozta recurrens angina és a tünetek továbbra is fennállnak, akkor trimetazidine alkalmazása, illetve revascularizációs beavatkozás (PCI, CABG) mérlegelése szükséges.
3.6.4.6. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható készítmények a vonatkozó indikációs pont alapján:
3.6.4.6.1. Invazív vagy non-invazív módszerekkel igazolt krónikus stabil angina pectoris tüneti kezelésére sinus ritmusban, ha kombinált antianginás kezelés ellenére tachycardia okozta recurrens angina fennáll béta-blokkolót is magába foglaló standardkezelés mellett, vagy olyan esetekben, amikor a béta-blokkolók alkalmazása ellenjavallt vagy a beteg nem tolerálja azt: ivabradine. (EÜ90 34)
3.6.4.6.2. Coronariascleroticus stabil angina pectoris, komplex antianginás kezelés mellett ismétlődő anginiform panaszok fennállása esetén: trimetazidine. (EÜ50 10)
4. Az ellenőrzés alapját képező, finanszírozási szempontból lényeges sarokpontok
4.1. A stabil angina pectoris diagnózisa terheléses, illetve egyéb képalkotó vizsgálatokkal igazolt?
4.2. A kórkép fennállása esetén a beteg teljes körű prognózist javító gyógyszeres kezelésben részesült?
4.3. A betegdokumentáció alátámasztja, hogy a betegnél a hagyományos gyógyszeres terápia ellenére továbbra is fennállnak anginás panaszok?
4.4. Trimetazidin alkalmazása esetén stabil angina pectoris diagnózisa fennállt?
4.5. Az ivabradine alkalmazására sinus ritmus esetén került sor?
4.6. Amennyiben a klinikai tünetek és az elvégzett vizsgálatok invazív beavatkozás szükségességére utalnak, megtörtént-e a koronarográfia és a revaszkularizáció?
4.7. Amennyiben nem történt invazív diagnosztika, ennek milyen szakmai okai voltak?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | I2010 | Angina pectoris bizonyított koszorúér spazmussal |
| 3 | I2080 | Angina pectoris egyéb formái |
| 4 | I2090 | Angina pectoris, k.m.n. |
| 5 | I2480 | Az ischaemiás szívbetegség egyéb formái |
| 6 | I2490 | Heveny ischaemiás szívbetegség, k.m.n. |
| 7 | I2500 | Atheroscleroticusként megnevezett szív- és érrendszeri betegség |
| 8 | I2510 | Atheroscleroticus szívbetegség |
| 9 | I2550 | Ischaemiás cardiomyopathia |
| 10 | I2560 | Néma szívizom-ischaemia |
| 11 | I2580 | Idült ischaemiás szívbetegség egyéb formái |
| 12 | I2590 | Idült ischaemiás szívbetegség, k.m.n. |
6.2 Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 11301 | Kontrollvizsgálat, konzílium |
| 4 | 12601 | EKG végtag és mellkas elvezetéssel |
| 5 | 12620 | EKG kerékpár-terheléssel |
| 6 | 12621 | EKG futószalag terheléssel |
| 7 | 31310 | Mellkasfelvétel, AP/PA |
| 8 | 3612D | Echocardiographia color Doppler |
| 9 | 3612A | Echocardiographia (M-mód, 2D) |
| 10 | 3562A | Szívizom perfúzió SPECT vizsgálata Tc-mal |
| 11 | 35223 | Szívizom perfúzió szcintigráfia Tc-mal |
| 12 | 3586A | Pótlék: egy testtájék kiegészítő SPECT vizsgálata |
| 13 | 12605 | EKG Holter monitorizálása |
| 14 | 36121 | Mellkasi nagyerek UH vizsgálata |
| 15 | 3617B | Duplex UH, mellkasi erek, aorta |
| 16 | 3617A | Duplex UH, nyaki erek |
| 17 | 3581E | Radioventriculográfia equilibriumban EKG kapuzott SPECT-tel |
| 18 | 21082 | Kardiális troponin I meghatározása |
| 19 | 21083 | Kardiális troponin T meghatározása |
| 20 | 2489B | CK-MB koncentráció meghatározása immunmódszerrel |
6.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 2230 | Atherosclerosis, angina pectoris, egyéb keringési betegségek |
| 3 | 1800 | Diagnosztikus katéterezés |
| 4 | 2110 | Keringési betegségek AMI kivételével, katéterezéssel igazolva |
| 5 | 183G | Percutan cardiovascularis műtétek egy ágon egy vagy több stenttel, áthelyezés nélkül |
| 6 | 183G | Percutan cardiovascularis műtétek egy ágon egy vagy több stenttel, áthelyezés nélkül |
| 7 | 2230 | Atherosclerosis, angina pectoris,egyéb keringési betegségek |
| 8 | 177B | Coronaria bypass, katéterezés nélkül |
| 9 | 183L | Percutan cardiovascularis műtétek stent nélkül, áthelyezés nélkül |
| 10 | 2110 | Keringési betegségek AMI kivételével, katéterezéssel igazolva |
| 11 | 177D | Coronaria bypass (négy vagy több), katéterezés nélkül |
| 12 | 177A | Coronaria bypass, katéterezéssel |
| 13 | 183K | Kiegészítő HBCs haemodinamikai eljárásokhoz (további ágakba történő stent beültetésre, vagy coronarografiás nyomásgrádiens meghatározására) |
| 14 | 177C | Coronaria bypass (négy vagy több), katéterezéssel |
| 15 | 268Z | Keringési rendellenességek (kivéve: AMI thrombolysissel, endocarditis, krónikus szívelégtelenség) súlyos társult betegséggel |
| 16 | 9541 | 5 napot meghaladó gépi lélegeztetés nyitott szívműtétek esetén |
| 17 | 183H | Percutan cardiovascularis műtétek egy ágon egy vagy több stenttel, áthelyezéssel |
| 18 | 270Z | Keringési betegségek műtétei súlyos társult betegséggel |
| 19 | 192B | Diagnosztikus katéterezés, percutan cardiovascularis műtét és coronaria bypass műtét stent nélkül |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | B01AC06 | acetilszalicilsav |
| 3 | B01AC04 | clopidogrel |
| 4 | C10AA01 | simvastatin |
| 5 | C10AA05 | atorvastatin |
| 6 | C10AA07 | rosuvastatin |
| 7 | C10AX09 | ezetimibe |
| 8 | C10BA02 | ezetimibe+simvastatin |
| 9 | C09A | ACE-inhibitorok önmagukban |
| 10 | C09B | ACE-inhibitorok kombinációban |
| 11 | C09CA | angiotensin II antagonisták önmagukban |
| 12 | C09D | angiotensin II antagonisták kombinációi |
| 13 | C07AB02 | metoprolol |
| 14 | C07AB03 | atenolol |
| 15 | C07AB07 | bisoprolol |
| 16 | C07AG02 | carvedilol |
| 17 | C07BB07 | bisoprolol+thiazidok |
| 18 | C07FB02 | metoprolol+egyéb vérnyomáscsökkentők |
| 19 | C08CA01 | amlodipin |
| 20 | C08CA05 | nifedipin |
| 21 | C08DA01 | verapamil |
| 22 | C01DA02 | glyceryl trinitrate |
| 23 | C01DA14 | isosorbide-mononitrate |
| 24 | C01EB15 | trimetazidin |
| 25 | C01EB17 | ivabradine |
7. Rövidítések
ACE-inhibitor: angiotenzin-konvertáló enzimgátlók
CABG: coronary artery bypass graft műtét
EF: ejekciós frakció
PCI: percutan coronaria intervenció
ISZB (CAD): ischaemiás szívbetegség (coronary artery disease)
MI: myocardialis infarctus
TIA: Transiens ischaemiás attack - átmeneti agyi keringés zavar"
29. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"26. melléklet a 31/2010. (V. 13.) EüM rendelethez
A nem-seminoma típúsú heredaganatok diagnosztikájának és terápiájának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Rosszindulatú daganatos megbetegedések
1.1. A here daganatai (BNO: C62)
2. A kórkép leírása
2.1. A heredaganat relatíve ritka előfordulású tumor, a rosszindulatú daganatos megbetegedések mindössze 2%-át teszi ki. Ellenben ez a leggyakoribb szolid tumor a 15-35 éves férfiak körében, és incidenciája több mint megduplázódott az utóbbi 40 évben. A csírasejtes heredaganat az egyetlen olyan szolid tumor, amelyben a betegek túlnyomó többségénél gyógyulás érhető el, ezért jelen irányelv a már jelenleg is elérhető terápiás lehetőségek hatékonyságnövelését tűzi ki célul.
2.2. A testicularis carcinoma a here bármely sejtjéből kiindulhat, de a primer heredaganatok 90-95%-a csírasejtes daganat. A csírasejtes daganat további két csoportba sorolható: seminoma és nem-seminoma. Az előfordulás sorrendjében a csírasejtes daganatok típusai a kevert daganat, seminoma, embrionális carcinoma, teratoma, choriocarcinoma, endodermalis sinus tumor és gondadoblastoma. A heredaganatok diagnózisában az egyik legfontosabb lépés a daganat típusának meghatározása a megfelelő kezelés kiválasztásához.
2.3. A heretumornak két fő típusa van, a seminoma és a nem-seminoma típusú daganat. Mindkét típus alapvető kezelése a sebészeti beavatkozás, a here radikális eltávolítása (radikális semikasztráció), majd indokolt esetben a szövettani vizsgálattól, a pre- és posztoperatív tumormarker szintektől, a staging vizsgálatok eredményétől függően további kezelések jöhetnek szóba (aktív surveillance, kemoterápia, radiáció, retroperitonealis lymphadenectomia). A nem-seminoma típusú betegek esetében általában a kemoterápiás utókezelés a legalkalmasabb további terápiás eredmények elérésére. A seminoma típusú daganatok kevésbé agresszívek, mint a nem-seminomatikus elváltozások, ezért az utóbbi agresszívebb ellátást igényel. A testicularis carcinoma a here bármely sejtjéből kiindulhat, de a primer heredaganatok 90-95%-a csírasejtes daganat. A csírasejtes daganat további két csoportba sorolható: seminoma és nem-seminoma. Az előfordulás sorrendjében a csírasejtes daganatok típusai a kevert daganat, seminoma, embrionális carcinoma, teratoma, choriocarcinoma, endodermalis sinus tumor és gondadoblastoma. A heredaganatok diagnózisában az egyik legfontosabb lépés a daganat típusának meghatározása a megfelelő kezelés kiválasztásához.
2.4. TNM klinikai klasszifikáció, primer tumor
| A | B | |
| 1 | Primer tumor (pT) | |
| 2 | pTX | A primer tumor nem értékelhető |
| 3 | pT0 | A primer tumor léte nem bizonyítható |
| 4 | pTis | Carcinoma in situ (intratubularis csírasejtes neoplazma) |
| 5 | pT1 | A tumor atestisre, esetleg az epididimisre korlátozódik, nincs vaszkuláris és nyirokinvázió, tunica albuginea invázió lehetséges, de tunica vaginalis invázió nem |
| 6 | pT2 | A tumor a testisre és az epididimisre korlátozódik, vaszkuláris- vagy nyirokér- invázióval, vagy a tumor túlnyúlik a tunica albuginea-n, eléri a tunica vaginalist |
| 7 | pT3 | A tumor elérte az ondózsinórt, vaszkuláris/limfatikus invázió mellett vagy anélkül |
| 8 | pT4 | A tumor elérte a scrotumot, vaszkuláris/limfatikus invázió mellett vagy anélkül |
2.5. TNM klinikai klasszifikáció, regionális nyirokcsomó
| A | B | |
| 1 | Regionális nyirokcsomók (N) | |
| 2 | NX | A regionális nyirokcsomók nem értékelhetők |
| 3 | N0 | Nincs regionális nyirokcsomó-érintettség |
| 4 | N1 | Nyirokcsomó metasztázis max. 2 cm-es átmérővel, vagy több metasztázis max. 2 cm- es átmérővel |
| 5 | N2 | Nyirokcsomó metasztázis 2-5 cm-es átmérővel, vagy több metasztázis, egyenként 2-5 cm-es átmérővel |
| 6 | N3 | Nyirokcsomó metasztázis több mint 5 cm-es átmérővel |
2.6. TNM klinikai klasszifikáció, patológiai N
| A | B | |
| 1 | Patológiai (pN) | |
| 2 | pNX | A regionális nyirokcsomók nem értékelhetők |
| 3 | pN0 | Nincs regionális nyirokcsomó metasztázis |
| 4 | PN1 | Nyirokcsomó metasztázis max. 2 cm-es átmérővel, max. 5 db pozitív csomó, melyek mindegyike max.2 cm-es legnagyobb átmérőjű |
| 5 | pN2 | Nyirokcsomó metastasis nagyobb, mint 2 cm és kisebb, mint 5 cm átmérővel, vagy több, mint 5 darab pozitív nyirokcsomó, melyek mindegyike kisebb, mint 5 cm átmérőjű vagy bizonyított nyirokcsomón túli kiterjedés |
| 6 | pN3 | 5 cm-nél nagyobb nyirokcsomó áttét |
2.7. TNM klinikai klasszifikáció, távoli áttétek
| A | B | |
| 1 | Távoli metasztázis (M) | |
| 2 | MX | A távoli metasztázis nem értékelhető |
| 3 | M0 | Nincs távoli metasztázis |
| 4 | M1 | Távoli metasztázis |
| 5 | M1a | Nem regionális, nyirokáttét, vagy pulmonális áttét |
| 6 | M1b | Távoli metasztázis a nem regionális nyirokcsomóáttéteken és a tüdőn kívül |
2.8. Szérum tumor markerek
| A | B | |
| 1 | Szérum tumor markerek | |
| 2 | SX | A marker vizsgálatok nem hozzáférhetőek vagy nem történtek meg |
| 3 | S0 | Marker értékek a normális értéktartományon belül |
| 4 | S1 | LDH < 1,5x a normális érték BHCG (mlu/mL) < 5000 AFP (ng/mL) < 1000 |
| 5 | S2 | LDH 1,5-10x a normális érték BHCG (mlu/mL) 5000-50 000 AFP (ng/mL) 1000-10 000 |
| 6 | S3 | LDH > a normális érték 10x-ese BHCG (mlu/mL) > 50 000 AFP (ng/mL) > 10 000 |
Megjegyzés: "S" stádiumot a semikasztráció utáni (minimumot elért) marker alapján kell felállítani.
2.9. táblázat: A csírasejtes heretumorok osztályozása
| A | B | C | D | E | |
| 1 | Stádiumbesorolás | ||||
| 2 | 0. stádium | pTis | N0 | M0 | S0 |
| 3 | I stádium | pT1-4 | N0 | M0 | SX |
| 4 | IA stádium | pT1 | N0 | M0 | S0 |
| 5 | IB stádium | pT2 | N0 | M0 | S0 |
| 6 | pT3 | N0 | M0 | S0 | |
| 7 | pT4 | N0 | M0 | S0 | |
| 8 | IS stádium | Bármely pT/TX | N0 | M0 | S1-3 |
| 9 | II stádium | Bármely pT/TX | N1-3 | M0 | SX |
| 10 | IIA stádium | Bármely pT/TX | N1 | M0 | S0 |
| 11 | Bármely pT/TX | N1 | M0 | S1 | |
| 12 | IIB stádium | Bármely pT/TX | N2 | M0 | S0 |
| 13 | Bármely pT/TX | N2 | M0 | S1 | |
| 14 | IIC stádium | Bármely pT/TX | N3 | M0 | S0 |
| 15 | Bármely pT/TX | N3 | M0 | S1 | |
| 16 | III stádium | Bármely pT/TX | N3 | M1 | SX |
| 17 | IIIA stádium | Bármely pT/TX | Bármely N | M1a | S1 |
| 18 | Bármely pT/TX | Bármely N | M1a | S2 | |
| 19 | IIIB stádium | Bármely pT/TX | N 1-3 | M0 | S2 |
| 20 | Bármely pT/TX | Bármely N | M1a | S2 | |
| 21 | IIIC stádium | Bármely pT/TX | N 1-3 | M0 | S3 |
| 22 | Bármely pT/TX | Bármely N | M1a | S3 | |
| 23 | Bármely pT/TX | Bármely N | M1b | Bármely S |
3. A nem-seminoma típusú csírasejtes heredaganat finanszírozási algoritmusa
3.1. Nem-seminoma típusú csírasejtes heredaganatok diagnosztikájának finanszírozási algoritmusa
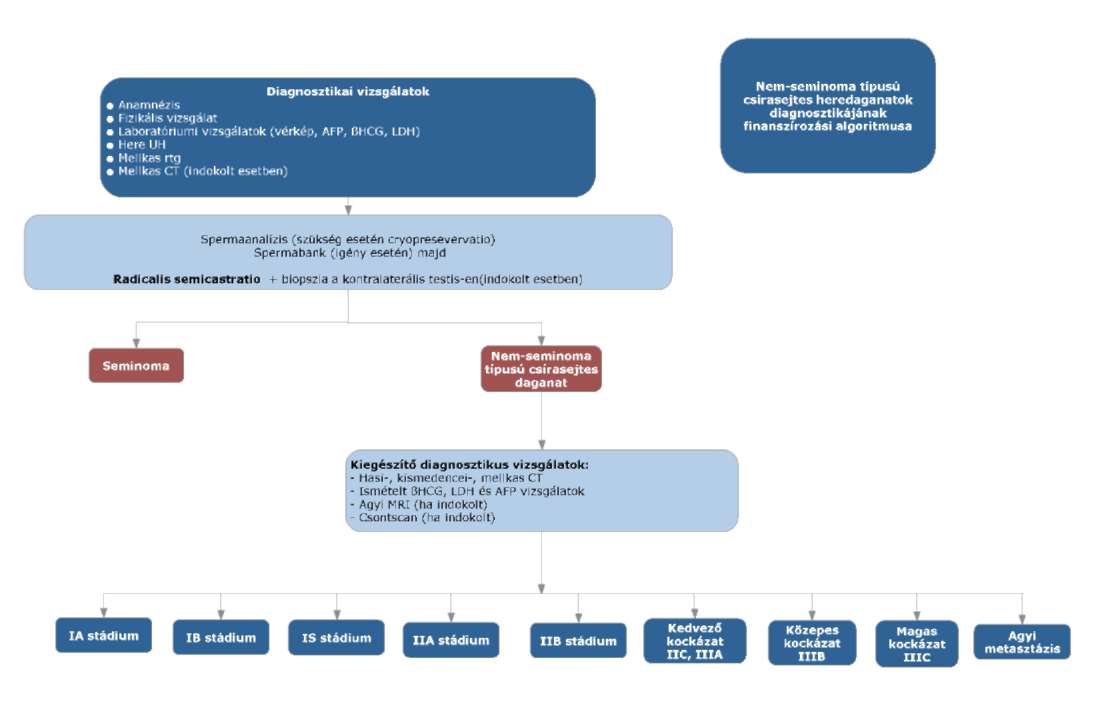
3.2. Nem-seminoma típusú csírasejtes heredaganatok ellátásának finanszírozási algoritmusa
IA, IB, IS stádium
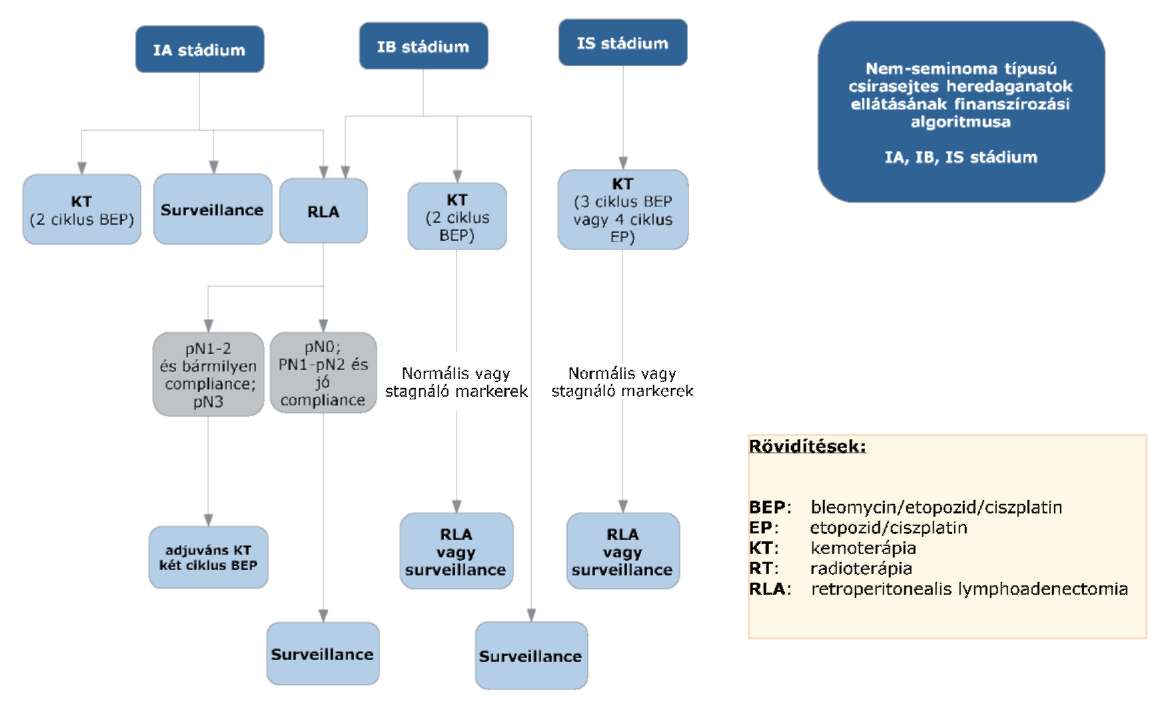
3.3. Nem-seminoma típusú csírasejtes heredaganatok ellátásának finanszírozási algoritmusa
IIA, IIB stádium
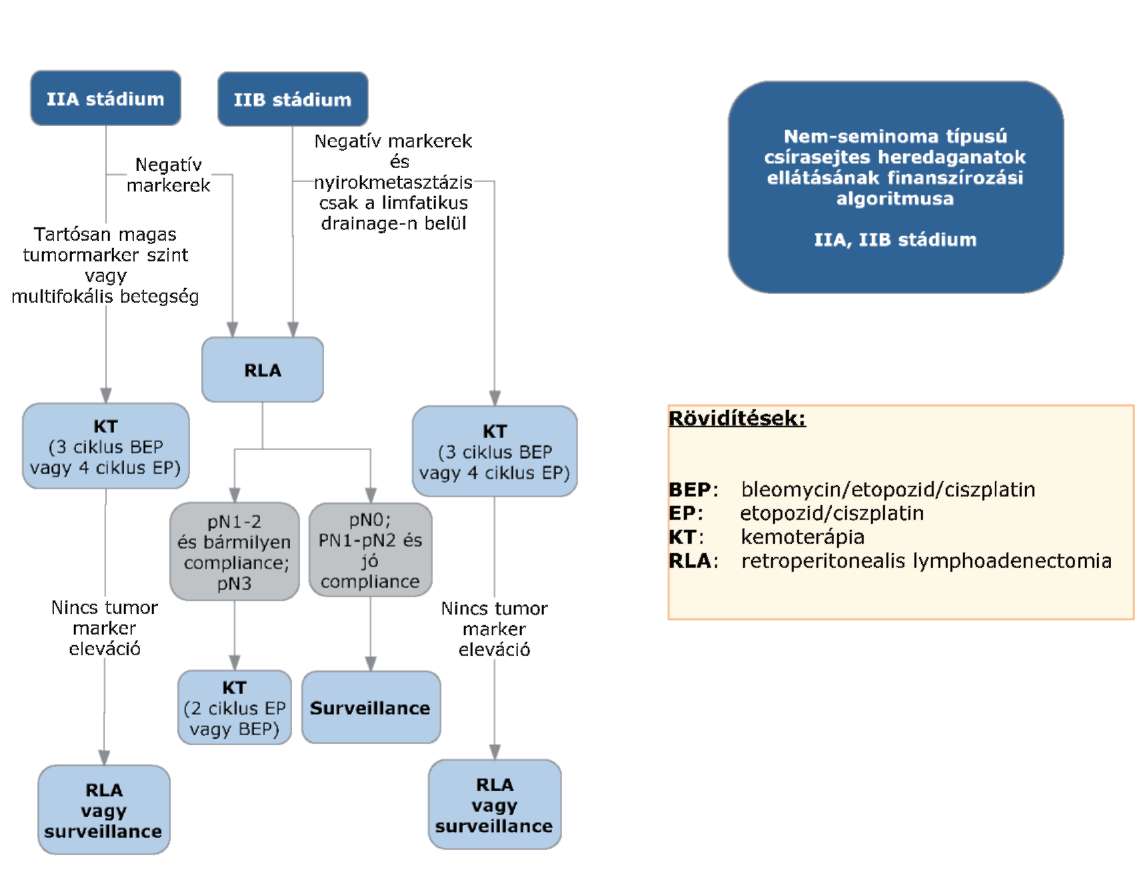
3.4. Nem-seminoma típusú csírasejtes heredaganatok ellátásának finanszírozási algoritmusa
IIC, IIIA, IIIC stádium, agyi metasztázis esetén
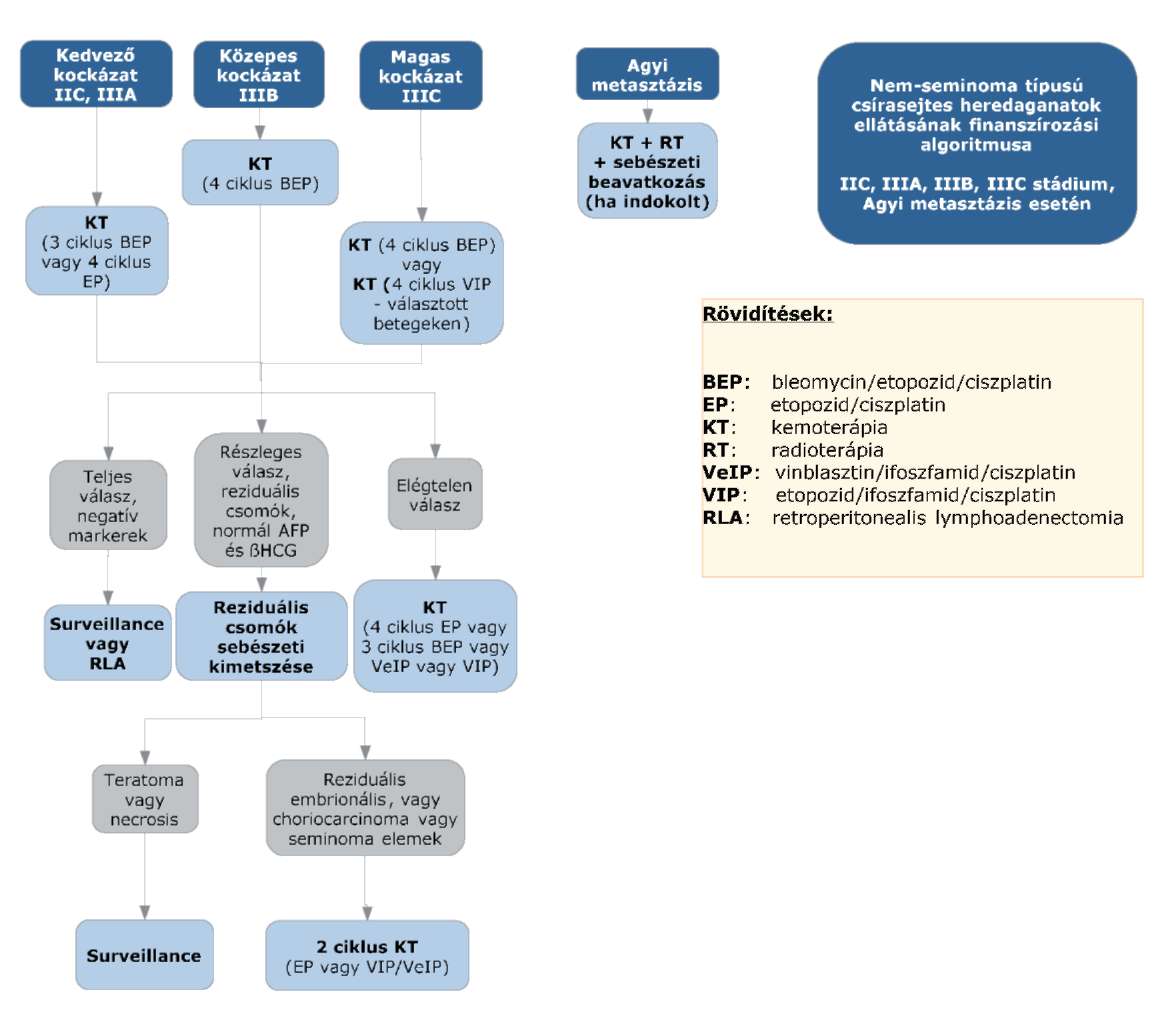
3.5. Nem-seminoma típusú csírasejtes heredaganatok ellátásának finanszírozási algoritmusa Rekurrencia esetén primer kemoterápiát követően
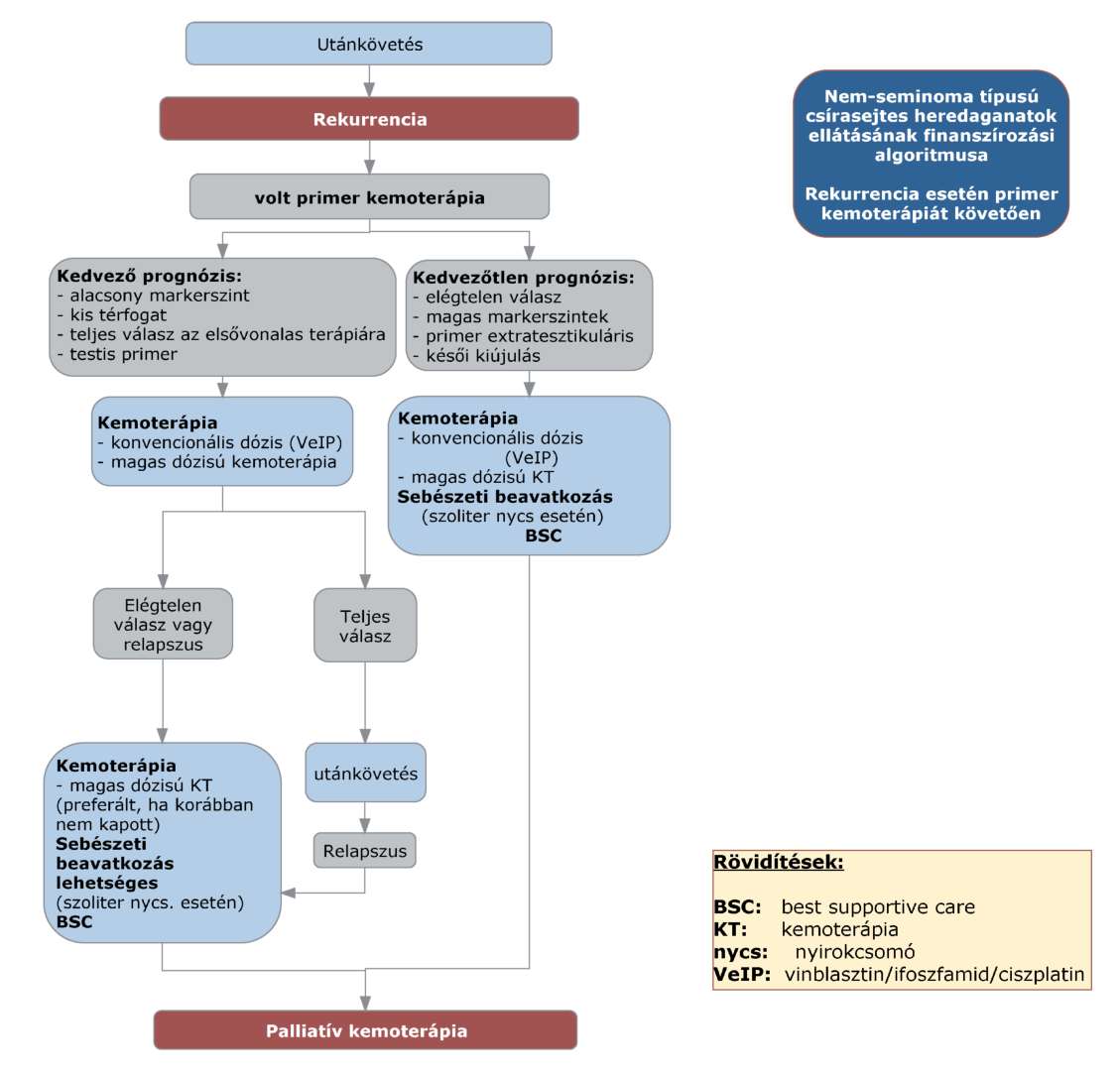
3.6. Nem-seminoma típusú csírasejtes heredaganatok ellátásának finanszírozási algoritmusa Rekurrencia esetén primer kemoterápiában nem részesült betegeknél
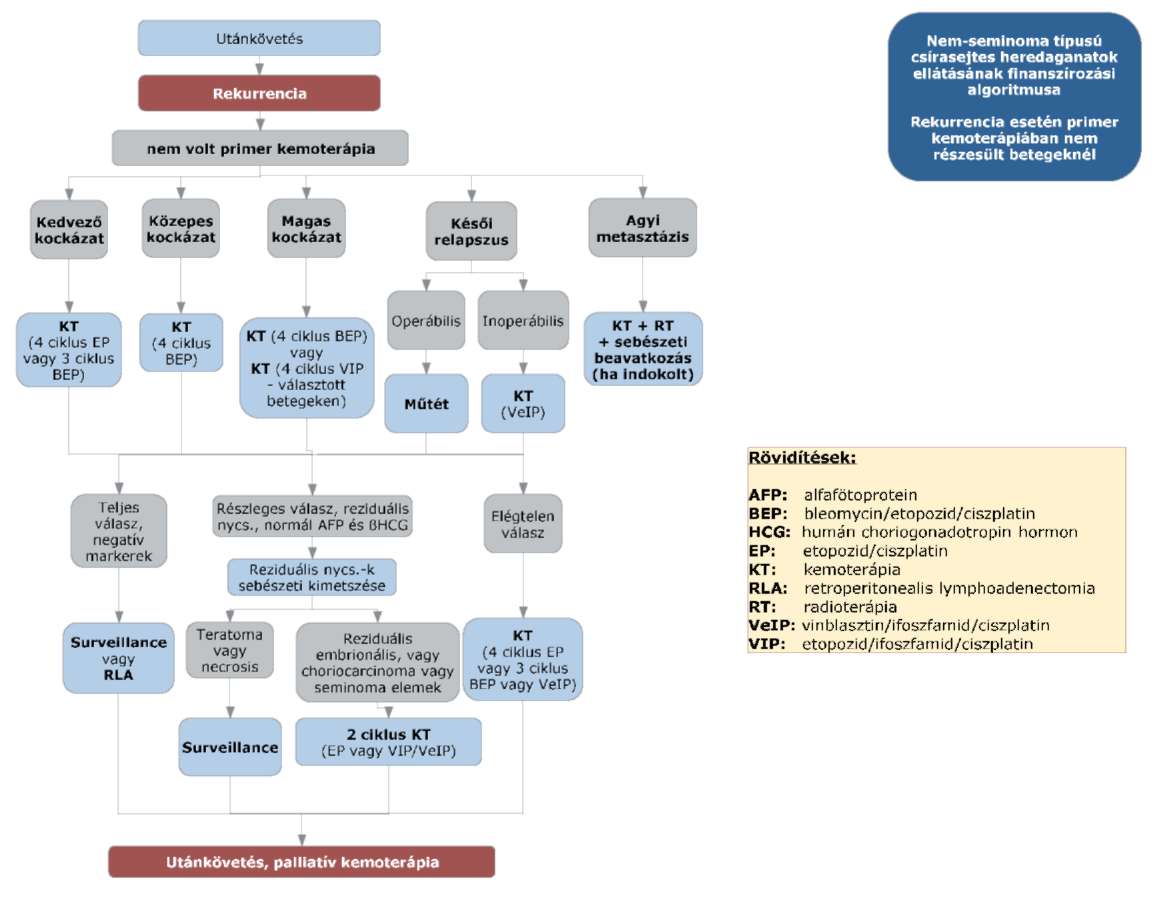
4. A finanszírozási algoritmus részletezése
4.1. A here-UH vizsgálat minden esetben elvégzendő.
4.2. A primer beavatkozás radikális semikasztráció. Súlyos és indokolt esetben megelőzheti kemoterápia. A kemoterápia csak közvetlen életveszély fennállása esetén előzheti meg a semikasztrációt (műtéti kontraindikáció, légzési elégtelenség, csontvelő elégtelenség, stb.).
4.3. A serum tumormarker vizsgálatokat a radikális semikasztráció előtt, és utána 7. postoperatív napon rutinszerűen, de normalizálódásig vagy progresszióig kell végezni.
4.4. A retroperitonealis, mediastinalis és supraclavicularis nyirokcsomókat vizsgálni kell. Ha a nyirokcsomók negatívak, a mellkas CT nem indokolt.
4.5. IS stádiumú betegség (vagyis tartósan emelkedett marker státusz, de negatív képalkotó vizsgálat) esetén kemoterápiás kezelés végzése javasolt. Megjegyzés: IS stádium felállításához szükséges a semikasztráció utáni marker követés.
4.6. Első vonalban alkalmazható kemoterápiák: BEP, EP.
5. Kockázati besorolás
| A | B | |
| 1 | Kockázat | Besorolás |
| 2 | Tesztikuláris vagy retroperitoneális primer tumor és nincs nem pulmonális viszcerális metasztázis, | |
| 3 | Alacsony kockázat | valamennyi poszt-kasztrációs marker: |
| 4 | AFP < 1000 ng/mL | |
| 5 | BHCG< 5000 iu/L | |
| 6 | LDH < a normális felső szint 1,5-szerese | |
| 7 | Tesztikuláris vagy retroperitoneális primer tumor és nincs nem pulmonális viszcerális metasztázis, | |
| 8 | Közepes kockázat | valamennyi poszi-kasztrációs marker: |
| 9 | AFP 1000-10 000 ng/mL | |
| 10 | BHCG 5000-50 000 iu/L | |
| 11 | LDH a normális felső szintjének 1,5-10-szerese | |
| 12 | Mediastinális primer tumor vagy nem pulmonális viscerális metasztázisok vagy | |
| 13 | Magas kockázat | AFP 10 000 ng/mL< |
| 14 | BHCG 50 000 iu/L < | |
| 15 | LDH magasabb, mint a normális felső szintjének 10-szerese |
6. Kezelési lehetőségek stádium szerint
| A | B | C | |
| 1 | Nem-Seminoma I. stádium | Nem-seminoma IIA/B | Nem-seminoma (IIC+) |
| 2 | Surveillance (megfelelő feltételek és beteg-compliance esetén) | 3 EP v. 4 BEP (emelkedett marker szint) | 3 ciklus BEP (jó prognózis) + sebészeti beavatkozás nem teljes radiológiai remisszió esetén |
| 3 | Adjuváns kemoterápia (BEP) v. RLA, ha a betegek nem akarnak surveillance programban részt venni, vagy surveillance feltételei nem adottak | Surveillance (nem emelkedett marker szint) | 4 ciklus BEP (közepes-rossz prognózis) + sebészeti beavatkozás nem teljes radiológiai remisszió esetén |
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
7.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
7.1.2. Betegadatok (online TAJ ellenőrzés)
7.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7.2. A legfontosabb ellenőrzési sarokpontok a következők:
7.2.1. A here UH vizsgálata megtörtént-e?
7.2.2. Stádiumbesztásra vonatkozó adatok megtalálhatóak-e?
7.2.3. Szérum tumormarker-vizsgálatok műtét előtti és műtét utáni eredményei megvannak?
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása.
8.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | C6200 | Nem descendált here rosszindulatú daganata |
| 3 | C6210 | Descendált here rosszindulatú daganata |
| 4 | C6290 | Here rosszindulatú daganata k.m.n |
| 5 | D2920 | Here jóindulatú daganata |
| 6 | D4010 | Here bizonytalan és ismeretlen viselkedésű daganata |
9.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 24333 | Szabad Humán Chorio-Gonadrotropin béta lánc meghatározása szérumban |
| 3 | 29000 | Szövettani vizsgálat a szokásos feldolgozási módszerrel |
| 4 | 29050 | Szövettani vizsgálat immunhisztokémiai reakció alkalmazása esetén |
| 5 | 30642 | Besugárzás tervezése, külső, számítógépes, 3D |
| 6 | 31310 | Mellkasfelvétel, AP/PA |
| 7 | 31460 | Has célzott felvétel |
| 8 | 33350 | Szuperszelektív arteriographia - első ág, egy irány |
| 9 | 33850 | Kemoterápia-szelektív |
| 10 | 36123 | Pleuraűr UH vizsgálata |
| 11 | 36130 | Hasi (áttekintő, komplex) UH vizsgálat |
| 12 | 36135 | Vese UH vizsgálata |
| 13 | 36150 | Kismedence transabdominalis UH vizsgálat |
| 14 | 36154 | Herezacskó UH vizsgálata |
| 15 | 36155 | Húgyhólyag UH vizsgálata |
| 16 | 36164 | Végtagi lágyrész UH vizsgálata |
| 17 | 69972 | Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpendált, szerelékkel |
| 18 | 88460 | Vérvétel |
| 19 | 2662G | AFP meghatározása szérumban |
| 20 | 24330 | Human Chorio-Gonadotropin meghatározása szérumban |
| 21 | 24500 | Tejsav dehidrogenáz (LDH) meghatározása |
| 22 | 24501 | LDH izoenzimek elektroforézises elválasztása |
| 23 | 34410 | Agykoponya natív CT vizsgálata |
| 24 | 34411 | Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
| 25 | 34440 | Mellkas CT vizsgálata natív |
| 26 | 34441 | Mellkas CT vizsgálata iv. kontrasztanyag adását követőleg |
| 27 | 34450 | Teljes has CT vizsgálata natív |
| 28 | 34451 | Teljes has CT vizsgálata iv. kontrasztanyag adását követőleg |
| 29 | 34460 | Medence CT vizsgálata natív |
| 30 | 34461 | Medence CT vizsgálata iv. kontrasztanyag adását követőleg |
9.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 6110 | Férfi reproduktív rendszer radikális műtétei |
| 3 | 6140 | Here műtétei malignus betegségek miatt |
| 4 | 6190 | Férfi reproduktív rendszer egyéb műtétei rosszindulatú daganat miatt |
| 5 | 621C | Férfi reproduktív rendszer rosszindulatú daganatai |
| 6 | 639Z | Férfi reproduktív rendszer betegségei súlyos társult betegséggel |
| 7 | 640Z | Férfi reproduktív rendszer műtétei súlyos társult betegséggel |
| 8 | 9430 | Sugárterápia |
| 9 | 980B | Daganatos megbetegedések (kivéve: pajzsmirigy daganatok) kezelése nyílt radioizotóppal |
| 10 | 959C-959G | Rosszindulatú daganat kemoterápiája "C"-"G" |
9.4. Releváns kemoterápiás protokollok
| A | B | |
| 1 | Kód | Kemoterápiás protokoll megnevezése |
| 2 | 7125 | Kemoterápia, IFO+VP+CDDP protokoll szerint |
| 3 | 7266 | Kemoterápia, CBP monoterápia szerint |
| 4 | 7314 | Kemoterápia, VeIP protokoll szerint |
| 5 | 7315 | Kemoterápia, VeIP/A protokoll szerint |
| 6 | 7316 | Kemoterápia, VIP/J Carboplatinnal protokoll szerint |
| 7 | 7331 | Kemoterápia, BECA protokoll szerint |
| 8 | 7332 | Kemoterápia, BEP/A protokoll szerint |
| 9 | 7338 | Kemoterápia, VPB+CDDP protokoll szerint |
| 10 | 7339 | Kemoterápia, VPB+CBP protokoll szerint |
| 11 | 7361 | Kemoterápia, VIP/E protokoll szerint |
| 12 | 7365 | Kemoterápia, BEP/B protokoll szerint |
| 13 | 7373 | Kemoterápia, VIP/I protokoll szerint |
| 14 | 7462 | Kemoterápia, VP+CBP protokoll szerint |
| 15 | 7463 | Kemoterápia, VP+CDDP protokoll szerint |
| 16 | 7966 | Kemoterápia, GCT-PE protokoll szerint 18 év alatt |
| 17 | 7967 | Kemoterápia, GPEI protokoll szerint 18 év alatt |
| 18 | 7970 | Kemoterápia, MAHO-PVB protokoll szerint 18 év alatt |
| 19 | 7971 | Kemoterápia, GVAC protokoll szerint 18 év alatt |
| 20 | 7972 | Kemoterápia, GBEP protokoll szerint 18 év alatt |
| 21 | 7973 | Kemoterápia, GCAREB protokoll szerint 18 év alatt |
| 22 | 7974 | Kemoterápia, GBEP5 protokoll szerint 18 év alatt |
10. Fogalmak, rövidítések
10.1. Fogalmak
10.1.1. RLA (retroperitonealis lymphadenectomia): A retroperitonealis nyirokcsomók és a nyirokszövet meghatározott dissectiós séma szerinti eltávolítása laparoszkópos vagy nyílt műtéttel, melynek diagnosztikai és terápiás értéke van.
10.1.2. Salvage terápia: Végső kezelési lehetőség, melyet azoknál a betegeknél alkalmaznak, akik nem reagálnak a standard kezelési stratégiára vagy nem tolerálják azt (2. vonalbeli kemoterápiát követően).
10.1.3. Surveillance: Aktív követés. A surveillance program alatt a betegek rendszeres időközönként előre meghatározott vizsgálatokon vesznek részt a betegség esetleges progressziójának szigorú monitorozása érdekében. Aktív beavatkozás helyett a betegek részt vehetnek a surveillance programban, ha a progresszió, illetve a kiújulás kockázata alacsony, és a gyógyszeres vagy radikális sebészi beavatkozások végzése a betegség miatt nem indokolt. Célszerű a beteg írásos beleegyező nyilatkozatát kérni a kezeléshez.
10.2. Rövidítések
AFP alfa-fötoprotein
BEP bleomycin/etopozid/ciszplatin
BNO Betegségek Nemzetközi Osztályozása
BSC best supportive care
CT computer tomográfia
EAU European Association of Urology
EP etopozid/ciszplatin
ESMO European Society for MedicalOncology
GCC csírasejtes daganat vagy germinális
HBCS Homogén betegségcsoport
HCG humán choriogonadotropin hormon
LDH laktát dehidrogenáz
MRI mágneses rezonancia vizsgálat
NCCN National Comprehensive Cancer Network
NICE National Institute of Clinical Excellence
NSE neuron specifikus enoláz
OENO Orvosi Eljárások Nemzetközi Osztályozása
PET pozitron emissziós tomográf
PLAP placentaris alkalikus foszfatáz
RLA retroperitonealis lymphadenectomia
VeIP vinblasztin/ifoszfamid/ciszplatin
VIP etopozid/ifoszfamid/ciszplatin"
30. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"27. melléklet a 31/2010. (V. 13.) EüM rendelethez
A seminoma típusú heredaganatok kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Rosszindulatú daganatos megbetegedések
1.1.1. A here daganatai (BNO: C62)
2. A kórkép leírása
2.1. A csírasejtes heredaganat relatíve ritka előfordulású tumor, a rosszindulatú daganatos megbetegedések mindössze 2%-át teszi ki. Ellenben ez a leggyakoribb szolid tumor a 15-35 éves férfiak körében, és incidenciája több mint megduplázódott az utóbbi 40 évben. A csírasejtes heredaganat az egyetlen olyan szolid tumor, amelyben a betegek túlnyomó többségénél gyógyulás érhető el, ezért jelen irányelv a már jelenleg is elérhető terápiás lehetőségek hatékonyságnövelését tűzi ki célul.
A heretumornak két fő típusa van, a seminoma és a nem-seminoma típusú daganat. Mindkét típus alapvető kezelése a sebészeti beavatkozás, a here radikális eltávolítása (radikális semikasztráció), majd indokolt esetben a szövettani vizsgálattól, a pre- és posztoperatív tumormarker szintektől, a staging vizsgálatok eredményétől függően további kezelések jöhetnek szóba (aktív surveillance, kemoterápia, radiáció, retroperitonealis lymphadenectomia). A nem-seminoma típusú betegek esetében általában a kemoterápiás utókezelés a legalkalmasabb további terápiás eredmények elérésére. A seminoma típusú daganatok kevésbé agresszívek, mint a nem- seminomatikus elváltozások, ezért az utóbbi agresszívebb ellátást igényel.
A testicularis carcinoma a here bármely sejtjéből kiindulhat, de a primer heredaganatok 90-95%-a csírasejtes daganat. A csírasejtes daganat további két csoportba sorolható: seminoma és nem-seminoma. Az előfordulás sorrendjében a csírasejtes daganatok típusai a kevert daganat, seminoma, embrionális carcinoma, teratoma, choriocarcinoma, endodermalis sinus tumor és gondadoblastoma. A heredaganatok diagnózisában az egyik legfontosabb lépés a daganat típusának meghatározása a megfelelő kezelés kiválasztásához.
2.2. TNM klinikai klasszifikáció, primer tumor
| Primer tumor (pT) | |
| pTX | A primer tumor nem értékelhető |
| pT0 | A primer tumor léte nem bizonyítható |
| pTis | Carcinomain situ (intratubularis csírasejtes neoplazma) |
| pT1 | A tumor a testisre, esetleg az epididimisre korlátozódik, nincs vaszkuláris és nyirokinvázió, tunica albuginea invázió lehetséges, de tunica vaginalis invázió nem |
| pT2 | A tumor a testisre és az epididimisre korlátozódik, vaszkuláris- vagy nyirokér-invázióval, vagy a tumor túlnyúlik a tunica albuginea-n, eléri a tunica vaginalist |
| pT3 | A tumor elérte az ondózsinórt, vaszkuláris/limfatikus invázió mellett vagy anélkül |
| pT4 | A tumor elérte a scrotumot, vaszkuláris/limfatikus invázió mellett vagy anélkül |
2.3. TNM klinikai klasszifikáció, regionális nyirokcsomó
| Regionális nyirokcsomók (N) | |
| NX | A regionális nyirokcsomók nem értékelhetők |
| N0 | Nincs regionális nyirokcsomó-érintettség |
| N1 | Nyirokcsomó metasztázis max. 2 cm-es átmérővel, vagy több metasztázis max. 2 cm-es átmérővel |
| N2 | Nyirokcsomó metasztázis 2-5 cm-es átmérővel, vagy több metasztázis, egyenként 2-5 cm-es átmérővel |
| N3 | Nyirokcsomó metasztázis több mint 5 cm-es átmérővel |
2.4. TNM klinikai klasszifikáció, patológiai N
| Patológiai (pN) | |
| pNX | A regionális nyirokcsomók nem értékelhetők |
| pN0 | Nincs regionális nyirokcsomó metasztázis |
| PN1 | Nyirokcsomó metasztázis max. 2 cm-es átmérővel, max. 5 db pozitív csomó, melyek mindegyike max. 2 cm-es legnagyobb átmérőjű |
| pN2 | Nyirokcsomó metasztázis nagyobb, mint 2 cm és kisebb, mint 5 cm átmérővel, vagy több, mint 5 darab pozitív nyirokcsomó, melyek mindegyike kisebb, mint 5 cm átmérőjű vagy bizonyított nyirokcsomón túli kiterjedés |
| pN3 | 5 cm-nél nagyobb nyirokcsomó áttét |
2.5. TNM klinikai klasszifikáció, távoli áttétek
| Távoli metasztázis (M) | |
| MX | A távoli metasztázis nem értékelhető |
| M0 | Nincs távoli metasztázis |
| M1 | Távoli metasztázis |
| M1a | Nem regionális, nyirok- vagy pulmonáris áttét |
| M1b | Távoli metasztázis a nem regionális nyirokcsomóáttéteken és a tüdőn kívül |
2.6. Szérum tumor markerek
| Szérum tumor markerek | |
| SX | A marker vizsgálatok nem hozzáférhetőek, vagy nem történtek meg |
| S0 | Marker értékek a normális értéktartományon belül |
| LDH < 1,5x a normális érték | |
| S1 | BHCG (mlu/mL) < 5000 |
| AFP (ng/mL) < 1000 | |
| LDH 1,5-10x a normális érték | |
| S2 | BHCG (mlu/mL) 5000-50 000 |
| AFP (ng/mL) 1000-10 000 | |
| LDH > a normális érték 10x-ese | |
| S3 | BHCG (mlu/mL) > 50 000 |
| AFP (ng/mL) > 10 000 | |
Megjegyzés: "S" stádiumot a semikasztráció utáni (minimumot elért) marker alapján kell felállítani.
2.7. A csírasejtes heretumorok osztályozása
| A | B | C | D | E | |
| 1 | Stádiumbesorolás | ||||
| A | B | C | D | E | |
| 1 | Stádiumbesorolás | ||||
| 2 | 0. stádium | pTis | N0 | M0 | S0 |
| 3 | I stádium | pT1-4 | N0 | M0 | SX |
| 4 | IA stádium | pT1 | N0 | M0 | S0 |
| 5 | IB stádium | pT2 | N0 | M0 | S0 |
| 6 | pT3 | N0 | M0 | S0 | |
| 7 | pT4 | N0 | M0 | S0 | |
| 8 | IS stádium | Bármely pT/TX | N0 | M0 | S1-3 |
| 9 | II stádium | Bármely pT/TX | N1-3 | M0 | SX |
| 10 | IIA stádium | Bármely pT/TX | N1 | M0 | S0 |
| 11 | Bármely pT/TX | N1 | M0 | S1 | |
| 12 | IIB stádium | Bármely pT/TX | N2 | M0 | S0 |
| 13 | Bármely pT/TX | N2 | M0 | S1 | |
| 14 | IIC stádium | Bármely pT/TX | N3 | M0 | S0 |
| 15 | Bármely pT/TX | N3 | M0 | S1 | |
| 16 | III stádium | Bármely pT/TX | N3 | M1 | SX |
| 17 | IIIA stádium | Bármely pT/TX | Bármely N | M1a | S1 |
| 18 | Bármely pT/TX | Bármely N | M1a | S2 | |
| 19 | IIIB stádium | Bármely pT/TX | N 1-3 | M0 | S2 |
| 20 | Bármely pT/TX | Bármely N | M1a | S2 | |
| 21 | IIIC stádium | Bármely pT/TX | N 1-3 | M0 | S3 |
| 22 | Bármely pT/TX | Bármely N | M1a | S3 | |
| 23 | Bármely pT/TX | Bármely N | M1b | Bármely S | |
3. A seminoma típusú heredaganat finanszírozási algoritmusa
3.1. Seminoma típusú heredaganatok diagnosztikájának finanszírozási algoritmusa
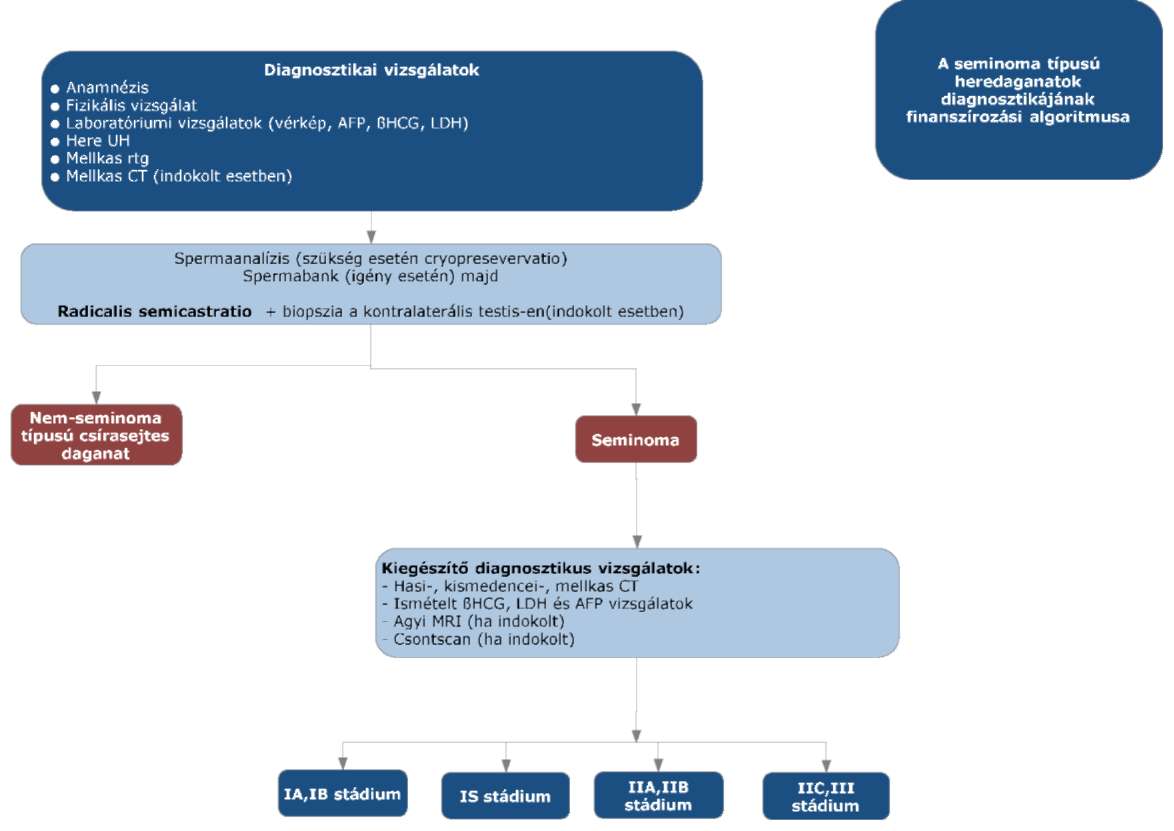
3.2. Seminoma típusú heredaganatok ellátásának finanszírozási algoritmusa
IA, IB, IS stádium
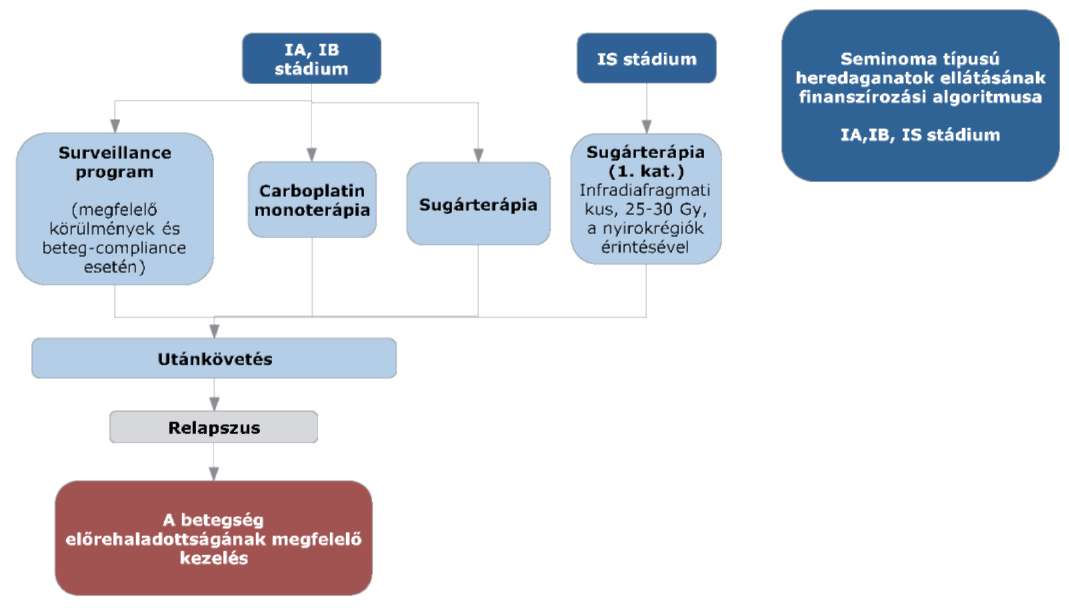
3.3. Seminoma típusú heredaganatok ellátásának finanszírozási algoritmusa
IIA, IIB, IIC és III stádium
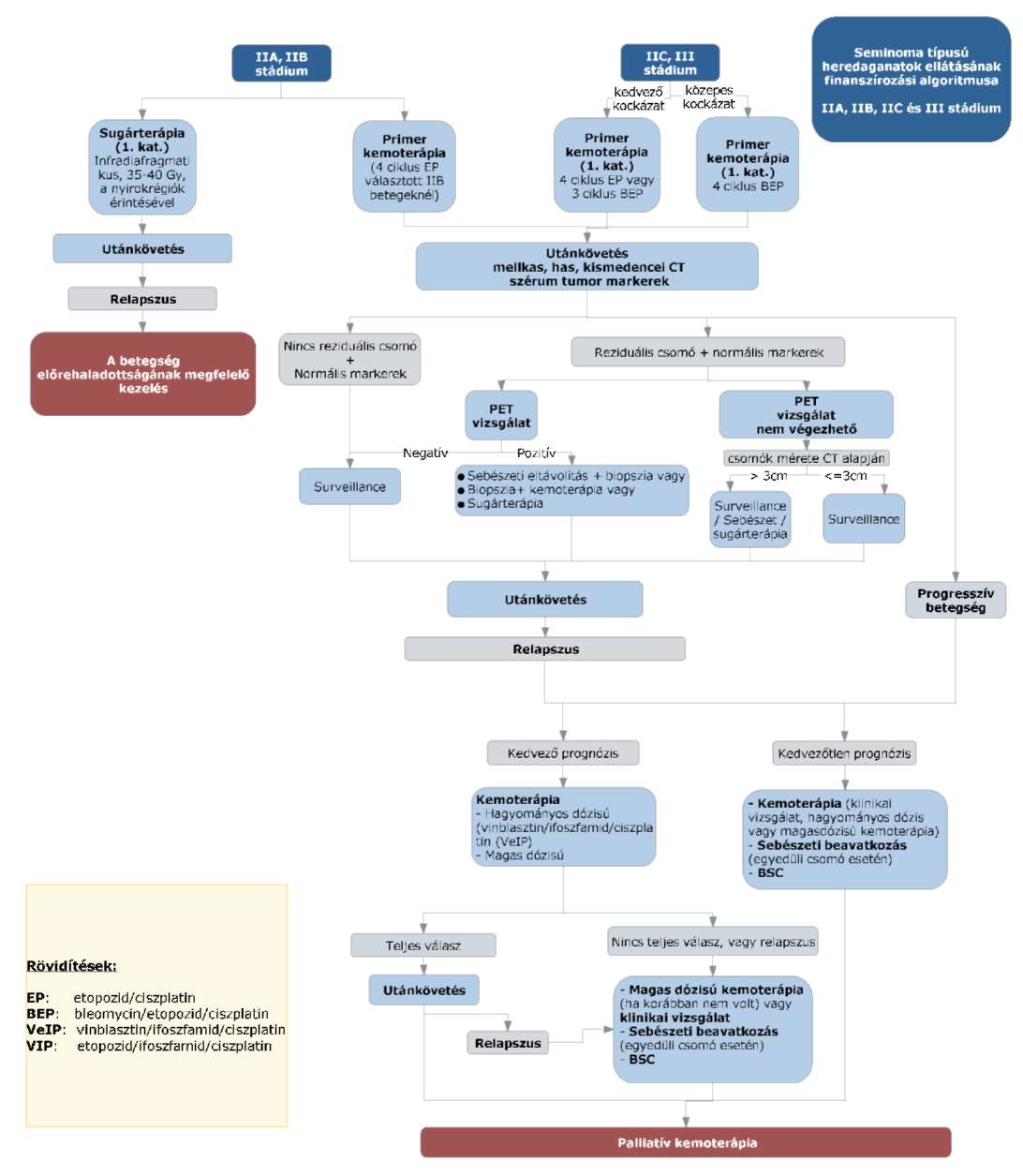
3.4. A here-UH vizsgálat minden esetben elvégzendő.
3.5. A primer beavatkozás radikális semikasztráció. Súlyos és indokolt esetben megelőzheti kemoterápia. A kemoterápia csak közvetlen életveszély fennállása esetén előzheti meg a semikasztrációt (műtéti kontraindikáció, légzési elégtelenség, csontvelő elégtelenség, stb.).
3.6. A serum tumormarker vizsgálatokat a radikális semikasztráció előtt, és utána 7. postoperatív napon rutinszerűen, de normalizálódásig vagy progresszióig kell végezni.
3.7. A retroperitonealis, mediastinalis és supraclavicularis nyirokcsomókat vizsgálni kell. Ha a nyirokcsomók negatívak, a mellkas CT nem indokolt.
3.8. IS stádiumú betegség (vagyis tartósan emelkedett marker státusz, de negatív képalkotó vizsgálat) esetén kemoterápiás kezelés végzése javasolt. Megjegyzés: IS stádium felállításához szükséges a semikasztráció utáni marker követés.
3.9. Első vonalban alkalmazható kemoterápiák: carboplatin monoterápia (seminoma I. stádium) BEP, EP.
4. Kezelési lehetőségek stádiumok szerint
| Seminoma I. stádium | Seminoma IIA/B | Seminoma (IIC+) |
| Surveillance (megfelelő feltételek és beteg-compliance esetén) | Radioterápia | 3 ciklus BEP (jó prognózis) + sebészeti beavatkozás látható maradék tumor esetén |
| Carboplatin monoterápia | 4 EP v 4 BEP | 4 ciklus BEP (közepes-rossz prognózis) + sebészeti beavatkozás látható maradék tumor esetén |
| Sugárterápia |
4.1. Kockázati csoportok
| Kedvező prognózis | Alacsony marker értékek, kis térfogat, teljes válaszadás az elsővonalas terápiára, primer daganat a testisben. |
| Kedvezőtlen prognózis | Nem teljes válasz a primer kemoterápiára, magas marker értékek, nagy térfogat, extratesztikuláris primer daganat, késői relapszus. |
5. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
5.1. A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket.
5.2. A legfontosabb ellenőrzési sarokpontok a következők:
5.2.1. A here UH vizsgálata megtörtént-e?
5.2.2. Szérum tumormarker vizsgálatok megtörténtek-e műtét előtt és műtét után?
5.2.3. A stádium beosztásra vonatkozó adatok megtalálhatók-e?
5.3. Természetesen - figyelemmel az aktuális ellenőrzés prioritásaira - az említett szempontokon kívül egyéb szempontok vizsgálatára is kiterjedhet az ellenőrzés.
5.4. A dokumentáció tartalmi és formai megfelelőségének vizsgálata az ellenőrzés részét képezi.
5.5. A finanszírozási feltételek betartása, a sarokpontok megvalósulása bizonyos mértékig informatikai úton, továbbá helyszíni ellenőrzés során ellenőrizhető.
6. A döntést megalapozó hatásossági, költséghatékonysági mutatók
6.1. A finanszírozási eljárásrend a hazai és nemzetközi szakmai és finanszírozási irányelveknek megfelelően került összeállításra.
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A finanszírozási eljárásrend hatását a következő indikátorokkal kívánjuk mérni:
7.1.1. A területre fordított közkiadások alakulása.
7.1.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | C6200 | Nem descendált here rosszindulatú daganata |
| 3 | C6210 | Descendált here rosszindulatú daganata |
| 4 | C6290 | Here rosszindulatú daganata k.m.n |
| 5 | D2920 | Here jóindulatú daganata |
| 6 | D4010 | Here bizonytalan és ismeretlen viselkedésű daganata |
8.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 24333 | Szabad Humán Chorio-Gonadrotropin béta lánc meghatározása szérumban |
| 3 | 29000 | Szövettani vizsgálat a szokásos feldolgozási módszerrel |
| 4 | 29050 | Szövettani vizsgálat immunhisztokémiai reakció alkalmazása esetén |
| 5 | 30642 | Besugárzás tervezése, külső, számítógépes, 3D |
| 6 | 31310 | Mellkasfelvétel, AP/PA |
| 7 | 31460 | Has célzott felvétel |
| 8 | 33350 | Szuperszelektív arteriographia - első ág, egy irány |
| 9 | 33850 | Kemoterápia-szelektív |
| 10 | 36123 | Pleuraűr UH vizsgálata |
| 11 | 36130 | Hasi (áttekintő, komplex) UH vizsgálat |
| 12 | 36135 | Vese UH vizsgálata |
| 13 | 36150 | Kismedence transabdominalis UH vizsgálat |
| 14 | 36154 | Herezacskó UH vizsgálata |
| 15 | 36155 | Húgyhólyag UH vizsgálata |
| 16 | 36164 | Végtagi lágyrész UH vizsgálata |
| 17 | 69972 | Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpendált, szerelékkel |
| 18 | 88460 | Vérvétel |
| 19 | 2662G | AFP meghatározása szérumban |
| 20 | 24330 | Human Chorio-Gonadotropin meghatározása szérumban |
| 21 | 24500 | Tejsav dehidrogenáz (LDH) meghatározása |
| 22 | 24501 | LDH izoenzimek elektroforézises elválasztása |
| 23 | 34410 | Agykoponya natív CT vizsgálata |
| 24 | 34411 | Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
| 25 | 34440 | Mellkas CT vizsgálata natív |
| 26 | 34441 | Mellkas CT vizsgálata iv. kontrasztanyag adását követőleg |
| 27 | 34450 | Teljes has CT vizsgálata natív |
| 28 | 34451 | Teljes has CT vizsgálata iv. kontrasztanyag adását követőleg |
| 29 | 34460 | Medence CT vizsgálata natív |
| 30 | 34461 | Medence CT vizsgálata iv. kontrasztanyag adását követőleg |
8.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 6110 | Férfi reproduktív rendszer radikális műtétei |
| 3 | 6140 | Here műtétei malignus betegségek miatt |
| 4 | 621C | Férfi reproduktív rendszer rosszindulatú daganatai |
| 5 | 639Z | Férfi reproduktív rendszer betegségei súlyos társult betegséggel |
| 6 | 640Z | Férfi reproduktív rendszer műtétei súlyos társult betegséggel |
| 7 | 9430 | Sugárterápia |
| 8 | 959C-959G | Rosszindulatú daganat kemoterápiája "C"-"G" |
| 9 | 6190 | Férfi reproduktív rendszer egyéb műtétei rosszindulatú daganat miatt |
| 10 | 980B | Daganatos megbetegedések (kivéve: pajzsmirigy daganatok) kezelése nyílt radioizotóppal |
8.4. Releváns kemoterápiás protokollok
| A | B |
| 1 | KÓD | Kemoterápiás protokoll megnevezése |
| 2 | 7125 | Kemoterápia, IFO+VP+CDDP protokoll szerint |
| 3 | 7266 | Kemoterápia, CBP monoterápia szerint |
| 4 | 7314 | Kemoterápia, VelP protokoll szerint |
| 5 | 7315 | Kemoterápia, VeIP/A protokoll szerint |
| 6 | 7316 | Kemoterápia, VIP/J Carboplatinnal protokoll szerint |
| 7 | 7331 | Kemoterápia, BECA protokoll szerint |
| 8 | 7332 | Kemoterápia, BEP/A protokoll szerint |
| 9 | 7338 | Kemoterápia, VPB+CDDP protokoll szerint |
| 10 | 7339 | Kemoterápia, VPB+CBP protokoll szerint |
| 11 | 7361 | Kemoterápia, VIP/E protokoll szerint |
| 12 | 7365 | Kemoterápia, BEP/B protokoll szerint |
| 13 | 7373 | Kemoterápia, VIP/I protokoll szerint |
| 14 | 7462 | Kemoterápia, VP+CBP protokoll szerint |
| 15 | 7463 | Kemoterápia, VP+CDDP protokoll szerint |
| 16 | 7966 | Kemoterápia, GCT-PE protokoll szerint 18 év alatt |
| 17 | 7967 | Kemoterápia, GPEI protokoll szerint 18 év alatt |
| 18 | 7970 | Kemoterápia, MAHO-PVB protokoll szerint 18 év alatt |
| 19 | 7971 | Kemoterápia, GVAC protokoll szerint 18 év alatt |
| 20 | 7972 | Kemoterápia, GBEP protokoll szerint 18 év alatt |
| 21 | 7973 | Kemoterápia, GCAREB protokoll szerint 18 év alatt |
| 22 | 7974 | Kemoterápia, GBEP5 protokoll szerint 18 év alatt |
9. Fogalmak és rövidítések
RLA (retroperitonealis lymphadenectomia): A retroperitonealis nyirokcsomók és a nyirokszövet meghatározott dissectiós séma szerinti eltávolítása laparoszkópos vagy nyílt műtéttel, melynek diagnosztikai és terápiás értéke van.
Salvage terápia: Végső kezelési lehetőség, melyet azoknál a betegeknél alkalmaznak, akik nem reagálnak a standard kezelési stratégiára vagy nem tolerálják azt (2. vonalbeli kemoterápiát követően).
Surveillance: Aktív követés. A surveillance program alatt a betegek rendszeres időközönként előre meghatározott vizsgálatokon vesznek részt a betegség esetleges progressziójának szigorú monitorozása érdekében. Aktív beavatkozás helyett a betegek részt vehetnek a surveillance programban, ha a progresszió, illetve a kiújulás kockázata alacsony, és a gyógyszeres vagy radikális sebészi beavatkozások végzése a betegség miatt nem indokolt. Célszerű a beteg írásos beleegyező nyilatkozatát kérni a kezeléshez.
AFP alfa fötoprotein
BNO Betegségek Nemzetközi Osztályozása
BSC Best supportive care
CT computer tomográfia
EAU European Association of Urology
EP etopozid/ciszplatin
ESMO European Society for Medical Oncology
GCC csírasejtes vagy germinális daganat
HBCS Homogén betegségcsoport
HCG humán chorio gonadotropin hormon
LDH laktát dehidrogenáz
MRI mágneses rezonancia vizsgálat
NCCN National Comprehensive Cancer Network
NICE National Institute of Clinical Excellence
NSE neuron specifikus enoláz
OENO Orvosi Eljárások Nemzetközi Osztályozása
PET pozitron emissziós tomográf
PLAP placentaris alkalikus foszfatáz
RLA retroperitonealis lymphadenectomia
BEP bleomycin/etopozid/ciszplatin
VeIP vinblasztin/ifoszfamid/ciszplatin
VIP etopozid/ifoszfamid/ciszplatin
VPB vinblastin/cisplastin/beomycin"
31. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"28. melléklet a 31/2010. (V. 13.) EüM rendelethez
A húgyhólyagrák diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Daganatos megbetegedések
1.1.1. Rosszindulatú daganatos megbetegedések
1.1.1.1. Húgyhólyagrák
2. A kórkép leírása
2.1. A hólyagdaganat heterogén, térben és időben multiplex, polikronotóp krónikus megbetegedés. A klinikai spektrum három kategóriába osztható. Az első kategóriába a nem invazív tumor tartozik. Ebben az esetben a kezelés célja a rekurrencia és a progresszió meggátlása. A második kategóriába az invazív elváltozások tartoznak. Invazív tumor esetén el kell dönteni, hogy szükséges-e a hólyag eltávolítása a túlélés biztosításához, valamint hogy a daganat helyi kezelése kielégítő-e, vagy szisztémás kezelés szükséges. A harmadik csoportba a metasztatikus daganatok tartoznak, amelyek mellett az élet meghosszabbítása a cél. A magyar terápiás irányelv is megkülönbözteti a felismerés pillanatában - az urotheliumra korlátozódó vagy a basalis membránt áttörő, de - az izomszövetet el nem érő felületes tumorokat (75-85%) és az izomszövetet érintő tumorokat (15-25%).
2.1.1. TNM klinikai klasszifikáció, primer tumor
| Primer tumor (pT) | |
| pTX | A primer tumor nem értékelhető. |
| pT0 | A primer tumor léte nem bizonyítható. |
| pTa | Non invazív papillaris karcinóma. |
| pTis | Karcinóma in situ (lapos tumor). |
| A tumor átterjedt a subepithelialis kötőszövetre. | |
| pT2 | A tumor infiltrálja az izomszövetet. |
| pT2a | A tumor infiltrálja a (belső) felületes izomréteget. |
| pT2b | A tumor infiltrálja a (külső) mély izomréteget. |
| pT3 | A perivesicalis (zsír) szöveteket is infiltrálja a tumor. |
| pT3a | Mikroszkópos perivesicalis tumoros infiltráció. |
| pT3b | Makroszkópos perivesicalis tumoros infiltráció. |
| pT4 | A prosztatára, vesicula seminalisokra, nőknél vaginára, uterusra, mindkét nemnél a hasfalra, illetve medencefalra terjedő tumor. |
| pT4a | A tumor a prosztatára, vaginára, uterusra terjed. |
| pT4b | A tumor a medencefalra, hasfalra terjed. |
2.1.2. TNM klinikai klasszifikáció, Regionális nyirokcsomó
| Regionális nyirokcsomók (N) A regionális nyirokcsomók az elsődleges és a másodlagos nyirokelvezetés régióit magukban foglalják. Minden más nyirokcsomó, ami az aorta bifurcatio felett helyezkedik el, távoli nyirokcsomó. | |
| NX | A regionális nyirokcsomók nem értékelhetők. |
| N0 | Nincs regionális nyirokcsomó-érintettség. |
| N1 | Egyetlen regionális nyirokcsomó áttét a medencében (hypogastricus, obturator, iliaca externa menti, presacralis nyirokcsomó). |
| N2 | Többszörös regionális nyirokcsomó áttét a medencében (hypogastricus, obturator, iliaca externa menti, presacralis nyirokcsomó). |
| N3 | Iliaca communis menti nyirokcsomók áttéte. |
2.1.3. TNM klinikai klasszifikáció, Távoli áttétek
| Távoli metasztázis (M) | |
| MX | A távoli metasztázis nem értékelhető. |
| M0 | Nincs távoli metasztázis. |
| M1 | Távoli metasztázis. |
2.1.4. A hólyagrák stádiumbeosztása
| Stádium-beosztás (NCCN) | |||
| 0a stádium | Ta | N0 | M0 |
| 0is stádium | Tis | N0 | M0 |
| I stádium | T1 | N0 | M0 |
| II stádium | T2a | N0 | M0 |
| T2b | N0 | M0 | |
| III stádium | T3a | N0 | M0 |
| T3b | N0 | M0 | |
| T4a | N0 | M0 | |
| IV stádium | T4b | N0 | M0 |
| Bármely T | N1-3 | M0 | |
| Bármely T | N2 | M0 | |
| Bármely T | N3 | M0 | |
| Bármely T | Bármely N | M1 | |
2.1.5. Kockázati csoportbeosztás non-invazív hólyagdaganatoknál
| Alacsony kockázatú daganat (a non-invazívak 50%-a) | Ha: pTaG1 szoliter, 3 cm-nél kisebb, és minimum 1 évig nem recidivál |
| Közepes kockázatú daganat (a non-invazívak 30%-a) | Ha: pTaG2-3, pT1G1-2, vagy multiplex, vagy 3 cm-nél nagyobb, vagy 1 éven belül recidivál |
| Magas kockázatú daganat (a non-invazívak 20%-a) | Ha: pCIS, pT1G3, vagy 5-nél több gócú, vagy az első 3 hónapos kontrollnál recidivál |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
3.1. A húgyhólyagrák diagnosztikájának finanszírozási algoritmusa
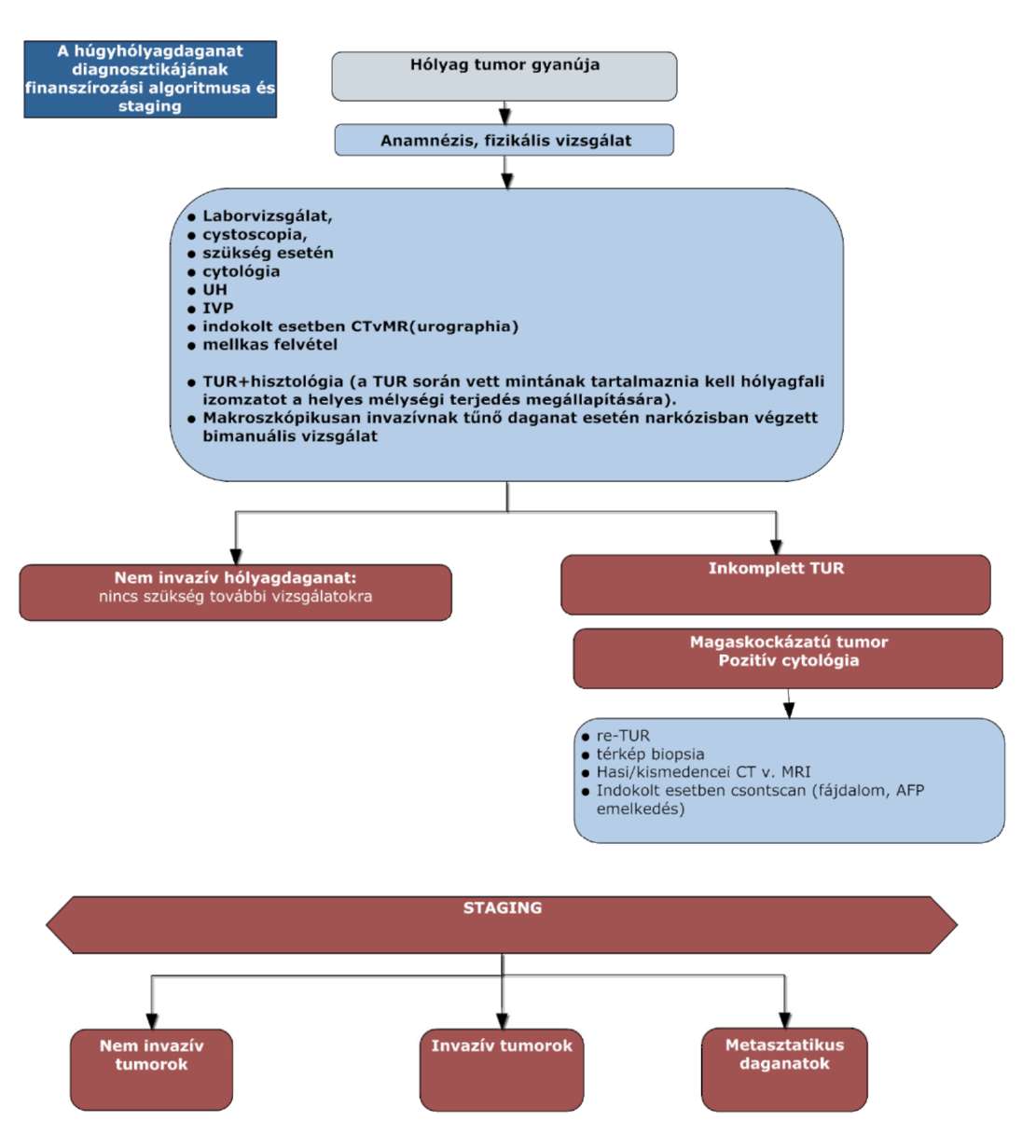
3.2. A nem invazív tumorok finanszírozási algoritmusa
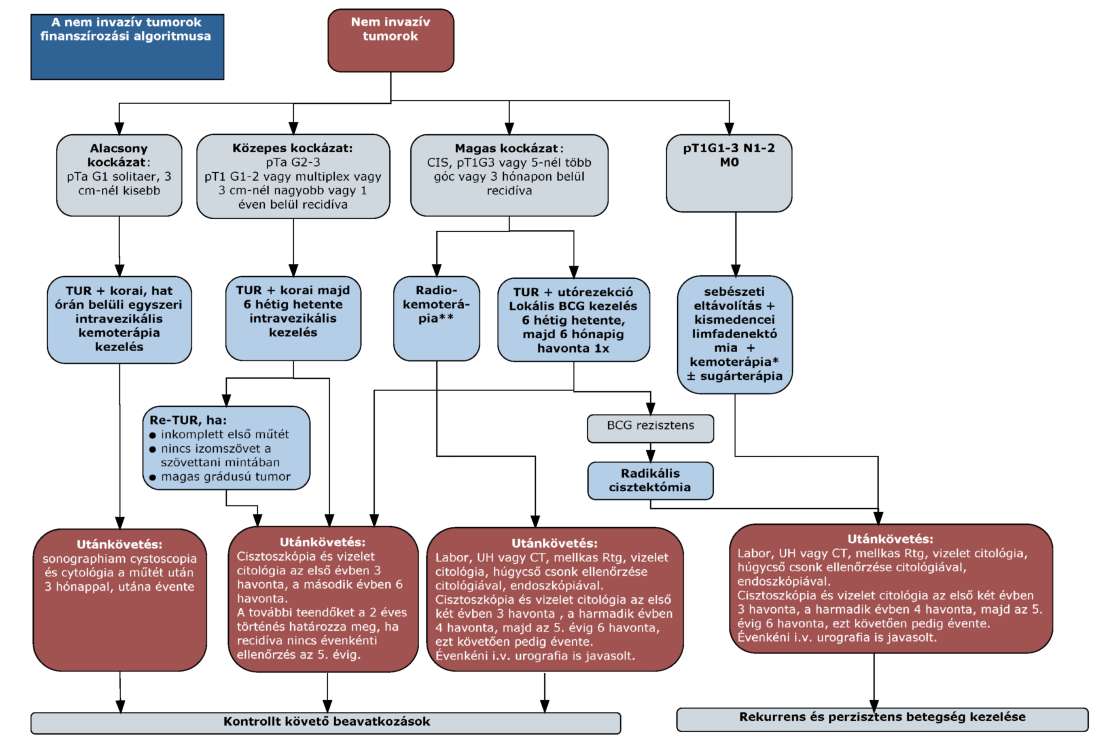
3.3. Az invazív tumorok finanszírozási algoritmusa
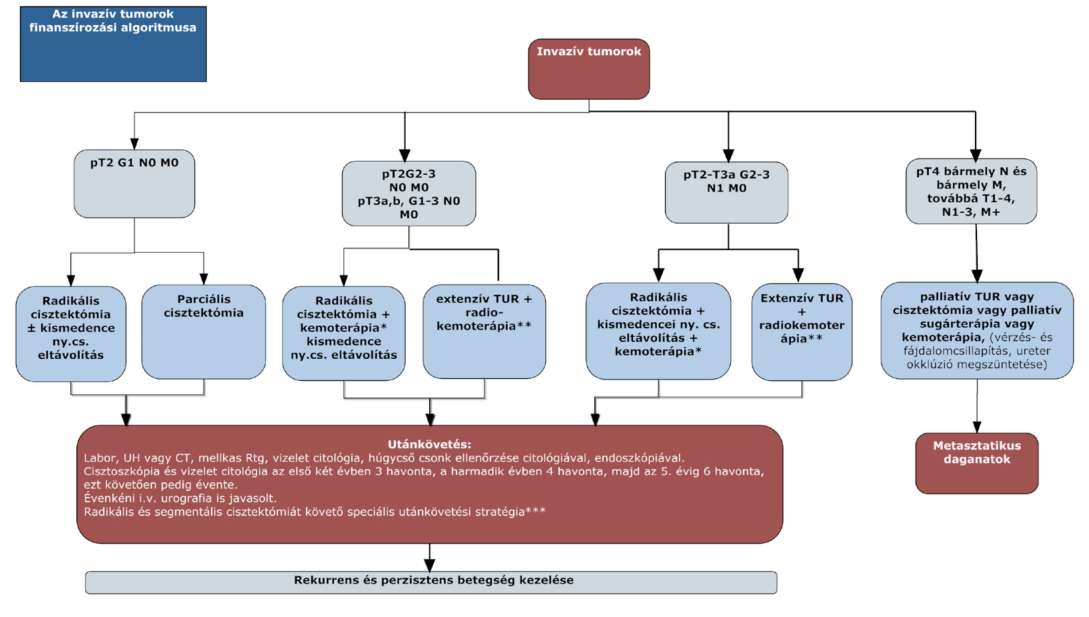
3.4. A metasztatikus daganatok
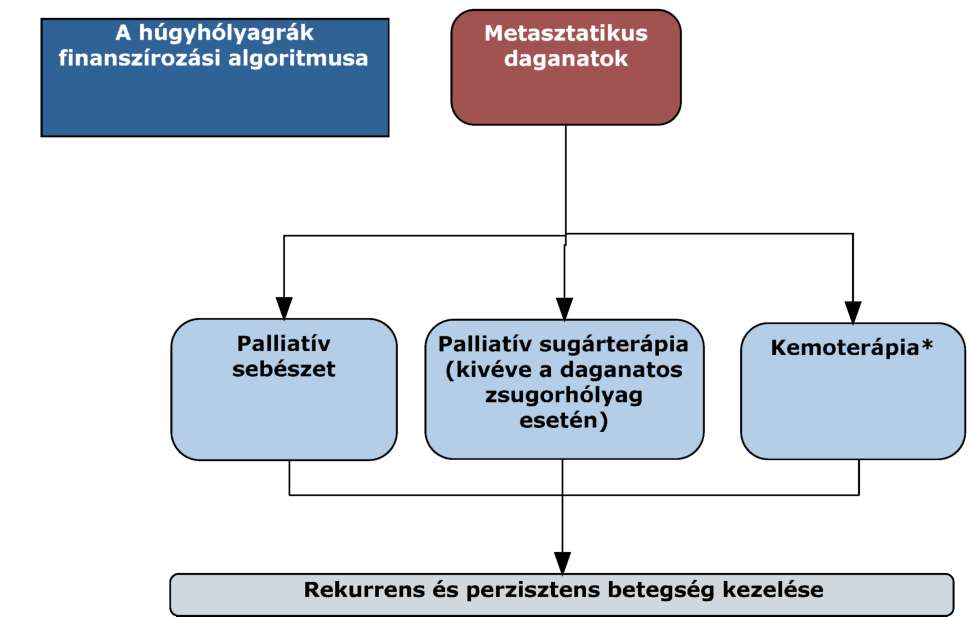
3.5. A húgyhólyag tumorok utánkövetése
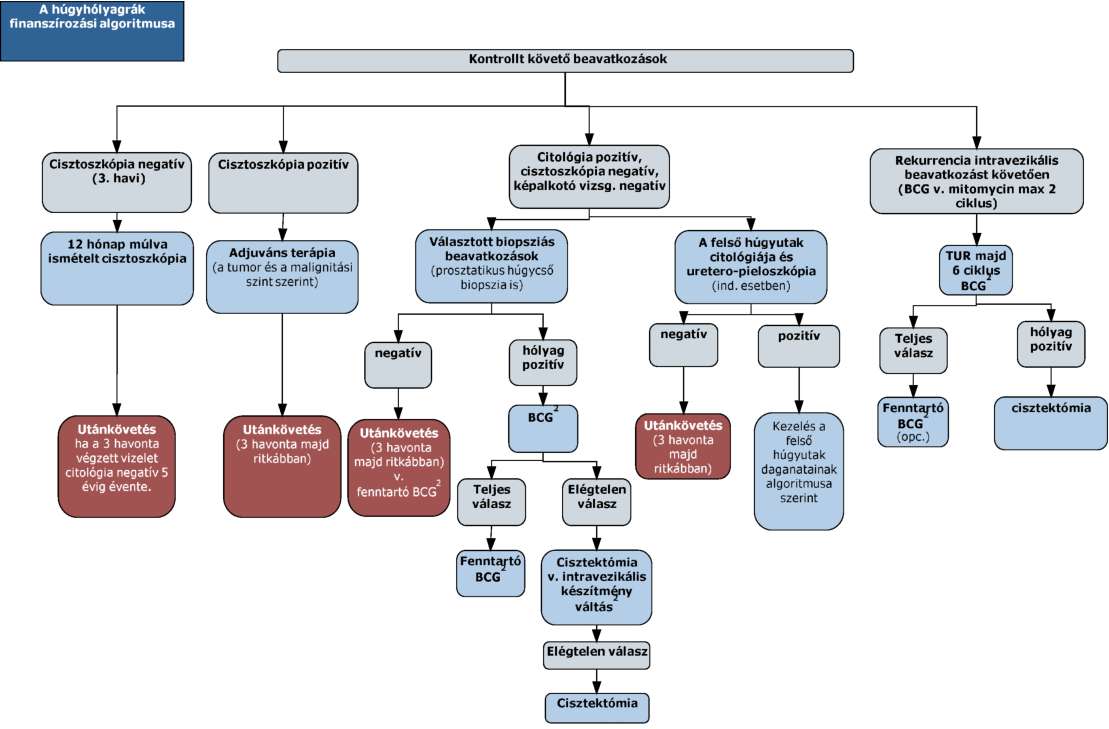
3.6. A rekurrens és perzisztens betegség kezelése
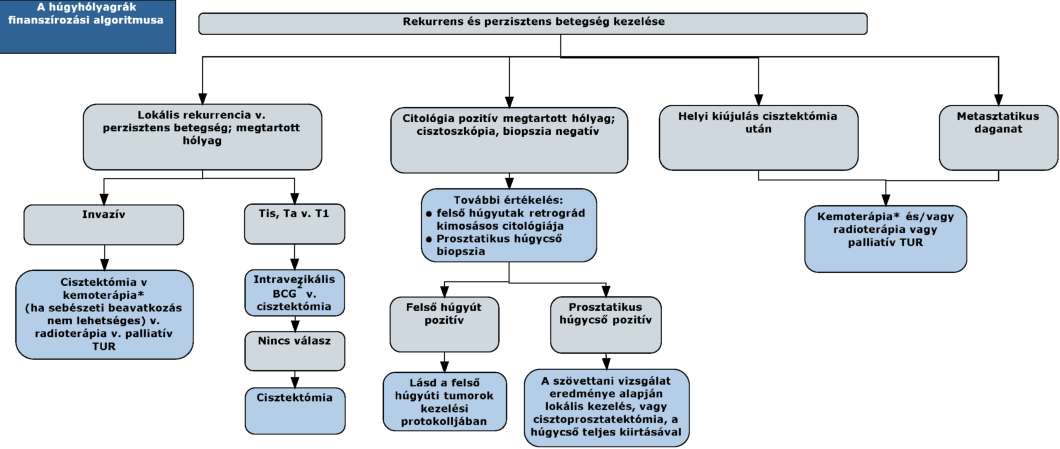
3.7. A finanszírozási algoritmusok részletezése:
3.7.1. A húgyhólyag daganatok diagnosztikai specifikumai a következők: labor, citológia és cisztoszkópia alapján minden esetben szükséges annak megállapítása, hogy a tumor invazív-e, és ezen információ birtokában kell a kezelést megkezdeni.
3.7.2. EÜ100 8/l1. támogatott hatóanyagok hólyagtumor alacsony és közepes kockázatú eseteiben az intravesicalis instilláció céljára:
3.7.2.1. epirubicin (L01DB03)
3.7.3. EÜ100 8/l2. támogatott hatóanyagok hólyagtumor magas kockázatú eseteiben intravesicalis instilláció céljára és in situ carcinomában:
3.7.3.1. vakcina (bakteriális) (L03AX03)
3.7.4. Utánkövetés radikális cisztektómia után:
3.7.4.1. Vizelet citológia, kreatinin, elektrolitok 3-6 havonta 2 évig, majd a klinikailag indikált gyakorisággal.
3.7.4.2. A mellkas, has és kismedence medence képalkotó vizsgálatai 3-12 havonta a kiújulás kockázata alapján 2 évig, majd klinikai indikáció szerint.
3.7.4.3. Vizelet citológia 6-12 havonta (különösen, ha a prosztata, hólyag urethra területén Tis található).
3.7.4.4. B12 vitamin deficiencia vizsgálat évente (indokolt esetben).
3.7.4.5. Utánkövetés segmentális cisztektómia után.
3.7.4.6. A fenti stratégia követése.
3.7.4.7. + 3 havi vizelet citológiai vizsgálatok és citoszkópia a hólyagdaganat relapszus vizsgálatára.
4. A húgyhólyagrák finanszírozásának ellenőrzési kritériumai
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése.
4.1.2. Betegadatok (online TAJ ellenőrzés).
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése.
4.2. Szakmai ellenőrzési pontok
4.2.1. A diagnózis kritériumainak felállítása megfelelő volt-e?
4.2.2. A tumor invazivitásának ellenőrzése megtörtént-e?
4.2.3. Az utánkövetés a megfelelő időben megtörtént-e, és ezen minden szükséges vizsgálatot elvégeztek-e?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B |
| 1 | BNO | BNO megnevezés |
| 2 | C6700 | Húgyhólyag trigonumának rosszindulatú daganata |
| 3 | C6710 | Húgyhólyag tető (vertex) rosszindulatú daganata |
| 4 | C6720 | Húgyhólyag oldalfalának rosszindulatú daganata |
| 5 | C6730 | Húgyhólyag mellső falának rosszindulatú daganata |
| 6 | C6740 | Húgyhólyag hátsó falának rosszindulatú daganata |
| 7 | C6750 | Húgyhólyag nyakának rosszindulatú daganata |
| 8 | C6760 | Húgyvezeték nyílás (orificium) rosszindulatú daganata |
| 9 | C6770 | Urachus rosszindulatú daganata |
| 10 | C6780 | A húgyhólyag átfedő elváltozása, rosszindulatú daganata |
| 11 | C6790 | Húgyhólyag rosszindulatú daganata, k.m.n. |
6.2. Releváns OENO kódok
| A | B | |
| 1 | OENO kód | OENO megnevezés |
| 2 | 5558F | Percutan nephrostoma cseréje |
| 3 | 11041 | Vizsgálat |
| 4 | 11301 | Kontrollvizsgálat, konzílium |
| 5 | 16520 | Cystoscopia |
| 6 | 16550 | Urethro-cystoscopia |
| 7 | 29000 | Szövettani vizsgálat a szokásos feldolgozási módszerrel |
| 8 | 29400 | Diagnosztikus aspirációs/exfoliatív citológiai vizsgálat a szokásos feldolgozási módszerrel |
| 9 | 37200 | Lineáris accelerátor, foton 6 MV-ig, egy mező |
| 10 | 37210 | Lineáris accelerátor, foton 7-15 MV-ig, egy mező |
| 11 | 37220 | Lineáris accelerátor, foton 16 MV és afelett, egy mező |
| 12 | 55731 | TUR ves.urin.therapeutic |
| 13 | 55732 | TUR ves.urin.palliativa |
| 14 | 55850 | Húgycsőtágítás |
| 15 | 88135 | Transzfúzió során végzett tevékenység |
| 16 | 92235 | Immuno-chemotherapia intravesicalis |
| 17 | 55773 | Húgyhólyagpótlás coecum + ileummal |
| 18 | 55774 | Húgyhólyagpótlás sigmabéllel |
| 19 | 55775 | Húgyhólyagpótlás egyéb bélszakasszal |
| 20 | 55760 | Cystectomia simplex ves. urin. |
| 21 | 55761 | Cystectomia totalis ves. urin. |
| 22 | 55762 | Cystektomia radicalis |
6.3. Releváns kemoterápiás protokollok
| A | B | |
| 1 | Kód | Kemoterápiás protokoll megnevezése |
| 2 | 7026 | Kemoterápia, CAP I. protokoll szerint |
| 3 | 7050 | Kemoterápia, GEM/A protokoll szerint |
| 4 | 7051 | Kemoterápia, GEM+CDDP I. protokoll szerint |
| 5 | 7052 | Kemoterápia, GEM+CDDP II. protokoll szerint |
| 6 | 7053 | Kemoterápia, GEM/B protokoll szerint |
| 7 | 7054 | Kemoterápia, GEM+CDDP III. protokoll szerint |
| 8 | 7316 | Kemoterápia, VIP/J Carboplatinnal protokoll szerint |
| 9 | 7317 | Kemoterápia, CMV protokoll szerint |
| 10 | 7320 | Kemoterápia, GEM+CBP/C protokoll szerint |
| 11 | 7321 | Kemoterápia, CISCA protokoll szerint |
| 12 | 7322 | Kemoterápia, CMV/C protokoll szerint |
| 13 | 7364 | Kemoterápia, CEP protokoll szerint |
| 14 | 7372 | Kemoterápia, MVAC protokoll szerint |
| 15 | 7402 | Kemoterápia, CEP II. protokoll szerint |
| 16 | 7404 | Kemoterápia, MVEC protokoll szerint |
| 17 | 7405 | Kemoterápia, CMV/B protokoll szerint |
| 18 | 7414 | Radiokemoterápia, hólyag rák esetén CDDP protokoll szerint |
| 19 | 7415 | Radiokemoterápia, hólyag rák esetén CBP protokoll szerint |
| 20 | 7701 | Kemoterápia, CAP I.+dexrazoxane protokoll szerint |
| 21 | 7720 | Kemoterápia, CEP+dexrazoxane protokoll szerint |
| 22 | 7721 | Kemoterápia, CEP II.+dexrazoxane protokoll szerint |
| 23 | 7727 | Kemoterápia, SIVD2+dexrazoxane protokoll szerint 18 év alatt |
| 24 | 7728 | Kemoterápia, SCErV+dexrazoxane protokoll szerint 18 év alatt |
| 25 | 7948 | Kemoterápia, SV protokoll szerint 18 év alatt |
| 26 | 7949 | Kemoterápia, SVA protokoll szerint 18 év alatt |
| 27 | 7950 | Kemoterápia, SIVA2 protokoll szerint 18 év alatt |
| 28 | 7951 | Kemoterápia, SIVD2 protokoll szerint 18 év alatt |
| 29 | 7952 | Kemoterápia, SIVA3 protokoll szerint 18 év alatt |
| 30 | 7953 | Kemoterápia, SCErV protokoll szerint 18 év alatt |
| 31 | 7954 | Kemoterápia, SI3VE protokoll szerint 18 év alatt |
| 32 | 7955 | Kemoterápia, SICARE5 protokoll szerint 18 év alatt |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC kód | Hatóanyag |
| 2 | L01AA01 | Cyclophosphamide |
| 3 | L01AA06 | Ifosfamid |
| 4 | L01BA01 | Metotrexat |
| 5 | L01BC05 | Gemcitabine |
| 6 | L01CA01 | Vinblastin |
| 7 | L01CA02 | Vincristine |
| 8 | L01CB01 | Etoposide |
| 9 | L01DB01 | Doxorubicin |
| 10 | L01DB03 | Epirubicin |
| 11 | L01DC03 | Mitomycin |
| 12 | L01XA01 | Cisplatin |
| 13 | L01XA02 | Carboplatin |
| 14 | L02AB01 | Megestrol |
| 15 | L03AA02 | Filgrastim |
| 16 | L03AA13 | Pegilfilgrastim |
| 17 | L03AX03 | BCG vakcina |
| 18 | M05BA08 | Zolendronsav |
| 19 | N02AB03 | Fentanyl |
| 20 | V03AF01 | Mesna |
| 21 | V03AF02 | Dexrazoxan |
7. Fogalmak, rövidítések
AJCC American Joint Committee on Cancer
ATC Anatomical Therapeutic Chemical klasszifikáció
BCG Intravezikális immunterápia Bacillus Calmette-Guérin
BNO Betegség nemzetközi osztályozása
BSC Best supportive care
CIS Karcinóma in situ
CT Computer tomográfia
M Távoli metasztázis
MRI Mágneses rezonancia vizsgálat
N Regionális nyirokcsomók
NCCN National Comprehensive Cancer Network
OENO Orvosi eljárások nemzetközi osztályozása
OEP Országos Egészségbiztosítási Pénztár
PET Pozitronemissziós tomográfia
pT Primer tumor
TAJ Társadalombiztosítási azonosító jel
TUR Transurethalis rezekció
UH Ultrahang
WHO World Health Organization
Aktív surveillance: Fokozott felügyelet. A surveillance program alatt a betegek rendszeres időközönként előre meghatározott vizsgálatokon vesznek részt a betegség esetleges progressziójának szigorú monitorozása érdekében. Aktív beavatkozás helyett a betegek részt vehetnek a surveillance programban, ha a progresszió, illetve a kiújulás kockázata alacsony, és a radikális beavatkozások végzése emiatt nem indokolt.
Cisztektómia: A húgyhólyag eltávolítása sebészeti beavatkozással.
Intravezikális immunterápia: Intravezikális terápia az immunrendszerre ható készítménnyel.
Intravezikális kemoterápia: Az eljárás során a kemoterápiás hatóanyagot katéteren keresztül juttatják a húgyhólyagba, amelyek magas koncentrációban jutnak el a tumor kiindulási területére.
Salvage terápia: Végső kezelési lehetőség, melyet azoknál a betegeknél alkalmaznak, akik nem reagálnak a standard kezelési stratégiára, vagy nem tolerálják azt.
Transzurethralis rezekció (TUR): A diagnózisra és a rákos szövet eltávolítására használt eljárás. Az urethran keresztül cisztoszkópot juttatnak a hólyagba. A rákos szövetet resectoszkóppal távolítják el."
32. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"29. melléklet a 31/2010. (V. 13.) EüM rendelethez
A prosztata daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Daganatos megbetegedések
1.1.1. Rosszindulatú daganatos megbetegedések
1.1.1.1. Prosztata daganat
2. A kórkép leírása
2.1. A prosztatarák a férfi genitális rendszerhez tartozó dülmirigy rosszindulatú megbetegedése. A férfiakban a prosztatarák az egyik leggyakrabban felismert rosszindulatú elváltozás. Az újonnan diagnosztizált esetek 75%-a a 65 év feletti korosztályból származik. Magyarországon az összes daganatos halálozás szempontjából a prosztatarák a nyolcadik, a férfi daganatos halálozás tekintetében a negyedik helyen áll. A prosztata daganat szövettanilag adenokarcinóma, mely a prosztata mirigyekből indul ki. Négy fő típusát különböztetjük meg: kis acinusú, nagy acinusú, kribriform és szolid trabekuláris. A prosztatarák kiindulási helye és a morfológiai megjelenés alapján két főcsoportba osztható: a perifériás duktusz- és acinus kiindulású karcinómák, illetve a nagy duktuszokból kiinduló karcinóma.
2.2. A daganat TNM klasszifikációja a következő:
2.2.1. TNM klinikai klasszifikáció, primer tumor
| Primer tumor | |
| Tx | A primer tumor nem ítélhető meg |
| T0 | Nincs bizonyított primer tumor |
| T1 | Incidentális, klinikailag tünetmentes, nem tapintható, képalkotó eljárással nem látható daganat |
| T1a | A rezekátum </= 5%-a tumoros |
| T1b | A rezekátum > 5%-a tumoros |
| T1c | Tűbiopsiával igazolt tumor (pl.: magasabb PSA miatt) |
| T2 | Szervre lokalizált, klinikailag kimutatható tumor |
| T2a | Egy lebeny felét vagy kevesebb, mint felét involválja a tumor |
| T2b | Egy lebeny több, mint felét involválja a tumor |
| T2c | Mindkét lebenyt érinti a tumor |
| T3 | A tumor áttöri a prosztata tokját (ha a prosztata apexébe észlelhető tumoros invázió vagy apikális tok infiltrált, de a daganat nem terjed túl rajta, akkor a stádium nem minősül T3-nak, csak T2-nek) |
| T3a | A tumor ráterjed a tokjára, de az ondóhólyagokat nem érinti (extrakapszuláris terjedés, uni- vagy bilaterális, valamint ide tartozik a mikroszkopikus hólyagnyak invázió is) |
| T3b | Infiltrálja a tumor az ondóhólyago(ka)t |
| T4 | A tumor fixált vagy ráterjed a szomszédos szervekre: külső sphincter, rectum, m. levatorizmok, illetve a medencefal |
2.2.2. TNM klinikai klasszifikáció, Regionális nyirokcsomó
| Regionális nyirokcsomók (N) | |
| Nx | Regionalis nyirokcsomók nem ítélhetők meg |
| N0 | Nincs regionalis nyirokcsomó-metasztázis |
| N1 | Regionalis nyirokcsomó metasztázis kimutatható |
2.2.3. TNM klinikai klasszifikáció, Távoli áttétek
| Távoli metasztázis (M) | |
| Mx | Távoli áttét nem ítélhető meg |
| M0 | Nincs távoli metasztázis |
| M1 | Távoli metasztázis kimutatható* |
| M1a | Nem regionalis nyirokcsomó |
| M1b | Csontmetasztázis |
| M1c | Más helyen előforduló metasztázis |
* Ha egynél több lokalizációban van metasztázis, a legelőrehaladottabb kategória, vagyis M1c
2.2.4. A prosztatadaganat stádiumbeosztása, prognosztikai csoportok
| Stádium | TNM | PSA | Gleason pontszám |
| I. Csoport Alacsony kockázat | T1a-c N0 T2a N0 | M0 PSA < 10 M0 PSA < 10 | Gleason ≤ 6 Gleason ≤ 6 |
| IIA Csoport Közepes kockázat | T1a-c N0 T1a-c N0 T2a, b N0 | M0 PSA < 20 M0 10 ≤ PSA < 20 M0 PSA < 20 | Gleason 7 Gleason ≤ 6 Gleason ≤ 7 |
| IIB Csoport Közepes kockázat | T2c N0 T1-2 N0 T1-2 N0 | M0 bármely PSA M0 PSA ≥ 20 M0 bármely PSA | Bármely Gleason Bármely Gleason Gleason ≥ 8 |
| III Csoport Magas kockázat | T3a, b N0 | M0 bármely PSA | Bármely Gleason |
| IV Csoport Nagyon magas kockázat | T4 N0 Bármely T N1 Bármely T Bármely N | M0 bármely PSA M0 bármely PSA M1 bármely PSA | Bármely Gleason Bármely Gleason Bármely Gleason |
2.3. Az ellátás igénybevételének szakmai rendje
Az ellátás igénybevételének szakmai rendjét a hatályos szakmai irányelv tartalmazza.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
3.1. A prosztata daganatok diagnosztikája
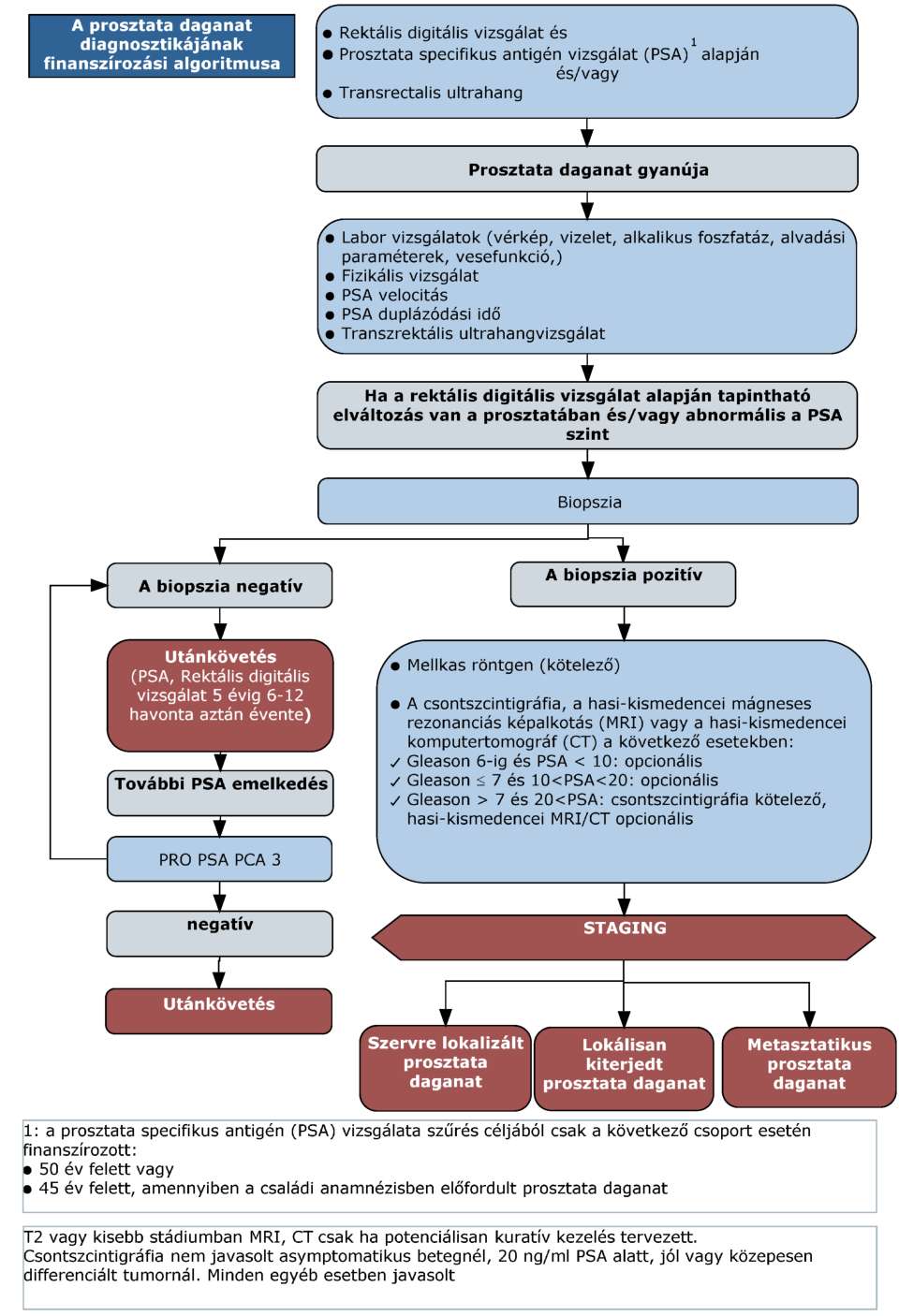
3.2. A prosztata daganat ellátása - szervre lokalizált alacsony kockázattal
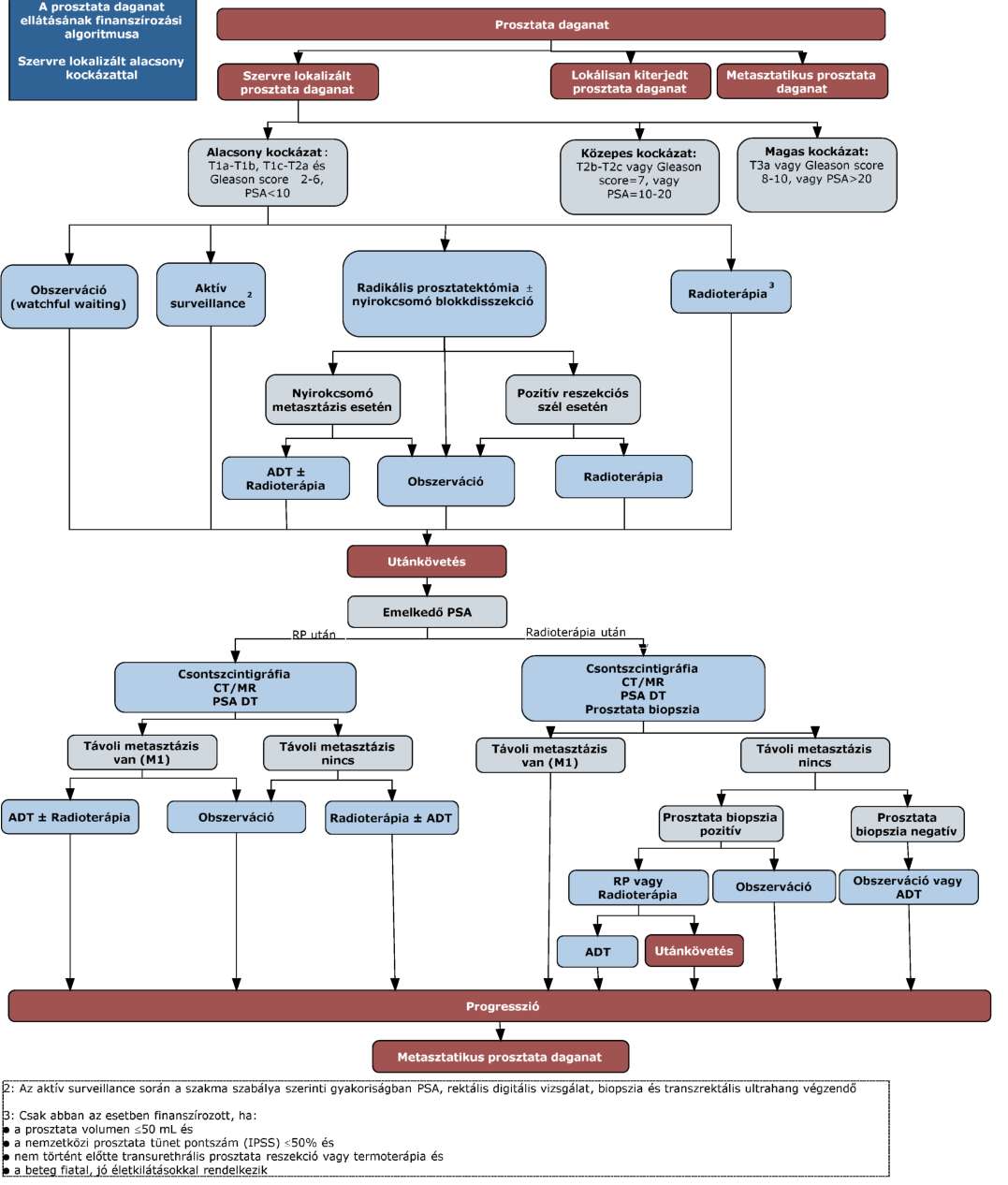
3.3. A prosztata daganat ellátása - szervre lokalizált közepes kockázattal
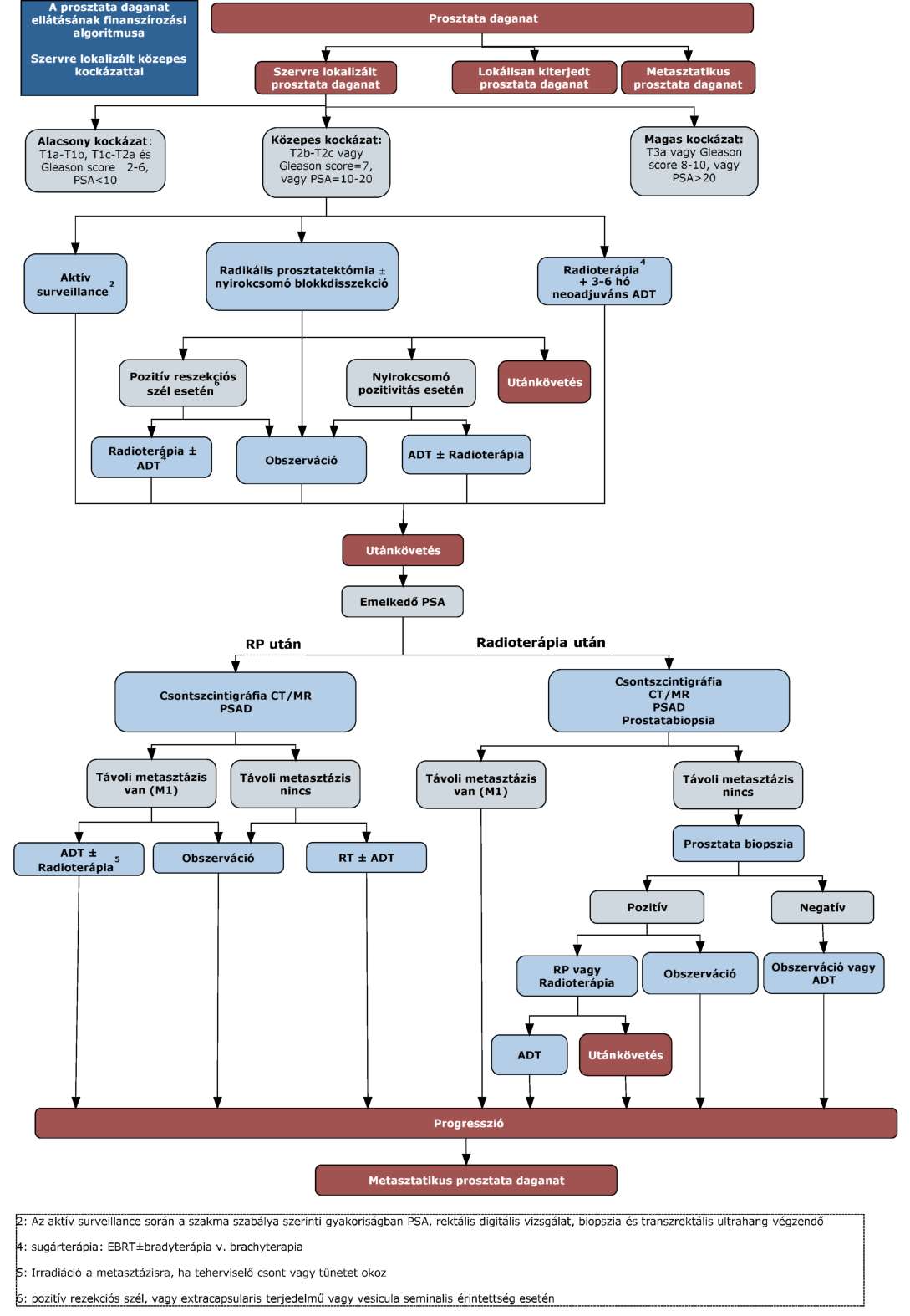
3.4. A prosztata daganat ellátása - szervre lokalizált magas kockázattal, illetve lokálisan kiterjedt nagyon magas kockázattal
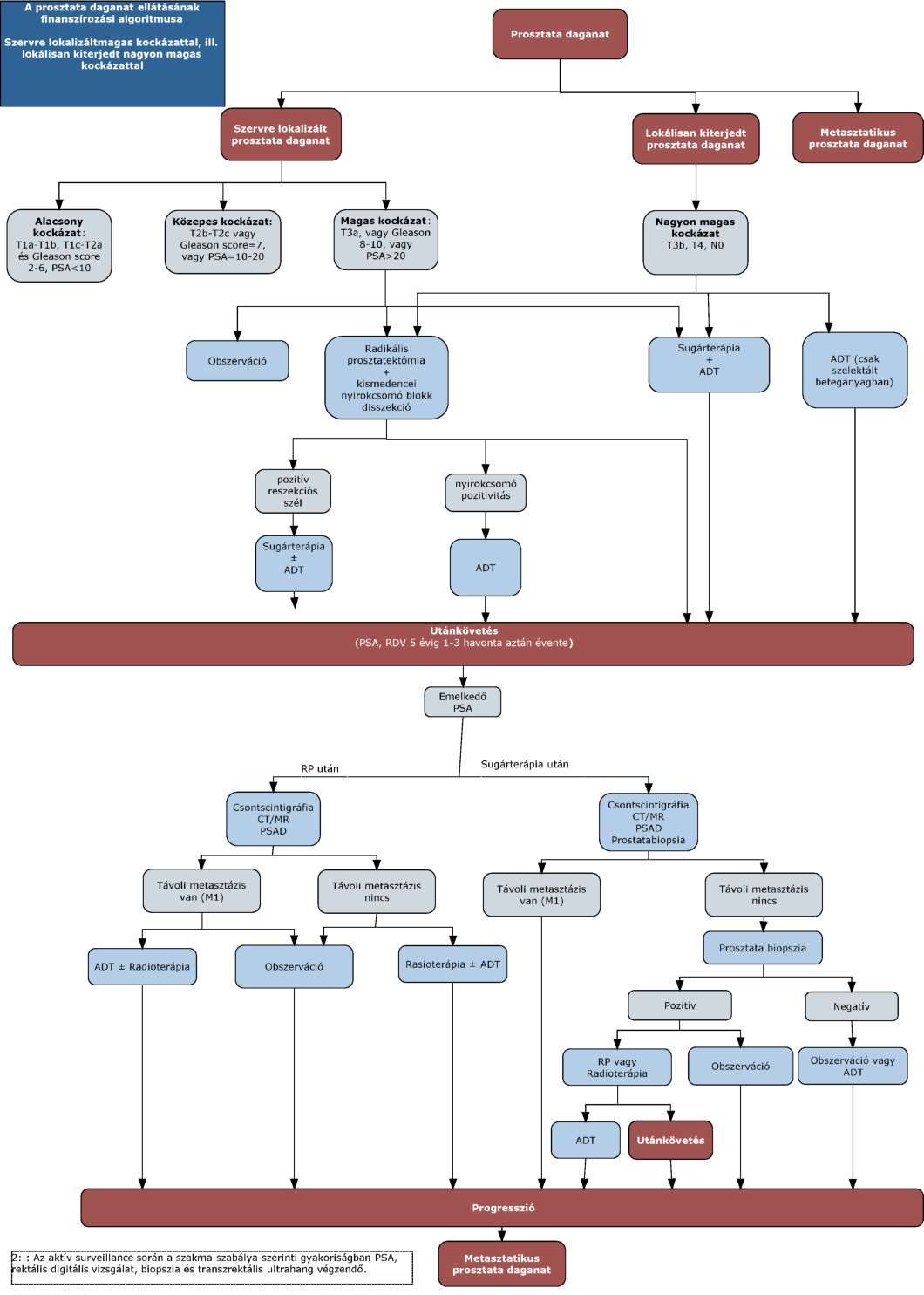
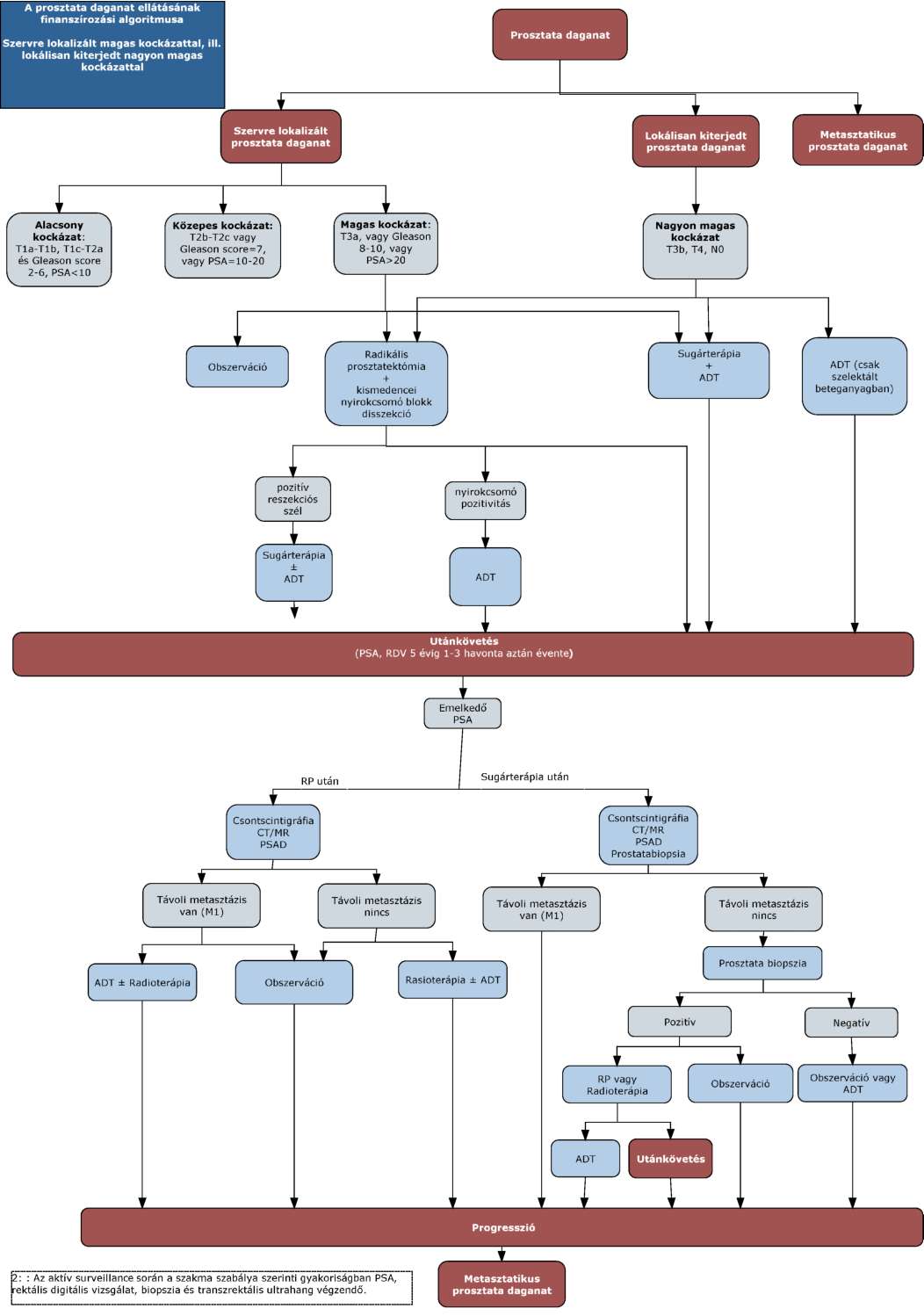
3.5. A metasztatikus prosztata daganat ellátása - metasztatikus prosztata daganat
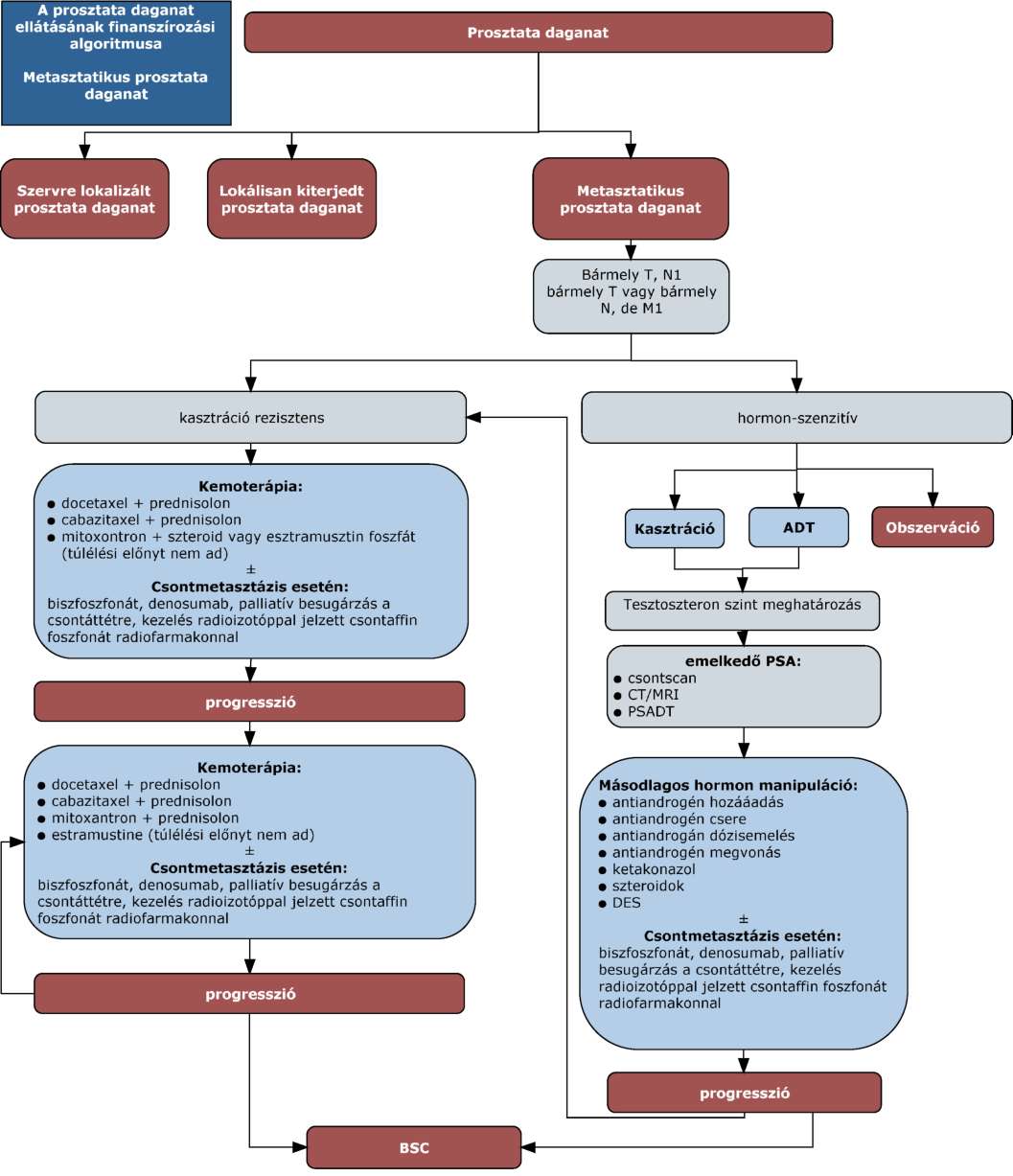
3.6. A finanszírozási algoritmus részletezése
3.6.1. Kemoterápia alatt a következő protokollok számolhatóak el:
7165 Kemoterápia, TXT protokoll szerint
7184 Kemoterápia, TXT/B monoterápia protokoll szerint
7216 Kemoterápia, MITX iv. monoterápia protokoll szerint
7998 Kemoterápia, KAB protokoll szerint
4. A prosztatadaganat finanszírozásának ellenőrzési kritériumai
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. Szakmai ellenőrzési pontok
4.2.1. A diagnózis kritériumainak felállítása megfelelő volt-e?
4.2.2. Az utánkövetés a megfelelő időben megtörtént-e, és ezen minden szükséges vizsgálatot elvégeztek-e?
4.2.3. Meddig tartott az antiandrogén terápia?
4.2.4. A kuratív kezelésre alkalmas betegek valóban kuratív kezelésben részesültek-e? Amennyiben nem, mi ennek az oka?
4.2.5. Műtét és sugárterápia után a követés megfelelő volt-e?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | C61H0 | A prosztata rosszindulatú daganata |
| 3 | D0750 | Prosztata in situ carcinomája |
| 4 | D4000 | Prosztata bizonytalan és ismeretlen viselkedésű daganata |
| 5 | Z1250 | Szűrővizsgálat prosztata daganat kimutatására |
6.2. Releváns finanszírozási kódok (diagnosztika)
| A | B | |
| 1 | KÓD | Megnevezés |
| 2 | 25311 | Antibiotikum MIC, MBC meghatározás / antibiotikum |
| 3 | 3523B | Áttekintő csontszcintigráfia |
| 4 | 25131 | Bakteriuria vizsgálata nitrit próbával |
| 6 | 36130 | Hasi (áttekintő, komplex) UH vizsgálat |
| 7 | 36154 | Herezacskó UH vizsgálata |
| 8 | 36155 | Húgyhólyag UH vizsgálata |
| 9 | 13310 | Kérdőív felvétele, prosztata-betegségekben |
| 10 | 36150 | Kismedence transabdominalis UH vizsgálat |
| 11 | 11301 | Kontrollvizsgálat, konzílium |
| 12 | 31310 | Mellkasfelvétel, AP/PA |
| 13 | 3523B | Áttekintő csontszcintigráfia |
| 14 | 2662C | Prostata specifikus antigén (PSA) |
| 15 | 36152 | Prostata UH vizsgálata |
| 16 | 29000 | Szövettani vizsgálat a szokásos feldolgozási módszerrel |
| 17 | 24398 | Totál tesztoszteron meghatározása |
| 18 | 13340 | Uroflowmetria |
| 19 | 28014 | Vérkép, automatával IV. |
| 20 | 88460 | Vérvétel |
| 21 | 36135 | Vese UH vizsgálata |
| 22 | 22552 | Vizelet üledék alakos elemek meghatározása automatával, beleértve az esetleges mikroszkópos ellenőrzést is |
| 23 | 36180 | Vizeletürítés vizsgálata ultrahanggal |
| 24 | 22551 | Vizeletvizsgálat üledék nélkül minimum 5 paraméter |
| 25 | 11041 | Vizsgálat |
6.3. Releváns finanszírozási kódok (kemoterápia)
| A | B | |
| 1 | KÓD | Megnevezés |
| 2 | 7216 | Kemoterápia, MITX iv. monoterápia protokoll szerint |
| 3 | 7165 | Kemoterápia, TXT protokoll szerint |
| 4 | 7184 | Kemoterápia, TXT/B monoterápia protokoll szerint |
| 5 | 7998 | Kemoterápia, KAB protokoll szerint |
6.4. Releváns finanszírozási kódok (egyéb eljárások)
| A | B | |
| 1 | KÓD | Megnevezés |
| 2 | 88911 | Felszíni érzéstelenítés |
| 3 | 91241 | Gyógyszer beültetés tartós hatás céljából |
| 4 | 88912 | Helyi infiltrációs érzéstelenítés |
| 5 | 81350 | Hólyagkatéter (állandó) cseréje |
| 6 | 81320 | Húgyhólyag öblítés |
| 7 | 85881 | Infúzió adása |
| 8 | 85860 | Injectio in cutis seu subcutis |
| 9 | 85850 | Injectio in musculus, tendo, bursa seu ligamentum |
| 10 | 85880 | Intravénás injectio |
| 11 | 37008 | Konformális besugárzás kiegészítő pontja |
| 12 | 81924 | Sebkötözés, kötéscsere (aszeptikus) |
| 13 | 30670 | T esthelyzetrögzítés sugárkezeléshez |
6.5. Releváns ATC kódok
| A | B | |
| 1 | ATC kód | Hatóanyag |
| 2 | G03HA01 | cyproteron |
| 3 | G04CB01 | finasterid |
| 4 | H02AB06 | prednizolon |
| 5 | L01CD02 | docetaxel |
| 6 | L01DB07 | mitoxantron |
| 7 | L01XX11 | estramustin |
| 8 | L02AE01 | buserelin |
| 9 | L02AE02 | leuprorelin |
| 10 | L02AE03 | goserelin |
| 11 | L02AE04 | triptorelin |
| 12 | L02BB02 | nilutamid |
| 13 | L02BB03 | bicalutamid |
| 14 | L02BX02 | degarelix |
| 15 | L01CD04 | kabazitaxel |
7. Fogalmak, rövidítések
ADT antigén deprivációs terápia
BSC legjobb tüneti kezelés
PSA prosztata specifikus antigén
PSA DT PSA doubling time
PSA velocitás A serum PSA egy év alatti abszolút növekedése (ng/ml/év)
aktiv surveillance Fokozott felügyelet. A surveillance program alatt a betegek rendszeres időközönként előre meghatározott vizsgálatokon és mintavételeken vesznek részt a betegség esetleges progressziójának szigorú monitorozása érdekében.
watchful waiting kezelés halasztása
TUR: transzuretralis prosztata rezekció: a prosztata szövet húgycsövön keresztüli eltávolítása
radikális prosztatektomia: a szervre lokalizált prosztatarák nyílt vagy laparoszkópos eltávolítása
Gleason score: a prosztatarák differenciáltsági fokának megállapításához használt pontszám. A pontszám 4 (2) és 10 között lehet, a 4 (2) a legkevésbé, a 10 a leginkább agresszív daganat.
Gx: a Gleason score nem állapítható meg;
Gleason 4-6: jól differenciált daganat (minimális anaplázia);
Gleason 7: közepesen vagy mérsékelten differenciált daganat (mérsékelt anaplázia);
Gleason 8-10: rosszul differenciált daganat vagy differenciálatlan (jellegzetes anaplázia)."
33. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"30. melléklet a 31/2010. (V. 13.) EüM rendelethez
A szkizofrénia antipszichotikus gyógyszeres kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Szkizofrénia (BNO: F20)
2. A kórkép leírása
2.1. A szkizofrénia az elmeműködés zavarának súlyos formája, a különböző pszichés funkciók, mint pl. észlelés, gondolkodás, érzelmi élet, motiváció, valóságérzékelés, magatartás zavarai jellemzik, különböző munkahelyi és szociális működési problémáktól kísérten. A jellemző tünetek minimum egy hónapig (sikeres terápia után rövidebb ideig) fennállnak, de egyes jegyek hat hónapnál tovább is fennállhatnak. A szkizofrénia fázisokban megjelenő betegségként írható le (premorbid, prodromális, pszichotikus vagy akut fázisok, majd a felépülési vagy stabilizációs, végül a stabil fázis). A kórkép tünetei két fő kategóriába sorolhatók, a pozitív és negatív tünetcsoportba, de ezek mellett újabban a dezorganizált tünetcsoportot is körülírhatjuk. A betegség hosszú távú kimenetele nagyon változatos képet mutat. 10-15%-ban nem jelentkezik további epizód, de a többségnél többszöri exacerbációval és remisszióval kell számolni, és a betegek 10-15%-a krónikusan pszichotikus marad.
2.2. A finanszírozási eljárásrendet a hatályba lépését követően diagnosztizált és kezelésbe vont szkizofrén betegek antipszichotikus gyógyszeres kezelésére kell alkalmazni. Nem terjed ki az eljárásrend hatálya az ellátás során alkalmazott antiparkinson, anxiolitikus és egyéb gyógyszeres, valamint nem gyógyszeres kezelésekre, amely tekintetben az egyébként irányadó pszichiátriai szakmai ajánlások szerint szükséges eljárni.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritumusa
3.1. A szkizofrénia antipszichotikus gyógyszeres kezelésének finanszírozási algoritmusa
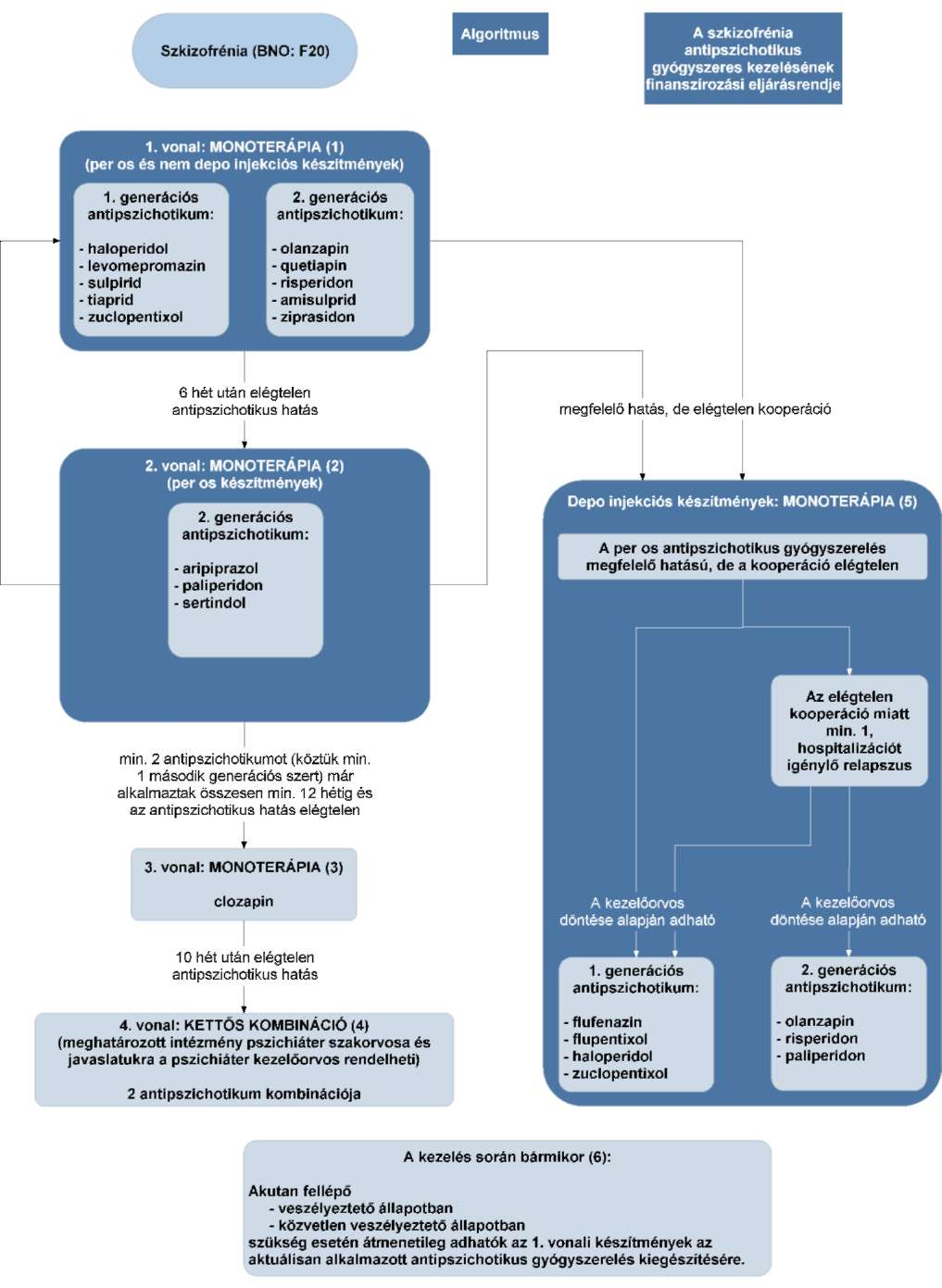
A finanszírozási algoritmus részletezése
3.1.1. (1) Az első vonalban támogatott - per os és nem depo injekciós - antipszichotikus készítmények. A lépcsőn belül több gyógyszer is alkalmazható, de a választott gyógyszert monoterápiában és legalább 2 hétig kell alkalmazni. Az (1) lépcsőt legalább 6 hétig folytatni kell.
3.1.2. (2) A második vonalban támogatott - per os - antipszichotikus készítmények. Akkor választhatók, ha az (1) szerint legalább 6 hétig folytatott kezelés ellenére az antipszichotikus hatás nem volt megfelelő. A lépcsőn belül több gyógyszer is alkalmazható, de a választott gyógyszert monoterápiában és legalább 2 hétig kell alkalmazni. A (2) lépcsőt legalább 6 hétig folytatni kell. A (2) pont szerinti kezelésről lehetőség van bármikor ismét az (1)-re lépni.
3.1.3. (3) A harmadik vonalban támogatott antipszichotikus készítmények. Akkor választhatók, ha legalább két különböző - köztük legalább egy második generációs - hatóanyagú antipszichotikus gyógyszerrel összesen legalább 12 hétig folytatott kezelés ellenére az antipszichotikus hatás nem volt megfelelő. A választott gyógyszert monoterápiában kell alkalmazni. A (3) lépcsőt legalább 10 hétig folytatni kell.
3.1.4. (4) A negyedik vonalban támogatott gyógyszeres kezelés: kettő antipszichotikum kombinációja. Akkor választható, ha a (3) pont szerint legalább 10 hétig folytatott kezelés ellenére az antipszichotikus hatás nem volt megfelelő. Az antipszichotikumok kettős kombinációban történő rendelésére kizárólag a II. vagy magasabb progresszivitási szintű pszichiátriai osztályok pszichiáter szakorvosai, valamint e szakorvosok javaslatára a kezelést végző pszichiáter szakorvosok jogosultak.
3.1.5. (5) A támogatott injekciós hosszú hatású depo készítmények. Ha az (1) szerint legalább 6 hétig tartó vagy a (2) szerint legalább 6 hétig tartó kezelésre megfelelő antipszichotikus hatás jelentkezik, de a beteg a per os kezeléssel nem kooperál megfelelően, a kezelőorvos döntése alapján választható első generációs depo készítmény. Amennyiben a nem megfelelő kooperáció miatt legalább 1, hospitalizációt igénylő relapszus következett be, úgy a kezelőorvos döntése alapján választható első vagy második generációs depo készítmény. Második generációs depo készítmény választásának további feltétele, hogy a beteg az azonos hatóanyagú per os készítménnyel végzett kezelés alatt álljon és az antipszichotikus hatás megfelelő legyen. A választott depo készítményt monoterápiában kell alkalmazni. Amennyiben második generációs depo készítménnyel történő kezelés megkezdését követő 3 éven belül - a választott készítmény alkalmazása mellett -2, hospitalizációt igénylő relapszus következett be, úgy ezen készítmény tovább nem alkalmazható.
3.1.6. (6) Amennyiben a kezelés során bármikor akutan kialakuló veszélyeztető vagy közvetlen veszélyeztető állapot jelentkezik, úgy - legfeljebb ezen állapot időtartamáig - szükség esetén átmenetileg adhatók az (1) lépcső szerinti első vonalbeli készítmények az aktuálisan alkalmazott antipszichotikus gyógyszeres kezelés kiegészítésére.
3.2. Amennyiben az alkalmazott hatóanyagú készítmény kontraindikált, vagy az alkalmazási előírás szerinti dózisban vele szemben intolerancia (tolerálhatatlan mellékhatás) lép fel, akkor azt úgy lehet tekinteni, mintha az adott terápiás lépcsőn belül az érintett hatóanyaggal az előírt ideig megfelelő dózisban folytatott terápia - a megfelelő eredmény nélkül - megtörtént volna. Ez kizárólag az adott hatóanyaggal végzett kezelés alól mentesít, az érintett terápiás lépcsőt - ha az adott lépcsőben van további hatóanyag - a fenti szabályok szerint teljesíteni kell.
3.3. Adott terápiás lépcsőről - az orvosszakmai szabályok betartása mellett - bármikor vissza lehet lépni bármelyik korábbi lépcsőre.
3.4. Gyógyszerbeállítás, gyógyszerváltás:
3.4.1. A gyógyszerbeállítás vagy gyógyszerváltás során a beállítás vagy váltás részeként - az orvosszakmai szabályok betartása mellett - átmenetileg szükség lehet két antipszichotikum egyidejű adására. A két készítmény egyidejű adásának időtartama nem haladhatja meg a 8 hetet. A beállítás vagy váltás legfeljebb 8 hetes időszaka - az orvosszakmai szabályok betartása esetén - nem minősül kombinált antipszichotikus terápiának.
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket. A legfontosabb ellenőrzési sarokpontok a következők:
4.1.1. Az antipszichotikumot monoterápiában alkalmazták-e?
4.1.2. Több antipszichotikum egyidejű alkalmazása esetén indokolt volt-e azok kombinálása?
4.1.3. Terápiás lépcső váltása esetén fennálltak-e a váltás feltételei?
4.1.4. Depo injekciós készítmény alkalmazása esetén teljesültek-e az ehhez szükséges feltételek?
4.2. Természetesen - figyelemmel az aktuális ellenőrzés prioritásaira - az említett szempontokon kívül további szempontok vizsgálatára is kiterjedhet az ellenőrzés. A dokumentáció vizsgálata az ellenőrzés részét képezi. A finanszírozási feltételek betartása, a sarokpontok megvalósulása részben informatikai úton, részben helyszíni ellenőrzés során ellenőrizhető.
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. Azon betegek arányának alakulása, akiknél monoterápiában alkalmaznak antipszichotikumot.
5.2. A kiváltott antipszichotikus, antiparkinson és anxiolitikus gyógyszerek mennyiségének és a rájuk kifizetett TB-támogatás összegének alakulása.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | F20 | Szkizofrénia |
6.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 12070 | Standard EEG |
| 3 | 12601 | EKG végtag és mellkaselvezetéssel |
| 4 | 19200 | Pszichiátriai/klinikai pszichológiai exploráció |
| 5 | 19201 | Pszichiátriai/pszichológiai diagnosztikus interjú |
| 6 | 19203 | Pszichiátriai/pszichológiai heteroanamnézis |
| 7 | 19204 | Pszichodiagnosztikai elemző exploráció |
| 8 | 19205 | Pszichodiagnosztikai exploráció teszt előtt |
| 9 | 19211 | Neuropszichológiai diagnosztika |
| 10 | 1930D | Pszichiátriai keresztmetszeti status |
| 11 | 1930E | Pszichiátriai hosszmetszeti kép |
| 12 | 1930F | Pszichodinamikai elemzés |
| 13 | 19322 | Rorschach projektív próba |
| 14 | 19326 | Személyiségvizsgálat, Szondi-féle kétprofilos |
| 15 | 19327 | Személyiségvizsgálat, Szondi-féle tízprofilos |
| 16 | 1932M | MMPI-teszt |
| 17 | 19352 | BPRS pszichiátriai állapotbecslő skála |
| 18 | 34410 | Agykoponya natív CT vizsgálata |
| 19 | 34914 | Agykoponya natív MR vizsgálat |
| 20 | 96007 | Első pszichiátriai gondozói találkozás |
| 21 | 96008 | Pszichiátriai szakgondozói vizit |
| 22 | 96009 | Pszichiátriai szakápolói intervenció |
| 23 | 96011 | Pszichiátriai környezettanulmány |
| 24 | 96032 | Csoportos pszichiátriai foglalkozásterápia |
6.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 19M 826A | Pszichózisok 60 év alatt |
| 3 | 19M 826B | Pszichózisok 60 év felett |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | N04 | Antiparkinson szerek |
| 3 | N05A | Antipszichotikumok |
| 4 | N05AA02 | levomepromazin |
| 5 | N05AB02 | flufenazin |
| 6 | N05AD01 | haloperidol |
| 7 | N05AE03 | sertindol |
| 8 | N05AE04 | ziprasidone |
| 9 | N05AF01 | flupentixol |
| 10 | N05AF05 | zuclopenthixol |
| 11 | N05AH02 | clozapin |
| 12 | N05AH03 | olanzapin |
| 13 | N05AH04 | quetiapin |
| 14 | N05AL01 | sulpirid |
| 15 | N05AL03 | tiaprid |
| 16 | N05AL05 | amisulprid |
| 17 | N05AX08 | risperidon |
| 18 | N05AX12 | aripiprazol |
| 19 | N05AX13 | paliperidon |
| 20 | N05B | Anxiolitikumok |
7. Fogalmak, rövidítések
NICE: National Institute for Health and Clinical Excellence
OEP: Országos Egészségbiztosítási Pénztár
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy
NTK: Napi terápiás költség
DSM: Diagnostic and Statistical Manual of Mental Disorders
ECT: Elektrokonvulzív terápia
Hospitalizációt igénylő relapszus: a tünetek kiújulása vagy súlyosbodása olyan mértékű romlást okoz a beteg életvitelében és funkcióiban, hogy emiatt szükséges az aktív kórházi szakellátása."
34. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"31. melléklet a 31/2010. (V. 13.) EüM rendelethez
A sclerosis multiplex diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Sclerosis multiplex (BNO: G35H0)
2. A kórkép leírása
2.1. A sclerosis multiplex (SM) a központi idegrendszer demielinizációval és axonális károsodással járó krónikus gyulladásos megbetegedése. A betegséget változatos, multifokális panaszok és tünetek jellemzik, amelyek típusosan a látóideg, az agytörzs, a kisagy és a gerincvelő károsodására utalnak. Előfordulása nőkben kb. kétszer gyakoribb, mint férfiakban. Általában 20 és 40 éves kor között - tehát az aktív életkorban - jelentkezik, 15 éves kor előtt és 50 éves kor után ritka. Klinikailag két alapvető formája definiálható:
2.1.1. visszaeső-javuló (relapszáló-remittáló) forma, amely az esetek jelentős részében másodlagos progrediáló formába megy át,
2.1.2. primer progresszív forma.
2.2. A kórkép az esetek jelentős részében hosszú távon a funkcionalitás nagyfokú csökkenésével társul. A sclerosis multiplex kóreredete multifaktoriális, a patomechanizmusában genetikai és környezeti tényezők együttes szerepét tételezik fel, azonban a pontos etiológiai háttér jelenleg tisztázatlan.
2.3. A jelen finanszírozási protokoll hatálya a sclerosis multiplex (beleértve a relapszusokat is) diagnosztikájára, valamint progressziójának/aktivitásának csökkentését és a relapszusok ellátását célzó gyógyszeres kezelésére terjed ki. Nem terjed ki a protokoll hatálya az ellátás során alkalmazott egyéb kezelésekre, amely tekintetben az egyébként irányadó neurológiai szakmai ajánlások szerint szükséges eljárni.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
3.1. A sclerosis multiplex diagnosztikája
3.1.1. Anamnézis és klinikai tünetek
3.1.2. Kötelező vizsgálatok:
3.1.2.1. Fizikális vizsgálat:
3.1.2.1.1. neurológiai vizsgálat (visus is)
3.1.2.1.2. belgyógyászati vizsgálat
3.1.2.2. Kontrasztanyagos koponya MR-vizsgálat
3.1.3. Kiegészítő vizsgálatok
3.1.3.1. Gerinc és n. opticus MR-vizsgálat
3.1.3.2. Likvor immunológiai vizsgálata
3.1.3.3. VEP
3.1.3.4. Szemészeti vizsgálat
3.1.4. A betegség időbeli és térbeli terjedésének igazolása klinikai vagy képalkotó (MR) vizsgálattal
3.2. A sclerosis multiplex McDonald-kritériumok szerinti diagnosztikájának algoritmusa
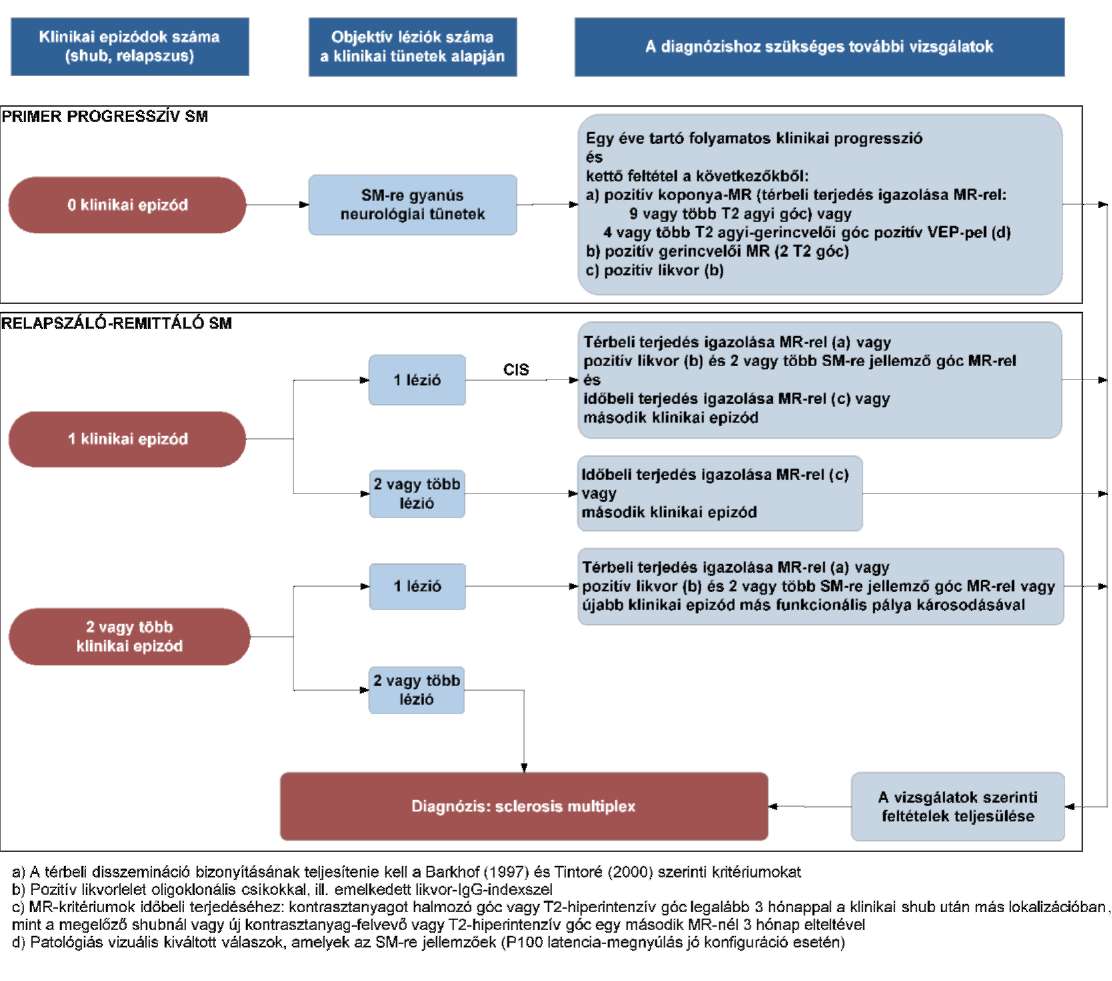
3.3. Sclerosis multiplexben az akut relapszus diagnosztikájának és gyógyszeres kezelésének algoritmusa
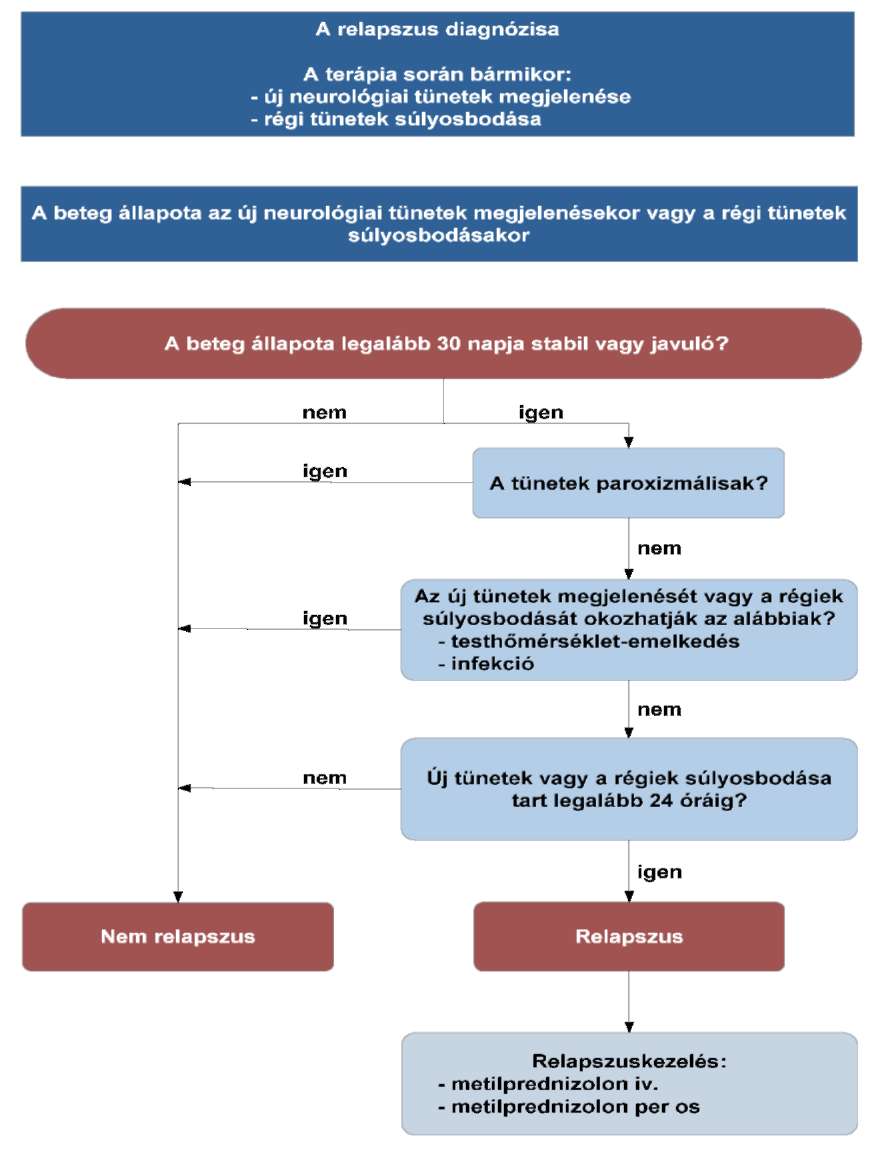
3.4. A sclerosis multiplex progressziójának/aktivitásának csökkentését célzó gyógyszeres kezelés algoritmusa
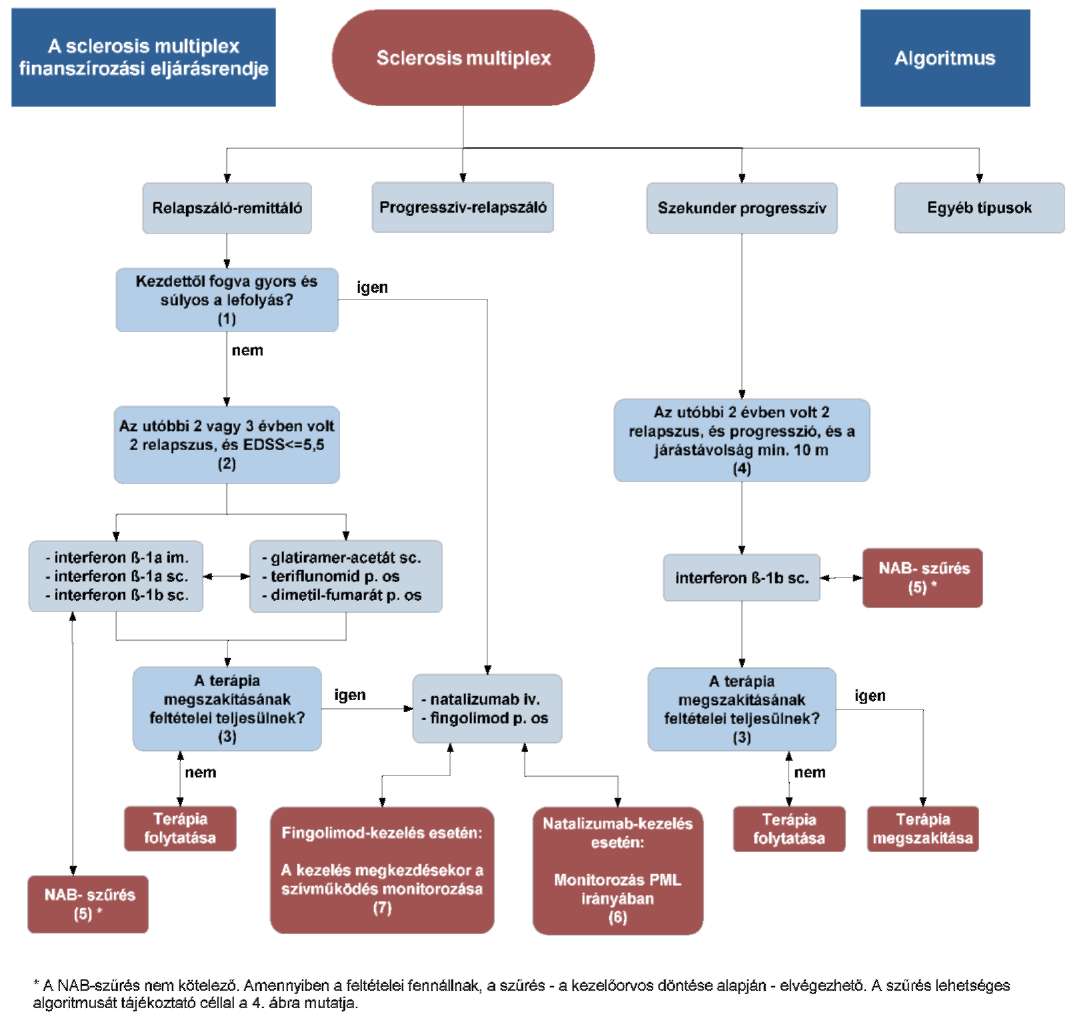
3.5. A finanszírozási algoritmus részletezése
3.5.1. (1) Relapszáló-remittáló SM-ben kezdettől fogva gyors és súlyos a betegség lefolyása, ha az alábbi feltételek teljesülnek:
3.5.1.1. 2 vagy több funkcióvesztést okozó relapszus fordult elő egy év alatt.
3.5.1.2. Friss MR-felvételen 1-nél több Gd-dúsulással járó lézió vagy megnövekedett T2-góctérfogat észlelhető.
3.5.2. (2) Relapszáló-remittáló SM-ben interferon-β, glatiramer-acetát, teriflunomid vagy dimetil-fumarát alkalmazásának feltételei:
3.5.2.1. A gyógyszer alkalmazási előírása szerint az utóbbi 2 vagy 3 éven belül legalább 2 jelentős klinikai relapszus volt.
3.5.2.2. A beteg állapota a Kiterjesztett Rokkantsági Állapot Skála szerint legfeljebb 5,5 (EDSS ≤ 5,5, a járástávolság segítség nélkül legalább 100 m).
3.5.3. (3) Relapszáló-remittáló SM-ben az interferon-β- vagy glatiramer-acetát-kezelés megszakításának feltételeit a 3.8. ábra tartalmazza.
3.5.4. (4) Szekunder progresszív SM-ben interferon-β-1b alkalmazásának feltételei:
3.5.4.1. Az utóbbi 2 évben legalább 2, mozgáskorlátozottságot okozó relapszus volt.
3.5.4.2. A járástávolság legalább 10 m.
3.5.4.3. A neurológiai tünetek progressziója észlelhető.
3.5.5. (5) Interferon-β-kezelés során a neutralizáló ellenanyagok (NAB) szűrését - a kezelőorvos döntése alapján - el lehet végezni, amennyiben a szűrés feltételei adottak. A szűrés lehetséges algoritmusát a 3.6. ábra tartalmazza tájékoztató céllal.
3.5.6. (6) Natalizumab-kezelés során szükséges a betegek folyamatos monitorozása, és új neurológiai tünetek fellépésekor a progresszív multifokális leuko-enkefalopátia lehetőségét ki kell zárni. A PML iránti monitorozást a 3.7. ábra szerinti külön algoritmus írja le.
3.5.7. (7) Fingolimod-kezelés megkezdésekor az alkalmazási előírásban meghatározott módon kötelező az EKG, a vérnyomás és a pulzus monitorozása, valamint a további szükséges beavatkozások elvégzése.
3.6. A neutralizáló antitestek szűrésének tájékoztató célú algoritmusa sclerosis multiplexben az interferon-kezeléshez kapcsolódóan.
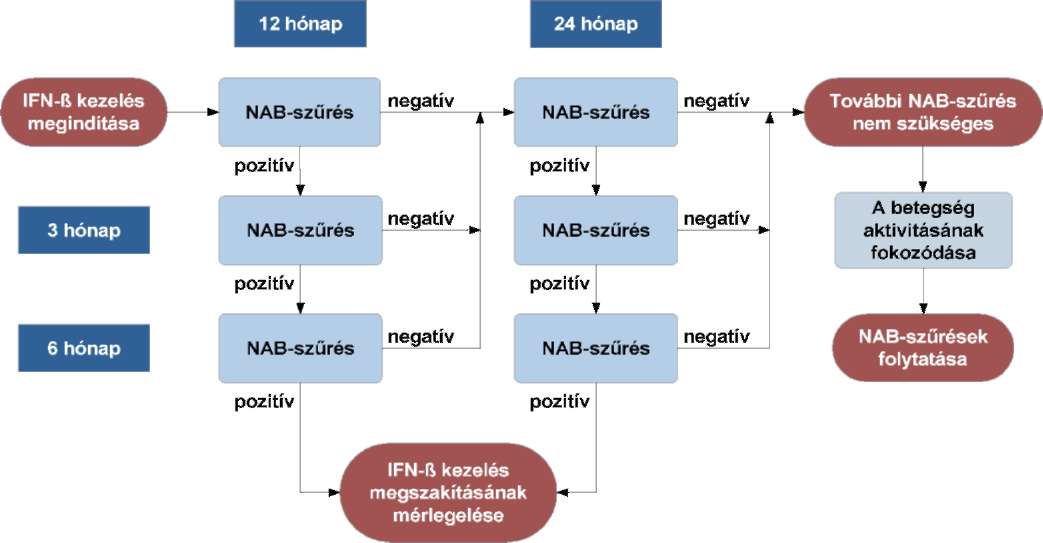
A 3.6. ábra a NAB-szűrés lehetséges algoritmusát mutatja.
3.7. A progresszív multifokális leuko-enkefalopátia irányában történő monitorozás algoritmusa sclerosis multiplexben a natalizumab-kezeléshez kapcsolódóan
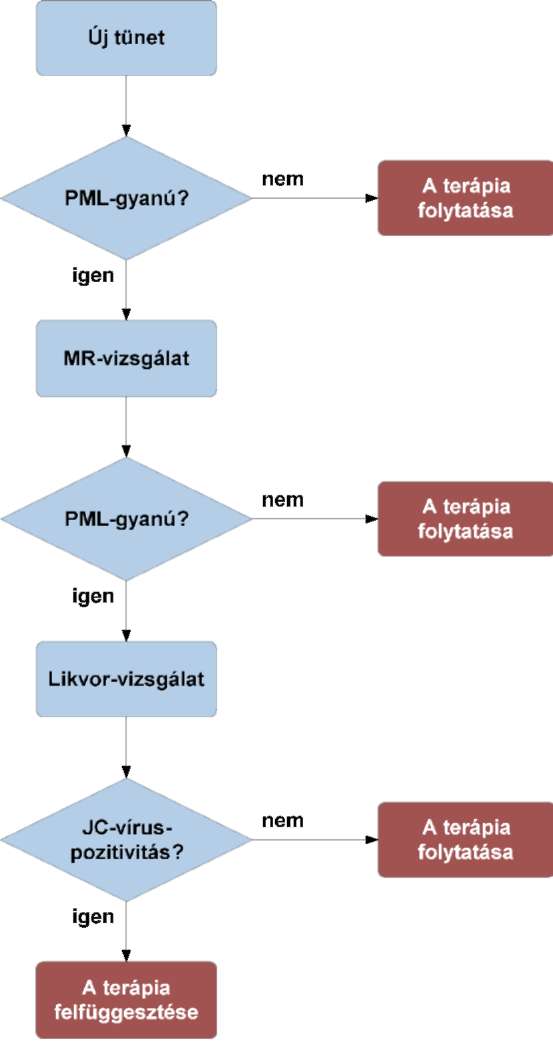
3.8. Az interferon-β- és a glatiramer-acetát-kezelés megszakítása
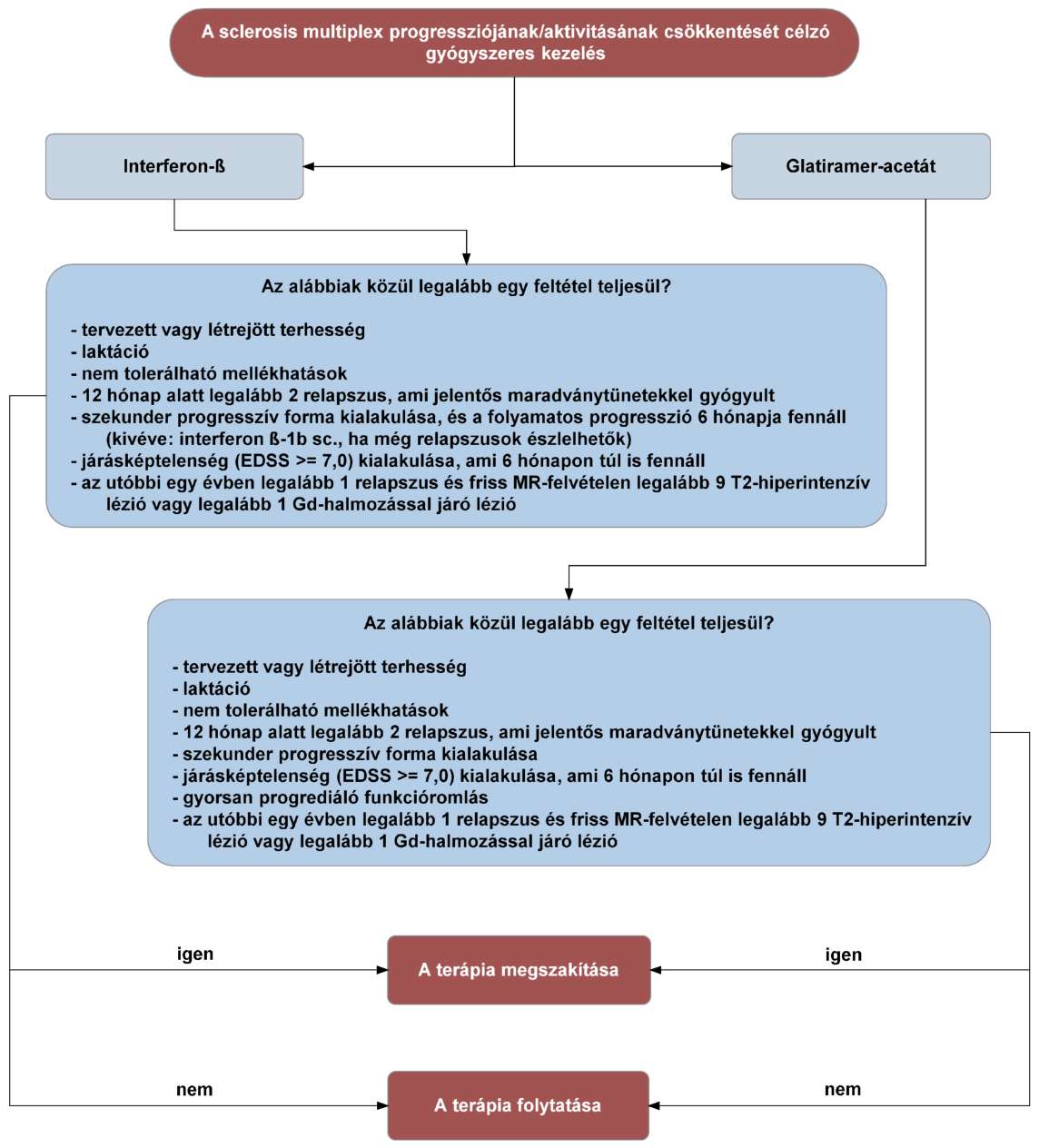
3.9. Az immunmoduláló kezelés megszakításának és módosításának további, általános - a kezelőorvos mérlegelési körébe tartozó - szempontjai:
3.9.1. Ha időarányosan legalább annyi shub jelentkezik a kezelés első 2 éves periódusa alatt, mint az immunmoduláló kezelés elindítása előtt, vagy egy év alatt egy súlyos relapszus lép fel, a felépülés részleges, vagy MR-felvételen Gd-halmozó vagy szaporodó T2-gócok észlelhetők (ilyen esetekben indokolt más kémiai szerkezetű immunmoduláló szerre váltás egyedi mérlegelés alapján).
3.9.2. Ha interferon-kezelés esetén elégtelen terápiás válasz emelkedett neutralizáló-antitest-titerrel párosul a szérumban (indokolt más kémiai szerkezetű immunmoduláló szerre váltás).
3.9.3. Ha az immunmoduláló kezelés alatt a beadás módjával összefüggő mellékhatás mutatkozik - és egyébként a kezelés hatásos -, indokolt lehet másik immunmoduláló szerre váltani.
3.9.4. Ha egyéb, nem tolerálható mellékhatás miatt szükséges megszakítani az adott béta-interferon-terápiát, másik béta-interferon-készítmény adása nem indokolt. Ilyen esetekben glatiramer-acetát, teriflunomid vagy dimetil-fumarát adása mérlegelhető. Glatiramer-acetát, teriflunomid vagy dimetil-fumarát kezelés során fellépő mellékhatás esetén interferonokra való átállás jöhet szóba.
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket. A legfontosabb ellenőrzési sarokpontok a következők:
4.1.1. Igazolható-e a sclerosis multiplex (BNO: G35H0) klinikailag határozott diagnózisa?
4.1.2. Teljesülnek-e az adott terápiás lépcső alkalmazásának feltételei progresszió-csökkentő kezelés esetén?
4.1.3. Teljesülnek-e az akut relapszus diagnosztikus kritériumai relapszuskezelő terápia esetén?
4.2. Természetesen - figyelemmel az aktuális ellenőrzés prioritásaira - az említett szempontokon kívül további szempontok vizsgálatára is kiterjedhet az ellenőrzés. A dokumentáció vizsgálata az ellenőrzés részét képezi. A finanszírozási feltételek betartása, a sarokpontok megvalósulása bizonyos mértékig informatikai úton, továbbá helyszíni ellenőrzés során ellenőrizhető.
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. Azon betegek arányának alakulása, akiknél a finanszírozási eljárásrend szerinti terápiás utak a kapcsolódó kritériumokkal együtt maradéktalanul megvalósulnak.
5.2. Az SM ellátására fordított finanszírozási és ártámogatási összegek ellátási formák szerinti alakulása.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | G35H0 | Sclerosis multiplex |
6.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 12091 | Kiváltott válasz vizsgálatok (Retinographia, Visuális, Acusticus, Somatosensoros) |
| 3 | 12094 | Kiváltott potenciál térképezés |
| 4 | 21017 | Fehérjék identifikálása izoelektromos fókuszálással |
| 5 | 21041 | Albumin meghatározása szérumban, immunturbidimetriás, immunnefelometriás módszerrel |
| 6 | 22741 | Liquor összfehérje meghatározása |
| 7 | 22743 | Liquor albumin meghatározása |
| 8 | 22781 | Liquor sejtszám meghatározása |
| 9 | 25065 | Punktátum, liquor, genny tenyésztése, csak aerob |
| 10 | 26390 | Escherichia AG kimutatása liquorban |
| 11 | 26391 | Neisseria AG kimutatása liquorban |
| 12 | 26392 | Haemophilus AG kimutatása liquorban |
| 13 | 26780 | IgG meghatározása |
| 14 | 26792 | Fehérjék azonosítása immunelektroforézissel |
| 15 | 34914 | Agykoponya natív MR vizsgálat |
| 16 | 34915 | Agykoponya MR vizsgálat natív plusz iv. kontrasztanyag adását követőleg |
| 17 | 34924 | Gerinc MR vizsgálata natív gerinc |
| 18 | 34925 | Gerinc MRvizsgálata iv. kontrasztanyag adását követőleg |
| 19 | 34926 | Gerinc MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
6.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 01M 014A | Sclerosis multiplex komplex vizsgálattal |
| 3 | 01M 014B | Sclerosis multiplex speciális kivizsgálással |
| 4 | 01M 023B | Egyéb idegrendszeri és cerebrovascularis betegségek |
| 5 | 01M 060Z | Idegrendszer egyéb betegségei súlyos társult betegséggel |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | H02AB04 | metilprednizolon |
| 3 | L03AB07 | interferon béta-1a |
| 4 | L03AB08 | interferon béta-1b |
| 5 | L03AX13 | glatiramer-acetát |
| 6 | L04AA23 | natalizumab |
| 7 | L04AA27 | fingolimod |
| 8 | L04AA31 | teriflunomid |
| 9 | M03BX01 | baclofen |
| 10 | M03BX02 | tizanidin |
| 11 | M03BX04 | tolperison |
| 12 | L04AX01 | azatioprin |
| 13 | N04BB01 | amantadin |
| 14 | N07XX09 | dimetil-fumarát |
7. Rövidítések
NICE: National Institute for Health and Clinical Excellence
EFNS: European Federation of Neurological Societies
OEP: Országos Egészségbiztosítási Pénztár
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy
NTK: Napi terápiás költség
SM: Sclerosis multiplex
CDMS: Klinikailag definitív sclerosis multiplex
CIS: Klinikailag izolált szindróma
PML: Progresszív multifokális leuko-enkefalopátia
MR: Mágneses rezonancia
CT: Számítógépes rétegvizsgálat
VEP: Vizuális kiváltott válasz
EDSS: Expanded Disability Status Scale
OGP: Oligoklonális gammopátia
MBP: Myelin basic protein
BAB: Kötő antitest
NAB: Neutralizáló antitest
JCV: JC-vírus, John Cunningham vírus
ACTH: Adrenokortikotrop hormon
IFN: Interferon
iv.: Intravénás
im.: Intramuszkuláris
sc.: Szubkután"
35. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"32. melléklet a 31/2010. (V. 13.) EüM rendelethez
A sigma és colon daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések (C00-C97)
A sigma és a colon rosszindulatú daganatai (C18)
2. A kórkép leírása
Napjainkban a colorectalis daganatok (CRC) okozta halálozások száma nő. Évente mintegy 800 000 új megbetegedést diagnosztizálnak a fejlett országokban. Ez az összes diagnosztizált tumornak a 15%-át teszi ki.
Magyarországon évente nagyságrendileg 7000 új esetet ismernek fel, az éves halálozások száma 4000 fő. Így a CR daganatok a népesség halálozása szempontjából a második legveszélyesebb betegségcsoportnak tekinthetők. A mortalitás emelkedő tendenciát mutat. A betegség csak elvétve jelenik meg 40 éves életkor alatt, leggyakrabban az 60-70 éves korosztályban fordul elő.
A colorectalis daganatok kialakulásában főként környezeti, táplálkozási, genetikai, családi faktorok, valamint precancerosus állapotok játszanak szerepet. A colorectalis daganatok stádium beosztása során a következő TNM klasszifikációt (TNM 7. kiadás) alkalmazzuk:
2.1. Colorectalis daganatok TNM osztályozása
| A | B | |
| 1 | Mélységi terjedés | TNM- beosztás |
| 2 | Primer tumor nem ítélhető meg | Tx |
| 3 | Primer tumor nem mutatható ki | T0 |
| 4 | Carcinoma in situ: a lamina proprija intraepithelialis invasioja | Tis |
| 5 | A tumor infiltrálja a submucosát | T1 |
| 6 | A tumor infiltrálja a muscularis propriát | T2 |
| 7 | A tumor a muscularis propriát áttörve ráterjed a subserosára, vagy a nem peritonealizált pericolicus vagy perirectalis szövetkere | T3 |
| 8 | A tumor közvetlenül betör más szervekbe, szövetekbe, illetve perforálja a zsigeri peritoneumot | T4 |
| 9 | A tumor perforálja a zsigeri peritoneumot | T4a |
| 10 | A tumor közvetlenül betör más szervekbe, szövetekbe | T4b |
| 11 | Regionális nyirokcsomó nem ítélhető meg | Nx |
| 12 | Regionális nyirokcsomó nem mutatható ki | N0 |
| 13 | Regionális nyirokcsomó áttétek 1-3 nyirokcsomóban | N1 |
| 14 | Regionális nyirokcsomó áttét 1 nyirokcsomóban | N1a |
| 15 | Regionális nyirokcsomó áttétek 2-3 nyirokcsomóban | N1b |
| 16 | Tumor depozit(ok), például szateliták a subserosában vagy a nem peritonealizált pericolicus | N1c |
| A | B | |
| 1 | Mélységi terjedés | TNM- beosztás |
| vagy perirectalis szövetekben, regionális nyirokcsomó metasztázisok nélkül | ||
| 17 | Regionális nyirokcsomó áttétek 4 vagy több nyirokcsomóban | N2 |
| 18 | Regionális nyirokcsomó áttétek 4-6 nyirokcsomóban | N2a |
| 19 | Regionális nyirokcsomó áttétek 7 vagy annál több nyirokcsomóban | N2b |
| 20 | Távoli áttét nem mutatható ki | M0 |
| 21 | Távoli áttét | M1 |
| 22 | A metasztézis egy szervre lokalizálódik [máj, tüdő, petefészek, nem regionális nyirokcsomó(k)] | M1a |
| 23 | Áttét egynél több szervre vagy a peritoneumora lokalizálódik | M1b |
2.2. Colorectalis daganatok stádiumbeosztása
| A | B | C | D | E | |
| 1 | TNM státusz | Primer tumor | Nyirokcsomó érintettség | Távoli metasztázis | Módosított Astler- Coller |
| 2 | Stádium 0. | Tis | N0 | M0 | |
| 3 | Stádium I. | T1, T2 | N0 N0 | M0 M0 | A B1 |
| 4 | Stádium II. | T3, T4 | N0 | M0 | |
| 5 | Stádium II.A | T3 | N0 | M0 | B2 |
| 6 | Stádium II.B | T4a | N0 | M0 | B2 |
| 7 | Stádium II.C | T4b | N0 | M0 | B3 |
| 8 | Stádium III. | Bármilyen T | N1, N2 | M0 | |
| 9 | Stádium III.A | T1, T2 T1 | N1 N2a | M0 M0 | C1 C1 |
| 10 | Stádium III.B | T3, T4a T2, T3 T1, T2 | N1 N2a N2b | M0 M0 M0 | C2 C1/C2 C1 |
| 11 | Stádium III.C | T4a T3, T4a T4b | N2a N2b N1, N2 | M0 M0 M0 | C1 C2 C3 |
| 12 | Stádium IV.A | Bármilyen T | Bármilyen N | M1a | |
| 13 | Stádium IV.B | Bármilyen T | Bármilyen N | M1b |
3. Finanszírozás rendje, finanszírozási algoritmusa
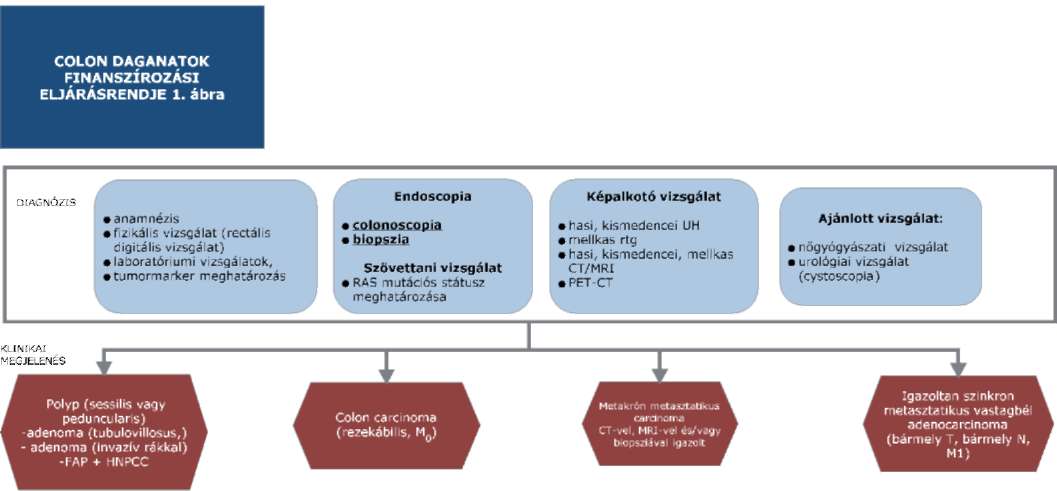
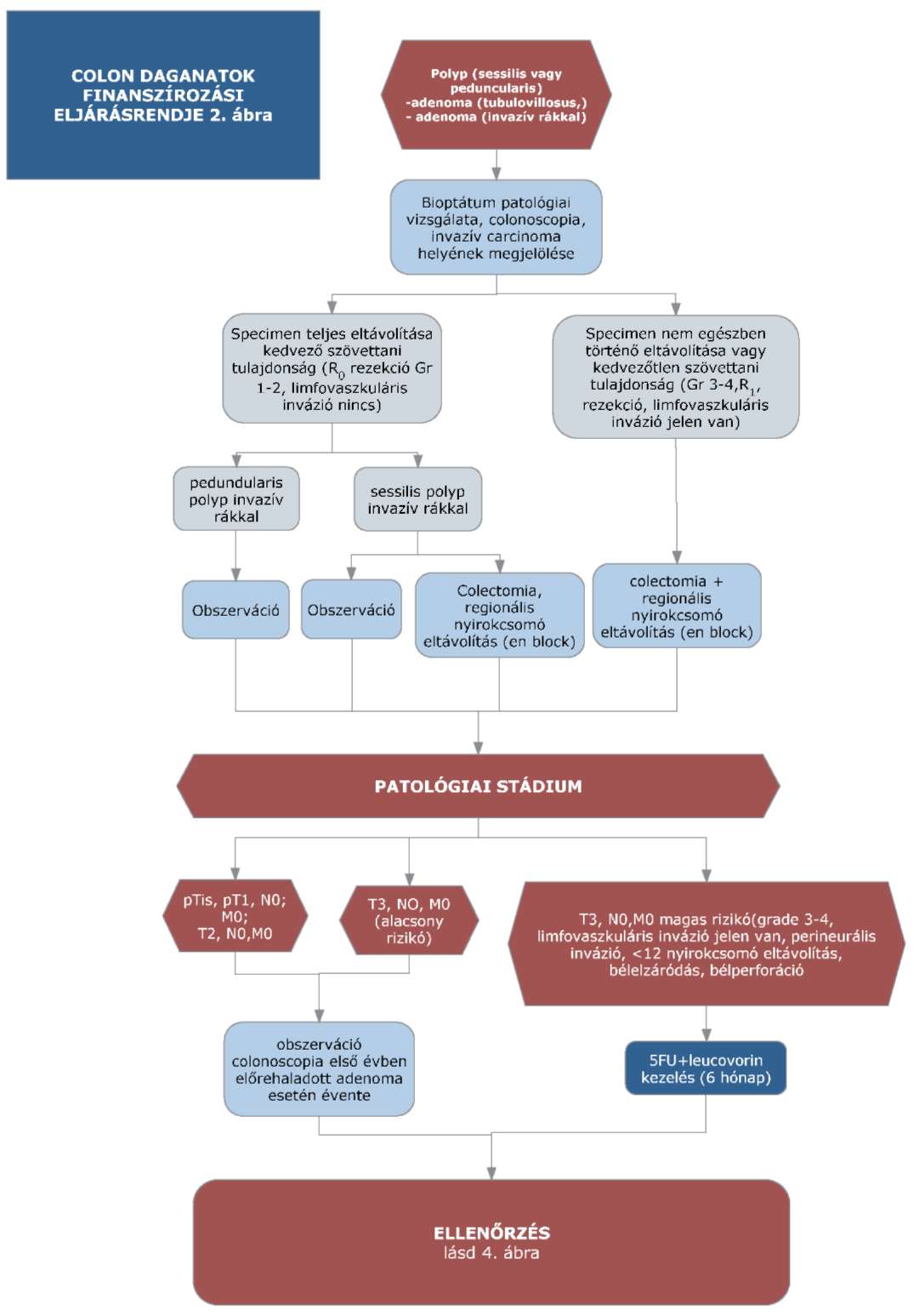
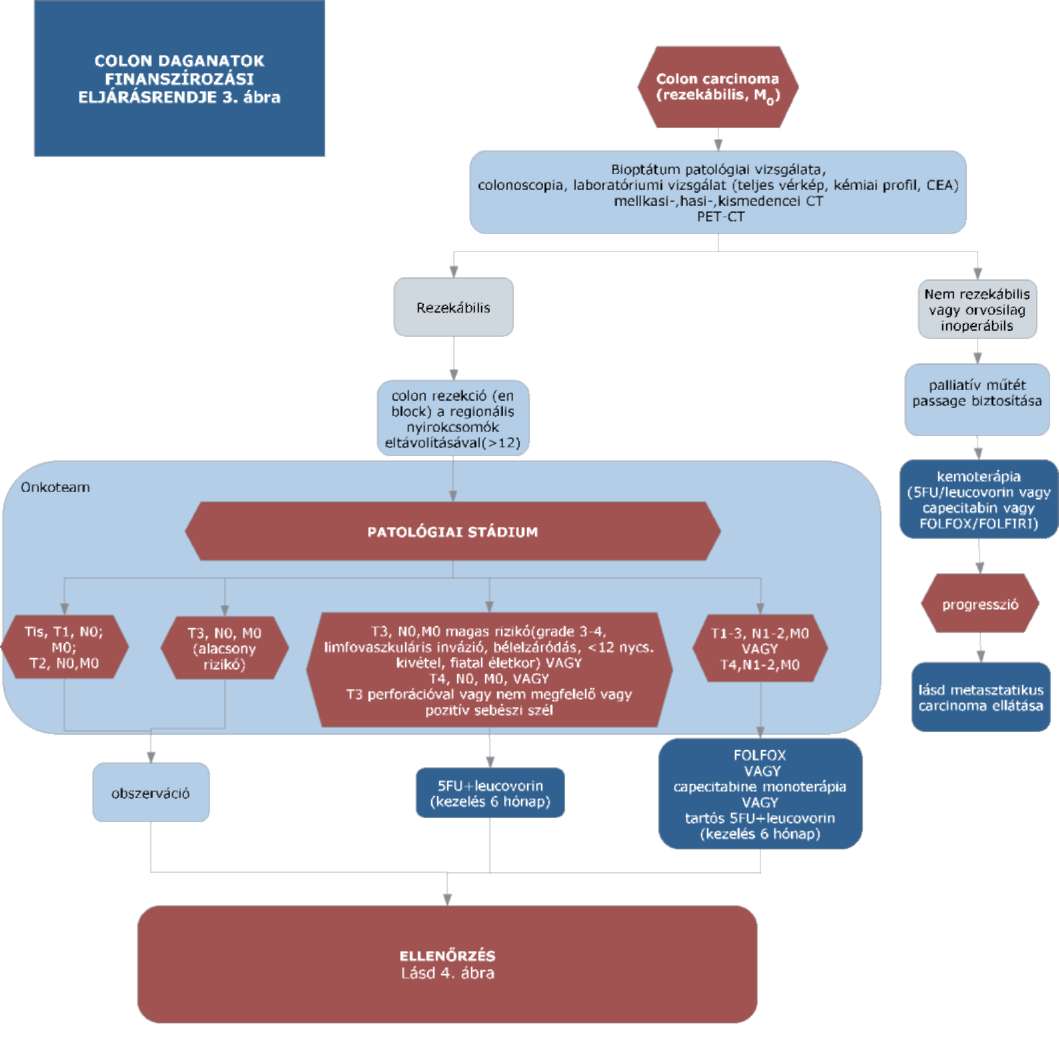
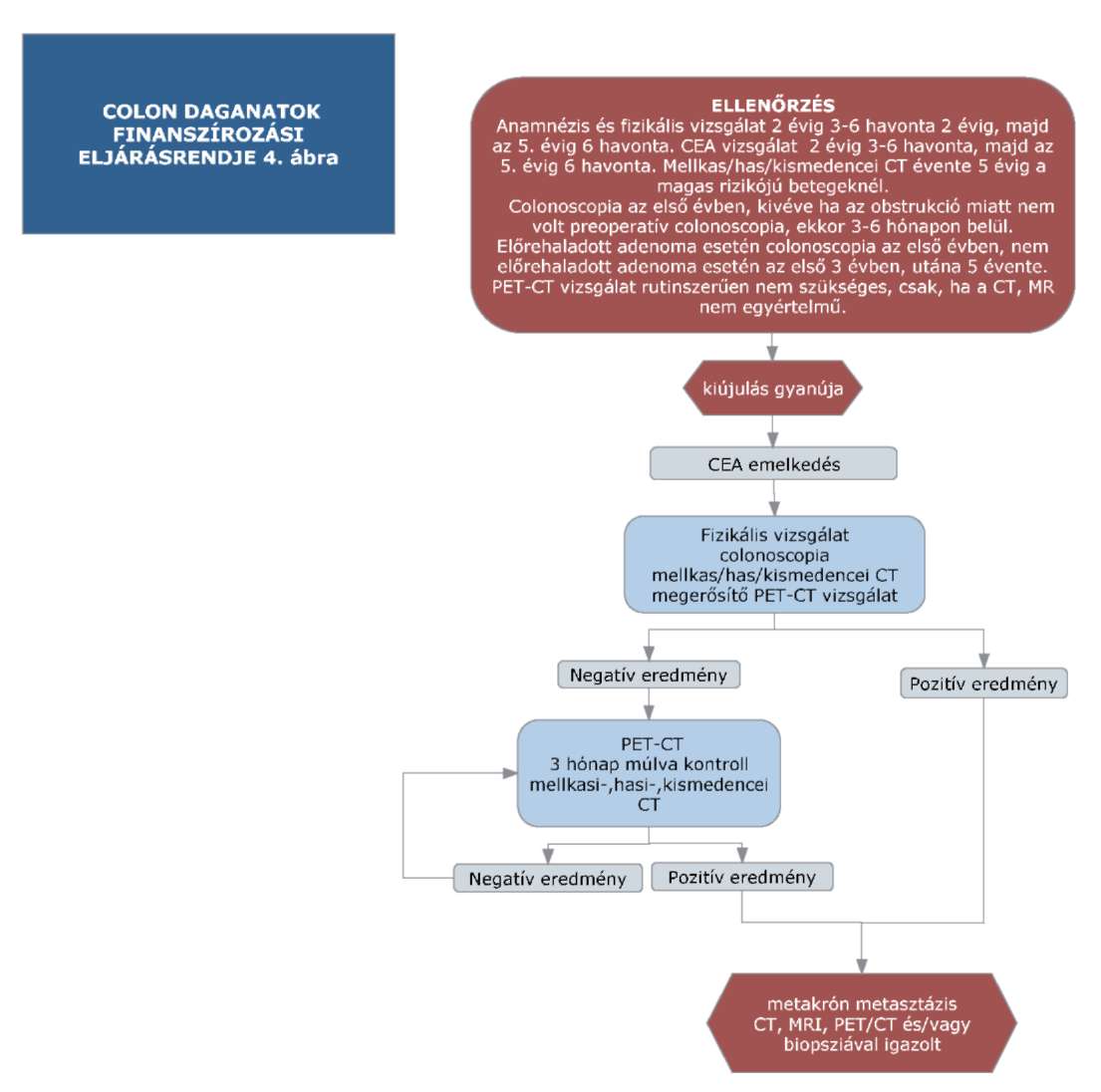
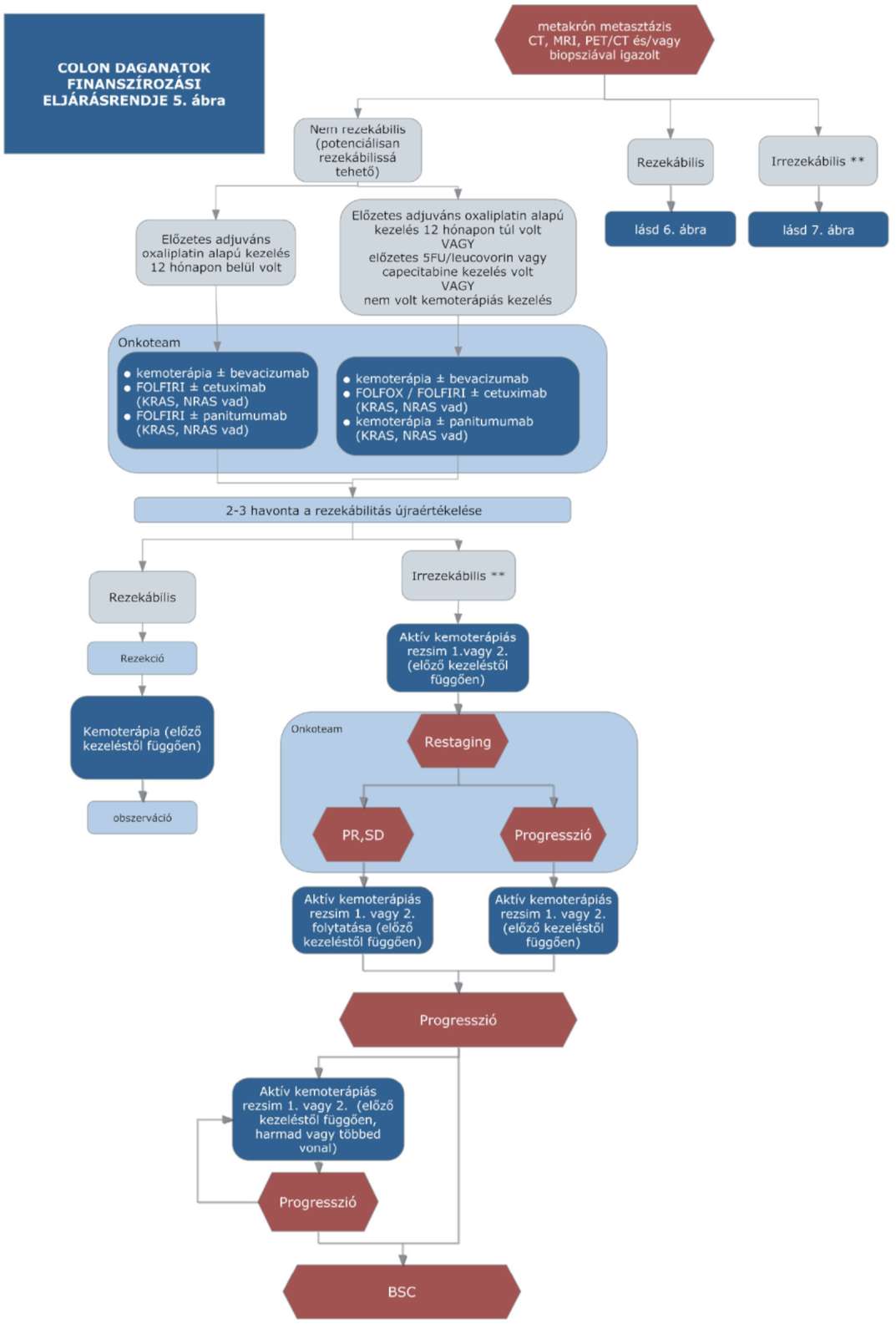
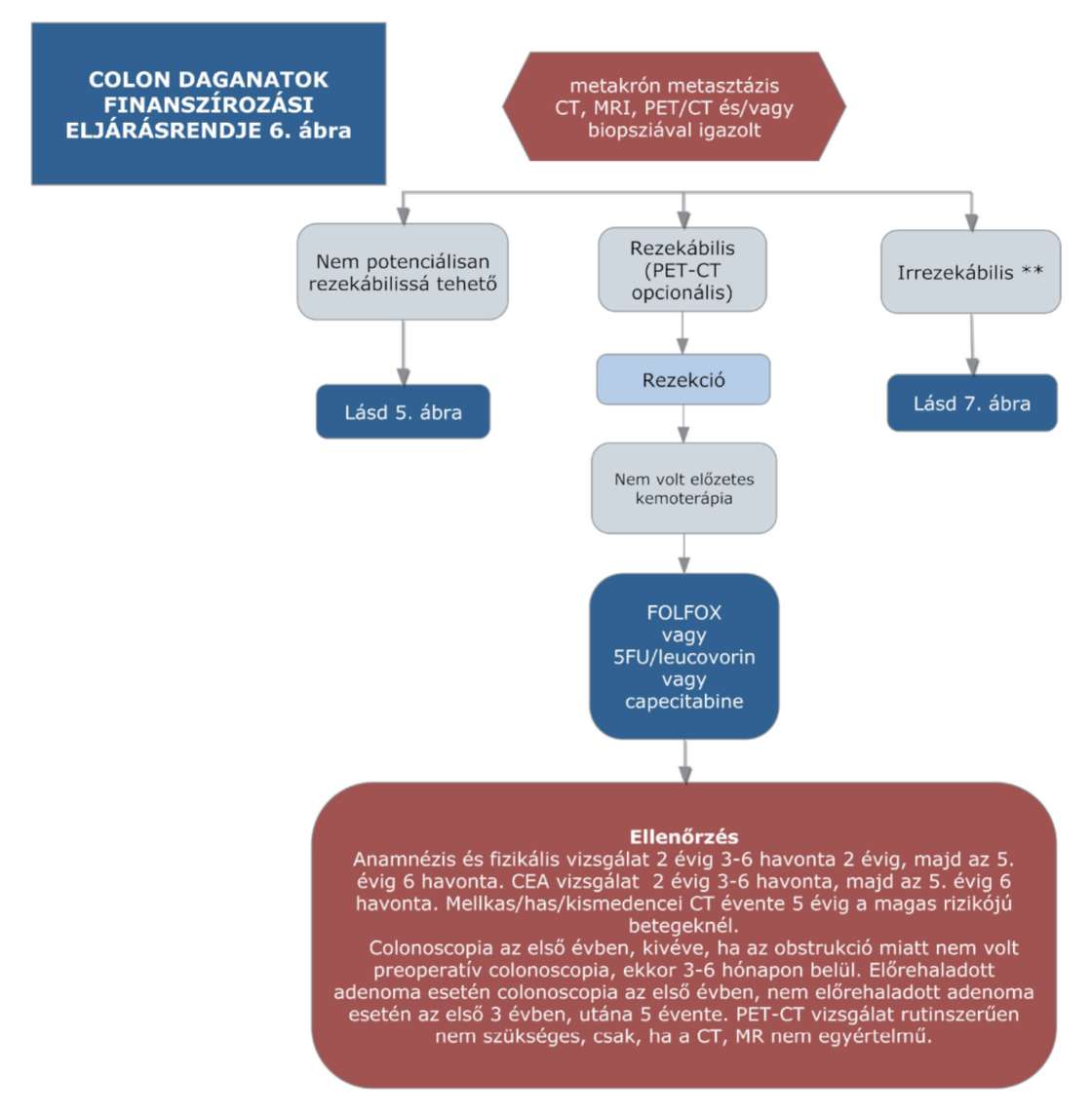
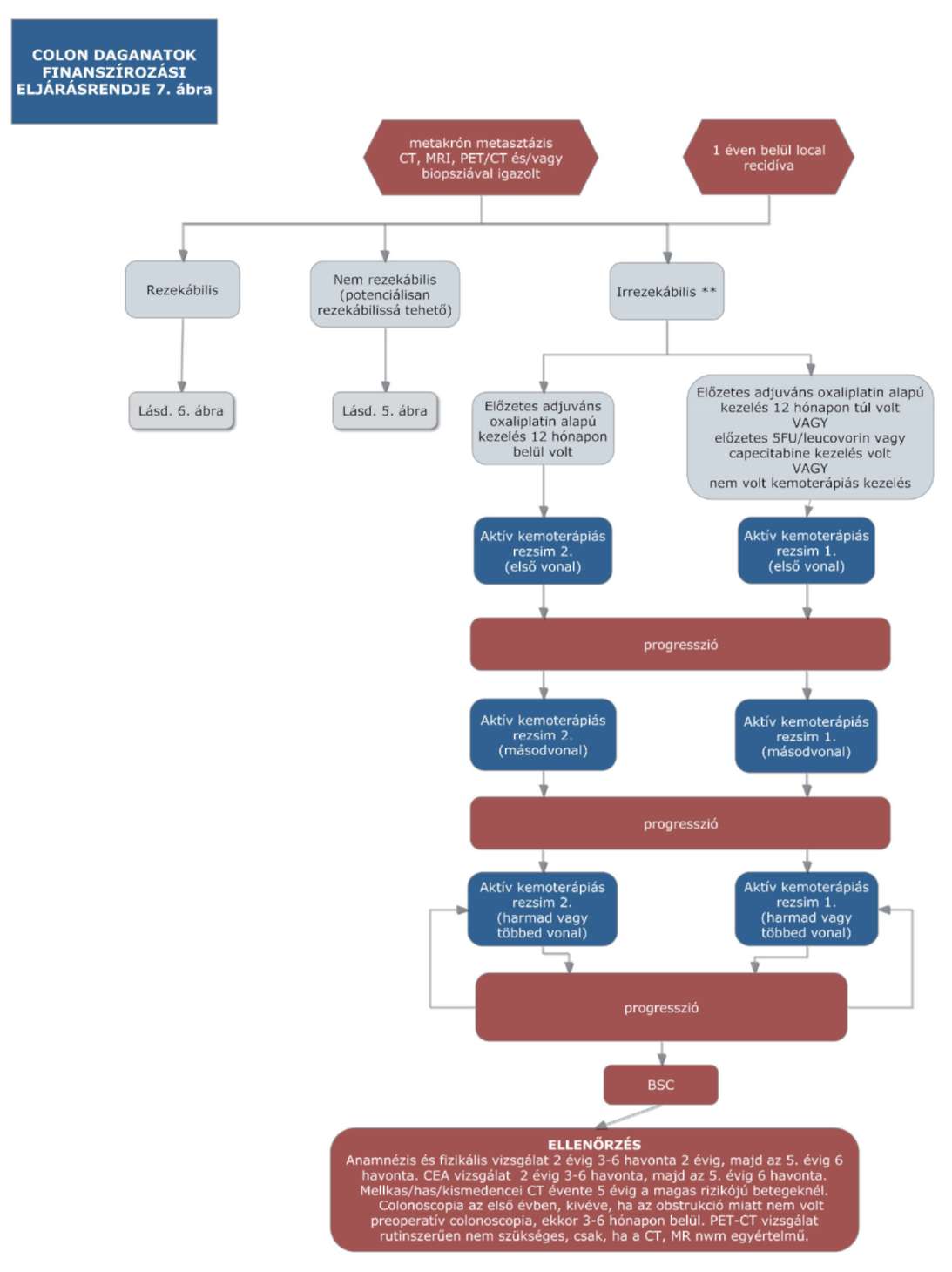
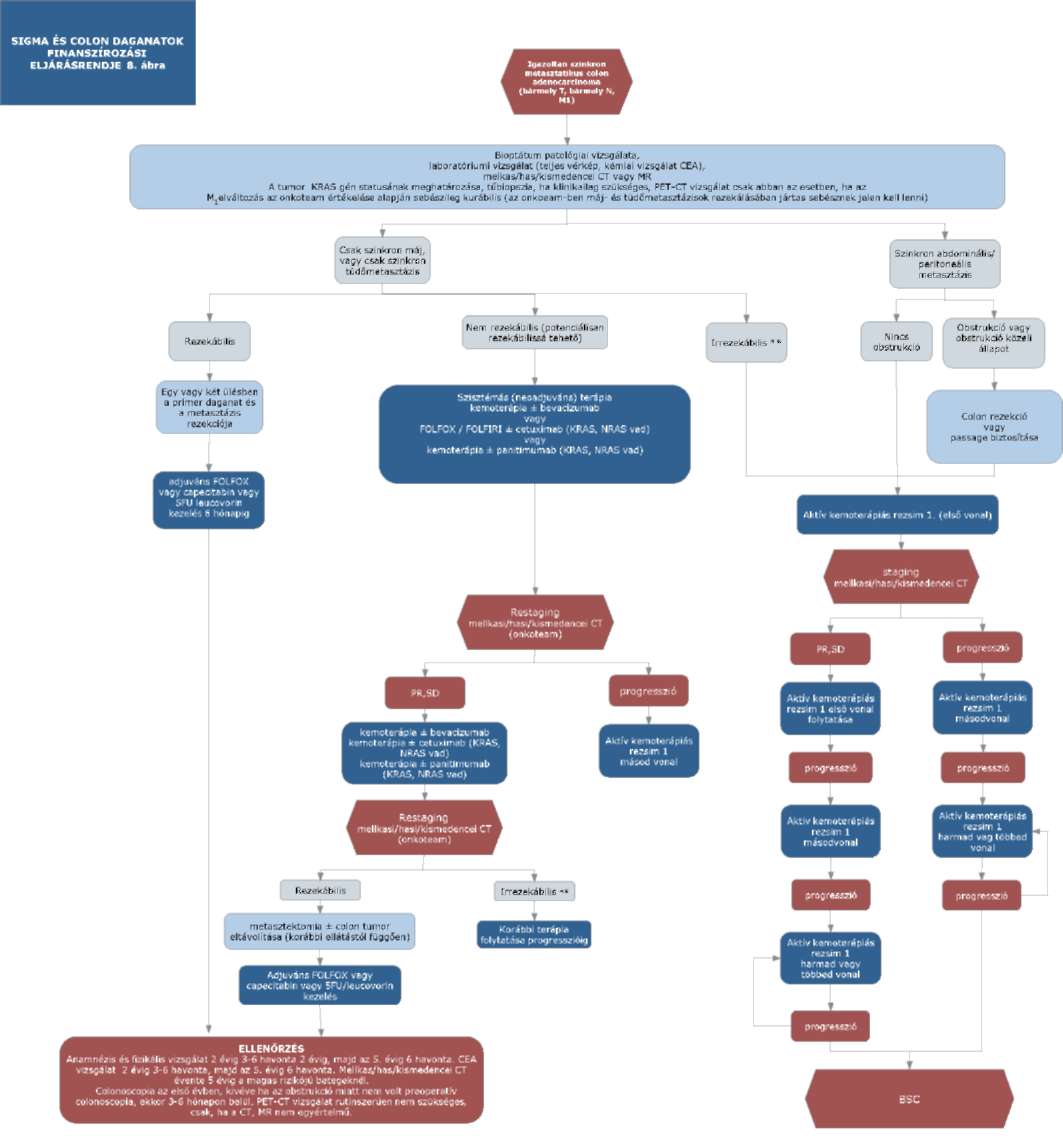

3.1. Megjegyzések:
* A biológiai terápiák harmad vonalban alkalmazhatók, de negyed és többed vonalban nem.
** Intraarterialis kemoterápia, radiofrekvenciás abláció, szóba jöhet a szakmai irányelvek, illetve az orvosi gyakorlat szabályai szerint.
Biológiai terápia alkalmazása során 100 napon belül staging (CT, laboratóriumi, tumor marker vizsgálat) elvégzése szükséges.
Az "Aktív kemoterápiás rezsim" korábbi vonalában adott kezelésének hatástalansága esetén a későbbi vonalban az adott kezelés nem alkalmazható. Egy adott kezelés intoleranciája nem jelent vonalbeli váltást.
A bevacizumab monoterápia a törzskönyvi indikáció alapján nem engedélyezett, tehát off-label kezelés.
3.2. A colorectalis daganatok utánkövetése a következő időpontokban esedékes
3.2.1. A colorectalis daganatok gondozása
| Hónap | ||||||||||||||
| 3. | 6. | 9. | 12. | 15. | 18. | 21. | 24. | 30. | 36. | 42. | 48. | 54. | 60. | |
| Anamnézis | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Fizikális vizsgálat | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Laborvizsgálat (CEA, CA-50, CA19- 9y; GT, széklet, vér) | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| Mellkas-röntgen vizsgálat (indokolt esetben CT és PET/CT) | + | + | + | + | + | + | + | + | + | + | ||||
| Hasi kismedencei UH és CT/MR (indokolt eseteben PET-CT) | + | + | + | + | + | + | + | + | + | + | ||||
| Endoszkópia, virtuális colonoscopia (esetleg irrigoszkópia) | + | + | + | + | + | |||||||||
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. A diagnózis kritériumainak rögzítése (BNO: C1800; C1810; C1820; C1830; C1840; C1850; C1860; C1870; C 1880; C1890)
4.2.1. A diagnózis klinikai szempontrendszer szerint megy végbe.
4.2.2. A beteg vizsgálata, ellenőrzése és a terápia követése rendszeres időközönként történik.
4.3. Gyógyszeres kezelés
4.3.1. Bevacizumab a jogszabálynak megfelelő indikációban és kombinációban alkalmazandó.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére az egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettség esetén azon betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.3. pont szerint folytatható az ellátás az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének 8/e2.3. pontja szerint.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis metasztatikus colorectalis carcinoma első-, másod- vagy harmadvonalú kezelésére a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján, azon betegek részére, akiknél a megkezdett terápia 8. hét után elvégzett képalkotó eljárással dokumentált módon hatásosnak bizonyult, a daganat összes tömege nem növekedett a terápia megkezdése óta. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. A kezelés a betegség progressziójáig folytatható. Amennyiben a kezelés hatására két egymást követő képalkotó diagnosztikai kontroll során komplett klinikai remisszió igazolódik, a kezelést fel kell függeszteni. Abban az esetben, ha a betegség a kezelés felfüggesztését követően újra progrediál, bevacizumab ismételten alkalmazható az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e3.3. pontja szerint.
4.3.2. Cetuximab a jogszabálynak megfelelő indikációban és kombinációban alkalmazandó.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperálibilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kezelésére, FOLFOX vagy FOLFIRI kemoterápiával kombinálva, azon egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettséggel rendelkező betegeknél, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.1. pont szerint folytatható az ellátás az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e2.1. pontja szerint.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperabilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma első-, másod- vagy harmadvonalú kezelésére a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján, azon betegek részére, akiknél a megkezdett terápia 8. hét után elvégzett képalkotó eljárással dokumentált módon hatásosnak bizonyult, a daganat összes tömege nem növekedett a terápia megkezdése óta. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. A kezelés progresszióig folytatható. Amennyiben a kezelés hatására két egymást követő képalkotó diagnosztikai kontroll során komplett klinikai remisszió igazolódik, a kezelést fel kell függeszteni. Abban az esetben, ha a betegség a kezelés felfüggesztését követően újra progrediál, cetuximab ismét alkalmazható az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e3.1. pontja szerint.
4.3.3. Panitumumab a jogszabálynak megfelelő indikációban és kombinációban alkalmazandó.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére azon egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettséggel rendelkező betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e.3.2. pont szerint folytatható az ellátás az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e2.2. pontja szerint.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma első-, másod- vagy harmadvonalú kezelésére a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján, azon betegek részére, akiknél a megkezdett terápia 8. hét után elvégzett képalkotó eljárással dokumentált módon hatásosnak bizonyult, a daganat összes tömege nem növekedett a terápia megkezdése óta. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. A kezelés progresszióig folytatható, illetve amennyiben a kezelés hatására két egymást követő képalkotó diagnosztikai kontroll során komplett klinikai remisszió igazolódik, a kezelést fel kell függeszteni. Abban az esetben, ha a betegség a kezelés felfüggesztését követően újra progrediál, panitumumab ismét alkalmazható az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e3.2. pontja szerint.
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
5.3. Egészségnyereségre gyakorolt hatás.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | C1800 | Vakbél rosszindulatú daganata |
| 3 | C1810 | Féregnyúlvány rosszindulatú daganata |
| 4 | C1820 | Colon ascendens rosszindulatú daganata |
| 5 | C1830 | Flexura hepatica rosszindulatú daganata |
| 6 | C1840 | Colon transversum rosszindulatú daganata |
| 7 | C1850 | Flexura lienalis rosszindulatú daganata |
| 8 | C1860 | Colon descendens rosszindulatú daganata |
| 9 | C1870 | Colon sigmoideum rosszindulatú daganata |
| 10 | C1880 | A vastagbél átfedő elváltozása, rosszindulatú daganata |
| 11 | C1890 | Vastagbél rosszindulatú daganata k. m. n. |
6.2. Releváns OENO kódok (diagnosztika)
| A | B | |
| 1 | OENO | OENO Megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 88460 | Vérvétel |
| 4 | 26620 | Carcino-embrionális antigén (CEA) meghatározása |
| 5 | 16431 | Rectum és sigma endoscopos ultrahang vizsgálata |
| 6 | 16410 | Colonoscopia |
| 7 | 1641D | Colon endoszkópos UH vizsgálata |
| 8 | 1641E | Colonoscopia et colonographia |
| 9 | 32460 | Irrigoscopia |
| 10 | 32470 | Irrigoscopia kettős kontrasztanyaggal |
| 11 | 34450 | Teljes has CT vizsgálata natív |
| 12 | 34451 | Teljes has CT vizsgálata iv. kontrasztanyag adását követőleg |
| 13 | 34452 | Teljes has CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 14 | 36153 | Transrectalis UH vizsgálat |
| 15 | 35960 | Egésztest PET/CT vizsgálata |
6.3. Releváns OENO kódok (kemoterápia)
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 7019 | Kemoterápia, capecitabine monoterápia protokoll szerint |
| 3 | 7022 | Kemoterápia, 5FU protokoll szerint |
| 4 | 7023 | Kemoterápia, 5FU+FOLINAC hetenkénti nagy dózisú protokoll szerint |
| 5 | 7030 | Kemoterápia, EEP protokoll szerint |
| 6 | 7031 | Kemoterápia, ELF protokoll szerint |
| 7 | 7033 | Kemoterápia, FAM protokoll szerint |
| 8 | 7034 | Kemoterápia, FAMB protokoll szerint |
| 9 | 7035 | Kemoterápia, FAMTX protokoll szerint |
| 10 | 7037 | Kemoterápia, FEM/B protokoll szerint |
| 11 | 7044 | Kemoterápia, MAYO protokoll szerint |
| 12 | 7045 | Kemoterápia, DeGramont protokoll szerint |
| 13 | 7046 | Kemoterápia, irinotecan-DeGramont protokoll szerint |
| 14 | 7047 | Kemoterápia, irinotecan/A protokoll szerint |
| 15 | 7049 | Kemoterápia, raltitrexed/A protokoll szerint |
| 16 | 7063 | Kemoterápia, 5FU+FOLINAC protokoll szerint |
| 17 | 7064 | Kemoterápia, raltitrexed/B protokoll szerint |
| 18 | 7207 | Kemoterápia, módosított FAM protokoll szerint |
| 19 | 7268 | Kemoterápia, Bevacizumab+FOLFIRI protokoll szerint |
| 20 | 7270 | Kemoterápia, Bevacizumab+DeGramont protokoll szerint |
| 21 | 7271 | Kemoterápia, Cetuximab+FOLFIRI (telítő) protokoll szerint |
| 22 | 7272 | Kemoterápia, Cetuximab+FOLFIRI (fenntartó) protokoll szerint |
| 23 | 7273 | Kemoterápia, Cetuximab monoterápia protokoll szerint |
| 24 | 7275 | Kemoterápia, FOLFOX-4 protokoll szerint |
| 25 | 7449 | Kemoterápia, Cetuximab(2w)+FOLFIRI protokoll szerint |
| 26 | 7450 | Kemoterápia, panitumumab protokoll szerint |
| 27 | 7488 | Kemoterápia, CETUX+FOLFOX-6 (telítő) protokoll szerint |
| 28 | 7489 | Kemoterápia, CETUX+FOLFOX-6 (fenntartó) protokoll szerint |
| 29 | 7495 | Kemoterápia, PAN+FOLFOX-4 protokoll szerint |
| 30 | 7496 | Kemoterápia, PAN+FOLFIRI protokoll szerint |
| 31 | 7514 | Kemoterápia, bevacizumab+capecitabine protokoll szerint |
| 32 | 7515 | Kemoterápia, bevacizumab+FOLFOX4 protokoll szerint |
| 33 | 7517 | Kemoterápia, bevacizumab+XELOX protokoll szerint |
| 34 | 7518 | Kemoterápia, bevacizumab+XELIRI protokoll szerint |
| 35 | 7528 | Kemoterápia, XELOX protokoll szerint |
| 36 | 7529 | Kemoterápia, XELIRI protokoll szerint |
| 37 | 7542 | Kemoterápia, Bevacizumab+FOLFIRI/B protokoll szerint |
| 38 | 7543 | Kemoterápia, Bevacizumab+DeGramont/B protokoll szerint |
| 39 | 7544 | Kemoterápia, Bevacizumab+FOLFOX4/B protokoll szerint |
| 40 | 7574 | Kemoterápia, nagydózisú CIFU (5FU) protokoll szerint |
| 41 | 7578 | Kemoterápia, irinothecan 2 hetenkénti protokoll szerint |
| 42 | 7579 | Kemoterápia, MMC+nagydózisú 5FU protokoll szerint |
| 43 | 7586 | Kemoterápia, irinothecan 3 hetenkénti protokoll szerint |
| 44 | 7702 | Kemoterápia, EEP+dexrazoxane protokoll szerint |
| 45 | 7725 | Kemoterápia, FEM/C+dexrazoxane protokoll szerint |
| 46 | 7731 | Kemoterápia, FEM/B+dexrazoxane protokoll szerint |
| 47 | 7924 | Kemoterápia, 5FU heti nagydózisú protokoll szerint |
| 48 | 7926 | Kemoterápia, FEM/A protokoll szerint |
| 49 | 7927 | Kemoterápia, 5FU+FOLINAC hetenkénti kis dózisú protokoll szerint |
| 50 | 7928 | Kemoterápia, FEM/C protokoll szerint |
6.4. A releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 959A - 959 L | Rosszindulatú daganatok kemoterápiája |
| 3 | 287C | Emésztőszervi malignomák |
| 4 | 2750 | Vékony-, vastagbél nagyobb műtétei |
| 5 | 340Z | Gyomor, oesophagus, duodenum,vékony-, vastagbél műtétei (kivéve: oesophagus nagyobb műtétei) súlyos társult betegséggel |
| 6 | 337Z | Emésztőrendszeri betegségek (kivéve: oesophagitis, gastroenteritis, nem szövődményes fekélyek) súlyos társult betegséggel |
| 7 | 2880 | Tápcsatorna jóindulatú daganata és in situ carcinomái (kivéve: ajak, szájüreg, garat) |
6.5. A releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | L01* | Antineoplastic ágensek, különösen: |
| 3 | L01BC06 | capecitabin |
| 4 | L01XC06 | cetuximab |
| 5 | L01XC07 | bevacizumab |
| 6 | L01XC08 | panitumumab |
7. Fogalmak, rövidítések
ATC Anatomical Therapeutic Chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
BSC Best supportive care
CR Colorectalis
CRC Colorectalis carcinoma
CT Computer tomográfia
HBCS Homogén betegségcsoport
MR Mágneses rezonancia
NCCN National Comprehensive Cancer Network
OENO Orvosi eljárások nemzetközi osztályzása
OEP Országos Egészségbiztosítási Pénztár
PET-CT Pozitronemissziós tomográfia
TNM Tumor, node, metastasis (tumor, nyirokcsomó, metasztázis)
UH Ultrahang"
36. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"33. melléklet a 31/2010. (V. 13.) EüM rendelethez
A rectum daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések (C00-C97)
A rectum rosszindulatú daganatai C19, C20, C21
1.1. Az eljárásrend célja
Figyelembe véve a nemzetközi finanszírozási elveket, a hazai és nemzetközi szakmai irányelvek alapján összeállított finanszírozási eljárásrend szerint történő diagnosztikus és terápiás utak kijelölése, ellenőrzése.
A szűrés szerepe kiemelten fontos, különösen a magas rizikójú csoportokon belül (HNPCC, FAP, egyéb családi halmozódás), azonban a szekunder prevencióra vonatkozó ajánlások túlmutatnak jelen finanszírozási eljárásrend keretein.
2. A kórkép leírása
Napjainkban a colorectalis daganatok (CRC) okozta halálozások száma nő. Évente mintegy 800 000 új megbetegedést diagnosztizálnak a fejlett országokban. Ez az összes diagnosztizált tumornak a 15%-át teszi ki.
Magyarországon évente nagyságrendileg 7000 új esetet ismernek fel, az éves halálozások száma 4000 fő. Így a CR daganatok a népesség halálozása szempontjából a második legveszélyesebb betegségcsoportnak tekinthetők. A mortalitás emelkedő tendenciát mutat. A betegség csak elvétve jelenik meg 40 éves életkor alatt, leggyakrabban a 60-70 éves korosztályban fordul elő.
A colorectalis daganatok kialakulásában főként környezeti, táplálkozási, genetikai, családi faktorok, valamint precancerosus állapotok játszanak szerepet. A colorectalis daganatok stádium beosztása során a következő TNM klasszifikációt (TNM 7. kiadás) kell alkalmazni.
2.1. Colorectalis daganatok TNM osztályozása
| A | B |
| 1 | Mélységi terjedés | TNM- beosztás |
| 2 | Primer tumor nem ítélhető meg | Tx |
| 3 | Primer tumor nem mutatható ki | T0 |
| 4 | Carcinoma in situ: a lamina proprija intraepithelialis invasioja | Tis |
| 5 | A tumor infiltrálja a submucosát | T1 |
| 6 | A tumor infiltrálja a muscularis propriát | T2 |
| 7 | A tumor a muscularis propriát áttörve ráterjed a subserosára, vagy a nem peritonealizált pericolicus vagy perirectalis szövetkere | T3 |
| 8 | A tumor közvetlenül betör más szervekbe, szövetekbe, illetve perforálja a zsigeri peritoneumot | T4 |
| 9 | A tumor perforálja a zsigeri peritoneumot | T4a |
| 10 | A tumor közvetlenül betör más szervekbe, szövetekbe | T4b |
| 11 | Regionális nyirokcsomó nem ítélhető meg | Nx |
| 12 | Regionális nyirokcsomó nem mutatható ki | N0 |
| 13 | Regionális nyirokcsomó áttétek 1-3 nyirokcsomóban | N1 |
| 14 | Regionális nyirokcsomó áttét 1 nyirokcsomóban | N1a |
| 15 | Regionális nyirokcsomó áttétek 2-3 nyirokcsomóban | N1b |
| 16 | Tumor depozit(ok), például szateliták a subserosában vagy a nem peritonealizált pericolicus vagy perirectalis szövetekben, regionális nyirokcsomó metasztázisok nélkül | N1c |
| 17 | Regionális nyirokcsomó áttétek 4 vagy több nyirokcsomóban | N2 |
| 18 | Regionális nyirokcsomó áttétek 4-6 nyirokcsomóban | N2a |
| 19 | Regionális nyirokcsomó áttétek 7 vagy annál több nyirokcsomóban | N2b |
| 20 | Távoli áttét nem mutatható ki | M0 |
| 21 | Távoli áttét | M1 |
| 22 | A metasztézis egy szervre lokalizálódik [máj, tüdő, petefészek, nem regionális nyirokcsomó(k)] | M1a |
| 23 | Áttét egynél több szervre vagy a peritoneumora lokalizálódik | M1b |
2.2. Colorectalis daganatok stádiumbeosztása
| A | B | C | D | E | |
| 1 | TNM státusz | Primer tumor | Nyirokcsomó érintettség* | Távoli metasztázis | Módosított Astler- Coller |
| 2 | Stádium 0. | Tis | N0 | M0 | |
| 3 | Stádium I. | T1, | N0 | M0 | A |
| T2 | N0 | M0 | B1 | ||
| 4 | Stádium II. | T3, T4 | N0 | M0 | |
| 5 | Stádium II.A | T3 | N0 | M0 | B2 |
| 6 | Stádium II.B | T4a | N0 | M0 | B2 |
| 7 | Stádium II.C | T4b | N0 | M0 | B3 |
| 8 | Stádium III. | Bármilyen T | N1, N2 | M0 | |
| 9 | Stádium III.A | T1, T2 | N1 | M0 | C1 |
| T1 | N2a | M0 | C1 | ||
| 10 | T3, T4a | N1 | M0 | C2 | |
| Stádium III.B | T2, T3 | N2a | M0 | C1/C2 | |
| T1, T2 | N2b | M0 | C1 | ||
| 11 | T4a | N2a | M0 | C1 | |
| Stádium III.C | T3, T4a | N2b | M0 | C2 | |
| T4b | N1, N2 | M0 | C3 | ||
| 12 | Stádium IV.A | Bármilyen T | Bármilyen N | M1a | |
| 13 | Stádium IV.B | Bármilyen T | Bármilyen N | M1b |
2.3. Az ellátás igénybevételének szakmai rendje
Az ellátás igénybevételének szakmai rendjét a szakmai irányelv tartalmazza.
3. Finanszírozás rendje, finanszírozási algoritmusa
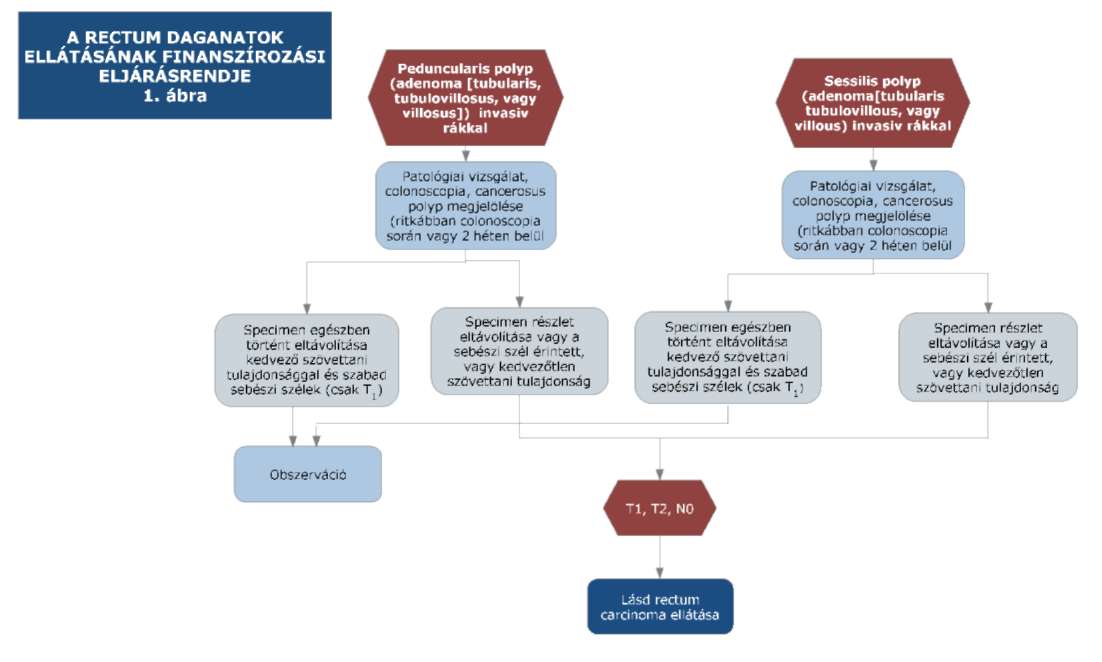
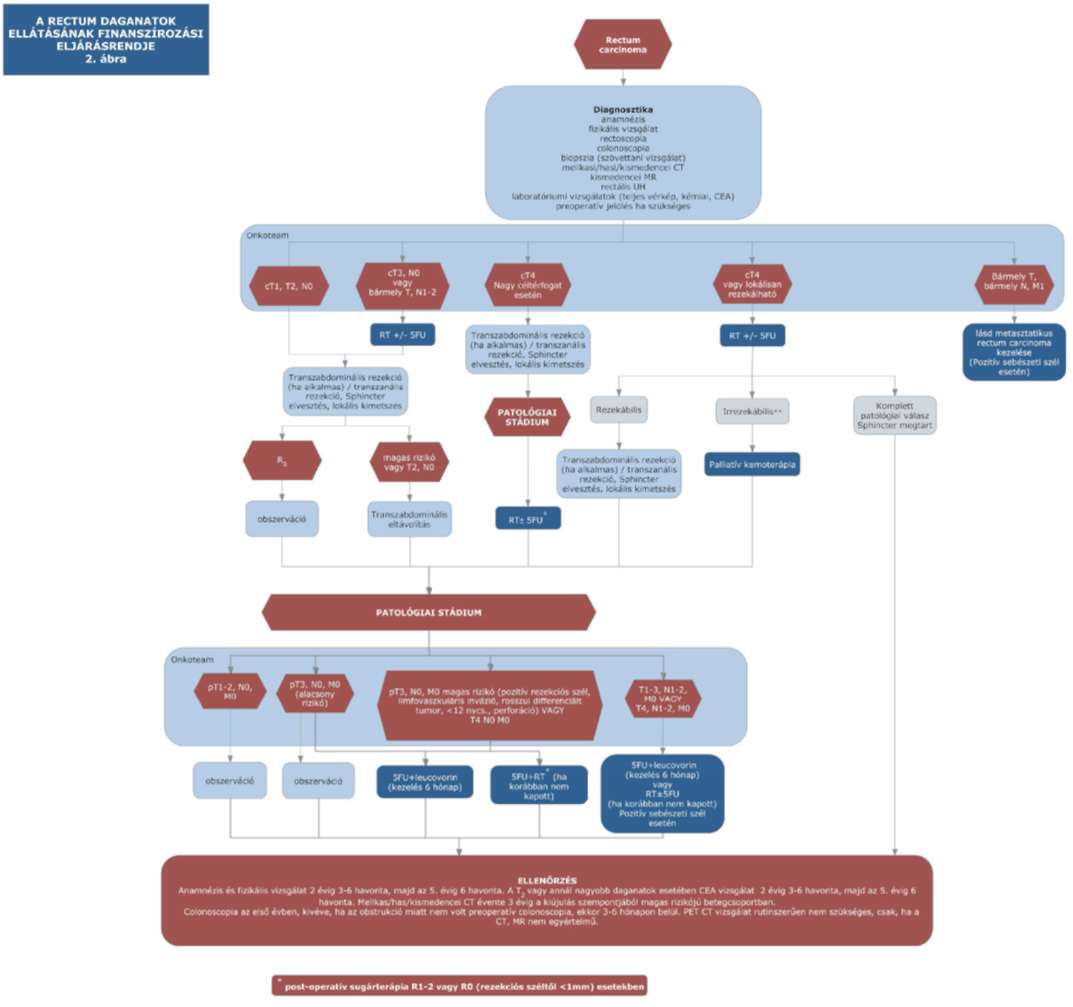
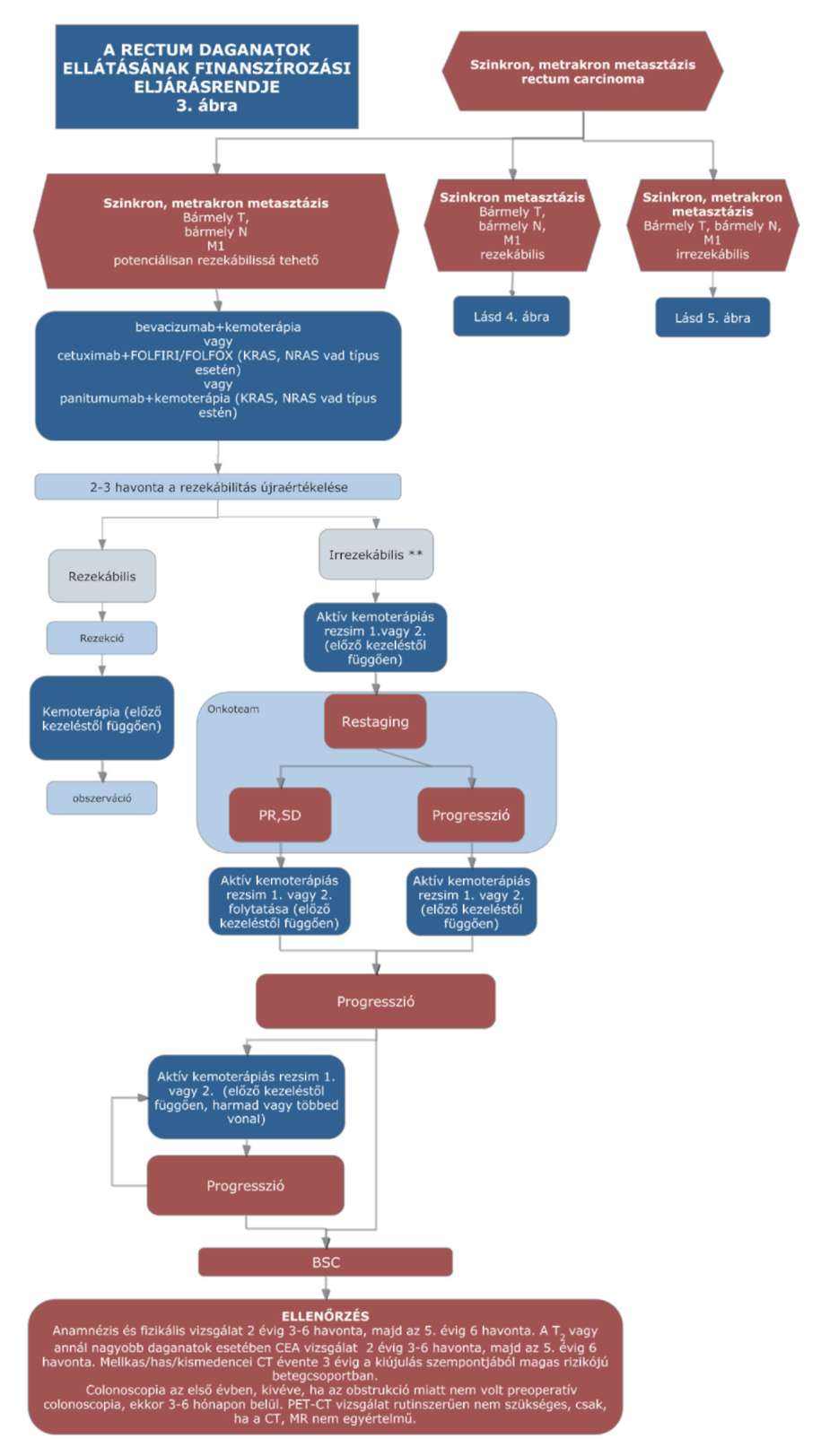
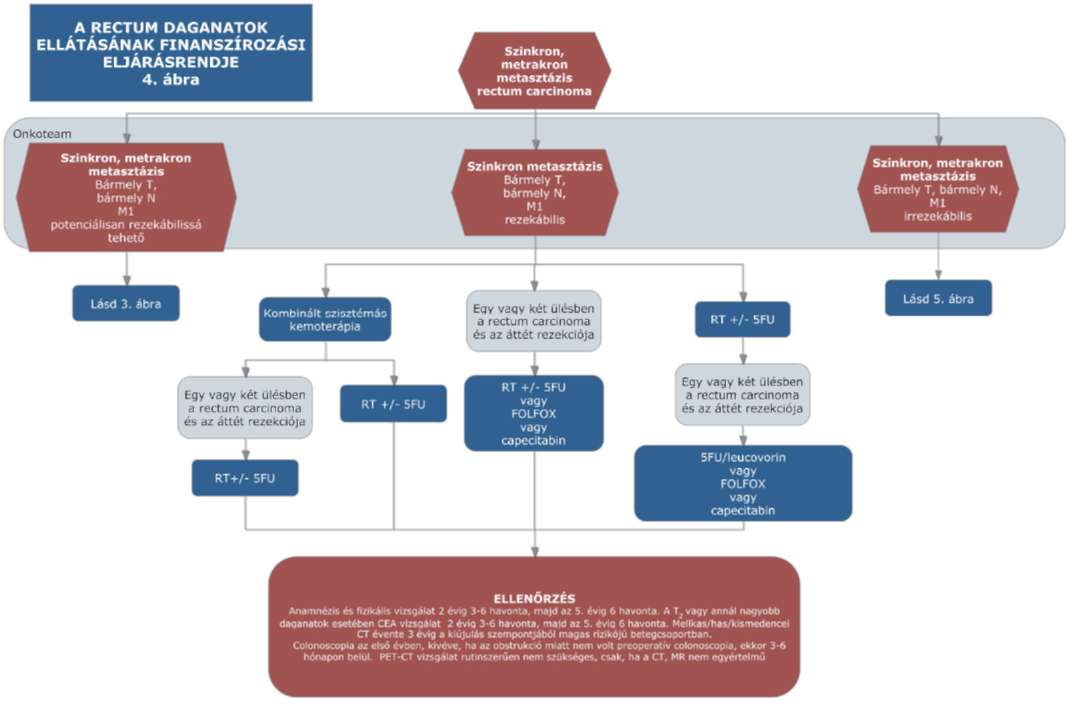
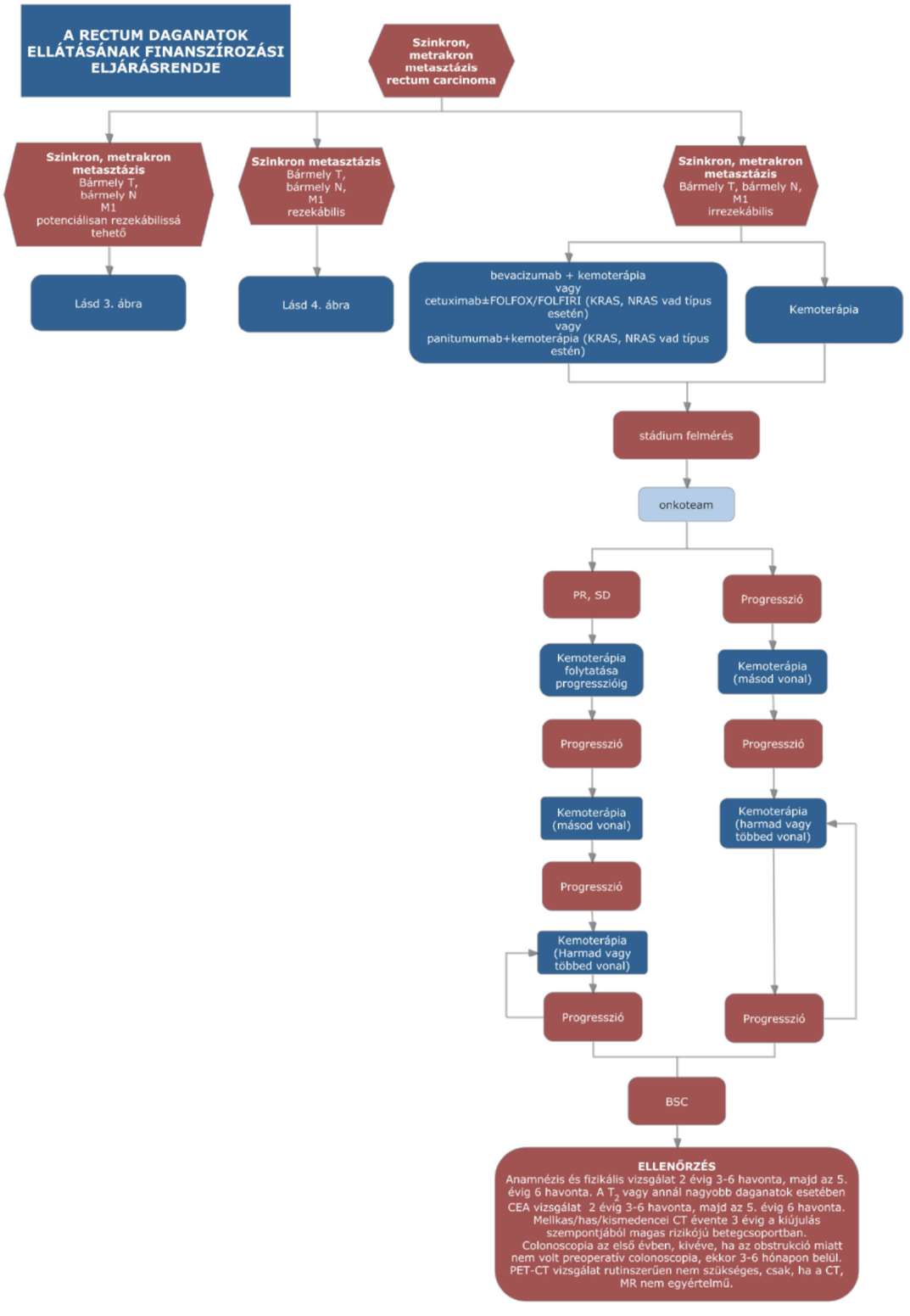
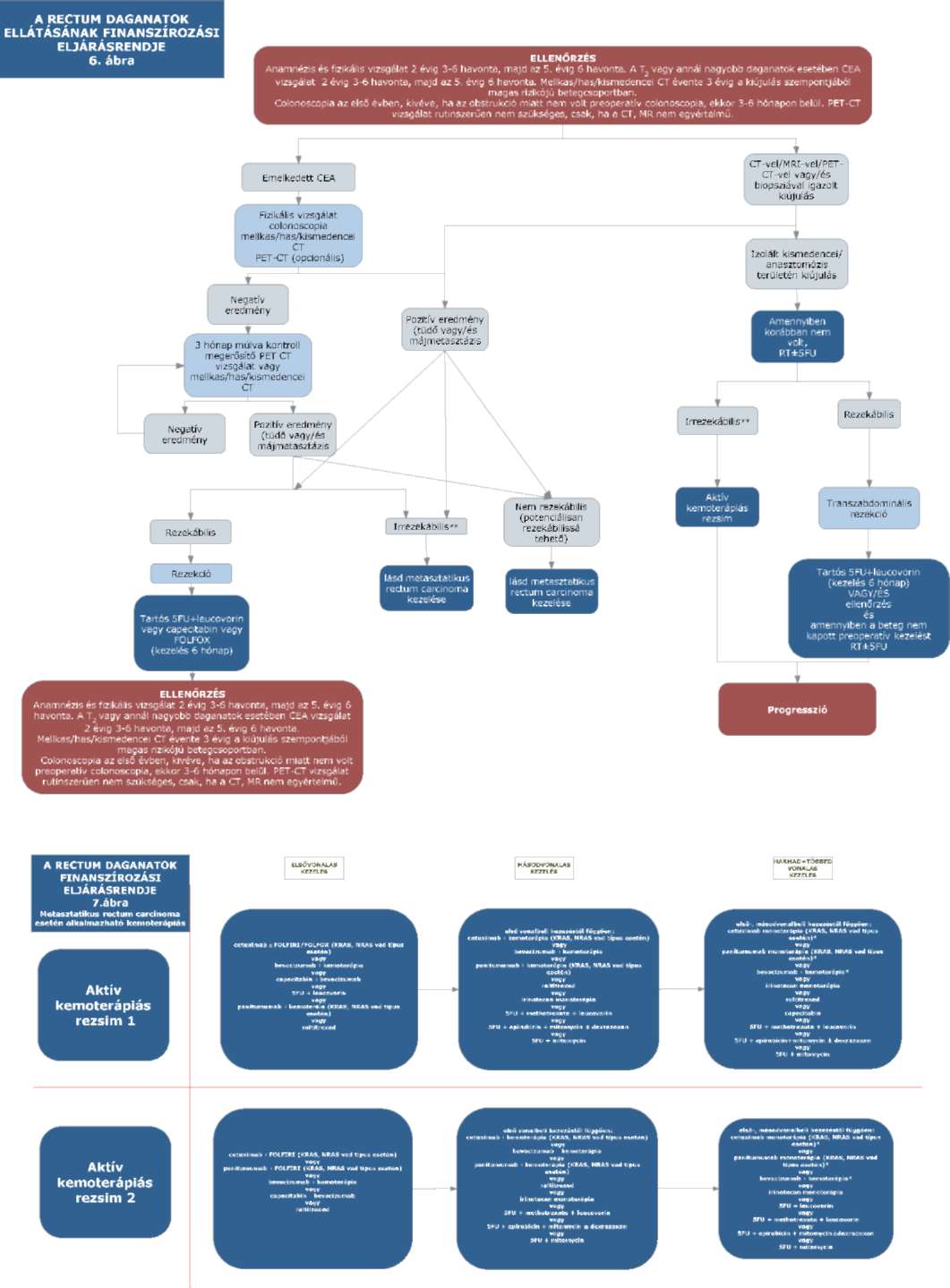
3.1. Megjegyzések:
* A biológiai terápiák harmad vonalban alkalmazhatók, de negyed és többed vonalban nem.
** Intraarterialis kemoterápia, radiofrekvenciás abláció, szóba jöhet a szakmai irányelvek, illetve az orvosi gyakorlat szabályai szerint.
Biológiai terápia alkalmazása során 100 napon belül staging (CT, laboratóriumi, tumor marker vizsgálat) elvégzése szükséges.
Az "Aktív kemoterápiás rezsim" korábbi vonalában adott kezelésének hatástalansága esetén a későbbi vonalban az adott kezelés nem alkalmazható. Egy adott kezelés intoleranciája nem jelent vonalbeli váltást.
A bevacizumab monoterápia a törzskönyvi indikáció alapján nem engedélyezett, tehát off-label kezelés.
3.2. A colorectalis daganatok utánkövetése a következő időpontokban esedékes:
3.2.1. A colorectalis daganatok gondozása
| A | B | ||||||||||||||
| 1 | Hónap | ||||||||||||||
| 2 | 3. | 6. | 9. | 12. | 15. | 18. | 21. | 24. | 30. | 36. | 42. | 48. | 54. | 60. | |
| 3 | Anamnézis | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| 4 | Fizikális vizsgálat | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| 5 | Laborvizsgálat (CEA, CA-50, CA19-9y; GT, széklet vér) | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
| 6 | Mellkas-röntgen vizsgálat (indokolt esetben CT és PET-CT) | + | + | + | + | + | + | + | + | + | + | ||||
| 7 | Hasi kismedencei UH és CT/MR (indokolt eseteben PET-CT) | + | + | + | + | + | + | + | + | + | + | ||||
| 8 | Endoszkópia, virtuális colonoscopia (esetleg irrigoszkópia) | + | + | + | + | + | |||||||||
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. A diagnózis kritériumainak rögzítése (BNO: C2100; C2110; C2120; C2180; C19H0; C20H0)
4.2.1. A diagnózis klinikai szempontrendszer szerint megy végbe.
4.2.2. A beteg vizsgálata, ellenőrzése és a terápia követése rendszeres időközönként történik.
4.3. Gyógyszeres kezelés
4.3.1. Bevacizumab a jogszabálynak megfelelő indikációban és kombinációban alkalmazandó.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére az egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettség esetén azon betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.3 pont szerint folytatható az ellátás az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e2.3. pontja szerint.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis metasztatikus colorectalis carcinoma első, másod vagy harmad vonalú kezelésére a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján, azon betegek részére, akiknél a megkezdett terápia 8 hét után elvégzett képalkotó eljárással dokumentált módon hatásosnak bizonyult, a daganat összes tömege nem növekedett a terápia megkezdése óta. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. A kezelés a betegség progressziójáig folytatható. Amennyiben a kezelés hatására két egymást követő képalkotó diagnosztikai kontroll során komplett klinikai remisszió igazolódik, a kezelést fel kell függeszteni. Abban az esetben, ha a betegség a kezelés felfüggesztését követően újra progrediál, bevacizumab ismételten alkalmazható az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e3.3. pontja szerint.
4.3.2. Cetuximab a jogszabálynak megfelelő indikációban és kombinációban alkalmazandó.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperálibilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kezelésére, FOLFOX vagy FOLFIRI kemoterápiával kombinálva, azon egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettséggel rendelkező betegeknél, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.1. pont szerint folytatható az ellátás az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e2.1. pontja szerint.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperabilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma első, másod vagy harmad vonalú kezelésére a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján, azon betegek részére, akiknél a megkezdett terápia 8 hét után elvégzett képalkotó eljárással dokumentált módon hatásosnak bizonyult, a daganat összes tömege nem növekedett a terápia megkezdése óta. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. A kezelés progresszióig folytatható. Amennyiben a kezelés hatására két egymást követő képalkotó diagnosztikai kontroll során komplett klinikai remisszió igazolódik, a kezelést fel kell függeszteni. Abban az esetben, ha a betegség a kezelés felfüggesztését követően újra progrediál, cetuximab ismét alkalmazható az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e3.1. pontja szerint.
4.3.3. Panitumumab a jogszabálynak megfelelő indikációban és kombinációban alkalmazandó.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére azon egyszervi, illetve - a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján - kétszervi parenchimás érintettséggel rendelkező betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.2. pont szerint folytatható az ellátás az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e2.2. pontja szerint.
Onkológiai sebészeti szakvéleménnyel igazoltan inoperabilis - miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról - vad típusú metasztatikus colorectalis carcinoma első, másod vagy harmad vonalú kezelésére a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján, azon betegek részére, akiknél a megkezdett terápia 8 hét után elvégzett képalkotó eljárással dokumentált módon hatásosnak bizonyult, a daganat összes tömege nem növekedett a terápia megkezdése óta. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik és aláírásukkal azt hitelesítik. A kezelés progresszióig folytatható, illetve amennyiben a kezelés hatására két egymást követő képalkotó diagnosztikai kontroll során komplett klinikai remisszió igazolódik, a kezelést fel kell függeszteni. Abban az esetben, ha a betegség a kezelés felfüggesztését követően újra progrediál, panitumumab ismét alkalmazható az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú melléklet 8/e3.2. pontja szerint.
5. A döntést megalapozó hatásossági, költséghatékonysági mutatók
A finanszírozási eljárásrend a hazai és nemzetközi szakmai és finanszírozási irányelveknek megfelelően került összeállításra.
6. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
A finanszírozási eljárásrend hatását a következő indikátorokkal kívánjuk mérni:
6.1. A területre fordított közkiadások alakulása.
6.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
6.3. Egészségnyereségre gyakorolt hatás.
7. A finanszírozás szempontjából lényeges finanszírozási kódok
7.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | C2100 | Végbélnyílás rosszindulatú daganata, k.m.n. |
| 3 | C2110 | Canalis analis rosszindulatú daganata |
| 4 | C2120 | Cloacogen zóna rosszindulatú daganata |
| 5 | C2180 | Rectum, anusés canalis analis átfedő elváltozása, rosszindulatú daganata |
| 6 | C19H0 | A simabél-végbél határ rosszindulatú daganata |
| 7 | C20H0 | A végbél rosszindulatú daganata |
7.2. Releváns OENO kódok (diagnosztika)
| A | B | |
| 1 | OENO | OENO Megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 88460 | Vérvétel |
| 4 | 26620 | Carcino-embrionális antigén (CEA) meghatározása |
| 5 | 13200 | Rectum digitális vizsgálata |
| 6 | 16440 | Anoscopia |
| 7 | 16430 | Rectoscopia, merev eszközzel |
| 8 | 16431 | Rectum és sigma endoscopos ultrahang vizsgálata |
| 9 | 1643D | Rectum endoscopos ultrahang vizsgálata |
| 10 | 16420 | Rectosigmoideoscopia (flexibilis) |
| 11 | 32460 | Irrigoscopia |
| 12 | 32470 | Irrigoscopia kettős kontrasztanyaggal |
| 13 | 34450 | Teljes has CT vizsgálata natív |
| 14 | 34451 | Teljes has CT vizsgálata iv. kontrasztanyag adását követőleg |
| 15 | 34452 | Teljes has CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 16 | 36153 | Transrectalis UH vizsgálat |
7.3. Releváns OENO kódok - Kemoterápia
| A | B |
| 1 | OENO | OENO megnevezés |
| 2 | 7019 | Kemoterápia, capecitabine monoterápia protokoll szerint |
| 3 | 7022 | Kemoterápia, 5FU protokoll szerint |
| 4 | 7023 | Kemoterápia, 5FU+FOLINAC hetenkénti nagy dózisú protokoll szerint |
| 5 | 7030 | Kemoterápia, EEP protokoll szerint |
| 6 | 7031 | Kemoterápia, ELF protokoll szerint |
| 7 | 7033 | Kemoterápia, FAM protokoll szerint |
| 8 | 7034 | Kemoterápia, FAMB protokoll szerint |
| 9 | 7035 | Kemoterápia, FAMTX protokoll szerint |
| 10 | 7037 | Kemoterápia, FEM/B protokoll szerint |
| 11 | 7041 | Kemoterápia, MBC protokoll szerint |
| 12 | 7044 | Kemoterápia, MAYO protokoll szerint |
| 13 | 7045 | Kemoterápia, DeGramont protokoll szerint |
| 14 | 7046 | Kemoterápia, irinotecan-DeGramont protokoll szerint |
| 15 | 7047 | Kemoterápia, irinotecan/A protokoll szerint |
| 16 | 7049 | Kemoterápia, raltitrexed/A protokoll szerint |
| 17 | 7063 | Kemoterápia, 5FU+FOLINAC protokoll szerint |
| 18 | 7064 | Kemoterápia, raltitrexed/B protokoll szerint |
| 19 | 7207 | Kemoterápia, módosított FAM protokoll szerint |
| 20 | 7268 | Kemoterápia, Bevacizumab+FOLFIRI protokoll szerint |
| 21 | 7270 | Kemoterápia, Bevacizumab+DeGramont protokoll szerint |
| 22 | 7271 | Kemoterápia, Cetuximab+FOLFIRI (telítő) protokoll szerint |
| 23 | 7272 | Kemoterápia, Cetuximab+FOLFIRI (fenntartó) protokoll szerint |
| 24 | 7273 | Kemoterápia, Cetuximab monoterápia protokoll szerint |
| 25 | 7275 | Kemoterápia, FOLFOX-4 protokoll szerint |
| 26 | 7408 | Radiokemoterápia, végbélrák esetén TEG-FOLINAC protokoll szerint |
| 27 | 7410 | Radiokemoterápia, végbélrák esetén 5FU protokoll szerint |
| 28 | 7428 | Radiokemoterápia anális rák esetén 5FU-MMC protokoll szerint |
| 29 | 7449 | Kemoterápia, Cetuximab(2w)+FOLFIRI protokoll szerint |
| 30 | 7450 | Kemoterápia, panitumumab protokoll szerint |
| 31 | 7488 | Kemoterápia, CETUX+FOLFOX-6 (telítő) protokoll szerint |
| 32 | 7489 | Kemoterápia, CETUX+FOLFOX-6 (fenntartó) protokoll szerint |
| 33 | 7495 | Kemoterápia, PAN+FOLFOX-4 protokoll szerint |
| 34 | 7496 | Kemoterápia, PAN+FOLFIRI protokoll szerint |
| 35 | 7514 | Kemoterápia, bevacizumab+capecitabine protokoll szerint |
| 36 | 7515 | Kemoterápia, bevacizumab+FOLFOX4 protokoll szerint |
| 37 | 7517 | Kemoterápia, bevacizumab+XELOX protokoll szerint |
| 38 | 7518 | Kemoterápia, bevacizumab+XELIRI protokoll szerint |
| 39 | 7528 | Kemoterápia, XELOX protokoll szerint |
| 40 | 7529 | Kemoterápia, XELIRI protokoll szerint |
| 41 | 7542 | Kemoterápia, Bevacizumab+FOLFIRI/B protokoll szerint |
| 42 | 7543 | Kemoterápia, Bevacizumab+DeGramont/B protokoll szerint |
| 43 | 7544 | Kemoterápia, Bevacizumab+FOLFOX4/B protokoll szerint |
| 44 | 7574 | Kemoterápia, nagydózisú CIFU (5FU) protokoll szerint |
| 45 | 7575 | Radiokemoterápia, nagydózisú CIFU (5FU) protokoll szerint |
| 46 | 7578 | Kemoterápia, irinothecan 2 hetenkénti protokoll szerint |
| 47 | 7579 | Kemoterápia, MMC+nagydózisú 5FU protokoll szerint |
| 48 | 7586 | Kemoterápia, irinothecan 3 hetenkénti protokoll szerint |
| 49 | 7702 | Kemoterápia, EEP+dexrazoxane protokoll szerint |
| 50 | 7725 | Kemoterápia, FEM/C+dexrazoxane protokoll szerint |
| 51 | 7731 | Kemoterápia, FEM/B+dexrazoxane protokoll szerint |
| 52 | 7924 | Kemoterápia, 5FU heti nagydózisú protokoll szerint |
| 53 | 7926 | Kemoterápia, FEM/A protokoll szerint |
| 54 | 7927 | Kemoterápia, 5FU+FOLINAC hetenkénti kis dózisú protokoll szerint |
| 55 | 7928 | Kemoterápia, FEM/C protokoll szerint |
7.4. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 959A - 959 L | Rosszindulatú daganatok kemoterápiája |
| 3 | 9511-9512 | Radiokemoterápia "A" és "B" |
| 4 | 287C | Emésztőszervi malignomák |
| 5 | 2750 | Vékony-, vastagbél nagyobb műtétei |
| 6 | 340Z | Gyomor, oesophagus, duodenum, vékony-, vastagbél műtétei (kivéve: oesophagus nagyobb műtétei) súlyos társult betegséggel |
| 7 | 337Z | Emésztőrendszeri betegségek (kivéve: oesophagitis, gastroenteritis, nem szövődményes fekélyek) súlyos társult betegséggel |
| 8 | 2880 | Tápcsatorna jóindulatú daganata és in situ carcinomái (kivéve: ajak, szájüreg, garat) |
7.5. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | L01* | Antineoplastic ágensek, különösen: |
| 3 | L01BC06 | capecitabin |
| 4 | L01XC06 | cetuximab |
| 5 | L01XC07 | bevacizumab |
| 6 | L01XC08 | panitumumab |
8. Fogalmak, rövidítések
ATC Anatomical Therapeutic Chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
BSC Best supportive care
CR Colorectalis
CRC Colorectalis carcinoma
CT Computer tomográfia
HBCS Homogén betegségcsoport
MR Mágneses rezonancia
NCCN National Comprehensive Cancer Network
OENO Orvosi eljárások nemzetközi osztályzása
OEP Országos Egészségbiztosítási Pénztár
PET-CT Pozitronemissziós tomográfia
TNM Tumor, node, metastasis (tumor, nyirokcsomó, metasztázis)
UH Ultrahang"
37. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"34. melléklet a 31/2010. (V. 13.) EüM rendelethez
A szénhidrát-anyagcsere rendezése 2-es típusú cukorbetegségben nem terhes felnőttekben
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
2-es típusú diabetes mellitus (BNO: E11)
2. A kórkép leírása
A diabetes mellitus (cukorbetegség, cukorbaj) olyan anyagcsere-betegség, amelyben a szénhidrát-anyagcsere zavara játszik központi szerepet, de a kórfolyamat hatással van a zsír- és a fehérje-anyagcserére is. A cukorbetegség oka az inzulin relatív vagy abszolút hiánya, illetve az inzulinhatás elmaradása, e két eltérés azonban együttesen is előfordulhat. A cukorbetegség kórélettani eltérései számos szerv működésében okozhatnak zavart. A cukorbetegségnek heveny és idült (micro- és macroangiopathiás) szövődményeivel is számolnunk kell, amelyek ellátása, kezelése komoly terhet ró a betegre és a társadalomra egyaránt. A diabetes mellitus elnevezés szó szerint édes (mellitus), bő vizelést (diabinein = túlcsordulás) jelent: az elnevezés arra utal, hogy cukor jelenhet meg a vizeletben. A cukorbetegség nem egységes kórkép, a diabetes mellitus tünetegyüttese több típusra osztható fel. A klinikai tünetek nagymértékben függenek attól, hogy a diabetes melyik típusáról van szó. A 2-es típusú diabetes mellitus a diabetes széles tartományát fogja át, a főleg inzulinrezisztencián alapuló, relatív inzulinhiánnyal jellemezhető formáktól a primeren szekréciós zavarból eredő, inzulinrezisztenciával társuló vagy anélkül megjelenő formákig. A jelen finanszírozási eljárásrend tárgya a szénhidrát-anyagcsere rendezése a nem terhes felnőttekben kialakuló 2-es típusú diabetes mellitusban.
3. A finanszírozás rendje, finanszírozási algoritmus
3.1. A 2-es típusú diabetes mellitus gyógyszeres terápiájának finanszírozási algoritmusa
3.1.1. A nem inzulin-típusú antidiabetikumok alkalmazásának részletes szabályai
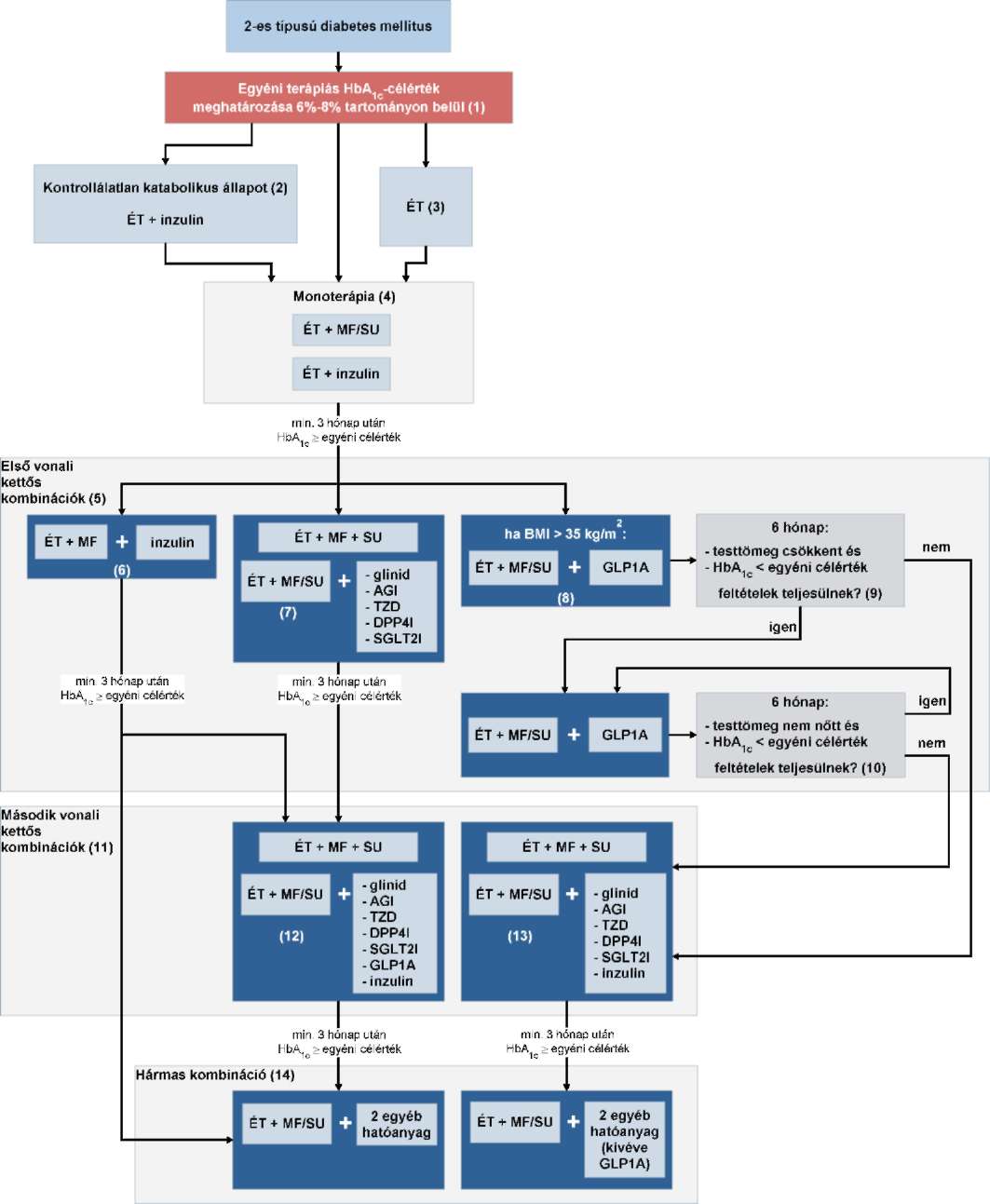
A 3.1.1. pont vonatkozásában a gyógyszeres kombinációk szempontjából az inzulin egyetlen hatóanyagnak minősül függetlenül attól, hogy ténylegesen hányféle inzulint alkalmaznak. Inzulin adása esetén az inzulinra vonatkozó általános szabályokat a 3.2. pont, a részletes szabályokat a 3.3. pont tartalmazza. Nem inzulin-típusú antidiabetikumok és inzulin egyidejű alkalmazásakor mindkét gyógyszercsoport szabályai párhuzamosan értelemszerűen alkalmazandók.
(1) A diagnózis felállításakor meg kell határozni a beteg egyéni HbA1c-célértékét a beteg életkora, a betegség fennállásának tartama, a kísérőbetegségek és a szövődmények alapján. A beteg egyéni HbA1c-célértékét a 6-8% tartományon belül kell meghatározni és évente felül kell vizsgálni. Az egyéni HbA1c-célérték meghatározása és évenkénti felülvizsgálata a beteget gondozó szakorvos feladata. A kezelés során a beteg szénhidrátanyagcsere-háztartásának megítélésekor az egyéni HbA1c-célérték az irányadó.
(2) Kontrollálatlan, katabolikus állapotú beteg esetében (éhgyomri plazmaglükóz >13,9 mmol/l, random plazmaglükóz konzisztensen >16,7 mmol/l, HbA1c >10%, vagy ketonuria van jelen, vagy polyuriával, polydipsiával és fogyással járó diabetes áll fenn) választható az életmód-terápiával kombinált inzulinkezelés. A (2) lépcső minimális időtartamára - a szakmai előírások betartása mellett - finanszírozási/ártámogatási szempontból nincs megkötés.
(3) A diagnózis felállításával egyidejűleg el kell kezdeni az életmód-terápiát. Az életmód-terápia magába foglalja az orvosi táplálkozási terápiát és a megfelelő mennyiségű és minőségű fizikai aktivitást. Az életmód-terápiát a kezelés minden fázisában folyamatosan és következetesen folytatni kell, azonban a gyógyszeres kezelés megkezdése előtti minimális időtartamára - a szakmai előírásokon túl -finanszírozási/ártámogatási szempontból nincs megkötés.
(4) Monoterápia.
A (3) lépcső szerinti életmód-terápia megkezdésével egyidejűleg vagy annak eredménytelensége esetén az életmód-terápia mellé metformint vagy inzulint lehet választani. Ha a metformin kontraindikált vagy arra intolerancia jelentkezett, úgy a metformin helyett szulfonilurea adható. A (2) és (3) lépcső szerinti kezelésről bármikor lehet a (4) lépcsőre lépni. A (4) lépcsőt minimum 3 hónapig folytatni kell.
(5) Első vonali kettős kombinációk.
Ha a (4) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c ≥ egyéni célérték, akkor a (6), (7) vagy (8) lépcső szerinti kettős kombinációt lehet választani, amely kombinációk részletes feltételeit a (6), (7) és (8) pontok tartalmazzák.
(6) Ha a (4) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c ≥ egyéni célérték, akkor a metformin mellé választható inzulin. A (6) lépcsőt minimum 3 hónapig folytatni kell.
(7) Ha a (4) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c > egyéni célérték, akkor választható a metformin+szulfonilurea kettős kombináció, vagy a metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea) mellé választható egy hatóanyag az alábbiak közül, a szakmai előírások és a készítmények alkalmazási előírásai által megengedett kombinációban:
- glinid,
- AGI,
- TZD,
- DPP4I,
- SGLT2I.
A (7) lépcsőt minimum 3 hónapig folytatni kell.
(8) Ha a (4) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c ≥ egyéni célérték és a beteg testtömegindexe BMI>35 kg/m2, akkor a metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea) mellé választható GLP1A.
(9) A metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea)+GLP1A 6 hónapon túl akkor alkalmazható, ha a 6 hónapos időszak utolsó 3 hónapja során mért HbA1c < egyéni célérték és a beteg testtömege az alábbi feltételek valamelyike szerint csökkent:
- a BMI legalább 2 kg/m2-es csökkenése vagy
- a testtömeg legalább 5 kg-os csökkenése.
(10) A metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea)+GLP1A további 6 hónapon túl akkor alkalmazható, ha a további 6 hónapos időszak utolsó 3 hónapja során mért HbA1c < egyéni célérték és a beteg testtömege a (9) pont szerinti megfelelően csökkent testtömeghez képest nem nőtt.
(11) Második vonali kettős kombinációk.
Ha a (6) vagy (7) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c ≥ egyéni célérték, akkor a (12) lépcső szerinti kettős kombinációt lehet választani. Ha a metformin/szulfonilurea+GLP1A terápia a (9) vagy (10) pont szerint tovább nem alkalmazható, akkor választható a (13) lépcső szerinti kettős kombináció. A kombinációk részletes feltételeit a (12) és (13) pontok tartalmazzák.
(12) Ha a (6) vagy (7) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c ≥ egyéni célérték, akkor választható a metformin+szulfonilurea kettős kombináció, vagy a metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea) mellé választható egy hatóanyag az alábbiak közül, a szakmai előírások és a készítmények alkalmazási előírásai által megengedett kombinációban:
- glinid,
- AGI,
- TZD,
- DPP4I,
- SGLT2I,
- GLP1A,
- inzulin.
A (12) lépcsőt minimum 3 hónapig folytatni kell.
(13) Ha a (9) vagy (10) pont szerint a metformin/szulfonilurea+GLP1A terápia tovább nem alkalmazható, akkor választható a metformin+szulfonilurea kettős kombináció, vagy a metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea) mellé választható egy hatóanyag az alábbiak közül, a szakmai előírások és a készítmények alkalmazási előírásai által megengedett kombinációban:
- glinid,
- AGI,
- TZD,
- DPP4I,
- SGLT2I,
- inzulin.
A (13) lépcsőt minimum 3 hónapig folytatni kell.
(14) Hármas kombináció.
- Ha a (6) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c > egyéni célérték, akkor a metformin+inzulin mellé választható további egy hatóanyag.
- Ha a (12) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c ≥ egyéni célérték, akkor a metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea) mellé választható további kettő hatóanyag.
- Ha a (13) lépcső szerinti terápia legalább 3 hónapos alkalmazása ellenére a HbA1c > egyéni célérték, akkor a metformin (vagy metformin-kontraindikáció/intolerancia esetén szulfonilurea) mellé választható további kettő hatóanyag GLP1A kivételével.
A választott kombinációk a szakmai előírások és a készítmények alkalmazási előírásai által megengedett kombinációk lehetnek. A (14) lépcsőt minimum 3 hónapig folytatni kell.
3.2. Az inzulin-készítmények alkalmazásának általános szabályai
3.2.1. Az inzulin-terápiás rendszer meghatározása az irányadó szakmai szabályok alapján.
3.2.2. Az inzulin-készítmények kiválasztása:
a) elhúzódó hatástartamú készítmények,
b) gyors hatású készítmények,
c) előkevert készítmények.
3.2.3. A 3.2.2. pont szerinti csoportokon belül vagy humán vagy analóg inzulin adható. Azonos csoporton belül humán és analóg inzulin egyidejűleg nem adható.
3.2.4. Az inzulin-készítmények önmagukban vagy - figyelemmel a 3.23. pontban foglaltakra is - egymással kombinálva alkalmazhatók.
3.2.5. Humán inzulin kiemelt támogatással - figyelemmel a 3.2.3. pontban foglaltakra is - bármikor adható.
3.2.6. Analóg inzulin emelt támogatással - figyelemmel a 3.2.3. pontban foglaltakra is - bármikor adható.
3.2.7. Analóg inzulin kiemelt támogatással - figyelemmel a 3.2.3. pontban foglaltakra is - akkor adható, ha:
a) a 3.2.2. pont szerinti azonos csoportbeli humán inzulin alkalmazásával az előírt idő alatt az egyéni HbA1c-célértéket a beteg nem érte el,
b) a 3.2.2. pont szerinti azonos csoportbeli humán inzulin alkalmazása mellett dokumentált, külső segítséget igénylő hipoglikémiás epizód lépett fel, vagy
c) a 3.2.2. pont szerinti azonos csoportbeli, emelt támogatású analóg inzulin alkalmazásával az előírt idő alatt az egyéni HbA1c-célértéket a beteg elérte.
3.2.8. Analóg inzulin kiemelt támogatással tartósan addig adható, ameddig az egyéni HbA1c-célértéket a beteg tartósan eléri.
3.2.9. A részletes ártámogatási szabályok a 3.2.2. pont szerinti mindhárom készítménycsoportban (elhúzódó hatástartamú, gyors hatású, előkevert készítmények) külön-külön értendők és alkalmazandók.
3.3. Az inzulin-készítmények alkalmazásának részletes szabályai
3.3.1. Az elhúzódó hatástartamú inzulin-készítmények alkalmazásának részletes szabályai
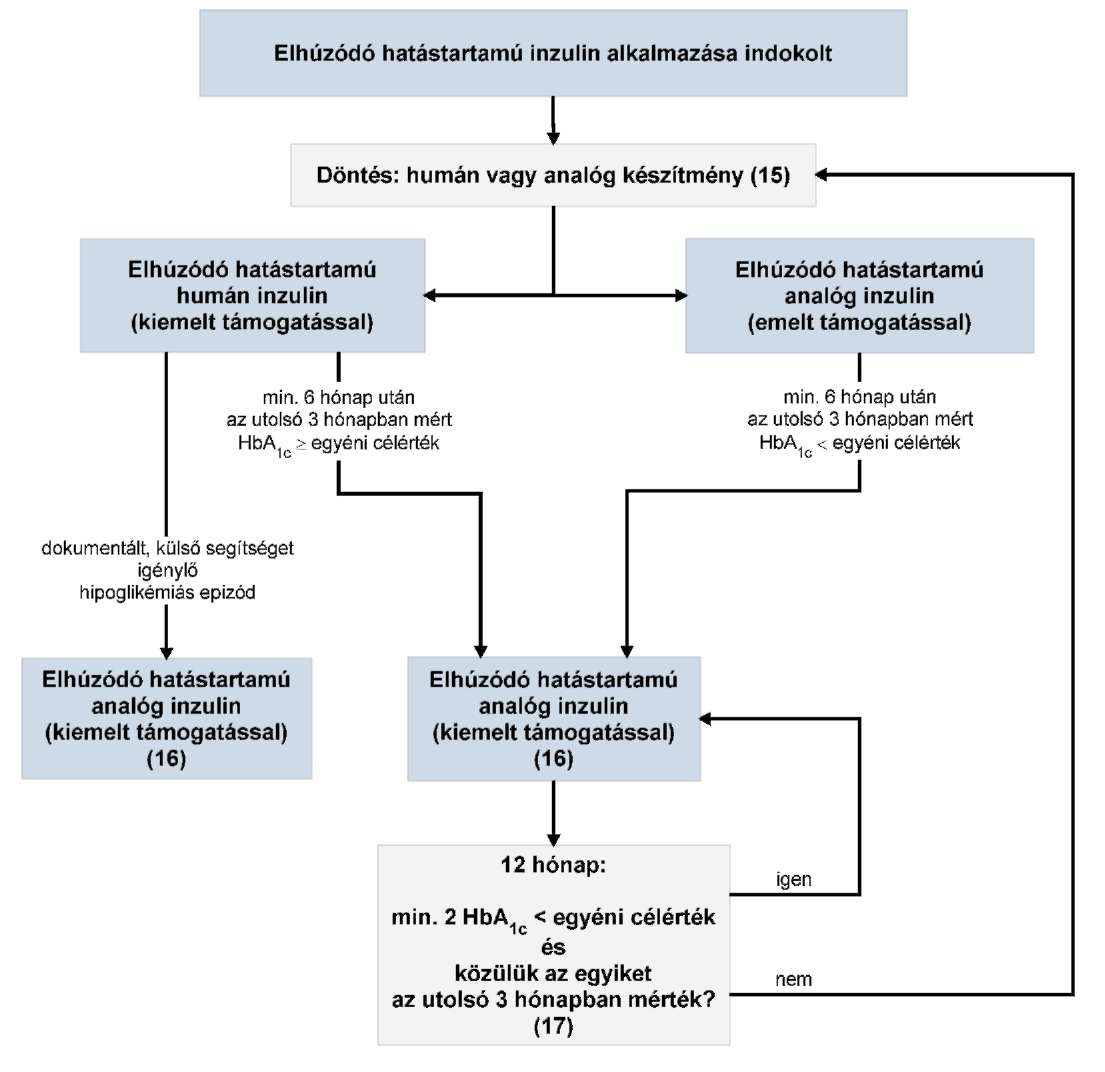
(15) Amennyiben elhúzódó hatástartamú inzulin adása indokolt, úgy adható humán inzulin kiemelt vagy analóg inzulin emelt támogatással.
(16) Elhúzódó hatástartamú analóg inzulin kiemelt támogatással akkor adható, ha az alábbi feltételek valamelyike teljesül:
- elhúzódó hatástartamú humán inzulin legalább 6 hónapig történő alkalmazása mellett az utolsó 3 hónap során mért HbA1c ≥ egyéni célérték,
- elhúzódó hatástartamú humán inzulin alkalmazása mellett dokumentált, külső segítséget igénylő hipoglikémiás epizód lépett fel,
- elhúzódó hatástartamú, emelt támogatású analóg inzulin legalább 6 hónapig történő alkalmazása mellett az utolsó 3 hónap során mért HbA1c < egyéni célérték.
(17) Elhúzódó hatástartamú analóg inzulin kiemelt támogatással 12 hónapnál tovább akkor adható, ha az alábbi feltételek valamelyike teljesül:
- az elhúzódó hatástartamú analóg inzulin 12 hónapig történő alkalmazása során legalább 2 alkalommal - legalább 3 hónap különbséggel - mért HbA1c < egyéni célérték, és e megfelelő HbA1c-értékek közül az egyiket az utolsó 3 hónap során mérték,
- az elhúzódó hatástartamú analóg inzulin alkalmazására elhúzódó hatástartamú humán inzulin alkalmazása során fellépő, dokumentált, külső segítséget igénylő hipoglikémiás epizód miatt került sor.
E feltételek nem teljesülése esetén elhúzódó hatástartamú analóg inzulin kiemelt támogatással 12 hónapnál tovább nem adható, a kezelés folytatására a (15) pont szabályai irányadók.
3.3.2. A gyors hatású inzulin-készítmények alkalmazásának részletes szabályai
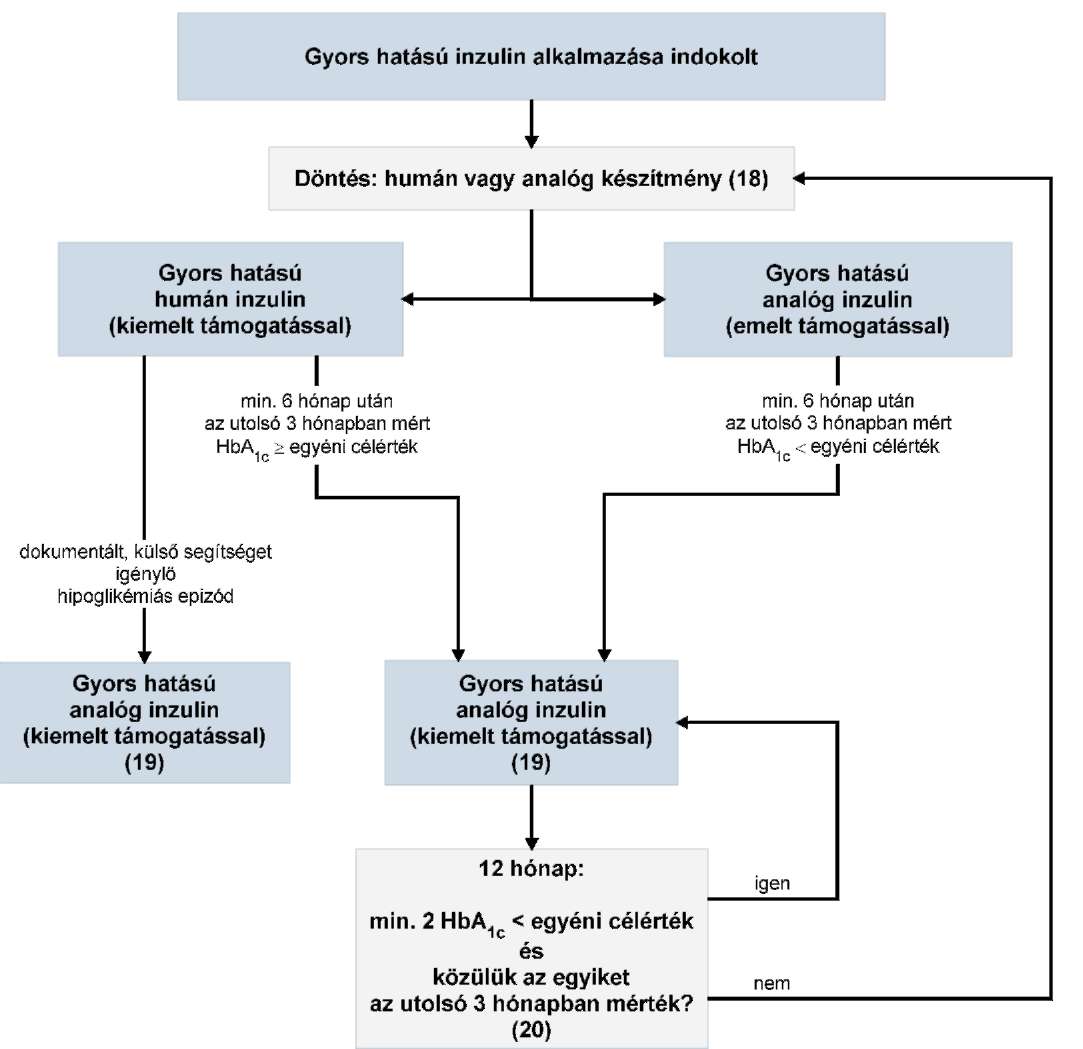
(18) Amennyiben gyors hatású inzulin adása indokolt, úgy adható humán inzulin kiemelt vagy analóg inzulin emelt támogatással.
(19) Gyors hatású analóg inzulin kiemelt támogatással akkor adható, ha az alábbi feltételek valamelyike teljesül:
- gyors hatású humán inzulin legalább 6 hónapig történő alkalmazása mellett az utolsó 3 hónap során mért HbA1c ≥ egyéni célérték,
- gyors hatású humán inzulin alkalmazása mellett dokumentált, külső segítséget igénylő hipoglikémiás epizód lépett fel,
- gyors hatású, emelt támogatású analóg inzulin legalább 6 hónapig történő alkalmazása mellett az utolsó 3 hónap során mért HbA1c < egyéni célérték.
(20) Gyors hatású analóg inzulin kiemelt támogatással 12 hónapnál tovább akkor adható, ha az alábbi feltételek valamelyike teljesül:
- a gyors hatású analóg inzulin 12 hónapig történő alkalmazása során legalább 2 alkalommal - legalább 3 hónap különbséggel - mért HbA1c < egyéni célérték, és e megfelelő HbA1c-értékek közül az egyiket az utolsó 3 hónap során mérték,
- a gyors hatású analóg inzulin alkalmazására gyors hatású humán inzulin alkalmazása során fellépő, dokumentált, külső segítséget igénylő hipoglikémiás epizód miatt került sor.
E feltételek nem teljesülése esetén gyors hatású analóg inzulin kiemelt támogatással 12 hónapnál tovább nem adható, a kezelés folytatására a (18) pont szabályai irányadók.
3.3.3. Az előkevert inzulin-készítmények alkalmazásának részletes szabályai
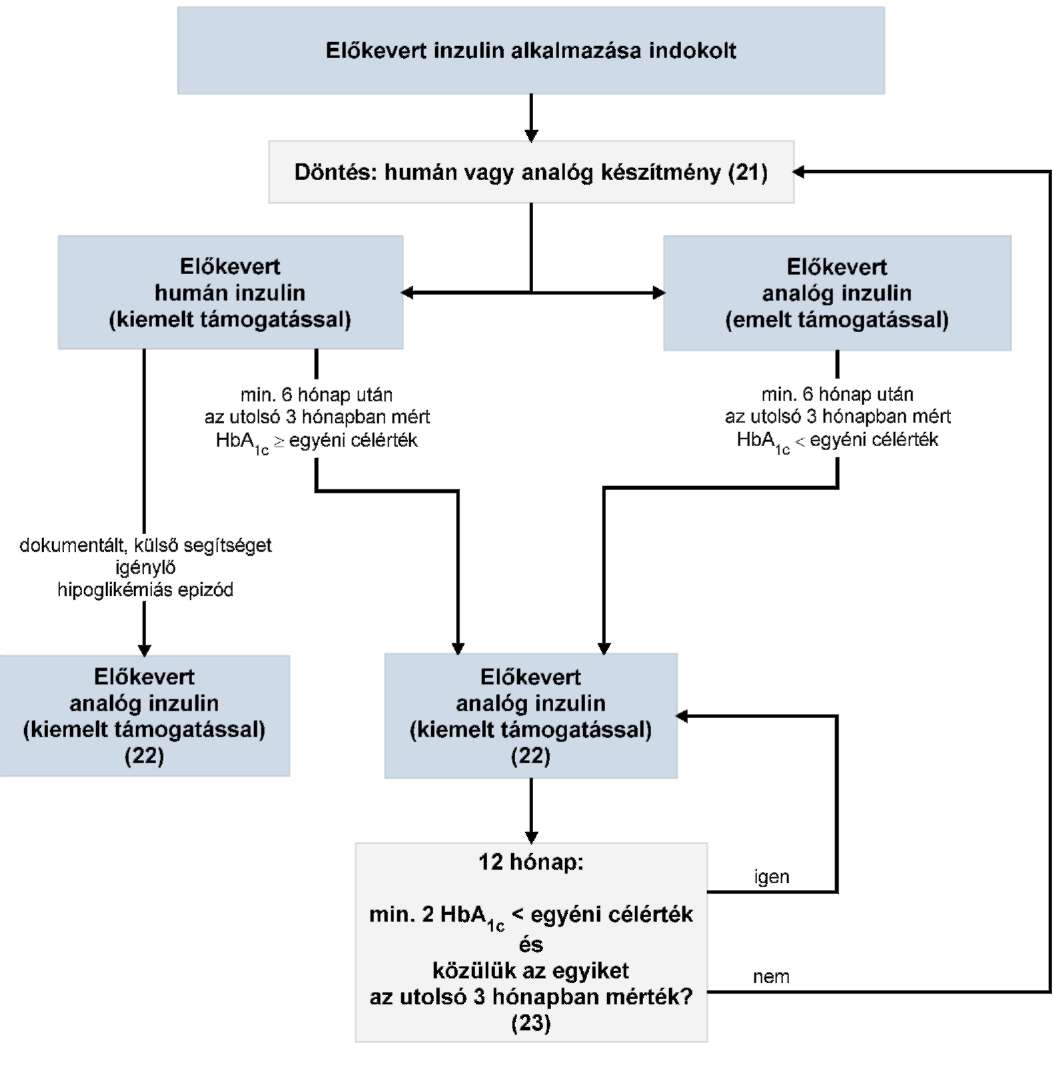
(21) Amennyiben előkevert inzulin adása indokolt, úgy adható humán inzulin kiemelt vagy analóg inzulin emelt támogatással.
(22) Előkevert analóg inzulin kiemelt támogatással akkor adható, ha az alábbi feltételek valamelyike teljesül:
- előkevert humán inzulin legalább 6 hónapig történő alkalmazása mellett az utolsó 3 hónap során mért HbA1c ≥ egyéni célérték,
- előkevert humán inzulin alkalmazása mellett dokumentált, külső segítséget igénylő hipoglikémiás epizód lépett fel,
- előkevert, emelt támogatású analóg inzulin legalább 6 hónapig történő alkalmazása mellett az utolsó 3 hónap során mért HbA1c < egyéni célérték.
(23) Előkevert analóg inzulin kiemelt támogatással 12 hónapnál tovább akkor adható, ha az alábbi feltételek valamelyike teljesül:
- az előkevert analóg inzulin 12 hónapig történő alkalmazása során legalább 2 alkalommal - legalább 3 hónap különbséggel - mért HbA1c < egyéni célérték, és e megfelelő HbA1c-értékek közül az egyiket az utolsó 3 hónap során mérték,
- az előkevert analóg inzulin alkalmazására előkevert humán inzulin alkalmazása során fellépő, dokumentált, külső segítséget igénylő hipoglikémiás epizód miatt került sor.
E feltételek nem teljesülése esetén előkevert analóg inzulin kiemelt támogatással 12 hónapnál tovább nem adható, a kezelés folytatására a (21) pont szabályai irányadók.
Amennyiben egy készítmény kontraindikált, vagy az alkalmazási előírás szerinti dózisban vele szemben intolerancia (tolerálhatatlan mellékhatás) lép fel, akkor azt úgy lehet tekinteni, mintha az adott terápiás lépcsőn belül az érintett hatóanyagcsoporttal az előírt ideig megfelelő dózisban folytatott terápia - a megfelelő eredmény nélkül - megtörtént volna. Ez kizárólag az adott hatóanyagcsoporttal végzett kezelés alól mentesít, az érintett terápiás lépcsőt - ha az adott lépcsőben van további hatóanyagcsoport - a fenti szabályok szerint teljesíteni kell.
Adott terápiás lépcsőről - a szakmai szabályok betartása mellett - bármikor vissza lehet lépni bármelyik korábbi lépcsőre.
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket. A legfontosabb ellenőrzési sarokpontok a következők:
4.1. Meghatározták-e a beteg egyéni HbA1c-célértékét a szükséges paraméterek alapján?
4.2. A beteg egyéni HbA1c-célértékének módosítása esetén indokolt volt-e a módosítás?
4.3. Terápiás lépcső váltása esetén kezelték-e a beteget az előző lépcsőn az előírt ideig?
4.4. Terápiás lépcső váltása esetén az előző lépcsőn történt-e érdemi terápiás próbálkozás a szénhidrát-anyagcsere rendezésére az alkalmazott gyógyszer alkalmazási előírás szerint megengedett legnagyobb vagy a tolerált legnagyobb dózisával?
4.5. Az érintett terápiás lépcsők esetén valóban elérték-e a beteg egyéni HbA1c-célértékével jellemezhető megfelelő szénhidrát-anyagcserehelyzetet az előírt ideig tartó és szakmailag helyesen végzett kezeléssel?
4.6. Az érintett terápiás lépcsők esetén valóban nem volt-e elérhető a beteg egyéni HbA1c-célértékével jellemezhető megfelelő szénhidrát-anyagcserehelyzet az előírt ideig tartó és szakmailag helyesen végzett kezeléssel?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. Rövid távon értékelhető mutatók:
5.1.1. azon betegek számának és arányának alakulása, akiknél végeznek HbA1c-vizsgálatot,
5.1.2. a kiváltott antidiabetikus gyógyszerek mennyiségének és a rájuk kifizetett TB-támogatás összegének alakulása,
5.1.3. a kiváltott humán és analóg inzulinok mennyiségének, a rájuk kifizetett TB-támogatásnak, valamint a humán és az analóg inzulint kapott betegek arányának alakulása.
5.2. Hosszú távon értékelhető mutatók:
5.2.1. a végső kimenetelt jelző események előfordulási gyakoriságának alakulása: alsó végtagi amputációk, veseelégtelenség, szívinfarktus, vakság, stroke.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | E11 | Nem-insulin-dependens cukorbetegség |
6.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 21310 | Glukóz meghatározása |
| 3 | 21312 | Glukóz meghatározása hexokináz módszerrel |
| 4 | 23130 | Glukóz terhelés |
| 5 | 28493 | Haemoglobin A1c meghatározás (HPLC kivételével) |
| 6 | 28494 | Haemoglobin A1c meghatározás HPLC-vel, tömegspektrometriával |
| 7 | 91313 | Hagyományos inzulinkezelésben részesülő cukorbeteg anyagcsere állapotának időszakos elemzése |
| 8 | 91314 | Intenzív inzulinkezelés alatt álló diabeteses beteg anyagcsere állapotának időszakos elemzése |
| 9 | 91316 | Hagyományos inzulinkezelés alatt álló diabeteses betegek oktatása tanfolyam keretében |
| 10 | 91318 | Diabeteses gravidák, illetve a gestatios diabetesesek időszakos ellenőrzése |
| 11 | 91321 | Neuropathiás diabeteses láb ellenőrző vizsgálata |
6.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 10M 537B | Diabetes 36 év felett, nem insulin dependens |
| 3 | 10M 537C | Diabetes mellitus 14-36 éves kor között |
| 4 | 10S 537E | Diabetes mellitus, hypoglykaemias állapotok sürgősségi ellátása |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | A10A | Inzulinok és analógjaik |
| 3 | A10B | Orális antidiabetikumok |
7. Fogalmak, rövidítések
ADA: American Diabetes Association
EASD: European Association for the Study of Diabetes
NICE: National Institute for Health and Clinical Excellence
UKPDS: United Kingdom Prospective Diabetes Study
OEP: Országos Egészségbiztosítási Pénztár
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy
NTK: Napi terápiás költség
GySE: Gyógyászati segédeszköz
IDDM: Inzulin-dependens diabetes mellitus
NIDDM: Nem inzulin-dependens diabetes mellitus
HbA1c: Hemoglobin-A1c
FPG: Fasting plasma glucose
OGTT: Orális glükóz-tolerancia-teszt
IFG: Impaired fasting glucose
IGT: Impaired glucose tolerance
SMBG: Self-monitoring of blood glucose
OAD: Orális antidiabetikum
ÉT: Életmód-terápia
MF: Metformin
SU: Szulfonilurea
TZD: Tiazolidindion
DPP4I: Dipeptidil-peptidáz-4-inhibitor
GLP1A: Glukagonszerű-peptid-1-agonista
AGI: Alfa-glükozidáz-inhibitor
SGLT2I: Nátrium-glukóz-kotranszporter-2-inhibitor
BMI: Body Mass Index (testtömegindex)
NPH: Neutral protein Hagedorn vagy isophane inzulin
BBT: Bázis-bólus terápia
BOT: Bázis inzulin és orális antidiabetikus terápia
IMT: Intenzív mix terápia
PPT: Prandiális premix terápia"
38. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"35. melléklet a 31/2010. (V. 13.) EüM rendelethez
A gyermekkori asthma bronchiale diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Asthma bronchiale (BNO: J45)
Status asthmaticus (BNO: J46H0)
2. A kórkép leírása
Az asthma a légutak krónikus gyulladásos megbetegedése. A kórkép kialakulása és az exacerbatiók megjelenése hátterében több ok állhat (genetikai hatások, intrauterin allergén-expozíció, lélegeztetett újszülöttek tüdőkárosodása, inhalatív és alimentáris allergének, vírusos megbetegedések, fizikai terhelés, légszennyezés, aktív és passzív dohányzás, meteorológiai változások, érzelmi stressz, cirkadián ritmus).
Külön figyelmet kell fordítani az 5 évesnél fiatalabb gyermekekre. Ebben az életkorban a diagnózis felállításakor a klinikai megítélés a legfontosabb. A légzésfunkciós tesztek általában nem kivihetőek, sok gyermeknél csak 6-7 éves kortól végezhetők el ezen vizsgálatok, bár 4-5 évesek esetleg megtanulhatják a peak flow meter használatát, és így náluk a PEF meghatározható. A kisgyermekkori asthma négy fő formában jelenhet meg:
2.1. átmeneti korai "wheezing": 3 éves korig általában gyógyul, gyakran összefügg a koraszülöttséggel, következményes bronchopulmonális diszpláziával és a környezeti dohányzással,
2.2. perzisztáló, 3 éves kor előtt kezdődő korai wheezing: vírusinfekciókkal összefüggő megjelenés, nincs a családban atópia, és a betegnél az atópia egyéb jele (pl. ekcéma) sem észlelhető; ez eltarthat az iskoláskorig, és gyakran még 12 éves korban is jelen van,
2.3. későn kezdődő wheezing/asthma: atópia igazolható a családban, a gyermeknél a pozitív bőrpróbák és az ekcéma gyakori; ebből a gyermekkorban megmaradó kórképből gyakran lesz felnőttkori asthma,
2.4. hosszú tünetmentesség után ritka, de nagyon súlyos asthmás állapot (exacerbáció) lép fel; gyakran egyéb atópiás jelenség is észlelhető.
A gyermekkori asthma ma a korosztály leggyakoribb, krónikus kezelést igénylő betegsége. Előfordulása a technikai civilizáció közepes vagy magas szintjén álló országokban 1% és 30% között mozog. Magyarországon jelenleg 4-8%-os asthma-előfordulást állapítanak meg.
A jelen finanszírozási eljárásrend hatálya a gyermekkori asthma bronchiale diagnosztikájára, valamint gyógyszeres kezelésére terjed ki.
3. A finanszírozás rendje, a finanszírozási algoritmus
3.1. A gyermekkori asthma bronchiale diagnosztikájának algoritmusa
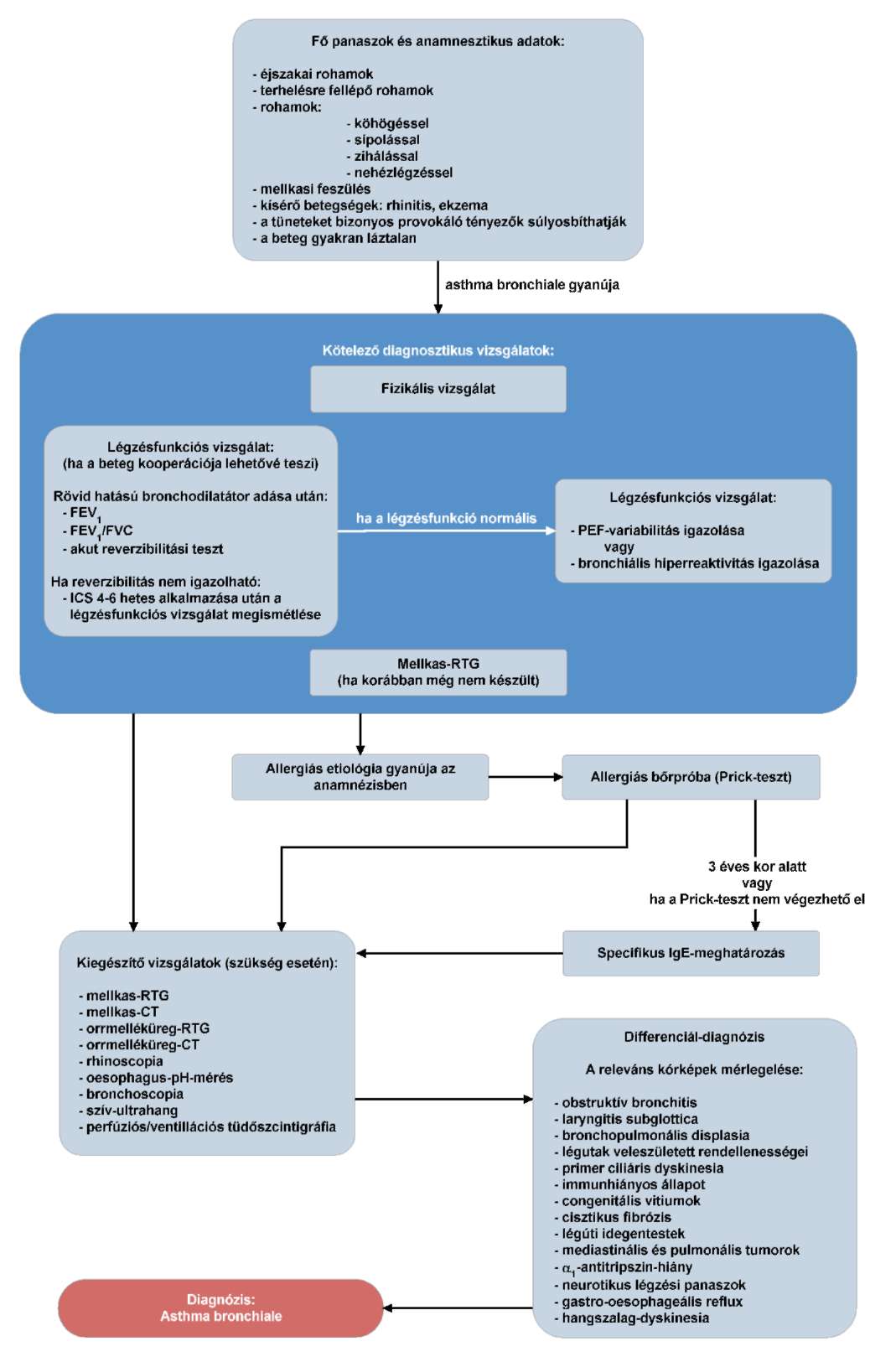
Szisztémás antihisztamin-kezelés alatt az allergiás bőrpróba helyett nem végezhető specifikus IgE-meghatározás. A szisztémás antihisztamin-kezelés felfüggesztése után 1 héttel az allergiás bőrpróba elvégezhető.
3.2. A gyermekkori asthma bronchiale gyógyszeres kezelésének finanszírozási algoritmusa
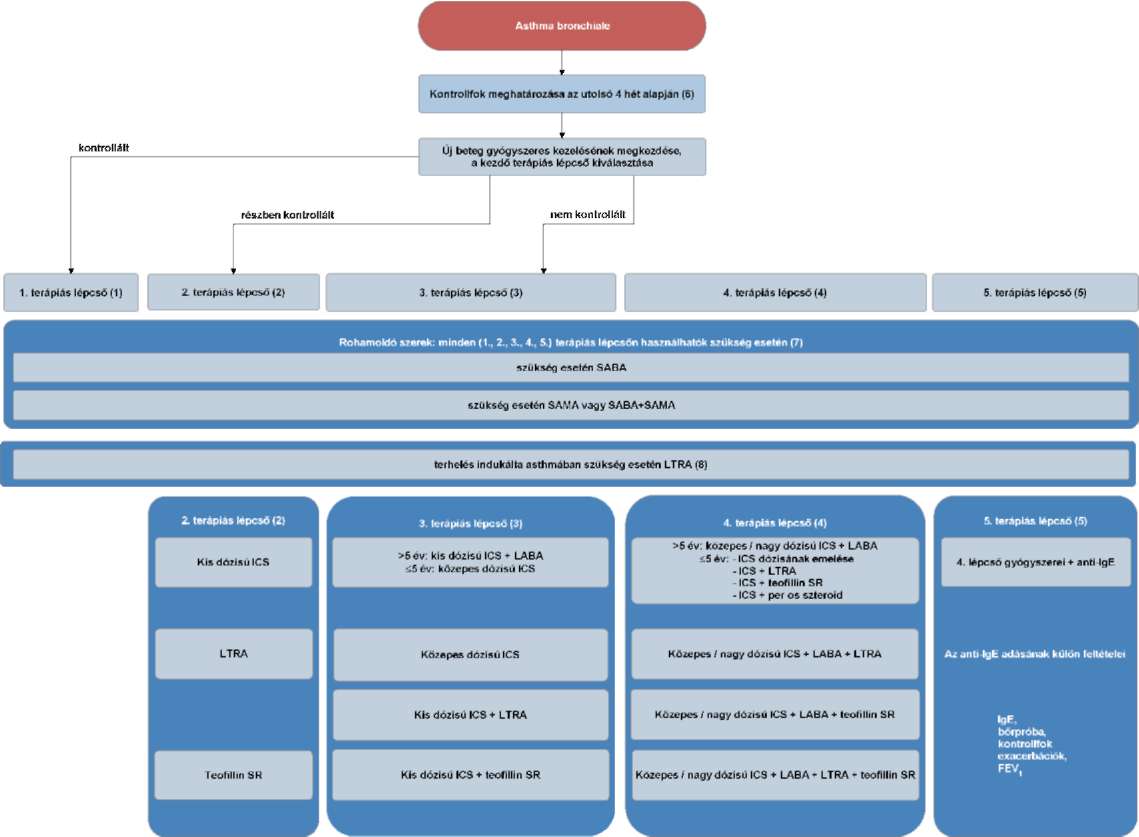
A gyógyszeres kezelés algoritmusában szereplő egyes terápiás lépcsők tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) 1. terápiás lépcső
Rohamoldó szer alkalmazható szükség esetén, amelynek részletes szabályai a (7) pontban szerepelnek.
LTRA alkalmazható terhelés indukálta asthmában szükség esetén, amelynek részletes szabályai a (8) pontban szerepelnek.
(2) 2. terápiás lépcső
a) Az 5 évesnél fiatalabbak infekció indukálta asthmája kivételével a választandó kezelés a kis dózisú ICS.
b) Az 5 évesnél fiatalabbak infekció indukálta asthmája esetén a választandó kezelés az LTRA.
c) További választható kezelés a teofillin SR.
(3) 3. terápiás lépcső
a) 5 évesnél fiatalabbak esetén a választandó kezelés a közepes dózisú ICS.
b) 5 évesnél idősebbek esetén a választandó kezelés a kis dózisú ICS+LABA.
c) Ha a LABA kontraindikált vagy vele szemben intolerancia lép fel, az 5 évesnél idősebbek esetén választható a következő kezelések egyike:
- közepes dózisú ICS,
- kis dózisú ICS+LTRA,
- kis dózisú ICS+teofillin SR.
d) Ha a b) és c) pontban meghatározott valamelyik - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, az 5 évesnél idősebbek esetén választható a következő kezelések egyike:
- közepes dózisú ICS,
- kis dózisú ICS+LTRA,
- kis dózisú ICS+teofillin SR,
- lépés a 4. terápiás lépcsőre.
e) Ha a b) és c) pontban meghatározott valamelyik - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. terápiás lépcsőn folytatható a kezelés.
(4) 4. terápiás lépcső
a) 5 évesnél fiatalabbak esetén választható a következő kezelések egyike:
- ICS dózisának emelése,
- ICS+LTRA,
- ICS+teofillin SR,
- ICS+per os szteroid (legfeljebb 4 hétig, de lehetőleg 7 napnál nem tovább).
b) 5 évesnél idősebbek esetén a választandó kezelés a közepes/nagy dózisú ICS+LABA.
c) Ha a b) pont szerinti - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált vagy nem kontrollált, választható a következő kezelések egyike:
- közepes/nagy dózisú ICS+LABA+LTRA,
- közepes/nagy dózisú ICS+LABA+teofillin SR,
- közepes/nagy dózisú ICS+LABA+LTRA+teofillin SR.
d) Ha a b) és c) pontban meghatározott - legalább 2 különböző, egyenként legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált vagy nem kontrollált és az 5. terápiás lépcső feltételei teljesülnek, az 5. terápiás lépcsőn folytatható a kezelés.
(5) 5. terápiás lépcső
Perzisztáló allergiás asthmában választható a 4. lépcső szerinti kezelés kiegészítése anti-IgE-vel. Az anti-IgE adásának további feltételei:
- IgE-szint > 76 NE/ml és az IgE-szint nem haladja meg az alkalmazási előírás szerinti maximális értéket,
- perenniális inhalatív allergénnel szembeni pozitív bőrpróba vagy specifikus IgE kimutatása a szérumban,
- szisztémás szteroid tartós (legfeljebb 4 hétig történő) alkalmazása ellenére az asthma nem kontrollált vagy nagy dózisú ICS+LABA alkalmazása ellenére gyakoriak a szisztémás szteroidot igénylő exacerbációk (≥ 4/év),
- FEV1 < ref. 80%-a,
- az anti-IgE-kezelés megkezdését követően évente értékelni kell a kezelés hatását, és az anti-IgE-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő.
(6) Újonnan diagnosztizált betegnél meg kell állapítani az asthma kontrollfokát az utolsó 4 hét alapján. A gyógyszeres kezelés a kontrollfokhoz igazodó terápiás lépcsőn kezdhető meg.
Új beteg gyógyszeres kezelését az 1. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma kontrollált.
Új beteg gyógyszeres kezelését a 2. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma részben kontrollált.
Új beteg gyógyszeres kezelését a 3. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma nem kontrollált.
(7) Rohamoldó szerek
Minden terápiás lépcsőn (1., 2., 3., 4., 5.) használhatók szükség esetén.
a) A választandó kezelés a SABA.
b) Ha a SABA kontraindikált vagy vele szemben intolerancia lép fel, választható a SAMA vagy a SABA+SAMA.
(8) Terhelés indukálta asthmában minden terápiás lépcsőn (1., 2., 3., 4., 5.) szükség esetén választható LTRA.
Amennyiben az alkalmazott hatóanyagú készítmény kontraindikált, vagy az alkalmazási előírás szerinti dózisban vele szemben intolerancia (tolerálhatatlan mellékhatás) lép fel, akkor azt úgy lehet tekinteni, mintha az érintett hatóanyagcsoporttal a megfelelő dózisban folytatott terápia - a megfelelő eredmény nélkül - megtörtént volna.
3.3. Az inhalációs szteroidok becsült ekvivalens napi adagjai 5 évesnél idősebb gyermekekre vonatkozóan
| A | B | C | D | |
| 1 | Hatóanyag | Alacsony napi dózis (µg) | Közepes napi dózis (µg) | Magas napi dózis (µg) |
| 2 | budesonid | 100-200 | >200-400 | >400 |
| 3 | budesonid (inhalátorral vagy porlasztva) | 250-500 | >500-1000 | >1000 |
| 4 | ciclesonid | 80-160 | >160-320 | >320 |
| 5 | fluticason-propionát | 100-200 | >200-500 | >500 |
| 6 | fluticason-furoát | 100 | 100-200 | 200 |
3.4. Az inhalációs szteroidok alacsony napi adagjai 5 éves és fiatalabb gyermekekre vonatkozóan
| A | B | |
| 1 | Hatóanyag | Alacsony napi dózis (µg) * |
| 2 | budesonid (MDI+toldalék) | 200 |
| 3 | budesonid (inhalátorral vagy porlasztva) | 500 |
| 4 | ciclesonid | n.v. |
| 5 | fluticason-propionát | 100 |
| 6 | * A táblázatban szereplő dózisok nem jelentenek klinikai ekvivalenciát n.v.: Nem vizsgálták ebben a korcsoportban | |
3.5. Az asthma kontrollfok szerinti osztályozása
| A | ||||
| 1 | Az aktuális klinikai kontroll megállapítása 4 hetes időszak vonatkozásában | |||
| 2 | Jellemző | Kontrollált (mindegyik igaz) | Részben kontrollált (bármelyik jellemző jelenléte esetén) | Nem kontrollált |
| 3 | Nappali tünetek | nincs ( ≤ 2x/hét) | > 2x/hét | a részben kontrollált asthma legalább három jellemzőjének jelenléte * |
| 4 | Fizikai aktivitás korlátozottsága | nincs | van | |
| 5 | Éjszakai tünetek, felébredések | nincs | van | |
| 6 | Rohamoldó iránti igény | nincs ( ≤ 2x/hét) | > 2x/hét | |
| 7 | Légzésfunkció (PEF vagy FEV1) ** | normális | az elvárt érték vagy az ismert egyéni legjobb érték 80%-a alatt | |
| 8 | Az asthma jövőbeli kockázatának felmérése: exacerbáció rizikója instabil asthma gyors légzésfunkció-vesztés gyógyszer-mellékhatások | |||
| 9 | * Bármilyen exacerbáció esetén a beteg asthmája nem kontrollált, és felül kell vizsgálni a fenntartó kezelés megfelelőségét ** Bronchodilatátor adása nélkül; a légzésfunkciós vizsgálat 5 éven aluli gyermek esetén nem megbízható |
3.6. Az asthma bronchiale akut exacerbációja diagnosztikájának és gyógyszeres kezelésének algoritmusa
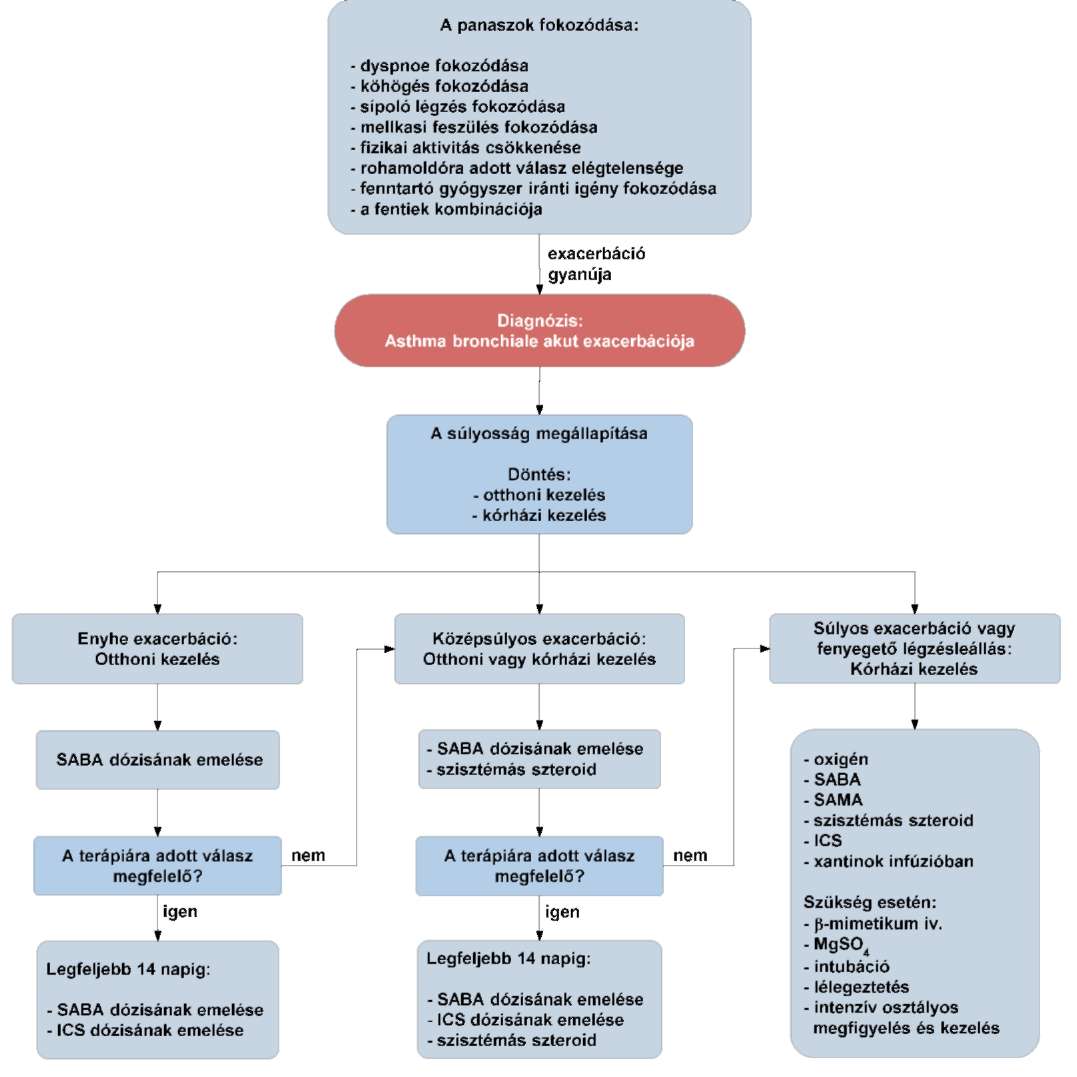
3.7. Az exacerbáció súlyosság szerinti osztályozásának szempontjai
| A | B | C | D | E | ||
| 1 | Klinikai paraméter | Súlyosság | ||||
| 2 | enyhe | középsúlyos | súlyos | fenyegető légzésleállás | ||
| 3 | Nehézlégzés | nehézlégzés járásra képes feküdni | nehézlégzés beszédre csecsemőknél rövid erőtlen sírás, táplálási nehézség inkább ül | nehézlégzés nyugalomban csecsemők nem táplálhatók előrehajol | ||
| 4 | Beszéd | mondatok | frázisok | szavak | ||
| 5 | Éberség | izgatott lehet | általában izgatott | általában izgatott | aluszékony vagy zavart | |
| 6 | Légzési frekvencia | kissé emelkedett | közepes mértékben emelkedett | kifejezett tachypnoe (több, mint a normális kétszerese) | Csecsemő: 26- 30/perc 1-5 év: 22-26/perc 6-14 év: 18-22/perc 14 év felett: 14- 18/perc | |
| Normál légzési frekvencia éber gyermekeknél: Életkor Normál érték 2 hónap < 60/perc 2-12 hónap < 50/perc 1-5 év < 40/perc 6-8 év < 30/perc | ||||||
| 7 | Légzési segédizmok és suprasternális behúzódás | általában nem | általában igen | általában igen | paradox thoraco- abdominális mozgás | |
| 8 | Sípolás | mérsékelt, gyakran csak a kilégzés végén | hangos | általában hangos | sípolás hiánya | |
| 9 | Pulzus/perc | < 100 | 100-120 | > 120 | bradycardia | |
| Normál pulzusfrekvencia gyermekeknél: Életkor Normál érték 2-12 hónap < 160/perc 1- 2 év < 120/perc 2- 8 év < 110/perc | ||||||
| 10 | Pulzus paradoxus | nincs < 10 Hgmm | jelen lehet 10-25 Hgmm | gyakran felnőtt: > 25 Hgmm gyermek: 20-40 Hgmm | hiánya jelzi a légzőizmok kifáradását | |
| 11 | Hörgtágító utáni PEF a kívánt vagy az egyéni legjobb érték %-ában | > 80% | 60-80% | < 60% (felnőtt: < 100 l/min) vagy a válasz tartama < 2 h | ||
| 12 | PaO2 | normális, általában nem kell vizsgálni | >= 60 Hgmm | < 60 Hgmm cyanosis lehetséges | ||
| 13 | PaCO2 | < 45 Hgmm | < 45 Hgmm | >= 45 Hgmm légzési elégtelenség lehetséges | |
| 14 | SaO2 | > 95% | 91-95% | <= 90% | |
| A hypercapnia (hypoventilláció) fiatal gyermekekben könnyebben kialakul, mint serdülőkben és felnőttekben. | |||||
3.8. A következő tényezők bármelyikének megléte esetén - az exacerbáció súlyosságától függetlenül indokolt a hospitalizáció:
3.8.1. súlyos, életet veszélyeztető asthmás roham az anamnézisben
3.8.2. egy éven belüli kórházi kezelés súlyos exacerbáció miatt
3.8.3. gyakori hörgtágító-használat
3.8.4. pszichoszociális problémák (a tünetek nem megfelelő értékelése, nem megfelelően együttműködő beteg/szülő).
3.9. Az asthma bronchiale gyógyszeres kezelése kontrollfokhoz történő igazításának algoritmusa
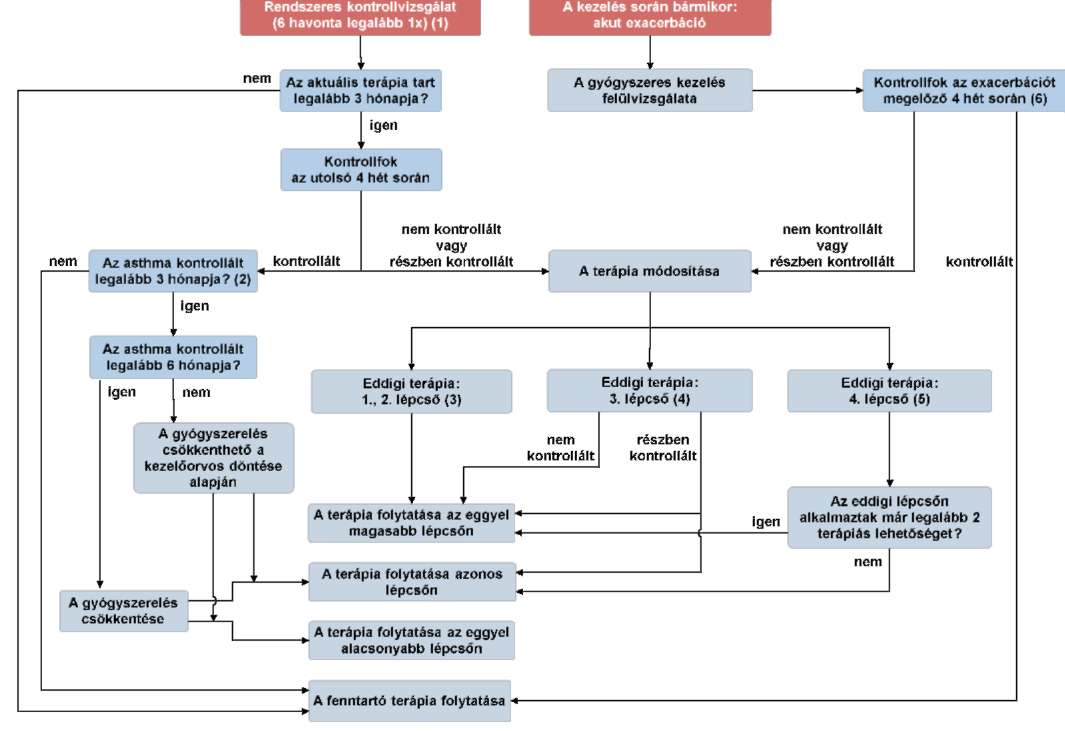
A gyógyszeres kezelés kontrollfokhoz történő igazításának algoritmusában (3.9. pont) szereplő döntések tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) Minden betegnek 6 havonta legalább egyszer részt kell vennie szakorvosi kontrollvizsgálaton.
(2) Ha a legalább 3 hónapja alkalmazott gyógyszeres kezeléssel az asthma legalább 3 hónapja kontrollált, a kezelőorvos döntése alapján meg lehet kísérelni a gyógyszerelés csökkentését.
Ha az asthma legalább 6 hónapja kontrollált, meg kell kísérelni a gyógyszerelés csökkentését.
A gyógyszerelés csökkenthető a dózis csökkentésével vagy egy gyógyszer elhagyásával. Ennek megfelelően a terápia folytatható az azonos vagy az eggyel alacsonyabb lépcsőn.
A 2. lépcsőn a fenntartó gyógyszerelés akkor hagyható el teljesen, ha az asthma legalább 1 éve kontrollált.
(3) Ha az 1. vagy a 2. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, az eggyel magasabb lépcsőn folytatható a kezelés.
(4) Ha a 3. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. lépcsőn folytatható a kezelés. Ha az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, a kezelőorvos döntése szerint vagy a 4. lépcsőn vagy a 3. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(5) Ha a 4. lépcső szerinti, legalább 2 különböző, egyenként legalább 3 hónapig alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, és az 5. lépcső feltételei teljesülnek, az 5. lépcsőn folytatható a kezelés. Ha a 4. terápiás lépcsőn még nem alkalmaztak legalább 2 különböző, egyenként legalább 3 hónapig tartó gyógyszeres kezelést, a 4. lépcsőn folytatható a kezelés.
(6) Exacerbáció esetén meg kell állapítani az exacerbációt közvetlenül megelőző 4 hetes időszakra vonatkozó kontrollfokot. Ha a megelőző 4 hét során az asthma kontrollált volt, úgy az exacerbációt követően a korábbi fenntartó gyógyszeres kezelés folytatandó. Ha a megelőző 4 hét során az asthma nem kontrollált vagy részben kontrollált volt, úgy az exacerbációt követően a (3), (4), (5) pont szerint fokozható a gyógyszeres kezelés.
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket. A legfontosabb ellenőrzési sarokpontok a következők:
4.1. Az asthma bronchiale diagnózisának felállítása az előírt módon történt-e (különös tekintettel a légzésfunkciós vizsgálatra, az allergiás bőrpróba és a specifikus IgE-meghatározás feltételeire)?
4.2. A beteg a kórelőzmény és a kontrollfok alapján szükséges terápiás lépcső szerinti gyógyszeres kezelést kapja-e?
4.3. Terápiás lépcső váltása, valamint terápia lépcsőn belüli váltása esetén valóban nem volt-e elérhető a kontroll az adekvát terápia megfelelő alkalmazásával?
4.4. A kontroll elérése és fennállása esetén történt-e érdemi próbálkozás a gyógyszerelés csökkentésére?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. azon betegek arányának alakulása, akiknél a finanszírozási eljárásrend szerinti diagnosztikus és terápiás utak a kapcsolódó kritériumokkal együtt maradéktalanul megvalósulnak,
5.2. az asthma bronchiale ellátására fordított finanszírozási összegek ellátási formák szerinti alakulása,
5.3. az asthma bronchiale gyógyszeres kezelésére fordított ártámogatási összegek gyógyszercsoportok szerinti alakulása.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1 Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | J45 | Asthma bronchiale |
| 3 | J46H0 | Status asthmaticus |
6.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 17021 | Intracutan allergia próba, azonnali reakció |
| 3 | 17071 | Légúti aspecifikus bronchiális provokáció |
| 4 | 17072 | Légúti allergia provokáció, specifikus antigénnel |
| 5 | 17073 | Fizikai terhelés hatásának vizsgálata a hörgőkre |
| 6 | 17102 | Spirometria |
| 7 | 17191 | Dohányzás leszokás támogatás - paciens vizsgálat |
| 8 | 17192 | Dohányzás leszokás támogatás - leszokási vizit |
| 9 | 17193 | Dohányzás leszokás támogatás - kilégzett levegő szénmonoxid mértékének a meghatározása |
| 10 | 17194 | Csoportos dohányzás leszokás támogatása |
| 11 | 21202 | Vérgáz analízis |
| 1 | A | B |
| OENO | OENO megnevezése | |
| 12 | 2678E | Allergén specifikus IgE meghatározása |
| 13 | 31310 | Mellkasfelvétel, AP/PA |
| 14 | 31311 | Mellkasfelvétel, oldalirányú |
| 15 | 31312 | Mellkasfelvétel, kétirányú |
| 16 | 31380 | Mellkasfelvétel, célzott |
| 17 | 3521A | Perfúziós tüdőszcintigráfia |
| 18 | 3521B | Inhalációs tüdőszcintigráfia Tc-mal jelzett farmakonnal |
| 19 | 40060 | Mellkas-szűrővizsgálat |
| 20 | 87510 | Inhalációs terápia gyógyszerrel vagy gyógynövénnyel |
| 21 | 87600 | Oxigén terápia |
| 22 | 89442 | Pulzoxymetria |
6.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 04M 1320 | Légzőrendszeri betegségek légzéstámogatással |
| 3 | 04M 144B | Asthma, bronchitis, egyéb krónikus obstruktív betegségek 18 év alatt |
| 4 | 04S 144C | Status asthmaticus és egyéb légúti betegségek sürgősségi ellátása |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezése |
| 2 | R03 | Obstruktív légúti betegségekre ható szerek |
| 3 | H02AB04 | Metilprednizolon |
| 4 | H02AB06 | Prednizolon |
6.5. Releváns ISO kódok
| A | B | |
| 1 | ISO | ISO megnevezése |
| 2 | 04 03 06 03 03 | Ultrahangos inhalátorok |
| 3 | 04 03 06 06 03 | Kompresszoros inhalátorok |
| 4 | 04 03 27 03 03 | Beszívási, illetve kifújási ellenállást képező maszkok |
| 5 | 04 03 30 | Légzésmérők |
| 6 | 04 03 33 | Egyéb légzésgyógyászati eszközök |
7. Fogalmak, rövidítések
GINA: Global Initiative for Asthma
OEP: Országos Egészségbiztosítási Pénztár
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy (terápiás napok)
NTK: Napi terápiás költség
FEV: Forced exspiratory volume (erőltetett kilégzési térfogat)
FEV1: Forced exspiratory volume in one second (erőltetett kilégzési térfogat 1 másodperc alatt)
FVC: Forced vital capacity (erőltetett vitálkapacitás)
PEF: Peak exspiratory flow (kilégzési csúcsáramlás)
IC: Inspiratory capacity (belégzési kapacitás)
IVC: Inspiratory vital capacity (belégzési vitálkapacitás)
EVC: Exspiratory vital capacity (kilégzési vitálkapacitás)
BHR: Bronchiális hiperreaktivitás
SABA: Short-acting β2-agonist (rövid hatású β2-agonista)
LABA: Long-acting β2-agonist (hosszú hatású β2-agonista)
RABA: Rapid-acting β2-agonist (gyors hatású β2-agonista)
SAMA: Short-acting muscarinic antagonist (rövid hatású muszkarinerg-antagonista)
LAMA: Long-acting muscarinic antagonist (hosszú hatású muszkarinerg-antagonista)
ICS: Inhaled corticosteroid (inhalációs kortikoszteroid)
SCS: Szisztémás kortikoszteroid
LTRA: Leukotrién-receptor-antagonista
Teofillin SR: Hosszú hatású teofillin
NIV: Nem invazív gépi lélegeztetés
MDI: Metered dose inhaler (adagolószelepes aeroszol)
DPI: Dry powder inhaler (szárazpor-inhalátor)
GYSE: Gyógyászati segédeszköz"
39. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"36. melléklet a 31/2010. (V. 13.) EüM rendelethez
A krónikus obstruktív tüdőbetegség (COPD) diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Emphysema (BNO: J43)
Egyéb idült, obstruktív tüdőbetegség (BNO: J44)
2. A kórkép leírása
A COPD jórészt a dohányzás által okozott kórkép jelentős extrapulmonális hatásokkal. A betegség pulmonális komponense rendszerint progresszív jellegű, túlnyomóan irreverzibilis légúti szűkületet jelent. Gyakori az exacerbáció, ami a tünetek (nehézlégzés, köhögés, köpetürítés) normális napi ingadozásán túli változásával járó, gyorsan fellépő állapotrosszabbodást jelent. Az exacerbációk jelentős része infekciós etiológiájú. A COPD tünetei reagálhatnak a gyógyszeres és egyéb terápiákra, a rendszeresen alkalmazott megfelelő fenntartó kezelés javítja a betegséggel kapcsolatos életminőséget, csökkenti az exacerbációk gyakoriságát, de a kezelések a légúti obstrukcióra csak korlátozott hatással vannak.
A fejlett ipari országokban a COPD a felnőtt lakosság 4-7%-át érinti, a 40 év felettiek körében a prevalencia 5-10%. Magyarországon a nyilvántartott betegek száma 2012-ben 169 000 volt, a tényleges betegszám azonban legalább 500-600 ezerre becsülhető.
A jelen finanszírozási eljárásrend hatálya a stabil COPD és az akut exacerbációk diagnosztikájára, valamint gyógyszeres és oxigénkezelésére terjed ki. Nem terjed ki az eljárásrend hatálya az infektív eredetű exacerbációk antibiotikus kezelésére, amely tekintetben az egyébként irányadó pulmonológiai és infektológiai szakmai ajánlások szerint szükséges eljárni. Nem terjed ki továbbá az eljárásrend hatálya a lélegeztetésre, a sebészi kezelésre és a rehabilitációra.
A COPD korszerű kezelése a dohányzás abbahagyásán, a korszerű gyógyszeres kezelésen és a megfelelő segédeszközökkel támogatott légzőszervi rehabilitáción alapul.
3. A finanszírozás rendje, finanszírozási algoritmus
3.1. A COPD diagnosztikájának algoritmusa
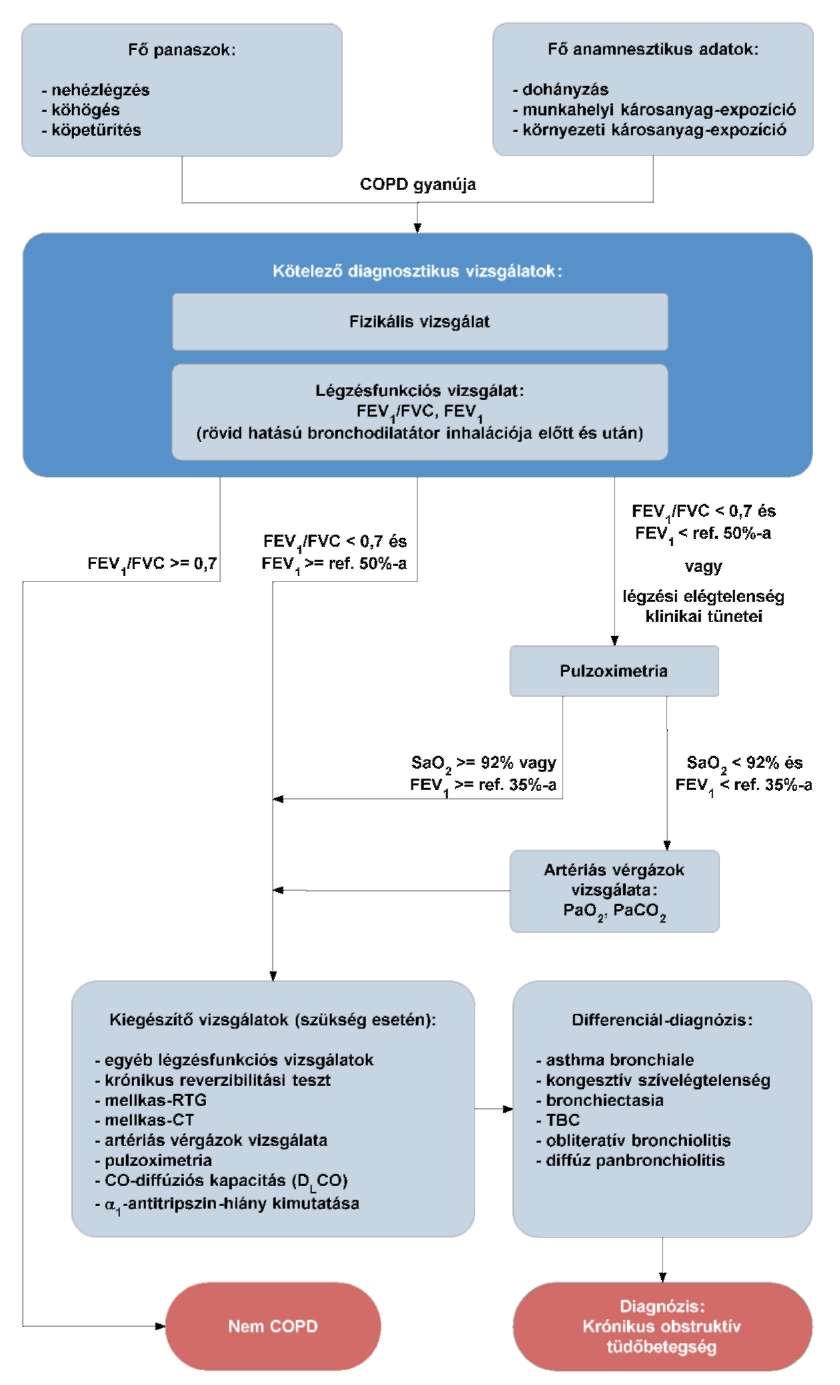
3.1.1. A légúti szűkület GOLD szerinti osztályozása a bronchodilatátor alkalmazása után mért FEV1 értékek alapján
| A | B | C | |
| 1 | GOLD szerinti osztály | Súlyossági fokozat | Légzésfunkciós paraméter |
| 2 | GOLD1 | Enyhe | FEV1/FVC < 0,7 |
| 3 | FEV1 ≥ ref. 80%-a | ||
| 4 | GOLD2 | Közepesen súlyos | FEV1/FVC < 0,7 |
| 5 | ref. 50%-a ≤ FEV1 < ref. 80%-a | ||
| 6 | GOLD3 | Súlyos | FEV1/FVC < 0,7 |
| 7 | ref. 30%-a ≤ FEV1 < ref. 50%-a | ||
| 8 | GOLD4 | Nagyon súlyos | FEV1/FVC < 0,7 |
| 9 | FEV1 < ref. 30%-a |
3.1.2. A beteg csoportba sorolása a GOLD-osztályozás, az exacerbáció kockázata és a tünetek alapján
| A | B | C | D | E | F | |
| 1 | Csoport | Jellemzők | Légzésfunkciós osztály | Exacerbációk száma évente | mMRC | CAT |
| 2 | A | alacsony kockázat, kevesebb tünet | GOLD 1-2 | ≤1 | 0-1 | <10 |
| 3 | B | alacsony kockázat, több tünet | GOLD 1-2 | ≤1 | ≥2 | ≥10 |
| 4 | C | magas kockázat, kevesebb tünet | GOLD 3-4 | ≥2 | 0-1 | <10 |
| 5 | D | magas kockázat, több tünet | GOLD 3-4 | ≥2 | ≥2 | ≥10 |
3.1.3. A beteg csoportba sorolása a GOLD-osztályozás, az exacerbáció kockázata és a tünetek alapján
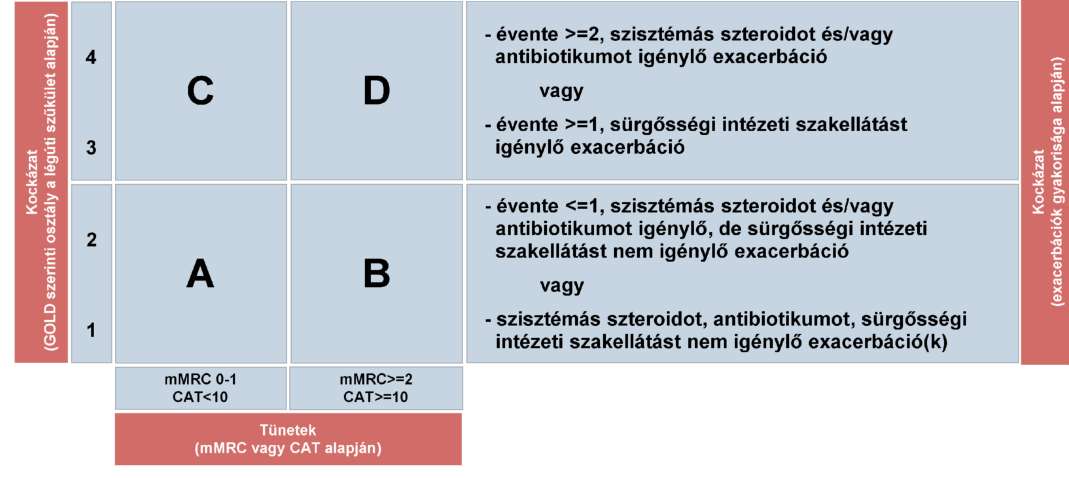
A beteg "C" vagy "D" csoportba sorolásához az exacerbációk gyakorisága szerinti feltétel akkor teljesül, ha legalább egy feltétel teljesül az alábbiak közül:
- évente legalább 2, szisztémás szteroidot, illetve antibiotikumot igénylő exacerbáció,
- évente legalább 1, sürgősségi intézeti szakellátást igénylő exacerbáció.
Amennyiben a GOLD szerinti légzésfunkciós osztály és az exacerbáció kockázata alapján a beteg különböző csoportokba sorolható, úgy a GOLD-osztály és az exacerbációs kockázat közül az az irányadó, amelyik alapján a beteg a súlyosabb csoportba sorolható.
3.2. A COPD akut exacerbációja diagnosztikájának algoritmusa
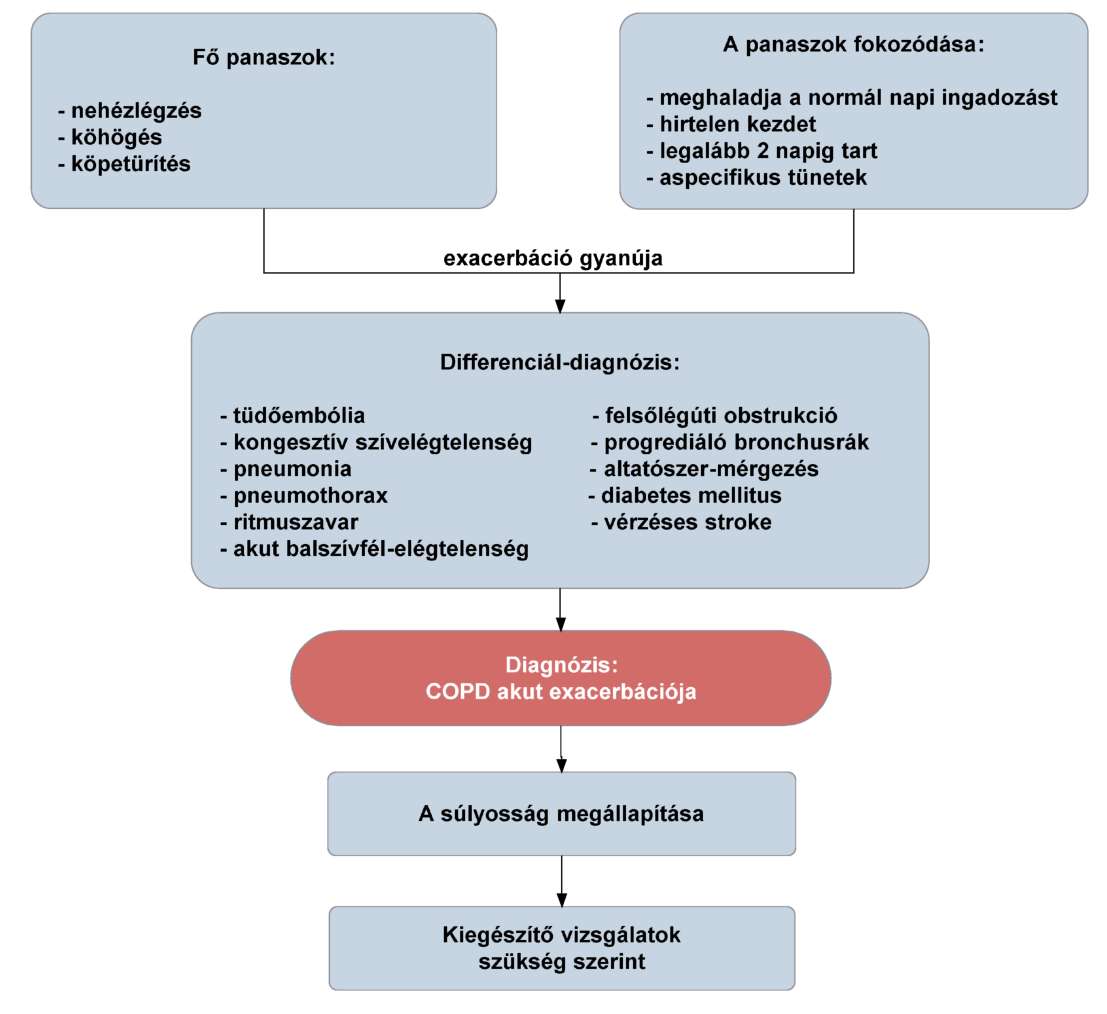
3.2.1. Az akut exacerbáció súlyosságának megítélésében szerepet játszó szempontok
| A | B | |
| 1 | Kórtörténet | A súlyosság jelei |
| 2 | FEV1 súlyossága | Légzési segédizmok használata |
| 3 | Új vagy rosszabbodó tünetek időtartama | Paradox mellkasmozgás |
| 4 | Előző epizódok száma (exacerbációk és hospitalizációk) | Rosszabbodó vagy újonnan fellépő centrális cianózis |
| 5 | Komorbiditás | Perifériás ödéma megjelenése |
| 6 | Jelenlegi terápiás rezsim | Hemodinamikai instabilitás |
| 7 | Jobbszívfél-elégtelenség jelei |
4. A stabil COPD gyógyszeres kezelésének általános algoritmusa
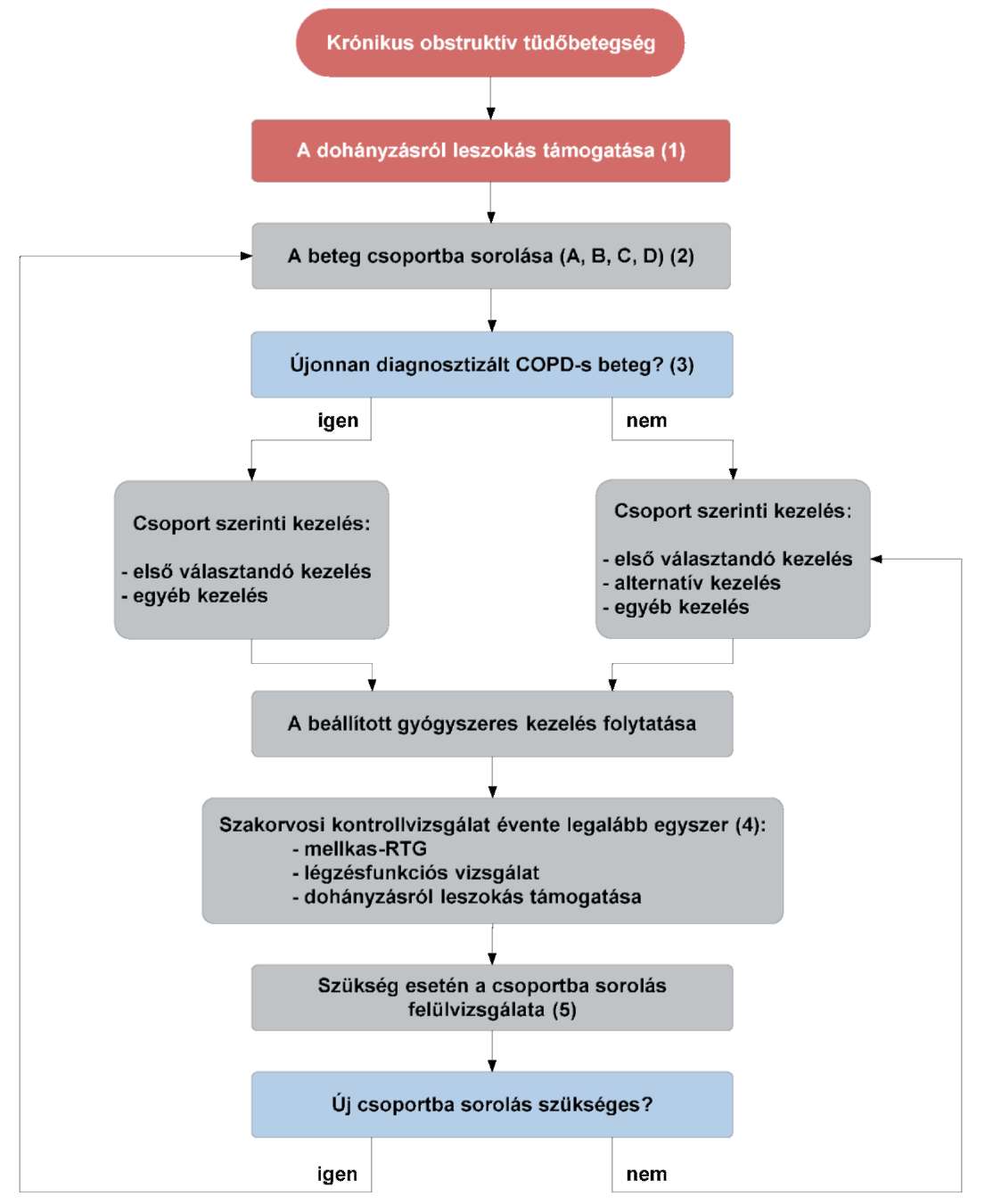
4.1. A stabil COPD kezelésében választható hatóanyagcsoportok a beteg csoportja szerint
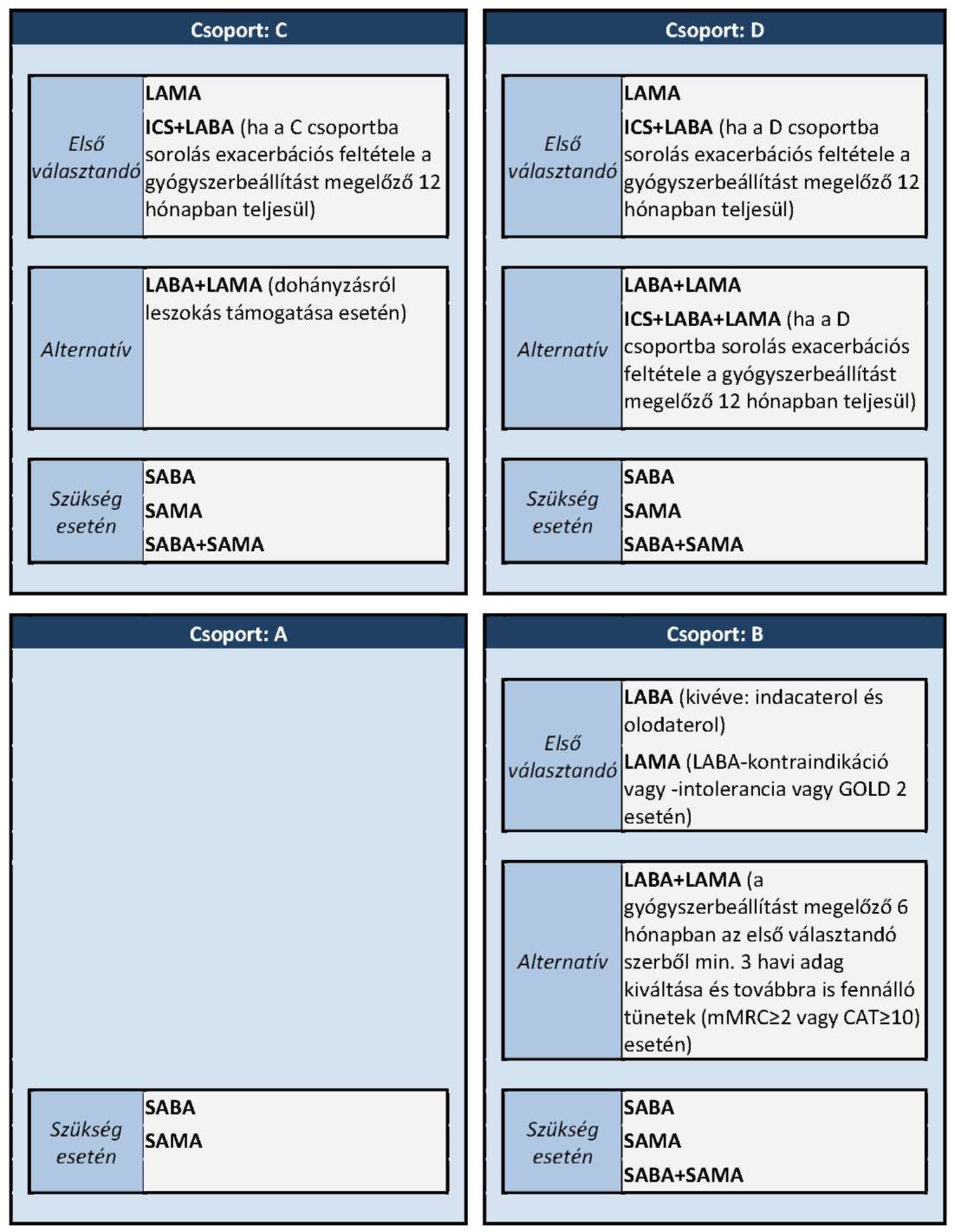
4.2. A stabil COPD gyógyszeres kezelésének algoritmusában (4. és 4.1. pont) szereplő feltételeket az alábbiakban részletezzük:
4.2.1. Amennyiben a beteg dohányzik, a dohányzásról leszokás támogatásáról szóló mindenkor hatályos szakmai irányelv szerint támogatni kell őt a dohányzás abbahagyásában.
4.2.2. A GOLD-osztályozás, az exacerbáció kockázata és a tünetek alapján szükséges a beteget csoportba sorolni. A csoportba sorolás konkrét paramétereit a 3.1.1., a 3.1.2. és a 3.1.3. pont tartalmazza.
4.2.3. Az egyes csoportokhoz tartozó gyógyszerválasztási feltételek szerint a beteg részére ki kell választani a csoportja szerinti valamely gyógyszeres kezelést, figyelembe véve, hogy újonnan diagnosztizált betegről vagy már gyógyszeres kezelés alatt álló betegről van szó.
4.2.4. Minden betegnek évente legalább egyszer részt kell vennie szakorvosi kontrollvizsgálaton, amelyhez kapcsolódóan mellkas-röntgen- és légzésfunkciós vizsgálatot kell végezni. Amennyiben a beteg dohányzik, a dohányzásról leszokás támogatásáról szóló mindenkor hatályos szakmai irányelv szerint támogatni kell őt a dohányzás abbahagyásában.
4.2.5. A kezelés során szükség esetén - a GOLD-osztályozás, az exacerbáció kockázata és a tünetek alapján - a beteg csoportba sorolása felülvizsgálható, és szükség esetén a beteg új csoportba sorolható.
4.3. Új beteg gyógyszeres kezelését a csoportja szerinti első választandó kezeléssel kell megkezdeni. Alternatív kezelés az alábbi esetekben alkalmazható:
4.3.1. ha az első választandó kezeléssel nem érhető el megfelelő terápiás eredmény,
4.3.2. ha a már gyógyszeres kezelés alatt álló beteget új csoportba sorolják,
4.3.3. ha az első választandó kezelés gyógyszere kontraindikált, vagy vele szemben intolerancia lép fel.
4.4. Ha a már gyógyszeres kezelés alatt álló beteget új csoportba sorolják, első választandó kezelés vagy alternatív kezelés alkalmazható.
4.5. Valamennyi csoportban szükség szerint alkalmazhatók a csoporton belül külön meghatározott rövid hatású hörgőtágítók.
4.6. "A" csoport:
- Szükség szerint alkalmazhatók:
- SABA,
- SAMA.
4.7. "B" csoport:
- Első választandó kezelés:
- LABA (kivéve: indacaterol és olodaterol),
- LAMA. A LAMA akkor választható, ha a LABA kontraindikált vagy vele szemben intolerancia lép fel vagy a légzésfunkciós vizsgálat alapján a beteg a GOLD 2 osztályba tartozik.
- Alternatív kezelés:
- LABA+LAMA. A LABA+LAMA akkor választható, ha a gyógyszerbeállítást megelőző 6 hónapban a beteg a "B" csoport első választandó gyógyszeréből legalább 3 havi adagot kiváltott, és ennek ellenére a tünetek továbbra is jelentősek (mMRC≥2 vagy CAT≥10)
- Szükség szerint alkalmazhatók:
- SABA,
- SAMA,
- SABA+SAMA.
4.8. "C" csoport:
- Első választandó kezelés:
- LAMA,
- ICS+LABA. Az ICS+LABA akkor választható, ha a "C" csoportba sorolásnak az exacerbációk gyakorisága szerinti feltétele a gyógyszerbeállítást megelőző 12 hónapban teljesül (évente legalább 2, szisztémás szteroidot, illetve antibiotikumot igénylő exacerbáció vagy évente legalább 1, sürgősségi intézeti szakellátást igénylő exacerbáció).
- Alternatív kezelés:
- LABA+LAMA. Amennyiben a beteg dohányzik, úgy a LABA+LAMA akkor választható, ha a beteg részesült a dohányzásról leszokást támogató szakellátásban a dohányzásról leszokás támogatásáról szóló mindenkor hatályos szakmai irányelv szerint.
- Szükség szerint alkalmazhatók:
- SABA,
- SAMA,
- SABA+SAMA.
4.9. "D" csoport:
- Első választandó kezelés:
- LAMA,
- ICS+LABA. Az ICS+LABA akkor választható, ha a "D" csoportba sorolásnak az exacerbációk gyakorisága szerinti feltétele a gyógyszerbeállítást megelőző 12 hónapban teljesül (évente legalább 2, szisztémás szteroidot, illetve antibiotikumot igénylő exacerbáció vagy évente legalább 1, sürgősségi intézeti szakellátást igénylő exacerbáció).
- Alternatív kezelés:
- LABA+LAMA,
- ICS+LABA+LAMA. Az ICS+LABA+LAMA akkor választható, ha a "D" csoportba sorolásnak az exacerbációk gyakorisága szerinti feltétele a gyógyszerbeállítást megelőző 12 hónapban teljesül (évente legalább 2, szisztémás szteroidot, illetve antibiotikumot igénylő exacerbáció vagy évente legalább 1, sürgősségi intézeti szakellátást igénylő exacerbáció).
- Szükség szerint alkalmazhatók:
- SABA,
- SAMA,
- SABA+SAMA.
5. A COPD akut exacerbációja gyógyszeres kezelésének algoritmusa
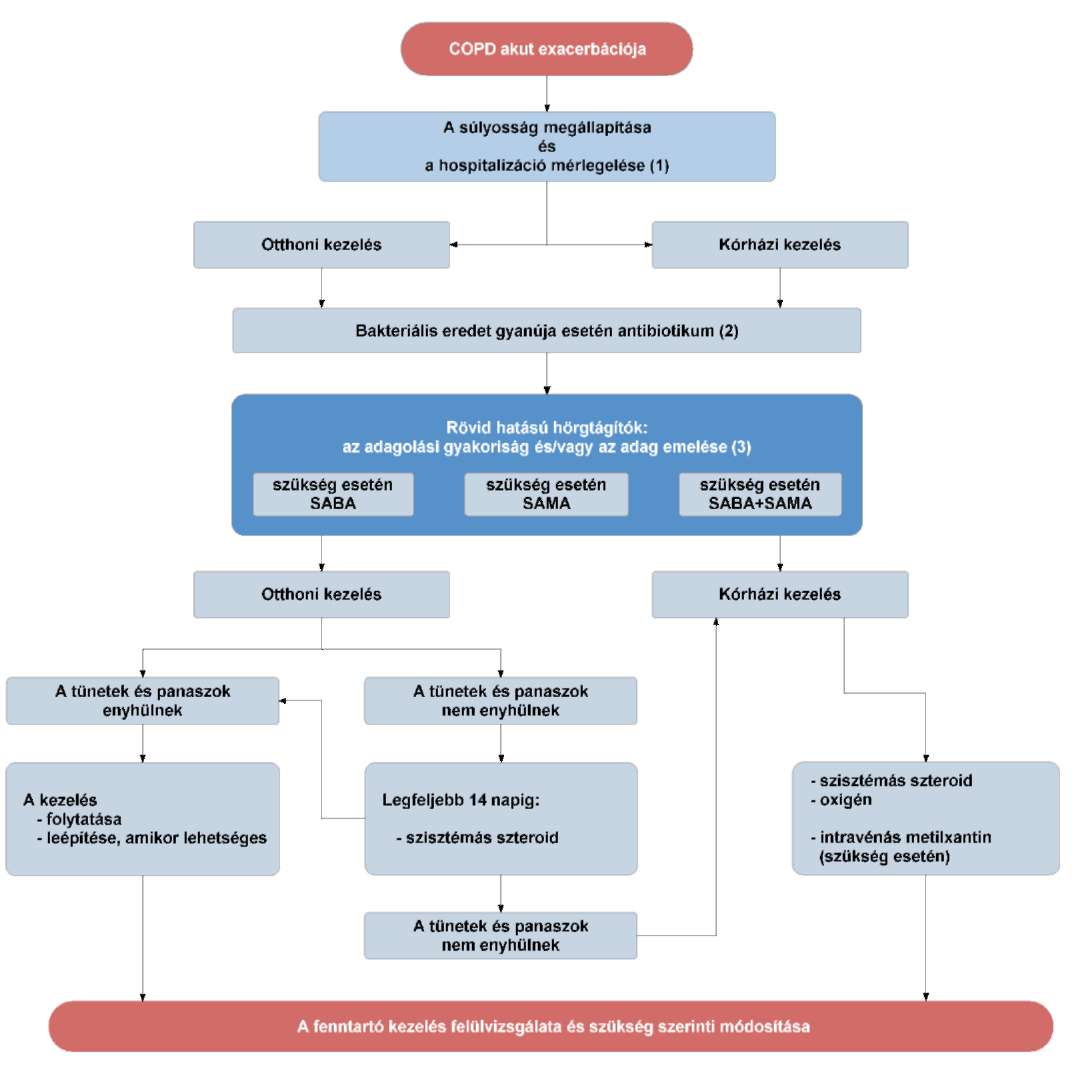
5.1. A COPD akut exacerbációja gyógyszeres kezelésének algoritmusában (5 pont) szereplő egyes terápiás lépcsők tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
5.1.1. Az akut exacerbáció súlyosságának megállapítása és döntés a hospitalizációról. A súlyosság megállapításának paramétereit a 3.2.1. pont tartalmazza.
5.1.2. A finanszírozási eljárásrend nem fogalmaz meg specifikus előírást az antibiotikus kezelésre vonatkozóan. Az antibiotikus kezelésre és a konkrét készítmény megválasztására az egyébként irányadó pulmonológiai és infektológiai szakmai szabályokat kell alkalmazni.
5.1.3. A rövid hatású hörgtágítók adagolási gyakorisága, illetve adagja emelhető. Szükség esetén SABA, SAMA, valamint SABA+SAMA használható.
6. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket. A legfontosabb ellenőrzési sarokpontok a következők:
6.1. Elvégezték-e a szükséges légzésfunkciós vizsgálatokat mind a diagnózis, mind a terápia során?
6.2. Amennyiben a beteg dohányzik, a dohányzásról leszokás támogatásáról szóló mindenkor hatályos szakmai irányelv szerint támogatták-e őt a dohányzás abbahagyásában?
6.3. A beteg a tényleges csoportjához (A, B, C, D) tartozó gyógyszeres kezelést kapja-e?
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. azon betegek arányának alakulása, akiknél a finanszírozási eljárásrend szerinti diagnosztikus és terápiás utak a kapcsolódó kritériumokkal együtt maradéktalanul megvalósulnak,
7.2. a COPD ellátására fordított finanszírozási összegek ellátási formák szerinti alakulása,
7.3. a COPD gyógyszeres kezelésére fordított ártámogatási összegek gyógyszercsoportok szerinti alakulása.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | J43 | Emphysema |
| 3 | J44 | Egyéb idült, obstruktív tüdőbetegség |
8.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 17073 | Fizikai terhelés hatásának vizsgálata a hörgőkre |
| 3 | 17102 | Spirometria |
| 4 | 17120 | Légúti ellenállás és vezetőképesség számítása |
| 5 | 17150 | Effectivitas ventillationis et perfusionis calc. |
| 6 | 17170 | Diffúziós kapacitásvizsgálat |
| 7 | 17191 | Dohányzás leszokás támogatás - paciens vizsgálat |
| 8 | 17192 | Dohányzás leszokás támogatás - leszokási vizit |
| 9 | 17193 | Dohányzás leszokás támogatás - kilégzett levegő szénmonoxid mértékének a meghatározása |
| 10 | 17194 | Csoportos dohányzás leszokás támogatása |
| 11 | 21202 | Vérgáz analízis |
| 12 | 31310 | Mellkasfelvétel, AP/PA |
| 13 | 31311 | Mellkasfelvétel, oldalirányú |
| 14 | 31312 | Mellkasfelvétel, kétirányú |
| 15 | 31380 | Mellkasfelvétel, célzott |
| 16 | 40060 | Mellkas-szűrővizsgálat |
| 17 | 43591 | Influenza elleni szezonális vaccinatio |
| 18 | 43593 | Tüdőgyulladás elleni vaccinatio |
| 19 | 87510 | Inhalációs terápia gyógyszerrel vagy gyógynövénnyel |
| 20 | 87600 | Oxigén terápia |
| 21 | 89442 | Pulzoxymetria |
| 22 | 93493 | Gyógyászati segédeszköz használatának betanítása |
| 23 | 94722 | Mellkasi gyógytorna, légzőtorna |
| 24 | 95320 | Rehabilitációs oktatás |
8.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 04M 1320 | Légzőrendszeri betegségek légzéstámogatással |
| 3 | 04M 1430 | Asthma, bronchitis, egyéb krónikus obstruktív betegségek 18 év felett, speciális kezeléssel |
| 4 | 04M 144B | Asthma, bronchitis, egyéb krónikus obstruktív betegségek 18 év alatt |
| 5 | 04M 1510 | Légzőrendszer egyéb betegségei |
| 6 | 04M 174Z | Légzőrendszeri fertőzések, gyulladások, súlyos társult betegséggel |
| 7 | 04M 175Z | Légzőrendszeri betegségek, egyéb fertőzések (kivéve: gümőkór polirezisztens kórokozóval) súlyos társult betegséggel |
8.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezése |
| 2 | R03 | Obstruktív légúti betegségekre ható szerek |
| 3 | H02AB04 | Metilprednizolon |
| 4 | H02AB06 | Prednizolon |
8.5. Releváns ISO kódok
| A | B | |
| 1 | ISO | ISO megnevezése |
| 2 | 04 03 06 03 03 | Ultrahangos inhalátorok |
| 3 | 04 03 06 06 03 | Kompresszoros inhalátorok |
| 4 | 04 03 18 06 03 | Oxi génkoncentrátorok |
| 5 | 04 03 27 03 03 | Beszívási, illetve kifújási ellenállást képező maszkok |
| 6 | 04 03 30 | Légzésmérők |
| 7 | 04 03 33 | Egyéb légzésgyógyászati eszközök |
9. Fogalmak, rövidítések
NICE: National Institute for Health and Clinical Excellence
GOLD: Global Initiative for Chronic Obstructive Lung Disease
OEP: Országos Egészségbiztosítási Pénztár
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy (terápiás napok)
NTK: Napi terápiás költség
COPD: Chronic obstructive pulmonary disease (krónikus obstruktív légúti betegség)
FEV: Forced exspiratory volume (erőltetett kilégzési térfogat)
FEV1: Forced exspiratory volume in one second (erőltetett kilégzési térfogat 1 másodperc alatt)
FVC: Forced vital capacity (erőltetett vitálkapacitás)
PEF: Peak exspiratory flow (kilégzési csúcsáramlás)
IC: Inspiratory capacity (belégzési kapacitás)
IVC: Inspiratory vital capacity (belégzési vitálkapacitás)
EVC: Exspiratory vital capacity (kilégzési vitálkapacitás)
CAT: COPD Assessment Test (COPD Állapotfelmérő Teszt)
mMRC: Modified Medical Research Council Questionnaire (a COPD-s beteg nehézlégzésének súlyosságát mérő teszt)
SABA: Short-acting β2-agonist (rövid hatású β2-agonista)
LABA: Long-acting β2-agonist (hosszú hatású β2-agonista)
RABA: Rapid-acting β2-agonist (gyors hatású β2-agonista)
SAMA: Short-acting muscarinic antagonist (rövid hatású muszkarin-antagonista)
LAMA: Long-acting muscarinic antagonist (hosszú hatású muszkarin-antagonista)
ICS: Inhaled corticosteroid (inhalációs kortikoszteroid)
SCS: Szisztémás kortikoszteroid
Teofillin SR: Hosszú hatású teofillin
NIV: Nem invazív gépi lélegeztetés
MDI: Metered dose inhaler (adagolószelepes aeroszol)
DPI: Dry powder inhaler (szárazpor-inhalátor)
BMI: Body mass index (testtömegindex)
LTOT: Long-term oxygen therapy (tartós oxigén-terápia)"
40. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"37. melléklet a 31/2010. (V. 13.) EüM rendelethez
Az asthma bronchiale diagnosztikája és gyógyszeres kezelése felnőttkorban finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Asthma bronchiale (BNO: J45)
Status asthmaticus (BNO: J46H0)
2. A kórkép leírása
Az asthma bronchiale a légutak krónikus gyulladásos megbetegedése. A patomechanizmus fő tényezői a gyulladás, a légutak strukturális átalakulása és a bronchiális hiperreaktivitás. A légutak obstrukcióval reagálnak nem specifikus stimulusokra. Klinikailag rendszeresen jelentkeznek nehézlégzéssel, mellkasi feszüléssel, köhögéssel járó epizódok leginkább éjszaka vagy kora reggel. A panaszok hátterében álló változó mértékű légúti szűkület spontán vagy megfelelő farmakoterápia hatására többnyire reverzibilis. Bármely súlyossági fokozatban felléphet exacerbáció, ami a jellemző tünetek (nehézlégzés, köhögés, sípoló légzés, mellkasi feszülés) fokozódása, illetve e fokozott tünetek kombinációja. Az asthma multifaktoriális etiológiájú kórkép, kialakulásában genetikai és környezeti tényezők játsszák a fő szerepet. Az európai országokban az asthma prevalenciája 5-10% körül mozog. Magyarországon a pulmonológiai szakellátásban mintegy 200 ezer beteget tartanak nyilván, az új megbetegedések száma évente 10-20 ezer. A betegség ellátása komoly terhet ró a betegre és a társadalomra egyaránt. Az asthma klinikai manifesztációi adekvát gyógyszeres kezeléssel és megfelelő gondozással jól kontrollálhatók, de maga a betegség nem gyógyítható.
A jelen finanszírozási eljárásrend hatálya a felnőttkori asthma bronchiale diagnosztikájára, valamint gyógyszeres kezelésére terjed ki.
3. A finanszírozás rendje, a finanszírozási algoritmus
3.1. Az asthma bronchiale diagnosztikájának algoritmusa
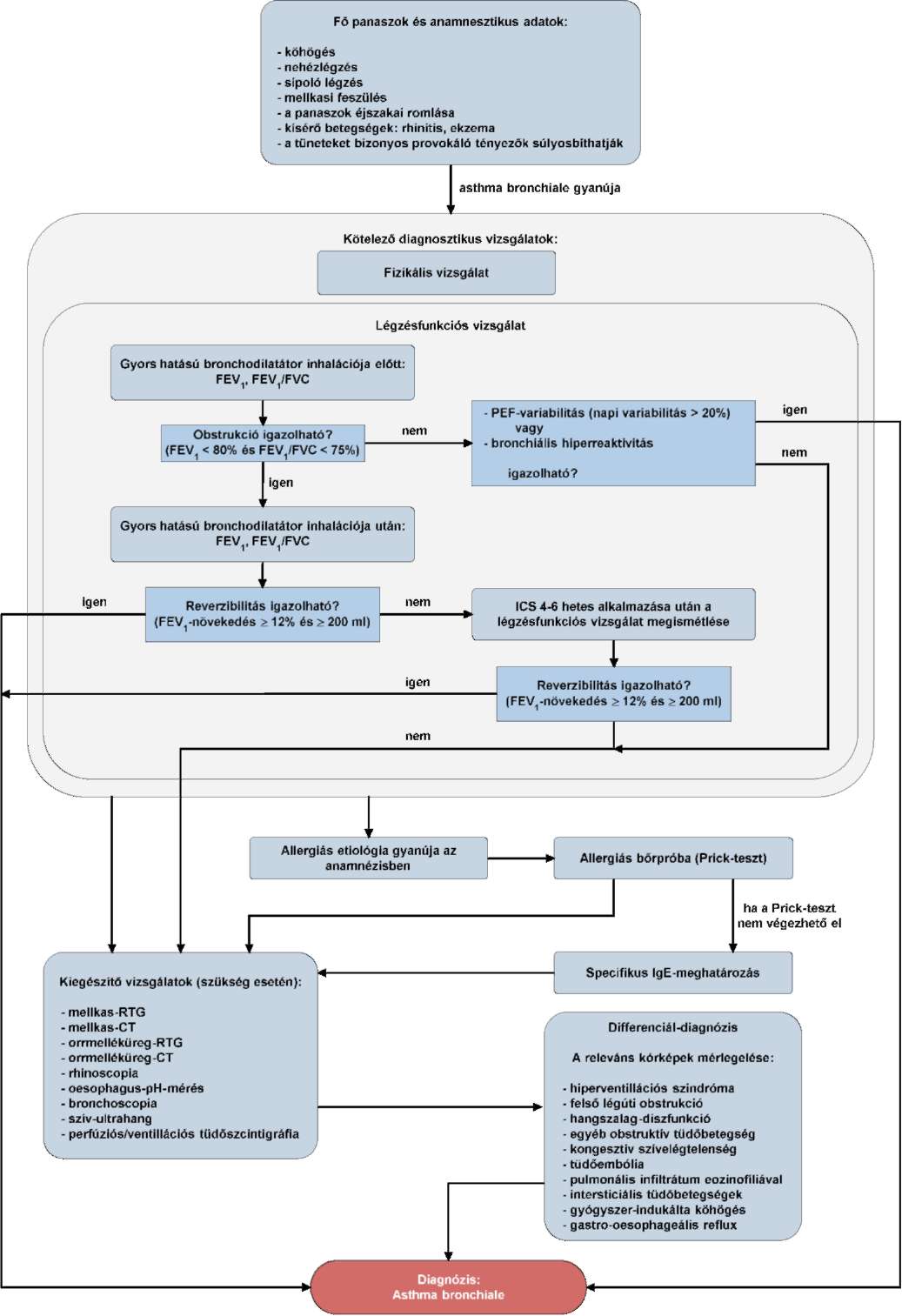
Szisztémás antihisztamin-kezelés alatt az allergiás bőrpróba helyett nem végezhető specifikus IgE-meghatározás. A szisztémás antihisztamin-kezelés felfüggesztése után 1 héttel az allergiás bőrpróba elvégezhető.
4. Az asthma bronchiale gyógyszeres kezelésének finanszírozási algoritmusa
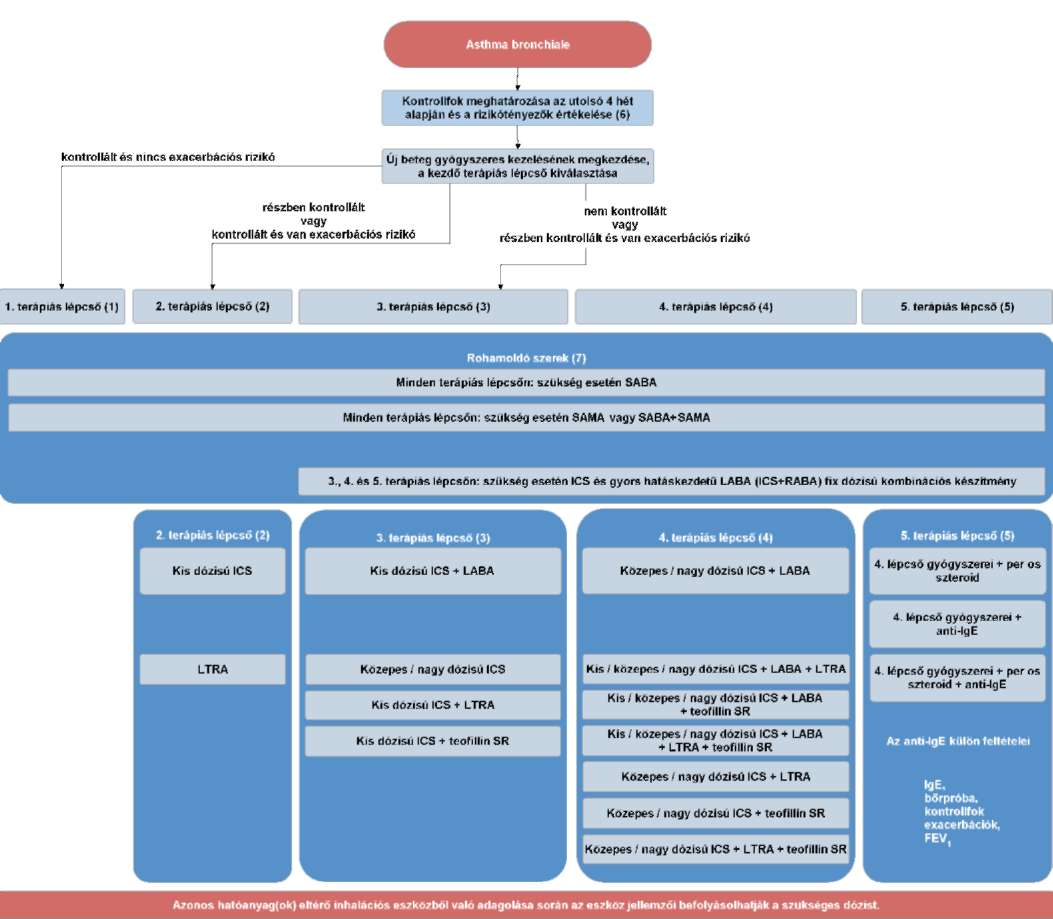
4.1. A gyógyszeres kezelés algoritmusában (4. pont) szereplő egyes terápiás lépcsők tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) 1. terápiás lépcső.
Rohamoldó szer alkalmazható szükség esetén, amelynek részletes szabályai a (7) pontban szerepelnek.
(2) 2. terápiás lépcső.
a) A választandó kezelés a kis dózisú ICS.
b) LTRA akkor választható az ICS helyett, ha az ICS kontraindikált vagy vele szemben intolerancia lép fel.
(3) 3. terápiás lépcső.
a) A preferált kezelés a kis dózisú ICS+LABA.
b) További választható kezelések:
- közepes/nagy dózisú ICS
- kis dózisú ICS+LTRA
- kis dózisú ICS+teofillin SR
c) Ha az a) és b) pontban meghatározott valamelyik - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, ismét választható az a) és b) pontban meghatározott valamelyik kezelés vagy a 4. terápiás lépcsőn folytatható a kezelés.
d) Ha az a) és b) pontban meghatározott valamelyik - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. terápiás lépcsőn folytatható a kezelés.
(4) 4. terápiás lépcső.
a) A preferált kezelés a közepes/nagy dózisú ICS+LABA.
b) További választható kezelések:
- kis/közepes/nagy dózisú ICS+LABA+LTRA
- kis/közepes/nagy dózisú ICS+LABA+teofillin SR
- kis/közepes/nagy dózisú ICS+LABA+LTRA+teofillin SR
- közepes/nagy dózisú ICS+LTRA
- közepes/nagy dózisú ICS+teofillin SR
- közepes/nagy dózisú ICS+LTRA+teofillin SR
c) Ha az a) pont szerinti - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált vagy nem kontrollált, választható a b) pontban meghatározott valamelyik kezelés vagy az 5. terápiás lépcsőn folytatható a kezelés.
d) Ha a b) pont szerinti - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált vagy nem kontrollált és az a) pont szerinti kezelést még nem alkalmazták legalább 3 hónapig, úgy választható az a) és b) pontban meghatározott valamelyik kezelés.
e) Ha a b) pont szerinti - legalább 3 hónapig tartó - kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált vagy nem kontrollált és az a) pont szerinti kezelést már alkalmazták legalább 3 hónapig, úgy választható a b) pontban meghatározott valamelyik kezelés vagy az 5. terápiás lépcsőn folytatható a kezelés.
(5) 5. terápiás lépcső.
f) A választható kezelések:
- a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal
- perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése anti-IgE-vel
- perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal és anti-IgE-vel
Az anti-IgE adásának további feltételei:
- IgE-szint > 76 NE/ml és az IgE-szint nem haladja meg az alkalmazási előírás szerinti maximális értéket
- perenniális inhalatív allergénnel szembeni pozitív bőrpróba vagy specifikus IgE kimutatása a szérumban
- szisztémás szteroid tartós alkalmazása ellenére az asthma nem kontrollált vagy nagy dózisú ICS+LABA alkalmazása ellenére gyakoriak a szisztémás szteroidot igénylő exacerbációk (≥ 4/év)
- FEV1 < ref. 80%-a
- az anti-IgE-kezelés megkezdését követően évente értékelni kell a kezelés hatását, és az anti-IgE-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő
(6) Újonnan diagnosztizált betegnél meg kell állapítani az asthma kontrollfokát az utolsó 4 hét alapján és a rizikótényezők fennállását vagy hiányát. A gyógyszeres kezelés a kontrollfokhoz és a rizikóbecsléshez igazodó terápiás lépcsőn kezdhető meg.
Új beteg gyógyszeres kezelését az 1. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma kontrollált és nincs exacerbációs rizikó.
Új beteg gyógyszeres kezelését a 2. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma részben kontrollált, vagy kontrollált és van exacerbációs rizikó.
Új beteg gyógyszeres kezelését a 3. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma nem kontrollált, vagy részben kontrollált és van exacerbációs rizikó.
(7) Rohamoldó szerek.
Minden terápiás lépcsőn (1., 2., 3., 4., 5.) használhatók szükség esetén.
a) A választandó kezelés a SABA.
b) Ha a SABA kontraindikált vagy vele szemben intolerancia lép fel, választható a SAMA vagy a SABA+SAMA.
A 3., 4. és 5. terápiás lépcsőn használhatók szükség esetén.
c) ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítmény. Amennyiben a beteg a 3., 4. vagy 5. terápiás lépcsőn ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítményt használ fenntartó terápiaként, és e készítmény alkalmazási előírásában a javallatok között szerepel a rohamoldóként történő, szükség szerinti alkalmazás is, úgy e készítmény - az alkalmazási előírásnak megfelelően - használható rohamoldó szerként is.
4.2. Amennyiben az alkalmazott hatóanyagú készítmény kontraindikált, vagy az alkalmazási előírás szerinti dózisban vele szemben intolerancia (tolerálhatatlan mellékhatás) lép fel, akkor azt úgy lehet tekinteni, mintha az érintett hatóanyagcsoporttal a megfelelő dózisban folytatott terápia - a megfelelő eredmény nélkül - megtörtént volna.
4.3. Az inhalációs szteroidok becsült ekvivalens napi adagjai
| A | B | C | D | |
| 1 | Hatóanyag | Alacsony napi dózis (µg) | Közepes napi dózis (µg) | Magas napi dózis (µg) |
| 2 | beclometason-dipropionát (CFC) | 200-500 | >500-1000 | >1000 |
| 3 | beclometason-dipropionát (HFA) | 100-200 | >200-400 | >400 |
| 4 | budesonid (DPI) | 200-400 | >400-800 | >800 |
| 5 | ciclesonid (HFA) | 80-160 | >160-320 | >320 |
| 6 | fluticason-propionát (DPI) | 100-250 | >250-500 | >500 |
| 7 | fluticason-propionát (HFA) | 100-250 | >250-500 | >500 |
| 8 | fluticason-propionát (Axahaler) | 50-125 | >125-250 | >250 |
| 9 | fluticason-furoát * | 100 | 100-200 | 200 |
Az ICS-ot tartalmazó kezelést elrendelő orvos feladata, hogy a dózisekvivalenciát a hatályos szakmai irányelv és az alkalmazási előírás alapján ellenőrizze, az előírt dózist pedig szükség esetén módosítsa.
* Naponta egyszer alkalmazandó, vilanterollal fix kombinációban.
4.4. Az asthma kontrollfok, valamint exacerbációs rizikótényezők szerinti osztályozása
| A | B | C | D | ||
| 1 | Az aktuális klinikai kontroll megállapítása 4 hetes időszak vonatkozásában | ||||
| 2 | Jellemző | Kontrollált (mindegyik igaz) | Részben kontrollált (bármelyik jellemző jelenléte esetén) | Nem kontrollált | |
| 3 | Nappali tünetek | nincs (≤ 2x/hét) | > 2x/hét | a részben kontrollált asthma legalább három jellemzőjének jelenléte * | |
| 4 | Fizikai aktivitás korlátozottsága | nincs | van | ||
| 5 | Éjszakai tünetek, felébredések | nincs | van | ||
| 6 | Rohamoldó iránti igény | nincs (≤ 2x/hét) | > 2x/hét | ||
| 7 | Légzésfunkció (PEF vagy FEV1) ** | normális | az elvárt érték vagy az ismert egyéni legjobb érték 80%-a alatt | ||
| Az asthma jövőbeli kockázatának felmérése: exacerbáció rizikója instabil asthma gyors légzésfunkció-vesztés gyógyszer-mellékhatások | |
| * Bármilyen exacerbáció esetén a beteg asthmája nem kontrollált, és felül kell vizsgálni a fenntartó kezelés megfelelőségét. ** Bronchodilatátor adása nélkül. | |
| 10 | Az exacerbáció rizikótényezői |
| 11 | Nem kontrollált asthmás tünetek |
| Gyakori SABA használat | |
| Elégtelen ICS kezelés, rossz adherencia vagy eszközhasználat | |
| Alacsony FEV1 érték (főleg, ha < 60%) | |
| Változékony csúcsáramlás | |
| Jelentősebb pszichológiai vagy szociális-gazdasági problémák | |
| Dohányzás | |
| Szenzitizáltság esetén allergén expozíció | |
| Társbetegségek: obezitás, rhinosinusitis, táplálékallergia | |
| Terhesség | |
| Asztma miatti intubáció vagy intenzív osztályos kezelés a kórelőzményben | |
| ≥ 1 súlyos exacerbáció az elmúlt 12 hónapban | |
4.5. Az exacerbáció súlyosság szerinti osztályozásának szempontjai
| A | B | C | D | E | |
| 1 | Klinikai paraméter | Súlyosság | |||
| enyhe | középsúlyos | súlyos | fenyegető légzésleállás | ||
| 2 | Nehézlégzés | nehézlégzés járásra képes feküdni | nehézlégzés beszédre inkább ül | nehézlégzés nyugalomban előrehajol | |
| 3 | Beszéd | mondatok | frázisok | szavak | |
| 4 | Éberség | izgatott lehet | általában izgatott | általában izgatott | aluszékony vagy zavart |
| 5 | Légzési frekvencia | emelkedett | emelkedett | gyakran > 30/perc | |
| 6 | Légzési segédizmok és suprasternális behúzódás | általában nem | általában igen | általában igen | paradox thoraco- abdominális mozgás |
| 7 | Sípolás | mérsékelt, gyakran csak a kilégzés végén | hangos | általában hangos | sípolás hiánya |
| 8 | Pulzus/perc | < 100 | 100-120 | > 120 | bradycardia |
| 9 | Pulzus paradoxus | nincs < 10 Hgmm | jelen lehet 10-25 Hgmm | gyakran > 25 Hgmm | hiánya jelzi a légzőizmok kifáradását |
| 10 | Hörgtágító utáni PEF a kívánt vagy az egyéni legjobb érték %-ában | > 80% | 60-80% | < 60% (< 100 l/min) vagy a válasz tartama < 2 h | |
| 11 | PaO2 | normális, általában nem kell vizsgálni | > = 60 Hgmm | < 60 Hgmm cyanosis lehetséges | |
| 12 | PaCO2 | < 45 Hgmm | < 45 Hgmm | >= 45 Hgmm légzési elégtelenség lehetséges | |
| 13 | SaO2 | > 95% | 91-95% | <= 90% | |
5. Az asthma bronchiale akut exacerbációja diagnosztikájának és gyógyszeres kezelésének algoritmusa
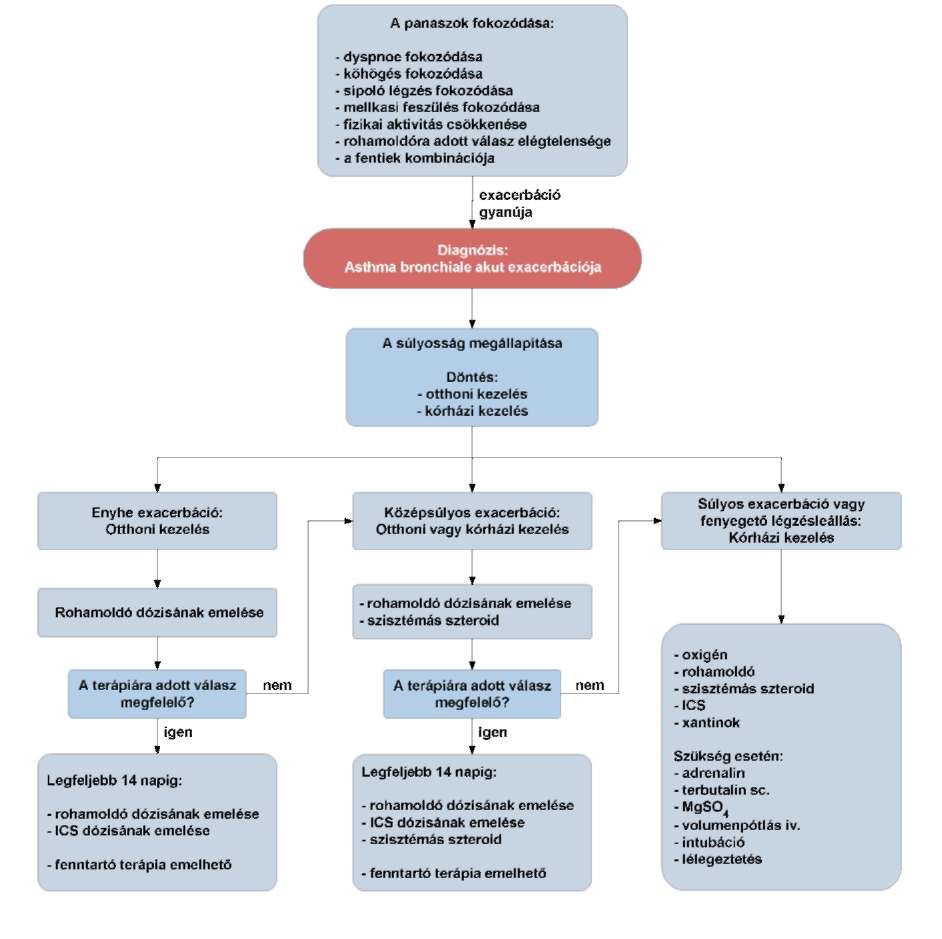
6. Az asthma bronchiale gyógyszeres kezelése kontrollfokhoz történő igazításának algoritmusa
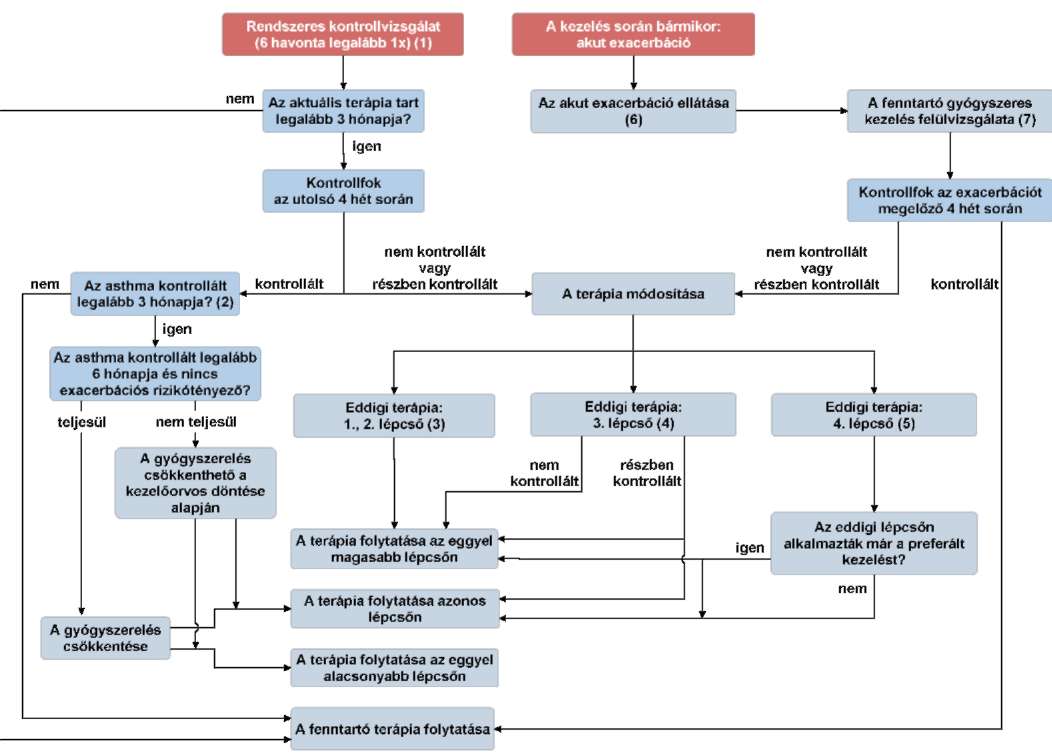
A gyógyszeres kezelés kontrollfokhoz történő igazításának algoritmusában szereplő döntések tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) Minden betegnek 6 havonta legalább egyszer részt kell vennie szakorvosi kontrollvizsgálaton.
(2) Ha a legalább 3 hónapja alkalmazott gyógyszeres kezeléssel az asthma legalább 3 hónapja kontrollált, a kezelőorvos döntése alapján meg lehet kísérelni a gyógyszerelés csökkentését.
Ha az asthma legalább 6 hónapja kontrollált és nincs exacerbációs rizikótényező, meg kell kísérelni a gyógyszerelés csökkentését.
A gyógyszerelés csökkenthető a dózis csökkentésével vagy egy gyógyszer elhagyásával. Ennek megfelelően a terápia folytatható az azonos vagy az eggyel alacsonyabb lépcsőn.
A 2. lépcsőn a fenntartó gyógyszerelés akkor hagyható el teljesen, ha az asthma legalább 1 éve kontrollált.
(3) Ha az 1. vagy a 2. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, az eggyel magasabb lépcsőn folytatható a kezelés.
(4) Ha a 3. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. lépcsőn folytatható a kezelés. Ha az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, a kezelőorvos döntése szerint vagy a 4. lépcsőn vagy a 3. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(5) Ha a 4. lépcső szerinti, legalább 3 hónapig alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, és a preferált kezelést (közepes/nagy dózisú ICS+LABA) már alkalmazták legalább 3 hónapig, a kezelőorvos döntése szerint vagy az 5. lépcsőn vagy a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés. Ha a 4. terápiás lépcsőn a preferált kezelést még nem alkalmazták legalább 3 hónapig, a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(6) Akut exacerbáció fellépése esetén annak ellátására külön szabályok vonatkoznak (az 5. pont szerinti ábra és a 4.5. pont szerinti táblázat).
(7) Akut exacerbáció kezelését és lezajlását követően felül kell vizsgálni a fenntartó gyógyszeres kezelést. E felülvizsgálat során meg kell állapítani az exacerbációt közvetlenül megelőző, az exacerbációtól még mentes 4 hetes időszakra vonatkozó kontrollfokot. Ha a megelőző 4 hét során az asthma kontrollált volt, úgy az exacerbációt követően a korábbi fenntartó gyógyszeres kezelés folytatandó. Ha a megelőző 4 hét során az asthma nem kontrollált vagy részben kontrollált volt, úgy az exacerbációt követően a (3), (4), (5) pont szerint fokozható a gyógyszeres kezelés.
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket. A legfontosabb ellenőrzési sarokpontok a következők:
7.1. Az asthma bronchiale diagnózisának felállítása az előírt módon történt-e (különös tekintettel a légzésfunkciós vizsgálatra, az allergiás bőrpróba és a specifikus IgE-meghatározás feltételeire)?
7.2. A beteg a kórelőzmény és a kontrollfok alapján szükséges terápiás lépcső szerinti gyógyszeres kezelést kapja-e?
7.3. Terápiás lépcső váltása, valamint terápia lépcsőn belüli váltása esetén valóban nem volt-e elérhető a kontroll az adekvát terápia megfelelő alkalmazásával?
7.4. A kontroll elérése és fennállása esetén történt-e érdemi próbálkozás a gyógyszerelés csökkentésére?
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. azon betegek arányának alakulása, akiknél a finanszírozási eljárásrend szerinti diagnosztikus és terápiás utak a kapcsolódó kritériumokkal együtt maradéktalanul megvalósulnak,
8.2. az asthma bronchiale ellátására fordított finanszírozási összegek ellátási formák szerinti alakulása,
8.3. az asthma bronchiale gyógyszeres kezelésére fordított ártámogatási összegek gyógyszercsoportok szerinti alakulása.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | J45 | Asthma bronchiale |
| 3 | J46H0 | Status asthmaticus |
9.2. Releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezése |
| 2 | 17021 | Intracutan allergia próba, azonnali reakció |
| 3 | 17071 | Légúti aspecifikus bronchiális provokáció |
| 4 | 17072 | Légúti allergia provokáció, specifikus antigénnel |
| 5 | 17073 | Fizikai terhelés hatásának vizsgálata a hörgőkre |
| 6 | 17102 | Spirometria |
| 7 | 17191 | Dohányzás leszokás támogatás - paciens vizsgálat |
| 8 | 17192 | Dohányzás leszokás támogatás - leszokási vizit |
| 9 | 17193 | Dohányzás leszokás támogatás - kilégzett levegő szénmonoxid mértékének a meghatározása |
| 10 | 17194 | Csoportos dohányzás leszokás támogatása |
| 11 | 21202 | Vérgáz analízis |
| 12 | 2678E | Allergén specifikus IgE meghatározása |
| 13 | 31310 | Mellkasfelvétel, AP/PA |
| 14 | 31311 | Mellkasfelvétel, oldalirányú |
| 15 | 31312 | Mellkasfelvétel, kétirányú |
| 16 | 31380 | Mellkasfelvétel, célzott |
| 17 | 3521A | Perfúziós tüdőszcintigráfia |
| 18 | 3521B | Inhalációs tüdőszcintigráfia Tc-mal jelzett farmakonnal |
| A | B | |
| 1 | OENO | OENO megnevezése |
| 19 | 40060 | Mellkas-szűrővizsgálat |
| 20 | 87510 | Inhalációs terápia gyógyszerrel vagy gyógynövénnyel |
| 21 | 87600 | Oxigén terápia |
| 22 | 89442 | Pulzoxymetria |
9.3. Releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezése |
| 2 | 04M 1320 | Légzőrendszeri betegségek légzéstámogatással |
| 3 | 04M 1430 | Asthma, bronchitis, egyéb krónikus obstruktív betegségek 18 év felett, speciális kezeléssel |
| 4 | 04S 144C | Status asthmaticus és egyéb légúti betegségek sürgősségi ellátása |
| 5 | 04M 174Z | Légzőrendszeri fertőzések, gyulladások, súlyos társult betegséggel |
| 6 | 04M 175Z | Légzőrendszeri betegségek, egyéb fertőzések (kivéve: gümőkór polirezisztens kórokozóval) súlyos társult betegséggel |
9.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezése |
| 2 | R03 | Obstruktív légúti betegségekre ható szerek |
| 3 | H02AB04 | Metilprednizolon |
| 4 | H02AB06 | Prednizolon |
9.5. Releváns ISO kódok
| A | B | |
| 1 | ISO | ISO megnevezése |
| 2 | 04 03 06 03 03 | Ultrahangos inhalátorok |
| 3 | 04 03 06 06 03 | Kompresszoros inhalátorok |
| 4 | 04 03 27 03 03 | Beszívási, illetve kifújási ellenállást képező maszkok |
| 5 | 04 03 30 | Légzésmérők |
| 6 | 04 03 33 | Egyéb légzésgyógyászati eszközök |
10. Fogalmak, rövidítések
GINA: Global Initiative for Asthma
OEP: Országos Egészségbiztosítási Pénztár
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy (terápiás napok)
NTK: Napi terápiás költség
FEV: Forced exspiratory volume (erőltetett kilégzési térfogat)
FEV1: Forced exspiratory volume in one second (erőltetett kilégzési térfogat 1 másodperc alatt)
FVC: Forced vital capacity (erőltetett vitálkapacitás)
PEF: Peak exspiratory flow (kilégzési csúcsáramlás)
IC: Inspiratory capacity (belégzési kapacitás)
IVC: Inspiratory vital capacity (belégzési vitálkapacitás)
EVC: Exspiratory vital capacity (kilégzési vitálkapacitás)
BHR: Bronchiális hiperreaktivitás
SABA: Short-acting β2-agonist (rövid hatású β2-agonista)
LABA: Long-acting β2-agonist (hosszú hatású β2-agonista)
RABA: Rapid-acting β2-agonist (gyors hatású β2-agonista)
SAMA: Short-acting muscarinic antagonist (rövid hatású muszkarinerg-antagonista)
LAMA: Long-acting muscarinic antagonist (hosszú hatású muszkarinerg-antagonista)
ICS: Inhaled corticosteroid (inhalációs kortikoszteroid)
SCS: Szisztémás kortikoszteroid
LTRA: Leukotrién-receptor-antagonista
Teofillin SR: Hosszú hatású teofillin
NIV: Nem invazív gépi lélegeztetés
MDI: Metered dose inhaler (adagolószelepes aeroszol)
DPI: Dry powder inhaler (szárazpor-inhalátor)
GYSE: Gyógyászati segédeszköz"
41. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"38. melléklet a 31/2010. (V. 13.) EüM rendelethez
Korai és helyileg kiterjedt (nem távoli áttétes) nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések
1.1. Rosszindulatú daganatos megbetegedések
1.1.1. Nem-kissejtes tüdő daganat
1.1.1.1. Korai és helyileg kiterjedt (nem távoli áttétes) nem-kissejtes tüdőrák
2. A kórkép leírása
Magyarország világelső a tüdőrák előfordulását és halálozási arányát tekintve. Évente körülbelül 7000 új eset kerül felfedezésre.
A betegek átlag életkora 55-70 év. Ritkán fordul elő 40 év alatt, ami a dohányzási szokásokkal is magyarázható, ugyanis a tüdőrák több évtizedes rendszeres dohányzás után alakul ki. Férfi női arány 1,5:1, de meg kell említeni, hogy míg a férfiaknál az előfordulás csökkenése figyelhető meg, addig a nők esetében ennek növekedése tapasztalható.
Elsődleges oka a több évtizedes dohányzás. A betegek kb. 90%-a dohányzik. Nem elhanyagolható rizikót jelent a passzív dohányzás is. A dohányfüstben számos karcinogén anyag található, emellett gyulladásos folyamatokat is kivált a tüdőben. A dohányzás mellett főleg a laphámrák és a kissejtes tüdőrák előfordulása gyakori.
A betegség halmozottan jelentkezik bizonyos foglalkozási körökben. A tüdő hegesedéssel járó betegségei (fibrózis) is fokozzák a tüdőrák kockázatát.
A betegek 10%-a sohasem dohányzott. Közöttük az adenocarcinoma előfordulása gyakoribb.
A nem-kissejtes tüdőrák heterogén betegség. Kezelése során a patológiai altípusainak, illetve a célzott terápia szempontjából a prediktív biomarkereknek alapvető jelentőségük van. Ebbe a csoportba három fő daganatos elváltozást sorolnak: a laphámrákot, a nagysejtes tüdőrákot, illetve az adenocarcinómát.
2.1. TNM klinikai klasszifikáció, primer daganat
2.1.1. Primer daganat
| A | B | |
| 1 | Tx | Primer daganat nem mutatható ki, vagy a tumor köpetcitológia vagy bronchus mosófolyadékból kimutatható, de nem vizualizálható a képalkotók vagy bronchoscopia által |
| 2 | T0 | Primer tumor nem igazolható |
| 3 | Tis | Carcinoma in situ |
| 4 | T1 | A tumor legnagyobb átmérője 3 cm, vagy kisebb, tüdőszövet vagy visceralis pleura fogja körül, bronchoscopos vizsgálattal nem mutatható ki infiltráció egy lebenyhörgőtől proximalisan (a főhörgő szabad) (2.4.1.) |
| 5 | T1a | A tumor legnagyobb átmérője 2 cm, vagy kisebb |
| 6 | T1b | A tumor nagyobb, mint 2 cm, de nem nagyobb, mint 3 cm legnagyobb átmérőjét tekintve |
| 7 | T2 | A tumor nagyobb, mint 3 cm, de nem nagyobb, mint 7 cm vagy bármelyik a következők közül (2.4.2.): - a tumor befogja a főhörgőt, 2 cm-re vagy annál távolabb a carinától, - a tumor infiltrálja a visceralis pleurát, - kísérő atelectasia, vagy a hilusig terjedő obstruktív gyulladás, mely azonban nem terjed ki az egész tüdőre |
| 8 | T2a | A tumor nagyobb, mint 3 cm, de nem nagyobb, mint 5 cm a legnagyobb átmérőjét tekintve |
| 9 | T2b | A tumor nagyobb, mint 5 cm, de nem nagyobb, mint 7 cm a legnagyobb átmérőjét tekintve |
| 10 | T3 | A tumor nagyobb, mint 7 cm, vagy közvetlenül ráterjed a következő struktúrák egyikére: - mellkasfal (beleértve a sulcus superior tumorait), - rekeszizom, - nervus phrenicus, - mediastinalis pleura, - parietalis pericardium; - főbronchusban elhelyezkedő tumor, mely 2 cm-nél kisebb távolságban helyezkedik el a carinától distalisan, de maga a carina nincs beszűrve; - a tumor az egész tüdő atelectasiáját vagy obstruktív gyulladását okozza, - különálló daganatfészkek ugyanabban a lebenyben |
| 11 | T4 | Bármely nagyságú tumor, mely infiltrája a következő struktúrák egyikét: mediastinum, szív, nagyerek, légcső, nervus laryngeus recurrens, nyelőcső, csigolyatest, carina; vagy különálló daganatfészkek azonos oldali, de a primer tumortól eltérő lebenyekben |
2.2. TNM klinikai klasszifikáció, regionális nyirokcsomók
2.2.1. Regionális nyirokcsomók
| A | B | |
| 1 | Nx | Regionális nyirokcsomók nem megítélhetők |
| 2 | N0 | Nincs regionális nyirokcsomó áttét |
| 3 | N1 | Áttét az azonos oldali peribronchiális, illetve azonos oldali hilusi nyirokcsomókban és intrapulmonalis nyirokcsomókban, beleértve a primer tumor közvetlen ráterjedését is |
| 4 | N2 | Áttét az ipsilateralis mediastinális, illetve subcarinalis nyirokcsomókban |
| 5 | N3 | Áttét a kontralaterális mediastinális, kontralaterális hilusi, ipsi- vagy kontralaterális scalenus vagy supraclavicularis nyirokcsomókban |
2.3. TNM klinikai klasszifikáció, távoli áttét
2.3.1. Távoli áttét
| A | B | |
| 1 | M0 | Nincs távoli áttét |
| 2 | M1 | Távoli áttét |
| 3 | M1a | Különálló daganatfészkek az ellenoldali tüdőlebenyben, pleurális daganatfészkekkel, vagy malignus pleurális vagy pericardiális (2.4.3.) folyadékgyülemmel |
| 4 | M1b | Távoli áttét |
2.4. Megjegyzések:
2.4.1. Ritka, superficiális terjedésű tumor, melynek az invazív komponense a bronchus falára korlátozódik, és proximál felé a fő bronchusig terjedhet, bármely méretű, szintén T1a-ként klasszifikált
2.4.2. T2 tumorok a fenti jellemzőkkel T2a csoportba sorolandók, ha 5 cm vagy kisebb méretűek, vagy ha a méret nem meghatározott, és T2b ha nagyobb, mint 5 cm, de nem nagyobb, mint 7 cm
2.4.3. A tüdőtumor mellett jelentkező pleurális és pericardiális folyadékgyülem leggyakrabban a tumor következménye. Néhány betegben a pleuralis (pericardiális) folyadék többszörös mikroszkópos vizsgálata negatív daganatsejtre nézve, és a folyadék nem véres és nem exudatum. Ha az előbbiek és a klinikai megítélés alapján a folyadék nem függ össze a daganattal, a folyadék jelenlétét ki kell zárni a staging elemekből, és M0-nak kell tekinteni
2.5. Stádium besorolás
| A | B | C | D | |
| 1 | Occult carcinoma | Tx | N0 | M0 |
| 2 | Stádium 0 | Tis | N0 | M0 |
| 3 | Stádium IA | T1ab | N0 | M0 |
| 4 | Stádium IB | T2a | N0 | M0 |
| 5 | Stádium II A | T2b | N0 | M0 |
| T1ab | N1 | M0 | ||
| T2a | N1 | M0 | ||
| 6 | Stádium II B | T2b | N1 | M0 |
| T3 | N0 | M0 | ||
| 7 | Stádium IIIA | T1-2 | N2 | M0 |
| T3 | N1-2 | M0 | ||
| T4 | N0-1 | M0 | ||
| 8 | Stádium III B | T4 | N2 | M0 |
| Bármely T | N3 | M0 | ||
| 9 | Stádium IV | Bármely T | Bármely N | M1a, M1b |
2.6. ECOG PERFORMANCE STATUS
| A | B | |
| 1 | Fok | ECOG |
| 2 | 0 | Teljes aktivitás, önellátás, korlátozás nélkül. |
| 3 | 1 | Nem képes megerőltető aktivitásra, de könnyű munkát, pl. irodai munka, könnyű otthoni munka, képes végezni. |
| 4 | 2 | Ambuláns bejárásra képes, önellátó, de nem tud munkát végezni. Az ébren töltött órák több mint 50%-át ágyon kívül tölti. |
| 5 | 3 | Csak korlátozottan önellátó, az ébren töltött idő több mint 50%-át pihenéssel tölti. |
| 6 | 4 | Nem önellátó, teljes ellátást igényel, egész nap ágyhoz kötött. |
| 7 | 5 | Halál. |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
3.1. A korai nem-kissejtes tüdődaganatok diagnosztizálása
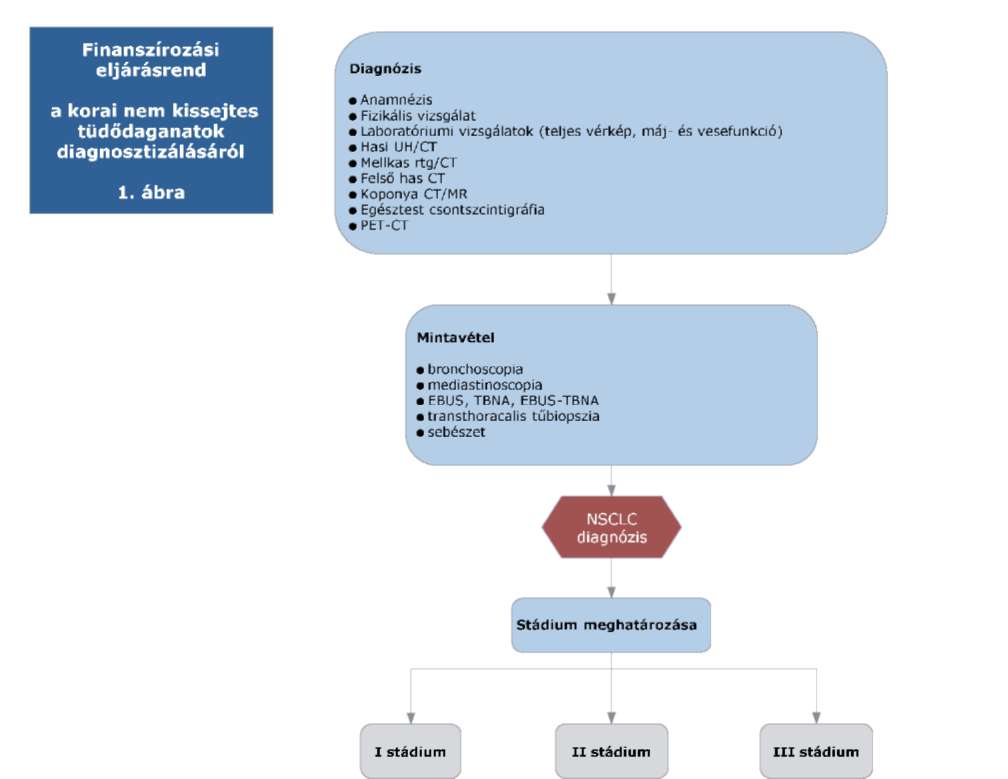
3.2. Az I stádium ellátása
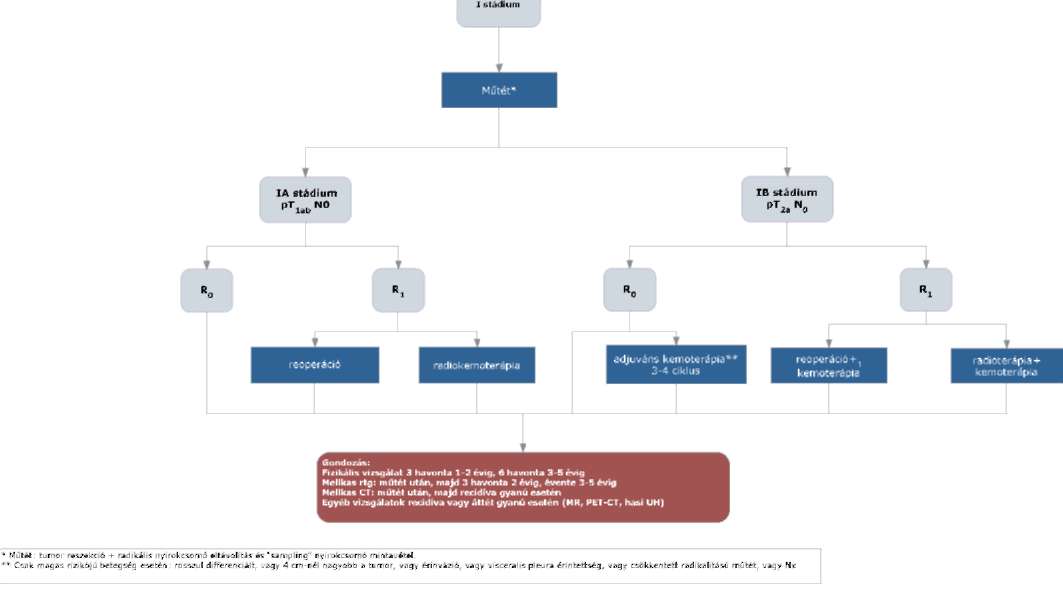
3.3. A II stádium ellátása
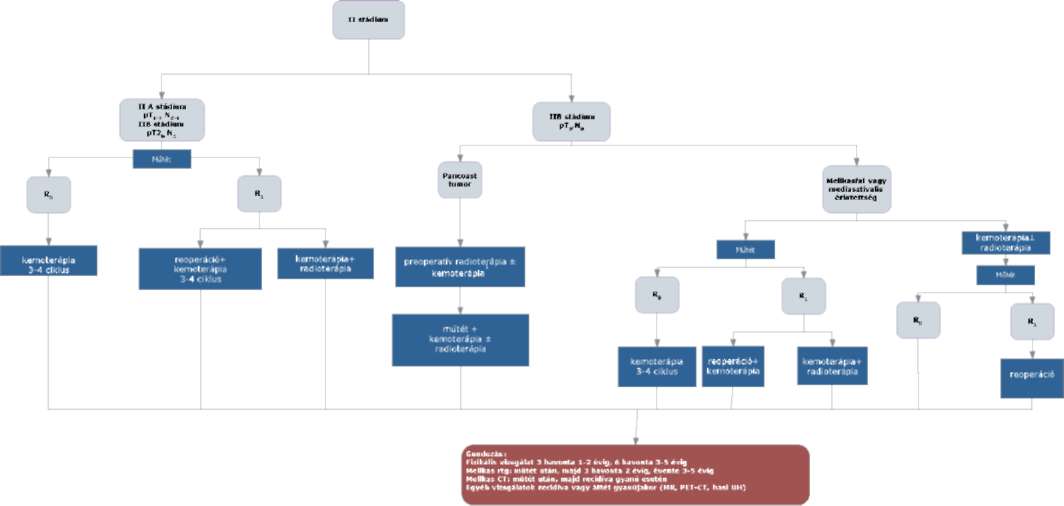
3.4. A III stádium ellátása
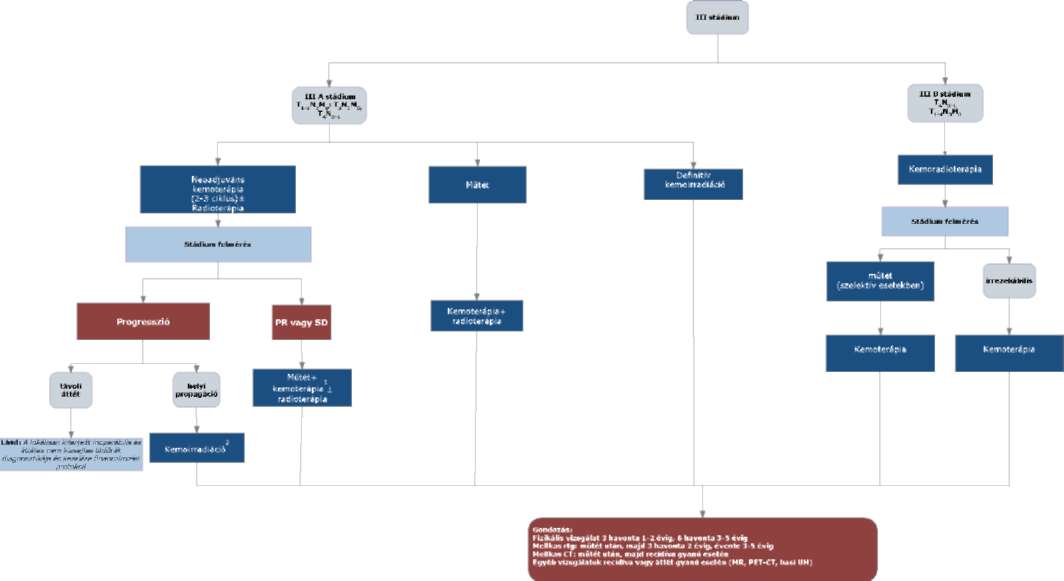
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. Szakmai ellenőrzési pontok
4.2.1. A diagnózis kritériumainak felállítása megfelelő volt-e?
4.2.2. Az utánkövetés a megfelelő időben megtörtént-e, és ezen minden szükséges vizsgálatot elvégeztek-e?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. A releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | C3400 | A főhörgő rosszindulatú daganata |
| 3 | C3410 | Felső lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 4 | C3420 | Középső lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 5 | C3430 | Alsó lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 6 | C3480 | A hörgő és tüdő átfedő elváltozása, rosszindulatú daganata |
| 7 | C3490 | Hörgő vagy tüdő rosszindulatú daganata, k.m.n. |
6.2. A releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 12601 | EKG végtag és mellkaselvezetéssel |
| 3 | 16200 | Bronchoscopia |
| 4 | 18441 | Thoracocentesis diagnosticus |
| 5 | 25063 | Köpet, bronchusváladék tenyésztése |
| 6 | 28014 | Vérkép, automatával IV. |
| 7 | 31310 | Mellkasfelvétel, AP/PA |
| 8 | 34440 | Mellkas CT vizsgálata natív |
| 9 | 34441 | Mellkas CT vizsgálata iv. kontrasztanyag adását követőleg |
| 10 | 34442 | Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 11 | 34474 | Biopsia pulmonis transthoracalis, CT vezérelt |
| 12 | 34930 | Mellkas MR vizsgálata natív |
| 13 | 34931 | Mellkas MR vizsgálata iv. kontrasztanyag adását követőleg |
| 14 | 34932 | Mellkas MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 15 | 3523B | Áttekintő csontszcintigráfia |
| 16 | 3521A | Perfúziós tüdőszcintigráfia |
| 17 | 53416 | Mediastinoscopia collaris sec. Carlens |
| 18 | 53417 | Mediastinoscopia parasternalis sec. Stemmer |
| 19 | 89442 | Pulzoxymetria |
| 20 | 35960 | Egésztest PET/CT vizsgálata |
6.3. A releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 7030 | Kemoterápia, EEP protokoll szerint |
| 3 | 7052 | Kemoterápia, GEM+CDDP II. protokoll szerint |
| 4 | 7053 | Kemoterápia, GEM/B protokoll szerint |
| 5 | 7059 | Kemoterápia, TXT+CDDP protokoll szerint |
| 6 | 7076 | Kemoterápia, CDDP+VNB protokoll szerint |
| 7 | 7088 | Kemoterápia, PEV protokoll szerint |
| 8 | 7089 | Kemoterápia, VICE protokoll szerint |
| 9 | 7092 | Kemoterápia, CBP+VP protokoll szerint |
| 10 | 7096 | Kemoterápia, MMC+IFO+CDDP protokoll szerint |
| 11 | 7097 | Kemoterápia, PE protokoll szerint |
| 12 | 7098 | Kemoterápia, IEC protokoll szerint |
| 13 | 7099 | Kemoterápia, TAX+CBP protokoll szerint |
| 14 | 7119 | Kemoterápia, heti TAX protokoll szerint |
| 15 | 7179 | Kemoterápia, GEM/C protokoll szerint |
| 16 | 7180 | Kemoterápia, GEM+CBP/B protokoll szerint |
| 17 | 7183 | Kemoterápia, CBP+TXT/C protokoll szerint |
| 18 | 7184 | Kemoterápia, TXT/B monoterápia protokoll szerint |
| 19 | 7185 | Kemoterápia, PEM monoterápia protokoll szerint |
| 20 | 7186 | Kemoterápia, CDDP+VNB/B protokoll szerint |
| 21 | 7187 | Kemoterápia, VNB protokoll szerint |
| 22 | 7188 | Kemoterápia, PE/B protokoll szerint |
| 23 | 7189 | Kemoterápia, PE/C protokoll szerint |
| 24 | 7191 | Kemoterápia, PEM-CDDP protokoll szerint |
| 25 | 7195 | Kemoterápia, CEP/B protokoll szerint |
| 26 | 7320 | Kemoterápia, GEM+CBP/C protokoll szerint |
| 27 | 7362 | Kemoterápia, BEV-tüdő monoterápia protokoll szerint |
| 28 | 7369 | Kemoterápia, CDDP+TAX/B protokoll szerint |
| 29 | 7370 | Kemoterápia, CPH+CDDP/B protokoll szerint |
| 30 | 7402 | Kemoterápia, CEP II. protokoll szerint |
| 31 | 7419 | Radiokemoterápia, tüdőrák esetén CDDP protokoll szerint |
| 32 | 7420 | Radiokemoterápia, nem kissejtes tüdőrák esetén TAX protokoll szerint |
| 33 | 7422 | Radiokemoterápia, tüdőrák esetén CDDP-VP/B protokoll szerint |
| 34 | 7423 | Radiokemoterápia, nem kissejtes tüdőrák esetén TXT-CDDP protokoll szerint |
| 35 | 7424 | Radiokemoterápia, nem kissejtes tüdőrák esetén TAX-CBP protokoll szerint |
| 36 | 7436 | Kemoterápia, GEM+CDDP II.+BEV protokoll szerint |
| 37 | 7437 | Kemoterápia, TXT+CDDP+BEV protokoll szerint |
| 38 | 7438 | Kemoterápia, CDDP+VNB/A protokoll szerint |
| 39 | 7458 | Kemoterápia, VNB+CBP protokoll szerint |
| 40 | 7468 | Radiokemoterápia, tüdőrák esetén CBP protokoll szerint |
| 41 | 7474 | Kemoterápia, TAX+CBP+BEV protokoll szerint |
| 42 | 7475 | Kemoterápia, GEM+CBP/B+BEV protokoll szerint |
| 43 | 7477 | Kemoterápia, CDDP+TAX/C+BEV protokoll szerint |
| 44 | 7478 | Kemoterápia, CBP+TXT/C+BEV protokoll szerint |
| 45 | 7479 | Kemoterápia, CDDP+VNB/B+BEV protokoll szerint |
| 46 | 7485 | Kemoterápia, VNB+CBP+BEV protokoll szerint |
| 47 | 7702 | Kemoterápia, EEP+dexrazoxane protokoll szerint |
| 48 | 7721 | Kemoterápia, CEP II.+dexrazoxane protokoll szerint |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC kód | Hatóanyag |
| 2 | L01XA02 | carboplatin |
| 3 | L01XA01 | cisplatin |
| 4 | L01AA01 | cyclophosphamid |
| 5 | L01CD02 | docetaxel |
| 6 | L01DB03 | epirubicin |
| 7 | L01CB01 | etoposide |
| 8 | L01BC05 | gemcitabine |
| 9 | L01AA06 | ifosfamide |
| 10 | V03AF01 | mesna |
| 11 | L01CD01 | paclitaxel |
| 12 | L01CA04 | vinorelbin |
7. Fogalmak, rövidítések
CR Komplett remisszió
CT Computer tomográfia
EBUS Endobronchialis ultrasound (endobronchiális ultrahang)
EGFR Epidermális növekedési faktor
MR Mágneses rezonancia vizsgálat
NSCLC Non small cell lung cancer (Nem-kissejtes tüdődaganat)
PET-CT Pozitron emissziós tomográfia
PR Parciális remisszió
PS Általános állapot rtg Röntgen
SD Változatlan állapot
UH Ultrahang
TBNA Transbronchialis needle biopsy (transbronchialis tűbiopszia)
WBRT Whole brain radiotherapy (teljes agykoponya besugárzás)"
42. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"39. melléklet a 31/2010. (V. 13.) EüM rendelethez
Az ST-elevációval járó akut myocardiális infarktus diagnosztikájának és terápiájának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Az ST elevációval járó akut myocardiális infarctus (STEMI)
2. Kórkép leírása
Magyarországon a daganatos betegségek és az ér- és szívrendszeri betegségek képezik a vezető halálokokat. 2010-ben a rosszindulatú daganatokat követő második halálok az ischaemiás szívbetegség volt. Akut szívizom infarctus (AMI) miatt 2010-ben 7 125 ember hunyt el, majd ez a szám 2011-ben 6 776-ra majd és 2012-re 6 691-re csökkent a KSH legfrissebb adatai szerint. Az akut infarktus miatt elvesztett betegek számának csökkenése tartós tendenciát mutatott az elmúlt 10 évben. Az AMI és az ischaemiás szívbetegség (ISZB) optimális kezelése nemcsak a halálozást, hanem a különösen veszélyeztetett 40-60 év közötti férfiak életminőségét és munkaképességét is nagymértékben befolyásolja. A reperfúziós terápia, a primer perkután koronária intervenció (primer PCI), a modern antithrombotikus terápia és a másodlagos prevenciós terápiák elterjedt alkalmazásával párhuzamosan csökkent a STEMI rövid és hosszú távú mortalitása, ennek ellenére a betegség mortalitása jelentősnek mondható.
Az utóbbi években a terápiás lehetőségek gyors ütemű bővülése a kiadások ugrásszerű gyors növekedését hozta, ami szükségessé teszi a terápiás területnek a betegek és a járulékfizetők érdekében történő elemzését finanszírozói szemszögből is.
Akut szívizom infarktus kifejezés mellett napjainkban már az akut koronária szindróma (ACS) összefoglaló elnevezés is egyre szélesebb körben terjedt el. Az akut koronária szindróma EKG megjelenési forma alapján három főcsoportba sorolható: az ST-elevációval járó ACS, az ST-T rendellenességgel járó ACS, illetve a normál vagy bizonytalan EKG-val járó szindrómák. Biokémiai laborvizsgálatok elvégzését követően, biomarkerek (troponin, CK-MB) felszabadulás alapján beszélhetünk a továbbiakban ST-elevációval és minden esetben troponin pozitivtással bíró myocardialis infarktusról (STEMI), ST-T rendellenességgel vagy normál, esetleg bizonytalan EKG eltéréssel, azonban mindig troponin pozitivitással járó myocardialis infarktusról (NSTEMI), és ugyancsak ST-T rendellenességgel vagy normál, esetleg bizonytalan EKG eltéréssel járó, viszont normál troponin szint mellett jelentkező instabil angináról (IA). Mint látható, pusztán EKG alapján az NSTEMI és IA kórképek között nem lehet egyértelmű különbséget tenni (2.1. ábra).
2.1. ACS felosztása (átalakított 2012. évi ESC ajánlás)
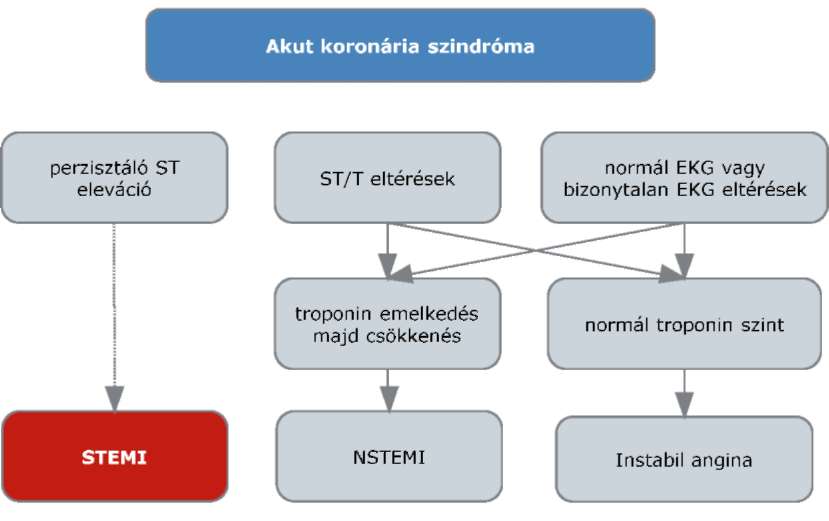
2.1.1. Az AMI kezelésében áttörő változást hozott a "nyitott ér" szemléletének megszületése, előbb a szisztémás thrombolysis, majd a thrombolysisnél lényegesen hatékonyabb primer percután translumináris coronaria angioplasztika (PTCA) megjelenése. Ettől az időszaktól számítható az infarktus kezelés reperfúziós korszaka. Ezt követően az AMI prognózisa jóval kedvezőbbé vált, mára elsősorban a percután coronaria intervenció (PCI) elterjedése miatt.
2.1.2. Ezekkel együtt, közel egy időben széleskörűen kerültek alkalmazásra a prognózist kedvezően befolyásoló gyógyszerek is: aszpirin (ASA), béta receptor blokkolók (BB), angiotenzin konvertáz enzim gátlók (ACEI), angiotenzin receptor blokkolók (ARB), sztatinok és aldoszteron receptor antagonisták.
2.1.3. A primer percutan coronaria intervenció széleskörű elterjedésével a betegség kórházi halálozása a korábbi 15%-ról 5-6%-ra csökkent.
2.1.4. Az AMI miatt egy éven belül meghalt betegek fele a tünetek jelentkezéséhez képest egy-két órán belül halt meg, jórészt még a kórházba kerülés előtt. Emiatt a lakosság felvilágosítása, a fenyegető tünetek felismerésének oktatása, illetve az "első észlelő" szerepe nagyon fontos.
2.1.5. Patofiziológiájára jellemző a coronariában kialakuló occlusive thrombus. A kezelés fő célja az elzáródott coronaria mielőbbi megnyitása, és a szöveti áramlás minél teljesebb helyreállítása. Ma Magyarországon mindenképp az időintervallumon belül elvégzett primer PCI a preferálandó kezelés, részben kimagasló eredményessége, részben költséghatékony volta miatt is.
2.1.6. Thrombolysis akkor választandó kezelés, ha a primer PCI az ajánlás szerinti időhatárokon belül nem érhető el.
2.1.7. A munkadiagnózis felállításában rendkívül fontos és elégséges a tünetorientált fizikális vizsgálat és az EKG helyes, gyors értékelése.
2.1.8. Típusos, nitroglycerin hatásra nem szűnő és 20 percnél tovább tartó retroszternális fájdalom vagy egyéb szívinfarktusra jellemző panasz, valamint az alábbiak közül egy jellemző, amivel a diagnózis kimondható (ha nincsen bal kamra hypertrophia jelen):
2.1.8.1. új típusos ST-eleváció a J-pontban két vagy több összetartozó elvezetésben
- ≥0,25 mV a V1-3 elvezetésekben a 40 év alatti férfiak esetében,
- ≥0,20 mV a V1-3 elvezetésekben a 40 éves és afeletti férfiak esetében,
- ≥0,15 mV a V1-3 elvezetésekben a nők esetében,
- ≥0,10 mV az egyéb elvezetésekben;
2.1.8.2. új (korábbról nem ismert) bal Tawara-szár blokk megjelenése.
2.1.9. Alsó fali infarktus esetében javasolható a jobb oldali praecordialis (V3R és V4R) elvezetések alkalmazása is, mivel ezen elvezetések ST-elevációja esetén jobb kamrai infarktus valószínűsíthető. A V7-V9 elvezetések eltérései a körbefutó ágról (CX) adhatnak információt.
2.1.10. Az EKG eltérések helyes értékelése sokszor nagy kihívást jelent, zajló myocardialis ischaemia tünetei és az alábbi 3 atípusos EKG egyikének manifesztációja esetén ugyancsak STEMI analóg intézkedések meghozatala válhat szükségessé:
- kamrai pacemaker ritmus (PM) ritmus vagy
- a V1-3 elvezetésekben jelentkező ≥0,05 mV ST depresszió vagy
- a VR, illetve V1 elvezetés(ek)ben jelentkező ≥0,10 mV ST-eleváció
2.1.11. AMI gyanúja esetén a diagnózis felállításának első lépései:
| A | B | C | |
| 1 | Ajánlások | Osztály | Szint |
| 2 | 12 elvezetéses vizsgálatot kell készíteni mihamarabb az első orvosi kontaktus során (célszerű 10 percnél rövidebb késlekedési idővel) | I | B |
| 3 | EKG-monitorizálás megkezdése szükséges mihamarabb minden STEMI gyanújával obszervált betegnél | I | B |
| 4 | A nekrózis szérum markereinek vizsgálatához szükséges vérvétel az akut szakban rutinszerűen elvégzendő, de az eredményre történő várakozásnak nem szabad hátráltatnia a reperfúziós kezelés elvégzését | I | C |
| 5 | Megfontolandó a kiegészítő poszterior mellkasfali elvezetések használata (V7-V9≥0,05 mV) azon betegeknél, akiknél infero-basalis myocardiális infarktus alapos gyanúja merül fel (körbefutó ágelzáródás) | IIa | C |
| 6 | Bizonytalan esetekben az echokardiográfia segíthet a diagnózis felállításában, de nem szabad, hogy ez késleltesse az angiográfia elvégzését | IIb | C |
2.1.12. Azonnali ellátást igénylő betegek:
| 1 | Azonnali ellátást igénylő betegek, ha az atípusos EKG jelek mellett a myocardialis ischaemia tünetei perzisztálnak |
| 2 | LBBB (bal Tawara szár-blokk) |
| 3 | Kamrai pótritmus |
| 4 | Betegek diagnosztikus mértékű EKG-eltérések nélkül, de perzisztáló ischaemiás tünetekkel |
| 5 | Izolált poszterior myocardialis infarktus |
| 6 | ST szegmens eleváció az aVR elvezetésben |
3. STEMI finanszírozási algoritmusa
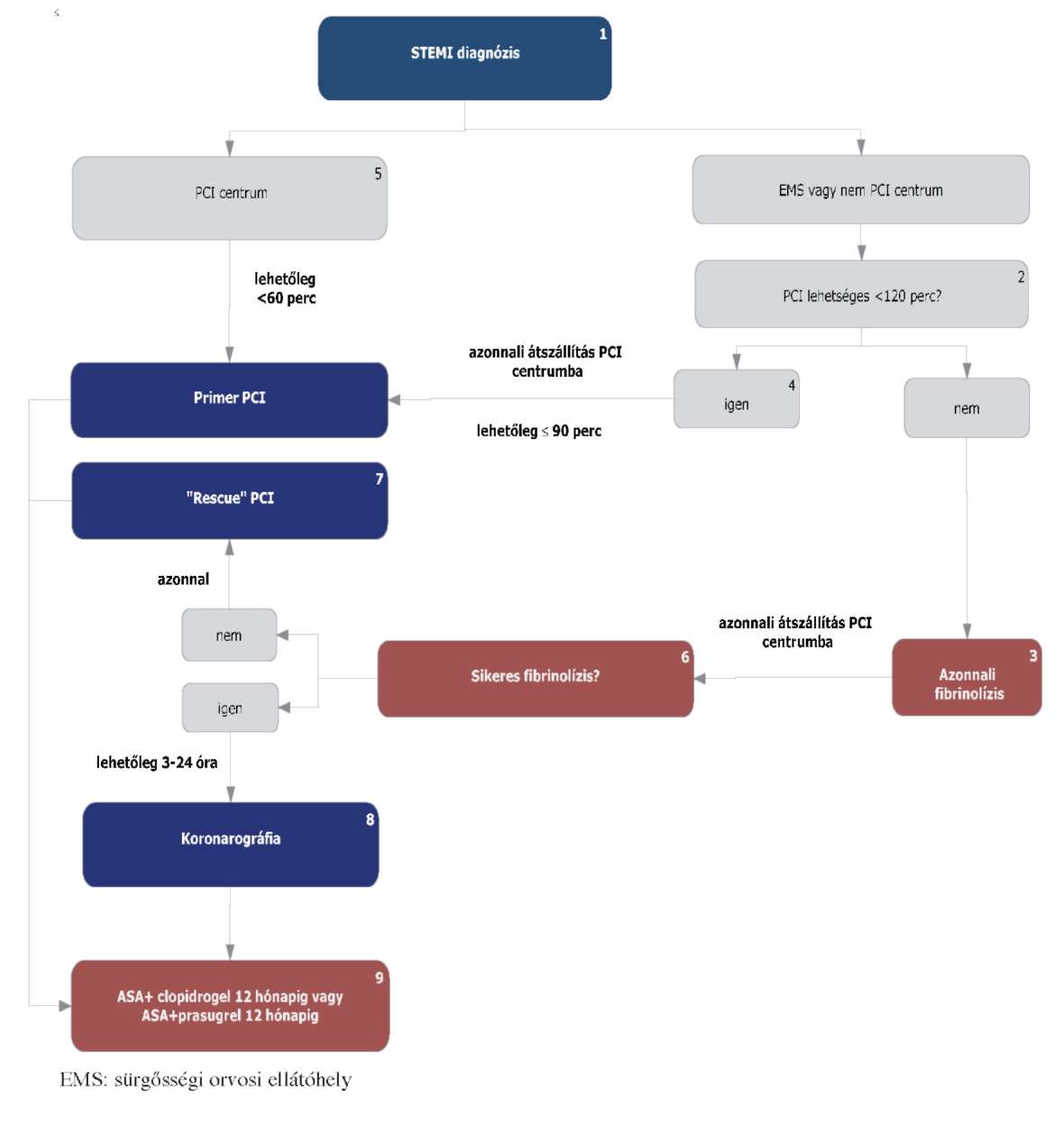
4. A finanszírozási algoritmus részletezése
4.1. A diagnózis felállítása (1)
A diagnózis az anamnézis és az EKG alapján felállításra kerül, ideálisan az első orvosi kontaktustól számított 10 percen belül. A beteg további ellátása attól függ, hogy PCI vagy nem PCI centrumba kerül felvételre.
4.1.1. Kezdeti értékelés:
4.1.1.1. anamnézis, rizikófaktorok felmérése
4.1.1.2. mellkasi fájdalom megítélése: fájdalom jellege, időtartama, visszatérő volta, adekvát gyógyszeres kezelésre adott válasz megítélése
4.1.1.3. tünetorientált fizikális vizsgálat
4.1.1.4. EKG monitorozás
4.1.1.5. laborban biomarkerek vizsgálata: troponin, CK-MB
4.1.1.6. differenciál diagnózis céljából, amennyiben szükséges: echocardiographia (falmozgászavar, balkamra funkció, esetleges mechanikus szövődmények kimutatása), ez azonban nem késleltetheti az intervenciós centrumba történő transzfert
4.2. Amennyiben PCI-re alkalmatlan centrumba került a beteg, mérlegelni szükséges, hogy 120 percen belül invazív centrumban a beavatkozás elvégezhető-e (2)
4.3. Azonnali fibrinolízis (3)
Amennyiben PCI elvégzésére 120 percen belül nincsen lehetőség, azonnali fibrinolízis elvégzése szükséges. Az első ellátás kezdetétől a fibrinolízist 30 percen belül el kell kezdeni. (Az ellenjavallatok mérlegelése szükséges.)
4.3.1. A thrombolysis ellenjavallatai
| A | |
| 1 | Abszolút |
| 2 | Korábbi ismeretlen etiológiájú koponyaűri vérzés vagy stroke az esemény óta eltelt időtől függetlenül |
| 3 | Az elmúlt 6 hónapon belül lezajlott ischaemiás stroke |
| 4 | Központi idegrendszeri károsodás, daganat vagy arterio-venosus malformáció |
| 5 | A közelmúltban végzett major trauma, sebészeti beavatkozás vagy fejsérülés (3 héten belül) |
| 6 | Egy hónapon belül lezajlott gyomor-bélrendszeri vérzés |
| 7 | Vérzési zavar (a havi vérzést leszámítva) |
| 8 | Aorta disszekció |
| 9 | Nem komprimálható szúrások 24 órán belül (pl. májbiopszia, lumbálpunkció) |
| 10 | Relatív |
| 11 | Tranziens ischaemiás attak |
| 12 | Oralis antikoaguláns kezelés (ha az INR >2) |
| 13 | Terhesség és a szülés után első hét végéig tartó időszak |
| 14 | Terápia refrakter magas vérnyomás (szisztolés vérnyomás >180 Hgmm és a diasztolés vérnyomás >110 Hgmm) |
| 15 | Előrehaladott májbetegség |
| 16 | Infektív endocarditis |
| 17 | Aktív peptikus fekély |
| 18 | Tartós vagy traumatikus újraélesztés |
Minden más esetben az alkalmazott gyógyszerkészítmény Alkalmazási előiratában foglaltak az irányadók.
4.4. Primer PCI a beteg átszállítását követően
Amennyiben a PCI 120 percen belül elérhető, a beteg azonnali átszállítása szükséges PCI-re alkalmas centrumba. Az első ellátás kezdetétől a primer PCI-ig eltelt idő ≤ 90 perc (és nagy anterior AMI esetén ≤ 60 perc). (4)
4.5. Primer PCI arra alkalmas centrumban
Amennyiben a beteg azonnal primer PCI-re alkalmas ellátóhelyre kerül, a felvételtől a PCI-ig eltelt idő ideálisan (ajtó-ballon idő) ≤ 60 perc. (5)
4.6. A fibrinolízis eredményességének értékelése (6)
Amennyiben fibrinolízisre került sor, annak az eredményességét értékelni kell.
4.7. Sikertelen fibrinolízis (7)
Sikertelen fibrinolízis esetén a betegnél azonnal "rescue PCI" elvégzése szükséges.
4.8. Sikeres fibrinolízis (8)
Sikeres fibrinolízist követő 3-24 órán belül koronarográfia elvégzése javasolt.
4.9. PCI után 12 hónapig ASA és clopidogrel terápia folytatása szükséges. (9)
ASA+prasugrel kombinációt kaphatnak eü. emelt támogatással 12 hónapig azok a betegek, akiknél percutan coronaria intervenció és stent beültetés történt, emellett kórelőzményükben stroke vagy transiens ischaemiás attack (TIA) nem szerepel és clopidogrel allergia vagy laboratóriumilag igazolt non-reszponzió vagy igazolt diabetes mellitus áll fenn vagy stent trombózist szenvedtek el.
4.10. AMI esetén a CABG indikációja korlátozott, csak kivételes esetekben, pl.: életet veszélyeztető mechanikus szövődmény esetén.
4.11. STEMI kapcsán javasolt gyógyszeres terápiás javaslat:
4.11.1. Clopidogrel + aszpirin kombinált adása indokolt STEMI után legfeljebb 12 hónapig. A minimális időtartam:
4.11.1.1. BMS stent implantációt követően: 1 hónap,
4.11.1.2. DES stent implantációt követően: 6 hónap.
4.11.2. Alacsony dózisú aszpirin (75-100 mg) alapú antiaggregációs kezelés javasolt STEMI után élethossziglan.
4.11.3. Már a korai kórházi szakban szükséges a korai nagydózisú (agresszív) sztatin kezelés elkezdése.
4.11.4. Béta-receptor blokkolókat a kezelés megkezdésekor kell alkalmazni, egy időben az aszpirinnel és a rövid hatású nitrát készítménnyel, ha kontraindikáció nincs.
4.11.5. Már az első 24 órában ajánlott ACEI-kezelés csökkent bal kamra funkció (EF <40%) vagy tüdőpangás esetén, ha a szisztolés vérnyomás 100 Hgmm felett van és nem csökkent a kiindulási értékhez képest jelentős mértékben (30 Hgmm).
4.11.6. ACEI intoleráns betegeknek ARB kezelés alkalmazása indokolt, amennyiben a szívelégtelenség vagy csökkent balkamra funkció (EF <40%) áll fenn.
4.12. Kései kockázatfelmérés:
4.12.1. A klinikai állapot felmérését és az infarktus kiterjedésének, valamint a nyugalmi balkamra-funkciónak a megítélését 24-48 órán belül el kell végezni.
4.12.2. Szövődménymentes infarktust követően a 4-6. napon szubmaximális, majd negatív esetben 6 hét múlva maximális, tünet limitált protokoll szerinti terheléses vizsgálatot javasolt végezni (szekunder prevenció elengedhetetlen az ismételt esemény, illetve a mortalitás csökkentése céljából).
4.12.3. A dinamikus terhelésre képtelen betegek esetében vagy azoknál a betegeknél, akiknél az EKG ischaemia szempontjából nem releváns vagy bizonytalan, képalkotó eljárással kombinált terheléses vizsgálat végezhető (dipyridamol terheléses szívizom perfúziós szcintigráfia vagy dobutamin stressz-echocardiographia).
4.13. Képalkotó és terheléses vizsgálatok indikációi
| A | B | C | D | E | |
| 1 | Diagnosztika | Felvételkor | <48óra | Kibocsátás előtt | Kibocsátás után |
| 2 | 2D-echo | diff. diagnózis felállításához | - balkamra-funkció - thrombus kizárása | - balkamra- funkció | - |
| - mechanikus szövődmény - szívelégtelenség | |||||
| 3 | Stressz-echo Szívizom perfúziós szcintigráfia | - | - | - ischaemia+ prognózis | primer PCI után |
| 4 | Terheléses EKG | - | - | - ischaemia+ prognózis | PCI után |
| 5 | Coronarographia | PCI-hez | - magas klinikai rizikó | - magas rizikó - képalkotó- vizsgálatok alapján - közepes rizikó + panaszok - refrakter panaszok | - |
5. Az ellenőrzés alapját képező finanszírozás szempontból lényeges sarokpontok
A finanszírozási ellenőrzés során elsődlegesen az kerül ellenőrzésre, hogy a kezelő orvosok betartják-e a kihirdetett finanszírozási rendet, különös tekintettel a következő főbb sarokpontokra. A finanszírozási és ellenőrzési sarokpontok megjelenítése rendkívül fontos, hiszen a társadalombiztosítási támogatások optimális felhasználását biztosíthatja. Ezek az alábbiak:
5.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
5.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
5.1.2. Betegadatok (online TAJ ellenőrzés)
5.1.3. Jogszabályba foglalt adatszolgáltatási kötelezettség a Nemzeti Szívinfarktus Regiszterben
5.2. Szakmai ellenőrzési pontok
5.2.1. A diagnózis kritériumainak rögzítése
5.2.1.1. anamnézis, rizikófaktorok
5.2.1.2. mellkasi panaszok jellege és kezdete (óra, perc)
5.2.1.3. EKG ST-eltérések
5.2.1.4. troponin pozitivitás, amennyiben nincs sürgős szállítás
5.2.2. A kórkép korai kezelésének megkezdése és dokumentálásának ellenőrzése
5.2.2.1. ASA+ clopidogrel
5.2.2.2. ASA+ prasugrel
5.2.2.3. sztatin kezelés
5.2.2.4. béta-blokkoló, amennyiben nem kontraindikált
5.2.2.5. ACE-gátló, illetve ACE-gátló intolerancia vagy mellékhatás esetén ARB (csökkent balkamra funkció esetén)
5.2.3. A kezelési stratégiák megválasztásának ellenőrzése
5.2.3.1. reperfúziós technika megválasztásának monitorozása
5.2.3.2. reperfúziós technika hiányában az intézmény által használt kockázat-besorolás alkalmazása, elmaradás okainak ellenőrzése
5.2.3.3. teljeskörű szekunder prevenció alkalmazásának monitorozása
6. A döntést megalapozó hatásossági, költséghatékonysági mutatók
A finanszírozási eljárásrend a hazai és az Európai Kardiológus Társaság 2012-ben kiadott szakmai irányelve és a hazai finanszírozási szabályoknak megfelelően került összeállításra, és nem helyettesíti a gyógyszerek alkalmazási előiratában foglaltakat. Azon szakmai döntési pontokról, amelyeket a jelen melléklet nem tartalmaz, a szakmai irányelvek rendelkeznek.
6.1. A finanszírozás szempontjából lényeges finanszírozási kódok
6.2. A releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezése |
| 2 | I2100 | Heveny elülső fali transmuralis szívizomelhalás |
| 3 | I2110 | Heveny alsó fali transmuralis szívizomelhalás |
| 4 | I2120 | Egyéb lokalizációjú heveny transmuralis szívizomelhalás |
| 5 | I2130 | Heveny transmuralis szívizomelhalás a lokalizáció megjelölése nélkül |
| 6 | I2190 | Heveny szívizomelhalás, k.m.n. |
| 7 | I2191 | Heveny szívizomelhalás, k.m.n. Q hullám nélkül |
| 8 | I2200 | Ismétlődő elülső fali szívizomelhalás |
| 9 | I2210 | Ismétlődőinferior szívizomelhalás |
| 10 | I2280 | Ismétlődő szívizomelhalás egyéb lokalizációban |
| 11 | I2290 | Ismétlődő szívizomelhalás nem meghatározott helyen |
6.3. A releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 11041 | Vizsgálat |
| 3 | 12601 | EKG végtag és mellkaselvezetéssel |
| 4 | 21082 | Kardiális troponin I meghatározása |
| 5 | 21083 | Kardiális troponin T meghatározása |
| 6 | 21202 | Vérgáz analízis |
| 7 | 2489B | CK-MB koncentráció meghatározása immunmódszerrel |
| 8 | 3612D | Echocardiographia color Doppler |
| 9 | 3612A | Echocardiographia (M-mód, 2D) |
| 10 | 35223 | Szívizom perfúzió szcintigráfia Tc-mal |
| 11 | 89410 | EKG monitorizálás |
| 12 | 89442 | Pulzoxymetria |
| 13 | 88340 | Véna kanülálás |
| 14 | 88750 | Véna preparálás |
6.4. A releváns HBCS kódok
| 1 | HBCS | HBCS megnevezés |
| 2 | 2070 | AMI speciális kezelés nélkül |
| 3 | 2081 | AMI PCI-vel (egy vagy több stenttel) |
| 4 | 2082 | AMI PCI-vel, stent nélkül |
| 5 | 2050 | AMI thrombolysis kezeléssel |
| 6 | 2060 | AMI ideiglenes pacemaker beültetéssel |
| 7 | 2091 | Thrombolysis AMI esetén szöveti plazminogen aktivátorral, áthelyezéssel |
| 8 | 2092 | Thrombolysis AMI esetén szöveti plazminogen aktivátorral, áthelyezés nélkül |
6.5. A releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | B01AC06 | acetilszalicilsav |
| 3 | B01AC04 | clopidogrel |
| 4 | B01AC22 | prasugrel |
| 5 | B01AD01 | streptokinase |
| 6 | B01AD02 | alteplase |
| 7 | B01AD11 | tenecteplase |
| 8 | C10AA01 | simvastatin |
| 9 | C10AA05 | atorvastatin |
| 10 | C10AA07 | rosuvastatin |
| 11 | C10AX09 | ezetimibe |
| 12 | C10BA02 | ezetimibe-simvastatin |
| 13 | C09A | ACE-inhibitorok önmagukban |
| 14 | C09B | ACE-inhibitorok kombinációban |
| 15 | C09CA | angiotensinII antagonisták önmagukban |
| 16 | C09D | angiotensin II antagonisták kombinációi |
| 17 | C07AB02 | metoprolol |
| 18 | C07AB07 | bisoprolol |
| 19 | C07AB12 | nebivolol |
| 20 | C07AG02 | carvedilol |
| 21 | C07BB07 | bisoprolol+thiazidok |
| 22 | C07FB02 | metoprolol+egyéb vérnyomáscsökkentők |
6.6. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
A finanszírozási eljárásrend hatását a következő indikátorokkal kívánjuk mérni:
6.6.1 A területre fordított közkiadások alakulása
6.6.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya
7. Rövidítések
ASA acetil-szalicilsav
ACS akut coronaria szindróma
BB béta-receptor blokkolók
AMI akut myocardiális infarktus
CABG coronaria artéria bypass graft műtét
EMS sürgősségi orvosi ellátórendszer
IA instabil angina
ISZB (CAD) ischaemiás szívbetegség (coronary artery disease)
PCI percutan coronaria intervenció
SBO sürgősségi betegellátó osztály
STEMI ST-elevációval járó akut myocardiális infarktus
NSTEMI ST-elevációval nem járó járó akut myocardiális infarktus
TAGG thrombocyta aggregáció gátló készítmények
ACEI angiotenzin konvertáló enzim gátlók
ARB angiotenzin receptor gátlók
Killip kategóriák szívelégtelenség osztályozására használt kategóriák
ESC European Society of Cardiology
DES gyógyszerkibocsátó stent (drug-eluting stent)
LBBB bal Tawara-szár blokk
MPS myocardial perfusion scintigraphy"
43. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"40. melléklet a 31/2010. (V. 13.) EüM rendelethez
Lokálisan kiterjedt inoperábilis és áttétes nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Daganatos megbetegedések
1.1.1. Rosszindulatú daganatos megbetegedések
1.1.1.1. Nem-kissejtes tüdő daganat
1.1.1.1.1. Lokálisan kiterjedt inoperábilis és áttétes nem-kissejtes tüdő daganat
2. A kórkép leírása
Magyarország világelső a tüdőrák előfordulását és halálozási arányát tekintve. Évente körülbelül 7000 új eset kerül felfedezésre.
A betegek átlag életkora 55-70 év. Ritkán fordul elő 40 év alatt, ami a dohányzási szokásokkal is magyarázható, ugyanis a tüdőrák több évtizedes rendszeres dohányzás után alakul ki. Férfi-női arány 1,5:1, de meg kell említeni, hogy míg a férfiaknál az előfordulás csökkenése figyelhető meg, addig a nők esetében ennek növekedése tapasztalható.
Elsődleges oka a több évtizedes dohányzás. A betegek kb. 90%-a dohányzik. Nem elhanyagolható rizikót jelent a passzív dohányzás is. A dohányfüstben számos karcinogén anyag található, emellett gyulladásos folyamatokat is kivált a tüdőben. A dohányzás mellett főleg a laphámrák és a kissejtes tüdőrák előfordulása gyakori.
A betegség halmozottan jelentkezik bizonyos foglalkozási körökben. A tüdő hegesedéssel járó betegségei (fibrózis) is fokozzák a tüdőrák kockázatát.
A betegek 10%-a sohasem dohányzott. Közöttük az adenocarcinoma előfordulása gyakoribb.
A nem-kissejtes tüdőrák heterogén betegség. Kezelése során a patológiai altípusainak, illetve a célzott terápia szempontjából a prediktív biomarkereknek alapvető jelentőségük van. Ebbe a csoportba három fő daganatos elváltozást sorolnak: a laphámrákot, a nagysejtes tüdőrákot, illetve az adenocarcinómát.
2.1. TNM klinikai klasszifikáció, primer tumor
2.1.1. Primer daganat
| A | B | |
| 1 | Tx | Primer daganat nem mutatható ki, vagy a tumor köpetcitológia vagy bronchus mosófolyadékból kimutatható, de nem vizualizálható a képalkotók vagy bronchoscopia által |
| 2 | T0 | Primer tumor nem igazolható |
| 3 | Tis | Carcinoma in situ |
| 4 | T1 | A tumor legnagyobb átmérője 3 cm vagy kisebb, tüdőszövet vagy visceralis pleura fogja körül, bronchoscopos vizsgálattal nem mutatható ki infiltráció egy lebenyhörgőtől proximalisan (a főhörgő szabad) (2.4.1.) |
| 5 | T1a | A tumor legnagyobb átmérője 2 cm vagy kisebb |
| 6 | T1b | A tumor nagyobb, mint 2 cm, de nem nagyobb, mint 3 cm legnagyobb átmérőjét tekintve |
| 7 | T2 | A tumor nagyobb, mint 3 cm, de nem nagyobb, mint 7 cm vagy bármelyik a következők közül (2.4.2.) - a tumor befogja a főhörgőt, 2 cm-re vagy annál távolabb a carinától, - a tumor infiltrálja a visceralis pleurát, - kísérő atelectasia, vagy a hilusig terjedő obstruktív gyulladás, mely azonban nem terjed ki az egész tüdőre |
| 8 | T2a | A tumor nagyobb, mint 3 cm, de nem nagyobb, mint 5 cm a legnagyobb átmérőjét tekintve |
| 9 | T2b | A tumor nagyobb, mint 5 cm, de nem nagyobb, mint 7 cm a legnagyobb átmérőjét tekintve |
| 10 | T3 | A tumor nagyobb, mint 7 cm, vagy közvetlenül ráterjed a következő struktúrák egyikére: - mellkasfal (beleértve a sulcus superior tumorait), - rekeszizom, - nervus phrenicus, - mediastinalis pleura, - parietalis pericardium; - főbronchusban elhelyezkedő tumor, mely 2 cm-nél kisebb távolságban helyezkedik el a carinától distalisan, de maga a carina nincs beszűrve; - a tumor az egész tüdő atelectasiáját vagy obstruktív gyulladását okozza, - különálló daganatfészkek ugyanabban a lebenyben |
| 11 | T4 | Bármely nagyságú tumor, mely infiltrája a következő struktúrák egyikét: mediastinum, szív, nagyerek, légcső, nervus laryngeus recurrens, nyelőcső, csigolyatest, carina; vagy különálló daganatfészkek azonos oldali, de a primer tumortól eltérő lebenyekben |
2.2. TNM klinikai klasszifikáció, regionális nyirokcsomók
2.2.1. Regionális nyirokcsomók
| A | B | |
| 1 | Nx | Regionális nyirokcsomók nem megítélhetők |
| 2 | N0 | Nincs regionális nyirokcsomó áttét |
| 3 | N1 | Áttét az azonos oldali peribronchiális, illetve azonos oldali hilusi nyirokcsomókban és intrapulmonalis nyirokcsomókban, beleértve a primer tumor közvetlen ráterjedését is |
| 4 | N2 | Áttét az ipsilateralis mediastinális, illetve subcarinalis nyirokcsomókban |
| 5 | N3 | Áttét a kontralaterális mediastinális, kontralaterális hilusi, ipsi- vagy kontralaterális scalenus vagy supraclavicularis nyirokcsomókban |
2.3. TNM klinikai klasszifikáció, távoli áttét
2.3.1. Távoli áttét
| A | B | |
| 1 | M0 | Nincs távoli áttét |
| 2 | M1 | Távoli áttét |
| 3 | M1a | Különálló daganatfészkek az ellenoldali tüdőlebenyben, pleurális daganatfészkekkel, vagy malignus pleurális vagy pericardiális (2.4.3.) folyadékgyülemmel |
| 4 | M1b | Távoli áttét |
2.4. Megjegyzések:
2.4.1. Ritka, superficiális terjedésű tumor, melynek az invazív komponense a bronchus falára korlátozódik, és proximál felé a fő bronchusig terjedhet, bármely méretű, szintén T1a-ként klasszifikált.
2.4.2. T2 tumorok a fenti jellemzőkkel T2a csoportba sorolandók, ha 5 cm vagy kisebb méretűek, vagy ha a méret nem meghatározott, és T2b ha nagyobb, mint 5 cm, de nem nagyobb, mint 7 cm.
2.4.3. A tüdőtumor mellett jelentkező pleurális és pericardiális folyadékgyülem leggyakrabban a tumor következménye. Néhány betegben a pleuralis (pericardiális) folyadék többszörös mikroszkópos vizsgálata negatív daganatsejtre nézve, és a folyadék nem véres és nem exudatum. Ha az előbbiek és a klinikai megítélés alapján a folyadék nem függ össze a daganattal, a folyadék jelenlétét ki kell zárni a staging elemekből, és M0-nak kell tekinteni.
2.5. Stádium besorolás
| A | B | C | D | |
| 1 | Occult carcinoma | Tx | N0 | M0 |
| 2 | Stádium 0 | Tis | N0 | M0 |
| 3 | Stádium IA | T1ab | N0 | M0 |
| 4 | Stádium IB | T2a | N0 | M0 |
| 5 | Stádium II A | T2b | N0 | M0 |
| T1ab | N1 | M0 | ||
| T2a | N1 | M0 | ||
| 6 | Stádium II B | T2b | N1 | M0 |
| T3 | N0 | M0 | ||
| 7 | Stádium IIIA | T1-2 | N2 | M0 |
| T3 | N1-2 | M0 | ||
| T4 | N0-1 | M0 | ||
| 8 | Stádium III B | T4 | N2 | M0 |
| Bármely T | N3 | M0 | ||
| 9 | Stádium IV | Bármely T | Bármely N | M1a, M1b |
2.6. ECOG PERFORMANCE STATUS
| Fok | ECOG |
| 0 | Teljes aktivitás, önellátás, korlátozás nélkül. |
| 1 | Nem képes megerőltető aktivitásra, de könnyű munkát (pl. irodai munka, könnyű otthoni munka) képes végezni. |
| 2 | Ambuláns bejárásra képes, önellátó, de nem tud munkát végezni. Az ébren töltött órák több mint 50%- át ágyon kívül tölti. |
| 3 | Csak korlátozottan önellátó, az ébren töltött idő több mint 50%-át pihenéssel tölti. |
| 4 | Nem önellátó, teljes ellátást igényel, egész nap ágyhoz kötött. |
| 5 | Halál. |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
3.1. A nem-kissejtes tüdődaganat diagnosztizálási rendje
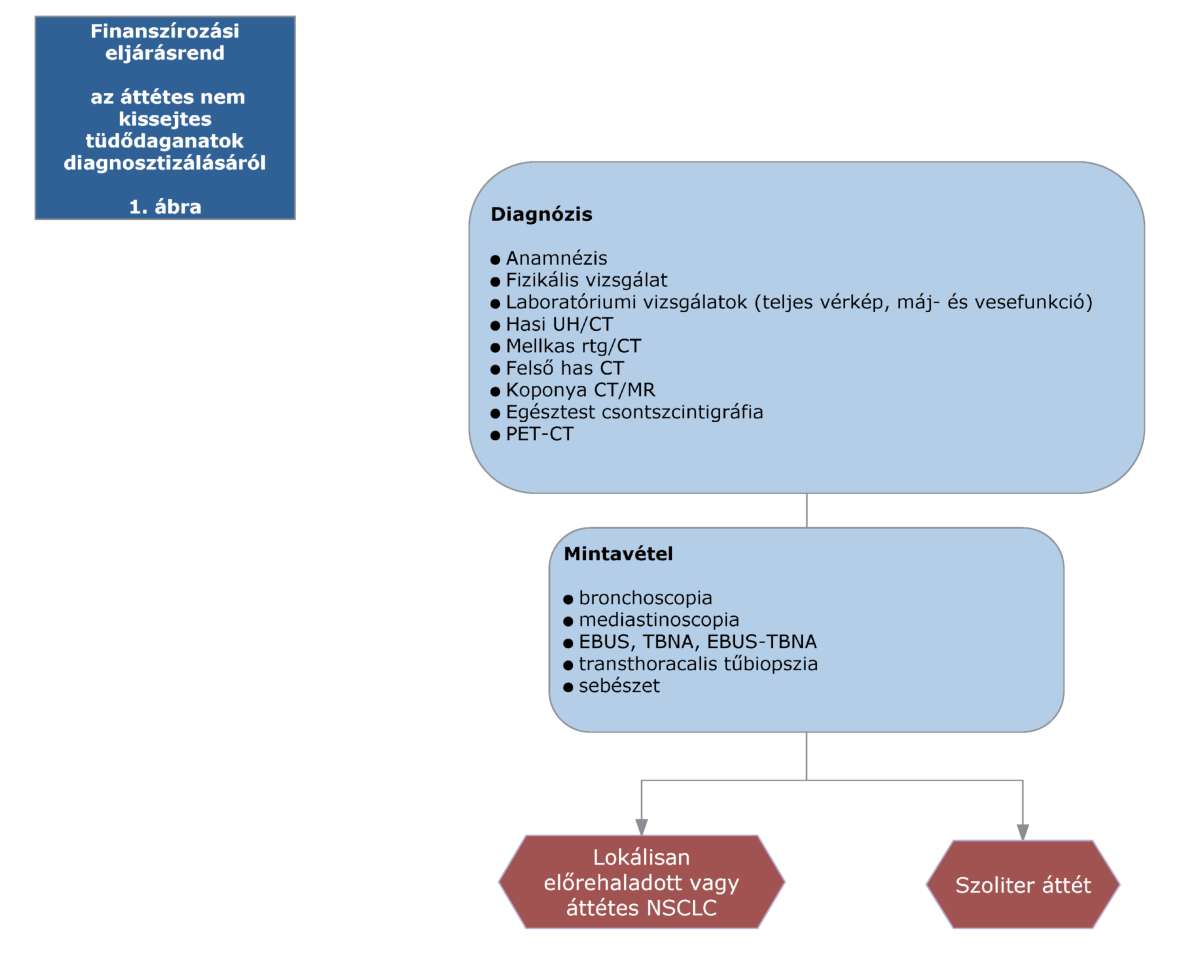
3.2. A nem-kissejtes tüdődaganat ellátása EGFR-TK aktiváló mutáció pozitív betegeknél
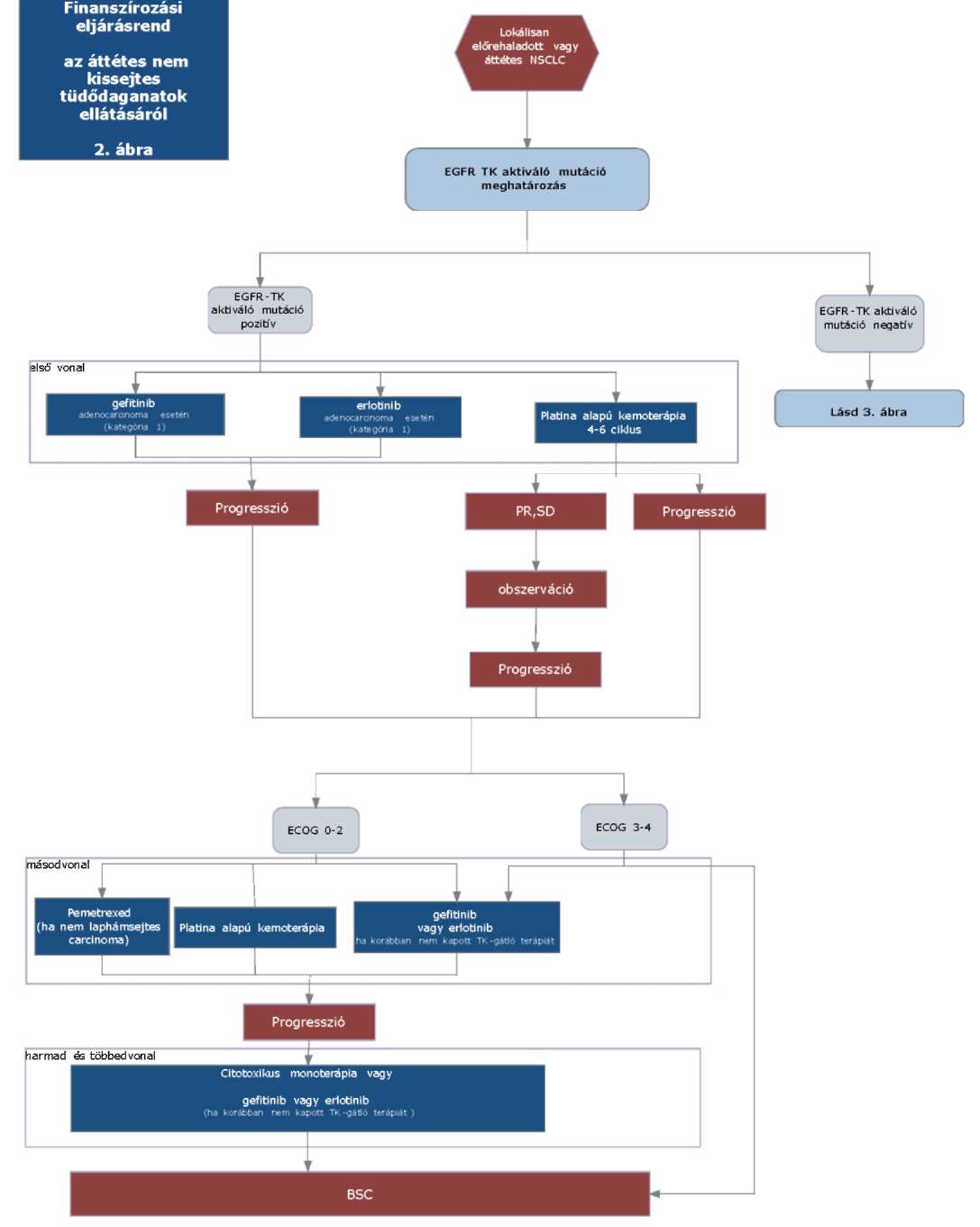
3.3. A nem-kissejtes tüdődaganat ellátása EGFR-TK aktiváló mutáció negatív betegeknél
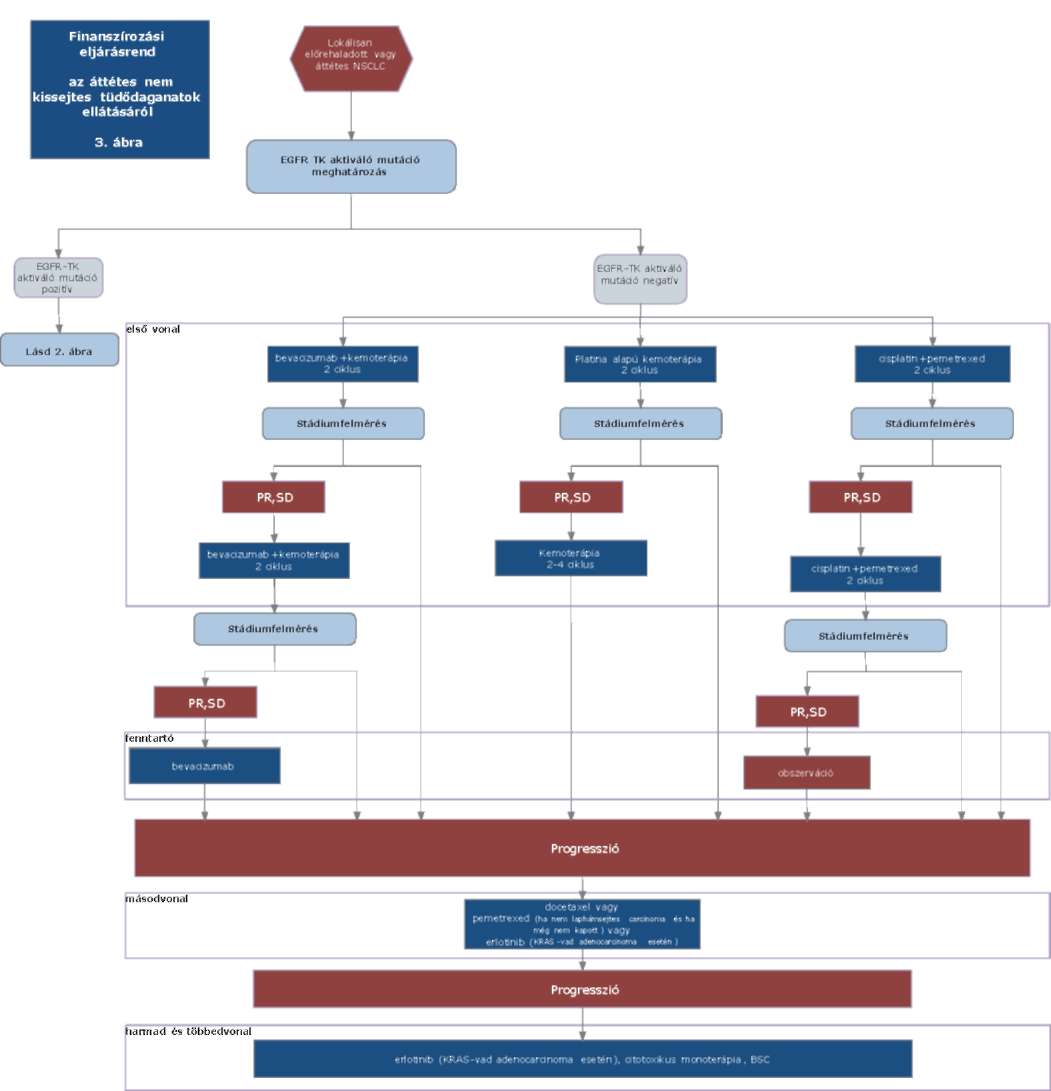
3.4. A nem-kissejtes tüdődaganat ellátási rendjéről szoliter áttét esetén
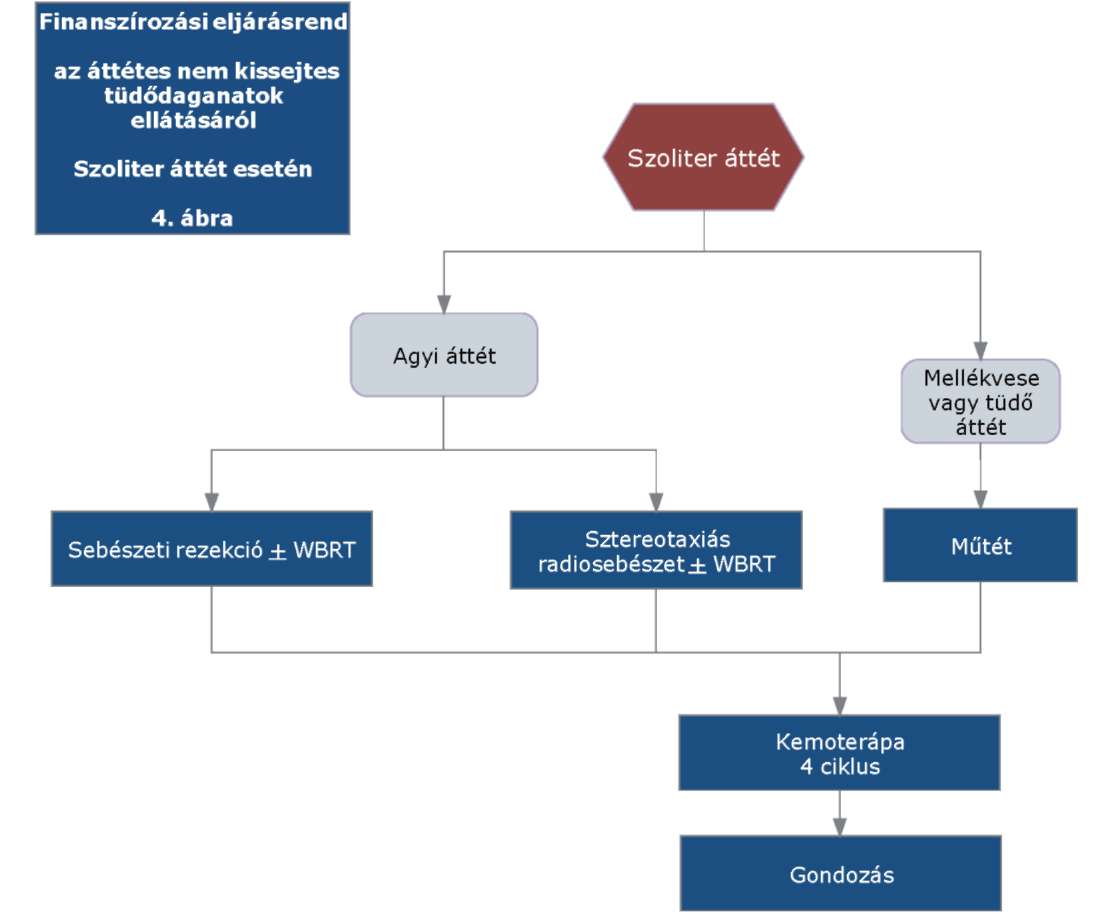
3.5. Megjegyzés:
A pemetrexed, bevacizumab, gefitinib és erlotinib terápiák tételes finanszírozásúak, a támogatott indikációk az alábbiak:
3.5.1. Pemetrexed: Lokálisan előrehaladott vagy metasztatikus adenocarcinoma és nagysejtes carcinoma típusú, nem-kissejtes tüdőrák elsővonalbeli kezelése platina-alapú kombinációban. Lokálisan előrehaladott vagy metasztatikus nem laphámsejtes, nem-kissejtes tüdőrák másodvonalbeli kezelése monoterápiában.
3.5.2. Bevacizumab: Inoperábilis előrehaladott, metasztatikus vagy kiújuló tüdő adenocarcinoma elsővonalbeli kezelése platina-alapú kemoterápiával kombinációban, majd azt követően monoterápiában progresszióig.
3.5.3. Gefitinib: Lokálisan előrehaladott vagy metasztatikus, nem-kissejtes tüdő adenocarcinómában szenvedő felnőtt betegek kezelésére, akiknél fennáll EGFR-TK aktiváló mutáció.
3.5.4. Erlotinib: Lokálisan előrehaladott vagy metasztatikus, nem-kissejtes tüdő adenocarcinómában szenvedő felnőtt betegek kezelésére, akiknél fennáll EGFR-TK aktiváló mutáció. Lokálisan előrehaladott vagy metasztatikus, nem-kissejtes tüdőkarcinómában szenvedő felnőtt betegek másod- és többedvonalbeli kezelésére, akiknél legalább egyféle kemoterápiás kezelés ellenére a WHO-kritériumok szerint értékelt progresszió jelentkezik, és az EGFR-TK (epidermális növekedési faktor receptor tirozinkináz) aktiváló mutációja vagy a K-RAS mutációjának hiánya (vad típus) igazolt, legfeljebb a WHO-kritériumok szerinti további progresszióig.
4. A nem-kissejtes tüdődaganat finanszírozásának ellenőrzési kritériumai
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. Szakmai ellenőrzési pontok
4.2.1. Stádiumbesztásra vonatkozó adatok megtalálhatóak-e?
4.2.2. A relapszus/progesszió igazolt és megfelelően dokumentált?
4.2.3. Megfelelően igazolták-e az EGFR-TK mutációt?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. A releváns BNO kódok
| 1 | A | B |
| BNO | BNO megnevezése | |
| 2 | C3400 | A főhörgő rosszindulatú daganata |
| 3 | C3410 | Felső lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 4 | C3420 | Középső lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 5 | C3430 | Alsó lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 6 | C3480 | A hörgő és tüdő átfedő elváltozása, rosszindulatú daganata |
| 7 | C3490 | Hörgő vagy tüdő rosszindulatú daganata, k.m.n. |
6.2. A releváns OENO kódok (diagnosztika)
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 12601 | EKG végtag és mellkaselvezetéssel |
| 3 | 16200 | Bronchoscopia |
| 4 | 18441 | Thoracocentesis diagnosticus |
| 5 | 25063 | Köpet, bronchusváladék tenyésztése |
| 6 | 28014 | Vérkép, automatával IV. |
| 7 | 31310 | Mellkasfelvétel, AP/PA |
| 8 | 34440 | Mellkas CT vizsgálata natív |
| 9 | 34441 | Mellkas CT vizsgálata iv. kontrasztanyag adását követőleg |
| 10 | 34442 | Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 11 | 34474 | Biopsia pulmonis transthoracalis, CT vezérelt |
| 12 | 34930 | Mellkas MR vizsgálata natív |
| 13 | 34931 | Mellkas MR vizsgálata iv. kontrasztanyag adását követőleg |
| 14 | 34932 | Mellkas MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 15 | 3523B | Áttekintő csontszcintigráfia |
| 16 | 3521A | Perfúziós tüdőszcintigráfia |
| 17 | 53416 | Mediastinoscopia collaris sec. Carlens |
| 18 | 53417 | Mediastinoscopia parasternalis sec. Stemmer |
| 19 | 89442 | Pulzoxymetria |
| 20 | 35960 | Egésztest PET/CT vizsgálata |
6.3. A releváns HBCS kódok (kemoterápia, radiokemoterápia)
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 7030 | Kemoterápia, EEP protokoll szerint |
| 3 | 7052 | Kemoterápia, GEM+CDDP II. protokoll szerint |
| 4 | 7053 | Kemoterápia, GEM/B protokoll szerint |
| 5 | 7059 | Kemoterápia, TXT+CDDP protokoll szerint |
| 6 | 7076 | Kemoterápia, CDDP+VNB protokoll szerint |
| 7 | 7088 | Kemoterápia, PEV protokoll szerint |
| 8 | 7089 | Kemoterápia, VICE protokoll szerint |
| 9 | 7092 | Kemoterápia, CBP+VP protokoll szerint |
| 10 | 7096 | Kemoterápia, MMC+IFO+CDDP protokoll szerint |
| 11 | 7097 | Kemoterápia, PE protokoll szerint |
| 12 | 7098 | Kemoterápia, IEC protokoll szerint |
| 13 | 7099 | Kemoterápia, TAX+CBP protokoll szerint |
| 14 | 7119 | Kemoterápia, heti TAX protokoll szerint |
| 15 | 7179 | Kemoterápia, GEM/C protokoll szerint |
| 16 | 7180 | Kemoterápia, GEM+CBP/B protokoll szerint |
| 17 | 7183 | Kemoterápia, CBP+TXT/C protokoll szerint |
| 18 | 7184 | Kemoterápia, TXT/B monoterápia protokoll szerint |
| 19 | 7185 | Kemoterápia, PEM monoterápia protokoll szerint |
| 20 | 7186 | Kemoterápia, CDDP+VNB/B protokoll szerint |
| 21 | 7187 | Kemoterápia, VNB protokoll szerint |
| 22 | 7188 | Kemoterápia, PE/B protokoll szerint |
| 23 | 7189 | Kemoterápia, PE/C protokoll szerint |
| 24 | 7191 | Kemoterápia, PEM-CDDP protokoll szerint |
| 25 | 7195 | Kemoterápia, CEP/B protokoll szerint |
| 26 | 7320 | Kemoterápia, GEM+CBP/C protokoll szerint |
| 27 | 7362 | Kemoterápia, BEV-tüdő monoterápia protokoll szerint |
| 28 | 7369 | Kemoterápia, CDDP+TAX/B protokoll szerint |
| 29 | 7370 | Kemoterápia, CPH+CDDP/B protokoll szerint |
| 30 | 7402 | Kemoterápia, CEP II. protokoll szerint |
| 31 | 7419 | Radiokemoterápia, tüdőrák esetén CDDP protokoll szerint |
| 32 | 7420 | Radiokemoterápia, nem kissejtes tüdőrák esetén TAX protokoll szerint |
| 33 | 7422 | Radiokemoterápia, tüdőrák esetén CDDP-VP/B protokoll szerint |
| 34 | 7423 | Radiokemoterápia, nem kissejtes tüdőrák esetén TXT-CDDP protokoll szerint |
| 35 | 7424 | Radiokemoterápia, nem kissejtes tüdőrák esetén TAX-CBP protokoll szerint |
| 36 | 7436 | Kemoterápia, GEM+CDDP II.+BEV protokoll szerint |
| 37 | 7437 | Kemoterápia, TXT+CDDP+BEV protokoll szerint |
| 38 | 7438 | Kemoterápia, CDDP+VNB/A protokoll szerint |
| 39 | 7458 | Kemoterápia, VNB+CBP protokoll szerint |
| 40 | 7468 | Radiokemoterápia, tüdőrák esetén CBP protokoll szerint |
| 41 | 7474 | Kemoterápia, TAX+CBP+BEV protokoll szerint |
| 42 | 7475 | Kemoterápia, GEM+CBP/B+BEV protokoll szerint |
| 43 | 7477 | Kemoterápia, CDDP+TAX/C+BEV protokoll szerint |
| 44 | 7478 | Kemoterápia, CBP+TXT/C+BEV protokoll szerint |
| 45 | 7479 | Kemoterápia, CDDP+VNB/B+BEV protokoll szerint |
| 46 | 7485 | Kemoterápia, VNB+CBP+BEV protokoll szerint |
| 47 | 7702 | Kemoterápia, EEP+dexrazoxane protokoll szerint |
| 48 | 7721 | Kemoterápia, CEP II.+dexrazoxane protokoll szerint |
6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC kód | ATC megnevezés |
| 2 | L01XA02 | carboplatin |
| 3 | L01XA01 | cisplatin |
| 4 | L01AA01 | cyclophosphamid |
| 5 | L01CD02 | docetaxel |
| 6 | L01CB01 | etoposide |
| 7 | L01BC05 | gemcitabine |
| 8 | L01AA06 | ifosfamide |
| 9 | V03AF01 | mesna |
| 10 | L01CD01 | paclitaxel |
| 11 | L01BA04 | pemetrexed |
| 12 | L01CA04 | vinorelbine |
| 13 | L01XC07 | bevacizumab |
| 14 | L01XE03 | erlotinib |
| 15 | L01XE02 | gefitinib |
7. Rövidítések
CR Komplett remisszió
CT Computer tomográfia
EBUS Endobronchialis ultrasound (endobronchiális ultrahang)
EGFR Epidermális növekedési faktor
EGFR-TK Epidermális növekedési faktor receptor tirozinkináz
KRAS Daganat növekedését befolyásoló gén
NSCLC Non small cell lung cancer (Nem-kissejtes tüdődaganat)
MR Mágneses rezonancia vizsgálat
PET-CT Pozitron emissziós tomográfia
PR Parciális remisszió
PS Általános állapot
rtg Röntgen
SD Változatlan állapot (stable disease)
TBNA Transbronchialis needle biopsy (transbronchialis tűbiopszia)
UH Ultrahang
WBRT Whole brain radiotherapy (teljes agykoponya besugárzás)"
44. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
"41. melléklet a 31/2010. (V. 13.) EüM rendelethez
A kissejtes tüdődaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések
Kissejtes tüdődaganat
2. A kórkép leírása
A tüdőrák Magyarországon a vezető daganat, évi kb. 10 000 új eset kerül felismerésre. A kissejtes tüdőrák a tüdő daganatos megbetegedéseinek kb. 15-18%-át teszi ki, így évente kb. 1500-1800 új esetet diagnosztizálnak. Az utóbbi években az előfordulása csökken, de a nőknél emelkedik, a férfi-női arány 1:1. A dohányzás a tüdődaganat kialakulását elősegíti, a kissejtes tüdőrák kialakulásának kockázatát fokozza. Mind a két nemnél egyformán növeli a daganatos kockázatot, de a nők érzékenyebbek a dohányzás carcinogén hatására. A legtöbb betegnél hematogén módon történő gyors áttétképződés van jelen. A betegek csak harmadánál lokalizált, azaz a tüdőre lokalizált a betegség. A kissejtes tüdőrák magas osztódási rátával bír. Csaknem minden esetben keratin, TTF-1 (thyroid transcripciós factor-1), valamint epiteliális membrán antigén pozitív. A legtöbb kissejtes tüdőrák pozitív reakciót ad a neuroendokrin differenciációs markerekkel, mint a chromogranin A-val, NSE-vel (neuron specifikus enoláz), és NCAM-val (neural cell adhesion molecule). A TNM klasszifikáció mellett a limitált betegség (LD limited disease), illetve a kiterjedt betegség (ED extensive disease) meghatározások használatosak. A limitált betegséghez tartozik a T1-2, N0, valamint a Tx, N1, míg a kiterjedt betegség a T3-4, Nx, M0, valamint a Tx, Nx, M1.
2.1. TNM klinikai klasszifikáció, primer daganat
2.1.1. Primer daganat
| A | B | |
| 1 | Tx | Primer daganat nem mutatható ki, vagy a tumor köpetcitológia vagy bronchus mosófolyadékból kimutatható, de nem vizualizálható a képalkotók vagy bronchoscopia által |
| 2 | T0 | Primer tumor nem igazolható |
| 3 | Tis | Carcinoma in situ |
| 4 | T1 | A tumor legnagyobb átmérője 3 cm vagy kisebb, tüdőszövet vagy visceralis pleura fogja körül, bronchoscopos vizsgálattal nem mutatható ki infiltráció egy lebenyhörgőtől proximalisan (a főhörgő szabad)1 |
| 5 | T1a | A tumor legnagyobb átmérője 2 cm vagy kisebb |
| 6 | T1b | A tumor több, mint 2 cm, de nem több, mint 3 cm legnagyobb átmérőjét tekintve |
| 7 | T2 | A tumor több, mint 3 cm, de nem több, mint 7 cm a következő jellemzőkkel2 - a tumor befogja a főhörgőt, 2 cm-re vagy annál távolabb a carinától, - a tumor infiltrálja a visceralis pleurát (PL1 vagy PL2), - kísérő atelectasia, vagy a hilusig terjedő obstruktív gyulladás, mely azonban nem terjed ki a az egész tüdőre |
| 8 | T2a | A tumor több, mint 3 cm, de nem több, mint 5 cm a legnagyobb átmérőjét tekintve |
| 9 | T2b | A tumor több, mint 5 cm, de nem több, mint 7 cm a legnagyobb átmérőjét tekintve |
| 10 | T3 | A tumor nagyobb, mint 7 cm, vagy közvetlenül ráterjed a következő struktúrák egyikére: parietalis pleura (PL3), mellkasfal (beleértve a sulcus superior tumorait), rekeszizom, nervus phrenicus, mediastinalis pleura, parietalis pericardium; vagy főbronchusban elhelyezkedő tumor, mely 2 cm-nél kisebb távolságban helyezkedik el a carinától distalisan, de maga a carina nincs beszűrve; vagy a tumor az egész tüdő atelectasiáját vagy obstruktív gyulladását okozza, vagy különálló tumor (nodulus) ugyanabban a lebenyben |
| 11 | T4 | Bármely nagyságú tumor, mely infiltrája a következő struktúrák egyikét: mediastinum, szív, nagyerek, légcső, nervus laryngeus recurrens, nyelőcső, csigolyatest, carina; különálló daganat fészkek A különböző azonos oldali lebenyekben |
2.2. TNM klinikai klasszifikáció, regionális nyirokcsomók
2.2.1. Regionális nyirokcsomók
| A | B | |
| 1 | Nx | Regionális nyirokcsomók nem megítélhetők |
| 2 | N0 | Nincs regionális nyirokcsomó áttét |
| 3 | N1 | Áttét az azonos oldali peribronchiális, illetve azonos oldali hilusi nyirokcsomókban, beleértve a primer tumor közvetlen ráterjedését is |
| 4 | N2 | Metastasisok az ipsilateralis mediastinális, illetve subcarinalis nyirokcsomókban |
| 5 | N3 | Metastasisok a kontralaterális mediastinális, kontralaterális hilusi, ipsi- vagy kontralaterális scalenusvagy supraclavicularis nyirokcsomókban |
2.3. TNM klinikai klasszifikáció, távoli áttét
2.3.1. Távoli áttét
| A | B | |
| 1 | M0 | Nincs távoli áttét |
| 2 | M1 | Távoli áttét |
| 3 | M1a | Különálló daganatfészkek az ellenoldali tüdőlebenyben, pleurális daganatfészkekkel, vagy malignus pleurális vagy pericardiális3 folyadékgyülemmel |
| 4 | M1b | Távoli áttét |
2.4. Megjegyzések:
1 Bármely méretű, ritkán superficiális terjedésű tumor, melynek az invazív komponense a bronchus falára korlátozódik, és proximál felé a fő bronchusig ér, szintén T1a-ként klasszifikált.
2 T2 tumorok a fenti jellemzőkkel T2a csoportba sorolandók, ha 5 cm vagy kisebb méretűek, vagy ha a méret nem meghatározott, és T2b ha nagyobb, mint 5 cm, de nem nagyobb, mint 7 cm.
3 Leggyakrabban a pleurális és pericardiális folyadékgyülem a tüdőtumor következménye. Néhány betegben a pleuralis (pericardiális) folyadék többszörös mikroszkópos vizsgálata negatív daganatsejtre nézve, és a folyadék nem véres és nem exudatum. Ha az előbbiek és a klinikai megítélés alapján a folyadék nem függ össze a daganattal, a folyadék jelenlétét ki kell zárni a staging elemekből, és M0-nak kell tekinteni.
2.5. Stádium besorolás
| A | B | C | D | |
| 1 | Occult carcinoma | Tx | N0 | M0 |
| 2 | Stádium 0 | Tis | N0 | M0 |
| 3 | Stádium IA | T1ab | N0 | M0 |
| 4 | Stádium IB | T2a | N0 | M0 |
| 5 | Stádium II A | T2b | N0 | M0 |
| T1ab | N1 | M0 | ||
| T2a | N1 | M0 | ||
| 6 | Stádium II B | T2b | N1 | M0 |
| T3 | N0 | M0 | ||
| 7 | Stádium IIIA | T1-2 | N2 | M0 |
| T3 | N1-2 | M0 | ||
| T4 | N0-1 | M0 | ||
| 8 | Stádium III B | T4 | N2 | M0 |
| Bármely T | N3 | M0 | ||
| 9 | Stádium IV | Bármely T | Bármely N | M1a, M1b |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
3.1. A kissejtes tüdődaganat diagnosztizálása és a limitált betegség ellátása
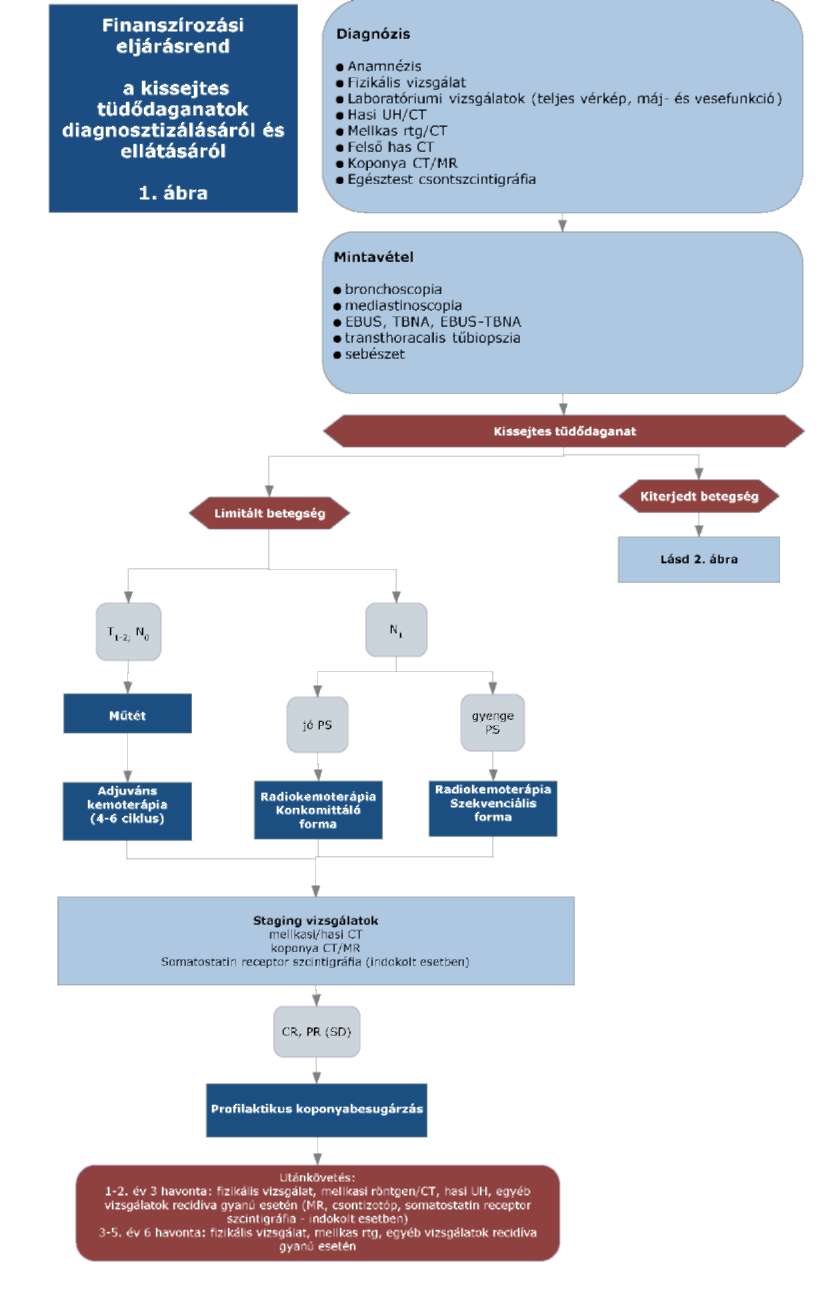
3.2. A kiterjedt kissejtes tüdődaganat ellátása
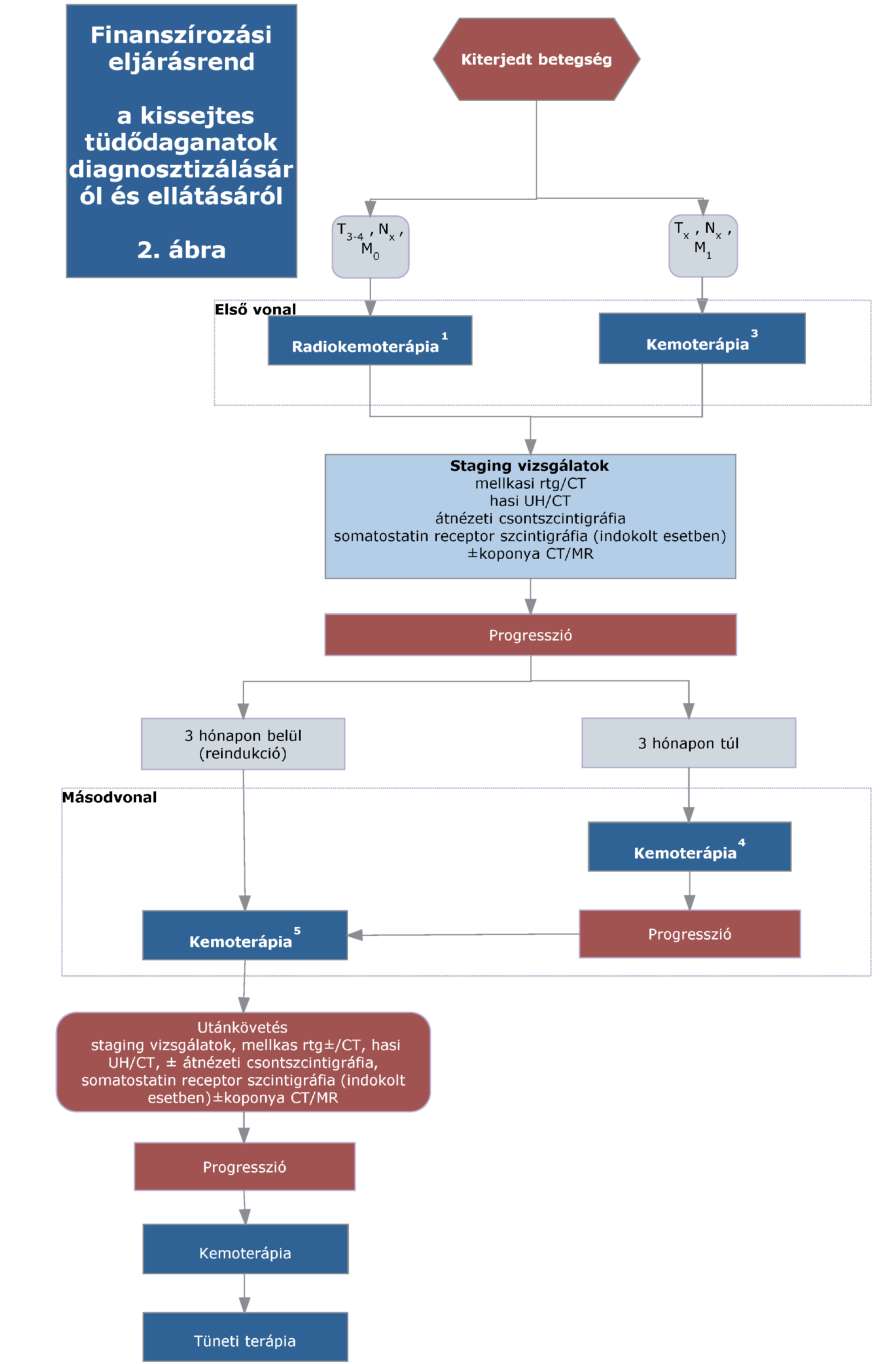
3.3. Az algoritmusban számmal megjelölt kemo-, illetve radioterápiák az alábbiak:
3.3.1. 1: radioterápia+ kemoterápia
3.3.2. 7422* Radiokemoterápia, tüdőrák esetén CDDP-VP/B protokoll szerint
3.3.3. 2: 4-6 ciklus PE (cisplatin+etoposid) vagy
EC (etoposid+carboplatin)
CEV (cyclophosphamid +epirubicin+vincristin) vagy
3.3.4. 3: 4-6 ciklus PE (cisplatin+etoposid)
3.3.5. 4: PE (cisplatin+etoposid)
3.3.6. 5: CEV (cyclophosphamid +epirubicin+vincristin), vagy TOP (topotecan)
3.4. Megjegyzés:
3.4.1. Szekvenciális radiokemoterápia:
N0-1-2 2-3x kemoterápia, majd 45-50/2,5 Gy irradiáció kiterjesztett mezőből, majd a kemoterápia folytatása összesen 4-6 kúráig. A sorozat végén változatlan M0 esetén 10x2,5 Gy teljes agykoponya profilaktikus besugárzás.
3.4.2. Konkomittáló radiokemoterápia:
1x kemoterápia, majd 50/2 Gy irradiáció konkomittálóan a 2. és 3. ciklussal, majd 4. ciklus konszolidációban (max. 6. ciklusig). (A evidencia)
3.4.3. Profilaktikus koponya besugárzás: 10x2,5 Gy. minden betegnél, amennyiben nem progrediált.
3.4.4. Cisplatin Hospira-nak nincs támogatott indikációja tüdődaganatban.
3.4.5. Az epirubicin-TEVA és az epirubicin- Kabi hatóanyagok törzskönyvi indikációjában nincs külön kiemelve a tüdődaganat, azonban megfogalmazták, hogy többféle daganat kezelésére alkalmas, melyre mindössze néhány példát hoztak.
3.4.6. Az uromitexan kötelező kiegészítője a tüdődaganat indikációjában támogatott ifosfamide-nek.
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
5. Szakmai ellenőrzési pontok
5.1. A diagnózis kritériumainak felállítása megfelelő volt-e?
5.2. Az utánkövetés a megfelelő időben megtörtént-e, és ezen minden szükséges vizsgálatot elvégeztek-e?
6. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
6.1. A terültre fordított közkiadások alakulása.
6.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
7. A finanszírozás szempontjából lényeges finanszírozási kódok
7.1. A releváns BNO kódok
| A | B | |
| 1 | BNO | BNO megnevezés |
| 2 | C3400 | A főhörgő rosszindulatú daganata |
| 3 | C3410 | Felső lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 4 | C3420 | Középső lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 5 | C3430 | Alsó lebeny, hörgő vagy tüdő rosszindulatú daganata |
| 6 | C3480 | A hörgő és tüdő átfedő elváltozása, rosszindulatú daganata |
| 7 | C3490 | Hörgő vagy tüdő rosszindulatú daganata, k.m.n. |
7.2. A releváns OENO kódok
| A | B | |
| 1 | OENO | OENO megnevezés |
| 2 | 12601 | EKG végtag és mellkaselvezetéssel |
| 3 | 16200 | Bronchoscopia |
| 4 | 18441 | Thoracocentesis diagnosticus |
| 5 | 25063 | Köpet, bronchusváladék tenyésztése |
| 6 | 28014 | Vérkép, automatával IV. |
| 7 | 31310 | Mellkasfelvétel, AP/PA |
| 8 | 34440 | Mellkas CT vizsgálata natív |
| 9 | 34441 | Mellkas CT vizsgálata iv. kontrasztanyag adását követőleg |
| 10 | 34442 | Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 11 | 34474 | Biopsia pulmonis transthoracalis, CT vezérelt |
| 12 | 34930 | Mellkas MR vizsgálata natív |
| 13 | 34931 | Mellkas MRvizsgálata iv. kontrasztanyag adását követőleg |
| 14 | 34932 | Mellkas MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
| 15 | 3523B | Áttekintő csontszcintigráfia |
| 16 | 3521A | Perfúziós tüdőszcintigráfia |
| 17 | 53416 | Mediastinoscopia collaris sec. Carlens |
| 18 | 53417 | Mediastinoscopia parasternalis sec. Stemmer |
| 19 | 89442 | Pulzoxymetria |
| 20 | 35274 | Szomatostatin receptor szcintigráfia |
7.3. A releváns HBCS kódok
| A | B | |
| 1 | HBCS | HBCS megnevezés |
| 2 | 7094* | Kemoterápia, CEV (kissejtes tüdőrák) protokoll szerint |
| 3 | 7097J | Kemoterápia, PE protokoll szerint |
| 4 | 7098J | Kemoterápia, IEC protokoll szerint |
| 5 | 7188 | Kemoterápia, PE/B protokoll szerint |
| 6 | 7077 | Kemoterápia, ECO protokoll szerint |
| 7 | 7088 | Kemoterápia, PEV protokoll szerint |
| 8 | 7096 | Kemoterápia, MMC+IFO+CDDP protokoll szerint |
| 9 | 7367 | Kemoterápia, TOP/B protokoll szerint |
| 10 | 7422 | Radiokemoterápia, tüdőrák esetén CDDP-VP/B protokoll szerint |
| 11 | 7189 | Kemoterápia, PE/C protokoll szerint |
7.4. A releváns ATC kódok
| A | B | |
| 1 | ATC kód | ATC megnevezés |
| 2 | L01XA02 | carboplatin |
| 3 | L01XA01 | cisplatin |
| 4 | L01AA01 | cyclophosphamid |
| 5 | L01DB01 | doxorubicin |
| 6 | L01DB03 | epirubicin |
| 7 | L01CB01 | etoposide |
| 8 | L01AA06 | ifosfamide |
| 9 | V03AF01 | mesna |
| 10 | L01DC03 | mitomycin |
| 11 | L01XX17 | topotecan |
| 12 | L01CA02 | vincristine |
8. Fogalmak, rövidítések
CR Komplett remisszió
CT Computer tomográfia
EBUS Endobronchialis ultrasound (endobronchiális ultrahang)
LDH Laktát-dehidrogenáz
MR Mágneses rezonancia vizsgálat
PS Általános állapot
PR Parciális remisszió
rtg Röntgen
SD Változatlan állapot
SCLC Small cell lung cancer (kissejtes tödődaganat)
TBNA Transbronchialis needle biopsy (transbronchialis tűbiopszia)
UH Ultrahang"
45. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
1. Az R3. 2. melléklet I. pontjában foglalt táblázat a "43593" megjelölésű sort követően a következő sorral egészül ki:
| (OENO kód | Cs | Egészségügyi eljárás | 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | 11 | 12 | ||||||||||||||||||||||||||
| " | ||||||||||||||||||||||||||||||||||||||||
| 43594 | Meningococcuselleni vaccinatio | O | O | X | ||||||||||||||||||||||||||||||||||||
| 13 | 14 | 16 | 18 | 19 | 22 | 24 | 26 | 28 | 29 | 31 | 32 | 33 | 34 | 38 | 39 | 40 | 46 | 48 | 50 | 51 | 54 | 55 | 56 | 59 | 601 | 604 | 65 | A2 | OENO kód2) | |||||||||||
| O | 43594 | |||||||||||||||||||||||||||||||||||||||
| " | ||||||||||||||||||||||||||||||||||||||||
2. Az R3. 2. melléklet I. pontjában foglalt táblázat a "99910" megjelölésű sort követően a következő sorral egészül ki:
| (OENO kód | Cs | Egészségügyi eljárás | 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 | 11 | 12 | |||||||||||||||||||||||||||
| 99930 | * | Kiegészítő pont onkológiai indikációjú CT, MRdiagnosztika 14 napon belül történő elvégzése és rosszindulatú daganatos kórkép igazolódása esetén | |||||||||||||||||||||||||||||||||||||||
| 13 | 14 | 16 | 18 | 19 | 22 | 24 | 26 | 28 | 29 | 31 | 32 | 33 | 34 | 38 | 39 | 40 | 46 | 48 | 50 | 51 | 54 | 55 | 56 | 59 | 601 | 604 | 65 | A2 | OENO kód2) | ||||||||||||
| X | 99930 | ||||||||||||||||||||||||||||||||||||||||
46. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
1. Az R3. 3. melléklet "42190 Újszülött kori objektív hallásszűrés" megjelölésű része helyébe a következő rendelkezés lép:
"42190 Újszülött kori objektív hallásszűrés
Újszülött korban teljes körűen, lehetőleg kórházból történő hazabocsátás előtt szűrő BERA-val történő hallásvizsgálat.
Elszámolási lehetőség: 0-1 éves korig
Kizárva: 12393, 1239A, 11041, 11042, 11301, 11302"
2. Az R3. 3. melléklete a "43593 Tüdőgyulladás elleni vaccinatio" megjelölésű részt követően a következő rendelkezéssel egészül ki:
"43594 Meningococcus elleni vaccinatio
Meningococcus elleni vaccinatio"
3. Az R3. 3. melléklete a "99910 Kiegészítő pont veszélyeztető beteg ellátásáért" megjelölésű részt követően a következő rendelkezéssel egészül ki:
"99930* Kiegészítő pont onkológiai indikációjú CT, MR diagnosztika 14 napon belül történő elvégzése és rosszindulatú daganatos kórkép igazolódása esetén
Kiegészítő pont onkológiai indikációjú CT, MR diagnosztika 14 napon belül történő elvégzése és rosszindulatú daganatos kórkép igazolódása esetén."
47. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az R4. 2. melléklet "**** 99 959J Rosszindulatú daganat kemoterápiája "J"" megjelölésű része helyébe a következő rendelkezés lép:
"**** 99 959J Rosszindulatú daganat kemoterápiája "J"
DAGANATOK "S"
A kódlistát ld. kiemelve a főcsoport elején!
DAGANATOK "W5"
A kódlistát ld. kiemelve a főcsoport elején!
DAGANATOK "R1"
A kódlistát ld. kiemelve a főcsoport elején!
KEMOTERÁPIÁK "*E"
7318* Kemoterápia, INF-alfa+IL2+5FU protokoll szerint
KEMOTERÁPIÁK "*F"
7998* Kemoterápia, KAB protokoll szerint
(["1"-ES TÍPUSKÉNT DAG. "S" ÉS "3"-AS TÍPUSKÉNT DAG. "W5"] ÉS KEMOT. "*E") VAGY (DAG. "R1" ÉS KEMOT. "*F")"
48. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
1. Az R4. 4. mellékletében foglalt táblázat az "58132" megjelölésű sort követően a következő sorral egészül ki:
| (KÓD | MEGNEVEZÉS | BESOROLÁSI SZEMPONT) |
| " | ||
| 58133 | Felszínpótló bokaízületi protézis beültetése | * |
| " | ||
2. Az R4. 4. mellékletében foglalt táblázat a "79971" megjelölésű sort követően a következő sorral egészül ki:
| (KÓD | MEGNEVEZÉS | BESOROLÁSI |
| SZEMPONT) | ||
| " | ||
| 79981 | Kemoterápia, KAB protokoll szerint (01. fázis) | * |
| " | ||
49. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az R5. 1. mellékletében foglalt táblázat a "79971" megjelölésű sort követően a következő sorral egészül ki:
| (Kód | Megnevezés) |
| " | |
| 79981 | Kemoterápia, KAB protokoll szerint (01. fázis) |
| " | |
50. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az R5. 2. melléklete a "7997J Kemoterápia, N7 protokoll szerint 18 év alatt" megjelölésű részt követően a következő résszel egészül ki:
| "7998* Kemoterápia, KAB protokoll szerint | ||||
| Protokoll időtartama : 1 [nap] Protokollok közti szünet : 20 [nap] Fázisok száma : 1 | ||||
| Diagnózisok: | ||||
| C61H0 A prostata rosszindulatú daganata | ||||
| Fázisok leírása: | ||||
| Beavatkozás kód: 79981 Kemoterápia, KAB protokoll szerint (01. fázis) | ||||
| Fázis azonosító: 1 Fázis hossza: 1 [nap] | ||||
| KAB Kabazitaxel Adagolás: 25,0 mg/m2 | ||||
| Ellátási napok a ciklus kezdetétől: | 1 | |||
| Fázisok: | 1 | |||
| KAB | kabazitaxel | * | ||
51. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az R5. 3. mellékletében foglalt táblázat a következő 28a. sorral egészül ki:
| (1. | Szinonima | Hatóanyag | ATC-kód) |
| " | |||
| 28a. | KAB | Kabazitaxel | L01CD04 |
| " | |||
52. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az R5. 4. mellékletében foglalt táblázat "C61" megjelölésű része a "7216" megjelölésű sort követően a következő sorral egészül ki:
| (Kód | Megnevezés | Melyik HBCS-be sorolódik | |
| C61 | A prostata rosszindulatú daganata) | ||
| " | |||
| 7998 | Kemoterápia, KAB protokoll szerint | 959J | Rosszindulatú daganat kemoterápiája "J" |
| " | |||


