36/2019. (XII. 30.) EMMI rendelet
az egyes gyógyszerek társadalombiztosítási támogatásáról szóló miniszteri rendeletek módosításáról
A kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (4) bekezdés k) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 92. § (1) bekezdés 2. pontjában meghatározott feladatkörömben eljárva,
a 2. alcím, valamint a 3-6. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (3) bekezdés c) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 92. § (1) bekezdés 2. pontjában meghatározott feladatkörömben eljárva - a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 64. § (1) bekezdés 2. pontjában meghatározott feladatkörében eljáró pénzügyminiszterrel egyetértésben -,
a 3. alcím, valamint a 7-16. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés a) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 92. § (1) bekezdés 2. pontjában meghatározott feladatkörömben eljárva,
a 4-5. alcím, valamint 17-22. melléklet tekintetében a kötelező egészségbiztosítás ellátásairól szóló 1997. évi LXXXIII. törvény 83. § (6) bekezdés f) pontjában kapott felhatalmazás alapján, a Kormány tagjainak feladat- és hatásköréről szóló 94/2018. (V. 22.) Korm. rendelet 92. § (1) bekezdés 2. pontjában meghatározott feladatkörömben eljárva
a következőket rendelem el:
1. Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet módosítása
1. § (1) Az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet (a továbbiakban: R1.) 1/A. számú melléklete az 1. melléklet szerint módosul.
(2) Az R1. 4. számú melléklete a 2. melléklet szerint módosul.
2. A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet módosítása
2. § (1) A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet (a továbbiakban: R2.) 25. §-a a következő (19) bekezdéssel egészül ki:
"(19) A 2. számú melléklet 2020. január 15-ét megelőzően hatályos Eü100 66. pontja alapján felírt gyógyszerek vényei érvényességi idejükig válthatóak ki és számolhatóak el."
(2) Az R2.1. számú melléklete a 3. melléklet szerint módosul.
(3) Az R2. 2. számú melléklete a 4. melléklet szerint módosul.
(4) Az R2. 3. számú melléklete az 5. melléklet szerint módosul.
(5) Az R2. 4. számú melléklete a 6. melléklet szerint módosul.
3. A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet módosítása
3. § (1) A finanszírozási eljárásrendekről szóló 31/2010. (V. 13.) EüM rendelet (a továbbiakban: R3.) 2. melléklete a 7. melléklet szerint módosul.
(2) Az R3. 5. melléklete a 8. melléklet szerint módosul.
(3) Az R3. 10. melléklete a 9. melléklet szerint módosul.
(4) Az R3. 11. melléklete a 10. melléklet szerint módosul.
(5) Az R3. 14. melléklete a 11. melléklet szerint módosul.
(6) Az R3. 17. melléklete a 12. melléklet szerint módosul.
(7) Az R3. 19. melléklete a 13. melléklet szerint módosul.
(8) Az R3. 29. melléklete a 14. melléklet szerint módosul.
(9) Az R3. 31. melléklete a 15. melléklet szerint módosul.
(10) Az R3. 37. melléklete a 16. melléklet szerint módosul.
4. A gyógyító-megelőző eljárás jogcímén az Egészségbiztosítási Alap terhére finanszírozható homogén betegségcsoportok kódolási és besorolási szabályairól szóló 10/2012. (II. 28.) NEFMI rendelet módosítása
4. § (1) A gyógyító-megelőző eljárás jogcímén az Egészségbiztosítási Alap terhére finanszírozható homogén betegségcsoportok kódolási és besorolási szabályairól szóló 10/2012. (II. 28.) NEFMI rendelet (a továbbiakban: R4.) 2. melléklete a 17. melléklet szerint módosul.
(2) Az R4. 4. melléklete a 18. melléklet szerint módosul.
5. Az Egészségbiztosítási Alapból a 959A-L, valamint 9511-9515 homogén betegségcsoportok szerint finanszírozott daganatellenes terápiákról szóló 11/2012. (II. 28.) NEFMI rendelet módosítása
5. § (1) Az Egészségbiztosítási Alapból a 959A-L, valamint 9511-9515 homogén betegségcsoportok szerint finanszírozott daganatellenes terápiákról szóló 11/2012. (II. 28.) NEFMI rendelet (a továbbiakban: R5.) 1. melléklete a 19. melléklet szerint módosul.
(2) Az R5. 2. melléklete a 20. melléklet szerint módosul.
(3) Az R5. 3. melléklete a 21. melléklet szerint módosul.
(4) Az R5. 4. melléklete a 22. melléklet szerint módosul.
6. Záró rendelkezések
6. § Ez a rendelet 2020. január 15-én lép hatályba.
Dr. Kásler Miklós s. k.,
emberi erőforrások minisztere
1. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R1. 1/A. számú mellékletének 1/a1. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház"
2. Az R1. 1/A. számú mellékletének 1/a2. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház"
3. Az R1. 1/A. számú mellékletének 2/a. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház"
4. Az R1. 1/A. számú mellékletének 3. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"2425 Tolna Megyei Balassa János Kórház"
5. Az R1. 1/A. számú mellékletének 4. pontjának "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorokkal egészül ki:
"06067 szekukinumab 06068 ixekizumab"
6. Az R1. 1/A. számú mellékletének 4. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"2425 Tolna Megyei Balassa János Kórház"
7. Az R1. 1/A. számú mellékletének 5. pontjának "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorral egészül ki:
"06074 guszelkumab"
8. Az R1. 1/A. számú mellékletének 6/a1. pontjának "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorral egészül ki:
"06075 sarilumab"
9. Az R1. 1/A. számú mellékletének 6/a1. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"2425 Tolna Megyei Balassa János Kórház"
10. Az R1. 1/A. számú mellékletének 6/a2. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"2425 Tolna Megyei Balassa János Kórház"
11. Az R1. 1/A. számú mellékletének 6/b. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"2425 Tolna Megyei Balassa János Kórház"
12. Az R1. 1/A. számú mellékletének 6/c. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"2425 Tolna Megyei Balassa János Kórház"
13. Az R1. 1/A. számú mellékletének 7/a. pontjának az "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorral egészül ki:
"06076 ixazomib"
14. Az R1. 1/A. számú melléklet 7/b7. pontja "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű részében a "06067 Plerixafor" szövegrész hatályát veszti, helyébe a következő sor lép:
"06073 Plerixafor"
15. Az R1. 1/A. számú melléklete a következő 7/b12. ponttal egészül ki:
"7/b12. pont
TÁMOGATOTT INDIKÁCIÓK:
Olyan 17p delécióval vagy TP53 mutációval nem rendelkező krónikus lymphoid leukémiában (CLL) szenvedő betegek esetén, akiknél egy kezelési ciklust követően relapszus vagy progresszió következik be.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06028 ibrutinib
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1568 Fejér Megyei Szent György Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1876 Szent Borbála Kórház, Tatabánya
2137 Kaposi Mór Oktató Kórház, Kaposvár
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet, Szolnok
2425 Tolna Megyei Balassa János Kórház
2734 Zala Megyei Kórház, Zalaegerszeg
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház"
16. Az R1. 1/A. számú melléklete a következő 7/b13. ponttal egészül ki:
"7/b13. pont
TÁMOGATOTT INDIKÁCIÓK:
- Rituximabbal kombinálva olyan krónikus lymphoid leukaemiában (CLL) szenvedő felnőtt betegek kezelésére, akik korábban már legalább egy kezelésben részesültek.
- Monoterápiaként krónikus lymphoid leukaemiában (CLL) szenvedő felnőtt betegek kezelésére
• akik 17p deléciót vagy TP53 mutációt hordozók, és akiknél a B-sejt receptor jelút gátlás nem alkalmazható, vagy az eredménytelen volt; vagy
• akik 17p deléciót vagy TP53 mutációt nem hordozók és akiknél az immuno-kemoterápia és a B-sejt receptor jelút gátlás is eredménytelen volt.
A kezelés a betegség progressziójáig, vagy addig folytatható, ameddig a beteg a kezelést tolerálja.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06078 venetoklax
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1568 Fejér Megyei Szent György Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1876 Szent Borbála Kórház, Tatabánya
2137 Kaposi Mór Oktató Kórház, Kaposvár
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet, Szolnok
2425 Tolna Megyei Balassa János Kórház
2734 Zala Megyei Kórház, Zalaegerszeg
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház"
17. Az R1. 1/A. számú melléklete a következő 8/d3. ponttal egészül ki:
"8/d3.
TÁMOGATOTT INDIKÁCIÓK:
Jól differenciált pajzsmirigyrák miatt thyroidectomián és radiojód ablációs kezelésen átesett betegeknél a betegség kiújulásának igazolására akik pajzsmirigyhormon-szuppressziós terápiában (THST) részesülnek, valamint a hormonszuppressziós kezelés elhagyása szempontjából magas kockázatúnak számítanak, és akiknél THST mellett nincs kimutatható mennyiségű, vagy csak mérsékelten emelkedett szérum tireoglobulin (TG) (<20 ng/ml) észlelhető a következő megjegyzések figyelembevételével:
- Az rhTSH stimuláció előtt kötelező a TSH, thyreoglobulin és anti-thyreoglobulin meghatározás, valamint a nyaki ultrahang elvégzése.
- Nem kell diagnosztikus célú rhTSH stimulációt végezni:
- akinél egyértelmű a maradék betegség (recidiva),
- citológiailag igazolt maradék betegség esetén.
- A klinikailag progrediáló, de normális thyreoglobulin és anti-thyreoglobulin szintű betegek esetében a maradék betegség kizárására az rhTSH stimulációt követő thyreoglobulin és anti-thyreoglobulin, illetve szükség esetén teljes test I-131-szcintigráfia elvégzése szükséges.
- Anti-thyreoglobulin pozitív betegek esetében minden esetben szükséges teljes test I-131-szcintigráfia végzése rhTSH stimuláció után.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06080 alfa-tirotropin
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1487 Dr. Bugyi István Kórház, Szentes
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház
R787 Debreceni Egyetem Kenézy Gyula Egyetemi Kórház"
18. Az R1. 1/A. számú melléklete a következő 8/g. ponttal egészül ki:
"8/g.
TÁMOGATOTT INDIKÁCIÓK:
Előrehaladott vesesejtes carcinoma kezelésére felnőtteknél, a finanszírozási eljárásrendben foglaltaknak megfelelően.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06024 nivolumab
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1640 Petz Aladár Megyei Oktató Kórház, Győr
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
K403 Magyar Honvédség Egészségügyi Központ
2906 Országos Onkológiai Intézet
N511 Szent Margit Kórház, Budapest
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N594 Csolnoky Ferenc Kórház, Veszprém
2734 Zala Megyei Kórház"
19. Az R1. 1/A. számú mellékletének 15/b. pontjának "KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT" megjelölésű része a következő sorral egészül ki:
"2137 Somogy Megyei Kaposi Mór Oktató Kórház"
20. Az R1. 1/A. számú melléklet 15/c. pontja "OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:" megjelölésű része a következő sorral egészül ki:
"06016 enzalutamid"
21. Az R1. 1/A. számú melléklete a következő 15/d. ponttal egészül ki:
"15/d.
TÁMOGATOTT INDIKÁCIÓK:
Újonnan diagnosztizált, magas kockázatú, metasztatizáló, hormonszenzitív prosztatarák (mHSPC) kezelése, felnőtt férfiaknál, androgén-deprivációs kezeléssel (ADT) kombinálva.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06015 abirateron-acetát
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1487 Dr. Bugyi István Kórház, Szentes
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2879 Jahn Ferenc Dél-pesti Kórház
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház
R787 Debreceni Egyetem Kenézy Gyula Egyetemi Kórház"
2. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
Az R1. 4. számú melléklet 125/d. pontja a "74501" megjelölésű sort követően a következő sorokkal egészül ki:
"74801 Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (01. fázis)
74802 Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (02. fázis)
74803 Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (03. fázis)"
3. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R2. 1. számú mellékletében foglalt táblázat "C09DB" megjelölésű sorát követően az alábbi sorral egészül ki:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIA | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KI- EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KÜLÖN- KERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉR- TÉK NÉL- KÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| C09DX | angiotenzin II antagonisták, egyéb kombinációk | X | X | |||||
| " | ||||||||
2. Az R2. 1. számú mellékletében foglalt táblázat "H01A" megjelölésű sorát követően az alábbi sorral egészül ki:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIA | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KI- EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KÜLÖN- KERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉR- TÉK NÉL- KÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| H01AB | thyrotropin | X | ||||||
| " | ||||||||
3. Az R2. 1. számú mellékletében foglalt táblázat "B02BX" megjelölésű sora helyébe a következő rendelkezés lép:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIA | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KI- EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KÜLÖN- KERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉR- TÉK NÉL- KÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| B02BX | egyéb systemás haemostaticumok | X | X | X | X | |||
| " | ||||||||
4. Az R2. 1. számú mellékletében foglalt táblázat "C09DB" megjelölésű sora helyébe a következő rendelkezés lép:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIA | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KI- EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KÜLÖN- KERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉR- TÉK NÉL- KÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| C09DB | angiotenzin II antagonisták és calcium csatorna blokkolók | X | ||||||
| " | ||||||||
5. Az R2. 1. számú mellékletében foglalt táblázat "L02BX" megjelölésű sora helyébe a következő rendelkezés lép:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIA | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KI- EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KÜLÖN- KERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉR- TÉK NÉL- KÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| L02BX | egyéb hormonantagonisták és rokon anyagok | X | X | |||||
| " | ||||||||
6. Az R2. 1. számú mellékletében foglalt táblázat "N04BC" megjelölésű sora helyébe a következő rendelkezés lép:
| (ATC | ATC MEGNEVEZÉS | TÁMOGATÁSI KATEGÓRIA | ||||||
| NORMATÍV | EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KI- EMELT INDI- KÁCIÓ- HOZ KÖ- TÖTT | KÜLÖN- KERET) | |||||
| 0% | 25% | 55% | 80% | |||||
| ÉR- TÉK NÉL- KÜL | ÁTLA- GON ALULI | ÁTLA- GOS | ÁTLA- GON FELÜLI | |||||
| " | ||||||||
| N04BC | dopamin agonisták | X | X | X | ||||
| " | ||||||||
4. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R2. 2. számú mellékletének az EÜ100 8/a2., EÜ100 8/c., EÜ100 8/d1., EÜ100 8/d2., EÜ100 8/f., EÜ100 8/n1., EÜ100 8/n2., EÜ100 8/n3., EÜ100 8/p., EÜ100 8/t., EÜ100 29., EÜ100 32., EÜ100 36/a., EÜ100 36/b., EÜ100 36/c., EÜ100 37/a., EÜ100 37/b., EÜ100 37/c., EÜ100 38/a., EÜ100 38/b., EÜ100 41., EÜ100 42., EÜ100 43., EÜ100 51. indikációs pontjaiban a
"A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
MUNKAHELY: SZAKKÉPESÍTÉS: JOGOSULTSÁG:" részben a Gyermek hemato-onkológia szakképesítés jogosultság "javasolhat és írhat" szövegrésze helyébe az "írhat" szöveg lép.
2. Az R2. 2. számú mellékletének EÜ100 65. pontjának "TÁMOGATOTT INDIKÁCIÓK" rész helyébe a következő rendelkezés lép:
(EÜ100 65.)
"TÁMOGATOTT INDIKÁCIÓK:
Előrehaladott Parkinson-kór esetén A Parkinson betegségcsoport diagnosztikájának és kezelésének finanszírozási eljárásrendjében meghatározottak szerint"
3. Az R2. 2. számú mellékletének EÜ100 66. pontjának "TÁMOGATOTT INDIKÁCIÓK" rész helyébe a következő rendelkezés lép:
(EÜ100 66.)
"TÁMOGATOTT INDIKÁCIÓK: Perzisztáló súlyos eozinofil asthma bronchiale kiegészítő kezelése céljából, a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend (felnőttkori asthma bronchiale) alapján. "
4. Az R2. 2. számú mellékletének EÜ100 67. pontjának "TÁMOGATOTT INDIKÁCIÓK" rész helyébe a következő rendelkezés lép:
(EÜ100 67.)
"TÁMOGATOTT INDIKÁCIÓK: Aromatáz-inhibítorral kombinálva hormonreceptor-pozitív, humán epidermális növekedési faktor 2 (HER2)-negatív, lokálisan előrehaladott vagy metasztatikus emlőrákos betegek kezelésére, akik korábban még nem részesültek aromatáz-inhibítor vagy CDK4/6-gátló kezelésben előrehaladott betegségükre. Pre- vagy perimenopausában lévő nők esetében az endokrin terápiát luteinizáló hormon-releasing hormon (LHRH) agonistával kell kombinálni."
5. Az R2. 2. számú melléklete a következő EÜ100 70. ponttal egészül ki:
"EÜ100 70.
TÁMOGATOTT INDIKÁCIÓK: Szisztémás szklerózisban másodlagos Raynaud-szindrómával vagy fennálló digitális fekélybetegségben szenvedő betegeknél, akik
- korábban részesültek kálcium-csatorna blokkoló vagy pentoxifillin kezelésben, vagy ezekre kontraindikáltak, illetve intoleránsak
- első észleléskor vagy követés során 1 éven belül ≥ 3 heg van jelen/keletkezett vagy 1 éven belül 1 aktív, fájdalmas fekélye van/volt
- vagy ujjperc felszívódás klinikai vagy radiológiai jelei megjelentek.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| III. progresszivitási szintű fekvőbeteg gyógyintézet | Reumatológia | javasolhat és írhat |
| III. progresszivitási szintű fekvőbeteg gyógyintézet | Immunológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
| SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap | ||
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot):
M3400 és I7302"
6. Az R2. 2. számú mellékletének EÜ100 34. pontjában foglalt "Kijelölt intézmények:" táblázata a "Budapest Országos Reumatológiai és Fizioterápiás Intézet" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Budapest | Nyírő Gyula Országos Pszichiátriai és Addiktológiai Intézet" |
7. Az R2. 2. számú mellékletének EÜ100 34. pontjában foglalt "Kijelölt intézmények:" táblázata a "Miskolc Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Nagykanizsa | Kanizsai Dorottya Kórház" |
8. Az R2. 2. számú mellékletének EÜ100 35. pontjában foglalt "Kijelölt intézmények:" táblázata a "Hódmezővásárhely Erzsébet Kórház-Rendelőintézet" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Kistarcsa | Pest Megyei Flór Ferenc Kórház" |
9. Az R2. 2. számú mellékletének EÜ100 36/a. pontjában foglalt "Kijelölt intézmények:" táblázata az "Eger Markhot Ferenc Oktatókórház és Rendelőintézet" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Gyöngyös | Bugát Pál Kórház" |
10. Az R2. 2. számú mellékletének EÜ100 36/a. pontjában foglalt "Kijelölt intézmények:" táblázata a "Kecskemét Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Keszthely | Keszthelyi Kórház és Rendelőintézet" |
11. Az R2. 2. számú mellékletének EÜ100 36/b. pontjában foglalt "Kijelölt intézmények:" táblázata a "Szeged Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, II. sz. Belgyógyászati Klinika" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház" |
12. Az R2. 2. számú mellékletének EÜ100 36/c. pontjában foglalt "Kijelölt intézmények:" táblázata a "Szeged Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, II. sz. Belgyógyászati Klinika" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház" |
13. A R2. 2. számú mellékletének EÜ100 38/b. pontjában foglalt "Kijelölt intézmények:" táblázata az "Eger Markhot Ferenc Oktatókórház és Rendelőintézet" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Gyöngyös | Bugát Pál Kórház" |
14. Az R2. 2. számú mellékletének EÜ100 38/b. pontjában foglalt "Kijelölt intézmények:" táblázata a "Szeged Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, Gyermekgyógyászati Klinika" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház" |
15. Az R2. 2. számú mellékletének EÜ100 56. pontjában foglalt "Kijelölt intézmények:" táblázata a "Miskolc Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Mosonmagyaróvár | Karolina Kórház" |
16. Az R2. 2. számú mellékletének EÜ100 56. pontjában foglalt "Kijelölt intézmények:" táblázata a "Szeged Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ, II. sz. Belgyógyászati Klinika" megjelölésű sort követően a következő sorral egészül ki:
| (Város | Intézmény neve) |
| "Székesfehérvár | Fejér Megyei Szent György Egyetemi Oktató Kórház" |
17. Az R2. 2. számú mellékletének EU100 66. pontjának
"A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés/ Fekvőbeteg | Tüdőgyógyászat | írhat |
| gyógyintézet |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
J4590" része helyébe a következő rendelkezés lép:
"A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Kijelölt intézmények | Tüdőgyógyászat | javasolhat és írhat |
| Járóbeteg szakrendelés/ Fekvőbeteg | Tüdőgyógyászat | javaslatra írhat |
| gyógyintézet | ||
| SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 4 hónap | ||
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
J4590
Kijelölt intézmények:
| Város | Intézmény neve |
| Budapest | Országos Korányi Pulmonológiai Intézet |
| Budapest | Semmelweis Egyetem Pulmonológia Klinika |
| Debrecen | Debreceni Egyetem Klinikai Központ, Tüdőgyógyászati Klinika |
| Deszk | Csongrád Megyei Mellkasi Betegségek Szakkórháza, I. sz. Tüdőgyógyászati Osztály |
| Győr | Petz Aladár Megyei Oktató Kórház |
| Gyula | Békés Megyei Központi Kórház |
| Mátraháza | Mátrai Gyógyintézet |
| Miskolc | Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
| Pécs | Pécsi Tudományegyetem Klinikai Központ, I. sz. Belgyógyászati Klinika, Tüdőgyógyászat |
| Szombathely | Markusovszky Egyetemi Oktatókórház |
| Szolnok | Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
| Törökbálint | Tüdőgyógyintézet Törökbálint |
"
5. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R2. 3. számú mellékletének EÜ70 13. pontjának "A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK" része a következő sorral egészül ki:
| (MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG:) |
| "Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet | Arc-, állcsont- és szájsebészet | javasolhat és írhat" |
2. Az R2. 3. számú mellékletének Eü90 31. pontjának "A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK" része helyébe a következő rendelkezés lép:
| "MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Kardiológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
| SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap" | ||
3. AZ R2. 3. számú melléklete a következő EÜ90 37. ponttal egészül ki:
"Eü 90 37.
TÁMOGATOTT INDIKÁCIÓK:
- Az alkalmazási előírás szerinti csökkent balkamra-funkcióval rendelkező szívelégtelenségben szenvedő beteg, aki tolerálja a mineralokortikoid-receptor-antagonista kezelést, de gynaecomastia vagy emlőfájdalom mellékhatás miatt nem tolerálja a spironolakton-kezelést (a fájdalomskálán elért pontszám dokumentáltan 4 vagy a feletti; hétköznapi életvitelét jelentősen megnehezíti), illetve a fizikális vizsgálattal az emlő megnagyobbodása (>4 cm), érzékenysége tapasztalható.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| Járóbeteg szakrendelés / Fekvőbeteg gyógyintézet | Kardiológia | írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
| SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap | ||
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I5092"
4. Az R2. 3. számú melléklete a következő EÜ90 38. ponttal egészül ki:
"Eü 90 38.
TÁMOGATOTT INDIKÁCIÓK:
Olyan NYHA besorolás szerint II-es, vagy III-as stádiumú, tünetekkel járó, csökkent ejekciós frakciójú (LVEF<35%,) krónikus szívelégtelenségben szenvedő felnőtt betegek kezelésére, akik korábban progresszív szívelégtelenség miatt rehospitalizációra kerültek, azaz legalább kétszer kórházi kezelésben részesültek, és akiknek az állapota legalább egy éven keresztül tartó, maximálisan tolerálható ACE-gátló (ACE gátló intolerancia esetén ARB) és béta-blokkoló kezelés, illetve amennyiben nem ellenjavallt, mineralokortikoid receptor antagonista kezelés ellenére nem javult.
További kezelési feltételek:
- Szisztolés vérnyomás >100 Hgmm
- eGFR>30ml/perc
- se K < 5,2 mmol/L
- Örökletes vagy idiopátiás angio-ödéma nem lehet a kórelőzményben
- Súlyosan károsodott májműködés; biliaris cirrózis és kolesztázis kizáró feltételek
- N-terminális pro-BNP [NT-proBNP] > 600 pg/mL - vagy NT-proBNP ≥ 400 pg/ml, ha a beteg 12 hónapon belül szívelégtelenség miatt hospitalizálva volt
JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
| MUNKAHELY: | SZAKKÉPESÍTÉS: | JOGOSULTSÁG: |
| II és III. progresszivitási szintű Fekvőbeteg gyógyintézet | Kardiológia | javasolhat és írhat |
| Háziorvos | Megkötés nélkül | javaslatra írhat |
| SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap | ||
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I5092, I5093"
6. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
Az R2. 4. számú mellékletének 1-2. pontjai helyébe a következő rendelkezés lép:
(Az alábbi indikációs területeken beszerezhető hatóanyagok köre:)
"1. A veleszületett vérzékenység kezelésére:
1.1) antithrombin III. koncentrátum,
1.2) hazai plazmából előállított nagytisztaságú VIII. faktor koncentrátum,
1.3) részben hazai plazmából előállításra kerülő, külföldön feldolgozott nagytisztaságú VIII. faktor koncentrátum, ITI kezelésre alkalmas von Willebrand faktor tartalommal,
1.4) külföldi plazmából előállításra kerülő, haemophilia A kezelésére szolgáló nagytisztaságú VIII. faktor koncentrátum, ITI kezelésre alkalmas von Willebrand faktor tartalommal,
1.5) külföldi plazmából előállításra kerülő, hemophilia A kezelésére szolgáló nagytisztaságú nem albuminnal stabilizált VIII. faktor koncentrátum,
1.6) recombináns technológiával előállított 2. generációs VIII. faktor koncentrátum,
1.7) recombináns technológiával előállított 3. generációs teljes molekulaméretű VIII. faktor koncentrátum,
1.8) nagy von Willebrand faktor tartalmú nagytisztaságú, plazma eredetű VIII. faktor koncentrátum, amely mérsékelt súlyosságú von Willebrand betegség, haemophilia A, immuntolerancia indukciós kezelésére alkalmas,
1.9) von Willebrand betegség kezelésére szolgáló, nagy von Willebrand faktor tartalmú plazma eredetű von Willebrand faktor/VIII. faktor készítmény,
1.10) von Willebrand betegség kezelésére szolgáló, kiegyensúlyozott von Willebrand/VIII. faktor tartalmú plazma eredetű von Willebrand faktor/VIII. faktor készítmény,
1.11) eptacog alfa (aktivált) (rekombináns aktivált VII. koagulációs faktor),
1.12) aktivált prothrombin komplex koncentrátum (VIII. koagulációs faktor inhibitor "bypassing" aktivitású készítmény),
1.13) hazai plazmából előállított nagytisztaságú plazma eredetű IX. faktor készítmény,
1.14) nagytisztaságú import IX. faktor készítmény,
1.15) prothrombin komplex koncentrátum ismert VIIF aktivitással,
1.16) szöveti ragasztóanyagok (humán kétkomponensű fibrin fehérjeragasztó koncentrátum),
1.17) fibrinogén koncentrátum (I koagulációs faktor),
1.18) recombináns technológiával előállított 3. generációs B-domain-depletált VIII. faktor koncentrátum,
1.19) recombináns technológiával előállított 1. generációs VIII. faktor koncentrátum,
1.20) recombináns technológiával előállított 3. generációs B-domain rövidített, teljesen tirozin-szulfatált VIII. faktor koncentrátum, korábban már kezelt, ún. PTP betegek részére,
1.21) recombináns technológiával humán sejtvonalon előállított természetes, kémiai módosítás nélküli 4. generációs B-domain rövidített VIII. faktor koncentrátum.
1.22) rekombináns technológiával, humán sejtvonalon előállított, 4. generációs, elnyújtott felezési idejű VIII. faktor koncentrátum, Fc fúziós fehérje,
1.23) rekombináns technológiával, humán sejtvonalon előállított, elnyújtott felezési-idejű IX. faktor koncentrátum, Fc fúziós fehérje.
1.24) emicizumab (FVIII elleni inhibitorral rendelkező betegek kezelésére szolgáló monoklonális antitest).
1.25) Rekombináns technológiával előállított, rövidített B doménnel, magas von Willebrand faktor affinitással rendelkező, kovalens kötéssel kapcsolt, egyláncú, igazolt fél élettartam-előnnyel rendelkező, 3. generációs VIII-as faktor koncentrátum.
2. Krónikus aktív hepatitis C kezelésére (a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján):
2.1) boceprevir,
2.2) daclatasvir,
2.3) interferon alfa természetes,
2.4) interferon alfa-2a,
2.5) interferon alfa-2b,
2.6) peginterferon alfa-2a,
2.7) peginterferon alfa-2b,
2.8) ribavirin,
2.9) simeprevir,
2.10) sofosbuvir,
2.11) telaprevir,
2.12) dasabuvir,
2.13) ombitasvir/paritaprevir/ritonavir,
2.14) ledipasvir/sofosbuvir,
2.15) elbasvir/grazoprevir,
2.16) sofosbuvir/velpatasvir.
2.17) glecaprevir- pibrentasvir
2.18) sofosbuvir/velpatasvir/voxilaprevir"
7. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 2. mellékletében a "A világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje" 1. ábra helyébe a következő rendelkezés lép:
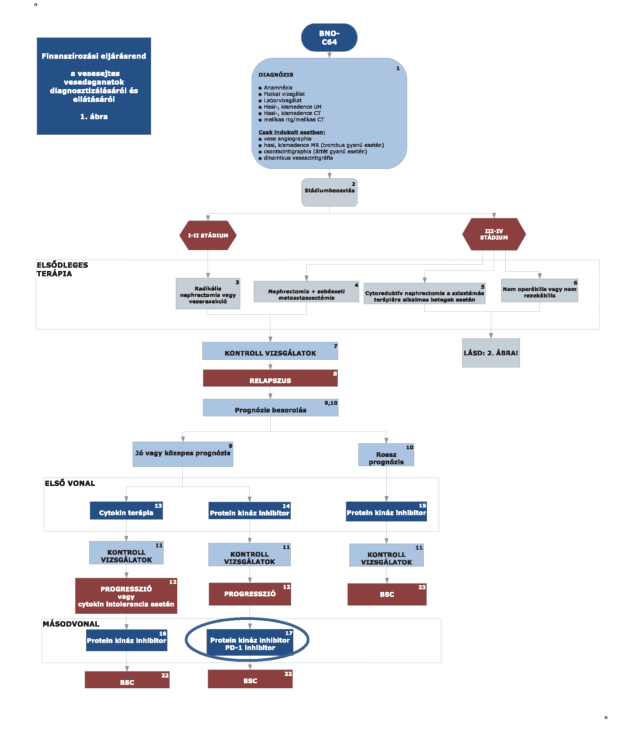
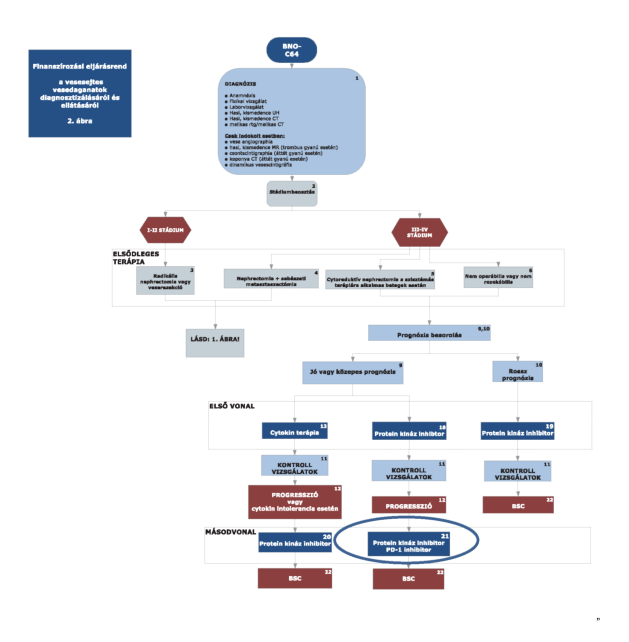
2. Az R3. 2. mellékletében a "finanszírozási eljárásrend a vesesejtes vesedaganatok diagnosztizálásáról és eljárásáról" 2. ábra helyébe a következő rendelkezés lép:
3. Az R3. 2. mellékletének 17. pontja helyébe a következő rendelkezés lép:
| 17: Alkalmazható protein kináz és PD-1 inhibitor(ok): |
| axitinib: |
| kizárólag sunitinib kezelést követően adható olyan esetekben, amikor a beteg a legkorábban a második sunitinib kezelési ciklust követően végzett képalkotó eljárással dokumentáltan reagált a sunitinib kezelésre. |
| everolimus: |
| sunitinib és pazopanib kezelést követően egyaránt adható. |
| cabozantinib: előrehaladott, áttétes vesesejtes carcinómában szenvedő, megfelelő állapotú, megelőzővascularis endothelialis növekedési faktor (VEGF) célzott terápiában részesült felnőttbetegek kezelésére,ha a lokális terápiás modalitás alkalmazása nem jön szóba. |
| nivolumab: monoterápiában, megelőző tirozin kináz gátló kezelésben részesült, előrehaladott, inoperabilis vagy áttétes ECOG 0-1 felnőtt betegeknek a WHO kritériumok szerinti progresszióig |
4. Az R3. 2. mellékletének 21. pontja helyébe a következő rendelkezés lép:
| 21: Alkalmazható protein kináz és PD-1 inhibitor(ok): |
| axitinib: |
| kizárólag sunitinib kezelést követően adható olyan esetekben, amikor a beteg a legkorábban a második sunitinib kezelési ciklust követően végzett képalkotó eljárással dokumentáltan reagált a sunitinib kezelésre. |
| everolimus: |
| sunitinib és pazopanib kezelést követően egyaránt adható |
| cabozantinib: előrehaladott, áttétes vesesejtes carcinómában szenvedő, megfelelő állapotú, megelőző vascularis endothelialis növekedési faktor (VEGF) célzott terápiában részesült felnőtt betegek kezelésére, ha a lokális terápiás modalitás alkalmazása nem jön szóba. |
| nivolumab: monoterápiában, megelőző tirozin kináz gátló kezelésben részesült, előrehaladott, inoperabilis vagy áttétes ECOG 0-1 felnőtt betegeknek a WHO kritériumok szerinti progresszióig |
5. Az R3. 2. mellékletének 5.4. alpontja az alábbi sorokkal egészül ki:
| (ATC | ATC MEGNEVEZÉSE) | |
| " | ||
| L01XE26 | cabozantinib | |
| L01XC17 | nivolumab | |
8. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
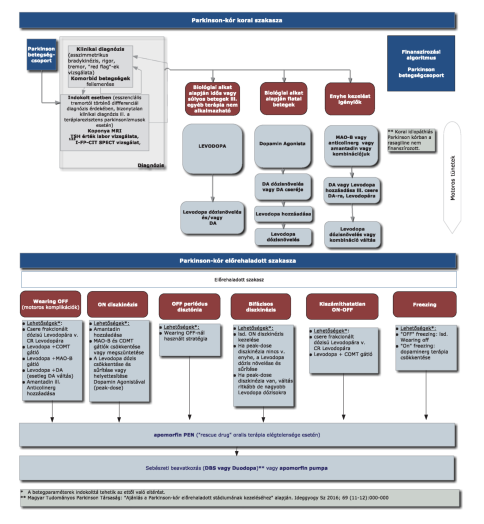
1. Az R3. 5. mellékletében a "Finanszírozás rendje, finanszírozási algoritmus" helyébe a következő rendelkezés lép:
2. Az R3. 5. mellékletének 5. pontja a következő 5.4. alponttal egészül ki:
"5.4. A motoros hullámzások ("on-off jelenség) kezelése olyan Parkinson-kórban szenvedő betegeknél, akik nem kezelhetők kielégítő módon a szájon át adott anti-Parkinson készítménnyel - a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.4.1. Apomorfin-hidroklorid-hemihidrát pen ("rescue drug") alkalmazható optimálisan beállított, de elégtelen oralis terápia mellett:
- a megjósolható motoros és nem - motoros OFF periódusok gyors megelőzésére,
- hirtelen vagy akut OFF periódus gyors megszüntetésére,
- ha az oralis levodopa feszívódása zavart vagy gyomor ürülési problémák (gasztroparesis) esetén,
- a késve jelentkező gyógyszerhatás ("delayed on") vagy a kimaradó gyógyszerhatás ("no on") kezelésére a gyomor motilitással, ürüléssel összefüggésben,
- hajnali vagy kora reggeli akinesia és dystonia megoldására."
3. Az R3. 5. melléklete a következő 5.5. alponttal egészül ki:
"5.5. EÜ100 65. Támogatott indikációk:
Előrehaladott Parkinson-kór esetén a Parkinson betegségcsoport diagnosztikájának és kezelésének a finanszírozási eljárásrendjében meghatározottak szerint.
5.5.1. levodopa+ carbidopa intesztinális gél
5.5.2. apomorfin-hidroklorid-hemihidrát pumpa alkalmazható:
- ha a beteg gyakran (több, mint 6 alkalom/nap) igényel pen adagot,
- ha zavaró dyskinesiák limitálják a további terápia módosítást,
- ha súlyos nem - motoros tünetek jelentkeznek "OFF"-ban,
- ha műtét (mély agyi stimuláció (DBS)) vagy levodopa+carbidopa intesztinális gél kezelés kontraindikált
- döntően nem-motoros, elsősorban neuropsychiátriai tünetek túlsúlya esetén
A terápia hatástalannak tekinthető, ha a betegség progrediált és a beteg állapota az eszközös terápiák (Duodopa, Apomorphin se. infúzió vagy Apormorphin pen) mellett a Hoehn&Yahr skála szerint 5. stádiumú. A beteg állapotát évente orvosilag dokumentálni kell."
4. Az R3. 5. mellékletének 9.3. alpontja a következő 13. sorral egészül ki:
(9.3. Finanszírozott hatóanyagok Magyarországon)
| (1 | ATC | Hatóanyag) |
| "13 | N04BC07 | apomorfin-hidroklorid-hemihidrát" |
9. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 10. mellékletének 6.3.4. alpontja helyébe a következő rendelkezés lép:
"6.3.4. Interleukin-inhibitor: usztekinumab, ixekizumab, szekukinumab, guszelkumab"
2. Az R3. 10. mellékletének 8. pont 8.2. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"8.2. Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC-kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 3 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 4 | D05BB02 | acitretin | Retinoid | Antipsoriatikus szisztémás szer |
| 5 | L04AB01 | etanercept | BRMD | Biológiai terápia eszközei |
| 6 | L04AB02 | infliximab | BRMD | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | BRMD | Biológiai terápia eszközei |
| 8 | L04AC05 | usztekinumab | BRMD | Biológiai terápia eszközei |
| 9 | L04AC10 | szekukinumab | BRMD | Biológiai terápia eszközei |
| 10 | L04AC13 | ixekizumab | BRMD | Biológiai terápia eszközei |
| 11 | L04AC16 | guszelkumab | BRMD | Biológiai terápia eszközei |
"
10. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 11. mellékletének 4. pont 4.4.2. alpontja helyébe a következő rendelkezés lép:
"4.4.2. interleukin-6 receptor gátlók (tocilizumab, sarilumab)"
2. Az R3. 11. mellékletének 5. pont 5.2.2. alpontja helyébe a következő rendelkezés lép:
"5.2.2. Súlyos, aktív rheumatoid arthritis esetén az anti-TNF-α terápia (infliximab, etanercept, adalimumab, golimumab, certolizumab pegol) vagy interleukin-6 receptor gátlók (tocilizumab, sarilumab), CTLA-4 analóg (abatacept) terápia alkalmazható azon betegek számára, akiknél az alábbi kritériumok együttesen teljesülnek:"
3. Az R3. 11. mellékletének 5. pont 5.2.4. alpontja helyébe a következő rendelkezés lép:
"5.2.4. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek (DAS 28 nem javult legalább 1,2 ponttal), másik anti-TNF-α terápiára történő váltás (switch), IL6 receptor gátlók (tocilizumab, sarilumab), CTLA-4 analóg (abatacept) vagy B sejt gátló (rituximab) kezelés megengedett. Switch-et követően, hatástalanság esetén további TNF-α gátló szerre nem érdemes váltani."
4. Az R3. 11. mellékletének 5. pont 5.2.7. alpontja helyébe a következő rendelkezés lép:
"5.2.7. Az interleukin-6 receptor gátlók (tocilizumab, sarilumab) és a CTLA-4 analóg (abatacept) terápiák alkalmazásának feltételei megegyeznek az anti-TNF-α terápia alkalmazásának feltételeivel."
5. Az R3. 11. mellékletének 7. pont 7.2.6.4. alpontja helyébe a következő rendelkezés lép:
"7.2.6.4. Interleukin-6 receptor gátlók: tocilizumab, sarilumab"
6. Az R3. 11. mellékletének 9. pont 9.2. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"9.2. Táblázat: Releváns ATC kódok
| A | B | C | D | |
| ATC kód | Hatóanyag | Kategória | Megjegyzés | |
| 1 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 2 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 3 | L04AA13 | LEF | DMARD | Betegségmódosító szerek |
| 4 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 5 | L04AX01 | azathioprin | DMARD | Betegségmódosító szerek |
| 6 | P01BA01 | chloroquin | DMARD | Betegségmódosító szerek |
| 7 | L04AB01 | etanercept | TNF alfa gátló | Biológiai terápia eszközei |
| 8 | L04AA24 | abatacept | CTLA-4 analóg | Biológiai terápia eszközei |
| 9 | L04AA29 | tofacitinib | JAK gátló | Betegségmódosító szerek |
| 10 | L04AA37 | baricitinib | JAK gátló | Betegségmódosító szerek |
| 11 | L04AB02 | infliximab | TNF alfa gátló | Biológiai terápia eszközei |
| 12 | L04AB04 | adalimumab | TNF alfa gátló | Biológiai terápia eszközei |
| 13 | L04AB06 | golimumab | TNF alfa gátló | Biológiai terápia eszközei |
| 14 | L04AB05 | certolizumab-pegol | TNF alfa gátló | Biológiai terápia eszközei |
| 15 | L04AC07 | tocilizumab | IL-6 R gátló | Biológiai terápia eszközei |
| 16 | L04AC14 | sarilumab | IL-6 R gátló | Biológiai terápia eszközei |
| 17 | L01XC02 | rituximab | B sejt gátló | Biológiai terápia eszközei |
| 18 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 19 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 20 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 21 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
"
11. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
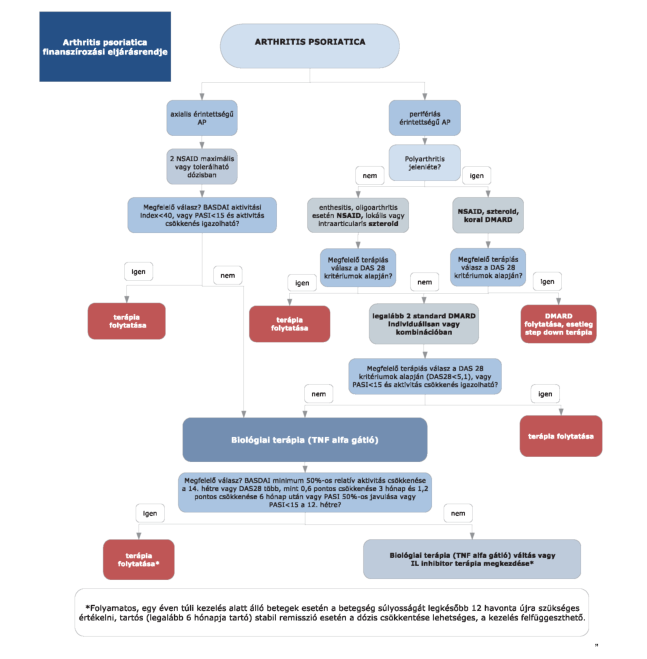
1. Az R3. 14. mellékletének 3. pontja helyébe a következő rendelkezés lép:
"3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
"
2. Az R3. 14. mellékletének 4. pont 4.6. alpontja helyébe a következő rendelkezés lép:
"4.6. A biológiai terápiás kezelés további folytatásának kritériumai:
4.6.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-α terápiára történő váltás (switch) vagy IL inhibitor terápia megkezdése megengedett.
4.6.2. Az anti-TNF-α terápia dózisának emelése a forgalomba hozatali engedélyben meghatározott induló dózishoz képest nem javasolt.
4.6.3. Csak szakavatott és a terápia-alkalmazásban jártas kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α és az IL inhibitor terápia indikálása és alkalmazása."
3. Az R3. 14. mellékletének 6. pontja 6.2.5.4.alponttal egészül ki: "6.2.5.4. IL inhibitor: szekukinumab, ixekizumab"
4. Az R3. 14. mellékletének 8. pont 8.2. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"8.2. táblázat: Releváns ATC kódok
| A | B | C | D | |
| 1 | ATC kód | Hatóanyag | Kategória | Megjegyzés |
| 2 | A07EC01 | sulfasalazin | DMARD | Betegségmódosító szerek |
| 3 | L01BA01 | metotrexát | DMARD | Betegségmódosító szerek |
| 4 | L04AA13 | LEF | DMARD | Betegségmódosító szerek |
| 5 | L04AD01 | ciklosporin | DMARD | Betegségmódosító szerek |
| 6 | L04AB01 | etanercept | TNF-alfa gátló | Biológiai terápia eszközei |
| 7 | L04AB04 | adalimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 8 | L04AB02 | infliximab | TNF-alfa gátló | Biológiai terápia eszközei |
| 9 | L04AB06 | golimumab | TNF-alfa gátló | Biológiai terápia eszközei |
| 10 | L04AC10 | szekukinumab | IL-inhibitor | Biológiai terápia eszközei |
| 11 | L04AC13 | ixekizumab | IL-inhibitor | Biológiai terápia eszközei |
| 12 | M01A | NSAID | NSAID | Nem szteroid gyulladáscsökkentő |
| 13 | H02AB04 | metilprednizolon | Szteroid | Szteroid gyógyszerek |
| 14 | H02AB06 | prednizolon | Szteroid | Szteroid gyógyszerek |
| 15 | H02AB08 | triamcinolon | Szteroid | Szteroid gyógyszerek |
"
5. Az R3. 14. mellékletének 9. pontja helyébe a következő rendelkezés lép:
"9. Fogalmak, rövidítések
AP Arthritis psoriatica
ATC Anatomical therapeutic chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
EULAR European League Against Rheumatism
DAS Disease activity score
BASDAI Bath ankylosing spondylitis disease activity index
PASI Psoriasis area and severity index
DMARD Disease modifying antirheumatic drug
TNF Tumor nekrózis faktor
IL Interleukin
CRP C-reaktív protein
MTX Methotrexat
CsA Ciklosporin A
LEF Leflunomid
SSZ Szulfaszalazin
NSAID Non-steroid anti-inflammatory drug"
12. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 17. mellékletének 5. pontja az 5.2.9-5.2.10. alpontokkal egészül ki:
"5.2.9. glecaprevir+pibrentaszvir kombinációs kezelés
A glecaprevir (GLE) a pibrentaszvirral (PIB) fix dózisú kombinációban törzskönyvezett készítmény.
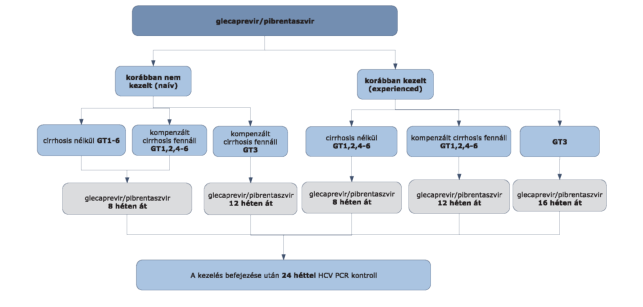
5.2.9.1. A kezelés hossza korábban nem kezelt betegek esetén valamennyi genotípus esetében (G1-G6) 8 hét, amennyiben cirrhosis nem áll fenn. A naív, kompenzált cirrhosisban szenvedő betegek esetében a kezelés időtartama G1,2,4-6 genotípus esetén 8 hét, G3 esetében 12 hét).
5.2.9.2. Korábban kezelésben részesült betegeknél, G1,2,4-6 genotípusban, amennyiben cirrhosis nem áll fenn, a kezelés időtartama 8 hét. Amennyiben kompenzált cirrhosis fennáll, 12 hetes kezelés szükséges.
5.2.9.3. G3 genotípus esetén a kezelés időtartama 16 hét.
5.2.9.4. klinikai tapasztalatok hiányában nem ajánlott olyan betegek ismételt kezelésére, akiket korábban sikertelenül kezeltek NS5A-inhibitorral.
A GLE/PIB kombinációval végzett kezelés során nincsen STOP-szabály, ezért kezelés közben a HCV-RNS-szint monitorozása nem szükséges.
5.2.9.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére
5.2.10. sofosbuvir+velpatasvir+voxilaprevir kombinációs kezelés
A voxilaprevir (VOX) a sofosbuvirral (SOF) és a velpatasvirrel (VEL) fix dózisú kombinációban törzskönyvezett készítmény.
5.2.10.1. A kezelés hossza korábban DAA-val nem kezelt betegek esetén valamennyi genotípus esetében (G1-G6) 8 hét, amennyiben cirrhosis nem áll fenn. A DAA-naív, kompenzált cirrhosisban szenvedő betegek esetében a kezelés időtartama 12 hét.
5.2.10.2. A kezelés hossza korábban DAA kezelésben részesült betegek esetében 12 hét.
5.2.10.3. Az ABT2D/3D±RBV vagy SOF/LDV±RBV-kombinációval sikertelenül kezelt betegek esetében is hatékony kombináció, a kezelés hossza 12 hét."
2. Az R3. 17. mellékletének 6. pontja helyébe a következő rendelkezés lép:
"6. Speciális esetek
6.1. HCV korai kezelése
Megelőző icterus vagy ismert dátumú expozíció után 8-12 hét múlva is perzisztáló HCV-RNS-pozitivitás esetén korai antivirális kezelés indokolt. A kezelés formája megegyezik a krónikus infekció kezelésével
6.2. HCV-fertőzött várandósok és kismamák
HCV-fertőzött várandósok és kismamák kezelése a terhesség és szoptatás utánra halasztandó. HCV-fertőzött anyáknál az elektív császármetszés nem véd a HCV-fertőzés átvitele ellen, ezért preventív császármetszés nem indokolt.
Szoptatással történő transzmisszióra nincs evidencia, ezért a HCV-fertőzött kismama szoptathat. Ugyanakkor a szoptatás felfüggesztése megfontolandó, ha a mellbimbó bereped, illetve vérzik.
HCV-fertőzött anya gyermekénél a szűrés 18 hónapos korban javasolt.
6.3. Gyermekek
Hároméves kor felett indokolt esetben gyermekgyógyász és hepatológus együttes javaslata alapján 48 hetes PR kettős kezelés javasolható. Dozírozás az alkalmazási előírás szerint. Az interferonmentes terápiák közül a SOF+LDV kombináció 12 éves kortól adható.
6.4. Interferonmentes kezeléssel sikertelenül kezelt betegek
Az NS5A komponenst tartalmazó terápiával sikertelenül kezelt betegek esetében kimutathatóan megnő az NS5A ellen rezisztens vírusvariációk jelenléte, ezért ismételt kezeléskor elsősorban 24 hetes SOV+VEL+RBV vagy 12 hetes SOF+VEL+VOX kezelés ajánlott.
6.5. Extrahepaticus manifesztációk
Az extrahepaticus manifesztációk közül egyértelmű kezelési prioritást élvez a cryoglobulinaemiás vasculitis, a glomerulonephritis, a súlyos polyarthritis, a porphyria cutanea tarda, a lichen ruber planus és a non-Hodgkin lymphoma (NHL).
NHL esetén hematológus és hepatológus együttes véleménye alapján dönthető el, hogy melyik betegség kezelése történjen elsőként.
6.6. Pozitív addiktológiai anamnézisű és pszichiátriai betegek
A kábítószer-használók körében világszerte növekszik a HCV-fertőzöttek száma. Kábítószert jelenleg vagy a közelmúltban használó személy esetén az addiktológus véleményét figyelembe véve mérlegelhető kezelés.
Ha kábítószer használatára pozitív az anamnézis, akkor a kombinált antivirális kezelés 3 hónapos - legalább két negatív drogteszttel igazolt - absztinencia után kezdhető meg.
A DAA készítmények megválasztásakor a gyógyszer-interakciók figyelembevétele szükséges.
IFN-kezelés megkezdése előtt a manifeszt pszichiátriai zavar (különös tekintettel a depresszióra és a szorongásos kórképekre) kizárása szükséges, pszichiátriai javaslattal, szoros pszichiátriai ellenőrzés mellett kezdhető meg a kezelés.
6.7. HCV-HBV társfertőzés
A HCV kezelése alatt vagy után a HBV-infekció fellángolhat, emiatt szoros monitorozás indokolt.
A HBV-társfertőzött CHC-s betegeket a HCV-monoinfekció szabályai szerint kell kezelni.
6.8. HIV-HCV társfertőzés
Aktív retrovirális kezelés, illetve <200/μl CD4 sejtszám esetén fokozott ellenőrzés indokolt a tejsavacidosis, illetve a cytopenia lehetősége miatt.
IFN-mentes kezelés a HIV-társfertőzés nélküli HCV-nek megfelelően végezhető.
6.9. Haemoglobinopathiák
A kezelés indikációja megegyezik a haemoglobinopathiában nem szenvedő HCV-fertőzöttekével. A jelentős anaemizálódási hajlam miatt IFN- és RBV-mentes kezelés előnyben részesítendő.
6.10. Krónikus veseelégtelenség
Krónikus vesebetegeknél a kezelési mód megválasztása a szérumkreatinin-szinttől és a kreatininclearancetől vagy a becsült glomeruláris filtrációs rátától (eGFR) függ.
Enyhe és középsúlyos veseelégtelenségben valamennyi, interferonmentes kezelés biztonsággal adható.
Végstádiumú vesebetegek esetében (CKD4, CKD5, beleértve a dializáltakat) az ABT2D/ABT3D±RBV, a GZR/EBR±RBV, vagy GLE/PIB-kombináció adható.
Hemodializált betegek kombinált antivirális kezelése egyedi mérlegelés alapján elsősorban akkor indokolt, ha a beteg vesetranszplantációra is esélyes.
6.11. Szervtranszplantáció (kivéve májátültetés)
Szervtranszplantáció (kivéve májátültetés) után csak IFN-mentes kombináció adása javasolható; a kezelés mindenképpen indokolt és prioritást élvez.
Az esetleges gyógyszerinterakciók körültekintő értékelésével egyedi mérlegelés szükséges. SOF, LDV vagy DCV esetén sem a tacrolimus, sem a cyclosporin A adagjának módosítása nem szükséges. SIM és cyclosporin A együtt adása nem javasolható.
Szervtranszplantáltak HCV kezelése olyan intézményben végzendő, ahol az immunszuppresszív szerek (cyclosporin, tacrolimus) koncentrációját egyidejűleg monitorozni lehet.
6.12. Májtranszplantáltak (Májtranszplantáció utáni HCV rekurrencia kezelése)
Májtranszplantált betegeknél kialakuló új HCV-fertőzés (vagy rekurrencia) a rejekció lehetőségének kizárását követően korán kezelendő, mindenképpen indokolt és prioritást élvez.
A DAA készítmények potenciális interakciói fokozott figyelmet igényelnek.
Májtranszplantáltak HCV kezelése olyan intézményben végzendő, ahol az immunszuppresszív szerek (cyclosporin, tacrolimus) koncentrációját egyidejűleg monitorozni lehet."
3. Az R3. 17. mellékletének 9. pont 9.4. alpontjában szereplő táblázat helyébe a következő rendelkezés lép:
"9.4. ATC kódok
| ATC | ATC megnevezés |
| L03AB04 | interferon alfa-2a |
| L03AB01 | interferon alfa természetes |
| L03AB05 | interferon alfa-2b |
| L03AB11 | peg-Interferon alfa-2a |
| L03AB10 | peg-Interferon alfa-2b |
| J05AB04 | ribavirin |
| J05AE11 | telaprevir |
| J05AE12 | boceprevir |
| J05AE14 | simeprevir |
| J05AX14 | daclatasvir |
| J05AX15 | sofosbuvir |
| J05AX16 | dasabuvir |
| J05AX67 | ombitasvir, paritaprevir, ritonavir |
| J05AX65 | ledipasvir, sofosbuvir |
| J05AX68 | elbasvir, grazoprevir |
| J05AX69 | sofosbuvir, velpatasvir |
| J05AP57 | glecaprevir, pibrentasvir |
| J05AP56 | sofosbuvir, velpatasvir, voxilaprevir |
"
4. Az R3. 17. mellékletének 10. pontja helyébe a következő rendelkezés lép:
"10. Rövidítések
10.1. ALT Alanin aminotranszferáz
10.2. ATC Anatomical Therapeutic Chemical klasszifikáció
10.3. BNO Betegségek nemzetközi osztályozása
10.4. CHC Krónikus hepatitis C
10.5. DAA Direkt ható antiviralis szerek
10.6. GPT Glutamát-piruvát transzamináz
10.7. HBCS Homogén betegségcsoport
10.8. HCC HepatoCelluláris Carcinoma
10.9. HCV Hepatitis C vírus
10.10. OENO Orvosi eljárások nemzetközi osztályozása
10.11. PCR Polymerase Chain Reaction
10.12. PegIFN Pegilált interferon
10.13. PI Proteáz inhibitor
10.14. PR Pegilált interferon ribavirin
10.15. PRP PegIFN+RBV+PI kezelés
10.16. RVR Rapid vírusválasz
10.17. RBV Ribavirin
10.18. SVR Sustained virologic response (tartós virológiai válasz)
10.19. ABT2D ombitasvir/paritaprevir/ritonavir
10.20. ABT2D ombitasvir/paritaprevir/ritonavir + dasabuvir
10.21. LDV ledipasvir
10.22. SOF sofosbuvir
10.23. SIM simeprevir
10.24. DAC daclatasvir
10.25. EBR elbasvir
10.26. GZR grazoprevir
10.27. VEL velpatasvir
10.28. GLE glecaprevir
10.29. PIB pibrentaszvir
10.30. VOX voxilaprevir"
13. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 19. mellékletének 4. pont 4.3. alpontjában a "myeloma multiplex második és többedik relapszusa" ábra helyébe a következő rendelkezés lép:
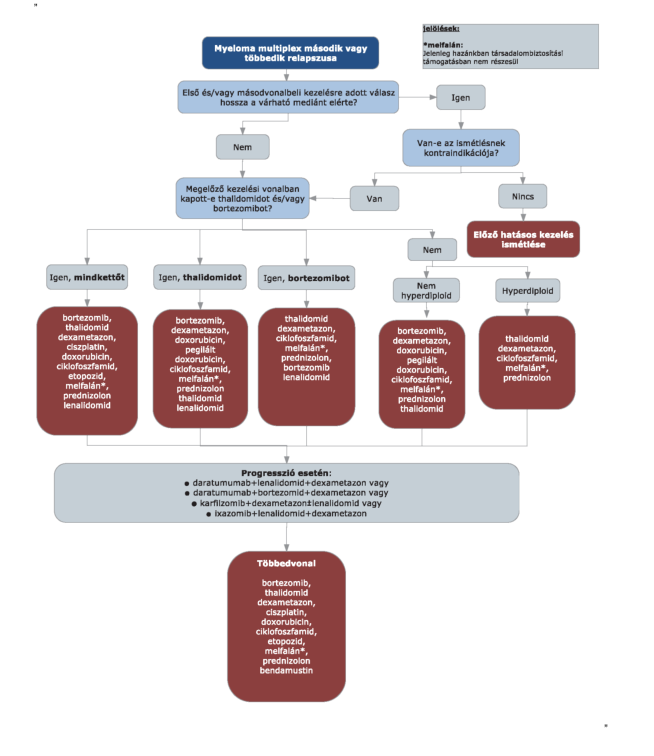
2. Az R3. 19. mellékletének 4. pont 4.3.5. alpontja helyébe a következő rendelkezés lép:
"4.3.5. Az ixazomib+ lenalidomid+ dexametazon kombináció harmad vagy negyedvonalban második vagy harmadik relapszust követően alkalmazható "fenntartó" jelleggel, ha a beteg nem refrakter lenalidomidra, felszívódási zavarban nem szenved és megtartott csontvelői rezervvel rendelkezik (legalább 75 ezer/μl vérlemezke és 1000/μl neutrofil sejtszám). A mellékhatás profil alapján a legnagyobb terápiás előny szív- és tüdőbetegek esetén várható. A terápia hossza legfeljebb 24 ciklus azzal, hogy a terápia hatásosságának értékelésére négy héttel később kerül sor. A terápia hatásosságát havonta értékelni szükséges."
3. Az R3. 19. mellékletének 4. pontja a következő 4.3.6. alponttal egészül ki:
"4.3.6. A jelen anyag az allogén őssejt-transzplantáció részletes finanszírozási eljárásrendjére nem terjed ki."
4. Az R3. 19. mellékletének 7. pont 7.3. alpontjában szereplő táblázat a következő 16. sorral egészül ki:
| (A | B | |||
| 1 | ATC | ATC megnevezés) | ||
| " | ||||
| 16 | L01XX50 | ixazomib | ||
| " | ||||
14. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 29. mellékletének 3. pont 3.5. alpontja helyébe a következő rendelkezés lép:
"3.5. * A metasztatikus prosztata daganat ellátása - metasztatikus prosztata daganat
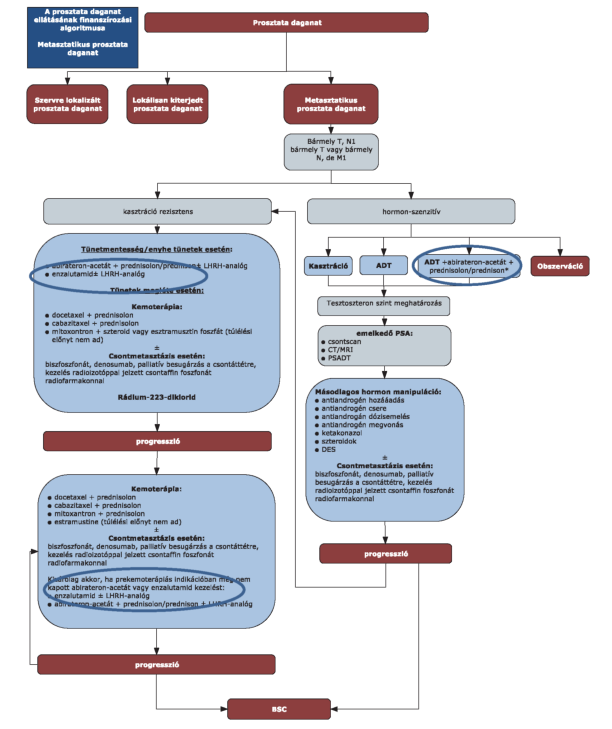
"Kizárólag magas kockázatú, újonnan diagnosztizált betegség esetén, ha az alábbi paraméterek közül legalább 2 jelen van:
3.5.1. Gleason pontszám ≥8
3.5.2. Csontmetasztázis ≥3
3.5.3. mérhető visceralis metasztázis(a nyirokcsomó betegséget kivéve)"
2. Az R3. 29. mellékletének 3. pont 3.6.4. alpontja helyébe a következő rendelkezés lép:
"3.6.4. * Enzalutamid alkalmazásának feltételei:
3.6.4.1. Prekemoterápiás indikációban
Metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére, akik sikertelen androgén deprivációs kezelést követően tünetmentesek vagy enyhe tüneteket mutattak, és akiknél a klinikai állapot alapján a kemoterápiás kezelés még nem indokolt, amennyiben a primer elváltozás vagy a metasztázis lokálisan nem kezelhető. Prekemoterápiás alkalmazás esetén posztkemoterápiás indikációban az abirateron-acetát és enzalutamid már nem alkalmazható. A terápia hatásosságát 3 hónapos kezelést követően értékelni szükséges.
3.6.4.2. Posztkemoterápiás indikációban
Metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére, akiknek a betegsége docetaxel-kezelés mellett vagy azt követően progrediált és a kemoterápiát megelőzően még nem részesültek abirateron-acetát vagy enzalutamid kezelésben amennyiben a primer elváltozás vagy a metasztázis lokálisan nem kezelhető .
3.6.4.3. nem sebészi kasztráció esetén az LHRH-analóg adását folytatni kell"
3. Az R3. 29. mellékletének 3. pont 3.6.6. alpontja helyébe a következő rendelkezés lép:
"3.6.6.- Abirateron-acetát alkalmazásának feltételei:
3.6.6.1. Hormon-szenzitív metasztatikus prosztatarák esetén:
Újonnan diagnosztizált, ECOG 0-1, magas kockázatú, metasztatikus, hormon-szenzitív prosztatarákban szenvedő felnőtt férfiak kezelésére, androgén deprivációs kezeléssel kombinálva, akiknél a lokális ellátás nem jön szóba és kemoterápia adása nem szükséges. Magas kockázatú a betegség, ha az alábbi paraméterek közül legalább 2 jelen van:
3.6.6.1.1. Gleason pontszám ≥8
3.6.6.1.2. Csontmetasztázis ≥3 lézió
3.6.6.1.3. mérhető visceralis metasztázis
Magas kockázatról akkor beszélünk, ha legalább 2 kritérium teljesül a következők közül: T3-4; Gleason score= 8-10; PSA >40 ng/ml
A terápia progresszióig vagy tolerálhatatlan toxicitásig folytatható.
Amennyiben a beteg hormon-szenzitív vonalban már egyszer részesült abirateron acetát kezelésben a későbbiekben már nem alkalmazható.
A terápia hatásosságát értékelni szükséges az 5. kezelési ciklustól 4 havonta történő képalkotó vizsgálattal és havonta PSA-meghatározással.
3.6.6.2. Kasztráció rezisztens metasztatikus prosztatarák esetén:
3.6.6.2.1. Prekemoterápiás indikációban:
Metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére, akik sikertelen androgén deprivációs kezelést követően tünetmentesek vagy enyhe tüneteket mutattak, és akiknél a klinikai állapot alapján a kemoterápiás kezelés még nem indokolt, amennyiben a primer elváltozás vagy a metasztázis lokálisan nem kezelhető. Prekemoterápiás alkalmazás esetén posztkemoterápiás indikációban az abirateron-acetát és enzalutamid már nem alkalmazható. A terápia hatásosságát 3 hónapos kezelést követően értékelni szükséges.
3.6.6.2.2. Posztkemoterápiás indikációban:
Metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére, akiknek a betegsége docetaxel-kezelés mellett vagy azt követően progrediált és a kemoterápiát megelőzően még nem részesültek abirateron-acetát kezelésben, amennyiben a primer elváltozás vagy a metasztázis lokálisan nem kezelhető.
3.6.6.3. nem sebészi kasztráció esetén az LHRH-analóg adását folytatni kell."
4. Az R3. 29. mellékletének 6. pont 6.5. alpontja helyébe a következő rendelkezés lép:
"6.5. Releváns ATC kódok
| A | B | |
| 1 | ATC kód | Hatóanyag |
| 2 | G03HA01 | cyproteron |
| 3 | G04CB01 | finasterid |
| 4 | H02AB06 | prednizolon |
| 5 | L01CD02 | docetaxel |
| 6 | L01DB07 | mitoxantron |
| 7 | L01XX11 | estramustin |
| 8 | L02AE01 | buserelin |
| 9 | L02AE02 | leuprorelin |
| 10 | L02AE03 | goserelin |
| 11 | L02AE04 | triptorelin |
| 12 | L02BB02 | nilutamid |
| 13 | L02BB03 | bicalutamid |
| 14 | L02BX02 | degarelix |
| 15 | L01CD04 | kabazitaxel |
| 16 - | H02AB07 | prednizon |
| 17 - | V10XX03 | rádium-223-diklorid |
| 18 - | L02BB04 | enzalutamid |
| 19 - | L02BX03 | abirateron-acetát |
"
5. Az R3. 29. mellékletének 7. pontja helyébe a következő rendelkezés lép:
"7.- Fogalmak, rövidítések
| ADT | androgéndeprivációs terápia |
| ALT | alanin-aminotranszferáz |
| AST | aszpartát-aminotranszferáz |
| BSC | legjobb tüneti kezelés |
| CrCL | kreatinin clearance |
| ECOG | Eastern Cooperative Oncology Group |
| LHRH | luteinizáló hormon releasing hormon |
| NYHA | New York Heart Association |
| AV-blokk | atrio-ventrikuláris blokk |
| PSA | prosztata specifikus antigén |
| PSA DT | PSA doubling time |
| PSA velocitás | A serum PSA egy év alatti abszolút növekedése (ng/ml/év) |
| aktiv surveillance | Fokozott felügyelet. A surveillance program alatt a betegek rendszeres időközönként előre meghatározott vizsgálatokon és mintavételeken vesznek részt a betegség esetleges progressziójának szigorú monitorozása érdekében. |
| watchful waiting | kezelés halasztása |
| TUR: | transzuretralis prosztata rezekció: a prosztata szövet húgycsövön keresztüli eltávolítása |
| ULN | upper limit of normal, a normál tartomány felső határa |
| radikális prosztatektomia: | a szervre lokalizált prosztatarák nyílt vagy laparoszkópos eltávolítása |
| Gleason score: | a prosztatarák differenciáltsági fokának megállapításához használt pontszám. A pontszám 4 (2) és 10 között lehet, a 4 (2) a legkevésbé, a 10 a leginkább agresszív daganat. |
| Gx: a Gleason score nem állapítható meg; |
| Gleason 4-6: jól differenciált daganat (minimális anaplázia); | |
| Gleason 7: közepesen vagy mérsékelten differenciált daganat (mérsékelt anaplázia); | |
| Gleason 8-10: rosszul differenciált daganat vagy differenciálatlan (jellegzetes anaplázia). |
"
15. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 31. mellékletének 3. pont 3.4. alpontja helyébe a következő rendelkezés lép:
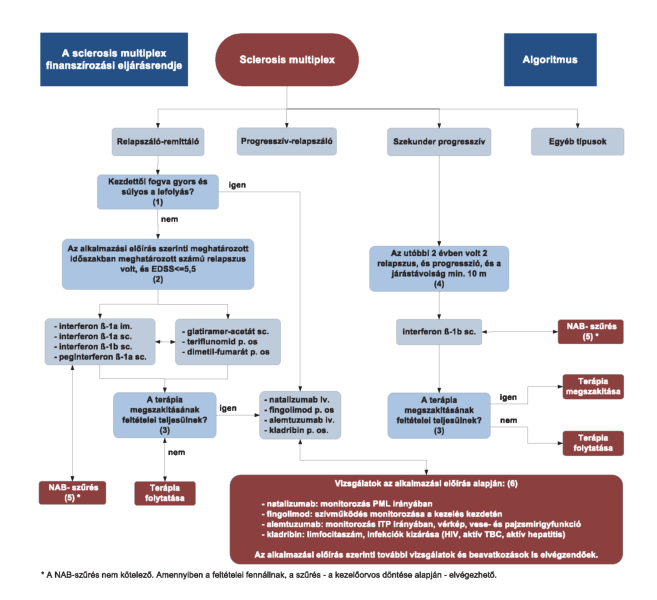
"3.4. A sclerosis multiplex progressziójának/aktivitásának csökkentését célzó gyógyszeres kezelés algoritmusa
"
2. Az R3. 31. mellékletének 3. pont 3.5-3.6 alpontjai helyébe a következő rendelkezés lép:
"3.5. A finanszírozási algoritmus részletezése
3.5.1. (1) Relapszáló-remittáló SM-ben kezdettől fogva gyors és súlyos a betegség lefolyása, ha az alábbi feltételek teljesülnek:
3.5.1.1. 2 vagy több funkcióvesztést okozó relapszus fordult elő egy év alatt.
3.5.1.2. Friss MR-felvételen 1-nél több Gd-dúsulással járó lézió vagy megnövekedett T2-góctérfogat észlelhető.
3.5.2. (2) Relapszáló-remittáló SM-ben interferon/peginterferon-ß, glatiramer-acetát, teriflunomid vagy dimetil-fumarát alkalmazásának feltételei:
3.5.2.1. A gyógyszer alkalmazási előírásában részletezett feltételek szerint az utóbbi meghatározott időszakban előfordult legalább a meghatározott számú jelentős klinikai relapszus.
3.5.2.2. A beteg állapota a Kiterjesztett Rokkantsági Állapot Skála szerint legfeljebb 5,5 (EDSS ≤ 5,5, a járástávolság segítség nélkül legalább 100 m).
3.5.3. (3) Relapszáló-remittáló SM-ben az interferon/peginterferon-ß- vagy glatiramer-acetát-kezelés megszakításának feltételeit a 3.8. ábra tartalmazza.
3.5.4. (4) Szekunder progresszív SM-ben interferon-ß-1b alkalmazásának feltételei:
3.5.4.1. Az utóbbi 2 évben legalább 2, mozgáskorlátozottságot okozó relapszus volt.
3.5.4.2. A járástávolság legalább 10 m.
3.5.4.3. A neurológiai tünetek progressziója észlelhető.
3.5.5. (5) Interferon/peginterferon-ß-kezelés során a neutralizáló ellenanyagok (NAB) szűrését - a kezelőorvos döntése alapján - el lehet végezni, amennyiben a szűrés feltételei adottak. A szűrés lehetséges algoritmusát a 3.6. ábra tartalmazza tájékoztató céllal.
3.5.6. (6) Az adott készítmény alkalmazási előírásában foglaltak alapján a kezeléshez kapcsolódóan az előírt vizsgálatokat el kell végezni:
3.5.6.1. Natalizumab: monitorozás progresszív multifokális leuko-enkefalopátia irányában. Új neurológiai tünetek fellépésekor a PML lehetőségét ki kell zárni. A PML iránti monitorozást a 3.7. ábra szerinti külön algoritmus írja le. Az alkalmazási előírás szerinti további vizsgálatokat és beavatkozásokat is el kell végezni.
3.5.6.2. Fingolimod: a kezelés kezdetén az EKG, a vérnyomás és a pulzus monitorozása. Az alkalmazási előírás szerinti további vizsgálatokat és beavatkozásokat is el kell végezni.
3.5.6.3. Alemtuzumab: monitorozás immunmediált thrombocytopeniás purpura irányában, vérkép, vese- és pajzsmirigyfunkció vizsgálata. Az alkalmazási előírás szerinti további vizsgálatokat és beavatkozásokat is el kell végezni.
3.5.6.4. Kladribin: limfocitaszám meghatározása, HIV-fertőzés, aktív TBC és aktív hepatitis kizárása. Az alkalmazási előírás szerinti további vizsgálatokat és beavatkozásokat is el kell végezni.
3.6. A neutralizáló antitestek szűrésének tájékoztató célú algoritmusa sclerosis multiplexben az interferon/peginterferon-kezeléshez kapcsolódóan.
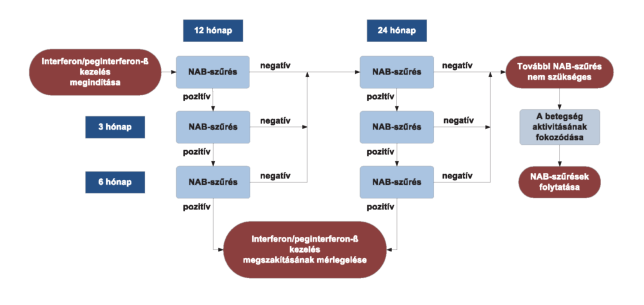
A 3.6. ábra a NAB-szűrés lehetséges algoritmusát mutatja."
3. Az R3. 31. mellékletének 3. pont 3.8-3.9. alpontjai helyébe a következő rendelkezés lép:
"3.8. Az interferon/peginterferon-ß- és a glatiramer-acetát-kezelés megszakítása
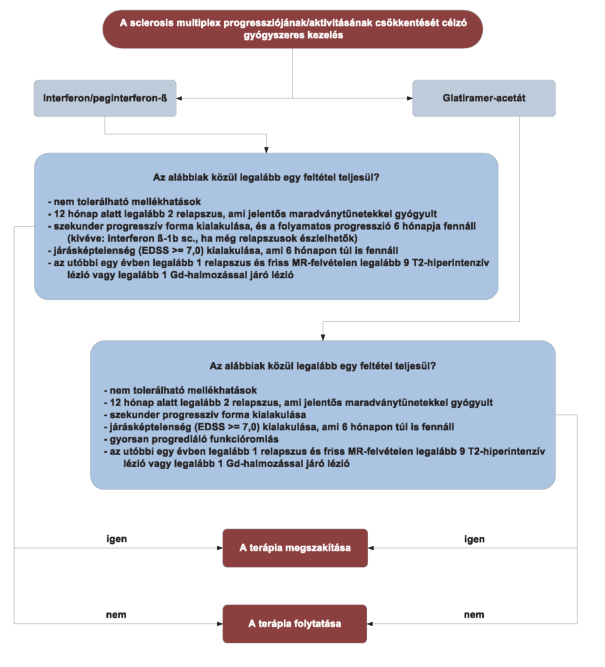
3.9. Az immunmoduláló kezelés megszakításának és módosításának további, általános - a kezelőorvos mérlegelési körébe tartozó - szempontjai:
3.9.1. Ha időarányosan legalább annyi shub jelentkezik a kezelés első 2 éves periódusa alatt, mint az immunmoduláló kezelés elindítása előtt, vagy egy év alatt egy súlyos relapszus lép fel, a felépülés részleges, vagy MR-felvételen Gd-halmozó vagy szaporodó T2-gócok észlelhetők (ilyen esetekben indokolt más kémiai szerkezetű immunmoduláló szerre váltás egyedi mérlegelés alapján).
3.9.2. Ha interferon/peginterferon-kezelés esetén elégtelen terápiás válasz emelkedett neutralizáló-antitest-titerrel párosul a szérumban (indokolt más kémiai szerkezetű immunmoduláló szerre váltás).
3.9.3. Ha az immunmoduláló kezelés alatt a beadás módjával összefüggő mellékhatás mutatkozik - és egyébként a kezelés hatásos -, indokolt lehet másik immunmoduláló szerre váltani.
3.9.4. Ha egyéb, nem tolerálható mellékhatás miatt szükséges megszakítani az adott béta-interferon/peginterferon-terápiát, másik béta-interferon/peginterferon-készítmény adása nem indokolt. Ilyen esetekben glatiramer-acetát, teriflunomid vagy dimetil-fumarát adása mérlegelhető. Glatiramer-acetát, teriflunomid vagy dimetil-fumarát kezelés során fellépő mellékhatás esetén interferonra/peginterferonra való átállás jöhet szóba.
3.9.5. Tervezett vagy létrejött terhesség, továbbá laktáció esetén a béta-interferon/peginterferon- vagy glatiramer-acetát-kezelés megszakítását az alkalmazási előírásban foglaltak figyelembe vételével szükséges mérlegelni."
4. Az R3. 31. mellékletének 6. pont 6.4. alpontja helyébe a következő rendelkezés lép:
"6.4. Releváns ATC kódok
| A | B | |
| 1 | ATC | ATC megnevezés |
| 2 | H02AB04 | metilprednizolon |
| 3 | L03AB07 | interferon béta-1a |
| 4 | L03AB08 | interferon béta-1b |
| 5 | L03AB13 | peginterferon-béta-1a |
| 6 | L03AX13 | glatiramer-acetát |
| 7 | L04AA23 | natalizumab |
| 8 | L04AA27 | fingolimod |
| 9 | L04AA31 | teriflunomid |
| 10 | L04AA34 | alemtuzumab |
| 11 | L04AA40 | kladribin |
| 12 | L04AX01 | azatioprin |
| 13 | L04AX07 | dimetil-fumarát |
| 14 | M03BX01 | baclofen |
| 15 | M03BX02 | tizanidin |
| 16 | M03BX04 | tolperison |
| 17 | N04BB01 | amantadin |
"
5. Az R3. 31. mellékletének 7. pontja helyébe a következő rendelkezés lép:
"7. Rövidítések
NICE: National Institute for Health and Clinical Excellence
EFNS: European Federation of Neurological Societies
NEAK: Nemzeti Egészségbiztosítási Alapkezelő
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy
NTK: Napi terápiás költség
SM: Sclerosis multiplex
CDMS: Klinikailag definitív sclerosis multiplex
CIS: Klinikailag izolált szindróma
PML: Progresszív multifokális leuko-enkefalopátia
ITP: Immunmediált thrombocytopeniás purpura
MR: Mágneses rezonancia
CT: Számítógépes rétegvizsgálat
VEP: Vizuális kiváltott válasz
EKG: Elektro-kardiográfia
EDSS: Expanded Disability Status Scale
OGP: Oligoklonális gammopátia
MBP: Myelin basic protein
BAB: Kötő antitest
NAB: Neutralizáló antitest
JCV: JC-vírus, John Cunningham vírus
HIV: Humán immundeficiencia vírus
TBC: Tuberculosis
ACTH: Adrenokortikotrop hormon
IFN: Interferon
iv.: Intravénás
im.: Intramuszkuláris
sc.: Szubkután"
16. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R3. 37. mellékletének 2. pontja helyébe a következő rendelkezés lép:
"2. A kórkép leírása
Az asthma bronchiale a légutak krónikus gyulladásos megbetegedése. A patomechanizmus fő tényezői a gyulladás, a légutak strukturális átalakulása és a bronchiális hiperreaktivitás. A légutak obstrukcióval reagálnak nem specifikus stimulusokra. Klinikailag rendszeresen jelentkeznek nehézlégzéssel, mellkasi feszüléssel, köhögéssel járó epizódok leginkább éjszaka vagy kora reggel. A panaszok hátterében álló változó mértékű légúti szűkület spontán vagy megfelelő farmakoterápia hatására többnyire reverzibilis. Bármely súlyossági fokozatban felléphet exacerbáció, ami a jellemző tünetek (nehézlégzés, köhögés, sípoló légzés, mellkasi feszülés) fokozódása, illetve e fokozott tünetek kombinációja. Az asthma multifaktoriális etiológiájú kórkép, kialakulásában genetikai és környezeti tényezők játsszák a fő szerepet. Az európai országokban az asthma prevalenciája 5-10% körül mozog. Magyarországon a pulmonológiai szakellátásban mintegy 300 ezer beteget tartanak nyilván, az új megbetegedések száma évente 10-20 ezer. A betegség ellátása komoly terhet ró a betegre és a társadalomra egyaránt. Az asthma klinikai manifesztációi adekvát gyógyszeres kezeléssel és megfelelő gondozással jól kontrollálhatók, de maga a betegség nem gyógyítható.
A jelen finanszírozási eljárásrend hatálya a felnőttkori asthma bronchiale diagnosztikájára, valamint gyógyszeres kezelésére terjed ki."
2. Az R3. 37. mellékletének 3. pontja helyébe a következő rendelkezés lép:
"3. A finanszírozás rendje, a finanszírozási algoritmus
3.1. Az asthma bronchiale diagnosztikájának algoritmusa
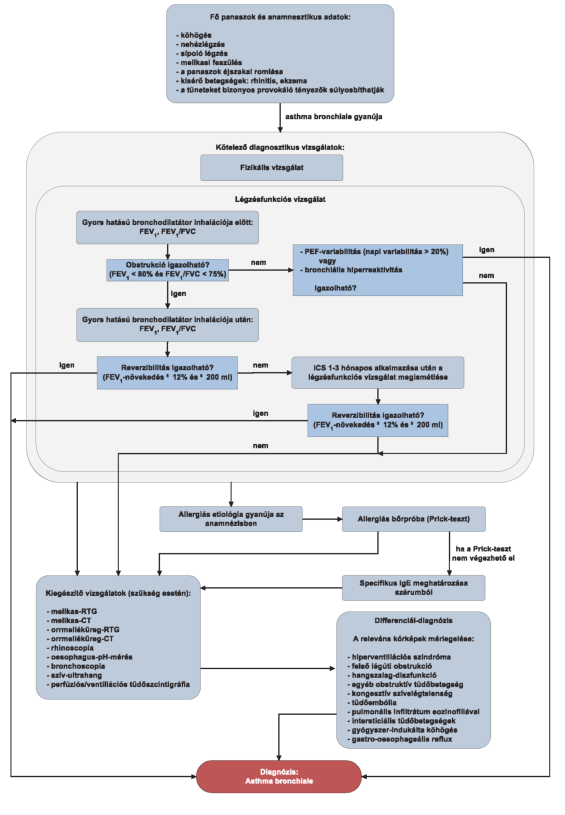
Szisztémás antihisztamin-kezelés alatt az allergiás bőrpróba helyett nem végezhető specifikus IgE-meghatározás. A szisztémás antihisztamin-kezelés felfüggesztése után 1 héttel az allergiás bőrpróba elvégezhető."
3. Az R3. 37. mellékletének 4. pontja helyébe a következő rendelkezés lép:
"4. Az asthma bronchiale gyógyszeres kezelésének finanszírozási algoritmusa
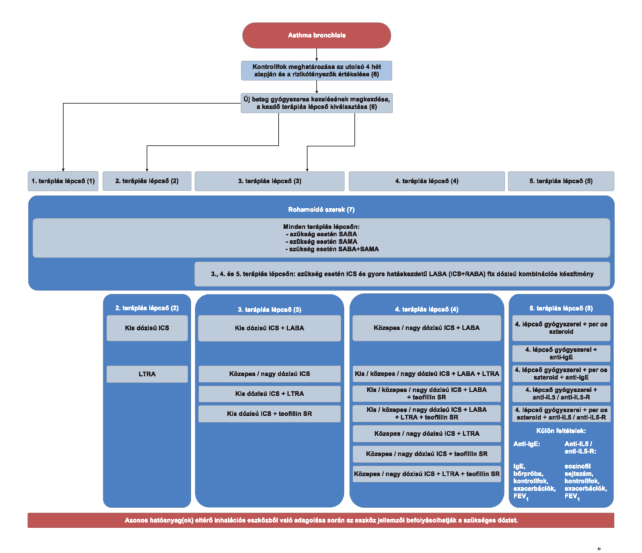
"
4. Az R3. 37. mellékletének 4. pont 4.1. (5)-(7) alpontjai helyébe a következő rendelkezések lépnek:
"4.1. (5) 5. terápiás lépcső.
a) A választható kezelések:
aa) a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal
ab) perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése anti-IgE-vel
ac) perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal és anti-IgE-vel
ad) perzisztáló súlyos eozinofil asthmában a 4. lépcső szerinti kezelés kiegészítése anti-IL5-tel anti-IL5 vagy anti-IL5-R készítménnyel
ae) perzisztáló súlyos eozinofil asthmában a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal és anti-IL5-tel anti-IL5 vagy anti-IL5-R készítménnyel.
b) Az anti-IgE adásának további feltételei:
ba) IgE-szint > 76 NE/ml és az IgE-szint nem haladja meg az alkalmazási előírás szerinti maximális értéket
bb) perenniális inhalatív allergénnel szembeni pozitív bőrpróba vagy specifikus IgE kimutatása a szérumban
bc) szisztémás szteroid tartós alkalmazása ellenére az asthma nem kontrollált vagy nagy dózisú ICS+LABA alkalmazása ellenére gyakoriak a szisztémás szteroidot igénylő exacerbációk (≥ 4/év)
bd) FEV1 < ref. 80%-a
be) az anti-IgE-kezelés megkezdését követően évente értékelni kell a kezelés hatását, és az anti-IgE-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő vagy a korábban alkalmazott tartós fenntartó szisztémás szteroidkezelés dózisa az anti-IgE-kezelés megkezdése előtti dózis 50%-ára vagy az alá csökkent.
c) Valamennyi anti-IL5/anti-IL5-R adásának további feltételei:
ca) laboratóriumi vérképvizsgálat által kimutatott perifériás eozinofil sejtszám a terápia megkezdése előtt a készítmény alkalmazási előírásában definiáltnak megfelel, de legalább 300 sejt/μl
cb) tartós szisztémás szteroid kezelés ellenére az asthma nem kontrollált, vagy az elmúlt 12 hónapban legalább 4 szisztémás szteroid kezelést igénylő asthma exacerbáció alakult ki
cc) nagydózisú ICS+LABA fenntartó terápia legalább 6 hónapos rendszeres használata ellenére FEV1<80% és nem kontrollált asthma áll fenn
cd) FEV1 < ref. 80%-a
ce) az anti-IL5/anti-IL5-R-kezelés megkezdését követően évente értékelni kell a kezelés hatását és az anti-IL5/anti-IL5-R-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő vagy a korábban alkalmazott tartós fenntartó szisztémás szteroidkezelés dózisa az anti-IL5/anti-IL5-R-kezelés megkezdése előtti dózis 50%-ára vagy az alá csökkent.
cf) ha az anti-IL5/anti-IL5-R-kezelés az évenkénti értékelés alapján tovább nem folytatható, úgy az anti-IL5/anti-IL5-R-kezelés másik anti-IL5/anti-IL5-R hatóanyaggal sem folytatható.
d) A benralizumab alkalmazásának - a valamennyi anti-IL5/anti-IL5-R adására vonatkozó feltételek melletti -további feltételei:
da) a benralizumab-kezelés megkezdése után 6 hónappal értékelni kell a kezelés hatását és a benralizumab-kezelés kizárólag akkor folytatható, ha a FEV1 a kezelés első 6 hónapja során bármikor legalább 100 ml-rel nagyobb volt, mint a benralizumab-kezelés megkezdésekor, és a kezelés első 6 hónapja során szisztémás szteroidot igénylő exacerbáció legfeljebb 1 alkalommal fordult elő
db) ha a benralizumab-kezelés az első 6 hónap értékelése alapján tovább nem folytatható, úgy az anti-IL5/anti-IL5-R-kezelés másik anti-IL5/anti-IL5-R hatóanyaggal sem folytatható.
e) Anti-IgE és anti-IL5/anti-IL5-R egyidejűleg nem alkalmazható.
(6) Újonnan diagnosztizált betegnél meg kell állapítani az asthma kontrollfokát az utolsó 4 hét alapján és a rizikótényezők fennállását vagy hiányát. A gyógyszeres kezelés a kontrollfokhoz és a rizikóbecsléshez igazodó terápiás lépcsőn kezdhető meg.
a) Új beteg gyógyszeres kezelését az 1. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma kontrollált, és a nappali tünetek jelentkezése nem gyakoribb havi 2 alkalomnál, és nincs exacerbációs rizikó.
b) Új beteg gyógyszeres kezelését a 2. terápiás lépcsőn kell elkezdeni, ha az utolsó 4 hét vonatkozásában:
ba) az asthma kontrollált, de a kezelés 1. terápiás lépcsőn való elkezdésének feltételei nem teljesülnek;
bb) az asthma részben kontrollált és nincs exacerbációs rizikótényező.
c) Új beteg gyógyszeres kezelését a 3. terápiás lépcsőn kell elkezdeni, ha az utolsó 4 hét vonatkozásában:
ca) az asthma nem kontrollált;
cb) az asthma részben kontrollált és van exacerbációs rizikótényező. (7) Rohamoldó szerek.
Minden terápiás lépcsőn (1., 2., 3., 4., 5.) használhatók szükség esetén.
a) A választandó kezelés a SABA.
b) Ha a SABA kontraindikált vagy vele szemben intolerancia lép fel, választható a SAMA vagy a SABA+SAMA. A 3., 4. és 5. terápiás lépcsőn használhatók szükség esetén.
c) ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítmény. Amennyiben a beteg a 3., 4. vagy 5. terápiás lépcsőn ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítményt használ fenntartó terápiaként, és e készítmény alkalmazási előírásában a javallatok között szerepel a rohamoldóként történő, szükség szerinti alkalmazás is, úgy e készítmény - az alkalmazási előírásnak megfelelően - használható rohamoldó szerként is.
a) Minden terápiás lépcsőn (1., 2., 3., 4., 5.) használhatók szükség esetén:
aa) választandó kezelés a SABA
ab) ha a SABA kontraindikált vagy vele szemben intolerancia lép fel, választható a SAMA
ac) ha a SABA nem eredményezett megfelelő hörgtágítást, választható a SABA+SAMA.
b) A 3., 4., és 5. terápiás lépcsőn használhatók szükség esetén:
ba) amennyiben a beteg a 3., 4. vagy 5. terápiás lépcsőn ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítményt használ fenntartó terápiaként, és e készítmény alkalmazási előírásában a javallatok között szerepel a rohamoldóként történő, szükség szerinti alkalmazás is, úgy ez a készítmény - az alkalmazási előírásnak megfelelően - használható rohamoldó szerként is."
5. Az R3. 37. mellékletének 4. pont 4.2-4.3. alpontjai helyébe a következő rendelkezések lépnek:
"4.2. Amennyiben az alkalmazott hatóanyagú készítmény kontraindikált, vagy az alkalmazási előírás szerinti dózisban vele szemben intolerancia (tolerálhatatlan mellékhatás) lép fel, akkor azt - a kezelőorvos mérlegelése és döntése alapján - úgy lehet tekinteni, mintha az érintett hatóanyagcsoporttal a megfelelő dózisban folytatott terápia - a megfelelő eredmény nélkül - megtörtént volna. Ilyen esetben ugyanakkor - a kezelőorvos mérlegelése és döntése alapján - lehetőség van az érintett hatóanyagcsoporton belül másik készítmény alkalmazására is.
4.3. Az inhalációs szteroidok becsült ekvivalens napi adagjai
| A | B | C | D | |
| 1 | Hatóanyag | Alacsony napi dózis (Mg) | Közepes napi dózis (Mg) | Magas napi dózis (Mg) |
| 2 | beclometason-dipropionát (CFC) | 200-500 | >500-1000 | >1000 |
| 3 | beclometason-dipropionát (HFA és DPI) | 100-200 | >200-400 | >400 |
| 4 | budesonid (DPI) | 200-400 | >400-800 | >800 |
| 5 | ciclesonid (HFA) | 80-160 | >160-320 | >320 |
| 6 | fluticason-propionát (DPI) | 100-250 | >250-500 | >500 |
| 7 | fluticason-propionát (HFA) | 100-250 | >250-500 | >500 |
| 8 | fluticason-propionát (Axahaler) * | 50-125 | >125-250 | >250 |
| 9 | fluticason-furoát ** | 100 | 100-200 | 200 |
| 10 | budesonid (Axahaler) *** | 120-240 | 240-480 | >480 |
Az ICS-ot tartalmazó kezelést elrendelő orvos feladata, hogy a dózisekvivalenciát a hatályos szakmai irányelv és az alkalmazási előírás alapján ellenőrizze, az előírt dózist pedig szükség esetén módosítsa.
* Fluticason Axahaler: a DPI inhalációs eszközök közül Axahaler esetében a fluticason-propionát ekvivalens dózisa a Diskus-ból adott dózis 50%-a.
** Naponta egyszer alkalmazandó, vilanterollal fix kombinációban.
***Budesonid Axahaler: a DPI inhalációs eszközök közül Axahaler esetében a budesonid ekvivalens dózisa a Turbuhalerből/Easyhalerből adott dózis 75%-a."
6. Az R3. 37. mellékletének 4. pont 4.4. alpontja helyébe a következő rendelkezés lép:
"4.4. Asthma-kontroll"
7. Az R3. 37. mellékletének 4. pont 4.4.2. alpontja helyébe a következő rendelkezés lép:
"4.4.2. Az asthma jövőbeli kockázatának felmérése:
a) exacerbáció rizikója
b) fixált légúti obstrukció kialakulásának rizikója
c) gyógyszer-mellékhatások"
8. Az R3. 37. mellékletének 4. pont 4.5. alpontjában foglalt táblázat C:3 mezője helyébe a következő mező lép:
| (C) | |
| (3) | mondattöredékek |
9. Az R3. 37. mellékletének 6. pontja helyébe a következő rendelkezés lép:
"6. Az asthma bronchiale gyógyszeres kezelése kontrollfokhoz történő igazításának algoritmusa
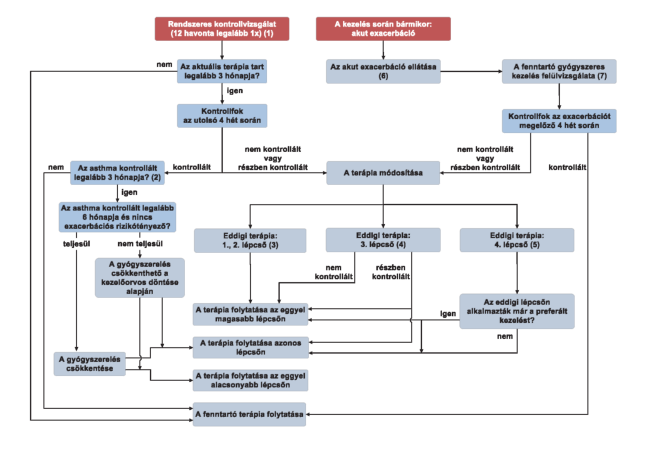
A gyógyszeres kezelés kontrollfokhoz történő igazításának algoritmusában (6. pont) szereplő döntések tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) Minden betegnek 12 havonta legalább egyszer részt kell vennie szakorvosi kontrollvizsgálaton.
(2) a) Ha a legalább 3 hónapja alkalmazott gyógyszeres kezeléssel az asthma legalább 3 hónapja kontrollált, a kezelőorvos döntése alapján meg lehet kísérelni a gyógyszerelés csökkentését.
b) Ha az asthma legalább 6 hónapja kontrollált és nincs exacerbációs rizikótényező, meg kell kísérelni a gyógyszerelés csökkentését egy olyan időpontban, amikor nem zajlik légúti infekció, a beteg nem terhes és nem tervez utazást.
c) A gyógyszerelés csökkenthető a dózis csökkentésével vagy egy gyógyszer elhagyásával. Ennek megfelelően a terápia folytatható az azonos vagy az eggyel alacsonyabb lépcsőn.
d) A 2. lépcsőn adott kisdózisú ICS monoterápia elhagyása nem javasolt, kivéve olyan esetben, amikor ez az asthma diagnózis megerősítéséhez szükséges.
(3) Ha az 1. vagy a 2. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, az eggyel magasabb lépcsőn folytatható a kezelés.
(4) Ha a 3. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. lépcsőn folytatható a kezelés. Ha az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, a kezelőorvos döntése szerint vagy a 4. lépcsőn vagy a 3. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(5) Ha a 4. lépcső szerinti, legalább 3 hónapig alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, és a preferált kezelést (közepes/nagy dózisú ICS+LABA) már alkalmazták legalább 3 hónapig, a kezelőorvos döntése szerint vagy az 5. lépcsőn vagy a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés. Ha a 4. terápiás lépcsőn a preferált kezelést még nem alkalmazták legalább 3 hónapig, a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(6) Akut exacerbáció fellépése esetén annak ellátására külön szabályok vonatkoznak (az 5. pont szerinti ábra és a 4.5. pont szerinti táblázat).
(7) Akut exacerbáció kezelését és lezajlását követően felül kell vizsgálni a fenntartó gyógyszeres kezelést. E felülvizsgálat során meg kell állapítani az exacerbációt közvetlenül megelőző, az exacerbációtól még mentes 4 hetes időszakra vonatkozó kontrollfokot. Ha a megelőző 4 hét során az asthma kontrollált volt, úgy az exacerbációt követően a korábbi fenntartó gyógyszeres kezelés folytatandó. Ha a megelőző 4 hét során az asthma nem kontrollált vagy részben kontrollált volt, úgy az exacerbációt követően a (3), (4), (5) pont szerint fokozható a gyógyszeres kezelés."
10. Az R3. 37. mellékletének 7. pont 7.1. alpontja helyébe a következő rendelkezés lép:
"7.1. Az asthma bronchiale diagnózisának felállítása az előírt módon történt-e (különös tekintettel a légzésfunkciós vizsgálatokra és az allergiás etiológia gyanúja esetén szükséges vizsgálatokra)?"
11. Az R3. 37. mellékletének 9. pont 9.4. alpontja a következő 22. sorral egészül ki:
(9.4. Releváns ATC kódok)
| A | B | |
| "22 | R03DX10 | Benralizumab" |
12. Az R3. 37. mellékletének 10. pontja helyébe a következő rendelkezés lép:
"10. Fogalmak, rövidítések
GINA: Global Initiative for Asthma
NEAK: Nemzeti Egészségbiztosítási Alapkezelő
TB: Társadalom-biztosítás
HBCS: Homogén betegségcsoport
OENO: Orvosi Eljárások Nemzetközi Osztályozása
BNO: Betegségek Nemzetközi Osztályozása
ATC: Anatomical, therapeutic, chemical klasszifikáció
DOT: Day of therapy (terápiás napok)
NTK: Napi terápiás költség
FEV: Forced exspiratory volume (erőltetett kilégzési térfogat)
FEV1: Forced exspiratory volume in one second (erőltetett kilégzési térfogat 1 másodperc alatt)
FVC: Forced vital capacity (erőltetett vitálkapacitás)
PEF: Peak exspiratory flow (kilégzési csúcsáramlás)
IC: Inspiratory capacity (belégzési kapacitás)
IVC: Inspiratory vital capacity (belégzési vitálkapacitás)
EVC: Exspiratory vital capacity (kilégzési vitáikapacitás)
BHR: Bronchiális hiperreaktivitás
SABA: Short-acting ß2-agonist (rövid hatású ß2-agonista)
LABA: Long-acting ß2-agonist (hosszú hatású ß2-agonista)
RABA: Rapid-acting ß2-agonist (gyors hatású ß2-agonista)
SAMA: Short-acting muscarinic antagonist (rövid hatású muszkarinerg-antagonista)
LAMA: Long-acting muscarinic antagonist (hosszú hatású muszkarinerg-antagonista)
ICS: Inhaled corticosteroid (inhalációs kortikoszteroid)
SCS: Szisztémás kortikoszteroid
LTRA: Leukotrién-receptor-antagonista
Teofillin SR: Hosszú hatású teofillin
Anti-IgE Anti-immunglobulin-E
Anti-IL5 Interleukin-5-gátló
Anti-IL5-R Interleukin-5-receptor-gátló
NIV: Nem invazív gépi lélegeztetés
MDI: Metered dose inhaler (adagolószelepes aeroszol)
DPI: Dry powder inhaler (szárazpor-inhalátor)
CFC Kloro-fluoro-karbon hajtógáz
HFA Hidro-fluoro-alkán hajtógáz
GYSE: Gyógyászati segédeszköz"
17. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
Az R4. 2. melléklet "**** 99 959J Rosszindulatú daganat kemoterápiája "J"" megjelölésű része helyébe a következő rendelkezés lép:
"**** 99 959J Rosszindulatú daganat kemoterápiája "J"
DAGANATOK "G2"
A kódlistát ld. kiemelve a főcsoport elején!
DAGANATOK "S"
A kódlistát ld. kiemelve a főcsoport elején!
DAGANATOK "W"
A kódlistát ld. kiemelve a főcsoport elején!
DAGANATOK "W5"
A kódlistát ld. kiemelve a főcsoport elején!
DAGANATOK "R1"
A kódlistát ld. kiemelve a főcsoport elején!
KEMOTERÁPIÁK "*E"
7318* Kemoterápia, INF-alfa+IL2+5FU protokoll szerint
KEMOTERÁPIÁK "*F"
7998* Kemoterápia, KAB protokoll szerint
KEMOTERÁPIÁK "*G"
7480* Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint
(["1"-ES TÍPUSKÉNT DAG. "S" ÉS "3"-AS TÍPUSKÉNT DAG. "W5"] ÉS KEMOT. "*E") VAGY (DAG. "R1" ÉS KEMOT. "*F") VAGY (["1"-ES TÍPUSKÉNT DAG. "G2" ÉS "3"-AS TÍPUSKÉNT DAG. "W'] ÉS KEMOT. "*G")"
18. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
Az R4. 4. mellékletében foglalt táblázat a "74792" megjelölésű sort követően a következő sorokkal egészül ki:
| (KÓD | MEGNEVEZÉS | BESOROLÁSI SZEMPONT) |
| " | ||
| 74801 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (01. fázis) | * |
| 74802 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (02. fázis) | * |
| 74803 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (03. fázis) | * |
| " | ||
19. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
Az R5. 1. mellékletében foglalt táblázat a "74792" megjelölésű sort követően a következő sorokkal egészül ki:
| (Kód | Megnevezés) |
| " | |
| 74801 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (01. fázis) |
| 74802 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (02. fázis) |
| 74803 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (03. fázis) |
| " | |
20. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
Az R5. 2. melléklete a "7479* Kemoterápia, CDDP+VNB/B+BEV protokoll szerint" megjelölésű részét követően a következő rendelkezéssel egészül ki:
"7480* Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint
Protokoll időtartama : 15 [nap]
Protokollok közti szünet : 13 [nap]
Fázisok száma : 3
Diagnózisok:
1-es típusú diagnózis (alapbetegség)
C2500 Hasnyálmirigy fej rosszindulatú daganata
C2510 Hasnyálmirigy test rosszindulatú daganata
C2520 Hasnyálmirigy farok rosszindulatú daganata
C2530 Hasnyálmirigy vezeték rosszindulatú daganata
C2540 Endocrin pancreas rosszindulatú daganata
C2570 A hasnyálmirigy egyéb részeinek rosszindulatú daganata
C2580 A hasnyálmirigy átfedő rosszindulatú daganata
C2590 Hasnyálmirigy rosszindulatú daganata, k.m.n.
3-as típusú diagnózis (ápolást indokló fődiagnózis)
C7700 A fej, az arc és a nyak nyirokcsomóinak rosszindulatú daganata
C7710 Intrathoracalis nyirokcsomók rosszindulatú daganata
C7720 Intraabdominalis nyirokcsomók rosszindulatú daganata
C7730 A hónalj és a felső végtag nyirokcsomóinak rosszindulatú daganata
C7740 A lágyék és az alsó végtag nyirokcsomóinak rosszindulatú daganata
C7750 Medencei nyirokcsomók rosszindulatú daganata
C7780 Több régió nyirokcsomóinak rosszindulatú daganata
C7790 Nyirokcsomó rosszindulatú daganata, k.m.n.
C7800 A tüdő másodlagos rosszindulatú daganata
C7810 A gátor másodlagos rosszindulatú daganata
C7820 A mellhártya másodlagos rosszindulatú daganata
C7830 Egyéb és k.m.n. légzőszerv másodlagos rosszindulatú daganata
C7840 A vékonybél másodlagos rosszindulatú daganata
C7850 A vastagbél és végbél másodlagos rosszindulatú daganata
C7860 A retroperitoneum és a hashártya másodlagos rosszindulatú daganata
C7870 A máj másodlagos rosszindulatú daganata
C7880 Egyéb és k.m.n. emésztőszerv másodlagos rosszindulatú daganata
C7900 A vese és a vesemedence másodlagos rosszindulatú daganata
C7910 A húgyhólyag és egyéb húgyszervek másodlagos rosszindulatú daganata
C7920 A bőr másodlagos rosszindulatú daganata
C7930 Az agy és agyburkok másodlagos rosszindulatú daganata
C7940 A központi idegrendszer k.m.n. részének másodlagos rosszind. daganata
C7950 A csontok és csontvelő másodlagos rosszindulatú daganata
C7951 A koponya csontjának másodlagos rosszindulatú daganata
C7952 A gerincoszlop csontjainak másodlagos rosszind. daganata
C7960 A petefészek másodlagos rosszindulatú daganata
C7970 A mellékvese másodlagos rosszindulatú daganata
C7980 Egyéb meghatározott lokalizáció másodlagos rosszindulatú daganata
Fázisok leírása:
| Beavatkozás kód: 74801 Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (01. fázis) | |||||
| Fázis azonosító: 1 | Fázis hossza: 1 [nap] | ||||
| GEM nab TAX | Gemcitabine nab-Paclitaxel | Adagolás: Adagolás: | 1000,0 125,0 | mg/m2 mg/m2 | |
| Beavatkozás kód: 74802 Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (02. fázis) | |||||
| Fázis azonosító: 2 | Fázis hossza: 1 [nap] | ||||
| GEM nab TAX | Gemcitabine nab-Paclitaxel | Adagolás: Adagolás: | 1000,0 125,0 | mg/m2 mg/m2 | |
| Beavatkozás kód: 74803 Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint (03. fázis) | |||||||||||||||||
| Fázis azonosító: 3 | Fázis hossza: 1 [nap] | ||||||||||||||||
| GEM nab TAX | Gemcitabine nab-Paclitaxel | Adagolás: Adagolás: | 1000,0 125,0 | mg/m2 mg/m2 | |||||||||||||
| Ellátási napok a ciklus kezdetétől: | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | ||
| Fázisok: | 1 | 2 | 3 | ||||||||||||||
| GEM | Gemcitabine | * | * | * | |||||||||||||
| nab TAX | nab-Paclitaxel | * | * | * | |||||||||||||
21. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
Az R5. 3. mellékletében foglalt táblázat a következő 42a. sorral egészül ki:
| (A | B | C | |
| 1. | Szinonima | Hatóanyag | ATC-kód) |
| " | |||
| 42a. | nab TAX | nabPaclitaxel | L01CD01 |
| " | |||
22. melléklet a 36/2019. (XII. 30.) EMMI rendelethez
1. Az R5. 4. mellékletében foglalt táblázat "C25 A hasnyálmirigy rosszindulatú daganata" megjelölésű része a "7416" megjelölésű sort követően a következő sorral egészül ki:
| (Kód | Megnevezés | Melyik HBCS-be sorolódik) | |
| " | |||
| 7480 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint | 959J | Rosszindulatú daganat kemoterápiája "J" |
| " | |||
2. Az R5. 4. mellékletében foglalt táblázat "C77 A nyirokcsomók másodlagos és nem meghatározott rosszindulatú daganata" megjelölésű része a "7450" megjelölésű sort követően a következő sorral egészül ki:
| (Kód | Megnevezés | Melyik HBCS-be sorolódik) | |
| " | |||
| 7480 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint | 959J | Rosszindulatú daganat kemoterápiája "J" |
| " | |||
3. Az R5. 4. mellékletében foglalt táblázat "C78 A légzőszervek és emésztőszervek másodlagos rosszindulatú daganata" megjelölésű része a "7450" megjelölésű sort követően a következő sorral egészül ki:
| (Kód | Megnevezés | Melyik HBCS-be sorolódik) | |
| " | |||
| 7480 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint | 959J | Rosszindulatú daganat kemoterápiája "J" |
| " | |||
4. Az R5. 4. mellékletében foglalt táblázat "C79 Egyéb lokalizációk másodlagos rosszindulatú daganata" megjelölésű része a "7450" megjelölésű sort követően a következő sorral egészül ki:
| (Kód | Megnevezés | Melyik HBCS-be sorolódik) | |
| " | |||
| 7480 | Kemoterápia, nabTAX+GEM (pancreas) protokoll szerint | 959J | Rosszindulatú daganat kemoterápiája "J" |
| " | |||


