NEFMI közlemény (EüK 2011/18.)
új, illetve módosított szakmai irányelvek, szakmai protokollok kiadásáról
| SZEMÉSZET | |
| A keratitisek kezeléséről (1. módosított változat) | P |
| TRAUMATOLÓGIA | |
| KÉZSEBÉSZET | |
| A kéz arthrosisairól (radiocarpalis, radioulnaris, intercarpalis, carpometacarpalis, | |
| metacarpophalangealis, interphalangealis) | P |
| A kéz és csukló ganglionok kezeléséről | P |
| Az acut flexorín-sérülésekről a kézen | P |
| A cubital tunnel syndromáról (sulcus nervi ulnaris syndroma) | P |
| A feszítőín sérülésekről | P |
| A kézfejlődési rendellenességekről | P |
| A makroreplantációról | P |
| A metacarpus - phalanx törésről | P |
| A mikroreplantációról | P |
| A nervus radialis tunnel syndromairól (Radial tunnel syndroma, Supinator syndroma, Wartenberg syndroma) | P |
| A scaphoideum (sajkacsont) álízület kezeléséről | P |
| A scaphoideum (sajkacsont) törések kezeléséről | P |
| A szeptikus kézről | P |
| VÉDŐNŐI ELLÁTÁS | |
| A kórházi védőnői feladatokról a szülészeti és újszülött ellátásban | P |
| A védőnő feladatairól az egészséges csecsemő gondozásában | P |
| CSECSEMŐ ÉS GYERMEKGYÓGYÁSZAT | |
| Az 1 és 3 éves kor közötti kisgyermekek táplálása | IE |
| INFEKTOLÓGIA | |
| Tuberkolózis diagnosztikájáról és terápiájáról | P |
| (1. módosított változat) | |
| TRANSZFÚZIOLÓGIA ÉS HAEMATOLÓGIA | |
| AZ ANAEMIÁK DIAGNÓZISA ÉS KEZELÉSE | IE |
| Hiányanaemiák | |
| Autoimmun haemolyticus anaemiák (AIHA) diagnózisa és kezelése | |
| A MYELOPROLIFERATIV BETEGSÉGEK DIAGNÓZISA ÉS KEZELÉSE | IE |
| Felnőttkori heveny leukaemiák | |
| Idült myeloid leukaemia (CML) | |
| A myelodysplastikus szindróma diagnózisa és kezelése | |
| Chronicus myelomonocytás leukaemia (CMMoL) | |
| Polycythaemia vera ellátása (PRV) | |
| Essentialis thrombocythaemia (ET) ellátása | |
| A LYMPHOPROLIFERATIV BETEGSÉGEK DIAGNÓZISA ÉS KEZELÉSE | IE |
| Agresszív (kifejezett malignitású) nem-Hodgkin-lymphomák (NHL) | |
| A köpenysejtes lymphoma | |
| A follikuláris lymphoma kezelése | |
| Idült lymphoid leukaemia (CLL) | |
| Hajas sejtes leukaemia (HSL) és a rokon betegségek | |
| A myeloma multiplex (MM) diagnózisa és kezelése | |
| A felnőttkori Hodgkin-lymphoma ellátása | |
| T-sejtes non-Hodgkin lymphomák (NHL) | |
| SÚLYOS CYTOPENIÁK DIAGNÓZISA ÉS KEZELÉSE | IE |
| Aplasticus anemia | |
| Felnőttkori immun thrombocytopenia | |
| A thrombotikus thrombocytopeniás purpura (TTP) és a haemolytikus uraemiás | |
| syndroma (HUS) kezelése | |
| KIEGÉSZÍTŐ (SUPPORTIV) KEZELÉSI MÓDSZEREK ALKALMAZÁSA | IE |
| HEMATOLÓGIAI BETEGSÉGEKBEN | |
| A haemopoeticus növekedési faktorok alkalmazása malignus betegségekben | |
| A thrombocyta transzfúzió | |
| A neutropeniás beteg fertőzéseinek megelőzése és kezelése | |
| Kemoterápia okozta hányás megelőzése és kezelése onkohematológiai betegekben |
| VÉRALVADÁSI ZAVAROK KEZELÉSÉNEK MÓDSZEREI | IE |
| A haemophilia előfordulása, öröklődése, diagnosztikája, szövődményei | |
| A haemophilia A és B kezelése | |
| A haemophilia perioperatív szubsztitúciós kezelése | |
| A gyermekkori haemophilia etiológiája, tünettana és kezelése | |
| Alvadási faktor elleni gátlótestek okozta vérzékenység | |
| Inhibitoros A és B típusú haemophilia | |
| Szerzett (gátlótest) haemophilia diagnózisa és kezelése | |
| A von-Willebrand-betegség kezelése | |
| Ritka faktorhiányok okozta vérzékenységek kezelése | |
| Veleszületett vérzékeny betegek sürgősségi ellátása | |
| Thrombocytopathiák okozta vérzékenységek kezelése | |
| CSECSEMŐ- ÉS GYERMEKKORI HEMATOLÓGIAI BETEGSÉGEK | IE |
| DIAGNÓZISA ÉS KEZELÉSE | |
| A granulocyták congenitalis betegségei | |
| Gyermekkori immun thrombocytopenia | |
| Gyermekkori akut leukémiák | |
| Malignus lymphomák a gyermekkorban | |
| A neutropéniás gyermek fertőzéseinek ellátása | |
| Thromboemboliás megbetegedések kezelése csecsemő- és gyermekkorban | |
| Gyakoribb congenitális anemiák | |
| Jelmagyarázat: | |
| IE - szakmai irányelv | |
| P - szakmai protokoll |
A Nemzeti Erőforrás Minisztérium szakmai protokollja a keratitisek kezeléséről
(1. módosított változat)
Készítette: a Szemészeti Szakmai Kollégium
I. Alapvető megfontolások
A keratitisek a cornea gyulladásos folyamatait jelentik, amelynek kiváltó oka különböző lehet. Eszerint megkülönböztetünk baktériumok, vírusok, gombák által okozott gyulladásokat. Specifikus gyulladást okoz az acanthamoeba. Immunfolyamatok is kiválthatnak gyulladásos reakciókat. Külső, mechanikus behatások is okozhatnak keratitiseket.
Bakteriális keratitisek
Meghatározás: a cornea baktériumok által kiváltott gyulladásos folyamata, amely kezdetben a cornea gyulladásos infiltrációját, majd ulcus corneae kialakulását okozza.
Szubjektív tünetek: enyhe vagy súlyos fájdalom, fotofóbia, látásélesség csökkenése, váladék.
Objektív tünetek: vörös szem, körülírt fehér homály (infiltrátum), majd a stroma rétegeinek beolvadása (ulcus). Az ulcus területének megfelelően a cornea elvékonyodik, körülötte a stroma oedemás lehet. Az ulcusnak ill. az ödémás területnek megfelelően Descemet redők lehetnek, a csarnokban megjelenik a hypopyon, ami gennysejtek gyüleme. Ekkor ulcus serpens cum hypopyo-ról beszélünk. Purulens váladék lehet jelen a conjunctiván, amelyet a felső szemhéj ödémája kísér. Később, ha a gyulladás a szem mélyebb részeit is érinti, hátsó synechiák, hyphaema és secunder glaukoma is kialakulhat.
Etiológia:
Baktériumok okozzák. Legveszedelmesebb a pseudomonas pyocyanea, proteus vulgaris. Az ulcus serpens-t diplococcusok okozzák.
A keratitisek kialakulását mindig megelőzi a cornea felszines hámhiánya, amelyen át a kórokozó a stromába hatol.
II. Differenciál diagnózis
Steril fekélyek (száraz szem szindróma, rheumatoid arthritis vagy más collagén-betegség keratoconjunctivitis vernalis, neurotroph keratopathia, A vitamin hiány), gomba, acanthamöba, egyéb kórokozó által okozott fekély. Irányadó lehet a baktérium tenyésztés.
Betegvizsgálat: anamnaesisben fontos rákérdezni kontaktlencse viselésre, traumára, korábbi szemcsepp használatára, korábbi cornea betegségre, szisztémás megbetegedésre.
Réslámpa vizsgálat: megállapitani a hámhiányt, leirni a beszűrődés, fekély mélységét, megmérni a szemnyomást (tonopen!) Mintavétel a fekély felszinéről, kenet vizsgálat, tenyésztés
Kontaktlencse viselők esetében megvizsgálni a konzerváló folyadékot, tároló és mosó folyadékot és a kontaktlencsét
Kifordítani a felső szemhéjat (Desmarres kanál!) és átfecskendezni a könnyútakat.
III. Terápia
1. cycloplegia
2. antibiotikum a következő algoritmus szerint
enyhe gyulladás, látásélesség nincs, vagy alig van veszélyben:
nem kontaklencse viselő: Brulamycin csepp
kontaktlencse viselő: Brulamycin vagy ciprofloxacin csepp vagy kenőcs
látás csökkenés veszélye nagyobb, gyulladás nagyobb
ciprofloxacin óránként
kifejezett látás csökkenés - ha az infiltratum nagyobb és kifejezett elülső szegmens reakció van (pl. csarnokvíz tyndallizál)
tobramycin vagy gentamycin váltakozva cefazolinnal vagy vancomycinnel
minden félórában
3. subconjunctivális antibioticum (gentamycin, cefazolin vagy vancomycin)
4. a cornea elvékonyodása esetén amnion fedés
5. kontaktlencse tilos
6. sz.e. fájdalom csillapítás perorálisan
7. oralis antibiotikum (fluorokinolon, mert az jól penetrál a corneába)
8. kórházi kezelés, ha szükséges
ha a kezelés nem hatásos
ha a beteg nem tud cseppenteni
ha a beteg nem kezeli magát
ha nem tud visszajárni naponta ellenőrzésre
ha szisztémás antibiotikus kezelés szükséges
9. atipikus mycobacterium esetében amikacin is szóba jöhet
Kontroll vizsgálatok:
- Naponta ellenőrizni a fekély nagyságát, a beszűrődés területét, a kezelés hatásosságát,
- ellenőrizni a szemnyomást
- Az antibiotikumot lehetőleg a tenyésztési eredmény szerint kell alkalmazni, illetve a folyamat stagnálása vagy rosszabodása esetén váltogatni.
- Ha tenyésztés nem volt a betegség kezdetén és a folyamat rosszabbodik a legszélesebb spektrumú antibiotikumot kell alkalmazni és a fekvőbeteg kezelés is szóba jön.
- Ismételt tenyésztés szükséges, ha a folyamat nem javul, vagy az első tenyésztés negatív volt.
- Cornea biopszia is szükséges lehet, ha a kórokozó ismeretlen és a betegség nem gyógyul.
- Ha perforáció veszélye fenyeget, amnion fedés (AMT) vagy perforáló keratoplasztika (PKP) jöhet szóba.
Figyelem!
Az antibiotikumok epitheliotoxicusak. Nem megfelelő, túl hosszú ideig tartó alkalmazásuk károsítja a cornea hámsejtjeit, ezáltal hámhiányt okozhat, amely tovább rontja a folyamatot. Különösen károsak lehetnek a fluorochinolonok, amelyek a corneában és a precipitátumokban tárolódhatnak. Célszerű az antibiotikumok váltása közben 1-2 nap "antibiotikum mentes" kezelést alkalmazni.
Gombák által okozott keratitis
Szubjektív tünetek: fájdalom, fotofóbia, vörös szem, könnyezés, idegentest érzés, váladék. Szerepelhet trauma az anamnaesisben (különösen növényekkel), vagy krónikus szembetegség (sokáig alkalmazott antibiotikumok, steroidok) és kontaktlencse viselés.
Objektív tünetek: a cornea strómában szürkés-fehér beszűrődés, amely éles szélű, körülötte kis, satellita léziók felismerhetők.
Conjunctiva vérbő, csarnokban hypopyon lehet.
Etiológia: candida - elsősorban előzetes szembetegségből származó
Fusarium v. Aspergillus fonalas gomba, amely főleg növényi sérülések után fordul elő.
II. Differenciál diagnózis és diagnosztika
Lásd. bakteriális keratitiseknél.
Diagnosztikához tartozik a fekély kaparék vizsgálata kenetben.
Könnyutak átfecskendezése - ha elzárt DCR végzendő.
III. Terápia
Minden keratitist először úgy kezelünk, mintha bakteriális volna. A gombák kimutatása után kezdjük el a specifikus kezelést.
1. Általában szükséges a fekvőbeteg intézetbe való utalás!
2. Natamycin 5%-os fél óránként vagy óránként nappal, kétóránként éjjel, vagy Vfend (voriconazol) 1%-os hasonlóan. Candida fertőzés esetén Amphotericin B 0,15%-os cseppel kezdjünk óránként. Utóbbit liposomális Amphotericin B ampullából készíttessük.
3. Cycloplegia.
4. Glaukóma (ha fennáll).
5. Steroid nem adható, ha a beteg korábban használt sürgősen le kell állítani.
6. Nem szabad AMT-t alkalmazni.
7. Hypopyonnal járó esetekben általánosan adott gombaellenes gyógyszerek alkalmazása is szóba jöhet. Ha a folyamat progrediál PKP jöhet szóba.
Kontroll:
Naponta
Általánosan adható gombaellenes gyógyszerek
Ajánlott dózisok
AmphotericinB Intravénás 0.5-1.0 mg/kg
Flucytosin Oralis 50-150 mg/kg 6-hr intervall
Miconazol Intravénás 600-3600 mg/die
Ketoconazol Oralis 200-800 mg/nap egy v. két adagban
Fluconazol Oralis 200-400 mg/die Intravénás
Itraconazol Oralis 200-400 mg/die két adagban
Acanthamöba keratitis
Kontaktlencse viselők keratitiseiben mindig gombás fertőzésre vagy acanthamöbára kell gondolni elsődlegesen különösen akkor, ha a kontaktlencse higiénia hiányos gyors progresszió esetén bakteriális infekció valószínű.
Szubjektív tünetek: igen nagy fájdalom, vörös szem, fotofóbia hetekig
Objektív tünetek:
Koraiak: a fájdalom nagyobb, mint amennyi az objektív tünetek után várható lenne. Kis pontszerű beszűrődések az epithelben, pseudodendrit alakú infiltratum (herpesre hasonlíthat), mert a kórokozó az idegek mentén terjed.
Később: gyűrű alakú infiltrátum a paracentralis cornea strómában.
Fekély alakulhat ki, hypopyon, perforáció is létrejöhet.
II. Differenciál diagnózis
Herpes simplex keratitis
Gomba keratitis
Bakteriális keratitis (pseudomonás fekély, de ez inkább a limbus közeli stromában van)
Betegvizsgálat, diagnózis:
1. réslámpa vizsgálat
2. confoscan, amellyel az acanthamöba jól kimutatható
3. kaparék az infiltratum vagy fekély felszínéről. Giemsa és PAS jól kimutatja a cystákat
4. tenyészteni is lehet
5. kontaktlencse és mosófolyadékainak vizsgálata is szükséges
III. Terápia
Ellentmondásos és néha hatástalan.
A következő kombinált terápiát fekvőbeteg intézetben kell bevezetni.
1. Polymyxin/neomycin/gramicidin)Neosporin) csepp fél-2 óránként
2. Propamidin izothionat (Brolen 0.1%) fél-2 óránként
3. Intraconazol 400 mg/die, majd 200 mg
4. polyhexamethyl biguanidin 0.02%-os óránként
5. Tilos a kontaktlencse viselése
6. Cycloplegia
7. Orális nonsteroid antiinflammatorikus ágensek különösen, ha a sclera is érintett és nagy fájdalom van.
8. PKP szóbajöhet ha a kezelés nem hatásos vagy perforáció fenyeget. A PKP után a konzervatív kezelés legalább egy évig folytatandó.
Kontroll
Naponta, míg a javulás nem látható kórházi kezelés szükséges.
Herpes simplex által okozott keratitis
Szubjektív tünetek: vörös szem, fotofóbia, fájdalom, látáscsökkenés, általában egyoldali.
Objektív tüvetek:
Az alábbi tünetek közül lehet csak egy vagy az összes is fennállhat egyszerre:
A szemhéj bőrén kis vesiculumok.
Conjunctivitis vesiculumokkal preauricularis csomókkal.
Cornea epitheliumában elváltozások: a finomepithelialis beszűrődés majd hámhiány alakja szerint keratitis (K) punctata superficialis, K. dendritica, K.stellata. Lehet a beszűrődés folt alakú dendritucus szegéllyel. A corneális hámhiányok fluoresceinnel festődnek. A cornea érzékenysége csökkent.
Az epitheliális deffektusok helyén neurotrofikus fekélyek kialakulhatnak, ami stroma perforációhoz vezethet.
Cornea stroma folyamatai:
K disciformis - korong alakú stromális oedema intakt epitheliummal. A cornea hátsó felszínén precipitátumok lehetnek. Ereződés nincs.
K interstitialis (necrotisans) - multiplex vagy diffuz fehéres szürke stroma-infiltráció epithel deffectussal, elvékonyodással és ereződéssel. Iritis lehet hypopyonnal. Glaukoma lehet.
Uveitis: a cornea gyulladásos folyamatát a szem mélyebb részeinek gyulladása kíséri.
Retinitis is kialakulhat - nagyon ritka, masszív infekció után alakul ki. Kétoldali lehet.
II. Differenciál diagnózis
Herpes zoster, recidiváló cornea erosio, kontaktlencse által okozott erosiók, acanthamöba kezdeti stádiuma (pseudodentritis).
Betegvizsgálat, diagnózis:
1. Anamnaesis - korábbi herpeses fertőzés? Immunstatus, korábbi vesiculumok arcon, orron genitaliákon?
2. Külső megtekintés a vesiculumok irányában.
3. réslámpás vizsgálat, szemnyomás mérés.
4. cornea érzékenység vizsgálata.
5. a réslámpavizsgálat általában elégséges a diagnózishoz, de ha nem akkor cornea- kaparék vizsgálata lehetséges: Papanicolau festés intranuclearis eosinofil testecskéket mutat, ELISA technika is alkalmazható. A virus ki is tenyészthető.
III. Terápia
Bőrelváltozások erithromycin vagy bacitracinnal kezelhetők.
Conjunctivitis és a cornea deffectusai: acyclovir csepp, kenőcs.
Pupillatágítás szükséges.
Stroma folyamatok.
K disciformis - cycloplegia, lokális steroid, antivirális cseppek, esetenként antibiotikus kezelés profilaxisként szóbajön. Szisztémás steroid és antivirális szer nem jön szóba.
Cornea perforáció esetén PKP.
Kontroll:
2-4 naponta míg a javulás be nem következik. A javulást a következőkből ítéljük meg: a hámhiány vagy a fekély kiterjedésének csökkenése. A kezelést 14 napig kell folytatni. A lokális steroid kezelés fokozatosan bevezethető a stroma folyamatokban.
PKP végezhető az akut folyamat befejeződése után a látást rontó cornea homályok miatt.
Herpes zoster által okozott keratitis
Szubjektív tünetek: bőr-diakomfort érzés, paresztézia. Fejfájás, láz, zavaros látás, szem fájdalom, vörös szem.
Objektív tünetek: acut vesicularis bőrelváltozás, amely az V. agyideg első ága mentén van és gyorsan hegesedéshez vezet. Huchinson tünet: a folyamat megjelenése a n. nasociliaris mentén, amit az orr azonos oldalán és az orrhegyen jelentkező vesiculum mutat.
Conjunctivitis, epithelialis deffektus jöhet létre, amelyet interstitialis keratitis követ. Uveitis, iris atrophia,scleritis, retinitis, chorioiditis, n.nervi optici, agyideg bénulások, glaukoma fordulhat elő. Gyakran elviselhetetlen fájdalmat okoz a postherpeticus neuralgia.
II. Differenciál diagnózis
A herpes simplex által okozott folyamatoktól való elkülönítés általában nem nehéz.
Betegvizsgálat, diagnózis:
1. Anamnaesis: immundefficiens állapot? Korábbi virusos fertőzés?
2. Réslámpa vizsgálat, fluoresceins festés, T mérés, pupilla tágításban szemfenék vizsgálat.
III. Terápia
A betegség kezdetén az első 72 órában per orális antivirális kezelés (acyclovir 800 mg 5x naponta 7-10 napig)
A bőr bőrgyógyászati ellátása.
Szemészeti terápia:
Conjunctivitis esetén: Erythromycin kenőcs.
Cornea érintettségben: konzerválószer nélküli műkönny, steroid pseudodendriticus elváltozásban.
K interstitialis - steroid.
Uveitis - lokális steroid, cycloplegia, antibiotikus kenőcs.
Retinitis - általános acyclovir 10 mg/kg iv. 8 óránként egy hétig, steroid 60 mg fokozatosan csökkentve egy hétig. Neurológiai konzultáció.
Glaukoma - uveitis vagy steroid okozza. Lokális kezelés általában elégséges - ha nem műtét szükséges.
Kontroll:
Naponta 7 napig szemészeti tünetekkel, szemtünetek nélkül 1-4 hetente. A gyógyulás után 3-6 havonta kontroll, mert relapszus lehetséges.
IV. Rehabilitáció
A keratitis után általában kisebb-nagyobb hegek maradnak a corneában, amelyek a látást rontják. A hosszú ideig csökkentlátó szemen tompalátás alakulhat ki, ezért mihamarabb szükséges a látóélesség helyreállítása. Ez hegek esetében csak szaruhártyaátültetéssel lehetséges. A gyulladás teljes lezajlása után azonban több hónap várakozás szükséges abból a célból, hogy ne alakuljon ki transzplantatum-betegség. A virus által okozott gyulladások eseteiben az antivirális kezelés folytatása keratoplasztika után is egy évig szükséges
V. Gondozás
A keratitisen átesett beteg gondozása virusos etiológia esetén szükséges. Ebben az esetben a gyulladások recidiválhatnak.
VI. Irodalomjegyzék
1. Süveges I.(szerk.): Szemészet. Medicina. 2010.
2. The Wills Eye Manual International Edition. Lippincott Williams and Wilkins 2008. 49.o-98.o.
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja
a kéz arthrosisairól
(radiocarpalis, radioulnaris, intercarpalis, carpometacarpalis, metacarpophalangeal, interphalangealis)
Készítette: a Magyar Kézsebész Társaság vezetősége az Ortopédiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO M1500 Elsődleges, általánosult (osteo-)arthrosis
M1510 Heberden-csomók (arthropathiával)
M1520 Bouchard csomók (arthropathiával)
M1530 Másodlagos többízületi arthrosis
M1540 Erosiv osteoarthrosis
M1580 Egyéb polyarthrosis
M1590 Polyarthrosis, k.m.n.
M1800 Az I. carpometacarpalis ízület kétoldali elsődleges arthrosisa
M1810 Az I. carpometacarpalis ízület egyéb elsődleges arthrosisa
M1820 Az I. carpometacarpalis ízület kétoldali posttraumás arthrosisa
M1830 Az I. carpometacarpalis ízület egyéb posttraumás arthrosisa
M1840 Az I. carpometacarpalis ízület egyéb, kétoldali, másodlagos arthrosisa
M1850 Az I. carpometacarpalis ízület egyéb, másodlagos arthrosisa
M1890 Az I. carpometacarpalis ízület arthrosisa, k.m.n.
M1900 Egyéb elsődleges arthrosis
M1910 Egyéb ízületek posttraumás arthrosisa
M1920 Egyéb másodlagos arthrosis
M1980 Egyéb, meghatározott arthrosis
M1990 Arthrosis, k.m.n.
1. A protokoll alkalmazási, érvényességi területe
- Ortopédia, kézsebészet, traumatológia, reumatológia, radiológia
- Családorvos-kompetenciaszintnek megfelelően
2. A protokoll bevezetésének alapfeltétele
- a szakmai kollégium illetékes tagozatának legitimációja
- Ortopéd és traumatológiai szakmai minimumfeltételeknek megfelelő ellátás szerint
3. Definíció
A kéz valamelyik ízületének: radiocarpalis, radioulnaris, intercarpalis, carpometacarpalis, metacarpophalangealis vagy interphalangealis ízületének felszínét borító hyalinporc fokozatos pusztulása, mely végső stádiumában az ízület teljes porcfosztottságához vezet. A porcfelszínen kívül érintett még az ízületi tok, a synovialis hártya és az ízületet stabilizáló szalagok.
3.1.Kiváltó tényezők (A szintű evidencia: 1, 7,8,9,10, 14,20,23,27)
Számos oka lehet, mind idiopathias, mind traumás. A kéz ízületeinek primer arthrosisának pontos kóreredete tisztázatlan, kialakulásának időpontja genetikailag determinált, de exogén tényezők, mint a foglalkozás, mindennapi igénybevétel is jelentős szereppel bír. A kezeletlen idiopathias avascularis kéztőcsont necrosis úgymint a Kienböck vagy a Preiser betegség radiocarpalis arthrosishoz vezetnek. A veleszületett Madelung deformitás radiocarpalis, ulnocarpalis és distalis radioulnaris ízületi (DRUJ) károsodáshoz vezetnek. Az életkor előrehaladtával a porcsejtek funkciója változik, proteoglycanok termelése lecsökken, így a porc collagén hálózatának integritása sérül, víztartalma csökken. Epidemiológiai adatok alapján a nagyízületek artrózisához képest a kéz kisízületeiben gyakrabban fordulnak elő artrózisos elváltozások. Az úgynevezett secunder arthrosis, prearthroticus elváltozások és egyéb betegségek következményei.
3.2.Kockázati tényezők (B típusú evidencia - 1, 7, 10, 12, 14, 17, 20, 27)
A leggyakoribb kockázati tényezőket az úgynevezett prearthroticus elváltozások jelentik.
Posttraumás állapotok
Álízülettel gyógyult kéztőcsont törés (pl. os scaphoideum-SNAC)
Tengely deformitások (ízületbe hatoló vagy tengelyeltéréssel gyógyult distalis radius törés)
Erős fizikai munka, tartós mikrotrauma
TFCC károsodás
A kéz ízületeinek instabilitása (radiocarpalis, radioulnaris, intercarpalis, SLAC, carpometacarpalis, metacarpophalangealis stb.)
Gyulladások (bakteriális arthritis)
Idiopathias (nem traumás) állapotok
Tengely deformitások (a radius congenitalis Madelung deformitása)
Gyulladások (RA, JCA, specifikus és bakteriális arthritis)
Kéztőcsont idiopathias avascularis necrosis (M.Kienböck, M.Preiser)
Anyagcsere betegségek, csontdysplasiák (osteomalacia, Paget-kór, fibrosus dysplasia, dysplasia epiphysealis multiplex, stb.)
Arthropathiák (neurogén, haemophiliás, köszvényes)
Tumoros csuklóízületi destrukció, tumorszerű elváltozások
4. Panaszok, tünetek, általános jellemzők
Ízületi fájdalom mellett az ízületi duzzanat is megjelenik.
A fájdalom kezdetben csak mozgáskor keletkezik, terhelésre fokozódik, majd a folyamat előrehaladtával nyugalomban sem szűnik.
Ízületi mozgáskorlátozottság, mely a fájdalom megjelenése után progrediál.
Az ízületi instabilitás a kéz bármely ízületében előfordulhat.
A kéz ízületi fájdalma és a mozgásbeszűkülés a kéz funkciójának csökkenését eredményezi, ami által a kéz szorítóereje is csökken.
A csuklóízület mellett a nyeregízület betegszik meg leggyakrabban.
5. A betegség leírása
A degenerativ folyamatban a porcszövet károsodása a leginkább ismert. Ez rendszerint a leginkább igénybevett zónában kezdődik, majd később az elváltozás kiterjedése progrediál. A porc elvékonyodik, elveszti sima fénylő jellegét és sárgás barnán elszíneződik. Felszíne felrostozódik, majd töredezik, fissurrák keletkeznek, később porcfekélyek alakulnak ki. A folyamat előrehaladtával a porcfelszín fokozatosan lepusztul és a végállapot a porcfosztott, csontfelszín. Az ép porcszövet pusztulása során eljut a IV. stádiumú chondropathiának megfelelő állapotba. A széli területeken osteophyták alakulnak ki, csontban sclerosis, cysták.
5.1.Érintett szervrendszer
radiocarpalis ízület alkotásában résztvevő csontok, synoviális hártya, ízületi tok, szalagok
radioulnaris ízület alkotásában résztvevő csontok, synoviális hártya, ízületi tok, szalagok
intercarpalis ízület alkotásában résztvevő csontok, synoviális hártya, ízületi tok, szalagok
carpometacarpalis ízület alkotásában résztvevő csontok, synoviális hártya, ízületi tok, szalagok
metacarpophalangealis ízület alkotásában résztvevő csontok, synoviális hártya, ízületi tok, szalagok
interphalangealis ízület alkotásában résztvevő csontok, synoviális hártya, ízületi tok, szalagok
5.2.Genetikai háttér Nem ismert.
5.3.Incidencia - Prevalencia- Morbiditás-Mortalitás
Kiváltó okoktól függően változik.
5.4.Jellemző életkor
Mind a posttraumás, mind az idiopathias eredetűek bármely életkorban előfordulhatnak.
5.5.Jellemző nem
Mindkét nemben egyforma arányban.
II. Diagnózis
1. Diagnosztikai algoritmusok
A beteg panaszai és az anamnézis alapján felmerülhet a betegség gyanúja.
A társ- illetve alapbetegségeket kikérdezéssel, korábbi zárójelentésekkel vagy laboratóriumi vizsgálatokkal lehet bizonyítani. Képalkotó vizsgálattal kell bizonyítani a pathoanatómiai eltérést a kéz érintett ízületében.
2. Anamnezis
A klinikai tünetek megjelenése és intenzitása függ a kiváltó októl és az elváltozás mértékétől.
Fájdalom kezdetben csak az ízület mozgatásakor jelentkezik Később a fájdalom fokozódhat, terhelésre. Az állandósult fájdalom előrehaladt folyamatot jelezhet, persistáló, ízületi duzzanattal kisérve. A fájdalom intenzitása függ a beteg egyéni tűrőképességétől. Éles fájdalom jelentkezhet mérsékelt elváltozás mellett, máskor a súlyos degeneratív elváltozást a beteg hosszabb ideig mérsékelt fájdalommal tűri. A fájdalom az érintett ízületi résre lokalizálódhat, de több ízület is érintve lehet.
Duzzanat megjelenése arthrosisban a degeneratív, levált porcrészletek indukálta synovitis következménye. Legtöbbször az egész ízület bedagad, az ízületben néha folyadék itapintható. A folyadékkal telt ízületet a beteg enyhén flectált helyzetben tartja, mivel az ellazított szalagok mellett mérsékeltebb a feszülés érzése.
A tapintás már kezdeti arthrosisban is fájdalmas, ezzel pontosan lokalizálhatjuk az érintett beteg ízületet, esetleg az érintett ízületi résnek megfelelően enyhébb-durvább crepitáció is észlelhető. Megállapíthatjuk, hogy csak a radiocarpalis ízület vagy a distalis radioulnaris ízület vagy ezek kombinációja, esetleg valamelyik intercarpalis ízület degenerációjáról van szó. Vizsgáljuk azt is hogy a fájdalom a proximalis vagy a distalis kéztőcsontsorban van vagy esetleg ezek között. A bőrhőmérséklet emelkedés inflammált folyamatra utal.
Mozgásterjedelem beszűkülés kezdetben csak időnként jelentkezik, később csökken a flexió és extenzió végpontja, a széli exostosisok megjelenésével egyidejűleg. A rheumatoid arthritisben fájdalmas tenosynovitis alakulhat ki, ami nem csak lokálisan, hanem két három ízületet is áthidalva okoz funkciózavart. A mozgásterjedelem beszűkülése megnehezíti a kéz használatát.
A csukló és a kéz kisízületének instabilitáshoz vezet a recidiváló folyadékgyülem kiváltotta tok és szalagrendszer lazulás.
3. Fizikális vizsgálatok
A kéz ízületeinek aktív és passzív mozgástartományának vizsgálata (flexio- extensio, a csukló ulnar- és radialductiója, a hüvelykujj oppositiója és valamennyi ujj ab- és adductiója). A kéz szorítóerejének meghatározása. A kéz sensibilitásának vizsgálata. A kézen inspectioval észlelhető elváltozások (duzzanat, deformitás, hegek, bőrelszíneződés), valamint tapintási lelet (bőrhőmérséklet, arteria radialis és ulnaris pulzusok vizsgálata).
4. Kötelező diagnosztikai vizsgálatok (B szintű evidencia: 1, 10, 11, 20, 27)
Anamnézis értékelése, fizikális vizsgálat, képalkotó diagnosztika, szükség esetén kiegészítve laboratóriumi (általános- ill ízületi puctatum) vizsgálattal.
4.1.Laboratóriumi vizsgálatok
Amennyiben a diagnózis alátámasztásához szükséges, végezhető általános laborvizsgálat, speciális tesztek, továbbá az ízületi punctatum vizsgálata (általános és bacterilógiai szempontból). Az alap- illetve kísérő betegségek laboratóriumi eltérései segíthetnek a diagnózis pontosításában.
4.2.Képalkotó vizsgálatok: (A szintű evidencia - 1, 7, 9, 10, 14, 17, 20)
- Kétirányú (A-P és oldal) rtg, esetleg 4 irányú csukló rtg radiocarpalis vagy intercarpalis érintettség esetén. Vizsgáljuk az ízületi rés beszűkülését, osteophyta képződést és/vagy a subchondralis sclerosis vagy cysta képződését. Figyelmet kell fordítani a capitatum fej vizsgálatára, ugyanis ez alkotja a fő ízületi felszint intercarpalisan. Ízületi instabilitas esetén esetén tartott röntgen készíthető.
- Izotóp vizsgálat (fakultatív)
- MR (obligát - amennyiben az rtg negatív) (A szintű evidencia - 14)
- UH (fakultatív)
- CT, 3D CT (fakultatív)
Lunatum malatia gyanúja esetén, amennyiben a hagyományos rtg és az izotóp vizsgálat eredménye negatív, MR elvégzése szükséges a korai diagnózishoz. Az izotóp vizsgálat esetén az elhalás okozta kiesést gyakran elfedi a következményes synovitis okozta dúsulás.
UH akkor lehet indokolt, ha kíváncsiak vagyunk, hogy van-e folyadék az ízületben. A folyadék MR-en is jól látható.
CT-re illetve 3D CT-re inkább a műtétek tervezésekor lehet szükség.
5. Kiegészítő diagnosztikai vizsgálatok
A csuklóízületi diagnosztikában speciális lehetőség az ízületi arthroscopia, nem oly gyakran végzett beavatkozás, mint a térd vagy váll arthroscopia, de ugyanúgy jelenthet diagnosztikai, mint terápiás beavatkozást (ízület átöblítése, debridement stb.) is. (B típusú evidencia - 5,6)
6. Differenciál diagnosztika
A differenciáldiagnózisban az alábbi betegségek kerülnek szóba:
infect arthritisek
- pyogen
- tuberculoticus
- mycogen
gyulladásos vagy reaktív arthritisek
- systemas betegségek
- sarcoidosis
- synovitis villonodularis
- synovialis chondromatosis
anyagcsere betegségek ízületi megjelenéssel
- amyloidosis
- köszvény és más kristály indukálta arthropathiák
- ochronosis
arthropathiák
- neurogen
- metabolicus
- haemophilias
csontnecrosisok
- os lunatum (M.Kienböck)
- os scaphoideum (M.Preiser)
posttraumás állapotok
neoplasmák, csontdysplasiák
- primer tumorok
- áttétek
- fibrosus dysplasia
- M. Paget
III. Kezelés
Nem gyógyszeres kezelés
1. A megfelelő egészségügyi ellátás szintje
A szakmai minimumfeltételek alapján
2. Általános intézkedések (B típusú evidencia - 1, 8, 9, 11, 14, 17)
Konzervativ kezelési lehetőségek alkalmazása: gyógytorna, fizio-, balneo terápia, manuálterápia, magnetoterápia, psychoterápia, életmódterápia.
3. Speciális ápolási teendők
A kéz állapotától függően ortézissel történő ellátása.
4. Fizikai aktivitás
Törekedni kell a műtét utáni könyök, váll és lehetőség szerint a kéz aktív tornájára, mely kezdetben terhelés nélküli, majd később a fokozatos terhelés mellett minél teljesebb fizikai aktivitást lehetővé téve.
5. Diéta (B típusú evidencia - 7, 11)
Az egyéb társbetegségeknek megfelelően.
6. Betegoktatás (B típusú evidencia -1, 7, 11)
Általános betegtájékoztató, felvilágosítás, tanácsadás, életmódterápia.
A beteg részletes felvilágosítása műtétről, a rehabilitációs tervről és a várható kimenetelről.
III/2. Gyógyszeres kezelés (A szintű evidencia - 7, 11)
1. A megfelelő egészségügyi ellátás szintje
A szakmai minimumfeltételek alapján
2. Speciális ápolási teendők
Tekintettel arra, hogy steril gyulladásos folyamat eredménye a folyadékgyülem, csak fokozott óvatossággal és kiemelt sterilitás mellett végezhető ízületi punkció. Hasonló megfontoltságot igényel az intraartikulási injekciós therapia.
3. Ajánlott gyógyszeres kezelés
A steroid és nonsteroid gyulladáscsökkentők mérséklik az ízületi exsudatum újratermelődését, a fájdalmat enyhitik, de tartós alkalmazásuk mellett az arthrosis progrediálhat a jól észlelhető és fenyegető tünetek nélkül! Steroid injectio javallata az exsudativ synovitis, ha az ízületi folyadékgyülem NSAID-dal nem szűntethető meg. Steril körülmények között adható. (B típusú evidencia - 7. 11) Kontraindikáció: bakteriális eredetű synovitis.
Per os, illetve intraartikulárisan alkalmazható chondroprotektiv szerek a kezdeti porclaesió esetén alkalmazhatók. A kezelés eredményessége csak a kiváltó ok egyidejű megszüntetésével remélhető. (A típusú evidencia - 3) A konzervatív kezelés előnye az, hogy a betegség korai szakaszában a tünetek és panaszok jól befolyásolhatók. Előrehaladt arthrosisban viszont az izomerősítés és gyógytorna jó előkészítője az eredményes műtéti megoldásnak.
Kontraindikációk: gyógyszer- vagy hatóanyag túlérzékenység, NSAID nem adható peptikus ulcus, aktív gasztrointesztinális vérzés esetén, myasthenia gravisban nem adható izomrelaxáns.
Lehetséges jelentős interakciók: lítium, digoxin, glükokortikoidok, nifluminsav (Donalgin) együtt szedése a fenti gyógyszerekkel interakciót okozhatnak.
4. Kiegészítő/alternatív gyógyszeres kezelés Gyógytorna, fizikoterápiás eljárások.
5. Terápiás algoritmus
Amennyiben a konzervatív módszerek nem segítenek a betegség stádiumától függően többféle műtéti beavatkozás ajánlható.
III/3. Műtét
1. A megfelelő egészségügyi ellátás szintje
Járóbeteg ellátás: működési engedély alapján.
2. Általános intézkedések
Szokásos műtét előtti kivizsgálás lehetőség szerint ambuláns módon, a választott műtéti időpont előtti hetekben. Aneszteziológiai ambulancián a beteg előzetesen jelenjen meg (esetleg bizonyos gyógyszerek szedését fel kell függeszteni
A műtét tárgyi feltételei
Kiemelt sterilitást biztosító műtő, a szakmai minimumfeltételeknek megfelelően felszerelve.
A műtétet vértelenségben kell végezni.
A műtét biztonságos kivitelezéséhez kézsebészeti műszerkészlet.
Az esetleges implantáció kivitelezéséhez szükséges speciális műszerkészlet.
A tervezett implantációs eszköz teljes méretválasztékából legalább egy sorozat.
Leggyakoribb szövődmények ellátásához szükséges műszerek, implantátumok megléte.
A műtét személyi feltételei
Minősített műtéti eljárás, amelyet olyan ortopéd vagy kézsebész szakorvos végezhet, aki megfelelő kézsebészeti jártassággal rendelkezik, az adott kézműtét kivitelezésében alapos, megfelelő szintű tapasztalatot szerzett. A műtét elvégzésében olyan gyakorlattal kell rendelkeznie, amelynek birtokában nemcsak a műtét biztonságos kivitelezésére képes, hanem alkalmas a műtét során adódó szövődmények, komplikációk ellátására is.
Lehetőség szerint egy asszisztens.
Anaesthesiológus orvos, anaesthesiológus asszisztens.
További szakemberek: gyakorlott műtősnő, és legalább egy gyakorlott műtőssegéd.
3. Speciális ápolási teendők
A műtétet követően, a beteg általános belgyógyászati statusában felmerülő állapot-változások korrekciójának biztosítása.
4. Sebészeti kezelés
Prearthrosisos állapotokban végzett műtétek
A preventiv műtétek célja az arthrosis kialakulásának megakadályozása. A beavatkozás jellege a kiváltó októl függ
Friss trauma
A kéz ízületeinek friss traumájánál lehetőség szerint az anatómiai viszonyok helyreállítására törekedjünk pl.: ízületi szalagsérülésnél, az ízületi szalag gyógyulásának biztosítása, különös tekintettel a csukló szalagsérüléseire, azon belül is a scapho-lunaris (SL) dislocatióra vagy a hüvelykujj MP-ízület zömében ulnaris collateralis szalagsérülésére, a kisízületi luxatiókra, vagy a radioulnaris (DRUJ) ízületre. Ilyenkor szükség szerint szalagvarratot, dróttűzést végzünk.
Törés esetén reponáljuk a tört darabokat és gipsszel vagy implantatummal rögzítjük a reponált helyzetet. A tengelyeltéréssel gyógyult radiustörés esetében, amennyiben még nem alakult ki arthrosis a radiocarpalis (RC) ízületben, radius osteotomiát végzünk és beállítjuk a kívánt helyzetet.
Az ízületek nyílt sebeit az infectió megelőzése céljából a sterilitás szabályainak megfelelően kell ellátni.
(B szintű evidencia-7,11)
Chondropathiák és arthrosisok esetében végzett műtétek.
Inveterált ízületi sérülés
Arthrosis radiocarpalis
Arthrosis intercarpalis
Csuklóízületi szalagsérülés, radioscaphoidalis-arthrosissal járó sajkacsont álízület SNAC (scaphoid nonunion advanced collapse), ritkábban a scaphoideum avascularis necrosisa esetén DISI (dorsiflexed intercalated segment instability) és ritkábban PISI (palmarflexed intercalated segment instability) alakulhat ki. Ezekben az esetben már nincs lehetőség az eredeti anatómiai viszonyok helyreállítására. Ilyenkor már a radioscaphoidealis ízületben arthrosis alakult ki, de a radiolunaris (RL) ízületben még nem. Ezt kihasználva intercarpalis arthrodesist végezhetünk, a sajkacsont eltávolításával. Lunatum malatia esetén stadiumtól függően végezzük el a beavatkozásokat. (14)
RS- arthrosissal és csuklócollapsussal nem járó sajkacsont álízület esetében spongiosa plasztikát és implantatiós rögzítést alkalmazunk. Bizonyos esetekben elegendő a csontspánnal töténő rögzítés. A sajkacsont distalis törései esetén vascularisalt csontspan beültetését implantatiós technikát alkalmazva alkalmazhatunk.
Érdemes valamennyi előbb felsorolt beavatkozást Wilhelm szerinti szelektív denervatióval kiegészíteni, mely előtt helyi érzéstelenítéses tesztet végzünk.
Az előrehaladott, mind a radiocarpalis, mind az intercarpalis ízületet érintő arthrosis esetében csuklóízületi arthroplastika vagy a csuklóízület teljes elmerevítése végezhető egyéni elbírálás alapján. Fizikai munkásoknál előnyösebb a csuklóarthrodesis. (B típusú evidencia-7, 11, 19)
Arthrosis radioulnaris
A distalis radioulnaris ízület invetaralt sérülése esetén a distalis radioulnaris ízület arthrodesisét végezhetjük el Sauvé-Kapandji szerint, vagy az ulnafejet részlegesen vagy teljesen resecaljuk. Protézist is helyezhetünk az ulnafejre. (B szintű evidencia-7, 11) TFC (triangular fibrocartilage complex) sérülés gyanúja esetén csuklóízületi arthroscopia végezhető és hasonlóan a térd arthroscopiához, a szakadt részt resecaljuk. Előrehaladott, DRUJ-ban kialakult arthrosis esetében ulnafej resectió végezhető. (B szintű evidencia-7, 11)
Arthrosis carpometacarpalis
A leginkább érintett ízület a hüvelykujj nyeregízülete. Jó eredménnyel jár az os trapezium resectiója interpositiós arthroplasztikával (palmaris longus, flexor carpi radialis ingomolyag) kiegészítve vagy az innal (FCR) történő felfüggesztéses plasztika. Az os trapezium eltávolítása után szilikonprotézis is beültethető. A nyeregízület arthrodeise csak akkor végezhető, ha az STT-ízület ép. (B szintű evidencia-7, 11)
Arthrosis metacarpophalangealis
Synovectomia vagy arthroplastica végezhető. A hüvelykujjMP ízületi arthrosisa, subluxatiója esetén MP ízületi arthrodesis javasolt. (B szintű evidencia-7, 11, 18)
Arthrosis interphalangealis
- proximalis
PIP-ízületi arthrodesis vagy arthroplastica végezhető. (B szintű evidencia-7, 11, 18)
- distalis
Heberden csomók kialakulása esetén a cysták és osteophyták eltávolítása, legtöbbször DIP-ízületi arthrodesissel kiegészítve. (B szintű evidencia-7, 11)
Idiopathias (nem traumás) állapotok
Rheumatoid arthritis (RA) vagy polyarthritis chronica progressziva (PCP) esetében Steinbrocker stadiumtól függően korai stadiumban (I-II) synovectomia és szelektívdenervatió, késői stadiumban (III-IV) arthrodesis vagy arthroplastica végezhető egyéni elbírálás alapján. (B szintű evidencia-7, 11)
Kéztőcsont idiopathias avascularis necrosisa esetén, ha a betegség az os lunatumot érinti, a stadiumtól függően radiusrövidítés, revascularisatio, intarcarpalis arthrodesis (STT), proximal row carpectomia csuklóízületi szelektív denervatióval kiegészítve vagy arthroplastica esetleg total csukló arthrodesis végezhető.
Ha a betegség a sajkacsontot érinti, az elhalt sajkacsontot eltávolítjuk és intercarapalis arthrodesist vagy proximal row carpectomiát vagy csuklóízületi arthroplasticát vagy teljes csuklóízületiarthrodesist végezhetünk.
Tengely deformitások pl.a radius congenitalis Madelung deformitása esetén az epiphysisfuga lezáródása után radius ékosteotomia vagy radioulnaris arthrodesis végezhető a panaszoknak megfelelően.
(B szintű evidencia-7, 11)
Az anyagcsere betegségek, csontdysplasiák és egyéb arthropathiák (neurogén, haemophiliás, köszvényes) valamint a tumoros csuklóízületi destrukció, tumorszerű elváltozások kezelése etiológiától függően szakmai protokollok alapján történik: bakteriális arthritis esetében megfelelő antibiotikum terápia, osteomalatia, köszvény esetében anyagcsere zavar rendezése. (B szintű evidencia-7, 11)
4.1.Általános műtéti indikációk
A kéz arthrosisainak sebészi kezelése indokolt, amikor a konzervatív kezelésre nem csökken a fájdalom, terhelési nehezítettség, a mozgástartomány beszűkülés, instabilitás (tok és szalagrendszer meggyengülése), valamint a következményes izomatrophia -már nem tolerálható életminőség-csökkenést eredményez a beteg életvitelében és a sebészi beavatkozás eredményességének megítélése meghaladja a kockázati tényezők mértékét.
A beteg panaszai, a klinikai tünetek és a képalkotó eljárásokkal készített felvételek alapján az ízület funkciója, konzervatív kezeléssel, vagy más eljárással helyre nem állítható.
A csukló vagy a kéz kisízületeinek arthroplasticája vagy arthrodesise akkor jön számításba amikor a funkcióromlás hátterében olyan morfológiai elváltozás szerepel, amelyet konzervatív kezelési eljárásokkal eredményesen befolyásolni nem tudunk és további javulás már nem várható. Ezért a jelentősen degenerált vagy destruált ízületek esetében gyakran a rehabilitáció egyik lehetősége az endoprothesis beültetés vagy az interpositiós arthroplastica vagy az arthrodesis.
Az endoprothesis beültetés megítélését differenciált módon kell kezelni: a klinikai tünetek, radiológiai eltérések és az intraoperativ lelet összehangolásával.
4.2.Műtéti kontraindikáció
Általános tényezők:
- A beteg kooperálóképességének hiánya. Amennyiben a beteg képtelen a postoperatív együttmüködésre az operatőr és a gyógytornász utasításainak végrehajtására. A várható komplikációk leküzdése után az eredmény rosszabb lehet, mint a kiindulási állapot. Ezekben az esetekben alternatív megoldást kell keresni. Ez lehet ortézis viselete, vagy konzervatív kezelés.
Abszolút kontraindikáló tényezők.
- Aktiv szeptikus állapot.
- Súlyos végtagkeringési zavar.
Ilyenkor a sebésznek le konzervatív kezelést kell alkalmaznia
4.3.Műtéti előkészítés
Általános belgyógyászati kivizsgálás, szükség szerinti szakorvosi konzíliumokkal kiegészítve. Anaesthesiologiai protokoll szerinti előkészítés. Antibiotikus profilaxis rizikófaktortól függően
4.4.Műtéti érzéstelenítés
Anaesthesiologiai protokoll leírása szerint
4.5.Műtét
A műtét kivitelezése a műtéttechnikai leírásoknak megfelelően:
- A beteg asztalra történő fektetése, rögzítése, az operálandó kar karasztalra történő helyezése
- A karra vértelenítő madzsettát helyezünk
- A műtéti területen a bőr szőrtelenítése és fertőtlenítése. A sterilitás szabályainak betartásával az operálandó terület izolálása
- Az ízület feltárása, az ismert műtéttechnikai leírásoknak megfelelően.
- Az adott műtét elvégzése
- Drainek behelyezése, rögzítése, majd rétegs sebzárás.
- A seb környékének lemosása, fertőtlenítése, steril fedése.
- A végtagra rugalmas pólya felhelyezése, karfelpolcolás
4.6. Posztoperatív teendők
Az ortopédiai műtétek utáni szokásos teendőkre van szükség: posztoperatív megfigyelés, fájdalom csillapítás, kézfelpolcolás, az operált végtag keringésének megfigyelése, szoros kötés esetén a kötés lazítása, folyadék- és elektrolit pótlás, stb. Az alapbetegség kiegészítő speciális gyógyszerelése
A műtét menetének részletes leírása A műtéti leírás csatolása a kórlaphoz
A beültetett implantatum helyzetének ellenőrzése képalkotó eljárással, legkésőbb 48 órán belül
5. Fizikai aktivitás
A gyógytorna kezelés megkezdése előtt orvosi vélemény szükséges, hogy a műtéti körülmények függvényében, egyéni megítélés és mérlegelés alapján, a beteg az operált végtagját teljes erővel mikortól terhelheti.
Első nap a terhelés nélküli torna a műtét típúsától függően már elkezdhető.
(B szintű evidencia - 7, 11)
Kontroll vizsgálatok alapján egyénileg meghatározott fokozatos terhelési program szerint.
6. Diéta
Általános, vagy belgyógyászati indikációnak megfelően, dietetikai előírások szerint.
7. Betegoktatás
Általános betegtájékoztató szerint. Implantátum egyedi előírásainak megfelelően. Gyógytornász utasításainak megfelelően.
IV. Rehabilitáció
A gondos műtéti tervezés és kivitelezés döntő a végeredmény szempontjából. Gyakran több műtétre van szükség. A műtétet mindig szakszerű utókezelésnek kell követnie. Szükséges a beteg részletes tájéloztatása a rehabilitációs tervről, a műtétről és arról, hogy milyen eredményre számíthat.
Késői rehabilitáció
A beteg állapotának folyamatos ellenőrzése, utánkövetése, s amennyiben szükséges utókezelésre, gyógytornára utalása, otthoni ápolás elősegítése, sz.e. gyógyszeres kiegészítő kezelés.
V. Gondozás
1. Rendszeres ellenőrzés
A beteg általános mozgásszervi állapotának, az operált ízület rendszeres felügyelete, utánvizsgálata szükséges a műtétet követő 1-6 héten, majd fél év, egy évvel később. A hosszabb utánkövetés ízületi implantatumok beültetése esetén szükséges, hasonló képen, mint a nagy ízületeknél.
Röntgenkontroll közvetlen műtét után, 1-3 hónap és 1 év múlva, illetve panasz esetén és az operáló osztály útmutatása szerint.
2. Megelőzés
Bekövetkező állapotromlás esetén haladéktalan beavatkozás szükséges: utókezelés, rehabilitáció, sz.e. reoperáció.
3. Lehetséges szövődmények:
Intraoperatív szövődmények: - vérzés
- ideg, ér, ínsérülés
Postoperatív szövődmények: - feltárást igénylő haematóma képződés
- keringészavar, lebenyelhalás
- lebenylelökődés
- korai infectio, sebgyógyulási zavar
Késői szövődmények: - késői infectió
- álízület
- lemeztörés
- kilazulás
4. A szövődmények kezelése
A kialakult és észlelt szövődmény azonnal megkezdett kezelése szakmai protokollok útmutatásai alapján.
Az intraoperativ észlelt szövődmény műtőben történő ellátása, vérzéscsillapítás. A postoperatív szakban észlelt haematóma műtőben, steril körülmények között történő kiürítése. Infectió gyanúja esetén a műtéti terület feltárása, tenyésztésvétel, seböblítés, drain, antibiotikus kezelés elkezdése. Bőrnecrosis esetén debridement. A seb feltisztulása után a bőrhiányos felület plasztikázása.
Általános gyógyszer tájékoztató szerint.
5. Kezelés várható időtartama/prognózis
A praearthrosisos állapotok korai felismerése és kezelése esetén a prognózis jó.
Késői felismerés és beavatkozás esetén pl. RA, SL-instabilitás, SLAC-wrist, SNAC-wrist, lunatum malatia, nyeregízületi arthrosis, inveteralt MP-ízületi szalagszakadás, nem korrekten ellátott ízületbe hatoló törések, ízületi infectio, DRUJ szalagsérülés esetén a prognózis rosszabb.
A beteg egyedi mozgásszervi statusából következően egyedi felépülési prognózist kell megállapítani, amelyben törekedni kell az életminőség javításának legrövidebb, de legbiztosabb módjára.
6. Az ellátás megfelelősségének indikátorai
A műtött beteg általános és speciális mozgásszervi állapotának dokumentálása a kórlapban a műtét előtt, hazabocsátáskor, valamint az utánvizsgálatok során is.
Műtét utáni fájdalommentesség, mozgástartomány.
Életminőség és ízületi funkció meghatározása nemzetközi kérdőivek alapján
Septicus komplikációk gyakorisága
Betegállományban töltött napok, betegségi nyugdíjazás, mint a gyógyeredmény minőségi mutatói
Protézis túlélési idő/lazulási arány vizsgálata
VI. Irodalomjegyzék
1. Bathala EA, Bancroft LW. The case: Scapholunate advanced collapse (SLAC wrist). Orthopedics. 2007 Jun;30(6):418, 498-9.
2. Bain Gl, Munt J, Turner PC. New advances in wrist arthroscopy. Arthroscopy. 2008 Mar;24(3):355-67.
3. Cavaliere CM, Chung KC. Total wrist arthroplasty and total wrist arthrodesis in rheumatoid arthritis: a decision analysis from the hand surgeons' perspective. J Hand Surg Am. 2008 Dec;33(10):1744-55, 1755.e1-2.
4. Chloros GD, Wiesler ER, Poehling GG. Current concepts in wrist arthroscopy. Arthroscopy. 2008 Mar;24(3):343-54.
5. Dósa Gábor, Grúber Károly A sajkacsont álízület osteosynthesise egyidejű részleges csuklóízületi denervációval. Magyar Traumatológia, Ortopédia, Kézsebészet és Plasztikai Sebészet. 1994. 37. évf. 3. sz., p. 211-215.
6. Gaston RG, Greenberg JA, Baltera RM, Mih A, Hastings H. Clinical outcomes of scaphoid and triquetral excision with capitolunate arthrodesis versus scaphoid excision and four-corner arthrodesis. J Hand Surg Am. 2009 Oct;34(8):1407-12.
7. Gaál Csaba: Sebészet, Medicina Bp. 2010.
8. Green D.P.
9. Operative Hand Surgery 4th edition.
10. London: Churchill Livingstone, 1999.
11. Kiefhaber TR. Management of scapholunate advanced collapse pattern of degenerative arthritis of the wrist. J Hand Surg Am. 2009 Oct;34(8):1527-30.
12. Kleinman WB. Stability of the distal radioulna joint: biomechanics, pathophysiology, physical diagnosis, and restoration of function what we have learned in 25years. J Hand Surg Am. 2007 Sep;32(7):1086-106. Review.
13. Kloppenburg M, Stamm T, Watt I, Kainberger F, Cawston TE, Birrell FN, Petersson IF, Saxne T, Kvien TK, Slatkowsky-Christensen B, Dougados M, Gossec L, Breedveld FC, Smolen JS. Research in hand osteoarthritis: time for reappraisal and demand for new strategies. An opinion paper. Ann Rheum Dis. 2007. Sep;66(9):1157-61.
14. Kriegs-Au G.,.Scharizer E. Unterarm und Hand. Carl Joachim Wirt: Praxis der Orthopädie" Georg Thieme Verlag, Stuttgart-New York 2001; 368-386
15. Mády Ferenc A csukló és a kéz betegségei. Szendrői Miklós: Ortopédia, 1. kiadás. Budapest: Semmelweis Kiadó, 2006;299-300
16. Mulford JS, Ceulemans LJ, Nam D, Axelrod TS. Proximal row carpectomy vs four corner fusion for scapholunate (Slac) or scaphoid nonunion advanced collapse (Snac) wrists: a systematic review of outcomes. J Hand Surg Eur Vol. 2009. Apr;34(2):256-63. Review.
17. Paksima N, Canedo A. Kienböcks Disease. J Hand Surg Am. 2009. Dec;34(10):1886-9. Review.
18. Payatakes A, Sotereanos DG. Pedicled vascularized bone grafts for scaphoid and lunate reconstruction. J Am Acad Orthop Surg. 2009 Dec;17(12):744-55. Review.
19. Povlsen B. Denervation of wrists with rheumatoid arthritis. J Hand Surg Am. 2008 Oct;33(8):1444-5;
20. Prosser R, Herbert R, LaStayo PC. Current practice in the diagnosis and treatment of carpal instability-results of a survey of Australian hand therapists. J Hand Ther. 2007 Jul-Sep;20(3):239-42;
21. Renner Antal Poszttraumás arthrosisok kezelése a kézen : endoprotézis vagy arthrodesis?: 1. [r.], Endoprotézisek alkalmazása a hosszúujjak metacarpophalangealis (MP) és a proximális interphalangealis (PIP) ízületeiben. Magyar Traumatológia, Ortopédia, Kézsebészet és Plasztikai Sebészet. 2001. 44. évf. 4. sz., p. 255-265.
22. Renner Antal Poszttraumás arthrosisok kezelése a kézen : endoprotézis vagy arthrodesis? : 2. [r.], Csuklóízületi totál-endoprotézisek. Magyar Traumatológia, Ortopédia, Kézsebészet és Plasztikai Sebészet. 2002. 45. évf. 2. sz., p. 87-96.
23. Sennwald G. The wrist.Berlin; New York; Springer-Verlag, c1987.
24. Shin EK, Jupiter JB. Radioscapholunate arthrodesis for advanced degenerative radiocarpal osteoarthritis. Tech Hand Up Extrem Surg. 2007 Sep;11(3):180-3.
25. Shin EK, Osterman AL. Treatment of thumb metacarpophalangeal and interphalangeal joint arthritis. Hand Clin. 2008 Aug;24(3):239-50, v. Review.
26. Szepesi Kálmán A kéz betegségei.Vizkeleti Tibor: Az ortopédia tankönyve, 2. kiadás. Budapest: Semmelweis Kiadó, 1999;176
27. Tsuge Kenya Atlas der Handchirurgie.Hippokrates Verlag GmbH, Stuttgart, 1990.
28. Vadstrup LS, Schou L, Boeckstyns ME. Basal joint osteoarthritis of the thumb treated with Weilby arthroplasty: a prospective study on the early postoperative course of 106 consecutive cases. J Hand Surg Eur Vol. 2009 Aug;34(4):503-5.
29.Vermeulen GM, Brink SM, Sluiter J, Elias SG, Hovius SE, Moojen TM. Ligament reconstruction arthroplasty for primary thumb carpometacarpal osteoarthritis
30. (weilby technique):prospective cohort study.J Hand Surg Am. 2009.Oct;34(8):1393-401.
31. Weiss KE, Rodner CM. Osteoarthritis of the wrist. J Hand Surg Am. 2007. May-Jun;32(5):725-46. Review.
32. Wollstein R, Watson HK, Wear-Maggitti K, Schmidt S, Carlson L. Surgical technique for the treatment of radial wrist pain. Scand J Plast Reconstr Surg Hand Surg. 2008;42(3):149-52.
Kapcsolódó internetes oldalak:
http://www.sign.ac.uk/guidelines/index.html
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a kéz és csukló ganglionok kezeléséről
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO M6740 Ganglion
1. A protokollok alkalmazási / érvényességi területe
2. A protokollok bevezetésének alapfeltétele
3. Definíció
A kéz és a csukló tájékán elhelyezkedő, synoviális szövetből kiinduló (ízületi tok, ín, ínhüvely) mucintartalmú pseudotumort ganglionnak nevezzük.
3.1. Kiváltó tényezők
Létrejöttében synoviális herniációt, ínhüvely szakadást, embrionális sejtek maradványainak szaporodását, a synoviális membrán kinövéseit, illetve a normális anatómiához tartozó burzák, valamint degenerációs cysták módosulásait vetik fel, de inkább nevezhető a kórkép eredete ma is ismeretlennek.
4. Panaszok/Tünetek/Általános jellemzők
Általában nem, vagy alig okoz panaszt, de növekedésénél, illetve elhelyezkedésénél fogva fájdalom, kellemetlenség érzés, a nervus medianus és nervus ulnaris nyomása esetén érzés- és mozgás zavarok észlelhetők.
5. A betegség leírása
5.1.Incidencia/Prevalecia/Morbiditás/Mortalitás Magyarországon: A kéz lágyrész tumorainak mintegy 70%-át teszi ki.
5.2.Jellemző életkor: Leggyakoribb a 2. és a 4. dekád között.
5.3.Jellemző nem: Nőkben 3x gyakoribb, mint férfiakban.
6. Gyakori társbetegségek:
Predilectiós helyei a csukló feszítő oldala, illetve a hajlító ínhüvelyek mentén való előfordulás, de a kéz és csukló bármelyik ízülete mentén kialakulhat.
Gyakrabban fordul elő a 2.3- carpometacarpalis ízületek degeneratív elváltozása, De Quervain betegség (Tenosynovitis stenosans), valamint a DIP ízületek Hebereden csomóinak jelenléte esetén.
II. Diagnózis
A csomó kozmetikai megjelenése, valamint a fájdalom tereli a gyanút rá. A rtg-felvétel csaknem mindig negatív, de intraossealis cysták esetenként megfigyelhetők.
Fizikális és ultrahang vizsgálattal a diagnózis egyértelműen felállítható.
1. Diagnosztikai algoritmusok: fizikális vizsgálat, rtg-felvétel, Ultrahang vizsgálat. Kétes esetben, ideg kompresszió esetén CT vagy MRI is végezhető
2. Anamnézis: trauma az előzményben csak 10%-ban mutatható ki, többnyire inkább gyakrabban előforduló mikrotraumák fordulnak elő.
3. Fizikális vizsgálatok: a kéz szokásos fizikális vizsgálata elvégzendő, amely a ganglionon kívül a kéz más részeire is terjedjen ki. Az észrevehető elváltozásokon kívül a kéz minden ízületének mozgását, az izmok, inak funkcióját, valamint az érzést is vizsgálni kell.
A kórképnek nincsenek laboratóriumi jellemzői. A laboratóriumi vizsgálatokat a végzendő műtéti beavatkozás, illetve az anaesthesia módja szabja meg.
III. Kezelés
III/1 . Nem gyógyszeres kezelés
Általános intézkedések
A magas műtéti recidíva szám miatt korábban több nem operatív kezelési módszer is kialakult. A kézzel vagy könyvvel való szétpukkasztástól a injekciós, sclerotizáló kezelésig. A ganglionok leszívása, illetve feltöltése különösen a palmaris oldalon veszélyes lehet a fontos képletek jelenléte miatt.
III/2. Gyógyszeres kezelés: nincs
III/3. Műtét
Sebészeti kezelés
1. műtéti indikáció:
A műtét elvégzése csaknem mindig indikált. Műtét indikált minden olyan esetben, amikor a ganglion esztétikai megjelenése folytán a beteget zavarja, illetve ha a szomszédos képletek nyomása folytán bármilyen tünetet okoz, vagy fájdalom jelentkezik. Biztos diagnózis esetén, malignitás hiányában azonban a műtét halasztható a beteg által kért időpontra.
Kontraindikációk
A beteg rossz általános állapota, szeptikus góc a környéken.
A kéz ganglionjainak leghatásosabb kezelési módszere a műtéti eltávolítás.
2. műtéti érzéstelenítés:
A műtétet jó érzéstelenítésben, kipólyázásos vértelenítésben, kézsebészeti műszerekkel, kézsebészetben jártas orvos által javasolt elvégezni. A szomszédos képletek kipreparálása érdekében nagyító szemüveg illetve operációs mikroszkóp jelenléte is szükséges lehet.
3. műtét:
A metszést a kézsebészetben használt engedélyezett metszési vonalaknak megfelelően kell vezetni. A gangliont teljes egészében, eredéséről leválasztva kell kiirtani a recidívák elkerülése érdekében. A vértelenítésben végzett műtét végén a leszorítás felengedése után vérzéscsillapítást kell végezni. Sikeres vérzéscsillapítás után drain nélkül, vagy kis bőrdrainek felett zárjuk a sebet.
Amennyiben ízületi tok kimetszésére is sor került, átmenetileg gipszrögzítés felhelyezésére is sor kerülhet 8-10 napra.
4. postoperatív teendők:
Az eltávolított anyagot szövettani vizsgálatra kell küldeni.
IV. Rehabilitáció
A rehabilitáció, szükségességének paraméterei
Műtét után a ganglion elhelyezkedésétől függően kéztornában jártas gyógytornász segítségével a kéz ízületeinek szisztémás bemozgatása javasolt az esetleges contractúrák elkerülésének érdekében.
V. Gondozás
1. Rendszeres ellenőrzés: A varratot a 8-10 napon javasolt eltávolítani.
2. Lehetséges szövődmények
Intraoperatív:
Postoperatív: haematoma, sebszél necrosis, lebeny necrosis, sebszétválás, infectio
VI. Irodalomjegyzék
1. Gaál Csaba: Sebészet, Medicina Bp. 2010.
2. Green, D.: Operative Hand Surgery 1989-2006 Churchill Livingstone 1993
3. Renner, A.: Traumatológia. Budapest 2000. Medicina.
Kapcsolódó internetes oldalak
http://www.arsmedica.hu/ganglion-mutetek.html http://en.wikipedia.org/wiki/Ganglion_cyst
A szakmai protokoll érvényessége: 2014. június 30.
VII. Melléklet
1. Érintett társszakmákkal való konszenzus:
ortopédia, plasztikai sebészet, fizikotherápia, gyógytornászok
2. Megjelenési formák:
Dorzális csukló ganglion
Voláris csukló ganglion
Voláris hajlító ínhüvelyi ganglion
Mukozus cysta (DIP ízület)
Ritkább elhelyezkedésű ganglionok
Carpometacarpalis ízületi dudor
PIP ízületi ganglion
Extenzor ín ganglion
Első feszítő ínhüvelyi ganglion
Carpalis csatorna ganglion
Ulnar tunnel ganglion
Intraossealis ganglion
A Nemzeti Erőforrás Minisztérium szakmai protokollja az acut flexorín-sérülésekről a kézen
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO S5600 A hüvelykujj hajlítóizmának és inának sérülése az alkar szintjében
S5610 A kéz többi ujja hajlító izmainak-inainak sérülése az alkar szintjében
S5620 Az alkar egyéb hajlító izmainak-inainak sérülése az alkar szintjében
S6600 A musc.flexor poll.longus izma-ina sérülése a csukló, kéz szintjében
S6610 A kéz egyéb ujja hajlító izma-ina sérülése csukló, kéz szintjében
S6640 A hüvelykujj belső izmainak-inainak sérülése a csukló, kéz szintjében
S6650 Egyéb ujj belső izmainak-inainak sérülése a csukló és kéz szintjében
S6660 Többszörös hajlító izom és ín sérülés a csukló és kéz szintjében
S6680 Egyéb izmok és inak sérülése a csukló és kéz szintjében
S6690 K.m.n. izom és ín sérülése a csukló és kéz szintjében
1. A protokollok alkalmazási / érvényességi területe
Traumatológia, ortopédia, sebészet, gyermeksebészet, kézsebészet.
2. A protokollok bevezetésének alapfeltétele
Az öt szakmában a baleseti sebészet és a kézsebészet alapos ismerete.
3. Definíciók
A kéz valamely hajlítóínának acutan létrejött, részleges vagy teljes folytonosság megszakadása.
3.1.Kiváltó tényezők: Általában éles eszköz általi metszés, vágás, vagy szúrt sebzés során keletkezik, ritkábban túlfeszítéses mechanismussal, vagy fáradásos szakadással.
3.2.Kockázati tényezők
4. Panaszok - Tünetek - Általános jellemzők
Legtöbbször nyilvánvaló, nyílt sebzés. Functio laesa. Általános megfontolások
- A sérült felvilágosítása szükséges,hogy kiterjedjen a többszöri műtét szükségességének lehetőségére.
- Számos study megkérdőjelezi a sürgős sebészi ellátás előtérbe helyezését, azt állítva, hogy a halasztott primer ellátás eredményei semmivel sem rosszabbak, sőt jobbak alkalmanként.
- Kimutatható, hogy jobb a FDP és FDS inakat is helyreállítani.
- Primer varrat kontraindikációjaként tekinthető: erősen kontaminált, több szövetféleséget érintő sérülés, jelentős bőrhiány a flexor apparátus felett.
- Egyidejű törés, vagy neurovasculáris sérülés nem egyértelműen kontraindikálja a primer vagy primer halasztott ínvarrat elvégzését. Ha teherbíró osteosynthesist tudunk végezni, szinte mindig előnyösebb továbblépni a flexorvarrat elkészítésével, illetve az ér-, idegképletek mikroszkópos rekonstrukciójával. Hangsúlyoznunk kell,hogy a több képletet érintő sérülés esetén az eredmények szerényebbek lehetnek.
- Primer rekonstrukció acut vagy subacut esetekben előnyös, hetek alatt a sérült ín végeinek állapota, illetve az ín-izom egység állapota romlik. Sebfertőzés alapos veszélye esetén megengedett a több napos várakozás a tiszta sebviszonyok biztosítására. Kifejezett sebfertőzés esetén a primer rekonstrukciótól eltekintünk, alternatív funkció-helyreállító műtétek javasoltak.
- Ha az eltelt idő miatt sem primer, sem halasztott primer, sem secunder ellátás nem lehetséges, a szabad ínátültetés kiváló lehetőség, feltéve hogy a sérült szövetek közel normális biológiai állapotba kerültek, és az ujj passzív mozgásai megőrződtek.
- Ha az ujj nagyon heges, vagy komplexebb reconstructiót igényel, szükség lehet mesterséges rúd(silicon), vagy ínprothesis alkalmazására.
5. A betegség leírása
5.1.Incidencia: Incidenciája a nemzetközi szakirodalom szerint sem ismert.
5.2.Nemek, életkor és egyéb megoszlása nem jellegzetes
6. Gyakori társbetegségek Jellege miatt nem jellemző.
II. Diagnózis
1. Diagnosticai algorhythmus
Physicalis vizsgálat: inspectio, palpatio, RTG-felvétel (ha a mechanizmus alapján törésgyanú felmerül). Relevans laboratóriumi jellemzők nincsenek, a laboratóriumi vizsgálatokat a műtéti beavatkozás, illetve az anaesthesia módja szabja meg.
2. Anamnesis: Általában nyilvánvaló, direct sérüléses mechanizmus.
3. Fizikális vizsgálatok: A kéz szokásos fizikális vizsgálata (Moberg-schema stb.) végzendő, társsérülések keresésével.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok (felhasznált bizonyítékok, azok szintjei): Fizikális vizsgálat
4.1. Laboratóriumi vizsgálatok
Gyógyszerek, amelyek befolyásolhatják a laboratóriumi eredményeket Betegségek, amelyek befolyásolhatják a laboratóriumi eredményeket
4.2.Képalkotó vizsgálatok: Törés-, ficamgyanú esetén röntgen vizsgálat is. 4.3. Egyéb
5. Kiegészítő diagnosztikai vizsgálatok
Általában nem szükségesek. Digitális idegek vizsgálata (érzésvizsgálat) az esetleges társsérülések kiderítésére.
6. Differenciál-diagnosztika
Az általában nyilvánvaló mechanizmus és sérülésnyomok miatt korlátozottan szükséges.
III. Kezelés
III/1.Nem gyógyszeres kezelés (felhasznált bizonyítékok, azok szintjei)
A megfelelő egészségügyi ellátás szintje: Amennyiben az operatív kezelésnek kontraindikációja van.
III/2. Gyógyszeres kezelés: nincs
III/3. Műtét
1. A megfelelő egészségügyi ellátás szintje: Minden flexorín-sérülést műtőben kell ellátni. Megfelelő assistentia, világítás, kézsebészeti műszerezettség szükséges.
2. Általános intézkedések
- lupe alkalmazása javasolt
- megfelelő műszerek
- atraumatikus technika
- takarékos debridement az ínállomány esetében
- Bruner-féle cikk-cakk metszés a legtöbb esetben jól alkalmazható
3. Sebészeti kezelés
3.1. műtéti indikáció:
3.2. műtéti előkészítés: A műtétet megfelelő érzéstelenítésben, kipólyázásos (ha contraindicatioja nincs) vértelenítésben végezzük. Szükséges lehet operatios nagyító, illetve mikroszkóp.
3.3. műtéti érzéstelenítés:
3.4. műtét: A metszést a kézsebészet szabályainak megfelelően kell vezetni, a műtét során atraumaticus technikát kell alkalmazni. Vértelenítésben végzett műtét végén a leszorítás felengedése után vérzéscsillapítást kell végezni. Végül drainálás nélkül, vagy kis bőrdrainek felett sebzárás.
Kontraindikációk
A beteg rossz általános állapota. Amennyiben a primer ínvarrat feltételei(a sérülés jellege,megfelelő műtéti körülmények és műszerezettség,szakavatott kézsebész)nem adottak,a sérülést a "korai halasztott sürgősség" szabályai szerint kell ellátni.
Kezelés zónák szerint
I-es zóna
Ha palmar plate sérülést is észlelünk, az finom non-reactiv fonallal (pl. 6/0-ás Mersilene) helyreállítandó. A functionalisan legfontosabb A4-es pulley-t mindenképpen meg kell kísérelni legalább részlegesen megtartani. Ha az ínsérülés a tapadási ponttól több, mint 1 cm-rel proximalisabban van, vég a véghez reconstructiot végzünk, tovafutó epitendinosus (6/0-ás) varrattal kiegészítve. Amennyiben a szakadás a tapadási ponttól kevesebb, mint 1 cm-re van, a proximalis íncsonk előrehúzása és reinsertioja javasolt. (Leddy által módosított Bunnell-féle pull-out wire és gomb technika) Az ín folytonosságának helyreállítása után, (lehetőség szerint) reconstrualjuk az ínhüvelyt.
Hüvelykujj
A hüvelyken functionalisan a ferde pulley a legfontosabb, de ez is kimetszhető, feltéve ha az A1-es intact. Amennyiben több, mint 1 cm-rel kell előre húzni a proximalis csonkot, elvégezhető a flexor pollicis longus Z-tenotomiája a csuklótól proximalisan, vagy a musculotendinosus határon fractionalis meghosszabbítás végezhető. Az ín folytonosságának helyreállítása után, reconstrualjuk az ínhüvelyt.
II-es zóna
Az ínhüvelyt az annularis pulley-k között L-alakú metszéssel nyitjuk meg. Elegendő annularis pulley-t hagyjunk meg! Az íncsonkok felkeresése és előhúzása után módosított Kessler-féle belső rögzítő varrattal (4/0-ás Ethibond),vagy dupla Tsuge varrattal (4/0-s PDS) rögzítjük az íncsonkokat egymáshoz, majd epitendinosus tovafutó varrattal (6/0) adaptálunk. Ha mind a superficialis-, mind a profundus ín sérült, lehetőség szerint mindkét ínat állítsuk helyre. A flexor supeficialist 5/0-ás Ethibond fonallal kivitelezett verticalis matrac öltésekkel reconstrualjuk.Rögzíthetjük a leírt Tsuge technikával is. Ha a felületes hajlítóínat nem állítjuk helyre, a vinculumtól distalis csonkját hagyjuk meg, megóvandó a mély hajlítóín vérellátását, s elkerülendő a PIP-ízület hyperextensios deformitását. Ha lehetséges, reconstrualjuk (6/0-ás fonallal) az ínhüvelyt. Az A1 és A2 pulley megóvása fontos, legalább egyikük maradjon intact, és mindent el kell követni a palmaris aponeurosis pulley megóvására.
Hüvelykujj
A hüvelykujjon az A1 és a ferde pulley közül legalább az egyiket meg kell kímélni. Az ínhüvelyt itt legtöbbször nem állítjuk helyre.
III-as zóna
Itt gyakran találkozunk a neurovascularis képletek sérülésével, ezeket állítsuk helyre. Ha mind a superficialis-, mind a profundus ín sérült, lehetőség szerint mindkét ínat reconstrualjuk. Ínreconstructio, valamint (lehetőség szerint) ínhüvelyellátás mint az I-es és II-es zónában.
IV-es zóna
Módosított Kessler-féle belső rögzítő varrattal (4/0-ás Ethibond),vagy dupla Tsuge varrattal (4/0-s PDS) rögzítjük az íncsonkokat egymáshoz, majd epitendinosus tovafutó varrattal (6/0) adaptálunk. A carpalis alagút egyéb képleteinek sérülése itt gyakori, ezeket szintén reconstrualni szükséges.
V-ös zóna
Módosított Kessler-féle belső rögzítő varrattal (4/0-ás Ethibond),vagy dupla Tsuge varrattal(4/0-s PDS) rögzítjük az íncsonkokat egymáshoz, majd epitendinosus tovafutó varrattal (6/0) adaptálunk. Ebben a zónában rendszerint többszörös ínsérüléssel találkozunk, gyakori a nervus medianus és a nervus ulnaris, valamint az arteria radialis és arteria ulnaris sérülése, ezeket szintén reconstrualni szükséges.
IV. Rehabilitáció
A rehabilitáció szükségességének paraméterei
Aktív extensión ,gumiszalagos flexión alapuló módszerek
- flectált csukló és MP mellett rögzít
- distalis tenyéri csiga alkalmazása mellett is a superficiális és a profundus inak közötti relatív elmozdulás kicsi,az inak közötti adhaesio veszélye nagy,a DIP-et gyengén mobilizálja
- számos modifikáció ismert
Kontrollált passzív mozgatáson alapuló módszerek
- kevésbé valószínű flexiós kontraktura kialakulása,mint az előbbi módszernél
- a tornáztatások között eltelt időszakokban jobb védelmet biztosít az operált ujjnak
Kontrollált aktív mozgatáson alapuló módszerek
- a perifériás epitenon varratsorral megerősített 4-6 fonalas varrat jól kivitelezve a gyógyulás egész időtartama alatt elég erős ahhoz,hogy a könnyű aktív mozgatás során keletkező erőknek ellenálljon
- extendált csukló és flectált MP mellett keletkezik a legkisebb feszülés az ínvarrat területén aktív ujjflexió esetén
- a legnagyobb ínelmozdulás így biztosítható, csökkentve az adhaesiók számát
- biológiailag kedvezőbb heg remodellációt biztosít
- a korai reruptúrák aránya a passzív mozgatásos metódusokéval összevethető
- agresszív, erősítő jellegű terhelés a postoperatív 8. hétig nem megengedett egyik módszer esetében sem
- külön megfontolást igényelnek a 10 év alatti gyerekek és a "megbízhatatlan" betegek
- megbízhatatlan beteg esetén válasszunk hosszabb immobilizációt,mely letapadás és tenolysis esetén megmenthet a beteg számára több-kevesebb funkciót
- számos esetben szükséges s protokollok egyénre szabása a sérült biológiai adottságai szerint
- ideális esetben a postoperatív kezelés a következő jellemzőkkel bír
- figyelembe veszi a duzzanatot és a keringést
- a csuklót és az MP ízületeket nyugalomban flexióban tartja
- nyugalomban a PIP és DIP ízületeket extensióban tartja
Gyermekkori flexor sérülések
- technikai nehézségek a kisebb méretek miatt
- nehézkes postoperatív kezelés és mobilizáció
- növekedési zavar,komoly későbbi funkciózavarok előfordulhatnak
- korai aktív mobilizáció nem egyértelműen előnyösebb,4 hetet meghaladó rögzítés viszont biztosan káros
V. Gondozás
1. Lehetséges szövődmények
- Ruptura (fizikális vizsgálat, UH, MRI), ízületi contractura, ín letapadások.
3.1. szövődmények kezelése: Prompt feltárás, ismételt varrat, kevésbé agresszív mobilizációs protokoll rossz minőségű ínvégek esetén, az érintett ízület mozgásait jobban elősegítő mobilizációs protokoll, a legnagyobb gondosság és a legjobb cooperatió mellett is előfordul ínletapadás, tenolysis indikált, ha nincs értékelhető funkciójavulás adequát gyógytorna mellett, a lágyrészviszonyok megfelelőek, ízületi kontraktúrák nincsenek, vagy minimálisak
Flexorinak fedett rupturái és avulsiós sérülései
Rupturák
- leggyakoribb okok: rheumatoid arthritis,krónikus tenosynovitist
okozó kórképek,parciális sérülések,TFCC meszesedés csontos felszín feletti lefutás
- Primer direct reconstrukció javasolt a korábban vázolt módon
Flexor digitorum profundus avulsiók
I. típus
- RTG többnyire negatív.
- az ín a tenyér területére húzódik vissza.
- 7-10 napon belül rekonstruálandó.
- katéter, vagy más segédeszköz segítségével a profundus ín az intact pulley rendszeren keresztül visszahúzandó
- lege artis reinsertio. Direct reconstrukcio kivihetetlensége esetén az ujj "úgy hagyása", szabad íntransplantáció vagy DIP tenodesis mérlegelendő.
II. típus
- Az ín a PIP-ig húzódik vissza
- Gyakran kis csontfragmentum is látható
- akár 6 héttel a sérülés után is lehetséges reconstructio
- feltárás a C1 keresztszalagon keresztül,az inat az intact pulley rendszeren keresztül visszahúzva reinsertiót végzünk
- idővel I. típusúvá konvertálódhat spontán
III. típus
- relatíve nagy csontos defractum,mely az A4 pulley magasságában elakad
- osteosynthesis a választandó megoldás
Ritkán előfordulhat a distalis phalanx törés és az ín avulsiója egyidejüleg
Idősült, kezeletlen profundus ín avulsiók reinsertiója nem javasolt, DIP arthrodesis,válogatott esetekben szabad ínátültetés jön szóba. Ha a proximalis íncsonk a tenyérben tapintható terimeként van jelen, excindálható.
VI. Irodalomjegyzék
1. Gaál Csaba: Sebészet, Medicina Bp. 2010
2. Green, D: Operative Hand Surgery 1989-2006, Churchill Livingstone 1993
3. Renner Antal: Traumatológia Medicina Bp. 2000.
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a cubital tunnel syndromáról
(sulcus nervi ulnaris syndroma)
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO G5620 A n. ulnaris károsodása
1. A protokollok alkalmazási / érvényességi területe
Kézsebészet, traumatológia, ortopédia, plasztikai sebészet
2. A protokollok bevezetésének feltétele
Az öt szakmában a kézsebészet, traumatológia és mikrosebészet alapos ismerete.
3. Definíció
A nervus ulnaris direkt vagy indirekt kompressziója a cubitalis csatornában. A carpal tunnel syndroma után a második leggyakoribb tunnel syndroma.
3.1. Kiváltó tényezők
Direkt kompresszió:
Fibroticus kötegek
Rendellenes ér
Izomhypertrophia
Tumor
Indirekt hatások:
Extrém terhelés
Cubitus valgus
Direkt trauma
3.2. Kockázati tényezők
Korábbi könyöktörés, túlzott igénybevétel, reumatológiai és anyagcsere betegségek, cubitus valgus, arteriosclerosis
4. Panaszok / Tünetek / Általános jellemzők
A klinikai tünetek típusosan a nervus ulnaris beidegzési területén: érzészavar (8-10 volaris-digitalis, 6-10 dorsalis-digitalis ideg területén), hypaestesia, paraestasia majd anaestasia. Súlyosabb esetben motoros kiesés a nervus ulnaris ellátási területén, elsősorban a kis kézizmokban: hüvelykadductor izomzat sorvadása, az interosseus izomzat sorvadása. Tünetek: "karonkéz", az ujjak elsősorban a kisujj és hüvelykujj zárásának képtelensége. A hüvelykujj csúcsfogásának a gyengülése vagy kiesése.
Anatómiai áttekintés
A cubitalis tunnelen (sulcus nervi ulnaris) a nervus ulnaris könyöktáji lefutásának azt a 8 cm-es szakaszát nevezzük, ami a Struthers-ről elnevezett árkádtól (a mély felkari fascia és intermuscularis septum találkozása) az Osborn-ról elnevezett szalagig terjed (ligamentum arcuatum, ami a flexor carpi ulnaris izom felett feszül). A csatornában a nervus ulnaris medialis epycondilustól posterior irányban halad. Normális esetben subluxatio nélkül némi mozgást mutat csukló flexio és extensios helyzetében. Az idegre eső nyomás flexiokor növekszik. Érellátását elsősorban a vele együtt futó domináns arteriaja adja, mely a nagyobb erekkel a csatornába való belépésnél anastomisal.
A leszorítást általában a ligamentum epicondylo-olecranicum vagy a ligamentum arcoatum okozza.
5. A betegség leírása
5.1. Érintett szervrendszer(ek):Könyök és a kéz
5.2. Genetikai háttér: Nincs genetikai háttere
5.3. Incidencia / Prevalecia / Morbiditás Magyarországon: Középkorú nőkön és férfiakon, nőkön valamivel gyakoribb, a fiataloknál és gyermekeknél ritka
5.4. Jellemző életkor: 40-60 év
5.5. Jellemző nem: Nőknél valamivel gyakoribb
II. Diagnózis
1. Diagnosztikai algoritmusok
Fizikális vizsgálat, rtg. vizsgálat, EMG vizsgálat, labor és egyéb diagnosztikai vizsgálatok szükségesek.
2.Anamnézis:
Beteg panaszainak értékelése, fájdalom, érzés kiesés, mozgászavar, van-e és mióta, pontosan megtudja-e mondani a panaszok idejét, kiváltó okát, provokálhatóságát, szünteti-e valami, emlékszik-e valamilyen traumára vagy konkrét okra, milyen egyéb betegségei vannak, stb.
3. Fizikális vizsgálatok
3.1.Érzésvizsgálat:a nervus ulnaris vizsgálati területén, hideg-meleg tapintás, fájdalom, kétpont diszkrimináció.
3.2.Mozgásvizsgálat: könyöknyújtás, hajlítás, csukló nyújtás, hajlítás, az ujjak nyújtása hajlítása, terpesztése, zárása, csúcsfogás, kulcsfogás.
3.3.Kompressziós teszt, Tinel-jel.
3.4.Provokatios teszt, Phallen teszt.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok
4.1.Laboratóriumi vizsgálatok
Műtét esetén szükséges anaetesiológiai okokból vagy anyagcsere betegség, reumatológia vagy egyéb belgyógyászati betegség lehetőségének kizárására vagy jelenlétének igazolására (pl. Diabetes).
4.2.Képalkotó vizsgálatok
Rtg. vizsgálat: 2 irányú és tuner felvétel igazolhatja a csatorna deformáltságát, esetleges csonttumor jelenlétét, törést, fejlődési rendellenességet, kifejezett arthrosist, exsostosist, myositist, stb. MRI vizsgálat: lágyrész elváltozások kimutatására (nem feltétlenül szükséges).
4.3.Egyéb: ENG és EMG vizsgálatok.
A betegségnél legfontosabb diagnosztikus módszer Gold Standard. Ideg vezetési sebesség 50 m/s-nél kisebb, korjelző a betegségre.
5. Kiegészítő diagnosztikai vizsgálatok
A cervicobrachialis spondylarthroris gyöki irritáció, kompresszió, discus hernia, Guillant- Barré Syndroma elkülönítésére gyanú esetén, ill. bizonytalan diagnózis miatt az ott leírtak szerint kell eljárni.
6. Differenciál diagnosztika
6.1. Ulnar tunnel syndroma (Guyon-syndroma).
A nervus ulnaris tunnel syndromája a csukló szintjében. Tünetek: a cubital tunnel syndroma tüneteivel megegyezőek, csak érzészavar dorsalisan nincs. Elkülönítésben az EMG vizsgálat magassági diagnosisa perdöntő.
6.2. Nyaki discushernia, spondylosis, spondylarthrosis.
6.3. Guyon-Barré syndroma.
6.4. Amyotrophias lateral sclerosis.
III. Terápia
III/1. Nem gyógyszeres kezelés
1. A megfelelő egészségügyi ellátás szintje
Szintje kézsebészeti, baleseti, ortopédiai, reumatológiai szakrendelés szükség esetén a fenti szakterületeken osztályos kezelés.
2. Általános intézkedések
2.1. Az érintett végtag pihentetése, éjszakai sín, könyökvédő viselése.
2.2. Gyógytorna: a nyomási panaszok csökkentésére speciális gyógytorna: nyújtó és ideggördülést javító gyakorlatok.
A kiesett izomfunkció helyreállítására a kiskéz izmokat aktivizáló gyakorlatok.
2.3. Szelektív ingeráram kezelés: az izomfunkció javítására
3. Speciális ápolási teendők
A panaszok csökkenését vagy fokozódását a klinikai vizsgálatok során ellenőrizni kell.
4. Fizikai aktivitás
Gyógytorna rendkívül fontos, speciális nyújtó és ideg gördülést javító gyakorlatok.
Egyebekben a betegnek a beteg felvilágosítása az extrém könyökhajlítás, valgus állás elkerülésére.
5. Diéta
Alkohol és dohányzási tilalom
6. Betegoktatás Gyógytorna oktatás
Az elveszett funkciók visszaszerzése rendszeres tornával.
III/2. Gyógyszeres kezelés
1. A megfelelő egészségügyi ellátás szintje
A fenti szakmák rendelőintézeti és kórházi szintje.
2. Ajánlott gyógyszerek kezelés
Nonsteroid gyulladáscsökkentő tabletták, kenőcsök, fájdalomcsillapítók, ill. lokális steroid injekció.
2.1. Kontraindikációk
2.2. Lehetséges jelentős interakciók
III/3. Műtéti kezelés
1. A megfelelő egészségügyi ellátás szintje
Kézsebészeti, traumatológiai, ortopédiai osztályon vagy klinikán végezhető.
2. Általános intézkedések
Anaesthesiológiai, belgyógyászati kivizsgálás
3. Speciális ápolási teendők
Műtéti behatolás területén ne legyen fertőző forrás.
4. Sebészeti kezelés
4.1. műtéti indikáció
4.1.1. Konzervatív kezelésre nem javuló (2-4 hónap)
EMG-vel 50 m/s. alatti vezetési sebesség csökkenést mutató fizikálisan cubitalis tunnel syndromára utaló esetek.
4.1.2. Absolut indikáció
Típusos tünetek, 40 m/sec. alatti EMG lelet.
4.1.3. Relatív indikáció
Enyhébb tünetek. Konzervatív kezelés eredménytelen, vagy csak átmeneti javulás jön létre. Ha a panaszok fokozódnak izomatrophia jön létre, ha egyéb ok kizárható.
4.2. Műtéti előkészítés
Elektív tervezett műtétnek megfelelő a kivizsgálás
4.3. Műtéti érzéstelenítés
Általános érzéstelenítés, vezetéses érzéstelenítés, local anaestesia.
4.4. Műtéti kezelés elfogadott módszerei
4.4.1. Nyílt insitu decompresszio, vagy + medialis epicondylectomia (mini antepositio)
Műtéti leírás: 6-10 cm-es bőrmetszés a medialis epicondylus felett, óvatosan behatolva a medialis alkari bőrideget a sérüléstől megóvva feltárjuk a csatornát. A sulcust teljes hosszában az árkádtól a FCU eredéséig az ideget fedő fasciat és szalagokat átvágjuk. Az ideget ellátó longitudinalis vérellátást megkímélve extraneurolysist végezhetünk. Ezután a könyökízület flexiojával a luxatios tendenciáról meg kell győződnünk, mert ennek jelenléte esetén más módszerre kell áttérni.
Az insitu decompressiot epicondylectomiaval egészíthetjük ki, amit vésővel végezhetünk. Horizontális vagy saggitalis síkban maximum a sulcus mélységének 20%-áig (hogy ne okozzunk instabilitást). Mindkettővel a nervus ulnaris mozgásterének javítását érhetjük el. Functionális próba után drain, réteges sebzárás. 10 nap rögzítés. Irodalmi ajánlás: In situ decompresszio:
- Osborne: 1957. 1970.
- Steven: 1999.
Medialis epicondylectomia: King Morgan: 1959. Frontalis parcialis epicondylectomia: Popa: 2004.
4.4.2. Endoscopos decompresszio
Műtéti leírás: Az endoszkópos eszköz típusától függően egy vagy két portálos behatolásból kb. 1,5 cm-es metszésből kongrad vagy retrograd irányba hasítjuk be endoszkóp ellenőrzése mellett a nervus ulnaris leszorító képleteket.
Jelenleg nem túl elterjedt technika. A műtét effectivitasa intraoperatíve nehezen ítélhető meg. Irodalmi ajánlás: Endoscopos: Taniguchi 2002.
4.4.3. Antepositio Subcutan
Műtéti leírás: Az ulnaris csatorna feltárását az előzőekben leírt módon végezzük, ezután a nervus ulnaris teljes hosszában mobilizáljuk, proximalisan az intermuscularis septumot behasítjuk, distalisan az FCU eredésénél szintén az izomfejeket szétválasszuk. A minél kisebb feszülés érdekében a nervus ulnaris hátsó motoros ágát különválasztjuk a nervus ulnaris főtörzsétől (intra neurolysis) és így emeljük a medialis epicondylus elé a nervus ulnarist. A visszacsúszást fascia lebennyel, vagy a fascianak és subcutisnak az összevarrásával akadályozzuk meg. Functionális próba után drain, réteges sebzárás. 10 nap nyugalomba helyezés.
Black 2000, Andrew 2000.
Intramuscularis
Műtéti leírás: Műtéti leírás a subcutan antepositiotól annyiban különbözik, hogy az anteponalt helyzetben a pronator flexorcsoportban képzett izomárokban helyezzük el az ideget. Functionális próba után drain, réteges sebzárás. 10 nap nyugalomba helyezés.
Előnye lehet: védettebb helyzet, hátránya: a fokozottabb hegesedés.
Harrison
Submuscularis
Műtéti leírás: A nervus ulnaris feltárása a korábbiakkal megegyezik. Transpositionál a flexor-pronator tapadást leválasszuk, a feszülésmentes antepositiohoz az ideget mind proximalisan, mind distalisan korábbiakhoz képest 1-2 cm-el hosszabban mobilizáljuk, majd ezután anteponáljuk, és az anteponált ideg felett a flexorpronator csoportot reinsertaljuk. Functionális próba után drain, réteges sebzárás. 10 nap nyugalomba helyezés. Előnye lehet: védettebb helyzet, hátránya: a fokozottabb hegesedés, leszorítás.
Learmonth 1943.
Transmuscularis
Műtéti leírás: A leírás a submuscularishoz képest abban különbözik, hogy a leszorítást okozó septum és fascia részeket is eltávolítjuk az izomágyból és a pronator-flexor csoportot Z plasticaszerűen meghosszabbítva varrjuk vissza eredésére. Functionális próba után drain, réteges sebzárás. 10 nap nyugalomba helyezés. Előnye: a submuscularishoz képest az epicondylitises panaszokat a Z plastica megelőzi.
Green 2005.
A fenti felsorolásból is látszik, hogy a szakirodalom szerint nincs kikristályosodott műtéti kezelési eljárás. Leginkább az In situ decompressio, antepositionál a subcutan, ill. transmuscularis a szélesebb körben alkalmazott. Fontos megemlítenünk a transpositio hátrányait: Extensionál a feszülés megegyezik a normál helyzetben mért flexios feszüléssel (Grewal 2000), jelentős a devascularisatio (Ogata 1985, Messina 1995), reluxatios tendencia, megcsavarodás, leszorítás, perineuralis hegesedés, FCU motoroságsérülés, könyök kontraktúra.
Antepositio abszolút javallata: Reoperatio, szűk tunnel, deformált tunnel, csontcsőr, synovitis, tumor, subluxatios tendencia. Speciális sporttevékenység (dobó atléták).
A műtétek részletes leírását lásd:
Green, D.P.: Green's operative hand surgery. Philadelphia, 2005,
4.5. Posztoperációs teendők
A műtéti terület drainage a végtag felpolcolása, átmeneti rögzítése, gyógytorna megkezdése.
5. Fizikai aktivitás: Az operált terület kivételével teljes fizikai aktivitás, majd az operált terület gyógytornájának megkezdése a műtét után a műtét típusától függően.
6. Diéta
Dohányzás tilalom
7. Betegoktatás
Gyógytorna oktatása, kéz használatának gyakorlása.
IV. Rehabilitáció
A kéz kisizmainak erősítése speciális gyógytornával, elsősorban az ujj zárás-nyitás, kulcsfogás, csúcsfogás, markolás. Atrophia esetén, ill. az izomerő fokozására szelektív ingeráram kezelés.
V. Gondozás
1. Rendszeres ellenőrzés: Klinikai tünetek és panaszok kezelésére rendszeres ellenőrzés javasolt.
2. Megelőzés: Reflex sympathicus dystrophia kialakulásának megelőzése. Hegesedés megelőzése gyógytornával és localis kezeléssel.
3. Lehetséges szövődmények:
3.1. A klinikai tünetek változatlanul fennállnak
A klinikai tünetek változatlanul fennállnak
Kezelése: differenciáldiagnosztikai vizsgálatok alapján a kezelés megváltoztatása javasolt.
3.2. A panaszok megszűnnek, majd ismételten jelentkeznek
A panaszok megszűnnek, majd ismételten jelentkeznek.
Terápia: ismételt vizsgálat a compressio ismételt kialakulását valószínűsíti, konzervatív kezelés, esetleg műtét javasolt, de ilyenkor kevésbé számíthatunk jó klinikai eredményekre.
3.3. Az interosseus és adductor izom atrophiaja olyan súlyos, hogy kezelésre sem tér vissza Terápia: EIP-I. interosseus transfer,
I. MP desis,
V. extensor propirus-interosseus transfer.
4. Kezelés várható időtartama / Prognózis: Típusos esetben 4-8 hét, izomatrophiaval járó esetben 1 év is lehet.
VI. Irodalomjegyzék
1. Ács, G. Hargitai, E.: Gyermektraumatológia. Budapest, 2001. Medicina.
2. Gaál Csaba: Sebészet, Medicina Bp. 2010.
3. Green, D.P.: Green's operative hand surgery. Philadelphia, 2005, Elseiver, Churchill Livingstone.
4. Grewal R, Varitimidis SE, Varkadas DG, FU FH, Sotereanos DG: Ulnara nerve elongation and excursion in the cubital tunnel after decompression and anterior transposition. Hand Surg 2000. Oct.? 25(5):457-60.
5. Kómár, J.: Alagút-szindrómák. Budapest, 1977, Medicina.
6. Learmnoth JR: A technique for transplanting teh ulnar nerve. Surg Gynecol Obstet 75:792-793. 1942.
7. Lundborg, G.: Nerve injury and repair. Edinburgh-London-New York, 1988, Churchill Livingstone.
8. Messina A, Messina JC: Transposition of the ulnar nerve and its vascular bundle for the entrapment syndrome at the elbow. Hand Surg 1995. Oct., 20(5):638-48.
9. Mowlavi A. Andrews K.Lille S.et al: The management of cubital tunnel syndrome: A meta-analysis of clinical studies. Plast Reconstr Surg 106:327-334. 2000.
10. Ogata K., Manske PR, Lesker PA: The effect of surgical dissection on regional blood flow to the ulnar nerve int he cubital tunnel. Clin Orthrop Relat Res. 1985. Mar. (193):195-8.
11. Pechan J. Julius I: The pressure measurement of the ulnar nerve: A contribution to the pathophysiology of the cubital tunnel syndrome. J Biomech 8:75-79, 1975.
12. Popa M, Dubert T: Treatment of cubital syndrome by frontal partial medial epicondylectomy. A retrospective series of 55 cases. Hand Surg 2004. Dec., 29(6):563-7.
13. Renner, A.: Traumatológia. Budapest 2000. Medicina.
14. Sunderland, S.: Nerves and nerve injuries. Edinburgh-London-New York, 1978, Churchill Livingstone
15. Taniguchi Y, Takami M, Takami T, Yoshida M: Simple decompression with small skin incision for cubital tunnel syndrome. Hand Surg 2003. Dec.; 27(6):559-62.
16. Vekerdy-Nagy Zs.: Rehabilitációs orvoslás, Budapest 2010., Medicina
17. Wilbourn AJ: The electrodianostic Examination with peripheral nerve injuries. Clin Plast. Surg 30:139-154. 2003.
A szakmai protokoll érvényessége: 2014. június 30.
VII. Melléklet
Dokumentáció, bizonylat: általános dokumentumokon túl esetleg műtét utáni fotók
A Nemzeti Erőforrás Minisztérium szakmai protokollja a feszítőín sérülésekről
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO S5630 A hüvelykujj feszítő-távolító izmai-inai sérülése az alkar szintjében
S5640 A kéz egyéb ujjai feszítő izmai-inai sérülése az alkar szintjében
S5650 Az alkar egyéb feszítő izmainak-inainak sérülése az alkar szintjében
S5670 Több izom és ín sérülése az alkar szintjében
S5680 Egyéb és k.m.n. izmok és inak sérülése az alkar szintjében
S6620 A hüvelyujj feszítő izmának-inának sérülése a csukló, kéz szintjében
S6630 A kéz egyéb ujja feszítő izma-ina sérülése a csukló, kéz szintjében
S6640 A hüvelykujj belső izmainak-inainak sérülése a csukló, kéz szintjében
S6650 Egyéb ujj belső izmainak-inainak sérülése a csukló és kéz szintjében
S6670 Többszörös feszítő izom és ín sérülés a csukló és kéz szintjében
S6680 Egyéb izmok és inak sérülése a csukló és kéz szintjében
S6690 K.m.n. izom és ín sérülése a csukló és kéz szintjében
1. A protokoll alkalmazási/érvényességi területe
Kézsebészet, ortopédia, traumatológia
2. A protokoll bevezetésének alapfeltétele
A szakmai kollégium illetékes tagozatának legitimációja
Szakmai minimum feltételeknek megfelelő traumatológiai, ortopédiai vagy kézsebészeti osztály
3. Definíciók
A feszítőinak folytonosság-megszakadása amelyek lehetnek nyíltak és fedettek. Az ínsérülés szövődhet a tapadási pont csontos sérülésével. A sérülés az érintett ín / inak / által mozgatott ízületek aktív nyújtási képtelenségével jár.
3.1.Kiváltó tényezők
Külső vagy belső mechanikai erők. Lehet nyílt, vagy zárt, direkt, vagy indirekt hatásra bekövetkező.
3.2.Kockázati tényezők
Éles vagy roncsoló károsodást okozó direkt külső erőbehatás. Ízületközeli sérülések, ficamok, ízületközeli törések, különösen radius distalis vég törései. Extrém terhelés. Krónikus synovitis, autoimmun kötőszöveti betegségek. Inak körül alkalmazott szteroid infiltráció.
4. Panaszok/tünetek/általános jellemzők
Direkt ,nyílt sérülésnél áthatoló sebzés az ín lefutásának megfelelően, az ín által mozgatott ízület aktív nyújtási képtelensége. Zárt sérülésnél az említett aktív nyújtási képtelenség, érzékenység az ín fölött, esetlegesen tapintható folytonossághiány.
5. A betegség leírása
5.1.Érintett szervrendszer(ek): A kéz extrinsic és intrinsic feszítő apparátusa.
5.2.Jellemző életkor és nem: Nem jellemző. Nyílt sérülések inkább a fiatalabb, aktív korosztályt érintik, zárt, indirekt sérülés idősebb életkorban, és speciális betegségek együttes meglétekor gyakoribb.
II. Diagnózis
1. Diagnosztikai algoritmusok: A biztos diagnózis felállításához az anamnézis, a fizikális vizsgálat és a rtg felvételek általában elégségesek, az ok tisztázására nagyon ritkán UH, illetve MRI vizsgálat is szükséges lehet.
2. Anamnézis: Részletes anamnesis (sérülési mechanizmus). Helyszín, végzett tevékenység, ha van, a sértő eszköz meghatározása.
3. Fizikális vizsgálatok: A páciens és a kéz fizikális vizsgálata az adott körülmények által lehetővé tett legnyugodtabb viszonyok mellett.
Vizsgálati sémák alkalmazása.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok (felhasznált bizonyítékok, azok szintjei)
Diagnosztikus jelek
Aktív nyújtási képtelenség, deformitás. Nyílt sérülések esetén a seb elhelyezkedése, jellemzői. Egyéb struktúrák károsodásának lehetősége.
4.1. Laboratóriumi vizsgálatok: specifikus vizsgálat nincs, az ismert okok némelyike az alapbetegség miatt kóros laboreredményeket eredményezhet.
4.2. Képalkotó vizsgálatok: Rtg felvételek
A csontos sérülés kizárására kétirányú célzott röntgen felvétel készítése
UH és MRI vizsgálat
Lágyrész elváltozások kimutathatók
5. Kiegészítő diagnosztikai vizsgálatok (felhasznált bizonyítékok, azok szintjei)
6. Differenciál diagnosztika
Csont, ízületi sérülések, idegsérülések járhatnak hasonló tünetekkel, képalkotó eljárások, műtéti exploráció pontosíthatja a diagnózist.
7. Sérülésbeosztás zónák szerint
I. Zóna: a DIP ízület fölötti sérülések, hüvelyk IP ízület fölötti sérülések
II. Zóna: hosszú ujjak középperc, hüvelykujj alapperc
III. Zóna: PIP ízület fölötti sérülések (Boutonniere deformitás), hüvelyk MP ízület fölötti sérülések
IV. Zóna: proximalis phalanx fölötti sérülések, hüvelyk metecarpus fölötti sérülések
V. Zóna: MP ízület fölötti sérülések, hüvelyk CMC fölötti sérülések
VI. Zóna: a metacarpusok szintjében
VII. Zóna: a csukló szintjében
VIII. Zóna: alkar distalis szintje
IX. Zóna: alkar proximalis szintje (izomhas sérülés, idegsérülés lehetséges)
III. Kezelés
III/1. Fedett sérülés:
Ujjakon-csontos komponens nélkül - DIP ízület fölött: konzervatív kezelés (Brooks gyűrű 6 hét)
PIP ízület fölött (centrális szár sérülés) nyújtott sínezés 4 hétig, majd extensios rugós sín (Capener) csontos komponenssel - műtét (fedett, vagy feltárás , repositio és tűzés)
Inveterált esetben centrális szár rekonstrukció. IV.,V.,VI.,VII. zóna: műtéti rekonstrukció, ínáthelyezés.
III/2. Nyílt sérülés: Műtéti kezelés.
III/3. Műtét
1. A megfelelő egészségügyi ellátás szintje.
2. Általános intézkedések
3. Speciális ápolási teendők
4. Sebészeti kezelés
4.1. Műtéti indikáció: A feszítőinak diagnosztizált sérülése, functio kiesése.
4.2. Műtéti előkészítés: A kézsebészeti műtéti előkészítés általános szabályainak betartása mellett speciális előkészítést nem igényel.
4.3. Műtéti érzéstelenítés: A műtét az ujjakon a PIP ízülettől distalis eseteknél vezetéses érzéstelenítésben végezhető.
A kézháton vagy több ujjon végzett műtétnél javasolt általános vagy axilláris, regionalis localis anaesthesia 4.4: Műtét: Nyílt feltárásos, mindig kipólyázásos vértelenségben. A DIP, IP, illetve PIP ízület fölötti fedett sérüléseknél végezhető műtét az ízület fedett, nyújtott helyzetű áttűzése amennyiben ez a rögzítést biztosabbá teszi. A műtét lényege a sérült ínvégek izolálása, többszörös ínsérülés esetén identifikálása, majd az ínvégek egyesítése. Az I,II,III,IV,V,VI. zónában U öltésekkel, 4/0, vagy 3/0-s monofil felszívódó vagy nem felszívódó fonallal. A konnexus intertendineától proximalis sérüléseknél/VI. zóna proximalis harmada / tehermentesített varrat. A VII, VIII. zónában standard centrálisán vezetett hurkolt varrat (core suture), pl. Kessler, Tsuge végzendő. A VII. zónában gyakran sérül az extensor retinaculum, kívánatos a varrattól distalisan vagy proximalisan a rekonstrukció, megelőzendő a feszítőinak csukló fölötti előemelkedését. A IX. zónában izomhas adaptáció 4/0-s monofil felszívódó fonallal. A vérzéscsillapítás után réteges sebzárás, drain visszahagyásával, nyomókötés felhelyezésével. Külső rögzítés az I, II. zóna sérülései után alumínium sínnel, ettől proximalis sérüléseknél palmaris gipszsínnel, a csukló 40 fokos dorsalextensios helyzetében, az ujjak "safe-position" állásában. Nyílt, szennyezett sérüléseknél profilaktikus systhemás antibiotikus kezelés,tetanus elleni védőoltás.
4.5. Posztoperativ teendők: 4-5 napig a kar elevatiója.
A 3. posztoperatív héttől fokozatosan aktív és passzív funkcionális kezelés, a 4. héten a rögzítés eltávolítható, az zóna sérüléseinél a III/1.-ben leírtak szerint.
4.6. Műtéti kontraindikáció
Az alkar, csukló, kéz területére lokalizálódó gyulladásos megbetegedés.
Aktív gyulladásos bőrfolyamat.
A beteg rossz általános állapota, kooperáció hiánya.
A műtét nem végezhető el ha a beteg a felvilágosítás után a műtéti kezelést nem vállalja, illetve a műtét biztonságos elvégzéséhez szükséges intézkedéseknek nem hajlandó alávetni magát
IV. Rehabilitáció
A rehabilitáció szükségességének paraméterei
V. Gondozás
1. Rendszeres ellenőrzés: A rögzítés eltávolításáig hetente, majd az utókezelés alatt 3- 6 hetente kontroll.
2. Lehetséges szövődmények
A sebészi beavatkozás általános szövődményei (sebfertőzés, iatrogén sérülések) az ín varratának szakadása.
A helyreállított ín környezetéhez való letapadása.
Ízületi contracturák.
A mozgásterjedelem beszűkülése
2.1. Szövődmények kezelése
A fenti szövődmények korai felismerése, azok műtéti korrekciója infectio esetén korai feltárás (antibiotikum, lokális sebkezelés), sebgyógyulási zavarnál konzervatív sebkezelés, adott esetben műtéti feltárás. Ínvarrat szakadása esetén reoperáció, rekonstrukció. Ínfelszabadítás, ízületi mozgás-felszabadítás.
3. Kezelés várható időtartama/Prognózis: Az ínvarrat konszolidálódása általában 4 hét, a rögzítés eltávolítása után 4-8 hetes functionalis utókezelés. Amennyiben 3 hónapos utókezelés után sem kielégítő a functio, a 3. Pontban felsorolt mozgásfelszabadító beavatkozások szükségességét mérlegelni kell.
VI. Irodalomjegyzék
1. Renner (szerk.)Traumatológia 2003.Medicina,Budapest
2. Gaál Csaba: Sebészet, Medicina 2010
3. Green: Operative Hand Surgery Churchill-Livingstone 3d ed. 1993
4. Lister:THE HAND Diagnosis and Indications Churchill-Livingstone 1993
5. Oberlin:Manule de Chirurgie du Mambre Superieur Elsevier 2000
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a kézfejlődési rendellenességekről
Készítette: a Magyar Kézsebész Társaság vezetősége az Ortopédiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO Q6810 A kéz veleszületett deformitása
Q6880 Egyéb meghatározott veleszületett csont-izom deformitások
Számfeletti ujjak (polydactilia)
Q6900 Járulékos ujj(-ak)
Q6910 Járulékos hüvelykujj(-ak)
Q6990 Polydactylia, k.m.n
Összenőtt ujjak (syndactilia)
Q7000 Összenőtt ujjak
Q7010 Úszóhártyás ujjak
Q7040 Polysyndactylia
Q7090 Ujjak összenövése, k.m.n.
A felső végtag redukciós defektusai
Q7100 A felső végtag(-ok) veleszületett teljes hiánya
Q7110 A felkar és alkar veleszületett hiánya, a kéz meglétével
Q7120 Mindkét alkar és kéz veleszületett hiánya
Q7130 Kéz és ujj(-ak) veleszületett hiánya
Q7140 Az orsócsont megrövidülése
Q7150 A singcsont megrövidülése
Q7160 Rákolló-kéz
Q7180 A felső végtag(-ok) egyéb redukciós defektusai
Q7190 A felső végtag redukciós defektusa, k.m.n. Nem meghatározott végtag redukciós defektusai
Q7300 Nem meghatározott végtag(-ok) veleszületett hiánya (Amelia k.m.n.)
Q7310 Nem meghatározott végtag(-ok) proximális végének hiány (Phokomelia k.m.n.)
Q7380 Nem meghatározott végtag(-ok) egyéb redukciós defektusai
Q7300 Nem meghatározott végtag(-ok) veleszületett hiánya
Q7310 Nem meghatározott végtag(-ok) proximális végének hiánya
Q7380 Nem meghatározott végtag(-ok) egyéb redukciós defektusai
Q7400 A felső végtagok és vállöv egyéb veleszületett rendellenességei Járulékos kéztőcsontok, Dysostosis cleidocranialis, Macrodactylia, Madelung-féle deformitás, Orsócsont-singcsont synostosis, Sprengel féle deformitás, Triphalangealis hüvelykujj
Q7430 Arthrogryposis multiplex congenita
Q7480 Egyéb meghatározott veleszületett végtagrendellenességek
Q7490 A végtag(-ok) k.m.n. veleszületett rendellenessége
1. A protokoll alkalmazási, érvényességi területe
Kézsebészet, ortopédia, gyermeksebészet, gyermekgyógyászat, plasztikai sebészet, radiológia, rehabilitáció, genetika.
2. A protokoll bevezetésének alapfeltétele
A betegség diagnosztikájának és terápiájának egységes szemlélete a kézfejlődési rendellenességekkel foglalkozó szakmákban.
3. Definíció
Endogén és exogén okokra visszavezethető embriót ért olyan károsodás, mely során az intrauterin életben a kéz fejlődése zavart szenved, a kéz deformáltsága már születés után azonnal felismerhető. Minden kézfejlődési rendellenesség specifikus, más fejlődési rendellenességgel társulhat. A Nemzetközi Kézsebészeti Társaság (International Federation of Societies for Surgery of the Hand) Swanson és munkatársai által (1976, 1983) kidolgozott beosztást használja, mely morfológiailag hét csoportba osztja a kéz fejlődési rendellenességeit. (5, 7, 13) (A típusú evidencia)
I. Részek kifejlődésének zavara (arrest of development)
II. Részek differenciálódási zavara (separation)
III. Kettőződés (duplications)
IV. Túlnövekedés (overgrowth, gigantism)
V. Alulnövekedés (hypoplasia)
VI. Veleszületett lefűződési szindróma (constriction hand syndrome)
VII. Generalizált csontvázdeformitás (skeletal abnormalities)
3.1.Kiváltó tényezők
Endogén (örökletes) és exogén (intrauterin életben ható károsító tényezők) okokra vezethető vissza a kialakulásuk. (5,7,13) (A típusú evidencia)
Endogén: Polydactylia (13-as kromoszóma trisomia), Brachydactylia (21-es kromoszóma trisomia), Hüvelykujj hiány (13q kromoszóma -syndróma), valamint a hasadtkéz is családi okokra vezethető vissza.
Exogén: A transversalis végtaghiányok kialakulása összefüggésbe hozható a menstruáció utáni 35-50. napon szedett altatók, nyugtatók pl Contergan káros mellékhatásával, ugyanis ebben az érzékeny szakaszban alakul ki a felső végtag distalis része. (7, 11, 13) (A típusú evidencia)
3.2.Kockázati tényezők
Azoknál a szülőknél, akik gyermekén genetikai okokra visszavezethető kézfejlődési rendellenességet észlelnek, további gyermekvállalás esetén humángenetikai vizsgálat javasolt. (A típusú evidencia) (7, 11, 13)
4. Panaszok, tünetek, általános jellemzők
Csoportonként változnak. Az alábbiakban a Swanson által javasolt morfológiai felosztást ismertetjük. (5,7,13) (A típusú evidencia)
1. Részek kifejlődésének zavara (arrest of development)
| A) Tranzverzális | B) Longitudinális | C) Intersegmentalis (phocomelia) |
| váll | radialis sugár | |
| felkar | ulnaris sugár | |
| könyök | centrális sugár (hasadás) | |
| alkar | ||
| csukló | ||
| carpus | ||
| metacarpus | ||
| phalanx |
2. Részek differenciálódási zavara (separation)
| A) Lágyrész érintettség | B) Csontos érintettség | C) Veleszületett tumorszerű elváltozás |
| arthrogryphosis | váll | haemangiómás |
| váll | könyök synostosis | lymphaticus |
| könyök és alkar | alkari synostosis neurogen | |
| csukló és kéz | csukló és kéz | kötőszövetes |
| - cutan syndactylia | - ossealis syndactylia | csontos |
| - camptodactylia | - carpalis synostosis | |
| - thumb-in-palm | - symphalangia | |
| -deviáló ujj | - clinodactylia |
3. Kettőződés (duplications) egész végtag humerus
radius
ulna (tükör kéz)
ujj
- radialis polydaktylia
- centralis polydaktylia
- ulnaris polydaktylia
4. Túlnövekedés (overgrowth, gigantism)
egész végtag
a végtag egy része ujj (macrodaktylia)
5. Alulnövekedés (hypoplasia)
egész végtag
egész kéz metacarpus
ujj
- brachysyndactylia
- brachydactylia
6. Veleszületett lefűződési szindróma (constriction hand syndrome)
lefűződés
acrosyndaktylia
intrauterin
amputáció a fentiek kombinációja
7. Generalizált csontvázdeformitás (skeletal abnormalities)
kromoszóma abnormalitás
más generalizált abnormalitás
5. A betegség leírása
Az alábbiakban sebészeti szempontból leggyakoribb kézfejlődési rendellenességeket a következőképen csoportosíthatjuk. (5, 7, 13) (A típusú evidencia)
- Syndactylia
- Lefűződési szindróma
- Hasadtkéz
- Polydactylia
- Oligodactylia
- Méretbeli variációk
- Veleszületett kontraktúrák és deviációk
5.1. Syndactylia
A kéz fejlődése során az ujjak szétválása nem történt meg az intrauterin 6-8 héten, az ujjakat bőrhíd és bizonyos esetekben csont köti össze.
Formái:
Syndactylia cutanea
Syndactylia ossea
Komplikált syndactylia (más szindrómával társult)
5.1.1. Érintett szervrendszer
A kéz ujjai. Az ujjak összenövése alakilag lehet komplett és inkomplett. A másik felosztás azon alapszik, hogy milyen képletek érintettek az összenövésben, így megkülönböztetünk egyszerű (syndactylia cutanea) és komplex (syndactylia ossea) ujjösszenövést. Az utóbbi esetében gyakoribb a rendellenes ín, izom és neurovascularis elrendeződés. (3, 5, 7) (A típusú evidencia)
5.1.2.Genetikai háttér
Autoszomális domináns öröklődés. (3, 5, 7, 11, 13) (A típusú evidencia)
5.1.3.Incidencia - prevalencia
Kéz leggyakoribb fejlődési rendellenessége, incidencia 1:1000 (11,13) (A típusú evidencia)
5.1.4.Morbiditás, mortalitás
Önállóan vagy más szindrómával együtt jelentkezik, Apert szindróma (Acrocephalosyndactylia), Hasadt kézhez társult syndactylia, Symbrachydactylia, Polysyndactylia (5, 7, 11, 13) (A típusú evidencia)
5.1.5.Jellemző életkor
Születéskor már észlelhető elváltozás.
5.1.6.Jellemző nem
A fiúknál 70%-val gyakrabban fordul elő, mint a lányoknál (13) (B típusú evidencia)
5.2.Lefűződési szindróma
Amputációs csonkhoz hasonló felszín alakul ki a végtagon. Négy formája van, mely egyenként és együtt is előfordulhat. 1/ egyszerű gyűrű leszorítás, 2/ gyűrű leszorítás a distalis rész deformálódásával lymphödémával vagy anélkül, 3/ gyűrű leszorítás a distalis rész lágyrész összeköttetésével, 4/ intrauterin amputáció
(5, 7) (A típusú evidencia)
5.2.1.Érintett szervrendszer
Az ujjak dorzális oldala, kéz, alkar, felkar. A leszorítás lehet sekély vagy mély. A musculoskeletalis és neurovascularis képletek lehetnek elvékonyodottak vagy teljesen megszakítottak.
5.2.2.Genetikai háttér
Nagy valószínűséggel genetikai okokra vezethető vissza, de az exogén faktorok szerepe sem kizárt. (5) (B típusú evidencia)
5.2.3.Incidencia - prevalencia
1:15 000 születéshez. (7) (B típusú evidencia) Magyarországi adat nem áll rendelkezésre.
5.2.4.Morbiditás, mortalitás
Acrosyndactyliával együtt járhat. (7)
5.2.5.Jellemző életkor
Születéskor már észlelhető elváltozás.
5.2.6.Jellemző nem
Mindkét nemben egyforma gyakorisággal fordul elő. (7) (B típusú evidencia)
5.3.Hasadtkéz (centrális hypoplasia)
5.3.1.Érintett szervrendszer
Enyhébb esetben csak a középső ujj ujjpercei hiányoznak, a metacarpus érintetlen. Súlyosabb formában az egész középső ujj sugara hiányzik és mély hasadás osztja ketté a kezet. A középső ujjon kívül a gyűrűs és a mutatóujj is hiányozhat. Rendszerint kétoldali, gyakran a láb is érintett, a meglevő részek normális méretűek, a legsúlyosabb esetben csak a kisujj érintetlen. Syndactylia lehet a szétvált ujjak között. (3, 5, 7, 13) (A típusú evidencia)
5.3.2.Genetikai háttér Domináns öröklődésű (5, 7, 11, 13) (A típusú evidencia)
5.3.3.Incidencia - prevalencia, morbiditás, mortalitás
0.4:10 000 születésre. (11) (B típusú evidencia) Magyarországi adat nem áll rendelkezésre
5.3.4.Jellemző életkor
Születéskor már észlelhető elváltozás.
5.3.5.Jellemző nem
60%-ban gyakoribb fiúknál. (5) B-típusú evidencia)
5.4.Polydactylia
A kéz normálisan meglevő öt ujján kívül számfeletti ujj jelenik meg, mely lehet teljes ujj vagy csökevényes forma.
5.4.1. Érintett szervrendszer
-Radiális polydactylia: a hüvelykujj duplázódása
-Centrális polydactylia: legtöbbször a mutató és a gyűrűsujj duplázódása syndactyliával együtt.
- Ulnáris polydactylia: duplázódott kisujj, gyakran kétoldali.
-Tükörkéz: a radius és a hüvelykujj hiányzik, a carpus és az ulna duplázódott. A 7-8 ujj normálisan fejlett, de flexióban akadályozott. A csukló és könyökmozgás zavart. A nervus ulnaris is duplázódott. (3, 5, 14) (A típusú videncia)
5.4.2.Genetikai háttér
13 kromoszóma trisomia (ulnaris polydactylia) (11,13) (A típusú evidencia)
5.4.3.Incidencia - prevalencia
A fehér népességnél 1:3.000 az élve születetteknél. A sötét bőrű gyerekeknél 1.3% az ulnaris polydactylia incidenciája. (7) (B típusú evidencia)
5.4.4.Morbiditás, mortalitás
Több szervet érintő fejlődési rendellenességgel járhat pl.: Ellis-van-Creveld- syndróma, Carpenter-syndróma (7) (B típusú evidencia)
5.4.5.Jellemző életkor
Születéskor már észlelhető elváltozás.
5.4.6.Jellemző nem
Mindkét nemben egyforma gyakorisággal fordul elő. (5) (B típusú evidencia)
5.5.Oligodactylia
Ide soroljuk az ujjhiányt, az ujjsugár hiányt és a csökevényesen fejlődő ujjat (hypoplasia). (5)
5.5.1.Érintett szervrendszer
Hüvelykujj hypolasia, aplasia (gyakran kétoldali) (3,5,7) (A típusú evidencia) Ujj hypoplasia vagy aplasia
5.5.2.Genetikai háttér
A hüvelykujj hiány a 13q kromoszómához köthető. (5,7,11,13) A típusú evidencia)
5.5.3.Incidencia - prevalencia
Az IFSSH (International Federation of Societies for Surgery of the Hand) Veleszületett betegségek Bizottsága Lamb és munkatársai bevonásával felmérést végzett 1982-ben, a világ hét különböző klinikájának adatait felhasználva és megállapították, hogy évente 18 deformitás esik 10 000 lakosra. Magyarországi adat nem áll rendelkezésre. (11, 3) (B típusú evidencia)
5.5.4.Morbiditás, mortalitás
A hypoplasia és a brachydactylia más csoportban is megtalálható, mint pl. syndactylia, clinodactylia, camptodactylia, duplikáció. (5,7,13) (A típusú evidencia)
A hüvelykujj hypoplasiában több súlyosságú fokozatot lehet elkülöníteni: 1. a hüvelykujj csökevényes, de valamennyi anatómiai képlet megtalálható, 2. csökevényes, instabil hüvelykujj a thenár izom hiányával, 3. csökevényes hüvelykujj, az I. metacarpus hypoplasiás vagy részben hiányzik, 4. csökevényes hüvelykujj hiányzó I. metacarpussal, 5. teljesen hiányzik a hüvelykujj. (5, 7) (A típusú evidencia)
5.5.5.Jellemző életkor
Születéskor már észlelhető elváltozás.
5.5.6.Jellemző nem
Mindkét nemben egyforma gyakorisággal fordul elő. (5) (B típusú evidencia)
5.6.Méretbeli variációk
Brachydactylia: mindhárom phalanx vagy csak a metacarpus csontos részének megrövidülése.
Hüvelykujj triphalangia: két formája ismert, az egyik esetben a hüvelykujj a hosszú ujjakhoz hasonló és hiányzik vagy atrophiás a thenár izomzat (Dolichophalangia). A másik esetben a középső perc a három phalanxból ék alakú és emiatt az oppositió, a kulcsfogás nehezített, a komisszúra is beszükült (Brachymesophalangia).
Hyperphalangia: legtöbbször az alapperc harántirányú szegmentációja és brachymesophalangiával. A kéz funkciója jó. (5,7,13) (A típusú evidencia)
5.6.1.Érintett szervrendszer
A rövidülés kiterjedhet mindhárom phalanxra vagy a metacarpusra is.
5.6.2.Genetikai háttér
Brachydactylia (21-es kromoszóma trisomia) (5,7,11,13) (A típusú evidencia)
5.6.3.Incidencia - prevalencia
Az IFSSH (International Federation of Societies for Surgery of the Hand) Veleszületett betegségek Bizottsága Lamb és munkatársai bevonásával felmérést végzett 1982-ben, a világ hét különböző klinikájának adatait felhasználva és megállapították, hogy évente 18 deformitás esik 10 000 lakosra. Magyarországi adat nem áll rendelkezésre. (11, 13) (B típusú evidencia)
5.6.4.Morbiditás, mortalitás
5.6.5.Jellemző életkor
Születéskor már észlelhető elváltozás.
5.6.6.Jellemző nem
Mindkét nemben egyforma gyakorisággal fordul elő. (5) (B típusú evidencia)
5.7. Veleszületett kontraktúrák és deviációk
Formái: Atipikus csontosodási zavar Klinodactylia, Kirner-deformitás, Symphalangia, Madelung deformitás Kamptodactylia Macrodactylia Veleszületett synostosis Radial clubhand (dongakéz radius hiánnyal) Ulnar clubhand (dongakéz ulna hiánnyal) (7)
5.7.1.Érintett szervrendszer
Kéz, alkar, felkar
5.7.2.Genetikai háttér
Endogen és exogén hatások egyaránt szerept játszanak ezen betegségek kialakulásában.
5.7.3.Incidencia - prevalencia
Az IFSSH (International Federation of Societies for Surgery of the Hand) Veleszületett betegségek Bizottsága Lamb és munkatársai bevonásával felmérést végzett 1982-ben, a világ hét különböző klinikájának adatait felhasználva és megállapították, hogy évente 18 deformitás esik 10 000 lakosra. Magyarországi adat nem áll rendelkezésre. (11,13) (B típusú evidencia)
5.7.4.Morbiditás, mortalitás
Betegségenként változik.
5.7.5.Jellemző életkor
Születéskor már észlelhető elváltozás.
5.7.6 Jellemző nem
Betegségenként változik.
II. Diagnózis
1. Diagnosztikai algoritmusok
Születés előtti diagnózis
A születés előtti ultrahangos diagnózis egyre elterjedtebb, főleg az aplasia esetében informativ. Ez lehetőséget ad a szülők felkészítésére már a születés előtt. (11,13) (A típusú evidencia)
2. Anamnézis
A kéz fejlődési rendellenességét már a szülőszobán észlelik. A születés utáni neonatológiai és gyermekgyógyászati vizsgálat során további fejlődési rendellenességek után kell kutatni. Tisztázandó, hogy a családban fordult-e már elő kézfejlődési rendellenesség, érhette-e az anyát a terhessége alatt külső károsító tényező.
3. Fizikális vizsgálat
A felső végtagi veleszületett rendellenességek esetében alapos kivizsgálásra van szükség, mind a fizikális állapotot, mind a szellemi képességeket illetően.
3.1.Szenzibilitás vizsgálat. Általánosságban a veleszületett anomáliáknál normális a szenzibilitás.
3.2.Mozgásfunkció vizsgálata. Izomerő, ízületek aktív és passzív mozgásterjedelme.
3.3.A beteg általános és mentális képességei. A csökkent szellemi kapacitású gyermeknek is szüksége van a kézfunkcióra, ha lehetséges, akkor mindkét oldalon, de a funkcionális végeredmény a vártnál szerényebb lehet.
3.4. A mobilitást befolyásoló gerincvelő vagy alsó végtag rendellenességei. Ilyen esetekben a felső végtagra még fontosabb feladat hárul a segédeszközök használatával kapcsolatosan vagy az ágyból a kerekesszékbe történő átszállás során. Ehhez legalább egy aktív könyöknyújtásra alkalmas felső végtaggal kell rendelkeznie. (13)
4. Kötelező diagnosztikai vizsgálatok
4.1.Laboratóriumi vizsgálatok
A diagnózishoz nem feltétlenül szükséges.
4.2.Képalkotó vizsgálatok:
A röntgen az újszülött korban még nem olyan informatív, mint később néhány hónapos korban, a műtétet megelőzően. Ekkor, ha csontot is érintő elváltozásra van gyanú, 2 irányú összehasonlító kéz-alkar röntgen felvétel készítése ajánlott. (5, 7, 13) (A típusú evidencia)
Esetleg fénykép vagy videofelvétel a műtét előtti alaki és funkcionális elváltozás dokumentálására. (13) Angiographia: pl. syndactylia bizonyos formáiban a keringés tisztázása, műtéti tervezés céljából. (5, 7, 8, 12) (A típusú evidencia) Doppler vizsgálat (13)
4.3.Egyéb:
A felső végtagi anomália egy nagyobb fejlődési rendellenesség része lehet. Erre is gondolnunk kell a vizsgálat során. Pl.: VATER asszociáció (vertebral, anal, tracheo.oesophageal, radial club hand) vagy a VACTERL (az előbbi kombináció kiegészítve cardiális és renális anomáliával) (13)
5. Kiegészítő diagnosztikai vizsgálatok
Ld. még 4.3. Haematológiai vizsgálat ajánlott radial club hand esetében thrombocytopénia kizárása céljából. (13)
6. Differenciál diagnosztika (A szintű evidencia - 27)
- Szüléskor elszenvedett plexus brachiális sérülés
- Kézsérülés.
- Lefűződési szindróma esetén a hypoplasticus ujj
III. Terápia
Általános kezelési elvek
A cél a lehetséges maximális felső végtagi funkció elérése, ami esetenként változik, de nem elhanyagolható a kozmetikai megjelenés sem.
III/1. Nem gyógyszeres kezelés
A típusú evidencia alapján:
1. A megfelelő egészségügyi ellátás szintje
A szakmai minimumfeltételek alapján
2. Általános intézkedések:
Neonatológai és gyermekgyógyászati kivizsgálás, a műtéti időpont meghatározása, a szülők felvilágosítása a kezelési lehetőségről.
Speciális ápolási teendők:
A korai felismerés és a kézsebészetben jártas orvossal történő konzultáció fontos. A fizioterápia, az ergoterápia, az ortézisek alkalmazása már újszülött korban elkezdhető. A proximális részek hiánya esetén a beteg protézissel ellátható. A konzervatív kezelés a pre-és posztoperativ szakban a kezelési terv fontos részét képezi. Az esetlegesen társult egyéb fejlődési rendellenesség kezelése. (13) Fizikai aktivitás
Gyógytornász, ergoterápeuta passziv és dinamikus sineket helyeznek fel. A gyermekeknél játékos formában vizsgáljuk a markolás képességét. (13)
3. Betegoktatás
A műtét részletes megbeszélése a szülőkkel, a műtéti időpontok egyeztetése a gyermek fejlődését, iskoláztatását és az esetleges egyéb műtéti beavatkozásokat is figyelembe véve. Felhívni a kockázati tényezőkre a figyelmet. A szülő felvilágosításakor ügyeljünk, hogy ne tápláljunk hiú reményeket a bennük, ne adjunk okot a félreértésre. Vázoljuk a kezelési tervet. Térjünk ki arra is, hogy milyen műtétek várhatók, a keletkezett hegek esetleg látható helyen lesznek a kézen. Végül a szülő írásos beleegyezését csatoljuk a dokumentumokhoz. (3,5,13)
III/2. Gyógyszeres kezelés
A beteg egyéb betegségének megfelelően. A preoperativ szakban anaesthesiológiai protokollnak megfelelő premedicatio, postoperatív fájdalomcsillapítás, folyadék és ionháztartás korrekciója, szükség esetén antibioticum.
Terápiás algoritmus
III/3. Műtét
1.A megfelelő egészségügyi ellátás szintje
Ortopéd osztály, kézsebészeti osztály, plasztikai sebészeti osztály. Előnyös, ha a műtétet végző orvos kéz és mikrosebészetben is jártas.
2.Általános intézkedések
A műtét előtti gyermekgyógyászati kivizsgálás lehetőség szerint ambuláns módon történjen, a választott műtéti időpont előtti hetekben.
Az aneszteziológiai vizsgálatot előnyös, ha a gyerekgyógyászatban járatos altatóorvos végzi.
3.Speciális ápolási teendők
Az egyébként szokásos műtétek utáni ápolásra, ellátásra van szükség műtéti típustól függően, Előnyös, ha az operált gyermeket gyermeksebészeti osztályon vagy részlegen helyezik el a perioperativ szakban. (13)
4.Sebészi kezelés
A műtéti technika megfelel a kézsebészetben alkalmazott elveknek, vértelenítő alkalmazása, kézsebészeti műszerek, szükség esetén akár mikroszkóp használata is, korrekt metszésvezetés, stabil osteosynthesis, bőrdefektusok esetén lebenyelforgatás, bőrplasztika.
A bőrgraftok esetén a teljes vastagságú bőr több előnnyel rendelkezik a részvastag bőrrel szemben, mert nem zsugorodik, együtt nő a gyerekkel, nem színeződik el. Az elforgatott érnyeles lebenyek adják a legjobb eredményt kozmetikailag és funkcionálisan is. (1,7,13) (A típusú evidencia) A műtét időzítése: a vita tárgyát képezi. Szempont: amilyen hamar csak lehet, lehetőleg a növekedés befejeződése előtt. Néhány beavatkozást már egy-két hetes korban el kell végezni pl lefűződési szindrómák, de a legtöbb műtétet csak 6-18 hónap között. A hosszabb, több órán át tartó műtéteket pl.: a kézre történő mikroszkópos lábujjátültetést 2 és 4 éves kor közötti időszakra érdemes halasztani. Az egyszerűbb hüvelykujjképzést (pollicisatio) funkcionális okokból korábban is elvégezhetjük. Gyakran előnyös kis lépésekben haladni előre. A többszöri beavatkozást úgy kell megtervezni, hogy az a beiskolázási korra véget érjen.
4.1. Műtéti indikáció
A kéz jó funkciójához jó váll és könyökmozgásra van szükség. A műtéti terv felállításánál elsődleges a funkció, a kozmetikai megjelenés csak másodlagos.
Főbb szempontok:
Funkció
a) - oppositio kialakítása amennyiben lehetséges
b) - külön mozgó ujjak pl.:syndactylia szétválasztása
c) - megfelelő ujjhossz és interphalangealis mozgás pl.: markolás
d) - érző tenyér mozgó csuklóval
e) - transverzalis hiányoknál a könyök aktiv mozgása
f) - thoraco-humeralis fogás rövid kar esetén (13)
Kozmetikai megjelenés
Az ujjak száma, formája, hossza, mozgása egyaránt fontos a kéz megjelenésében.
Protézis
Az egyszerű protézis proximális hiányoknál már egy vagy két éves korban is alkalmazható majd később tíz éves kor környékén lehetőség szerint myoelectromos protézisre cserélhető.
4.2. Műtéti előkészítés
Hasznos, ha a műtétet egy ergoterápiás funkciós és terhelési teszt előzi meg, mely kiterjed a végtag körfogatra, speciális izomcsoportokra, azok feszességére, a beteg koncentrációs képességére, kooperációjára.
4.3. Műtéti érzéstelenítés
Aneszteziológiai protokoll szerint.
A bőrfűggeléken lógó számfeletti ujj helyi érzéstelenítésben is eltávolítható.
4.4. Műtét
Syndactylia
A cél puha, hegnélkűli komisszura képzése Z-alakú metszésvezetéssel, lebenyelforgatással, teljes vastagságú bőrgraft átültetésével, Z-plasztikával, V-Y plasztikával egy vagy két éves korban. A néhány hetes korban végzett beavatkozások estében a bőr jobban nyújtható, kevés a subcután zsír és gyakran bőr átültetés nélkül is elvégezhető az ujjak szétválasztása. Az ujjak szétválasztásakor érdemes meggyőződni, hogy marad-e tápláló artéria a leválasztott ujjban. Az ideg ritkán okoz ilyen jellegű problémát. Ha az MP ízűlettől distalisan csontos vagy inas összeköttetés van, ezt is szét kell választani. Súlyosabb esetekben osteotomia esetleg csontrövidítés is végezhető. A csont stabilizálására vékony Kirschner drótot használunk. Műtéti szövődményként jelentkezhet az ujj keringészavara, amely az ujj elvesztését jelentheti. Az infectio ritka, előfordulhat a lebeny elhalása, a graft lelökődése, hegképződés az ujjon vagy a redőben. Az ujjak szétválasztása során az ideg vagy az ín sérülhet, ezeket a szokásos módon el kell látni.
Lefűződési szindróma
A súlyosabb leszorításos esetekben még újszülöttkorban szükséges elvégezni a műtétet a distalis rész megmentésének reményében, egyébként az esetek többségében később is el lehet végezni a beavatkozást kozmetikai és funkcionális okokból. A műtét célja a funkció nélküli ujjmaradványok amputációja vagy a funkcionálisan fontos lefűzött képletek megmentése korai műtéttel, legtöbbször többszörös Z-plasztikával vagy V-Y-plasztikával, amit majd később ismételni lehet az ujj növekedése miatt. Bizonyos esetekben ujjhosszabbításra is szükség van, ami a hagyományos módon történik. Műtéti komplikáció lehet a szöveti nekrózis illetve a sebgyógyulási zavar.
Hasadtkéz
A műtét célja a syndactylia szétválasztása, a hasadék kisebbítése. Flexiós contractura esetén a húzó kötegeket eltávolítjuk és Z-plasztikát végzünk. Szükség lehet még a hüvelykujj adductiós contracturájának oldására is, ez a II sugárnak a III sugárra történő osteotomiájával történhet.Az eset súlyosságától függően egy vagy két beavatkozásra van szükség. A műtétet 3-4 éves korig érdemes befejezni.
Polydactylia
A csak lágyrészen lógó számfeletti ujjat local anaesthesiában a szülés utáni első hetekben eltávolíthatjuk. Radiális polydactylia: amennyiben a radialis hüvelykujj kisebb ezt érdemes eltávolítani. Amennyiben egyforma méretűek, a radialis hüvelykujjat eltávolítjuk és az ulnáris hüvelykujjat hagyjuk meg vagy hosszanti irányban felezhetjük mindkét hüvelykujjat és a centralis részt eltávolítva a maradék felezett ujjrészeket egyesítjük.
Centralis polydactylia gyakran több műtétet igényel. A nurovascularis anomáliákat csak a feltárás során lehet tisztázni. Polysyndactylia esetén korán el kell távolítani a járulékos ujjat, főleg, ha a normal ujjal egy ízületen vannak és törekedjünk valamennyi normál kinézetű ujj rekonstrukciójára. Ha idősebb a beteg, akkor ujjperc osteotomia, collateralis szalagképzés és kisízületi arthrodesis is szóba jön. Valamennyi betegnél cél a négy hosszú ujj helyreállítása, de a három ujj is elfogadható.
Ulnaris polydactylia ellátása hasonló a radialis polydactyliához.. Az ulnarisan levő számfeletti ujjat eltávolítjukTO/rör/céz: hüvelykujjat képzünk a legfejlettebb radialis ujjból és a többi számfeletti ujjat eltávolítjuk. Ha a csuklóízületben flexiós contractura észlelhető, a flexor carpi radialis izom dorzálisan áthelyezhető.
Oligodactylia
Hüvelykujj hypolasia esetén a kezelés a hypoplasia súlyosságától függ. A hüvelykujj hypoplasia enyhébb formája nem igényel kezelést, esetleg ha az ujj deviál, az osteotomiával korrigálható. Az instabil MP ízület szalagplasztikával stabilizálható, opponens plasztika mérlegelendő. Amennyiben az I metacarpus hypoplasias vagy hiányzik, úgy a csökevényes hüvelykujj eltávolítása után a mutatóujjat a neurovascularis kötegével együtt nyelezzük és átültetjük a hüvelykujj helyére, Kirschner dróttal rögzítjük.
A hypoplasiás és aplasias ujjak esetében több vélemény ismeretes a kezelést illetően. Amennyiben a másik kéz ép és van csuklómozgás az érintett oldalon, nem mindig szükséges műtétet végezni, megfelelő ortézissel kozmetikailag és funkcionálisan is kielégítő eredményt érhetünk el. A másik vélemény szerint lehetőség szerint operálni kell. Műtét során szét lehet választani az ujjösszenövést, rotációs osteotomiával, ujjhosszabbítással, ujjsugár kimélyítéssel ki lehet alakítani egy funkcionálisan jobb kezet. Egyénileg mérlegelendő mindkét lehetőség.
Méretbeli variációk
Brachydactylia: ékosteotomia, rotációs osteotomia, interpositios osteotomia vagy callus distractió alkalmazható a megrövidült metacarpus (Brachymetacarpia) meghosszabbítására.
Hüvelykujj triphalangia és hyperphalangia ritkán igényel kezelést, mivel a kézfunkció általában jó.
Veleszületett kontraktúrák és deviációk
A műtéti rekonstrukció az esetek súlyosságától függ, egyébként konzervatív. A clubhand rekonstrukcióját korán kell végezni.
Kamptodactylia: A sebészi kezelés végeredménye nem mindig jósolható meg, emiatt ritka a műtét. PIP ízületi extenziót elősegítő segédeszköz éjszakai viselésre jön még szóba konzervativ kezelésként, ennek használata felnőtt korig ajánlott.
Radial clubhand: Már a neonatalis korban el kell kezdeni a nyújtást, a sínrögzítést. A nyújtáshoz fixateur externe is használható, mellyel lassú distractiót is végezhetünk. Műtét során a cél a kéz centralizálása. Buck-Gramcko szerint a műtétet egy legkésőbb két éves korban kell végezni. A centralizált helyzet elérésekor Kirschner-drótot, fixateur externe-t használhatunk ennek megőrzéséhez. A flexor carpi radialis izom áthelyezhető csukló dorso-ulnaris oldalára és a csuklófeszítő inakhoz varrható. Ha az alkari izmok hiányoznak, akkor ulnocarpalis arthrodesis végezhető. Az első beavatkozás után fél évvel pollicizáció végezhető a mutatóujj felhasználásával.
(1, 2, 3, 4, 5, 6, 7, 8, 10,12,13,14,15,16,18) (A típusú evidencia)
4.5. Posztoperatív teendők
Syndactylia esetén fontos a megfelelő kötés a komisszúra képzéshez. Az ujjak közé puha gézcsíkokat helyezünk, majd lazán körbetekerjük a kezet az egész alkarra terjedően. A kézre rövid sínt helyezhetünk fel. A Kirschner drót a második héten eltávolítható.
A lefűződési szindróma estében is hasonlók a postoperatív teendők, mint a syndactyliánál.
A hasadt kéz esetében sín rögzítés ajánlott 6 héten át. (5,7,13) (A típusú evidencia)
A műtét menetének részletes leírása.
Az operált végtag keringésellenőrzése, szükség esetén a kötés lazítása, fájdalomcsillapítás.
5.Fizikai aktivitás
Műtéttől függően időzítjük a mozgást. Általában a korai postoperativ szakban nyugalomba helyezzük az operált végtagot, sínnel rögzítjük. Hetente cseréljük a kötést. Lágyrész műtétnél a mozgás 2-3 hét eltelte után már elkezdhető, csontos műtét után 6 hétig sínben rögzítjük a végtagot. Ezt követően a tűződrótot eltávolítjuk és elkezdjük a tornát. Általában néhány nappal a műtétek után a betegek hazaengedhetők.
6.Diéta
A kézfejlődési rendellenességhez társult egyéb fejlődési rendellenességnek megfelelően.
7.Betegoktatás
A szülőket a gyógytornával kapcsolatosan ki kell oktatni
A műtét utáni közvetlen szakban a hegek gyakran hypertrophicusak lehetnek, később néhány év múlva elhalványodhatnak.
IV. Rehabilitáció
Gyógytornász és ergoterápeuta segítségével már a preoperativ szakban elkezdődhet a foglalkozás, a műtét után közvetlenül az intézetben, majd később otthonában végezhető rendszeresen naponta a megtanult torna szülői felügyelettel. Bizonyos időszakonként kontroll vizsgálatokon ellenőrizzük az elért funkciót. Új és nehezített gyakorlatok csak fokozatosan vezethetők be.
V. Gondozás
1. Rendszeres ellenőrzés debridement
2. Megelőzés: Genetikai tanácsadás, terhesség alatti szűrés
3. Lehetséges szövődmények:
Intraoperativ szövődmények: - vérzés
- ideg, ér, ínsérülés
Postoperatív szövődmények: - feltárást igénylő haematóma képződés
- keringészavar, lebenyelhalás
- lebenylelökődés
- korai infectio, sebgyógyulási zavar
Késői szövődmények:
- késői infectió
A szövődmények elhárítása:
A kialakult és észlelt szövődmény azonnal megkezdett kezelése szakmai protokollok útmutatásai alapján. Az intraoperatív észlelt szövődmény műtőben történő ellátása, vérzéscsillapítás, mikroszkópos idegvarrat, a végtag keringését veszélyeztető érsérülés esetében mikroszkópos érvarrat, amennyiben az érsérülés a végtag keringését nem veszélyezteti, az ér leköthető. A postoperatív szakban észlelt haematóma műtőben, steril körülmények között történő kiürítése. Infectió gyanúja esetén a műtéti terület feltárása, tenyésztésvétel, seböblítés, drain, antibiotikus kezelés elkezdése. Bőrnecrosis esetén debridement. A seb feltisztulása után a bőrhiányos felület plasztikázása.
4. Kezelés várható időtartama/prognózis
A beteget a növekedés befejeződéséig gondozni kell
5. Az ellátás megfelelőségének indikátorai (szakmai munka eredményességének mutatói) A szükséges műtétek időben végzése, azt követően gyógytorna, ergoterápia Életminőség és kézfunkció meghatározása nemzetközi kérdőívekkel
Kezelés és ellenőrzés megfelelő intézetben, ennek megfelelő dokumentálása
VI. Irodalomjegyzék
1. Benatar N. Full-Thickness Skin Grafts from the Cubital Fossa for Syndactyly-Release Handchir Mikrochir Plast Chir 2004; 36: 186-188
2. Benatar N. Thumb Duplicatio-Simple Surgery for a Common Problem. Handchir Mikrochir Plast Chir 2004; 36: 137-140
3. Buck-Gramcko D, ed. Congenital malformation of the hand and forearm. London:Churchill Livingstone, 1998.
4. Cooney W.P, Wolf J, Holtkamp K, Dobyns J.H.Congenital Duplication of the Thum. Handchir Mikrochir Plast Chir 2004; 36:126-136
5. Dobyns J.H, Wood V.E, Bayne L.G. Congenital Hand Deformities. eds.Green's Operative Hand Surgery, Vol. 1, 4th edition. London: Churchill Livingstone, 1999.
6. Foucher G, Medina J, Lorea P, Pivato G, Szabó Zs. Pollicization in Congenital Differences
7. Handchir Mikrochir Plast Chir 2004; 36: 146-151
8. Kriegs-Au G.,.Scharizer E. Unterarm und Hand Carl Joachim Wirt: Praxis der Orthopädie" Georg Thieme Verlag, Stuttgart-New York 2001; 368-386
9. Mády Ferenc A kéz fejlődési rendellenességei. Szendrői Miklós: Ortopédia, 1. kiadás. Budapest: Semmelweis Kiadó, 2006;299-300
10. Ogino T. Teratogenic Mechanisms of Longitudinal Deficiency and Cleft Hand. Handchir Mikrochir Plast Chir 2004; 36: 108-116
11. Samson P, Salazard B, Magalon G. The "Bilhaut-Cloquet" Technique for Treatment of Thumb Duplication Handchir Mikrochir Plast Chir 2004; 36:141-145
12. Schwabe G.C., Mundlos S. Genetics of Congenital Hand Anomalies Handchir Mikrochir Plast Chir 2004; 36: 85-97
13. Szepesi Kálmán A kéz betegségei- Gyakoribb fejlődési rendellenességek. Vizkeleti Tibor: Az ortopédia tankönyve, 2. kiadás. Budapest: Semmelweis Kiadó, 1999;176
14. Tonkin M.A. An Introduction to Congenital Hand Anomalies. Handchir Mikrochir Plast Chir 2004; 36: 75-84
15. Tsuge Kenya AtlasderHandchirurgie. Hippokrates Verlag GmbH, Stuttgart, 1990.
16. Upton J. Simplicity and Treatment of the Typical Cleft Hand. Handchir Mikrochir Plast Chir 2004; 36: 152-160
17. Vízkelety Tibor Végtagfejlődési rendellenességek. Vizkeleti Tibor: Az ortopédia tankönyve, 2. kiadás. Budapest: Semmelweis Kiadó, 1999;48-49
18. Vízkelety Tibor Végtagfejlődési rendellenességek. Szendrői Miklós: Ortopédia, 1. kiadás. Budapest: Semmelweis Kiadó, 2006;105-108
19. Watson S.The principles of management of congenital anomalies ofthe upper limb. Arch Dis Child 2000;83:10-17
Kapcsolódó internetes oldalak:
http://www.sign.ac.uk/guidelines/index.html
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a makroreplantációról
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO S4810 A felkar traumás amputatiója
S5800 A könyök traumás amputatiója
S5810 Az alkar traumás amputatiója
S5890 Az alkar traumás amputatiója szint megnevezése nélkül
S6840 A kéz traumás csonkolása a csukló szintjében
1. A protokollok alkalmazási / érvényességi területe
Kézsebészet, traumatológia.
2. A protokollok bevezetésének alapfeltétele
II. és III. szintű balesetsebészeti és kézsebészeti ellátási jogosultság. Érsebészeti háttér. Mikroérsebészetben, érsebészetben járatos kézsebész szakorvos. Mikrosebészeti műszertálca. Atraumatikus varróanyagok 5-8, 10/0 kerek hegyes végű tűvel. Nagyítás: Lupe és operációs mikroszkóp. Bőrhőmérő, Mobil (zseb) Doppler készülék. Intenzív osztályos háttér. A fenti feltételek a nap 24 órájában az év minden napján rendelkezésre álljanak.
3. Definíciók
Replantációnak, azt a beavatkozást nevezzük, amikor teljes amputáció után a leválasztott részt visszaültetjük, a képletek helyreállításával nem csak az életben maradását, hanem a visszaültetett rész funkcióját is biztosítjuk. Replantációt nem csak teljes amputáció esetén, hanem azokban az esetekben is végzünk, amikor bizonyos lágyrész összeköttetések megmaradnak, azonban a részlegesen levágott végtagnak vagy végtagrésznek kimutatható keringése nincs.
Revascularisationak a részleges amputációk azon eseteiben végzett beavatkozást nevezzük, amikor a részleges amputáció után megmaradt lágyrész összeköttetés a leválasztott rész számára minimális keringést biztosít, ez azonban csak optimális esetben tudja életben tartani.
Makroreplantációról akkor beszélünk, ha a leválasztás a csukló vonalától, vagy a felső ugróízület vonalától proximalisan következett be. Az amputátumban nagyobb izom mennyiség található, mely ha az ischaemia tartós részlegesen vagy teljesen elhal és a keringés helyreállítás után az izomból kiszabadult myoglobin és a kálium szövődményeket okoz. Ld. Revascularisatios syndroma. Az anoxaemias idő helyes tárolás esetén sem lehet a fentiek miatt lényegesen hosszabb 6 óránál.
Nomenklatúra: Amputáció - az a sérülésforma, amikor a végtag vagy végtagok részeit, a sérülést okozó eszköz, vagy a sérülést okozó erő részlegesen, vagy teljesen leválasztja és az életben maradás kétségei mellett, igen súlyos funkciókárosodást eredményez.
Teljes amputáció - teljes amputációról akkor beszélünk, ha a csonk és a leválasztott rész között semmilyen összeköttetés nincs, megfelelő műtéti beavatkozás nélkül a levágott rész a továbbiak számára elveszett.
Részleges amputáció - részleges amputációról akkor beszélünk, ha a csonk és a levágott végtagrész között bizonyos összeköttetések maradnak. Maga az összeköttetés lehet bőr, ín, csont, izom, ideg vagy ér. A részleges amputáció műtéti megoldására két lehetőségünk van; replantáció vagy revascularisatio.
Ischaemiás vagy anoxaemias idő - az az időszak, mely a leválasztás, a keringés megszűnésének pillanatától, a keringés helyreállításáig tart. Makroreplantációnál ez + 4 C°-on való tárolásnál 6 óra. Hosszabb idő izomelhalást, myoglobin keringésbe jutását, vese tubulus károsodást, anuriat okoz.
3.1. Kiváltó tényezők: Éles metsző, vágó eszköz, fűrész által vagy szakítás, csavarásos mechanizmussal létrejövő sérülés.
4. Panaszok/Tünetek/Általános jellemzők:
Jellemző, hogy a levágott rész és csonk között összeköttetés nincs, vagy az összeköttetést a csonk és a levágott rész között valamilyen anatómiai képlet biztosítja. Ez lehet bőr, ideg, ér, ín és csont.
5. A betegség leírása
5.1.Érintett szervrendszer(ek): A sérülés a végtagot érinti, a felső végtagon a csukló, az alsó végtagon a felső ugróízület felett bármely magasságban.
5.2.Incidencia/Prevalecía/Morbiditás/Mortalitás Magyarországon: 1,000,000 lakosra évente kb. 1-2 ilyen sérült jut.
5.3.Jellemző életkor: A sérült általában munkaképes korosztályhoz tartozik.
5.4.Jellemző nem: Nem meghatározó.
6. Gyakori társbetegségek: Súlyos sérülések részjelensége is lehet, ezekben az esetekben, a visszaültetés mérlegelendő.
II. Diagnózis
1. Diagnosztikai algoritmusok
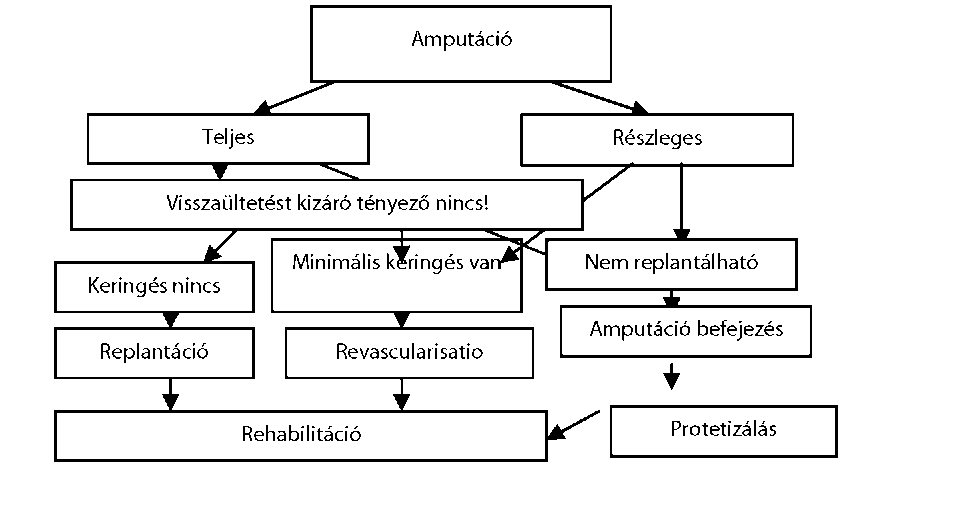
Anamnézis, fizikális vizsgálat, Rtg. vizsgálat szükséges a diagnózis felállításához
2. Anamnézis: A beteg csonkoló sérülésről számol be. A sértő eszköz, a sérülés mechanizmusa, a sérülés helye, ideje (óra perc), pontosan rögzítendő.
3. Fizikális vizsgálatok: A csonkolás magassága, a sebfelszínek, a roncsolás kiterjedése, az anatómiai sajátságokkal való összevetése fontos.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok:
4.1. Laboratóriumi vizsgálatok
Vérkép, haematokrit, (a vérveszteség megítélésére). Vércsoport meghatározás. Vérzési, alvadási idő, és az érzéstelenítés elvégzéséhez, altatáshoz szükséges laborok.
4.2. Képalkotó vizsgálatok
Kétirányú rtg. kép készítése. A levágott részben a csont állapotának meghatározása, amputátumban lévő további törés kizárása.
III. Kezelés
III/1. Műtét: lényege a levágott rész visszaültetése
1. A megfelelő egészségügyi ellátás szintje: II. III szint
2. Általános intézkedések: A műtét elvégzéséhez, a műtét utáni kezelés és ellenőrzés, valamint a szövődmények felismerésének és elhárításának feltételrendszerének adottnak kell lenni. Intenzív osztályos háttér szükséges.
3. Speciális ápolási teendők: Az első posztoperatív napokban intenzív osztályos megfigyelés szükséges. Műtét után a replantált végtag felpolcolása. Rendszeres, fél, illetve óránként a beteg keringési paramétereinek ellenőrzése és a visszaültetett rész keringésének, bőrszín, bőr hőmérsékletének ellenőrzése.
4. Sebészeti kezelés
4.1. műtéti indikáció: Replantáció, revascularisatio indikált, ha a csonkolás következtében a végtag funkciója elvész. A replantáció vagy revascularisatio indikációjának felállításakor figyelembe kell venni a beteggel kapcsolatos körülményeket, a sérülés formáját, magasságát, az ellátó intézet felkészültségét és felszereltségét, valamint egyéni mérlegelés alapján olyan szempontokat, melyek csak az egyénre, a sérülésre, annak funkcionális károsodására illetve ennek megszüntetésére irányulnak.
Abszolút indikált a visszaültetés: Bármely magasságban bekövetkezett végtag amputációnál, ha a beteg a műtét elvégzésére alkalmas, a sérülés az anatómiai képletek helyreállítását lehetővé teszik a jó funkció biztosítása érdekében. Pl.: Felkar esetén a három ideg sérülése olyan, hogy helyreállításával a funkció remélhetően visszatér.
Végtag visszaültetéseknél az indikáció a várható érző és mozgató funkciótól függ. A visszaültetett végtag nem fájhat, minimális érzésnek védő szenzibilitásnak kell lenni, és fontos még, hogy a beteg kisfokban mozgatni tudja. Az is ismert tény, hogy az amputációk 1/3 részében végezhető replantáció.
Az indikációt befolyásoló tényezők:
A beteg kora - Gyermekeknél mindenképpen, felkar magasságában középkorú betegeknél, alkar vonatkozásában ennél idősebbeknél is megkísérelhető. Általában egyéni mérlegelés szükséges az egyén regenerációs képességének figyelembevételével.
A beteg neme - Nem meghatározó.
A beteg általános állapota - egyéb betegségek a replantáció elvégzését behatárolhatják, egyéb megbetegedések, a hosszú műtétet kizárhatja.
Egyéb betegségek - súlyos rendszerbetegségek, malignus folyamatok kizárják a replantációt.
Műtéti kockázat - a hosszantartó műtétnek és postoperativ szövődmények elhárításának figyelembevétele fontos. Csak egészséges betegeket lehet terhelni, kiknek az életét nem fogja veszélyeztetni a replantácó.
Kooperációs készség - a beteg részéről bizonyos együttműködést el kell várni, máskülönben a replantáció funkcionálisan eredménytelen.
A leválasztás magassága azért fontos, mert a jó funkció más-más magasságban más anatómiai képletektől függ.
Leválasztás felszíneinek állapota: A replantáció elvégezhetőségét befolyásolja. Éles, guillotine szerű amputáció után a visszaültetés igen eredményes, az esélyek a roncsolódás kiterjedésével csökkennek. Szakításos, kicsavarásos mechanizmus esetén emeletes sérülésre számíthatunk, mely eredménytelenséghez vezet.
Súlyos roncsoló sérülések esetén a replantáció kilátástalan.
4.2. műtéti előkészítés:
4.3. műtéti érzéstelenítés: műtétet altatásban, végezzük.
4.4. műtét lépései:
4.4.1. A seb kimetszése mind a csonkon, mind a levágott részen. A képleteket izoláljuk. A levágott rész hűtőben marad, közvetlenül a visszaültetés előtt vesszük ki és végezzük el a sebkimetszést.
4.4.2 Osteosynthesis elvégzése. Terhelés vagy mozgásstabil osteosynthesist végzünk lemezzel, intramedullaris felfúrás nélküli reteszelt technikával, vagy fixateur externnel.
4.4.3. Arteria varrat. Vég a véghez, feszülésmentes anasztomózis, körkörös csomós öltéssel. Ha feszül a varratvonal, szabad véna áthidalást készítünk. Ez a vénák anasztomózisánál is érvényes.
4.4.4. Vénák varrata. Artériánként két véna helyreállítása szükséges, ha lehetséges, körkörös csomós varrat technikával.
A keringést az artéria és egy véna varrata után engedjük fel. Csak akkor, ha a végtagba a vér befolyásának és kifolyásának útja biztosított! Ezzel az anoxaemias időt csökkentjük
4.4.5. Belülről kifelé haladva, az izmok varrata.
4.4.6. Idegek varrata.
4.4.7. Vérzéscsillapítás. Redon drainek. Bőrvarrat. A műtét után gipszrögzítést alkalmazni tilos!
4.5. posztoperációs teendők: Két-három nap intenzív osztályos megfigyelés. A végtag felpolcolása, rugalmas kötés, anticoagulans (kis mólsúlyú heparinok) adása. A seb szennyezettségétől függően, antibiotikum adása. A beteg folyamatos észlelése. Fél, illetve óránkénti a visszaültetett végtag keringésének ellenőrzése, bőr hőmérséklet mérése.
5. Fizikai aktivitás: Felső végtag visszaültetés műtéte után a beteg 24 óra múlva felkelhet, sétálhat, a visszaültetett végtag lógatása.
6. Diéta: Dohányzás tilos
7. Betegoktatás: A beteget a passzív tornára, az együttműködésre ki kell oktatni.
III/2. Egyéb terápia (pszichoterápia, gyógyfoglalkoztatás stb.) Gyógytorna, első naptól indul a gyógytorna és motoros ideg helyreállítása után szelektív ingeráram terápia.
III/3. Az ellátás megfelelőségének indikátorai
A visszaültetett végtag keringése és funkciója határozza meg a visszaültetés eredményességét.
IV. Rehabilitáció
A rehabillitáció szükségességének paraméterei
Rehabilitáció a műtét utáni nap kezdődik és tart a végleges funkció kialakulásáig, illetve a végállapot eléréséig. Ha a mozgás érzés javulása megakad, helyreállító műtét jön szóba, ez az esetek 25-30 százalékában szükséges.
A rehabilitáció egyéni gyógytornából, ha motoros beidegzésében károsodott izom idegének helyreállítása megtörtént, szelektív ingeráram terápiából áll.
V. Gondozás
1. Rendszeres ellenőrzés: A betegek rendszeres ellenőrzést igényelnek. A műtét után intézetben legalább 8 napot töltenek. Az első héten igen szoros kontroll javasolt. Hazabocsátás után, két majd négy hetes korban rendeljük vissza. Egy hónap után három hetenként a gyógytorna effektivitását, az ideg regenerációt a Tinel jellel ellenőrizzük.
2. Lehetséges szövődmények Artériás, vagy vénás thrombosis. Vesekárosodás kialakulása.
A végtag részleges, vagy teljes elhalása. A seb gennyedése
2.1. Szövődmények kezelése: Artériás, vagy vénás thrombosis azonnali műtétet igényel: Thrombectomia és reanastomosis készítése, illetve értranszplantátum beültetése a megoldás. Kiegészítve; a anticoagulans terápiával, helyzettől függően plexus blokáddal illetve értágító adásával.
Hosszabb idejű keringés romlás esetén a visszaültetett végtag eltávolítása is szóba jön.
A veseműködés ellenőrzése szükséges. A vesekárosodást a nem megfelelő tárolás, az anoxaemias idő túllépése okozza. Izomelhalás, myoglobinuria, vesetubulus károsodás jön létre. Az állapot súlyosságától függően vízhajtás, dalízis, szükség esetén a visszaültetett végtag amputációja szükséges.
Gennyedés esetén a kezelése sebészi feltárás, szükség szerint antibiotikum adása javasolt. A kiterjedéstől függően a visszaültetett rész feláldozása is szóba jön.
3. Kezelés várható időtartama/Prognózis:
Intézeti kezelés általában egy hét, az ideális, szövődménymentes gyógyulás másfél két évet igényel. Szövődmények fellépte esetén a gyógyulás ennél is hosszabb. Kiegészítő műtétek is hosszabbíthatják a gyógyulási időt.
VI. Irodalomjegyzék
1. Ács Géza, Hargitai Ernő (szerk.) Gyermektraumatológia, Medicina 2001.
2. Biemer , E., Duspiva, W.: Rekonstruktive Mikrogefásschirurgie. Springer Verlag Berlin-Heidelberg-New York 1980.
3. Chen Z, Zhang J. Replantation of severed limbs: current status and prospects. Chin
4. Chew WY, Tsai TM. Major upper limb replantation. Hand Clin. 2001 Aug;17(3):395-410, viii. Review.
5. Cziffer E. Operatív töréskezelés, Springer 1997
6. Cobbett, J.R.: Microvascular Surgery. Surg.Clin.North.Amer. 47, 521 (1967)
7. Malt R., McKhann C.: Replantation of severed arms. J.A.M.A. 189, 716 (1964)
8. Med J (Engl). 1999 Oct;112(10):914-7. Review. No abstract available.
9. Nyárády J.; Vilmos Zs.; Kovácsy Á.: Felső végtag replantáció. Orvosi Hetilap l26: 3l3-3l6. 6.sz.(l985).
10. O'Brien, N.McC.: Microvascular reconstructive surgery. Curchill Livingstone Edinburgh London and New York 1977.
11. Papanastasiou S. Rehabilitation of the replanted upper extremity. Plast Reconstr Surg. 2002 Mar;109(3):978-81.
12. Sun Y. [The significance of successful experimental limb replantation in China] (Chi).] Zhonghua Yi Shi Za Zhi. 1986;16(4):210-2. Chinese. No abstract available.
13. Zhang J, Chen ZW. Retrospective of the replantation of severed limbs in the People's Republic of China: Current status and prospects. Microsurgery. 2002 Jan;22(1):39-43.
Kapcsolódó internetes oldalak
http://tra.sagepub.com/cgi/content/abstract/11/4/209
http://archsurg.highwire.org/cgi/content/summary/88/1/66
http://www.ncbi.nlm.nih.gov/pubmed/15630658
http://archsurg.ama-assn.org/cgi/content/summary/91/2/211
http://cat.inist.fr/?aModele=afficheN&cpsidt=20082313
A szakmai protokoll érvényessége: 2014. június 30.
VII. Melléklet
1. Érintett társszakmákkal való konszenzus:
Érsebészeti háttér biztosított kell, hogy legyen.
2. Dokumentáció, bizonylat: Az általános dokumentumokon túl műtét előtti és utáni fényképek, valamint a funkcióról készült képek ajánlottak.
A Nemzeti Erőforrás Minisztérium szakmai protokollja
A metacarpus - phalanx törésről
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO S6220 Az első metacarpus törése
S6230 A metacarpus egyéb csontjának törése
S6240 A kézközépcsontok többszörös törése
S6250 A hüvelykujj törése
S6260 A kéz egyéb ujjának törése
S6270 A kéz ujjainak többszörös törése
1. A protokollok alkalmazási/érvényességi területe
Kézsebészet, traumatológia, ortopédia.
2. A protokollok bevezetésének alapfeltétele
Szakmai minimum feltételeknek megfelelő kézsebészeti, traumatológiai, ortopédiai osztályok. Ott, ahol a személyi és tárgyi feltételek adottak.
3. Definíciók
A metacarpus, illetve phalanx fedett vagy nyílt elmozdulás nélküli vagy elmozdulással járó ízületi, ízületközeli vagy diaphysis törése.
3.1. Kiváltó tényezők
Elesés, tompa vagy éles tárgy okozta ütés
4. Panaszok/Tünetek/Általános jellemzők
Duzzanat, fájdalom, mozgásbeszűkülés, kóros mozgathatóság, crepitáció, nagy nyílt lágyrész roncsolódás
5. A betegség leírása
5.1.Érintettszervrendszer(ek)
A sérülés a kezet és részeit érinti
5.2.Incidencia/Prevalecia/Morbiditás /Mortalitás Magyarországon
Az összes sérültek 25-30%-a kézsérült
A törések 30-35%-a ízületbe hatoló törés
A kézsebészeti osztályok összbeteganyagának 70%-a kézsérülés - ebből 42% törés
5.3.Jellemző életkor
Leggyakrabban a munkaképes korosztály tartozik
5.4.Jellemző nem
A sérültek főleg férfiak
6. Gyakori társbetegségek: nem jellemzőek (az alkoholizmus azonban kiemelendő)
II. Diagnózis
1. Diagnosztikai algoritmusok
2. Anamnézis
A sérülés körülményei, a sérülés mechanizmusa, az esetleges sértő eszköz, a sérülés helye, ideje pontosan rögzítendő
3. Fizikális vizsgálatok
A sérült sugár vagy sugarak megtekintése, (duzzanat, bőrpír, definíciók). A fájdalmas terület megtapintása, kóros mozgathatóság, crepitáció.
Fájdalom vagy nem kivihető mozgások. Érzés vagy keringészavar detektálása.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok
4.1. Laboratóriumi vizsgálatok
Gyógyszerek, amelyek befolyásolhatják a laboratóriumi eredményeket Betegségek, amelyek befolyásolhatják a laboratóriumi eredményeket
4.4.1. Képalkotó vizsgálatok
RTG: A sérülés sugárra centrált 2 irányú rtg. felvétel, a metacarpus törés gyanúja esetén 3 irányú rtg. felvétel Labor vizsgálat: Vérkép, haematokrit, vérzési, alvadási idő, azaz a műtéthez és az érzéstelenítéshez szükséges laborok
III. Kezelés
Célja: a funkció helyreállítása, ill. a meglévő funkció megőrzése.
Törekedni kell: ízfelszín congruentiájának helyreállítása, dislocatiók (szöglet, rotatio, deviatio) megszűntetése vagy lecsökkentése, az elért repositios helyzet fenntartása konzervatív vagy sebészi úton, a lehető legkorábbi utókezelés megkezdése A töréseket 2 nagy csoportba soroljuk
1. Stabil törések haránt vagy csipkés felszín, ezeket konzervatívan kezeljük
Konzervatív kezelés: repositio+palmaris oldali gipszsín esetleg fémsín, rögzítési idő: 4-6 hét. Metacarpus és alapperc törések gipszben, a kp. és végperctöréseket lehet fém U sínben is rögzíteni.
2. Instabil törések: ferde, spirál, ékkitöréses darabos romtörés, ill. nyílt roncsolódással járó törések. Az instabil töréseket műtéttel kezeljük.
III/1. Műtét
1. A megfelelő egészségügyi ellátás szintje: II. III. szint
2. Általános intézkedések: A műtét elvégzésének a műtét utáni kezelés és ellenőrzés, valamint a szövődmények kezeléséhez a személyi és tárgyi feltételeknek meg kell lennie.
3. Speciális ápolási teendők: Műtét után a kar felpolcolása (elevatio). A műtétet követő 1,5 órával a compressios kötés felvágása, A beteg általános állapotának ellenőrzése.
Megfelelő fájdalomcsillapítás.
4. Sebészeti kezelés
4.1. műtéti indikáció: lásd előzőekben
4.2. műtéti előkészítés: friss esetben steril lapos fedőkötés, elektív műtét esetén az operálandó terület (metszés helye) szőrtelenítése, ill. fertőtlenítése, betakarása.
4.3. műtéti érzéstelenítés
4.4. műtét: friss esetben sebkimetszés, zúzott roncsolt lágyrészek eltávolítása az extensor ín eltartása vagy hosszanti megfelezése. Tört csontvégek kitakarítása (Kirschner dróttal, KFI mini csavarral, lemezzel, compressios hurokkal vagy fixateurrel az adott helyzetnek megfelelően.
Elektív műtét esetén dorsalis bőrmetszés, metacarpus törés esetén hosszanti, ívelt vagy "Z" formában, phalanx törés esetén ívelt metszéssel, az extensor ín hosszanti bemetszés után jutunk a tört csontvégek a csonthártya óvatos mobilizálása után végezzük el a repositiot, ill a stabilizálást.
A műtétet a mobilizált részek egyesítésével és silicon drain után bőrvarrattal fejezzük be. A sebzárást követően gipszsínt helyezünk fel, ennek idejét a műtét alatt elért stabilitás határozza meg.
Bizonyos esetekben rtg. képerősítő alatti percutan dróttűzéssel is rögzíthetjük a tört csontot.
Adaptatios fixatio: Kirschner drótos rögzítés
Functio stabil fixatio: rigid (csavar, lemez, fixateur)
Dynamics: compressio hurkos rögzítés (intra-,extraossealis)
4.5. postoperációs teendők
elevatio, compressios kötés felvágása, 24 óra múlva kötéscsere, drain kivétel, 10. nap varratszedés. Későbbiekben a műtét stabilitásától függően gipszeltávolítás, szakszerű óvatos aktív gyógytorna megkezdése.
5. Fizikai aktivitás: a gipszből kimaradt ízületek tornája (váll, könyök, ujjak)
6. Betegoktatás: kötésre vigyázni (nedvesség, piszok)
III/2. Egyéb terápia
A szakszerű, rendszeres gyógytorna a gipszlevétel után nélkülözhetetlen
IV. Rehabiltáció
A rehabilitáció, szükségességének paraméterei
A rehabilitáció a végleges functio kialakulásáig, ill. a végállapot eléréséig szükséges. A tornak elsajátítása után a beteg otthon is végezze, mert csak ez együttesen hozza meg a várt eredményt.
V. Gondozás
1. Rendszeres ellenőrzés: A beteg rendszeres ellenőrzést igényelnek. Egy hónap után havonta ellenőrizzük a gyógytorna effectivitását.
2. Lehetséges szövődmények: sebgyógyulási zavarok, gyulladás. A rögzítő anyagok kilazulása, ízületi contracturák
3. Kezelés várható időtartama/Prognózis: Intézeti kezelés 2-3 nap. A szövődménymentes gyógyulás 8-12 hét
VI. Irodalomjegyzék
1. Amadio PC, Beckenbaugh RD, Bishop AT, Cooney WP, DobynsrUH, Linscheid RL, Meland NB, Wood MB: Fractures of the hand and wrist. pp. 122-185. In Jupiter 18 (ed). Flynn's Hand Surgery. 4th Ed. Williams & Wilkins, Baltimore, 1991
2. Barton N: Internal fixation of hand fractures (editorial). J Hand Surg 14B:139-142, 1989
3. Büchler U, McCollam SM, OppikoferC: Comminuted fractures of the basilar joint of the thumb: Combined treatment by external fixation, limited internal fixation, and bone grafting. J Hand Surg 16A:556-560, 1991
4. Campbell RM Jr: Operative treatment of fractures of dislocations of the hand and wrist region in children. Orthop Clin North Am 21:217-243,1990
5. Greene TL, Noellert RC, Belsole RJ, Simpson LA: Composite wiring of metacarpal and phalangeal fractures. J Hand Surg 14A:665-669,1989.
6. Heim U, Pfeiffer KM: Small Fragment Set Manual. Internal Fixation of Small Fractures. 2nd Ed. Springer- Verlag, New York, 1982
7. O'Brien ET: Fractures of the hand and wrist region. pp. 319. 413. In Rockwood CA Jr, Wilkens KE, King RE (eds): Fractures in Children. 3rd Ed. JB Lippincott, Philadelphia, 1991
8. Pun WK, Chow SP, So YC, Luk KDK, Ngai WK, Ip Fl<, Peng WH, Ng C, Crosby C: Unstab1e phalangeal fractures: Treatment by AO. screw and p1ate fixation. J Hand Surg 16A:113-117, 1991
9. Rayhack JM, Bottke CA: Intraosseous compression wiring of disp1aced articular condylar fractures. J Hand Surg 15A:370. 373, 1990
10. Shehadi SI: Externallixation of metacarpal and phalangeal fractures. J Hand Surg 16A:544-550, 1991
11. Swanson TV, Szabo RM, Anderson DD: Open hand fractures: Prognosis and classification. J Hand Surg 16A: 101 - 107, 1991
12. Wray RC Jr: Fractures and joint injuries of the hand. p. 4628. In McCarthy JG (ed): Plastic Surgery. WB Saunders, Philadelphia, 1990.
13. Zimmerman NB, Weiland AJ: Ninety-ninety intraosseous wiring for internal fixation of the digital skeleton. Orthopedics 12:99-103, 1989
A szakmai protokoll érvényessége: 2014. június 30.
VII. Melléklet
1. Érintett társszakmákkal- való konszenzus: fizikotherápia, gyógytornászok
2. Dokumentáció, bizonylat: általános dokumentumokon túl ízületi mozgások mérése (flexio, extensoo) erőkifejtés mérése (expander)
A Nemzeti Erőforrás Minisztérium szakmai protokollja a mikroreplantációról
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO S6800 A hüvelykujj (teljes) (részleges) traumás csonkolása S6810 Egyéb kézujj (teljes) (részleges) traumás csonkolása S6820 Két vagy több kézujj kizárólagos traumás csonkolása S6830 Kézujj vagy részeinek, csukló, kéz egyéb részeinek együttes csonkolása S6840 A kéz traumás csonkolása a csukló szintjében S6880 A csukló és kéz egyéb részeinek traumás csonkolása S6890 A csukló és kéz traumás csonkolása a szint meghatározása nélkül
1. A protokollok alkalmazási/érvényességi területe
Kézsebészet, traumatológia, plasztikai sebészet
2. A protokollok bevezetésének alapfeltétele
II. III. szintű kézsebészeti ellátási jogosultság. Mikrosebészetben járatos kézsebész szakorvos. Mikrosebészeti műszertálca. Atraumatikus varróanyagok 8, 9, 10/0 kerek hegyes végű tűvel. Nagyítás: Lupe és operációs mikroszkóp. Bőrhőmérő mobil (zseb) Doppler készülék.
A fenti feltételek a nap 24 órájában az év minden napján álljanak rendelkezésre.
3. Definíció:
Replantációnak, azt a beavatkozást nevezzük, amikor egy teljes amputáció után a leválasztott részt visszaültetjük, a képletek helyreállításával nem csak az életben maradását, hanem a visszaültetett rész funkcióját is biztosítjuk. Replantációt nem csak teljes amputáció esetén, hanem azokban az esetekben is végzünk, amikor bizonyos lágyrész összeköttetések megmaradnak, azonban a részlegesen levágott végtagnak vagy végtagrésznek keringése nincs.
Revascularisationak a részleges amputációk azon eseteiben végzett beavatkozást nevezzük, amikor a részleges amputáció után megmaradt lágyrész összeköttetés a leválasztott rész számára minimális keringést biztosít, ez azonban csak optimális esetben tudja azt életben tartani. A legkisebb zavar esetén, pl.: gyulladás okozta ödéma, minimális leszorítás fellépte esetén ez a megmaradt keringés összeomlik és a leválasztott rész elhal.
Revascularisationál a funkciót biztosító képletek helyreállítását és a főtörzsi keringés helyreállítását végezzük.
Mikroreplantáció: Abban az esetben végzünk mikroreplantációt, ha a leválasztás a csuklóízület vonalától distalisan következik be. Mivel az izom mennyisége kevés, a visszaültetés megfelelő tárolás esetén 12 óra után is elvégezhető.
Nomenklatúra: Amputáció - az a sérülésforma, amikor a végtag vagy végtagok részeit, a sérülést okozó eszköz, vagy a sérülést okozó erő részlegesen, vagy teljesen leválasztja és az életben maradás kétségei mellett, igen súlyos funkciókárosodást eredményez.
Teljes amputáció - teljes amputációról akkor beszélünk, ha a csonk és a leválasztott rész között semmilyen összeköttetés nincs, megfelelő műtéti beavatkozás nélkül a levágott rész a továbbiak számára elveszett.
Részleges amputáció - részleges amputációról akkor beszélünk, ha a csonk és a levágott végtagrész között bizonyos összeköttetések maradnak. Maga az összeköttetés lehet bőr, ín, csont, izom, ideg vagy ér. A részleges amputáció műtéti megoldására két lehetőségünk van; replantáció vagy revascularisatio.
Ischaemias vagy anoxaemias idő - az az időszak, mely a leválasztás pillanatától, a keringés megszűnésének pillanatától a keringés helyreállításáig tart. Mikroreplantációnál, ha megfelelő a tárolás, 12 óra is lehet, mivel nincs vagy minimális az izom az amputátumban. (+ 4 C°-on tároljuk az amputátumot a visszaültetésig.)
3.1.Kiváltó tényezők:
Éles metsző vágó eszköz, fűrész által vagy szakítás, csavarásos mechanizmussal létrejövő sérülés.
3.2.Kockázati tényezők
4. Panaszok/Tünetek/Általános jellemzők:
Jellemző, hogy a levágott rész és csonk között összeköttetés nincs, vagy az összeköttetést a csonk és a levágott rész között valamilyen anatómiai képlet biztosítja. Ez lehet bőr, ideg, ér, ín és csont.
5. A betegség leírása
5.1.Érintett szervrendszer: A sérülés a kezet és részeit érinti.
5.2.Genetikai háttér
5.3.Incidencia/Prevalecia/Morbiditás/Mortalitás: Magyarországon 1 000 000 lakosra évente kb.: 100-150 beteg jut.
5.4.Jellemző életkor: Az alany általában munkaképes korosztályhoz tartozik.
5.5.Jellemző nem: A sérültek főleg férfiak.
6. Gyakori társbetegségek
Súlyos sérülések részjelensége is lehet, ezekben az esetekben, a visszaültetés mérlegelendő.
II. Diagnózis
1. Diagnosztikai algoritmusok
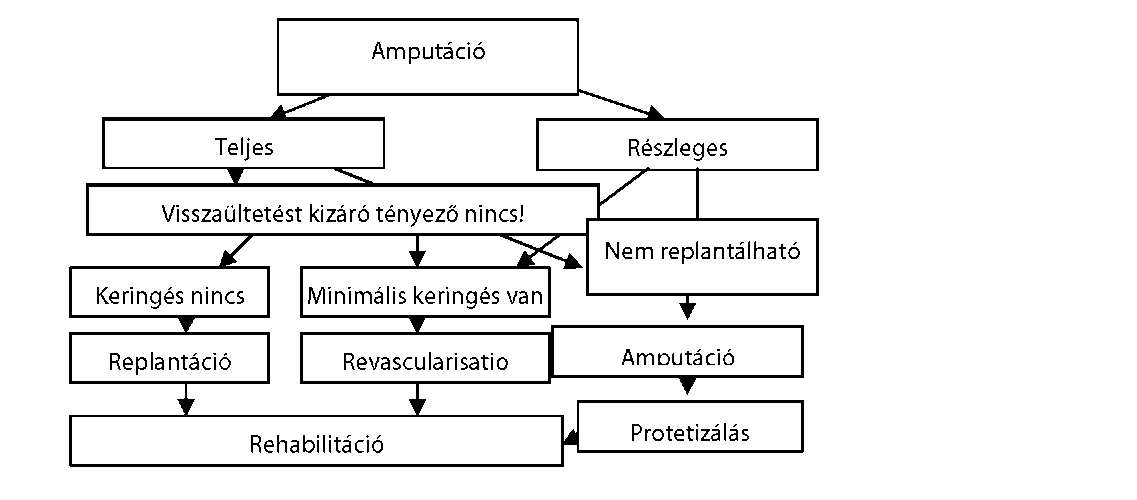
Anamnézis, fizikális vizsgálat, rtg. vizsgálat szükséges a diagnózis felállításához
2. Anamnézis: A beteg csonkoló sérülésről számol be. A sértő eszköz, a sérülés mechanizmusa, a sérülés helye, ideje (óra perc), pontosan rögzítendő.
3. Fizikális vizsgálatok: A csonkolás magassága, a sebfelszínek, a roncsolás kiterjedése, az anatómiai sajátságokkal való összevetése fontos.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok (felhasznált bizonyítékok, azok szintjei):
4.1. Laboratóriumi vizsgálatok: Vérkép, haematokrit, (a vérveszteség megítélésére). Vércsoport meghatározás. Vérzési, alvadási idő, az érzéstelenítés elvégzéséhez, altatáshoz szükséges laborok.
4.2. Képalkotó vizsgálatok Kétirányú Rtg. kép készítése. A levágott részben a csont állapotának meghatározása, amputátumban lévő további törés kizárása.
4.3. Egyéb
III. Kezelés
Műtét lényege a levágott rész visszaültetése.
1. A megfelelő egészségügyi ellátás szintje: II. III szint
2. Általános intézkedések: A műtét elvégzéséhez, a műtét utáni kezelés és ellenőrzés, valamint a szövődmények felismerésének és elhárításának feltételrendszerének adottnak kell lenni.
3. Speciális ápolási teendők Műtét után a kar felpolcolása. Rendszeres, fél, illetve óránként a beteg és a visszaültetett rész keringésének, bőrszín, bőr hőmérsékletének ellenőrzése.
4. Sebészeti kezelés
4.1. műtéti indikáció
Replantáció, revascularisatio indikált, ha a csonkolás következtében a kéz funkciója elvész. Itt is szem előtt kell tartanunk a minimális fogásra alkalmas kéz kialakítását. ("Basic hand").
A replantáció vagy revascularisatio indikációjának felállításakor figyelembe kell venni a beteggel kapcsolatos körülményeket, a sérülés formáját, magasságát, az ellátó intézet felkészültségét és felszereltségét, valamint egyéni mérlegelés alapján olyan szempontokat, melyek csak a sérültre, funkcionális és kozmetikai károsodására illetve ennek megszüntetésére irányulnak. Abszolút indikált a visszaültetés: Csukló és tenyér magasságában bekövetkezett amputációnál.
Ujjak vonatkozásában: A hüvelykujj replantáció abszolút indikációt jelent, két vagy több hosszú ujj amputációja szintén indikált. Egy hosszú ujj amputációja esetén csak akkor célszerű replantációt végezni, ha e sérülés mellett több ujj is sérült. Az is ismert tény, hogy az amputációk 1/3 részében végezhető replantáció.
Relatív kontraindikációt képez egy ujj leválasztása, szakításos sérülések, korábban sérült kéz, ujjak, hosszú meleg ischaemia esetei. Abszolút kontraindikált a visszaültetés súlyos állapotú betegeknél, fej üregi sérülések esetén, emeletes amputációknál kiterjedt roncsolódásoknál, és egyéb életveszélyes megbetegedéseknél. Az indikációt befolyásoló tényezők:
A beteg kora - gyakorlatilag minden korban végezhető replantáció, egészen kis gyermekeknél a replantáció lehetőségét az anatómiai képletek nagysága határozza meg, illetve az ezek helyreállításához szükséges műszerek és anyagok. Egy bizonyos méret alatt, ha nem megfelelő a műszerezettség, varró anyag, a nagyság miatt nem végezhető el a replantáció. A felső korhatár sem határozható meg, itt más szempontok segítenek döntésünkben: Mi a replantációval várható funkció, és milyen a funkció e nélkül. Önellátó marad-e a beteg?
A beteg neme - Férfiaknál kozmetikai szempontok dominanciája nem olyan nagy, mint hölgyeknél ezért bizonyos esetekben a replantáció elvégzéséről lemondhatunk.
A beteg általános állapota - egyéb betegségek a replantáció elvégzését behatárolhatják, egyéb megbetegedések, a hosszú műtétet kizárhatja. Egyéni mérlegeléssel kell meghatározni, hogy felvállaljuk-e a replantációt, vagy a replantáció elmaradásából származó következmények kockázatát.
Egyéb betegségek - súlyos rendszerbetegségek, malignus folyamatok kizárják a replantációt.
Műtéti kockázat - a hosszantartó műtétnek és postoperativ szövődmények elhárításának figyelembevétele fontos. Egészséges betegeket lehet terhelni, kiknek az életét nem fogja veszélyeztetni a replantácó.
Kooperációs készség - a beteg részéről bizonyos együttműködést el kell várni, máskülönben aa replantáció funkcionálisan eredménytelen.
A leválasztás magassága: különféle magasságban az anatómiai struktúrák sérülése más és az eredmények ezektől függnek. Kéz vonatkozásában az amputáció magasságát 5 zónára osztjuk, az ujjvégektől a csukló irányában haladva az I. zóna az ujj csúcs amputációja, a II. zóna a végperc amputáció, a III. az ujj amputáció, a IV. zóna a kézközép, metacarpusokon átmenő amputáció, míg az V. zóna maga a kéz amputáció. A zónákat az teszi fontossá, hogy I. zóna esetén varrható vénát általában nem találunk, a vénás keringés biztosítására. Az ujjvég hiánya bizonyos szakmáknál, pl. zenészeknél igen súlyos hiányt jelent, gyermeknél maga az artéria mérete és kicsinysége miatt esetleg lehetetlenné teszi a visszaültetést.
Leválasztás felszíneinek állapota: A replantáció elvégezhetőségét befolyásolja. Éles, guillotine szerű amputáció után a visszaültetés igen eredményes, az esélyek a roncsolódás kiterjedésével csökkennek. (körfűrész, láncfűrész okozta sérülések, szakításos sérülések).
Súlyos roncsoló sérülések esetén a replantáció kilátástalan.
4.2.műtéti érzéstelenítés
A műtét altatásban, vagy plexus érzéstelenítésben végezendő, célszerű ezen utóbbi esetben kanült behelyezni, a műtét elhúzódása, illetve a posztoperatív fájdalmak csökkentése céljából.
4.3.műtét
4.3.1. A seb kimetszése mind a csonkon, mind a levágott részen. A levágott rész hűtőben marad, közvetlenül a visszaültetés előtt vesszük ki és végezzük el a sebkimetszést.
4.3.2 Osteosynthesis elvégzése, stabil, legalább mozgásstabil osteosynthesis, melyek a következők: dróthurok és tűződrót. Mini lemez és csavarok, mini titán lemez és csavarok.
4.3.3. Hajlító ín varrata, (Kleinert- Kessler, Matev, Zehner, Tsuge) lényeg, hogy stabil ínvarrat legyen, a korai mozgatást tegye lehetővé.
4.3.4. Artéria varrat. Vég a véghez anasztomózis, körkörös csomós öltéssel.
4.3.5. Idegvarrat (Perineuralis).
4.3.6. Volaris bőr zárása.
4.3.7. Extensor ín varrata, vagy az extensor apparátus varrata. Itt is mozgást lehetővé tevő varrat, mozgásstabil ínvarrat szükséges.
4.3.8. Vénák varrata, artériánként két véna helyreállítása szükséges, ha lehetséges. Körkörös csomós varrattechnikával.
4.3.9. Bőrvarrat.
4.4.postoperatios teendők
Kéz felpolcolása, anticoagulans (kis mólsúlyú heparinok) adása. A seb szennyezettségétől függően, antibiotikum adása. Fél, illetve óránkénti, a visszaültetett rész keringésének ellenőrzése, bőr hőmérséklet mérése.
5. Fizikai aktivitás:
A beteg műtét után felkelhet, sétálhat, a visszaültetett részt felemelve kell tartania
6. Dohányzás tilos!
7. Betegoktatás:
A beteget a passzív tornára, az együttműködésre ki kell oktatni.
Egyéb terápia: Gyógytorna, első napokban passzív, negyedik naptól fél passzív, nyolcadik naptól aktív mozgatás.
IV. Rehabilitáció
A rehabilitáció szükségességének paraméterei
Rehabilitáció a műtét utáni nap kezdődik és tart a végleges funkció kialakulásáig, illetve a végállapot eléréséig. Ha a mozgás érzés javulása megakad, helyreállító műtét jön szóba, ez az esetek 25-30 százalékában előfordul.
A rehabilitáció egyéni gyógytornából, ha motoros beidegzésében károsodott izom idegének helyreállítása megtörtént, szelektív ingeráram terápiából áll. A torna elsajátítása után a beteg otthon is végezheti a tornát és az izom ingerlését. A gyógytorna és mozgásjavulás ellenőrzése egyéni, a betegek hozzáállása, gyógyulni vágyása határozza meg.
V. Gondozás
1.Rendszeres ellenőrzés:
A betegek rendszeres ellenőrzést igényelnek. A műtét után intézetben 5-8 napot töltenek. Az első három nap igen szoros kontroll javasolt. 5-8. naptól a beteg maga ellenőrzi a visszaültetett rész bőrhőmérsékletét és a bőr színét. Két majd négy hetes korban rendeljük vissza. Egy hónap után három hetenként a gyógytorna effektivitását, az ideg regenerációt, a Tinel jellel ellenőrizzük.
2.Lehetséges szövődmények
Artériás, vagy vénás thrombosis.
A visszaültetett rész részleges, vagy teljes elhalása.
A seb gennyedése
2.1. Szövődmények kezelése:
Artériás, vagy vénás thrombosis azonnali műtétet igényel: Thrombectomia és reanastomosis készítése, illetve értranszplantátum beültetése a megoldás. Kiegészítve a anticoagulans terápiával, helyzettől függően plexus blokáddal, illetve értágító adásával. A visszaültetett rész részleges, vagy teljes elhalása esetén az elhalt területek eltávolítása és a szituációtól függően a visszaültetett rész mentése, vagy eltávolítása a megoldás
Gennyedés esetén a kezelése sebészi feltárás, szükség szerint antibiotikum adása javasolt. A kiterjedéstől függően a visszaültetett rész feláldozása
3. Kezelés várható időtartama/Prognózis: Intézeti kezelés általában egy hét, az ideális, szövődménymentes gyógyulás 3-6 hónapot igényel. Szövődmények fellépte esetén a gyógyulás ennél is hosszabb.
Kiegészítő műtétek is hosszabbíthatják a gyógyulási időt. Idegátültetés, tendolysisek, a kialakult álízületek sebészi kezelése, arthrodesisek elvégzése, ezek közül, a leggyakoribb.
VI. Irodalomjegyzék
1. al-Shammari S, Gupta A. Revascularization of the digits and palm. Hand Clin. 2001 Aug;17(3):411-7, 8. Review.
2. Atroshi I, Rosberg HE. Epidemiology of amputations and severe injuries of the hand. Hand Clin. 2001 Aug;17(3):343-50, vii.
3. Ács Géza, Hargitai Ernő (szerk.) Gyermektraumatológia, Medicina 2001
4. Biemer , E., Duspiva, W.: Rekonstruktive Mikrogefásschirurgie. Springer Verlag Berlin-Heidelberg-New York 1980.
5. Buncke, H.J., Schulz, W.P.: Experimental digital amputation and reinplantation. Plast. Reconstr.Surg. 36, 62 (1965)
6. Chen Z, Zhang J. Replantation of severed limbs: current status and prospects. Chin Med J (Engl). 1999 Oct;112(10):914-7. Review. No abstract available.
7. Chen HC, Tang YB. Replantation of the thumb, especially avulsion. Hand Clin. 2001 Aug;17(3):433-45. Review.
8. Clayton A. Peimer, M.D. Surgery of the Hand and Upper Extremity Volume I., McGraw-Hill Health Professions Division 1995
9. Cobbett, J.R.: Microvascular Surgery. Surg.Clin.North.Amer. 47, 521 (1967)
10. Cziffer E. Operatív töréskezelés, Springer 1997
11. David P.Green, M.D. Operative Hand Surgery I., Churchill Livingstone 1988
12. H.Nigst, D.Buck-Gramcko, H.Millesi Handchirurgie, Georg Thieme Verlag Stuttgart New York 1983
13. Jaquet, Jean-Bart; Schreuders, TAR; Kalmijn, S; Kuypers, PDL; Ruys, ACJ; Hovius, SER: Median and Ulnar Nerve Injuries: Prognosis and Predictors for Clinical Outcome. The Journal of Hand Surgery Vol. 30B No.S1 June 2005
14. Lim BH, Tan BK, Peng YP. Digital replantations including fingertip and ring avulsion. Hand Clin. 2001 Aug;17(3):419-31, viii-ix. Review.
15. Malt R., McKhann C.: Replantation of severed arms. J.A.M.A. 189, 716 (1964)
16. McCabe SJ. Patient participation in the decision for replantation. Hand Clin. 2001 Aug;17(3):351-5, vii.
17. O'Brien, N.McC.: Microvascular reconstructive surgery. Curchill Livingstone Edinburgh London and New York 1977.
18. Nyárády J.: Invaginációs mikroéranasztomózisok alkalmazása patkányszív- és vesetranszplantációk esetén. Magyar Seb. 34, 143 (1981)
19. Nyárády J.: Sikeres öregujj replantáció invaginációs mikroéranasztomózis alkalmazásával. Magyar Traumat. 24, 279 (1981)
20. Papanastasiou S. Rehabilitation of the replanted upper extremity. Plast Reconstr Surg. 2002 Mar;109(3):978-81.
21. Soucacos PN. Indications and selection for digital amputation and replantation. J Hand Surg [Br]. 2001 Dec;26(6):572-81.
22. Scheker LR, Hodges A. Brace and rehabilitation after replantation and revascularization. Hand Clin. 2001 Aug;17(3):473-80.
23. Zhang J, Chen ZW. Retrospective of the replantation of severed limbs in the People's Republic of China: Current status and prospects. Microsurgery. 2002 Jan;22(1):39-43.
Kapcsolódó internetes oldalak
http://emedicine.medscape.com/article/1288203-overview
http://orthoinfo.aaos.org/topic.cfm?topic=A00314
http://cat.inist.fr/?aModele=afficheN&cpsidt=20085826
http://health.allrefer.com/health/replantation-of-digits-amputated-finger.html
A szakmai protokoll érvényessége: 2014. június 30.
VII. Melléklet
1. Érintett társszakmákkal való konszenzus: ortopédia, plasztikai sebészet, fizikotherápia, gyógytornászok
2. Dokumentáció, bizonylat: Az általános dokumentumokon túl műtét előtti és utáni fényképek, valamint a funkcióról készült képek ajánlottak.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a nervus radialis tunnel syndromairól
(Radial tunnel syndroma, Supinator syndroma, Wartenberg syndroma)
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO G5630 A. n. radialis károsodása
1. A protokollok alkalmazási/érvényességi területe
Kézsebészet, traumatológia, ortopédia, plasztikai sebészet.
2. A protokollok bevezetésének feltétele
A négy szakmában a kézsebészet, traumatológia és mikrosebészet alapos ismerete.
3. Definíció
A nervus radialis direkt vagy indrirekt kompressziója a könyök magasságában és az alkaron.
3.1.Kiváltó tényezők Direkt kompresszió: Fibroticus kötegek Rendellenes ér Izomhypertrophia Tumor
Radius fejecs törés, radius fejecs ficam Direkt trauma Indirekt hatások: Extrém terhelés Cubitus varus
3.2.Kockázati tényezők
Korábbi könyöktörés, túlzott igénybevétel, reumatológiai és anyagcsere betegségek, cubitus varus, arteriosclerosis.
4. Panaszok/Tünetek/Általános jellemzők
A klinikai tünetek típusosan a nervus radialis beidegzési területén jelentkeznek: Wartenberg syndroma (a nervus radialis érző ágának a kompressziója a BR és ECRL izmok között való kilépésénél) érzészavar (5-10 dorsalis ideg területén), hypaestesia, paraestasia majd anaestasia.
Supinator syndroma: típusos esetben tisztán bénulásos típus (az érző ág a Frose árkád előtt leválik). A kiesett funkciók segítenek a kompresszió magasságának megállításában. A syndrománál csak az ECRL izom működik az extensorok közül, mivel ennek a beidegzése a supinator csatorna felett van. Ha a supinatio és csukló extensio gyengült, akkor a kompresszió Frose árkád magasságában lehet, ha csak az ulnaris extensor funkciók estek ki (EDC, ECU), vagy csak a radialisak (EPL, APL, EPB, EIP), akkor supinator csatornában lehet a leszorítás a motoros ág oszlása után. Ha egyik izom sem működik, akkor természetesen az oszlás előtt.
A radial tunnel syndroma-nál mind sensoros, mind motoros kiesési tünetek észlelhetők, a motoros kiesésnél az egyszerű izomgyengeségtől a teljes bénulásig egy, ill. az összes izom érintettségéig, esetenként bármi előfordulhat típusosan a Tinel-jel, a kompresszios teszt, a radius fejecs felett volarisan a legkifejezettebb. A provokatios tesztek közül a III. ujj extensioja, ill. a csukló supinatioja ellenállással szemben kifejezett panaszokat okoz a fenti magasságban, és ez korjelző. Egyes szerzők szerint a nervus radialus ramus recurensenek kompressziója miatt radial tunnel syndromával együttesen lateralis epicondylitis tünet együttese is fenn állhat, tehát a fájdalom és az érzékenység az epicondylus területén is kifejezett lehet. E miatt az elkülönítés a két syndroma között sokszor nem is lehetséges.
Anatómiai áttekintés
A nervus radialis könyöktáji lefutásánál 3 helyen érheti leszorítás a felső szakaszon, legmagasabban a lateralis epicondylus felett kb. 10 cm-el, a lateralis intermuscularis septumon való átlépésénél (Wilheim 1970), a középső szakaszon, ez a radial tunnel (Roles 1972) ami a nervus radialisnak az elülső kompartmenbe való belépésétől a Frose árkádig terjed, s ezen szakaszon a BR, ECRL, ECRB izmok, a humerus, az ízület és a radius fejecs határolják. A harmadik, alsó szakaszon (supinator csatorna) (Kaeser 1986) a supinatorizom két feje közti áthaladásánál.
5. A betegség leírása
5.1. Érintett szervrendszer(ek): Könyök és a kéz
5.2. Genetikai háttér: Nincs genetikai háttere
5.3. Incidencia/Prevalecia/Morbiditás Magyarországon: Középkorú férfiakon gyakoribb, mint nőkön, fizikai munkásokon, sportolókon gyakoribb, ahol a könyöknek elsősorban a rotaciós igénybevétele kifejezett.
5.4. Jellemző életkor: 35-50 év
5.5. Jellemző nem: Férfiakon gyakoribb
II. Diagnózis
1. Diagnosztikai algoritmusok
Fizikális vizsgálat, rtg. vizsgálat, EMG vizsgálat, labor és egyéb diagnosztikai vizsgálatok szükségesek
2. Anamnézis: Beteg panaszainak értékelése, fájdalom, érzés kiesés, mozgászavar, van-e és mióta, pontosan megtudja-e mondani a panaszok idejét, kiváltó okát, provokálhatóságát, szünteti-e valami, emlékszik-e valamilyen traumára vagy konkrét okra, milyen egyéb betegségei vannak, stb.
3. Fizikális vizsgálatok
3/1. Érzésvizsgálat: a nervus radialis vizsgálati területén, hideg-meleg tapintás, fájdalom, kétpont diszkriminátio. 3/2. Mozgásvizsgálat: könyöknyújtás, hajlítás, supinatio, pronatio, csukló nyújtás, hajlítás, az ujjak nyújtása, hajlítása. 3/3. Kompresszios teszt, Tinel-jel 3/4. Provokatios teszt, Phallen teszt
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok
4.1. Laboratóriumi vizsgálatok
Műtét esetén szükséges anaetesiológiai okokból vagy anyagcsere betegség, reumatológia vagy egyéb belgyógyászati betegség lehetőségének kizárására vagy jelenlétének igazolására (pl. Diabetes)
4.2. Képalkotó vizsgálatok
Rtg. vizsgálat: 2 irányú felvétel igazolhat a könyök deformáltságát, varus állását, esetleges csonttumor jelenlétét, radius fejecs törést vagy ficamot, fejlődési rendellenességet, kifejezett arthrosist, exsostosist, myositist, stb. MRI vizsgálat: lágyrész elváltozások kimutatására (nem feltétlenül szükséges).
4.3. Egyéb
ENG és EMG vizsgálatok
Aprólékos vizsgálat segít a diagnosis felállításában, elsősorban a motoros kieséssel járó eseteknél.
5. Kiegészítő diagnosztikai vizsgálatok
A cervicobrachialis spondylarthroris gyöki irritáció, kompresszio, discus hernia, plexus sérülés elkülönítésére gyanú esetén, ill. bizonytalan diagnózis miatt az ott leírtak szerint kell eljárni.
6. Diferenciál diagnosztika
6/1. LateralElbowPain (epicondylitis lateralis humeri, teniszkönyök)
A tünetegyüttes nehezen különíthető el a radial tunnel syndromától, sokak szerint az elváltozás is tunnel syndromák közé tartozik, mivel szerintük .(Wilhelm 1998., K.Kalb 1998.) a tüneteket a nervus radialis ramus recurrens ágának a kompressziója okozza, ami a lateralis epicondylus területét idegzi be. Természetesen teniszkönyökre utal, ha nincsenek a betegnek bénulásos tünetei vagy izomgyengesége, és a direkt-indirekt tesztek az érzékenységet az epicondylus területére localisaljak. 6/2. Nervus radialis sérülés kompresszió a felkar magasságában. Anaemnasis, fizikális vizsgálat, a nervus radialis teljes kiesése.
6/3. Inruptura
6/4. Nyaki discushernia, spondylosis, spondylarthrosis 6/5. Ólom vagy arzén mérgezés
III. Terápia
III/1. Nem gyógyszeres kezelés
1. A megfelelő egészségügyi ellátás szintje
Szintje kézsebészeti, baleseti, ortopédiai, reumatológiai szakrendelés, szükség esetén a fenti szakterületeken osztályos kezelés.
2. Általános intézkedések
2/1. Az érintett végtag pihentetése, éjszakai sín, könyökvédő viselése, a könyök hajlított és supinalt helyzetű rögzítésével. 2/2. Gyógytorna: a nyomási panaszok csökkentésére speciális gyógytorna: nyújtó és ideggördülést javító gyakorlatok. A kiesett izomfunkció helyreállítására a megfelelő izmokat aktivizáló gyakorlatok. 2/3. Szelektív ingeráram kezelés: az izomfunkció javítására
3. Speciális ápolási teendők
A panaszok csökkenését vagy fokozódását a klinikai vizsgálatok során ellenőrizni kell.
4. Fizikai aktivitás
Gyógytorna rendkívül fontos, speciális nyújtó és ideg gördülést javító gyakorlatok.
Egyebekben a betegnek a beteg felvilágosítása az extrém könyöknyújtás, supinatio-pronatio, varus állás elkerülésére.
5. Diéta
Alkohol és dohányzási tilalom
6. Betegoktatás
Gyógytorna oktatás
Az elveszett funkciók visszaszerzése rendszeres tornával.
III/2. Gyógyszeres kezelés
1. A megfelelő egészségügyi ellátás szintje
A fenti szakmák rendelőintézeti és kórházi szintje.
2. Speciális ápolási teendők
3. Ajánlott gyógyszerek kezelés
Nonsteroid gyulladáscsökkentő tabletták, kenőcsök, fájdalomcsillapítók, ill. lokális steroid injekció, UH, mágnes, iontoforézises kezelések.
3.1. Kontraindikációk
3.2. Lehetséges jelentős interakciók
4. Kiegészítő/Alternatív gyógyszeres kezelés
5. Terápiás algoritmusok
III/3. Műtéti kezelés
1. A megfelelő egészségügyi ellátás szintje
Kézsebészeti, traumatológiai, ortopédiai osztályon vagy klinikán végezhető.
2. Általános intézkedések
Anaesthesiológiai, belgyógyászati kivizsgálás
3. Speciális ápolási teendők
Műtéti behatolás területén ne legyen fertőző forrás.
4. Sebészeti kezelés
4.1. műtéti indikáció:
4.1.1. Konzervatív kezelésre nem javuló (2-4 hónap), elsősorban teniszkönyökként kezelt esetek műtéti kezelése vagy revisioja.
4.1.2. Absolut indikáció
Bénulásos típusú esetek, ahol a fizikális vizsgálat is, és az EMG is a radialis vagy a supinator csatorna kompressziójára utal.
4.1.3. Relatív indikáció
Enyhébb tünetek. Konzervatív kezelés eredménytelen, vagy csak átmeneti javulás jön létre. Ha a panaszok fokozódnak izomatrophia jön létre, ha egyéb ok kizárható.
4.2.műtéti előkészítés:
Elektív tervezett műtétnek megfelelő a kivizsgálás
4.3.műtéti érzéstelenítés:
Általános érzéstelenítés, vezetéses érzéstelenítés, local anaesthaesia.
4.4.műtéti kezelés elfogadott módszerei:
4.4.1. Direkt decompresszio
A Frose árkád feltárása, az ott lévő kompresszios tényezők megszüntetése, az árkád behasítása Irodalmi ajánlás: Roles: 1972., Bíró: 1988., Xiag Koob: 1988., Partecke 1997.
4.4.2. Indirekt decompresszio
A supinator izom felületes fejének Z plastikája vagy leválasztása, flexor carpi radialis brevis eredésének részleges vagy teljes leválasztása.
Irodalmi ajánlás: Naracas : 1987., Wilhelm: 1998.
4.4.3. Szelektív denervatio
Az epicondylus lateralis humerit és környékét ellátó érző rostok denervatioja
A korábban leírtak szerint a syndroma megítélése nem egységes, elkülönítése a teniszkönyöktől sokszor nem is lehetséges, az irodalomban sokak szerint a műtéti kezelésnél nem is annyira fontos, mert a legjobb eljárásnak az indirekt decompresszio és vele együtt elsősorban az algoticus típusnál a denervatio elvégzése is javasolt. A műtétek részletes leírását lásd: Green, D.P.: Green's operative hand surgery. Philadelphia, 2005,
4.5.Posztoperációs teendők
A műtéti terület drainage a végtag felpolcolása, átmeneti rögzítése, gyógytorna megkezdése.
5. Fizikai aktivitás
Az operált terület kivételével teljes fizikai aktivitás, majd az operált terület gyógytornájának megkezdése a műtét után a műtét típusától függően.
6. Diéta
Dohányzás tilalom
7. Betegoktatás
Gyógytorna oktatása, kéz használatának gyakorlása.
IV. Rehabilitáció
A kéz és az alkar izmainak erősítése speciális gyógytornával, elsősorban a kiesett funkció forszírozása, csukló extensio, ujjnyújtás, supinatio-pronatio. Atrophia esetén, ill. az izomerő fokozására szelektív ingeráram kezelés.
V. Gondozás
1. Rendszeres ellenőrzés: klinikai tünetek és panaszok kezelésére rendszeres ellenőrzés javasolt.
2. Megelőzés: Reflex sympathicus dystrophia kialakulásának megelőzése. Hegesedés megelőzése gyógytornával és localis kezeléssel.
3. Lehetséges szövődmények:
3.1. A klinikai tünetek változatlanul fennállnak
A klinikai tünetek változatlanul fennállnak
Kezelése: differenciáldiagnosztikai vizsgálatok alapján a kezelés megváltoztatása javasolt.
3.2. A panaszok megszűnnek, majd ismételten jelentkeznek
Terápia: ismételt vizsgálat a compressio ismételt kialakulását valószínűsíti, vagy a magasság megítélése nem volt megfelelő, konzervatív kezelés vagy műtéti revisio indokolt.
3.3. A csukló extensio, ujj nyújtás, hüvelykujj nyújtás és abductio nem áll helyre.
3.3.a. Arthrodesisek 3.3.b. Intranspositiok
4. Kezelés várható időtartama / Prognózis Típusos esetben 4-8 hét, Izomatrophiaval járó esetben 1 év is lehet.
VI. Irodalomjegyzék
1. A.Wilhelm: Die Behandlung der therapieresisten Epicondylitis laterali humeri durch Denervation. Zur Pathogenese, Handchir.Mikrochir.Plast.Chir. 31 (1999) 291-302.
2. Ács, G. Hargitai, E.: Gyermektraumatológia. Budapest, 2001. Medicina.
3. Bíró Vilmos, Vámhidy László: A nervus radialis supinator alagút szindromája, Magyar Traumatológia 28. 250-253. 1985.
4. Gaál Csaba: Sebészet, Medicina Bp. 2010.
5. Green, D.P.: Green's operative hand surgery. Philadelphia, 2005, Elseiver, Churchill Livingstone.
6. K.Kalb, P. Gruber, B. Landsleitner: Das Kompressionssyndrom des Nervus radialis im Bereich der Supinatorloge. Handchir. Mikrochir. Plast. Chir. 31. (1999) 303-310.
7. Kómár, J.: Alagút-szindrómák. Budapest, 1977, Medicina.
8. N.C.Roles and R.H.Maudsley, Ascot, Berkshire, England: Resistant Tennis Elbow as a Nerve Entrapment, vol.54 B, No. 3, august 1972.
9. M.Völlinger, B.-D.Partecke: Das Supinatorsyndrom. Hand.Mikr.Pl.Chir.30 (1998) 103-108
10. Renner, A.: Traumatológia. Budapest 2000. Medicina.
11. S.Erak, R.Day, A. Wang: The Role Of Supinator In The Pathogenesis Of Chronic Lateral Elbow Pain: A Biomechanical Study, Journal os Hand Surgery (British and European Volume, 2004) 29 B: 5: 461-464.
12. Vekerdy-Nagy Zs.: Rehabilitációs orvoslás, Budapest 2010., Medicina
13. Von Guang Xiang Hong, K. Steffens und E. Koob: Das Supinatorsyndrom, Handchir.Mikrochir.Plast.Chir.21 (1989) 147-152
14. Wilbourn AJ: The electrodianostic Examination with peripheral nerve injuries. Clin Plast. Surg 30:139-154. 2003.
A szakmai protokoll érvényessége: 2014. június 30.
VII. Melléklet
Dokumentáció, bizonylat: általános dokumentumokon túl esetleg műtét utáni fotók
A Nemzeti Erőforrás Minisztérium szakmai protokollja a scaphoideum (sajkacsont) álízület kezeléséről
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO S6200 A kéz sajkacsontjának törése
M8410 Össze nem forrt csonttörés [álízület]
1. A protokollok alkalmazási / érvényességi területe
Traumatológia, ortopédia, sebészet, gyermeksebészet, kézsebészet.
2. A protokollok bevezetésének alapfeltétele
Az öt szakmában a baleseti sebészet és a kézsebészet alapos ismerete.
3. Definíció
A sajkacsont nem gyógyult törése
3.1.Kiváltó tényezők
3.1.1. A beteg nem megy orvoshoz, jelentéktelennek tartva a sérülést, nem fáj és nincsenek törésre utaló típusos tünetek, a panaszok csökkennek, sőt panaszmentessé válik a sérült és egy újabb csuklóízületi trauma deríti ki, hogy korábban volt egy scaphoideum törése a betegnek.
3.1.2. Orvoshoz megy, de az nem ismeri fel a sérülést és nem kér vizsgálatot, distorsionak tartva a tünetszegény sérülést
3.1.3. Radiológiai vizsgálat során csak kétirányú csukló felvétel készül, amely nem mutatja ki a scaphoideum törést
3.1.4. A primer négyirányú felvételen a törés nem látszik és nem ismétlik
3.1.5. A törést rövid ideig rögzítik
3.1.6. A törést nem megfelelő gipszkötéssel rögzítik (a törés mozog)
3.1.7. Interpositum megakadályozza a törés gyógyulását
3.1.8. Keringészavar miatt nem gyógyul: avascularis necrosis (proximális harmadi törés, pólus törés)
3.2.Kockázati tényezők
gyakorlatilag nincs, fiatal férfiak sérülése után kialakuló álízület
4. Panaszok/Tünetek/Általános jellemzők
Törésre jellemző tünetek: szegényesek, a csukló radialis oldalán mérsékelt fájdalom, amely pihenésre mérséklődik. A csuklóízületi fájdalom fokozatosan erősödik, jellemző a terhelésre jelentkező fájdalom és csuklóízületi duzzanat. Gyakran ismételt trauma irányítja rá a figyelmet a sajkacsont álízületére.. A fossa tabatier területén észlelhető nyomásérzékenység.
Anatómiai áttekintés:
A sajkacsont öt ízfelszínnel rendelkezik (radius, lunatum, capitatum, trapesium trapesoideum) csaknem teljesen porccal borított. A scaphoideum distalis része palmarisan helyezkedik el a csukló középvonalától, ezért az extensio során létrejött törésben púposság deformitás (humpback deformity), vagyis palmar felé történő elbillenés következik be. A scaphoideum vérellátása szegényes, distal felől két vagy három kis artéria látja el a csontot, ezért a porccal borított proximális pólus csak intraosseális vérellátást kap, ezért gyakori az avascularis necrosis polus törések esetén.
A scaphoideum álízület a törések helye szerint alakulnak ki:
A) középső harmadi álízület (leggyakoribb)
B) distalis harmadi álízület (ritka)
C) proximalis harmadi álízület (polus avascularis necrosisa)
5. A betegség leírása
5.1.Érintett szervrendszer(ek) Csukló és kéztő
5.2.Genetikai háttér Nincs genetikai háttere
5.3.Incidencia /Prevalecia /Morbiditás/Mortalitás Magyarországon
A scaphoideum törésekből gyakran alakul ki álízület, súlyos következményei miatt jelentősége igen nagy.
5.4.Jellemző életkor
Fiatalok betegsége legtöbb esetben 20-30 éves kor között jön létre
5.5.Jellemző nem
A fiatal férfiak betegsége, a scaphoideum álízületek több, mint négy-ötöde férfiakon fordul elő.
II. Diagnózis
1. Diagnosztikai algoritmusok
Gondos klinikai vizsgálatot kell végezni! A szegényes klinikai tünetek miatt fiatal férfiak nyújtott kézzel korábban történt elesése és a törésre, álízületre jellemző tünetek hiánya miatt gondolni kell scaphoideum álízület lehetőségére.
2. Anamnézis
Korábbi sérülés lehetőségét ki kell deríteni, esetenként évekkel korábbi elhanyagolt trauma lehet a háttérben. A nyújtott felső végtaggal, extensios helyzetű csuklóval történő kézre esés (letenyerelés) fiatal férfiak esetén gyanút kell keltsen. A fokozatosan kialakuló csuklóízületi fájdalom, vagy ismételt traumára jelentkező csuklóízületi panasz a scaphoideum álízület gyanuját kelti fel. Scaphoideum álízület gyanuja esetén a fájdalom jellegére és a fájdalmas mozgásokra mindig rá kell kérdezni.
3. Fizikális vizsgálatok
A sérült csukló vizsgálatakor a nyomásérzékenység punctum maximumát kell vizsgálni, amely scaphoideum álízület esetén a fossa tabatier felett a legkifejezettebb. A csukló extensioja éles fájdalmat provokálhat a csukló radiális felében, de fájdalmat idézhet elő a flexio és radial-ductio is. Radiocarpalis arthrosis esetén a csuklóízület mozgatásakor a csuklóízületi fájdalom mellett ropogás is észlelhető, a mozgásterjedelem beszűkült.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok
4.1.Laboratóriumi vizsgálatok
Műtét esetén szükséges anaesthesiológiai okokból.
4.2.Képalkotó vizsgálatok
Scaphoideum álízület gyanúja esetén mindig négyirányú felvételt kell készíteni a sérült csuklóról. CT vagy MR vizsgálatot az álízület kiterjedésének és a scaphoideum (proximális pólus) keringésének vizsgálatára végezhetünk.
4.3.Egyéb
Nem szükséges
5. Kiegészítő diagnosztikai vizsgálatok
Scaphoideum álízület gyanúja esetén CT vizsgálat és 3D rekonstrukció is indokolt lehet, keringés zavar, avascularis necrosis gyanúja esetén az MR vizsgálat hasznos segítséget jelenthet.
6. Differenciál diagnosztika
A scaphoideum álízület és a szalagos instabilitások (scapho-lunaris dissciáció) elkülönítése szükséges. Fontos meghatározni a radiocarpalis arthrosis mértékét is. Bizonytalan csuklótáji fájdalom esetén a lunatum malatia, valamint egyéb betegségeket kell kizárni.
III. Terápia
III/1. Nem gyógyszeres kezelés
1. A megfelelő egészségügyi ellátás szintje
A. scaphoideum álízület ellátása traumatológiai vagy kézsebészeti osztályon / klinikán történik, ahol kézsebész szakorvos végzi az ellátást.
2. Non operatív, konzervatív kezelés.
2.1. A fájdalom csökkentésére pihentető gipszsínt vagy tépőzáras csukló rögzítőt helyezhetünk fel a műtéti ellátásig.
3. Speciális ápolási teendők
Az átmeneti rögzítés és a csuklóízületi torna egyensúlyát kell meghatározni. Lokálisan nonsteroid gyulladáscsökkentők mérsékelhetik a fájdalmat és a duzzanatot.
4. Fizikai aktivitás
Gyógytornával a könyökízület, a hosszú ujjak MP, PIP és DIP ízületi, valamint a hüvelykujj IP ízületi funkcióját meg kell tartani.
5. Diéta
6. Betegoktatás Gyógytorna oktatás
A kéz funkciójának megtartása
III/2. Gyógyszeres kezelés
1. Ajánlott gyógyszeres kezelés
Szükség esetén fájdalomcsillapítás és/vagy nonsteroid gyulladáscsökkentők adása javasolt.
III/3. Műtéti töréskezelés
1. A megfelelő egészségügyi ellátás szintje
Traumatológiai és/vagy kézsebészeti osztályon / klinikán végezhető.
2. Általános intézkedések Anaesthesiológia belgyógyászati kivizsgálás
3. Speciális ápolási teendők
A műtéti behatolás területén ne legyen fertőző forrás.
4. Sebészeti kezelés Műtéti töréskezelés
4.1.műtéti indikáció
A műtéti töréskezelés absolut és relatív indikáció alapján végezhető. Absolut indikáció:
Fiatal férfiak álízülete
Relatív indikáció:
Arthrosissal járó álízület
4.2.műtéti előkészítés Tervezett műtét
4.3 műtéti érzéstelenítés Általános érzéstelenítés
4.4.műtét: A műtéti töréskezelés módszerei:
4.4.1. Ha nincs radiocarpalis arthrosis, akkor a scaphoideum álízületét dörzsfúróval kitakarítjuk és scaphoideum álízületében két párhuzamos felszínt alakítunk ki és a scaphoideum magasságának helyreállítására a csípőlapátból vett cortico-spongiosus blockból megfelelő méretet faragunk ki és behelyezzük az álízület helyére és Herbert csavarral rögzítjük.
4.4.2. A Matti-Russe műtétet (hosszanti csont-block beültetés az álízületbe) ma már nem végzik.
4.4.3. 4.4.3. Súlyos radiocarpalis arthrosis esetén radiocarpalis arthrodesissel szüntetjük meg a csuklóízület fájdalmát és állítjuk helyre a kéz működését.
4.4.2. Átmenti megoldás, hogy a proximális csontsort eltávolítjuk (proximal row carpectomy), így megmarad a csuklóízületi mozgás is, de gyakran nem szűnik meg a csuklóízületi fájdalom.
4.4.3. A csuklóízület Wilhelm szerinti denervatiójával a fájdalom csökkenthető, a csuklóízület mozgáskorlátozottsága keveset javul és a csuklóízületi arthrosis progrediál.
4.5.posztoperációs teendők
A műtéti terület drenálása, a végtag felpolcolása, gyógytorna megkezdése.
5. Fizikai aktivitás
Stabil rekonstrukció esetén 6-8 hetes Bennett gipszrögzítés szükséges. Radiocarpalis arthrodesis esetén nincs szükség külső rögzítőre. Proximal row carpectomy után korai gyógytornát kezdünk el.
6. Betegoktatás
Gyógytorna oktatása, fizikai terhelés engedélyezése
IV. Rehabilitáció
A rehabilitáció szükségességének paraméterei
V. Gondozás
1. Rendszeres ellenőrzés
Az álízület gyógyulását meghatározott időszakonként ellenőrizzük. Radiológiai vizsgálat 8 és 16 hetes valamint fél és egy év elteltével szükséges.
2. Megelőzés
A radiocarpalis arthrosis kialakulásának megelőzése Csuklóízületi mozgáskorlátozottság megelőzése
3. Lehetséges szövődmények
3.1. Scaphoideum álízület nem gyógyul meg.
Kezelése: ismételt műtét vagy radio-carpalis arthrodesis.
3.2. Proximalis pólus avascularis necrosisa.
Terápia: proximal row carpectomy vagy radiocarpalis arthrodesis.
3.3. Radio-carpalis arthrosis.
Terápia: radio-carpalis arthrodesis
3.4. Nervus radialis dorsalis érző ágának iatrogén károsodása (teljes vagy részleges)
Terápia: konzervatív kezelés, a n. radialis feltárása, neurolysis idegvarrat vagy graft. (WHO 50421, 50440, 50430)
4. Kezelés várható időtartama / Prognózis
Egyszerű álízület cortico-spongiosus block behelyezés esetén 4 hónap Radiocarpalis arthrodesis esetén 8-16 hét
Teljes radiológiai gyógyulás fél-1 év
5. Az ellátás megfelelőségének indikátorai
Szakmai munka eredményességének mutatói Az álízület átépülésének, a gyógyulás időtartama Szövődmények aránya Funkcionális végeredmény monitorizálása
VI. Irodalomjegyzék
1. Ács Géza - Hargitai Ernő: Gyermektraumatológia. Medicina Bp. 2001.
2. Browner B. D., Jupiter J. B. Levine A. M. Trafton. P. G.: Skletal Trauma W. B. Saunders Co Philadephia, London, Toronto, Montreal Sydney, Tokyo 1992.
3. Cziffer E.: Operatív töréskezelés. Spinger Hungarica Budapest 1997.
4. Gaál Csaba: Sebészet, Medicina 2010
5. Green, D.P., Hotchkiss, R.N., Pederson, W.C., Wolfe, S.W.: Green's Operative Hand Surgery, Elsevier Chuchill Livingstone, 2005
6. Herbert, T.J.: The Fractured Scaphoid, Quality Medical Publiching, Inc. St.Louis, Missouri, 1990.
7. Renner Antal: Traumatológia Medicina Bp. 2000.
8. Rüter A. Tentz. O. Wanger M.: Unfallchirurgie. Munchen, Wien, Baltimore 1995.
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a scaphoideum (sajkacsont) törések kezeléséről
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO S6200 A kéz sajkacsontjának törése
1. A protokollok alkalmazási / érvényességi területe
Traumatológia, ortopédia, sebészet, gyermeksebészet, kézsebészet.
2. A protokollok bevezetésének alapfeltétele
Az öt szakmában a baleseti sebészet és a kézsebészet alapos ismerete.
3. Definíció
A sajkacsont (scaphoideum) külső erőbehatásra létrejött törése. (S62000)
3.1.Kiváltó tényezők Keletkezési mechanizmus:
indirekt: nyújtott felső végtagra, extendált kézre történő esés okozza leggyakrabban a scaphoideum középső harmadában a törést. Ilyenkor a capitatum gyakorol nyomást a scaphoideum distalis harmadára és a törés keletkezésében a csavarásos mechanizmus is szerepet játszik.
3.2.Kockázati tényezők
gyakorlatilag nincs, fiatal férfiak sérülése
4. Panaszok/Tünetek/Általános jellemzők
Törésre jellemző tünetek: szegényesek, a csukló radialis oldalán mérsékelt fájdalom, amely pihenésre mérséklődik. Nincs deformitás, crepitatio, kóros mozgathatóság, bevérzés. A fossa tabatier területén észlelhető nyomásérzékenység.
Anatómiai áttekintés:
A sajkacsont öt ízfelszínnel rendelkezik (radius, lunatum, capitatum, trapesium trapesoideum) csaknem teljesen porccal borított. A scaphoideum distalis része palmarisan helyezkedik el a csukló középvonalától, ezért az extensio során létrejött törésben púposság deformitás (humpback deformity), vagyis palmar felé történő elbillenés következik be. A scaphoideum vérellátása szegényes, distal felől két vagy három kis artéria látja el a csontot, ezért a proccal borított proximális pólus csak intraosseális vérellátást kap, ezért gyakori az avascularis necrosis polus törések esetén.
A scaphoideum törés classificatioja a törés helye szerint:
A) középső harmadi törés (70%)
B) distalis harmadi törés (20%)
C) proximalis harmadi törés (10%)
A scaphoideum törés classificatioja a törés síkja alapján (Russe):
1. horizontális (40%)
2. transverzalis (55%)
3. verticalis (5%)
Herbert classificatio:
A) stabil acut törések A1. tuber törés
A2. incomplett középső harmadik törés
B) Instabil acut törések B1. distalis ferde törés
B2. középső harmadik complett törés B3. proximális pólus törés
B4. trans-scaphoideo-perilunaris törés (De Quervain)
5. A betegség leírása
5.1.Érintett szervrendszer(ek)
Csukló és kéztő
5.2.Genetikai háttér
Nincs genetikai háttere
5.3.Incidencia/Prevalecia/Morbiditás/Mortalitás Magyarországon
Nem gyakori törés, a kéz töréseinek 10-12%-a, de rossz gyógyhajlama, az ál- ízületképződés magas aránya és annak súlyos következményei miatt jelentősége igen nagy.
5.4.Jellemző életkor
Fiatalok törése, legtöbb esetben 20-30 éves kor között jön létre
5.5.Jellemző nem
A fiatal férfiak sérülése, a scaphoideum törések több, mint négy-ötöde férfiakon fordul elő.
II. Diagnózis
1. Diagnosztikai algoritmusok
Gondos klinikai vizsgálatot kell végezni! A szegényes klinikai tünetek miatt fiatal férfiak nyújtott kézzel történő elesése és a törésre jellemző tünetek hiánya miatt gondolni kell scaphoideum törés lehetőségére.
2. Anamnézis
A sérülés mechanizmusát mindenképp tisztázni kell. A nyújtott felső végtaggal, extensios helyzetű csuklóval történő kézre esés (letenyerelés) fiatal férfiak esetén gyanút kell keltsen, főleg, ha a klinikai tünetek nem típusosak más (pl. radius) törésre. Scaphoideum törés gyanúja esetén a fájdalom jellegére és a fájdalmas mozgásokra mindig rá kell kérdezni.
3. Fizikális vizsgálatok
A sérült csukló vizsgálatakor a nyomásérzékenység punctum maximumát kell vizsgálni, amely scaphoideum törés esetén a fossa tabatier felett a legkifejezettebb. A csukló extensioja éles fájdalmat provokálhat a csukló radiális felében, de fájdalmat idézhet elő a flexio és radial-ductio is. Trans-scaphoid-perilunaris ficamos törés esetén a csuklóízület deformált, duzzadt, fájdalmas, kifejezett nyomásérzékenység észlelhető és a csukló mozgatása a fájdalmat jelentősen fokozza.
4. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok
4.1.Laboratóriumi vizsgálatok
Műtét esetén szükséges anaesthesiológiai okokból.
4.2.Képalkotó vizsgálatok
Scaphoideum törés gyanúja esetén mindig négyirányú felvételt kell készíteni a sérült csuklóról. Ha klinikai tünetek, az anamnaesis típusos, akkor a törést konzervatív módszerekkel kezdjük el kezelni és a 4 irányú scaphoideum felvételt 7-14 nap múlva meg kell ismételni (gipsz nélkül). Ha ekkor sem látható scaphoideum törés, de a klinikai tünetek fennállnak CT vagy MR vizsgálatot végzünk a törés megerősítésére illetve kizárására.
4.3.Egyéb
Nem szükséges
5. Kiegészítő diagnosztikai vizsgálatok
Jelentős elmozdulással járó, luxatios törés, vagy álízület gyanúja esetén CT vizsgálat és 3D rekonstrukció is indokolt lehet, keringés zavar, avascularis necrosis gyanúja esetén az MR vizsgálat hasznos segítséget jelenthet.
6. Differenciál diagnosztika
A friss törés és az álízület elkülönítése fontos, mert sokszor korábbi sérülés következtében kialakult, csaknem tünetmentes scphoideum álízület acut trauma miatt válik panaszossá. Bizonytalan csuklótáji fájdalom esetén egyéb kéztőcsont törését, a lunatum malatiat, valamint egyéb betegségeket kell kizárni.
III. Terápia
III/1.Nem gyógyszeres kezelés
1. A megfelelő egészségügyi ellátás szintje
Elsősegélynyújtás a helyszínen a sérült végtag nyugalomba helyezése ha a fájdalom ezt szükségessé teszi, mint luxatiós, vagy kombinált sérülések esetén. A végleges ellátás osztályos háttérrel rendelkező járó beteg szakellátáson vagy traumatológiai osztályon / klinikán történik, ahol kézsebészeti szakképzettséggel, jártassággal rendelkező szakorvos is elérhető.
2. Non operatív, konzervatív kezelés.
2.1. Repositio (WHO 82 080)
A scaphoideum törések többsége elmozdulás nélküli, repositiot nem igényel. Ficammal (De Quervain), vagy radius töréssel kombinált törés repositioját megfelelő anaesthesiában húzás ellenhúzás mellett fedetten végezzük képerősítő ellenőrzésével.. Ezt követi a Bennett típusú felvágott gipszrögzítés.
2.2. A végleges körkörös Bennett gipszrögzítést a duzzanat megszűnése után kb. 1 hét elteltével helyezzük fel, gondosan ügyelve, a rögzítés jól modellált legyen és a hosszú ujjak, valamint a hüvelykujj végperc szabad mozgását biztosítsa.
A rögzítési idő 12-16 hét, instabil és proximális pólus törése esetén akár 20 hét is lehet.
3. Speciális ápolási teendők
A gipszrögzítés lazulása esetén annak cseréjét el kell időben végezni.
4. Fizikai aktivitás
Gyógytornával a könyökízület, a hosszú ujjak MP, PIP és DIP ízületi, valamint a hüvelykujj IP ízületi funkcióját meg kell tartani.
5. Betegoktatás Gyógytorna oktatás
A kéz funkciójának megtartása
III/2. Gyógyszeres kezelés
1. Ajánlott gyógyszeres kezelés Szükség esetén fájdalomcsillapítás.
III/3. Műtéti töréskezelés
1. A megfelelő egészségügyi ellátás szintje
Traumatológiai osztályon / klinikán végezhető.
2. Általános intézkedések Anaesthesiológia belgyógyászati kivizsgálás
3. Speciális ápolási teendők
A műtéti behatolás területén ne legyen fertőző forrás (bulla).
4. Sebészeti kezelés Műtéti töréskezelés
4.1.műtéti indikáció
A műtéti töréskezelés absolut és relatív indikáció alapján végezhető.
Absolut indikáció:
Nagy elmozdulással járó, instabil törés
Trans-scaphoideo-perilunaris luxátiós törés
Trans-stylo-tans-scaphoideo-perilunaris kombinált törés
Relatív indikáció:
Minden felnőttkori elmozdulással járó és elmozdulás nélküli középső és proximális harmadi törés
Tuber törés
4.2.műtéti előkészítés
Lehet acut (luxatios törés) vagy halasztott műtét
4.3.műtéti érzéstelenítés
Általános érzéstelenítés, plexus érzéstelenítés, local anaesthesia
4.4.műtét: A műtéti töréskezelés módszerei:
4.4.1. Kanülált percután bevezetett Herbert-Whipple csavaros rögzítés (58118)
Képerősítő ellenőrzése mellett a palmaris oldalon a tuber felett ejtett kis metszésből scaphoideum tengelyébe bevezetjük a Kirschner drótot, majd megfúrjuk a csavar helyét és bevezetjük a megfelelő méretű kanülált önmenetvágó Herbert Whipple csavart. Proximális pólus törés esetén dorsal felől kis feltárásból a képleteket estensor inakat eltartva hasonló módon helyezzük be a csavart.
4.4.2. Feltárásos Herbert csavarozás (58118)
Palmar felől feltárjuk az os scaphoideumot, szem ellenőrzése mellett repositiot végzünk, felhelyezzük a célzó készüléket, megfúrjuk a csavar helyét, menetet vágunk és a célzó készülékkel mért hosszúságú csavarral stabilizáljuk a törést. Proximális pólus törés esetén szabadkézi célzással képerősítő ellenőrzése mellett helyezzük be a Herbert csavart.
4.4.3. Kompressziós csavaros osteosynthesis
A kompressiós csavarokat fedett vagy feltárásos módszerrel helyezzük be a scaphoideumba distal vagy a proximalis pólus felöl.
4.4.4. Ender lemezkés osteosynthesis
Palmaris feltárásból az os scaphoideum proximális törtdarabjába helyezzük a lemezke pengéjét és az excentrikusan behelyezett csavarral végezzük a kompressziót és a rögzítést. (Ma már a Herbert csavar megjelenése miatt háttérbe szorult ez a rögzítési módszer) 4.4.3. Kirschner drótos rögzítés
Gyermekkori törések esetén végezzük a fedett, képerősítő ellenőrzése mellett behelyezett tűződrótos osteosynthesist. Alkalmazható olyan darabos törések rögzítésére, amelyek más módon nem kezelhetők.
4.5.posztoperációs teendők
A műtéti terület drainageja, a végtag felpolcolása, gyógytorna megkezdése.
5. Fizikai aktivitás
Stabil synthesis esetén gipszrögzítést nem vagy csak néhány napig alkalmazunk, aktív csukló és ujjízületi tornát, gyógytornát kezdünk el. Fizikai terhelést tiltjuk. Instabil törés esetén 6-8 hetes Bennett gipszrögzítés szükséges.
6. Betegoktatás
Gyógytorna oktatása, fizikai terhelés engedélyezése
IV. Rehabilitáció
A rehabilitáció szükségességének paraméterei
V. Gondozás
1. Rendszeres ellenőrzés
A törésgyógyulást meghatározott időszakonként ellenőrizzük. Radiológiai vizsgálat 8 és 16 hetes valamint fél és egy év elteltével szükséges.
2. Megelőzés
Álízület kialakulásának megelőzése Csuklóízületi mozgáskorlátozottság megelőzése
3. Lehetséges szövődmények
3.1. Scaphoideum álízület kialakulása.
Kezelése: cortico-spongiosus block beültetése és Herbert csavaros osteosynthesis
3.2. Proximalis pólus avascularis necrosisa.
Terápia: Herbert csavaros rögzítés és csontpótlás, proximal row carpectomy vagy radiocarpalis arthrodesis.
3.3. Radio-carpalis arthrosis.
Terápia: radio-carpalis arthrodesis
3.4. Nervus radialis dorsalis érző ágának iatrogén károsodása (teljes vagy részleges)
Terápia: konzervatív kezelés, a n. radialis feltárása, neurolysis idegvarrat vagy graft. (WHO 50421, 50440, 50430)
4. Kezelés várható időtartama/Prognózis
Egyszerű törés esetén 8-16 hét
Gyermekkori törés esetén 8-12 hét
Teljes radiológiai gyógyulás fél-1 év
5. Az ellátás megfelelőségének indikátorai
Szakmai munka eredményességének mutatói
Rögzítési idő és a gyógyulás összefüggése
Konzervatív és műtéti kezelés aránya
Szövődmények aránya
Funkcionális végeredmény monitorizálása
VI. Irodalomjegyzék
1. Ács Géza - Hargitai Ernő: Gyermektraumatológia. Medicina Bp. 2001.
2. Cziffer E.: Operatív töréskezelés. Spinger Hungarica Budapest 1997.
3. Gaál Csaba: Sebészet, Medicina Bp. 2010
4. Renner Antal: Traumatológia Medicina Bp. 2000.
5. Rüter A. Tentz. O. Wanger M.: Unfallchirurgie. Munchen, Wien, Baltimore 1995.
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a szeptikus kézről
Készítette: a Magyar Kézsebész Társaság vezetősége a Traumatológiai Szakmai Kollégium egyetértésével
I. Alapvető megfontolások
BNO L0880 A bőr és a bőralatti szövetek egyéb, meghatározott helyi fertőzései
M0090 Ízületi gyulladás nem specifikált pyogen kórokozó miatt
M6500 Ínhüvely tályog
M6510 Egyéb fertőzéses tendinitis (synovitis)
M6511 Tendinitis, tendinitis purulenta
M6512 Mélytenyéri phlegmone
M8610 Egyéb akut osteomyelitis
M8620 Szubakut osteomyelitis
M8660 Egyéb idült osteomyelitis
M8680 Egyéb osteomyelitis
M8690 Osteomyelitis, k.m.n.
Alapelvek
Pontos diagnózis, időben elvégzett, esetenként megelőző sebészi beavatkozás, radikális sebészi kezelés, célzott antibiotikus kezelés, időben végzett ismételt műtéti beavatkozás a szeptikus folyamatok kezelésének alapvető szempontjai.
A beavatkozásokat a sterilitás maximális betartásával kell és szabad végezni, műtői körülmények között.
A szeptikus kéz kezelési tervének kialakítását és a szükséges beavatkozások elvégzését minden esetben jártas, tapasztalt szakember végezze
1. A protokoll alkalmazási, érvényességi területe
Sebészet, kézsebészet, ortopédia, traumatológia.
2. A protokoll bevezetésének alapfeltétele
A szakmai kollégium illetékes tagozatának legitimációja.
Szakmai minimum feltételeknek megfelelő sebészeti, traumatológiai, ortopédiai vagy kézsebészeti osztály.
3. Definíció
A kéz szeptikus folyamatán a kézen létrejött, a kéz speciális anatómiai szerkezete következtében speciális, a kézre vonatkozó jellemzőkkel bíró, baktériumok okozta fertőzéses állapotokat értjük.
3.1. Kiváltó tényezők
Az ok gyakran nem felismert, banális sérülés, mikrosérülés. Gyakori, hogy a primer sérülés nem kerül felismerésre. A kéz sokrétű feladatának végzése közben létrejövő különböző sérülések, mechanikai, kémiai, termikus hatások. Különböző mechanikai erők, hegyes és éles eszközök, emberi és állati harapás, horzsolás. Orvosi beavatkozás, műtét utáni szövődmény. Kimutatható bizonyos foglalkozások és kézfertőzések közötti összefüggés (fodrászok, konyhai dolgozók, hentesek, nehéz fizikai munkát végzők, egészségügyi dolgozók).
3.2. Kockázati tényezők
Diabetes mellitus, immundeficiens állapotok, keringési zavarok, anatómiai lokalizáció (hüvelykujj, mutatóujj gyakrabban érintettek). Légzőszervi infekciók, bőrfertőzések.
4. Panaszok, tünetek, általános jellemzők
A gyulladás általános tünetei (tumor, dolor, rubor, calor, functio laesa) gyakran csak részben vagy elfedve, speciális formában jelennek meg. Általában váratlanul, gyorsan kialakuló panaszok, tünetek. Lüktető jellegű spontán fájdalom, amely a kéz lógatására fokozódik. A fertőzéses góc kifejezett nyomásérzékenysége. Bőrpír nem minden esetben jellemző, mélyebb folyamatokban hiányozhat. A duzzanat tenyéri folyamat esetén a háti felszínen alakulhat ki, a speciális tenyéri anatómiai szerkezet miatt. A folyamat lokalizációja mindig a legnagyobb érzékenység helyének, és nem a legnagyobb duzzanat helyének felel meg. Funkciókiesés minden esetben létrejön, mértéke és jellege a folyamat súlyosságának, illetve anatómiai elhelyezkedésének függvénye. Tenyéri folyamatok jellemzője az ún. védekező, enyhén hajlított helyzetű kéztartás. A láz nem mindig jellemző tünet, de a mély folyamatok mindig lázzal járnak. Lymphangitis főképp felületes akut folyamatok kísérője.
5. A betegség leírása
5.1.Érintett szervrendszer
A bőr, szubkután réteg, peritendineum, ínhüvelyzsák, ízület, csont, illetve ezek összessége.
5.2.Genetikai háttér:
Nincs genetikai háttér.
5.3.Incidencia/Prevalecia/Morbiditás/Mortalitás Magyarországon:
5.4.Jellemző életkor
Leggyakoribb a 20-40 éves korosztályban, de minden életkorban előfordulhat. Idősebb korban gyakori a súlyos lefolyás.
5.5.Jellemző nem: Egyik nemben sem fordul elő gyakrabban.
II. Diagnózis
Akut esetben
1. Diagnosztikai algoritmusok
A biztos diagnózis felállításához elsősorban az anamnézis, a fizikális vizsgálat és a laborvizsgálatok általában elégségesek. RTG felvétel krónikus esetben lehet kórjelző, de mindenképpen hozzátartozik a vizsgálati protokollhoz. A váladékból bakteriológiai mintavétel.
2. Anamnézis
Általános és speciális anamnézis felvétele.
Nyílt sérülések után létrejött fertőzések esetén a sérülés jellege, létrehozó eszköz, környezet, kockázati tényezők rögzítése. Primer kézfertőzések esetén a kiváltó ok sokszor nem tisztázható.
3. Fizikális vizsgálat
A páciens és a kéz fizikális vizsgálata az adott körülmények által lehetővé tett legnyugodtabb viszonyok mellett. Vizsgálati sémák alkalmazása. Szondateszt vizsgálat, melynek során gombos szondával meghatározzuk a góc kiterjedését, az ép szövetek felől közelítve. A fájdalom punctum maximumának meghatározása.
4. Diagnosztikus jelek
Fájdalom, duzzanat, védekező kéztartás. Nyílt sérülések esetén a seb elhelyezkedése, jellemzői.
4.1.Laboratóriumi vizsgálatok:
Általános vizsgálatokon túl a gyulladásos paraméterek (PCT, CRP, süllyedés ) vizsgálata.
4.2.Képalkotó vizsgálatok:
Röntgen felvételek
Akut esetben nem kórjelző, idegentest, csontsérülés kimutatható. UH és MRI vizsgálat
Lágyrész elváltozások, folyadékgyülem kimutathatók
4.3.Egyéb
5. Kiegészítő diagnosztikai vizsgálatok: Nincs.
6. Differenciál diagnosztika
A különböző, kézen előforduló szeptikus kórformák elkülönítése a speciális tünetek, érzékenységi területek, ujjtartások, funkció kiesés alapján.
A nem pyogén, specifikus betegségek elkülönítése.
Akut synovitis, tenosynovitis: az anamnézis, fizikális vizsgálat, illetve laborvizsgálatok alapján.
Osteoarthrosis: anamnézis, laborvizsgálat, rtg.
Köszvényes csomó akut érzékenysége szeptikus folyamat klinikai képével járhat.
Krónikus esetben
1. Fizikális vizsgálat
Gyulladásos tünetek nem mindig állnak fenn, kórjelző a tartós váladékozás.
2. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok:
1. Laboratóriumi vizsgálatok:
Krónikus esetben sokszor nem kórjelző.
2. Képalkotó vizsgálatok:
Csont, ízületi folyamat esetén alapvető jelentőségű
3. Differenciál diagnosztika:
Akut szeptikus kórképek a kézen
1. Bulla purulenta cutaneum: a bőrben elhelyezkedő purulens bulla, környéki duzzanat, bőrpír, gyakori lymphangitis jellemzik.
2. Köröm körüli gyulladások
Paronychia
Panaritium periunguale
Panaritium subunguale
Gyakran előforduló, igen fájdalmas, a körömsánc gyulladása az elsődleges, ennek tovaterjedése során a köröm körül, illetve alatt is kialakulhat a pyogén folyamat. A körömsáncon duzzanat, bőrpír, érzékenység egyik oldalon, vagy a köröm körül. A köröm alatti kiterjedés esetén a köröm alatt áttűnő váladék.
3. Panaritium subcutaneum: heves, lüktető fájdalom, főképpen éjszaka. Környező bőrpír, a duzzanat elsősorban dorsalisan látható. A góc szondával körülhatárolható. Az ujjakon és a tenyérben egyaránt előfordulhat. Speciális formája az inggomb-tályog, ami a cutan bulla és a panaritium kombinációja. Bulla cutaneum esetén mindig gondolnunk kell ennek lehetőségére.
4. Phlegmone interdigitalis: erős nyomási fájdalom a tenyéri oldalon, dorsalisan duzzanat. Típusos kéztartás az érintett sugarakban a terpesztett ujj.
5. Tenosynovitis purulenta: az ínhüvely mentén érzékenység, legkorábban a tenyéri szájadéknál jelentkezik. Magas láz, hidegrázás. Flexiós kényszertartás. Körkörös oedema, a háti felszínen kifejezettebb, a kézhátra is terjed. Speciális formája az I. illetve az V. ínhüvelyzsák gyulladás során kialakuló V phlegmone, ami az említett ínhüvelyzsákok anatómiai összeköttetése következtében jön létre. Súlyos általános tünetek mellett a hüvelyk és kisujj flexiós tartása, fájdalom végig az érintett ínhüvelyek mentén.
6. Arthritis purulenta, ujjízületek: direkt sérülés következménye, anamnézis fontossága. Duzzadt ízület, körkörös érzékenység, 30-40 fokos flexiós kényszertartás.Passzív mozgatás igen fájdalmas. Láz, hidegrázás.
Radiocarpalis ízület: általában másodlagos, mély tenyéri gyulladások progressziója során, vagy haematogén úton jöhet létre. Duzzanat, fájdalom, mozgásbeszűkülés, kényszertartás.
7. Osteomyelitis: erős spontán lüktető fájdalom, erős duzzanat, ujjperc érintettsége esetén orsószerű duzzanat. Akut esetben magas láz. Krónikus esetben sipolyképződés. Csontelváltozás rtg jele 8-10 nap után.
8. Mély tenyéri terek gyulladása (középső, radialis):erős duzzanat, jelentős kézháti oedema, láz, hidegrázás, elesettség. A radialis tér gyulladása esetén a thenar erős duzzanata, I-II. interdigitalis tér kitöltöttsége. A középső tér gyulladása esetén jellemző a hosszú ujjak alappercének hyperextensioja, percközti ízületek enyhe flexiója.
9. A Parona tér gyulladása: a pronator quadratus és a membrana interossea, illetve az alkari flexorok között lévő virtuális tér gyulladása. Az alkaron volarisan duzzanat, erős fájdalom, bőrpír, dorsalisan jelentős oedema. Magas láz, elesettség.
10. Phlegmone a kéz háti oldalán: kiterjedt környéki odema, bőrpír, spontán és tapintási fájdalom, láz.
11. Pandactylitis: a pyogén gyulladásnak az ujj valamennyi szövetére való kiterjedése, együttesen való megléte. Általában kezelési hibák következtében, vagy nem elvégzett kezelés során alakul ki. A diagnózis felállítása az amputáció műtéti indikációja. Hüvelykujj esetén szoros obszerváció mellett csak a biztosan életképtelen részeket távolítjuk el.
III. Kezelés
II/1. Alapelvek
Korai diagnózis, megfelelő értékelés, obszerváció. Konzervatív vagy operatív kezelés lehetőségének értékelése. Amennyiben műtéti kezelés szükséges, a lehető legkorábbi időpontban kell elvégezni. Szisztémás antibiotikus kezelés a műtéti feltárással együtt, illetve konzervatív kezelés esetén alkalmazandó. Ambulánsan kezelhetők a felületes, kezdeti folyamatok, a körömperc lokális, kezdeti folyamatai.
Hospitalizáció szükséges általános tünetek (láz, lymphangitis) esetén, mély folyamatok kezelése során, illetve amennyiben a sebészi feltáráshoz általános anaesthesia szükséges.
Konzervatív kezelés:
A kezdeti felületes gyulladások, a körömrégió kezdeti gyulladásai kezelhetők abortív kezeléssel.
Functionalis helyzetű rögzítés, párakötés. Lymphangitis, láz esetén szisztémás antibiotikus kezelés, szoros obszerváció. Amennyiben 24-48 órán belül nincs vissszafejlődés, sebészi feltárás végzendő.
III/2. Műtét
Konzervatív kezelés során 24-48 órán belül nem regrediáló, illetve az 1. pontban nem felsorolt esetek mindegyikén műtéti kezelés végzendő.
1. Sebészi feltárás, incisio. A metszésvezetés a kézsebészeti fiziológiás metszésvezetés alapelvei szerint végzendő, célja a váladék lebocsátása, a nekrotikus szövetek kimetszése, a váladékelvezetés biztosítása, öblítés lehetősége.
2. Drenázs: sebváladék zavartalan elfolyásának biztosítása puha felezett szilikondrénnel. Az öblítés lehetősége instilláló drainnel érhető el. A daineket öltésekkel rögzítjük.
3. Lokális antibiotikus kezelés: hatása nem bizonyított, legfontosabb az öblítés mechanikus tisztító effektusa.
4. Funkcionális helyzetű rögzítés körömperc folyamatok esetén alusínnel, proximalisabb folyamatok esetén gipszrögzítéssel. A végtag felpolcolása.
5. Szisztémás antibiotikus kezelés a sebészi feltárással együtt, illetve azt követően is végzendő, kezdetben empirikus, majd-amennyiben szükséges és lehetséges- célzott antibiotikus kezelés. Első választandó a béta laktamáz aminopenicillin, érzékenység esetén klindamicin iv. adása. A második postoperatív naptól láz hiánya esetén per os adagolásra térhetünk át.
6. Amputáció: pandactylitis esetén, illetve progrediáló, az életet veszélyeztető folyamat esetén indokolt.
7. Műtéti kontraindikáció
A műtét nem végezhető el, ha a beteg a felvilágosítás után a műtéti kezelést nem vállalja, illetve a műtét biztonságos elvégzéséhez szükséges intézkedéseknek nem hajlandó alávetni magát. Akut veszélyeztető állapotban megfelelő dokumentáció után vitális indikációval a műtét elvégezhető.
8. Műtéti előkészítés
A kézsebészeti műtéti előkészítés általános szabályainak betartása mellett . A vértelenség soha nem kipólyázva, csak eleváció mellett alkalmazható.
9. Műtéti érzéstelenítés
A műtét az ujjakon a PIP ízülettől distalis eseteknél vezetéses érzéstelenítésben végezhető. A proximalisabb lokalizációnál általános anesztézia, narkózis alkalmazandó.
10. Posztoperatív teendők
A végtag elevációja. Naponta-vagy szükség esetén gyakrabban- sebellenőrzés. Ismételt feltárás, second-look műtét, amennyiben szükséges .Az akut szak lezajlása után functionalis kezelés.
IV. Rehabilitáció
V. Gondozás
1. Rendszeres ellenőrzés: Bőrápolás, functionalis utókezelés.
2. Lehetséges szövődmények:
A sebészi beavatkozás általános szövődményei.
A gyulladás progressziója.
Ízületi contracturák.
A mozgásterjedelem beszűkülése
2.1. Szövődmények kezelése
A fenti szövődmények korai felismerése, azok műtéti korrekciója progresszió esetén korai ismételt feltárás. Ízületi mozgásfelszabadítás
3. Kezelés várható időtartama/Prognózis
Nem meghatározható. Korai diagnózis, beavatkozás esetén a - folyamat súlyosságától függően - gyors remisszió várható. Osteomyelitis hosszú idejű kezelést igényelhet.
VI. Irodalomjegyzék
1. Gaál Csaba: Sebészet, Medicina Bp. 2010.
2. Renner (szerk.)Traumatológia 2003.Medicina,Budapest
3. Renner:A kéz piogén fertőzési 1999. Medicina, Budapest
4. Green: Operative Hand Surgery Churchill-Livingstone 3d ed. 1993
5. Lister:THE HAND Diagnosis and Indications Churchill-Livingstone 1993
6. Oberlin:Manuel de Chirurgie du Mambre Superieur Elsevier 2000
A szakmai protokoll érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja
a kórházi védőnői feladatokról a szülészeti és újszülött ellátásban
Készítette: a Védőnői Szakmai Kollégium
I. Alapvető megfontolások
A védőnő alapfeladata az elsődleges prevenció. A gyermeket váró szülők részéről alapvető elvárás, hogy a várandós anya, szülő nő és születendő/megszületett gyermeke fokozott törődést kapjon a társadalomtól. A Nemzeti Népegészségügyi Program kiemelt prioritása az elsődleges megelőzés. A folyamatos ellátás érdekében nélkülözhetetlen alapellátás és a fekvőbeteg ellátás közötti kapcsolat, melyet a kórházi védőnő nagymértékben elő tud segíteni.
A szülészeti-, gyermekágyas-, újszülött ellátás olyan összetett, interdiszciplináris szolgáltatás, amely a szülész-nőgyógyász (egészségügyi szolgáltató), szülésznő, a védőnők és a szülő anya (és családja) valamint szükség esetén szociális és gyermekvédelmi ellátó rendszer esetenként civil szervezetek együttműködésére épül.
Protokoll bevezetésének alapfeltételei
Személyi feltétel:
Az intézményi védőnői feladatokat felsőfokú védőnői végzettséggel rendelkező, az alapnyilvántartásban szereplő, működési regisztrációba felvett védőnő láthat el, mely a helyettesítésre is vonatkozik. Főállású védőnőt kell alkalmazni a 30 ágynál nagyobb, illetve 1500 szülést meghaladó szülészeti-nőgyógyászati osztályokon. Kórházi védőnő feladatait személyre szóló munkaköri leírás tartalmazza.
Tárgyi feltétel:
A fekvőbeteg ellátásban a szülészeti/újszülött osztályokkal/egységekkel rendelkező intézményekben, a dokumentáció végzésére, szülő nővel való személyes négyszemközti megbeszélésre alkalmas helyiség biztosítása. Számítógép, nyomtató, telefon, fax, Internet vonal időben és fizikailag korlátlan használatának lehetősége.
Az intézményen belül, jól látható helyen a kórházi védőnő nevének, elérhetőségének és rendelkezésre állási idejének feltüntetése.
Szülő edukációhoz (újszülött gondozás, szoptatás) szükséges oktatóeszközök.
1. Alkalmazási/érvényességi területe
1.1. Protokoll témájának pontos meghatározása, témaválasztás indoklása
Az egyén egészséges életét a szülés körül bekövetkezett változások, események igen nagymértékben befolyásolják.
Nincs egységesen megvalósuló, mindenki számára megközelítően azonos ellátás a fekvőbeteg intézményekben a kórházi védőnői tekintetben. A kórházak eltérő lehetőséget biztosítanak az ellátás nyújtására.
1.2. A protokoll célja
- A fekvőbeteg intézményekben közreműködés a várandós/gyermekágyas anyák megelőző ellátásában, különösen az anyák felkészítésében az újszülött táplálására és ellátására, a hazabocsátást követő első napok szervezésére és a legfontosabb teendőkre.
- A fekvőbeteg intézmény és az egészségügyi alapellátás közötti együttműködés kialakítása, az egészségügyi ellátás folyamatosságának biztosítása a szükségletnek megfelelő ellátás érdekében.
A protokoll célkitűzése
Országosan megvalósuljon az egységes kórházi védőnői tevékenység a fekvőbeteg ellátás területén, ezen belül:
- az újszülött hazaadás feltételeinek egységes meghatározása
- az újszülött fogadására a szülői felkészülés segítésére és szabályainak lefektetésére
- a kórház és az alapellátás kívánatos kapcsolatának rögzítése
- fekvőbeteg intézményen belül a szoptatás támogatásának elvárásainak rögzítése, a bababarát kórházak kritériumrendszerének megfelelően
- a várandós/gyermekágyas anya egészségének megőrzése
- a magzat egészséges életkezdésének elősegítése
- a veszélyeztetettség megfelelő időben történő felismerése, megelőzése
- az örökbe adó szülő döntésének megfelelően a nyílt, vagy titkos örökbeadás segítése
- az intézményen belül működő szülésre felkészítő programok segítése
- a kizárólagos szoptatás megvalósulásának segítése
- a szülés körüli esetleges hangulatzavar megfigyelése
- speciális ellátást igénylő anya pszichés támogatása
1.3. A protokoll célcsoportjai
- A fekvőbeteg intézményben dolgozó, illetve a feladatot ellátó kórházi védőnő
- A fekvőbeteg intézménybe felvett várandós/szülő nő és családja, illetve magzata/ újszülöttje
- Közvetve az alapellátás védőnője
2. Definíciók, rövidítések
2.1. Definíciók
A védőnői gondozás: Az egészségi ártalmakat megelőző és elhárító, az életkörülmények javítására irányuló szervezett, tervezett tevékenység, amelynek speciális módszere a tanácsadás, kiegészítő eleme az egészségi állapot felmérése, a kialakult kóros anomáliák és betegségek megelőzése, szükség esetén jelzése.
3. Az ellátási folyamat leírása,
1. számú melléklet
II. Gondozási szükséglet feltárás (diagnosztikai eljárások)
A folyamat leírása, ellátási algoritmus (Készült a "Védőnői Szakfelügyeleti Iránymutatás a kórházi védőnői munkával kapcsolatos szakmai felügyelethez" felhasználásával)
1. Állapotfelmérés, vizsgálatok, adatfelvétel, tevékenység
A szülész által vezetett szülészeti napló, illetve a kórházi informatikai rendszer használata alapján a kórházi védőnő nyilvántartásba veszi a szült anyát földrajzi területtől függetlenül. Az értesítő (1.2.) megküldésével (3. számú melléklet) tájékoztatja a távozási cím szerinti területi védőnőt.
1.1. Anamnézis/adatfelvétel
Célja: A várandós/szülő nő jelen állapotot, hazabocsátását befolyásoló (protektív és rizikó) tényezők, rögzítése és a szükséges intézkedések indítása.
Helye: a várandós/szülő nő kórterme, a védőnő munkaszobája
Ideje: A fekvőbeteg intézménybe való felvételt követően
Eszköze, módja: Anamnézist készít a gyermekágyas anya és újszülöttje szükségleteinek meghatározásához a hazamenetelre való felkészítéshez (testi, lelki, szociális).
1.2. Fizikális vizsgálatok
Célja: az újszülött szopásának megfigyelése, szoptatási-szopási akadályok feltárása, annak érdekében, hogy az észlelést követően a lehetőség szerinti legrövidebb időn belül a szaksegítség megtörténjen.
Helye: a várandós/szülő nő kórterme, a védőnő munkaszobája
Ideje: A fekvőbeteg intézménybe való felvételt követően a lehető legrövidebb időn belül
1.2.1. Az emlők szemrevételezése és tapintásos vizsgálat
Célja: Az anatómiai helyzet tisztázása, rendellenesség felderítése és lehetőség szerint korrigálás elvégzésének megkezdése, az eredményes szoptatás érdekében.
A vizsgálat módja, a mérési eredmények értékelése: 2. számú melléklet Teendők:
- Felkészítjük a várandóst a szülést követő teendőkre
- Közreműködés gyermekágyas anya részéről felmerülő szoptatási nehézség elhárításában
- A mért eredmények dokumentálása
1.2.2. Az újszülött szopási magatartásának megfigyelése Célja: A jó szopási technika megalapozása
A tapasztalatok értékelése külön protokoll szerint (Az Egészségügyi Minisztérium szakmai protokollja Az egészséges csecsemő (0-12 hónap) táplálásáról Készítette: a Védőnői Szakmai Kollégium) Teendő:
- Szopási nehézség esetén pszichés és gyakorlati segítségnyújtás
- Az észlelések dokumentálása
2. Tájékoztat
2.1. A gyermekágyas állapot testi-lelki változásairól:
a) involúciós folyamatok: belső nemi szervek,
b) sebgyógyulás folyamata: gyermekágyi folyás (lochia) jellemzői, vagina, vulva sérüléseinek, a gátmetszés sebének gyógyulása,
c) evolúciós folyamat a gyermekágyban: az emlő változásai, tejelválasztás menete, tejbelövellés, tejtermelés (prolactin-reflex), tejkiürülés (oxytocin-reflex), hangulati változás;
d) szülés utáni lehangoltság:
- ok nélkül sírva fakad,
- átmenetileg alvási, evési, döntéshozatali nehézségei vannak,
- megkérdőjelezi, hogy képes lesz-e ellátni gyermekét, stb.
e) orvosi ellátást igénylő tünetekről:
- nemi szervi vérzések
- gyermekágyi infekciók, gyermekágyi láz
- visszérgyulladás, trombózis,
- tüdőembólia
- gyermekágyi pszichózis
- csont- és ízületi rendszer betegségei
- húgyúti gyulladások,
- emlőgyulladás
2.2. Szükség esetén az újszülöttjeiket nem szoptatható, illetve megfelelő tájékoztatás ellenére szoptatni nem akaró anyák tájékoztatása az újszülött táplálásának egyéb lehetőségeiről
a) női tej biztosításának lehetőségei,
b) tápszer esetén a legfontosabb használati útmutatás.
2.3. Kórházi védőnő feladatiról, az intézményen belül, jól látható helyen a kórházi védőnő nevének, elérhetőségének és rendelkezésre állási idejéről.
3. Felkészíti
az anyát újszülött gondozásának alapvető műveleteire, különös tekintettel az alábbi szempontokra:
a) az újszülött elhelyezése, felemelése, tartása (hirtelen csecsemőhalálozás, baleset megelőzése),
b) vetkőztetés, öltöztetés,
c) a bőr, köldök ápolása,
d) a pelenkázás módszerei,
e) lázmérés, lázcsillapítás módszerei,
f) tájékoztatja az orvosi ellátást igénylő tünetekről (http://www.ogyei.hu/hu/files/download.php?id=64) (5. sz. melléklet)
4. Támogatja a harmonikus anya-gyermek közötti kapcsolat kialakulását, az anya és újszülöttje "biztosan" kötődésének folyamatát, hogy az anya érzékenyen, gyorsan és megfelelően reagáljon újszülöttje jelzéseire.
g) az újszülött jelzéseinek figyelése, megértése, a reagálás fontossága,
h) a szemkontaktus,
i) a bőrkontaktus,
j) a simogatás,
k) az ölelés,
l) a beszéd,
m) az együttes elhelyezés,
n) a szoptatás fontossága a kötődés folyamatában.
5. Közreműködik
5.1. a szoptatást támogató környezet kialakításában ("Minden csecsemő fontos! - Egészségügyi dolgozók kézikönyve az anyatejet helyettesítő készítmények marketingjének nemzetközi kódexéhez - A Szoptatásért Magyar Egyesület, 2005.), segíti az anyát a szoptatásban (Gyakorlati útmutató a szoptatás segítéséhez (OGYEI, Szoptatást Támogató Nemzeti Bizottság, 2009.), az újszülött igénye szerinti kizárólagos szoptatás megvalósításában a protokoll szerint, különös tekintettel az alábbi szempontokra:
a) a korai, az újszülött igénye szerinti, kizárólagos szoptatás jelentősége az első 6 hónapban,
b) felkészülés a szoptatásra,
c) az anya testtartása, az újszülött testhelyzete,
d) az emlő tartása, alátámasztása,
e) mellre helyezés és mellre tapadás,
f) az újszülött evés iránti igényének jelei:
g) ébresztési technikák,
h) a szopás mechanizmusa, a hatékony szopás jelei,
i) az emlő kiürítése (kézi fejés menete, mellszívók használatával kapcsolatos fontos tudnivalók),
j) leggyakrabban előforduló problémák és azok megelőzése (jelek/tünetek, okok, kezelés): fájdalmas, sérült emlőbimbó, túltelítődés, tejcsatorna elzáródás, mastitis, elégtelen tejtermelés, ismerje a teendőket ezek esetén.
k) az anyatejet helyettesítő készítmények marketingjének nemzetközi kódexe (WHO Kódex) pontos ismerete, betartása.
5.2. a gyermekvédelemben (Gyermekvédelem szempontjából veszélyeztetettség ("GyV"): olyan magatartás, mulasztás vagy körülmény következtében kialakult állapot, amely a gyermek testi, értelmi, érzelmi és erkölcsi fejlődését gátolja, vagy akadályozza), szükség esetén az újszülött ideiglenes hatályú elhelyezésében, örökbeadás/örökbefogadás előkészítésében.
A védőnő a gyermek családban történő nevelkedésének elősegítése, a magzat, a gyermek veszélyeztetettségének megelőzése és megszüntetése érdekében a gyermekvédelmi rendszerhez kapcsolódóan is ellát feladatokat - az észlelő- és jelző rendszer tagja. Ennek keretében köteles jelezni (igazolható módon) a gyermek veszélyeztetettségének észlelése esetén a kórházi szociális munkás (A gyermekek védelméről és a gyámügyi igazgatásról szóló 1997. évi XXXI. törvény 40. §. (3) bekezdése alapján:
"Gyermekjóléti központnak minősül az az önálló intézményként, illetve szervezeti és szakmai szempontból önálló intézményegységként működő gyermekjóléti szolgálat, amely az általános szolgáltatási feladatain túl a gyermek családban nevelkedésének elősegítése, a gyermek veszélyeztetettségének megelőzése érdekében a gyermek igényeinek és szükségleteinek megfelelő önálló egyéni és csoportos speciális szolgáltatásokat, programokat nyújt. Így: c) kórházi szociális munkát,") vagy a lakóhely szerint illetékes gyermekjóléti szolgálat, gyámügyi hatóság felé.
(Megjegyzés: a személyes gondoskodást nyújtó gyermekjóléti, gyermekvédelmi intézmények, valamint személyek szakmai feladatairól és működésük feltételeiről szóló 15/1998. (IV. 30.) NM rendelet 7/C. § szerint:
(1)A kórházi szociális munka célja
a)a szülészeti-nőgyógyászati osztályon a kórházi védőnővel együttműködve a szociális válsághelyzetben lévő anya és gyermekének segítése;
b)a gyermekosztályon a gyermekelhanyagolás és bántalmazás észlelése esetén a Gyvt. 17. §-ának (2) bekezdése szerint szükséges intézkedések megtétele.
(2)A gyermekjóléti központ szerződést köt az egészségügyi intézménnyel, amelyben rögzítik a kórházi szociális munka biztosításának kereteit, valamint az együttműködés módját.
(3)A gyermekjóléti központ az illetékessége alá nem tartozó gyermeket, a gyermek további ellátása biztosításának érdekében az illetékes gyermekjóléti szolgálathoz vagy központhoz irányítja.)
5.3. Közreműködik a szülészeti/újszülött osztály/egység csoportos foglalkozásainak szervezésében és/vagy vezetésében és/vagy tartásában.
6. A kórházi védőnő együttműködik a feladatok ellátása során az adott intézménnyel, szervezeti és működési rendjének megfelelően tervez, egyeztet, szervez.
7. Megbeszéli a gyermekágyas anyával a táplálkozásra, a személyi higiénére - vonatkozó fontosabb szempontokat:
a) egészséges táplálkozás a gyermekágyban, a szoptatás alatt,
b) személyi higiéne (testápolás, bőrápolás, emlőápolás, fogápolás, stb.).
8. Kapcsolatot létesít, tájékoztatja és együttműködik a lakóhely/tartózkodási hely szerint illetékes területi védőnővel az intézményből való távozást követő szükséglet szerinti otthoni gondozás és alapellátás (egészségügyi, szociális) biztosítása érdekében.
a) Értesíti várható lakóhely/tartózkodási hely szerint illetékes területi védőnőt a gyermekágyas anya és/vagy az újszülött intézményből való távozásról. Az Értesítő adattartalmát az Kórházi Értesítő Születésről című 3. sz. melléklet foglalja össze.
b) Speciális ellátást igénylő esetekben védőnői szociális helyzetelemzést (védőnői környezettanulmányt) kér, hogy otthonába bocsátható-e az újszülött.
9. Dokumentálja a kórházi védőnői tevékenységet
Az egészségügyről szóló 1997. évi CLIV. törvény 136-137. §: Az egészségügyi ellátást igénybe vevő személy vizsgálatával és gyógykezelésével kapcsolatos adatokat az egészségügyi dokumentáció tartalmazza. Az egészségügyi dokumentációt úgy kell vezetni, hogy az a valóságnak megfelelően tükrözze az ellátás folyamatát. 1/b) melléklet: "Értesítő újszülöttről/gyermekágyas anyáról" című mintapéldány.
1/c) melléklet: A gyermekágyas anya és az újszülött egészségügyi dokumentációja - védőnői szempontból a legfontosabb adattartalom összefoglalása.
a) A gyermekágyas anya, az újszülött kórházi védőnői ellátását - az egészségügyi dokumentációjában. Védőnői szempontból a gyermekágyas anya és az újszülött egészségügyi dokumentációjának legfontosabb adattartalmát foglalja össze a 4. számú melléklet.
b) Az elvégzett kórházi védőnői tevékenységet nyomtatott- papír alapú formában az újszülött kórházi dokumentációjával együtt, a kórház iratkezelési szabályzata szerint tárolja, mely igazolható módon tartalmazza a megtett intézkedéseket.
10. Beszámolót készít az éves tevékenységgel kapcsolatban (a kórházi védőnői tevékenységével kapcsolatos számszaki, szöveges összefoglaló).
III.-IV.-V. Kezelés Segítségnyújtás az állapotromlás megelőzésében/rehabilitáció/Gondozás
1. Prognózis
1.1 Az intézménybe felvett szülő nő védőnői gondozásának várható kimenetele:
tájékozottan, felkészülten távozik újszülöttjével/újszülött nélkül intézményben védőnő ellátásban nem részesült
1.2 A gondozás várható időtartama 3-7 nap:
A gondozás várható időtartama függ bekövetkező korszülést okozó elváltozástól, az esetleges túlhordás idejétől, a fejlődési rendellenesség meglététől
1.3 Lehetséges szövődmények megelőzése, segítségnyújtás az állapotromlás megakadályozásában
Szövődmények:
- szoptatási probléma, speciális esetek, -fertőzés,
- terhességi/szülési szövődményből származó problémák,
- gyermekágyi involúció,
- emlők gyulladása,
- ikerszülés,
- sérült, fejlődési rendellenességgel született újszülött.
Segítségnyújtás az állapotromlás megakadályozásában:
- tájékoztatás és a területi védőnővel való kapcsolatfelvétel
6. Ellenőrzés
A egészségügyi törvény és a szakmai felügyeletről szóló jogszabály alapján
7. A kórházi védőnői ellátás megfelelőségének indikátorai
Eredményesség mutatói indikátorok alapján:
| Ssz. | Cél | Indikátor megnevezése | Indikátor számítás metodikája | Minőséget befolyásoló okok | ||
| Számláló | Nevező | szorzó- szám | ||||
| 1. | Minden újszülött, | Távozási cím | Újszülöttek, | Nyilvántartásba | 100% | A területi védőnő |
| gyermekágyas | szerinti védőnő | gyermekágyasok | vett újszülöttek, | a kórházi | ||
| előzetes értesítést | értesítése | száma, akikről | gyermekágyasok | eseményeket | ||
| követően távozzon | írásos jelzést küldött | száma | ismerve kezdheti | |||
| a kórházból | meg a gondozást | |||||
| 2. | Szociális okból | Kapcsolatfelvét | Azon szociális okból | Szociális okból | 100% | A szociális |
| veszélyeztetett | el a területi | veszélyeztetett szülő | veszélyeztetett | veszélyeztetettségi | ||
| szülő nők esetében | védőnővel | nők száma, amely | szülő nők száma | ok elhárítására | ||
| történjen | esetekben | kísérlet tehető | ||||
| konzultáció a | megtörtént a | az újszülött | ||||
| területi védőnővel | konzultáció a területi védőnővel | hazaérkezéséig | ||||
| 3. | Minden | Védőnői ellátás | Azon nők száma akik | Az intézményben | 100% | A védőnői ellátás |
| intézményben | védőnői ellátásban | szült nők száma | nyújtása segíti | |||
| szült nő kapjon | részesültek szült nők | az anyát a szoptatás | ||||
| védőnői ellátást | ellátásának ellátást kapottak száma | sikerében | ||||
8. A protokoll bevezetésének feltételei
Tárgyi feltételek
A kórházi védőnői munkaszoba Négyszemközti beszélgetésre alkalmas hely Zárható íróasztal
Számítógép internet kapcsolat, telefon, fax, saját email cím
Személyi feltételek Védőnői képesítés megléte
Szakmai/képzési feltételek
28/1998. (VI. 17.) NM rendelet az egészségügyi szakdolgozók továbbképzésének szabályairól
15/2006. (IV. 3.) OM rendelet az alap- és mesterképzési szakok képzési és kimeneti követelményeiről
45/2007. (III. 20.) Korm. rendelet az egészségügyben dolgozók alap- és működési nyilvántartásának vezetéséről Jogszabályi háttér
1992. évi LXXIX. törvény a magzati élet védelméről
1997. évi CLIV. törvény az egészségügyről
33/1992. (XII. 23.) NM rendelet a terhesgondozásról
51/1997. (XII. 18.) NM rendelet a kötelező egészségbiztosítás keretében igénybe vehető betegségek megelőzését és korai felismerését szolgáló egészségügyi szolgáltatásokról és a szűrővizsgálatok
49/2004. (V. 21.) ESzCsM rendelet a védőnői területi ellátásról
60/2003. (X. 20.) ESzCsM rendelet az egészségügyi szolgáltatások nyújtásához szükséges szakmai minimumfeltételekről
Egészség Évtizedének Johan Béla Nemzeti Programjáról 46/2003. (IV. 16.) OGY határozat,
Nemzetei Csecsemő és Gyermek Egészségügyi Program (2005)
"Legyen jobb a gyermekeknek" Nemzeti Stratégiáról 47/2007. (V. 31.) OGY határozat
VI. Irodalomjegyzék
1. A védőnő preventív alapfeladatai, kötelezettsége és felelőssége a megelőző ellátásban (OTH 2004.)
2. Védőnői Szakmai Kollégium Módszertani útmutatói I-II-III. 2007. - A kórházi/klinikai védőnő feladatai az intézményi ellátásban
3. Védőnői Módszertan (jegyzet), szerk. Székely-Szél-Szeles-Kispéterné Semmelweis Egyetem Egészségügyi Főiskolai Kar
Budapest 2002.
A szakmai protokoll érvényessége: 2014. június 30.
VII. Mellékletek
1. számú melléklet: Gyermekágyas nő kórházi védőnői gondozásának folyamatábrája
2. számú melléklet: Az emlők szemrevételezése és tapintásos vizsgálat
3. számú melléklet: Kórházi Értesítő Születésről
4. számú melléklet: Gyermekágyas anya és az újszülött egészségügyi dokumentációjának legfontosabb adattartalma
5. számú melléklet: Mikor forduljunk sürgősséggel gyermekgyógyászati ellátáshoz, ügyelethez?
1. számú melléklet
Gyermekágyas nő kórházi védőnői gondozásának folyamatábrája
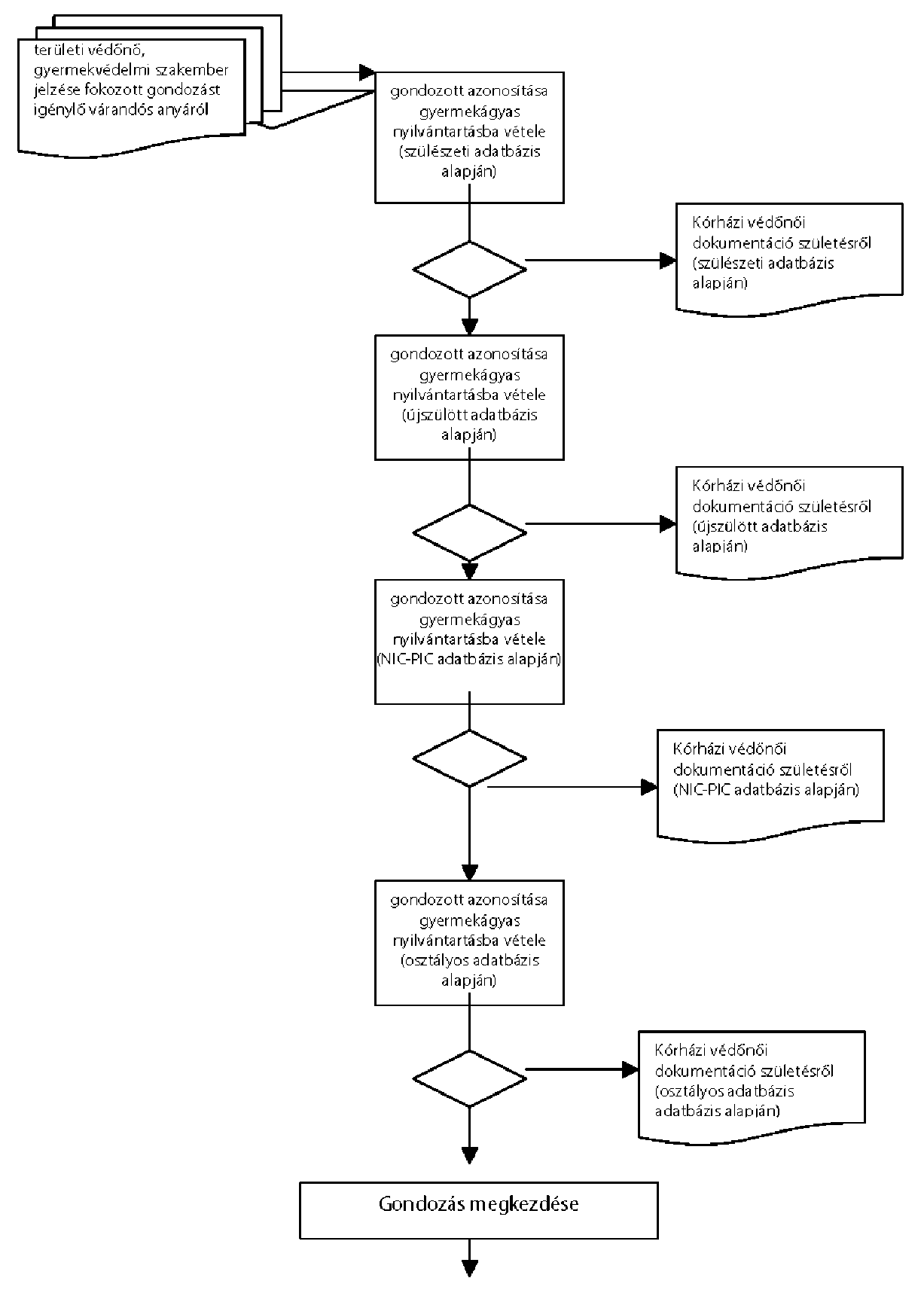
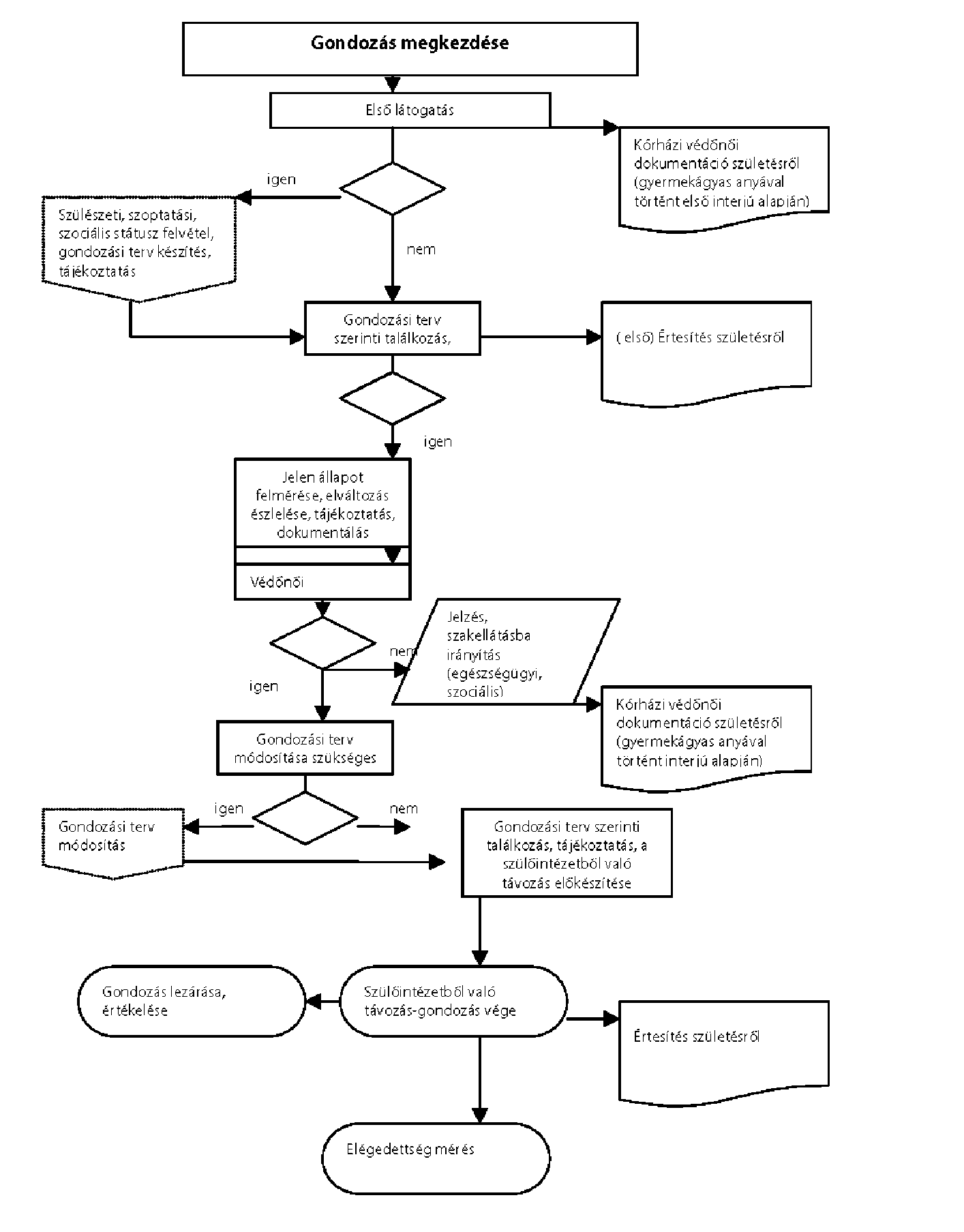
2. számú melléklet
Az emlők szemrevételezése és tapintásos vizsgálat
A vizsgálat módja:
Mielőtt a várandós nőt megkéri, hogy tegye szabaddá emlőit részletesen magyarázza el, miért is van szükség az emlő vizsgálatára.
Kérdezze ki részletesen vett-e észre változást a mellein, volt-e emlő műtéte, mellkas műtéte. Majd kérje beleegyezését, hogy az emlőit megnézhesse, megvizsgálja.
- Miután a várandós levetkőzött, figyelje meg nincs-e túlzott asszimmetria a két mell között, nincs-e szokatlan kúp alakja az emlőknek, nem túlzottan hosszú-e, vagy esetleg kicsi, vagy húsos, vastag az emlőbimbó. Ezeknek lehet, hogy semmiféle jelentősége nincs, de figyelmeztető jel lehet, hogy mögötte szoptatást akadályozó tényező rejtőzhet.
- A következőkben azt kell megvizsgálni, milyen az emlőbimbó, kiemelkedő, lapos, vagy befele forduló. Ezt szemmel nem tudjuk megítélni.
- Meg kell kérni az anyát, nyomja össze a bimbó mögötti szövetet. A bimbó ilyenkor kiemelkedhet, ellapulhat, vagy a közepe behúzódhat. Sokszor a nyugalomban befele fordulónak látszó emlőbimbó a mell összenyomásával kifordítható, még az is előfordulhat, hogy kiemelkedő bimbó a mell összenyomására ellaposodik.
- A bimbóudvar bármely részének a mutató és hüvelykujjal történő megemelése a rugalmasságról tájékoztat.
(12) Vizsgálati eredmények értékelése:
A fent leírtak szerint
3. számú melléklet

4. számú melléklet
Kórházi védőnői dokumentáció legfontosabb adattartalma
1. Területi védőnő, gyermekvédelmi szakember jelzése fokozott gondozást igénylő várandós anyáról:
- Várandós anya neve, születési neve, anyja neve:
- Várandós anya születési ideje:
- Szülés várható időpontja:
- Jelzést küldő neve, foglalkozása, az általa képviselt intézmény neve, címe, telefonszám
- Jelzés oka, milyen típusú intézkedést vár.
2. Kórházi védőnői dokumentáció születésről
= szülészeti adatbázis alapján
- Szült anya neve, születési neve
- szülészeti anamnaesis
- születés időpontja, módja,
- várandós gondozásban részesült: igen, nem, részlegesen
= újszülött adatbázis alapján
- Újszülött neve, születési súlya, hossza, fej-, és mellkörfogata, Apgar.
= NIC-PIC adatbázis alapján
- Újszülött neve, születési súlya, hossza, fej-, és mellkörfogata, Apgar, felvételi diagnózis, kezelőorvos neve.
= osztályos adatbázis alapján
- gyermekágyas anya elhelyezése, kóros gyermekágy
= gyermekágyas anyával történt első interjú alapján
- újszülött neve
- apa neve
- távozási címe
- területi védőnőt, tanácsadót ismeri, nem ismeri
- családgondozó neve
= gyermekágyas anyával történt interjú alapján
- jelzés, szakellátásba irányítás (egészségügyi, szociális)
5. számú melléklet
Mikor forduljunk sürgősséggel gyermekgyógyászati ellátáshoz, ügyelethez?
Az Országos Gyermekegészségügyi Intézet és a Házi Gyermekorvosok Országos Egyesületének ajánlása
1. Milyen esetekben forduljanak mentőhöz illetve orvosi ügyelethez?
A csecsemők és kisgyermekek állapota rövid idő alatt változhat, súlyosbodhat,
ezért ha gyermekénél az alábbi aggasztó tüneteket tapasztalja, kérjen mielőbb segítséget!
2. A mentőket riassza, és kezdje meg az elsősegélynyújtást! Mentők: 104.
-Ha a gyermek nem vesz levegőt, eszméletlen, pulzusa nem tapintható.
- Egyes légzészavarok esetén: nehézlégzés, fulladás, leszürkülés, elkékülés, ugató köhögési rohammal kísért nehéz, húzó belégzés, hirtelen bekövetkező rekedtség kínzó légszomjjal, hirtelen kialakuló heves mellkasi fájdalom.
- Sérülések, balesetek esetén: láthatóan súlyos sérülés, észlelhető csonttörés, magasból leesés, nagy vérzés, vérvesztés, eszméletvesztéses fejsérülés, égés, forrázás, fagyás, kihűlés, vízbefúlás, mérgezés, idegentest félrenyelése, áramütés, vagy ezek gyanúja, állat súlyos harapása, kígyó marása.
- Idegrendszeri tünetek esetén: eszméletlenség, eszméletzavar, eszméletzavarral járó izomrángatózások, feltűnő aluszékonyság, szokatlan heves nyugtalanság, merev tarkó, csillapíthatatlan fejfájás, erős kínzó szédülés, hirtelen látászavar, kettős látás, öngyilkossági kísérlet.
3. Ügyelethez forduljon elsősorban!
Ügyelet helye: Telefon:
- Egyes lázas állapotok esetén: láz 3 hónaposnál fiatalabb csecsemőnél, szabályos lázcsillapítás ellenére sem enyhülő magas láz, láz súlyos, elesett állapottal.
- Egyes légúti tünetek esetén: kínzó, nem csillapodó köhögés, nehezített ugató köhögés, sípoló nehézlégzés, légúti betegségben hirtelen rosszabbodás, fájdalomcsillapítás ellenére is fennálló kínzó fülfájás.
- Hasi tünetek esetén: csillapíthatatlan görcsös hasfájás, kínzó haspuffadás, szelek elakadása, súlyos, ismétlődő hányás, hasmenés (kiszáradásra utal ha több órája száraz a pelenka), csecsemőnél véres széklet, erős alhasi fájdalom, erős nőgyógyászati vérzés, a here fájdalmas duzzanata esetén.
- Vizeletürítési zavarok esetén: vizeletürítés több, mint 12 órás hiánya, gyakori fájdalmas vizelés lázzal, véres vizelet nagy hasi fájdalommal.
- Veszélyes allergiás állapot esetén: hirtelen bekövetkező, rekedtséggel járó nehezített belégzés, rovarcsípés kifejezett fej/nyak és szemhéj duzzanattal, nagy testfelületre kiterjedő csalánkiütés.
- Egyes bőrtünetek esetén: terjedő bőrvérzések, sárgaság, kiterjedt bőrkiütések lázzal.
- Szociális sürgősség esetén: ha a gyermeket felügyelet nélkül hagyják, elhanyagolás, bántalmazás jelei vannak.
4. Indokolatlannak tekinthető az ügyelethez fordulás, ha a gyermeknek:
- enyhe náthája, kevés köhögése, csak hőemelkedése van, vagy láza csillapítható,
- kevés, nem terjedő kiütése van, általános állapota jó, kullancsot kell kivenni,
- hasmenése, nem ismétlődő hányása, székrekedése van jó állapot mellett,
- receptírás: a szokásos tápszere, állandó gyógyszere elfogyott,
- igazolás közösségbe, táborozáshoz, sportoláshoz.
A Nemzeti Erőforrás Minisztérium szakmai protokollja
a védőnő feladatairól az egészséges csecsemő gondozásában
Készítette: a Védőnői Szakmai Kollégium
I. Alapvető megfontolások:
Az élet első évében végzett gondozás megalapozza a csecsemő további egészséges fejlődését, és a védőnő családban végzett prevenciós tevékenységét. Az eredményes védőnői tevékenységhez szükséges a legfontosabb minimális szakmai követelmények meghatározása.
A gondozás során kialakuló bizalmi kapcsolat segíti a családot a csecsemőkor optimális kezelésében a védőnőt pedig a munkája elvégzésében.
A védőnő a tevékenységét önállóan végzi a mindenkori szakmai szabályoknak és protokolloknak megfelelően. A védőnői gondozás team munka része, mely során a védőnő igénytől és helyzettől függően együttműködik a háziorvossal, házigyermekorvossal a szakellátás egyéb szakembereivel illetve a szociális alapellátással.
A protokoll bevezetésének alapfeltételei: Személyi feltétel:
Felsőfokú védőnői végzettséggel rendelkező, az alapnyilvántartásban szereplő, működési regisztrációba felvett védőnő [49/2004. ESZCSM rendelet 2. § (1) bekezdés].
Tárgyi feltételek:
Védőnői alapvizsgálatok otthoni és a tanácsadóban történő elvégzéséhez a rendelet által előírt tárgyi feltételek, elektronikus dokumentálás lehetőségének megléte védőnői programmal, számítógép, Internet kapcsolat, nyomtató.
1. Alkalmazási/érvényességi terület:
A védőnő a jogszabályok, és a szakma szabályai alapján komplex csecsemőgondozást végez az alapellátás keretében a családok otthonában és a védőnői tanácsadóban, valamint közösségi - egészségfejlesztésre alkalmas - helyszíneken. A csecsemőgondozás olyan összetett, interdiszciplináris szolgáltatás, amely a házi gyermekorvos/háziorvos, a védőnő és a gyermeket nevelő szülők/család együttműködésére épül.
Általánosan ismert, hogy hazánkban a népesedési mutatók az utóbbi évtizedekben kedvezőtlenül alakulnak. Az egyre csökkenő születési szám mellett a koraszülési arány sem mutat javulást. Így felértékelődik a csecsemőgondozás, azaz az a cél, hogy a lehető legtöbb gyermek egészségben felnőve érje el a felnőtt kort.
Az egyén életét, egészségét csecsemőkorban bekövetkezett események igen nagymértékben befolyásolják.
A védőnő családgondozási tevékenysége már a várandós gondozás során megalapozódik, mely a gyermek megszületése után tovább folytatódik.
A prevenció területén a védőnői ellátás lényege: az egészség megőrzése, fejlesztése, a betegségre utaló tünetek, kapcsolódó betegségek korai felismerése, a rászorultak gondozást végző orvoshoz történő irányítása és nem utolsó sorban a megfelelő életvezetési tanácsokkal való ellátása.
Jelen protokoll érvényessége: a csecsemő 12 hónapos korának betöltéséig.
Jelen protokoll nem terjed ki a koraszülött, a dysmaturus, ill. a fiziológiástól eltérő fejlődésű csecsemőre.
1.1. Protokoll témájának pontos meghatározása, témaválasztás indoklása
A védőnő által önálló kompetenciában végzett csecsemő gondozás az egészséges gyermek fejlődése érdekében megalapozza a védőnő és a család együttműködését. Az egészséges életkezdet jelentősen befolyásolja az egyén egészségben megélt életéveit, teljesítőképességét az iskolai évek alatt valamint a munka világában való helytállását.
1.2. A protokoll célja:
A protokoll célja a védőnő minimálisan és egységesen elvégzendő feladatainak meghatározása, - a 0-11 hónapos csecsemő (kiemelten az újszülött) látogatása,
- az önálló védőnői tanácsadáson való megjelenés alkalmával elvégzendő feladatok
- közösségi színtereken történő találkozások alkalmával, felvilágosítás, ismeret átadás során
Egységes elven valósuljon meg
a 0-11 hónapos csecsemő (az újszülött kor kiemelt figyelemmel) gondozási folyamatának indítása, fenntartása, a mindenkori szomatikus, pszichés és szociális állapotának, körülményeinek feltérképezése, az akadályozó tényezők felismerése (és elhárítása) összhangban a "Védőnő preventív alapfeladatai, kötelessége és felelőssége a megelőző ellátásban" c. szakmai útmutatóval, valamint a Magyar Egészségügyi Ellátási Standardokkal (továbbiakban: MEES).
1.3. A protokoll célcsoportja:
0-11 hónapos korú, egészséges csecsemő, családja, és a védőnő.
2. Definíciók:
Védőnői csecsemő gondozás definíciója:
A védőnő a jogszabályok, és a szakma szabályai szerint komplex csecsemőgondozást végez az alapellátás keretében. A védőnő a gondozási folyamatban kiemelt figyelmet fordít a prevencióra, különösen az új élet fogadása, egészségben való felnevelése érdekében.
3. Csecsemő kor leírása
Két szakaszát különböztetjük meg a gondozási feladatok szempontjából:
a) Újszülött időszak a gyermek születésétől 4 hetes koráig tart.
b) Csecsemőkor 4 hetes kortól betöltött 12 hónapos korig
3.1. Kiváltó tényezők: megszületés
3.2. Genetikai háttér: családi anamnézis
3.3. Incidencia/Prevalencia/Népmozgalmi adatok (KSH gyorstájékoztató 2011. január 27.)
3.3.1. KSH adatai alapján 2010-ben 90 350 gyermek született, 6,3%-kal kevesebb, mint egy évvel korábban. A halálozások száma 130 450 volt, ami nagyságrendben megegyezett a 2009. évivel.
Az adatok alapján 2010-ben jóval kevesebb gyermek született az előző évinél, a halálozások száma pedig lényegében megegyezett az egy évvel korábbival. A havonkénti születésszám egyenetlenül alakult. Az év első negyedében csak kismértékben maradt el az előző évitől, a május és október közötti hat hónapban viszont számottevő, átlagosan 11%-os csökkenést mutatott. A novemberi enyhe emelkedést követően, decemberben ismét 4,4%-kal kevesebb újszülött jött világra, mint egy évvel korábban. 2010-ben összességében 6092-vel (6,3%-kal) csökkent a születések száma, és a 90 350 újszülött egy újabb mélypontot jelent a hazai születési statisztika történetében.
Ezer lakosra 9,0 élveszületés és 13,0 halálozás jutott, előbbi 0,6 ezrelékponttal alacsonyabb volt, az utóbbi megegyezett a 2009. évi értékkel.
A természetes fogyás 4,0 ezrelék volt, 0,6 ezrelékponttal több az egy évvel korábbinál. Főleg az újszülött halálozás november-december havi emelkedése miatt 2010-ben ezer élveszületésre 5,3 csecsemőhalálozás jutott, 0,2 ezrelékponttal több, mint 2009-ben.
A születések száma jelentős mértékben csökkent, a halálozásoké viszont változatlan maradt, ennek következtében 2010-ben a természetes fogyás 40 100 fő volt, 6128 fővel több, mint egy évvel korábban. Eszerint a népesség lélekszáma az időszak végén 9 millió 986 ezer fő volt.
3.3.2. Koragyermekkori időszak jelentősége a későbbi teljesítőképességre [47/2007. (V. 31.) OGY határozat a "Legyen jobb a gyermekeknek!" Nemzeti Stratégiáról, 2007-2032. 4.2; 6. pont]
A korai képességgondozás:
Régóta ismert és az utóbbi években ismét előtérbe kerülő tény, hogy a korai életéveknek meghatározó szerepük van a későbbi életút szempontjából. Számos hazai és külföldi vizsgálat bizonyítja, hogy az iskolai pályafutás későbbi (középiskolai) szakaszaiban tapasztalható elmaradás elsősorban a kora gyermekkori feltételekkel, körülményekkel magyarázható. A korai életkorban tett befektetések megtérüléséhez képest a későbbi, illetve kiegyenlítő célú beavatkozások jóval kevésbé hatékonyak.
Legfontosabb célkitűzések:
- Rendszeres időközönként megvalósuló szűrés a gyermekek egészségi állapotáról, kognitív-, mozgás-, beszéd- és érzelmi fejlődéséről a korai és hatékony fejlesztés érdekében.
Egészségesebb gyermekkor biztosítása:
A szegénység és egyenlőtlenségek sokféle összefüggést mutatnak a megbetegedési és halandósági statisztikákkal, noha e kérdésről jóval több a nemzetközi, mint a magyarországi viszonyokra vonatkozó ismeretünk.
Néhány összefüggés régóta a demográfusok látókörében van. Tudjuk például, hogy az alacsonyabb iskolai végzettségű anyák csoportjában az átlagnál gyakoribb a koraszülés, a kis súlyú csecsemő születése, és nagyobb a csecsemőhalandóság is. Az egészségügyi egyenlőtlenségek - az ellátásokhoz való hozzáférés, az egészségi állapot mutatóinak kedvezőtlen alakulása stb. - fokozottan érintik a rosszabb szociális helyzetű családokat. Az egészségre ártalmas, valamint az egészséges életmódot lehetetlenné tevő lakáskörülmények és a táplálkozás rossz színvonala mellett, a hátrányos helyzetű, illetve marginális csoportok az ezen folyamatok ellen ható, már rendelkezésre álló egészségügyi szolgáltatásokhoz sem jutnak hozzá.
Kiemelt célcsoportként kell kezelni a 0-3 éves korosztályt, az ebben a korban biztosított életminőség és korai fejlesztés alapvető hatással van a gyermek további fejlődésére, egészségi és mentális állapotára, életlehetőségeire. A Stratégia számos céljának megvalósulását segítik a 2005 novemberében elkészült "Közös kincsünk a gyermek" Nemzeti Csecsemő- és Gyermekegészségügyi Program intézkedési javaslatai. Ennek szinte minden eleme fontos e Nemzeti Stratégia szempontjából is.
3.4. Jellemző életkor és nem:
0-11 hónapos gyermek, azaz a születéstől a 12 hónapos kor betöltéséig terjed.
Mindkét nemet érinti.
3.5. Általános jellemzők /Panaszok/Tünetek/
a) Az egészséges csecsemő jellemzői:
Arckifejezése - békés, nyugodt, érdeklődő, mosolygós.
Tartása - szimmetrikus
Bőre
- halvány rózsaszínű, esetleg előfordulhatnak rajta anyajegyek, allergiás foltok, kiütések,
- feszessége (turgora) jó, ezt a bőr alatti kötőszövet zsír- és folyadéktartalma határozza meg. Izomtónusa - jó, ami azt jelenti, hogy izmai nincsenek sem megfeszítve, sem petyhüdt állapotban. Sírás és "beszédhangja" - nem tér el a megszokottól, keveset sír és jellegzetes
Pulzusszáma - 120-140/perc.
Testhőmérséklete - 36,5-37,5 °C.
Hőszabályozása - abilis, ezért több rétegű, természetes anyagú (pamut) ruhába kell öltöztetni, amit a bőr hűvössége, illetve kimelegedettsége szerint kell rétegezni (föl- és levenni).
Hossznövekedése - az első hónapban átlagosan 5 cm, a másodikban pedig 3 cm, 3-7. hónapig 2 cm, majd 1 éves korig 1-1,5 cm. Testtömege - 600 g-mal emelkedik havonta átlagosan az első félévben Napirendje van
b) Panaszok, tünetek:
A születés utáni napokban, hetekben kialakuló mozgás- és testtartászavarok, figyelmi elégtelenség vagy hiány, convulsiok, tudatzavar, nyelési képtelenség, plexus brachiais sérülésnél az érintett végtag paresise vagy plegiája, MMC-nél az also végtagok mozgászavara, vizelet és széklet incontinentia, táplálási nehézség észlelése esetén haladéktalanul orvosi ellátás szükséges.
Az agyi károsodás nyomán keletkezett leggyakoribb progresszív kórfolyamatok: mozgásfogyatékosság, neurogén dysphagia, értelmi fogyatékosság, halmozott fogyatékosság, symptomás epilepsia. Az agyfejlődési kórfolyamatok közül, képalkotó eljárásokkal kimutatható: corticalis atrophia, periventricularis leukomalatia, polycystás encephalomalatia, hydrocephalus, subduralis effusio. Az agyi kórfolyamat kifejlődése közben keletkező korai mozgásfejlődési károsodás, kezelés nélkül, cerebralis paresist hoz létre, a korai precognitive funkciózavar végül értelmi fogyatékossággá válik, súlyos halmozott fogyatékossági kombinációk alakulhatnak ki, a korai neurogen dysphagia, táplálkozási képtelenséghez és gastrostoma kialakításához vezet, meningomyelocele (MMC) nyomán paraparesis, incontinentia, neurogén hólyag, veseelégtelenség.
(Az Egészségügyi Minisztérium szakmai protokollja
A fejlődésneurológia és neurotherapia
Készítette: A Csecsemő- és Gyermekgyógyászati Szakmai Kollégium)
4. Az ellátás folyamata, algoritmus:
A védőnő feladata, hogy folyamatos megfigyelésen alapuló tanácsadással és egészségfejlesztéssel
- menedzselje és támogassa az 0-11 hónapos - hangsúlyozottan az újszülött - időszak zavartalan, harmonikus folyamatát, az újszülött zavartalan adaptációja és csecsemő testi, lelki, szellemi és szociális jól-léte, fejlődése érdekében,
- segítséget nyújtson a családnak az egészségkárosodások megelőzése érdekében,
- felfigyeljen az újszülött és csecsemő életében bekövetkező kedvező vagy kedvezőtlen változásokra.
- újszülött korban dokumentálja, az 1; 3; 6; 12; hónapos korban elvégzi és dokumentálja (8. számú melléklet) a betegségek megelőzését és korai felismerését szolgáló szűrővizsgálatokat.
- a gondozásba vételkor prioritást állít fel a gondozás dimenziói között.
A védőnő hívja fel a szülők figyelmét az orvosi és védőnői szűrővizsgálatok elvégzésére, jelentőségére. A védőnő feladata a 51/1997. (XII. 18.) NM rendeletben valamint a protokollokban a számára előírt szűrővizsgálatok elvégzése, az egyéb szűrővizsgálatokról információadás, valamint a szűrővizsgálatok megtörténtének ellenőrzése, dokumentálása.
Újszülött/csecsemő gondozása - folyamatábra - 1. számú melléklet
Célja: az újszülött és egészséges csecsemő fejlődésének követése,
Helye: elsősorban a család otthona, illetve a csecsemő tartózkodási helye és a tanácsadó.
Ideje: első alkalommal a hazaadást, illetve a védőnői értesítés megérkezését követő 48 órán belül (munkaszüneti nap kivételével), ezt követően a jogszabályok és szakmai útmutatók szerint.
II. Gondozási szükséglet feltárás (diagnosztikai eljárások)
1. Anamnézis felvétele / állapotfelmérés:
1.1. A szülővel folytatott személyes beszélgetés alapján.
1.2. Terhességi és szülészeti anamnézis, kórházi zárójelentés, újszülött jelentés, vagy előző védőnői, orvosi dokumentációk alapján:
- a csecsemő orvosi vizsgálata során, rögzített, észlelések
- kötelező szűrővizsgálatok megtörténte és dokumentálása.
- védőoltások dokumentálása
1.3. Környezeti status felvétele
1.4. Minden látogatás alkalmával az aktuális életkor szerinti állapot, fejlődési szint felmérése.
1.5. Kockázatfelmérés átlagostól eltérő v. kóros állapotok felismerése.
Kockázati tényezők előfordulása esetén a gondozás külön protokoll alapján történik.
2. Fizikális vizsgálatok, megfigyelés, megtekintés
Célja: A csecsemőt veszélyeztető állapotok lehető legkorábbi észlelése, és az észlelést követően a lehetőség szerint a legrövidebb időn belül a szakellátás megtörténjen.
Helye: elsősorban a család otthona, illetve a csecsemő tartózkodási helye és a tanácsadó.
Ideje: A jogszabálynak [49/2004. (V. 21.) ESzCsM rendelet a területi védőnői ellátásról 1. számú melléklete] megfelelően, illetve a csecsemő állapotától függően
A csecsemőgondozás keretében a védőnők által önállóan végezhető vizsgálatok az aktuális életkornak megfelelően, jogszabály által előírtak alapján.
3. Kötelező (minimálisan elvégzendő) szükséglet feltáró (diagnosztikai) vizsgálatok és azok gyakorisága
3.1. Általános állapot megfigyelése, találkozások alkalmával mindig (2. számú melléklet) figyelemmel a tápláltságra, a széklet-, vizeletürítésre, valamint fejlődési rendellenességekre,
3.2. Testarányok mérése (testtömeg, testhossz, fej körfogat/forma, mell körfogat) tanácsadások, státuszvizsgálatok alkalmával, figyelemmel a mell, törzs deformitásokra
3.3. Elemi mozgásminták/reflexek -3. számú melléklet
3.4. Pszichomotoros fejlődés vizsgálata, státuszvizsgálatok alkalmával, értékelés szempontjait a 4. számú melléklet tartalmazza
3.5. Érzékszervi szűrővizsgálatok: látás, hallás vizsgálata protokoll alapján (5. számú melléklet)
3.6. Mozgás, mozgásszervek vizsgálata, figyelemmel az izomtónusra (6. számú melléklet)
3.7. BCG-heg ellenőrzése, 6 hónapos korig való megtörténte
3.8. Kültakaró vizsgálata, figyelemmel a köldök, köröm, nemi szervek állapotára, minden találkozási alkalommal, amikor a csecsemő levetkőztetése lehetséges (7. számú melléklet)
3.9. Szájüreg megtekintése látogatások és tanácsadás alkalmával
3.10. Táplálás a mindenkor érvényes csecsemőtáplálási protokoll szerint
3.11. Szociális környezet a mindenkor érvényben levő helyzetértékelés és környezettanulmányi kód szerint
- családi viszonyok
- anyagi, egzisztenciális háttér
- tárgyi feltételek, lakás adottságai.
4. Szükségletfeltáró lépések követendő sorrendje
A szülővel történő konzultáció és a védőnői észlelések alapján az eltérések kiszűrése a probléma azonosítása és a szükséges intézkedések megtétele.
5. Ellátás/ondozás tervezése
5.1. Gondozási terv elkészítése:
A terv magába foglalja a csecsemő egészséges fejlődésének feltételeit, a szülő szoptatásra/táplálásra, és a csecsemőgondozásra való felkészítését.
A szükséglet meghatározása célzott és egyénre szabott.
Célja: Meghatározni a csecsemő egyedi, minőségi ellátására irányuló célokat és azok eléréséhez szükséges tevékenységeket.
Gondozási terv kiterjed:
- a 6 hónapos korig tartó kizárólagos szoptatás támogatására
- a kötelező és ajánlott védőoltások rendjére
- a szűrővizsgálatok ajánlott idejére
- a látogatások során észleltek rendszerezésére, rögzítésére a további gondozás tervezése céljából,
- fiziológiás és kóros tünetek időben való felismerésére,
- a korrekció időben történő megkezdésének támogatására.
5.1.2. Célok megvalósításának alternatívái
A védőnői csecsemőlátogatásokat "a területi védőnői ellátásról" szóló a 49/2004. (V. 21.) ESZCSM rendelet szabályozza. A korai csecsemőkorban történő látogatásokra még "A védőnő feladatai újszülött és gyermekágyas anya otthoni első látogatásakor" protokollban leírtak irányadók.
5.2. Családlátogatás
Családi körülmények megismerése, veszélyeztető tényezők feltárása, folyamatos segítségnyújtás a gondozásban, csecsemő fejlődésének megfigyelése.
Tartalma: az aktuális csecsemőkori időszaknak megfelelően a csecsemő egészséges fejlődéséhez szükséges ismeretek átadása, a változások megbeszélése.
Csecsemő korban a családlátogatás preferált.
5. 3. Tanácsadási alkalmak
Aktuális állapot felmérése, szűrővizsgálatok elvégzése a jogszabály alapján 1; 3; 6; 12; hónapos korban, panaszok, és szűrési eredmények rögzítése, tájékoztatás (az észlelt eltérésről a házi gyermekorvos, illetve a háziorvos írásban történő értesítése.)
Tartalma:
Önálló védőnői tanácsadás legalább heti 1 alkalommal, minimum 2 órában, az ellátottak igényének figyelembevételével Orvos-védőnő közös tanácsadás, helyi eljárási rend szerint Mozgó szakorvosi szolgálattal helyi eljárási rend szerint
5.4. Közösség egészségügyi gondozás, csoportos egészségfejlesztés
Helyi igények és lehetőségek szerint Kismamaklub, Szoptatás támogató anyacsoportok működtetése
5.5. Fogadóóra, egyéb konzultáció igény, helyi eljárásrend szerint
III.-IV.-V. Kezelés Segítségnyújtás az állapotromlás megelőzésében/Rehabiltáció/Gondozás
A folyamatos gondozás biztosítása a védőnői tanácsadóban és családlátogatás keretében történik, a területi védőnői módszertani útmutató szerint.
1. Védőnői tevékenység, beavatkozások
A csecsemőkorban végzett szűrővizsgálatok elvégzése a védőnői tanácsadókban történik. Itt biztosítottak a személyi és tárgyi feltételek.
A csecsemő gondozása multidiszciplináris team munkában történik. (gyermeket nevelő szülők/család, házigyermekorvos/háziorvos, védőnő, gyermekjóléti szolgálat)
Az ellátáshoz biztosítani kell a szükséges szűrőeszközöket.
A csecsemő szükségleteiből kiindulva, multidiszciplináris megközelítéssel lehet megfelelő gondozást elérni.
1.1. módszere:
- tanácsadás
- állapotszűrés eszköze:
- gondozási terv
- családlátogatás
- tanácsadási alkalmak
- közösség egészségügyi gondozás csoportos egészségfejlesztés
- fogadóóra, egyéb konzultáció
1.2. Általános műveletek:
- megfigyelés,
- megtekintés,
- kikérdezés,
- komplex támogatás,
- információadás
- jövőbeli teendők ismertetése
- konzultáció a gondozásban résztvevő háziorvossal/házi gyermekorvossal
- veszélyeztető életkörülmény észlelése esetén jelzés szakellátás, gyermekjóléti szolgálat felé
1.3. Szűrővizsgálatok:
- Az 51/1997. (XII. 18.) NM rendeletben meghatározottak szerint.
1.4. Dokumentálás:
- A gondozás folyamata, az elvégzett feladatok a gondozási dokumentációban rögzítésre kerülnek, erről tájékoztatást kap a szülő. (8. sz. melléklet)
2. Gondozási műveletek (Fizikai aktivitás)
2.1. A nyilvántartásba vett újszülött hazaadását követő 48 órán belül - szombat, vasárnap vagy munkaszüneti nap esetében az azt követő első munkanap -, (Külön protokoll szerint) majd ezt követően az első 6 hétben legalább hetente. A csecsemő 6 hetes és 1 éves kora között havonta, fokozott gondozást igénylők esetében szükség szerint történnek a találkozási alkalmak.
2.2. A folyamatos gondozás biztosítása a tanácsadóban, ahol az állapot felmérés, panaszok, és vizsgálati eredmények rögzítése történik.
Szűrővizsgálatok elvégzése a módszertani ajánlások alapján és az észlelt eltérésről a házi gyermekorvos, illetve a háziorvos írásban történő értesítése.
2.3. Rendszeres/szükség szerint konzultáció a csecsemő ellátásában résztvevő házigyermekorvossal/háziorvossal, Családsegítő-, vagy Gyermekjóléti Szolgálatokkal. Szakmai konzultáció a felmerülő problémákról és minden olyan körülményről, ami kedvezőtlenül befolyásolhatja a csecsemő zavartalan fejlődését.
2.4. A család szociális, családi körülményeinek csecsemőre veszélyt jelentő változása esetén írásos jelzés házigyermekorvos/háziorvos, valamit a Gyermekjóléti Szolgálat felé.
2.5. Sürgősségi ellátás
- Bármilyen az életet, egészséget súlyosan veszélyeztető jelenség észlelése esetén azonnali orvosi ellátás kezdeményezése, az orvos megérkezéséig/szükség esetén elsősegélynyújtás. (Hornyák István Ph.D.: Elsősegélynyújtás mindenkinek Otthoni biztonság, biztonságos otthon dr. Páll Gabriella OGYEI - Svéd Kereskedelmi Kirendeltség 2008. )
- Súlyos szociális veszélyeztető tényező észlelése esetén azonnali jelzés a Gyermekjóléti Szolgálat felé
2.6. Állapotromlás:
- Szekunder, tercier prevencióban a védőnő orvosi javaslat alapján jár el.
- Bármilyen élettanitól vagy a megelőző állapottól eltérő jelenség észlelése esetén orvosi konzultáció, vizsgálat szükséges
3. Képzés, oktatás
3.1. A csecsemő családja tájékoztatása a védőnői kompetencia szerint.
Tartalma:
A primer prevenció célja az egészséges- életmód, környezet, életkörülmények, személyiség fejlődés biztosítása.
A védőnő az alábbi témakörökben ad át rendszeresen ismereteket a csecsemő családjának egészséges táplálás, különös tekintettel a szoptatásra csecsemő egészséges fejlődése az állapotnak megfelelő gondozás helyes öltözködés napirend kiegyensúlyozott anya-gyermek kapcsolat szülői szerepek egészséges életmód szociális ellátások baleset megelőzés környezetkárosító hatások az egészségre Csecsemőgondozási tanácsok, valamint a csecsemő minden napját segítő tevékenységek és eszközök megismertetése. Együttműködési készség fenntartása.
A védőnő hívja fel a figyelmet a csecsemőkor alatti rizikótényezőkre, a kontroll szűrések fontosságára, győzze meg a szülőket az esetleges káros szenvedélyének elhagyásáról és az aktív élet, mozgás fontosságáról. Rendszeresen kapja meg a család a szükséges érzelmi támogatást.
Egyéni: Az elsődleges prevenció során a cselekvési lehetőségeket a védőnő a gondozottjával megismerteti, megtanítja, alternatív lehetőségeket tár fel számára, ezzel készteti a szülőket gyermekük életének egészséges irányítására, szükség esetén magatartásának megváltoztatására.
3.2. Csoportos: alternatív gondozás/oktatás
Olyan tevékenység, amikor a védőnő egy időpontban egyszerre több szülő részére szervezi meg a tanácsadást (tanácsadóban, közösségi helyszínen) egy közös cél érdekében. A célja lehet: figyelemfelkeltés, kölcsönös támogatás, oktatás, életmódbefolyásolás /pl. torna/, gyermekgondozási teendők elsajátítása, begyakorlása, csecsemőmasszázs oktatása
4. Kiegészítő/alternatív gondozás
- Aktuális helyzetnek megfelelően.
- Családi napközi, nevelő vagy örökbefogadó szülő, bébiszitter, segítő családtag pl. nagyszülő. Az alternatív ellátási formák számszerű emelkedése indokolja, hogy a védőnői gondozás során erre külön figyelmet fordítsanak.
5. Prognózis
5.1. A csecsemőkor várható kimenetele: 12 hónapos kor elérése egészségben/, szülési sérülés, vagy egyéb megbetegedés miatti állapotromlás/, betegség miatti, vagy hírtelen csecsemő halál
5.2. A gondozás várható időtartama 12 hónap
5.3. Lehetséges szövődmények, megelőzésük, segítségnyújtás az állapotromlás megakadályozásában
- táplálási problémák
- organikus eredetű elváltozások miatti fejlődésben való visszamaradás
- megbetegedés okozta maradandó elváltozás
- baleset okozta maradandó elváltozások
6. Ellenőrzés
A szakmai felügyeletéről szóló jogszabály alapján
7. A csecsemő ellátás megfelelőségének indikátorai
7.1. Szakmai munka eredményességének mutatói
7.1.1. A csecsemő szakmai protokoll szerinti ellátásának ellenőrzésére szolgáló folyamat indikátorok: A védőnő a gondozásba vételt követően 48 órán belül meglátogatta otthonában a csecsemőt. Az életkorhoz kötött szűrések időben megtörténtek.
A gondozásba vétel időpontjához viszonyítva a látogatások száma és ütemezése megfelelő. A védőnői szűrővizsgálatok teljes körűen, a jogszabályoknak megfelelően megtörténnek.
Gondozási terv követi a csecsemő állapotában estelegesen bekövetkező változásokat és a gondozási terv szerinti ellátás megvalósult.
A dokumentáció vezetése megvalósult.
7.1.2. Az ellátás eredményességének mutatói eredmény indikátorok alapján: A csecsemő gondozásba vétele megtörtén az értesítést követően.
Az első látogatás a hazaérkezést követő 48 órán belül megtörtént.
Védőnői látogatások száma a rendeletben előírtnak, és a csecsemő állapotának megfelelően valósult meg.
A dokumentáció folyamatos, tükrözi a csecsemő állapotát.
A gondozás a szükségletnek megfelelően zajlott, gondozási terv alapján.
Csecsemőkor probléma-, és szövődménymentesen zajlott.
A szakemberek informáltsága/az információ áramlás megfelelő volta az ellátás különböző szintjei között.
1. Eredményesség mutatói indikátorok alapján:
| Ssz. | Cél | Indikátor megnevezése | Indikátor számítás metodikája | Minőséget befolyásoló okok | ||
| Számláló | Nevező | szorzószám | ||||
| 1. | A családdal egyeztetett és szükségleten alapuló gondozási tevékenység történjen | Gondozási terv | csecsemők száma akik számára egyeztetett, szülője által aláírt gondozási terv rendelkezésre áll | Nyilvántartásba vett csecsemők száma | 100% | Hatékonyabb az együttműködés. Tudatosabb a szülő közreműködése. Eredményes védőnői gondozás várható. |
| 2. | Minden csecsemő életkorhoz kötött szűrővizsgálata megtörténjen | Szűrővizsgálatok | csecsemők száma akiknél a szűrővizsgálat megtörtént az adott életkor betöltéséig | Nyilvántartásba vett csecsemők száma | 100% | Korai észlelés, elváltozás esetén jelzés, és a szükséges ellátás időben megtörténik. |
| Ssz. | Cél | Indikátor megnevezése | Indikátor számítás metodikája | Minőséget befolyásoló okok | ||
| Számláló | Nevező | szorzószám | ||||
| 3. | Jelzési | Jelzőrendszer | Írásban jelzett | Jelzést igénylő | 100% | Időben |
| kötelezettség | esetek száma | esetek száma | megtörténik a | |||
| teljesüljön | további ellátás. | |||||
Csecsemő táplálás indikátorait Az egészséges csecsemő (0-12 hónap) táplálásáról protokoll tartalmazza.
7.1.3. Gondozott elégedettsége az ellátási ciklus (első életév betöltése) befejeztével
8. A protokoll bevezetésének feltételei
Tárgyi feltételek
49/2004. (V. 21.) ESzCsM rendelet a területi védőnői ellátásról 5. számú melléklet
Személyi feltételek
49/2004. (V. 21.) ESzCsM rendelet a területi védőnői ellátásról
Szakmai/képzési feltételek
15/2006. (IV. 3.) OM rendelet az alap- és mesterképzési szakok képzési és kimeneti követelményeiről
27/1998. (VI. 17.) NM rendelet az egészségügyi szakképesítést szerzett személyek alapnyilvántartásáról, valamint az egészségügyi szakdolgozók működési nyilvántartásának szabályairól
28/1998. (VI. 17.) NM rendelet az egészségügyi szakdolgozók továbbképzésének szabályairól
Jogszabályi háttér
1990. évi LXV. törvény a helyi önkormányzatokról 1997. évi CLIV. törvény az egészségügyről
51/1997. (XII. 18.) NM rendelet a kötelező egészségbiztosítás keretében igénybe vehető betegségek megelőzését és korai felismerését szolgáló egészségügyi szolgáltatásokról és a szűrővizsgálatok igazolásáról
49/2004. (V. 21.) ESzCsM rendelet a védőnői területi ellátásról
Egészség Évtizedének Johan Béla Nemzeti Programjáról 46/2003. (IV. 16.) OGY határozat,
Nemzeti Csecsemő- és Gyermek Egészségügyi Program
"Legyen jobb a gyermekeknek" Nemzeti Stratégiáról 47/2007. (V. 31.)
OGY határozat 1997. évi XXXI. törvény a gyermekek védelméről és gyámügyi igazgatásról
2002. évi LVIII. törvény egyes az egészségügyet és társadalombiztosítást érintő törvények módosításáról
19/2009. (VI. 18.) EüM rendelet a tizenhat éveseknek szervezett ingyenes orvosi vizsgálat megvalósításával és az új Egészségügyi Könyv bevezetésével kapcsolatban.
VI. Irodalomjegyzék
1. A védőnő preventív alapfeladatai, kötelezettsége és felelőssége a megelőző ellátásban (OTH 2004.)
2. A "Védőnői Ellátás Folyamata" I/3. Magyar Egészségügyi Ellátási Standardok kézikönyvéről (MEES) 1.0 változat - Eü. Közlöny, 2007. év 4. szám. (727-740.) Védőnői Szakmai Kollégium Módszertani útmutatói I-II-III. 2007.
3. A védőnői ellátás céljai, általános feladatai, módszerei
4. A területi védőnő feladatai a komplex családgondozásban
5 A kórházi/klinikai védőnő feladatai az intézményi ellátásban
6. Védőnői Módszertan (jegyzet), szerk. Székely - Szél - Szeles - Kispéterné Semmelweis Egyetem Egészségügyi Főiskolai Kar Budapest 2002.
7. A pszichomotoros fejlődés zavarainak felismerése és ellátása az alapellátás gyakorlatában 2. számú módszertani levél OGYEI-MAVE. 2005.
8. Egészségügyi Minisztérium - Egészségügyi Szakképző és Továbbképző Intézet (2005. november) "Közös kincsünk a gyermek" Nemzeti Csecsemő és Gyermekegészségügyi Program
9. A szülést követő időszak pszichés változásai. Védőnők szerepe, lehetősége, kompetenciája a szülés körüli hangulatzavarok felismerésében. (Az Egészségügyi Minisztérium szakmai protokollja - Eü. Közlöny 2006. március 31.)
10. Maródi László Gyermekgyógyászat Medicina Kiadó 2003.
11. C. Molnár Emma, Füredi János, Papp Zoltán Szülészet nőgyógyászati pszichológia és pszichiátria (Medicina 2006 Bp.)
12. Gyermekegészségügyi kiskönyv, OGYEI 2003. ISBN963 04 3330 3
13. Csecsemőtáplálási Protokoll
14. Otthoni biztonság, biztonságos otthon dr. Páll Gabriella OGYEI - Svéd Kereskedelmi Kirendeltség 2008.
15. dr. Krivácsy Péter Gyermekkori vészhelyzetek S. O.S megoldások. Budapest 2006.
16. Szakmai irányelv a 0-18 éves gyermekek teljeskörű, életkorhoz kötött hallásszűréséről
17. A 0-18 éves életkorú gyermekek látásfejlődésének követése, a kancsalság és a fénytörési hibák felismerése. Szűrővizsgálati irányelvek védőnők és gyermekorvosok számára
Kapcsolódó internetes elérhetőségek: www.leghajo.hu
A szakmai protokoll érvényessége: 2014. június 30.
VII. Mellékletek
1. számú melléklet: Csecsemő gondozása - folyamatábra
2. számú melléklet: Elemi mozgásminták, Primitív reflexek
4. számú melléklet: Pszichomotoros fejlődés vizsgálata
5. számú melléklet: Érzékszervi szűrővizsgálatok
6. számú melléklet: Mozgás, mozgásszervek vizsgálata
7. számú melléklet: Kültakaró vizsgálata
8. számú melléklet: 1; 3; 6; 12; hónapos korban végzett védőnői szűrővizsgálatokról
9. számú melléklet: Mikor forduljunk sürgősséggel gyermekgyógyászati ellátáshoz, ügyelethez?
1. számú melléklet
Csecsemő gondozása - folyamatábra
A) Védőnői látogatás folyamata
A védőnő feladatai újszülött és gyermekágyas anya otthoni első látogatásáról című Egészségügyi Minisztérium szakmai protokoll 2. számú melléklete szerint
B) Védőnői tanácsadás folyamata
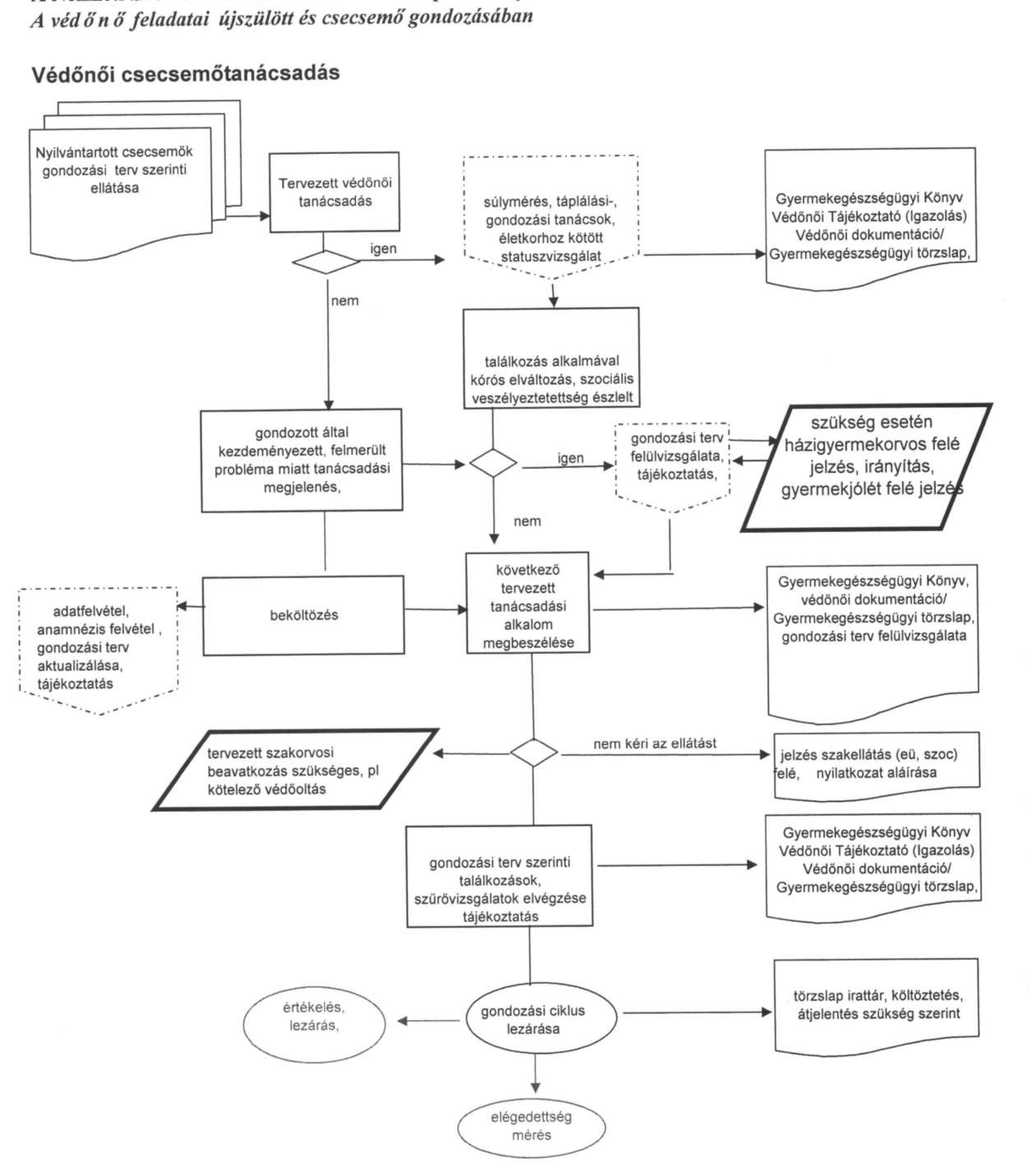
2. számú melléklet
Az általános állapot megfigyelése
A megfigyelés szempontrendszere
1. Táplálás: (külön protokoll szerint (Az egészséges csecsemő (0-12 hónap) táplálásáról (Nemzeti Erőforrás Minisztérium 2010.)
a) fiziológiás
b) kóros
c) egyéb
2. Vizeletürítés:
a) Fiziológiás
normál vizeletürítés (3-4 nedves pelenka) megfelelően ürülő vizeletsugár
b) Kóros kevés vizelet kellemetlen szagú vizelet elszíneződött vizelet
c) egyéb
Megjegyzés:
Kóros elváltozás gyanúja (kellemetlen szag, elszíneződés) esetén orvosi vizsgálat szükséges.
Fokozott figyelmet kell fordítani szoptatásra.
3. Székletürítés:
a) fiziológiás
rendszeres, gyakori (napi 1-6x) székletürítés
b) kóros
a széklet állagának megváltozása (pl. dyspepsia) bűzös habos széklet nehéz/fájdalmas székletürítés
c) egyéb
Megjegyzés:
Enyhébb esetben táplálási tanácsadás elegendő. Kóros elváltozás gyanúja (kellemetlen szag, rendellenes szín), tartós panaszok esetén orvosi vizsgálat szükséges.
4. Bőr
a) fiziológiás elváltozás nélküli bőr
b) kóros sárga bőrszín szürkés, livid bőrszín
barna foltos bőrelváltozás/ok, festéksejtek túlburjánzás
haemangioma
petyhüdt, ráncos bőr
bőr alatti bevérzés a koponyán
karcolás, sérülés nyomok az arcon
pontszerű sárgás kiütések az arcon
száraz, hámló lerakódások a hajas fejbőrön
száraz, vörös bőr
fizikai bántalmazásra utaló jelek
c) egyéb
Megjegyzés:
Bármely kóros elváltozás gyanúja esetén orvosi vizsgálat szükséges.
Köldök
a) fiziológiás reakciómentes, ép
b) kóros
irritált környékű köldök gennyesen váladékozó köldök sarjadzás (fungus umbilici) köldök kitüremkedése/sérv gyanúja
c) egyéb
Megjegyzés:
Bármely kóros elváltozás gyanúja esetén orvosi vizsgálat szükséges.
Mell
a) fiziológiás elváltozás nélkül
b) kóros
egyik/mindkét oldali emlőduzzanat érzékeny, piros duzzadt emlő, váladékozás több/kevesebb mellbimbó
c) egyéb
Megjegyzés:
Tartós elváltozás, fejlődési rendellenesség esetén orvosi vizsgálatra van szükség.
Köröm
a) fiziológiás
a köröm eléri az ujjbegyet
b) kóros
a köröm berepedt, töredező
benőtt köröm
gyulladt lobos körömágy
c) egyéb
Megjegyzés:
Gyulladás esetén orvosi ellenőrzés szükséges.
Fej
a) fiziológiás
a koponyacsontok kemények, a fejkörfogat nagyobb a mellkörfogatnál
b) kóros
koponya körmérete az átlagosnál kisebb, vagy nagyobb, szülést követő koponya deformitások fektetés következtében koponya deformitások
D-vitamin hiány következtében benyomható koponyacsontok (pingpong labda tünet (!)
kutacsok nívóban tapinthatók
besüppedt nagykutacs (elégtelen folyadékbevitel!)
elődomborodó nagykutacs
nem záródott kiskutacs és /vagy nyílvarrat
tátongó nagykutacs
c) egyéb
Megjegyzés:
Rendellenes fejméret, fejforma, eltérő kutacs-tapintat esetén orvosi vizsgálat szükséges.
Fül
a) fiziológiás elváltozás nélkül
b) kóros
berepedt fülcimpa, sérült fülkagyló gyulladt váladékozó fül, fülcimpa fülcimpa mögötti terület intertrigója hallássérülésre utaló gyanújelek újszülöttkori hallásszűrés megtörtént
c) egyéb
Megjegyzés:
Rendellenesség, gyulladás gyanúja esetén orvosi vizsgálat szükséges.
Szemek
a) fiziológiás
elváltozás nélkül, pupillák fényre reagálnak
b) kóros
kötőhártya bevérzés, duzzadt szemhéjak
fokozott váladék a szemrésben, fokozott könnyezés (a könnycsatorna elzáródása vagy fertőzés gyanúja) aszimmetrikus, vagy rendellenes (mongoloid jellegű) szemrés látássérülésre utaló gyanújelek
újszülöttkori látásszűrés pozitív, veleszületett elváltozás
c) egyéb
Megjegyzés:
Rendellenesség, gyulladás gyanúja esetén orvosi vizsgálat szükséges.
Szájüreg
a) fiziológiás elváltozás nélkül
b) kóros
ajak, szájpad alaki eltérése (hasadék) átlagosnál nagyobb, szájból kilógó nyelv lenőtt nyelvfék
soor felrakódások a szájnyálkahártyán szájnyálkahártya sérülés, egyéb fertőzés gyanúja
c) egyéb
Megjegyzés:
Rendellenesség, tartós elváltozás, szopási nehézség, képtelenség esetén orvosi vizsgálat szükséges.
Nemi szervek, genitáliák
a) fiziológiás elváltozás nélkül
b) kóros
duzzadt, bevérzett genitáliák
duzzadt herezacskó
a nagyajkak a kisajkakat nem takarják
rendellenesen elhelyezkedő húgycsőnyílás
váladék ürülése hüvelyből
lobos, piros esetleg hámfosztott bőrfelület a nemi szervek környékén végbélnyílás rendellenessége, sérülése here nincs a herezacskóban
c) Egyéb
Megjegyzés:
Rendellenesség, gyulladásos tünetek esetén orvosi vizsgálat elengedhetetlen.
Mozgásszervek
a) fiziológiás elváltozás nélkül
b) alsó/felső végtag alaki elváltozása, végtaghiány,
alsó/felső végtag aszimmetrikus tartása, rendellenes tónusa, mozgásban elmaradó végtag fejlődési rendellenesség vagy szülési sérülés miatt
kézfej, tenyér felszín alaki rendellenességei lábfej rendellenes tartása
c) egyéb
Megjegyzés:
Bármely eltérés esetén orvoshoz irányítás szükséges.
Törzs
a) fiziológiás elváltozás nélkül
b) kóros
mellkas deformitás puffadt, elődomborodó has gerincoszlop formai eltérése
c) egyéb
Megjegyzés:
Elváltozás esetén orvosi vizsgálat szükséges.
Fejlődési rendellenesség
Bármely szervrendszert, szervet érintheti, halmozottan is előfordulhat. Gyanú esetén orvosi vizsgálat szükséges. Diagnózis felállítása minden esetben orvosi feladat
3. számú melléklet
Elemi mozgásminták, primitív reflexek
(http://www.gekkonet.hu/bolcsode/mozgasfejlodes-ujszulott-csecsemo-korban.html http://sites.google.com/site/fejlodesneurologia/Fejlodesneurologia-Home/vizsgalatok)
Elemi mozgásmintáknak nevezzük a csecsemő azon mozgásait, amelyek a magzati élet során alakultak ki, és így az idegrendszerben lenyomatot hagytak maguk után Kiválthatók 7 hónapos korig, később kóros.
VERTIKALIZÁCIÓS (testtartás)
- Lebegtető ültetés
- Ülésbe felrugaszkodás
- Ülésbe húzás háton fekvő helyzetből
LOKOMOTOROS (helyváltoztató)
- Lejtőn felfele kúszás
- Lejtőn lefele kúszás
- Elemi mászás (Bauer reakció))
- Elemi járás
- Fejemeléssel aktivált kúszás
PRIMITÍV REFLEXEK (20-24. hétig kiváltva normális reakció)
- Moro reflex
- Kapaszkodási reakció
- Babinszky tünet
- Szopó reflexek, periorális, orális reakciók ( keresési, alsó ajak, felső ajak, állkapocs reflex) Kóros állapot:
- elemi reflexek valamelyike nem váltható ki
- fokozott izomtónus
- hypotonia
Megjegyzés:
Bármilyen elváltozás, rendellenesség gyanúja esetén neurológiai vizsgálatra kell küldeni az újszülöttet.
4. számú melléklet
Pszichomotoros fejlődés vizsgálata1
Pszichomotoros és mozgásfejlődés
- életkornak megfelelő
- életkornak nem megfelelő
Pszichés állapot 10
- kiegyensúlyozott, éber, figyelmes
- nyugtalan, sírós, (alvás, táplálás nehezített)
- passzív, apatikus, aluszékony
| Szempontok a csecsemő pszichomotoros fejlődésének értékeléséhez 1 éves korig | |
| 1 hónapos korban javasolt ellenőrizni | erős hangra összerezzen |
| emberi hangra figyel | |
| rövid ideig arcra fixál | |
| hason fekve fejét átfordítja | |
| flexiós tartás, kezek ökölben | |
| 2 hónapos korban javasolt ellenőrizni | flexiós tartás csökken |
| fejével hang irányába fordul | |
| 25-30 cm távolságban arcot követ | |
| arcra mosolyog ( szociális mosoly) | |
| kezébe adott csörgőt megtartja | |
| háton gyakran aszimmetrikus tartás | |
| hason fekve fejét / vállát emeli | |
| torokhangot ad (pl. agggiii) | |
| 3 hónapos korban javasolt ellenőrizni | elnyújtott hangokat hallat (aa, öö, gii) |
| fejét stabilan tartja | |
| oldaláról a hátára fordul | |
| hasra téve tenyérrel kitámaszt | |
| kezét nézegeti | |
| tárgyak felé nyúl, próbálja megfogni | |
| 4 hónapos korban javasolt ellenőrizni | elnyújtott magánhangzókkal gőgicsél, hangosan nevet |
| kezét középvonalban nézegeti | |
| pontosan nyúl tárgyakért | |
| hason fekve alkarra támaszkodik, mellkasát emeli | |
| oldalára fordul | |
| szimmetrikus testtartás és végtagmozgás | |
| 6 hónapos korban javasolt ellenőrizni | gagyog, élvezi a hangadást |
| közvetlen hozzátartozókhoz fokozottan kötődik | |
| játékot egyik kézből másdikba áttesz, szájba vesz | |
| forog | |
| hason fekve egykézen támaszkodva játék után nyúl | |
| leeső tárgy után néz | |
| rövid ideig megtámasztva megül | |
1 A pszichomotoros fejlődés zavarainak felismerése és ellátása az alapellátás gyakorlatában című 2. számú módszertani levél OGYEI-MAVE 2005.
| Szempontok a csecsemő pszichomotoros fejlődésének értékeléséhez 1 éves korig | |
| 9 hónapos korban javasolt ellenőrizni | szótagokat ismételget (pl. ba-ba-ba) |
| nevére felfigyel, tiltást ért | |
| "Hol van?" kérdésre, ismerős személyre, tárgyra rámutat | |
| ismerős személlyel huncutkodik, idegentől fél | |
| öltöztetésnél kezét lábát dugja | |
| tárgyakat egymáshoz, asztalhoz ütöget | |
| apróbb tárgyakat hüvelyk oppozicióval megfog | |
| felül | |
| kúszik, mászik | |
| 12 hónapos korban javasolt ellenőrizni | egyszerű utasítást gesztus segítségével megért |
| anyanyelvi hangzókészlettel halandzsázik | |
| számára érdekes dolgokra hanggal, mutogatással felhívja környezete figyelmét | |
| játékot ki-be rámol | |
| kézbe vehető ételeket önállóan eszik | |
| apró tárgyakat csippentő fogással megfog | |
| feláll, kapaszkodva lépeget | |
5. számú melléklet
Érzékszervi szűrővizsgálatok (Szóbeli közlés Holló Rózsa Főiskolai docens szakmai anyagai alapján (védőnői szűrővizsgálatok továbbképzés 2010.)
I. Látás
1. A látás fejlődése Magzati kor:
1. Szemmozgások 16-18 hetes gesztációs korban
2. Szemnyitás 24-28 hetes korban
Újszülött
- Cornea átmérője viszonylag nagy, írisz szürkés színű, a szem átmérője a felnőtt szem 66-70%-a
- A születés pillanatában van vizuális funkció: pupillareakció, fényérzés
- Az első 3-72 órában automatikus reflexmozgás vizuális ingerre, távollátás miatt látásuk homályos
- Optokinetikus nystagmus kiváltható
Látás az első hetekben
- Oculo-palpebrális reflex a 2., 3. héten már kiváltható (közelítünk a szeméhez zárja a szemhéjakat)
- Szemmozgások még nem teljesen koordináltak, kezdetben nincs tárgykövetés
6 hetes kor
- Szemével elkezdi követni a tárgyakat
- Arcot fixál, visszamosolyog
2. Látásfunkciók vizsgálata-szűrések
Újszülöttkor - alak, méret, működés
- anamnézis felvétele - szemészeti is
- megtekintés - fejlődési rendellenesség, sérülés, az arc felépítésének sajátosságai
- szaruhártya (cornea) átmérője 10 mm - mérés eszköze: cornea mérésére alkalmas cm?
- megfigyelés: pupilla egyenletesen sötét, fekete
- fényérzékelés vizsgálata: pupillalámpával kb. fél méter távolságból világítsuk meg a szemeket külön-külön, figyeljük, hogy a pupillák beszűkülnek-e a direkt fényre, fényre reagálnak
- vörös visszfény vizsgálata: pupillalámpával kb. fél méter távolságból világítsuk meg a szemeket, azt figyeljük, hogy mindkét szemből nyerhető-e vörös visszfény, hogy azonos színű és intenzitású-e mindkét oldalon. Azonnali szakorvosi vizsgálatot igényel: a vörös visszfény sötétebb vörös, világos és/vagy eltér a két szemen, fehér vagy egyáltalán nincs (pl. veleszületett szürkehályog) Segítséget adhatnak a gyermekről készült fotók.
3 hónapos kor - tárgykövetés, fixálás, szemmozgás
- Megtekintés - nagyság, helyzet, mozgás
- Corneális reflexkép - pupilla középen áll, szimmetrikusan tükröződik a lámpa fénye
- Fejtartás
- Szemhéjjak állása, mozgása
- Követéses vizsgálat - színes (piros, narancssárga), kontrasztos tárgy segítségével hívjuk fel a figyelmét, várjuk meg míg fixál, mozgassuk mindkét irányba, figyeljük a követést, elmarad-e az egyik szem a másikhoz képest
6 hónapos kor - corneális fényreflexek, szemmozgások, kancsalság vizsgálata (külön-külön tud-e figyelni a két szem) -iemelt fontosságú feladat - ekkor kell megkezdeni a kezelést
- Megfigyelés (pl. nyúl-e a játékokért, milyen a fejtartása, stb.), szülő kikérdezése
- Corneális reflexkép - pupilla középen áll, szimmetrikusan tükröződik a lámpa fénye
- Szemmozgások vizsgálata tárgykövetéssel - a bénulásos kancsalság felismerésére szolgál
- A csecsemő az anya ölében ül. Egy élénk tárggyal felkeltjük a figyelmét (kb. fél méterről)és megvárjuk, míg fixálja a tárgyat
- Ezután a homlokát óvatosan rögzítjük, majd a tárgyat elmozdítjuk mindkét irányban.
- Bénulásos kancsalság esetén az egyik szem valamelyik irányban elmarad a másikhoz képest
- Ezután közelítsük a gyermek szeme felé valamilyen apró tárgyat /üveggyöngy, gyöngy/ normális esetben ilyenkor a pupillák beszűkülnek, és szimmetrikusan konvergálnak.
Takarásos teszt Cover teszt - ez a teszt a valódi kancsalság kimutatására szolgál.
- A gyermek a szülő ölében ül. A jól kooperáló gyermekkel könnyen elvégezhető a vizsgálat abban az esetben, ha a szemmozgások szabadok /tehát nincs bénulás/.
- A kisgyermeknek olyan játékot mutatunk, kb. fél méter távolságból, ami felkelti az érdeklődését.
Eközben a vizsgáló eltakarja a gyermek egyik szemét, s közben a másik szem mozgását figyeli. Ha a szem megtartja eredeti tekintési irányát, akkor valószínű, hogy ezen a szemen nincs kancsalság. Ezután a másik szem vizsgálata következik ugyanilyen módon.
Ezután az egyik, majd a másik szem gyors egymás utáni, váltakozó takarása következik. Ha a szem úgynevezett "beigazító mozgást" végez, s ezt mindkét szemen felváltva észleljük, akkor az heterophoriára /rejtett kancsalság/ utal. Korai felismerése azért fontos, mert valódi kancsalságba mehet át.
Fontos tünet még ha a gyermek csak az egyik szem takarása ellen tiltakozik - elkapja a fejét - akkor gyanús, hogy a szabadon maradt szemével rosszul lát, és tiltakozik a jól látó szeme letakarása ellen. Ezzel a módszerrel csak durvább látáshiba derülhet ki.
1 éves kor
- Megfigyelés - (pl. korának megfelelően mozog, tájékozódik, apró képeket felismeri, egyszerű képekre mutogat), szülő kikérdezése
- Corneális reflexkép - pupilla középen áll, szimmetrikusan tükröződik a lámpa fénye
- Takarásos teszt az előző életkorban leírtak szerint
- Kukucsjáték - egyformán használja-e mindkét szemét?
Rizikófaktorok
Gyermekszemészeti vizsgálat indokolt ha a szülők anamnézisében szerepel
- Retinoblastoma
- Veleszületett szürkehályog
- Veleszületett zöldhályog
- Retinadistrophia
- Kancsalság
- Tompalátás
- Szemüvegviselés
- Nem sérülés okozta vakság
- Koraszülöttség (< 1500 g, < 30 geszt. hét)
- ROP
- Intrauterin retadáció
- Perinatalis komplikáció
- Neurológiai rendellenesség
- Juvenilis idiopathiás arthritis
- Pajzsmirigy-betegség
- Szájpadhasadék vagy más craniofacialis abnormalitás
- Diabetes mellitus
- Tartós gyógyszeres kezelés (szteroid)
II. Hallás
1. A hallás folyamata
- hangok először a külső hallójáratba jutnak, majd megrezegtetik a dobhártyát
- a dobhártya által közvetített rezgések hatására a hallócsontocskák rezegni kezdenek és a folyadékkal teli csigába továbbítják a rezgéseket
- a rezgések ingerületté alakulnak a csigában található Corti-féle szervben
- Innen az idegi jeleket a hallóideg közvetíti az agy hallóközpontjába, ahol a hangok tudatos érzékletté lesznek.
Hallás már az intrauterin életben is működik - erős hangok hatására a magzati szívverés gyorsul. Kb. 2 éves korra éri el a hallórendszer a felnőttre jellemző paramétereket.
30 dB = suttogó hang (szociális hallásküszöb) - ekkora vagy ennél nagyobb halláscsökkenés a beszédmegértést fontos frekvenciában lehetetlenné teszi.
60dB = társalgási hang
A normál beszéd és nyelvi fejlődést már az egyoldali halláscsökkenés is jelentősen korlátozza, jegyekkel rosszabb tanulási teljesítményt okozhat.
2. Halláscsökkenés típusai
Vezetéses jellegű a halláscsökkenés, ha a laesio a külső vagy a középfülben van.
Szenzoros jellegű a halláscsökkenés, ha a laesio a cochleában van.
Idegi vagy neurális a halláscsökkenés, ha a laesio a cochleától felfelé van.
Kevert formák is előfordulhatnak, pl. a vezetéses és az idegi halláscsökkenés kombinációja.
A halláscsökkenés fokozatai
Nincs illetve nem jelentős a halláscsökkenés
25dB
Kisfokú 26-40dB
Közepes 41-60dB
Nagyfokú 61-80dB
Súlyos 81-90dB
Süketséggel határos
vagy ún. hallásmaradvány >90dB
Teljes hallásvesztés hallást nem lehet kimutatni
3. Halláscsökkenés okai, epidemiológiája és rizikófaktorai újszülött korban
- legtöbbször szenzoneurális (percepciós) típusúak
- 50% genetikai eredet
- 75-80% mindkét szülő normál hallású, tehát recesszíven öröklődik
- 20%-a autoszomális domináns
- 2-5%-a X kromoszómához kötött
- otitis media különböző formái ritkák
- 50% környezeti ok
- terhesség alatti fertőzések - CMV, toxoplazma, rubeola, herpes simplex
- terhesség alatt alkalmazott ototoxikus gyógyszerek - aminoglycosid antibiotikumok, citosztatikumok
- anya krónikus alkoholizmusa
- toxaemia, diabetes
- intenzív újszülött ellátás
csecsemő korban
- fülkürt anatómiája és a gyermeket érő infekciók
- gyakori savós középfülgyulladás okozta vezetéses nagyothallás - általában nem haladja meg a 30 dB-t, viszont a beszéd megtanulását nehezíti ha tartósan fenáll
Születéstől a 28. napig
- pozitív családi anamnézis a gyermekkori tartós halláscsökkenéssel kapcsolatban
- méhen belüli infekciók (CMV, toxoplazma, rubeola, herpes, szifilisz)
- fül- és egyéb craniofaciális fejlődési rendellenesség
- transzfundálást igénylő hiperbilirubinémia
- 1500 gr-nál kisebb születési súly
- alacsony Apgar értékek: 0-3 = 5 perces, 0-6 = 10 perces
- RDS (meconium aspiracio)
- tartós (több mint 10 nap) gépi lélegeztetés
- ototoxikus gyógyszerek pl.: gentamicin, citosztatikum több mint 5 napig tartó alkalmazása
29 naptól iskolakezdésig
- szülői gyanú a hallás, beszédfejlődés késésével kapcsolatban
- az I. pontban felsorolt újszülött kori rizikófaktorok bármelyike
- visszatérő vagy elhúzódó középfülgyulladás (legalább 3 hónapig)
- os temporale törésével járó fejsérülés
- gyermekkori fertőző betegségek - meningitis, mumpsz, kanyaró, haemophilus influensae, streptococcus pneomoniae, varicella zoster
- neurodegeneratív betegségek - pl. Hunter szindróma
- progresszív halláscsökkenéssel járó szindrómák - pl. neurofibromatozis, stb.
4. Hallásszűrés
Szűrések gyakorisága (51/1997.(XII.18) NM rendelet szerint):
- 1, 3 és 6 hónapos korban
- 1 éves életkorban
Objektív szűrővizsgálatok
Szubjektív szűrővizsgálatok
Nagy tapasztalatot igényel
- A gyermekek globális megítélése is szükséges - reakciók, figyelem, mozgásügyesség, stb.
- Az életkorhoz tartozó értelmi szint figyelembe vétele
- Környezet - kellemes, játékos, háttérzajok kiszűrése
- Szabad hangtérben vagy fejhallgatóval?
Újszülött kor - hírtelen zajkeltés közvetlen közelében
Meglepetési reflex: a gyermek a sírást és a testmozgást egy pillanatra megszünteti
Auropalpebrális reflex: a nyitott szemhéjak gyors zárása/záródása, a zárt szemhéjak összerándulása (pl. koppanó hang adására)
Mozgási reflex: a karok átölelő mozdulata, rúgú-lökő mozgások végzése
Kiáltási reflex: sírás, amit a diszkomfort érzés mimikája vezet be (pl. száj lefelé görbül)
Légzési reflex: igen mély légvétel amit szünet követ, majd néhány felületes légvétel
Ébredési reflex: az alvó újszülött felébred a hirtelen hangra
Értékelés:
- a vizsgálat elfogadható minimum 3 válasz megléte esetén
- fontos figyelni arra, hogy étkezés után csökken a reflexválasz
- a reflex-készség hamar kimerül - többszöri ismétlés után bizonytalanná válik
3 hónapos kor - orientációs reflex (babyscin)
hangforrás felé fordul, lokalizálja, szemét vagy fejét a hang irányába fordítja. Ezt használjuk fel az ún.
Boel-teszt: különböző hangok adása, játékszerek, csörgők segítségével, vizuális eltereléssel (pontos kivitelezés)
Értékelés:
- Magas frekvencia (4000 Hz): sziszegők (sz)
- Közepes frekvencia (1000, 2000 Hz): csésze + kanál
- Mély frekvencia (500 Hz): emberi "á" hang
6 hónapos kor - orientációs reflex
hangforrás felé fordul, lokalizálja, szemét vagy fejét a hang irányába fordítja.
Ezt használjuk fel az ún.:
Boel-teszt: különböző hangok adása, játékszerek, csörgők segítségével, vizuális eltereléssel (pontos kivitelezés)
Értékelés:
- Magas frekvencia (4000 Hz): sziszegők (sz)
- Közepes frekvencia (100, 2000 Hz): csésze + kanál
- Mély frekvencia (500 Hz): emberi "á" hang
1 éves kor - orientációs reflex
hangforrás felé fordul, lokalizálja, szemét vagy fejét a hang irányába fordítja. Ezt használjuk fel az ún.:
Boel-teszt: különböző hangok adása, játékszerek, csörgők segítségével, vizuális eltereléssel (pontos kivitelezés)
Értékelés:
- Magas frekvencia (4000 Hz): sziszegők (sz)
- Közepes frekvencia (100, 2000 Hz): csésze + kanál
- Mély frekvencia (500 Hz): emberi "á" hang
Hallás és beszéd
Hallás - beszéd skála
Magatartás-megfigyelés vizsgálat - 1-3 hónapos kor
- Hírtelen, erős zajra megváltozik a magatartás
- Megnyugszik az anya beszédére
- Megjelennek az első különbségek a hangadásban - már nem monoton
- Csengő hangra figyel, ha nem is látja
- Szemmozgás jelzi, hogy keresi a számára ismert hangok forrását
- Gagyogás megindul
Hallás - beszéd skála - 4-6 hónapos kor
- Fejfordítás a hangadás irányába
- Hangadással nevet "kacag"
- Oldalról, mélyebbről jövő hangforrások lokalizálása fejfordítással
- Csengő, pengő hangokra (pl. hangvilla) figyel, "fülel"
- Zene hangjára abbahagyja a sírást
- Felnőttel hangi kapcsolatot vesz fel
Hallás - beszéd skála -10-12 hónapos kor
- Megérti a tiltást
- Felfigyel és tudatosan keresi a hangforrást (mozgással is)
- Zenére hangadással reagál, táncol
- Halk, hozzá intézett beszédre 1 méter távolságból reagál
- Érthetően ejt 1-3 szót
- Magában gagyog ha egyedül van, szórakoztatja a hangja
5. Hallássérülésre utaló jelek
2 éves kor alatt:
- Beszédre, zajokra, zörejre gyengén vagy nem reagál.
- Éneklés, beszéd, zenélő játékok nem kötik le, nem nyugtatják meg.
- Feltűnően figyeli a beszélő arcát, szájmozgását.
- Megijed egy személy hirtelen megjelenésekor, ha előzőleg nem látta.
- Túl hangosan játszik hangot adó játékokkal, olykor nagyon hangosan kiabál, beszél, vagy rikoltozik, torokhangokat hallat, melyek vibrációs érzetet váltanak ki belőle.
- Gagyogása, hangadása az életkorral inkább ritkul, mint gyarapszik, gazdagodik.
- éves korára még alig, vagy egyáltalán nem érti a hozzá intézett beszédet.
6. Mit kérdezzen a védőnő? 1 hónapos kor:
Vannak-e olyan hangos zajok amelyek megijesztik (pl. ajtócsapódás, tárgyak leesése, csörömpölés, stb.)
Szokott-e megmozdulni álmában, ha a közelében hangos lárma van - ha egyébként csendes a környezet
2-4 hónapos kor:
Felfigyel-e a számára kellemes zajra
Felerősödik-e a gagyogása, ha anyja szól hozzá
5-6 hónapos kor:
Meg tudja-e nyugtatni az anyai hang, akkor is ha nincs a látóterében
Folyamatosan gazdagodik-e új hangokkal a gagyogása
Különböző hangmagasságokban gagyog-e
7-8 hónapos kor:
Megpróbál-e a gyermek beszélni, amikor az anya szól hozzá
Felfigyel-e a felnőttek egymás közötti beszélgetésére a környezetében
Megijed-e amikor az anya halkan az ágyához lép, hogy felemelje
9-10 hónapos kor:
Felfigyel-e a halk hangokra - pl. papír zsebkendő zizegése
Sok szót megért-e már, és ezekre megfelelően reagál-e (odanéz, megfordul, megfog egy tárgyat, cselekvést abbahagy, stb.
6. számú melléklet
Mozgás, mozgásszervek vizsgálata
Ahhoz, hogy a csecsemő nagymozgásai megfelelő időben érjenek be és azokat megfelelő minőségben tudja kivitelezni, számos tényező szükséges:
Ép idegrendszer: az agy mozgásszabályozásért felelős területeinek épsége, melyek mindig megfelelő időben küldik az utasításokat a nagymozgások fejlődéséhez.
Megfelelő izomtónus
Érett egyensúly- és koordinációs készség
Életkornak megfelelő mentális érettség
Csípőszűrés: Megtekintjük az alsó végtagok redőinek szimmetriáját háton fekvő és hason fekvő helyzetben is, valamint megtekintjük, hogy van-e hosszbeli eltérés az alsó végtagok nyújtása és egymás mellé helyezése alapján.
1. Mozgásfejlődés
1. Az első hónap
A kar, láb és a kéz mozdulatai még mindig elsősorban reflex-szerűek Spontán módon megriad - ez az ún. Moro-reflex Kezét általában ökölben tartja
Ha ülő helyzetbe felhúzzák, a fejét a gerincével egy vonalban tartja
Rácsodálkozik a tárgyakra, de még nem nyúl értük Ha az ujjait szétnyitjuk, megfogja a csörgőt vagy más játékot, de hamar elengedi
2 hónapos kor
Fejlődik az izomtónusa
Kicsit még tétován, de nézegeti a körülötte lévő világot
Ha egy tárgyat figyel, koordinált a szemmozgása
Fejével a hang irányába fordul 25-30 cm távolságban arcot követ
Kezébe adott csörgőt megtartja
Háton gyakran aszimmetrikus tartás
Hason fekve fejét 45 fokban emeli
Flexiós tartás csökken
4 hónapos kor
Reflexek eltűnnek
Kezét a középvonalban nézegeti
Pontosan nyúl tárgyakért
Hason fekve alkarra támaszkodik, mellkasát emeli
Oldalra fordul
Szimmetrikus testtartás és végtagmozgás
6 hónapos kor
Gagyog, élvezi a hangadást
Játékot egyik kezéből a másikba veszi
Forog
Hason fekve egy kézen támaszkodva játék után nyúl
Leeső tárgy után néz
Rövid ideig megül
7 hónapos kor
Inkább kúszik (hasával a földön), semmint mászik
Négykézlábra áll, és előre-hátra ringatja magát
Háton is mozog, fenekét fölemeli, és leteszi
Egyszerre két kezében egy-egy tárgyat fog, és összeütögeti őket
A tárgyak megfogásánál használja az ujjait is
8-9 hónapos kor
Öltözködésnél kezét, lábát dugja
Tárgyakat egymáshoz, asztalhoz ütöget
9 hónaposan apróbb tárgyakat hüvelyk oppozicióval megfog
Felül
Kúszik, mászik
Saját testének határairól kap visszajelzést, amikor kúszik 5-8 hónapos korban és ekkor (nagy felülettel érintkezik a talajjal). Saját testhatárai ismerete szükséges ahhoz, hogy megtanulja, milyen kiterjedése van a térben.
Megtanulja bemérni a távolságokat, a magasságokat, mélységeket. Később e tapasztalatokra épülnek majd a testrészek nevei.
Mászás: fejleszti az egyensúlyt és a koordinációs készséget, erősíti a hátizomzatot, kódolja az agyban a jobb-bal testfél mozgását, az onnan érkező információkat.
A kúszás, mászás (8-10 hónapos korban) begyakorlása a helyes mozgáskoordináció fejlődése szempontjából, illetve az agyféltekék dominanciájának kialakulása terén is nagyon lényeges mozgásformák. Két agyféltekénk közül a jobb oldali a bal test felet irányítja, a bal a jobb oldalit. Ám a két agyfélteke nem egymástól izoláltan működik, hanem egymással folyamatosan integrálja tapasztalatait. A kúszás, mászás éppen olyan mozgásformák, melyeknél a váltott kar-lábmozgás miatt megvalósul az agyféltekék szinkronizációja. Nagyon fontos, hogy a kúszás, mászás folyamatát alaposan begyakorolja, tökéletesítse.
12 hónapos kor
- Számára érdekes dolgokra hanggal, mutogatással hívja fel a figyelmet
- Játékot ki-be rámol
- Kezébe vehető ételeket önállóan eszik apró tárgyakat csippentő fogással megfog
- Feláll, kapaszkodva lépeget
Ebben az életkorban a kéreg alatti területek is bekapcsolódnak az irányításba Az idegrendszer fejlődése szoros kapcsolatban áll az egyensúlyi szervvel.
Az egyensúlyi rendszer intenzív stimulálása kedvezően befolyásolja az összes agyi érési folyamatot, így a figyelmet is. Nagy hangsúlyt kap az egyensúlyi ingerek biztosítása különböző játékeszközök segítségével.
7. számú melléklet
Kültakaró vizsgálata
Célja:
- a bőr betegségeinek és/vagy egyes fertőzőbetegségek időbeni felismerése,
- tanácsadás a felmerült probléma megszüntetése érdekében,
- orvosi vizsgálatra irányítás,
- a kialakult elváltozások nagyságbeli eltérésének észlelése,
- a betegség esetleges súlyosbodásának felismerése.
A vizsgálat nagy fontosságú, mivel a bőr egyszerre védőburok és fontos érzékszerv is!
Vizsgálati módszer: észlelés és tapintás
Vizsgálat rendszeressége:
- minden tanácsadási alkalommal, amikor a csecsemő levetkőztetésére kerül sor,
- panasz esetén.
Vizsgálat menete:
1. anamnézis felvétele, mely során tisztázandóak
- a családban előforduló bőrelváltozások, bőrbetegségek,
- szülés során keletkezett sérülés.
2. A vizsgálat sorrendje
2.1. A csecsemő kültakarójának vizsgálata hanyattfekvő helyzetben
- a hajas fejbőr megtekintése, tapintása
- a fej formájának megtekintése, a koponya deformitások észlelése
- fülek, szemek megtekintése,
- szájüregbe tekintés,
- a nyak bőrének megtekintése, tapintása
- kulcscsont tapintásos vizsgálata a zöldgalytörés észlelésére
- a mellkas bőrének megtekintése, tapintása
- a hónalj megtekintése, tapintása
- a felkar bőrének megtekintése - különös tekintettel a BCG-oltás helyére, a felkar bőrének tapintása
- alkarok, tenyerek, ujjak bőrének és a körmök állapotának megtekintése, tapintása
- a has bőrének megtekintés, kiemelt figyelemmel a köldök állapotára 3 hónapos korig, a bőrfelület tapintása
- a lágyék megtekintése, tapintása
- herék tapintásos vizsgálata, hogy a scrotumban vannak-e.
- a combok bőrének megtekintése, tapintása
- alszárak, talpak, ujjak bőrének és a körmök állapotának megtekintése, a bőrfelület tapintása
- genitáliák, gluteális tájék megtekintése, a bőrfelület tapintása
2.2. A csecsemő kültakarójának vizsgálata hason fekvő helyzetben
- a hát bőrének megtekintése, a bőrfelület tapintása
- a combok bőrének megtekintése, a bőrfelület tapintása
- a gluteális tájék megtekintése, a bőrfelület tapintása
2.3. A bőr turgorának vizsgálata
- a bőr ráncolhatósága, az alaptól elemelhetősége, a ráncok kisimulása,
- vizsgálat helye: a comb belső felszíne vagy az alhas,
(A kültakaró általános állapotának megfigyelési szempontjait az 1. számú melléklet tartalmazza.)
8. számú melléklet




9. számú melléklet
Mikor forduljunk sürgősséggel gyermekgyógyászati ellátáshoz, ügyelethez?
Az Országos Gyermekegészségügyi Intézet és a Házi Gyermekorvosok Országos Egyesületének ajánlása
1. Milyen esetekben forduljanak mentőhöz illetve orvosi ügyelethez?
A csecsemők és kisgyermekek állapota rövid idő alatt változhat, súlyosbodhat,
ezért ha gyermekénél az alábbi aggasztó tüneteket tapasztalja, kérjen mielőbb segítséget!
2. A mentőket riassza, és kezdje meg az elsősegélynyújtást! Mentők: 104.
- Ha a gyermek nem vesz levegőt, eszméletlen, pulzusa nem tapintható.
- Egyes légzészavarok esetén: nehézlégzés, fulladás, leszürkülés, elkékülés, ugató köhögési rohammal kísért nehéz, húzó belégzés, hirtelen bekövetkező rekedtség kínzó légszomjjal, hirtelen kialakuló heves mellkasi fájdalom.
- Sérülések, balesetek esetén: láthatóan súlyos sérülés, észlelhető csonttörés, magasból leesés, nagy vérzés, vérvesztés, eszméletvesztéses fejsérülés, égés, forrázás, fagyás, kihűlés, vízbefúlás, mérgezés, idegentest félrenyelése, áramütés, vagy ezek gyanúja, állat súlyos harapása, kígyó marása.
- Idegrendszeri tünetek esetén: eszméletlenség, eszméletzavar, eszméletzavarral járó izomrángatózások, feltűnő aluszékonyság, szokatlan heves nyugtalanság, merev tarkó, csillapíthatatlan fejfájás, erős kínzó szédülés, hirtelen látászavar, kettős látás, öngyilkossági kísérlet.
3. Ügyelethez forduljon elsősorban!
Ügyelet helye: Telefon:
- Egyes lázas állapotok esetén: láz 3 hónaposnál fiatalabb csecsemőnél, szabályos lázcsillapítás ellenére sem enyhülő magas láz, láz súlyos, elesett állapottal.
- Egyes légúti tünetek esetén: kínzó, nem csillapodó köhögés, nehezített ugató köhögés, sípoló nehézlégzés, légúti betegségben hirtelen rosszabbodás, fájdalomcsillapítás ellenére is fennálló kínzó fülfájás.
- Hasi tünetek esetén: csillapíthatatlan görcsös hasfájás, kínzó haspuffadás, szelek elakadása, súlyos, ismétlődő hányás, hasmenés (kiszáradásra utal ha több órája száraz a pelenka), csecsemőnél véres széklet, erős alhasi fájdalom, erős nőgyógyászati vérzés, a here fájdalmas duzzanata esetén.
- Vizeletürítési zavarok esetén: vizeletürítés több, mint 12 órás hiánya, gyakori fájdalmas vizelés lázzal, véres vizelet nagy hasi fájdalommal.
- Veszélyes allergiás állapot esetén: hirtelen bekövetkező, rekedtséggel járó nehezített belégzés, rovarcsípés kifejezett fej/nyak és szemhéj duzzanattal, nagy testfelületre kiterjedő csalánkiütés.
- Egyes bőrtünetek esetén: terjedő bőrvérzések, sárgaság, kiterjedt bőrkiütések lázzal.
- Szociális sürgősség esetén: ha a gyermeket felügyelet nélkül hagyják, elhanyagolás, bántalmazás jelei vannak.
4. Indokolatlannak tekinthető az ügyelethez fordulás, ha a gyermeknek:
- enyhe náthája, kevés köhögése, csak hőemelkedése van, vagy láza csillapítható,
- kevés, nem terjedő kiütése van, általános állapota jó, kullancsot kell kivenni,
- hasmenése, nem ismétlődő hányása, székrekedése van jó állapot mellett,
- receptírás: a szokásos tápszere, állandó gyógyszere elfogyott,
- igazolás közösségbe, táborozáshoz, sportoláshoz.
A Nemzeti Erőforrás Minisztérium szakmai irányelve az 1 és 3 éves kor közötti kisgyermekek táplálásáról
Készítette: a Csecsemő- és Gyermekgyógyászati Szakmai Kollégium
I. Alapvető megfontolások
A gyermekgyógyászati táplálkozástudomány irodalmában általában a csecsemőkorra, azaz az élet első évére, majd pedig a gyermekkor további éveire vonatkozóan kezelik elkülönítetten a táplálási ajánlásokat. Ennek az elhatárolásnak az elvi alapja az a módszertani különbség, hogy míg csecsemőkorban a szoptatott csecsemő táplálékbevitelét teljes joggal tekinthetjük a követendő mintának, addig a csecsemőkor után jóval összetettebb, ám ugyanakkor bizonytalanabb módszertanra hagyatkozhatunk csak a táplálási ajánlások megfogalmazásakor.
A gyermekgyógyászat gyakorlata azonban igényt tartana a táplálási ajánlások szempontjából igen jól körvonalazott csecsemőkort közvetlenül követő kisdedkori/kisgyermekkori (egyéves és hároméves életkor közötti) időszakra vonatkozó ajánlásokra is. Egyrészt ez az időszak a további erőteljes testi növekedés időszaka, aminek során a gyermeki test szövetei mintegy 50%-kal bővülnek. Másrészt a kisdedkor a központi idegrendszer további jelentős differenciálódásának az időszaka is, amikor az akár csak átmenetileg érvényesülő nutríciós elégtelenség potenciálisan késői következményeket is magában hordozó fejlődési zavar legalábbis járulékos tényezője lehet.
A fenti gyakorlati igény kielégítésére hívta életre a Gyermekgyógyászati Szakmai Kollégium a kisdedkor táplálási alapelveinek rövid összefoglalását célul kitűző ad hoc bizottságát.
II. Diagnózis
III. Kezelés
Folyadékszükséglet
A tápanyagszükséglet biztosításán belül elsődleges a folyadékigény (a táplálkozástudomány újabban a vízigény megnevezést használja) kielégítése. A szomjazás már nagyon rövid idő, 12-24 óra alatt az életfolyamatok súlyos zavarához vezethet. A test víztartalmát a folyadékfelvétel és a folyadékleadás közti egyensúly nagymértékben meghatározza. A szervezet folyadékigényét befolyásolja az életkor, a környezeti- és a testhőmérséklet, a fizikai aktivitás, a táplálék ásványi anyag tartalma, emocionális- és fizikai stressz, műtéti beavatkozás, trauma okozta sérülés, egyes betegségek, gyógyszerek, abnormális folyadékvesztés és a folyadékretenció (oedema-képződés).
A szervezet folyadékigénye szoros összefüggésben van az elfogyasztott táplálék energiatartalmával, 1 kcal (4,187 kJ) energiabevitelre 1 ml folyadékszükségletet számíthatunk. A víz az energiaszolgáltató tápanyagok (szénhidrátok, zsírok és fehérjék) metabolizmusának végterméke is, ez a kb.12ml/100kcal (3ml/100kJ) víz azonban a folyadékszükséglet kiszámításakor a gyakorlatban elhanyagolható. Az élettani helyzetben lévő kisded teljes folyadékigénye (ételben, italokban, ivóvízben) kb. 1300 ml/nap; ami a testfelszínre számítva 1500ml/m2/nap, a testsúlyra számítva a befolyásoló tényezőktől függően 100-120 ml/ttkg/nap értéknek felel meg. A folyadékbevitel formája egyéves kor után elsődlegesen az ivóvíz (esetleg gyermekeknek való ásványvíz) legyen, amit napi nem több mint 500ml tej, valamint alkalomszerűen gyümölcslevek, levesek és más folyadékok fogyasztása egészíthet ki.
Energiaigény
A kisdedek energiaigényének meghatározásakor a minden életkorban energiát igénylő élettani folyamatok (alapanyagcsere, táplálék által kiváltott hőtermelés, fizikai aktivitás, veszteségek) mellett a gyors növekedés energiaszükségletét is figyelembe kell venni. Azonban míg a növekedés energiaszükséglete a csecsemőkor első hónapjaiban akár a teljes energiaigény 1/3-át is elérheti, addig 2-3 éves életkor körül már csupán a teljes energiaigény 1%-a körüli érték. A kisdedkorban az energiaigény mintegy 82-84 kcal/ttkg/nap (340-350 kJ/ttkg/nap) értékre tehető, ami egyéves életkorban 800 kcal (3500 kJ), míg hároméves korban 1200 kcal (5000 kJ) körüli értékként számszerűsíthető (1). Kisdedkorban a fizikai aktivitás befolyásolja legnagyobb mértékében az energiaszükségletet: a mérsékelt intenzitású fizikai aktivitás a nyugalmi állapothoz képest kb. 20%-kal növelheti az energiaigényt.
Mennyiségi és minőségi fehérjeigény
Egy- és hároméves kor között a kisded mennyiségi fehérjeigénye a testsúly egységére számítva már nem olyan magas, mint csecsemőkorban, de jelentősen meghaladja felnőttkori szükségletet. Kisdedkorban a testhossz és a testsúly az egyéves csecsemő értékeihez képest hozzávetőlegesen 40-50%-kal növekszik, az agy, valamint a zsigeri szervek tömege is jelentősen gyarapszik, vagyis a fenntartó fehérjeszükséglet mellett jelentős a növekedéshez szükséges fehérjeigény is. A számítások szerint az ajánlott fehérjeszükséglet (recommended dietary allowance, RDA) kisdedkorban 1,2 g/ttkg/nap (2). Hangsúlyozandó, hogy az ennél magasabb fehérjebevitel nem előnyös, mert az így táplált kisdedek később nagyobb arányban válhatnak túlsúlyossá. A legújabb vizsgálati eredmények ugyanis azt mutatják, hogy a csecsemőkori fokozott fehérjebevitel a későbbiekben nagyobb arányban vezethet elhízás kialakulásához (3). A tehéntej viszonylag magas fehérjetartalma (kb. 3g/100ml) miatt célszerű a hígítatlan tej és az annak megfelelő összetételű készítmények (kakaó, madártej, stb.) napi bevitelét legfeljebb 500 ml-re korlátozni, ami például önmagában is fedezi egy 12 kg-os kisded teljes napi mennyiségi fehérjeszükségletét.
Az anyatej és a csecsemőtápszerek fehérjéi megfelelő mennyiségben tartalmaznak esszenciális aminosavakat. Az egyéb táplálékokban található fehérjék minőségi értéke attól függ, hogy milyen mértékben hasonlít aminosav összetételük az anyatej fehérjéihez. A csecsemőkorra vonatkozóan egyértelmű, hogy a felnőttkorban is esszenciális aminosavak mellett a cisztein és a tirozin is esszenciális aminosavnak tekinthető. Feltételezhető, hogy még kisdedkorban is szükséges lehet ez utóbbi aminosavak pótlása is. A kisdedkori esszenciális aminosav igényt az 1. táblázat foglalja össze.
1. TÁBLÁZAT
Egészséges kisdedek esszenciális aminosav igénye (mg/ttkg/nap) (2)
| Esszenciális aminosav | Kisdedek (1-3 éves kor) |
| Aromás aminosavak | 46 |
| Izoleucin | 28 |
| Leucin | 56 |
| Lizin | 51 |
| Kéntartalmú esszenciális aminosavavak (metionin + cisztein) | 25 |
| Treonin | 27 |
| Triptofán | 7 |
| Valin | 32 |
Szénhidrátok a kisdedek táplálásában
A szénhidrátok a szervezet számára a legkönnyebben emészthető energiaszolgáltató tápanyagok, melyeknek az energiatartalma grammonként kb. 4kcal (16,7 kJ). Hangsúlyozni kell, hogy élettani körülmények között a szénhidrátok jelentik az egyedüli energiaforrást a központi idegrendszer és a szemlencse számára. A legfontosabb szénhidráttartalmú élelmiszerek a gabonaipari termékek (liszt, kenyér, tészta, gabonapelyhek, magvak), a gyümölcsök (alma, szilva, narancs, stb.), a zöldségfélék (burgonya, kukorica, borsó, stb.), a tej és tejtermékek, a finomított cukrok és szirupok (fehér-, barna cukor, méz stb.).
A gyermekekre vonatkozó ajánlások az optimális szénhidrátbevitelt általában az energiabevitel 45-55%-ában határozzák meg, ami kisdedkorban napi átlagosan 130g szénhidrátbevitelnek felel meg (1 éves életkorban kb. 100 g, 3 éves életkorban kb. 150 g szénhidrát naponta).
A kisdedek étrendjében szereplő szénhidrátok nagyobb része összetett szénhidrát, elsősorban keményítő (burgonya-, gabonakeményítő) legyen, ami komplex enzimatikus folyamatok útján a szervezeten belül glükóz molekulákra bomlik le. Célszerű a szénhidrátbevitellel együtt a túlnyomóan komplex szénhidrátokból, illetve a szénhidrátokkal rokon kémiai struktúrájú vegyületekből álló diétás rostok bevitelére is figyelmet fordítani, ugyanis az általuk felszívott víz segíti a bélbaktériumok erjesztő hatását. Kisdedeknek 5-10 g diétás rost bevitele javasolható naponta. A laktóz szintén fontos szerepet játszik a normális bélflóra fenntartásában, a megfelelő laktózbevitel tej, vagy az azt helyettesítő készítmények fogyasztásával biztosítható. Ugyanakkor az egyszerű, finomított cukrok bevitele ártalmas lehet a fogszuvasodást elősegítő, valamint nagy mennyiségben a hyperglykaemia és hyperlipidaemia kialakulására hajlamosító hatásuk miatt.
Kisdedkorban a nagyon alacsony szénhidráttartalmú étrend alkalmazása számos okból kifejezetten ellenjavallt. Az alacsony szénhidrátbevitel energiahiányt okozhat, ill. az energiahiány elkerülésére nagyobb mennyiségben fogyasztott fehérjék a vese megterhelését, a nagyobb mennyiségben fogyasztott zsírok pedig az érrendszer és keringés megterhelését okozhatják.
Zsírok a kisdedek táplálásában
A csecsemők számára vitathatatlanul a szoptatás a kívánatos táplálási mód, ezért számukra a női tej zsírtartalma és zsírsavösszetétele szolgál a táplálék lipidösszetételének mintájául. Mivel a női tej zsírtartalma hozzávetőlegesen az energiatartalom 40-50%-ának felel meg, ezért a nem szoptatott csecsemő zsírigényét is az energiabevitel hasonló arányában határozták meg. A szoptatás szilárd táplálékokkal történő felváltásának folyamatában azonban a zsírok a táplálkozásban betöltött szerepe fokozatosan csökken.
Az egészséges gyermekek, köztük kisdedek táplálására vonatkozó ajánlások áttekintése azt mutatja, hogy kisgyermekkorban az étrend zsírtartalmaként általában az energiabevitel 30-35%-ának megfelelő érték javasolt (4). Ugyanis a táplálék energiatartalmának 35%-át meghaladó zsírbevitel az elhízás kockázatát növeli meg, míg ha a zsírok az energiatartalom 30%-ánál kisebb arányban szerepelnek az étrendben, akkor felmerülhet a nem kielégítő energiabevitel veszélye. A táplálék zsírsavösszetételére vonatkozó javaslat szerint az étrend közel egyforma mennyiségben tartalmazzon telített, egyszeresen telítetlen és többszörösen telítetlen zsírsavakat. Más szavakkal, a zsírsavak legfontosabb csoportjai az étrendben egyenként az energiabevitel kb. 10-12%-át szolgáltassák. A koleszterinbevitelt gyermekkorban is célszerű napi 200 mg alatt tartani. A csecsemők és gyermekek étrendjének zsírsavösszetétele az elmúlt évtizedekben került az érdeklődés homlokterébe. Az emberi szervezet nem képes az esszenciális zsírsavakat, azaz a linolsavat és az alfa-linolénsavat szintetizálni, ezért az esszenciális zsírsavakat az emberi étrendnek készen kell tartalmaznia. Az esszenciális zsírsavak metabolizmusának jobb megismerését követően azonban ma már egyértelmű, hogy a legfontosabb biológiai hatások nem a linolsavnak és az alfa-linolénsavnak, hanem hosszú szénláncú, többszörösen telítetlen metabolitjaiknak, elsősorban az arachidonsavnak és a dokozahexénsavnak tulajdoníthatóak. Az n-6 és az n-3 többszörösen telítetlen zsírsavak együttes bevitele akár az energiabevitel 10%-át is elérheti, azonban az n-6 zsírsavak bevitel ne haladja meg az n-3 zsírsavak bevitelének 5-10-szeresét. Míg az n-6 többszörösen telítetlen zsírsavaknak gazdag forrása a legtöbb növényi olaj (pl. napraforgó, kukorica), addig az n-3 zsírsavak a tengeri eredetű élelmiszerek mellett a repceolajban találhatóak nagyobb mennyiségben. Kisdedkorban is javasolt a transz zsírsavak bevitelét az energiabevitel legfeljebb 2%-ában korlátozni, ami a gyakorlatban a hidrogénezett növényi olajakat nagy mennyiségben tartalmazó készítmények (pl. margarinok, ízesített krémek) lehetőség szerinti kerülését jelenti.
Ásványi anyagok iránti igény
Az emberi test felépítésében 11 fő elem alkotja a testtömeg 99,7%-át, a közéjük tartozó nátriumot, káliumot, foszfort, klórt, kalciumot és magnéziumot hagyományosan ásványi anyagoknak nevezzük. A 2. táblázat mutatja a kisdedkori napi szükségletet ezekből az elemekből (4, 5).
2. TÁBLÁZAT
A kisdedek (1-3 évesek) átlagos napi szükséglet a különböző ásványi anyagokból (mg)
| Ásványi anyag | Napi szükséglet |
| Nátrium | 1000 |
| Klór | 1500 |
| Kálium | 3000 |
| Kalcium | 500 |
| Foszfor | 460 |
| Magnézium | 80 |
Az adatok jól mutatják, hogy a kisdedek ásványi anyag igénye testtömegükhöz képest jelentősen meghaladja a felnőttkori igényt. Külön hangsúlyozandó a magas kalciumszükséglet, amit a csontok az erre az életkorra jellemző jelentős növekedése magyaráz. A kalciumszükséglet fedezésekor nehézséget jelenthet azonban, hogy az arányaiban nagyobb szükségletet a szokványos kisdedkori étrend nem mindig fedezi, vagyis szükség lehet ebben az életkorban is olyan speciálisan a kisdedek számára összeállított tejhelyettesítő készítmények alkalmazására, melyek többek között kalciummal és foszforral is megfelelő mennyiségben és arányban dúsítva van.
Nyomelemszükséglet
Az emberi szervezet felépítéséhez 0,01%-nál kisebb arányban hozzájáruló elemeket nevezzük nyomelemeknek. A nyomelemek közül 10 bizonyosan szerepet játszik a szervezet anyagcseréjében. Ezekből a kisdedkori napi szükségletet a 3. táblázat mutatja
(4-6).
3. TÁBLÁZAT
A kisdedek (1-3 évesek) átlagos napi szükséglete a különböző nyomelemekből
| Nyomelem | Napi szükséglet |
| Vas (mg) | 7 |
| Jód (µg) | 90 |
| Cink (mg) | 3 |
| Réz (µg) | 340 |
| Króm (µg) | 11 |
| Szelén (µg) | 20 |
| Molibdén (µg) | 17 |
| Mangán (mg) | 1,2 |
| Fluor (mg) | 0,7 |
Kisdedkorban a vasszükséglet testtömeg kilogrammra számítva a felnőttkori igény háromszorosa. Érthető, hogy a nem megfelelően összeállított étrend esetén ebben az életkorban igen gyakori a vashiány (6, 7). Lényeges tudni, hogy a vashiány következményei már akkor is jelentkeznek, ha a kisded nem volt anaemiás. A vas nélkülözhetetlen a pszichomotoros és kognitív funkciók fejlődéséhez, hiányában ezekben a funkciókban zavarok keletkezhetnek. A vashiány fáradékonyságot, levertséget, sápadtságot, étvágytalanságot okozhat, valamint fokozza az infekciókkal szembeni fogékonyságot. A vashiány kialakulásához hozzájárulhat a kisdedek esetében, hogy főként nem adaptált tehéntejet fogyasztanak, aminek igen alacsony a vastartalma. Ezzel szemben a vassal dúsított, speciálisan a kisdedek számára összeállított tejhelyettesítő készítményekből 500 ml a napi vasszükséglet több mint felét fedezi.
Vitaminszükséglet
A vízben oldódó vitaminok (B-vitaminok, C-vitamin, biotin) különböző biokémiai enzimreakciók, köztük az RNS- és DNS-szintézis, valamint az energiatermelés kofaktoraiként vesznek részt a szervezet metabolizmusában. A zsírban oldódó vitaminok (A-, D-, E-és K-vitamin) olyan lipofil vegyületek, amelyek nem különböző enzimreakciók koenzimeiként játszanak szerepet, hanem a fehérjeszintézis szabályozásában vesznek részt. A vízben oldódó vitaminok felszívódása kevésbé függ a szervezet emésztő és felszívó működésétől, ugyanakkor a szervezetben nincs lehetőség ezeknek a vegyületeknek a raktározására. A vízben oldódó vitaminokból tehát a napi szükségletet a szervezetnek napról napra meg kell kapnia. A zsírban oldódó vitaminokat a szervezet képes a zsírszövetben elraktározni, ezért a tápláléknak nem feltétlenül kell ezeket a vegyületeket mindennap tartalmaznia. A kisdedek napi becsült vitaminigényét a 4. táblázatban foglaltuk össze.
4. táblázat
Kisdedek (1-3 év) napi vitaminszükséglete
| Vízben oldódó vitaminok | |
| Bi-vitamin (tiamin, mg) | 0,5-0,8 |
| B2-vitamin (riboflavin, mg) | 0,5-0,8 |
| B6-vitamin (piridoxin, mg) | 0,5-0,8 |
| Folsav (B11-vitamin, µg) | 100-150 |
| B12-vitamin (kobalamin, µg) | 0,8-1,2 |
| C-vitamin (aszkorbinsav, mg) | 50-75 |
| Biotin (µg) | i0-i5 |
| Zsírban oldódó vitaminok | |
| A-vitamin (retinol ekvivalens, µg) | 400-600 |
| D-vitamin (kalciferol, µg)1 | 10-15 |
| E-vitamin (RRR-a-tokoferol ekvivalens, mg) 6-9 | |
| K-vitamin (naftokinonok, µg) | 15-25 |
Napjainkban széles körben terjedő helytelen gyakorlat a kisgyermekkorban is adott multivitamin-kezelés. A vitaminok egy része túladagolva kifejezetten toxikus (pl. az A- vagy a D-vitamin), más részüknek nincs ugyan kimutatható toxicitása, de azok a szervezetből való eliminációja felesleges metabolikus terhelésnek tekintendő. A jól megválasztott vegyes étrend egyaránt tartalmazza a kisded fejlődéséhez szükséges vitaminokat.
Összefoglalás
A kisdedkori mennyiségi és minőségi táplálékigény áttekintése jól mutatja, hogy az 1-3 éves korosztályban a megfelelő étrend megtervezése nem is egyszerű feladat. Egyszerre kell elkerülni az ásványi anyagok, nyomelemek és vitaminok a szükségesnél kisebb beviteléből fakadó rövidtávú veszélyeket, valamint a szükségletet meghaladó energia- és fehérjebevitel hosszú távú kockázatait. A növekedés és fejlődés érzékeny szakaszában lévő kisdedek táplálását megkönnyítheti a speciálisan ennek a korosztálynak a táplálékigényét figyelembe vevő élelmiszerkészítmények az étrendbe történő beépítése.
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Butte M: Energy requirements of infants, children and adolescents. In: Koletzko B (ed.): Pediatric Nutrition in Practice. Basel, Karger, 2008, pp. 31-36.
2. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes: Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein and Amino Acids. Washington DC: National Academy Press, 2002.
3. Grote V, von Kries R, Closa-Monasterolo R, Scaglioni S, Gruszfeld D, Sengier A, Langhendries JP, Koletzko B; European Childhood Obesity Trial Study Group. Protein intake and growth in the first 24 months of life. J Pediatr Gastroenterol Nutr. 2010, 51 (Suppl 3), S117-8.
4. Prentice A, Branca F, Decsi T, Fleischer-Michaelsen K, Fletcher RJ, Guesry P, Manz F, Vidailhet M. Energy and nutrient dietary reference values for children in Europe: methodological approaches and current nutritional recommendations. Brit J Nutr 2004, 92 (Suppl2), S83-146.
5. Standing Committee on the Scientific Evaluation of Dietary Reference Intakes, Food and Nutrition Board, Institute of Medicine: Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D and Fluoride. Washington, DC, National Academy Press, 1997.
6. Panel on Micronutrients, Subcommittees on Upper Reference Levels of Nutrients and of Interpretation and Use of Dietary Reference Intakes, and the Standing Committee on the Scientific Evaluation of Dietary Reference Intakes, Food and Nutrition Board, Institute of Medicine: Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, DC, National Academy Press, 2001.
7. Butte N, Cobb K, Dwyer J, Graney L, Heird W, Rickard K. The start healthy feeding guidelines for infants and toddlers. J Am Diet Assoc 2004, 104, 442-454.
8. Baker RD, Greer FR; Committee on Nutrition American Academy of Pediatrics. Diagnosis and prvention of iron deficiency and iron-deficiency anemia in infants and young children (0-3 years of age). Pediatrics 2010, 126, 1040-50.
A szakmai irányelv érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai protokollja a tuberkulózis diagnosztikájáról és terápiájáról
(1. módosított változat)
Készítette: a Tüdőgyógyászati Szakmai Kollégium
I. Alapvető megfontolások
1. A protokoll alkalmazási/érvényességi területe
1.1. A protokoll témája a tuberkulózisdiagnosztikája és terápiája a járó- és fekvőbeteg-szakellátásban.
1.2. A protokoll célja az egységes gyakorlat kialakítása, figyelembe véve a témában meghatározó jelentőségű nemzetközi (WHO, IUATLD, Euro TB) és más külföldi szervezetek (CDC) ajánlásait és az érvényben lévő hazai rendelkezéseket.
1.3. A protokoll célcsoportjai (ellátottak és a protokollt alkalmazó ellátók köre, ellátási szint)
1.3.1.Ellátottak: tuberkulózisfertőzés és megbetegedés gyanúja, tuberkulózissal fertőzöttek, tuberkulózis betegségre veszélyeztetettek, tuberkulózis betegségben szenvedők.
1.3.2.A protokollt alkalmazó ellátók: pulmonológiai járóbeteg-ellátó intézmények (tüdőgondozók), pulmonológiai fekvőbeteg ellátó intézmények (kórházi és klinikai pulmonológiai osztályok), mikobakteriológiai laboratóriumok.
1.3.3.Ellátási szint: szakellátás.
2. Definíciók
A tuberkulózisban megbetegedésre gyanús és megbetegedett eseteket a következő szempontok szerint csoportosítják: a diagnózis megalapozottsága, a betegség szervi lokalizációja, korábban kezelték-e tuberkulózis miatt.
2. 1. A diagnózis megalapozottsága
2.1.1.(Tüdőjtuberkulózisra gyanús eset - akinél a klinikai és/vagy radiológiai tünetek felvetik tuberkulózis lehetőségét. Tuberkulózisra gyanúsnak kell azt a beteget tartani, akinek két héten túl elhúzódó légzőrendszeri tünetei vannak és/vagy mellkas-röntgenvizsgálattal változást (javulást vagy rosszabbodást) mutató kóros elváltozás látható, ami széles spektrumú antibiotikum kezelésre nem javul vagy nem tűnik el. Ezeket a betegeket haladéktalanul tüdőgyógyászati intézménybe kell irányítani a diagnózis tisztázásához (megerősítéséhez vagy kizárásához) szükséges vizsgálatok elvégzése céljából. Extrapulmonalis tuberkulózis gyanúja esetén a beteget megfelelő szakorvoshoz kell irányítani.
2.1.2.Tuberkulóziseset - akinek a köpetéből vagy más szövetnedvéből bakteriológiai vizsgálattal (tenyésztéssel) M. tuberculosist azonosítottak (igazolt tuberkulózis), vagy akinél az orvos klinikai vizsgálattal aktív tuberkulózis diagnózisát állapította meg, vagy akinél a tuberkulózis diagnózisát post mortem (sectióval) igazolták.
Minden olyan személyt, akinél a tuberkulózis diagnózisát állapították meg, kombinált antituberkulotikum-kezelésben kell részesíteni, illetve minden olyan személyt, akinél az orvos kombinált antituberkulotikum-kezelést tart szükségesnek, tuberkulózis megbetegedésnek kell tekinteni, és nyilvántartásba kell venni.
2.2. Latens tuberkulózisfertőzés - ebbe a csoportba tartoznak mindazok, akik Mycobacterium tuberkulózissal megfertőződtek, azonban a szervezetükben a tuberkulózis megbetegedés nem alakult ki. Ezeknek az egyéneknek fokozott a tuberkulózis megbetegedési kockázatuk, életük során átlagosan 10%-uknál alakul ki klinikai tuberkulózis. Ez a fokozott megbetegedési kockázat preventív antituberkulotikum kezeléssel csökkenthető. Korábban a latens tuberkulózis fertőzés kimutatására a tuberkulin bőrpróba alkalmazását javasolták. Ennek az eljárásnak azonban több olyan tulajdonsága van, amelyek korlátozzák alkalmazhatóságát. Ilyenek az alacsony specificitás (a lezajlott tuberkulózisfertőzés és a BCG-vakcináció vagy az atípusos Mycobacteriumok okozta reakció nem különíthető el biztonsággal), és a korlátozott szenzitivitás (csökkent celluláris immunitás vagy immunszuppresszív kezelés következtében az eredmény fertőzötteknél is negatív lehet), valamint az ún. booster hatás (néhány héten belül megismételt tuberkulinpróba esetén újabb Mycobacterium tuberculosis-fertőzés nélkül is nagyobb lehet az induratio átmérője, ami tévesen konverziónak tűnhet). Mindezek miatt a tuberkulinpróba a latens tuberkulózis fertőzés kimutatására csak korlátozottan használható. A közelmúltban leírt T-sejt-alapú in vitro interferon-gammateszt alkalmas a tuberkulózisfertőzés kimutatására. A M. tuberculosis genom által expresszált specifikus antigének hatására a T-sejtekből interferon-gamma szabadul fel. Mivel ezek az antigének hiányoznak a M. bovis BCG-ből és a legtöbb atípusos Mycobacteriumból, ezzel a módszerrel el lehet különíteni a M. tuberculosis, a BCG-oltás és az atípusos Mycobacteriumok okozta tuberkulinreakciót. A tuberkulinpróba és az interferon-gamma-teszt kombinálása okozhat interpretálási nehézséget. Az interferon-gamma-teszt ismétlése esetén nincs booster hatás. A módszer megbízhatóságát immunszupprimált betegeken is bizonyították. Az interferongamma- teszt alkalmazásának korlátot szab költségessége és eszközigényessége, de speciális helyzetekben szükséges az alkalmazása. A tuberkulinpróba eredményétől függetlenül fertőzöttnek kell tekinteni - és preventív kezelésben kell részesíteni - az igazolt (aktív) tbc-s betegek 5 évesnél fiatalabb vagy HIV pozitív vagy immunszupprimált kontaktjait.
2.3. Szervi lokalizáció
2.3.1.Tüdőtuberkulózis - a betegség a tüdő parenchymáját érinti (nem tartozik ide az intrathoracalis nyirokcsomó-tuberkulózis vagy a pleuritis tuberculosa, ha a tüdő parenchymája érintetlen).
2.3.2.Extrapulmonalis tuberkulózis - a betegség egyéb szervet érint.
A tuberkulózis leggyakoribb és epidemiológiai szempontból legfontosabb lokalizációja a tüdőtuberkulózis. A kombinált kórformájú betegeket, azaz akiknek pulmonalis és extrapulmonalis tuberkulózisuk is van, epidemiológiai szempontból tüdőtuberkulózisnak kell tekinteni.
2.4. Korábban nem kezelt és korábban kezelt betegek. Krónikus tuberkulózis
2.4.1.Korábban nem kezelt betegek - a beteg korábban nem részesült egy hónapnál hosszabb ideig antituberkulotikum-kezelésben (ezt a csoportot régebben első megbetegedésnek nevezték).
2.4.2.Korábban kezelt betegek - a beteg korábban egy hónapnál hosszabb ideig antituberkulotikum-kezelésben részesült, és betegségét gyógyultnak nyilvánították (recidíva, relapsus) (ezt a csoportot régebben ismételt megbetegedésnek nevezték). Ide tartoznak azok a betegek is, akiket korábban "eltűnt"-ként töröltek a nyilvántartásból.
2.4.3.Krónikus tuberkulózis - azokat a betegeket, akiket korábban bizonyított tuberkulózis miatt sikertelenül kezeltek (bakteriológiai vizsgálattal pozitívak maradtak vagy átmeneti negatívitás után ismét pozitív bakteriológiai vizsgálati eredményük volt), vagy akik a kezelést önkényesen vagy egyéb okból (pl. gyógyszer-intolerancia miatt) félbeszakították, nem "korábban kezelt betegnek", hanem krónikus tuberkulózisnak kell tekinteni.
2.4.4.Rezisztens, tuberkulózis:
- Monorezisztencia: rezisztencia egy alapszerre;
- Polilirezisztencia: rezisztencia két vagy több elsővonalbeli antituberkulotikumra, de nem INH+RMP-ra egyszerre;
- Multidrug rezisztencia (MDR): rezisztencia a legfontosabb két alapszerr (INH és RMP).
- Kiterjedten rezisztens TBC (XDR, Extensively): MDR + rezisztencia egy fluorokinolonra + egy parenterális másodikvonalbeli antituberkulotikumra (streptomycin, amikacin, kanamycin, capreomycin).
- Kiemelkedően rezisztens TBC (XXDR, Extremly): gyakorlatilag nincs adható gyógyszer.
3. A betegség/állapot leírása
A tuberkulózisfertőző betegség, amelynek kórokozója a Mycobacterium tuberculosis complex. A Mycobacterium tuberculosis complex tagjai (M. tuberculosis, M. africanum, M. bovis, M. bovis BCG, M. microti, M. canettii, M. caprae, M. pinnipedii) a Mycobacterium nemzetségen belül közeli rokonságban álló obligát patogén kórokozók. Tagjai különböznek egymástól a gazdaszervezet, a fertőzés eredete, a földrajzi elterjedés és a patogenitás tekintetében. A tüdőtuberkulózis legfontosabb terjedési módja a cseppinfekció. A fertőzés átvitelének valószínűségét befolyásolja a köpetben található életképes baktériumok száma, a kórokozó virulenciája, az expozíció időtartama, a helyiség szellőzése és a levegő páratartalma, hőmérséklete. A tbc-s betegeket potenciálisan fertőzőnek kell tekinteni. A fertőzés átviteléért, a betegség terjesztéséért legfőképpen azok a betegek felelősek, akiknek a köpetében mikroszkópos vizsgálattal ki lehet mutatni a kórokozót (mikroszkóposan saválló pálca pozitív betegek). A tuberkulózisfertőzés következményei meglehetősen széles változatosságot mutathatnak a teljesen tünetmentes állapottól (latens tuberkulózis) kezdve a fatális kimenetelű, gyorsan progrediáló megbetegedésig (miliaris tuberkulózis). Ez a változatosság azt jelzi, hogy a tuberkulózisban kialakuló immunválasz eredményezheti mind a fertőzés leküzdését, mind szöveti károsodás kialakulását.
3.1. Kockázati és kiváltó tényezők
A tuberkulózis kialakulásában eddig ismert legnagyobb kockázati tényező a HIV-fertőzés, mert számottevően növeli a primer megbetegedés és a reaktiváció előfordulását. A HIV-pozitív betegeknél a HIV-negatív betegekhez képest nagyobb arányban fordul elő az extrapulmonalis és a disszeminált forma (átlagosan 30, illetve 15%). Tuberkulózisra hajlamosító egyéb körülmények:
- friss (két éven belüli) fertőzés, különösen gyermekek esetében;
- alkohol-függőség;
- kábítószer-fogyasztás/-függőség;
- nem megfelelően kezelt tuberkulózis a kórelőzményben;
- diabetes mellitus, szilikózis, szervtranszplantáció utáni állapot, kortikoszteroid- vagy egyéb immunszuppresszív kezelés, a fej és a nyak karcinómás betegsége, hematológiai megbetegedések, zsugorvese, intestinalis bypass vagy gastrectomia utáni állapot, krónikus malabszorpciós szindróma, leromlott általános állapot.
A tuberkulózis kockázatát fokozó eddig felsorolt, az egészségi állapotot érintő tényezők mellett fokozott a tuberkulózis kockázata a lakosság bizonyos csoportjaiban is (szociális tényezők).
Az átlagnépességhez viszonyítva jelentősen gyakoribb a tuberkulózis a hajléktalanok, a szoros közösségben (szociális otthon). A gyulladásos ízületi betegség (rheumatoiő arthritis, arthritis psoriatica, spondylitis ankylopoetica és juvenilis idiopátiás arthritis) biológiai terápiájában (elsősorban TNF-alfa gátlás) részesült betegeknél latens tuberkulózis reaktivációját figyelték meg. Ennek a biológiai terápiák a természetes és az ellenanyag közvetítette immun védekezést gátolják. Elsősorban a TNF-alfa hiányában az immunrendszer nem képes féken tartani a perzisztáló, dormáns állapotban lévő tuberkulózis-kórokozókat. Ennek a veszélynek a kiküszöbölése céljából bármely biológiai terápia megkezdése előtt (vagy ha ez nem történt meg, úgy minél előbb) ki kell zárni aktív tuberkulózis lehetőségét, illetve a latens tuberkulózis fertőzés felderítésére tuberkulin bőrtesztet és/vagy interferongamma (IFN-gamma)-tesztet kell végezni (B evidencia). Aktív tuberkulózis gyógyulása előtt biológiai terápia nem kezdhető el. Korábban nem vagy nem megfelelően kezelt gyógyult tuberkulózis, illetve pozitív IFN-gamma- teszt esetén a biológiai terápiában részesülő személyeket profilaktikus antituberkulotikum kezelésben kell részesíteni (kilenc hónap INH vagy négy hónap RMP-monoterápia). A profilaktikus antituberkulotikus kezelést legalább egy hónappal a biológiai terápia megkezdése előtt kell elkezdeni. A biológiai terápiában részesült betegeknek - különösen a tuberkulózis egyéb fokozott kockázati tényezőjének megléte esetén (lásd fent), vagy azoknak, akik magas tuberkulózis prevalenciájú területen születtek vagy éltek tartósan - a kezelés befejezése után legalább két évig évente egy alkalommal tuberkulózis szempontjából ellenőrző vizsgálaton (mellkasröntgen, klinikai vizsgálat) kell részt venniük, figyelembe véve, hogy a biológiai terápia kapcsán az átlagosnál gyakrabban figyeltek meg extrapulmonalis tuberkulózist.
3.2. A tuberkulózis epidemiológiai helyzete Magyarországon
A megbetegedések száma az 1950-es évek eleje óta folyamatosan csökken, kivétel az 1990-1995 közötti időszak (1990: 34/100 000, 1995: 42/100 000).
A 2009-ben nyilvántartásba vett betegek száma 1448, ez 14,4/100 000 incidenciának felel meg.
A hazai tuberkulózishelyzet jellegzetességei:
- A megbetegedettek 95%-nak tüdőtuberkulózisa volt. Az extrapulmonalis eseteknél 54% pleuritis volt, 16% húgy-ivarszervi, 13% nyirokcsomó, 11% csont-ízületi. A legsúlyosabb kórformát jelentő meningitis tuberculosában hárman betegedtek meg.
- A 2009-ben nyilvántartásba vett betegek kétharmada férfi, egyharmaduk nő volt.
- A megbetegedések kormegoszlására jellemző, hogy a kötelező újszülöttkori BCG oltás 1953-ban történt bevezetése óta a gyermekkori tuberkulózis sporadikus betegség lett, 2009-ben 14 éves kor alatt ötten betegedtek meg. A férfiak és a nők körében is az 50 és 59 éves kor között legtöbb a megbetegedések száma, majd idősebb korban csökken.
- A megbetegedések gyakoriságában az ország egyes területei között jelentős különbségek vannak, továbbra is az ország északkeleti részén a legmagasabb az incidencia, Borsod és Szabolcs megyékben, meghaladja a 25/100 000.
- A 2009-ben ismételten nyilvántartásba vett betegek aránya 15%. Nyugat-Európában ez 10% alatt van.
3.3. Panaszok/tünetek/általános jellemzők
Tüdőtuberkulózisban a tünetek nem jellegzetesek. Gyakori a tünetmentesség, amikor a betegséget szűrővizsgálattal vagy egyéb okból végzett vizsgálat alkalmával véletlen mellékleletként ismerik fel. Leggyakoribb tünet a köhögés, amely lehet száraz vagy produktív. Jelentkezhet pleuralis fájdalom, subfebrilitas, éjszakai izzadás, fogyás. A nehézlégzés csak előrehaladott állapotban vagy spontán légmell esetén jelentkezik. A vérköpést régebben leggyakrabban tuberkulózis okozta, ma elsősorban daganat gyanúját veti fel.
3.4. Érintett szervrendszer(ek)
A leggyakoribb szervi lokalizáció a tüdő, az egyéb érintett szervek: pleura, mellkasi és perifériás nyirokcsomók, gége, gerinc, egyéb csontok-ízületek, húgy-ivari szervek, bőr, szem, központi idegrendszer, gastrointestinalis rendszer.
3.5. Gyakori társbetegségek
A leggyakoribb társbetegségek: alkoholfüggőség (18,5%) és diabetes mellitus (3,4%).
4. Az ellátási folyamat leírása, ellátási algoritmus
Tuberkulózis gyanúja esetén a beteget a lakhely szerint illetékes tüdőgondozóba kell irányítani, vagy pulmonológiai fekvőbeteg osztályra kell áthelyezni a diagnózis megerősítése vagy kizárása céljából. A tuberkulózisban szenvedő beteg gondozása (kezelés, ellenőrző vizsgálatok) és környezetének ellátása a tüdőgondozó feladata.
Mikroszkópos vizsgálattal pozitív beteg kezelését kórházi pulmonológiai osztályon kell végezni, amíg a köpet negatívvá válik.
II. Diagnosztikai eljárások
A tuberkulózis diagnosztikája során az anamnézis, a fizikális vizsgálat, a képalkotó eljárások, a tuberkulin tesztek természetesen nélkülözhetetlen lépések, azonban a definitív diagnózist a kórokozó kimutatására szolgáló a mycobacteriológiai vizsgálatok adják.
1. Anamnézis, tünetek, fizikális és általános laboratóriumi vizsgálatok
Az anamnézis csakúgy, mint a mycobacteriológiai vizsgálatokat leszámítva bármely diagnosztikai eljárás, nem specifikus tuberkulózisra. A környezetben előforduló betegség vagy a tuberkulózis fertőzés fokozott kockázatával járó kórképek, életkörülmények azonban fel kell, hogy hívják a figyelmet a kivizsgálás szükségességére. A tünetek szintén nem típusosak, kezdetben nem is feltétlenül a tuberkulózis az első felmerülő diagnózis. Ilyen lehet a köhögés, köpetürítés, haemoptoe, nehézlégzés, mellkasi fájdalom, hőemelkedés, láz, étvágytalanság, fogyás, fáradékonyság, éjszakai izzadékonyság. A fizikális vizsgálattal ennek megfelelően nem lehet specifikus eltérést észlelni. Általános laboratóriumi vizsgálattal ugyancsak aspecifikus eredmények igazolódhatnak, mint a gyorsult süllyedés, emelkedett C-reaktív protein, leukocytosis, anaemia. A biopszia során nyert anyag szövettani vizsgálata mindezekkel ellentétben komoly segítséget jelenthet az elváltozás pontos meghatározásában.
2. Mellkas átnézeti röntgenfelvétel, komputertomográfia
Tüdőtuberkulózis gyanúja esetén PA sugárirányú mellkas röntgenfelvételt kell készíteni. CT készítése rutinszerűen nem indokolt, erre leginkább differenciáldiagnosztikai célból lehet szükség.
Tüdőtuberkulózis vonatkozásában a mellkas röntgenvizsgálata magas érzékenységű, de alacsony specificitású eljárás. A mellkas röntgen elvétel a diagnózis felállítását követően a betegség aktivitásának monitorozásában nélkülözhetetlen eljárás.
3. Tuberkulin bőrpróba
5 TE PPD i.c. az alkar hajlító oldalának felső és középső harmada határán. Értékelés 72 óra múlva a tapintható indurációnak az alkar hossztengelyére merőleges átmérője, mm-ben. BCG oltásban nem részesült személy esetében a 6 mm-nél nagyobb átmérőjű indurációt tekintik fertőzés okozta reakciónak. BCG oltott személyeken ez a határ 15 mm. Az ezeknél kisebb átmérőjű (<6 mm illetve <15 mm) tuberkulin reakció nem zárja ki a M. tuberculosis-sal történt fertőződést, mint ahogyan álpozitív eredmény is előfordulhat.
4. Interferon-gamma tesztek
A tesztek a betegből izolált T-sejtek interferon-gamma felszabadító képességét mérik M. tuberculosis-specifikus antigénekkel történő stimulációt követően. A tuberkulin bőrpróbához képest előnyt jelent a magasabb érzékenysége és specificitása, Mivel ezek az antigének hiányoznak a M. bovis BCG-ből és a legtöbb atípusos mycobacteriumból, ezzel a módszerrel el lehet különíteni a M. tuberculosis, a BCG oltás és az atípusos mycobacteriumok okozta tuberkulin reakciót. Az interferon-gamma teszt ismétlése esetén ugyan nincs booster hatás, de az előzetesen végzett tuberkulin próba fokozhatja a gamma-interferon kiválasztást, ami tévesen "konverziónak" tartható. A módszer megbízhatóságát immunszuprimált betegeken is bizonyították, ugyanakkor immunszuppresszív kezelések valamint az immunrendszer működését károsító megbetegedések potenciálisan csökkenthetik az interferon-gamma termelést. Ha a vérvétel a sejtes immunválasz kialakulása előtt történt meg, akkor álnegatív eredményt kaphatunk. Ugyancsak álnegatív eredményt adhat a vérvételi csövek helytelen kezelése. Azt is figyelembe kell venni, hogy a M. kansasii, M. szulgai és M. marinum fertőzésekben is pozitív eredményt ad a teszt. Az interferon-gamma teszt alkalmazásának korlátot szab költségessége és eszközigényessége, emellett Magyarországon kellő tapasztalatok nem állnak rendelkezésre a klinikai értékelésében, de speciális helyzetekben szükség lehet elvégzésére.
5. Mycobacteriológiai vizsgálatok
A tuberkulózis diagnózisának felállításához vagy megerősítéséhez valamint az elért gyógyeredmény igazolásához elsősorban a M. tuberculosis kimutatását célzó vizsgálatokat kell végezni, az egyéb, előbbiekben említésre került beavatkozások mellett. A tuberkulózis diagnózisa csak akkor tekinthető bizonyítottnak, ha a M. tuberculosis-t a beteg testnedveiből (köpet, pleuralis folyadék, vizelet, hörgőmosó folyadék, stb.) sikerült tenyésztéssel vagy azzal egyenértékű vizsgálattal kimutatni. A beteg akkor tekinthető gyógyultnak, ha a kezelés alatt illetve annak befejezése után megfelelő számú (legalább 2x3) negatív tenyésztési lelettel igazolták, hogy a beteg nem ürít baktériumot.
A tuberkulózis mikrobiológiai diagnosztikáját illetően az Orvosi Mikrobiológiai Szakmai Kollégium irányelveit tartjuk mérvadónak.
5.1. Laboratóriumi vizsgálatok
5.1.1. Bakteriológiai vizsgálatok - mikroszkópos vizsgálat és tenyésztés
5.1.1.1. A bakteriológiai vizsgálatokra történő helyes mintavétel, mintatovábbítás, tárolás
A tuberkulózis és az egyéb mycobacteriális fertőzések megbízható, pontos és gyors mikrobiológiai diagnosztikájának alapja a megfelelő mennyiségű, minőségű, és kellő számú minta továbbítása a laboratórium számára. Az inadekvát mintavételből fakadó problémákat a legmodernebb molekuláris biológia módszerek sem képesek kiküszöbölni. Nagyon fontos, hogy a minták késedelem nélkül és minél gyorsabban megérkezzenek a laboratóriumba, mivel egyes vizsgálatok átfutási idejét (pl. mikroszkópia és direkt nukleinsav amplifikáció 24 órán belül) és minőségét (tenyészetek befertőződése) jelentősen befolyásolhatja, ha a mintát a laboratórium a mintavételt követő 24-48 órán belül nem kapja kézhez.
Mycobacteriológiai vizsgálatra alkalmatlan a nyálköpet, a gyűjtött köpet, a tamponnal vett garat és sebváladék. A reggeli, ébredés utáni köpet begyűjtésére kell törekedni. Mintavétel céljából a fertőzés veszélyének kiküszöbölésére, egy erre a célra elkülönített, jól szellőztethető helységet kell használni. A beteg kb. 3-4 alkalommal vegyen mély lélegzetet és minden lélegzetvétel végén tartsa vissza a lélegzetét néhány másodpercig, majd az utolsó légvételt követően köhögjön. A felköhögött köpetet ürítse az erre a célra rendszeresített steril edénybe. A legmegfelelőbb a 30-50 ml-es steril, milliliteres beosztású, kónuszos, csavaros kupakos műanyag centrifugacső. Optimális esetben a köpet 5-10 ml térfogatú. A mintavételt követően, a következő mintavétel előtt, a helyiséget alaposan ki kell szellőztetni és saját biztonságunk érdekében is legalább 10 percre UV lámpát is kapcsoljunk be. Ügyelni kell a mintavételi csövek megfelelő címkézésére a kellő azonosíthatóság érdekében. A mintavétel mindig a nővér felügyelete mellett történjen a betegek közötti esetleges mintacsere elkerülése céljából. A mintavételi edények 1-2 órán át szobahőn, nagyobb nyári meleg esetén vagy 24-72 órára 2-8°C-n hűtőben tárolandók. Amennyiben a laboratórium nem házon belül van, akkor a centrifugacsöveket jól zárható fémtartályokba, majd ezeket papírdobozba csomagolva a megfelelő kísérő papírokkal ellátva kell továbbítani a laboratórium részére. Egyebekben a "121/ 2000 Postaügyi értesítő 32. Fertőző anyagok kezelése" című utasítása a mérvadó. A kísérőlap feltétlenül tartalmazza a beteg adatai mellett, hogy a kért vizsgálat célja a diagnózis megállapitása/megerősítése, illetve a kezelés eredményességének ellenőrzése. Fel kell tüntetni azt is, hogy korábban tuberkulózis miatt nem kezelt vagy tuberkulózis miatt már korábban is kezelt betegtől származik-e a vizsgálatra küldött minta. Ha ismert, azokat az antituberkulotikumokat (legfőképpen a rifampicin vonatkozásában) is fel kell sorolni, amelyekre a beteg korábbi vizsgálatok során rezisztens volt. Utóbbi információk kiemelten fontosak a rezisztencia vizsgálatok indítása és értékelése szempontjából, mind a laboratórium, mind a klinikus számára. Minden újonnan felismert esetből ugyanis kötelezően rezisztencia vizsgálatot kell végeztetni, amennyiben azonban a fent jelzett információk nem állnak rendelkezésre a kérőlapon, úgy a laboratórium képtelen lesz azonosítani a kötelezően elvégzendő vizsgálatok mintáit.
Amennyiben a beteg alkalmatlan értékelhető köpet adására úgy meg lehet kísérelni hypertóniás (5-10%) sóoldattal való inhaláltatást követően ú.n. indukált köpet gyűjtését, illetve ébredés utáni, még az ágyban levett éhgyomori gyomorbennék aspirátum (és nem mosás) nyerését. Négy órát meghaladó tárolás esetén a gyomorsav mycobacteriumokat is elölő hatását 100 mg steril szódabikarbona segítségével semlegesíthetjük.
A köpeten kívül a leggyakrabban beküldésre került minták a következők: bronchusmosó folyadék, bronchoalveoláris lavage, pleurális, pericardiális vagy ascites folyadék (steril edényben, utóbbi három esetében 0,2 mg/ml heparin hozzáadásával vagy közvetlenül folyékony táptalajra oltva), vizelet (> 40 ml, reggeli középsugaras vagy katéteres, nem gyűjtött, nem katéter zsákból, kellő genitális toalettet követően), széklet (> 1 g), liquor (>2-5 ml), seb vagy steril fecskendőbe felszivott tályogváladék, menstruációs folyadék, biopszia (nem formalinba ágyazott, csak fiziológiás sóoldatban). Vér kizárólag erre a célra rendszeresített speciális mycobacterium hemokultúra táptalajokban tenyészthető (pl.: Bactec 13A táptalaj). A ritkábban előforduló minták esetében a mintavétel előtt érdemes a laboratórium tanácsát kérni a mintavételi, tárolási és szállítási előírásokat illetően.
A mikroszkópos vizsgálatokat minden alkalommal három különböző alkalommal levett mintából, a tenyésztéseket öt különböző alkalomal levett mintából kell végezni.
5.1.1.2. Mikroszkópos köpetvizsgálat saválló baktérium kimutatására
A mikroszkópia a mycobacteriológiai vizsgálatok legolcsóbb, legegyszerűbben kivitelezhető és leggyorsabb módszere. Kenetkészítést követően a festés leggyakrabban Ziehl-Neelsen (ZN) féle karbol-fukszin alapú, vagy ritkábban auramin alapú fluoreszcein eljárásokkal történhet. A ZN-festést követően a Mycobacteriumok vörös pálcákként észlelhetők a kék háttér kontrasztja mellett. Az auramin festést követően a Mycobacteriumok sárgászölden fluoreszkálnak fekete háttér mellett. Bár a fluoreszceinmikroszkópia során egy-egy kenet áttekintése gyorsabb, ugyanakkor a ZN-vizsgálathoz képest nagyobb gyakorlatot igényel, az álpozitív lelet lehetősége ugyanis sokkal gyakoribb ilyenkor, továbbá minden újonnan felismerésre került beteg esetén a fluoreszceinmikroszkópos pozitivitást ZN-vizsgálattal meg kell erősíteni. A mikroszkópia legnagyobb hátránya, hogy nem kellően érzékeny, és időigényes. Bár a pozitív eredmény a tuberkulózis preszumptív diagnózisa mellett szól, a negatív lelet az alacsony érzékenységi mutató miatt nem zárja ki a tuberkulózis lehetőségét. Mindemellet azt is figyelembe kell venni, hogy a mikroszkópia nem képes különbséget tenni élő és élettelen Mycobacterium között, csakúgy mint a M. tuberculosis complex és a nem tuberkulózist okozó Mycobacteriumok között.
5.1.1.3.Direkt nukleinsav-amplifikációs módszerek
A direkt nukleinsav-amplifikációs módszereknek (DNAM) a mycobacteriológiában való alkalmazása a lassan tenyészthető M. tuberculosis és a bizonyos speciális tenyésztési feltételeket igénylő, ezért nehezen izolálható NTM-ek direkt (közvetlenül a klinikai mintából történő) kimutatásának gyors, 24 órán belüli kimutathatóságának lehetőségét teremtette meg. A DNAM elméletileg akár egyetlen Mycobacterium DNS-tartalmát is képes egy anzimatikus reakció segítségével, néhány órán belül több milliószorosára, azaz immár kimutatható mennyiségűvé sokszorozni. A jelenleg rutinszerűen alkalmazott kereskedelmi tesztek alapvetően a M. tuberculosis complex légúti mintákból való kimutatását célozzák meg, de M. avium kimutatására alkalmas eljárás is forgalomban van. Klinikai felmérések azt mutatták, hogy mikroszkóposan pozitív minta esetén a DNAM érzékenysége gyakorlatilag 100%, azonban csak tenyésztéssel pozitív, de mikroszkóposan negatív esetben 60-80% közötti az eljárások szenzitivitása. Ezen adatok jelentősége a kivizsgálás során abban nyilvánul meg, hogy a negatív mikroszkópia és DNAM vizsgálat nem zárja ki a tuberkulózis lehetőségét.
5.1.1.4. Tenyésztés
A mycobacteriológiai vizsgálatok közül a dekontaminált minta tenyésztése továbbra is nélkülözhetetlen, melynek okai a következők: 1.) a tenyésztés érzékenysége nagyságrendekkel nagyonn, mint a mikroszkópiáé, 2.) a M. tuberculosis complexen belüli differenciáláshoz, a különböző NTM azonosításához, a molekuláris epidemiológiai vizsgálatok elvégzéséhez (DNS-ujjlenyomatvizsgálat) kellő nagyságú biomasszára van szükség, amelyet a tenyésztés biztosít, 3.) a rezisztenciavizsgálatok elvégzéséhez élő kórokozót ugyancska a tenyésztés biztosít. A leggyakrabban használt szilárd táptalaj a tojás alapú Löwenstein-Jensen (LJ) táptalaj. Agar alapú táptalajok terjedtek még el, melyeken a LJ-hez képest némileg gyorsabb a tenyésztési idő és a transzparenciájuk folytán egyszerűbb a kolóniamorfológiai-vizsgálat lehetősége miatt kedveltek. Ezen szilárd táptalajokon történő tenyésztések esetén a kórokozó telepei ritkán jelennek meg 5-6 hétnél korábban és a leolvasást 8 hét elteltével lehet lezárni. Emellett bár a tenyésztés érzékenysége jobb, mint a mikroszkópiáé, de nem haladja meg a 70-80%-ot. Ha figyelembe vesszük, hogy a Center for Disease Control and Precention ajánlása szerint a tbc izolálása, identifikálása, valamint az ezt követő rezisztenciavizsgálatok lehetőleg a mintavétel időpontjától számított 2-3 (izolálás, identifikálás), illetve 2-5 (rezisztenciameghatározás) héten belül történjenek meg, akkor a szilárd táptalaj alapú tenyésztés ideje már önmagában meghiúsítja ezt. Ugyanakkor ez az átfutási idő nélkülözhetetlen ahhoz, hogy a klinikus a kezelés nyolcadik hetének végén el tudja dönteni, hogy az alkalmazott négyes kombinációból biztonsággal elhagyhatja-e a pyrazinamidot és az ethambutolt. Ahhoz, hogy ez az ajánlás a gyakorlatban is megvalósítható legyen, nélkülözhetetlen az újabb, folyákony táptalaj alapú rendszerek rutinszerű alkalmazása. Folyákony táptalajon tenyésztve a tenyésztési idő a minta Mycobacterium tartalmától függően 1-3 hétre rövidíthető. Emellett a folyékony táptalajok szenzitivitása 90% feletti. Hátrányuk, hogy jóval hajlamosabbak a befertőződésre. Tekintettel arra, hogy bizonyos törzsek nem növekednek jól folyékony táptalajban, szilárd táptalaj alapú tenyésztésekre továbbra is szükség van. A szilárd táptalaj további előnye, hogy a növekedés kvantitatív formában is visszajelenthető, a kolóniamorfológia és a pigment-termelés is vizsgálható, illetve kellő biomassza biztosítható az identifikálást segítő biokémiai tesztekhez. Mindezek alapján jelenleg a Mycobacteriumok izolálása szilárd és folyékony táptalaj kombinációján kell hogy alapuljon.
5.1.1.5.Identifikálás
A különböző Mycobacterium-fajok egymástól való identifikálásának hagyományos útját a különböző hőmérsékleti szinteken mutatott növekedési sajátosságok, a telepmorfológia és pigment-termelés vizsgálata, valamint különböző enzimaktivitás vagy növekedésgátlás kimutatását célzó biokémiai reakciók elvégzése jelenti. Ezeknek a hagyományos identifikálási teszteknek a legnagyobb hátránya, hogy elvégzésük jelentős mennyiségű biomasszát igényel, amely szubkulturákra való átoltással és a primer izolálást követően még további többhetes tenyésztéssel és időveszteséggel jár.. Emellett a vizsgálatok elvégzése munkaigényes, az eredmények értékelése sok esetben szubjektív, továbbá leírásra kerültek olyan NTM törzsek, amelyek identifikálása a hagyományos módszerek segítségével egyáltalán nem lehetséges. Mindezen okok miatt új molekuláris biológiai módszerek terjedtek el világszerte, a hagyományos identifikálási metodikák pedig jelentős mértékben visszaszorulóban vannak.
5.1.1.5.1.Nukleinsav hibridizációs módszer
A kereskedelmi forgalomban hozzáférhető AccuProbe nukleinsav-hibridizációs teszt nem tartalmaz amplifikációs lépést, így közvetlenül a klinikai mintából való kórokozó kimutatásra alkalmatlan, azonban kiváló pozitív tenyészetek esetén az 1-2 órán belüli identifikálásra M. tuberculosis complex, M. avium complex, a M. gordonae és a M. kansasii esetén.
5.1.1.5.2.PCR és restrikciós fragmenthosssz-polimorfizmus-analízis (RFLP)
A PRA legelterjedtebb formája a hsp65 gén PCR segítségével történő amplifikációján, enzimes emésztésén majd gélelektroforézis elvégzésén alapszik. A módszer gyors, olcsó és az amplifikációs lépés miatt nem igényel bőséges növekedést mutató tenyészetet. Problémát jelenthet az ún intraspecies genetikai variabilitás, melynek köszönhetően egyes fajok ritka variánsai tévesen új fajként kerülhetnek regisztrálásra. Emiatt az elmúlt években 16S-23S DNS spacer régión, illetve az rpoB génen alapuló módszerek kerültek bevezetésre. Ugyancsak a 16S-23S DNS spacer régió vizsgálatán alapszik az Inno-Lipa Mycobacterium teszt, mely a M. tuberculosis complex, a M. avium, a M. intracellulare, a M. kansasii, a M. xenopi, a M. gordonae, a M. scrofulaceum és a M. chleonae identifikálására alkalmas.
5.1.1.5.3.DNS szekveálás
A DNS szekvenálás a Mycobacteriumok identifikálásának jelenleg a leggyorsabb és legpontosabb módszere. Az ehhez szükséges referenciabázissorrend adatbázis összeállítása történhet a helyi laboratóriumban, de kereskedelmi forgalomból is beszerezhető. Automata DNS szekvenáló műszer segítségével a vizsgálat 1-3 nap alatt elvégezhető. Az eredményeket azonban figyelmesen kell kezelni, mivel az értékeléshez használt egyes kereskedelmi vagy más közforgalom számára hozzáférhető szekvencia adatbázisok némelyike hibás bázissorrendet tartalmazhat, vagy számos faj szekvenciasorrendje nem található meg ezekben a rendszerekben. Ennek a problémának az orvoslására hozták létre az ún Ribosomal Differentiatio of Medical Microorganism rendszert, amely a 16S rRNS mycobacterium szekvenciák minőség ellenőrzött és ingyenes hozzáférését biztosítja.
5.1.1.6.A M. tuberculosis és a NTM genotipizálása, molekuláris epidemiológiai vizsgáló módszerek
A DNS-ujjlenyomat vizsgálat és a PCR alapú spoligotyping bevezetésével a MTB nagy pontosságú tipizálására nyílt lehetőség, aminek köszönhetően az epidemiológiai vizsgálatokban is kiválóan alkalmazhatóvá váltak ezek a módszerek. A DNS ujjlenyomatvizsgálatot sikeresen alkalmazták különböző járványok vizsgálatára, a tuberkulózis aktív transzmisszióját befolyásoló rizikótényezők vizsgálatára, a konvencionális módszerekkel azonosíthatatlan kontaktok kiszűrésére és ezáltal a fertőzési lánc felderítésére, különböző veszélyeztetett szubpopulációkon belül a tuberkulózis transzmissziójának vizsgálatára, és a laboratóriumi keresztfertőzések okozta téves diagnózisok kiszűrésére. RFLP alapú DNS ujjlenyomat vizsgálatot sikeresen alkalmaztak NTM esetében is, így a M. avium complex, M. kansasii, M. celatum, M. chelonae, M. xenopi, M. abscessus és a M. malmoense okozta megbetegedések molekuláris epidemiológiája is vizsgálható.
5.1.1.7.A rezisztencia meghatározása
Az eddigi genetikai vizsgálatok szerint a M. tuberculosis antituberkulotikumokkal szembeni rezisztenciájának kialakulásában vagy a gyógyszer támadáspontját kódoló génekben, vagy a gyógyszer aktiválásáért felelős enzimeket kódoló génekben kialakuló spontán pontmutációk a felelősek. A nemzeti tuberkulózisprogram szabályozásának megfelelően minden újonnan felismerésre került tuberkulózisban szenvedő beteg elsőként izolált tenyészeteiből kötelezően rezisztenciavizsgálatokat kell végezni. Ellenőrző rezisztencivizsgálatok végzése akkor szükséges, ha a beteg kontrolltenyésztései a kezelés negyedik hónapja után is pozitivitást mutatnak, illetve ha radiológiai romlás vagy reaktiváció jelei észlelhetők.
A hagyományos, szilárd táptalajon végzett rezisztenciameghatározás pontos, de idő (további 3-5 hetes tenyésztés) és munkaigényes. A vizsgált biomasszaigénye miatt gyakran szükség van az identifikált kórokozó LJ vagy egyéb szubkulturán történő felszaporítására, vagy ha a M. tuberculosis NTM-el együtt ún. kevert tenyészet formájában került izolálásra, akkor a tenyészetnek az álrezisztenciához vezető NTM-től való megtisztítására, ami újabb többhetes időveszteséget okozhat. A BACTEC MGIT, a radiometriás Bactec 460 TB, vagy a Bact/Alert rendszer segítségével az öt első vonalbeli antituberkulótikumon kívül a másodrendű szerek többségével szembeni rezisztenciavizsgálatok kb. 4-6 nap alatt elvégezhetőek és a klinikus számára visszajelezhetők. Minden rezisztens esetben elengedhetetlen, hogy a vizsgálat eredménye vagy egy másik módszerrel, vagy ugyanazon módszerrel, de egy másik laboratóriumban megerősítésre kerüljön.
Fontos lépés volt annak felismerése, hogy a rifampycin monorezisztencia rendkívül ritka, és leggyakrabban polirezisztencia, vagy isoniciddel társulva multidrog rezisztens tuberkulózsi formájában jelentkezik. Így a rifampycin rezisztencia gyors kimutatása nemcsak a kezelés optimalizálása szempontjából, hanem a legveszélyeztetettebb MDR-betegek gyors azonosítása szempontjából is fontos. Ebben nyújtott komoly előrelépést, amikor a rifampycin rezisztencia gyors kimutatására alkalmas Inno-
LiPA Rif TB teszt kereskedelmi forgalomba került. A másodvonalbeli antituberkulótikumokra minden olyan esetben el kell végezni a vizsgálatot, ahol isonicid és rifampycin rezisztencia igazolódott.
III. Kezelés
III/1. Gyógyszeres kezelés
1.1. Gyógyszeres terápia részletes algoritmusa
(ellátási szintek megjelölésével)
Latens tuberkulózis (bizonyított vagy gyanú): ellátási szint tüdőgondozó; profilaktikus gyógyszeres kezelés; Tuberkulózis megbetegedés: ellátási szint pulmonológiai osztály és/vagy tüdőgondozó;
- korábban nem kezelt és korábban kezelt esetek: kombinált kezelése standard antituberkulotikumokkal, szükség esetén a kombináció módosítása a gyógyszerérzékenységi vizsgálat eredménye alapján;
- krónikus tuberkulózis: kombinált kezelés a gyógyszer-érzékenységi vizsgálat eredménye alapján;
2.1. Ajánlott gyógyszeres kezelés
2.1.1.A kezelés alapelvei
A tuberkulózis gyógyítható megbetegedés. A gyógyulás alapját a megfelelő kombinációban, megfelelő dózisban és kellő ideig alkalmazott gyógyszeres kezelés jelenti. A tuberkulózis kezelésének célja:
1. a gyorsan osztódó kórokozók elölése, a beteg meggyógyítása;
2. a fertőzési lánc megszakítása;
3. a szerzett antituberkulotikum-rezisztencia kialakulásának megakadályozása;
4. a fertőzött szövetek ún. sterilizálása a csak időszakosan anyagcserét folytató kórokozóktól, amelyek a betegség reaktivációjához vezethetnek.
A kezelés két szakaszra oszlik:
A kezelés első két hónapja az ún. kezdeti, intenzív szakasz, ennek célja az aktívan metabolizáló kórokozók elölése.
Az utókezelési szakasz (további 4-7 hónap) célja a szövetek sterilizálása, az alig metabilizáló szemidormáns kórokozók
elpusztítása. (az utókezelési szakasz után még életben maradt kórokozókból kiindulva a megbetegedés bármikor újra kiújulhat).
2.1.2.Ellenőrzött gyógyszerbevételi program (directly observed therapy, DOT)
A tuberkulózis gyógyulása időigényes folyamat, amely a beteg és a kezelést végző személyzet türelmét és szoros együttműködését igényli. A javasolttól eltérő, rendszertelen, a szükségesnél rövidebb ideig tartó és nem az előírt gyógyszereket alkalmazó kezelés a gyógyulás elmaradását, a betegség krónikussá válását, a betegség terjedését és gyógyszerrezisztens törzsek kialakulását eredményezi. Mindezeknek a kiküszöbölésére a tuberkulózis kezelését a WHO ajánlása szerint ún. ellenőrzött gyógyszerbevételi (directly observed therapy, DOT) program keretében kell végezni - azaz a betegnek minden gyógyszeradagját egészségügyi dolgozó (esetleg megbízható családtag) jelenlétében, annak közvetlen ellenőrzése alatt kell bevennie és ezt minden esetben, dokumentálni kell.
2.2. Antituberkulotikumok (1. táblázat)
2.2.1. Isoniazid
Adagolás
Felnőttek esetében javasolt adagolása 5 mg/kg (max. 300 mg) naponta, vagy 15 mg/kg (max. 900 mg) a heti kétszeri vagy háromszori intermittáló kezelés esetén. Szintén emelt dózisú napi 15-20 mg/kg adagolása javasolt alacsony fokú INH rezisztencia esetén.
Gyermekeknél javasolt adagolása napi 10-15 mg/kg (max. 300 mg), illetve hetente kétszeri intermittáló kezelésnél 20-30 mg/kg (max. 900mg).
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
Az egyik leggyakoribb mellékhatás, amely az INH szedése mellett jelentkezhet, a hepatotoxicitás. Nem jelent problémát a májenzimeknek a normál értékek ötszöröséig való emelkedése, ha a beteg tünetmentes. Ekkor rendszeres (havonkénti), vagy tünetek jelentkezése esetén történő májenzimkontroll javasolt. Ha azonban az értékek magasabbak, mint a normál érték ötszöröse, vagy az értékek magasabbak, mint a normálérték háromszorosa, de a betegnek már kapcsolódó tünetei is vannak,
akkor a kezelést azonnal fel kell függeszteni a többi hepatotoxicitást okozható antituberkulotikummal együtt (RMP, PZA). A kezelést három másik, nem hepatotoxikus szerrel kell folytatni mindaddig, míg a májkárosodás oka (gyógyszer mellékhatás, hepatitis-vírusinfekció etc.) nem tisztázódik.
Abban az esetben, ha a beteg májbetegségben szenved már a kezelés megkezdése előtt, a gyógyszer indukálta hepatitis veszélye nagyobb, és mivel a beteg májfunkciós tartaléka már eleve kisebb, könnyen életveszélyes állapot alakulhat ki. Emellett a már emelkedett májfunkciós értékek miatt a gyógyszer indukálta hepatitis felismerése vagy monitorozása is sokkal nehezebb. Ilyen helyzetben mindig hepatológiai konzílium szükséges, és lehetőleg olyan kombináció alkalmazása, amelyben csak egy hepatotoxikus szer van, vagy egy sincsen. Ha mód van rá, elsősorban az RMP megtartására kell törekedni. Kevésbé gyakori mellékhatás a perifériás neurotoxicitás, amely elsősorban alkoholfüggő, alultáplált, diabéteszes vagy HIV-fertőzött betegek esetében, vagy terhes és szoptató nőknél fordulhat elő. Ez esetben a kezelés napi 25 mg/kg piridoxin- (B6-vitamin-) pótlással történik. Ritkán előfordul vérképző rendszeri mellékhatás (agranulocytosis, hemolitikus- és aplasticus anaemia), központi idegrendszeri mellékhatás (dysarthria, dysphoria, görcsrohamok, psychosis), illetve túlérzékenységi reakciók (láz, vasculitis, lupusszerű szindróma). Az INH a terhesség és szoptatás alatt adható. A központi idegrendszeri penetráció kiváló, a szérumszinttel megegyező koncentráció mérhető a liquorban. Veseelégtelenségben és dialízist igénylő végstádiumú vesebetegségben is dózismódosítás nélkül adagolható. Az INH gátolja a fenitoin és a carbamazepin metabolizációját, amely esetlegesen a jelzett két antikonvulzív szer túladagolásos toxicitásához vezethet. Emellett az INH fokozhatja az acenokumarol/ warfarin antikoaguláns aktivitását. A HIV-fertőzés kezelésére alkalmazott antiretrovirális készítményekkel kapcsolatos interakció nem ismeretes. Az INH felezési idejét emeli a PAS, a procainamid és a klórpromazin, míg csökkenti az alkohol.
2.2.2. Rifampicin
A rifampicin (RMP) a rifamycin családba tartozó rifamycin B széles spektrumú, szemiszintetikus származéka. A tuberkulózis kezelésére 1966 óta alkalmazzák.
Hatásmechanizmus és rezisztencia
Az RMP az INH mellett a leghatékonyabb és a legfontosabb szer a tuberkulózis gyógyításában. Amellett, hogy az RMP-nek kifejezett korai baktericid hatása van a metabolikusan aktív M. tuberculosisra (mind extra-, mind intracellulárisan), ugyancsak kiváló az időszakosan rövid időre metabolikusan aktiválódó szemidormáns baktériumokon kifejtett ún. hosszan tartó, késői sterilizáló hatása is, elsősorban a nem savanyú közegben perzisztáló kórokozók esetében. Az RMP e késői hatásának felismerése, továbbá a pyrazinamid alkalmazása együttesen járult hozzá, hogy a rutin kezelés időtartamát egy évről fél évre lehetett csökkenteni. Míg az INH monorezisztencia elég gyakori, addig az RMP monorezisztencia ritka. A RMP rezisztencia leggyakrabban olyan törzsekben fordul elő, amelyek INH-ra is rezisztensek, így a RMP rezisztencia egyben a két gyógyszerrel szembeni együttes rezisztencia (MDR) indikátora.
RMP rezisztencia esetén gyakran rifabutin és majdnem mindig rifapentin keresztrezisztencia is fennáll.
Adagolás
Felnőttek esetében javasolt adagolása 10 mg/kg (max. 600 mg) naponta, heti kétszeri vagy háromszori intermittáló kezelés esetén is. Gyermekeknél javasolt adagolása 10-20 mg/kg (max. 300 mg) naponta, hetente kétszeri intermittáló kezelésnél is. A gyógyszerbevételnél figyelmet kell fordítani arra, hogy a PZA az RMP felszívódását akadályozza. Ennek megfelelően a két gyógyszer egyidejű bevétele esetén az RMP dózisának emelése javasolt (napi 750 mg).
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
Az INH-val szemben az RMP hepatotoxikus hatása kisebb mértékű, leggyakrabban az INH-val történő együttes adagolás mellett jelentkezhet. Az RMP inkább cholestaticus hatású, így elsősorban hyperbilirubinaemiát okozhat. Az RMP szedése mellett kialakult májfunkciós eltérések esetén való teendők és májbetegségben való alkalmazásának szempontjai, a májfunkciós értékek monitorozásának indikációja és módja megegyezik az INH kapcsán fentebb részletezettekkel. Az RMP szedése mellett igen ritkán figyelhető meg valódi túlérzékenységi reakció, a betegek mintegy 6%-ánál inkább csak viszketés, esetlegesen bőrkiütés jelentkezik. Hányinger, hányás, étvágytalanság, hasi fájdalom elvétve fordul elő, és szinte soha nem olyan súlyos, hogy szükséges lenne a gyógyszerelés felfüggesztése. Ún. megfázásszerű (flu-like) szindróma alakulhat ki a betegek 0,7%-ánál. Ugyancsak nagyon ritkán jelentkező mellékhatás (a betegek kb. 0,1%-ánál) thrombocytopenia, hemolitikus anémia, akut veseelégtelenség és thrombocytopeniás purpura - ezekben az esetekben a gyógyszer szedésének azonnali és végleges leállítása szükséges. A gyógyszer a vizeletet, köpetet, könnyet narancssárgára színezi, erről a beteget előre tájékoztatni kell. Az RMP a terhesség és szoptatás alatt is biztonsággal alkalmazható. A liquorkoncentráció csak a szérumkoncentráció 10-20%-át éri el, de még ez is kellő klinikai hatásosságot biztosít. Az RMP veseelégtelenségben és dialízist igénylő végstádiumú vesebetegségben is dózismódosítás nélkül adagolható. Az RMP felfüggeszti az orális fogamzásgátlók hatását, erre a reprodukciós korban lévő nők figyelmét minden esetben fel kell hívni.
Mint májenzim induktor növelheti a májban metabolizálódó gyógyszerek szükséges adagját (pl. kortikoszteroidok, oralis antidiabeticumok, analgeticumok, digitalisok, betablokkolók, enalapril, verapamil, anticoagulans szerek, metadon, narcoticum, theophyllin, oralis anticoncipiensek, macrolid antibiotikumok, azol antifungalis szerek, HIV 1 proteáz-gátlók, nem-nukleozid reverz transzkriptáz gátlók).
2.2.3.Pyrazinamid
A pyrazinamid (PZA) egy nikotinamid-analóg, a pirazin-2-karboxilsav amid derivátuma. A tuberkulózis kezelésében először 1952-ben alkalmazták. A PZA elsősorban a makrofágok belsejében, illetve a sajtos nekrózisban meghúzódó szemidormáns mycobacteriumokra fejt ki igen kifejezett sterilizáló hatást. RMP-vel kombinációban használva a tuberkulózisban szenvedő beteg kezelésének tartamát egy évről hat hónapra rövidíti, és jelentősen csökkenti a relapsusok előfordulását.
Adagolás
Felnőttek esetében naponta 20-25 mg/kg PZA adása javasolt. A beteg testsúlyához igazodó dozírozást a 3. táblázat mutatja. Gyermekek esetében napi 15-30 mg/kg (max. 2,0 g), heti kétszeri intermittáló kezelés esetében 50 mg/kg (max. 4,0 g) PZA adása javasolt.
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
Az általában alkalmazott napi 25 mg/kg mellett májkárosodás a betegek kevesebb, mint 1%-ánál fordul elő. A standard dózisok mellett előfordulhat enyhe hányinger, étvágytalanság. PZA szedése mellett jelentkezhet tünetmentes hyperurikaemia. Ismert köszvényes betegnél a PZA adása kontraindikációt jelent, mivel akut köszvényes rohamot válthat ki. Az igen ritkán és átmenetileg jelentkező morbilliform kiütés vagy fotoszenzitív dermatitis nem kontraindikálja a kezelés folytatását Nem köszvényes polyarthralgia a PZA-szedők 40%-ánál is kialakulhat. Ez a mellékhatás semteszi szükségessé a PZA-szedés megszakítását, a fájdalom nem szteroid gyulladásgátlók segítségével jól csillapítható. A terhesség és szoptatás alatti alkalmazhatóságát illetően ellentmondóak az ajánlások. Míg az American Thoracic Society terhességben való alkalmazását nem ajánlja, addig a WHO és az IUATLD terhesség alatt is biztonságosnak tartja. Központi idegrendszeri penetrációja kiváló, a szérumszinttel megegyező koncentráció mérhető a liquorban. A PZA metabolitjai a vizeletbe választódnak ki, ezért veseelégtelen betegeknél felhalmozódhatnak. Az ilyen betegeknél a hyperurikaemia veszélye is nagyobb, ezért mindenképpen dóziscsökkentés szükséges. Végstádiumú vesebetegségben a dialízist követően hetente háromszor napi 25-30 mg/kg a javasolt adagolás. Bár ritkábban okoz májkárosodást, mint az INH vagy az RMP, az okozott májkárosodás súlyos és tartós lehet, így ismert májbetegségben szenvedők esetében gyakoribb laboratóriumi és fokozott klinikai monitorozás szükséges.
2.2.4.Ethambutol
Az ethambutolt (EMB) a tuberkulózis kezelésére 1966-ban vezették be. Az EMB szerepe a kombinált antituberkulotikum-kezelésben az RMP-rezisztencia kialakulásának megakadályozása, abban az esetben, ha primer INH-rezisztencia veszélye fennáll. Ennek megfelelően alkalmazására akkor van szükség a kezdő kombinációban, ha az ellátási területen a primer INH-rezisztencia mértéke meghaladja a 4%-ot (így hazánkban is), vagy ha ez az információ nem áll rendelkezésre. Adagolás
Felnőttek esetében a kezelés első két hónapjában naponta 25 mg/kg, majd napi 15 mg/kg EMB adása javasolt. Gyermekek esetében napi 15-30 mg/kg (max. 2,0 g), heti kétszeri intermittáló kezelés esetében 50 mg/kg (max. 4,0 g) EMB adása javasolt. Gyermekek esetében, elsősorban ötéves kor alatt, az EMB alkalmazása kerülendő, mivel a látással kapcsolatos esetleges mellékhatásokról a kisgyermek nem feltétlenül tud beszámolni.
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
Az EMB szedése kapcsán jelentkező leggyakoribb mellékhatás a retrobulbaris neuritis, amely látászavar és zöld-vörös színtévesztés formájában jelentkezhet az egyik vagy mindkét szemen. A mellékhatás dózisfüggő és veseelégtelenségben is gyakoribb, de 15 mg/kg napi adag mellett ritkán fordul elő. Magasabb dózisok intermittáló kezelés formájában biztonsággal adhatók. Igen ritkán perifériás neuritis, vagy bőrreakciók is felléphetnek, ilyenkor általában fel kell függeszteni a gyógyszer adagolását. Az EMB terhesség és szoptatás alatt biztonsággal alkalmazható. Az EMB központi idegrendszeri penetrációja a gyulladásban lévő agyhártyákon keresztül jó, de meningitis basilarisban klinikailag nem bizonyult hatásosnak. Az EMB a veséken keresztül eliminálódik, ezért 50 ml/perc alatti kreatininclearance esetén a dózis vagy az adagolási intervallumok módosítása szükséges. Végstádiumú vesebetegségben a dialízist követően heti háromszori 15-20 mg/kg adagolás javasolt. Májbetegségekben az EMB veszély nélkül alkalmazható. Az EMB-kezelés megkezdése előtt a beteget alap szemészeti (ún. Snellen-tábla) és a színlátást (Isihara-teszt) is érintő ellenőrzésnek kell alávetni. A beteget havonta ki kell kérdezni a látást, színlátást érintő panaszokat illetően, és panasz jelentkezése esetén a gyógyszer szedését azonnal fel kell függeszteni. Havonkénti szemészeti kontroll szükséges azoknál a betegeknél, akik több mint két hónapja napi 15-20 mg/kg-nál magasabb dózisú EMB-kezelésben részesülnek. Ugyancsak havonkénti szemészeti ellenőrzés javasolt veseelégtelenségben is.
2.2.5.Aminoglikozidok és capreomycin
Az aminoglikozidok széles spektrumú antibiotikumok, amelyek elsősorban a Gramnegatív kórokozók, az Enterococcusok és a Mycobacteriumok ellen hatnak. Közülük a legfontosabb a Waksman és Shatz által 1943-ban a Streptomyces griseus
baktériumból izolált streptomicin (SM), amely az egyik első anti- tuberkulotikumként vonult be az orvoslásba. Azóta számos egyéb aminoglikozidot kifejlesztettek. Ezek közül antituberkulotikus aktivitásukat tekintve a kanamycin és az amikacin a jelentősebbek. Az igen gyenge orális felszívódás miatt az aminoglikozidok csak parenteralisan alkalmazhatók. Baktériumölő hatásuk koncentráció dependens. A központi idegrendszerbe rosszul penetrálnak, a bronchialis szekrétumokba ugyancsak rosszul választódnak ki. További hátrányt jelent, hogy alacsony pH és anaerob körülmények között (azaz intracellulárisan) transzportjuk és hatékonyságuk jelentősen romlik. Az amikacin és a kanamycin között gyakori a keresztrezisztencia, de az SM és az amikacin vagy kanamycin között az eltérő rezisztenciamechanizmus miatt nincs keresztrezisztencia. Adagolás
Felnőttek esetében 55 év alatt és 50 kg testsúly felett napi 15 mg/kg (max. 1,0 g) SM, amikacin, kanamycin vagy capreomycin adása javasolt. Naponkénti kezelés javasolt 2-4 hónapig vagy a tenyésztések negatívvá
válásáig. Ezt követően a kezelés heti kétszeri vagy háromszori adagolás formájában is folytatódhat. Idősebb és alacsony testsúlyú betegek esetében napi 10 mg/kg (max. 750 mg) SM, amikacin, kanamycin vagy capreomycin adása javasolt.
Gyermekek esetében napi 20-40 mg/kg (max.1,0 g) SM, illetve 15-30 mg/kg (max. 1,0 g) amikacin, kanamycin vagy capreomycin adása javasolt.
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
Az aminoglikozidok alkalmazása kapcsán fellépő leggyakoribb mellékhatások az oto-, nephro- és neurotoxicitás. Ototoxicitas esetén hallás- és egyensúlybeli zavarok jelentkeznek. Ennek veszélye az életkor előrehaladottságával, a vízhajtók együttes alkalmazásával, valamint az alkalmazott dózis emelésével fokozódik. Az egyensúlyzavarok az amikacin és kanamycin esetében ritkábbak. Nephrotoxicitas inkább kanamycin, amikacin vagy capreomycin szedése esetén fordul elő. A neurotoxicitás gyakori jelenség, leggyakrabban a száj körüli izmok paresztéziája figyelhető meg. Terhesség és szoptatás alatt az aminoglikozidok alkalmazása kontraindikált. A központi idegrendszeri penetráció rossz. Veseelégtelenségben az oto- és nephrotoxicitas fokozott veszélye miatt mindenképpen dóziscsökkentés szükséges, és az adagolást heti kétszeri vagy háromszori alkalomra kell csökkenteni. Az ilyen intermittáló kezelés esetében a 12-15 mg/kg dózisban való adagolás javasolt, dialízist követően a baktericid hatás megtartása és a túl korai gyógyszerkimosás elkerülése érdekében. Májbetegség esetén az aminoglikozidok alkalmazhatók. A kezelés megkezdése előtt audiogram, Romberg-teszt, szérumkreatinin-meghatározás szükséges. Ezt követően havonként vesefunkció-kontroll és a beteg hallással, egyensúlyzavarokkal kapcsolatos kikérdezése javasolt. Ismételt audiológiai és vestibularis vizsgálat csak panaszok esetén jön szóba. Capreomycin használata esetén havonkénti kálium- és magnéziumszint ellenőrzés is szükséges.
2.2.6.Fluorokinolonok
A fluorokinolonok közül a levofloxacinnak, moxifloxacinnak van számottevő antituberkulotikus hatása.
Az ofloxacin esetében ez a hatás mérsékeltebb. Antituberkulotikum rezisztens tuberkulózis kezelésére, valamint intolerancia miatt bármelyik alapszer pótlására a fluorokinolonok közül az első választandó szer a levofloxacin.
Adagolás
A levofloxacin napi dózisa 750 mg.
Gyermekeknek és serdülőknek a csont- és porcfejlődési zavarok veszélye miatt, nagy körültekintéssel csak MDR tuberkulózisban adható. Esetükben az optimális dózis nem ismert.
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
A leggyakrabban jelentkező mellékhatások a hányinger, insomnia, fejfájás, pruritus, fotoszenzitivitás.
Terhesség alatt a fluorokinolonok alkalmazását kerülni kell. Levofloxacin esetében a központi idegrendszeri penetráció közepes, a szérumkoncentráció 16-20%-a mérhető a liquorban. Az antacidok a fluorokinolonok felszívódását jelentősen csökkentik. Kisebb mint 50 ml/perc kreatininclearance esetében dózis csökkentés (heti háromszor 750-1000 mg) szükséges, a hemodialízis nem távolítja el a gyógyszert. Májbetegségben szenvedő betegnél is veszély nélkül használható.
2.2.7.Cycloserin
A cycloserin (CS) a rezisztens tuberkulózis kezelésére alkalmazott antituberkulotikum.
Adagolás
Felnőttek és gyermekek esetében is napi 15-20 mg/kg (max. 1,0 g) cycloserin adása javasolt, napi kétszeri adagolásban.
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
Napi 500 mg feletti dózisok esetén a mellékhatások gyakoribbak. A CS szedése kapcsán jelentkező mellékhatások, elsősorban a központi idegrendszert érintik. A panaszok enyhe fejfájástól, nyugtalanságtól kezdve súlyos görcsrohamokig, pszichózisig, suicid késztetésig terjedhetnek. Ritkábban perifériás neuritis is felléphet. A neurotoxikus mellékhatások mérséklésére napi 100-200 mg piridoxin adható. Terhességben kevés adat áll rendelkezésre az esetleges mellékhatásokat illetőleg, ezért csak akkor alkalmazható, ha más lehetőség nincs a tuberkulózis kezelésére. A központi
idegrendszerben a szérumkoncentrációval megegyező koncentrációt ér el. Károsodott vesefunkció esetén mindenképpen óvatosság, dóziscsökkentés és a szérumkoncentráció monitorozása szükséges. Kisebb, mint 50 ml/perc kreatininclearance esetén csak dialízis mellett adható cycloserin, napi 250 mg vagy hetente háromszor 500 mg dózisban. Májbetegség esetén az alkohol indukálta hepatitis igényel figyelmet, az ilyen betegek cycloserin mellett hajlamosabbak görcsrohamokra.
2.2.8.A para-amino-szalicilsav
A para-amino-szalicilsavat (PAS) 1943-ban Lehmann állította elő, 1944-ben már alkalmazták tuberkulózis kezelésére. Jelenleg rezisztens tuberkulózis kezelésére használt antituberkulotikum.
Adagolás
Felnőtteknek napi 8-12 mg/kg PAS adása javasolt napi két-három adagra osztva.
Gyer,ekek esetében napi 200-300 mg/kg adása javasolt ugyancsak napi két-három adagra osztva.
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
A leggyakrabban gastrointestinalis mellékhatások jelentkezhetnek. Ritkábban hepatotoxicitás, malabszorpciós szindróma, steatorrhoea, szérumfolsavszint-csökkenés, hypokalaemia és a protrombinidő megnyúlásához kapcsolódó coagulopathia is előfordulhat. Gyakoribb mellékhatás a hypothyreoidismus, különösen etionamiddal való együttes adagolás esetén. Ilyenkor hormonpótlás is szükséges lehet.
2.2.9.Etionamid
Az etionamid (ETH) az INH-val rokon kémiai szerkezetű, rezisztens tuberkulózis kezelésére használt antituberkulotikum.
A szerkezeti rokonság miatt az ETH és az INH között keresztrezisztencia fordulhat elő.
Adagolás
Felnőtteknek és gyermekeknek is napi 15-20 mg/kg (max. 1,0 g) ETH adása javasolt.
Mellékhatások, speciális kezelési helyzetek, gyógyszer-interakció
Mellékhatásként hányinger, fémes íz érzése, hányás, étvágytalanság léphet fel. Az ETH az INH-hoz hasonló hepatotoxikus mellékhatásokat okozhat, mintegy az esetek 2%-ában. Igen ritkán perifériás neuritis, ptikus neuritis, depresszió, gynaecomastia, alopecia, hypothyreoidismus, diabétesz is felléphet. Az ETH terhességben kontraindikált. Központi degrendszeri penetrációja jó, a liquorban a zérumkoncentrációval megegyező értékek mérhetők. Kisebb, mint 30 ml/perc creatininclearance vagy hemodialízis kezelésben részesülő betegek esetében napi 50-500 mg csökkentett dózis javasolt.
Májbetegségben szenvedőknél óvatosságot igényel az alkalmazása. Időszakos májfunkciós kontroll az INH és RMP szedése kapcsán leírtaknak megfelelően az etionamid esetében is szükséges.
2.3. A kezelés formái
A tuberkulózis kezelésének leggyakrabban alkalmazott formáit a 2. táblázat foglalja össze (tenyésztéssel pozitív beteg és antituberkulotikum-érzékeny törzs esetében). Mivel hazánkban a még soha nem kezelt betegek között az INH-rezisztencia 4% feletti, minden olyan esetben, amikor az antituberkulotikumokat aktív tuberkulózis kezelése céljából alkalmazzák, a kezelést négyes kombinációval kötelező kezdeni: 2 hónap kezdeti intenzív szakasz INH, RMP, PZA és EMB, majd 4 hónap utókezelési szakasz INH és RMP, amennyiben a törzs nem rezisztens. Bár a streptomycin (SM) és az EMB közel egyenlő hatékonyságú, a parenteralis adagolás, illetve a gyakoribb rezisztencia miatt a SM visszaszorult. Bizonyos helyzetekben szükségessé válhat a 4 hónapos utókezelési szakasz meghosszabbítása 7 hónapra. Erre azoknál a betegeknél van szükség, akiknek a kezelés második hónapjának végén levett mintáiból történt tenyésztések még mindig pozitívak (de a kórokozó érzékeny az alkalmazott gyógyszerekre) és/vagy a felfedezéskor a mellkas-röntgenvizsgálat kavitációt mutatott ki. Ezeknél a betegeknél a relapsus háromszor gyakoribb a kezelés megnyújtása nélkül. A kezelés történhet naponkénti, heti kétszeri, illetve háromszori gyógyszerbevétel formájában (2. táblázat). A különböző kezelési sémáknak megfelelő adagolást a 2. táblázat foglalja össze.
2.4. A kezelés monitorozása
A kezelés eredményességének, hatásosságának az ellenőrzésére, nyomon követésére alapvetően nem a radiomorfológiai kép, hanem a mikobakteriológiai vizsgálatok (mikroszkópia, tenyésztés és rezisztencia meghatározás) alkalmasak.
2.5. A kezelés "komplettálása" és megszakítása
A kezelés komplettálása nem egyedül a kezelés időtartamától, hanem a beteg által bevett adagok teljes számától függ. Nem ritka, hogy a szükséges bevett adagszám a kitűzött kezelési időtartam alatt nem teljesíthető a beteg nem megfelelő együttműködése vagy az antituberkulotikumok okozta mellékhatások miatt. Ha a kezelés az intenzív szakaszban több mint két hétre megszakad, elölről kell kezdeni a korábban alkalmazott gyógyszerekkel (ha ennek nincs akadálya pl. mellékhatás). Ha 14 napon belül vagyunk, akkor a kezelés folytatható, az intenzív szakasz a kihagyott napok számával megnyúlik Ha a kezelés megszakítása az utókezelési szakaszban történik és a beteg a szükséges adagok legalább 80%-át már megkapta, akkor a kezelés folytatásától el lehet tekinteni, kezdeti direkt mikroszkópos negatívitás esetén, ha az adagok kevesebb, mint 80%-át kapta meg, a kezelés folytatása javasolt az előírt adagszám eléréséig. Kezdeti direkt mikroszkópos pozitivitása esetén:
- ha a kezelési szünet kevesebb volt, mint 2 hónap, mód van a kezelés folytatására a teljes adagszám eléréséig.
- a kezelési szünet hosszabb volt, mint 2 hónap, a kezelést elölről kell kezdeni.
2.6. Relapsus és sikertelen kezelés
Relapsusról akkor beszélhetünk, ha a beteg az antituberkulotikum kezelésnek köszönhetően tenyésztés negatívvá válik és az is marad a kezelés befejeztéig, de a kezelés befejezését követően a tenyésztés ismét pozitív lesz, illetve ha a beteg klinikai vagy radiológiai romlást mutat. A klinikai tapasztalatok szerint a relapsus a kiterjedt megbetegedésben szenvedőknél, illetve azok esetében, akik a kezelés második hónapjának végén még tenyésztés pozitívak, sokkal gyakoribb. A relapsus általában a kezelés befejezését követő első 6-12 hónap folyamán jelentkezik. Relapsus gyanúja esetén minden eszközzel törekedni kell a bakteriológiai megerősítésre és a rezisztenciavizsgálatok elvégzésére. A relapsus lehet endogén reaktiváció (a hátramaradó dormáns populációból kiindulva) vagy exogén reinfekció eredménye. DOT-kezelt betegek esetében, akik RMP-t tartalmazó kombinációval voltak kezelve, igen nagy a valószínűsége annak, hogy a relapsus hátterében érzékeny kórokozó áll. A rezisztenciaeredmények megérkeztéig ezek a betegek tehát a standard négyes kombinációval kezelhetők. Ha a beteg nem DOT-kezelésben részesült, illetve gyógyszerszedése rendszertelen volt, akkor a szerzett antituberkulotikum rezisztencia veszélye fokozottabb, és a standard négyes kombinációt két további szerrel kell kiegészíteni a rezisztencia vizsgálatok visszaérkeztéig. Ez különösen olyan betegek esetében elengedhetetlen, akiknek az immunrendszere károsodott, légzési tartaléka beszűkült, központi idegrendszert érint a megbetegedés, vagy egyéb életveszélyes állapotban vannak. Exogén reinfekció gyanúja esetén hagyományos és molekuláris epidemiológiai vizsgálatokkal igyekezni kell a fertőző forrás azonosítására, és a kombináció összetételét az indexeset gyógyszerérzékenységi profiljához kell szabni.
A kezelést sikertelennek kell tartani akkor, ha a beteg folyamatosan vagy átmeneti tenyésztésnegativitás után ismételten, de az antituberkulotikum kezelés negyedik hónapja után tenyésztés pozitív. A sikertelen kezelés leggyakoribb oka a nem megfelelő együttműködés (rendszertelen gyógyszerszedés), az inadekvát antituberkulotikum kombináció, DOT-kezelés hiánya, fel nem ismert antituberkulotikum rezisztencia, de előfordulhat a kezelési szabályok betartása mellett is pl. malabszorpció következtében. Az ilyen betegeket rezisztens kórokozóval fertőzöttnek kell tartani mindaddig, míg a rezisztenciavizsgálatok eredményei vissza nem érkeznek. A kezelést legalább két (de inkább három) olyan szerrel kell kiegészíteni, amelyeket a beteg korábban még nem kapott. A rezisztenciavizsgálatok eredményeinek megfelelően a beteg kezelését módosítani kell. A sikertelennek bizonyult antituberkulotikum kombinációt soha nem szabad csak egyetlen szerrel bővíteni.
2.7. Speciális kezelési helyzetek
Az antituberkulotikum okozta mellékhatások, a terhesség, a HIV-pozitív betegek tuberkulózisa, az extrapulmonalis tuberkulózis bizonyos formái, valamint antituberkulotikum rezisztencia esetén speciális kezelési terv felállítása és az ilyen betegek ellátásában jártas szakértővel való konzultáció szükséges.
Azoknál a betegeknél, akik nem kaphatnak PZA-kezelést (súlyos májlaesio, köszvény vagy terhesség miatt), az utókezelési szakaszt 7 hónapra kell növelni. Azoknál a betegeknél, akik nem kaphatnak INH-t (hepatotoxicitás, monorezisztencia), 6 hónapos RMP-PZA-EMB kezelés javasolt. A RMP kontraindikációja esetén (hepatotoxicitás, monorezisztencia) minimálisan 9, de inkább 12 hónapos INH-PZA-EMB kezelés jön szóba. A HIV-fertőzött tuberkulózisos betegek kezelése, abban az esetben, ha proteáz gátló (PI) vagy nem nukleozid reverz transzkriptáz gátló (NNRTI) kezelés alatt állnak, igen komplex feladat, ezért mindenképpen szakértővel való egyeztetést igényel. Egyéb esetben a nem HIV-fertőzöttekkel kapcsolatos ajánlások érvényesek. A PI és NNRTI szerek RMP-vel történő együttadása kontraindikált, mivel az RMP szubterápiás szintre csökkentheti e szerek szérumkoncentrációját. Az RMP helyett ezért a rifabutin adása javasolt, ám még ez a szer is 20-25%-os PI és NNRTI szérumkoncentráció csökkenést eredményezhet. Ezért a rutinszerűen alkalmazott rifabutin dózist csökkenteni (napi 300 mg helyett napi 150 mg), míg az PI- és NNRTI-dózisokat emelni kell. A nukleozid reverz transzkriptáz gátlók (NRTI) nem igényelnek rifabutin dózisváltoztatást.
Az extrapulmonalis tuberkulózis kezelése általánosságban megegyezik a tüdőtuberkulózis fentebb részletezett elveivel. Miliaris és ízületi tuberkulózis, illetve meningitis basilaris esetén legalább 12 hónapos kezelés javasolt, különösen csecsemők és kisgyermekek esetében. Pleuritis, pericarditis tuberculosában és meningitis basilarisban az antituberkulotikumok mellett glükokortikoidok alkalmazása is szükséges lehet. Az első két kórforma esetén a szteroid kezeléstől a folyadékfelszaporodás ütemének csökkenése, a nehézlégzés, az esetleges pleuralis fájdalom enyhülése várható. Nem befolyásolja azonban számottevően a szteroid kezelés a reziduális pleura callus kialakulását, illetve annak mértékét. Meningitis basilarisban a szteroid kezelés csökkenti az intracranialis nyomásfokozódást, a cerebrális ödéma mértékét, az arachnoiditis mérséklésével segít
kiküszöbölni a következményes hydrocephalus, cranialis idegbénulások és gerincvelői blokád kialakulását, mindezek miatt jelentősen mérsékli ennek a súlyos kórformának a mortalitását. Általában napi 1 mg/kg prednizolon adása javasolt 4-8 héten át, a kortikoszteroid ezt követően 2-3 hét alatt építendő le. Súlyos állapotban, tekintettel arra, hogy az RMP a glükokortikoid szérumkoncentrációt jelentősen lecsökkenti, magasabb dózis alkalmazása is szükséges lehet.
2.8. Rezisztens tuberkulózis kezelése
A rezisztens tuberkulózis kezelése megkülönböztetett figyelmet érdemel, mivel a rezisztens törzs okozta fertőzés kezelése évekig elhúzódhat, az alkalmazott gyógyszerek mellékhatásai fokozottabban jelentkeznek, amelyeket a hosszantartó terápia felerősít. Az előbbiek miatt a betegek együttműködése is nehézkesebb lehet.
Monorezisztens eseteknél nem feltétlenül szükséges a terápiás kombináció bővítése, hanem a kezelés időtartama változik. Így INH-monorezisztencia esetében 6 hónapos folyamatos RMP-PZA-EMB kezelés javasolt. RMP-monorezisztencia esetén 9, de inkább 12 hónapos folyamatos INH-PZA-EMB kezelésszükséges. PZA-monorezisztencia esetén is 9 hónapos folyamatos INH-RMP-EMB kezelés jön szóba.
Magyarországon az MDR rezisztencia az esetek több mint 80%-ban ethambutol és streptomycin rezisztenciával is társul, így a kezdeti gyógyszer kombinációban alkalmazásuk nem javasolt.
A mielőbbi megfelelő kezelés beállítás céljából kiemelt szerepet kap a gyógyszerérzékenység minél rövidebb időn belüli meghatározása. Molekuláris biológiai módszerrel - mikroszkópos pozitivitás esetén - akár 1-2 napon belül eredményt kapunk az isoniazid és rifampicin érzékenységet illetően.
Korábban rezisztens tuberkulózis miatt már kezelt beteg esetén figyelembe vehető a már rendelkezésre álló gyógyszerérzékenység eredménye. A későbbiek során a terápia módosítható az aktuális gyógyszer érzékenységi leletek birtokában.
Általános kezelési elvek:
- kezdetben legkevesebb négy (de inkább több) hatásos antituberkulotikum beállítása javasolt, köztük szerepelnie kell egy parenterális szernek, egy fluorokinolonnak, ill. a negyedik antituberkulotikum csoportból az érzékenység alapján válaszható szereknek;
- a parenterális szer alkalmazása min. hat hónapig javasolt;
- DOT alkalmazása kötelező;
- nincs intermittáló kezelés;
- a kezelés időtartama az első negatív köpettenyésztési sorozattól számítva legkevesebb 18 hónap, súlyos kétoldali cavernás folyamatoknál, ill. HIV pozitív betegek esetén 24 hónap kezelés ajánlott.
1. TÁBLÁZAT
Antituberkulotikumok
| 1. Elsővonalbeli per os alkalmazott antituberkulotikumok | isoniazid, rifampicin, ethambutol, pyrazinamid, rifabutin |
| 2. Parenterális antituberkulotikumok | kanamycin, amikacin capreomycin, streptomycin |
| 3. Fluorokinolonok | levofloxacin, moxifloxacin ofloxacin |
| 4. Másodikvonalbeli per os alkalmazott bakteriosztatikus antituberkulotikumok | ethionamide, cycloserin terizidone, paraaminoszalicilsav (PAS) |
| 5. Kevésbé hatékony, a WHO által rutinszerűen nem ajánlott antituberkulotikumok | linezolid, claritromycin, imipenem, amoxicillin/clavulansav |
2. TÁBLÁZAT
Gyógyszerérzékeny kórokozó okozta tuberkulózis kombinált antituberkulotikum-kezelési sémái tenyésztéspozitív esetben
Intenzív szakasz Utókezelési szakasz Teljes adagszám
| Gyógyszer | Adagolás | Gyógyszer | Adagolás | |
| INH | Heti 7 nap, 56 adag (8 hét) vagy | INH+ | Heti 7 nap, 126 adag | 182-130 adag |
| RMP | heti 5 nap, 40 adag (8 hét) | RMP | (18 hét) | (26 hét) |
| PZA | vagy | |||
| EMB | hetente kétszer, 36 adag | 92-76 adag | ||
| (18 hét) | (26 hét) | |||
| INH | Heti 7 nap, 14 adag (2 hét), | INH+ | Hetente kétszer, 36 adag | 62-58 adag |
| RMP | majd hetente kétszer, 12 adag (6hét) | RMP | (18 hét) | (26 hét) |
| PZA | vagy | |||
| EMB | heti 5 nap, 10 adag (2 hét), majd | |||
| hetente kétszer, 12 adag (6 hét) | ||||
| INH | Hetente háromszor, 24 adag (8 hét) | INH+ | Hetente háromszor, | 78 adag (26 hét) |
| RMP | RMP | 54 adag | ||
| PZA | (18 hét) | |||
| EMB | ||||
| INH | Heti 7 nap, 56 adag (8 hét) | INH+ | Heti 7 nap, 217 adag (31 hét) | 273-195 adag |
| RMP | vagy | RMP | vagy | (39 hét) |
| EMB | heti 5 nap, 40 adag (8 hét) | hetente kétszer, 62 adag | ||
| (31 hét) | 118-102 adag | |||
| (39 hét) |
INH = isoniazid, RMP = rifampicin, PZA= pyrazinamid, EMB = ehtambutol.
3. TÁBLÁZAT
Az antituberkulotikumok adagolása
| Felnőtt/gyermek | Heti kétszeri adagolás | Napi adagolás | Heti háromszori adagolás | |
| INH | Felnőtt (max.) Gyermek (max.) | 5 mg/kg (300 mg) 10-15 mg/kg (300 mg) | 15 mg/kg (900 mg) 20-30 mg/kg (900 mg) | 15 mg/kg (900 mg) |
| RMP | Felnőtt (max.) Gyermek (max.) | 10 mg/kg (600 mg) 10-20 mg/kg (600 mg) | 10 mg/kg (600 mg) 10-20 mg/kg (600 mg) | 10 mg/kg (600 mg) |
| PZA | Felnőtt 1,5 g (56-75 kg) 2,0 g (75+ kg) Gyermek (max.) | 1,0 g (<55 kg) 2,5 g (56-75 kg) 3,0 g (75+ kg) 15-30 mg/kg (2,0 g)- | 1,5 g (<55 kg) 3,0 g (56-75 kg) 4,0 g (75+ kg) 50 mg/kg (4,0 g) | 2,0 g (<55 kg) |
| EMB | Felnőtt Gyermek (max.) | 25 mg/kg első 2 hónap 15 mg/kg utolsó 4 hónap (max. 2,5 g) | 50 mg/kg 30-50 mg/kg | 30 mg/kg |
A 14 év vagy 40 kg testsúly feletti gyermekek esetében a felnőtt dózisok alkalmazandók.
INH = isoniazid, RMP = rifampicin, PZA= pyrazinamid, EMB = ehtambutol.
III/2. Sebészeti ellátás
Ellátási szintek:
- tüdőtuberkulózis - mellkassebészeti osztály
- extrapulmonalis tuberkulózis - az érintett szervnek megfelelő osztály
Műtét
Tüdőtuberkulózisban műtéti terápiára csak kivételesen kerül sor. MDR-esetekben, ha az elváltozás körülírt, két hónap megfelelő gyógyszeres előkezelés szükséges, majd a műtétet követően másfél év.
Extrapulmonalis tuberkulózisban gyakrabban van szükség sebészi terápiára, főként csontízületi (gerinc), nyirokcsomó- és urogenitalis lokalizáció esetén.
Egyéb eljárások
1. Betegoktatás
A beteget részletesen tájékoztatni kell betegségének természetéről, a betegség terjedésének módjáról és ennek megelőzéséről, az (ellenőrzött) gyógyszeres kezelésről (rendszeresség, időtartam), az ellenőrző vizsgálatok (röntgen, bakteriológia) szükségességéről, és át kell adni részére a nyomtatott betegtájékoztatót. A tájékoztatásba lehetőleg be kell vonni a beteg hozzátartozóját, és meg kell nyerni együttműködését.
IV. Rehabilitáció
V. Gondozás
1. Primer és szekunder prevenció feladatai
Primer prevenció: újszülöttek kötelező BCG oltása.
Szekunder prevenció: fertőzöttek (latens tuberkulózis) profilaktikus gyógyszeres kezelése.
2. Prognózis
Amennyiben a betegséget gyógyszerérzékeny baktériumok okozták, a tuberkulózis eredményesen gyógyítható betegség (várható gyógyulási arány 80% fölött); a kezelés javasolt időtartama 6-9 hónap. Gyógyszerrezisztens baktériumok esetén a prognózis kevésbé kedvező, különösen igaz ez az MDR tuberkulózisra a szokásosnál hosszabb kezelés és a gyógyszerek mellékhatása miatt. MDR tuberkulózisban a várható gyógyulási arány 50% körüli, a kezelés javasolt időtartama 18-24 hónap.
3. Ellenőrzés
A gyógykezelés során, a kezelés hatásosságának ellenőrzésére, követésére a következő vizsgálatokat kell elvégezni:
3.1. Mellkasátnézeti röntgenfelvétel:
- 2 havonként.
3.2. Bakteriológiai vizsgálatok
3.2.1.A kezdetben mikroszkóposán saválló pozitív betegek esetében
Havonta mikroszkópos köpetvizsgálat és tenyésztés:
- ha a mikroszkópos vizsgálat eredménye két egymást követő hónapban negatív, a továbbiakban csak a kezelés befejezésekor kell mikroszkópos köpetvizsgálatot végezni;
- ha a tenyésztés eredménye két egymást követő hónapban negatív, utána két-három havonta kell tenyésztést végezni, utoljára a kezelés befejezésekor.
3.2.2.A kezdetben mikroszkóposan saválló negatív betegek esetében
A mikroszkópos vizsgálatot egy hónap elteltével meg kell ismételni.
Ha akkor is negatív, nem kell több mikroszkópos vizsgálatot végezni.
3.2.3. A kezdetben mikroszkóposán saválló negatív betegek esetében
Egy és két hónap elteltével kell köpettenyésztést végezni:
- ha ezen tenyésztések közül bármelyiknek az eredménye pozitív, addig kell havonta ismételni a tenyésztést, amíg legalább két egymást követő hónapban negatív lesz az eredmény; ezt követően két három havonta szükséges tenyésztést végezni, utoljára a kezelés befejezésekor;
- ha ezeknek a tenyésztéseknek az eredménye negatív, legközelebb a kezelés befejezésekor kell tenyésztést végezni.
3.3. Laboratóriumi vizsgálatok
3.3.1.Vérsejtsüllyedés:
- a kezelőorvos megítélése szerint.
3.3.2.Májenzimvizsgálatok
Abban az esetben, ha a kezelés megkezdése előtt végzett vizsgálatok kóros (emelkedett) értéket mutattak és/vagy a kórelőzményben alkoholfogyasztás, epekövesség, egyéb májártalomra utaló adat van, a vizsgálatot két hét gyógyszerszedés után meg kell ismételni. Ha az értékek nem romlottak, a kezelés folytatható, és az enzimvizsgálatokat a kezelés alatt havonta tanácsos megismételni.
A fent említett veszélyeztető tényezők hiányában potenciálisan hepatotoxikus gyógyszerek esetén kezdetben havonta, majd kéthavonta kerülhet sor a vizsgálat megismétlésére.
3.3.3.Szérumhúgysav-meghatározás
Elvégzése két hónapon túl tartó PZA-kezelés esetén javasolt havonta-kéthavonta.
3.3.4.Az egyes gyógyszerek alkalmazása esetén
A mellékhatások monitorozása céljából végzendő laboratóriumi és egyéb vizsgálatok a gyógyszer ismertetésénél találhatók meg, ezeket a kezelés megkezdése előtt és a kezelés alatt feltétlenül el kell végeztetni.
4. Az ellátás megfelelőségének indikátorai
Diagnózis: a bakteriológiai vizsgálatok (mikroszkópos és tenyésztés) aránya, a bakteriológiailag igazolt esetek aránya, a tenyésztéssel pozitív esetekben a rezisztenciavizsgálatok aránya.
Terápia: a kezdő gyógyszer-kombináció összetétele, az antituberkulotikum-kezelés időtartama, a rezisztens esetekben alkalmazott antituberkulotikumok és a rezisztencia összefüggése.
Monitorozás: a kezelés hatásosságának ellenőrzésére előírt kontroll-vizsgálatok elvégzése.
Gyógyeredmény: kohorszvizsgálat (az antituberkulotikum-kezelés megkezdésétől számított 12 hónap elteltével a beteg helyzete - eredményes kezelés, sikertelen kezelés, félbeszakított kezelés, meghalt, eltűnt).
5. Protokoll bevezetésének feltételei
1. Tárgyi feltételek
Az ország egész területén elérhető járó- és fekvőbeteg-szakellátás (tüdőgondozók, pulmonológiai osztályok). Megfelelő kapacitású mikobakteriológiai laboratóriumok, amelyek alkalmasak mikroszkópos és megfelelő metodikával végzett (szilárd és folyékony táptalaj) tenyésztéses bakteriológiai vizsgálatok végzésére. Gyógyszer-érzékenységi vizsgálatok hozzáférhetősége az ország egész területén.
2. Személyi feltételek
A tüdőgondozókban 50 000 lakosonként egy tüdőgyógyász szakorvos, pulmonológiai osztályokon 10 ágyanként egy tüdőgyógyász szakorvos vagy szakorvosjelölt.
Mikobakteriológiai laboratóriumban egy laboratóriumi szakorvos. Minden intézményben megfelelő számú egészségügyi szakdolgozó.
3. Szakmai/képzési feltételek
A protokoll oktatása a szakorvosképzés és szakorvos-továbbképzés keretében.
4. Egyéb feltételek
Antituberkulotikumok és tuberkulin folyamatos ellátásának biztosítása.
VI. Irodalomjegyzék
1. Orvosi Mikrobiológiai Szakmai Kollégium: Az Egészségügyi Minisztérium szakmai irányelve: A tuberkulózis mikrobiológiai diagnosztikájáról, Egészségügyi Közlöny, 21. szám, 2009. november 25., 3405-3417
2. Tuberkulózis diagnosztikus és terápiás protokoll - Tüdőgyógyászati Szakmai Kollégium 2009
3. Somoskövi Ákos, Magyar Pál - Pulmonális és extrapulmonalis tuberkulózis 2007
4. World Health Organisation. Treatment of tuberculosis: guidelines for national programmes. 2003.
5. American Thoracic Society/Centers for Disease Control and Prevention/Infectious Diseases Society of America: Treatment of tuberculosis. Am J Respir Crit Care Med. 2003;167:603-662.
6. Reichman and Hershfield's Tuberculosis A Comprehensive, International Approach 2006
7. The National Collaborating Centre for Chronic Conditions-London- Clinical diagnosis and management of tuberculosis and measures for its prevention and control 2006
8. WHO-Guideline for the prognostic management of drug resistant TB 2008
9. WHO-Global Tuberculosis Control-epidemiology, strategy, financing 2009
10. A pulmonológiai intézmények 2009 évi epidemiológiai és működési adatai - Korányi Bulletin 2010. 2. szám
11. Bártfai Z., Somoskövi Á., Ködömön Cs. Szabó N., Puskás E., Kosztolányi L., Faragó E., Mester J., Parsons L.M., Salfinger M.: Molecular characterization of Rifampicin-resistant isolates of Mycobacterium tuberculosis from Hungary by DNA sequencing and the Line Probe Assay. Journal of Clinical Microbiology, 2001; 39(10): 3736-3739.
12. Somoskövi Á., Ködmön Cs., Lantos Á., Bártfai Z., Tamási L., Füzy J., Magyar P: Comparison of Recoveries of Mycobacterium tuberculosis Using the Automated BACTEC MGIT 960 System, the BACTEC 460 TB System, and Löwenstein-Jensen Medium. Journal of Clinical Microbiology, 2000; 38(6): 2395-2397.
13. Lukacs J., Tubak V., Mester J., David S., Bartfai Z., Kubica T., Niemann S., Somoskovi A.: Conventional and molecular epidemiology of tuberculosis in homeless patients in Budapest, Hungary., Journal of Clinical Microbiology, 2004, 42(12): 5931-5934.
A szakmai protokoll érvényessége: 2014. június 30.
VII. Melléklet
1. A protokollfejlesztés módszerei
1.1. Az irodalomkeresés és -kiválasztás módszerei
Nemzetközi szervezetek (WHO, IUATLD, EuroTB) és tekintélyes külföldi intézmény (CDC), illetve szakmai társaság (ATS) által kiadott irányelvek alapján azokat az irodalmi hivatkozásokat vettük figyelembe, amelyek megfelelnek a fenti irányelveknek. A magyarországi adatokat az Országos Korányi Tbc és Pulmonológiai Intézet kiadványa alapján adtuk meg.
1.2. A felhasznált nemzetközi irányelvek adaptálásának módszerei
Az ajánlásokat a hazai intézményi, szabályozási és epidemiológiai viszonyoknak megfelelően adaptáltuk.
1.3. A bizonyíték- és ajánlásszintek meghatározása, magyarázata
I. szintű bizonyíték: Randomizált, kontrollált klinikai vizsgálat és ilyen vizsgálatok összefoglalása.
II. szintű bizonyíték: Jó minőségű kohorsz- vagy eset-kontroll vizsgálat.
III. szintű bizonyíték: Minden egyéb kontrollált vizsgálat.
IV. szintű bizonyíték: Kontroll nélküli vizsgálatok, szakértői vélemények.
Ajánlási szintek:
A: Legalább egy I. szintű vagy két II. szintű bizonyíték B: Legalább egy II. szintű vagy három III. szintű bizonyíték. C: Legalább két III. szintű bizonyíték.
2. Rövidítések
CDC - Center of Disease Control and Prevention CS - cycloserin
DOT - directly observed therapy (ellenőrzött kezelés) EMB - etambutol
EuroTB - Európai Tuberkulózis Surveillance Központ INH - izonicid
IUATLD - International Union Against Tuberculosis and Lung Disease
MDR - multidrug resistant tuberculosis
PAS - para-amino-szalicilsav
PZA - pirazinamid
SM - sztreptomicin
tbc - tuberkulózis
WHO - World Health Organisation (Egészségügyi Világszervezet)
XDR - extensive drug-resistant tuberculosis
A Nemzeti Erőforrás Minisztérium szakmai irányelve
a hematológiai betegségek korszerű kezeléséről - az anaemiák diagnosztikája és kezelése
- Hiányanaemiák
- Autoimmun haemolyticus anaemiák (AIHA)
Készítette: a Magyar Transzfúziológiai és Hematológiai Szakmai Kollégium és a Tudományos Társaság
HIÁNYANAEMIÁK
I. Alapvető megfontolások Az anaemia meghatározása
Az anaemia olyan állapot, amelyben a vvs-szám és paraméterei (haematocrit, haemoglobin koncentráció) a vér térfogategységében a normális populációra jellemző érték alá csökkennek. Az anaemia nem maga a betegség, hanem tükrözője a csontvelő működésének. Gyakran (latens) vérvesztés következménye, kísérő tünete háttérbetegségnek, megjelenési formája hiányállapotnak, ritkán jelzője genetikus eltérésnek.
Előfordulás
Az anaemia a betegségek egyik leggyakoribb megnyilvánulási formája. A fejlett országokban a kórházba kerül betegek 30-40%-a anaemiás. A fejlődő országokban a lakosság többsége anaemiás.
A Magyarországon felnőttekre érvényes normális vérsejtszám-adatokat a 7. és 3. táblázat tükrözi.
A beteg anamnézisének, fizikális vizsgálati adatainak ismeretében az anaemiák fő típusainak megállapításához, első diagnosztikus lépésként fontos adatok nyerhetők az automata gépi számadatokból és a festett vérkenet mikroszkópos tanulmányozásából. Megítélhető a vvs-ek nagysága, alakja, haemoglobin tartalma. Ezek alapján megkülönböztethetünk macrocytás (MCV >95-100 fl), normocytás, microcytás (<80 fl) anaemia-típust. A vvs-ek Hb tartalma szerint az anaemia lehet hyper-, normo-, hypochromasiás típusú.
Az abszolút reticulocyta-szám az erythropoesis aktuális produktivitását tükrözi, tehát a (korrigált) reticulocyta-számból megállapítható, hogy regeneratív, vagy aregeneratív formájú-e az anaemia. A vvs-ek további eltérése: sphaerocytosis, ovalo-eliptocytosis: örökletes haemolysisre utal. Durva alaki eltérések, vvs membrán sérülésének a következményei, melyek microangipathiákban keletkeznek. Ezek olykor a gyors diagnózist segítik, a kezelés hatásosságának korai megítélésében pedig nélkülözhetetlenek.
A fehérvérsejtek, vérlemezkék száma és morfológiája kiegészítheti az anaemia kórismézésének lehetőségét (supersegmentált magvú-, agranularis cytoplasmájú granulocyta, makrothrombocyták).
HIÁNYANAEMIÁK
A vérsejtképzéshez szükséges tényezők hiánya anaemia keletkezéséhez vezet. Leggyakrabban okoz anaemiát a következő tényezők egyenkénti vagy több társuló hiánya.
1.Vas, ritkán mangán, kobalt, réz.
2.Vitaminok:folsav, B-vitamin csoport: Bu-vitamin, B6-vitamin piridoxin stb., C-vitamin.
3.Fehérje (esszenciális aminosavak).
4.Erythropoetin, egyéb haemopoetikus növekedési faktorok.
5.Hormonok:androgének, tyroxin.
A hiányanaemiák közös jellemzője a reticulocytaszám csökkenése, tehát hypo-, aregeneratív az anaemia. Vashiányban mikrocytás-hypochrom típusú. Hormonhiányban normocytosis, ritkán mérsékelt makrocytosis van. B12-vitamin-, folsavhiányban ovalomakrocytosis van.
VASHIÁNY OKOZTA ANAEMIA
I. Alapvető megfontolások
A vashiányban nem szintetizálódik elégséges mennyiségű haemoglobin a vvs-praecursorok cytoplasmájában. Az erytropoeticus őssejt kinetikája és a DNS szintézise ilyenkor normális. Bármilyen okból elégtelen a haem-szintézis, következménye: hypochrom-microcytás típusú, aregeneratív anaemia.
Előfordulás, gyakoriság
Az összes anaemiák 75-85%-ában szerepel vashiány. A vashiány a szervezet egyik leggyakoribb hiányállapota, melynek oka többnyire vérvesztés. A vashiányos anaemiások 75-80%-a nő. A fertilis korú nők 20%-a vashiányos anaemiás, szülés után 30-35%, (az azonos életkorú férfiak 2-3%-a).
Hypochrom-microcytás (vashiányos) anaemia keletkezésének lehetséges okait a 2. táblázat foglalja össze
Elsődleges (valódi) vashiányról beszélünk akkor, ha az exogen vas hiánya az egyedüli tényezője az anaemiának, kísérőbetegség nélkül.
Másodlagos vashiány számos okból keletkezhet, leggyakrabban vérvesztés következménye és idült betegségekhez társul, s ilyenkor rendszerint több tényező is szerepel az anaemia keletkezésében. Ritkán heredetiter hátterű.
Tünetek
A vasnak központi szerepe van az oxidatív energiaszolgáltatásban. Az aktív vas 66%-a a haemoglobinban van, 13% a haem-szintézisben szerepel, 13%-a a myoglobinban van, továbbá életfontos enzimek tényezője, melyek működésére a szervezet valamennyi sejtjében szükség van. Ezért már az anaemia kialakulása előtt is jelentkezhetnek vashiányra visszavezethető tünetek szinte minden sejtrendszerben. A bőr száraz, a haj hullik, szájnyálkahártya-atrophia, nyelvégés, a szájzugban berepedés; cheilosis, nyelési zavar: Plummer-Vinson-szindróma. Hosszú ideig (több évig) tartó vashiányban orrnyálkahártya-atrophia: oezena, krónikus cystitis, vaginitis, atrophias gastritis alakul ki, amely achlorhydriát okoz. A köröm barázdált, törékennyé válik, ellaposodik, koilonychia keletkezik. Az anaemia idején fáradékonyság, hyperkinetikus vérkeringés-tünetek gyakoriak, subfebrilitás is elfordul. A vérkeringési tünetek megjelenése az anaemi kialakulásának gyorsaságától függ. Idült, lassan kialakuló anaemiához jól alkalmazkodik a szervezet és jelentős Hb csökkenés is kevés (csak terhelésre jelentkező) tünettel járhat.
II. Diagnózis
A vashiányos állapot, anaemia kialakulásának fokozatait foglalja össze a 3. táblázat.
A valódi vashiány kialakulása során először a macrophagokban (elsősorban a csontvelőben és a májban) raktározott vas mennyisége csökken, megelőzve a serumvas-szint csökkenését. Ilyenkor a serum ferritin koncentrációja arányosan változik a raktározott vas mennyiségével (1 mg/l equivalens 8 mg raktározott vassal), tehát legjobb korai jelzője a raktárvas csökkenésének (praelatens vashiány). Ha a vasraktár teljesen kiürül, csökkenni kezd a sideroblast arány a csontvelőben. Csökken a serumvas és nő a TVK (TIBC), mely tükrözi a serum transferrin-szint kompenzáló növekedését és a vasfelszívódás fokozódásának lehetőségét. Ilyenkor még normális a Hb-koncentráció (latens vashiány). Jelentősen nő a szolubilis transferrin receptor mennyisége. A vashiány progressziója során utoljára csökken a Hb-vas mennyisége. Számszerűen ezt tükrözi az MCH és a MCHC csökkenése. Festett vérkenetben ilyenkor a vvs-ek többsége hypochromasiás microcyta (manifeszt vashiányos anaemia). A súlyosabb anaemiában anisocytosis, (szivar formájú) poikilocytosis is látható. Ebben a stádiumban kiszélesedik az RDW (red distribution width). Az anaemiához kezdetben mérsékelt thrombocytosis is társul (400-600 G/L).
A csontvelő rendszerint normocellularis, enyhe erythroid hyperplasia van (G/E: 1-2 körül). Berlini-kékkel festett kenetben a macrophagokban nincsen vasszemcse. A normoblastok legfeljebb 5%-a tartalmaz vasszemcsét (sideroblastopenia).
Differenciáldiagnózis
Az elkülönítést segíti a 2. táblázat és a 4. táblázat.
Mindig szükséges vizsgálni a lehetséges vérzésforrások okait (polymenorrhoea, gastointestinalis rendszer, vizelet haemosiderin) Valódi vashiányban a csontvelő cytologiai vizsgálata nem szükséges az anaemia diagnózisához, ha vasbevitel csökkenése, vagy a vasvesztés nyilvánvaló.
Másodlagos vashiány kialakulásakor, idült gyulladásos (szinsztémás) betegséghez társuló anaemia differenciál-diagnózisahoz szükség lehet a csontvelő vizsgálatára. Ilyenkor a macrophag-vasraktározás normális vagy fokozott, de a sideroblastok ekkor is akár teljesen hiányozhatnak. A serumvas-szint normális vagy alacsony, de nem nő a TVK és a transferrin receptor szint (részletek később). A szerum ferritin pedig akút fázis proteinként változik, tehát szintje normális vagy növekszik, ezért ilyenkor nem használható a vasraktár megítélésére. Nő viszont a CRP vérszintje.
Ólommérgezésre utal a vvs-ek basophil punctatiója és a vvs szabad protoporfirin-szint jelentős növekedése. Az anamnézis kiegészítő adata fontos. Thalassaemiára utal a micrtocytosis, rendkívül súlyos hypochromasia, nagyrészt céltábla vvs-ekkel. A vvs-szám nem vagy csak mérsékelten csökken és olykor reticulocytosis is van. Familiáris vizsgálat, részletes se. fehérjeadatok, a Hb2 szint növekedésének bizonyítása szükségesek.
III. A vashiányos anaemia kezelése
Mindenkor gondolni kell a vashiányhoz vezető háttérre és elsőként annak eliminálása szükséges. A vashiányhoz vezető legfontosabb ok az idült vérvesztés (80%) megszüntetése. Van nemzetközi "guideline" is, de a gyakorlat inkább a több évtizedes kezelési tapasztalatra épül.
Per os vaspótlás
A per os használható vaskészítmények közül a ferrovas (szulfát) legalább tízszer jobban szívódik fel, mint a ferrivas (készítmények ATC kódja: BO3A) (5. táblázat). A vas éhgyomorra szívódik fel legjobban. A vasfelszívódás a duodenumban és a felső jejunumban történik. Tetraciklinek, antacídok, kolesztiramin, rendszeres nagymennyiségű teaivás (tannát képződés miatt) rontja a vas felszívódását.
A valódi vashiányos anaemia per os vaspótlásra kitűnően reagál. A vaskezelés akkor eredményes, ha a kezelés kezdete után 7-14 napon belül jelentős reticulocytosis keletkezik, és három-négy héten belül a Hb. is legalább 20 g/l-rel növekszik.
A vaskezelés mellékhatásai
A vaskészítményt éhgyomorra szedőkön kb. 20%-ban van gastrointestinális panasz, puffadás, nausea, étvágycsökkenés, hasmenés, obstipatio. Ez csökkenthető, ha kezdetben étkezés közben egy-kétszer naponta történik a bevétel és a dózis hetenkénti fokozatos növelésével éri el a napi 3-4 tablettát, ha nincs panasz célszerű fokozatosan áttérni az étkezés előtt egy órával történő bevételre.
Parenteralis, vaskezelés
Csak ritkán szükséges: malabsorptiós szindrómák, agastricus állapot, ritkán Billroth-II. gyomorresectio után, ha kiterjedt Crohn betegség van és a per os kezelés súlyos nem kívánatos hatása (ulcusképződés!) miatt.
Az iv. vasbevitelre a három vegyértékű vaskészítményt célszerű adni, amelyben a vas organikus kötésben van (Ferrlecit inj., Na-ferriglukonikum 62,5 mg /5 ml, Venofer inj. Ferrum hidroxi-szaharóz 100 mg Fe3+/5 ml, a készítmények ATC kódja: BO3AC). A pótlásra szükséges vasmennyiség összdózisának becslése legegyszerűbben a következőképpen lehetséges: A hiányzó Hb g/l x 3,4 * = hiányzó Hb vastartalma mg-ban x 4-5**= a teljes testre számított hiányzó vastartalom. Ehhez hozzá kell adni a vasraktárak feltöltéséhez szükséges vasmennyiséget (kb. 1000mg). (*=a Hb 1 g-jának vastartalma: ug) (**=a keringő vérmennyiség, becsülve a testkg 7%-a; literben)
A hiányzó vasmennyiséget kb. 200 mg-os dózisokban lehet iv. beadni nagyon lassan, vagy célszerűbb rövid infúzióban (2-300 ml fiziológiás sóban hígítva) 2-3 naponként. A teljes szükséges dózis bevitele 2-3 hét alatt történjen.
Kellemetlen mellékhatásként émelygés, hányinger, ritkán allergiás bőrreakció, láz, arthralgia, lymphadenopathia előfordul. Nagyon ritkán anafilaxiás reakció is lehet. Ezért az iv. vasbeadás fekvőbeteg gyógyintézetben vagy sokk kezelésre alkalmas ambulancián (biológiai próbát alkalmazva), orvosi felügyelettel végezhető.
Intramuscularis vas adását lehetőleg kerülni kell. A beadás helyén tartós fájdalom lehet és felette a bőr barnára pigmentálódhat.
IV. Rehabilitáció
V. Gondozás
A vashiány pótlásának kezdetén az orálisan adott vasnak 15-20%-a szívódik fel az első hetekben, az erythropoesis átmeneti, jelents fokozódásakor. A Hb-szint normálishoz növekedésével párhuzamosan csökken a felszívódás 5%-ra. Cél lehet 150-200 mg elemi vas per os bevétele naponta. Minthogy az aktív Hb-vas pótlásán kívül a vasraktárakat is (kb.1000-1500 mg) fel kell tölteni, a vas-kezelést sokáig, olykor fél éven át is, minden paraméter normálissá válásáig, szükséges folytatni.
Kiegészítő kezelés
Megfelelő táplálkozás mellett a megfelelő ideig, megfelelő dózisú vaskezelés során sem sósav, sem C-vitamin adására nincsen szükség. De vannak adatok, melyek szerint a C-vitamin fokozza a vas felszívódását. Tehát, ha C-vitamin hiányra van gyanú ennek adását is meg kell fontolni (olcsó és nincsen mellékhatása).
Kezelés eredménye
A vaskezelés során - 7-14 napon belül - jelentős reticulocytosis (krízis-szerű) keletkezik, és 3-4 hét múltán a Hb-koncentráció növekedés kb. 20 g/l lehet. Tehát a Hb 8-10 hét múlva normálissá válik. Valamivel hosszabb idő szükséges a vvs valamennyi paraméterének normális értékekre változásához.
Amennyiben a per os vagy iv. vaskezeléskor az értékek várt javulása nem megfelelő, a következő lehetőségekre kell gondolni:
1. a diagnózis felülvizsgálata
2. a vér-vasvesztés folytatódik (ilyenkor folyamatosan reticulocytosis van)
3. a beteg nem szedi megfelelően a vaskészítményt
4. idült gyulladásos, szisztémás betegség (daganat) társulása
5. B12-vitamin, vagy relatív folsavhiány van
6. egyidejű antacid szedés, rendszeres teafogyasztás (tannát képződés) gátolja a vasfelszívódást. Ilyenkor hematológus szakorvossal kell konzultálni.
TÜNETI MACROCYTOSIS ÉS MACROCYTÁS ANAEMIA
I. Alapvető megfontolások
Macrocytosisról beszélünk akkor, ha a vvs-ek többségének átmérje, köbtartalma jelentősen meghaladja a normális átlagot, MCV >100 fl. Ilyenkor rendszerint növekedett a MCH és az RDW értéke is. A vérkenetben rendszerint anisocytosis van és vvs-ek egy része hyperchromásiás kerek, vagy ovális macrocyta. Ez az eltérés lehet az erythropoesist érintő valamely változásnak (fiziológiásnak is) átmeneti, vagy tartós kísér tünete, máskor a sérült erythropoesis kóros produkciójának következménye, tehát fontos diagnosztikus jelzője. A macrocytosisok okait az 6. táblázat foglalja össze.
MEGALOBLASTOS VÉRSEJTKÉPZÉS
A megaloblastos vérsejtképzés oka a dezoxiribonukleinsav (DNS) szintézisének a károsodása. Ez egyaránt létrejön Bi2-vitamin és/vagy folsav hiányában. A B12-vitamin a DNS felépítésében döntőfontosságú biokémiai reakciók koenzimje kölcsönhatásban a folsavval. Együttes, vagy egyenkénti hiányukban a nukleoprotein működésben súlyos zavar keletkezik. Hasonló zavart okoznak mindazok a gyógyszerek is, melyek purin és pirimidin antagonisták, vagy más úton gátolják a DNS-képzést. Következmény a differenciált myelopoeticus praecursor sejtek magjának oszlási és érési zavara. Kevesebb sejtoszlás történik, nagyobb marad a cytoplasma, melyben zavartalan a haem-szintézis. E megaloblastos vérsejtképzés következménye: ovalo-macrocytás, hyperchrom, aregeneratív anaemia. Az erythro-, granulopoeticus- és megakaryocyta-működés egyaránt sérül ezért pancytopenia keletkezik.
Megaloblastos vérsejtképzéshez vezet:
Bn-vitamin hiány
Folsav hiány
B6-vitamin (piridoxin) hiány (ritka)
DNS- anyagcserét gátló más okok hatására
-genetikus
-cytostatikus (purin és pirimidin antagonista) kemoterápia
-egyéb gyógyszerek (altatószerek, fogamzásgátlók)
B12 vitamin (kobalamin) és a folsav-hiány az anaemiák 5-10%-ában szerepel, lehetséges okait a 6. és 7. táblázat foglalja össze. B12-VITAMINHIÁNY
A tápanyag kellő mennyiséget tartalmaz, leggyakrabban a felszívódás elégtelen, s rendkívül ritkán enzimhiány miatt nem jó a felhasználás.
A Bu-vitamin, a pancreas enzimek közreműködésével, a gyomor parietális sejtjeiben termelődő intrinsik (Castle) faktorhoz kötődve szívódik fel a distalis ileumból. Minden olyan körülmény, amely intrinsic faktor hiányt okoz, vagy a komplex felszívódását gátolja, B12- vitaminhiányt eredményez és megaloblastos vérsejtképzés keletkezik. A napi szükséglet 2 ug. Ép májban egy-két évre elégséges mennyiség tárolódik, tehát a felszívódás teljes hiányában is lassan alakul ki anaemia. Normális szint a vérben: 197-866 pg/ml.
FOLSAV HIÁNY
A folsav a tápanyagból ritkán hiányzik, gyakrabban a felszívódás elégtelen (idült alkoholistákon). Relatív hiány keletkezik, ha fokozott a szükséglet (serdülő korban, terhesség, tartós haemolysis idején), vagy nagy a veszteség. (Az USA lakosságának 10%-ában tünetszegény, vagy nyilvánvaló folsavhiány van. Idős korúakon a 70%-ot is elérheti) Az onko-haematologiai betegségek kezelésére használt, purin és pirimidin antagonista gyógyszerek gátolják a DNS-képzését. Heveny folsav hiány No2 narkózis során alakulhat ki. Ép májban legalább három hónapra elégséges készlet van. Hiányában tehát hamar kialakul az anaemia. Napi szükséglet kb. 0,5 mg. A vvs folsav-koncentráció >250 ng/ml. Ez pontosabb jelzője a szöveti folsavtartalomnak, mint a szérumszint (2-9 pg/ml).
Megaloblastos anaemiára jellemző tünetek
Összefüggenek a haematologiai következményekkel (macrocytás anaemia, haemolysis), az emésztőcsatorna eltéréseivel (atrophiás gastritis) és az idegrendszer degeneratív változásaival.
Az anaemia nagyon lassan fejlődik, van idő az adaptációra, ezért súlyosságához viszonyítva (a vvs-szám lehet 1-2 millió/ul közötti) későn okoz klinikai tüneteket. A kültakaró sajátos citromsárga színű, az anaemiás sápadtság és subicterus következményeként. Mérsékelt lépnagyobbodás gyakori. A myelopoesisen kívül más gyorsan proliferáló sejtrendszerek is sérülnek. Az emésztőrendszerben gyakori a nyálkahártya-atrophia (az esetek 50%-ában van) jelei (néha megelőzhetik az anaemiát): nyelvégés (Hunter-glossitis).
AZ ANAEMIA PERNICIOSA (AP)
I. Alapvető megfontolások
A Bu-vitaminhiány típusos formája: az Addison-Biermer-anaemia oka az intrinsic faktor autoimmun eredetű hiánya a gyomornyálkahártya atrophiája következtében. Intrinsic tényező nélkül a B12-vitamin nem szívódik fel. Hiányában a megaloblastos vérsejtképzésnek legtípusosabb formája jön létre.
Előfordulás, incidencia
Idősebb korban gyakoribb (az átlagos életkor 60 év körüli). A 40 év alatti elfordulás 10%. Nőkön valamivel gyakoribb, mint férfiakon (n:ffi arány. 1,6:1. A neuropathia viszont a férfiakon gyakoribb. Incidencia: 10 új beteg évente /100 000 lakos. Társul más betegségekkel (hasimoto thyreoiditis, Addison-kór, vitiligo, diabetes mellitus, hypogammaglobulinaemia, hypothyreosis). Gyakori a családon belüli elfordulás. "A" vércsoportúakon gyakoribb.
II. Diagnózis
Vérkenetben az aniso-ovalo-macrocytosis, hyperchromasia a jellemző. Az MCV (> 110 fl), a vvs-átmérő, az MCHC és az MCH egyaránt jelentősen növekedett. Nagyon kicsi a reticulocyta-szám. Extravascularis haemolysis jelei vannak. A serum szabad haptoglobin szint nem csökkent, az LDH-, a vasszint növekedett. A vérkenetben néhány %-ban, az átlagosnál nagyobb supersegmentált magvú neurtrophil (6-vagy több maglebenyű) granulocyták is láthatók. Csökkent a thrombocyták száma, ritkán jelentősen, néhány %-ban macro alak ( >5u átmérőjű) is van.
A csontvelő hypercellularis, a kenetben az erythroblastok a normálisnál nagyobbak (megaloblast), jelentős a balratolódás, a többség promegaloblast és basophil megaloblast. Az érettebb cytoplasmájú, haemoglobin-tartalmú, orthochrom festődésű megaloblast magja "éretlen", laza szerkezetű (a mag-plasmaérés aszinkróniája). E sejtek többsége (akár 80-90%-a is) már a csontvelőben elpusztul. Tehát az erythropoeticus hyperplasia ellenére sem termelődik elég vvs, vagyis az erythropoesis "ineffektív".
Sérül a granulo- és thrombocytopoesis is. E rendszerekben szintén ineffektív a sejtképzés. Sajátos "óriás" metamyelocyták és pálcaalakok láthatók. A megacaryocyták is nagyobbak és magjuk ugyancsak supersegmentált. A granulocyta- és a thrombocyta-képzés is csökken. Gyakori a pancytopenia.
Az anaemia perniciósához társuló tünetek
A korai őszülés jellegzetes. Az idegrendszeri tünetek típusos formája a myelosis funicularis, gyakori az alsó végtagon: paraesthesia, mélyérzészavar, izomgyengeség, (esetleg paresis), sajátreflex-hiány Babinski-tünettel (!) társulva. Ritkán az idegrendszeri tünetek megelőzik az anaemiát. Vitiligoval társulás is előfordul.
Histamin és gastrin refracter anaciditás (achilia gastrica) van. A B12- vitamin felszívódásának zavara bizonyítható: a Schilling-teszt I. patológiás (a vizeletben mindössze 1-3% 60Co-B12-vitamin ürül 24 óra alatt, norm.: >10%). A Schilling-teszt II. során (exogén intrinsic faktorral együtt adva), gyomorresectio és gastrectomia esetén a B12-vitamin felszívódása normálissá válik. Kóros adat esetén a bacterialis contaminatio szerepelhet a háttérben.
Autoantitestek kimutathatók: intrinsic faktor ellen (100%), ez specifikus AP-re. parietalis sejt ellen (90%), pajzsmirigysejt ellen (40%). A vvs-süllyedési sebesség rendszerint jelentősen gyorsult.
A macrocytás-megaloblastos vérsejtképzés differenciáldiagnózisa
A macrocytosisok elkülönítését segíti az 6. táblázat. Az AP nagyon jellemző klinikai megjelenése és cytomorfológiai eltérései, általában nem téveszthetők össze más macrocytosisokkal. Nagyon hasonló lehet a myelodysplasia szindrómában látható csontvelői kép, de itt nincsen a vérkenetben ovalo-macrocytosis és nincsen supersegmentált granulocyta, látható viszont agranularis cytoplasmájú granulocata. A csontvelőből cytogenetikai vizsgálat segíthet, vagy végső soron a B12-vitamin kezelésre adott válasz, vagy annak hiánya lehet döntő.
III. A megaloblastos anaemia gyógyítása B12-vitamin szubsztitúció
A szubsztitúciót célszerű nagy adag im. adott B12-vitamin injekcióval (1000 gamma, a készítmények ATC kódja: BO3BA) kezdeni. Ezt követően másodnaponként még 6-8-szor célszerű a dózist megismételni. Erre azonnal megindul a nagy tömegű fiatal erythropoeticus sejt (promegaloblast) normális menetű proliferációja és érése. A csontvelőből már 24-48 órán belül eltűnnek a megaloblastok és normoblastos hyperplasia látható. A keringésben 3-7 nap között hirtelen nő a reticulocyta-szám (reticulocytakrízis keletkezik). Ilyenkor a reticulocyta-arány 20-40%-ra is növekedhet (>400 000/ul).
A gyógyítás hatásosságának korai jelzője, hogy a beteg szubjektív állapota már az első napokban javul, a hőemelkedés megszűnik. A Hb növekedése hetenként 10 g/l is lehet. A granulo- és thrombocyták száma a 7-10. napon eléri a normális szintet, sőt átmeneti thrombocytosis is előfordul (500-800 G/l).
Neurológiai tünetek ugyancsak javulnak (lassan) Bn-vitamin-kezelés során; folsav adása ilyenkor nem célszerű, ez nem befolyásolja az idegrendszeri tüneteket, sőt alkalmazásakor esetleg rosszabbodás is következhet.
Folsav pótlás
AP-ban ritka az egyidejű folsav hiány, de a megaloblastos anaemiák más formáiban gyakori. Per os kezelés végezhető, kezdetben - 10-20 mg naponta - a tünetek megszűnéséig. Folyamatos kezeléskor (tartós felszívódási zavar, folyamatos haemolysis) napi 3-5 mg a célszerű dózis. Gastrointestinalis malabsorptios állapotokban, a tünetektől függően intermittálóan (naponta 5 mg) történhet a pótlás, többnyire Bn-vitaminnal és vaspótlással kombinálva.
Kiegészítő kezelés
A haemoglobin felgyorsult felépítése során a raktározott vas hamar felhasználódik és egy héten belül lecsökken a serumvas-szint, vashiány alakulhat ki. Ezért reticulocytakrízis esetén akkor is célszerű per os vaspótlás, ha előzően magas volt a serumvas-szint.
E periódusban ritkán kálium-hiány is kialakulhat (intracelluláris beáramlás!).
Elsősorban szimptómás, perniciosaszerű megaloblastos anaemia gyakran vashiánnyal is szövődik, ilyenkor mindig együtt kell adni a vasat és a Bu-vitamint, ill. folsavat.
Oralis contraceptivum szedéséhez ritkán társuló macrocytás anaemia a szer elhagyása, változtatása után jól reagál B6-vitaminra.
A szájnyálkahártya atrophiájával járó (égés, szárazság) panaszt befolyásolja riboflavin és nikotinsav.
Vvs-pótlás (transzfúzió)
A szubsztitúciós kezelés során nagyon gyors a javulás. Transzfúzióra csak vitális indikációként kerüljön sor. Ha a diagnóziskor, ágynyugalomban is súlyos hypoxiás jelek vannak, lázas infekció társulásakor célszer egy egység vvs-koncentrátum adása, a volumen-túlterhelésre figyelve (10-20 mg Furosemid iv együttadásával).
IV. Rehabilitáció
V. Gondozás Fenntartó kezelés
A Bn-vitamin-kezelést folytatni kell egész életen át. De a fenntartó kezelés adagjai sokkal kisebbek. Általában napi 1-2 mg B12-vitamint számíthatunk szükségletnek, s mivel ez a normális működésű májban jól raktározódik, 2-3 havonta adott 300 mg B12-vitamin (im.) elégséges. (Általános szokás ugyanilyen gyakorissággal 1000 mg B12-vitamin adása, ennek nincs akadálya, mert nincs mellékhatása és olcsó)
Gastrectomia után mindig, subtotalis gastrectomia után 20-25 %-ban alakul ki megaloblastos anaemia, ezért a beteg élete végéig szükséges B12-vitamin és/vagy folsavkezelés. Gondolni kell arra, hogy évekig tartó atrophiás gastritis következményeként is kialakulhat vashiány, társuló megaloblastos vérsejtképzéssel.
Ellenőrzés
Anaemia perniciosa társulhat gyomor-carcinomával. Korai diagnózis céljából enyhe panasz esetén is szükséges a gyomor vizsgálata (gastrosscopia, biopsia).
Refrakter megaloblastos anaemia
A B12-vitamin-kezelésre refrakter anaemia perniciosa rendkívül ritka, ezért ilyenkor revideálni kell a diagnózist. Ha a diagnózishoz nem fér kétség, és Bi2-vitaminnal mégsem érünk el remissiót, folsavat is kell adni.
KOMBINÁLT PATOGENEZISŰ ANAEMIÁK
I. Alapvető megfontolások
A szervezetet érő külső hatások és belső egyensúlyzavarok többsége befolyásolja a vérsejtképzést. Relatív hiányállapotokat idézve elő, csökken a vérsejtképzéshez szükséges tényezők felhasználása. A következmény gyakran anaemia, ritkábban egyéb cytopeniák keletkezése. E csoportban tárgyalt anaemiák:
- Idült betegségeket kísérő anaemia
= Idült májbetegségek = Idült vesebetegségek
- Várandós anyák anaemiája
I/A. IDÜLT BETEGSÉGEKET KÍSÉRŐ ANAEMIA
(Anemia of chronic disorders, ACD)
Gyakran társul - többnyire mérsékelt, ritkábban progrediáló - anaemia: autoimmun hátterű szisztémás betegségekhez (primaer chronikus polyarthritis (PCP), sistemas lupus erythematosus (SLE), sarcoidosis), idült infekciókhoz (tuberculosis, osteomyelitis, abscessus, pyelonephritis, újabban HIV-1, AIDS, égés-, myocardialis infarctus-, műtét utáni elhúzódó gyógyulás), malignus tumoros folyamatokhoz (lymphoproliferativ betegségek, carcinoma, esetleg szolid tumorok), idült máj- és vesebetegségekhez, endokrin szabályozási zavarokhoz, anyagcsere betegségekhez (pl. diabetes mellitus).
Előfordulás
A vashiányos anaemia után ez a leggyakoribb anaemia forma, az összes anaemiák 25-30%-a.
Patogenezis
1. A vvs.-destrukció fokozódik, enyhe extracorpuscularis haemolysis van.
2. A vasanyagcsere változásai:
a) Csökken a vas felszívódása.
b) A transzferrinszint csökken vagy legalábbis nem nő, a szolubilis transzferrin receptorszínt (sTFR) nem nő, a transzferrinszaturáció lehet normális, ritkábban csökken. Ezen változások következménye: a vastranszport az igényhez viszonyítva csökken.
c) A vvs.-ből kikerülő vas nagyobb része a RES-ben és a gyulladásos szövetek macrophagjaiban raktározódik haemosiderin formájában. Tehát a vasraktározás fokozódik, a ferritinszínt gyakori növekedése ilyenkor nem megbízható jelzője a fokozott vasraktározásnak, mert akút fázis fehérje lévén, a magas szint idült gyulladás következménye is lehet. A CRP-vérszint mindig növekedett.
d) A macrophagokban raktározott, nehezen mobilizálható vaskészlet mellett elégtelen a haemszintézis (funkcionális vashiánynak jelölik az állapotot (korábban dyssiderosisnak). Ilyenkor a RES-sejtekből a vasreease ún. gyors fázisa teljesen megszűnik és a lassú fázis is csökken. A vas újrafelhasználása legfeljebb 30%, szemben a normális 80-85%-kal).
e) Újabban szerepet tulajdonítanak egy peptidnek (hepcidin), amely idült gyulladásos folyamatokban fokozottan képződik (a májban). Ez gátolja a vasfelszívódását a bélhámon át és a vas mobilizálását a macrophagokból (RES-ből), ezért csökken a se.-vasszint és csökken a vas újrafelhasználhatósága a haemoglobin felépítéséhez. A hepcidin szint közel azonosan változik a gyulladásos folyamat aktivitását jelző CRP (és AST) szinttel.
3. A vvs.-produkció nem fokozódik az anaemia fokának megfelelően, tehát hyporegeneratio van.
4. A szöveti hypoxia ellenére nem fokozódik az erythropoetin (Epo) termelése.
5. A háttérben zajló immunológiai folyamatokkal összefüggésben nő az interleukin-1 (IL-1) és a tumornecrosis-faktor-a (TNF-a), továbbá az interferonok aktivációja, ezek gátolják a hemopoesist és a csökkent mennyiségben termelődő erythropoetin hatékonyságát. Gátolják továbbá a laktoferrin kiáramlását a granulocytákból.
II. Diagnózis
Az alap- (háttér-) betegség tünetei a meghatározóak. Az anaemia lassan kialakuló mérsékelt (Ht 0,30 körüli), kezdetben normocytás, normochrom (70-80%), később enyhén microcytás-hypochrom típusú, a reticulocyta-szám kissé csökkent. Az anisocytosis nem olyan fokú, mint vashiányos anaemiában. Ezt jól tükrözi a RDW ("red cell distribution width"), mely közel normális. A vvs-destrukció mérsékelt fokozódását (az élettartam 70-80 nap) tükrözheti az LDH-szint növekedése (idült gyulladás!) a vérben. Az anaemia mértéke az alapbetegség aktivitásának a függvénye. Ezen adatok változhatnak, ha occult vérvesztés is társul a krónikus gyulladáshoz.
A csontvelő cellularitása nem változik jelentősen. Az erythropoesis normoblastos, aránya normális. A háttérbetegségtől függően mérsékelt lymphocyta-, plasmasejt-, esetleg hízósejt-arány növekedés előfordul. A macrophagok vassal telítettek. Ugyanakkor a sideroblast nagyon kevés (0-15%).
Differenciáldiagnózis
Elkülönítése a vashiányos anaemiától nem mindig könnyű. Segítheti az 9. táblázat.
Egyik leghasználhatóbb elkülönítő adat a szérumferritin-szint, mely vashiányban mindig alacsony, ACD-ben normális vagy növekedett. A szérumferritin akutfázis-reakciót is tükröz; a stimulált macrophagokból több ferritin szabadul ki, az idült betegség aktivitásától függően vérszintje gyakran növekedett, ezért ACD-ben általában nem alkalmas a raktározott vas mennyiségének megítélésére.
ACD-ben a szérumvas-szint normális, illetve gyakran alacsonyabb, de a teljes vaskötő képesség (TVK, a transzferrin szaturáció) mindig csökkent, jelezve, hogy ebben az állapotban az alacsony szérumvasszint esetén sem nő a transzferrin szintézise. Az alacsony szérumvasszint mellett a csökkent transzferrin szaturáció valódi vashiányos anaemiában jellemző. De ha ACD-hez társuló occult vérvesztés miatt alakul ki vashiányos állapot, a TVK nem nő, akár csökkenhet is.
A transzferrinszaturáció ACD-ben normális vagy csökkent, vashiányos anaemiában mindig kisebb. A szolubilis transzferrinreceptor koncentrációja a plasmában normális vagy csökkent, valódi vashiányban mindig jelentősen, olykor többszörösére növekedett. A szérumrézszint ACD-ben feltűnően magas, valódi vashiányban nem változik.
A csontvelő vizsgálatára kerülhet sor, ha az előző adatok nem döntik el a diagnózist. ACD-ben a csontvelő cellularitása nem változik jelentősen. Az erythropoesis normoblastos, aránya normális, az anaemia ellenére nincs fokozott erythropoesis. Viszont fokozott a vasraktározás: (Berlinikékkel festett készítményben) a macrophagok vasszemcsével telítettek és sok extracellularis vasszemcse is látható, ugyanakkor a sideroblastok aránya 0-15%. A háttérbetegségtől függően mérsékelt lymphocyta-, plasmasejt-, esetleg hízósejt- (mastocyta-) arány növekedés előfordul.
III. Idült betegségeket kísérő anaemia kezelése
A kezelés elsősorban az alapbetegségre irányul, ennek sikerétől függ az anaemia javulása.
Vaspótlás csak kivételes esetekben szükséges. Per os kezelés eredménytelen (nem szívódik fel). Parenterális vaskészítmény (óvatos) adása megfontolandó, különösen, ha vér- (vas-) vesztés is van, vagy Epo kezelés kiegészítéseként.
B12-vitamin, folsav csak akkor befolyásolja az anaemiát, ha táplálkozási elégtelenség, vagy felszívódási zavar miatt hiány van. Erythropoetin (Epo) kezelés (rekombináns humán Epo -rHuEpo), biológiai hatásban egyenértékű hatóanyagokkal végezhető (Epo-a -Eprex, Epo-(3 -NeoRecormon, a-darbepoetin -Aranesp. Mindhárom készítmény előretöltött fecskendőben van forgalomban, intravenásan és subcután egyaránt alkalmazhatók, a készítmények ATC kódja: BO3XA). A készítményeket és az ajánlott dózisokat az Idült vesebetegségek c. fejezetben soroltuk fel (70. táblázat).
A készítmények hatékonyságát összehasonlítva 200 E Epo-a, vagy -(3 felel meg 1ug a-darbepoetinnek. Az Eprex és NeoRecormon adása szükséges hetenként 2-3x, az Aranesp 2-4 hetenként egyszer.
Epo kezelés néha látványos hatású egyes ACD folyamatok kezelésében (pl. PCP-hez társuló anaemiában 100-150E/ttkg heti 2-3x), a Hg növekedése 5-10 g/l is lehet 2-3 hét alatt.
Az onkohaematologiai neoplasiákhoz (elsősorban myeloma multiplex és kis malignitású (nem Hodgkin) lymphomához társuló anaemia egy része is jól reagál Epo kezelésre (lásd a megfelel fejezeteket).
Transzfúzió nem jelent tartós megoldást. Feleslegesen fokozza a vas szöveti raktározását. Csak életmentő céllal kerüljön rá sor; nyugalomban is jelentkező keringési elégtelenség tüneteinek esetén. Tumornecrosis faktor elleni antitestkezeléssel is történnek próbálkozások.
Az idült betegségeket kísérő anaemiák sajátos formája az idült máj- és idült vesebetegségekhez társuló anaemia.
IV. Rehabilitáció
V. Gondozás
Az idült betegségeket kísérő anaemia (anemia of chronic disorders, ACD) Számos háttérbetegséghez csatlakozhat. A folyamatos gondozás a megfelelő szakágazatok szerint oszlik meg: Reumatológus, immunológus, infektológus, diabetológus, gasztroenterológus, stb. A hematológus szakorvosnak többnyire konziliárusi szerepe van.
I/B. ANAEMIA IDÜLT MÁJBETEGSÉGEKBEN
I. Alapvető megfontolások
Idült májbetegség, elsősorban májcirrhosis szövődményeként a hematológiai változások a betegek 50-60%-án fordulnak elő. Az anaemiához gyakran társul thrombocytopenia, majd mérsékelt neutropenia is már a májbetegség korai szakában. A pancytopenia a betegség előrehaladott stádiumában különösen jelentős lehet. A májcirrhosis végstádiumához közeledve a betegek közel 100%-a anaemiás.
II. Diagnózis
A májbetegek anaemiájának jellegzetességei hasonlítanak az ACD-ben észleltekhez, de keletkezésében van néhány sajátosság. Az anaemia lehet macrocytás (50-60%), normocytás 20-30%, microcytás (15-20%). Létrejöttében számos ok szerepel:
1. Vashiány. Okkult gastrointestinalis vérzés (30% erozív gastritisből), máskor heveny varixvérzés következtében.
2. A májban csökken a transzferrinképzés, ezért elégtelenné válik a vastranszport.
3. A vas felhalmozódik a szövetekben nehezen mobilizálható haemosiderin formájában.
4. A portalis pangás és a krónikus alkoholizmus okozta idült enteropathia miatt romlik a felszívódás és elégtelen a májban a raktározás, ezért gyakrabban folsav-, ritkábbany B72-vitamin-hiány és ezekkel öszefüggő anaemia kialakul. Ilyenkor jellemző a kerek macrocytosis, mely az alkoholfogyasztás megszűnésekor eltünhet.
5. A portalis hypertoniával, nagy léppel járó formákban jelentősen nő a plazmavolumen ("splenic hydraemia"), tehát haemodilutio is van, miközben a teljes test vvs.-készlet normális is lehet.
6. Haemolysis: A vvs.-élettartam rövidülése bizonyítható a betegek 50-60%-ában. Autoimmun haemolytikus anaemia társdulhat vírusos eredetű vagy krónikus aktiv hepatitishez.
7. Szabad koleszterin- és foszfolipidmolkulák nagyobb arányban épülnek be a vvs. lipidmembránjának kettős rétegébe, ezáltal növelve a vvs. felszínét. (Szélsőséges formájában a vvs.-ek súlyos morfológiai eltérése következik be: a vérkenetben fogaskerék- (sarkantyú alakú) vvs.-ek (achantocytosis) láthatók. Ilyenkor corpuscularis haemolysis tünetei kerülnek előtérbe ("Spur (sarkantyú) cell anaemia)
8. Hypersplenia: A májfibrosis következtében kialakuló portalis pangás gyakori kísérője (80%) a pangásos (congestiv) splenomegalia. A nagy lépben fokozott a vérsejt-sequestratio és a vvs.-ek macrophagok áltai eliminatiója. Thrombocytopenia és granulocytopenia is gyakori ilyenkor.
Idült alkoholistákon, előrehaladott májbetegség nélkül is, többnyire multifaktoriális eredetű anaemia van. Elsősorban idült folsav- és vashiány alakulhat ki, lehet macrocytás anaemia megaloblastos jelekkel. Sideroblastos anaemiaforma is létrejöhet. Az alkohol gyakori etiológiai faktora az idült májbetegségeknek, májcirrhosisnak. Direkt toxikus hatású a hemopoetikus progenitor-praecursor sejtekre is a folsavanyagcsere befolyásolása útján.
Az alapbetegség ismerete és az anaemia társulása meghatározza a fentiek szerinti diagnosztikus lépéseket. A vvs eltérések függenek az anaemiát előidéző domináló eltéréstől. A macrocytás formában a vérkenetben kerek macrocyták (nem ovális) láthatók néhány %-ban (MCV: 95-110 fl), de nincs supersegmentált neutrophil granulocyta. Megaloblastos anaemiához hasonló klasszikus tünetcsoport ritkán fordul elő. Máskor a mikrocytosis - hypochromasia és aniso-poikilocytosis a domináló, ritka az acantho-fragmentocytosis. A se. vas mindkét szélsőségben előfordulhat. A ferritinszint általában magasabb, de nem biztos, hogy ez a vasraktározás jelzője.
III. Kezelés
Az alapbetegségre irányul és a hiánytünetek pótlásához igazodik.
IV. Rehabilitáció
V. Gondozás
A gondozottak az idült májbetegség (májcirrhosis) diagnózisa alapján akut ellátásban vagy krónikus gyógykezelésben részesülő betegek.
A májbetegségekhez társuló anaemia kezelése gastroenterológiai és hematológiai centrumokban vagy decentrumokban egyaránt történhet, a kontroll vérsejt-szám és egyéb vizsgálatok a területileg illetékes szakrendelőben is végezhetők. A beteg kezelésének, gondozásának irányításában a szakrendelést végző hematológus és gastroenterológus szakorvos együttműködése szükséges.
I/C. ANAEMIA IDÜLT VESEBETEGSÉGEKBEN
I. Alapvető megfontolások
A gyakran társuló anaemia normocytás, normochrom, aregenerativ típusú. A serum vas-szint és TVK többnyire normális, vagy csökkent. A reticulocyta-szám kicsi. A serum-ferritin szint majdnem mindig jelentősen növekedett. A serum erythropoetin a vesebetegség progressziójával párhuzamosan csökken.
Nyilvánvalóan haemolysissel járó formákban ritkán durva vvs-eltérések is láthatók a vérkenetben (Ritkán microangiopathias haemolysis is előfordul. Ilyenkor a vérkenetben anisocytosis, fragmentocytosis látható, esetleg reticulocytosissal társulva: malignus hypertonia, glomerulonephritis acuta; TTP és HUS).
II. Diagnózis
1. Idült vesebetegség
Azotaemi kialakulásakor az anaemia foka függ a veseelégtelenség súlyosságától. A veseelégtelenség előrehaladott stádiumában közel 100%-ában társul anaemia.
Az anaemia többnyire normocytás, normochrom, aregenerativ típusú. A reticulocytaszám kicsi. A vvs.-élettartam kisé csökkent. A szérumerythropoetin-szint a vesefolyamat progressziójával párhuzamosan csökkent. A szérumvasszint többnyire normális vagy alacsony. A szérumferritinszint majdnem mindig jelentősen növekedett, de ez akút fázis protein természete miatt az idült gyulladás jelzője is lehet. Jelentősége csak a C-reactiv protein-szinttel (CRP) összhangban értékelhető. A transzferrin szaturáció (Tsat) 20% alatti értéke vashiányt jelez. Vashiány jelzője, ha a hypochrom vvs arány >10% és a reticulocyta haemoglobin tartalma <28 pg. A csontvelő hypocellularis, elsősorban az erythropoesis csökkenése miatt. Az eritropoietin vérszint meghatározása rendszerint nem szükséges, ha a renalis anaemia diagnózisa nagyon valószínű és nincs az anaemiának kimutatható más oka.
2. Praedialysises periódusban
Kezelés nélkül az anaemia tovább súlyosbodhat (Ht: 0,25-0,30) a csontvelő hypocellularis, elsősorban az erythropoesis csökkenése miatt. Csökken a vvs-produkció:
a) a beteg vesében tovább csökken az erythropoetin képzése.
b) a retineálódó (uraemiás) toxikus anyagok (urea, kreatinin, foszfor, kálium) károsítják a haemopoesist. (inhibitor hatás).
3. Haemodialysis
Különösen extracorporalis haemodialysis folyamatos alkalmazásakor - az erythropoetin termelés csökkenésén kívül - az anaemia oka lehet:
1. Haemolysis van: a vvs-ek mechanikus sérülés és toxikus károsodása következtében.
2. Vér-, vasvesztés van, (egy év alatt legalább 2,5 l vér=1000 mg vas).
3. Ritkán folsavhiány van, elsősorban diétás okból.
4. Alumínium toxikózis hatására mindig microcytás, hypochrom anaemia keletkezik, amely Epo rezisztens.
5. Secundaer hyperparathyreosis csontvelői hypoplasiával, fibrosissal társul és rendszerint granulocytopenia, továbbá thrombocytopenia is van.
Veseátültetés után az anaemia gyakran megszűnik, ha nem, Epo hiányon kívül folsavhiány is előfordul, macrocytás anaemia tünetekkel.
III. Idült veseelégtelenséghez társuló anaemia kezelése
Idült vesebetegség minden stádiumában jól befolyásolható az anaemia erythropoetinnel. A jó hatás eléréséhez szükséges, hogy egyéb tényezők (vas, B12-vit. folsav, stb.) is rendelkezésre álljanak. Gyakran szükséges egyidejűen vaspótlás, ritkábban folsav és B12-vit.is. Korábban androgen hormonkészítmény adása is eredményezett javulást.
Az idült vesebetegek (Epo-) hiányanaemiájának kezelése nemzetközileg összehangolt kezelési módszertani ajánlása szerint történik. A különböző Epo készítmények adagolásának módja és egymást helyettesítő dózisa a 10. táblázaton látható. Előzően nem kezelt betegeken a kezdő Epo dózis-igény 20-30%-kal nagyobb, mint a később szükséges fenntartó adag. Az optimális haemoglobin szintet egyénileg kell meghatározni. Célkitűzés általában, hogy a Hb legalább110 g/l, a Ht 0,33 legyen. Idült hypoxiás tüdőbetegségben, cardiovascularis betegségben ismételt angina pectoris esetén a Hb: 120 g/l, a Ht: 0,33 felett is lehet a klinikai állapotnak megfelelően.
A célul kitűzött szinteket elérve a fenntartó adag: 30-50 E/ttkg hetenként 1-2 alkalommal, Aranesp 0,35-0,50 μg/ttkg. subcután egyszer hetenként.
Az így alkalmazott Epo a betegek közel 100%-ában hatásos. A jó hatás eléréséhez szükséges, hogy egyéb tényezők (vas, B12-vit. folsav, stb.) is rendelkezésre álljanak. Gyakran szükséges egyidejűen vaspótlás.
B12-vitamin és folsavpótlás normális táplálkozás esetén általában nem szükséges, de haemodializált betegeken kb. napi 1-2 μg. szükséges.
Vaspótlás: a pontosan kiszámított vasmennyiség haemodialysis alkalmával adható iv. infúzióban, peritonealis dialízissel kezelt betegen per os.
A vvs-, a vasanyagcsere paramétereinek ellenőrzése 4-6 hetenként szükséges. A renalis anaemia erythropoetin kezelését csak nephrologus szakorvos irányíthatja. Nem kívánatos hatások Epo-kezeléskor
Hypertonia jelentkezik, vagy súlyosbodik a kezelés kezdetén kevesebb, mint 20%-ban. Az antihypertonikumok adagjának változtatásával befolyásolható. Az Epo dózisának csökkentése ritkán szükséges.
A thrombosishajlam fokozódására ugyan nincs biztos adat, mégis javasolják, hogy diabetes mellitusos idült vesebetegek Hb-szintje ne legyen 120g/l feletti.
Pure red cell aplasia (PRCA) keletkezésére lehet gyanú, ha az Epo kezelés kezdeti eredményessége után a Hb koncentráció gyorsan csökkenni kezd. Epo ellen termeld neutralizáló antitestek szerepelhetnek a háttérben.
B12-vitamin és folsavpótlás normális táplálkozás esetén általában nem szükséges, de haemodializált betegeken folsavpótlás (kb. napi 1 mg.) szükséges.
Vaspótlás haemodialysis alkalmával iv infúzióban, peritonealis dialysissel kezelt betegen per os törtéjen. (Részletek a vaskezelés c. fejezetben találhatók.)
A vvs-, a vasanyagcsere paramétereinek ellenőrzése 4-6 hetenként szükséges.
IV. Rehabilitáció
V. Gondozás
Az idült vesebetegség diagnózisától folyamatos gondozás, ellenőrzés szükséges. A renalis anaemia erythropoetin kezelését csak nephrologus szakorvos irányíthatja.
VÁRANDÓS ANYÁK ANAEMIÁJA
I. Alapvető megfontolások
A várandós nők gyakran anaemiásak, ennek tényezői: a reproduktív (szűlőképes, fogamzóképes) korú nők 20-30%-ában terhesség előtt is (praelatens-latens) vashiány bizonyítható. A menstruációval a vasveszteség átlagosan 20-25 mg havonta. Polymenorrhoea esetén ez megduplázódhat. (>35-40 mg). Pótlására a normális táplálkozáskor naponta felszívódó 1,5-2 mg. vasmennyiség nem elégséges. Ezért nőkben a raktározott vas mennyisége kisebb, mint férfiakban, átlagosan <500 mg, gyakran <300 mg. Ezek következményeként a terhesség előtt is gyakori a vashiány-állapot. A terhesség vállalása előtt ezekre a körülményekre gondolni kell, vonatkozik ez különösen multiparákra.
A terhesség idején plasmavolumen növekedése nagyobb (kb. 45 %), mint a vvs massza növekedése (kb. 25%), tehát ez a dilutio is "anaemiát" okoz. Ezen ("terhességi fiziológiás anaemia") túlmenően az estek 80-85%-ában vashiány is van, vagy kialakul. Az O2-szolgáltatás így is kitűnő, a magzat nem szenved hátrányt.
A magzat fejlődése során fokozott a vasszükséglet. Mintegy 600-800 mg vas beépül a magzatba és a keringő vérmennyiség növekedéséhez is felhasználódik további 400-500 mg. Ez a nagy vasszükséglet döntően a terhesség harmadik harmadában alakul ki. Pótlására naponta >4 mg vas felszívódására lenne szükség, de a gondosan összeállított diétából sem szívódik fel ennyi. Ezért az esetek 80-85%-ában a második-harmadik trimesterben vashiány is kialakul.
A szülés környéki vasveszteség (placenta, vérzés) 300 mg körüli. A szoptatási időben is olyan a vasszükséglet, mint a menstruációs időszakban. Fokozottan érvényesülnek ezek multiparákon.
A harmadik trimesterben a folsavszükséglet ötszörösére nő, és amíg nem volt gondos pótlás, a terhességek mintegy 3%-ában megaloblastos, macrocytás anaemia is előfordult, multiparákon gyakrabban társul a vashiányhoz. Szülés után nem ritka a vvs folsavkoncetráció csökkenése. Bu-vitamin hiány rendkívül ritkán fordul elő.
II-III. A terhességi anaemia profilaxisa és kezelése
A vashiány megelőzésében döntő a vasraktárak állapota (telítettsége) a terhesség kezdetén. Figyelmet érdemel, hogy a nők 20%-án már az első terhesség előtt is vashiány van. Ez az arány az ismételten terheseken még nagyobb. A fogamzásgátlók némelyike és a nem szteroid gyulladásgátlók csökkentik a folsav felszívódását. Ha a terhesség előtt telített a vasraktár (kb. 1000 mg), ez megfelel a várható szükségletnek és nem keletkezik anaemia.
IV. Rehabilitáció
V. Gondozás
A gondozás elsősorban a terhesgondozási rendszerben történik. A hematológus szakorvosnak a diagnosztikában és kezelésben tanácsadóként vesz részt.
A terhesség előtti vérsejt-szám adatoknak, a vasanyagcserére irányuló vizsgálatoknak és az anamnézisnek is megfelelően profilaktikus kezelést kell végezni.
A második trimester elejétől okvetlenül szükség van vaspótlásra (100-150 mg elemi vas naponta oralisan). Lactatio idején kb. akkora a vasszükséglet, mint a menstruáló nőn. Fontos adat: A rendszeres folsav profilaxissal minimálisra csökkent a magzati gerincvelő záródási rendellenességek előfordulása (spina bifida, anencephalia, encefalocele). A gerinccsatorna záródása a magzati élet 28. napja körül történik. Ezért profilaktikusan szükséges a terhesség kezdetétől fólsav-pótlás (3-4 mg naponta), ha a korábbi szüléskor ilyen rendellenesség volt, akkor fogamzás előtt célszerű gondolni a folsavban gazdag táplálkozásra (bab, lencse borsó, dió, gyümölcsök, zöldségek), esetleg folsavkezelést kell kezdeni.
A vashiányos anaemia képében jelentkező thalassaemia minima ritkán előfordul Magyarországon is. Ez nem ellenjavallata a terhességnek, de folyamatosan figyelemmel kell kísérni a várandós állapotát.
VI. Irodalomjegyzék
1. Egyed M: A vasanyagcsere és betegségei. Semmelweis Kiadó, Budapest, 2007.
2.Frewin R, Henson A, Provan D: Iron deficiency anaemia. Brit med J 1997; 314: 360-3.
3.Hoffbrand AV, Catovsky D, Tuddenham EGD: Postgraduate Haematology, Ötödik kiadás, Blackwell, 2005.
4.Jandl JH: Hypochromic anemias and disorders of iron metabolism p 289-362. Megaloblastic anaemias p 251-288. Blood Textbook of hematology 2nd ed, Little, Brown and Company, Boston 1996.
5.Lehoczky D, Rák K: Klinikai hematológia. Medicina Budapest 2006.
6.Pfliglerm Gy: Az anaemiás beteg differenciális diagnosztikai megközelítése. Továbbképző füzetek, Sanofi-Aventis, Budapest, 2007.
7.A renalis anaemia vizsgálata és kezelése krónikus veseelégtelenségben. Szerkesztette: Dr. Kiss I, Hypertonia és Nephrologia 2005; 9 (Suppl 3): 25-36.
8.Rizzo JD, Lichtin AE, Wolf SH, et al: Use of epoetin in pacients with cancer; evidence-based clinical practice guidelines of the American Society of Clinical Oncology and the American Society of Hematology. Blood 2002; 100: 2303-20.
9.Wintrobe's Clkinical Hematology. Tizenegyedik kiadás, Lippincott W& W Philadelphia, 2004.
VII. Melléklet
1. táblázat. Normális vérsejt-paraméterek
| FÉRFI | NŐ | |
| Vvs-szám (1012/l=T/l) | 4,3-5,5 | 3,6-4,7 |
| Hb g/l | 135-160 | 120-150 |
| Ht | 0,41-0,53 | 0,37-0,44 |
| Reticulocyta (109/l=G/l) | 30-70 | |
| Vvs-volumen (MCV, fl.) | 85-95 | |
| Átlag Hb-tartalom (MCH, pg) | 27-32 | |
| Átlag Hb-konc. (MCHC, g/l) | 315-355 | |
| Vvs. megoszlása (RDW, %)* | 11 -14 | |
| Fvs-szám (109/l=G/l) ** | 3,7-10 | |
| Neutrophil granulocyta | 40-80 % | |
| Eosinophil " | 0-7 % | |
| Baasophil " | 0-2,5 % | |
| Moonocyta | 3-12 % | |
| Lymphocyta | 10-45% | |
| Thrombocyta-szám (109/l=G/l) | 120-350 | |
| Thromboc. volumen (MPV, fl.) | 10-11 | |
A vér sejtes elemeinek 96%-a vvs, ezért a haematocrit (Ht) a vvs arányt tükrözi.
A vvs. MCV és a MCH mindig egyformán változnak
* micro-, macrocyta, hypo-, hyperchrom vvs. lehet 0-4%
** fiatal, elsősorban lymphoid alak lehet 0-4%
2. táblázat. A hypochrom (vashiányos) anaemiák etiopatogenetikai csoportosítása
I. Elégtelen haem-szintézis
1. Primer vashiány
a) elégtelen a vasfelszívód
- tápanyagban kevés a vas (idősek, vegetáriánusok)
b) fokozott igény
- gyermek-, serdülőkor, terhesség, sportolók, haemodialysis
2. Szekunder vashiány
a) vérvesztés (gastrointestinális, polymenorrhoea)
b) malabsorptioval járó állapotok
- idült enteritis, gyomor-resectio, gastrectomia
c) vasmobilizáció és transzport zavara (dyssiderosis) idült betegségek (ACD)
szisztémás betegségek (PCP, SLE)
mácirrhosis, veseelégtelenség, stb.
malignus folyamatok (lymphomák, neoplasmák.)
d) idült haemoglobinuria (PNH)
3.Protoporfirin szintézis zavara
- Sideroblastos anaemia
II. Globinszintézis zavara
- S-haemoglobin betegség
- Thalassaemiák
3. táblázat. Vashiányos (microcytás, hypochrom) anaemia kialakulása
| Paraméterek | Normális értékhatár | Prelatens | Latens | Manifeszt anaemia |
| Vvs, x1012/l | 3,6-5,5 | Norm. | Norm. | Mérs. csökken |
| Hb, g/l | 120-160 | Norm. | Norm. | Csökkent |
| MCH, pg | 27-32 | Norm. | Norm. -csökkenő | Csökkent |
| MCV, fl | 85-95 | Norm. | Norm. -csökkenő | Csökkent <85 |
| Serum vas, umol/l | 10-28 | Norm. | Csökkent | Nagyon cs. <5 |
| TVK, umol/l | 37-69 | Norm. -növekvő | Növekedett | Nagyon növekedett |
| Transferrin | Norm. -növekvő | Növekedett | Növekedett | |
| Transferrin szat. % | 35+10 | Norm. -csökkenő | Csökkent < 20 | Nagyon cs. <10 |
| Vasfelszívódás, mg/nap | < 2 | Norm. -fokozódó | Fokozott | Fokozott, >3 |
| Serum ferritin, ng/ml | 30-150 | Csökkent | Csökkent | Nagyon cs. <10 |
| Csontvelő RES vas | Csökkent | Nagyon csökken | Hiányzik | |
| Sideroblast, % | 40-60 | Norm . | Csökkent - <10 | <5 -- hiányzik |
| Vvs szabad protoporfirin | 15- 80 | Norm. -növekvő | Növekedett | Növekedett, 5-10x |
| Transf receptor, mg/l | 5 | Norm. - növekvő | Növekedett | Növekedés, 2-4x-es |
| Vvs morfológia | Norm. | Norm. -hypo- chromasia > 10% | Microc. aniso-, poikilocytosis |
4. táblázat. A hypokrom, mikrocytás anaemia elkülönítő diagnózisa
5. táblázat. Magyarországon forgalmazott vaskészítmények
| Gyári név | Vaskötés | Vastartalom/mg |
| Ferrlecit inj. | Ferrous gluconate | 62,5 |
| Venofer inj. | 100 | |
| Aktiferrin kapszula | Ferrous sulfate | 113,85 |
| Ferro-Gradumet filmtabletta | 105 | |
| Sorbifer durales filmtabletta | 320 | |
| Tardyferon drazsé | 256,3 | |
| Maltofer fol rágótabletta* | Ferrous hydroxid + folsav | 100 |
| Tardyferon fol retard drazsé | Ferrous sulfate + folsav | 80 |
| Ferrograd folic filmtabletta | 105 | |
| Neo-Ferro Folgamma | ||
| gyomornedv-ellenálló tabletta | ||
| Ferro-Folgamma kapszula | Ferrous sulfate + B12-vitamin, | 100 |
| folsav | ||
| Ferroglobin-B12-vit. kapszula | Ferrous fumarate + B12-, B6-vitamin, | 24 |
| cink, réz |
* Ferri vasat tartalmaz, alig van nem kívánatos hatása
6. táblázat. A macrocytosis okai (MCV> 95 fl)
1. DNS-szintézis károsodása (MCV>110 fl)
Megaloblastos anaemia (ovalocytosis)
B12-vitamin hiány
Folsavhiány
Cytotoxikus szerek hatása (átmeneti)
2. Erythropoesis fokozódása (reticulocytosis, MCV 95-110 fl)
Idült haemolytikus anaemiák
Vérzés utáni regeneráció szaka
3. Vvs-membránfelszin növekedése (<110 fl)
Idült alkoholizmus (kerek macrocyták)
Májbetegségek, cirrhosis, obstructiós icterus
Splenectomia után
Myelodysplasia szindróma
Sideroblastos anaemia
Erythroleukaemia
Aplastikus anaemia
Pure red cell aplasia (PRCA)
Paraproteinaemiák
Hypothyreosis, myxoedema
Terhesség
Ólommérgezés
7. táblázat. A B12-vitaminhiány okai
A tápanyagban kevés van
- szigorú vegetarianizmus
- időskori hiányos táplálkozás
Intrinsic faktorhiány (IF)
- anaemia perniciosa (autoimmun)
- gastrectomia, gyomor-resectio
Fokozott felhasználás
- terheség, szoptatás
- serdülőkor
- haemolysis (idült)
Kompetició a bélben:
- vakbélkacsban bacteriumok
- diverticulosis, bakteriális gyulladás
A felszívódás csökken az ileumban
- idült pancreatitis
- enteropathiák
= gluténérzékenység
= Zollinger-Ellison szindróma
= diabetes mellitus
- hemicolectomia, ileum resectó, fistula
- Crohn betegség
- ileitis terminalis
- diphyllobatrium latum
- Téniázis
- Infiltrativ intestinális betegség;
= lymphoma, scleroderma
- AIDS
- Idült graft versus host betegség
- gyógyszerhatás
Kongenitális rendellenesség (nagyon ritka) transcobalamin-II hiány intrinsic faktor örökletes hiánya orotsav-uria
hyperhemocysteinaemiához társul
8. táblázat. A folsavhiány okai
A tápanyagban kevés van
- idős kori táplálkozáshiány
- rendszeres kecsketejivók
Felszívódás elégtelen
- gyomor-bél-jejunum resectio
- enteropathiák
= sprue
= Crohn betegség
= glutén érzékeny enteropathia
- diabetes mellitus
- alkohol, májcirrhosis
Fokozott felhasználás (relatív elégtelenség)
- terhesség, szoptatás, koraszülöttek
- serdülőkor
- haemolytikus anaemia
Idült onkohaematológiai és egyéb betegségek
- myelofibrosis
- sideroblastos anaemia
- Myeloma multiplex
- límphomák
- PCP
- exfoliativ dermatitis
- psoriasis
A veszteség fokozott (a vesében)
• krónikus dialysis (haemo-, peritonealis)
• congestiv szívelégtelenség
• aktív májbetegség
Gyógyszerek
9. táblázat.
Az idült betegségeket kísérő anaemia (ACD) és a vashiányos anaemia elkülönítése
| Vashiány | ACD | |
| Se Fe | Jelentős csökken. | Norm. vagy csökkent |
| Se transzferrin | Növekedett | Csökkent |
| Se vaskötő kapacitás | Növekedett | Csökkent |
| Se ferritin | Csökkent | Növekedett |
| Solubilis transzferrin receptor | Növekedett | Norm. vagy csökkent |
| Transzferrin rec./ferritin hányados | Nagy>4 | Kicsi<1 |
| Szabad protoporfirin a vvs.-ben | Növekedett | Növekedett |
| Csontvelői vasraktározás | Hiányzik | Fokozott |
10. táblázat.
Erythropoetin készítmények és adagolásuk
| Erythropoetin készítmény | Adagolás módja | Kezdő adag a korrekcióig | Fenntartó adag |
| EPREX Erythropoetin alfa | sc iv | 3x50 NE/ttkg/hét 3x50 NE/ttkg/hét | 3x17-33 NE/ttkg/hét 75-300 NE/ttkg/hét |
| NEORECORMON Erythropoetin beta | sc iv | 3x20 NE/ttkg/hét 3x20 NE/ttkg/hét | 1x30 NE/ttkg/hét 1x30 NE/ttkg/hét |
| ARANESP Darbepoetin alfa | sc iv | 75ug NE/ttkg/hét 75ug NE/ttkg/hét | 1,5ug NE/ttkg/hó 1,5ug NE/ttkg/hó |
| MIRCERA Metoxi-polietilenglikol Erythropoetin beta | 0,6ug NE/ttkg/2 hetente | 12ug NE/ttkg/hó | |
| RETACRIT Erythropoetin zeta | iv | 3x50 NE/ttkg/hét | 3x17-33 NE/ttkg/hét |
AUTOIMMUN HAEMOLYTICUS ANAEMIÁK (AIHA)
I. Alapvető megfontolások
Meghatározás
Autoimmun haemolyticus anaemia alakul ki, ha a saját vörösvérsejt ellen képződött autoantitestek azok élettartamának olyan mértékű megrövidülését okozzák, amelyet az ép erythropoesis már nem képes kompenzálni, vagy ha a csontvelő működése bármely okból ineffektív.
OSZTÁLYOZÁS
I. Az autoantitestek típusa alapján:
a) Meleg autoantitest okozta (MAIHA)
b) Hideg autoantitest okozta (HAIHA)
c) Kevert, hideg és meleg autoantitest egyaránt kimutatható
II. Kísérőbetegség jelenléte vagy hiánya alapján:
a) Primer (idiopathiás) AIHA
b) Szekunder AIHA - az alábbiakkal társulhat:
- lymphoproliferativ betegség
- nem lymphoid neoplasia
- szisztémás autoimmun betegség
- fertőzés
- idült gyulladás
- gyógyszerek
PATOGENEZIS
Primer AIHA
Etiológája ismeretlen, valószínű, hogy nem generalizált immundefektus, hanem izolált kóros immunválasz okozza.
Szekunder AIHA
SLE-vel, lymphomával társult AIHA hátterében mélyreható immunzavar áll. Megjegyzendő, hogy saját vörösvérsejt elleni autoantitest, általában alacsony titerű, hideg antitest formájában egészséges egyénekben is kimutatható (véradókban 1/10 000). Az autoantitestek jelenléte önmagában nem mindig vezet haemolysishez. Az antitestek mennyisége, ezek antigén irányú aviditása és komplementkötő képessége meghatározó a haemolysis létrejöttében.
A meleg típusú autoantitestekkel fedett vörösvérsejteket a lép és a máj macrophagjai kötik meg, előbb részben, majd teljesen phagocytálják. A következmény sphaerocyták, kevésbé fragmentocyták képződése, illetve a vörösvérsejtek pusztulása lesz. Ilyen esetben dominálóan extravasalis haemolysis történik.
A hideg agglutininek 37°C alatti hőmérsékleten a vörösvérsejtek aggregációját és közvetlen cytolysisét is okozzák. A haemolysis itt döntően intravasalis, ugyanez történik a hideg haemolysinek hatására is.
EPIDEMIOLÓGIA
Az AIHA incidenciája 1-2 eset/100 000/év (USA adat). Az esetek mintegy fele idiopathiás. Minden életkorban előfordul, a vírusfertőzéssel kapcsolatos ritka esetek főleg fiatalkorban, az életkori csúcs a hetedik évtizedre tehető.
TÜNETEK
A vérszegénység és a kísérő (alap) betegség tüneteiből adódnak. Sárgaság, sötét vizelet, lép-májduzzanat jellemző lehet. Haemolyticus vagy haemolyticus-aplasticus krízis a gyors anaemizálódás miatt súlyos, életveszélyes hypoxiához vezethet.
II. Diagnózis
1. Teljes vérkép:
- Az anaemia normocytás vagy a konsumptios fólsavhiány és retikulocytosis miatt mérsékelten macrocytás lehet
- Reticulocytaszám: az esetek kétharmadában növekedett
- Vérkenetben sphaerocyták (kórjelző), fragmentocyták, polychromasia, magvas vörösvérsejtek
- LDH és szérum bilirubin (indirekt): emelkedett
- Szérum haptoglobinszint: csökkent
- Plazma szabad Hb és vizelet Hb megjelenése intravasalis haemolysisben
2. Autoantitestek kimutatása
Az autoimmun haemolyticus anaemiák vércsoport-szerológiai vizsgálata
2.1. A vizsgálathoz szükséges vérminta:
- Két cső natív (10-10 ml)
- Egy cső citrátos (1-9 arányban levéve, 10 ml)
Amennyiben hideg típusú AIHA-ra van gyanú, a vérmintákat a levétel után azonnal 37oC-ra kell helyezni és vizsgáló laboratóriumba küldeni.
2.2. A vizsgálat menete:
Antigénvizsgálat: ABO, Rh (D), Rh fenotípus, Kell meghatározás, egyéb antigének meghatározása, ha szükséges.
Direkt Coombs vizsgálat Direkt Coombs vizsgálat polispecifikus Coombs savóval (anti-IgG és anti-komplement), amennyiben hagyományos módszerrel az eredmény negatív, a vizsgálatot érzékenyített módszerrel kell megismételni.
Ha a vizsgálati eredmény érzékenyített módszerekkel is negatív vagy pozitív, mindkét esetben célszerű monospecifikus (anti-IgM, anti-IgA tartalmú) antihumán-globulinnal (Coombs savóval), valamint IgG típusú antitest fedettség esetén, az IgG alosztályhoz való tartozás megállapítására vizsgálatokat végezni (kezelési konzekvenciája lehet).
A tapasztalatok szerint az IgG1 és/vagy IgG3 típusú autoantitestek általában gyakrabban okoznak hemolitikus krizist.
A direkt-Coombs pozitivitással járó immunhemolízisek okai: kb. 70%-ban meleg típusú autoantitestek, 15%-ban hideg típusúak, 2-5%-ban gyógyszerek okozta autoantitestek, 1%-ban biterminális hemolizinek.
Az AIHA-k kb. 7-10%-ában ab ovo negatív lehet a direkt-Coombs (terhesség alatt jelentkező AIHA-ban a leggyakoribb, csak mosott vérből végzik a vizsgálatot, vagy az autoantitest már csontvelő szinten hat).
Lehet a direkt-Coombs valódi antitest kötődés nélkül is (ál-)pozitív: ha pl. az EDTA-ban levett vérmintát hosszabb ideig alacsony hőmérsékleten tárolták a vizsgálat előtt, in vitro komplement kötődés következhet be, vagy a vérminta paraprotein vagy bármely kóros fehérjetartalma miatt, mosással el nem távolítható mértékű kóros fehérje kötődik a vörösvérsetekhez. A meleg típusú autoantitestek nagy része ún. pánautoantitest (pánagglutinin), amely minden vörösvérsejttel reagál, emiatt az ilyen betegnek laboratóriumi keresztpróbával nem találunk kompatibilis vért. Ha az autoantitestnek van vércsoport-specifictása (a pánantitest mellett, vagy önmagában) transzfúziós szempontból bizonyos esetekben figyelembe veendő (pl. a beteg heterozigóta tulajdonságú az autoantitestre nézve). Az autoantitestek gyakran fednek el allo-antitesteket (előfordulás 30-40%, szemben az autoantitesttel nem rendelkzők 2-3%-ával), melyek kimutatására ill. az autoantitestek specificitásának megállapítására különböző módszerek állnak rendelkezésre.
Hideg agglutinin titer vizsgálat végzése nem szükséges, mert a hideg típusú AIHA hőamplitudó és nem titer függő. A titer vizsgálat elvégzése a kezelésként végzett plasmacsere hatékonyságának méréséhez viszont elengedhetetlen. Az autoantitestek specificitása is jellemző lehet, mint pl.az Rh-,Jk-,Kell-rendszerbeli autoantitestek MAIHA-ban, míg az auto-anti-I a HAIHA-ban a leggyakoribb antitest. Ez utóbbinak azért van a vércsoportszerológiai vizsgálatok szempontjából fontos szerepe, mert a "I"antigén minden felnőtt vörösvérsejten és a thrombocytákon is megtalálható. A kiszélesedett hőamlitúdójú auto-anti-I az ABO meghatározást is zavarja, a beteg vércsoportja csak 37oC-on tisztázható, sőt a vérkép vizsgálatot is meleg körülmények között célszerű végezni, mert különben az arteficiális trombopénia megtévesztő lehet. Ritkán auto-anti-Pr és auto-anti-i antitest is előfordul HAIHA-ban. Anti-P specificitást találunk paroxizmális hideg hemoglobinuriában.
A gyógyszer okozta AIHA-kban az Rh-rendszerbeli specificitást mutató auto-antitestek közül az auto-anti-e a legjellemzőbb.
3. Kísérő (alap) betegség kimutatása
Ezt célzó vizsgálatok (klinikumtól függően fakultatív):
- Immunszerológia - szisztémás immunpatológiai betegség irányában
- Csontvelő-citológia, -hisztológia, -genetika, leképező eljárások malignus folyamat irányában
- Vírus (EBV, CMV, HIV, Parvovírus), Mycoplasma, Chlamydia, syphilis szerológia infekció irányában
Differenciáldiagnózis
- Egyéb sphaerocytosissal járó anaemiák [herediter sphaerocytosis, Zieve-szindróma (acanthocytosissal), Clostridium sepsis, Wilson-kór)
- Gyógyszer okozta haemolysis
- Coombs-pozitivitás egészségesekben, illetve közelmúltban transzfundáltakban
- Szervtranszplantáltak alloimmun haemolysise
- Paroxysmalis nocturnalis haemoglobinuria
- Microangiopathiás (fragmentocytás) haemolysisek
III. AIHA kezelése
Az AIHA kezelése randomizált tanulmányok hiányában jelenleg nem evidenciákon, hanem lényegében tapasztalaton alapul. A terápiás döntések többsége egyénre szabott.
Indikáció:
Nem kompenzált, anaemiához vezető haemolysis. (Coombs-teszt pozitivitás önmagában nem indok a kezelésre!) A kezelést meghatározó tényezők:
- az AIHA primer vagy secunder volta
- az autoantitest típusa
- a haemolysis és a csontvelő kompenzáló képességének mértéke
- a anaemia súlyossága
- a beteg általános állapota
Meleg autoantitestes AIHA kezelése
1. Glucocorticoid: első választandó gyógyszer primer és secunder AIHA esetén egyaránt
Hatásmechanizmusa: a macrophagok Fc receptorainak aktivitását csökkentve gátolja a vörösvérsejtek destrukcióját, késői hatásként mérsékli az autoantitest képződést.
Kezdő adag:
- Súlyos esetben: methylprednisolon 250-1000 mg iv. naponta
- Középsúlyos esetben: prednisolon 1 mg/kg vagy 40 mg/m2 per os naponta, nagydózisú kezelés, amíg a haemoglobin emelkedni kezd (kb. 10-20 nap)
Csökkenő adag:
- A prednisolon adagjának terápiás választól függő csökkentése napi 30-40 mg-ig, mintegy 4 héten át
Fenntartó adag:
- Hetente 5 mg-mal csökkentve a napi adagot 20 mg prednisolon 2-3 hónapon át
Leépítés:
- Stabil állapot esetén 1-2 hónap alatt
Steroidkezelés másik választható módja
Nagydózisú, pulsativ dexamethason-kezelés: egymást követő 4 napon naponta 40 mg dexamethason per os vagy iv., 28 naponta ismétlendő, szükség esetén maximum 6 alkalommal
Mellékhatás: myopathia, diabetes mellitus, fertőzéshajlam, gastrointestinalis vérzés, hypertonia Gyógyulás kritériuma
A haemolysisre jellemző laboratóriumi eltérések megszűnése.
A Coombs-pozitivitás lymphomához társuló AlHA-ban perzisztálhat, primer AIHA esetén egyesek szerint a steroidkezelés a Coombs-próba negatívvá válásáig folytatandó.
Steroidkezelés az esetek kétharmadában jelentős javulást, egyötödében teljes gyógyulást eredményez.
2.Splenectomia
indikáció:
- Folyamatos fenntartó steroidkezelést (> 15 mg/nap) igénylő betegek
- Steroidra egy hónapon belül nem reagáló, illetve korán relapsusba kerülő betegek
Hatásmechanizmus: autoantitest-termelés és phagocytosis csökkentése.
Izotóppal jelzett vörösvérsejtekkel végzett lép-májfelszíni detektálás nem ad felvilágosítást a splenectomia eredményére vonatkozóan. A műtét előtt legalább 2 héttel Pneumococcus, Meningococcus és Haemophilus influenzae elleni vakcináció, amely 5 évenként megismétlendő. Teljes vagy részleges remissio a splenectomia után a betegek kétharmadában következik be.
3.Immunszuppresszív gyógyszerek
indikáció:
- Steroidra és/vagy splenectomiára nem reagáló, illetve lépeltávolításra alkalmatlan betegek
a) Rituximab (CD20 pozitív sejtek elleni antitest, ATC L01XX.
Hatásmechanizmus: A CD20 pozitív antitest-termelő lymphocyták eliminációja és az Fc receptor mediált fagocytosis gátlása.
Adagolás: hetente egy alkalommal 375 mg/m2, 4 héten át. A terápiás válasz a 100%-ot is megközelítheti, azonban a remisszió gyakran csak átmeneti.
Mellékhatás: Citokin felszabadulási szindróma, fehérje túlérzékenységi reakció, fertőzések, progresszív multifokális encephalopathia (PML). Hepatitis-B aktív fertőzés esetén adása ellenjavallt.
További vizsgálatok dönthetik el, hogy a Rituximab az immunsuppressiv szerek közül elsőként alkalmazandó-e. A készítmény jelenleg csak "off label" indikációval rendelhető.
A CLL és a CLL-t kísérő immunhaematológiai betegségek egyidejű kezelésére a leghatásosabbak a Rituximabot tartalmazó kombinációk
b) Cyclophosphamid: 60 mg/m2/nap per os vagy nagydózisú lökéskezelés
Mellékhatás: karcinogenesis, mutasgenesis, csontvelő elégtelenség
c) Azathioprin: 80 mg/m2/nap
Mellékhatás: csontvelő károsodás
d) Cyclosporin A: 3-5 mg/tskg/nap
Mellékhatás: vesekárosodás, gyakori gyógyszerkölcsönhatások
A kezelés a kielégítő terápiás eredményig (maximum 6 hónapon át) folytatandó. Remissio esetén a szer lassú leépítése, hatástalanság esetén alternatív szer adása javasolt.
4.Egyéb, esetenként hatásos kezelési lehetőség
a) Plazmacsere vagy -ferezis
b) Nagydózisú iv. immunglobulin-kezelés
c) Danazol (nem virilizáló androgén) adása
d) Léptáji besugárzás
III/2. Hideg autoantitestes AIHA kezelése
Hidegagglutinin okozta haemolysis idiopathiás formájában a kezelés indikációja:
1. Nem kompenzált, kifejezett haemolysis
2. A végtagok (ujjak) vasoocclusiv elváltozásai
Ajánlott kezelés
a) Rituximab (első választandó szer)
b) Cyclophosphamid: 60 mg/m2/nap
c) Plazmaferezis (súlyos mikrocirkulációs zavar esetén)
d) Steroid általában nem, de extrém nagy adagja olykor hatásos
e) Transzfúzió (lásd 5.2.!)
A hagyományos kezelési eljárásokkal 16%-ban, a Rituximabbal 53%-ban érhető el terápiás válasz.
Tünetmentes hidegagglutinin betegségben szenvedők óvakodjanak a test, illetve a végtagok lehűlésétől.
A Mycoplasma, EBV, Chlamydia kiváltotta haemolysis az alapbetegség gyógyulásával kezelés nélkül 1-3 hét alatt megszűnik. Lymphoproliferativ betegséghez társuló hideg haemolysis esetén az alapbetegség kezelendő.
5. Szupportív kezelés
- Transzfúzió
- Folsavpótlás
5.1. Meleg típusú AIHA
- A transzfúzió progrediáló haemolysis, vagy ha nincs megfelelő csontvelő működés, hiányzik a retikulocytosis, a hypoxiás tünetek megjelenése esetén nem halasztható. A Vérellátó Szolgálattal történő szoros együttműködés, a szoros observatio a szövődményeket az átlagos szintre csökkentheti.
- A transzfúzió szempontjából mindig az alloantitesteket kell figyelembe venni. Ha az autoantitestnek vércsoport-specificitása van, a beteg antigén konstellációja függvényében lehet figyelembe venni.
- Mindig Rh fenotípus azonos és Kell antigén tulajdonság figyelembe vételével történjen a vörösvérsejt készítmény kiválasztása. Mosott, vörösvérsejt koncentrátum adása nem szükséges (a vörösvérsejt készítmények plazma/komplement tartalma elhanyagolható, 3 napos készítményben a komplement már inaktiválódik).
- Autotranszfúzió nem adható.
- FFP adása magas komplement tartalma miatt kerülendő, alvadási faktor készítménnyel kell helyettesíteni, ha szükséges.
- Thrombocytakészítmény csak fiziológiás sóoldatban reszuszpendálva ajánlott.
5.2. Hideg típusú AIHA
- A meleg típusú AlHA-nál leírtak az irányadók, azzal a megjegyzéssel, hogy a vérkészítményeket (és minden infúziós oldatot) 37oC-ra felmelegítve kell beadni.
- Mind a meleg, mind a hideg típusú AIHA-ban általános transzfúziós szabály: a lassú beadás. Folyamatos monitorozás mellett a szövődmények elkerülhetők.
- Haemolyticus krízisben az új irányelvek szerint, a súlyos, hypoxiás tüneteket okozó anaemiában az immunsuppressiv és az alapbetegség kezelése ill. ha gyógyszer a kóroki tényező, a gyógyszer elhagyása mellett kell a beteget transzfundálni választott és megfelelően kezelt vérkészítménnyel, amíg az alapbetegség kezelésének eredményeként meg nem szűnik a haemolysis.
- A veselaesio elkerülésére bő folyadékbevitel szükséges, diureticus kezelés mellett.
- Krónikus haemolysis esetén fólsavpótlás feltétlenül szükséges, napi 1-3 mg adagban.
IV. Rehabilitáció
V. Gondozás
Az autoimmun haemolytikus anaemiák jelentős aránya nem gyógyul meg a különböző kezelések hatására. A tünetmentessé válók közül relapsus előfordulhat. Ezért folyamatos ellenőrzésük szükséges, célszerűen a diagnózist és a kezeléseket végző hematológiai centrum/ decentrumban.
VI. Irodalomjegyzék
1. Autoimmune Hemolytic Anemia in Hoffmans Hematology fourth edition, 2005
2. Acquired hemolytic anemia due to warm-reacting autoantibodies. Cryopathic hemolytic syndromes. In: Williams Hematology 6th Edition, 2001
3. Diehl, LF, Ketchum LH: Autoimmune disease and CLL. Semin Oncol 1998; 25: 80-97.
4. Meyer O, Stahl D, et al: Pulsed high-dose dexamethasone in chronic autoimmune haemolytic anaemia of warm type. Brit J Haematol 1997; 98: 860-868.
5. Berentsen S, Ulvestad E, Gjertsen BT. et al: Rituximab for primary chronic cold agglutinin disease: a prospective study of 37 courses of therapy in 27 patients. Blood 2004;103: 2925-38.
6. Berentsen S, Ulvestad E, Langholm R, Beiske K, Hjorth-Hansen H, Ghanima W, Sorbo JH, Tjonnfjord GE: Primary chronic cold agglutinin disease: a population based clinical study of 86 patients. Haematologica 2006;91:460-6.
7. Cortes J, OBrien S, Loscertales J. et a.: Cyclosporin A for the treatment of cytopenia associated with chronic lymphocytic leukemia. Cancer 2001;92:2016-22,
8. DArena G, Laurenti L, Capalbo S, et al.: Rituximab therapy for chronic lymphocytic leukemia-associated autoimmune hemolytic anemia. Am. J Hematol 2006; 81:598-602,
9. Ding W. Zent CS: Diagnosis and management of autoimmune complications of chronic lymphocytic leukemia/small lymphocytic lymphoma. Clin. Adv. Hematol. Oncol. 2007; 5:257-61.
10. Gertz M.A: Management of cold haemolytic syndrome. Br. J. Haematol. 2007;138: 422-29.
11. Hoffmann PC: Immune hemolytic anemia - Selected topics. In: Hematology 2006. American Society of Hematology Education Program Book, 2006, pp. 13-18.
12. King K.E, Ness PM: Treatment of autoimmune hemolytic anemia. Seminars in Hematology S.: Fludarabine-induced hemolytic anemia: successful treatment by rituximab. Hematol. J. 2004;5: 81-83.
13. Pignon JM, Poirson E, Rochant H: Danazol in autoimmune haemolytic anaemia. Br J Haematol 1993;83:343-345.
14. Robak T.: Monoclonal antibodies int he treatment of autoimmune cytopenias. Eur J Haematol 2004;72: 79-88.
15. Rosse W.F, Hillmen P, Schreiber AD: Immune-mediated hemolytic anemia. Hematology 2004. American Society of Hematology Education Program Book, 2004, pp. 48-61.
16. Schollkopf C, Kjeldsen L, Bjerrum OW, Mourits-Andersen HT, Nielsen JL, Christensen BE. et al: Rituximab in chronic cold agglutinin disease: a prospective study of 20 patients. Leuk. Lymphoma 2006;47: 253-260.
17. Moyo VM, Smith D, Brodsky I. et a.: High-dose cyclophosphamide for refractory autoimmun hemolytic anemia. Blood 2002;100: 704-706,
18. Hoffer I, Vecsey Annamária: Autoimmun hemolítikus anémia (AIHA) Hatóanyagok, készítmények, terápia; Fókuszban az onkológia és onkohematológia 2006,400-413,
19. Garratty, G-Petz, LD: Approaches to selecting blood for transfusion to patients with autoimmune haemolytic anaemia. Transfusion 2002;42. 1390-1392.
20. Lechner K, Jäger Ulrich: How I treat autoimmune hemolytic anemias in adults. Blood, 2010;116: 1831-1838.
A szakmai irányelv érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai irányelve
a hematológiai betegségek korszerű kezeléséről - a myeloproliferativ betegségek diagnosztikája és korszerű kezelése
- Felnőttkori heveny leukémiák
- Krónikus myeloid leukémia
- A myelodysplastikus szindróma (MDS)
- Krónikus myelomonocytás leukaemia (CMMoL)
- Polycythaemia vera (PV)
- Essentialis thrombocythaemia (ET)
Készítette: a Magyar Transzfúziológiai és Hematológiai Szakmai Kollégium és a Tudományos Társaság
FELNŐTTKORI HEVENY LEUKÉMIÁK
I. Alapvető megfontolások
Meghatározás
A felnőttkori heveny leukémiák a differenciálódás korai stádiumában lévő vérképző sejtek proliferációjával és elégtelen differenciálódásával járó betegségek. Kezelés nélkül - döntően az érett sejtek hiánya miatt keletkező fertőzéses és/vagy vérzéses szövődmények miatt - heteken, vagy egy-két hónapon belül a beteg halálát okozzák. Közös jellemzőik ellenére patológiai, klinikai és terápiás szempontból heterogén betegségcsoportot jelentenek.
Epidemiológia (incidencia, prevalencia)
Magyarországon évente 300-350 felnőtt betegszik meg akut leukémiában. A betegek 3/4-e akut myeloid leukémiás (AML), 1/4-e pedig akut lymphoid leukémiás (ALL). Az ALL a gyermekek leggyakoribb malignus betegsége, felnőttekben az AML és az ALL is idős (>60 éves) korban gyakoribb. A betegek többsége betegsége első évében meghal vagy meggyógyul, így a prevalencia az incidencia legfeljebb másfélszerese. Gyógyulásról azonban csak a kezelés befejezését követően 3 évvel is normális csontvelői- és vérkép esetében beszélünk.
Etiopatogenezis
A betegség etiológiája az esetek többségében ismeretlen. Bizonyos vegyszerek (pl benzol) vagy sugár ártalom szerepét epidemiológiai adatok bizonyítják, és AML egyre gyakrabban fordul elő korábbi betegségük miatt kemo- és/vagy radioterápiában részesült betegek esetében. A heveny leukémia klonális és őssejt betegség. Egy normális őssejt genetikai károsodása vagy egy érettebb sejt önmegújító képességet eredményező mutációja révén született leukémiás őssejt a fiziológiás vérképzéssel szemben mutatkozó proliferatív előnye miatt dominánssá válik. Az AML kialakulásának két, a kóros sejtek proliferációját és túlélését segítő valamint differenciálódásukat károsító genetikai történés együtthatása szükséges, ALL-ben onkogén potenciálú fúziós gének (bcr/abl) keletkezését, mutációk következtében gének aktiválódását vagy funkció vesztését, így tumor supressorok inaktiválódását észlelték.
Tünettan
A tünetképződésben az érett vérsejtek számának csökkenése (legtöbbször pancytopenia) játssza a döntő szerepet. A betegek legtöbbször anémia, lázas állapot, valamilyen infekció vagy vérzés miatt fordulnak orvoshoz. A panaszok AML-es esetekben régóta ("preleukémiás" myelodysplasiás fázis) fennállhattak, de hírtelen fellépve az AML első tünetei lehetnek (un. "de novo" esetek). Ritkábban a kóros sejtproliferációból (gingiva hyperplasia, bőr, nyirokcsomó infiltratumok, meningeális leukaemia) adódó panaszok vizsgálata kapcsán diagnosztizálunk akut leukémiát. Az ajkak zsibbadása központi idegrendszeri betegség gyanúját veti fel. T sejtes ALL-ben a mediastinális nyirokcsomók megnagyobbodása okoz tüneteket: köhögés, fulladás, sőt véna cava superior szindróma is előfordul.A betegek gyakran panaszolnak csont vagy ízületinek mondott fájdalmat. Gyakran más, korábban is meglévő betegség súlyosbodása észlelhető. Mikroszkópos vizsgálat híján természetesnek mondható, hogy a beutaló diagnózis agranulocytosis, sepsis, tumor gyanú vagy ITP lehet. A tünetek sokszínűségére utaló megjegyzés szerint ma az akut leukémia tünettana "olyan, mint Osler korában a syphilis volt".
II. Diagnosztika
A heveny leukémia diagnózisa akkor állítható fel, ha a csontvelőben és/vagy a vérben a blastok aránya 20% felett van. Ebből következően a leukémia kórisméje sejtszámolási feladatnak látszik, de a betegség terápiás szempontból döntő jelentőségű heterogenitása további (citokémiai, immunfenotipizálási, cito- és molekuláris genetikai) vizsgálatokat igényel. Ezek racionális tervezése és elvégzése a betegek sikeres és költséghatékony gyógyításának érdekében kötelező penzum. Szemantikailag helyes a myeloproliferativ betegségek terminális fázisát és a myelodysplasiák blast szaporulattal (RAEB:5-20% blast) járó formáit az akut leukémiáktól elkülöníteni, bár az esetek jelentős részében (blastos crisis) kezelésük és annak költségigénye azonos (lehet).
Heveny leukémiában a perifériás kenetben blastokat lát(hat)unk, a csontvelő pedig rendszerint sejtdús és blastokkal infiltrált. De akut leukémiát kórismézünk akkor is, ha kevesebb blastot vagy blast ekvivalens sejtet találtunk, de leukémia specifikus genetikai aberrációt vagy szövettani vizsgálattal korai hemopoetikus sejtekből álló tumort diagnosztizálunk. Kivételesen hypoplasiás csontvelővel járó esetekkel is találkozunk. Az ALL-t nehéz lehet elkülöníteni a lymphoblastos lymphomáktól, és a Burkitt típusú "leukaemia/lymphoma" differenciálásnak sincs klinikai (terápiás) haszna.
A mindenütt elvégzendő mikroszkópos vizsgálattal kezdődő diagnosztikai munka folytatása felkészült laboratóriumokkal (FACS, genetika, PCR) történő kooperációt igényel. Speciális kérdések tárgyalása e fejezet kereteit meghaladja (a WHO 2008-as klasszifikációja az AML diagnosztikáját 45, az ALL-ét 10 oldalon részletezi), de terápiás szempontból fontos részleteire a következőkben utalni fogok.
Klasszifikáció
Ma a leukémiákat még legtöbb helyen egy francia, amerikai és brit hematológusokból álló csoport morfológiai osztályozása alapján soroljuk alcsoportokba. Az un. FAB klasszifikáció mindenütt kivitelezhető és speciális laboratóriumi felkészültséget nem igényel, de az egyes altípusok differenciálása nehéz lehet és a betegség biológiájáról illetve gyógyíthatóságáról sem ad kellő felvilágosítást. Nem nélkülözhető, de nem elégséges.
A differenciálás legrégebben használt módszere a citokémia volt. 3%-nál több peroxidáz (vagy Szudán fekete) pozitív blast myeloid leukémiát jelent, az alpha-naphtyl acetát vagy butirát észteráz pozitivitás monoblastos leukémiára jellemző, a durva rögös PAS reakció B-, a paranucleáris acid foszfatáz aktivitás T-sejtes betegségre utal. Nyilvánvaló értéke ellenére újabb, főként immunológiai reakciók egyre elterjedtebb alkalmazása miatt használata háttérbe szorult, mellőzhető.
A sejtek felszíni és cytoplasmatikus markereinek monoclonalis antitestek segítségével és áramlási (flow) citometriával történő vizsgálata a differenciál diagnosztika (ld. lymphoid leukémiák, 1. táblázat) legértékesebb és gyors módszere. A blastok immunológiai vizsgálata acut lymphoid és differenciálódást nem mutató leukémiákban kötelező, bifenotipusú leukémia diagnózisában nélkülözhetetlen és aberráns marker hordozás miatt AML-ben is hasznos a betegség követése, minimális reziduális betegség megállapításában.
1. táblázat. Az ALL immunológiai klasszifikációja és genetikai eltérései
| B-ALL | T-ALL | ||||||
| HLA-DR+, TdT+, CD19+, és/vagy CD79a+, és/vagy CD22+ | TdT+, cytosplasmatikus vagy membrán CD3+ (CD7+, kivéve az érett T-ALL-t) | ||||||
| Pro-B-ALL (pre-preB- ALL, korai-B- ALL) | Common B-ALL | Pre-B-ALL | B-ALL | Korai-T-ALL | Corticális T- ALL (Thy-ALL) | Érett T-ALL | |
| Gyakoriság | |||||||
| (%) | 9-11 | 50 | 12 | 5 | 6 | 10 | 6 |
| További | - | CD10+ | cytoplasmatikus | s- IgM | cyCD3+ | cyCD3+,CD | sCD3+, |
| jellemző | u lánc + CD10± | CD10± cy-u± | CD5±, CD2± | 1a+, sCD3± | CD1a- | ||
| Gyakori | t(4;11) | t(9;22) | t(9;22), t(1;19) | t(8;14) | t(11;14) | t(10;14) | |
| cytogenetikai | |||||||
| aberrációk | |||||||
| Gyakori | MLL-AF4 | BCR-ABL | BCR-ABL, | MYC- | LMO1-TCRa/p | HOX11- | |
| molekuláris | E2A-PBX1 | IGH | TCRa/p | ||||
| genetikai | |||||||
| aberrációk | |||||||
A WHO osztályozáshoz igazodva ma már minden leukémiás esetben kötelező genetikai diagnózisra törekedni kromoszóma (sávozással, FISH-sel) vagy molekuláris (PCR) módszerekkel. Segítségükkel nemcsak fontos diagnosztikus, de a kezelés várható eredményességét jelző adatokhoz jutunk. Cytogenetikai módszerekkel numerikus és strukturális kromoszóma eltéréseket igazolhatunk. Az aberrációk gyakran komplexek, a betegség lefolyása kapcsán változhatnak /clonalis evolutio/ és ezért egy gyanított eltérést tisztázó vagy igazolt eltérést detektáló szonda alkalmazása nem (mindig) helyettesíti a teljes "átvilágítást". A kromoszóma vizsgálatok leglényegesebb korlátait a mitózisok hiánya, mikroszkóppal fel nem deríthető eltérések lehetősége, csontvelő aspirációk szükségessége, a módszer munka illetve idő igényes volta jelentik. A FISH (fluorescein in situ hibridizáció), a hátrányok egy részét kiküszöböli. Molekuláris vizsgálattal cytogenetikai módszerekkel láthatatlan diagnosztikus eltéréseket is detektálhatunk. Egyre több azon epigenetikai, genomikai stb aberrációk száma, melyek egyes adatok szerint prognosztikus jelentőségűek, de egyelőre terápiás konzekvencia híján végzésük mellőzhető és diagnosztikus kapacitás hiányában nem elérhetők. Összegezve: a mikroszkópos vizsgálatok érzékenysége elmarad a molekuláris technikáktól, melyekkel akár 100000 sejt közt megbúvó 1 leukémiás sejt is detektálható lehet. A mikroszkópos detektálhatóság szintje alatti, PCR és/vagy immunológiai vizsgálatokkal kimutatható leukémiát mondjuk minimális reziduális betegségnek (MRD). A genetikai eltérések kromoszóma szintig történő vizsgálata kötelező, molekuláris vizsgálat végzése - elérhetőségük, a lehetőségek és racionalitásuk szerint- kívánatos. Az új WHO osztályozás (2008) már az említettek figyelembevételével, sőt a betegség előzményeit is számba véve született meg (2. táblázat).
2. táblázat. AML 2008-as WHO klasszifikációjának vázlata
AML gyakran észlelhető genetikai eltérésekkel
AML kiegyensúlyozott transzlokációval vagy inverzióval
- AML t(8;21)(q22;q22) (RUNX1-RUNX1T1) (leggyakrabban a FAB M2)
- AML inv(16)(p13.1q22) vagy t(16;16)(p13,1;q22)(CBFB-MYH11) (típusosan M4eo)
- AML t(15;17)(q22;12) (PML-RARA) (acut promyelocyta leukémia, M3)
- AML t(9;11)(p22;q23) (MLLT3-MLL)
Ideiglenesen:
- AML t(6;9)(p23;q34) (DEK-NUP214)
- AML inv(3)(q21;q26.2) vagy t(3;3)(q21;q26.2) (RPN1-EVI1)
- AML (megakarioblasztos) t(1;22)(p13;q23) (RBM15-MKL1)
AML gén mutációval/mutációkkal
Ideiglenesen:
- AML NPM1 (nucleophosmin) mutációval
- AML (dupla) CEBPA (CCAAT/enhancer-binding proteina) mutációval
AML myelodiszpláziás eltérésekkel
Terápiával kapcsolatba hozható AML
Egyéb AML-k (előzőek szerint nem jellemezhető AML)
AML minimális differenciálódással
AML érés nélkül
AML mieloid érés jeleivel,
Akut myelomonocytás leukémia
Akut monoblastos és monocytás leukémia
Akut erythroid leukémia
erythro(erythroid/myeloid) és tisztán erythroid leukémia,
Akut megakaryoblastos leukémia
Akut basophil leukémia
Acut panmyelosis myelofibrozissal
Myeloid sarcoma
Down kóros betegek myeloproliferatív betegsége
Ideiglenesen:
- Átmeneti (transitorikus) kóros myelopoesis.
- Down szindromával társult myeloid leukémia
Plazmocitoid dendritikus sejtek blasztos neopláziája
Az immunológiai és főleg a genetikai vizsgálatok klinikai szempontból lényegesebb hozadéka az un. "rizikó-csoportok" elkülönítése, mely a kezelés típusának, intenzivitásának meghatározója. A betegség gyógyíthatóságát a leukémia genetikája, a beteg kockázatát (kezeléssel összefüggő halálozás) kora, egyéb betegségei (comorbiditas) és fizikai teljesítőképessége határozza meg. A jelzett differenciál diagnosztikai, "leukémia specifikus" vizsgálatok mellett minden betegnél kötelező a máj és veseműködést kémlő laboratóriumi próbák, a véralvadás valamint a cardiorespiratorikus rendszer vizsgálata. Potenciális transzplantáció várományos betegeknél HLA vizsgálatot kell végezni. Elengedhetetlen a szövődmények, elsősorban az infekciók pontos tisztázása (mikrobiológiai és képalkotó vizsgálatok). A laboratóriumi "monitorozás" mindig a kialakult klinikai szituációtól függ, amit döntően befolyásol a vérkép alakulása. Vérképet másnaponta, kémiai vizsgálatokat hetente kétszer indokolt végezni, míg a fvs szám nem csökken kritikus érték alá. A csontvelő vizsgálatát a terápia hatásának, a rezisztencia korai felismerésének megállapítása céljából lehet korán (8. 14. napon) végezni, de a kezelés stratégiájától függően legtöbb esetben megelégedhetünk a kezelés megkezdése után három vagy négy héttel végzett és aspirációs vizsgálattal. Ezt elkerülhetővé teszi a periférián megjelenő blast, ajánlatossá az elhúzódó cytopenia. Hangsúlyozni kell azonban, hogy a vizsgálatok fentiekben javasolt rendje nem merev szabály, azt mindenkor a beteg állapota, betegségének szövődményei határozza meg, írja felül.
III. A heveny leukaemiás beteg kezelése
Általános irányelvek
A beteg citosztatikus kezelése a pontos diagnózis birtokában és a kezelés szövődményeit minimalizáló beavatkozások (só- és vízháztartás rendezése, valamint -ha szükséges és lehetséges- citaferezis) után kezdődhet. A heveny leukémiás beteg meggyógyítása az egyik legnehezebb, gazdaságilag pedig legköltségesebb onkohematológiai feladat, melyet olyan hematológiai centrumokban helyes és szabad végezni, ahol az ilyen beteg kezelésében kellően tapasztalt team dolgozik, az infekciók diagnosztikájának és kezelésének feltételei, valamint az adekvát vérsejtpótlás lehetőségei a legteljesebb mértékben adottak. A leukémiás betegek meggyógyítása nagy adagú citosztatikus kezelésekkel lehetséges. Ezek megjósolható súlyos szövődményei miatt idős illetve rossz állapotú betegek esetében elfogadható palliatív és/vagy szupportív beavatkozások alkalmazása is.
A kezelés fázisai
A heveny leukémiák cytostatikus kezelését hagyományosan három egymást követő fázisra osztjuk. Az első szakaszt indukciónak nevezzük, melynek célja a komplett remisszió elérése. Komplett remisszióban a kielégítően sejtes csontvelőben a blastok aránya 5% alatt van és a perifériás vérképben nincs blast, a neutrophil granulocyták száma meghaladja az 1000/ul-t, a thrombocyta-szám a 100000/ul-t. A postremissiós kezelés az indukcióhoz hasonló kombináció, esetleg annak redukált dózisú ismétlése (konszolidáció) vagy azonos illetve más szerek nagy dózisban (intenzifikáció) történő alkalmazása lehet. Fenntartó kezelést, mely két éven át tartó, kis dózisú per os citosztatikus kezelést jelent akut lymphoid leukémiában adunk. ALL-ben a betegség központi idegrendszerre terjedése esetén, annak híján preventive intrathecalis kemoterápiát alkalmazunk (illetve koponya irradiációt) indikálunk. ALL-s férfi betegeken különös figyelmet kell fordítani a gyakori here részvételre.
III/1. Az acut myeloid leukaemia kezelése
1. Az acut promyelocytás leukémia /RARa+ APL/ (régebben M3) kezelése
APL-ben a morfológiai (hypergranuláris formák), immunfenotípus (CD33+, CD34-,HLA-DR-, CD11b-), citogenetikai /t(15;17)(q22;q12)/ és molekuláris eltérések (PML/RARA) kivételes gyakoriságú egybeesését tapasztaljuk. A klinikai képet sok esetben uraló és az életet veszélyeztető vérzések miatt az APL "sürgősségi leukémia", melyben a morfológiai kép alapján felvetődő gyanú végleges tisztázása előtt csupa-transz-retin-sav (ATRA) kezelést kell kezdeni. Az ATRA különös értéke, hogy az APL-t szinte szabályszerűen kísérő DIC-et gyorsan gyógyítja. A vérzés veszély csökkentése céljából a beteg thrombocyta számát transzfúzióval 30000/ul fölé, fibrinogen szintjét FFP, fibrinogén vagy cryoprecipitatum adásával 100-150 mg% fölé kell emelni. Esetenként eleve magas vagy ATRA adására fokozódó leukoocytosis is rontja a meglévő vagy látens coagulopathiát, ezért a citosztatikus kezelést is késedelem nélkül el kell kezdeni. A hyperleukocytosis más eseteiben indokolt leukapheresis APL-ben ellenjavalltnak mondható, mert fatalis kimenetelü vérzést indukálhat. ATRA adására a betegek promyelocytái differenciálódni kezdenek és fehérvérsejt szám gyorsan emelkedhet, amit un. APL differenciálódási szindróma kísérhet. A régebben ATRA szindrómának mondott tünet együttest dyspnoe, respiratorikus distress, láz, tüdő infiltrátumok, testsúlynövekedés, pleuralis folyadékgyülem, veseelégtelenség, pericardiális effusio, szívelégtelenség, hypotonia és pseudotumor cerebri megjelenése jellemzi. Előfordulása akár 25%-ot is elérhet, a kezelés megkezdését követő napoktól akár egy hónapon túl (2-47nap) is jelentkezhet. Gyakran a fehérvérsejtek számának emelkedése előzi meg. Mortalitása 15%-os elérhet, ami adekvát kezeléssel 0,5%-ra csökkenthető. Bár az említett tünetek nem specifikusak, a szindroma veszélyei miatt akárcsak egy tünetének jelentkezése esetén is iv dexamethason (10mg) adását kell kezdeni és súlyosabb esetekben az ATRA átmeneti, a tünetek elmúltáig történő szüneteltetése is javasolható.
A betegség végleges gyógyulása a megelőzően taglalt ATRA kezeléssel szimultán kezdett anthracyclin kezeléstől remélhető (Ib evidencia, A javaslat). Úgy tűnik, hogy a gyógyulás eredményeit az anthracyclin választás (idarubicin vagy daunorubicin) nem befolyásolja, és kombinált citosztatikus kezelés sem emeli. ATRA kombinációkkal kezelt APL-es betegek morfológiai és/vagy molekuláris válaszának megállapítására egyéb akut myeloid leukémiákkal összehasonlítva egy későbbi, mintegy két hónappal a kezelés megkezdése után történő vizsgálata informatív.
Az ATRA-hoz hasonló átütő eredmény érhető el arzéntrioxid (ATO) kezeléssel is. Indukciós kezelésben történő alkalmazására vonatkozóan ma még csak szórványos adatok állnak rendelkezésünkre, de ralabált esetekben - ha allogén átültetésre nem kerülhet sor - ATO a választandó kezelés. Miként az ATRA kezeléssel kapcsolatban ATO-val kezelt betegeknél is előfordul APL differenciálódási szindróma, de különösen az alacsony kálium és magnézium szintű betegeknél súlyos cardiális szövődmények (QT megnyúlás, ritmus zavarok, torsade de pointes típusú ventricularis aritmia) is előfordulhatnak.
A komplett remiszióba jutott betegeknek még két vagy három anthracyclin alapú konszolidáló kezelést kell adni. (Ib, A). Ha a havonta alkalmazott konszolidáló kezeléseket 15 napig standard dózisú (45mg/m2) ATRA adással egészítjük ki a gyógyulási eredmények javulnak. A korábban javasolt fenntartó ATRA kezelés értéke megkérdőjeleződött, rutinszerű alkalmazása nem látszik indokoltnak. Néhány kutatócsoport a relapsus mentes túlélés megnyúlását reméli a nagy rizikójú (>10000/ul induló fehérvérsejtszám) esetek konszolidáló kezelésének cytarabinnal történő kiegészítésétől. A késői relapszusok egy része izolált központi idegrendszeri betegség. Ezért magas induló fehérvérsejt számmal induló betegségek (és fiatal betegek) esetén molekuláris remisszió alatt egyes csoportok profilaktikus intrathecalis kezelést javasolnak. Miképpen ezt, a korábban gyakran alkalmazott 6-mercaptopurin + methotrexat fenntartó kezelés eredményességére vonatkozóan sincsenek bizonyítékok. A nemzetközi javaslatoknak megfelelően az APL kezelésére életkori megszorítás nélkül ATRA + anthracyclin kezelést tartjuk követendőnek. Nem gyógyító szándékú (palliatív vagy szupportív) kezelés csak a betegség szövődményeként bekövetkező központi idegrendszeri állományi vérzés vagy befolyásolhatatlan szívbetegség esetén fogadható el. Az APL az esetek többségében de novo leukémia, de topoizomeráz gátló kezelést követően is kialakulhat. Kezelése nem különbözik a de novo esetektől.
A betegség ismert coagulopatológiai vonatkozásai miatt különösen nehéz és sokszor anyai és/vagy magzati vesztességgel jár a terhesség alatt felismert APL kezelése. Az első trimeszterben a betegség anthracyclinnel történő stabilizálását követően a terhesség megszakítását javasoljuk, második felében -a magzati szervek kifejlődését követően- már ATRA-val kombinált kezeléssel remisszió elérésére törekedhetünk.
A betegek ellenőrzésében a molekuláris követésnek döntő jelentősége van. Molekuláris remisszióba nem jutó (rezisztens) illetve molekuláris vizsgálat alapján (újra megjelenő vagy emelkedő PML/RARA) várhatóan visszaeső betegek mentő kezelésében - lehetőség esetén - allogén átültetés javasolható. Ennek előkészítésére vagy ellenjavallat esetén ATO, gentuzumab ozogamycin, esetleg autológ transzplantáció javasolható.
Fentebb vázolt kezelési előírások követése esetén az APL-es betegek mintegy 80%-a végleg meggyógyul.
2. A jó prognózisú, nem promyelocytás AML-es betegek kezelése
Az AML gyógyíthatóságát, a jelenleg rendelkezésünkre álló citosztatikumokkal szemben mutatkozó érzékenységét a leukémiás klón genetikája határozza meg. Gyakorlati következtetésként minden kuratív kezelésre alkalmas betegnél citogenetikai, célzott FISH és PCR vizsgálatok elvégzése kötelező. A standard cytarabin és anthracyclin kombinált kezeléssel elérhető eredmények alapján az AML heterogén csoportjából jó prognózisúak az un. CBF (core binding factor) leukémiák (ti. a CBF gént is érintő átrendeződéssel járó AML-k). A t(8;21)(q22,q22) átrendeződés kapcsán keletkező AML/ETO, újabban RUNX1-RUNX1T1 fúziós gén a CBFa-t, az inv(16) (p13.1;q22) inverzió illetve a t(16;16)(p13.1;q22) transzlokáció következtében létrejött CBFP-MYH11 a CBFp-t érinti. A CBFaés CBFp együtt a hemopoetikus precursorok normális differenciálódását biztosítja, átrendeződésük ezt gátolja. Hasonlóan jó prognózist jeleznek a normális karyotípusú betegek közül a NPM1 (nucleophosmin) pozitív és FLT3 (fms-szerű tirozin kináz 3) mutáció negatív, valamint a CEBPA (CCAAT/enhancer binding protein a) biallélikus gén mutációs esetek. A heveny myeloid leukaemia kuratív célú indukciós kezelés standardjának tekinthető un. "7+3" kezeléssel a betegek közel 80%-a komplett remisszióba jut és megfelelően magas dózisban alkalmazott cytarabin fenntartó terápiával több, mint 50%-uk meggyógyul. A komplett remissziós rátát további gyógyszerekkel (6-thioguanin, etoposid, stb) történő kombinálás, az anthracyclin típusa, az alkalmazott két szer dózisának emelése, a kezelés megnyújtása, hemopoetikus növekedési faktorok adása nem emeli és a p-glycoprotein közvetítette rezisztencia gátlása sem befolyásolja. A CBF leukémiák c-KIT pozitív eseteiben gentuzumab ozogamycin adás, normál karyotípusú NPM+, FLT3- leukémiákban ATRA-val kombinált kezelés jótékony hatású. A cytarabin-t folyamatos infúzióban szokás adni, de több centrumban a napi dózist 2x3 órás infúzióban alkalmazzák. A remissziót követő nagy adagú cytarabin rutinná vált. Ennek dózisa, ismétléseinek száma kérdéses, és jó eredményeket közöltek a HAM protokoll alkalmazásával (mitoxantronnal kombinált kezelés), illetve ennek dupla indukciós módosításával. Az utóbbi évek gyakorlata a kezelési fázisok határvonalait és az alkalmazott kezelések különbözőségeit némileg elmosta. Jó túlélési eredmények érhetők el a cytarabin vagy az anthracyclin standard dózisainál nagyobb adagban és már az indukciós fázisban történt alkalmazásával. A leukémia remissziójától illetve a csontvelő regenerációtól függően 3-4 intenzív kúra után a kezelés befejezhető, más szóval fenntartó terápia AML-ben nem szükséges.
A kezelési tapasztalatok azt mutatják, hogy az AML ezen csoportjában elért eredmények a kezelés intenzitásától, jelentős mértékben a cytarabin dózisától függnek. A jó eredmények és az allogén átültetés veszélyei miatt transzplantáció csak (korán) relabált, elsősorban t(8;21) transzlokációs betegeknél indokolt, de molekuláris remisszió esetén autológ átültetés is megfontolandó lehet.
3. Intermedier és rossz genetikájú betegek kezelése.
Intermedier prognózisú a normális citogenetikájú, de NPM- betegek csoportja, míg a numerikus és főleg a komplex transzlokációs esetek prognózisa rossz. Remissziós arányuk kevéssel vagy jóval alacsonyabb. Az intermedier csoport relapszus rátája magas, a rossz prognózisú csoportban sok a terápia rezisztens eset. Mivel egyelőre nincs bizonyítottan jobb kezelés, mint a standard 7+3, elsősorban az intermedier esetekben a kezelést eszerint kell kezdeni. Ha komplett remissziót sikerül indukálni és a beteg minden szempontból (donora is van) transzplantációra alkalmas, akkor a végleges gyógyulás esélyével allogén átültetéssel kezelendő. Terápia refrakteritás, vagy intenzív kezelésre alkalmatlan esetekben korán (akár már a második kemoterápiás ciklust követően) palliatív kezelésre történő áttérés javasolt. Hasonló gondolatmenet alapján 10% gyógyulást ígérő és a jó prognózisú leukémiák standard 7+3 kezelésénél költségesebb intenzív terápiája helyett palliatív vagy lehetőség esetén kísérleti vizsgálathoz csatlakozva új gyógyszerek alkalmazását próbálhatjuk meg. A célzott terápia eddigi lehetőségei (FLT3 ellenes TKI-k) nem, bizonyos esetekben az epigenetikus támadáspontú demetiláló szerek bizonyultak hatékonynak. Legígéretesebbnek a purin analóg clofarabin és kombinációi látszanak, melyek myelodysplasiából transzformálódó AML-ben és idősek kezelésében is hatékonyak lehetnek.
4. Idős betegek AML-je
Az AML beteg gyógyíthatóságát döntő mértékben a beteg kora, általános állapota és a betegség genetikája befolyásolja. A beteg kora és az általános állapota az un. korai halál fő prediktora. Az 55-65 évesnél idősebbek rosszabbul viselik a standard és a nagy dózisú kemoterápiát, betegségük legtöbb esetben rezisztensebb, csontvelői és egyéb szervi tartalékjuk kisebb és egyéb betegség fennállása is gyakoribb. 65 évesnél idősebb, rossz általános állapotú betegnek palliativ kezelést javasoljunk. 65 évesnél fiatalabb, többször idősebb betegeknek is, ha fizikai állapotuk jó kuratív kezeléssel történő próbálkozást tanácsolhatunk. Előnytelen genetika esetén standard terápiától remisszió nem várható, ilyenkor új próbálkozások alkalmazásának (klinikai vizsgálatok) van jogosultságuk.
5. Csontvelő/őssejt transzplantáció
A postremissziós kezelés egyik lehetősége az őssejt átültetés, mely a betegek kora és a donorok hiánya miatt az esetek csak kisebb részében jön szóba. Intenzív kezelésben részesült jó prognózísú esetekben az allogén átültetés nem eredményesebb és azoknál több szövődménnyel járó volta miatt csak relapszus esetén javasolt. Rossz prognózisú akut myeloid vagy lymphoid leukémia első komplett remissziójában, illetve korai relapszusban indikált. Az őssejt átültetés és a kemoterápia is mindig egyéni megfontolást és számos további szempont (a remisszióba kerülés körülményei, szövődményei, pszichés status stb.) figyelembevételét, valamint a beteg együttműködését igényli.
6. Relabált beteg kezelése
A korai relapszus a rezisztenciával rokon állapot, gyógyszeres kezelése legtöbbször eredménytelen. Szerencsés esetben átültetéssel a betegek egy része meggyógyítható. Minél későbbi a relapsus, annál több beteg kerül tartós remisszióba a kellő időzítésű és dózisú protokollok alkalmazásával. Ritkán látunk inverziót: hosszabb második, mint első remissziót. Ezért a rezisztens és a relabált betegek kezelése új terápiás megközelítést (monoclonalis antitestek alkalmazása, jel átvitelt befolyásoló szerek, redukált intenzitású kondicionálással végzett transzplantáció, MUD) igényel.
7. Kiegészítő kezelések
A heveny leukémiás betegek gyógyításának utóbbi évtizedekben tapasztalt eredményesebb volta az agresszivebb citosztatikus kemoterápia és legalább ilyen mértékben a megfelelő hemoterápia (transzfúziós) és antimikrobás kezelések következménye. A thrombocyta transzfúziók bevezetése után röviddel a vérzések következtében bekövetkezett halálesetek aránya 67%-ról 37%-ra csökkent, mára biztosan 10%-nál kevesebb. Az infekciók aplasia idején észlelt súlyossága miatt hatékony antibiotikus ill. antifungális lehetőségek birtokában egyre több beteg jut remisszióba, hiányuk esetén a beteg kezelése kontraindikált. Kezdetben nagy reményt keltő kiegészítő kezelésekkel kapcsolatban meg kell említeni a hemopoetikus növekedési faktorokat, melyek egyes esetekben jótékony hatásúak, de alkalmazásuk mikéntjétől függetlenül nem nyújtják meg a betegek túlélését. A természetes eredetű citosztatikumokkal (anthracyclinek, mitoxantron, vinca alkaloidák) szemben kialakuló vagy eleve meglévő rezisztenciát megszüntető szerektől különösen idős betegeknél vártuk a kezelés eredményeinek javulását, egyelőre hiába.
III/2. AZ AKUT LYMPHOID LEUKAEMIA KEZELÉSE
Az ALL indukciójának alap gyógyszerei a vincristin, az anthracyclinek, a szteroidok és sokszor az l-aszparagin. Az irodalomból ismert protokollok hasonlóak, és az alkalmazásukkal elérhető eredmények is közel azonosak. A betegek közel 90%-a ugyan hematológiai remisszióba kerül, de csak 25-40%-uk gyógyul meg. A gyógyulás esélye a beteg kora (>35, >60év), fehérvérsejt száma (B-ALL >30000, T-ALL >100000), LDH szintje (magas), a blastok immunfenotípusa (pro-B, korai és érett T) és genetikája /(Ph'+, t(8;14)/, valamint az első hónap végén észlelt remissziós státus (nincs CR) alapján prognosztizálható. (Zárójelben az előnytelen változók.). A korábban számos vizsgálattal igazolt prognosztikai jelek némileg vagy jelentősen változtak új szerek (TKI-k, rituximab, remélhetően a clofarabin, nelarabin alkalmazásának), új megközelítések (serdülők és fiatal felnőttek kezelése, SCT) és a kezelés eredményének pontosabb detektálásának köszönhetően. Újabban a beteg kora és a kezelést követően mért betegség reziduum (MRD) kapják a fő hangsúlyt.
1. Az acut érett B-sejtes leukémia (FAB L3, Burkitt) kezelése
A felnőttkori ALL esetek kevesebb, mint 5%-a. Korábban a FAB klasszifikációban L3, Burkitt típusú ALL-nek mondott betegséget az új WHO klasszifikáció a Burkitt lymphoma leukémiás variánsaként tárgyalja. Az érett B-sejtes ALL-t a morfológiai ("mélyen" basophil, vacuolizált plazmájú blastok, sok osztódó sejt), immunfenotípus (CD19+, CD20+, CD22+, CD10+, BCL6+, CD38+), citogenetikai /t(8;14)(q24;q32)/ valamint molekuláris eltérések (MYC) kivételesen észlelhető egybeesése jellemzi. A kórképre gyors progresszió, gyakran splenomegalia és központi idegrendszeri propagáció jellemző. A felnőttkori ALL-ben szokatlanul magas (50-60%-os) gyógyulás alkilező szer és szteroid előkezelés után korán alkalmazott nagy adagú alkilező (cyclophosphamid vagy ifosphamid) és nagy adagú methotrexat és cytarabin "sűrün" ismételt alternáló adásának köszönhető. Központi idegrendszeri profilaxis kötelező, a koponya irradiáció szükségességéről a vélemények megoszlanak, magas kockázat esetén ajánlott. A nehezen befolyásolható relapszus előfordulása a leukocytosissal (>50000), anémiával és magas LDH-val induló esetekben, idős és rossz általános állapotú betegeknél gyakoribb. Ha a beteg az első hónap végére remisszióba kerül, akkor a hat hónapos kezelést nem kell fenntartó terápiának követnie és csak kivételesen észlelhető egy éven túli relapsus. Újabban rituximabbal kiegészített hyperCVAD kezeléstől az eredmények javulását tapasztalták.
2. (Éretlen sejtes) B-ALL kezelése
A Ph'+ esetekkel együtt számolva a felnőttkori ALL esetek 50%-a common ALL( CD10+). A különböző kutató csoportok ALL-ben alkalmazott minimálisan eltérő indukciós protokolljainak három bázis szere van: vincristin, valamely anthracyclin és szteroid hormon.. A választott anthracyclin (legtöbbször daunomycin, ritkábban idarubicin vagy doxorubicin) nem befolyásolja a kezelési eredményeket. A szteroidok közül több szerző a dexamethason prednisolonnál eredményesebb hatását hangsúlyozza. A negyedikként ALL specifikusnak mondható l-aszparaginázt mellékhatásai (hypersensitivitás, pancreatitis) miatt a felnőtt gyógyászatban (a kelleténél) ritkábban használjuk. A pegasparagináz tartósabb és hatékonyabb, megnyújtja a betegségmentes túlélést (a hyper-CVAD-dal kezelteknél nem) és mellékhatásai sem gyakoriak. CD20+ esetekben rituximab -miképpen érett sejtes esetekben is- javítja a kezelési eredményeket. Nemcsak a hyperCVAD-ban, sőt indukciós fázisban is cyclophosphamid adására is sor kerül.
A vincristint szokásosan hetente adunk. Legtöbben (mi is) a vincristin adásának napján, mások a cytostatikus kezelés 1., 2. és
3. napján adnak daunorubicint. Négy hétig per os alkalmazott Prednisolon fokozatosan kerül elhagyásra. Az 1-aszparagináz alkalmazására legáltalánosabban a kezelés 3. és 4. hetében kerül sor. Ha a perifériás vérképben nem látható blast, akkor az első napon, egyébként a leukémiás blastok eltűnése idején lumbal punctióval vizsgáljuk a liquort és alkalmazunk profilaktikusan methotrexátot. Ha a liquorban blastok vannak, illetve a postremissiós kezelési szakaszban az intrathecalis kezelést ara-C és dexamethason kiegészítéssel folytatjuk. Ha a beteg egy hónap után nem kerül remisszióba az indukciós kezelést nem vagy ritkán (legfeljebb 6 hétig) folytatják vincristinnel, inkább HAM kezelést vagy nagy adag methotrexátot (kortól függő dózisban és leukovorin rescue-val) szokás alkalmazni.
A kezelés indítása eltérhet a vázolttól. Nagy fehérvérsejt szám esetén a lymphoblastok tömeges szétesésétől tartva steroid és vincristin előfázis után alkalmazunk csak antraciklint, de sor kerülhet leukapheresisre is. Tumor lysis eshetősége miatt a beteg kellő hidrálása, allopurinol vagy rasburicase adása lehet indokolt. Rezisztens vagy relabált betegeknél átültetést kell javasolni, de kedvező eredmények érhetők el clofarabin tartalmú kombinációkkal is. A betegek kezelése kapcsán két körülményre nagyon kell ügyelnünk. A nagy dózísban alkalmazott methotrexat indítását 48 órával követően leukovorint kell adni, valamint allopurinol alkalmazás esetén a 6-mercaptopurin dózisát harmadolni kell. Különös figyelmet kell fordítanunk a központi idegrendszeri és a fiataloknál gyakoribb here ALL időben történő felismerésére és kezelésére.
3. Philadelphia kromoszóma pozitív ALL kezelése
Legtöbbször common, máskor pre-B ALL. A felnőttkori ALL esetek >20%-a. Különösen időskorban gyakori (~40%). Molekulárisan 2/3-ukat minor (p190), l/3-ukat major (p210) típusú BCR/ABL átrendeződés jellemzi. Sokszor magas sejtszámmal, több esetben nyirokcsomó és mérsékelt lépnagyobbodással járó betegség.
Korábban a legreménytelenebb ALL volt: bár a beteg többsége (75%) komplett remisszióba jutott, de szinte törvényszerűen visszaestek és az allogén átültetésben részesültek is csak kb. harmada gyógyult meg, harmada visszaesett, és a transzplantációs mortalitás (TRM) is 30% körüli volt.
A standard ALL kezelés tirozinkináz gátlókkal (imatinibbel, a központi idegrendszerbe is átjutó dasatinibbel) történt kombinálása a remissziós rátát (~90% komplett hematológiai, ~50% molekuláris remisszió) és a progressziómentes túlélést is javította. "Híd" szerepet is betölthet: időt ad a végleges gyógyulást kínáló allogén átültetéshez alkalmas donorkereséshez és optimális esetben a beteg jó, transzplantációra alkalmas állapotát biztosítja.
A rossz általános állapotú és idős betegeket a standard indukciós kezelés veszélyei miatt csak tirozin kináz gátló (TKI) szerekkel, esetleg TKI és szteroid, és/vagy nem csontvelő toxikus szerek (vincristin, methotrexat, asparagináz, cytarabin) adásával kezelhetők.
4. T-ALL kezelése
Kezelésük alapjaiban nem különbözik az éretlen B-ALL terápiájától. Kiemelést a cortikális (CD1a+) ALL érdemel, mely a T-ALL 50%-a. Különösen a sokszor mediastinális nyirokcsomó nagyobbodással járó corticalis T-ALL kezelési eredményei jók. A betegek 80%-a komplett, 50%-uk tartós remisszióba jut. A jó eredmények a fenntartó kezelés során alkalmazott nagy dózisú cytarabin és cytoxan adással magyarázhatók. A relabált betegek kezelésében egy új purin analóg, a nelarabin bizonyult eredményesnek. Ennek első vonalban történő alkalmazásától és az anti-CD52 antitest kezeléstől várható további javulás. T-ALL-ben a Notch1 út jelentőségének felismerését remélhetően célzott terápia követi.
Fiatal felnőttek kezelése
A gyermek és felnőtt ALL-s betegek kezelésében elért jelentősen különböző eredmények nyomán több kutató csoport vizsgálta a gyermekkorban alkalmazott kezelések eredményességét felnőtt betegeknél, Ugyan az életkor előrehaladtával egyre kevésbé, de serdülőkön és a fiatalabb felnőtteknél akár 40 éves korig a túlélési adatok javulását észlelték. A gyermekeknél gyakrabban észlelt komplikációk közül neurológiai, endokrín zavarok illetve aseptikus csont necrosis ritkábban, thrombosis gyakrabban fordul elő.
Várandós asszonyok kezelése
A súlyos betegség és az agresszív kezelés anyai és magzati kockázatait mérlegelve kell döntést hoznunk. Az első trimesterben felismert betegségnél a kezelés magzatot károsító hatása nyilvánvaló, de a terhesség megszakítása (thrombocytopeniás, lázas beteg) is kockázatos. A szükségképpen nem halasztható kezelés gyakran a terhesség megszakadását eredményezi. Ritkán van lehetőség kevéssé genotoxikus (szteroid) szerek adására. Bár végig a beteg asszony meggyógyítása elsőrendű feladatunk, a második, de főleg a harmadik trimeszterben elkezdett kezelés a magzatot kevésbé veszélyezteti. Mindvégig helyes a szülésszel történő szoros együtt működés és ha sikerül a szülésig kezelni a beteget a szülés időpontjának, módjának megválasztását, a gyermekágyi és a gyermekkel kapcsolatos teendőket is közösen kell eldönteni.
Allogén őssejtátültetés
Angol szerzők minden B-ALL-s beteg transzplantációját javasolják. Megítélésem szerint a beteg műtétre alkalmas állapotán kívül az indukciós kezelés eredményessége alapján indokolt a jelentős mortalitással járó beavatkozást elfogadni és javasolni. Minimális reziduális betegség kimutathatatlansága esetén a relapsus veszély kisebb, mint a transzplantáció rizikója. Rezisztencia vagy molekuláris relapszus esetén kemoterápiától gyógyulás nem várható, a betegnek transzplantációt javasoljunk.
IV. Rehabilitáció - V. Gondozás
Célszerűen a betegek gondozása a kezelést végző hematológiai centrumokban vagy decentrumokban történjen. A kezeléséért, gondozásáért a szakrendelést végző hematológus, vagy klinikai onkológus szakorvos felelős. Az adott kezelést hematológus vagy onkológus szakorvos rendelheti el. Az ellenőrzések ajánlott intervalluma 2-4 hónap.
VI. Irodalomjegyzék
1. Advani AS, Hunger SP, Burnett AK.: Acute leukemia in adolescents and young adults. Semin Oncol 2009; 36: 213-226.
2. Bassan R, Spinelli O, Oldani E et al.: Improved risk classification for risk-specific therapy based on molecular study of minimal residual disease (MRD) in adult acute lymphoblastic leukemia (ALL). Blood. 2009; 113: 4153-4162
3. Bassan R, Hoelzer D.: Modern therapy of acute lymphoblastic leukemia J. Clin Oncol Epud 2011. jan 10.
4. Bishop JF, Mattews JP, Young GA et al: Intensified induction chemotherapy with high-dose cytarabine and etoposide for acute myeloid leukemia: a review and updated results of the Australian Leukemia Study Group. Leuk. Lymphoma (1998) 28: 315327.
5. Chelghoum Y, Vey N, Raffoux E et al.: Acute leukemia during pregnancy Cancer 2005; 104: 110-117.
6. Döhner H, Estey EH, Amadori S et al: Diagnosis and Management of acute myeloid leukemia in adults: recommendation from
an international expert panel, on behalf of the European LeukemiaNet Blood. 2010; 115: 453-474.
7. Büchner T, Hiddemann W, Wörmann B et al: Double induction strategy of high-dose cytarabine with mitoxantrone instead of standard-dose cytarabine with daunorubicine and 6-thioguanine: A randomized trial by the German AML Cooperative Group. Blood 1999. 93:4116-4124.
8. Faderl S, O'Brian S, Pui C-H et al.: Adult Acute Lymphoblastic Leukemia Cancer 2010. 116: 1165-1176.
9. Goekbuget N, Leguay T, Hunault M et al: First european chemotherapy schedule for elderly patients with acute lymphoblastic leukemia: promising remission rate and feasible moderate dose intensity consolidation Blood 2008; 112: 118
10. Fullmer A, O'Brien S, Kantarjian et al.: Novel therapies for relapsed acute lymphoblastic leukemia. Curr Hematol Malig Rep 2009; 4: 148-156
11. Goekbuget N, Brueggemann M, Arniold R.: New definition of treatment response in adult lymphoblastic leukemia (ALL): use of molecular markers for minimal residual disease (MRD) Blood. 2009; 114: 12 (90a)
12. Gökbuger N, Hoelzer D.: Treatment of acute lymphoblastic leukemia Sem Hematol. 2009; 46: 64-75.
13. Huguet F, Leguay T, Raffoux E et al: Pediatric-inspired therapy in adults with Philadelphia chromosome-negative acute lymphoblastic leukemia: the GRAALL-2003 study. J Clin Oncol. 2009; 27: 911-198.
14. Larson RA, Dodge RK, Burns CP et al: A five-drug remission induction regimen with intensive consolidation for adult with acute lymphoblastiv leukemia: Cancer and Leukemia Group B Study 8811. Blood 1995, 85: 2025-2037.
15. Lee HJ, Thompson JE, Wang ES et al.: Philadelphia chromosome-positive acute lymphoblastic leukemia: current treatment and future perspective Cancer Epud 2010. nov 8.
16. Mayer RJ, Davis RB, Schiffer CA et al: for CALGB: Intensive postremission chemotherapy in adults with acute myeloid leukemia. N Engl J Med 1994, 331: 896-906.
17. Rowe J.: Optimal management of adults with ALL. Brit J Haematol 2008; 144: 468-483.
18. Sanz MA, Grimwade D, Tallman MS et al: Management of acute promyelocytic leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. Blood. 2009; 113: 1875-1891.
19. Stock W, La M, Sanford B et al.: What determines the outcomes for adolescents and young adults with acute lymphoblastic leukemia treated on cooperative group protocols? A comparison of Children's Cancer Group and Cancer and Leukemia Group B studies. Blood 2008; 112: 1646-1654.
20. Swerdlow SH, Campo E, Harris NL et al: WHO classification of toumors of haematopoietic and lymphoid tissues IARC Lyon 2008.
21. Thomas DA, O'Brien S, Kantarjian HM: Monoclonal antibody therapy with rituximab for acute lymphoblastic leukemia. Hematol Oncol Clin N Amer 2009; 23: 949-971.
VII. Mellékletek
Akut myeloid leukémia kezelési protokolljai
Indukciós kezelések
| Acut promyelocytás leukémia | |||
| AIDA (M3) | |||
| ATRA (tretinoin) idarubicin) | 45 mg/m2po 12 mg/m2iv | naponta 2.4.6.8. napon | |
| Acut myeloid, nem promyelocytás leukémiák | |||
| "7+3" | idarubicin vagy daunorubicin cytarabin | 12 mg/m2/nap 45-60(-90) g/m2/nap 100-200 g/m2/nap folyamatos | 1-3. napon 1-3 napon 1-7. napon |
| ICE | idarubicin cytarabin etoposid | 12 mg/m2nap iv 100(-200) mg/m2/nap folyamatos infúzióban 100 mg/m2/nap | 1-3-5. napon 1-7. napon 1-7 nap |
| DAT vagy TAD | |||
| daunorubicin | 45 mg/m2/nap | 1-3 vagy az 5-7 napon | |
| cytarabin 6-thioguanin | 100-200 g/m2/nap folyamatos infúzióban 100/m2/nap po | 1-7. napon 1-7. napon | |
| Australian Leukemia Study Group (Bishop) | |||
| cytarabin daunorubicin etoposid | 3g/m2/nap 2-3 órás infusio 50 mg/m2/nap iv 50 mg/m2/nap iv | 1-3-5-7. napon 1-3 napon 1-7 napon | |
| Dupla indukció (Buchner, Hiddemann) | |||
| TAD | majd a 21. napon TAD vagy HAM | ||
| ETI (Ruutu, Finnország) | |||
| etoposid 6-thioguanin Idarubicin | 2x80 mg/nap po 2x100 mg/nap po 15 mg/nap po | 1-5. nap 1-5. nap 1-3 nap | |
| Konszolidációs kezelések | |||
| CALGB (Mayer) | cytarabin | 3 g/m2/nap 2-3 órás infusio | 1-3-5. napon |
| ALSG (Bishop) | |||
| cytarabin daunorubicin etoposid | 100 mg/m2/nap folyamatos infusio 50 mg/m2/nap iv 50 mg/m2/nap iv | 1-5 napon 1-2 napon 1-5 napon | |
| HAM (Büchner, Hiddemann) | |||
| cytarabin | 3 g/m2/ 3óra | 12 óránként 8x (1-4nap) | |
| mitoxantron | 10 mg/m2/30 perc | 3-5. nap | |
| Mentő kezelés | |||
| FLAG | |||
| fludarabin | 30 mg/m2/iv 3óra | 1-5. napon | |
| cytarabin | 2 g/m2/4óra a Fludara után | 1-5. napon | |
| G-CSF | |||
Az akut lymphoid leukémia kezelési protokolljai
| NCRI UK indukciós és korai intenzifikációs sémája | ||
| Első fázis 1-4. hét | ||
| daunorubicin | 60 mg/m2 iv | 1,8,15,22. napon |
| vincristin | 1,4 mg/m2 iv | 1,8,15,22. napon |
| dexamethason | 10 mg/m2 | po1-5 és 11-14. napon |
| pegasparagináse | 2000 U/m2 iv | 2. és 16. napon |
| methotrexat | 12,5 mg it | 14. napon |
| Második fázis 5-8.hét | ||
| cyclophosphamid | 650 mg/m2 iv | 1.15.29. napon |
| cytarabin | 75 mg/m2 iv | 6-9, 13-16, 20-23, 27-30. napon |
| 6-mercaptopurin | 6 mg/m2po | 1-30. napon |
| methotrexat | 12,5 mg it | 1,8,15,22. napon |
| Intenzifikáció/KIR profilaxis | ||
| methotrexat | 3 g/m2 iv | 1,8. napon |
| pegasparagináz | 2000 U/m2 iv | a 2. napon |
| Az ALL cytostatikus kezelése (CALGB) | ||
| Indukció (4 hét) | ||
| cytoxan | 1200 mg/m2 iv | 1. napon |
| daunorubicin | 45 mg/m2 iv | 1-3. napon |
| vincristin | 2 mg iv | 1.8.15.22. nap |
| prednisolon | 60 mg/m2/die po vagy iv | 1-21 napon |
| L-asparaginase | 6000 E/m2 sc | 5.8.11.15.18.22. napon. |
| Korai intenzifikáció (4 hét, egyszer ismétlendő) | ||
| methotrexat | 15 mg it | 1. napon |
| cytoxan | 1000 mg/m2 iv | 1. napon |
| 6-mercaptopurin | 60 mg/m2po | 1-14 napon |
| cytarabin | 75 mg/m2 | 1-4. 8-11. napon |
| vincristin | 2 mg iv | 15.22. napon |
| L-asparaginase | 6000 IU/m2 sc | 15.18.22. 25. napon. |
| Központi idegrendszeri prophylaxis és közti fenntartó therápia (12 hét) | ||
| Koponya besugárzás | 2,400 cGy | 1-12- nap |
| methotrexat | 15 mg IT | 1.8.15.22.29.nap |
| 6-mercaptopurin | 60 mg/m2po | 1-70 napon |
| methotrexat | 20 mg/m2po | 36. 43.50.57.64. napon |
| (Kivéve, ha a beteg occult betegség miatt kapott kezelést az első fázisban) | ||
| Késői intenzifikáció (8hét) | ||
| doxorubicin | 30 mg/m2 iv | 1.8.15.napon |
| vincristin | 2 mg iv | 1.8.15.napon |
| dexamethason | 10 mg/m2 o | 1-14. napon |
| cytoxan | 1000 mg/m2 iv | 29. napon |
| 6-thioguanin | 60 mg/m2po | 29-42 napon |
| cytarabin | 75 mg/m2 sc | 29.32.36-39 napon |
| Fenntartó kezelés | ||
| vincristin | 2 mg iv | minden 4. héten |
| prednisolon | 60 mg/m2po | minden 4. héten 1-5 napig |
| 6-mercaptopurin | 80 mg/m2 po | 1-28 napig |
| methotrexat | 20 mg/m2 po | 1. 8. 15. 22. napon |
Az indukció eredményességétől, az esetleges komplikációktól és egyes altípusoktól függően a további kezelések (intenzifikáció/konszolidáció) eltérően alakulnak, majd 2 évig tartó fenntartó methotrexat (L01BA01) /6-mercaptopurin kezelés következik.
Az ALL cytostatikus kezelése (ECOG E2993/MRC UKALL XII)
| Indukció | ||
| Első fázis (1-4 hét) | ||
| daunorubicin | 60 mg/m2 iv | 1.8.15.22. nap |
| vincristin | 1,4 mg/m2 iv (max 2mg) | 1.8.15.22. nap |
| prednisolon po | 60 mg/m2 | 1-28 napon |
| L-asparaginase | 10000 E/m2 im | 17-28. napon |
| vagy iv (fél óra alatt | ||
| 100ml 5%-os cukorban) | ||
| methotrexat | 12,5 mg it | 15. napon |
| (Ha KIR leukaemia igazolható, akkor hetente MTX it, amig a liquor nem negatív, majd 24cG koponya | ||
| és 12 gerincvelő irradiáció a második fázis alatt.) | ||
| Második fázis (8 hét) | ||
| cyclophosphamid | 650 mg/m2 iv 250ml | |
| normál sóban fél óra alatt | 1. 5. 29. napon | |
| cytarabin | 75 mg/m2 iv fél óra alatt vagy sc | 31-34, 38-41, 45-48, 52-55. nap |
| 6-mercaptopurin | 60 mg/m2po | 29-57 napon |
| methotrexat | 12,5 mg IT | 1.8.15.22. nap |
| (Kivéve, ha a beteg occult betegség miatt kapott kezelést az első fázisban) | ||
| Intenzifikáció (12-16. hét, 4 héttel a második fázis 28. napja után, ha a fvs >3000 | ||
| HD- methotrexat | 3 g/m2 iv két óra alatt 500ml normál sóban 1.8.22. napon | |
| L-asparaginase | 10000 E/m2 im vagy iv (fél óra alatt) | 17-28. napon |
| leukovorin | 10 mg/m2 iv a MTX befejezése után 22 órával 6 óránként 4x | |
| 50 ml 5%-os cukorban | ||
| majd 10 mg/m2 po | 6 óránként 8x | |
| Konszolidáció (intenzifikációt követően, amikor fvs>3000, thrombocyta>100000) | ||
| 1 ciklus | ||
| cytarabin | 75 mg/m2 iv fél óra | |
| alatt 500 ml 5%-os cukorban | 1-5. napon | |
| etoposid | 100 mg/m2 iv 500 ml normál sóban egy óra alatt | 1-5. napon |
| vincristin | 1,4 mg/m2 iv (max 2mg) | 1.8.15.22. nap |
| dexamethason | 10 mg/m2 po | 1-28 napon |
| 2. ciklus (az 1. ciklus 28. napjától, ha a fvs >3000") | ||
| cytarabin | 75 mg/m2 iv fél óra alatt 500 ml 5%-os cukorban | 1-5. napon |
| etoposid | 100 mg/m2 iv 500 ml normál sóban egy óra alatt | 1-5. napon |
| 3. ciklus (az 2. ciklus 28. napjától, ha a fvs >3000") | ||
| daunorubicin | 25 mg/m2 iv | 1.8.15.22.nap |
| cytoxan | 650 mg/m2 iv 250 ml normál sóban fél óra alatt | 29. napon |
| cytarabin | 75 mg/m2 iv fél óra alatt | 31-34,38-41 nap |
| 6-thioguanin | 60 mg/m2po | 29-42 napon |
| 4. ciklus (az 3. ciklus 56. napjától, ha a fvs >3000') | ||
| cytarabin | 75 mg/m2 iv fél óra alatt 500 ml 5%-os cukorban | 1-5. napon |
| etoposid | 100 mg/m2 iv 500ml normál sóban egy óra alatt | 1-5. napon |
| Fenntartó kezelés (az intenzifikáció kezdetétől két és fél éven át) | ||
| vincristin | 1,4 mg/m2 iv (max 2mg) | minden 3. hónapban |
| prednisolon | 60 mg/m2po | minden 3. hónapban |
| 5 napig | ||
| 6-mercaptopurin | 75 mg/m2 po | naponta |
| methotrexat | 20 mg/m2 po vagy iv | hetente |
| interferon-a Ph'+ betegeknek | 3x3 ME sc/hét | 15 hónapig |
| (nem kötelező) | ||
Hyper-CVAD kezelési sémája (MDACC)
| 1 naptól | ||
| cyclophosphamid | 300 mg/m2 iv 3 óra alatt 12 óránként | 1-3 napon |
| doxorubicin | 25 mg/m2 folyamatos infúzióban | |
| 48 óráig 12 órával a CPM után kezdve | 4-5. napon | |
| vincristin | 1,4 mg/m2 max. 2mg iv | 4. 11. napon |
| dexamethason | 40 mg/m2 po | 1-4, 11-14. napon |
| 21. naptól. | ||
| methotrexat | 1 g/m2 folyamatos infúzióban 24 órán át | 1. napon |
| cytarabin) | 3 g/m2 iv. 2 órán át 12 óránként négyszer | 2-3. napon |
| leukovorin | 50 mg/m2 po a MTX befejezésekor | |
| 25 mg/m2 po 6 óránként | 48 órán át. |
Serdülőknek és fiatal felnőtteknek ajánlható CCG kezelési sémája
| Indukció | ||
| vincristin iv | 1,5 mg/m2 | 1.8.15.22. napon |
| daunomycin iv | 25 mg/m2 | 1.8.15.22. napon |
| prednisolon po | 60 mg/m2 | 1-28. napon |
| L-aszparagináz im | 6000 lU/m | 2 hetente 3x |
| összesen 9 alkalommal | ||
| cytarabin it | a 0. napon | |
| methotrexat it | a 14. napon, |
| Konszolidáció 5 hét | ||
| prednisolon | 7.5 mg/m2 | 0. napon, |
| 3.75 mg/m2, | ||
| az 1. és 2. napon | ||
| cyclophosphamid iv | 1000 mg/m2 | 0, 14. napon |
| 6-mercaptopurin po | 60 mg/m2 | 0-27. napon |
| vincristin iv | 1.5 mg/m2 | 14, 21, 42, 49. napon |
| cytarabin iv | 75 mg/m2 | 1-4, 8-11, 15-18, |
| 22-25 napokon | ||
| methotrexat it* | 12 mg | 1, 8, |
| 15, 22 napon, | ||
| ha a 0. napon | ||
| nem volt KIR ALL | ||
| koponya irradiado' | 1800 cGy 10 frakcióban, ha indulásnál nem volt KIR ALL | |
| 2400 cGy 12 frakcióban, ha az indulásnál KIR leukémia volt | ||
| gerinc irradiáció | 600 cGy 3 frakcióban, ha az indulásnál KIR leukémia volt | |
| (here irradiáció | 2400 cGray 8 frakcióban az intenzifikált séma szerint, ha a here > volt) | |
| Köztes fenntartó fázis 8 hét | ||
| 6-mercaptopurin po | 60 mg/m2 | 0-41 napokon |
| methotrexat po | 15 mg/m2 | 0, 7, 14, 21, 28, 35 |
| napokon | ||
| Késői intezifikáció 7 hét | ||
| Reindukció 4 hét | ||
| dexamethason po | 10 mg/m2 | 0-20 napokon, |
| majd 7 napig | ||
| csökkentve, | ||
| vincristin iv | 1.5 mg/m2 | 0,14, 21 napon |
| doxorubicin iv | 5 mg/m2 | 0, 7, 14 napon |
| Rekonszolidáció 3 hét | ||
| L- aszparagináz im | 6000 IU/m2 | 3, 5, 7, 10, |
| 12, 14. napokon | ||
| vincristin iv | 1.5 mg/m2 | 42, 29 napokon |
| cyclophosphamid iv | 1000 mg/m2 | 28. napon |
| 6-thioguanine po | 60 mg/m2 | 28-41. napokon |
| cytarabine sc vagy iv | 75 mg/m2 | 29-32, |
| 36-39 napokon | ||
| methotrexate it* | 12 mg, | 29, 36. napokon |
| Fenntartó kezelés, 12 hét | ||
| vincristin iv | 1.5 mg/m2 | 0, 28, 56 napokon |
| prednisolon po | 40 mg/m2 | 0-4, 28-32, |
| 56-60 napokon | ||
| mercaptopurin po | 75 mg/m2 | 0-83 napokon |
| methotrexat po | 20 mg/m2 | 7, 14, 21, 28, 35, |
| 42, 49, 56, 63, 70, | ||
| 77 napokon | ||
| methotrexate it* | 12 mg, | 0. napon |
| A fenntartó kezelés a közti fenntartástól számítva lányoknál 2, fiúknál 3 évig tart. | ||
Serdülők és fiatal felnőtteknek ajánlható GRAALL-2003 protokoll
| Remisszió indukció | |||
| Pre-fázis | |||
| Prednisolon po | 60 mg/m2/nap | a -7.-től a -1. napig | |
| Methotrexat it | 15 mg | a 7 és -4. nap között. | |
| Indukció | |||
| Prednisolon po | 60 mg/m2/nap | az 1.-től 14. napig | |
| Daunorubicin iv | 50 mg/m2/nap | az 1., 2. és 3. napon | |
| 30 mg/m2/nap | 5. és a 16. napon | ||
| Vincristin iv | az 1., 8., 15., 22. napon | ||
| L-aszparagináz | 6000 U/m2/nap | a 8., 10, 12., 20., | |
| 22, 24., 26., | |||
| és 28. napon | |||
| Cyclophosphamid | 750 mg/m2 | az 1. napon | |
| az erre jól reagálóknak 750mg/m2 a 15. napon | |||
| a többieknek 500mg/m2/12óra a 15. és a 16. napon | |||
| Lenograstim | 150 ug/m2/nap | a 17. naptól | |
| a neutrophil | |||
| rendeződéséig | |||
| Salvage | |||
| ldarubicin | 12 mg/m2/nap | az 1-3. napokon | |
| Cytarabin | 2 g/m2/12óra | az 1-4. napokon | |
| Lenograstim | 150 ug/m2/nap | a 9. naptól | |
| az ANC emelkedéséig | |||
| Konszolidáció | |||
| 1, 2 és 7-es blokk | |||
| Cytarabin | 2 g/m2/12 h | az 1. és a 2. napon | |
| Dexamethason | 10 mg/12 óra | az 1. és a 2. napon | |
| L-aszparagináz* | 10,000 U/m2 | a 3. napon | |
| Lenograstim | 150 ug/m2/nap | a 7-13. napig2, 5 és 8- | |
| as blokk | |||
| Methotrexat | 3 g/m2 folyamatos infúzióban | a 15. napon | |
| Vincristin | 2 mg | a 15. napon | |
| L-aszparagináz* | 10,000 U/m2 | a 16. napon | |
| 6-mercaptopurin | 60 mg/m2/nap | 15-21. napokon | |
| Lenograstim | 150 ug/m2/nap | a 22-27.-ik napig | |
| 3, 6 és 9-es blokk | |||
| Cyclophosphamid | 500 mg/m2 | a 29. és 30. napon | |
| Etoposid | 75 mg/m2 | a 29. és 30. napon | |
| Methotrexat | 25 mg/m2 | a 29. napon | |
| Lenograstim | 150ug/m2/nap | a 31. naptól ANCt-ig | |
| Késői intenzifikáció a 6. és 7. konszolidációs blokk közt | |||
| Azoknak a betegeknek, akik az első indukcióra CR-ba kerültek | |||
| Prednisolon | 60 mg/m2/nap | az 1-14. napokon | |
| Vincristin | 2 mg | az 1., 8., and | |
| 15. napon | |||
| Daunorubicin | 30 mg/m2/nap | az 1-3. napokon | |
| L-aszparagináz* | 6,000 U/m2/nap | a 8., 10., 12., 18., | |
| 20., 22. napon | |||
| Cyclophosphamid | 500 mg/m2/12óra | a 15. napon | |
| Lenograstim | 150 ug/m2/nap | amíg a neutrophil | |
| szám 500 | |||
| Azoknak a betegeknek, akik a salvage kezelésre kerültek remisszióba | |||
| ldarubicin | 9 mg/m2/nap | az 1-3. napokon | |
| Cytarabin | 2 g/m2/12óra | az 1-4. napokon | |
| Lenograstim | 150 ug/m2/nap | a 9. naptól az ANCt-ig | |
| Fenntartó kezelés | |||
| Prednisolon | 40 mg/m2/nap | havonta az 1-7. napokon 12 hónapig | |
| Vincristin | 2 mg | havonta az 1. napon 12 hónapig | |
| Methotrexat | 25 mg/m2 po | hetente egyszer 2 évig | |
| 6-mercaptopurin | 60 mg/m2/nap | 2 évig | |
| CNS kezelés | |||
| Prophylaxis | |||
| It triplett: | |||
| Methortrexat | 15 mg | az indukció 1. és 8. napján | |
| Cytarabin | 40 mg | minden konszolidáció 29. napján | |
| Methylprednisolon | 40 mg | a késői indukció l. napján | |
| Koponya irradiáció | 18 Gy | a fenntartó kezelés előtt | |
| 6-mercaptopurin | 60 mg/m2 | az irradiáció alatt | |
| Központi idegrendszeri leukémia kezelésére | |||
| It triplett | Nyolcszor a -7. és +21. | nap között. | |
| Négyszer az első két konszolidációs blokk alatt. | |||
| Egyszer a 3. és 6. konszolidáció 29. napján. | |||
| Koponya irradiáció15 Gy | a SCT előtt | ||
| vagy 24 Gy a fenntartó kezelés előtt | |||
| 6-mercaptopurin | 60 mg/m2 /nap | az irradiáció alatt | |
Idős Philadelphia negatív ALL-s betegek kezelése (Gökbuget et al, EWALL 2008)
| Előfázis | ||
| dexamethason | ||
| ±cyclophosphamid | ||
| Indukció | ||
| Első fázis | ||
| idarubicin | 10 mg | 1-2. és 8-9. napon |
| vincristin | 1 mg iv | 1. és 8. napon |
| dexamethason | 10 mg/m2 po | 1-2 és 8-11. napon |
| Második fázis | ||
| cyclophosphamid | 500 mg/m2 iv | 15-17. napon |
| cytarabin | 60 mg/m2/nap iv | 16-19. |
| és 23-26. napon |
| Konszolidáció háromszor ismételve | ||
| Első fázis | ||
| methotrexat | 1000 mg/m2 | 1. napon |
| E.coli asparaginase | 10000 E/m2 | 2. napon |
| Második fázis | ||
| cytarabin | 1 g/m2 iv 12 óránként 3 óra alatt | 1., 3. és 5..napon |
| G-CSF | 5 ug/kg/nap sc | 7-16. napig |
| Fenntartó terápia: 2 évig | ||
| 6-mercaptopurin | ||
| +methotrexat | ||
| +időközönként | ||
| vincristin | ||
| +dexamethason | ||
| 70 évesnél idősebb betegeknél további dózis redukció |
A német ALL munkacsoport kezelési protokollja (2003, Hoelzer)
A standard és rossz prognózisú ALL kezelése /Hoelzer/
| Előfázis (nagy tumor tömeg ill. magas fvs szám esetén | ||
| cyclophosphamid | 200 mg/m2/nap iv | 3-5. napon |
| dexamethason | 10 mg/m2/nap po | l-5. napon po |
| Indukció | ||
| Első fázis | ||
| *daunorubicin | 45 mg/m2/nap iv | 6.7.13.14. napon |
| vincristin | 2 mg iv | 6.13.20. napon |
| **peg-aszparagináz | 10000 E/m2/nap iv | 20. napon. |
| dexamethason | 10 mg/m2/nap po | 6-7, 13-16. napon |
| G-CSF | 5 ug/kg/nap sc | 6. naptól |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| *55-65éveseknek daunorubicin:30mg/m2/nap iv | ||
| *55-65éveseknek peg-aszparagináz 5000E/m2/nap iv | ||
| Második fázis | ||
| cyclophosphamid | 1000 mg/m2/nap iv | 26. 46. napon |
| cytarabin | 75 mg/m2/nap iv | 28-31, 35-38, |
| 42-45 nap | ||
| 6-mercaptopurin | 60 mg/m2 /nap po | 26-46 napon |
| methotrexat | 15 mg intrathecalisan | 28., 35., 42. napon |
| KIR besugárzás | 2 Gy/nap (össz:24Gy) | 26-46. napon |
| Konszolidáció 1 | ||
| 13. héttől kezdődően | ||
| dexamethason | 10 mg/m2/nap po | l-5. napon po |
| vindesin | 3 mg/m2/nap iv | 1. napon |
| methotrexat | 1500 mg/m2 /nap iv 24 órán át | 1. napon |
| etoposid | 250 mg/m2 /nap iv | 4. és 5 napon |
| cytarabin | 2 g/m2/nap iv 12 óránként 3 óra alatt | 5. napon |
| G-CSF | 5 ug/kg/nap sc | 7-16. napig |
Konszolidáció 2
| 6-mercaptopurin | 60 mg/m2/nap po | 1-7,15-21.napon |
| methotrexat | 1500 mg/m2 /nap iv 24 órán át | 1 és 15. napon |
| peg-aszparagináz | 500 E/m2 iv | 2. és 16. napon. |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | 4 mg intrathecalisan | 1. napon |
Standard kockázatú betegek 1-2 reindukciója és 3-6. konszolidációja
| Reindukció 1 | ||
| doxorubicin | 50 mg/m2/nap iv | 1. és 7. napon |
| vindesin | 3 mg/m2/nap iv (max 5mg) | 1. és 7. napon |
| prednisolon | 3x20 mg/m2/nap po | 1-14. napon |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | ||
| intrathecalisan | 4 mg | 1. napon |
| Reindukció 2 | ||
| cyclophosphamid | 1000 mg/m2/nap iv | 15. napon |
| cytarabin | 75 mg/m2/nap iv | 17-20. |
| és 24-27. napon | ||
| thioguanin | 60 mg/m2/nap po | 15-28. napon |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | 4 mg intrathecalisan | 1. napon |
| Konszolidáció 3 | ||
| 6-mercaptopurin | 60 mg/m2/nap po | 1-7,15-21.napon |
| methotrexat | 1500 mg/m2 /nap iv 24 órán át | 1 és 15. napon |
| peg-aszparagináz | 500 E/m2 iv | 2. és16. napon. |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | 4 mg intrathecalisan | 1. napon |
| Konszolidáció 4 | ||
| cytarabin | 150 mg/m2/nap iv | 1-5. napon |
| teniposid | 100 mg/m2/nap iv | 1-5. napon |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | 4 mg intrathecalisan | 1. napon |
| Konszolidáció 5 | ||
| cyclophosphamid | 1000 mg/m2/nap iv 1 óra alatt | 1. napon |
| cytarabin | 150 mg/m2/nap iv 24 óra alatt | 1-5. napon |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | 4 mg intrathecalisan | 1. napon |
| Konszolidáció 6 | ||
| 6-mercaptopurin | 60 mg/m2/nap po | 1-7,15-21.napon |
| methotrexat | 1500 mg/m2 /nap iv 24 órán át | 1 és 15. napon |
| peg-aszparagináz | 500 E/m2 iv | 2. és 16. napon. |
| Fenntartó terápia | ||
| 6-mercaptopurin | 60 mg/m2/nap po | naponta |
| methotrexat | 20 mg/m2 /nap iv vagy po | hetente 1x |
Rossz prognózisú betegek konszolidációja
| T-ALL: CLAEG | ||
| cladribin | 0,2 mg/kg/nap iv | 1-5. napon |
| etoposid | 60 mg/m2 /nap iv | 1-5. napon |
| *cytarabin | 1500 mg/m2/nap iv | 1-5. napon |
| G-CSF | 5 ug/kg/nap sc | 6. naptól |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | 4 mg intrathecalisan | 1. napon |
| *55-65 éveseknek 1000mg/m2 cytarabin | ||
| Pre-B ALL: FLAG-Ida | ||
| *idarubicin | 10 mg/m2 /nap iv | 1-3. nap |
| fludarabin | 30 mg/m2 /nap iv | 1-5. napon |
| **cytarabin | 1500 mg/m2/nap iv | 1-5. napon |
| G-CSF | 5 ug/kg/nap sc | 7. naptól |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon |
| dexamethason | 4 mg intrathecalisan | 1. napon |
| *55-65 éveseknek 7 mg/m2 idarubicin | ||
| **55-65 éveseknek 1000 mg/m2 cytarabin |
Cancer and Leukemia Group B 8811 protokollja
In CALGB 19802, the basic treatment backbone was modified to introduce higher doses of daunorubicin, cytarabine, and systemic methotrexate. The changes in cumulative doses are reflected in Tables 4 and 5. Intenzív BFM protokoll
| Konszolidáció 9 hét | ||
| cyclophosphamid iv | 1000 mg/m2 | 0, 28 napon |
| cytarabin sc vagy iv | 75 mg/m2 | 1-4, 8-11, 29-32, |
| 36-39. napokon | ||
| 6-mercaptopurin po | 60 mg/m2 | 0-13, 28-41. napokon |
| vincristin iv | 1.5 mg/m2 | 14, 21, 42, 49. napokon |
| aszparagináz im | 6000 U/m2 | 14,16, 18, 21, 23, 25, 42, 44, |
| 46, 49, 51, 53 napon | ||
| methotrexate it* | 12 mg | 1, 8, 15, 22 napon |
| koponya irradiációt | 1800 cGy | |
| 2400 cGy, | ||
| erinc irradiáció | 600 cGy; | |
| here irradiáció | 2400 cGy |
| Köztes fenntartó fázis 8 hét | ||
| vincristin iv | 1.5 mg/m2 | 0, 10, 20, 30, |
| 40. napon | ||
| methotrexat iv | 100 mg/mg2 | 0, 10, 20, 30, 40. napon |
| (dózisonként 50 mg/m2-rel emelve) | ||
| aszparagináz im | 15 000 IU/m2 | 1, 11, 21, 31, 41 napon |
| Késői intezifikáció I. (8 hét) | ||
| Reindukció 4 hét | ||
| dexamethason po | 10 mg/m2 | 0-20nap, majd |
| 7 napig csökkentve | ||
| vincristin iv | 1.5 mg/m2 | 0, 14, 21. napon |
| doxorubicin iv | 25 mg/m2 | 0, 7, 14. napon |
| Rekonszolidáció 4 hét | ||
| L-aszparagináz im | 6000 IU /m2 | 3, 5, 7, 10, 12, |
| 14. napon | ||
| vincristin iv | 1.5 mg/m2 | 42, 49. napon |
| cyclophosphamid iv | 1000 mg/m2 | 28. napon |
| 6-thioguanin po | 60 mg/m2 | 28-41. napokon |
| cytarabin sc vagy iv | 75 mg/m2/nap | 29-32, 36-39. |
| napokon | ||
| methotrexate it* | 12 mg | 29, 36 napon |
| L-aszparagináz iv | 6000 IU/m2 | 42, 44, 46, 49, 51, |
| 53 napokon | ||
| Köztes fenntartó fázis 8hét | ||
| vincristin iv | 1.5 mg/m2 | 0, 10, 20, 30, |
| 40 napon | ||
| methotrexat iv | 100 mg/m2 | 0, 10, 20, 30, 40 napon |
| (dózisonként 50 mg/m2-rel emelve) | ||
| [SCAP]L[R]-asparaginase | 15 000 IU/m2 | 1, 11, 21, 31, |
| 41 napokon | ||
| methotrexate it* | 12 mg, | 0, 20, 40 napokon |
| Késői intenzifikáció II. 8 hét | ||
| Azonos a késői intenzifikáció I-gyel | ||
| Fenntartó kezelés 12 hét | ||
| vincristin iv | 1.5 mg/m2 | 0, 28, 56 napokon |
| prednisolon po | 60 mg/m2 | 0-14, 28-32, |
| 56-60 napokon | ||
| mercaptopurin po | 75 mg/m2 | 0-83 napokon |
| methotrexat po | 20 mg/m2 | 7, 14, 21, 28, 35, |
| 42, 49, 56, 63, 70, | ||
| 77 napokon | ||
| methotrexate it* | 12 mg, | a 0. napon |
| A rossz prognózisú ALL kezelése /Hoelzer/ | ||
| Indukció | ||
| Vincristin | 2 mg iv | 1.8.15.22. napon |
| prednisolon | 3x20 mg/m2 | 1-28 napon |
| daunorubicin | 45 mg/m2 iv (fél óra alatt iv) | 1.8.15.22. napon |
| L-asparaginase | 5000 E/m2 iv (fél óra alatt iv) | 16-28. napon. |
| methotrexat | 15 mg intrathecalisan | 1. napon |
| Konszolidáció | |||
| 5. héttől kezdődően | |||
| cytarabin | 2x3g/m2/nap | iv. (három óra alatt) | 1-4. napon |
| mitoxantron | 10 mg/m2/nap | iv. | 3-5. napon |
| 13. héttől | |||
| methotrexat | 1500 mg/m2 | iv. 24 órán át | 1. és 15. napon |
| L-asparaginase | 10000 E/m2 | iv (egy óra alatt) | 2. és16. napon. |
| 6-mercaptopurin | 25 mg/m2/nap | po | 1-5, 15-19. napon |
| 17. héten | |||
| cytoxan | 1000 mg/m2 | iv. | 1. napon |
| cytarabin | 500 mg/m2 | iv. 24 órán át | 1. napon |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon | |
| dexamethason | 4 mg intrathecalisan | 1. napon | |
| 17. héttől kezdődően | |||
| teniposid | 100 mg/m2 | iv egy óra alatt | 1-5. napon |
| cytarabin | 150 mg/m2 | iv egy óra alatt | 1-5. napon |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon | |
| dexamethason | 4 mg intrathecalisan | 1. napon | |
| 17. héttől kezdődően | |||
| Konszolidáció | |||
| 33. héten | |||
| cytoxan | 1000 mg/m2 | iv | 1. napon |
| cytarabin | 500 mg/m2 | iv 24 óra alatt | l. napon |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon | |
| dexamethason | 4 mg intrathecalisan | 1. napon | |
| 39. héttő | |||
| teniposid | 100 mg/m2 | iv egy óra alatt | 1-5. napon |
| cytarabin | 150 mg/m2 | iv egy óra alatt | 1-5. napon |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon | |
| dexamethason | 4 mg intrathecalisan | 1. napon | |
| 45. héten | |||
| cytoxan | 1000 mg/m2 | iv | 1. napon |
| cytarabin | 500 mg/m2 | iv 24 óra alatt | 1. napon |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon | |
| dexamethason | 4 mg intrathecalisan | 1. napon | |
| 51. héttől | |||
| teniposid (VM26) | 100 mg/m2 | iv egy óra alatt | 1-5. napon |
| cytarabin | 150 mg/m2 | iv egy óra alatt | 1-5. napon |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon |
| cytarabin | 40 mg intrathecalisan | 1. napon | |
| dexamethason | 4 mg intrathecalisan | 1. napon |
| Fenntartó kezelés | |||
| 29. héttől | |||
| 6-mercaptopurin | 60 mg/m2/nap | po | 2. év végéig, |
| methotrexat | 20 mg/m2 | po | hetente 1x 2. év végéig |
| a 6MP a HD-MTX+asp-ase alatt 25 mg/m2/napra csökkenthető és a MTX-t el kell hagyni a VM26+ara-C alatt a vérképtől függően szünetelhet a kezelés Ha van donor: átültetés a 11. héten, ha nincs csontvelő harvesting autológ átültetésre a 29. héten | |||
T-ALL kezelése /Hoelzer/
| Indukció | ||||
| Első fázis | ||||
| vincristin | mg iv | 1.8.15.22. napon | ||
| Prednisolon | 3x20 mg/m2 po | 1-28 napon | ||
| daunorubicin | 45 mg/m2 iv (fél óra alatt iv) | 1.8.15.22. napon | ||
| L-asparaginase | 5000 E/m2 iv (fél óra alatt iv) | 16-28. napon. | ||
| methotrexat | 15 mg intrathecalisan | 1. napon | ||
| Második fázis | ||||
| cytoxan | 1000 mg/m2 | iv | 29. 43.57. napon | |
| cytarabin | 75 mg/m2 | iv egy óra alatt vagy sc | 31-34, 38-41, 45-48, | |
| 52-55. nap | ||||
| 6-mercaptopurin | 60 mg/m2 | po | 29-57 napon | |
| methotrexat | 15 mg intrathecalisan | 31. 38. 45. 52 napon | ||
| KIR irradiation 24Gy | ||||
| Konszolidáció | ||||
| 13. héttel kezdődően | ||||
| cytarabin | 2x1 g/m2/nap | iv. (három óra alatt) | 1-4. napon | |
| mitoxantron | 10 mg/m2/nap | iv. (fél óra alatt) | 3-5. napon | |
| 17. héttel kezdődően | ||||
| methotrexat | 1500 mg/m2 | iv. 24 órán át | 1. és 15. napon | |
| L-asparaginase | 10000 E/m2 | iv (egy óra alatt) | 2. és16. napon | |
| 6-mercaptopurin | 25 mg/m2/nap | po | 1-5, 15-19. napon | |
| 17. héten | ||||
| Cytoxan | 1000 mg/m2 | iv. | 1. napon | |
| Cytarabin | 500 mg/m2 | iv. 24 órán át | 1. napon | |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon | |
| cytarabin | 40 mg intrathecalisan | 1. napon | ||
| dexamethason | 4 mg intrathecalisan | 1. napon | ||
| Reindukció | ||||
| 21. héttől kezdődően | ||||
| Első fázis | ||||
| vincristin | 2 mg | iv | 1.8.15.22. napon | |
| doxorubicin | 25 mg/m2 | iv (fél óra alatt iv) | 1.8.15.22. napon | |
| prednisolon | 3x20 mg/m2 | po | 1-28 napon | |
| Második fázis | ||||
| Cytoxan | 1000 mg/m2 | iv | 29. napon | |
| cytarabin | 75 mg/m2 | iv egy óra alatt vagy sc | 31-34, 38-41 nap | |
| 6-thioguanin | 60 mg/m2 | po | 29-43 napon | |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 29. napon | |
| cytarabin | 40 mg intrathecalisan | 29. napon | ||
| dexamethason | 4 mg intrathecalisan | 29. napon | ||
| 17. héttől kezdődően | ||||
| teniposid (VM26) | 100 mg/m2 iv egy óra alatt | 1-5. napon | ||
| cytarabin | 150 mg/m2 iv egy óra alatt | 1-5. napon | ||
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon | |
| cytarabin | 40 mg intrathecalisan | 1. napon | ||
| dexamethason | 4 mg intrathecalisan | 1. napon | ||
| Konszolidáció | ||||
| 33. héttől | ||||
| cytarabin | 2x3 g/m2/nap | iv. (három óra alatt) | 1-4. napon | |
| mitoxantron | 10 mg/m2/nap | iv. | 3-5. napon | |
| 39. héttől | ||||
| methotrexat | 1500 mg/m2 | iv 24 órán át | 1. és 15. napon | |
| L-asparaginase | 10000 E/m2 | iv (egy óra alatt) | 2. és16. napon. | |
| 39. héttől | ||||
| teniposid (VM26) | 100 mg/m2 | iv egy óra alatt | 1-5. napon | |
| cytarabin | 150 mg/m2 | iv egy óra alatt | 1-5. napon | |
| 45. héten | ||||
| cytoxan | 1000 mg/m2 | iv | 1. napon | |
| cytarabin | 500 mg/m2 | iv 24 óra alatt | 1. napon | |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon | |
| cytarabin | 40 mg intrathecalisan | 1. napon | ||
| dexamethason | 4 mg intrathecalisan | 1. napon | ||
| 51. héttől | ||||
| teniposid (VM26) | 100 mg/m2 | iv egy óra alatt | 1-5. napon | |
| cytarabin | 150 mg/m2 | iv egy óra alatt | 1-5. napon | |
| KIR profilaxis | methotrexat | 15 mg intrathecalisan | 1. napon | |
| cytarabin | 40 mg intrathecalisan | 1. napon | ||
| dexamethason | 4 mg intrathecalisan | 1. napon | ||
| Fenntartó kezelés | ||||
| 29. héttől | ||||
| 6-mercaptopurin | 60 mg/m2/nap | po | 2. év végéig, | |
| Methotrexat | 20 mg/m2 | po | hetente | |
| 1x 2. év végéig | ||||
| a 6MP a HD-MTX+asp-ase alatt 25mg/m2/napra csökkenthető és a MTX-t el kell hagyni | ||||
| a VM26+ara-C alatt a vérképtől függően szünetelhet a kezelés | ||||
KRÓNIKUS MYELOID LEUKÉMIA
I. Alapvető megfontolások
Definíció
A krónikus myeloid leukémia (CML) olyan klonális myeloproliferativ betegség, amelyben a hemopoetikus őssejt malignus transzformációja következik be. A kiváltásában a 9 és a 22-es kromoszóma hosszú karjai közötti reciprok transzlokációból származó BCR-ABL fúziós gén által eredményezett konstitutívan aktivált tirozinkináz áll. CML-nek tehát csak az a betegség nevezhető, ahol a transzlokáció eredményeként létrejött Philadelphia (Ph) kromoszóma vagy a BCR-ABL fúziós gén kimutatható.
Epidemiológia
Incidencia: 1,06-1,1/100000 lakos/év. Prevalencia: ennek kb. 4 szerese, amelynek a meredek emelkedése várható a kezelési eredmények javulásával (túlélés hosszabbodás). Életkor: középkortól felfelé előfordulása gyakoribb (a betegek kb. egy negyede 60 év feletti), gyerekkorban csak kivételesen fordul elő. Nem: valamivel (1,2-1,3-szor) több a férfi mint a női beteg.
Klinikai tünetek
A betegség természetes lefolyása három szakaszból áll, és a klinikai tüneteket ezen szakaszok határozzák meg. A krónikus fázisban a betegek 30-40%-a tünetmentes vagy tünetszegény. Enyhe általános tünetek, mint fáradékonyság, kis fokú fogyás és/vagy étvágytalanság jelentkezhetnek. 30-80%-ban észlelhető különböző mértékű splenomegália, amely bal bordaív alatti fájdalmat okozhat. Hepatomegalia ritkább és kevésbé kifejezett. A nagyon magas fehérvérsejt(fvs) szám esetén (2-300ezer felett) hyperviszkozitás tünetei is jelentkezhetnek. Akcelerált fázisban jellemzőek a láz, éjszakai izzadás, fogyás és progresszív splenomegália. Gyakori a mérsékelt anaemia. A blasztos fázis morfológiailag hasonlít az akut leukémiához, és a fenti tünetek mellett a betegen az akut leukémiára jellemző granulo- és thrombocytopéniára visszavezethető infekciós és vérzéses jelek is fellépnek.
A CML-t az esetek 85%-ában a krónikus fázisban ismerik fel.
II. Diagnózis
Laboratóriumi diagnózis
Citogenetikai és molekuláris genetikai eltérések - Diagnosztikus kritérium
A konvencionális citogenetikával a Philadelphia (Ph) kromoszóma, a fluorescens in situ hibridizációval (FISH) illetve a reverz transzkriptáz polimeráz láncreakcióval (RT-PCR) a BCR-ABL fúziós gén jelenléte igazolható.
Differenciáldiagnózis
Az egyéb idült myeloproliferatív betegségektől a Ph kromoszóma ill. a BCR-ABL fúziós gén jelenléte biztosítja az elkülönítést. Ezek kimutatása diagnosztikus értékű A főleg idős korban gyakori Ph pozitív akut lymphoid leukémiától (ALL) az anamnézis a kórlefolyás és az eltérő molekulatömegű ( ALL-ben 190, a CML-ben 210, a ritka neutrofil leukémiában 230 dalton) BCR-ABL fúziós fehérje különíti el.
A betegség stádiumai
A stádium megállapítása a WHO szakértői által megalkotott fázis besorolás szerint történik:
1. táblázat. A CML akcelerált és blasztos fázisának kritériumai.
Akcelerált fázis:
- Blaszt 10-19% csontvelőben vagy periférián
- Periférián több mint 20% bazofil
- Terápiától független és/v. terápiára nem reagáló thrombocytopenia (<100x109/L) vagy thrombocytosis (>1000x109/L)
- Terápiára nem reagáló perzisztáló vagy emelkedő fehérvérsejt szám és/vagy perzisztló vagy fokozódó splenomegália
- Klonális citogenetikai evolució
Morfológiailag ebben a stádiumban a csontvelő hypercellulárisabb, néha myelodyspláziás vonásokkal. Retikulin vagy kollagén fibrózis jelenléte az akcelerált fázist valószínűsíti .
Blasztos fázis:
- Legalább 20% blaszt a periférián vagy a csontvelőben
- Extramedulláris blasztos proliferáció
Morfológiailag az esetek kb. 70%-ában a blasztok myeloid typusúak, a többi esetben lymphoidok. Cytokémiai és immunfenotípus analyzis szükséges a blasztos fázis típusának megállapításához, gyakori a myeloid és lymhoid sejtfelszini antigének koexpressziója.
III. Kezelés
Általános elvek
A kezelés elsődleges célja: teljes gyógyulás, teljes citogenetikai remisszió, szignifikáns molekuláris válasz. Másodlagos célok: hematológiai és citogenetikai válasz, tünetmentesség, progresszió megakadályozása.
A kezelést a diagnózis felállításakor azonnal meg kell kezdeni. Minél rövidebb idő óta áll fenn a betegség, annál nagyobb a valószínűsége, hogy a beteg rendelkezik még kellő mennyiségű normális hemopoetikus őssejttel. Ez biztosítja azt, hogy a kóros őssejt visszaszorítására szolgáló kezelés után a csontvelő megteljék normális hemopoetikus progenitorokkal.
A CML kezelésében a leghatékonyabb gyógyszerek a tirozinkinázgátló szerek csoportjában tartoznak. Az elsőként alkalmazott tirozinkinázgátló Imatinibnek (Glivec) a CML korábbi standard kezelésével (interferon+Ara-C) történt összehasonlító, több éves után-követéses vizsgálata bebizonyította, hogy a Glivec szignifikánsan hatásosabb mind az össztúlélés mind a progressziómentes túlélés tekintetében.
A kezelési stratégiát némiképpen módosítja a betegségnek a diagnózis idején észlelt fázisa. A kezelési stratégiához szükséges a terápiás válasz illetve fokozatainak nyomon követése (2. és 3. táblázat). A jó (optimális) terápiás választ mutató betegeknél szignifikánsan jobb túlélésre lehet számítani, és a terápiás válasz mélysége fordítottan arányos a betegség progressziójának kockázatával.
Kezelésre adott válasz és azok értékelése
2. táblázat. Krónikus myeloid leukémia kezelésére adott válasz
| Komplett hematológiai válasz (CHR, minden paraméter együttesen kell jelen lennie) |
| Thrombocytaszám: <450,000/microL |
| Fvs. <10,000/microL |
| Quali: nincsenek éretlen granulocyták, basofil:<5% |
| Lép nem tapintható |
| Cytogenetikai válasz (CyR) |
| Nincs válasz: Ph+ sejtek száma >95% |
| Minimális válasz: Ph+ sejtek száma 66-95% közötti |
| Minor válasz: Ph+ sejtek száma 36-65% közötti |
| Parciális válasz: Ph+ sejtek száma 1-35% közötti |
| Komplett válasz: Ph+ sejtek száma 0% |
| Molekuláris válasz (MoR) |
| Komplett válasz: BCR-ABL negatív |
| Major válasz: Standardhoz képest legalább három log redukció |
3. táblázat.
A lehetséges terápiás válaszok értékelése a krónikus myeloid leukémia kezelése során (az Európai LeukemiaNet ajánlása alapján)
| Diagnózis megállapításától eltelt idő | Célkitűzés (optimális válasz) | Szuboptimális válasz | Kudarc |
| 3 hónap | komplett hematológiai remisszió (CR) és Ph+<65% | Ph+ >95% | nincs komplett hematológiai remisszió |
| 6 hónap | Ph+ < 35% | Ph+> 35% | Ph+>95% |
| 12 hónap | komplett cytogenetikai válasz (CCR) | Ph+ 1-35% | Ph+ >35% |
| 18 hónap | major molekuláris válasz (MMR) | <MMR | <CCR |
| 18 hónap után bármikor | Állandó vagy javuló MMR | Nincs MMR vagy imatinib érzékeny mutáció van jelen | a hematológiai vagy citogenetikai remisszió elveszítése, abnormális citogenetikai eltérés Ph+ sejtben |
Kezelés krónikus fázisban Első vonalbeli kezelés
- Jelenleg javasolt és finanszírozott standard kezelés: Imatinib 400mg
(Újonnan diagnosztizált CML-es betegek Nilotinib vagy Dasatinib kezelésével rövidebb idő alatt és nagyobb arányban érhető el komplett cytogenetikai válasz, valamint 3 log BCR/ABL kópiaszám csökkenés is. Ez a betegek progressziómentes túlélésében
egyértelmű előnyt jelent. Ezen adatok alapján az Egyesült Államokban majd Európában a két szert törzskönyvezték a CML elsővonalbeli szereként. Magyarországon a két szer első vonalban finanszírozással még nem rendelkezik)
A terápiás válasz értékeléséhez szükséges teendők és a kezelés további megválasztása
A gyógyszer elkezdése után a betegek fizikális statusát és vérképét sűrűbben (hetente, majd kéthetente, illetve havonta) követjük a hatás illetve az esetleges mellékhatások gondos megfigyelése céljából. Az első részletesebb ellenőrző pont 3 hónappal az imatinib kezelés megkezdése után szükséges, ekkorra betegünk optimális esetben teljes hematológiai remisszióban van.
Teendők 3 hónap imatinib kezelés után: Vizsgálatok:
- Fizikális vizsgálat
- Vérkép
- Csontvelői metafázis vizsgálat, (sikertelenség esetén FISH és RQ PCR) Kezelés:
- Optimális válasz esetén (CHR és Ph+<65%): a 400 mg imatinib folytatása
- Szuboptimalis válaszkor (ha CHR és Ph+>65% ): imatinib dózisemelés 600mg
- Terápiás kudarc alkalmával (ha nincs CHR): 2. generációs TKI.
Az IRIS vizsgálat adatai alapján ismert, hogy 6 hónappal az imatinib kezelés megkezdése után optimális esetben a Ph pozitív osztódások aránya kevesebb, mint 35%, az ennél rosszabb válasz túlélési szempontból kedvezőtlen jel.
Teendők a 6 hónapos imatinib kezelést követően:
Vizsgálat:
- Fizikális vizsgálat
- Vérkép
- Citogenetika (sikertelenség esetén FISH és RQ PCR)
Kezelés:
- Optimális válasz esetén (CHR, Ph+ < 35%): 400 mg imatinib folytatása
- Szuboptimalis válaszkor (Ph+ >35%): dózis emelés 600 mg imatinibre
- Terápiás kudarc alkalmával (Ph+>95%): 2. generációs TKI vagy allogén őssejtátültetés (HSCT)
12 hónappal a megkezdett imatinib kezelés után optimális esetben a beteg teljes citogenetikai remisszióba kerül.
12 hónapos kezelést követően az ajánlott teendők:
Vizsgálat:
- Fizikális vizsgálat
- Vérkép
- Citogenetika
- RQ-PCR- amint CCyR kialakult utána 3 havonta MMR-ig, majd 6 havonta Kezelés:
- Optimális válasz (CCyR): 400mg imatinib folytatása
- Szuboptimális válasz (Nincs CCyR de Ph+ < 35%: ): imatinib dózisemelés .
- Terápiás kudarc (Ph >35% ): 2. generációs TKI, vagy HSCT.
A 18. hónapra elért major molekuláris válasz (MMR) hosszabb progressziómentes túlélést biztosít.
18 hónapos imatinib terápiát követő feladatok:
Vizsgálat:
- Fizikális vizsgálat
- Vérkép
- Citogenetika (csak ha még nem volt CCyR )
- RQ-PCR
Kezelés:
- CCyR: imatinib folytatása
- Nincs CCyR: 2. generációs TKI vagy HSCT
- Nincs MMR : Imatinib dózis emelés
A kezelésnek a fentiekben jelzett bármely időpontjában észlelt terápiás kudarc esetén a terápia váltása előtt vizsgálni kell: 1. beteg compliance 2. gyógyszerkölcsönhatás (mindkettő értékeléséhez az imatinib vérszint megmérése nagy segítség) 3. mutáció analysis (T315I mutáció jelenléte esetén 2.gen. TKI nem adható. HSCT vagy klinikai vizsgálatba történő bevonás javallt.)
A jó terápiás válasz elvesztése és/vagy a betegség előrehaladottabb fázisba kerülése (progresszió) a betegség relapszusának tekintendő.
Vizsgálati teendők és kezelés relapsus esetén:
a) Terápiás válasz elvesztése
CHR megszűnése (2 mérés alapján):mutáció keresés, 2. generációs TKI, vagy HSCT CCyR megszűnése (2 mérés alapján):mutáció keresés:2. generációs TKI, vagy HSCT
MMolR megszűnése: Ha romlik a BCR-ABL szint, akkor a havonta ismételt RQ-PCR után 3 alkalommal észlelt emelkedő tendencia esetén: citogenetika, mutáció analízis szükséges. döntés eredmény szerint
A terápiás váltások eredményéről általában min. 3 hónap kezelési idő után lehet nyilatkozni, kivéve az esetleges hamarabb jelentkező nyilvánvaló hematológiai progressziót.
b) Kezelés alatt előrehaladottabb fázisba kerülés (progresszió)
Imatinib dózis 600/800mg-ra emelése. HSCT-re felkészülés: donorkeresés, rizikó felmérés.
Teendők imatinib intolerancia esetén Intolerancia fogalma
Intolerancia: általában MCyR nélküli betegeknél perzisztens 3-as vagy 4-es fokozatú mellékhatás, és/vagy a perzisztens 2-es fokozatú, imatinibbel összefüggő mellékhatás több mint 1 hónap időtartamú és több mint háromszor jelentkezik újra úgy, hogy imatinib redukció szükséges.
Krónikus fázisban: Imatinibbel összefüggő, 3-as, vagy magasabb fokozatú nem hematológiai toxicitás előfordulása, vagy bármilyen, imatinibbel összefüggő 4-es fázisú hematológiai toxicitás, ami 7 napnál tovább tart.
Előrehaladott CML fázisokban: Imatinib dózis csökkentésének szükségessége 400mg/nap alá, vagy imatinib adagolásának felfüggesztése gyógyszerrel összefüggő toxicitás miatt.
Terápiás teendő
A kezelés alatt bármikor jelentkező imatinib intolerancia miatt a 2.gen. TKI-ra kell váltani.
Második vonalbeli kezelés Gyógyszeres
Imatinib váltása 2. generációs TKI-ra: napi 2x400mg Nilotinib vagy 1x100mg Dasatinib.
Indikáció: I) Imatinib primer rezisztencia (terápiás kudarc), vagy relapszus (terápiás válasz elvesztése és/v progresszió) 2) imatinib intolerancia
Rezisztencia miatti TKI váltás esetén győződjünk meg, hogy nem_T315I mutáció -val állunk-e szemben, amely esetben minden jelenleg ismert TKI hatástalan.
Másod vonalbeli kezelésként melyik második generációs TKI választandó? Figyelembe veendő tényezők:
1. Kísérőbetegségek
2. Imatinib-rezisztens mutáció típusa
Nilotinib választandó: szívbetegség, COPD, hypertonia, autoimmun betegség, bizonyos imatinib-rezisztens mutációk (V299L, F317L, Q252H).
Dasatinib választandó: cukorbetegség, máj-pancreas eltérések, emelkedett serum bilirubin és/v. lipáz, pancreas betegség az anamnézisben, bizonyos imatinib-rezisztens mutációk (E255K/V,Y253H, F359C/V).
A második generációs TKI kezelésre adott terápiás válasz kritériumai eltérnek az imatinibétől, mert az erősebb hatáserősségük miatt az optimális válasz hamarabb érhető el.
Hemopoetikus őssejt transzplantáció
A ma ismert és használatos kezelések közül csak az allogén átültetés eredményezhet gyógyulást, de ennek a halálozási kockázata még mindig nagyobb, mint a gyógyszeres kezeléseké.
Indikáció:
1. Első vonalbeli TKI (imatinib) terápiás kudarca, azaz 2. generációs TKI kezelés szükségessége a donor és kockázati feltétel teljesülésével
2. Blastos krízis vagy akkceleráció utáni állapot Feltétel: EBMT score=2 vagy <2
European Group for Blood and Marrow Transplantation (EBMT) score
| Rizikó | Pont |
| Beteg életkora | |
| <20 | 0 1 |
| >40 | 2 |
| Betegség stádiuma | |
| Korai | 0 |
| Közepesen előrehaladott | 1 |
| Késői | 2 |
| Transzplantációig eltelő idő | |
| <12 hó | 0 |
| >12 hó | 1 |
| A donor típusa | |
| HLA azonos testvér donor | 0 |
| Idegen donor | 1 |
| Donor recipiens nemi egyezés | |
| Bármely kombináció, kivéve | 0 |
| Női donor, férfi recipiens | 1 |
Az összes pontérték 0-7 között változhat. A donor recipiens HLA vizsgálati módszerek javulásával a családi és idegen identikus donor közötti különbség inkább csak idősebb recipiensnél lényeges. A TKI kezelés érájában úgy tűnik, hogy a II-III krónikus fázis transzplantációs kimenetele közelebb áll az akcelerált fáziséhoz, mint a blasztos fáziséhoz. Az idők folyamán a transzplantáció kimenetelében szerepet játszó újabb tényezők is felmerültek, mint pl. a recipiens CMV és Karnofsky statusa, komorbiditás és egyes citokinek polimorphizmusa. A nagy beteganyagon végzett statisztikai értékelések szerint azonban egyik tényező sem érvénytelenítette a rendszert. Bizonyos az is, hogy a transzplantáció előtti TKI kezelés nem hat kedvezőtlenül a kimenetelre.
EBMT score és a transplantáció várható kimenetele közötti összefüggés jelenleg
A score megalkotása idejében a transzplantációval kapcsolatos mortalitás még az alacsony rizikó pontértéknél is 20% körüli volt. A transzplantációs technika javulásával ez most 10% alá esett a 2 vagy kevesebb pontértéknél. Ha a pontérték 5 vagy annál több, akkor az ötéves túlélés valószínűsége most is csak 30-40%. Az allogén átültetés formái:
1. myeloablatív kondicionálással történő transzplantáció
2. Redukált intenzítású kondicionálással végzett ún. minitranszplantáció: a 2-nél nagyobb EBMT score -t mutató betegeknél jön szóba, ha más kezelés nem lehetséges.
Amennyiben az allogén átültetés indikációja a TKI kezelés során kialakult előrehaladott fázis, akkor az átültetés előtt TKI váltással meg kell próbálni a beteget ismét krónikus fázisba hozni.
Harmadik vonalbeli kezelés
Gyógyszeres: váltás másik, másod- vagy harmadgenerációs TKI-ra.
Indikáció: második vonalban adott TKI terápiás válasza nem optimális, vagy intolerancia van és az allogén őssejtátültetés nem kivitelezhető.
Allogén őssejtátültetés
Krónikus myeloid leukémia kezelése előrehaladottabb fázisokban
Első vonalbeli kezelés
Gyógyszeres: 600-800mg imatinib.
A diagnózis idején előrehaladott fázisban megjelenő CML esetén már kezdetben kötelező a BCR-ABL mutáció keresés, mert ilyen helyzetben gyakori az imatinib-rezisztens mutáció jelenléte. Ebben az esetben első kezelésként nilotinib, vagy dasatinib adandó. Blastos fázisban dasatinib adandó.
Allogén őssejt átültetés: a megfelelő donor keresését már a diagnózis után azonnal meg kell kezdeni. A TKI kezeléssel megkísérlendő a betegség kedvezőbb fázisba hozása az allogén őssejt átültetés előtt.
Második vonalbeli kezelés
Gyógyszeres: más TKI-ra váltás .
Bármelyik fázisú CML egyéb kezelése a TKI érában
Interferon alfa(rekombináns)
Alkalmazási módja a szubkután injekció, amely rekombináns interferon alfát tartalmaz.
Kezdő adagja napi 3-5millió NE/m2, amely napi 10millió NE-re emelhető a hematológiai és citogenetikai válaszhoz igazítva. Teljes citogenetikai remisszióban fenntartó kezelésként a dózis napi 3 millió NE lehet, és a gyakoriság csökkenthető heti 3-4 alkalomra. Az interferonnal a betegek 10-20%-ában major citogenetikai válasz érhető el. A teljes citogenetikai remissiót elérő betegek több mint %-e 10 évnél tovább él.
Indikáció: teljes intolerancia TKI-kal szemben, transplantáció kivihetetlensége, TKI-k kontraindikációja pl. terhesség.
Cytarabin (AraC)
Interferonnal kombinálva a major citogenetikai válasz kb. 30%.
Szubkután injekció formájában adandó. A kombinációban a szokásos dózis 20mg/m2 10 napon át havonta. Mellékhatás miatt a betegek legalább egy harmadánál tartósan nem lehetett alkalmazni. Ma már csak kivételes esetben indikált.
Hydroxyurea
Ma már csak citoredukcióra, ill. palliatív kezelésre használjuk.
Prognózis
A CML kimenetelét egyrészt a diagnózis idején jelenlevő tényezők és a betegség stádiuma, másrészt a TKI kezelésre adott válaszok minősége határozza meg.
Prognosztikus faktorok a diagnóziskor
Prognosztikus pontrendszer
A diagnóziskor észlelt tényezőkkel a betegek prognosztikus besorolása elvégezhető. Jelenleg két besorolásra alkalmas pontrendszer ismert, az egyik a Sokal score (www.roc.se/sokal.asp), a másik a Hasford, más néven Euro score (www.pharmacoepi.de/cmlscore.cgi) A Sokal pontérték kiszámításánál a beteg korát, a lépnagyságot, a thrombocyta - és a blaszt számot veszik figyelembe, míg a Hasford pontérték kiszámításánál a fentiek mellett a periférián számolt bazofilek és eozinofilek számát is beépítették a formulába. (A prognosztikus pontrendszer megalkotását a Sokal rendszerben a krónikus és az akcelerált fázisban levő betegek értékelése, míg a Hasford rendszerben csak a krónikus fázisban levő a betegek értékelése képezte). Mindkét pontrendszerrel a prognózis szempontjából 3 csoport állítható fel: rossz, közepes és jó. A beteg várható túlélését a prognosztikus csoportba sorolása határozza meg. Imatinib kezelés során a közepes és magas rizikójú betegek túlélése kedvezőtlenebb, mint az alacsony rizikójúaké. Ez a kezelés előtt felállított, a prognózist meghatározó pontérték a betegség kimenetelét többé már nem befolyásolja, ha az imatinib kezelés teljes citogenetikai remissziót eredményezett. Prognózis szempontjából figyelmeztető jel a Ph+ sejtekben a diagnózis idején észlelt kromoszóma rendellenesség.
A betegség fázisa
A diagnózis idején észlelt fázis önállóan meghatározza a betegség kimenetelét. Az akcelerált vagy blasztos fázisban TKI-kal nem várható hosszú túlélés.
A TKI kezelésre adott válasszal kapcsolatos prognosztikus tényezők
Az optimális időben adott terápiás válasz kedvező progressziómentes túlélést jósol. A 12 hónapos imatinib kezelésre elért komplett citogenetikai válasz ill. (CCR) remisszió és major molekuláris válasz szignifikánsan hosszabb túlélést jelent.
A citogenetikai és molekuláris válasz elvesztése kedvezőtlen kimenetelt vetít előre. Kedvezőtlen kimenetel várható akkor is, ha TKI rezisztens BCR-ABL KD mutáció jelenik meg,
Figyelmeztető jel, ha TKI kezelés alatt a Ph neg klónban kromoszóma abnormalitás lép fel.
A második generációs TKI-k másodvonalbeli alkalmazásánál a válasszal kapcsolatos prognosztikus tényezők még nem teljesen tisztázottak. Az imatinib intolerancia miatt adott második generációs TKI-k válasszal kapcsolatos prognosztikai tényezői valószínű nem különböznek az imatinibétől. Az értékelésnél azonban figyelemmel kell lenni arra, hogy ezen szerekkel az optimális terápiás válasz gyorsabb, mint imatinibbel.
Az imatinib rezisztens beteg második generációs TKI kezelésénél kedvezőtlen jel, ha az első három hónapban semmiféle citogenetikai válasz nincs, illetve ha 6 hónap után nincs legalább minimális citogenetikai válasz.
Az első vonalban adott imatinib kezeléshez hasonlóan a második vonalbeli 2. generációs TKI kezelés során megjelenő BCR-ABL KD mutáció megjelenése, illetve annak a TKI-kkal szembeni rezisztenciája prognosztikus jelentőségű.
Egyéb tényezők, mint pl. a diagnózis idején észlelt addicionális klonális kromoszóma rendellenességek, a TKI gyógyszernek a sejten belüli transzportja, vagy bizonyos gének expressziója, prognózisban betöltött szerepe még megerősítésre vár.
IV. Rehabilitáció
V. Gondozás
A betegek túlélése a kezelés és folyamatos gondozásnak is függvénye.
A CML-s beteg kezelése, kontroll vizsgálata hematológiai centrumokban vagy decentrumokban történjen. A beteg kezeléséért, gondozásáért a szakrendelést végző haematológus vagy klinikai onkológus szakorvos felelős. Az adott terápiát hematológus vagy onkológus szakorvos rendelheti el.
Szükséges dokumentumok, bizonylatok
A beteg ambuláns jelentkezéseit az ambuláns lap és napló, az intézeti kezeléseit a kórlap, a lázlap, az ápolási dokumentáció és zárójelentés rögzíti, amely tartalmazza a beteg felvilágosítását, beleegyezését (aláírásával hitelesítve) a vizsgálatokba és kezelésekbe. Minden vizsgálati eredményt, kezelést dokumentálni kell az ambuláns lapon vagy kórlapban (decursus, lázlap, ápolási napló).
VI. Irodalomjegyzék
1. A krónikus myeloid leukémia kezelésének finanszírozási eljárás rendje. Magyar Közlöny 2010. év 77. sz., Eü Közlöny LX. évf. 12. sz. jún. 8. 2010.
2. Baccarani M, Cortes J, Pane F et al: Chronic Myeloid Leukemia: An Update of Concepts and Management Recommendations of European LeukemiaNet. JCO 2009, 27, 6041-6051
3. de Lavallade H, Apperley JF, Khorashad J, Milojkovic D, Reid AG, Bua M, Szydlo R, Olavarria E, Kaeda J, Goldman JM, Marin D.: Imatinib for newly diagnosed patients with chronic myeloid leukemia: incidence of sustained responses in an intention-to-treat analysis. J Clin Oncol 2008, 26:3358-3363
4. Druker BJ, Guilhot F, O'Brien SG, Gathmann I, Kantarjian H, Gattermann N, Deininger MW, Silver RT, Goldman JM, Stone RM, Cervantes F, Hochhaus A, Powell BL, Gabrilove JL, Rousselot P, Reiffers J, Cornelissen JJ, Hughes T, Agis H, Fischer T, Verhoef G, Shepherd J, Saglio G, Gratwohl A, Nielsen JL, Radich JP, Simonsson B, Taylor K, Baccarani M, So C, Letvak L, Larson RA; IRIS Investigators: Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia. N Engl J Med. 2006;355:2408-17.
5. Gratwohl A, Heim D. Current role of stem cell transplantation in chronic myeloid leukaemia. Best Pract Res Clin Haematol. 2009,22:431-43.
6. Gratwohl A, Hermans J, Goldman JM, Arcese W, Carreras E, Devergie A, Frassoni F, Gahrton G, Kolb HJ, Niederwieser D, Ruutu T, Vernant JP, de Witte T, Apperley J :Risk assessment for patients with chronic myeloid leukaemia before allogeneic blood or marrow transplantation. Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation. Lancet 1998, 352:1087-92.
7. Gratwohl A; Stern M;, Brand R; Apperley J, Baldomero1 H, de Witte T, Dini G; Rocha V,; Passweg J, Sureda A, Tichelli A, Niederwieser D for the European Group for Blood and Marrow Transplantation and the European Leukemia Net. Risk score for outcome after allogeneic hematopoietic stem cell. transplantation A retrospective analysis. Cancer 2009;115:4715-26.
8. Hochhaus A, O'Brien SG, Guilhot F et al; IRIS Investigators: Six-year follow-up of patients receiving imatinib for the first-line treatment of chronic myeloid leukemia. Leukemia. 2009 Jun;23(6):1054-61.
9. Hughes T, Hochhaus A, Brandford S et al: Long-term prognostic significance of early molecular response to imatinib in newly diagnosed chronic myeloid leukemia: an analysis from the International Randomized Study of Interferon and STI571 (IRIS). Blood 2010, 116: 3758-65.
10. Jabbour E, Hochhaus A, Cortes J, La Rosée P, Kantarjian HM. Choosing the best treatment strategy for chronic myeloid leukemia patients resistant to imatinib: weighing the efficacy and safety of individual drugs with BC-ABL mutations and patient history. Leukemia. 2010 ;24:6-12. .
11. O'Brien SG, Gui lhot F, Larson RA, Gathmann I, Baccarani M, Cervantes F, Cornelissen JJ, Fischer T, Hochhaus A, Hughes T, Lechner K, Nielsen JL, Rousselot P, Reiffers J, Saglio G, Shepherd J, Simonsson B, Gratwohl A, Goldman JM, Kantarjian H, Taylor K, Verhoef G, Bolton AE, Capdeville R, Druker BJ; IRIS Investigators. Imatinib compared with interferon and low-dose cytarabine for newly diagnosed chronic-phase chronic myeloid leukemia. N Engl J Med. 2003;348:994-1004.
12. Soverini S, Colarossi S, Gnani A, Rosti G, Castagnetti F, Poerio A, Iacobucci I, Amabile M, Abruzzese E, Orlandi E, Radaelli F, Ciccone F, Tiribelli M, di Lorenzo R, Caracciolo C, Izzo B, Pane F, Saglio G, Baccarani M, Martinelli G; GIMEMA Working Party on Chronic Myeloid Leukemia. Contribution of ABL kinase domain mutations to imatinib resistance in different subsets of Philadelphia-positive patients: by the GIMEMA Working Party on Chronic Myeloid Leukemia. Clin Cancer Res. 2006;12:7374-9.
13. Rosti G, Palandri F, Castagnetti F, Breccia M, Levato L, Gugliotta G, Capucci A, Cedrone M, Fava C, Intermesoli T, Cambrin GR, Stagno F, Tiribelli M, Amabile M, Luatti S, Poerio A, Soverini S, Testoni N, Martinelli G, Alimena G, Pane F, Saglio G, Baccarani M; GIMEMA CML Working Party. Nilotinib for the frontline treatment of Ph(+) chronic myeloid leukemia. Blood. 2009;114:4933-8.
14. Vardiman JW, Melo JV, Baccarani M, Thiele J. Chronic myelogenous leukaemia, BCR-ABL1 positive. in: WHO Classification of tumours of haematopoietic and lymphoid tissues. 4. edition, 2008, IARC Lyon, 2008, . pp 32-37,
MYELODYSPLASTIKUS SZINDRÓMA (MDS)
I. Alapvető megfontolások
A myelodysplastikus szindrómát egy vagy több sejtrendszert érintő cytopenia jellemzi, mely a hemopoietikus őssejt klonális eltérése miatt jön létre. A betegek egy részében akut leukaemiás átalakulásra lehet számítani, azonban a prognózis e nélkül is kedvezőtlen, hiszen a súlyos cytopenia következtében kialakuló fertőzések, vagy a vérzéses szövődmények halálhoz vezetnek. A betegség kialakulásában a genetikai, az epigenetikai és az immunológiai tényezők egyaránt fontosak.
Előfordulás, incidencia
A myelodysplatikus szindróma (MDS) főként az idősek betegsége, a betegek 80%-a 60 évnél idősebb, 70 év feletti életkorban az incidencia 22-45/100000 lakos. A kialakulásban bizonyos jelentőség tulajdonítható a dohányzásnak, a szerves oldószereknek és az ionizáló sugárzásnak. Hajlamosít a férfi nem és gyakrabban észlelhető a betegség akkor, ha elsőfokú rokonban rosszindulatú vérképző szervi betegség fordult elő. Korábbi citosztatikus kezelés, elsősorban az alkiláló szerek és a topoizomeráz-II. gátlók, valamint a terápiás besugárzás jelentősen növeli a kialakulás lehetőségét. (1)
II. Diagnosztikus vizsgálatok és osztályozás
A típusos MDS-t legtöbbször anaemia jellemzi, bár a betegek egy részében fertőzések, vérzéses jelenségek, vagy autoimmun tünetek is előfordulhatnak.
A diagnosztikus lépések során a perifériás vérkép mennyiségi és minőségi jellemzői nélkülözhetetlenek. Csontvelő vizsgálat (Berlini kék-festés is) aspirátumból történik. A csontvelő értékelésének mindig magába kell foglalnia a cellularitás, a dysplastikus jelenségek, valamint a blastok arányának megítélését. A csontvelő többnyire hyper- vagy normocelluláris, de a betegek egy részében hypocellularitás is megfigyelhető. A csontvelő kenetekben egy vagy több sejtrendszert érintő dysplasia figyelhető meg. A dysplasticus jelek a sejtek legalább 10%-ában fellelhetők. A betegség osztályozásában a WHO 2008 ajánlása elfogadott, szemben a korábbi FAB és WHO klasszifikációval .
Ha a kezelés lehetőségek korlátozottak és a beteg nagyon idős, nem feltétlenül szükséges csontvelő biopszia. A fibrosissal járó és hypoplastikus esetek, valamint a blastok elhelyezkedésének megítélése azonban csak biopsziás mintából lehetséges. A MDS osztályozásában korábban használatos FAB besorolás a betegség prognózisa, a leukaemiás átalakulás esélye és bizonyos kezelési szempontok miatt is átgondolást igényelt. Az akut leukaemiák, myeloproliferatív betegségek, malignus lymphomák osztályozásához hasonlóan a MDS-ben is a WHO besorolása használatos, melyet 2008-ban módosítottak ismételten. Az entitások megítélésében a perifériás vérben a blastok, esetleg Auer pálca jelenlétét, a cytopenia kiterjedtségét és a csontvelő jellemzőit veszi figyelembe. (2)
1. táblázat. Az MDS WHO osztályozása 2008 (3)
| Betegség | Vérkép | Csontvelő |
| Refrakter cytopenia egy rendszert | Egy/két rendszert érintő cytopenia, | Egy rendszert érintő dysplasia, <10% |
| érintő dysplasiával | blast nincs | dyspl. sejt az érintett sejtvonalon, |
| Refracter anaemia (RA) | <5% blast, | |
| Refracter neutropenia (RN) | <15% gyűrűs sideroblast | |
| Refracter thrombocytopenia (RT) | ||
| RA gyűrűs sideroblastokkal (RARS) | Anaemia | Erythroid dysplasia, |
| <5% blast | ||
| >15% gyűrűs sideroblast | ||
| Refrakter cytopenia több rendszert | Mint előbb, de bicytopenia vagy | >10% dysplastikus sejt két vagy több |
| érintő dysplasiával (RCMD) | pancytopenia, | sejtsoron, |
| <1% blast, nincs Auer pálca, | <5% blast, nincs Auer pálca | |
| <1x(?)G/l monocyta | +/-15% gyűrűs sideroblast | |
| Refrakter anaemia magas blast | Cytopenia, | Egy vagy több sejtrendszer dysplasia, |
| aránnyal-1 (RAEB-1) | <5% blast, nincs Auer pálca, <1xG/l | 5-9% blast, nincs Auer pálca |
| monocyta |
| Betegség | Vérkép | Csontvelő |
| RAEB-2 | Mint előbb, de Auer pálca+/- | 10-19% blast, Auer pálca+/- |
| Nem osztályozható MDS (MDS-U) | Cytopenia, blast <1%, nincs Auer pálca | <10% dysplastikus sejt egy vagy több sejtsoron, <5% blast |
| MDS izolált Del(5q)-val | Anaemia, blast<1%, normális vagy emelkedett thrombocyta szám | Normális vagy emelkedett megakaryocyta (hypolobulált mag),<5% blast, izolált del(5q), nincs Auer pálca |
Citogenetikai eltérések
A de-novo MDS-ben szenvedő betegek felében találhatóak kromoszóma eltérések. A leggyakoribb eltéréseket a 2. táblázat foglalja össze. A kromoszóma eltérések egy része megfigyelhető akut myeloid leukaemiás betegekben is, alátámasztva azt a feltételezést, hogy bizonyos esetekben a két betegség eredete pontosan nem különíthető el. Egyes eltérések, mint a del(5q) és a del(20q) inkább MDS-ben fordulnak elő. Jelenleg MDS-ben csak egyetlen citogenetikai alcsoport különíthető el élesen a WHO besorolás szerint, ez az 5q-szindróma .
A citogenetikai vizsgálatra törekedni kell, ugyanis a prognózis megítélésében döntőek a kromoszóma eltérések. A leggyakoribb eltérések az 5 és 7 kromoszómát érintik. 5-s monoszómia és del(5q) a betegek 10%-ában található, a másodlagos MDS-k 40%-ában. 7-es monoszómia, del(7q) a de novo MDS-k 10%-ában, szekunder MDS-ben a betegek 50%-ában fordul elő. A betegek egy részében komplex citogenetikai eltérés van (legalább 4 típusú eltérés).
2. táblázat. A leggyakoribb kromoszóma eltérések MDS-ben. Mitelman Database of Chromosome Aberrations in Cancer alapján. (4)
| Citogenetikai eltérés | Betegek száma (n=1377) | % |
| -5 | 92 | 6,7 |
| 5q- | 349 | 25,0 |
| 5q- (önmagában) | 184 | 13,0 |
| -7 | 171 | 12,0 |
| -7 (önmagában) | 78 | 5,7 |
| +8 | 287 | 21,0 |
| +8 (egyedül) | 177 | 13,0 |
| der(12p) | 82 | 6,0 |
| 20q- | 82 | 6,0 |
| -Y | 64 | 7,6 |
Prognosztikai tényezők
A betegség prognózisában a korábbi ismereteink alapján jelentős szerepet tulajdonítottak a következő tényezőknek: a cytopenia hány sejtrendszert érint, milyen kromoszóma eltérések vannak és milyen a csontvelőben a blastok aránya. Ennek értelmében az ún. International Prognostic Scoring System (IPSS) alapján jól elkülöníthető prognózisú betegségcsoportok ismeretesek. Ezekben a csoportokban a leukaemiás átalakulás kockázata és a túlélés lényegesen különbözik (3. és 4. táblázat). (5)
3. táblázat. International Prognostic Scoring System (IPSS) (5)
| Pontszám | 0 | 0,5 | 1,0 | 1,5 |
| Csontvelő blast ( %) | <5 | 5-10 | 11-20 | |
| Kariotípus* | jó | közepes | rossz | |
| Cytopenia | 0/1 | 2/3 | ||
| Összesített pont | 0 | 0,5-1,0 | 1,5-2,0 | >2,5 |
| Kockázat | kicsi | közepes-1 | közepes-2 | nagy |
Kariotípus* jó: normális, -Y del (5q), del(20q), rossz: komplex (legalább 4 eltérés, vagy kromoszóma 7 eltérés), közepes: bármely egyéb eltérés
4. táblázat. A túlélés és a leukaemias átalakulás valószínűsége IPSS szerint (5)
| Kockázat | Összesített pont | Átlagos túlélés (év) | 25% AML (év) |
| Kicsi | 0 | 5,7 | 9,4 |
| Közepes-1 | 0,5-1,0 | 3,5 | 3,3 |
| Közepes-2 | 1,5-2,0 | 1,2 | 1,1 |
| Nagy | >2,5 | 0,4 | 0,2 |
Kockázatbecslés
A WHO osztályozás és a transzfúzió függőség fontosságának ismeretében 2007-ben Malcovati módosított prognosztikus rendszert dolgozott ki, mely a betegek WHO alcsoportba való tartozását, a citogenetikai eltérést és a transzfúziós igényt veszi figyelembe. Ebben a rendszerben 5 prognosztikai csoport különböztethető meg, a "nagyon kicsi", "kicsi", "közepes", "nagy" és "igen nagy" kockázati csoportba tartozó betegeket. Ezt a prognosztikai besorolást un. "WHO Classification-Based Prognostic Scoring System" (WPSS) névvel jelölik. A WPSS besorolása alapján "nagyon kicsi" kockázat esetén a score 0, "kicsi" kockázatban a score 1, "közepes" esetben a score 2, "nagy" kockázatnál a score 3-4, "nagyon nagy" a score 5-6 csoportba tartozó beteg. (6)
5. táblázat. Kockázatbecslés WPSS szerint (6)
| WPS pontszám | 0 | 1 | 2 | 3 |
| WHO alcsoport | RA/RARS/5q- | RCMD/RCMD-RS | RAEB-1 | RAEB-2 |
| Citogenetika | Jó | Közepes | Rossz | |
| Transzfúziós igény | Nincs | Van |
III. A MDS kezelése
Általános szempontok
A túlélés és a leukaemiás átalakulás szempontjából a kockázat megítélése a Nemzetközi Prognosztikai Score (IPSS) alapján volt korábban lehetséges. Jelenleg a WPSS egyértelműen megkülönbözteti a kis kockázatú csoporton belül a biztosan nagyon jó prognózisú eseteket, akikben nagyon kicsi a leukaemiás átalakulás valószínűsége és igen hosszú túlélésre számíthatnak. Ennek értelmében, minthogy egyébként is a WHO osztályozás a használatos, ez a score-rendszer ajánlható a mindennapi gyakorlatban is. Természetesen ezen túlmenően-bár nem szerepel a pontrendszer kritériumai között - döntő tényező az életkor, az általános állapot, alamint az, hogy a betegnek van-e HLA identikus csontvelődonora. A kis kockázatú esetekben a normális haemopoesis javítása, a cytopenia mérséklése a kezelés célja. Nagy kockázatú betegekben intenzív kemoterápia jöhet szóba a kóros klón kiirtása céljából.
Logikus ajánlásnak látszik a kezelés előtt két alapvető kérdést megválaszolni:
1. Van-e a betegnek klinikai szempontból jelentős neutropeniája vagy thrombopeniája az anaemián túlmenően.
2. Emelkedett-e a blast tartalom a csontvelőben, és ennek következtében van e leukaemiás kockázat?
Ha mindkét kérdésre nemleges a válasz, akkor egyetlen tennivaló az anaemia rendezése, melyre elsősorban a vörösvérsejt pótlás ajánlható. Az erythropoesist stimuláló agensek (ESA) önmagukban vagy granulocyta kolónia stimuláló faktorral (G-CSF) együtt, valamint antithymocyta-globulin (ATG) és cyclosporin (CsA), esetleg lenalidomid vagy hypometiláló szerek bizonyos esetekben szóba jöhetnek. Jelenleg a lenalidomid nem törzskönyvezett ebben a betgségcsoportban. Ha a válasz bármely kérdésre igen, szükségesnek látszik a betegség természetes lefolyásának a megváltoztatása. Ebben az értelemben jelenleg 5-azacitidin, decitabin tűnik hatékonynak, amelyek a nagy kockázatú betegek prognózisát javíthatják és a cytopeniát is mérséklik. Intenzív, akut leukaemia-szerű kezelés ugyancsak mindkét fontos célpont megváltoztatásra alkalmas lehet, de az általános tapasztalat az, hogy MDS-ben a betegek ezt a típusú kezelést nagyon rosszul tűrik. Az őssejt-transzplantáció meggyógyíthatja a betegséget, de erre csak kevés betegben van lehetőség. Azokban a betegekben, akikben a cytopenia jelentős, de a csontvelőben a blast arány nem emelkedett, elsősorban immunmoduláló szerek lehetnek hatékonyak. (7)
Szupportív kezelés
Az anaemia rendezése a legfontosabb cél. Elsősorban az "kis kockázatú" esetekben választandó ez a kezelési forma. A betegek életminősége a hemoglobin szint emelkedésével arányosa javul, ajánlott a hemoglobint 90-100 g/l, vagy ennél kissé magasabb szinten tartani, figyelembe véve a beteg életkorát és kísérő betegségeit. Összesen 20-25 E-nél nagyobb transzfúziós szükséglet esetén mindenképpen számolni kell a túlzott vasbevitel káros következményeivel, és az évek során egyre súlyosbodó hemosiderosis még a jó prognózisú esetekben is egyértelműen rontja a betegek túlélését. A parenterálisan adható desferrioxamin alkalmazása nehézkes. Az új, már hozzáférhető orális kelátképzők (deferasirox) lényeges segítséget jelentenek a hemosiderosis megelőzésében. A nemzetközi ajánlás szerint a rendszeresen transzfúzióban részesülő betegek esetében, 1500ng/ml szérum ferritin szint felett kelátképző alkalmazása indokolt. (8)
Az anaemia gyógyszeres kezelése
Az erythropoetin (ESA), a granulocyta colonia stimuláló faktor (G-CSF) nem csak ezeknek a vérképző sejtvonalaknak a differenciálódásában játszanak döntő szerepet, hanem az apoptosis gátlásában is jelentősek. Az anaemia mérséklése ESA ± G-CSF adásával kísérelhető meg. ESA önmagában a kis kockázatú esetek 20-30%-ában eredményes, ez az arány sideroblastos anaemiában megközelíti az 50%-ot. Az adagolás eltér a más betegségekben javasolt adagtól, 10-20000E/nap lehet a hatékony dózis. Ha az ESA és G-CSF (1ug/kg/nap) együttes adása történik, a kedvező terápiás válasz aránya 40-60%-ra emelkedhet. Ma már megjósolható, hogy mely betegekben lehet kedvező ez a kezelés. Lényegesen jobb a kombináció hatékonysága akkor, ha a kezelés megkezdése előtt a betegek <2E/hónap vörösvérsejt pótlásban részesültek, és ha a szérum Epo szint <500 E/l. (8. táblázat) Figyelembe véve azonban ennek a kezelési módnak a költségeit, rutinszerűen nem ajánlott, elsősorban klinikai vizsgálatok keretében jön szóba. Ha 2 hónap alatt nem reagál a beteg, a kezelést abba kell hagyni. (7)
6. táblázat. ESA+G-CSF hatékonyságának valószínűsége (7)
| Érték | Score | |
| Transzfúzió (egység/hó) | <2 | 0 |
| >2 | 1 | |
| Szérum EPO | <500E/l | 0 |
| >500E/l | 1 | |
| Alcsoport | Teljes pontszám | Reagálás (%) |
| Jó | 0 | 74 |
| Közepes | 1 | 23 |
| Kedvezőtlen | 2 | 7 |
Minthogy a kóroki tényezők összetettek, immunszuppresszív kezeléssel is történnek próbálkozások. Egyértelmű, hogy a prednisolon hatástalan. Anti-thymocyta globulin (ATG) kezeléssel elsősorban a refrakter anaemiák hypoplastikus formáiban csökkenthető lényegesen a transzfúziós igény, főként azokban a betegekben, akik 60 évnél idősebbek és csak rövid ideje áll fenn a transzfúziós igényük. A ciklosporin a transzfúziós igény csökkenését eredményezheti.
MDS-ben a betegek kb. 20%-ában jelentős klinikai tünetekkel járó thrombocytopenia van. Ezekben az esetekben rendszeres thrombocyta pótlás szükséges (7). Az immunthrombocytopeniákhoz hasonlóan, klinikai vizsgálatok alapján MDS-ben is ígéretesnek tűnik a Romiplostim (AMG531), mint új thrombopoesist stimuláló fehérje alkalmazása .
Immunmoduláló szerek
Az ATG azokban a betegekben lehet hatékony, akik a refrakter anaemia csoportba tartoznak, pancytopeniásak, nincs citogenetikai eltérésük, HLA-DR15 pozitívak, fiatalok, a csontvelő nem hypercelluláris és a transzfúzió függőség rövid ideje tart (9). Az anti-VEGF (thalidomid) a betegek 20%-ában a transzfúziós igény mérséklődését eredményezheti, de a granulopeniát és thrombopeniát nem befolyásolja. A szer módosított változata a lenalidomid. Ez a szer a transzfúziófüggő, különösképpen az 5q- eltéréssel bíró betegekben hatékony. A fázis I/II. klinikai vizsgálatok kis és közepes-1 kockázatú MDS-ben a transzfúziós igény csökkenését a betegek 64%-ában igazolták, 5q- esetén a betegek 67%-a teljesen transzfúziómentes lett. A betegek jelentős részében komplett citogenetikai remisszió alakult ki. Az átlagos túlélés is javult és az akut leukaemiás átalakulás igen csekély. A lenalidomidnak jelentős hatása van nem-del(5q) MDS-ben is. A kis kockázatú betegek 26%-a transzfúziómentessé válhat, és a reagálás időtartama 41 hét.
Transzkripciót befolyásoló kezelés
Hypometiláló szerek
A DNS hypometilációt eredményező szerek közül az 5-azacitidin és 5-aza-deoxicitidin ígéretesek a MDS kezelésében (10).
Azacitidin
75mg /m2 azacitidin 7 napon át történő iv. adásával 49%-os reagálás érhető el. Randomizált fázis III. vizsgálatban az azacitidin és szupportív kezelés összehasonlításában a kísérleti szerrel 60%-os, míg a szupportív ágon lévő betegek esetében 5%-os reagálást tapasztaltak,. A hatás tartama 14 hónap volt a vizsgált szer esetén. A leukaemiás transzformáció aránya 15% volt azacitidinnel, szemben a csak szupportív ellátásban részesülő betegek. 38%-ával. A leukaemiás transzformációig eltelt idő 21 hónap volt, 12 hónap a szupportív kezelés esetén. 2004 óta ez a szer regisztrált az MDS kezelésére.
Decitabin
MDS közepes-2, magas kockázat Esetén a reagálás 49%, a betegek további 20%-ában stabil állapot alakult ki. A reagálást nem befolyásolta a WHO alcsoport, a csontvelői blast arány és a citogenetikai eltérés sem. A reagálás tartama 36 hét, az átlagos túlélés 15 hónap. A betegek 31%-a élt 2 év után. A szer hatékonyságát közepes és nagy kockázatú betegekben vizsgálva 30% reagálást észleltek, 10 hónapos átlagos időtartammal. A betegek transzfúzióra nem szorultak, az akut leukaemiás átalakulásig eltelt idő is hosszabb volt. Az FDA 2006-ban a szert befogadta az MDS kezelésére.
Ismeretesek klinikai vizsgálatok hiszton- deacetiláz gátlók (valproátsav) és azacitidin ill. decitabin együttes adásával, azonban a bevont betegek viszonylag kisebb száma miatt még nem lehet nyilatkozni biztonsággal a hatékonyságról. A rendelkezésre álló adatok szerint a hypometiláló szerek elsősorban a nagy kockázatú MDS-ben indokoltak.
Intenzív kemoterápia
Elsősorban akut leukaemiában használatos protokollok jönnek szóba, bár nincsenek randomizált összehasonlító vizsgálatok. Az eredmények általában elmaradnak az akut leukaemiákban tapasztalhatóktól. Ennek oka elsősorban az, hogy a betegek idősek, gyakoriak a kedvezőtlen citogenetika eltérések, és a gyógyszer-rezisztencia.
Őssejt transzplantáció
A 65 évnél fiatalabb betegekben, jó általános állapotban és HLA identikus donor elérhetősége esetén jön szóba. A transzplantáció sikerét döntően befolyásolja a beteg életkorán túl az a tény, hogy milyen a blast arány a csontvelőben a transzplantációt megelőzően, vannak-e társbetegségek és milyen citogenetikai eltérések igazolhatóak. Az Európai Csontvelőtranszplantációs Regiszter (EBMT) adatai alapján, összevetve a csontvelő és perifériás őssejt alkalmazást ebben a betegség csoportban, az állapítható meg, hogy perifériás őssejt forrás esetén a megtapadás gyorsabb, kisebb a relapszus arány, a krónikus graft versus host betegség gyakoribb. Hasonlóak a Seattle munkacsoport megfigyelései, a 3 éves betegségmentes túlélés perifériás őssejt alkalmazásakor 68%, csontvelő őssejtek adásakor 48%. A különböző kondicionálási eljárásokat összevetve az mondható, hogy az intenzívebb kondicionálás nem jár a túlélés javulásával. Jóllehet a relapszusok aránya csökken, de transzplantációval összefüggő toxikus halálozás növekszik. A csökkentett intenzitású kondicionálás lehetővé teszi, hogy olyan betegek is transzplantációs kezelésben részesüljenek, akiken myeloablatív előkezelés nem lehetséges (11).Kiterjedt klinikai vizsgálatok történnek a transzplantációt megelőző, optimális kezelés kidolgozására, beleértve a hypometiláló szereket és a clofarabint. A transzplantációt követően az optimális fenntartó kezelés még nem pontosan kidolgozott. (11)
IV. Rehabilitáció
IV. Gondozás
E csoportba tartózó betegek többségén idős kora és a társbetegségek miatt csak supportív kezelés lehetséges. A beteg kezelése hematológiai centrumokban vagy decentrumokban történhet, a kontroll vérvételt a területileg illetékes szakrendelőben is végezhetik. A beteg kezeléséért, gondozásáért a szakrendelést végző haematológus vagy klinikai onkológus szakorvos felelős. Az adott terápiát hematológus vagy onkológus szakorvos rendelheti el.
A kezelés algoritmusa MDS-ben
MDS kezelése alacsony és közepes kockázatú betegeken (12)
MDS kezelése közepes és nagy kockázatú betegeken (12)
VI. Irodalomjegyzék
1. Germing U, Strupp C, Kundgen A, Bowen D, Aul C, Haas R, Gattermann N. No increase in agespecific incidence of myelodysplastic syndromes. Haematologica 2004; 89: 905-10.
2. Bowen D, Culligan D, Jowitt S, Kelesey S, Mufti G, Oscier D, Parker J. Guidelines for the diagnosis and therapy of adult myelodysplastic syndromes. Br J Haematol 2003; 120: 187-200
3. Swerdlow SH, Campo E, Harris NL et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC Press, 2008.
4. Mitelman F, Johansson B, Mertens F. The Mitelman Database of Chromosome Aberrations in Cancer. Available at: http://cgapncinihgov/Chromosomes/Mitelman accessed 1 November, 2001.
5. Greenberg P, Cox C, LeBeau MM, Fenaux P, Morel P, Sanz G, Sanz M, Vallespi T, Hamblin T, Oscier D, Ohyashiki K, Toyama K, Aul C, Mufti G, Bennett J. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89: 2079-88.
6. Malcovati L, Germing U, Kuendgen A, Della Porta MG, Pascutto C, Invernizzi R, Gagounidis A, Hildebrandt B, Bernasconi P, Knipp S, Strupp C, Lazzarino M, Aul C, Cazzola M. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25: 3503-10.
7. Jadersten M, Hellström-Lindberg E. myelodysplastic syndromes: biology and treatment. J of Int Med; 2008; 265: 307-328.
8. Angelucci E, Barosi G, Camaschella C, Cappellini MD, Cazzola M, Galanello R, Machetti M, Piga A, Tura S. Italian Society of Hematology practice guidelines for the management of iron overload in thalassemia major and related disorders. Haematologica 2008; 93: 741-52.
9. Saunthararajah Y, Nakamura R, Wesley R, Wang QJ, Barrett AJ. A simple method to predict response to imunosuppressive therapy in patients with myelodysplastic syndrome. Blood 2003; 102: 3025-3027
10. Griffiths EA, Gore SD. DNA methyltransferase and histone deacetylase inhibitors in the treatment of myelodysplastic syndromes. Semin Hematol 2008; 45: 23-30
11. de Witte T, Oosterveld M, Muus P. Autologous and allogeneic stem cell transplantation for myelodysplastic syndrome. Blood Rev 2007; 21: 49-59.
12. NCCN Clinical Practice Guidelines in Oncology: Myelodysplastic Syndromes V.2.2010 www.nccn.org.
KRÓNIKUS MYELOMONOCYTÁS LEUKAEMIA (CMMOL)
I. Alapvető megfontolások
A CMMoL a haemopoetikus őssejtek krónikus, klonális, proliferativ betegsége, melyben központi elem a monocyta szaporulat (abszolút monocytaszám > 1000/ul).
A klasszikus, korábbi FAB osztályozás az MDS-ek közé sorolta, a 2000-es WHO osztályozás taxative kevéssé érintette, a 2008-2010-es WHO rendszerben az MDS/MPN (myelodysplasia/myeloproliferativ neoplasma) csoportba nyert - helyes módon -besorolást. A CMMoL ugyanis betegenként változó mértékben, arányban és dominanciával magán viseli a myelodysplasia, ill. a myeloproliferativ tulajdonságokat.
Incidencia. A felnőttkori krónikus myelomonocytás leukaemia (CMMoL vagy a nemzetközi rövidités CMML) gyakorisága 1-4/100 000 lakos/év. Az idősebb kor betegsége, az átlag életkor 65-70 év, férfiakban 1,4-3,1-szor gyakoribb.
II. Diagnosztikus kritériumok
1. tartós monocytosis (>1000/ul) a periféruiás vérben
2. A Philadelphia pozitivitás és bcr/abl fusiós gén hiánya
3. a myeloblaszt arány a periférián és a csontvelőben kevesebb, mint 20%
4. a) van egy vagy több sejtvonalat érintő myelodysplasia
b) nincs myelodysplasia, de van klonális cytogenetikai vagy más genetikai eltérés
c) nincs myelodysplasia, nincs cytogenetikai eltérés, de a reaktiv monocytosis kizárható, és a monocytosis legalább 3 hónapja fennáll
Klinikai tünetek
Esetenként láz, gyengeség, az anaemia és thrombocytopenia tünetei, esetenként hepato/splenomegalia. MDS vagy myeloproliferativ tünetek. A betegek 30-50%-ban igazolható a betegség extramedulláris manifesztációja lépben, májban, bőrben és nyirokcsomóban
Etiologia. Az ok ismeretlen néhány ionizáló sugár, ill. cytotoxikus expositios adat ismert.
Morphologia, pathologia:
Tipikusan érett, lobulált (lóherelevél alaku magvu) monocyták. A granulocyták lehetnek típusosak, de hordozhatnak dysplastikus vonásokat is, igy hypogranuláció, pseudo- Pelger-Huet anomália, stb. Az esetek többségében korai myeloid érési alakok (myelocyta, promyelocyta, myeloblaszt) is megtalálhatók a perifériás vérben, de a blasztok száma kevesebb mint 20%. A vörösvértestek gyakran makrocyták, vagy változó mértékben dysplasiásak. A thrombocyták gyakran nagyok, hypogranuláltak, esetenként megakaryocyta fragmentek is láthatók .
Csontvelő. Az esetek 75%-ban hypercelluláris, a granulopoetikus túlsúly és a monocyták proliferációja szembetűnő. A blasztarány változó, azonban arányuk kevesebb mint 20%.
A CMMoL tumorsejtjei a myeloid és a monocyta antigéneket egyaránt hordozhatnak. CD33 és CD13 pozitivitás mellett változó mértékű CD14, CD68 és CD64 pozitivitás igazolható.
Az esetek mintegy harmadában igazolható kromoszóma rendellenesség. Leggyakrabban a 8-as, 7-es és az Y kromoszómát érintett, ill. gyakori a del(20q), a del(5q) és a 12p régiót érintő valamilyen anomália. Komplex kromoszóma rendellenesség előrehaladott, rossz prognózisú betegségben látható.
A betegek 1-2%-ában igazolható az 5-ös, és a 12-es kromoszóma szerzett, kiegyensúlyozott reciprok transzlokációja t(5;12)(q33;p13) (TEL/PDGF(3R), melyhez gyakran eozinofilia társul. Az eosinophiliával járó CMMoL-ban gyakran láthatjuk a hypereosinophil állapotokban leirt szervkárosodásokat
A molekuláris eltérések között kis arányban lehet Jak V613F, ill. Tet-2 tirozinkináz mutatio, valamint gyakori a ras és a c-fms gének pontmutációja.
Klinikai megjelenés, kórlefolyás:
A klinikai lefolyás változatos, az átlag túlélés 20-40 hónap. Idősebb korban, az enyhébb esetekben gyakori a cardialis elégtelenség miatti halál is. Az esetek egy része lassan progrediál, inkább myelodysplasiás dominanciáju, másik része inkább proliferativ és progressziv természetü. Ennek alapján két klinikai alcsoport különülhet el:
A) Myelodysplasiás jellegű CMMoL
Lassu progressio jellemzi, évekig viszonylag stacioner állapottal. A fehérvérsejtszám nomális vagy alacsony, általában dysplasiás karakterü aaemia és thrombocytopenia áll fenn. Az előtérben a cytopeniás tünetek állnak. Az MDS jellegü esetek átmehetnek a proliferativ formába.
B) Myeloproliferativ karakterű CMMoL
Proliferativ megjelenésü, általában gyorsabban progrediáló betegség. A fehérvérsejtszám nagy, hepatosplenomegalia, bőrtünetek. Olykor akár jelentős lymphadenopathia (T sejt aktiváció), sajátos papulosus exanthemák, viszketés, stb. jellemzik. A betegek 30%-ában alakul ki akut myeloid leukémiás tanszformáció, több mint egyharmadában a csontvelői elégtelensége vezethet halálhoz, 30%-át pedig a comorbiditások (kardiovaszkuláris érintettség) miatt veszítjük el.
Rossz prognózisra utal a cytogenetikai eltérés, a jelentős vérigény, a nagy blasztarány, a fokozott lizozim, LDH és érdekes módon a Beta2microglobulin aktivitás.
III. Kezelés
Az enyhe dysplastikus esetekben observatio, esetleg más MDS-ben adott szerek, pl. azacytidin, melyre van CMMoL-s tanulmány adat (75 mg pro négyzetméter 5 napig, 28 naponként)
A proliferativ esetekben, a cytoreduktiv kezelés hydroxyurea alapu, melyet etopozidos kétkaru tanulmányban vizsgáltak, s a hydroxyurea melletti tulélés 20 hónap volt, míg az etopoziddal csak 9. Az eosinophiliával kombinált esetekben imatinibbel próba tehető.
Az allogen transplantatio potenciálisan kurativ, de visszatartó erő lehet a nagy mortalitás és a jelentős relapsus hajlam. Az első tanulmány a fiatal korosztály mortaliztása 40% fölötti, az 50 év felettieké pedig 81% volt, de az adatsor a 80-as évek végéről való. Egy újabb, 50 fős tanulmányban az átlagos életkor 44 év volt, de az 5 éves tulélés csak 21%. A relapsus az esetek felében bekövetkezett, így nem ajánlott a T sejt depletált graft.
POLYCYTHAEMIA VERA (PV)
I. Alapvető megfontolások
A krónikus myeloproliferativ megbetegedéseket (CMP) több alcsoportra oszthatjuk, melyek közül négy csoport jól definiálható: a krónikus myeloid leukémia (CML), a polycythaemia rubra vera (PV), a primer (osteo-)myelofibrosis (OMF) és az essentiális thrombocythaemia (ET). A CML, a PV és az OMF diagnózisának megállapítása jól definiált diagnosztikus és klinikai módszerekkel történik.
A polycythaemia rubra verara jellemzője a csontvelői őssejtek klonális proliferációja, és a növekedett vörösvértest térfogat. Hasonló konstelláció fordul elő hypoxiás állapotban és erythropoetin termelő daganatokban.
Patogenezis
A PV klonális őssejt megbetegedés: klonalitását kromoszóma vizsgálatok eredményei is alátámasztják. A 20-as, 8-as és 9-es kromoszóma eltérések a betegek 30%-ban igazolatók. A JAK2 gén a 9-es kromoszómán található, melynek pontmutációja PV-ban szinte 100%-osan előfordul a 14-es vagy a 12-es axonon. A betegség nem öröklődik, genetikai háttér a kialakulásában nem igazolt.
Incidencia/Prevalencia/Morbiditás/Mortalitás Magyarországon
A PV incidenciája 1,9/100 000 lakos/év, mely nemzetközileg átlagosnak tekinthető. Minden populációban és minden életkorban előfordul, beleértve a fiatal felnőttkort is. Gyermekekben és serdülőkben is előfordulhat. Előfordulása férfiakban mérsékelten gyakoribb, mint nőkben (2,8 vs.1,3/100 000). Leggyakrabban 70- és 79 éves férfiak betegsége (24/100 000). A magyarországi incidencia 2008-ban 194 eset volt.
II. Diagnosztika
Panaszok, tünetek, általános jellemzők
A PV-s betegek egy része tünetmentes a diagnózis felismerésekor - a betegség akcidentálisan is kiderülhet.
Nem specifikus tünetei a fejfájás (48%), gyengeség (47%), szédülés (43%) és az excessziv izzadás (33%). Akut köszvényes roham 5-20%-ban fordul elő.
Pruritus meleg zuhany/fürdő után az esetek 43%-ban fordul elő. Oka nem ismert, több feltételezés létezik: a vörösvérsejt eredetű adenozid difoszfát vagy az adrenerg vazokonstriktor idegekből történő katekolamin elválasztás thromboyta aggregációhoz vezethet, amely lokális pruritogen prosztaglandin felszabadulást okozhathat. Ezen kívül hízósejt degranuláció, hisztamin felszabadulás, fibrinolytikus faktorok és interleukin 31 felszabadulás a még szóba jövő mechanizmusok. Az erythromelalgia égő fájdalom a kézen vagy a lábon, amelyet erythema, pallor vagy cyanosis kísér. Tanulmányok igazolják a PV-s thrombocyták abnormális arachidonsav metabolizmusa és a következményes, erythromelalgiát okozó arteriás microvascularis thrombosis közötti korrelációt. Főként 400.000/ul feletti thrombocyta számnál észleljük és jellemző rá, hogy alacsony dózisú acetylsalicylsav kezeléssel (ASA) drámai javulást lehet elérni e helyzetben. A betegek egy része rezisztens az ASA kezelésre és csak a cytoredukiv therápiára reagál.
Az artériás és a vénás thrombosis gyakori. A thrombosisok pathogenesisében a vér fokozott viszkozitása, a pathológiás thrombocyta, illetve leukocyta funkció is szerepet játszik. A betegek 15%-a már a PV diagnózisának felállítása előtt elszenvedett valamilyen thrombotikus eseményt (pl.cerebrovascularis, myocardiális infarctus, mélyvénás AV thrombosis, pulmonális embolia, stb.). Súlyos thrombotikus történések (Budd-Chiari szindróma, portális, mesentériális és lienalis thrombosis) olyan betegeknél is előfordulhatnak, akiknek klinikai vagy laboratóriumi leletei nem jellemzőek - hiszen a kialakuló portalis hypertensio és hypersplenizmus maszkírozhatja a PV fennállását. Utóbbi állapot 45 évnél fiatalabb nőknél fordul elő leggyakrabban. Átmeneti látászavar (amaurosis fugax, scintilláló scotoma, ophtalmicus migrain) az esszenciális thrombocythaemiához hasonlóan előfordul PV-ban.
Gasztrointesztinális tünetek jelentkezése epigasztriális tünetek, peptikus fekély és gasztroduodenalis eroziók formájában fordul elő. Aetiopathogenesisében a gyomornyálkahártya vérátáramlásának megváltozása, a szöveti basophilokból történő fokozott hisztamin felszabadulás és egy tanulmány szerint fokozott gyakorisággal előforduló Helicobacter pylori fertőzés játszat szerepet.
Prognózis
A kezeletlen PV életkilátása 6-18 hónap, míg kezeléssel 9,1-12,6 év. A kezelt betegek mortalitása 1,6-1,7-szerese az azonos életkorú és nemű egészséges személyekének. A halálokok között a kardiovaszkuláris mortalitás 45%-ban, thrombosis 29%-ban, haematológiai malignitás 23%-ban, szolid tumor 20%-ban, vérzés 7%-ban, myelofibrosis pedig 3%-ban fordul elő. Egy nagyobb tanulmány (Mayo Clinic) szerint három független prognosztikus tényező határozza meg a kórjóslatot: 1. a diagnozis felállításakor már észlelt artériás thrombosis, 2. emelkedett fvs szám (>15.000) és 3. a 60 év feletti életkor. Ha e tényezők nincsenek jelen, a medián túlélés 23 év, ha egy faktor kimutatható, akkor 14 év, két prognosztikus faktor jelenléte esetén pedig 9 év. Az érelzáródást okozó (vasoocclusiv) betegségek valószínűsége másfélszer nagyobb, mint a nem PV-s populációban. A haematológiai betegségek közül a myelofibrosisba (postpolycythaemiás myelofibrosis) vagy a myelodysplasiás szindrómába, majd akut myeloid leukaemiába történő transzformáció a jellemző kórlefolyás.
A postpolycythaemiás myelofibrosis kialakulásának rizikója a betegség tartamától függ: 6 éves betegség esetén a relativ kockázat 5,7%, 10 éve tartó betegség esetén 15,2%. Egy olasz tanulmányban a postpolycythaemiás myelofibrosis kialakulása utáni medián túlélés 5,7 évnek bizonyult. A transzformáció utáni túlélést a perifériás sejtszámok függvényében is meg lehet becsülni: Hb<10,0g%, thrombocyta szám <100.000/ul, fvs szám >30.000/ul a fontos tényezők. Ha ezek közül egy sem teljesül, illetve egy, kettő vagy három, akkor a túlélés 108, 51, 15, illetve 3 hónap. Az akut leukaemia, illetve a MDS kialakulásában a 70 év feletti életkor (relativ rizikó 4,3-5,0-szörös), valamint a betegség tartama alatti cytoreduktiv kezelés (kivéve a hydroxyureat és az interferont) játszik szerepet. A Mayo Clinic tanulmányában a következő összefüggés található a cytoreduktiv gyógyszerek és az akut leukaemia/MDS kialakulása (%) között:
- Cytoreduktiv kezelés nélkül (vagy anagrelid, interferon) - 2,4%
- Hydroxyurea (anagreliddel , interferonnal vagy anélkül) - 4%
- Monotherápia hydroxyureától különböző cytotoxikus szerrel -12%
- Két vagy több cytotoxikus szerrel -17%.
A krónikus myeloproliferativ betegségekben kialakuló bcr/abl negatív akut leukaemia prognózisa igen kedvezőtlen, a medián túlélés a blasztos transzformációtól számítva 5 hónap.
Érintett szervrendszer(ek)
A PV szisztémás megbetegedés, manifesztációi artériás és vénás thrombosisban nyilvánulhatnak meg. Az érintett erek által ellátott szervek ischémiás károsodást szenvedhetnek, mely funkciókiesésben nyilvánul meg. A központi idegrendszer, a myokardium és az abdominális vérkeringés károsodik a leggyakrabban.
Gyakori társbetegségek
Egyéb betegségekkel való gyakori jellemző társulása nem ismert.
Ellátási folyamat leírása, ellátási algoritmus
1. PV gyanúja: akcidentálisan észlelt laboratóriumi eltérés vagy panaszok/tünetek jelentkezése esetén a beteget további vizsgálatok céljából szakrendelésre szükséges irányítani
2. Alapvizsgálatok: anamnézis, fizikális vizsgálat, rutin labor és képalkotó diagnosztikai vizsgálatok
3. Polyglobulia differeciáldiagnosztika
4. Egyéb krónikus myeloproliferativ betegségek kizárása
5. Kezelési terv (alternatívák)
6. A PV-s beteg gondozása
Diagnosztikai eljárások - elvégzendő vizsgálatok (alapelv)
Anamnézis
A beteg panaszainak kezdetéről, panaszainak jellegét kérdezzük. Célzott kérdéseket teszünk fel a PV-ban gyakori általános és vazomotoros tünetekre, valamint az esetleg korábban előfordult thrombosisra, vérzésre.
Fokozott figyelmet kell fordítani a társbetegségekre, általános állapotra, a gyógyszerszedési szokásokra. A foglalkozási és környezeti anamnézis elengedhetetlen. A családi anamnézisben a halmozódó betegségek, onkológiai és hematológiai betegségek előfordulása explorálandó.
Fizikális vizsgálat
Megtekintés, tapintás - lép (70%-ban splenomegalia) és májnagyság (40%-an hepatomegalia), az arc plethorája (67%), erythromelalgia. A konjunktiva belöveltsége és a szemfenék vénáinak teltsége is jellemző lehet. A bőrön excoriatio nyoma
árulhatja el a pruritust. Köszvényes izületi deformitás, tophusok előfordulhatnak, valamint a fizikális vizsgálat során az előrement thrombosisok okozta eltérések is feltűnnek (hemiparesis, mélyvénás thrombosis, stb.).
Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok és azok gyakorisága (felhasznált bizonyítékok, azok szintjei és forrásai)
Laboratóriumi vizsgálatok
a) vérkép vizsgálata: növekedett Ht és Hb érték, az esetek 60%-ban a thrombocytaszám >400 000/ul, a leukocyta szám pedig 40%-ban nagyobb12 000/ul-nél (pontosabb az abszolut granulocytaszám meghatározása - ez jellemzően >10.000/ul). A vérkenet mikroszkópos vizsgálata normális sejtmorphológiát mutat.
b) egyéb vérvételi paraméterek vizsgálata: süllyedés (0-1mm/ó), se-vas, sTfR, ferritin
c) Az növekedett vörösvérsejt tömeg igazolása a polycythaemia vera study group korábbi (l. A függelékben) diagnosztikus kritériumaihoz hozzátartozott. A meghatározás higításos izotóp módszerrel történik. Férfiakon kóros értéknek számít, ha a térfogat >36ml/ttkg, nőknél >32ml/ttkg. A határértéket mutató betegek esetleg a betegség korai vagy inaktív fázisában voltak. A Haematológia Nemzetközi Standardizáló Tanács javasolja, hogy testsúly helyett testfelületre vonatkoztassuk a vörösvérsejt tömeget. Az érték pathognosztikus, ha 25%-al meghaladja a normális tartomány felső határát. A másik említésre méltó megfigyelés az, hogy azoknál a férfiaknál, akiknek Hb értéke >18,5g% vagy Ht értéke >56%, illetve nőknél Hb >16,5g% ,ill. Ht >50% a teljes vörösvértest tömeg gyakorlatilag mindig emelkedett.
Fenti megfigyelések az ilyen esetek többségében feleslegessé teszik a vörösvértesttömeg izotópos meghatározását.
d) Clonalis abnormalitás. A PV-s betegek csaknem 100%-ában pozitiv a V617F JAK2 mutáció - pozivitása a 14-es (95%) és a 12-es (5%) axont involválhatja. A JAK2 pozivitás segít a szekunder polycythaemiától való elkülönítésben. Nem teszi azonban lehetővé a betegség elkülönítését esszenciális thrombocythaemiától, illetve myelofibrosistól.
e) A szérum erythropoetin szint PV-ban alacsony. A vizsgálat szenzitivitása 64%, a specificitása pedig 92-99%-os. Hypoxiás állapotban és erythropoetint termelő daganatokban az erythropoetin szint emelkedett. Ritka diagnosztikus problémát jelenthet az EPO receptor mutációja, mely szintén alacsony EPO szinttel jár.
f) Endogén erythroid kolónia képződés igazolása - azaz a kolóniák fejlődése erythropoetin nélkül - jellemző PV-ra. E vizsgálat elvégzéséhez kutató laboratóriumi feltételek szükségesek. Értékes vizsgálat, amely 100%-os specificitással és szenzitivitással rendekezik.
g) Csontvelőbiopszia (crista biopszia) elvégzése, szövettani vizsgálat szükséges a JAK2 negatív esetekben. A szövettani vizsgálat hypercellularitást és emelkedett megakaryocyta számot, valamint fokozott retikulin tartalmat igazol PV-ban. A csontvelő cytológiai vizsgálata (aspirátum) a betegek 90%-ban fokozott cellularitást és az esetek 94%-ában hiányzó raktárvasat mutat.
Képalkotó vizsgálatok
Hasi ultrahang vizsgálattal a lép- és májnagyságot pontosabban meghatározhatjuk - a hasi UH vizsgálat a két leggyakoribb EPO termelő tumort is láthatóvá teheti: a vese és máj elsődleges daganainak kimutatására kiválóan alkalmas.
Kiegészítő diagnosztikai vizsgálatok, differenciál diagnosztika
ETTKG vizsgálat, echokardiographia, végtagok és az abdominális erek Doppler sonographiás vizsgálata, sz.e. angiographia thrombosisos szövődmények esetén
PV diagnózisának 2 alapvető kritériuma a WHO javaslata alapján:
1. A növekedett vörösvértest térfogat igazolása izotóp-dilúciós módszerrel vagy a Hb és Ht érték ismételten észlelt extrém növekedése (ffi: Hb >18,5,
Ht: >56%, nő: Hb > 16,5g%, Ht: >50%)
2. A szekundaer polycythaemiát okozó betegségek/állapotok kizárása, beleértve a hypoxia, a familiáris polycythaemia, a nagy affinitású haemoglobin vagy EPO-receptor eltérés és az EPO termelő daganatok kizárását.
A két alap-kritérium teljesülése esetén a WHO javasolja a következő eltérések közül még minimum egy kritérium igazolását:
Splenomegalia
Klonális genetikus abnormalitás - JAK2 mutáció igazolása Spontán endogén erythroid kolónia képződés
Ha a másodrendű kritériumok közül (splenomegalia, JAK2, endogén erythroid kolónia) egyik sem teljesül, akkor a két alapkritériumon kívül a következő eltérések közül 2-nek (vagy többnek) jelen kell lennie:
Thrombocyta szám >400.000/ul
Fehérvérsejt szám >12.000/ul
Alacsony EPO szint
Panmyelosis a csontvelőben prominens erythroid és megakaryocyta proliferációval, retikulin szaporulattal
III. A kezelés alapelvei
Csaknem minden esetben palliativ kezelésről van szó, a betegség nem gyógyítható.
A PVSG prospektiv tanulmánya szerint az alapkezelés a phlebotomia. A terápiás cél a Ht érték férfiaknál 45, nőknél 42 alatt tartása. A phlebotomia hatásossága a kialakuló relativ, illetve abszolut vashiánynak köszönhető. Vaspótlást nem szabad alkalmazni.
Fokozott thrombosis rizikó (anamnesisben thrombosis, vagy 60 év feletti életkor) esetén a phlebotomiával egyidőben hydroxyurea kezelést kezdünk 15-20 mg/die kezdő dózissal. A hydroxyurea hatása 3-5 nap alatt érvényesül - ezért hetente maximum egyszer szabad a dózisát változtatni.
Minden betegnek kis dózisú (50-100 mg/die) aszpirint kell adni, akin nincs az anamnesisben nagy vérzés vagy aszpirinintolerancia. Nagyobb dózisú kezelés nem ajánlott.
IFN-alpha adása reproduktiv életkorú nők esetén indokolt. Dózisa hetente 4,5-27ME, átlagosan 3x3M E /hét (2C).
Kezelési lehetőségek
Vérlebocsájtás: azonnali eredményt nyújt, fenyegető komplikáció esetében igen eredményes.A diagnózis felállítása után a cytoreduktiv kezelés hatásának eléréséig feltétlenül szükség van rá. A beavatkozás a vérképnek és a klinikai állapotnak megfelelően ismételhető, akár hetente is.
Erythrocytapheresis sejtszeparátorral: azonnali eredményt nyújt, fenyegető komplikáció esetében igen hasznos. Erythrocytapheresist extrémen emelkedett Ht érték esetén végzünk, 60%-os haematokrit érték felett, így ugyanis a Ht érték csökkenése jóval nagyobb mérvű, mint vérlebocsájtással.
A vérlebocsájtás a vérképnek megfelelően ismételhető, krónikus alkalmazása esetén általában hetenként végezzük. Fiatal betegeken, akiken korábban nem fordult elő thrombosis és nincs thrombocytosisuk sem, krónikus kezelésként is alkalmazható. Amennyiben a beteget csak phlebotomiával kezeljük, a thrombosis-gyakoriság 23% (HU-val 9%).
A tartós cytoreduktiv kezelés
Hydroxyurea (HU) kezdeti dózisa az első héten 30mg/ttkg, majd a második héttől 15mg/ttkg naponta per os, osztott adagokban, átlagos napi adagja: 0,5-2g. A therápiás cél a Ht érték 45(férfi)-42%(nő)-ra történő beállítása. A HU mellékhatásai: szájnyálkahártya fekélyek, bőrpigmentáció, köröm elváltozások. A betegek csekély hányadánál alszárfekélyek, nausea, diarrhoea és alopecia jelentkezhet. Igen ritkán láz, illetve a májspecifikus enzimértékek pathológiás eltérése is kialakulhat. Terhesség és lactatio alatt nem alkalmazható és kerülni kell használatát terhességet tervező fogamzáskorú nőknél is (II/C). A gyógyszer megaloblastos eltéréseket okoz, valamint enyhe anaemiát és fehérvérsejtszám csökkenést. Az MCV értéke a kezelés alatt emelkedik - ha ez az emelkedés elmarad, akkor ez azt jelenti, hogy a beteg nem veszi be a gyógyszert. A gyógyszer gyorsan hat, 3-5 nap alatt már változást okoz a vérképben. Túl gyakran nem szabad változtatni a HU dózisát, mert ez nagy sejtszám fluktuációhoz vezethez. Az első 3 hónapban gyakorta kell a vérképet és a "májfunkciót" ellenőrizni. A thrombosisok gyakorisága az első két HU-val kezelt évben 9%. Az akut leukaemia kialakulásának gyakorisága 6-10% - kialakulását olyan betegeknél észleljük, akik több, mint 6 éve szednek HU-t. A csak phlebotomiával kezelt betegek leukaemiás transzformációs gyakorisága 6%. Interferon-a polycythaemia vera-ban jelenleg nincs Magyarországon törzskönyvezve. Terhességben nagy rizikójú PV esetén feltétlenül szükséges az adása (II/C), hiszen ekkor minden egyéb cytoreduktiv gyógyszer adása ellenjavallt. HU intolerancia esetén szintén interferon a válaszandó kezelés, egyéni méltányossági kérelem alapján beszerezhető. Adagolása általában 3x hetente 3ME IFN-a, subkután. Tartós alkalmazása 75-88%-ban eredményez haematológiai remissziót. A kívánt Ht értéket egy hónapon belül érjük 3x3ME interferon hatására. A fenntartó kezelés dózisát a sejtszámok alakulása befolyásolja. Az interferon alfa pegylált formában történő adása az ideális.
Egyéb cytoreduktiv gyógyszerek, amelyeket hydroxyurea mellékhatás esetén adhatunk: pl. a busulphan, valamint a pipobroman, ez utóbbi dózisa 1mg/ttkg naponta. Egyéni importtal szerezhetők be, Európában széleskörben alkalmazzák. A busulphan adagja 3-6 mg/die.
Anagrelid alkalmazására rekrafter esetekben kerülhet sor, kölönösen extrém thrombocytosis esetén. Vérlebocsájtással kiegészítve krónikus kezelésre is alkalmas ezekben az esetekben. Napi 2x1mg kezdő dózis ajánlható, a maximális dózis általában 4mg naponta.
A radiofoszfor (32P) alkalmazása kizárólag olyan idős betegeken jön szóba, akiken a rendszeres kontrollvizsgálat és/vagy a rendszeres gyógyszerbevétel nem biztosítható és a várható élettartam kevesebb 10 évnél. Adása után az AML előfordulása 4,2%-os. Dózisa 2.3 millicurie/m2 a dózisa. Igen ritkán használjuk. Hatása hosszú hónapokig tart, évente 1x-2x kell ismételni.
Szupportiv gyógyszerek
A ciklooxigenáz inhibitor gyógyszerek. Az acetylsalicylsav a mikrovascularis thrombosis, erythromelalgia, TIA, fejfájás kezelésére, az u.n. vasomotoros tünetek megszüntetésére igen eredményesen alkalmazható napi 50-100 mg-os dózisban. Napi 100mg dózis felett a gasztrointesztinálisvérzések gyakorisága emelkedett. Azok az antithrombocyta gyógyszerek, amelyeknek nincs ciklooxigenáz gátló hatása, nem eredményesek, s hasonlóképpen nem használ a kumarin sem vasomotoros tünetek esetén.
Allopurinol adása emelkedett húgysav-szint esetén, valamint cytoreduktiv kezelés megkezdésekor szükséges, ennek szokásos adagja 300mg-600 mg naponta.
Antihistamin szerek. Kínzó bőrviszketés esetén az alapbetegség megfelelő kezelésén kívül antihistamin adása (pl. cyproheptadin) és H2 blokkoló szer (pl. ranitidine) együttes adása javasolt. A szupportiv kezelést a tünetek jelentkezésének megfelelően kell folytatni. Újabban szerotonin inhibitorokat is eredményesen használnak bőrviszketés kezelésére, pl. paroxetint, fluoxetint (10-20 mg/die).
Várható gyógyszer mellékhatások
A myeloszuppressziv kezelés (HU, busulphan, piporoman) mellékhatásaként rövid távú mellékhatásként csontvelődeppresszió alakulhat ki (anaemia, granulocytopenia, thrombocytopenia). A másodlagos leukaemia incidenciájának valószínűsége PV-ban 6%-os myeloszuppressziv kezelés nélkül. A HU kezelés melletti leukaemias transzformáció gyakoriságát illetően nem egységes a szakirodalom. A legtöbb tanulmány szerint 6-10%-os az előfordulás és talán a HU kezelés időtartamával arányos. A postpolycythaemiás myelofibrosis kialakulása kizárólag a betegség fennállásának tartamától függ, eddigi adataink szerint a kezelés nem befolyásolja. A HU egyéb mellékhatása: bőrpigmentáció, bőrkiütés, körömdeformitás, szájüregi fekélyek, ritkábban lichen planusra emlékeztető szájnyálkahártya - és bőrtünetek, lábszárfekély, láz, májspecifikus enzimszint emelkedés. Az interferon-afontosabb mellékhatásai: a kezelés bevezetésekor infulenza-szindróma lázzal, végtagfájdalommal, hidegrázással. Megkezdett kezelés mellett csontvelődepresszió alakulhat ki thrombocytopeniával, granulocytopeniával anaemiával. Hypertonia, psychosis, depresszió, étvágytalanság, fogyás jelentkezhet folyamatos kezelés mellett. Az aszpirin kezelés mellékhatásaként gasztrointesztinális vérzés jelentkezhet.
Az anagrelid főbb mellékhatásai a fokozott oedemakészség, cardiomyopathia, fáradtság, láz, palpitatio, fejfájás, csontvelői retikulin tartalom emelkedése.
Az ellátás megfelelőségének indikátorai
Mivel nem megelőzhető betegségről van szó, primer prevenció nem lehetséges. Szürővizsgálat nem költséghatékony. Használható mutatók:
1. Az első tünet és/vagy panasztól a PV felismeréséig eltelt idő.
2. Az adott évben felfedezett (regisztrált) új betegek (incidencia) és az ellátottak aránya.
3. A prognosztikai tényezők alapján a javasolt terápiás algoritmusok alkalmazásával kezelt betegek számának aránya.
4. A kezelés sikerességének mutatói: a kezelésre válaszolók aránya és teljes túlélés, valamint az alapbetegség szövődményei miatt jelentkező mortalitás.
5. Az adott év daganatos mortalitásának és morbiditásának (incidencia, prevalencia) aránya.
6. Az adott évben elhalálozott betegek átlagos túlélési ideje a diagnózis felállítása és a halál bekövetkezése között.
Az irányelv bevezetésének feltételei
Az ellátás tárgyi, személyi, szakmai/képzési és egyéb feltételei szempontjából az ET ellátásában kompetens szakterületek intézményi egységeinél az Egészségügyi Minisztérium és az Állami Népegészségügyi és Tisztiorvosi Szolgálat - mindenkor hatályos - rendelkezéseibe foglalt szakmai (tárgyi és személyi) minimumkövetelményeknek, beutalási elveknek és az orvos-, szakorvos-képzés, valamint a kötelező továbbképzések (akkreditáció) követelmény rendszerének történő megfelelés határozza meg az irányelvek vagy a protokoll bevezetését, alkalmazását. A helyi eljárásrendet - a jelen ajánlások felhasználásával - az adott intézmény készültsége alapján kell kialakítani a progressziv ellátórendszerben elfoglalt helyének megfelelő intézményi kapcsolatok (együttműködési megállapodások, szerződések) figyelembe vételével. A betegnek biztosítani kell a második szakértői vélemény (second opinion) kérésének lehetőségét is.
IV. Rehabilitáció
IV. Gondozás
A betegek túlélése a kezelés és folyamatos gondozásnak is függvénye.
A PV-s beteg kezelése hematológiai centrumokban vagy decentrumokban történhet, a kontroll vérvételt a területileg illetékes szakrendelőben is végezhetik. A PV-s beteg kezeléséért, gondozásáért a szakrendelést végző haematológus vagy klinikai onkológus szakorvos felelős. Az adott terápiát hematológus vagy onkológus szakorvos rendelheti el.
Szükséges dokumentumok, bizonylatok
A beteg ambuláns jelentkezéseit az ambuláns lap és napló, az intézeti kezeléseit a kórlap, a lázlap, az ápolási dokumentáció és zárójelentés rögzíti, amely tartalmazza a beteg felvilágosítását, beleegyezését (aláírásával hitelesítve) a vizsgálatokba és kezelésekbe. Minden vizsgálati eredményt, kezelést dokumentálni kell az ambuláns lapon vagy kórlapban (decursus, lázlap, ápolási napló). PV-s betegnél fel kell tüntetni a korábbi betegségeket, az első tünetek és panaszok jelentkezésének idejét, fizikális státusát. A beteg távozásakor javaslatot kell tenni az életmód, diéta és az otthon szedendő gyógyszerekre és konkrétan meg kell határozni a következő ellenőrző vizsgálat időpontját és a vényre felírt gyógyszereket.
VI. Irodalomjegyzék
1. Barosi G, Burgegard G, Finnazzi, Griesshammer M, Harrison C et al.: Response criteria for essential thrombocythaemia and polycythemia vera: result of a European LeukemiaNet consensus conference. Blood 2009; 113: 4829-33.
2. Spivak JL, Silver RT: The revised World Health Organization diagnostic criteria for polycythmia vera, essential thrombocytosis, and primary myelofibrosis: an akternative proposal. Blood 2008; 112:231-238.
3. Spivak JL.: Narrative review: thrombocytosis, polycythaemia vera, and JAK2 mutations: The Phenotypic mimicry of chronic myeloproliferation, Ann.Intern Med 2010;152:300-306.
4. Tefferi A, Thiele J, Crazi A et al.: Proposal and rationale for revision of the World Health Organization diagnostic criteria for polycythaemia vera, essential thrombocytemia, and primary myelofibrosis: recommendations from an ad hoc international expert panel. Blood 2007; 110:1092-1097.
Kapcsolódó internetes oldalak
Magyar Hematológiai és Transzfuziológiai Társaság honlapja - www.mhtt.hu www.update.com@2010UpToDate file://E:/UptoDate(Stanford)/PVThUptoDate.htm file://E:/UptoDate(Stanford)/PVDgUptoDate.htm
VII. Melléklet
Az irányelv fejlesztés módszerei
A szakmai irányelv érvényessége: a megjelentetéstől számított 3 év, illetve ezen belül a jelen ajánlásoktól lényeges kérdésben eltérő új tudományos eredmény megjelenése.
A szakmai irányelv "Nemzeti Erőforrás Minisztérium által"-i kiadása, a szakma szabályai közé történő beépítése és az erre vonatkozó kiadmányozói jog nem korlátozza a dokumentum tartalmi elemeinek kidolgozásában közreműködő szakértők szellemi produktumához fűződő szerzői jogát, azaz nem zárja ki e tartalmi elemek más formátumú tudományos publikációként való megjelentetését.
Táblázatok
Az erythrocytosis főbb okai
Autonóm (nem fiziológiás)
EPO szint emelkedés
Erythropoetin-termelő tumorok
Vesesejtes carcinoma
Hepatocellular carcinoma
Haemangioblastoma
Uterus fibrinoid
Eythropoetin termelő vesebetegségek
Vesetranszplantáció utáni állapot
Fiziológiás erythropoetin szint emelkedés
Hypoxia okozta EPO emelkedés
Krónikus pulmonális betegség
Jobb-bal szív shunt
Alvási apnoe
Masszív obesitas (Pickwick szindróma)
Magas helyen történő tartózkodás
Vörösvérsejt defektusok
Kongenitális methemoglobinopathia egyes esetei
Krónikus szénmonoxid mérgezés
Kobalt
Őssejt és szomatikus mutáció okozta polycythaemia
Polycythaemia rubra vera (PV) EPO receptor aktiváló mutációi
Chuvash polycythaemia
Methaemoglobinaemia
Idiopathiás familiaris polycythaemia
Magas oxigén affinitású haemoglobinok
A 2,3-difoszfoglicerát (DFG) mutáz hiánya
Egyéb okok
Androgén és egyéb anabolikus steroidok alkalmazása
Rekombináns erythropoetin injekció alkalmazása (doping)
Relativ erythrocytosis (plazmavolumen koncentráció) okai
Hányás
Hasmenés
Diuretikumok
Izzadás
Polyuria
Hypodipsia
Hypoalbuminemia
Capillary leak szindróma
Égés
Peritonitis Hypertensio D
ohányzás Ethanol abuzus
A Polycythaemia Vera Study Group diagnosztikus kritériumai
Major kritériumok
1. Emelkedett vörösvérsejt térfogat Ffi: >36ml/ttkg
Nő: >32ml/ttkg
2. Artériás oxygén szaturáció >92%
3. Splenomegália Minor kritériumok
Thrombocyta szám >400 000/ul Fvs szám >12 000/ul*
GAPA- granulocyta alkalikus foszfatát score >100*
Szérum B12 szint >900pg/ml vagy szérum B12 kötőkapacitás >2 222pg/mln
A PV diagnózisa kimondható, ha mindhárom major kritérium teljesül vagy az első kettő (1., 2.) és a minor feltételek közül bármelyik kettő. *Láz és infekció kizárandó
nEzt a két minor kritériumot jelenleg nem használjuk általánosan
A WHO által javasolt polycythemia vera diagnosztikus kritériumok
Maior kritériumok
1. Hb ffi: >18,5g%, nő >16,5g% vagy egyéb emelkedett vörösvérsejt tömeget bizonyító evidencia
5. JAK2 617V>F vagy egyéb funkcionálisan egyenértékű mutáció - JAK2 exon12 mutáció jelenléte
Minor kritériumok
1. Csontvelő szövettan, mely mindhárom sejtvonalra vonatkozó prominens hypercellularitást mutat
2. Az erythropoetin szérum koncentrációja a normális referencia szintnél alacsonyabb
3. Endogén erythroid kolónia növekedés in vitro
A PV kezelésének algoritmusa
A Polycythaemia vera kezelése
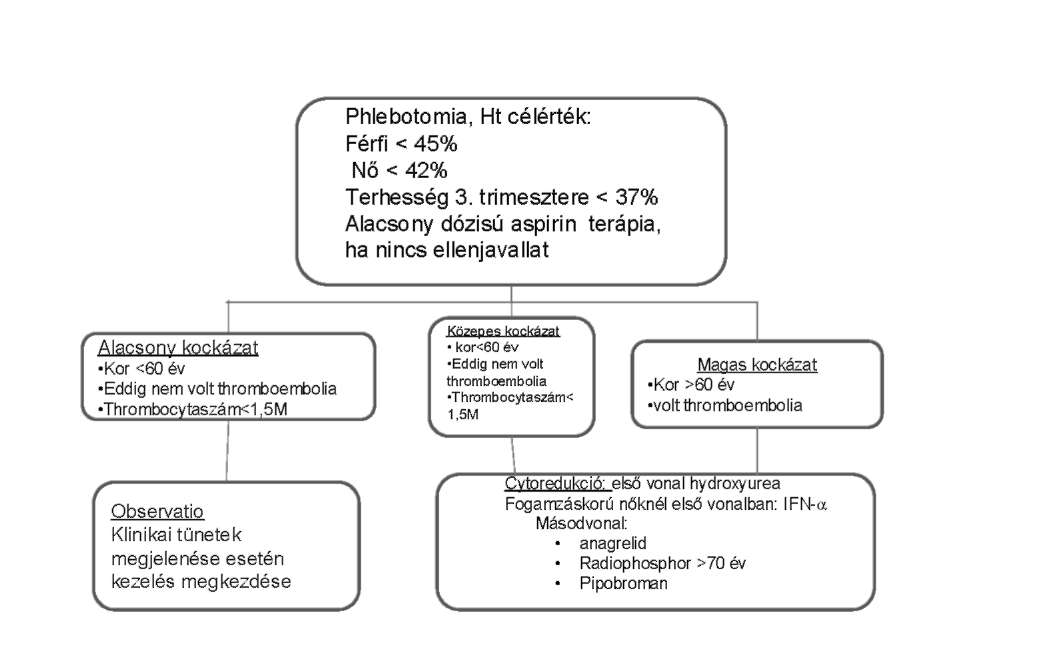
ESSENTIÁLIS THROMBOCYTHAEMIA (ET)
I. Alapvető megfontolások
1. Az irányelv alkalmazási/érvényességi területe
A vezérfonal ajánlásait alkalmazni kell a hazai egészségügyi ellátó rendszer szintjein, az alapellátás és a járó/fekvőbeteg szakellátás feladatait - ÁNTSZ engedéllyel - végző, a minimum feltételeknek megfelelő intézményekben; a 18 év feletti ET-ban szenvedő betegek diagnosztizálása, vizsgálata, kezelése során.
1.1.A irányelv témájának pontos meghatározása, a témaválasztás indoklása
Az essentiális thrombocythaemia előfordulásáról, felismeréséről, természetéről és kezeléséről szóló tudományos ismeretek - bizonyítékokon alapuló (EBM) - összefoglalása, valamint a diagnosztika és a therápia algoritmusának leírása. A cél a betegek nagyobb remissziós aránya, vérképük normalizálása, hogy életminőségük jobb legyen és élettartamukat ne befolyásolja a betegség.
1.2. A vezérfonal célja
Közvetlen cél, hogy egységes diagnosztikus, terápiás irányelvek alkalmazásával az ET (BNO-D4730) betegek kezelési eredményei jobbak legyenek és kevesebb komplikáció lépjen fel. Fontos a betegek ellátásának egységesítése és a jelenlegi ellátásban tapasztalható egyenetlenség felszámolása. Az ellátás biztonságát és magasabb színvonalra emelését olyan egységes módszerek alkalmazása szolgálja, amelyek eredményesek, költséghatékonyak és megfelelnek a szakma szabályainak, valamint a nemzetközi és hazai konszenzussal elfogadott szakértői álláspontnak (expert opinion). talaján állnak.
Másodlagos cél a jelen ajánlások további alkalmazása más eljárásrendek, kapcsolódó folyamat-szabályozások (pl.: finanszírozás, belső minőségirányítás, stb.) kidolgozásában.
1.3. A vezérfonal célcsoportjai (ellátottak és az irányvonalat alkalmazó ellátók köre, ellátási szint).
Ellátottak az ET célcsoportjai: az ET felfedezését elősegítő általános/rutin vagy szűrő jellegű vizsgálatokon résztvevő panasz/tünetmentes személyek, továbbá az ET konkrét gyanúját tisztázó, vagy a diagnózist pontosító (speciális) diagnosztikai célú beavatkozásokban, valamint az ET diagnózisa alapján akut ellátásban vagy krónikus gyógykezelésben részesülő betegek. Ellátók az irányelvekben szereplő diagnosztikus és terápiás tevékenységet végző valamennyi egészségügyi szolgáltató az 1. pont alatt meghatározott ellátási szinteken és ellátók körében - különös tekintettel a hematológiai betegek ellátására szervezett centrumok/decentrumok rendszerében együttműködő intézményekre és szolgáltató egységekre.
Az ellátás valamennyi formájának speciális szempontja az ET kezelése mellett a betegség akut és krónikus szövődményeinek felismerése.
2. Definiciók
A krónikus myeloproliferativ betegségeket (CMPB) több alcsoportra oszthatjuk, melyek közül négy csoport jól definiálható: a krónikus myeloid leukaemia (CML), a polycythaemia rubra vera (PRV), a primer (osteo)myelofibrosis (OMF) és az esszenciális thrombocythaemia (ET). A CML, a PRV és az OMF diagnózisának megállapítása jól definiált diagnosztikus és klinikai módszerekkel történik. Az ET diagnózisa kizárásos diagnózis: egyrészt a reaktiv thrombocytosisok, másrészt a többi krónikus myeloproliferativ betegség kizárásán alapszik. Egyelőre sem cytogenetikailag, sem morfológiailag nem tudjuk az ET-t definiálni. Az ET olyan nem reaktiv thrombocytosisos állapotot jelöl, amelynek hátterében sem más krónikus myeloproliferativ megbetegedés, sem myelodysplasiás szindróma (MDS) nem igazolható.
3. A betegség/állapot leírása
3.1.Kockázati és kiváltó tényezők
Patogenezis
Az ET klonális őssejt megbetegedés: klonalitását glukóz-6-foszfátdehidrogenáz enzim, valamint DNS és transcriptiós analizis vizsgálatokkal igazolták.
Sem a thrombopoetin (TPO), sem ennek receptora (c-Mpl) nem érintett az ET patogenezisében. Néhány ritka esetben leírták a c-Mpl gén mutációját. Az endogén megakaryocyta colonia növekedés nem autokrin TPO stimuláció következménye. Az autoszomális familiáris essentiális thrombocythaemiában a TPO és c-Mpl gének mutációi okozzák a TPO mediált thrombocytosist.
ET-ban a TPO szint normális vagy kissé emelkedett lehet, a thrombocyták c-Mpl expressziója pedig csökkent.
3.2. Genetikai háttér
A betegség nem öröklődik, genetikai háttér a kialakulásában nem igazolt. Elkülönítendő a legtöbbször már gyermekkorban jelentkező autoszomális essentiális thrombocythaemia, melyet a TPO és c-Mpl gének mutációi okoznak.
3.3. Incidencia/Prevalencia/Morbiditás/Mortalitás Magyarországon
Az ET incidenciája 2,5/100 000 lakos/év, mely nemzetközileg átlagosnak tekinthető. Újabb adatok szerint az ET nem befolyásolja lényegesen a túlélést és ezért prevalenciája jóval nagyobb, mint a megállapított diagnózisok száma, becslések szerint 24/100.000 lakos. A magyarországi incidencia 2008-ban 234 beteg.
3.4. Jellemző életkor és nem
A diagnóziskor a medián életkor 60 év. A betegeknek mintegy 20%-a fiatalabb 40 évnél. A nők predominanciája jellemző, a nő/férfi arány 2:1.
3.5.Panaszok, Tünetek, Általános jellemzők
Az ET-s betegek fele tünetmentes a betegség felismerésekor. A jellemző tünetek egyrészt a vazomotoros szindróma körébe tartoznak, másrészt manifeszt thrombózissal vagy vérzéssel jelentkeznek.
A vazomotor szindrómás manifesztációk: fejfájás, szédülés, syncope, atipusos mellkasi fájdalom, acralis paraesthesia, kínzó bőrviszketés, livedo reticularis, erythromelalgia, átmeneti látási zavarok. Tanulmányok igazolják a thromboxan dependens thombocyta aktiváció és a következményes, erythromelalgiát okozó arteriás microvascularis thrombosis közötti korrelációt. Ezek a vazomotoros tünetek nehezen tolerálhatók, de általában nem veszélyesek és nagyon jól befolyásolhatók alacsony dózisú acetylsalicylsav kezeléssel (ASA). A betegek kis része rezisztens az ASA kezelésre és cytoredukiv therápia bevezetése válik szükségessé.
A thrombosis 9-22%, vérzés pedig 3-37%-ban fordul elő a diagnóziskor. A különböző nagy tanulmányokban. 9 éves követéses vizsgálatban thrombosis a betegek 18%-ában, vérzés pedig a 4%-ban fordult elő.
A thrombotikus események: tranziens ischémiás attack (TIA), retinális artéria vagy véna elzáródás, coronaria occlusio, pulmonális embolia, vena hepatica és vena porta elzáródás, alsó végtag mélyvénás thrombosis, digitalis ischaemia. A digitális ischaemia jelentkezhet Raynaud fenoménnal és manifesztálódhat az ujjvégek nekrózisában is. Egyidejű orális kontraceptiv therápia a thrombosisok arányát 3-5-szörösére emelheti.
A vérzéses szövődmények különösen extrémen emelkedett thrombocyta szám mellett gyakoriak (>1M), valamint 325mg-nál nagyobb ASA kezelés,illetve NSAID adása után. Az extrém thrombocytosissal járó esetekben gyakori a szerzett von Willebrand betegség. Cytoreduktiv therápia bevezetése általában megszünteti a klinikai és a laboratóriumi eltéréseket.
A posztoperativ thrombosis és vérzés rizikója még a jól kezelt és/vagy adekvát thrombosis profilaxisban részesülő betegeken is nagy.
Az ET egyéb kórképekbe való transzformációja előfordul: akut myeloid leukaemia 0,6-5%-ban. Egyes megfigyelések szerint az AML-be történő transzformáció a több szerrel kezelt betegeken gyakoribb, de előfordul kezeletlen esetekben is. Terhesség esetén gyakori (45%) a spontán abortus - ezt a gyakoriságot nem befolyásolja az ASA therápia. A terhesség alatt a thrombocyta szám jelentősen csökken ET-s betegeken, átlagosan megfeleződik. A terhességi szövődmények szignifikánsan gyakrabban jelentkeznek V617F JAK2 mutáció jelenléte esetén.
3.6. Prognózis
A legtöbb beteg életkilátása nem külöbözik az azonos korú személyek életkilátásától. A morfológiailag és cytogenetikailag kivizsgált betegeken (ha a PRV, OMF, CML, MDS-t korrekten kizárták) a későbbi AML, illetve post-ET myelofibrosis kialakulása ritka: AML 2%-ban, MF 4%-ban jelentkezett. Egy nagy retrospektiv tanulmány szerint 15 éves megfigyelés alatt 17%-ban következett be thrombosis. Thrombosis kialakulása gyakoribb a JAK2 pozitiv betegek körében.
Rövidebb túlélésre lehet számítani a következő rizikófaktorok jelenléte esetén: anaemia, előrehaladott életkor, emelkedett leukocyta szám (>15.000), dohányzás, diabetes mellitus, lezajlott vénás thrombosis.
Egyszerűsített medián túlélés-becslése
Alacsony rizikójú csoport (életkor <60 év, fvs<15 000) - 25 év
Közepes rizikójú csoport (életkor >60 év vagy fvs >15 000) - 17 év
Magas rizikójú csoport (életkor >60 év és fvs >15 000) - 10 év
3.7. Érintett szervrendszer(ek)
Az ET szisztémás megbetegedés, manifesztációi artériás és vénás thrombosisban nyilvánulhatnak meg. Az érintett erek által ellátott szervek ischémiás károsodást szenvedhetnek, mely funkciókiesésben nyilvánul meg. A központi idegrendszer, a myokardium, a retina és a végtagok akrális része károsodik a leggyakrabban.
3.8. Gyakori társbetegségek
Egyéb betegségekkel való gyakori jellemző társulása nem ismert. Évtizedekig tartó megbetegedés, az előforduló társbetegségek megegyeznek a "normál populációban" előforduló kórképekkel.
4. Ellátási folyamat leírása, ellátási algoritmus
1. ET gyanúja: akcidentálisan észlelt laboratóriumi eltérés vagy panaszok/tünetek jelentkezése
2. szakrendelés: anamnézis, fizikalis vizsgálat, rutin labor és képalkotó diagnosztikai vizsgálatok)
3. Thrombocytosis differeciáldiagnosztika:
4. Egyéb CMP betegségek kizárása
5. Kezelési terv (alternatívák)
6. Az ET-s beteg gondozása
II. Diagnosztikai eljárások
2.1. Anamnézis
A beteg panaszainak kezdetéről, panaszainak jellegét kérdezzük. Célzott kérdéseket teszünk fel az ET -ben előfordulható vazomotoros tünetekre és panaszokra, korábban előfordult thrombosisra, vérzésre.
Fokozott figyelmet kell fordítani a korábbi és jelenlegi társbetegségeire, általános állapotára, gyógyszerszedési szokásaira. A foglalkozási és környezeti anamnézis elengedhetetlen. A családi anamnézisben a halmozódó betegségek, onkológiai és hematológiai betegségek előfordulása fokozottan explorálandó.
2.2. Fizikális vizsgálat
megtekintés, tapintás - lépnagyság, erythromelalgia, ujjhegynekrózis, neurológiai vizsgálat
2.3. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok és azok gyakorisága (felhasznált bizonyítékok, azok szintjei és forrásai)
2.3.1.Laboratóriumi vizsgálatok
a) vérkép vizsgálata: ismételt, konzekvens thrombocytaszám emelkedés >450.000/ul, a vérkenet mikroszkópos vizsgálata alkalmával a leukoerythroblasztos vérkép, dacryocyták myelofibrosisra vagy csontvelői szolid tumor metasztázisra utalhat
b) egyéb vérvételi paraméterek vizsgálata: süllyedés, CRP, se-vas, sTfR, ferritin, RF
c) JAK2 vizsgálata: a betegek mintegy felében pozitiv a V617F JAK2 mutáció - pozivitása segít a reaktiv thrombocytosis elkülönítésében
d) A BCR/ABL gén átrendeződés vagy a Philadelphia kromoszóma vizsgálata a CML differenciáldiagnózisát teszi lehetővé
e) csontvelőbiopszia (crista)- szövettani mintavétel szükséges a myelofibrosistól történő elkülönítésre
f) a csontvelő cytogenetikai vizsgálatával az 5q-szindrómát (MDS) zárhatjuk ki
g) von Willebrad betegség szűrővizsgálat elvégzése azoknál a betegeken, akiknél a thrombocyta szám >1M
2.3.2. Képalkotó vizsgálatok
Hasi ultrahang vizsgálattal a lépnagyságot pontosabban meghatározhatjuk
2.3.3. Kiegészítő diagnosztikai vizsgálatok, differenciál diagnosztika
EKG vizsgálat, echokardiographia, végtagok és az abdominális erek Doppler sonographiás vizsgálata, sz.e. angiographia thrombosisos szövődmények esetén.
ET diagnózisa a WHO átdolgozott kritériumai alapján
1. Tartós thrombocytaszám növekedett - >450 000/ul
2. A csontvelő szövettani vizsgálata főként a megakaryocyta sejtvonal proliferációját mutatja többségében nagy, érett megakaryocytákkal, a granulopoesis és az erythropoesis részéről sem fokozott proliferáció, sem balratolódás nem látszik.
3. A PRV, OMF, CML, MDS-t vagy egyéb myeloproliferativ betegséget definiáló WHO kritériumok nem teljesülnek
4. JAK2 617V >F gén vagy egyéb klonális marker demonstrációja vagy klonális marker hiánya esetén reaktív thrombocytosis kizárása
III. Az ET kezelésének alapelvei
Csaknem minden esetben palliativ kezelésről van szó, a betegség nem gyógyítható. A kezelés lehet tüneti (pl. ASA adása) vagy cytoreduktiv. A betegeket több csoportba oszthatjuk aszerint, hogy milyen valószínűséggel alakul ki thrombotikus vagy vérzéses szövődmény. A betegek nagy részének várható élettartama normális. A következő szövődmények esetén alkalmazunk kezelést: Vazomotoros tünetek: kis dózisú salicylsavval könnyen kezelhető tünetek: 40-80 mg/nap po. a szükséges dózis (2C).
Thrombotikus események alacsony rizikójú betegeken viszonylag ritkák, nem tesznek szükségessé élethossziglan adott potenciálisan káros hatással is rendelkező gyógyszeres kezelést (2C). Kardiovascularis rizikó fennállása esetén vagy extrém magas thrombocya szám mellett cytoreduktiv kezelés szükséges. A betegek 20%-ánál a diagnózis thrombotikus esemény alkalmával derül ki, a betegek 15%-nál pedig rekurrens thrombosist észlelünk. Ezeknél a magas rizikójú betegeken indokolt (IB) a cytoreduktiv gyógyszeres kezelés alkalmazása (tehát 60 év felett és /vagy lezajlott thrombosis után)
A vérzéses szövődmények kevésbé gyakoriak és megelőzhetőek, ha az aspirin napi dózisa 80mg/die alatt marad és kerüljük a NSAID-kat. Spontán vérzés jelentkezése esetén a szerzett von Willebrand kórt ki kell zárni.
- Az "alacsony rizikójú" thrombocythaemiás betegeket nem kell kezelni, esetükben elegendő a rendszeres kontrollvizsgálat (2C). Tünetek jelentkezése esetén alacsony dózisú aspirin adása javasolt, ez a kezelés "alacsony rizikójú" csoportba tartozó terhesség esetén is biztonsággal (opcionálisan) folytatható.
- A "nagy rizikójú" betegeknek cytoreduktiv kezelésre van szükségük (IB). A thrombosis valószínűsége ily módon jelentősen csökkenthető (3,6%vs. 24%). Jelen ismereteink szerint a hydroxyurea kezelés a legoptimálisabb lehetőség, az anagrelid kezeléssel összehasonlítva is kedvezőbb prognózist biztosít (thrombosis rizikó 36 vs.55%). A therápiás cél ebben a csoportban a 400.000/ul alatti thrombocytaszám elérése.
A kezelés lehetőségei
3.1. Thrombocythapheresis sejtszeparátorral: azonnali eredményt nyújt, fenyegető komplikáció esetében igen eredményes. Akkor alkalmazzuk, ha gyors thrombocyta-szám csökkenést akarunk elérni, például műtétek előtt vagy aktuálisan fellépő thrombosis, vérzés kezelésére. A beavatkozás a vérképnek és a klinikai állapotnak megfelelően ismételhető.
3.2.. Tartós cytoreduktiv kezelés hydroxureával, alpha interferonnal vagy anagreliddel történhet.
3.2.1. Hydroxyurea (HU) az elsőnek adandó gyógyszer ET-ban. Kezdeti dózisa 15mg/kg naponta per os, osztott adagokban, átlagos napi adagja:0,5-2g. A tartós HU kezelés 24%-kal csökkenti a thrombosis kialakulásának valószínűségét. A therápiás cél a thrombocyta szám 100 000 és 400 000/ul között tartása, hogy a beteg nem legyen anaemiás vagy/és thrombocytopeniás. A HU mellékhatásai: szájnyálkahártya fekélyek, bőrpigmentáció, köröm elváltozások. A betegek csekély hányadánál alszárfekélyek, nausea, diarrhoea és alopecia jelentkezhet. Igen ritkán láz, illetve a májspecifikus enzimértékek pathológiás eltérése is kialakulhat. Terhesség és lactatio alatt nem alkalmazható és kerülni kell használatát terhességet tervező fogamzáskorú nőknél is (2C). A gyógyszer megaloblastos eltéréseket okoz, valamint enyhe anaemiát és fehérvérsejtszám csökkenést. Az MCV értéke a kezelés alatt emelkedik - ha ez az emelkedés elmarad, akkor ez azt jelenti, hogy a beteg nem veszi be a gyógyszert. A gyógyszer gyorsan hat, 3-5 nap alatt már változást okoz a vérképben. Túl gyakran nem szabad változtatni a HU dózisát, mert ez nagy thrombocyta szám flukuációhoz vezethez. Az első 3 hónapban gyakorta kell a vérképet és a "májfunkciót" ellenőrizni.
3.2.2. Interferon-aET-ban jelenleg nincs Magyarországon törzskönyvezve. Terhességben nagy rizikójú essentiális thrombocythaemia esetén feltétlenül szükséges az adása (2C), hiszen ekkor minden egyéb cytoreduktiv gyógyszer adása ellenjavallt. HU intolerancia esetén szintén interferon a válaszandó kezelés, egyéni kérelem alapján beszerezhető. Adagolása általában 3x hetente 3ME IFN-a, subkután. Tartós alkalmazása 75-88%-ban eredményez haematológiai remissziót. A thrombocytaszám egy hónapon belül megfeleződik heti 3x3ME interferon hatására. A fenntartó kezelés dózisát a thrombocyta-szám alakulása befolyásolja. Az interferon alfa pegyláltformában történő adása az ideális.
3.2.3. Az anagrelidnek kettős hatása van: gátolja a csontvelői megakaryocyta-proliferációt és -érést, valamint egyidejűleg thrombocyta antiaggregációs hatással is rendelkezik (a thrombocyták anti cyclikus AMP phosphodiesterase aktivitását befolyásolja). Hydroxyurea refrakter esetekben alkalmazandó. Kezdeti adagja 0,5mg, mely napi 5mg-ig emelhető. Szignifikánsan csökkenti a thrombocyta számot és a thromboemboliás érszövődmények előfordulását. Mellékhatásként a csontvelői retikulin tartalom emelkedik és gyakrabban figyelhetjük meg myelofibrosis kialakulását (7% vs. 2%). Ezen kívül szerzett idiopathiás cardiomyopathia gyakoribb előfordulását is leírják.
3.2.4. Egyéb cytoreduktiv gyógyszerek, amelyeket hydroxyurea mellékhatás esetén adhatunk: pl. a busulphan, valamint a pipobroman, ez utóbbi dózisa 1 mg/kg naponta. Egyéni importtal szerezhetők be, Európában széleskörben alkalmazzák.
A radiofoszfor (32P) alkalmazása kizárólag olyan idős betegeken jön szóba, akiknél a várható élettartam kevesebb 10 évnél. Adása után az AML előfordulása 4,2%-os. 2.3 millicurie/m2 a dózisa. Ritkán használjuk.
3.3. Szupportiv gyógyszerek
3.3.1. A ciklooxigenáz inhibitor gyógyszerek: Az acetylsalicylsav az erythromelalgia, a mikrovascularis thrombosis, TIA, fejfájás kezelésére, az u.n. vasomotoros tünetek megszüntetésére igen eredményesen alkalmazható. Azok az antithrombocyta gyógyszerek, amelyeknek nincs ciklooxigenáz gátló hatása, nem eredményesek, s hasonlóképpen nem használ a kumarin sem vasomotoros tünetek esetén.
3.3.2. Allopurinol adása emelkedett húgysav-szint esetén, valamint cytoreduktiv kezelés megkezdésekor szükséges, ennek szokásos adagja 300mg-600mg naponta.
3.3.3. Antihistamin szerek. Kínzó bőrviszketés esetén az alapbetegség megfelelő kezelésén kívül adása (pl. cyproheptadin) és H2 blokkoló szer (pl. ranitidine) együttes adása javasolt. A szupportiv kezelést a tünetek jelentkezésének megfelelően kell folytatni.
A következő táblázatban a kezelés összefoglalva látható
| Hiperakut | Akut | Krónikus | |||
| enyhe | közepes | súlyos | kúra | ||
| Sürgősségi | aspirin | Thrombocyta | - alacsony | Elsőrendű | |
| pheresis | rizikó | ||||
| esetén | |||||
| Thrombocy- | aspirin | ||||
| tapheresis | - nagyrizikó | ||||
| esetén HU | Másodrendű | ||||
| +/- | |||||
| aspirin | |||||
| - interferon | |||||
| (terhesség | |||||
| vagy HU intolerancia) | |||||
| - anagrelid | |||||
| (HU | |||||
| mellékhatás vagy refrakteritás) | |||||
| - pipobroman | |||||
3.4. Várható gyógyszer mellékhatások
A myeloszuppressziv kezelés mellékhatásaként rövid távú mellékhatásként csontvelődeppresszió alakulhat ki. A másodlagos leukaemia incidenciája, amelynek valószínűsége ET-ban 2%-os nem változik hydroxyurea kezeléssel a nagy retrospektív tanulmányok szerint. A fibrotikus transzformáció valószínűsége 4%-os ET-ben és ezt a gyakoriságot az nemrég lezárt tanulmányok szerint az anagrelid és az interferon kezelés növeli.
IV. Rehabilitáció
V. Gondozás
Az ellátás megfelelőségének indikátorai
Mivel nem megelőzhető betegségről van szó a primer prevencióval kapcsolatos indikátorok nem jönnek szóba. Szürővizsgálat ebben a betegségben nem költséghatékony. Használható mutatók:
1. Az első tünet és/vagy panasztól az ET felismeréséig eltelt idő.
2. Az adott évben felfedezett (regisztrált) új betegek (incidencia) és az ellátottak aránya.
3. A prognosztikai tényezők alapján a javasolt terápiás algoritmusok alkalmazásával kezelt betegek számának aránya.
4. A kezelés sikerességének mutatói: a kezelésre válaszolók aránya és teljes túlélés, valamint az alapbetegség szövődményei miatt jelentkező mortalitás.
5. Az adott év daganatos mortalitásának és morbiditásának (incidencia, prevalencia) aránya.
6. Az adott évben elhalálozott betegek átlagos túlélési ideje a diagnózis felállítása és a halál bekövetkezése között.
Az irányelv bevezetésének feltételei
Az ellátás tárgyi, személyi, szakmai/képzési és egyéb feltételei szempontjából az ET ellátásában kompetens szakterületek intézményi egységeinél az Egészségügyi Minisztérium és az Állami Népegészségügyi és Tisztiorvosi Szolgálat - mindenkor hatályos - rendelkezéseibe foglalt szakmai (tárgyi és személyi) minimumkövetelményeknek, beutalási elveknek és az orvos-, szakorvos-képzés, valamint a kötelező továbbképzések (akkreditáció) követelmény rendszerének történő megfelelés határozza meg az irányelvek vagy protokoll bevezetését, alkalmazását. A helyi eljárásrendet - a jelen ajánlások felhasználásával - az adott intézmény készültsége alapján kell kialakítani a progressziv ellátórendszerben elfoglalt helyének megfelelő intézményi kapcsolatok (együttműködési megállapodások, szerződések) figyelembe vételével. A betegnek biztosítani kell a második szakértői vélemény (second opinion) kérésének lehetőségét is.
Szükséges dokumentumok, bizonylatok
A beteg ambuláns jelentkezéseit az ambuláns lap és napló, az intézeti kezeléseit a kórlap, a lázlap, az ápolási dokumentáció és zárójelentés rögzíti, amely tartalmazza a beteg felvilágosítását, beleegyezését (aláírásával hitelesítve) a vizsgálatokba és kezelésekbe. Minden vizsgálati eredményt, kezelést dokumentálni kell az ambuláns lapon vagy kórlapban (decursus, lázlap, ápolási napló). ET-s betegnél fel kell tüntetni a korábbi betegségeket, az első tünetek és panaszok jelentkezésének idejét, fizikális státusát. A beteg távozásakor javaslatot kell tenni az életmód, diéta és az otthon szedendő gyógyszerekre és konkrétan meg kell határozni a következő ellenőrző vizsgálat időpontját és a vényre felírt gyógyszereket.
Felelős személy
Az ET-s beteg kezelése hematológiai centrumokban vagy decentrumokban történhet, a kontroll vérvételt a területileg illetékes szakrendelőben is végezhetik. Az ET-es beteg kezeléséért, gondozásáért a szakrendelést végző haematológus vagy klinikai onkológus szakorvos felelős. Az adott terápiát hematológus vagy onkológus szakorvos rendelheti el.
VI. Irodalomjegyzék
1. Barosi G, Burgegard G, Finnazzi, Griesshammer M, Harrison C et al.: Response criteria for essential thrombocythaemia and polycythemia vera: result of a European LeukemiaNet consensus conference. Blood, 2009; 113: 4829-33.
2. Spivak JL.: Narrative review: thrombocytosis, polycythaemia vera, and JAK2 mutations: The Phenotypic mimicry og chronic myeloproliferation. Ann intern Med 2010;152:300-306.
3. Tefferi A, Thiele J, Crazi A et al.: Proposala and rationale for revisionof the World Health Organization diagnostic criteria for polycythaemia vera, essential thrombocytemia, and primary myelofibrosis: recommendations from an ad hoc international expert panel. Blood 2007; 110:1092-1097.
Kapcsolódó internetes oldalak
Magyar Hematológiai és Transzfuziológiai Társaság - www.mhtt.hu file://E:/UptoDate(Stanford)/ETThUptoDate.htm
VII. Melléklet
Az irányelvfejlesztés módszerei
A szakmai irányelv érvényessége: a megjelentetéstől számított 3 év, illetve ezen belül a jelen ajánlásoktól lényeges kérdésben eltérő új tudományos eredmény megjelenése.
A szakmai irányelv "Nemzeti Erőforrás Minisztérium által"-i kiadása, ílymódon a szakma szabályai közé történő beépítése és az erre vonatkozó kiadmányozói jog nem korlátozza a dokumentum tartalmi elemeinek kidolgozásában közreműködő szakértők szellemi produktumához fűződő szerzői jogát, azaz nem zárja ki e tartalmi elemek más formátumú tudományos publikációként való megjelentetését.
A szakmai irányelv érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai irányelve
a hematológiai betegségek korszerű kezeléséről - a lymphoproliferatív betegségek diagnosztikája és korszerű kezelése
- Agresszív (kifejezett malignitású) nem-Hodgkin lymphomák (NHL)
- Follikuláris lymphoma (FL)
- Köpenysejtes lymphoma
- T-sejtes non-Hodgkin lymphomák (NHL)
- Idült lymphoid leukaemia/kis lymphocytás lymphoma (CLL/SLL)
- Hajas sejtes leukémia (HSL) és a rokon betegségek
- Myeloma multiplex (MM)
- Felnőttkori Hodgkin-lymphoma (HL)
Készítette: a Magyar Transzfúziológiai és Hematológiai Szakmai Kollégium és a Tudományos Társaság
AGRESSZÍV (KIFEJEZETT MALIGNITÁSÚ) NEM-HODGKIN LYMPHOMÁK (NHL)
I. Alapvető megfontolások
BNO kód: C8330-90, C8440-50, C8570-90
Alkalmazott gyógyszerek ATC kódja: L01A, L01B, L01C, L01D, L01x.
Az agresszív nem-Hodgkin lymphomák kezelési elvei randomizált prospektív vizsgálatokon alapulnak, melyek nagyrésze multicentrikus eredményűek. Ahol jelenleg csak egy randomizált vizsgálaton alapul az ajánlott kezelés, azt kiemeltük.
Az agresszív NHL-k a nyirokrendszer rosszindulatú daganatainak egyik csoportját képezik, jellemzőjük a gyors növekedés.
Kezelés nélkül rövid idő alatt a beteg halálát okozzák. Többségük citosztatikum- és sugár-érzékeny. Megfelelő kezeléssel a betegek 60-70%-a komplett remisszióba (CR) kerül, és 40-50% a hosszan túlélők aránya, azaz 40-50% meggyógyul.
A szövettani típus a legfontosabb tényező, amely alapvetően meghatározza a betegség prognózisát, kezelhetőségét.
A szövettani besorolást a REAL osztályozáson alapuló WHO klasszifikációnak megfelelően végzik. Míg a korábbi (Kiel Working formulation) osztályozások prognosztikai csoportok szerint taglalták a NHL-kat, a WHO klasszifikáció a malignitás mértékének megjelölése nélkül sorolja fel a szövettani típusokat (1. és 2. táblázat).
A korábban, prospektiv multicentrikus vizsgálatokban kezelt betegek szövettani reklasszifikációja segítségével azonban kiderült, hogy prognosztikailag két nagy csoport különíthető el: 1. indolens, inkurábilis NHL lassú vagy gyors progresszióval; 2. gyors progressziójú, kurábilis (gyógyítható) lymphomák.
Az agresszív lymphomák elnevezés klinikai fogalom, a betegség klinikai viselkedése alapján alakult ki. Azért terjedt el, azért kedvelt fogalom, mert jól magába foglalja a korábban "kifejezett malignitású" lymphomákat és az indolens, gyors progressziójú lymphomákat. Mindkét csoport "sikeres" kezeléséhez elengedhetetlen a korai diagnózis és a haladéktalanul elindított kombinált kemoterápia.
Agresszív lymphomának kell tekinteni, s egyben legfontosabb entitásai a diffúz nagy B-sejtes NHL és altipusai (DLBCL), folliculáris lymphoma grade III. (FL gr.III), mediastinalis nagy B-sejtes és a köpenysejtes lymphoma (MCL), a Burkitt-lymphoma, az un. "gray zóna" (átmeneti) lymphomák, a lymphoblastos lymphoma (precursor, B- és T-sejtes malignus lymphoma), az anapláziás nagysejtes lymphoma (ALK pozitív és ALK negatív), NK/T-sejtes nasalis lymphoma, perifériás T-sejtes lymphoma (NOS), angioimmunoblastos lymphoma, enteropathiához társuló T-sejtes lymphoma.
Az FL gr.III.A és III.B megítélése klinikai szempontból nem egységes. Néhány vizsgálat különbséget talált a két típus között, miszerint a gr.III. B közelebb áll a DLBC-hez. Mégis az elkülönítés nem egyértelmű újabb genetikai és klinikai eredmények alapján, nem is említve, hogy maga a grédelés patológusok közti reprodukálhatósága is kétséges. Magunk a gr.III. FL-t agresszív lymphomaként kezeljük.
Előfordulás
Az agresszív NHL-k az összes malignus lymphoma kb. 50%-át teszik ki, s ezek fele DLBCL. Idős korban gyakrabban fordulnak elő, a betegek legnagyobb része 50-60 éves. Férfiakban gyakoribb, mint nőkben.
II. Diagnózis
Jellemző a gyorsan kialakuló és növekvő adenomegália, melyhez esetenként (kb. 20%-ban) aktivitási (B-) tünetek: láz, fogyás, éjszakai izzadás társulhatnak. A nagyon agresszív lymphoblastos lymphomák, Burkitt-lymphomák olyan heveny tünetekkel jelentkezhetnek, melyek gyors beavatkozás nélkül a beteg életét veszélyeztetik.
Az esetek kb. %-ében találunk un. "bulky tumor"-t, amikor a daganat nagysága vagy a daganatos nyirokcsomó konglomeratum 7-10 cm-nél nagyobb. Bulky tumorok a mediastinumban vena cacva superior syndromát hozhatnak létre, a kismedencében vagy inguinalisan végtagduzzanat, thrombosis lehet a következmény.
Közismert, hogy az összes lymphoma 30-35%-a extranodalis kiindulású. Extranodalis lymphomák esetén a klinikai kép változatos lehet annak megfelelően, hogy milyen szerv a kiindulási hely. Jelentkezhet pajzsmirigy megnagyobbodás formájában, légúti és nyelőcső kompresszióval. A gyakori gyomor lymphomák rendszerint tünetmentesek és gyomorpanaszok vagy fekélybetegség gyanúja miatti biopszia deríti ki a diagnózist. Glutén enteropathia esetén mindig gondolni kell T-sejtes lymphoma kialakulására, különösen akkor, amikor az enteropathia terápia rezisztenssé válik. A vékonybél lymphomák csaknem mindig bélelzáródás vagy perforáció miatt sürgősséggel végzett műtétek kapcsán derülnek ki. Központi idegrendszeri tumorra utaló tünetek vizsgálata során végzett biopszia szokta bizonyítani az elsődleges idegrendszeri lymphomákat. A betegek állapotának megítélése az un. ECOG skála alapján célszerű.
Laboratóriumi jelek
A klasszikus laboratóriumi vizsgálatokat tekintve különféle vérképeltérések lehetnek, amelyek főleg előrehaladott stádiumokban vagy csontvelő-érintettség esetén észlelhetők és cytopenia formájában jelentkeznek. Leukaemiás vérkép is előfordulhat. A betegség kiterjedtségének és aktivitásának megítélésében segít az LDH, a béta-2-microglobulin, esetleg a vérsejt-süllyedés, alkalikus foszfatáz.
Lymphomákkal kapcsolatban - ha laboratóriumi vizsgálatokat kérünk - rendszerint speciális immunhisztokémiai, citokémiai, molekuláris biológiai, vizsgálatok jutnak eszünkbe, melyek részben a szövettani feldolgozás részét képezik, mások flow cytometriát, PCR technikát igényelnek. Elvégzésük fontos a szövettani típus meghatározásához, a monoklonális antitest kezelés indikációjához (CD20, CD40), a reziduális betegség kimutatásához.
Szövettani diagnózis
A diagnózis mindig szövettani, amelyhez nyirokcsomó excízió vagy extranodális NHL-k esetén műtéti preparátum szükséges. Aspirátum biztosan nem elegendő, vékonytű biopszia (core biopszia) nem mindig elégséges (amikor a szövettani típus meghatározásához a minta nem elegendő). Mégis az ultrahang vagy CT vezérelt core biopszia gyakorlott kézben nélkülözhetetlen lehet mellkasi vagy hasi NHL-k esetén a nagyobb diagnosztikus műtétek elkerülésére. Gyors és biztos módszer a reziduális (PET pozitív) tumor mibenlétének tisztázására is.
A legpontosabb "célzás" mellett is előfordul, hogy a biopszia nem diagnosztikus értékű, mert a tű csak a nyirokcsomó széli részét érte, megnagyobbodott nyirokcsomók közti kötőszövetes szeptumokba jutott, csak necroticus tumorszövetet tartalmaz. Ilyenkor a biopszia megismétlése szükséges, végső esetben pedig műtéti úton (exploratio) kell anyagot nyerni. A mediastinoscopiával nyert minták csaknem kivétel nélkül kicsik, másodlagosan károsodottak, ezért használhatatlanok. Mindezekből következik, hogy a mintavételt gyakorlott team végezze. A szövettani feldolgozás csak lymphomák diagnosztikájában járatos, centralis vagy regionális laboratóriumban lehet megfelelő.
III. Az agressziv NHL kezelése
Az agresszív lymphomákat megfelelő diagnosztikus (patológia, képalkotó eljárások) és terápiás feltételekkel, valamint megfelelő tapasztalattal rendelkező hematológiai centrumban vagy osztályon kell kezelni.
A kezelés feltétele a szövettani diagnózis mellett a betegség kiterjedtségének ismerete. A stádium megállapításához (staging) az Ann Arbor-féle besorolást használjuk.
A klinikai staging elvégzéséhez, a klinikai stádium (CS) megállapításához feltétlenül szükséges: fizikális vizsgálat, kétirányú mellkas RTG (ma már csak tájékoztató jellegű), hasi UH, csontvelő-vizsgálat (kiváltképp vérképeltérések és kiterjedt betegség esetén), egész test CT (a pharynx érintettsége esetén a nyálkahártya megítélése végett egészen a koponya-alapig). További vizsgálatok lehetnek: csontfelvételek, MRI, de bizonyos szövettani típusoknál és esetekben pl. a gastrointestinális traktus részletes vizsgálata is szükségessé válhat. Alapvetően megváltozott a PET szerepe a NHL-k ellátása során is. Mivel a CT lehetőségeit előnyösen kapcsolja összes az aktív betegség kimutatásával, ideális módszer a stagingre. Jelentőségét még növeli, hogy a második ciklus után megismételt PET (interim PET) vizsgálat eredménye prognosztikus tényezővé vált, a kezelés befejezésekor készülő PET/CT pedig a remisszió/residuális lymphoma megitéléséhez nélkülözhetetlen.
Az egyénre szabott kezeléshez ("rizikó adaptált") a betegeket az IPI (International Prognostic Index) szerint kell csoportosítani (9). Bár az IPI kidolgozása óta más fontos prognosztikus faktorok is felmerültek, ma is ez (és módosított formái) a legelterjedtebben használt prognosztikus rendszer. Azon betegek kezelését, akik nem tudnak vagy nem akarnak vizsgálatokban részt venni, az IPI alapján kell irányítani. Az eredeti IPI-ben öt független prognosztikus tényező (életkor, stádium, LDH, általános állapot, extranodalis érintettség) alapján képeztek rizikócsoportokat, melyekben a remissziós ráta és túlélés szignifikánsan különbözik.
Az idők folyamán sok módosítást végeztek, amelyek növelik használhatóságát. Mivel 60 év felett és alatt igen eltérő a várható túlélés és az intenzív terápiás protokollok alkalmazásának korhatára rendszerint 60 év, un. korhoz igazított prognosztikai indexet dolgoztak ki. Az életkorhoz igazított IPI (aaIPI), a 60 év alatti és feletti betegeken külön-külön három tényező alapján biztosít besorolást. A kedvezőtlen prognosztikai tényezők, amelyek mindegyike egy-egy pontszámot jelent: magas LDH színt, III-IV. stádium, rossz általános állapot (ECOG >2). Tekintetve, hogy 60 év alatt és felett a kezelési stratégia igen különböző, a korhoz igazított IPI-t érdemes használni.
Az aalPI négy rizikócsoportot különböztet meg
- low risk_0_
- low intermediate 1
- high intermediate 2
- high risk 3
A kezelés megválasztásakor legalább két csoportot kell figyelembe venni:
- kis rizikójú betegeket (score 0-1),
- nagy rizikójú betegeket (score 2-3)
Az R-CHOP széleskörű használatával DLBCL kezelésében javultak a kezelés eredményei, s ezzel egy időben felmerült, hogy az IPI prognosztikus szerepe változott-e. Az IPI prediktív maradt, de kevesebb rizikócsoportot lehet vele elkülöníteni. A score értékek újracsoportosításával a "revised" IPI (R-IPI) segítségével 3 prognosztikus csoport hozható létre:
- nagyon jó prognózis 0
- jó prognózis 1-2
- rossz prognózis 3-4-5
A stage-modified IPI-t lokalizált betegség prognózisának becslésére használják. Rizikófaktorok: std. II, kor >60 év, LDH emelkedett. Az igen kedvező prognózisú, rizikófaktor nélküli eseteket szokás "very limited stage disease"-nek nevezni (std.I.-lehetőleg csak egy régió érintett - fiatal beteg, normális LDH).
Mantle cell lymphománál a MIPI-t, folliculáris lymphománál a FLIPI-t találták a legmegfelelőbbnek.
Természetesen egyéb prognosztikus tényezők is jelentőségre tettek szert az utóbbi évtizedekben. A legfontosabb az interim PET vizsgálat eredménye. Ebben a relációban a negatív interim PET prediktív értéke több mint 90%. Ezen betegek prognózisa kedvező, a standard kezelés elégséges. A pozitív PET prediktív értéke azonban bizonytalan (DLBCL-ben 25-33%). A kezelés módosítása indokoltnak tűnhet pozitív interim PET esetekben DLBCL-ben is, jelenleg azonban nincsenek olyan egyértelmű bizonyítékaink, melyek a kezelés megváltoztatásának szükségességét alátámasztanák, s annak kedvező hatását a túlélésre bizonyítanák.
DLBCL-ben a génexpressziós vizsgálatok alapján két csoportot lehet megkülönböztetni: a csíracentrum-szerű (GC) és aktivált B-sejt-szerű (ABC) DLBCL-t. Mivel a génexpressziós vizsgálatok nem tartoznak a "rutin" eljárások közé, formalinban fixált anyagokon elvégezhető immunhisztokémiai vizsgálatokat (CD10, BCL-6, MUM-1) használunk a két csoport elkülönítésére. A CHOP érában kezelt betegek adatai alapján a két csoport prognózisa különbözött, az ABC-szerű DLBCL életkilátásai rosszabbak.
Az R-CHOP bevezetése óta végzett vizsgálatok ezt nem erősítették meg, az R-CHOP eltünteti ezt a prognosztikus különbséget, tehát a mai mindennapi gyakorlatban a DLBCL sejt-eredet szerinti csoportosítása nem irányadó a kezelés megválasztásában. Prognózis szempontjából a B-sejtes lymphomák mindig kedvezőbbek, mint a T-sejtesek. Ezt a biológiai különbséget lényegesen fokozza az a tény, hogy a leggyakoribb B-sejtes NHL-k kezelésében az immuno-kemoterápia (anti-CD20 monoklonális antitest) jelentősen javította a kezelés eredményességét, a T-sejtes lymphomák esetében pedig nem rendelkezünk ilyen hatásos immunterápiás szerrel. A rituximab bevezetése óta minden B-sejtes NHL-ről kiderült, hogy rituximabot tartalmazó kemoterápiás kombinációkra jobban reagál, mint kemoterápiára önmagában, azonban az agresszív lymphomákon belül, a DLBCL-t és az FL grade IlI-t leszámítva, használata minden típusnál "off-label" indikációnak számít.
Klinikai tapasztalat az is, hogy kiindulási hely szerint más-más lehet a betegek kezelhetősége. A testiculáris, a központi idegrendszerből kiinduló, az enteropathia asszociált T-sejtes lymphomák rossz prognózisúak, míg a primer bőr lymphomák általában indolens lefolyásúak.
Az agresszív NHL kezelése a kombinált kemoterápia (CHT) elvei szerint történjen. Az ajánlott un. standard kezelés a CHOP (3). A kezelési protokollok egy részének leírása a függelékben található.
A CHOP-szerű protokollok, melyek lényege 1-1 citosztatikum cseréje vagy hozzáadása az eredeti kombinációhoz, gyakorlatilag hasonló hatékonysággal rendelkeznek. A CHOP dózisainak emelése (Mega-CHOP, high dose CHOP, dose-intense CHOP, stb.) egymagában nem hozott átütő sikert. Ide sorolható a GELA által használt ACVBP (10) is, mely randomizált vizsgálatban egyaránt növelte a relapszus-mentes és általános túlélést, de - mint az emelt dózisú sémáknál általában - nagyobb toxicitással kell számolnunk.
A ciklusok közti intervallum rövidítése, a dózisintenzitás növelése - dózisemeléssel vagy enélkül - képes a rossz prognózisú esetekben kedvezőbb eredményeket biztosítani. (12)
Bármilyen kezelést kezdünk, 3-4 ciklus után ellenőriznünk kell, hogy kellően hatékony-e a választott terápia. A korábbi "klasszikus" képalkotók mellett agresszív lymphomákban ennek ma az interim PET/CT a választandó módja. Ha jelentős regresszió jött létre (PR vagy közel CR, PET negatív), a megkezdett kezelést kell folytatni 6-8 cikluson át. Ha a válasz nem megfelelő, más, agresszívabb (hatékonyabb) kezelést kell választanunk. Ez utóbbi megállapítás nem reagálókra, esetleg progresszív betegségre feltétlen igaz, egyéb esetekben gondosan mérlegelnünk kell, mivel nincsenek meggyőző bizonyítékok arra, hogy ez a megfelelő megoldás, részlegesen reagáló, de PET poztitív DLBCL esetekben.
A lokalizált agresszív lymphomák kezelése
Lokalizált (CS I-II.) - nem bulky lymphoma, IPI 0-1 scorral - kezelése 3 CHOP és érintett mezős irradiáció.
A szisztémás kemoterápia alkalmazására azért van szükség, mert ez képes a mikrometasztatikus tumorterjedés következtében RT után kialakuló relapszusokat megelőzni. Lokalizált betegségben ehhez 3 ciklus CHOP elegendő. II. std. "bulky" betegség esetén a mikrometasztatikus tumortömeg túl nagy, 3 ciklus CHOP nem képes kontrollálni, ezért ezt a stádiumot a kiterjedt betegségeknél leírt elvek szerint kell kezelni.
A sugárkezelésnek egymagában csak az I. patológiai stádiumban (ez a kritérium operált extranodális lymphomáknál teljesülhet) lehet létjogosultsága, mind nodális, mind extranodális NHL esetén. Az irradiációt műtéti úton teljesen eltávolított, extranodális lymphomák adjuváns kezelésére is használják (pl. bőr lymphomái).
Egy GELA vizsgálat szerint (1) az eredmények nem rosszabbak, ha idős betegeknél 4 CHOP ciklus után az irradiáció elmarad. DLBCL és FL grade III. szövettani típusánál R-CHOP-t kell adni. Egy "SWOG" fázis II. tanulmány eredménye alapján 3 ciklus R-CHOP plusz egy rituximab és érintett mezős RT DLBCL-ben növelte a PFS-t a hagyományos 3 CHOP + RT-vel összevetve (6). Létezik egy igen kedvező életkilátásokkal bíró betegcsoport a lokalizált betegségeken belül, mely a "very limited disease" nevet kapta. Ennek I. std., 60 évnél fiatalabb életkor, tünetmentesség, normális LDH a jellemzői, más szavakkal rizikófaktor nélküli I. stádiumú betegekről van szó. Túlélésük 5-10 év után 90%. Ezekben az esetekben, ha 3xR-CHOP után a beteg PET negatív, még egy R-CHOP elegendő, nincs szükség RT-re (8).
Fentiek ellentéte az a II. stádium, ahol több rizikófaktor található (a lokalizált betegséget vizsgáló trial-ek rendszerint csak egy rizikó faktorral rendelkező betegeket vontak be a vizsgálatba) és az érintett mezők is távol esnek egymástól (pl. a nyak két oldala). Egyénileg kell megítélni ilyenkor, hogy elegendő a lokalizált betegség elvei alapján tervezni a kezelést, vagy jobban jár a beteg, ha kiterjedt betegségként kezeljük.
Kiterjedt agresszív lymphomák kezelése
DLBCL
Kiterjedt betegségnek tekintjük a CS III-IV-et és hasonlóan kezeljük a lokalizált lymphomát bulky tumorral. 60 év felett a rizikó csoportoktól függetlenül R-CHOP kombináció szükséges (2).
A Német High Grade non-Hodgkin Lymphoma Study Group hatékonynak találta a CHOP-14 elnevezésű protokollt (12), ami 14 naponta adott CHOP-t jelent, kiegészítve G-CSF-el. Hasonló megfigyelést közöltek más szerzők is. A dózis intenzitás növelése javította a kezelés hatékonyságát, jelentősen fokozza azonban a toxicitást, ezért az eljárást klinikai vizsgálatokon kívül nem javasolják.
Egy nagy négykarú vizsgálatban a német munkacsoport a 6xCHOP-14, 8xCHOP-14-et hasonlította össze rituximabbal és anélkül (7). Az eredmények alapján a 6xR-CHOP-14-et (6xCHOP+8xR) tartják a legjobb kezelésnek idős betegekben. 60 év alatti betegek kezelése már sokrétűbb.
Kis rizikó esetén (score 0-1), ha DLBCL-ről vagy follicularis lymphoma grade III-ról van szó, R-CHOP a választandó kezelés. Nagy rizikó esetén többfajta megoldás lehetséges, itt valóban egyénre szabott, rizikó adaptált kezelést kell választani:
- DLBCL-ben az R-CHOP hatékonyabb a klasszikus CHOP-nál, esetenként ez is elegendő lehet,
- Fiatal betegeknél első-vonalbeli kezelésként második és harmadik generációs citosztatikus kombinációk is használhatók: PACEBOM, VACOP-B, nagydózisú CHOP, DA-EPOCH, stb. Ezek a sémák rituximabbal kiegészítve is használatosak. Ilyenkor az első CR-ben autológ őssejt-átültetés (ASCT) jön szóba.
- Nagy rizikójú DLBCL-ben, egy olasz multicentrikus tanulmányban MegaCEOP olyan hatásos volt, mint a nagydózisú kezelés és ASCT (11).
Burkitt lymphoma kezelése
Felnőtt korban a Burkitt lymphoma rendszerint hasi tumor, B-tünetek és tumorlízis syndroma klinikai képében jelentkezik. A csontvelő az esetek 70%-ban infiltrált lehet, s nem ritka a leptomeningeális érintettség sem.
A betegek elesett állapota miatt a kezelést mihamarabb el kell kezdeni. Egyes intézetekben az a cél, hogy Burkitt lymphoma lehetőségének felmerülése után 48 órán belül elkezdődhessen a kezelés.
A diagnózis első feltétele a megfelelő mennyiségű és minőségű szövettani anyag. A pontos diagnózishoz a jellegzetes morfológiai kép és a magas proliferációs ráta (Ki67 pozitivitás, 90-95%) mellett a c-MYC transzlokáció kimutatását elégségesnek tarják.
Standard dózisú kemoterápia, mint pl. a CHOP nem megfelelő kezelés Burkitt lymphomában, a besugárzásnak nincs helye még lokalizált betegségben vagy paraspinális/vertebrális infiltrátumok esetében sem, mivel ezek nagyon gyorsan reagálnak kemoterápiára is
Fiatalokban a kezelési lehetőségek:
- intenzív, rövid kemoterápia (CODOX-M/IVAC, BFM, R-Hyper-CVAD/MA); - ALL szerű protokollok (GMALL-07/2003); A kemoterápia konszolidációjaként ASCT ajánlott.
CNS profilaxisnak intrathecalis kezelést javasolnak. Ha rituximabot is kap a beteg, ezt az első ciklusban nem adják a tumor-lízis syndroma okozta tünetek mérséklése céljából. Természetesen a tumor lízis szokásos kezelésének elemei (folyadék, bikarbonát, allopurinol, esetleg rasburicase) sem hiányozhatnak.
Idősekben az intenzív protokollok mellékhatásai kifejezettek,
- CHOP+R és intrathecalis profilaxis a leggyakrabban alkalmazott kezelés.
- Hyper-CVAD/MA és R-Hyper-CVAD/MA is hatékonynak bizonyult néhány vizsgálatban, azonban a toxicitás (idősek rosszul tűrik a nagydózisú Mtx és Ara-C kezelést) jelentős.
- Lymphoblastos lymphomát ALL protokoll szerint kell kezelni.
CNS profilaxis
A központi idegrendszer érintettségének megelőzésére ismételt intrathecalis kezelés, ill. nagydózisú methotrexat ajánlott bizonyos agresszív lymphoma típusokban, egyértelműen tesztikuláris lymphomákban, de Burkitt lymphomában, DLBCL egyes eseteiben is.
A rituximab érában, egy kontrolált vizsgálatban azt írták le, hogy R-CHOP-14 csökkenti a CNS érintettség rizikóját.
Vizsgálták azokat a rizikófaktorokat, melyek CNS érintettségre hajlamosítanak a rituximab érában, ezek a magas LDH; ECOG>1; egynél több extranodális érintettség. Meglétük esetén 33% a CNS érintettség rizikója, melyet intrathecalis rituximab nem befolyásolt. A szisztémás nagydózisú methotrexat hatását egy Ausztrál munkacsoport most vizsgálja.
Mit lehet ezek alapján ajánlani? Testiculáris DLBCL protokollja tartalmazza az intrathecalis profilaxist, Burkitt lymphomában szükséges, a többi esetben pedig a rizikótényezők megléte vagy hiánya alapján kell dönteni.
Extranodalis NHL kezelése
Az extranodális agresszív NHL nagyobb része DLBCL, tehát az R-CHOP a választandó kezelés.
A primer CNS lymphománál speciális kombinációt kell alkalmazni. A nagydózisú MTX (3.5 g/m2) jobb, mint a RT, ezért ez tekinthető a standard kezelésnek. Az IELSG fázis II. vizsgálata szerint a remissziós ráta és a túlélés is jobb, ha ezt nagydózisú Ara-C-vel egészítik ki (1. nap 3.5 g/m2 MTX, a 2. és 3. nap 2 g/m2 Ara-C 12 óránként). Egyesek kiegészítik koponya besugárzással, amit a neurotoxicitás miatt rendszerint elhagynak vagy elhalasztanak, 60 év felett pedig nem is javasolják. A heréből kiinduló DLBCL esetén a kezelés protokollja: 6xR-CHOP, az ellenoldali here irradiációja és intrathecalis CNS profilaxis. Intravasculáris nagy B-sejtes lymphoma szisztémás betegségnek tartható, R-CHOP adása szükséges. Egyedüli kivételt képez talán amikor idős korban, csak a lábon jelentkezik soliter elváltozás, ennek kedvezőbb a prognózisa (cutan variáns), helyi kezelés/RT is elég lehet.
A primer cután DLBCL "leg type" terápiája megegyezik, a "very limited stage disease" kezelésével.
Egyéb szervekből kiinduló extranodális DLBCL kezelése az általános részben leírt elvek szerint történjen. Érdemes gondolni arra, hogy primér emlő DLBCL eseteiben is gyakoribb a CNS érintettség/relapszus.
Miután CR alakult ki és a beteg az egyedi rizikóbecslés alapján nem igényel ASCT-t, a beteg követése, megfigyelése javasolt. Relapszus kezelése
Jelenleg nincs valódi "arany standard" relabált agresszív lymphomák kezelésére.
60 év alatt
- Autológ őssejt-transzplantáció a választandó kezelés, ha a betegség kemoszenzitív és az őssejt átültetésnek nincs ellenjavallata. Ilyenkor DHAP kezelést adnak leggyakrabban. Két ciklus után, amennyiben reagálás kimutatható, őssejt gyűjtés szükséges, majd a kezelés befejezése és transzplantáció.
Igen hatékonynak tartják CD20 pozitív NHL-ban (főleg DLBCL) a RIME (rituximab, ifosfamid, mitoxantron, etoposid) és RICE (rituximab, ifosfamid, carboplatin, etoposid) protokollokat nagydózisú kemoterápiaként ASCT előtt. A CORAL vizsgálatban (4) összehasonlították a R-ICE és az R-DHAP hatékonyságát relabált DLBCL-ben és a protokollok között nem találtak szignifikáns különbséget a terápiás válaszban, valamint az őssejt mobilizációban. A R-ICE-ban kevesebb súlyos mellékhatás volt. A legfontosabb prognosztikus faktoroknak bizonyultak: relapszus ideje (kevesebb mint 12 hónap), másodlagos IPI>1, előzetes R kezelés.
- Amennyiben őssejt átültetés nem lehetséges az un. salvage kombinációk jönnek szóba: ESHAP, IMVP-16, MINE. Figyelembe véve az első kezelést, második-harmadik generációs protokollok is adhatók.
- Rituximabot mindenképp adni kell, ha előzőleg nem kapott a beteg Mab kezelést.
60 év felett
- Egy évnél hosszabb remisszió esetén meg lehet ismételni az első-vonalbeli kezelést. Itt különösen lényeges, hogy R-CHOP-t kapjon a beteg, ha előzőleg nem kapott Mab-t.
- Tizenkét hónapnál rövidebb remisszió esetén, ismét egyedi megítélés szerint, adhatunk salvage kezelést vagy - különösen 70 év felett - palliatív terápiát, esetleg experimentális gyógyszerek is szóba jöhetnek.
- Ígéretesnek látszik az R-GEMOX kombináció (rituximab, gemcitabin, oxaliplatin) (5), jól tolerálják idős betegek is.
Rezisztens agresszív NHL kezelése
Rezisztens betegségről akkor beszélünk, ha a beteg az első-vonalbeli kezelésre nem reagál, vagy relapszus estén nem "senzitív", nem reagál a salvage terápiára. A beteg hatékony kezelésének esélye csekély.
Azon betegek, akik nem reagálnak a rituximabot tartalmazó első-vonalbeli kezelésre, különösen kedvezőtlen kilátásokkal
rendelkeznek.
Lehetőségek:
- Autológ őssejt- átültetés, ha a feltételek és a körülmények adottak, hatékonysága azonban sokkal kisebb, mint CR-ben végzett őssejt átültetés esetén
- Relapszusnál használt kombinációk
- Experimentális kezelések
Itt különösen fontos a kezelő team "bölcsessége", tapasztalata a terápia megválasztásában. Általános szabályok nincsenek, tanácsok nehezen adhatók. Milyen elvek követhetők? Kezelés alatt is progresszív betegség esetén új kombináció, új, eddig nem használt citosztatikum, Mab. adása jöhet szóba. Amennyiben minimális reagálás észlelhető, dóziseszkaláció lehet a megoldás. Az un. "kinetic failure" gyakrabban adott kezelésekkel (pl. CHOP 14) uralható, egyesek a DA-EPOCH kombinációt találták hatékonynak.
Szövődmények
A kezelések során a jól ismert szövődményekre - mint hányinger, hajhullás, jelentős cytopenia - lehet elsősorban számítani. Mab adásakor - különösen az első infúzió alatt - láz, hidegrázás, ritkábban dyspnoe és hypotensio alakulhat ki. Magas fehérvérsejt-számmal (leukémiás vérképpel) járó esetekben citokin-lízis syndromát írtak le, mely fatális lehet. Ilyenkor az első ciklusban a Mab adagját csökkenteni kell vagy a szükséges adagot megfelezve, két egymást követő napon kell beadni. Nagyobb tumor tömeg esetén, előrehaladott betegségben a terápia kezdetén tumor-lízis syndroma jellegzetes tüneteit észlelhetjük. Magas LDH és kreatinin hajlamosító tényezők. A német munkacsoport ezért a fenti esetben, különösen idős, elesett betegekben, un. Elő-fázis kezelést javasol: 5-7 napig 100mg prednisolon/nap az első CHOP előtt (van aki az első nap Vincristint is ad). Nagydózisú methotrexat után mucositis, veseelégtelenség jelentkezhet.
Nagydózisú Ara-C, elsősorban idős betegekben, cerebellaris tüneteket, aluszékonyságot, ritkán kómát válthat ki.
IV. A betegek követése,
V. Gondozás
A CR-be került betegek ellenőrzésének javasolt ideje az első két évben háromhavonta, a harmadik és negyedik évben félévenként, ezt követően évenként. Panaszok vagy relapszus gyanúját keltő tünetek estén soron kívüli ellenőrzésre van szükség. Ellenőrzéskor elvégzendő vizsgálatok:
fizikális vizsgálat, teljes vérkép, LDH, We és egyéb laboratoriumi vizsgálatok. A képalkotó eljárások is nélkülözhetetlenek, azonban ezek gyakoriságát illetően jelentős intézeti és egyéni különbségek figyelhetők meg. A relapszusok 60-70%-a az eredetileg érintett helyeken jelentkezik, ezért a képalkotó eljárásokkal (RTG, UH, CT, MR) elsősorban ezeket a régiókat vizsgáljuk. Extranodális lymphomáknál speciális vizsgáló módszerekre is szükség van, pl. gastrointestinális lymphomák. Residuumok, relapszus gyanús képletek megítélésében a PET/CT és a core biopszia nyújthat nélkülözhetetlen segítséget. Általános gyakorlat, hogy ha a reziduum PET negatív, nem igényel további kezelést. Amennyiben PET pozitív, szövettani vizsgálattal kell a lymphoma jelenlétét igazolni. Minden kétes esetben csak a szövettani vizsgálat lehet perdöntő.
VI. Irodalomjegyzék
1. Bonnet C, Fillet G, Mounier N. et al: Radiotherapy innecessary in elderly patients with localized aggressive non-Hodgkin lymphoma: results of the LNH 93-4 Study. Ann Oncol 2002; 13:Suppl. 2:27.
2. Coiffier B, Lepage E, Briere J. et al: CHOP chemotherapy plus rituximab compared with CHOP alone in elderly patients with diffuse large B-cell lymyphoma. N Engl J Med 2002; 346:235-242.
3. Fisher RI, Gaynor ER, Dahlberg S. et al: Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin's lymphoma. N Engl J Med 1993; 328:1002-1006.
4. Gisselbrecht C, Glass B., Mounier N. et al: R-ICE versus R-DHAP in relapsed patients with autologus stem cell transplantation: CORAL Study. J Clin Oncol, 2009. (ASCO)
5. El Gnaoui T, Dupuis J, Belhadj K et al. Rituximab, gemcitabine and oxaliplatin: an effective salvage regimen for patients with relapsed or refractory B-cell lymphoma not candidates for high-dose therapy. Ann. Oncol. 2007; 18: 1363-1368 .
6. Persky DO, Unger JM, Spier CM et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014. J. Clin. Oncol. 2008:26: 2258-2263.
7. Pfreundschuh M, Schubert J, Ziepert M et al. Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomised controlled trial (RICOVER-60). Lancet Oncol. 2008:9: 105-116.
8. Sehn LH, Donaldson J, Chhanabhai M et al. Introduction of combined CHOP plus rituximab therapy dramatically improved outcome of diffuse large B-cell lymphoma in British Columbia. J. Clin. Oncol. 2005;23: 5027-5033.
9. Shipp MA.: The international non-Hodgkin's lymphoma prognostic factors project: a predictive model for aggressive non-Hodgkin's lymphoma. N Engl J Med 1993; 329:987-994.
10. Tilly H, Lepage E, Coiffier B. et al: Intensive conventional chemotherapy (ACVBP regimen) compared with standard CHOP for poor-prognosis aggressive non-Hodgkin's lymphoma. Blood 2003; aug.
11. Vitolo U, Liberati AM, Lamberthenghi Deliliers G. et al: High dose chemotherapy (HDS) with autologous stem cell transplantation (ASCT) VS intensified chemotherapy MegaCEOP in high risk diffuse large cell lymphoma (DLCL): An update of a multicenter randomised trial by Italian Lymphoma Intergoup (ILI). Ann Oncol 2002; 13:Suppl. 2:29.
12. Wunderlich A, Kloess M, Reiser M. et al: Practicability and acute haemoatlogical toxicity of 2- and 3-weekkly CHOP and CHOEP chemotherapy for aggressive non-Hodgkin's lymphoma: results from the NHL-B trial of the German High-Grade Non-Hodgkin's Lymphoma Study Group (DSHNHL). Ann Oncol 2003; 14:881-93.
VII. Mellékletek
1. táblázat. WHO 2008: the mature B-cell neoplasms
Chronic lymphocytic leukemia/small lymphocytic lymphoma
B-cell prolymphocytic leukemia
Splenic marginal zone lymphoma
Hairy cell leukemia
Splenic lymphoma/leukemia, unclassifiable
Splenic diffuse red pulp small B-cell lymphoma*
Hairy cell leukemia-variant*
Lymphoplasmacytic lymphoma
Waldenstrom macroglobulinemia
Heavy chain diseases
Alpha heavy chain disease
Gamma heavy chain disease
Mu heavy chain disease
Plasma cell myeloma
Solitary plasmacytoma of bone
Extraosseous plasmacytoma
Extranodal marginal zone
B-cell lymphoma of mucosa-associated
lymphoid tissue (MALT lymphoma)
Nodal marginal zone
B-cell lymphoma (MZL)
Pediatric type nodal MZL
Follicular lymphoma
Pediatric type follicular lymphoma
Primary cutaneous follicle center lymphoma
Mantle cell lymphoma
Diffuse large B-cell lymphoma (DLBCL), not otherwise specified
T cell/histiocyte rich large
B-cell lymphoma
DLBCL associated with chronic inflammation
Epstein-Barr virus (EBV)+ DLBCL of the elderly
Lymphomatoid granulomatosis
Primary mediastinal (thymic) large
B-cell lymphoma Intravascular large
B-cell lymphoma
Primary cutaneous DLBCL, leg type
ALK+ large B-cell lymphoma
Plasmablastic lymphoma
Primary effusion lymphoma
Large B-cell lymphoma arising in
HHV8-associated multicentric
Castleman disease
Burkitt lymphoma
B-cell lymphoma, unclassifiable, with features intermediate between diffuse large
B-cell lymphoma and Burkitt lymphoma
B-cell lymphoma, unclassifiable, with features intermediate between diffuse large
B-cell lymphoma and classical
Hodgkin lymphoma
Hodgkin Lymphoma
Nodular lymphocyte-predominant
Hodgkin lymphoma
Classical Hodgkin lymphoma
Nodular sclerosis classical Hodgkin lymphoma
Lymphocyte-rich classical Hodgkin lymphoma
Mixed cellularity classical Hodgkin lymphoma
Lymphocyte-depleted classical Hodgkin lymphoma
* These represent provisional entities or provisional subtypes of other neoplasms.
Diseases shown in italics are newly included in the 2008 WHO classification.
2. táblázat. WHO 2008: the mature T-cell and NK-cell neoplasms
T-cell prolymphocyte leukemia T-cell large granular lymphocytic leukemia Chronic lymphoproliferative disorder of NK-cells* Aggressive NK cell leukemia
Systemic EBV+ T-cell lymphoproliferative disease of childhood
(associated with chronic active EBV infection) Hydroa vacciniforme-like lymphoma Adult T-cell leukemia/ lymphoma Extranodal NK/T cell lymphoma, nasal type Enteropathy-associated T-cell lymphoma Hepatosplenic T-cell lymphoma Subcutaneous panniculitis-like T-cell lymphoma Mycosis fungoides Sezary syndrome
Primary cutaneous CD30+ T-cell lymphoproliferative disorder Lymphomatoid papulosis
Primary cutaneous anaplastic large-cell lymphoma Primary cutaneous aggressive epidermotropic CD8+ cytotoxic
T-cell lymphoma* Primary cutaneous gamma-delta T-cell lymphoma Primary cutaneous small/medium CD4+ T-cell lymphoma* Peripheral T-cell lymphoma, not otherwise specified Angioimmunoblastic T-cell lymphoma Anaplastic large cell lymphoma (ALCL), ALK+ Anaplastic large cell lymphoma (ALCL), ALK-
* These represent provisional entities or provisional subtypes of other neoplams.
Diseases shown in italics are newly included in the 2008 WHO classification.
| Séma | Napi dózis mg/m2 | nap | |
| CHOP (21 naponként) | |||
| C-cyclophosphamid | 750 mg | iv | 1 |
| H-adriamycin | 50 mg | iv | 1 |
| O-vincristin | 1,4 mg (max 2 mg) | 1 | |
| P-prednisolon | 100 mg | per os | 1-5 |
| CHOP-14 (14 naponként) | |||
| Megegyezik a CHOP-21-gyel | |||
| De kéthetente kell adni | |||
| G-CSF adása szükséges | |||
| R-CHOP-21 | |||
| R-CHOP-14 | |||
| Mint fentiek és rituximab | 375 mg | iv | 1 |
| CHOP-Bleo (21 naponként) | |||
| mint a CHOP és | |||
| Bleo-bleomycin | 15 mg | iv | 1+5 |
| CHOEP és CHOP-VP-16 (21 naponként) | |||
| mint CHOP és | |||
| E-etoposid | 100 mg | iv (1 ó) | 3-5 |
| CEOP (21 naponként) | |||
| C-cyclophosphamid | 750 mg | iv | 1 |
| E-epirubicin | 60 mg | iv | 1 |
| O-vincristin | 1.5 mg | iv | 1 |
| P-prednisolon | 60 mg | per os | 1-5 |
| CEMP (21 naponként) | |||
| C-cyclophosphamid | 650 mg | iv | 1 |
| E-etoposid | 150 mg | iv | 1 |
| M-mitoxantron | 12 mg | iv | 1 |
| P-prednisolon | 60 mg | 1-5 | |
| Séma | Napi dózis mg/m2 | nap | |
| Pro-MACE- (C)MOPP (28 naponként) | |||
| Pro-prednisolon | 60 mg | per os | 1-14 |
| M-methotrexát | 1500 mg | iv | 14 |
| leukovorin | 50 mg | iv | 15 |
| 6 óránként 6x | |||
| A-doxorubicin | 25 mg | iv | 1+8 |
| C-cyclophosphamid | 650 mg | iv | 1+8 |
| E-etoposid | 120 mg | iv | 1+8 |
| C-cyclophosphamid | 650 mg | iv | 1+8 |
| O-vincristin | 1.4 mg | iv | 1+8 |
| P-procarbazin | 100 mg | per os | 1-14 |
| P-prednisolon | 40 mg | per os | 1-14 |
| Pro-MACE-Cyta-BOM (21 naponként) | |||
| Prednisolon | 60 mg | per os | 1-14 |
| doxorubicin | 25 mg | iv | 1 |
| cyclophosphamid | 650 mg | iv | 1 |
| etoposid | 120 mg | iv | 1 |
| cytarabin | 300 mg | iv | 8 |
| bleomycin | 5 mg | iv | 8 |
| vincristin | 1.4 mg | v | 8 |
| methotrexat | 120 mg | iv | 8 |
| leukovorin | 15 mg | per os (6x) | 9 |
| MACOP-B | |||
| M-methotrexat | 400 mg | iv | 8+36+64 |
| leukovorin | 15 mg | per os (6x) | 9+37+65 |
| A-doxorubicin | 50 mg | iv | 1+15+29+43+57+71 |
| C-cyclophosphamid | 350 mg | iv | 1+15+29+43+57+71 |
| O-vincristin | 1.4 mg | iv | 8+22+36+50+64+78 |
| P-prednisolon | 75 mg | per os | 1-84 |
| B-bleomycin | 10 mg | iv | 22+50+78 |
| Séma | Napi dózis mg/m2 | nap | |
| VACOP-B | |||
| V-etoposid | 50 mg | iv 1 | 3.7.11. héten |
| 100 mg | per os | 2+3 3.7.11. héten | |
| A-doxorubicin | 50 mg | iv | 1 3.5.7.9.11 héten |
| C-cyclophosphamid | 350 mg | iv | 1 5.9. héten |
| O-vincristin | 1.2 mg | iv | 8 4.6.8.10. |
| 12. héten | |||
| P-prednisolon | 45 mg | per os | 1-8 nap majd |
| másnaponta | |||
| a 12. hét végéig | |||
| B-bleomycin | 10 mg | iv | 8 4.6.8.10.12.héten |
| IMVP-16 (21 naponként) | |||
| I-ifoszfamid | 1000 mg | iv | 1-5 |
| M-methotrexat | 30 mg | iv | 3+10 |
| VP-16-etoposid | 100 mg | iv | 1-3 |
| MINE | |||
| M-mesna | iv | 1-3 | |
| I-ifoszfamid | 1500 mg | iv (1 óra) | 1-3 |
| N-mitoxantron | 10 mg | iv (15 perc) | 3+10 |
| E-etoposid | 80-100 mg | iv (30 perc) | 1-3 |
| DHAP (21-28 naponként) | |||
| D-dexamethason | 40 mg/nap | iv | 1-4 |
| HA-ara-C | 2000 mg | iv x2 (2 óra) | 12 óránként |
| P-cisplatin | 100 mg | iv | 1 |
| ESHAP (21 naponként) | |||
| E-etoposid | 60 mg | iv (1 óra) | 1-4 |
| S-methilprednisolon | 500 mg/nap | iv | 1-4 |
| HA-ara-C | 2000 mg | iv (2 óra) | 5 |
| P-cisplatin | 25 mg | civ | 1-4 |
| civ = folyamatos | |||
| 24 órás inf. | |||
| Séma | Napi dózis mg/m2 | nap | |
| Hyper-CVAD/MA | |||
| 1. ciklus – Cyclophosphamid | 300mg/m2 (3 óra alatt) 12 óránként | 1-- nap | |
| - Mesna | 600 mg/m2 folyamatos infúzióban | 3 napig | |
| (kezdet: 1 órával a Cyclophosphamid előtt, | |||
| befejezés: 12 órával az utolsó dózis után) | |||
| - Doxorubicin | 25 mg/m2 | civ | 4-5 nap |
| - Vincristin | 1 mg/m2 | (civ?) | 4-5 nap |
| 2 mg | 11. nap | ||
| - Dexamethason | 40 mg | per os | 1-4 és 11-14 nap |
| - G-CSF | 5 ug/kg | 24 órával a doxo után, amig az fvs. | |
| >30 000 vagy a 21. napig | |||
| 2. ciklus - Metothrexate | 1 g/m2 | 1 nap | |
| (200 mg/m2 2 óra alatt, 800 mg/m2 22 óra alatt, | |||
| Leucovorin 50 mg iv 12 órával a Mtx után, | |||
| majd 15 mg iv/po 6 óránként 8x) | |||
| - Ara-C | 3 g/m2 iv 2 óra alatt 12 óránként | 2-3 nap | |
| - G-CSF | 5 ug/kg 24 órával a citosztatikum után, | ||
| amíg fvs.>30 000 vagy a 21. napig | |||
| High dose CHOP (21 naponta 4 ciklus) | |||
| Cyclophosphamid | 2000 mg/m2 | iv | 1-2 nap |
| Doxorubicin | 70 mg/m2 | 48 órás folyamatos | |
| inf. 1-2 nap | |||
| Vincristin | 1.4 mg/m2 | iv | 1. nap |
| Prednisolon | 100 mg/m2 | per os | 1-5 nap |
| G-CSF | 10 ug/kg | sc | 4-18 nap |
| ICE | |||
| I-ifoszfamid | 5000 mg | civ | 2 mesnával! |
| C-carboplatin | AUC=5 (max 800 mg) | iv | 2 |
| E-etoposid | 100 mg | iv | 1-3 |
| R-ICE | |||
| mint ICE és | |||
| R-rituximab | 375 mg | iv | 1 |
| R-IME | |||
| R-rituximab | 375 mg | iv | |
| I-ifoszfamid | 2000 mg | iv | 1-3 mesnával! |
| M-mitoxantron | 8 mg | iv | 1 |
| E-etoposid | 100 mg | iv | 1-3 |
| Séma Napi dózis mg/m2 | nap | ||
| MegaCEOP (14-21 naponta) | |||
| C-cyclophosphamid | 1200mg | iv | 1 |
| E-epirubicin | 110 mg | iv | 1 |
| O-vincristin | 1.4 mg | iv | 1 |
| P-prednisolon | 40 mg | per os | 1-5 |
| G-CSF kezeléssel | |||
| ACVBP (14 naponta) | |||
| A-doxorubicin | 75 mg | iv | 1 |
| C-cyclophosphamid | 1200 mg | iv | 1 |
| V-vindesin | 2 mg | iv | 1+5 |
| B-bleomycin | 10 mg | iv | 1+5 |
| P-prednisolon | 60 mg | per os | 1-5 |
| Konszolidáció: | |||
| BFM (B-ALL) (blokkok közt 16 nap) | |||
| Előfázis | |||
| cyclophosphamid (Cytoxan) | 200 mg/m2 | iv (1 óra) | 1-5 |
| prednisolon | 60 mg/m2 | per os | 1-5 |
| 1. fázis | |||
| vincristin | 2 mg | iv | 1 |
| methotrexat | 3000 mg | civ | 1 |
| ifoszfamid (Holoxan) | 800 mg | iv (1 óra) | 1-5 |
| teniposid (Vumon) | 100 mg | iv (1 óra) | 4-5 |
| cytosin arabinosid (Cytosar, Alexan) | |||
| 2x150 mg | iv (1 óra) | 4-5 12 óránként | |
| dexamethason (Oradexon) | 10 mg | per os | 1-5 |
| mtx (15mg), dexamethason (4mg), cytosin arabinosid (40mg) | |||
| 1. ill. 5. nap | |||
| intrathecalisan | |||
| 2. fázis | |||
| vincristin | 2 mg | iv | 1 |
| methotrexat | 3000 mg | civ | 1 |
| cyclophosphamid (Cytoxan) | 200 mg | iv | 1-5 |
| doxorubicin | 25 mg | iv (inf. 25 perc) | 4-5 |
| dexamethason | 10mg | per os | 1-5 |
| mtx (15mg), dexamethson (4mg), cytosin arabinosid (40mg) | |||
| 1. napi intrathecalisan | |||
| G | -CSF kiegészítéssel | ||
| R-GemOx | |||
| R-rituximab | 375 mg | iv | 1 |
| Gemcitabin | 1000 mg | iv | 2 |
| Oxaliplatin | 100 mg | iv | 2 |
| CODOX-M /IVAC alternáló | |||
| 1. ciklus CODOX-M | |||
| cyclophosphamid | 800 mg | iv | 1 |
| vincristin | 1.5 mg (max 2mg) | iv | 1 |
| doxorubicin | 40 mg | iv | 1 |
| cytarabin | 70 mg | iv | 1 |
| cycophoshamid | 200 mg | iv | 2-5 naponta |
| cytarabin | 70 mg | iv | 3 |
| vincristin | 1.5 mg(max 2 mg) | iv | 8 |
| methotrexat | 1200 mg | iv | 10 > 1 óra alatt |
| 240 mg | iv | óránként 23x | |
| leukovorin | 192 mg | iv | 11 (36 órával az |
| MTX kezdete után) | |||
| 12 mg | iv | 11 (6 óránként, míg | |
| MTX < 5x108ug/l) | |||
| G-CSF | 5ug/kg | sc | 13 (naponta |
| míg ANC>1*G/l) | |||
| methotrexat | 12 mg it | 15 | |
| leukovorin | 15 mg | po | 16 (24 órával az |
| intrathecalis után) | |||
| Következő ciklus feltétele: | ANC > 1.0*G/l | ||
| thr > 75*G/l | |||
| 2. ciklus IVAC | |||
| etopozid | 60 mg | iv | 1-5 (1 óra alatt |
| 500ml fiz.sóban) | |||
| ifosfamide | 1500 mg | iv | 1-5 (1 óra alatt |
| 500ml fiz.sóban) | |||
| Mesna | 360 mg | iv (ifosfamiddal keverve) | |
| azután | 360 mg | iv 3 óránként | 7x naponta |
| cytarabin | 2 g | iv | 1-2 naponta 2x |
| (Összesen 4x) | |||
| Methotrexat | 12 mg | it | 5 |
| leukovorin | 15 mg | po | 6 (24 órával |
| az MTX után) | |||
| G-CSF | 5 ug/kg | sc | 7 (naponta |
| míg ANC>1*G/l) | |||
| Következő ciklus feltétele: | 0ANC > 1.0*G/l | ||
| thr > 75*G/l |
FOLLIKULÁRIS LYMPHOMA
I. Alapvető megfontolások
A follikuláris lymphoma (FL) a nyirokrendszer elsődleges, klonális B sejtes daganatos megbetegedése. A 2008-as WHO beosztás szerint aFLa perifériás B-sejtes, mérsékelt malignitású non-Hodgkin lymphoma (NHL) leggyakoribb altípusa, mely a nyirokcsomó csiracentrum eredetű döntően follikuláris-noduláris jellegű tumora, domináns sejteleme a centrocyta, de kisebb arányban centroblast is jelen van.
A betegség klinikailag nem különböztethető meg egyéb indolens lymphomától, de patomorfológiai, genetikai jellegzetességei, bizonyos értelemben sajátos prognózisa és kezelése indokolják önálló protokoll alkalmazását.
Rövidítések jegyzéke
CR= teljes remisszió; CT=komputer tomográfia; DLBCL= diffúz nagy B-sejtes lymphoma; EORTC=European Organization for the Research and Treatment of Cancer; FIT=First Indolent Trial; FL=follikuláris lymphoma; ; FLIPI=Follicular Lymphoma International Prognostic Index; IF-RT=érintett mezős sugárkezelés; NHL=non-Hodgkin lymphoma; PET=pozitron emissziós tomográfia; PR=részleges remisszió; PRIMA=Primary Rituximab and Maintenance; R-B=rituximab-bendamustin; R-Chl= rituximab-chlorambucil; R-CHOP= rituximab-cyclophosphamid, doxorubicin, vincristin, prednisolon; R-CHVP=rituximab-cyclophosphamid, doxorubicin, vumon, prednisolon; R-CNOP= rituximab-cyclophosphamid, mitoxantron, vincristin, prednisolon; R-CVP=rituximab-cyclophosphamid, vincristin, prednisolon; R-DHAP= rituximab-dexamethason, nagydózisú citarabin, cisplatin; R-FC= rituximab-fludarabin, cyclophosphamid; R-FCM= rituximab-fludarabin, cyclophosphamid, mitoxantron; R-FND= rituximab-fludarabin, mitoxantron, dexamethason; R-IME= rituximab-ifosphamid, mitoxantron, etoposid; R-IVE= rituximab-ifosphamid, mitoxantron, epirubicin; R-MCP=rituximab-mitoxantron, chlorambucil, prednisolon; R-MINE= rituximab-ifosphamid, mitoxantron, etoposid; RT=sugárkezelés; UH= ultrahang; WHO=World Health Organization;
Epidemiológia, etiológia
A FL a leggyakoribb indolens és a második leggyakoribb lymphoma típus. Az összes NHL 15-30%-a sorolható e betegségcsoportba. Az USA-ban és a fejlett nyugat európai államokban gyakoribb, mint hazánkban, incidenciája 1.5-3.0/100000.
A betegség Magyarországi incidenciája évi 1.5-1.8/100000, így évente 150-180 új FL beteg kerül felismerésre. Prevalenciája 15-18/100000, mely érték az egyre hatékonyabb kezeléseknek köszönhetően folyamatos emelkedést mutat.
Főleg középkorúak és idősek betegsége, a betegség előfordulási maximuma 55-60 életév körül van, nőknél gyakrabban fordul elő.
A betegség természetes kórlefolyása lassú, a várható átlagos túlélés az immunterápia előtti érában (2000 előtt) 8-10 év volt. Az immunterápia rutinszerű alkalmazása óta az élettartam látványos javulása észlelhető. Statisztikai számítások szerint a túlélés 15 év körül lesz. Egyes esetekben akár gyógyulás is várható.
Patogenezis, patomechanizmus
A FL esetek 85-90%-ában kimutatható a bcl-2 gén transzlokációja, amely a diagnózis felállításában és a betegség nyomon követésére is alkalmas.
A WHO osztályozás a többségében noduláris szerkezetű, de esetleg diffúz területeket is tartalmazó FL-t hisztomorfológiailag az alkotó sejtek összetétele alapján négy típust (fokozatot /grade/) különböztet meg. A grade-1 és 2 csoportba indolens, a grade-3a csoportba a már az agresszívebb, de klinikailag még mérsékelt malignitású formák tartoznak. A ritka grade-3b fokozat az előző formáktól elérő, agresszív, kifejezett malignitású típus. Ez utóbbi forma kezelése és prognózisa a diffúz nagy B-sejtes lymphomákéval (DLBCL) csaknem azonos.
II. Diagnosztika
A megnagyobbodott nyirokcsomóból, vagy daganatos szövetből a sebészi, ritkábban vastagtű (core) biopszia elvégzése, vagy a kivett minta szövettani feldolgozása igazolja a betegséget.
A diagnosztika és differenciáldiagnosztika magába foglalja a klasszikus hisztomorfológiai, immun hisztokémiai és molekuláris biológiai módszereket. A csiracentrum sejtek immunfenotípusa: CD20+, CD5-, CD10+, CD19+, CD43-, sIg+, bcl-2+, bcl-6+. A t(14;18) kimutatása nemcsak az elsődleges diagnózisban, hanem a kezelés hatásának lemérésre (molekuláris remisszió), a reziduális betegség vagy a relapszus korai kimutatására is alkalmas.
Klinikai jellemzők
A betegek 75-80%-a a diagnózis felállításakor panaszmentes. A legfontosabb tünet a lassan növekvő nyirokcsomó megnagyobbodás. Mediasztinális lymphadenomegália ebben a betegségben ritkább, míg a retroperitoneális, mezenteriális, olykor bulky hasi nyirokcsomó konglomerátumok gyakoribbak. Az esetek csaknem felében extranodális manifesztációval is találkozunk, mely a progresszió során gyakoribbá válik.
Az elsődleges kezelésre a betegek >90%-a jól reagál. Az immunokemoterápia, majd ezt követő fenntartó kezelésekkel (fenntartó immunterápia) jelentősen javult a remissziók minősége, nőtt a teljes remisszióba kerülők aránya, a remissziók időtartama és az élettartam is. A betegek többsége a későbbi kezelésekre is jól reagál, de a remissziós idő folyamatosan csökken, végül a betegség terápia rezisztenssé válik.
A betegség előrehaladása során az esetek 20-30%-ban agresszív lymphomába való transzformálódás következik be. E csoport kezelési eredményei kedvezőtlenebbek, mint a de novo agresszív lymphomáké.
Vizsgálatok, staging
A vizsgálatokat három (kötelező, célzott és ajánlott) csoportba oszthatjuk:
1. A kötelező vizsgálatok a minden betegnél rutinszerűen elvégzendő vizsgálatok.
2. A célzott vizsgálatok az egy-egy szervre irányuló alkalmi vizsgálatok, amelyek a kötelező vizsgálatok során felmerülő eltérések tisztázását szolgálják.
3. Az ajánlott vizsgálatok azok, amelyek jelenleg nem mindenütt érhetők el, vagy nagyon költségesek és/ vagy nem nyújtanak bizonyítottan előnyt a betegség kiterjedésének pontosításában.
1. Kötelezően elvégzendő vizsgálatok:
- Anamnézis -Fizikális vizsgálat
- Vérkép és vérkémia
- Virológia (HBsAg, HCV, HIV)
- Nyaki régiók CT, vagy ultrahang vizsgálata
- Mellkasi CT vizsgálat
- Has és kismedence CT vizsgálata Csontvelő biopszia
2. Célzott vizsgálatok, egyedi megítélés szerint és klinikai tünetek alapján (gastroscopia, neurológia, esetleg liquor vizsgálat, csontscintigráfia, esetleg MRI).
3. Ajánlott vizsgálatok:
- Májbiopszia (klinikai gyanú esetén).
- Fej-nyaki, illetve kismedencei szervi érintettség esetén CT helyett MRI Echocardiographiás vizsgálat antracyclin tartalmú kezelés esetén -PET/CT vizsgálat
= lokalizált betegség gyanúja esetén
= I-II/e manifesztáció esetén
= transzplantáció előtt
= relapszus, transzformáció gyanúja esetén a biopszia helyének kijelölésére
RESTAGING
- Mindazon "kötelező" vizsgálatok megismételendők, melyeket a staging során elvégeztünk.
- A célzott vizsgálatokból pedig azok ismétlése szükséges, melyek pozitívak voltak.
RELAPSZUS VIZSGÁLÁSA
- Ugyanazon vizsgálatok elvégzése szükséges, mint az első kezelés előtt.
- Teljes remisszióból történő relapszus, egy éven túli relapszus, transzformáció gyanúja esetén rebiopszia elvégzése is szükséges.
STÁDIUMBEOSZTÁS
FL-k esetében is - más lymphomákhoz hasonlóan - a betegség kiterjedtségét jelző Ann-Arbor-i stádiumbeosztás használatos (ld. más fejezetben).
PROGNÓZIS
A betegség kimenetelének előrejelzésére a legáltalánosabban még a "rituximab-éra" előtt kezelt betegekre kidolgozott FLIPI (Follicular Lymphoma International Prognostic Index) használata terjedt el. Az alábbi öt rizikótényező értékelése alapján a betegek három szignifikánsan különböző prognosztikus csoportba, az alacsony, a közepes és a kedvezőtlen rizikójú csoportokba sorolhatóak. FLIPI
| Értékelt paraméterek | Kedvezőtlen értékek Relatív rizikó | |
| Életkor: | > 60 év | 2,38 |
| Klinikai stádium: | III-IV | 2,00 |
| Hemoglobin szint: | < 12 mmol/l | 1,55 |
| LDH szint: | > normál1,50 | |
| Érintett régiók száma: | > 4 | 1,39 |
Az értékelésnél mindegyik kedvezőtlen értékű paraméter 1 pontot jelent. Így 0-5 pontot lehet elérni.
Ezek alapján képezhető az alábbi három rizikócsoport.
| Rizikó csoport | Rizikófaktorok | Betegek (%) | 5-év (%) | 10-év (%) | Relatív rizikó |
| Alacsony | 0-1 | 36 | 91 | 71 | 1.0 |
| Közepes | 2 | 37 | 78 | 51 | 2.3 |
| Kedvezőtlen | £ 3 | 27 | 53 | 36 | 4.3 |
A FLIPI az immun-kemoterápiás kezelések mellett is jól használhatónak bizonyult.
Immunterápia alkalmazása mellett előrehaladott stádiumban az 5 éves túlélés 60-70%-ról 80-90%-ra nőtt, a 10 éves 40% helyett 70-75% körül várható.
III. Kezelés
A FL kezelése nem egységes, függ a szövettani altípustól (grading), a betegség kiterjedtségétől, a prognosztikai faktoroktól, valamint a beteg korától, általános állapotától és kísérő betegségeitől. Tekintettel arra, hogy a betegek általában az idősebb korosztályba tartoznak, szem előtt kell tartani, hogy ne a betegséget, hanem a beteget kezeljük. A FL-s beteg kezelésében több lehetőség közül választhatunk.
Kezelési ajánlási algoritmus az FL elsődleges kezelésére
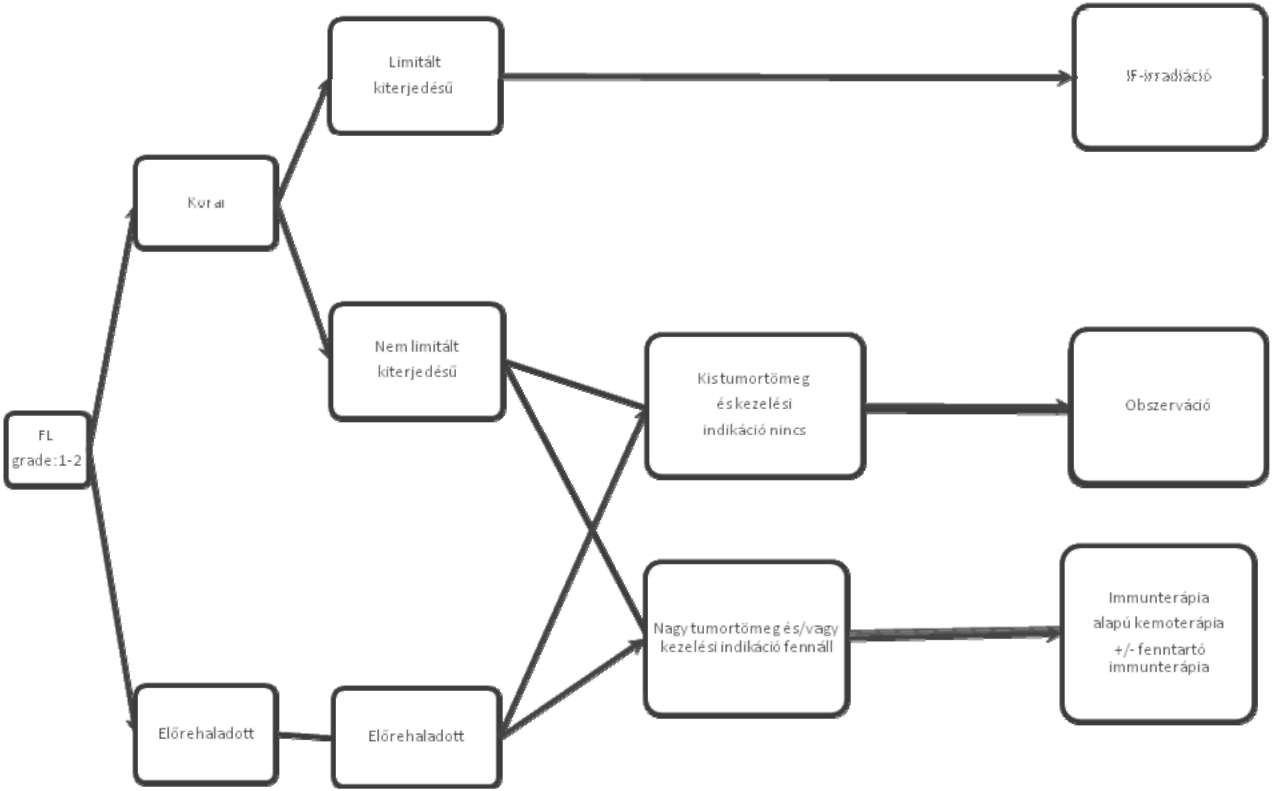
Elsődleges kezelés
A FL kezelése függ a szövettani altípustól (grade-1 és 2 versus grade-3a versus grade-3b), a stádiumtól, a prognosztikai faktoroktól, a beteg életkorától, általános állapotától.
A grade-1 és 2 típusokat klinikai, prognosztikai és kezelési szempontból egységes betegségnek tekintjük. A grade-3a típus klinikai és prognosztikai szempontból kevésbé homogen megbetegedés. Indolens és agresszívebb megbetegedések egyaránt előfordulnak ebben a csoportban, melyet a változatos 20-40% közötti Ki-67 aktivitás is jelez. Mivel a betegség természete kezelés előtt nem ismert, e csoportban a hatékonyabbnak tartott antraciklin tartalmú kezelés adása javasolt. A grade-3b típust DLBCL-ként kell kezelni.
Fontos annak eldöntése is, hogy a beteg potenciálisan alkalmas-e nagy dózisú kezelésre és őssejt pótlásra. A felsorolt tényezők közül a betegség kiterjedésének megállapítása a legfontosabb.
I-II/A Klinikai stádiumú, kedvező prognózisú (nincs nagy daganat, kevesebb, mint 3 régió érintett) Korai megbetegedések kezelése
A limitált kiterjedésű, rekesz azonos oldalán észlelhető (I-II klinikai stádium), un. kis tumor tömegű betegség esetén - mely az összes eset 15-20 %-a - kuratívcélú radioterápia (RT) az elsődlegesen választandó kezelési mód. E válogatott esetek csaknem felénél érintett mezős 30-36 Gy összdózisú besugárzással (IF-RT) végleges gyógyulás érhető el. A 10 éves progressziómentes túlélés 45-80%, relapszus a besugárzott területen csak 10%. E betegeknél a sugárkezelés előtt a betegség kiterjedésének ellenőrzésére ajánlható PET/CT vizsgálat elvégzése.
Amennyiben azonban a betegség háromnál több régiót érint, a túl nagy besugárzási mező miatt sugárkezelés már nem ajánlott. Korai klinikai stádium, de nagy daganat és/vagy klinikai tünetek esetén a kezelési elvek a kiterjedt betegségnél javasoltakkal azonosak.
Kiterjedt, kedvezőtlen prognosztikus jegyek nélküli betegség kezelése: II (3-nál több érintett régió) és III-IV klinikai stádium
Kiterjedt betegség esetén annak eldöntése a legfontosabb, hogy egyáltalán fennáll-e kezelést indikáló tényező [nagy daganat (>7 cm), nagy tumor-tömeg (több régióban 3-5 cm-t elérő daganatok), kompressziós tünet, citopéniát okozó csontvelői érintettség, immuncitopénia, leukémiás vérkép, jelentős hepato-splenomegalia, aktivitási tünet].
Amennyiben kezelési indikáció nincs, csak szoros obszerváció ("figyelő várakozás") javasolt (evidencia szint: IB). Ennek eldöntésében segítséget nyújt a FLIPI is. Főleg tünetmentes betegeknél, ha kicsi a tumortömeg, a betegség stacioner jellegű, kis rizikójú FLIPI esetén nem szükséges kezelés mindaddig, míg a betegség nem progrediál. Ezekben az esetekben a korán kezdett terápia nem javítja a túlélést.
Kiterjedt, kedvezőtlen prognózisú megbetegedés kezelése: II (3-nál több érintett régió) és III-IV klinikai stádium Kezelési indikáció fennállása esetén immunterápia alapú kemoterápiás kezelés alkalmazása ajánlott (evidencia szint: IB). Az elsődleges kezelésre a betegek többsége jól reagál az immuno-kemoterápia alkalmazása óta jelentősen javult a remissziók minősége, jelentősen nőtt a teljes remisszióba kerülők aránya.
Elsődleges kezelésként több kezelési séma jön szóba. Ezek az R-CVP, R-CHOP, R-MCP, R-CHVP és az R-Bendamustin (R-B) kezelések (evidencia szint: IB). A legnagyobb számú vizsgálatok az első két sémával történtek, ezek használata a legelterjedtebb. Az R-MCP-t német, míg az R-CHVP-t francia munkacsoportok alkalmazzák. Az R-B kezelés hatását német munkacsoport az R-CHOP kezelésével összevethetőnek találta. Ezeken kívül még chlorambucilt (R-Chl) és fludarabin, fludarabin tartalmú kombinációk használatosak (R-F, R-FND, R-FC, R-FCM) (evidencia szint: IB-IIB). A kezelések tervezésénél figyelembe kell venni, hogy előrehaladott Fludara-tartamú kezelések hátrányosan befolyásolhatják az őssejtgyűjtés sikerességét. Általános gyakorlat, hogy a grade-3a típust, ill. a bulky tumorral járó betegségeket R-CHOP séma szerint kezelik. Előnyösebbnek tartják az antracyclin tartamú kezelést fiatal, jó általános állapotú betegeknél is. Idősebb betegeknél, jelentős kísérőbetegségek, kisebb tumortömeg esetén R-CVP kezelés elégséges.
A III-IV klinikai stádiumú beteg elsődleges R-CVP vagy R-CHOP indukciós kezelését követően konszolidációs céllal Zevalint® is szóba jön. Azon ritka esetekben, mikor a beteg rituximabra allergiás, vagy a daganat CD20 negatív, vagy negatívvá válik, a fenti kemoterápiás kombinációk immunterápia nélkül alkalmazandók. Idős betegeknél pedig, ha a kemoterápia kontraindikált, az immunterápia (rituximab) monoterápia formájában is hatékonyan alkalmazható.
Második vonalbeli és későbbi kezelések
Terápia rezisztens esetek kezelése
A betegek kevesebb, mint 10%-a az elsődleges kezelésre nem reagál vagy a kezelés alatt progrediál (progresszív betegség). Ezeknél az un. primer rezisztens eseteknél fontos tisztázni, hogy csak az adott gyógyszerekre rezisztensek, vagy netán a lymphoma agresszívebb változatával állunk-e szemben (grade-3b, DLBCL). Ez utóbbi gyanúja esetén rebiopszia elvégzése mindenképpen ajánlott és amennyiben ez igazolódik, az adott kórképnek megfelelő kezelés szükséges.
Valódi primer rezisztencia esetén agresszívebb és nem keresztrezisztens szereket tartalmazó kombinációk adása ajánlott. (Pl. R-CVP esetén R-CHOP, illetve R-CHOP esetén R-B, vagy R-FND, vagy R-FCM). Fiatal (<65 év) betegek esetén a kedvezőtlen prognózis miatt középnagy dózisú kezelés (R-IME, R-DHAP, stb.), majd autolog őssejttranszplantáció javasolt.
Relapszusok kezelése
A relapszus gyakori, folyamatos, évente a betegek kb. 5-10 %-nál észlelhető. A relapszus során többségben hisztológiai változás, vagy progresszió is észlelhető, idővel az esetek 20-30%-nál DLBCL-be való transzformáció is megfigyelhető. A relapszus terápiája függ az első kezelés formájától, a relapszus stádiumától (lokalizált-disszeminált), a prognosztikai tényezőktől, a rebiopszia hisztológiai eredményétől és a beteg korától, állapotától. A terápiás stratégia szempontjából korai és késői relapszus különböztetünk meg.
Korai relapszus kezelése
Amennyiben az elsődleges kezeléssel teljes remissziót értünk el és a betegség egy éven belül kiújul, korai relapszusról beszélünk. A csoporton belül el szokták különíteni a fél éven belül visszaeső betegeket, akiket már a kedvezőtlenebb primer rezisztens csoportba sorolunk.
A fél éven túl visszaeső betegeknél a beteg általános állapota, életkora, a progresszió gyorsaságának értékelése alapján dönthetünk intenzív és újabb standard kezelési sémák között.
Késői relapszus kezelése
Amennyiben a kezeléssel teljes remissziót értünk el és a betegségmentes időtartam az egy évet meghaladja, késői relapszusról beszélünk. Ez esetben mindazon kezelések alkalmazhatók, melyek az elsődleges kezelésként felmerültek, a korábban hatékony kezelés is megismételhető.
A másod-, vagy többedleges kezelés után alkalmazott fenntartó immunterápiás kezelés (rituximab) mind a relapszus- és progressziómentes túlélést, mind a teljes túlélést növeli (evidencia szint: IB).
Relapszus esetén, különösen a speciális rituximab refrakter esetekben (mely a rituximab adást követő 6 hónapon belüli progressziót/ relapszust jelent) radioimmunoterápia adása is lehetséges. A béta-sugárzó Zevalin adására a betegek 50-70%-a reagál, 15-20% kerül teljes remisszióba. A remisszió tartama 2 év körüli (evidencia szint IB).
Fenntartó immunterápiás kezelés részleges és teljes remisszióban (evidencia szint: I)
Fenntartó immunterápiával (rituximab) a "csak" részleges remisszióba (PR) került betegek egy része teljes remisszióba kerül, más része pedig hosszasan részleges remisszióban tartható.
A teljes remisszióba (CR) kerültek fenntartó immunterápiás kezelése a betegségmentes túlélést, a teljes túlélést növeli és a minimális reziduális betegséget eliminálhatja.
Jelenleg a legáltalánosabb a 2 éven át 2-3 havonta adott standard dózisú (375 mg/m2) fenntartó rituximab kezelés.
Transzplantáció
65 évnél fiatalabb, primer rezisztens, korai relabáló, másod-, harmadvonalbeli kezelésekkel csak viszonylag rövid ideig remisszióba kerülő betegek esetében középnagy dózisú kezelést követően nagydózisú kemoterápiás kezelés és autolog őssejttranszplantáció végzése jön szóba.
Kezelési sémák
Rituximab - MabThera® (R) monoterápia
Ma a FL kezelésében elsőrendű gyógyszer mind a primer mind a későbbi kezelések során. Általában kemoterápiával kombinálva adják. Idős betegeknél, akiknél a kemoterápia adása ellenjavalt, alkalmazható monoterápia formájában is. Adagolása: hetente 1 x 375 mg/m2 infúzióban, négy alkalommal ismételve. Nagy tumortömeg, bulky tumor esetén önmagában alkalmazva kevésbé hatásos.
Rituximab - MabThera® fenntartó kezelés
2-3 havonta 375 mg/m2 legalább két éven át.
R-CVP (rituximab 375 mg/m2 1. nap - cyclophosphamid 750 mg/m2, vincristin 1,4 mg/m2, (max.: 2mg) 1. nap, prednisolon 100 mg 1-5. nap; 6-8 ciklus 21 naponta). Első vonalbeli standardkezelés. Késői relapszus esetén is ajánlott.
R-CHOP (rituximab 375 mg/m2 1. nap - cyclophosphamid 750 mg/m2, doxorubicin 50 mg/m2, vincristin 1,4 mg/m2, (max.: 2 mg) 1. nap, prednisolon 100 mg per os. 1-5. nap; 6-8 ciklus 21 naponta). Jelenleg a leghatékonyabb első vonalbeli standardkezelés. Késői relapszus esetén is ajánlott. Fiatal betegeknek, bulky tumor esetén ajánlott. Grade-3a típus esetén standard.
R-CNOP (rituximab 375 mg/m2 1. nap - cyclophosphamid 750 mg/m2, mitoxantron 12 mg/m2, vincristin 1,4 mg/m2, (max.: 2 mg) 1. nap, prednisolon 100 mg per os. 1-5. nap; 6-8 ciklus 21 naponta). Idősebb, betegeknek ajánlható, az R-CHOP-nél kevésbé hatékony.
R-B (rituximab 375 mg/m2 1. nap - bendamustin 90 mg/m2 infúzióban 1-2. nap; 6 ciklus 28 naponta). Elsődleges, másod-, harmadvonalbeli kezeléshez.
R-F (rituximab 375 mg/m2 1. nap - fludarabin 40 mg/m2 p. os, vagy 25 mg/m2 infúzióban 1-5. nap; 6 ciklus 28 naponta). Másod-, harmadvonalbeli kezeléshez. A későbbi esetleges őssejtgyűjtés sikerét befolyásolhatja.
R-FM (rituximab 375 mg/m2 1. nap - fludarabin 25 mg/m2 1-3 nap, mitoxantron 10 mg/m2 1. nap; 6 ciklus 28 naponta). Másod-, harmadvonalbeli kezelés. A későbbi esetleges őssejtgyűjtés sikerét befolyásolhatja.
R-FCM (rituximab 375 mg/m2, 1. nap - fludarabin 25 mg/m2, 1-3. nap, cyclophosphamid 200 mg/m2, 1-3. nap, mitoxantron 8 mg/m2, 1. nap; 6 ciklus 28 naponta). Másod-, harmadvonalbeli kezelés. A későbbi esetleges őssejtgyűjtés sikerét befolyásolhatja.
R-FND (rituximab 375 mg/m2, 1. nap - fludarabin 25 mg/m2, 1-3. nap, mitoxantron 10 mg/m2, 1. nap, dexamethason 20 mg 1-5. nap; 6 ciklus 28 naponta). Másod-, harmadvonalbeli kezeléshez. A későbbi esetleges őssejtgyűjtés sikerét befolyásolhatja. Őssejtgyűjtés szükséges előtte. Infekciók veszélyét növeli.
R-FCM (rituximab 375 mg/m2, 1. nap - fludarabin 25 mg/m2, 1-3. nap, chlorambucil 10 mg/m2, 1-7. nap, mitoxantron 10 mg/m2, 1-3. nap; 6 ciklus 28 naponta). Első-, másod-, harmadvonalbeli kezeléshez, idős betegek jól tolerálják. A későbbi esetleges őssejtgyűjtés sikerét befolyásolhatja.
R-Chl (rituximab 375 mg/m2, 1. nap - chlorambucil 10 mg/m2, 1-7. nap; 6-8 ciklus 28 naponta). Idős, jelentős társbetegséggel rendelkező és/vagy gyenge általános állapotú betegeknek.
R-DHAP (rituximab 375 mg/m2, 1. nap - dexamethason 40 mg, 1-4. nap; cytarabin 2 g/m2, 2. nap 2 x 12 óránként; cisplatinum 100 mg/m2 1. nap). Transzplantációt megelőző kezelés a kemorezisztencia áttöréséhez, ill. őssejtgyűjtéshez.
R-IME (R-VIM) (rituximab 375 mg/m2, 1. nap - ifosphamid 1500 mg/m2, 1-3. nap uromitexan védelemben; mitoxantron 12 mg/m2, 1. nap; etoposid 150 mg/m2, 1-3. nap). Transzplantációt megelőző kezelés a kemorezisztencia áttöréséhez, ill. őssejtgyűjtéshez.
R-MINE (rituximab 375 mg/m2, 1. nap - ifosphamid 1000 mg/m2, 1-3. nap uromitexan védelemben; mitoxantron 8 mg/m2, 1. nap; etoposid 80 mg/m2, 1-3. nap). Transzplantációt megelőző kezelés a kemorezisztencia áttöréséhez, ill. őssejtgyűjtéshez.
R-IVE (rituximab 375 mg/m2, 1. nap - ifosphamid 1500 mg/m2, 1-3. nap uromitexan védelemben; etoposid 150 mg/m2, 1-3. nap; epirubicin 60 mg/m2, 1. nap;). Transzplantációt megelőző kezelés a kemorezisztencia áttöréséhez, ill. őssejtgyűjtéshez.
Nagydózisú chlorambucil (HD-Chl) (chlorambucil, 10-15 mg/m2 naponta a remisszió eléréséig és/vagy a toxicitás kialakulásáig, maximális időtartam 6 hónap). Hetente vérkép ellenőrzés szükséges.
Intermittáló chlorambucil (chlorambucil, 15-40 mg/m2 1-4. napig 14-28 naponta ismételve).
Kis dózisú chlorambucil (chlorambucil, 1-4 mg/m2 naponta folyamatosan 3-6 hónapon át).
90Y-ibritumomab tiuxetan - Zevalin® [Zevalin 15 vs. 11 MBq/tskg (max.: 1200 MBq) 8. nap a thrombocyta szám függvényében; rituximab 250 mg/m2 1. és 8. nap]. Rituximab rezisztens esetek másod- és harmadvonalbeli kezelésére. Indukciós kezelés után konszolidáló kezelésre.
IV. Követés, V. Gondozás
A kezelésre nem szoruló, illetve a kezelésre remisszióba (PR, CR) kerülő betegek rendszeres ellenőrzésre szorulnak. Javasolt ideje az első két évben háromhavonta, a harmadik és negyedik évben félévenként, ezt követően évenként. Panaszok vagy relapsus gyanúját keltő tünetek estén soron kívüli ellenőrzésre van szükség. Ellenőrzéskor elvégzendő vizsgálatok:
Fizikális vizsgálat, teljes vérkép, LDH, We és egyéb laboratoriumi vizsgálatok. A képalkotó eljárások is nélkülözhetetlenek, azonban ezek gyakoriságát illetően jelentős intézeti és egyéni különbségek figyelhetők meg. A kontroll során általában képalkotó vizsgálatok (mellkas röntgen, hasi UH, sz. e. CT) szükségesek. A relapsus gyakran az eredetileg érintett helyeken jelentkezik, ezért a képalkotó eljárásokkal (RTG, UH, CT, MR) elsősorban ezeket a régiókat vizsgáljuk.
VI. Irodalomjegyzék
1. Ardeshna KM, Smith P, Norton A, et al.: Long-term effect of a watch and wait policy versus immediate systemic treatment for asymptomatic advanced-stage non-Hodgkin lymphoma: a randomised controlled trial. Lancet, 2003; 362: 516-22,
2. Armitage JO, Mauch PM, Harris NL, et al: Non-Hodgkin lymphomas (ed 2nd). Philadelphia, USA: Lippincott Williams and Wilkins, 2010.
3. Bachy E, Brice P, Delarue R, et al.: Long-term follow-up of patients with newly diagnosed follicular lymphoma in the prerituximab era: effect of response quality on survival - A study from the gruope d'Etude des Lymphomes de l'Adulte. J Clin Oncol 2010;28:822-829.
4. Czuczman MS, Koryzna A, Mohr A, et al.: Rituximab in combination with fludarabine chemotherapy in low-grade or follicular lymphoma. J Clin Oncol 2005; 23: 694-704.
5. Czuczman MS, Weaver R, Alkuzweny B, et al.: Prolonged clinical and molecular remission in patients with low-grade or follicular non-Hodgkin's lymphoma treated with rituximab plus CHOP chemotherapy: 9-year follow-up. J Clin Oncol 2004; 22: 4711-6
6. Forstpointner R, Dreyling M, Repp R, et al.: The addition of rituximab to a combination of fludarabine, cyclophosphamide, mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared with FCM alone in patients with relapsed and refractory follicular and mantle cell lymphomas: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood, 104: 3064-71, 2004.
7. Ghielmini M, Schmitz SF, Cogliatti SB, et al.: Prolonged treatment with rituximab in patients with follicular lymphoma significantly increases event-free survival and response duration compared with the standard weekly x 4 schedule. Blood, 103: 4416-23, 2004.
8. Hagenbeek A, Eghbali H, Monfardini S, et al.: Phase III intergroup study of fludarabine phosphate compared with cyclophosphamide, vincristine, and prednisone chemotherapy in newly diagnosed patients with stage III and IV low-grade malignant Non-Hodgkin's lymphoma. J Clin Oncol, 24: 1590-6, 2006.
9. Hainsworth JD, Litchy S, Morrissey LH, et al.: Rituximab plus short-duration chemotherapy as first-line treatment for follicular non-Hodgkin's lymphoma: a phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol, 23: 1500-6, 2005.
10. Hainsworth JD, Litchy S, Shaffer DW, et al.: Maximizing therapeutic benefit of rituximab: maintenance therapy versus re-treatment at progression in patients with indolent non-Hodgkin's lymphoma--a randomized phase II trial of the Minnie Pearl Cancer Research Network. J Clin Oncol, 23: 1088-95, 2005.
11. Herold M, Haas A, Srock S, et al.: Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: an East German Study Group Hematology and Oncology Study. J Clin Oncol, 25: 1986-92, 2007.
12. Hiddemann W, Kneba M, Dreyling M, et al.: Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood, 106: 3725-32, 2005.
13. Lenz G, Dreyling M, Schiegnitz E, et al.: Myeloablative radiochemotherapy followed by autologous stem cell transplantation in first remission prolongs progression-free survival in follicular lymphoma: results of a prospective, randomized trial of the German Low-Grade Lymphoma Study Group. Blood, 104: 2667-74, 2004.
14. Marcus R, Imrie K, Solal-Celigny P, et al.: Phase III study of R-CVP compared with cyclophosphamide, vincristine, and prednisone alone in patients with previously untreated advanced follicular lymphoma. J Clin Oncol, 26: 4579-86, 2008.
15. Morschhauser F, Radford J, Van Hoof A, et al.: Phase III trial of consolidation therapy with yttrium-90-ibritumomab tiuxetan compared with no additional therapy after first remission in advanced follicular lymphoma. J Clin Oncol, 26: 5156-64, 2008.
16. Peterson BA, Petroni GR, Frizzera G, et al.: Prolonged single-agent versus combination chemotherapy in indolent follicular lymphomas: a study of the cancer and leukemia group B. J Clin Oncol, 21: 5-15, 2003.
17. Portlock CS, Rosenberg SA: No initial therapy for stage III and IV non-Hodgkin's lymphomas of favorable histologic types. Ann Intern Med, 90: 10-13, 1979.
18. Robinson KS, Williams ME, van der Jagt RH, et al.: Phase II multicenter study of bendamustine plus rituximab in patients with relapsed indolent B-cell and mantle cell non-Hodgkin's lymphoma. J Clin Oncol, 26: 4473-9, 2008.
19. Salles GA, Mounier N, de Guibert S, et al.: Rituximab combined with chemotherapy and interferon in follicular lymphoma patients: final analysis of the GELA-GOELAMS FL2000 study with a 5-year follow-up. [Abstract] Blood, 110: A-792, 2007.
20. Salles GA, Seymour JF, Feugier P, et al: Rituximab maintenance for 2 years in patients with untreated high tumor burden follicular lymphoma after response to immunochemotherapy. [Abstract] J Clin Oncol, 28: A-8004, 2010.
21. Schouten HC, Qian W, Kvaloy S, et al.: High-dose therapy improves progression-free survival and survival in relapsed follicular non-Hodgkin's lymphoma: results from the randomized European CUP trial. J Clin Oncol, 21: 3918-27, 2003.
22. Schulz H, Bohlius J, Skoetz N, et al.: Combined immunochemotherapy with rituximab improves overall survival in patients with follicular and mantle cell lymphoma: updated meta-analysis results. [Abstract] Blood, 108: A-2760, 2006.
23. Swerdlow SH, Campo E, Harris NL, et al: WHO classification of tumours of haematopoietic and lymphoid tissues (ed 4th). Lion, France: IARC Press, 2008.
24. Tsimberidou AM, McLaughlin P, Younes A, et al.: Fludarabine, mitoxantrone, dexamethasone (FND) compared with an alternating triple therapy (ATT) regimen in patients with stage IV indolent lymphoma. Blood, 100: 4351-7, 2002.
25. van Oers MH, Klasa R, Marcus RE, et al.: Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood, 108: 3295-301, 2006.
26. Velasquez WS, Lew D, Grogan TM, et al.: Combination of fludarabine and mitoxantrone in untreated stages III and IV low-grade lymphoma: S9501. J Clin Oncol, 21: 1996-2003, 2003.
27. Zinzani PL, Pulsoni A, Perrotti A, et al.: Fludarabine plus mitoxantrone with and without rituximab versus CHOP with and without rituximab as front-line treatment for patients with follicular lymphoma. J Clin Oncol, 22: 2654-61, 2004.
KÖPENYSEJTES LYMPHOMA
I. Alapvető megfontolások
WHO klasszifikáció: perifériás B sejtes, (pre-centrum-germinativum eredetű) köpenysejtes (mantle cell) lymphoma
BNO besorolás (haematopathologiai vélemény alapján): C8200
A köpenysejtes lymphoma a nyirokcsomó struktúrában a nyirokcsomó folliculusokat övező köpenyrégió proliferációjaként vált ismertté az európai, Kiel-i lymphomacsoport meghatározása szerint. A 2000, majd 2008-as WHO osztályozásában az ún. perifériás B-sejtes lymphomák közé sorolta (2, 3). A köpenysejtes lymphoma genesise a centrum germinativum előtti érési szakaszra nyúlik vissza. A köpenysejtes lymphoma klinika lefolyásában keverednek az aggresszív és az indolens lymphomák kedvezőtlen elemei. Az agresszív lymphomákhoz hasonlóan gyors lefolyású és progresszív (a kóros sejt a lymphoid érés korai szakaszban keletkezik), de az indolens lymphomákhoz hasonlóan kemoterápiával, illetve immuno-kemoterápiával nem gyógyítható. A klinikai besorolásban szokás un. "mérsékelten aggressziv" kategóriaként említeni. A folliculushoz igazodó morphologia, a klinikai lefolyás és a hatékony therapia megválasztása szempontjából, a német példát követve (pl. egységes mantle cell és follicularis lymphoma indolens lymphoma tanulmányok) érdemes mégis a WHO terminológiát a BNO kódrendszerhez applikálva az indolens lymphoma megjelöléshez kapcsolni (C8200).
A betegség lényegesen gyakoribb a férfiakban, a közép- és idősebb korúakban. Az uj esetek számát Magyarországon évente 60-80 közöttinek becsülhetjük.
Klinikai pathologia
A köpenysejtes lymphoma morfológiailag többféle altípusban jelenhet meg, így a klasszikus köpenyzóna, a kissejtes, a pleiomorph variáns, illetve a blastoid típusok különíthetők el . Ezen típusok a tapasztalat alapján befolyásolják a betegség lefolyását és a terápiára adott választ Így pl a klasszikus köpenyzóna megjelenés gyakoribb időskorban, illetve jellemzőbb rá az indolens lefolyás és a viszonylag jó túlélés.
A klinikai pathologia egyik központi eleme a ciklin D1 szabályozás zavara, azaz pozitivitás, amelyet 11, 14 transzlokációs vizsgálattal is ki lehet mutatni. A ciklin D1 dysregulatiot nagyban befolyásolja a B-sejt érés immunglobulin érést szabályozó folyamata. Ezen kölcsönhatás révén ciklin D1 hyperexpresszió, ritkábban azonban ciklin D2, vagy D3 út belépése is kialakulhat. Kivételesen lehetnek CiklinD1 negastiv esetek is, de ezek általában a D2 vagy D3 pozitivitással jellemezhetők. A köpenysejtes lyphoma klón apoptosisa csökkent, amelyet leginkább a dcl2 FAS-ligand, illetve a TNF relációjú apoptosist indukáló ligand (ismert rövidítéssel trail) játszik szerepet. A p53, p16 és a p27 státusz heterogén, s ezek prognosztikus jelentősége is nagy. A Sox-11 negatív, hyperexpressio nélküli esetek lehetnek, körülírtak, indolensek, s nem progrediálnak. - Általában azonban néhány év múlva a Sox-11 hyperexpressio ezekben az esetekben is megjelenik később, s a kórkép aggresszivvé válik. A leukaemiás forma is lehet Sox 11 negativitás mellett indolens. A ritka blastoid variánsra jellemző a p53 vagy p16 megjelenése, kifejezetten agresszív lefolyású (de jól reagál as megfelelő kezelésre)
Immunfenotípus: A krónikus lymphoid leukémiához hasonlóan a köpenysejtes lymphoma is olyan B sejtekből áll, amelyek abberáns CD5 (eredetileg T-sejt marker) pozitivitással rendelkeznek. A köpenysejtes lymphomán a krónikus lymphoid leukémiával ellentétben nem kis CD20, hanem masszív CD20 pozitivitás (nem "dim", hanem "bright") látható, de CD23 és CD10 negatív. A köpenysejtes lymphomák praktikusan 100%-ban CD52 pozitivak.
II. Diagnosztika
A köpenysejtes lymphoma tipikusan középkorú, vagy idősebbekben megjelenő betegség kb. három-négyszeres férfi túlsúllyal. A betegségek túlnyomó része kiterjedt III-IV. stádiumban kerül felismerésre (nemcsak hazánkban). A klasszikus köpenyzóna lymphoma néha 1-2 nyirokcsomó régióra lokalizált. Jelentős az extranodális érintettség, 20-30%-ban gyomor, illetve vastagbél kiterjedt polipoid eltéréseivel (ún. lymphomatoid polyposis). A lépnagyobbodás néha jelentős Emellett megjelenhet 20-40% várható gyakorisággal köpenysejtes, leukémiás vérkép is (tipikusan 20-30 ezres fehérvérsejt szám, hasított magvú lymphoid sejtek). Csaknem minden tipikus esetben van B tünet.
A diagnosztika döntő eleme a nyirokcsomó szövettan, a csontvelő vizsgálat. Az aspirátumban, vagy a szövetttani mintában jól vizsgálhatók a köpenysejtes lymphoma immunfenotipus, illetve a ciklin D1 expresszió. A kivizsgálás és stádium felmérés része a tápcsatornai endoszkópia is, amit célszerű elvégezni a kezdeti staging részeként is. Újabb adatok arra utalnak, hogy tápcsatorna érintettség szinte minden esetben kialakul (gyakran mikroszkópikus). Ez egyben azért azt is jelenti, hogy gyors progressio esetén meg lehet kezdeni a kezelést endoscopia előtt is, de a követésben a vizsgálat már nem maradhat el.
A PET-CT vizsgálat köpenysejtes lymphomában a gyakorlatban mindig pozitív, de a PET CT tapasztalat sokkal kisebb, mint pl. a DLBC vagy Hodgkin eseteiben. Az interim PETCT algoritmus még nem alakult ki szélesebb körben elfogadható formában. A PET CT jól jelzi a gyomor, bélnyálkahártya lymphomás eltérését, így valószínűleg a gastroscopia és colonoscopia kiváltására is alkalmas, bár szerény tapasztalatunk szerint a vizsgálat nem teljesen specifikus a béleltérések vonatkozásában. Egyszerü prognosztikai index a kopenysejtes-lymphoma (Mantle cell) - IPI, azaz a MIPI. Az egyszerü MIPI az ECOG status, LDH, fehérvérsejtszám és az életkor alapján sorolja 3 kategoriába a betegeket: kedvező, azaz 60% feletti 5 éves túlélés, intermedier: kb. 51 hónapos medián tulélés, illetve kedvezőtlen azaz átlagosan 29 hónap medián túlélés csoportokba. A Ki67 hozzáadásával ún. biológiai MIPI is meghatározható, ami finomítja a prognosztikus csoport besorolást. A MIPI alap közelítésnek megfelel, de tudni kell, hogy kidolgozásakor, a 2008-ig gyűlt adatok retrospektiv elemzésére támaszkodtak, s az akkori időszak kezelése sokban különbözött a maiaktól, így még nem tudni, mennyire extrapolálható a legújabb therapiás törekvésekre. Tapasztalat szerint a köpenysejtes lymphoma aktivitását az LDH érzékenyebben jelzi, minta beta-2 microglobulin. A SOX11 marker segíthet (hazánkban ismeretem szerint még nem történik) alkalmas a kis számú, watch and wait stratégiára érdemes indolens kezdetű betegségformák felismerésére, s annak követésére, meddig tart a lassú progressioval járó fázis.
Kórlefolyás
A köpenysejtes lymphoma az egyik legrosszabb prognózisú lymphoproliferatív betegség, amelyet szokás kicsit megtévesztő módon mérsékelten agresszív lyphomaként kategorizálni. Egyesíti az indolens és az agresszív lymphomák rossz tulajdonságait, azaz gyorsan progrediál és rövid idő alatt a beteg halálához vezet, de az agresszív lymphomákkal ellentétben az indolens lymphomákhoz hasonló módon kemoterápiával nem gyógyítható. Mindez azt eredményezi, hogy a betegség kezelés nélkül (a kevés kivételtől eltekintve) általában fél-egy éven belül halálos lefolyású, illetve a hagyományos kemoterápia mellett a négyötéves túlélés 30% alatti, az 5-10 éves túlélés pedig 6% alatti különböző felmérésekben. Hangsúlyozni kell, hogy ez nem minden betegre egyformán igaz, mert vannak főleg idősebb korban klasszikus köpenyzóna megjelenésű, valószínűleg SOX11 - nem eleve kiterjedt stádiumú, egy-két régióra lokalizált esetek, amelyekkel nagyon idős beteg esetén még a terápiás várakozás is megengedhető, illetve jó esély van arra, hogy sugárterápiával a körülírt esetekben nagyon jó eredményt lehessen elérni. Ez a szelíd természetű, de nagyon kis számú beteg az immunkemoterápiára jó túlélési válasszal rendelkezik. Fontos a p53,16,27 status. Rossz prognózissal jár a blastoid variáns.
III. A köpenysejtes lymphoma kezelése
Az 5-10 évvel korábbi időszakban ez CHOP alapú volt, amellyel nagyon rossz komplett remissziós, ill. túlélési arány volt csak elérhető, 2,5 éves medián túléléssel. Hasonlóképp nagyjából egyformán elégtelennek bizonyult a Fludarabin, Chlorambucil, Cyclophosphamid monotherapia. A Fludarabin alapú kombinált kezelések közül az FCM közelítette meg a CHOP-vel elérhető eredményeket. Az első jelentős áttörést Howard és Gribben R (Rituximab) és CHOP (R-CHOP) protokollja jelenthette, amellyel átlagosan 28-35% komplett remisszió, sőt molekuláris remisszió is elérhető, ami minden korábbi eredménynél jobb volt. Azonban valamennyi eset, beleérte a molekuláris remissziót elérteket is, relapszusba került. Jelentősen jobb indukciós kezelésnek bizonyult a fiatalabb, de főleg jó biológiai állapotú betegeknek a Romaguera-féle R-hyperCVAD-MA protokoll, amelyben különböző tanulmányokban 70-90% komplett remissziós arány érhető el, azonban konszolidáció nélkül ezek az esetek is visszaesnek.
Az R-hyperCVAD jelentős megterhelést jelentett a betegeknek, a tanulmányokban 20-40% körüli nem megfelelő dózis intenzitás miatti kiesés volt. Nem könnyű a komplett kezelés után csontvelőt gyűjteni. Jó alternativa lehet a R-CHOP, R-DHAP alternáló hat ciklusú (2x3) kemotherápia, amely komplett remissziós aránya átlagosan 75-85% és a tolerálhatósága lényegesen kedvezőbb. Időközben a molekuláris alapú reziduális betegség vizsgálatok nyilvánvalóvá tették, hogy az igazán mély remisszió eléréséhez döntően két készítmény többszöri adására van szükség, természetesen kemotherápiás kombinációs környezetben: ez a Rituximab és a cytosin-arabinosid.
Az elmúlt két év további változásokat hozott az indukciós kezelésben is, így pl: a Bortezomib+R-CHOP jobb mint az R-CHOP, de lényegesen elmarad a hyperCVAD alapútól. A Bortezomib az Egyesült Államokban (FDA) törzskönyvezve van megelőző kemoterápia után köpenysejtes lymphoma kezelésére. Az európai köpenysejtes munkacsoport (MCL-Network) az elmúlt év második felében leállította az R-FC alapú indukciós kezelési karokat, tekintettel arra, hogy ugyan a komplett remissziós arány 5-8%-kal jobb volt, mint az R-CHOP karon, de a korai visszaesés aránya 30%-kal nagyobb volt és a kétéves túlélés 15%-kal rosszabb. Így az FC első vonalbeli kezelés nem igazán ajánlható.
A másik jelentős újinformáció a Bendamustin megjelenése a köpenysejtes lymphomában, ugyanis az R-bendamustin elsővonalbeli indukciós kombinációk eredménye valamennyivel jobb, mint az R-CHOP kezelésé és mellékhatás profilja lényegesen kedvezőbb (pl. nincs hajvesztés), így pl. az Egyesült Államokban a 60-65 év feletti betegek többsége ezt a kombinációt igényli és kapja első vonalbeli kezelésként.
Mivel a legjobb immunkemoterápia mellett is a törvényszerű a relapsus, ezért minden biológiailag arra alkalmas betegben konszolidációs és lehetőleg fenntartó kezelést kell végezni. A klinikai komplett remisszió, vagy akár a CRu esetében 65 év alatt a leghatékonyabb konszolidáció a nagy dózisú kemoterápia autológ transzplantációval. Az ezzel kapcsolatos nemzetközi tanulmányok 60-80% körüli 5 éves, vagy ennél hosszabb tartamú túlélést igazolnak, ami döntő fordulatot jelent a köpenysejtes lymphoma korábbi kezelési eredményeihez képest. Ez természetesen a hazai gyakorlatot is meg kell határozza. Az autológ transzplantációnál alkalmazott nagydózisú kemotherápia - kondicionáló kezelés az R-CHOP alapú kezelések esetén teljes TBI+cyclophosphamid, illetve R-hyperCVAD, vagy R-DHAP kezeléseknél BEAM is lehet, kedvezőek a Zevalin+BEAM-os megfigyelések is.
A 65 év feletti konszolidációra optimális a Rituximab+Lenalidomid kombináció, amely az Egyesült Államokban elég általános. Európában a kombináció tanulmányokban szerepel. A mértékadó európai gyakorlatban Rituximab fenntartó kezelések történnek a follicularis lymphomához hasonlóan. Ugyanezen kezelésmódok konszolidációként használhatók a 65 év feletti betegek komplett remissziójakor autológ transzplantáció nélkül. Az Interferon eredményessége konszolidációként elmarad az autolog transzplantációhoz képest, de a Rituximab, vagy Lenalidomide alapú kombinációval nincs direkt, prospektiv összehasonlítás. A Lenalidomide monoterápia valószínűleg nem megfelelő választás.
Relapsus esetén mindenképp érdemes a Rituximab adást ismételni. A köpenysejtes lymphomás sejteken van a legnagyobb CD20 sűrűség a B-sejtes lymphomák közül, így az újraadáskor 60-85%-ban relapsus esetén is hatékonyság várható és erre utalnak a klinikai tapasztalatok is. A relapsus kezelésében az FDA törzskönyv értelmében meghatározó további készítmény a Bortezomib, illetve az EMEA érvényes törzskönyvek alapján a Bendamustin és a Temsirolimus (EMEA törzskönyv 2009. augusztus, relapsusos köpenysejtes lymphoma). A klinikai tapasztalatok arra utalnak, hogy a myelomában használatos Bortezomib-os kombináció hatékonyak lehetnek köpenysejtes lymphoma relapsusban (pl Bortezomib -Lenalidomide, Bortezomib -Thalidomide, vagy a magyar gyakorlatban könnyebben elérhető VTD protokoll. A kezelésére felsorolt valamennyi szer szerepel az NCCN 2010-es ajánlásában köpenysejtes relapsusban.
Kezelési ajánlás
A) Indukciós kezelés első vonalban:
- Körülirt, 1-2 regiora lokalizált (rendkivül ritka) esetben sugártherapia
- Kiterjedt progressziv betegség, 65 (70?) év alatti autológ transzplantációra alkalmas betegen elsődlegesen R-hyperCVAD, esetleg R-CHOP, R-DHAP alternálva a legjobb remisszió eléréséig, ekkor perifériás őssejtgyűjtéssel.
- Kiterjedt progressziv betegség, 65 év felett, illetve autológ transzplantációra nem alkalmas biológiai állapotban standard első vonalbeli kezelés lehet az R-CHOP, illetve további megfontolások esetén az FDA törzskönyv alapján beépülhet a Bortezomib, illetve megfontolható az R-bendamustin. A Fludarabin, vagy clorambucil alapú kezelések nem igazán ajánlhatóak.
- A köpenysejtes lymphoma esetek nagyon kis része kezdetben (2-5 év) indolens lefolyású lehet, amelyet a SOX-11 vizsgálat alátámaszthat. Ilyen esetben a figyelmes várakozás is megengedhető a progresszió megjelenéséig.
- A leukémiás vérképpel a ritka izolált splenomegaliával, illetve tápcsatornai formával járó esetek kezelése az alapjavaslattal megegyezik.
- A ritka plasmablastoid variáns aggresszív kezelést igényel és ez esetben az intratecális profilaxis (metothrexat, cytosinarabinosid standard adagban) és feltétlenül szükséges.
B) Konszolidációs és fenntartó kezelés:
- Az autológ transzplantációra alkalmas betegek esetében, ha R-CHOP alapú kezelés volt, akkor TBI+cyclophosphamid alkalmazással autológ transzplantáció.
- Ha R-hyperCVAD, vagy R-DHAP kezelés volt az indukció, akkor BEAM alapú kondicionálás is megfelelő.
- A TBI-t helyettesítheti a Zevalin-BEAM kondicionálás.
- A nagy dózisú kemoterápia autológ transzplantáció a jó minőségű részleges remissziót kimélyítheti, amely túlélési előnyt eredményez, így arra minden ilyen esetben is törekedni kell.
Fenntartó kezelésként a follicularis lymphomához hasonlóan az első komplett remisszió után 2-3 havonta adott Rituximab lehet a hazai választás. Ez a kezelés az autológ transzplantációra nem alkalmas betegeken a legjobb minőségű remisszió elérését
követően konszolidációnak minősül. Az optimálisnak gondolható Rituximab+Lenalidomide egyelőre csak tanulmányokban érhető el.
C) Relapsus kezelése:
- A Rituximab újbóli adása minden 6 hónapon tuli relapsus esetén indokolt az irodalmi adatok alapján.
- Hasonlóképp indokolt az FDA törzskönyvre hivatkozva a Bortezomib, illetve Bortezomib alapú kombináció (VTD) alkalmazása, mely szinten minden életkorú és biológiai állapotú betegnél kivihető.
- Fiatalabb betegnél is (idősebbeknél is kivihető) jó választás lehet a Bortezomib+ Rituximab+Bendamustin hármas kombináció. A bendamustin relapszusos köpenysejtes lymphomában EMEA törzskönyvezett.
- A köpenysejtes lymphoma relapszus kezelésére alkalmas lehet valamelyik Rituximab + a beteg által nem kapott (pl. R-CHOP indukció utáni relapsusnál R-FCM) hagyományosabb, a köpenysejtes lymphomában ajánlott kemotherápia. Egyszerű kombináció a Bortezomib +cytozinarabinozid (+Rituximab)
- A köpenysejtes lymphoma relapszusra szintén EMEA törzskönyvvel rendelkező Temsirolimussal (Torisel) szintén próba tehető egymagában, vagy kombinációban is. A szer kevesebbet szerepel a legújabb tanulmányokban és a tapasztalat szerint adása a tanulmányokban kipróbált háromféle dózistartomány közül a legkisebb (25mg/75m mg karnak megfelelően hetente) dózisban is megfelelő.
- A relapsus betegben elért komplett vagy részleges remissio esetén, ha az lehetséges allogen transplantatiora kell törekedni az autolog transplantatio ismétlése helyett
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Lennert K, Feller AC: Histopathology of non-Hodgkin lymphomas based upon the updated Kiel classification, Springer Verlag, Berlin1992, 312-321.
2. Swerdlow SH, Campo E, Seto M, Müller-Hermelink HK. Mantle Cell Lymphoma. In: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues, ARC. Lyon, 2008.
3. Rosta A., Matolcsy A. (Szerk. Matolcsy A, Udvardy M, Kopper L),:Köpenysejtes lymphoma. Hematológiai Betegségek Atlasza, Medicina, Budapest 2006, 268-273.
4. Forstpointner R, Unterhalt M, Dreyling M, Böck H-P, Repp R, Wandt H, Pott C, Seymour J, Metzner B, Hanel A, Lehmann T, Hartmann F, Einsele H, Hiddemann W: Maintenance Therapy with Rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of Rituximab, fludarabine, cyclophosphamide and mitoxantrone (R-FCM) in patients with relapsed and refractory follicular and mantle cell lymphomas - Results of a prospective randomized study of the German Low Grade Lymphoma Study Group (GLSG). Blood 2006; 108:4003-4008.
5. Dreyling M, Bergsagel PL, Gordon LI, Cotter FE: Mantle cell lymphoma and other t(11;14) disorders: How biology can drive therapy. ASCO Educational book 2006, 476-484.
6. Dreyling M, Unterhalt M, Weigert O, Hiddemann W. Therapy of mantle cell lymphoma. Internist (Berl). 2007; 48: 382-388.
7. Schulz H, Bohlius JF, Trelle S, Skoetz N, Reiser M, Kober T, Schwarzer G, Herold M, Dreyling M, Hallek M, Engert A:Immunochemotherapy with rituximab and overall survival in patients with indolent or mantle cell lymphoma: a systematic review and meta-analysis. J Nat Cancer Inst. 2007; 99:706-14.
8. Weigert O, Unterhalt M, Hiddemann W, Dreyling M: Current management of mantle cell lymphoma. Drugs 2007;1689-702.
9. Smith, MR.: Mantle cell lymphoma: advances in biology and therapy. Current Opinion in Hematology 2008: 15:415-421
10. Dreyling M, Hiddemann W; European MCL Network Current treatment standards and emerging strategies in mantle cell lymphoma Am Soc Hematol Educ Program 2009:542-51.
11. Udvardy M. A köpenysejtes lymphoma therapiája Orv Hetil 2009; 150:2253-7.
12. Fernandez V, Salamero O, Espinet B, Solé F, Royo C, Navarro A, Camacho F, Bea S, Hartmann E, Amador V, Hernández L, Agostinelli C, Sargent RL, Rozman M, Aymerich M, Colomer D, Villamor N, Swerdlow SH, Pileri SA, Bosch F, Piris MA,
Montserrat E, Ott G, Rosenwald A, López-Guillermo A, Jares P, Serrano S, Campo E. Genomic and gene expression profiling defines indolent forms of mantle cell lymphoma. Cancer Res 2010; 70:1408-18. Epub 2010 Feb 2.
13. Goy A, Kahl B. Mantle cell lymphoma: The promise of new treatment options. Crit Rev Oncol Hematol 2010 [Epub ahead of print]
14. Ogura M. Current treatment strategy and new agents in mantle cell lymphoma. Int J Hematol.
15. 2010; 92:25-32. Epub 2010 Jun 8.
T-SEJTES NON-HODGKIN LYMPHOMÁK (NHL)
I. Alapvető megfontolások
BNO kód: C8400-90.
Alkalmazott gyógyszerek ATC kódja: L01A, L01B, L01C, L01D, L01x.
A T-sejtes lymphomák mind morfológiailag, mind klinikai megjelenésben, lefolyásban heterogén betegcsoport. Az összes lymphomás eset 5-10 %-a Európában.
A WHO 2008-as klasszifikáció számos altípust különít el (1 ábra). A B-sejtes típusokhoz hasonlóan precursor és érett T-sejtes lymphomákat ismerünk. Általánosságban megállapítható, hogy a T-sejtes lymphomáknak lényegesen kedvezőtlenebb a gyógyhajlama, kimenetele, mint a B-sejteseké.
A T-sejtes lymphomák megjelenés alapján 3 főcsoportba oszthatóak: nodális típus, extranodálisan megjelenő és leukémiás csoport.
A leggyakoribb altípusok: perifériás T-sejtes lymphoma, tovább nem osztályozható (PTCL-NOS vagy PTCL-U), anapláziás nagysejtes lymphoma (ALCL), ezen belül anapláziás lymphoma kináz (ALK) pozitív és ALK negatív típusok, angioimmunoblastos lymphoma (AITL). A leggyakoribb extranodális manifesztáció, leginkább érintett szerv a bőr. A mycosis fungoides, Sezary syndroma, CD30 pozitív T-sejtes lymphoproliferációk, mint a lymphomatoid papulosis és a primer cutan ALCL, subcutan panniculitis like lymphoma és egyéb primer bőr lymphomák a bőrgyógyászok látókörébe kerülnek. Gondozásuk, kezelésük többnyire a dermato-onkológusok feladata, ezek a betegek ritkán kerülnek hematológushoz. Néhány nagyon ritka extranodális T-sejtes lymphomás esetet hematológus kezel: enteropathia asszociált T-sejtes lymphoma és a hepatosplenicus T-sejtes lymphoma, extranodális NK/T-sejtes lymphoma (nasalis típus). A döntően leukémiával járó esetek részben távol keleten gyakoriak: felnőttkori T-sejtes lymphoma-leukémia, részben krónikus lymphoid leukémia variánsai (T-sejtes prolymphocytás leukémia, T-sejtes LGL leukémia).
Előfordulás
Európában 1,13/100 000 az érett T- és NK-sejtes neopláziák incidenciája. (0,54/100 000 a cutan T-sejtes lymphomáké, és 0,59/100 000 az egyéb T/NK-sejtes lymphomáké)1. Ez alapján Magyarországon évente 100-120 új T-sejtes lymphomás eset fordul elő. Különböző altípusokban más-más az életkorbeli halmozódása: az ALK pozitív ALCL gyermekkorban és fiatal felnőttkorban, a T-lymphoblastoma (T-LB) fiatal felnőttkorban, míg az AILD 60 éves kor felett halmozódik. Enyhe férfi dominancia figyelhető meg.
II. Diagnosztika
Klinikai tünetek
A nodális típus jellegzetes tünete a nyirokcsomó megnagyobbodás: a T-LB bulky (7-10 cm-nél nagyobb) mediastinalis tumort képez, mely akár vena cava superior syndromát is okozhat. Az egyéb altípusoknál nincs nyirokcsomó predilekciós hely. A hasüregi nyirokcsomó konglomerátumok nagyon ritkán húgyúti obstrukciót, alsó végtagi thrombosist, esetleg obstrukciós ileust, a májkapui lymphadenomegalia elzáródásos sárgaságot idézhet elő. Az aktivitási (úgynevezett "B") tünetek: láz (fertőzés nélkül), fogyás (testsúly 10%-ának fél éven belüli elvesztése) és az éjszakai izzadás viszonylag gyakoriak, az esetek felében jelen vannak.
Extranodalis lymphomák esetén bizarr klinikai kép is kialakulhat az érintett szerv diszfunkcióját létrehozva. Coeliakiában (gluten sensitiv enteropathia), különösen kezelés rezisztens esetben növekszik meg a T-sejtes lymphoma kialakulásának kockázata. A betegek állapotának megítélése az ún. ECOG skálát használjuk.
Laboratóriumi jelek
A laboratóriumi vizsgálat során leggyakoribbak a vérképeltérések, főleg előrehaladott stádiumban, csontvelő-érintettség során cytopenia alakul ki. Leukémiás vérkép ritkán észlelhető. A betegség kiterjedtségének, aktivitásának lemérésében segíthet a laktát dehidrogenáz enzim szintje (LDH), és a béta-2-microglobulin, a vörösvérsejt süllyedés mértéke (főként, ha nincs jelen vérszegénység és mégis gyorsult a süllyedés).
Szövettani diagnózis
A diagnózis mindig szövettani legyen, melyhez nyirokcsomó excízió vagy extranodális NHL-k esetén műtéti preparátum szükséges. Aspirátum nem elegendő, vékonytű biopszia (core biopszia) nem elégséges (a szövettani altípus meghatározásához a minta általában nem elegendő). Az ultrahang vagy CT vezérelt core biopszia gyakorlott kézben kiválthatja az invazív műtéteket (mellkasi vagy hasi nyirokcsomó konglomerátum miatti feltárás). A finomtű biopszia ritkán diagnosztikus értékű (gyakran sejtmentes a minta, vagy kötőszövetet, esetleges necroticus tumorszövetet nyerünk). Ilyenkor a biopszia megismétlése szükséges, végső esetben pedig műtéti úton (exploratio) kell anyagot nyerni. A mediastinoscopia T-lymphoblastoma esetén, mely rendzserint buky mediastinális tumorral jár, fontos diagnosztikus beavatkozás lehet. Elengedhetetlen a minták megfelelő kezelése, szállítása, nedvesen tartása. A szövettani feldolgozás lehetőség szerint a lymphomák diagnosztikájában járatos, centrális vagy regionális laboratóriumban történjen.
III. A T-sejtes lymphomák kezelése
Általános irányelvek
A T-sejtes lymphomák kezelésére ritka előfordulásuknál fogva, valamint a heterogén klinikai megjelenés, alcsoportok különbözősége miatt, még a nagy klinikai centrumok, de még a nemzetközi együttműködésben dolgozó tanulmányok is óvatos ajánlásokat tesznek hangsúlyozva azt, hogy nincsenek egységes kezelési elvek2,3. A T-sejtes lymphomákat megfelelő diagnosztikus (patológia, képalkotó eljárások) és terápiás feltételekkel, valamint jelentős tapasztalattal rendelkező hematológiai centrumban vagy osztályon ajánlott kezelni. A betegség rossz prognózisa miatt ezek az elvek a B-sejtes lymphomáknál hangsúlyosabbak, mivel a megfelelő kezelés, kellő időben történő kezelésváltás, hemopoetikus őssejt transzplantáció felé mozdulás kulcskérdés.
A kezelés feltétele a szövettani diagnózis mellett a betegség kiterjedtségének pontos ismerete. A stádium megállapításához (staging) az Ann Arbor-féle besorolást használjuk. Minden esetben kötelező a csontvelő biopszia elvégzése!!! A klinikai staging elvégzéséhez, a klinikai stádium (CS) megállapításához feltétlenül szükséges: fizikális vizsgálat, kétirányú mellkas RTG (ma már csak tájékoztató jellegű), hasi UH, csontvelő-vizsgálat, has-medence-mellkas-nyak CT. További vizsgálatok lehetnek: csontfelvételek, MRI, de bizonyos szövettani típusoknál és esetekben pl. a gastrointestinális traktus részletes vizsgálata is szükségessé válhat. A PET szerepe a T-NHL-ben nem egyértelmű (nincsenek nagy betegszámú vizsgálatok egyértelmű eredménnyel). Úgy tűnik, hogy a cutan lymphomák és a T-LGL leukémiák nem FDG-avidak, szemben a nodális és nem cutan extranodális esetekkel4. A GOELAMS munkacsoport vizsgálata szerint bár aT/NK lymphomák FDG-avidak a diagnóziskor, a negatív interim és kezelés utáni FDG-PET eredmény nem egyenlő a jobb progresszió mentes túléléssel az ALK negatív T/NK lymphomákban5. Mivel a CT lehetőségeit előnyösen kapcsolja összes az aktív betegség kimutatásával, ideális módszer a stagingre. A kezelés kimenetelének megjóslásához széles körben elterjedt pontrendszer az IPI (International Prognostic Index)6. Az eredeti IPI-ben öt független prognosztikus tényezőt vesznek figyelembe (életkor, stádium, LDH, általános állapot, extranodális érintettség), ezek alapján képeztek rizikócsoportokat, melyekben a terápiás válasz és a túlélés szignifikánsan különbözik. Újabban az életkorhoz adaptált prognosztikai indexet használják (aalPI), a 60 év alatti és feletti betegeken külön-külön három tényezőt vizsgálnak. A kedvezőtlen prognosztikai tényezők, amelyek mindegyike egy-egy pontszámot jelent: emelkedett LDH szint, III-IV. stádium, rossz általános állapot (ECOG >2). Mivel 60 év alatt és felett a kezelési stratégia jelentősen eltérő lehet, a korhoz igazított IPI-t javasolt használni.
Az aaIPI négy rizikócsoportot különböztet meg:
- kis kockázat 0
- kis-közepes kockázat 1
- nagy-közepes kockázat 2
- nagy kockázat 3
A kezelés megválasztásakor legalább két csoportot kell figyelembe venni:
- kis rizikójú betegeket (score 0-1),
- nagy rizikójú betegeket (score 2-3)
Nagy számú (385) PTCL-U-s betegen elvégezték az IPI kórjósló szerepének validálását és azt találták, hogy az IPI nem különítette el szignifikánsan a kis-közepes és nagy-közepes rizikójú betegek túlélését. Számos tényezőt figyelembe véve jól elkülönülő túlélést mutató csoportokat az alábbi változók használatával lehetett megalkotni: emelkedett LDH szint, életkor (>60 év), rossz általános állapot (ECOG >2) és a csontvelő érintettsége. Ezek alapján alkották meg a Prognosztikus index T-sejtes lymphomában (PIT) pontrendszert7.
Egyéb prognosztikus tényezőket is vizsgáltak az elmúlt években: a beteg (gazdaszervezet) és a tumor jellegzetességeire utalókat egyaránt. Egyváltozós analízissel több mutatót találtak jelentősnek (EBER+, CD15+, CD57+, B-tünet, bulky tumor, előrehaladott stádium), míg többváltozós analízissel 4 tényező bizonyult szignifikánsnak: nagy proliferációjú tumorok (Ki-67+ >80%), emelkedett LDH szint, kor (>60 év), rossz általános állapot (non ambulanter állapot)8.
PTCL-ben, (főként ALCL-ben) is történtek gén expressziós vizsgálatok, de szignifikáns túlélési különbség, mint a diffúz nagy B-sejtes lymphoma két alcsoportja között nem figyelhető meg. Döntő jelentőségű az anapláziás lymphoma kináz (ALK) immunhisztokémiai vizsgálat elvégzése anapláziás nagysejtes lymphomában. Az ALK pozitív esetek sokkal jobb prognózisúak az ALK negatív ALCL-hez képest. Ez utóbbiak azonban még mindig kedvezőbbek a PTCL-NOS eseteknél9. A formalinban fixált anyagokon elvégezhető immunhisztokémiai vizsgálatok közül a CD4, CD8 expresszió, koexpresszió segíthet a kimenetel megjóslásában (CD4+/CD8- tumor a jobb kimenetelű).
Prognózis szempontjából a B-sejtes lymphomák mindig kedvezőbbek, mint a T-sejtesek. Ezt a biológiai különbséget lényegesen fokozza az a tény, hogy a leggyakoribb B-sejtes NHL-k kezelésében az immuno-kemokezelés (anti-CD20 monoklonális antitest) jelentősen javította a kezelés eredményességét, a T-sejtes lymphomák esetében nem áll rendelkezésre széles körben elterjedt, hatásos immunterápiás szer. Anti-CD52 monoklonális antitesttel (MabCampath) kombinált CHOP némileg fokozta a kezelés hatékonyságát, de az infekciós szövődmények kockázata nőtt. Magyarországon ilyen kombinációs kezelések jelenleg "off-label" indikációnak számítanak.
Az extranodális megjelenés számos speciális tényezőt jelent. Az enteropathia asszociált T-sejtes lymphoma amellett, hogy rosszabb prognózisú, eredetéből eredően felszívódási zavarral jár, a szupportív kezelés (táplálás) különös jelentőséggel bír. A primer bőr lymphomák általában indolens lefolyásúak, a lokális kezelés rendkívűl fontos. Amíg a folyamat a bőrre korlátozódik, addig bőrgyógyászok kezelik a betegeket. Csak a visceralis manifesztációk megjelenése, a folyamat generalizálódása esetén kerülnek a betegek a hematológus látószögébe. Ekkor kombinált kemokezelés a választandó, elsősorban CHOP. A kezelés megválasztásában a fenti staging vizsgálatok és prognosztikus csoportba történő besoroláson kívül leginkább a szövettani altípus a döntő fontosságú. A perifériás T-sejtes NHL kezelése a kombinált kemokezelés elvei szerint ajánlott. Számos rendkívül rossz prognózisú altípus ismert, ezeknél a szokványos kemokezelés, mint például a CHOP teljességgel hatástalan. Csak palliatív szerepe lehet, kuratív hatással nem számolhatunk. Ilyen altípusok például az agresszív NK-sejtes leukémia, hepatosplenicus T-sejtes lymphoma. Ezekben az esetekben intenzív kemoterápiát követően (pl.: HyperCVAD/MA, vagy CHOP-14) allogén hemopoetikus őssejt transzplantáció lehet csak gyógyító. A nodális típusú gyakoribb formák közül a PTCL-NOS, ALK negatív ALCL, AITL, EATL előrehaladott stádiumban, kedvezőtlen IPI, PIT esetén szintén agresszív kezelést igényel, majd az első remisszióban autológ hemopoetikus őssejt transzplantáció javasolt (lásd 1. ábra). Ilyen agresszív kezelés lehet a CHOP-szerű protokoll dózis intenzitás növeléssel (a ciklusok közti intervallum rövidítésével elért CHOP-14). A rossz prognózisú esetekben a dose-dense kezelés esélyt adhat a kedvezőbb eredmény elérésére, a beteget a kemoszenzitív csoportba emelheti, az autológ hemopoetikus őssejt transzplantáció lehetőségét megteremtheti10. Idősebb betegek, illetve ALK+ ALCL kezelésére ajánlott a standard kezelés, a CHOP11. A kezelési protokollok egy részének leírása a függelékben található.
A kezelés hatékonyságát általában a 3. ciklus után ellenőrizzük képalkotó vizsgálatokkal. Ez általában CT vizsgálat, de az agresszív lymphomákban a 2. ciklus utáni interim PET/CT is hasznos információt adhat. Ha megfelelő a válasz (jelentős regresszió alakul ki), akkor folytatjuk a kezelést és összesen 6-8 ciklust adunk meg. Ha nem kielégítő a válasz, akkor más, agresszívabb kezelést kell választanunk. Különösen igaz ez primer refrakter, progresszív betegségben, ekkor csak hatékonyabb terápiával van esély eredményt elérni.
A lokalizált agresszív lymphomák kezelése
Lokalizált (CS I-II.) - nem bulky lymphoma, IPI 0-1 score-ral - kezelése 3 CHOP és érintett mezős irradiáció lehet, bár a T-sejtes lymphoma kedvezőtlen prognózisa miatt nem mindig elegendő 3 ciklus, inkább 6 ciklus a biztonságosabb. Extranodális NK/T sejes lymphoma, nasal type-ban az asparaginase, újabban a pegilált forma hatékonynak tűnik. Radiokezelés mindenképpen szükséges a kezelés kezdetén a kemoterápiával egy időben vagy utána.
A szisztémás kemokezelés alkalmazására azért van szükség, mert ez képes a mikrometasztatikus tumorterjedést meggátolni, megakadályozza a RT után kialakuló relapszusokat. II. std. "bulky" betegség esetén a mikrometasztatikus tumortömeg túl nagy, 3 ciklus CHOP nem képes kontrollálni, ezért ezt a stádiumot a kiterjedt betegségeknél leírt elvek szerint kell kezelni. A sugárkezelésnek egymagában csak az I. patológiai stádiumban (ez a kritérium operált extranodális lymphomáknál teljesülhet) lehet létjogosultsága, mind nodális, mind extranodális NHL esetén. Az irradiációt műtéti úton teljesen eltávolított, extranodális lymphomák adjuváns kezelésére is használják (pl. bőr lymphomái). Egy GELA vizsgálat szerint12 az eredmények nem rosszabbak, ha idős betegeknél 4 CHOP ciklus után az irradiáció elmarad.
Kiterjedt agresszív lymphomák kezelése
Kiterjedt betegségnek tekintjük a CS III-IV-et és hasonlóan kezeljük a lokalizált lymphomát bulky tumorral.
60 év felett a rizikó csoportoktól függetlenül CHOP kombináció szükséges. A Német High Grade non-Hodgkin Lymphoma Study Group hatékonynak találta a CHOP-14 elnevezésű protokollt10, ami 14 naponta adott CHOP-t jelent, kiegészítve G-CSF-el.
Hasonló megfigyelést közöltek más szerzők is. A dózis intenzitás növelése javította a kezelés hatékonyságát, jelentősen fokozza azonban a toxicitást, ezért az eljárást klinikai vizsgálatokon kívül nem javasolják.
60 év alatti betegek kezelése már sokrétűbb.
Kis rizikó esetén (score 0-1) általában CHOP a választandó kezelés, de a nagyon agresszív szövettani altípus esetén intenzívebb kezelés lehet szükséges.
Nagy rizikó esetén többfajta megoldás lehetséges, ebben az esetben egyénre szabott, rizikó adaptált kezelést kell választani:
- CHOP elegendő ALK + ALCL-ben, de más altípusban kevésbé hatékony.
- Fiatal betegeken első-vonalbeli kezelésként második és harmadik generációs citosztatikus kombinációk is használhatók: CHOP-
14, hyperCVAD, ProMACE-CytaBOM. Ilyenkor az ALK pozitív ALCL-t leszámítva az első CR-ben autológ őssejt-átültetés (ASCT) jön szóba. Nagyon agresszív szövettani altípusnál az autológ átültetés sem biztos, hogy elegendő. Hepatosplenicus lymphomában, agresszív NK sejtes leukémia/lymphomában, viscerális manifesztációjú Mycosis fungoidesben HLA identikus donor keresése, allogén hemopoetikus őssejt transzplantáció javasolt.
- T-lymphoblastomát ALL protokoll szerint kell kezelni (HyperCVAD/MA vagy Hoelzer protokoll).
CNS profilaxis
A központi idegrendszer érintettségének megelőzésére ismételt intrathecalis kezelés (általában methotrexat-cytosin arabinosid-dexamethason ún. triplet), illetve szisztémásan adott nagydózisú methotrexat ajánlott bizonyos agresszív lymphoma típusokban. Lymphoblastos lymphomákban egyértelműen és az agresszív PTCL egyes eseteiben is. Vizsgálták azokat a rizikófaktorokat, melyek secunder CNS érintettségre hajlamosítanak, ezek a magas LDH; ECOG>1; egynél több extranodális érintettség. Meglétük esetén megnő a CNS érintettség rizikója, CNS profilaxis ajánlott.
Relapszus kezelése
Jelenleg nincs egyértelmű ajánlás relapszusba került T-sejtes lymphomák kezelésére.
60 év alatt
- Autológ őssejt-transzplantáció a választandó kezelés, ha a betegség kemoszenzitív és az őssejt átültetésnek nincs ellenjavallata. Ilyenkor mentő protokollt kell indítani. Leggyakrabban alkalmazott ilyen salvage kezelés a DHAP (dexamethason, nagy dózisú cytosin arabinosid, cisplatin), ritkábban az ESHAP (etoposid, methyl prednisolon, nagy dózisú cytosin arabinosid, cisplatin) vagy az ICE (ifosfamid, carboplatin, etoposid). Két ciklus után restaging CT vagy PET/CT következik, amennyiben megfelelő a terápiás válasz, akkor a 3. ciklussal egybekötve perifériás őssejt gyűjtés ajánlott, majd következik a transzplantáció. Sajnos a relapszus sok esetben teljességgel refrakter állapot.
- Amennyiben őssejt átültetés nem lehetséges egyéb, salvage kombinációk jönnek szóba: miniBEAM IMVP-16, MINE. CEPP-B.
Figyelembe véve az első kezelést, második-harmadik generációs protokollok is adhatók.
- Nem kemoszenzitív, illetve rosszul reagáló esetekben experimentálisnak vagy "off label" indikációnak számító kezelések is szóbajöhetnek monoterápiában és kombinációban. Jelenleg pralatrexattal, gemcitabinnal, sőt alemtuzumabbal is vannak kedvező tapasztalatok. Kis dózisban alemtuzumab (10 mg) 28 naponként CHOP-val együtt adva kedvezőnek bizonyult, de heti háromszor 10 mg alemtuzmabbal is jó reagálást irtak le relabált T-sejtes lymphomáknál.
60 év felett
- Egy évnél hosszabb remisszió esetén meg lehet ismételni az első-vonalbeli kezelést. Sajnos azonban a T-sejtes lymphoma természetéből kifolyólag a kimenetel nagyon kedvezőtlen.
- Tizenkét hónapnál rövidebb remisszió esetén, ismét egyedi megítélés szerint, adhatunk salvage kezelést vagy - különösen
70 év felett - palliatív terápiát. Esetleg experimentális gyógyszerek is szóba jöhetnek (Gemcitabine, purinanalógok, pralatrexát), mint azt előzőleg már említettük.
Rezisztens T-sejtes lymphoma kezelése
Rezisztens betegségről akkor beszélünk, ha a beteg az első-vonalbeli kezelésre nem reagál, vagy relapszus estén nem reagál a salvage terápiára.
A beteg hatékony kezelésének esélye minimális.
Lehetőségek:
- Autológ őssejt- átültetés, ha a feltételek és a körülmények adottak, hatékonysága azonban sokkal kisebb, mint CR-ben végzett
őssejt átültetés esetén
- Relapszusnál használt kombinációk
- Experimentális kezelések (monoclonalis kezelés, főként alemtuzumabbal)
Itt fontos a kezelőorvos tapasztalata a kezelés megválasztásában. Általános szabályok nincsenek, tanácsok nehezen adhatók. Kezelés alatt is progresszív betegség esetén új kombináció, új, eddig nem használt citosztatikum adása jöhet szóba. Amennyiben minimális reagálás észlelhető, dóziseszkaláció lehet a megoldás. Az ún. "kinetic failure" gyakrabban adott kezelésekkel (pl. CHOP 14) uralható.
Szövődmények:
A kezelések során a jól ismert szövődményekre - mint hányinger, hajhullás, jelentős cytopenia - lehet elsősorban számítani. Monoclonalis antitest adásakor - különösen az első infúzió alatt - láz, hidegrázás, ritkábban dyspnoe és hypotensio alakulhat ki. Magas fehérvérsejt-számmal (leukémiás vérképpel) járó esetekben citokin-lízis syndromát írtak le, mely fatális lehet. A MabCampathot eszkaláló dózisban ajánlott indítani a CLL-ben használt módozatban. Cytomegalovírus reaktiváció rettegett szövődménye az anti-CD52 kezelésnek.
Nagyobb tumor tömeg esetén, előrehaladott betegségben a kezelés kezdetén tumor-lízis syndroma jellegzetes tüneteit észlelhetjük. Magas LDH és kreatinin hajlamosító tényezők. A német munkacsoport ezért a fenti esetben, különösen idős, elesett betegekben, ún. elő-fázis kezelést javasol: 5-7 napig 100mg prednisolon/nap az első CHOP előtt (van aki az első nap Vincristint is ad). Nagydózisú methotrexat után mucositis, veseelégtelenség jelentkezhet.
Nagydózisú cytosin arabinosid, elsősorban idős betegekben, cerebellaris tüneteket, aluszékonyságot, ritkán kómát válthat ki. Salvage kezelések általában platina tartalmúak. Ezek vesekárosítóak, ügyelni kell a megfelelő hidrálásra.
IV. A betegek követése, V. Gondozás
A CR-be került betegek ellenőrzésének javasolt ideje az első két évben háromhavonta, a harmadik és negyedik évben félévenként, ezt követően évenként. Panaszok vagy relapszus gyanúját keltő tünetek esetén soron kívüli ellenőrzésre van szükség.
Ellenőrzéskor elvégzendő vizsgálatok:
Fizikális vizsgálat, teljes vérkép, LDH, We, béta2 microglobin és egyéb laboratoriumi vizsgálatok. A képalkotó eljárások is nélkülözhetetlenek, azonban ezek gyakoriságát illetően jelentős intézeti és egyéni különbségek figyelhetők meg. A relapszusok 60-70%-a az eredetileg érintett helyeken jelentkezik, ezért a képalkotó eljárásokkal (RTG, UH, CT, MR) elsősorban ezeket a régiókat vizsgáljuk.
Extranodális lymphomáknál speciális vizsgáló módszerekre is szükség van, pl. gastrointestinális lymphomák. Residuumok, relapszus gyanús képletek megítélésében a PET/CT nyújthat segítséget. Vékony-tű ( un core biopsy) biopszia (UH vagy CT vezérelve, flow cytometriás vizsgálatra is célszerű mintát venni) a relapszus, reziduális eltérések gyanújának igazolásában alkalmazandó. Biztos eredményt az excízió (sebészi) ad. Agresszív lymphomában általános gyakorlat, hogy ha a reziduum PET negatív, nem igényel további kezelést. Amennyiben PET pozitív, szövettani vizsgálattal kell a lymphoma jelenlétét igazolni. Minden kétes esetben csak a szövettani vizsgálat lehet perdöntő.
1. ábra. Hemopoetikus őssejt transzplantációs ajánlás
T-sejtes lymphomában
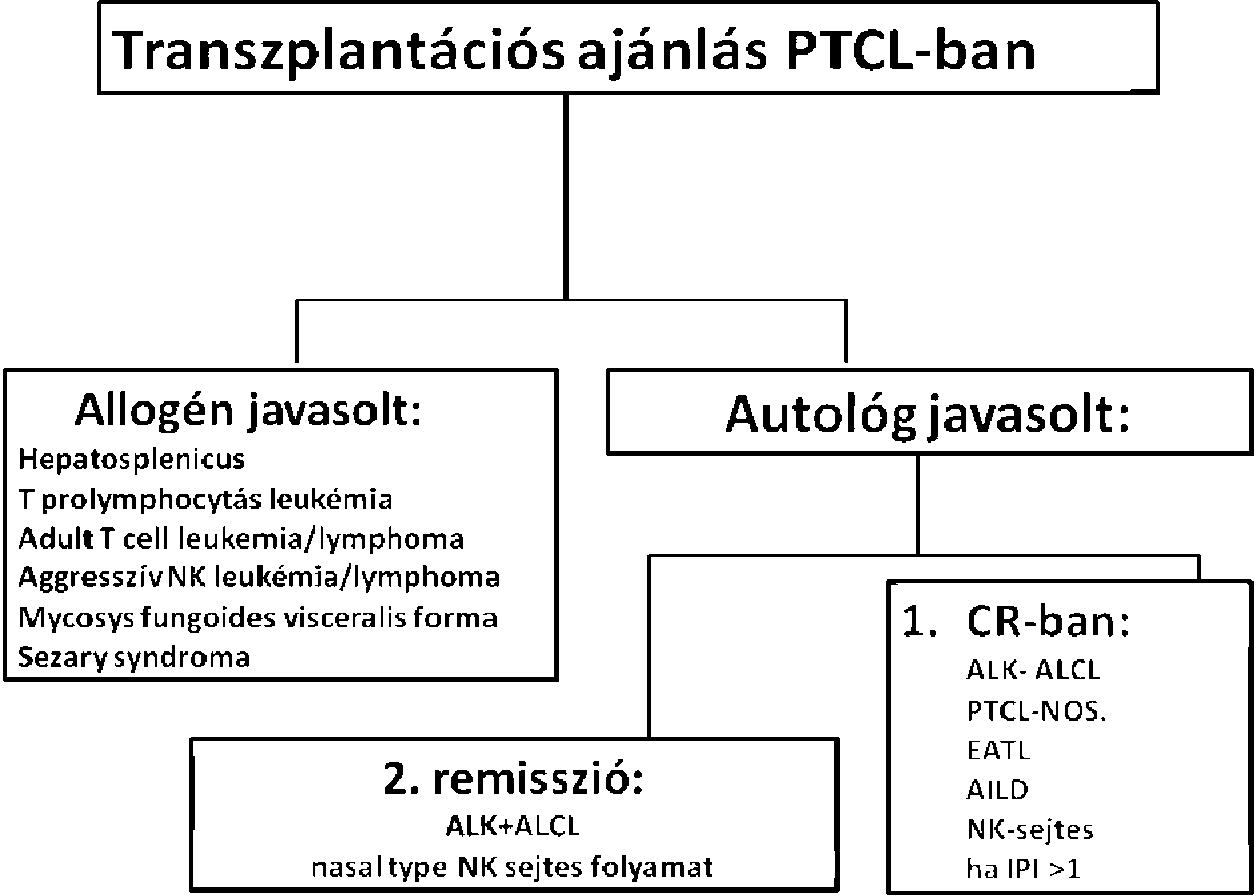
VI. Irodalomjegyzék
1. Sant M, Allemani C, Tereanu C et al: Incidence of hematologic malignancies in Europe by morphologic subtype: results of the HAEMACARE project. Blood 2010; 116:3724-3734.
2. Semenzatto G, Zambello R: Natural killer cell disorders. Haematologica 2009;3:294-301.
3. Savage KJ: Prognosis and primary therapy in peripheral T-cell lymphomas. ASH Education Book 2008 :280-288.
4. Khong PL, Pang CB, Liang R et al: Although T/NK lymphomas are FDG-avid at diagnosis, a negative interim or post-therapy FDG-PET does not translate into an improved PFS in ALK- T/NK lymphomas. Ann Hematol 2008;87:613-621.
5. Cahu X, Bodet-Milin C, Brissot E et al: 18F-fluorodeoxyglucose-positron emission tomography before, during and after treatment in mature T/NK lymphomas: a study from the GOELAMS group. Ann Oncol 2010. aug. 25. Epub ahead of print.
6. Shipp MA.: The international non-Hodgkin's lymphoma prognostic factors project: a predictive model for aggressive non-Hodgkin's lymphoma. N Engl J Med 1993; 329:987-994.
7. Gallamini A, Stelitano C, Calvi R et al: Peripheral T-cell lymphoma unspecified (PTCL-U):a new prognostic model from a retrospective multicentric clinical study. Blood 2004;103:2474-2479.
8. Went P, Agostinelli C, Gallamini A et al: Marker expression in peripheral T-cell lymphoma: a proposed clinical-pathologic prognostic score. J Clin Oncol 2006;24:2472-2479.
9. Savage KJ, Harris NL, Vose JM et al: ALK- anaplastic large-cell lymphoma is clinically and immunphenotipically different from both ALK+ ALCL and peripheral T-cell lymphoma, not otherwise specified: report from the International Peripheral T-Cell Lymphoma Project. Blood 2008; 111: 5496-5505.
10. Wunderlich A, Kloess M, Reiser M. et al: Practicability and acute haemoatlogical toxicity of 2- and 3-weekly CHOP and CHOEP chemotherapy for aggressive non-Hodgkin's lymphoma: results from the NHL-B trial of the German High-Grade Non-Hodgkin's Lymphoma Study Group (DSHNHL). Ann Oncol 2003; 14:881-93.
11. Fisher RI, Gaynor ER, Dahlberg S. et al: Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin's lymphoma. N Engl J Med 1993; 328:1002-1006.
12. Bonnet C, Fillet G, Mounier N. et al: CHOP alone compared with CHOP plus radiotherapy for localized aggressive lymphoma in elderly patients:A study by the Groupe d'Etude des Lymphomes de l'Adulte. J Clin Oncol 2007; 25:787-792.
VII. Mellékletek
1. táblázat. WHO 2008: the mature T-cell and NK-cell neoplasms.
T-cell prolymphocytic leukemia T-cell large granular lymphocytic leukemia Chronic lymphoproliferative disorder of NK-cells* Aggressive NK cell leukemia
Systemic EBV+ T-cell lymphoproliferative disease of childhood (associated with chronic active EBV infection)
Hydroa vacciniforme-like lymphoma
Adult T-cell leukemia/ lymphoma
Extranodal NK/T cell lymphoma, nasal type
Enteropathy-associated T-cell lymphoma
Hepatosplenic T-cell lymphoma
Subcutaneous panniculitis-like T-cell lymphoma
Mycosis fungoides
Sézary syndrome
Primary cutaneous CD30+ T-cell lymphoproliferative disorder Lymphomatoid papulosis
Primary cutaneous anaplastic large-cell lymphoma Primary cutaneous aggressive epidermotropic CD8+ cytotoxic T-cell lymphoma* Primary cutaneous gamma-delta T-cell lymphoma Primary cutaneous small/medium CD4+ T-cell lymphoma* Peripheral T-cell lymphoma, not otherwise specified Angioimmunoblastic T-cell lymphoma Anaplastic large cell lymphoma (ALCL), ALK+ Anaplastic large cell lymphoma (ALCL), ALK* Ezek provizórikus entitások vagy provizórikus altípusok. A dőlt betűs entitások újak a WHO 2008 klasszifikációban.
| Kezelési séma | Napi dózis mg/m2 | nap | |
| CHOP (21 naponként) | |||
| C-cyclophosphamid | 750 mg | iv | 1 |
| H-adriamycin | 50 mg | iv | 1 |
| O-vincristin | 1.4 mg (max 2 mg) | 1 | |
| P-prednisolon | 100 mg | per os | 1-5 |
| CHOP-14 (14 naponként) | |||
| Megegyezik a CHOP-21-gyel, de kéthetente kell adni és G-CSF adása szükséges | |||
| CHOP-Bleo (21 naponként) | |||
| mint a CHOP + Bleo-bleomycin 15 | mg iv | 1+5 | |
| CHOEP és CHOP-VP-16 (21 naponként) | |||
| mint CHOP + E-etoposid | 100 mg | iv (1 ó) | 3-5 |
| CEOP (21 naponként) | |||
| C-cyclophosphamid | 750 mg | iv | 1 |
| E-epirubicin | 60 mg | iv | 1 |
| O-vincristin | 1.5 mg | iv | 1 |
| P-prednisolon | 60 mg | per os | 1-5 |
| CEMP (21 naponként) | |||
| C-cyclophosphamid | 650 mg | iv | 1 |
| E-etoposid | 150 mg | iv | 1 |
| M-mitoxantron | 12 mg | iv | 1 |
| P-prednisolon | 60 mg | iv | 1-5 |
| Séma | Napi dózis mg/m2 | nap | |
| Pro-MACE-Cyta-BOM (21 naponként) | |||
| Prednisolon | 60 mg | per os | 1-14 |
| doxorubicin | 25 mg | iv | 1 |
| cyclophosphamid | 650 mg | iv | 1 |
| etoposid | 120 mg | iv | 1 |
| cytarabin | 300 mg | iv | 8 |
| bleomycin | 5 mg | iv | 8 |
| vincristin | 1.4 mg | iv | 8 |
| methotrexat | 120 mg | iv | 8 |
| leukovorin | 15 mg | per os (6x) | 9 |
| MACOP-B | |||
| M-methotrexat | 400 mg | iv | 8+36+64 |
| leukovorin | 15 mg | per os (6x) | 9+37+65 |
| A-doxorubicin | 50 mg | iv | 1+15+29+43+57+71 |
| C-cyclophosphamid | 350 mg | iv | 1+15+29+43+57+71 |
| O-vincristin | 1.4 mg | iv | 8+22+36+50+64+78 |
| P-prednisolon | 75 mg | per os | 1-84 |
| B-bleomycin | 10 mg | iv | 22+50+78 |
| Séma | Napi dózis mg/m2 | nap | ||
| VACOP-B | ||||
| V-etoposid | 50 | mg | iv | 1 3.7.11. héten |
| 100 | mg | per os | 2+3 3.7.11. héten | |
| A-doxorubicin | 50 | mg | iv | 1 3.5.7.9.11 héten |
| C-cyclophosphamid | 350 | mg | iv | 1 5.9. héten |
| O-vincristin | 1.2 | mg | iv | 8 4.6.8.10.12.héten |
| P-prednisolon | 45 | mg | per os | 1-8 nap majd |
| másnaponta | ||||
| a 12. hét végéig | ||||
| B-bleomycin | 10 | mg | iv | 8 4.6.8.10.12.héten |
| IMVP-16 (21 naponként) | ||||
| I-ifoszfamid | 1000 | mg | iv | 1-5 |
| M-methotrexat | 30 | mg | iv | 3+10 |
| VP-16-etoposid | 100 | mg | iv | 1-3 |
| MINE | ||||
| M-mesna | iv | 1-3 | ||
| I-ifoszfamid | 1500 | mg | iv (1 óra) | 1-3 |
| N-mitoxantron | 10 | mg | iv (15 perc) | 3+10 |
| E-etoposid | 80-100 | mg | iv (30 perc) | 1-3 |
| DHAP (21-28 naponként) | ||||
| D-dexamethason | 40 mg/nap | iv | 1-4 | |
| HA-ara-C | 2000 | mg | iv x2 (2 óra) | 2 12 óránként |
| P-cisplatin | 100 | mg | iv | 1 |
| ESHAP (21 naponként) | ||||
| E-etoposid | 60 | mg | iv (1 óra) | 1-4 |
| S-methilprednisolon | 500 mg/nap | iv | 1-4 | |
| HA-ara-C | 2000 | mg | iv (2 óra) | 5 |
| P-cisplatin | 25 | mg | civ | 1-4 civ=folyamatos |
| 24 órás inf. | ||||
| Séma | Napi dózis mg/m2 | nap | ||
| Hyper-CVAD/MA 1. ciklus - Cyclophosphamid - Mesna | 300mg/m2 (3 óra alatt) 600 mg/m2 folyamatos infúzióban | 12 óránként 1-3 nap 3 napig (kezdet: 1 órával a Cyclophosphamid előtt, befejezés: 12 órával az utolsó dózis után) | ||
| - Doxorubicin | 25 mg/m2 civ | 4-5 nap | ||
| - Vincristin | 1 mg/m2(civ?) 2 mg | 4-5 nap 11. nap | ||
| - Dexamethason | 40 mg | per os | 1-4 és 11-14 nap | |
| - G-CSF | 5 ug/kg | 24 órával a doxo után, amig az fvs. >30 000 vagy a 21. napig | ||
| 2. ciklus - Metothrexate | 1 g/m2 | 1 nap | |
| (200 mg/m2 2 óra alatt, 800 mg/m2 22 óra alatt, | |||
| Leucovorin 50 mg iv 12 órával a Mtx után, | |||
| majd 15 mg iv/po 6 óránként 8x) | |||
| - Ara-C | 3 g/m2 iv 2 óra alatt 12 óránként | 2-3 nap | |
| - G-CSF | 5 ug/kg 24 órával a citosztatikum után, | ||
| amíg fvs.>30 000 vagy a 21. napig | |||
| High dose CHOP (21 naponta 4 ciklus) | |||
| Cyclophosphamid | 2000 mg/m2 | iv | 1-2 nap |
| Doxorubicin | 70 mg/m2 48 órás folyamatos inf. | 1-2 nap | |
| Vincristin | 1.4 mg/m2 | iv | 1. nap |
| Prednisolon | 100 mg/m2 per os | 1-5 nap | |
| G-CSF | 10ug/kg | sc | 4-18 nap |
| ICE | |||
| I-ifoszfamid | 5000 mg | civ | 2 mesnával! |
| C-carboplatin | AUC=5 (max 800 mg) | iv | 2 |
| E-etoposid | 100 mg | iv | 1-3 |
| CODOX-M /IVAC alternáló | |||
| 1. ciklus CODOX-M | |||
| cyclophosphamid | 800 mg | iv | 1 |
| vincristin | 1.5 mg (max 2mg) | iv | 1 |
| doxorubicin | 40 mg | iv | 1 |
| cytarabin | 70 mg | iv | 1 |
| cycophoshamid | 200 mg | iv | 2-5 naponta |
| cytarabin | 70 mg | iv | 3 |
| vincristin | 1.5 mg (max 2 mg) | iv | 8 |
| methotrexat | 1200 mg | iv | 10 > 1 óra alatt |
| 240 mg | iv | óránként 23x | |
| leukovorin | 192 mg | iv | 11 (36 órával |
| az MTX kezdete után) | |||
| 12 mg | iv | 11 (6 óránként, | |
| míg MTX < 5x108 ug/l) | |||
| G-CSF | 5ug/kg | sc | 13 (napontamíg |
| ANC>1*G/l) | |||
| methotrexat | 12 mg | it | 15 |
| leukovorin | 15 mg | po 16 (24 órával az intrathecalis után) | |
| Következő ciklus feltétele:ANC > 1.0*G/l; thr > 75*G/l | |||
| 2. ciklus IVAC | |||
| etopozid | 60 mg | iv | 1-5 (1 óra alatt |
| 500ml fiz.sóban) | |||
| ifosfamide | 1500 mg | iv | 1-5 (1 óra alatt |
| 500ml fiz.sóban) | |||
| Mesna | 360 mg | iv | (ifosfamiddal keverve) |
| azután 360 mg | iv | 3 óránként 7x naponta | |
| cytarabin | 2 g | iv | 1-2 naponta |
| 2x (Összesen 4x) | |||
| Methotrexat | 12 mg | it | 5 |
| leukovorin | 15 mg | po | 6 (24 órával |
| az MTX után) | |||
| G-CSF | 5 ug/kg | sc | 7 (naponta |
| míg ANC>1*G/l) | |||
| Következő ciklus feltétele:ANC > 1.0*G/l; thr > 75*G/l | |||
IDÜLT LYMPHOID LEUKAEMIA/KIS LYMPHOCYTÁS LYMPHOMA (CLL/SLL)
I. Alapvető megfontolások
Az irányelv alkalmazási területe: felnőttgyógyászat, hematología BNO: C9110
A betegség meghatározása
A CLL szerzett, klonális, B-sejtes, leukémiás lymphocytás lymphoma, melyet a kis lymphocytás lymphomától (SLL) a leukémiás megjelenés különít el (14). A korábban T-CLL-ként leírt entitást ma T-sejtes prolymphocytás leukemiának nevezzük (t-PLL). A CLL-t jellemzi a kis, viszonylag érett, B-lymphocyták proliferációja és akkumulációja a csontvelőben, a vérben, a lymphoid szervekben, a májban és más szervekben. A CLL lefolyása a diagnózis után változatos képet mutat, a túlélés hónapoktól évtizedekig tarthat. SLL meghatározása: a CLL/SLL ugyanazon entitás két megnyilvánulása. Jellemzői: lymphadenopathia, csontvelői érintettség nélkül. A periferián a monoclonalis B-lymphocyták száma < 5x109/L. A diagózist nyirokcsomó biopsiával kell megerősíteni.
Incidencia
A CLL az idős kor betegsége. A diagnózis idején a medián életkor 65 év, férfi/nő arány 2/1. A betegség kezdetén a betegek 10%-a van 50 év alatt, 1/3-a 60 éves kor alatt, 1/3-a 60-70 éves kor között, kevesebb, mint 1/3-a pedig 70 éven túl van. Magyarországon kb. évi 3-500 újbeteggel lehet számolni. Incidenciája: 3-5/100.000 lakos/év, az összes leukaemia 25-30%-a. A kaukázusi populációban és a feketékben kb. 10-szer gyakoribb, mint Ázsiában, amelynek nem környezeti, inkább genetikai okai lehetnek.
Etiológia
A betegség oka ismeretlen. Nem lehet összefüggést kimutatni sugárhatással, vagy vírusokkal. Mezőgazdasági kemikáliákkal való tartós érintkezés összefügghet kialakulásával. A betegség kis részben familiáris halmozódást mutat. Az újonnan diagnosztizált CLL-es betegek családtagjai között a CLL vagy más lymphoproliferatív betegség rizikója 7-szeres fokozódást mutat. A genomban végzett single nucleotid polymorphismus (SNP) asszociációs vizsgálatok szerint 10 gyakori locus variáns (populációs prevalencia >5%) együttes öröklődése hajlamosít CLL kialakulására. Emellett lehetnek még fel nem fedezett ritka variánsok is, amelyek fokozzák a gyakori variánsok hatását (3).
Klinikai megjelenés és tünetek
Monoclonalis B-sejt lymphocytosis (MBL).
A 40 év feletti lakosok 3%-ában flow-cytometriával u.n. BML mutatható ki. Ez alatt azt értjük, hogy lymphocytáik hordozzák a CLL jellegzetességeit, de még nem betegek. Ha a lymphocyták abszolut száma normális, a MBL sejtek abszolut száma is alcsony <50 /ul. Akkor is, ha a kromoszóma abnormalitások jelen vannak, jó prognózis várható, mert a sejtek döntő többsége "mutált" típusú. Ezzel az eltéréssel rendelkező egyéneket nem kell monitorozni, mert kicsi a valószínűsége, hogy ebből az állapotból manifeszt CLL lesz. Ha a clonalis B-sejtek száma >2000/ul, évente az esetek kb. 1%-a alakul át manifeszt CLL-é, mely kezelést igényel, ezért ezeket követni kell. A CLL-es betegek elsőfokú rokonai között a MBL 13,5%-ban mutatható ki.
A manifeszt CLL-ben szenvedők 70-80%-a tünetmentes a diagnózis idején, de a perifériás vérben a clonalis B-lymphocyta szám már emelkedett és több mint 5 G/L.
A CLL típusos esetben szimmetrikus, nyaki, fájdalmatlan nyirokcsomók megjelenésével kezdődik. Később splenomegália (66%-ban), hepatomegália, és végül csontvelőelégtelenség alakul ki, melyet anémia, neutropenia és thrombocytopenia jellemez. Előrehaladott stádiumban "B" tünetek" léphetnek fel: a testsúly 10%-ának elvesztése 6 hónap alatt, infekció nélküli láz, éjjeli izzadás, gyengeség és bőrviszketés.
A betegség előrehaladtával komplex immundefektus alakul ki. A humorális immunválasz kóros, amelyet hypogammaglobulinaemia okoz, mert elsősorban az IgG, de az IgA szint is csökkent. Nem működik a T-sejt és B-sejt kölcsönhatása. A celluláris immunitás zavarát jelzi a CD4/CD8 arány, a T-helper, az autolog stimulált lymphocyták (LAK) és a természetes ölősejt (NK) funkció csökkenése, a dendritikus sejtek elégtelen funkciója és a macrophagok működészavarainak következtében kóros antigén prezentáció. A neutropenia a betegség előrehaladott stádiumában okoz funckiókiesést. A komplement rendszer elemeit és funkcióit illetően is defektus alakul ki. A kezelések is hozzájárulnak az infekciók számának és recidívájának növekedéséhez. Gyakoriak a felsőlégúti infekciók és a herpes zooster. A súlyos infekciók kockázata: 26%/5 év. A halálozás 1/3-a infekcióval függ össze. Az infekciók 50%-a recidívál, amelyre a következő rizkófaktorok hajlamosítanak:
a betegség előrehaladott stádiuma, az alacsony immunglobulin szint, nagy rizikójú cytogenetikai abnormalitás, nem-mutált IgVH status és az alkalmazott kezelés. A különféle terápiák okozta fertőzéshajlamot az egyes gyógyszereknél tárgyaljuk. A második malignomákra nézve a rizikófokozódás 2-7-szeres, szekunder MDS, AML, szolid tumorok (főleg a bőr, a colon és a cervix in situ carcinomája) fordulnak elő leggyakrabban.
Az autoimmun jelenségek ismertek CLL-ben. Coombs pozitivitás 10-20%-ban mutatható ki, a betegek <50%-ban meleg autoantitestek által okozott autoimmun haemolyticus anaemia (AIHA) ill. 2-5%-ban autoimmun thrombocytopenia alakulhat ki.
II. Diagnosztika
1. Anamnesis.
Felvétele a belgyógyászati vizsgálat szabályai szerint történik. Külön ki kell térni a családi anamnézisben a vérrokonok közötti lymphoproliferatív betegség előfordulására, mivel ez gyakoribb CLL-ben, mint más hematológiai malignitásban.
2. Fizikális vizsgálat.
A belgyógyászati szabályok szerint, minden szervrendszerre kiterjetően történjen. Le kell írni a legnagyobb nyirokcsomó átmérőjét 2 dimezióban, a következő sorrendben: a nyaki, axilláris, supraclavicularis, ingvinális és femoralis regiókban. A máj és a lép nagyságát tapintással kell megadni, és leírni, hány cm-el haladja meg a jobb, illetve a bal bordaívet. Az esetleg fennálló egyéb szervi manifesztáció kimutatása, a stádium megállapításnak is fontos része.
3. Laboratóriumi vizsgálatok.
A perifériás vérben a diagnózishoz legalább 3 hónapja fennálló 5x109/L feletti monoclonalis lymphocytosis szükséges. A sejtek többsége látszólag érett, keskeny cytoplazmájú, tömör, részben aggregálódott chromatint tartalmazó, de nucleolus nélküli maggal látható. A betegek 15%- ában a sejtek atípusosak lehetnek. Ezek a sejtek <55%-ban keverten fordulnak elő 10%-ban nagy, atípusos, hasadt magvú lymphocytákkal, amelyek prolymphocytáknak felelnek meg. Ha a prolymphocyták >55%-ban vannak jelen, akkor B-sejtes prolymphocytás leukaemiáról van szó. Az atípusos sejtek másik megjelenési formájában >15%-ban láthatóak a hasadt magvú lymphoplasmocytoid sejtek. A kenetben jellemző még az ún. Gumprecht-alakok jelenléte (eosinophil massza, mely az in vitro sérült, szétkent lymphocytákból származik).
Immunfenotipizálás a diagnózis első lépése. A periferiás vérből flow cytometriás vizsgálattal a CLL-re jellemző lelet a CD5 a CD19, CD20 és a CD23 coexpresszió és (a normális B-sejtekkel ellentétben) alacsony mértékben expresszálódó CD20, CD79b felszini immunglobulinok. A clonalitást jelzi, hogy dominálóan vagy kappa, vagy lambda könnyűlánc expresszió mutatható ki. A sejteken kis mennyiségben expresszálódnak a felszíni immunglobulinok (IgM , vagy IgM és IgD).
Differenciál diagnosztika
Más lymphoprofliferatív betegségektől kell elkülöníteni, melynek első lépése az immunphenotipizálás. Ilyenek a mantle cell lymphoma (CD23-, CD10+ cyclin-D1+, a CD5-) , a hairy cell leukémia (CD20+, CD22+, CD11c+, CD 25+CD103+, de a CD5-), marginális zóna lymphoma (CD23-, CD10-, CD103 +/-, CD5+/-, CD383+), a prolymphocytás leukaemia (CD20+, FCM-7+, CD5+/-, CD10-), és a follicularis lymphoma (CD20+, CD5-, CD10+, bcl-2+ CD43-). A differenciál diagnosztikában használható az ún. Matutes - score, mely 5 elemből áll, mindegyik potértéke 1 (CD5+, CD23+, FCM7-, SmIg gyenge, CD22/CD79b gyenge vagy negatív expresszió). A pontok összege 3-5 között CLL-re diagnosztikus, 0-2 között egyéb B-sejtes megbetegedésre utal. Segítséget nyújt emellett a periferiás vérkenet, a csontvelő és a nyirokcsomó morfológiai és a metafázis, - továbbá a molekuláris cytogenetikai vizsgálata. A csontvelő vizsgálata. CLL-ben a magvas sejtek több mint 30%-a lymphoid sejt. A diagnózis felállításához azonban ez a vizsgálat általában nem szükséges. Bár az infiltráció típusa prognosztikai szempontból jelentőséggel bír (noduláris, diffúz vagy kevert, melyben a diffúz infiltráció rosszabb prognózist jelent, mint a nem-diffúz), az új prognosztikai markerek értéke felülmúlja a csontvelővizsgálatét. A csontvelő biopszia elvégzése azonban ajánlott myeloszupresszív kezelés megkezdése előtti tisztázatlan cytopenia, vagy a kezelés után perzisztáló cytopenia esetén, annak tisztázására, hogy a cytopenia a kezeléssel függ össze, vagy a betegséggel kapcsolatos infiltráció okozza-e.
4. Prognosztikai/rizikó faktorok
Régi klinikai megfigyelés volt, hogy a CLL kórlefolyását tekintve két csoportra osztható. A betegek egy részének átlagos túlélése hosszú, kb. 25 év, másoknál viszont lényegesen rövidebb, kb. 8 év. Ennek hátterében új prognosztikai markereket ismertünk meg, amelyek nemcsak magyarázatot adnak az egyes betegcsoportok különböző klinikai megjelenésére, hanem egyben lehetővé vált a rizikó adaptált kezelést is.
Klinikai stádiumbeosztás
A módosított Rai - ill. Binet- féle stádiumbeosztás az 1. és 2. táblázatban látható. Magyarországon a Rai - féle beosztást használjuk. A Rai és a Binet-féle klinikai stádiumbeosztás jól használható a progresszió és a túlélés megítélésére a Rai III és IV, továbbá a Binet B és C stádiumban. Ezzel ellentétben a Rai 0, I és II, továbbá a Binet A stádiumban a prognózist illetően nem informatívak. Az egyedi esetekben, a diagnózis felállításakor különösen nehéz megmondani a betegség progressziós készségét és a túlélést, ezért további rizikó faktorok vizsgálata vált szükségessé.
| Stádium | Átlag túlélés (évek) | |
| Kis rizikójú | lymphocytosis | > 15 |
| Közepes rizikójú | I. lymphocytosis lymphadenomegalia | 9 |
| II. lymphocytosis hepato/splenomegalia | 5 | |
| Nagy rizikójú | III. lymphocytosis anaemia (HB <11 g/l) | 2 |
| IV. lymphocytosis tct-penia ( <100x109 /l) | 2 |
1 .táblázat. Módosított Rai - klasszifikáció (1987)
| Stádium | Átlag túlélés (évek) | |
| Stadium A - | nincs anaemia, tct-penia < 3 lymphoid regio* érintettsége | 12 |
| Stadium B - | nincs anaemia, tct-penia 3 vagy több régioban van nyirokcsomó | 5 |
| Stadium C - | anaemia (Hb <10g/dl és/vagy tct-penia ( <100x109 /L) | 2 |
*Lymphoid régiók: cervicalis, axillaris, ingvinalis, egy vagy kétoldali lymphadenopathia, lép és máj-megnagyobbodás. 2. táblázat Módosított Binet-klasszifikáció (1981) Molekuláris cytogenetika
PCR és interfázis fluorescens in situ hibridizáció (FISH) alkalmazásával a stabil betegek 66%-ában, a progrediáló betegek >80%-ában találtak eltérést. Leggyakoribb a 13q14 deletio (55%), utána következik a 11q23 deletio (18%), majd a 12q trisomia (16%), melyet korábban a leggyakoribbnak gondoltak, a 6q deletio (7%) és a 17p deletio (7%). Az egyes eltérések prognosztikai jelentőségét vizsgálva a legrövidebb median túlélést 17p/p53 deletionál (32 hó), és a 11q deletionál (79 hó) mutattak ki. Ez után a túlélést illetően következik a 12q trisomia (114 hó), ezt követi a normális kariotípus (111 hó), a leghosszabb túlélést pedig a 13q deletionál (133 hó) írták le (4). A del17p és a del11q független rizikófaktorok a gyors betegség progresszió és rövid túlélés vonatkozásában, mivel ezek a deletiók a tumor szupresszor géneket, a p53-t ill. az ataxia teleangiectasia gént inaktiválják. A del11q gyakran nagy, ún. "bulky" nyirokcsomó megnagyobbodásokkal jár. Az egyéb eltérés nélkül mutatkozó 13q14 deletio hosszútávú prognózisa a legjobb CLL-ben. Ez a deletio újabb vizsgálatok szerint azért befolyásolja a CLL pathogenezisét, mivel érint két, nem-kódoló microRNS cluster-t, a microRNS 15 és 16-t, ezek kritikusan deletálódnak, és csökkentik a CLL-ben fokozottan kifejeződő antiapoptotikus gén, a bcl-2 expresszióját, mely a sejtek fokozott "turnover"-éhez vezet. Az epigenetikus elváltozásoknak is, mint a gén promoterek methylációja (pl. a DNS globális hypomethylációja) és a histonhoz kötött DNA acetilációja, egyre nagyobb szerepet tulajdonítanak a CLL pathogenesisében.
A betegség lefolyása és a kezelés során, addicionális cytogenetikai eltérések, (pl. a clonalis evolúció) alakulhatnak ki. Ezért a legfontosabb genetikai rizikófaktorok vizsgálatát FISH-el a kezelések előtt mindig meg kell ismételni (l. a kezelés megkezdése előtti vizsgálatoknál)
Metafázis cytogenetika
Az esetek kb. 40-50%-ában cytogenetikai abnormalitások mutathatók a kóros sejtek alacsony mutációs készsége miatt azonban ez nem lehet rutin vizsgálat. A cytogenetikai eltérések társult előfordulása rossz prognózist jelez.
Az IGVH-gén mutációs analízise
Az IgVH gén mutációs státusa alapján a B-CLL-es betegek két csoportra oszthatók. Az egyikben azok a sejtek dominálnak, melyek a marginális zónából származnak és antigén inger hatására szomatikus hipermutáción estek át. Az IgVH gén mutált satusa kb. 50%-ban mutatható ki. Ebben a csoportban a betegség lassú progressziójú, a betegek túlélése a Binet A-stadiumtól követve singifikánsan hosszabb, átlagosan 25 év. Valószínűleg a "smouldering" esetek is ide tartoznak. A másik csoportban a sejtek szintén találkoztak antigén ingerrel, de érettlenebbek, nem estek át szomatikus hipermutáción (a "germline szekvenciákkal > 98%-ban azonosságot mutatnak). Az ilyen IgVH státuszú betegek túlélése sokkal rövidebb, átlagban 8 év. A korábbi kutatási eredményekkel ellentétben mind a kétféle B-sejt a memoria B-sejtekből származik. A CLL lefolyása során a két csoport B-sejtjeinek mutációs státusa nem változik. A mutáción átesett csoport eloszlása egyenletes nemek szerint, a nem mutált állapotúak között háromszor gyakoribbak a férfiak. Ezek a megfigyelések erősítik azt a feltevést, hogy nem egyfajta (hanem legalább kétfajta) CLL van. Az IgVH status meghatározása csak szekvenálással lehetséges, ezért jelenleg még nem válhat rutin módszerré. CLL-ben az IgVH-génben a génátrendeződéskor felhasznált V-regió szakaszok különböző prognosztikai jelentőséggel bírnak. A V3-21 és a V1-69 régiók rossz prognózist jelentenek és szignifikánsan nagyobb arányban vannak jelen a rövid élettartamú betegcsoportban. Ez független a IgVH gén mutációs státuszától és önmagában, mint előnytelen prognosztikai jel felülírja a mutációs status jelentőségét is.
CD 38 felszíni antigén expressziója.
A B-CLL-es sejtek felszínén segítséget jelenthet a betegség aktivitásának megállapításában és ezzel utalhat az IgVH statusra is. A mutált génnel rendelkezők többsége ugyanis <30%-os CD38 felszíni antigén expressziót mutat, míg a nem mutáltak esetében a CD38 expresszió általában >30%. Ez a határ újabb vizsgálatok lehet alacsonyabb is (pl. 7%), de ez még megerősítésre szorul. Kiderült azonban, hogy a CD38 expresszió az esetek 1/3-ában nem korrelál a nem-mutált IgVH gén statusszal és a betegség folyamán változhat. A CD38 pozitivitás a génmutációtól függetlenül is erős negatív prognosztikus marker. A jó prognózist hordozó alacsony expressziójú CD38 status a betegség progressziója alkalmával >30%-ra emelkedhet, és ez rendszerint együtt jár a klinikai progresszióval. Az esetek 15-40%-ban fordul elő ilyen változás.
ZAP-70 (zeta associated protein tirozin kinase)
A T-és NK sejt receptorok intracelluláris jelátviteli rendszerének tagja. B-CLL-ben a IgVH gén mutációs státusával kb.70%-ban korrelál, a fokozott aktivitást a >20%-os expresszió jelenti. A nem mutált csoport ZAP-70 expressziója kb. 5-ször nagyobb, és a betegek halálozása 13-szor magasabb, mint a mutált csoporté. Emelkedett aktivitása jelzi a betegség progresszióját és alátámaszthatja a kezelés szükségességét is. A ZAP-70 meghatározás több módszerrel lehetséges (FACS, immunhistokémia, immunoblot, kvantitatív RT-PCR, lympho-chip stb.). Ezek a módszerek jelenleg még nem kellően standardizáltak. A ZAP-70 és a CD38 expresszió nem befolyásolja a kezelés indikációját, valódi prognosztikai értékük azonban további klinikai vizsgálatokat igényel (III,B).
Tumor suppresszor gén státusz
A 17p abnormalitásai a p53 tumor suppresszor gént, a 11q abnormalitásai az ATM (ataxia teleangiectasia) és a RDX (radixin) géneket is érinti, ezért a P53 géntermék csökkenése az apoptosis csökkenését, a DNA repair kiesését és végeredményben kontrollálatlan sejtszaporodást okozva progresszív betegséget okoz. A P53 dysfunctio a IgVH- nem mutált csoportjában gyakori.
A 17p-/p53 aberráció jelenléte az alkiláló szerekkel, a purin nucleosid analógokkal és a CD20 ellenes monoclonalis antitestekkel szembeni rezisztenciát akkor okoz, ha ez a mitózis a sejtek több mint 20%-ban kimutatható. Ezért fontos therapiás következményei vannak. A del11q abnormalitással rendelkező betegek reagálnak az előbb felsorolt gyógyszerekre, de agresszívebb, nagyobb dózisú kezelést irényelnek, mint a del11q abnormalitással nem rendelkezők és rövidebb a progressziómentes túlélésük (PFS).
A gén profil meghatározása ("gene array") a közeli jövő módszere, a lympho-chipek segítségével. Multidrug-rezisztencia (MDR) fenotípus
A p170 glycoprotein termelés az mdr-1 gén expresszió következménye, mely chlorambucil (CLB) és a CHOP-kombinációt tartalmazó cytostaticumok ellen rezisztenciát jelent. Előrehaladott stádiumú CLL-es betegek között gyakori. Nem mdr-1 mechanizmussal okoz multidrug rezisztenciát a p53 gén mutáció, a magas bFGF-szint, és a magas PCNA-szint.
III. Kezelés
A kezelés megválasztásánál mérlegelendő tényezők (14).
1.A beteg általános állapota és a kísérő betegségei, melyek nem a CLL-el kapcsolatosak.
Az életkor nem, de a betegek fizikai állapota a döntő tényező. Ennek megítélésére különböző potrendszerek szolgálnak, mint pl. az ECOG vagy a CIRS - (cumulative illness rating scale) score. A német CLL munkacsoport (DCLLSG) a betegek erőnléte és kisérőbetegségei alapján történő rizikófelosztását vette át az MHTH CLL munkacsoportja. Az egyes szervrendszerek betegségének, nem CLL- függő súlyosságát 4 fokozattal lehet jelölni: mérsékelt; közepes; súlyos; nagyon súlyos. A vizsgálandó szervrendszerek a következők: szív, vérnyomás, vascularis károsodás, légzőszervi, fül-orr-gégészeti, felső gastrointestinális, alsó gastrointestinális, máj, vese, váz-és izomrendszeri, endokrin és metabolikus, neurológiai és psychiatriai. Ezek alapján a betegeket három csoportra lehet osztani; a kis, a közepes és a nagy kockázatúakra.
A kis kockázatú, legjobb prognózisú csoportot az u.n. "go-go" betegek képezik, akiknek általános állapota jó, önálló életvitelre képesek, és legfeljebb egy súlyos kisérőbetegségük van, de túlélésük nem különbözik az azonos korú nem CLL-es betegekétől (ECOG 0-1). Ezek a betegek első vonalban erélyesen kezelhetők, teljes remisszió elérésére (CR) lehet törekedni amellyel mind a progressziómentes (PFS), mind az általános túlélésük (OS) szignifikánsan meghosszabbítható.
Az ún. közepes kockázatúak, azaz a"slow-go"csoportba tartozók általános állapota rosszabb, (ECOG 2), maximum 2 súlyos comorbiditásuk van, de még segítséggel képesek önálló életvitelre. Ebben a betegcsoportban már kevésbé erélyes kezelés javasolt, de törekedni kell legalább jó parciális remisszió (PR) elérésére.
A nagy kockázatú, rossz általános állapotú és több súlyos társbetegségben szenvedők képezik a harmadik csoportot, az u.n. "no-go" betegeket, akiknek életkilátása jelentősen csökkent (ECOG 3-4). Ezeknél elsősorban szükség szerinti citoreduktív kezelést és granulocyta növekedései faktort, vörösvérsejt és thrombocyta pótlást, erythropoesist stimuláló szert kell alkalmazni - az erről szóló irányelveknek megfelelően - az általános állapot és az életminőség javítására.
2. A CLL-el kapcsolatos rizikófaktorok felmérése, amelyek mind a betegségprogresszió, mind a kezelés megválasztása szempontjából döntőek. Legfontosabbak közülük a genetikai eltérések, ill. a korábban felsorolt, nem genetikai, a betegség aktivitását jelző abnormalitások.
Az ismételt kezelések előtt a genetikai rizikófaktorokat is újra meg kell vizsgálni, mivel a kezelések során a nagy rizikót jelentő abnormalitások kiszelektálódhatnak, és egyre gyakoribbá válnak.
3.A klinikai stádium ma is a kezelés fontos meghatározó tényezője. A stádiumbesorolás egyszerű, olcsó, a fizikális vizsgálatra és egyszerű laboratóriumi tesztekre támaszkodik. Nem igényel ultrahang, CT vagy MRI képalkotó vizsgálatokat. Rai 0 vagy Binet A stádiumban a beteget, ha nincsenek a betegség aktivitására utaló jelei, általában csak monitorozni kell (I,A). Vérkép és klinikai vizsgálat 3-12 hónap között szükséges, un. "figyelő várakozás"-t kell folytatni.
A klinikai tünetekkel rendelkező Rai I-II vagy a Binet B stádiumban már indikált lehet a kezelés. A Rai III-IV. stádiumban ill. a Binet C-stádiumban, a betegség aktivitásának esetén (l.alább), a kezelést általában meg kell kezdeni.
A kezelés megkezdését indokoló aktivációs jelek (14) (I,A)(8)
1. Csontvelő elégtelenség (anaemia, tct-penia) kialakulása vagy romlása
2. Masszív splenomegalia (> 6 cm ) vagy lymphadenomegalia nycs átmérő >10 cm és tünetek esetén
3. Progresszív lymphocyosis: 2 hónap alatti > 50% növekedés vagy a lymphocyta kettőződési idő rövidülése (LDT) < 6 hónap. A sejtszám növekedés infekciós, v. egyéb okát ki kell zárni.
4. Autoimmun anaemia vagy thrombocytopenia, mely rosszul reagál corticosteroid, vagy egyéb standard kezelésre (splenectomia, IVIG, cysporin A, azathioprin, kis dózisú cyclophosphamid ). Jó hatású lehet a rituximab vagy az alemtuzumab. Ha nem reagál ezekre sem, cytostatikus kezelést kell kezdeni, a stádiumtól függetlenül.
5. Az alábbiak közül minimum 1 jelenléte:
- A testsúly >10% csökkenése a megelőző 6 hónapban
- Jelentős fáradtság: ECOG 2 vagy ennél rosszabb állapot - nem tud dolgozni vagy a szokásos aktivitását kifejteni
- 38 fok feletti láz >2 hétig infekció nélkül
- Éjszakai izzadás >1 hónapig infekció nélkül
Hypogammaglobulinaemia, vagy monoclonalis protein megjelenése önmagában nem aktivitási jel. Lehet nagyon magas a fehérvérsejtszám, de aggregátumok ritkán fordulnak elő
CLL-ben (amelyek pl. akut leukaemiában kialakulnak). Ezért az abszolut lymphocytaszám magas értéke önmagában nem indikálja a kezelés megkezdését.
A kezelés megkezdése előtti kiértékelés a mindennapi gyakorlatban (III,B)
1. A diagnózis precíz megállapítása (teljes vérkép, a lymphocyták immunophenotipizálása).
2. Anamnézis, fizikális vizsgálat és az általános erlőnlét felmérése (ECOG). Teljes vérkép és kenet vizsgálat. A csontvelővizsgálat nem kötelező, csak kívánatos. Szérum immunglobulin, és Coombs teszt meghatározá, mellkas Rtg és infekciós státus vizsgálata köztelező (HIV, HCV, HBV, CMV). Immunosupresszív kemoterápia alatt reaktiváció jöhet létre, ezért HIV pozitív betegeknél antiretroviralis kezelés szükséges, HBsAg pozitív esetekben profilaktikus lamivudin adása, CMV pozitivitásnál allogén őssejttranszplantáció vagy almetuzumab (A) kezelés esetén aktív CMV betegség irányába történő monitorozás és pozitivit esetben CMV ellenes kezelés bevezetése szükséges.
3. Kiegészítő vizsgálatok a kezelés megkezdése előtt: FISH vizsgálattal: del(13q), del( 11q), del(17p), 12-es trisomia és del6q kívánatos. Hasi UH elvégzése lehetséges. Álalában nem indikált CT, MRI, lymphographia, gallium scintigraphia. PET-CT sem javasolt, kivéve a Richter transformációt.
4. Nyirokcsomó biopsia -általában nem kötelező, csak diagnosztikus dilemma esetén vagy transzformáció gyanújánál.
A kezelésre adott válasz megállapítása, az alábbi kritériumok szerint történik
(14)
Komplett remisszió (CR)
Az alábbiak fennállása legalább 2 hónapig
1. A periferiás vérben a lymphocyta szám < 4 G/l ( 4000/ul)
2. Nincs tapintható nyirokcsomó megnagyobbodás (átmérő < 1,5 cm fizikális vizsgálattal)
3. Fizikális vizsgálattal nincs sem lép, sem máj megnagyobbodás
4. Nincs B-tünet
5. Normális vérkép: Neutrophil: >1,5X109/L (növekedési faktor nélkül), thrombocyta szám: >100x 109/L (pótlás nélkül), Hb: >110x109/L (transzfúzió nélkül).
Parciális remisszió (PR)
1. A kezelés előtti leletek 50%-os csökkenése:
- a perifériás lymphocytaszámban
- fizikális vizsgálattal a perifériás nyirokcsomó megnagyobbodásban
- fizikális vizsgálattal a máj és lép megnagyobbodásban.
2. Vérkép: Neutrophil: >1,5x109/L (növekedési faktor nélkül), vagy 50%-os javulás, thrombocyta szám: >100x 109/L (pótlás nélkül), vagy 50%-os javulás, Hb:>110x109/L (transzfúzió nélkül) transzfúzió nélkül, vagy 50%-os javulás.
Progresszív betegség (PD)
A kezelés alatt vagy utána a következők: A nyirokcsomó megnagyobbodás fokozódása, melyet elég fizikális vizsgálattal ellenőrizni, nem feltétlenül képalkotó eljárással. Újnyirokcsomók megjelenése (ámtmérő >1,5 cm), hepatomegalia, splenomegalia >50%-os növekedése vagy más szervi infiltráció megjelenése. A vérben a lymphocytaszám >50%-os növekedése, legalább 5000 B-lymphocyta jelenléte mikroliterenként. Agresszívebb formájú szövettani típusba való transzformáció (pl. Richter szindroma), melyet nyirokcsomó biopsiával kell megállapítani, cytopenia megjelenése, melyet CLL okoz és nem a citosztatikus kezelés. A kezelés utáni cytopenia, mely 3 hónap után jelenik meg és nem autoimmun eredetű, ha a Hb szint 20 g/l-el csökken a CLL-ban észlelt kiindulási értéknél, vagy 100 g/l alá esik, vagy a thrombocytaszám >50 %-os csökkenése, vagy 100G/l alá süllyedése.
Stabil betegség (SD)
Azonos a non-reszponder statusszal. Az a beteg, aki sem CR-t, sem PR-t nem ért el és nem mutatja a progresszív betegség jellemzőit.
Kezelési kudarc (TF)
A stabil betegség, a non-reszponder állapot, a progresszív betegség, és bármilyen okból bekövetkező halál együttes elnevezése.
Relapszus
Ha egy beteg CR, PR elérése után 6, vagy több hónappal betegség - progresszitót mutat.
Refrakter betegség
Kezelési kudarc, vagy az utolsó antileukemiás kezelés után 6 hónapon belüli progresszió. Ez az állapot a nagy rizikójú betegséget jellemzi, mely indikálja az allogén őssejt-transzplantáció elvégzését, amennyiben a betegség sem purin analog kezelésre vagy korábbi autolog őssejt-transzplantációra nem reagált.
Minimális reziduális betegség (MRD)
A MRD eradikálása a kezelés kívánt végpontja, de csak klinikai vizsgálatban, stadard módszerekkel. Akkor lehet ezt kimondani, ha CR elérése után, 1/10.000 leukocytában sem lehet kimutatni a betegséget. A vizsgálatot az utolsó kezelés után 3 hónapon belül kell először elvégezni. Viszonylag könnyen elérhető technika a multicolor flow-cytometria és a real time PCR, bonyulultabb és speciális laboratóriumi hátteret igényel az allél-specifikus olygonucleotid PCR. Különösen alemtuzumabbal, rituximabbal vagy más antitesttel végzett kezelés után fontos elvégezni, mert erős prognosztikai értéke van. Bár a MRD eradikálása javithatja a progózist, prospektív klinikai vizsgálatok szükségesek annak eldöntésére, hogy a MRD negatívitás eléréséhez és fenntartásához szükséges kezelések valóban javítják-e a klinikai kimenetelt.
A kezeléseket mindig hematológiai centrumban kell végezni.
Első vonalbeli kezelések
Korábban a CLL kezelésében a "nil nocere" elv uralkodott, mivel a CLL az indolens betegségek közé tartozik, ebből következően a korábbi kezelésekkel az általános túlélést nem lehetett meghosszabbítani. Az új kezelési lehetőségek bevezetésével mára a helyzet megváltozott.
Chlorambucil (CLB)
A kezelésben az 1970-es évektől rutin kezelésként CLL-ben a leggyakrabban alkalmazott gyógyszer volt. Bár magas arányú általános válasz arányt (ORR) váltott ki: 40-60%, a komplett remissziók (CR) aránya csak 5-10% volt. Hat randomizált klinikai vizsgálat metaanalízise (2) 1990-ben azt mutatta, hogy 2048 betegnél, az azonnal megkezdett kezelés (CLB+/- prednisolon), összehasonlítva a csak klinikai tünetek esetén kezdett kezeléssel, a 10 éves túlélést nem javította (44% vs. 47%). Úgyszintén egyforma volt az 5 éves túlélés is (48%) a 10 klinikai vizsgálatból származó 2035 beteg felmérésénél. A kombinált kemterápiával összsehasonlítva a csak CLB(+/- prednisolon) -al kezelt betegcsoportot, az 5 éves túlélésében sem volt különbség. A korán megkezdett kezelés tehát CLL-ben nem ajánlot (I,A). CLB kezelési sémák
Az ún. "nagy dózisú" (HD) - CLB: napi 16 mg, vagy 10 mg/m2 folyamatosan maximum 18 hónapig. RR: 86% CR: 43% (TTM-score szerint).
A "közepes intermittáló dózisú" (ID) CLB: 40 mg/m2 28 naponként vagy 20 mg/m2 14 naponként, maximum 12 hétig. ORR: 37-70%, CR: 0-20%. További javasolt dózis: 0.4-0.8 mg/kg fokozatosan emelve, majd megtartva a 0,8 mg/kg dózis, az 1. és a 15. napon maximum 12 hónapig.
CLB vs Fludarabine (F)
Kontrollált, multiklinikai vizsgálat során (DCLLSG CLL-5) a két gyógyszer hatását idősebb betegeknél próbálták ki. Dózisok: A CLB karban: CLB: 0.4 mg/kg, (0.1 mg-tól 0.8 mg/kg -ra emelve) az 1. és a 15. napon, maximum 12 hónapig; Fkarban F: 25 mg/m2, 1-5 napig iv., 28 naponként 6 ciklusban. Eredmények: a F karban szignifikánsan magasabb OR és CR arány volt a CLB karhoz képest (72% vs. 51% p=.003; 7% vs. 0%, p=.011). TTF a CLB karban szignifikánsan rövidebb volt a F-hoz viszonyítva (11 vs. 18 hónap, p=.004). A PFS -ben viszont nem volt különbség (F: 19 vs. CLB: 18 hónap, p = .7). Ezen kívül a F nem nyújtotta meg a medián túlélést (OS: CLB: 64 vs F: 46 hónap p = .15). Összegezve, az idősebb és tünetekkel járó, előrehaladott stádiumokban alkalmazott CLB a F-al összehasonlítva nem marad alul sem a RR-ra, sem az általános túlélésre (OS) gyakorolt hatásában. A CLB tehát standard kezelésnek számít ebben a nem-fitt (slow-go) betegcsoportban (II,B).
Cyclophosphamid (C) ritkán kerül alkalmazásra, CLB túlérzékenység vagy kontraindikáció esetén jön szóba, annak alternatívájaként, ha a beteg csak monoterápiát kaphat. Folyamatos orális adagolás 2-3 mg/kg/nap, vagy iv. infuzió 20 mg/kg 2-3 hetente ismételve.
A kombinált kemoterápiák, a lymphomákban elért eredményeket tapasztalva, egy évtizeddel később CLL-ben is bevezetésre kerültek. Ilyenek a COP: C:750 mg/m2, 1 nap i.v., Oncovin(O): 1,4 mg/m2 az első nap i.v., prednisolon (P) 100 mg 1-5 napig p.os. ismétlés: 21 naponként, 6x ; CHOP: doxorubicin 50 mg/m2, C: 750.0 mg/m2 és vincristin 1.4 mg2 -max. 2 mg az 1. napon, prednisolon 100.0 mg p.os 1-5 napig,; Binet-féle ChOP(csökkentett dóziú): C: 300 mg/m2 1-5 napig p.o., doxorubicin (h) 25 mg/m2 1. nap i.v; Oncovin(O): 1 mg/m2 az első nap i.v., Prednisolon (P) 40 mg/m2 1-5 napig p.os. ismétlés: 28 naponként, 6x. ORR: 71,5%, CR:30%; CAP: C: 750 mg/m2 az 1. nap i.v., Doxorubicin: 50 mg/m2 az 1. nap i.v., P: 40 mg/m2 az 1-5 napig p.os. Ismétlés: 28 naponként, 6-szor. ORR: 58,2, CR:15, stb.)
Az eredmények alig voltak jobbak, mint C kezeléssel, a CR arányát valamivel növelték (ORR: 78%, CR: 15-20 %), a túlélést azonban nem hosszabbították meg. Ma olyan relapsusba került betegeknél adjuk, akiknek nagy tumor-tömegük van és annak gyors csökkentése szükséges, vagy ha a beteg más kezelésre már nem reagál.
Adenosin analógok
1990-ben új gyógyszerként jelentek meg (fludarabine, pentostatin és cladribine), közülük a legtöbb vizsgálatot fludarabinnal (F) végezték.
Fludarabine monotherapia
F, mint antimetabolit (adenin nucleotidanalóg) gátolja, főleg a malignus sejtekben, a DNS és az RNS szintézist, továbbá fokozza az apoptosist. A Fludarabie injekció 50 mg/por ampulla és 10 mg/tabletta kiszerelésben kapható. A két készítmény bioaequivalens és egyforma a klinikai hatékonyságuk. A tabl. elsősorban ambuláns kezelésre ajánlott. Az OGYI 2008-ban regisztrálta első-vonalbeli kezelésként is CLL-ben.
Dózisok: 25 mg/m2 30 perces infúzióban 1-5 napig, 40 mg/m2 oralisan 1-5 napig. Mindkét formula 28 naponta, maximálisan 6-szor. Vérképkontroll: heti 1-szer. Restaging: a 3. és a 6. kezelés után. Eredmények: ORR: 75-80%, CR: 40-50%, a progresszió mentes túlélés: 27 hónap, mely singifikánsan hosszabb, mint a széles körben használt közepes dózisú CLL kezeléssel elérthető. Első vonalban, monoterápiában a korábbi kezelések eredményét felülmúlta, mind az ORR, mind a CR-s arányokat illetően, mind a közepes dózisú CLB-hoz, mind pedig a kombinált, +/- anthracyclin alapú kombinált kezelésekhez viszonyítva. A progressziómentes túlélést is javította, az általános túlélést viszont nem befolyásolta és nagyon alacsony arányban eradikálta a MRD-t.
FC
Az első, jelentős változást hozó terápia 2000-től kezdődően, mely a két citosztatikum szinergista hatásának és a keresztreakció hiányának köszönhető. Az FC kombináció minden korábbi kezelésnél eredményesebbnek bizonyult, amelyet három randomizált és kontrollált vizsgálat is bizonyított. A F az alkiláló szerek által okozott DNS keresztkötés "repair" - jét gátolja, ezen kívül gyengíti a complement védő fehérjék CD46, CD55 és CD59 expresszióját.
FC vs. F
DCLLSG CLL4 - es vizsgálatban (7) az F-t FC-vel hasonlították össze. Dózisok: FC karban: F 30 mg/m2 1-3 napig, C 250 mg/m2, 1-3 napig, 28 naponta a F karban F: 25 mg/rrf, 1-5 napig. Az FC kezelés szignifikánsan felülmúlta az F monoterápia hatását. Az FC kezelés további előnye a F monoterápiával szemben, hogy kevesebb AIHA-t okoz. Eredmények: ORR: 95%, vs. 83%, CR: 24% vs. 7%, a kezelésmentes időszak (TTF) 19,3 hónap után 46,7 vs. 21 hónap. Az általános túlélést azonban az FC kombináció sem nyújtotta meg.
Az FC kezelés 2007-tól a CLL-es betegek első vonalbeli kezelésének standardjává vált.
Az FC protokollok orálisan is adhatók, kényelmesebben, ambuláns kezelésre alkalmasabbak, egyforma hatékonyság mellett.
FC oralisan
Az iv. és orális kezelés eredményét több klinikai vizsgálatban hasonlították össze és nem találtak az eredményekben különbséget. Dózisok: F oralisan 30 mg/m2 naponta + C 200 mg/m2 naponta, 1-5 napig, 28 naponként 6 ciklusban. Az eredmények meggyőzőek: ORR: 80%, CR 53%.
Csökkentett dózisú FC kezelések.
A standard dózisú FC kezelést gyakran haematológiai és nem-haematológiai toxicitás kiséri, különösen idős korban. Ezért redukálták a dózisokat.
FC lite: orálisan ajánlott idős betegeknek (>70 év). Dózisok: Ebben az ajánlásban orális F-t 25 mg/m2/nap dózisban (maximálisan 40 mg-ot) + 120 mg/m2/nap C-t (maximálisan 200 mg-ot) ambulans kezelésként 1-4 napig 28 naponként, összesen 4 alkalommal javasolnak. Eredmények: Az ORR 96%, a CR: 46%, 24 hónapig követve a median EFS 16 hónap volt. A nem-haematológiai toxicitás enyhe, a myelotoxicitás 31% lett. Hasznos kezelés slow-go betegek részére.
Immunokemoterápia
Új irányt adott a kezelésnek és szignifikáns változást hozott a CLL kezelésében a monoclonalis antitestek bevezetése az utóbbi 10 évben. CLL-ben a rituximab (R), a lymphocyták CD 20 felszíni antigénje ellen kifejlesztett, rekombináns, egérből származó, de nagyrészt humanizált, I. generációs monoclonalis antitest került elsőként alkalmazásra. Hatásmehcinzmusa: 1. fokozza az antitest dependens celluláris citotoxicitást a granulocyták, makrophagok, NK sejtek FC-receptoraihoz kötődve 2. Fokozza a complement dependens citotoxicitást, a C1q aktivációt, a keringő B sejtek cytolysisét okozva (a klasszikus komplementaktivációs úton) 3. Fokozza az apoptosist a caspase - 3, 8, 9 - proteázok aktiválásával, és az antiapoptotikus proteinek csökkentésével (Bcl-2 és BcI-xl,), 4. Gátolja a sejtproliferációt, 5. Érzékenyíti a sejteket citosztatikumokkal szemben.
A R monoterápiában CLL-ben csak nagy dózisban alkalmazva hatékony, 100-1500 mg/m2 43%, 2250 mg/m2 75%-os ORR-t okoz, esetleg mentő kezelésként javasolható. A R kombinációja citosztatikumokkal nagyon eredményesnek bizonyult.
RF
A C kihagyása a kezelési sémából csökkenti a kombinált kezelés myelotoxicitását. Dózisok: F:25 mg/m2 1-5 napig, R: kezdő adag: 375 mg/m2, további adagoknál 500 mg/m2 az 1. nap.
28 naponként 6 ciklus javasolt. Eredmények: RR: 90%, CR: 47%. Jól alkalmazható kezelés első vonalban.
R - FC
Hatásmechanizmus: a R fokozza a fludarabine és a cyclophosphamid cytotoxicitását, és "down regulája" a Bcl-2 protein expresszióját, ezzel fokozódik az apoptózis.
Az R-FC vs FC kombinált kezelés hatását a GCLLSG CLL-8 nevű randomizált, kontrollált, nagy beteganyagon végzett klinikai vizsgálatban hasonlították össze.
Dózisok: R 1. ciklusban 375 mg/m2, 2-6 ciklusban 500 mg/m2 nap, F: 25 mg/m2 1-3 napig + C:250 mg/m2 1-3 napig, 28 naponta 6 cilkusban. A csak FC-t tartalmazó karban a dózisok: F: 25 mg/m2 1-3 napig + C:250 mg/m2 1-3 napig 28 naponta 6 ciklusban. Eredmények: Az R-FC kezelés az FC kezeléshez viszonyítva szignifikánsan (p< 0.0001) megemelte az általános válaszarányt (ORR: 95% vs. 85%), a komplett remissziót (CR: 45% vs 23%) és a PFS-t 3 év után ( 65% vs. 45%). Ez az első vizsgálat, amelynél az R-FC kombinált kezelés az általános túlélést is (OS) szignifikánsan megnyújtotta, az eddig legeredményesebbnek tartott FC kezeléssel szemben. Az OS különbsége 3 év után vált mérhetővé az R-FC karban is. Az OS 87,2%, az FC karban 82,5% volt (p= 0,012). A halál kockázatát az R-FC kezelés 36%-al csökkentette az FC karhoz viszonyítva, HR 0.64; 95% CI [0.41; 1.00], p = 0.0487, Wald test). A kezelésmentes időszak pedig több mint 5 évre megnyúlt. (II,A) (15).
Mellékhatások: az R-FC karban az FC-hez viszonyítva signifikánsan több 3. és 4. fokozatú neutropenia (34% vs 21%) leukocytopenia (24 vs 12%) fordult elő, de a súlyos infekciók száma nem nőtt. Az R-FC karban a beadott ciklusok számának átlaga 5,2, az FC karban 4,8 volt. Az R-FC karban 26%, az FC karban 34% nem kapta meg a tervezett 6 kezelést. Erős immunosuppresszív hatás miatt HSV, VZV és Pneumocystis jiroveci ellenes profilaxis javasolt: trimethoprim-sulfametoxazol másnaponta 2x1 tabl., acyclovir naponta 2x400 mg, a kockázati csoportokban (>65 é, steroid, másodvonalas kezelés, neutropenia, CD4: < 50/ul) a kezelés után 6 hónapig. Myeloszupresszív hatás miatt elhúzódó csontvelői alpasia is észlelhető.
A CLL-8 vizsgálat eredményeinek következtében a CLL kezelésben paradigmaváltás történt.
A go-go állapotú betegek esetén törekedni lehet és kell komplett remisszió (CR) elérésére, mivel az első vonalban adott immunokemoterápia megnyújtja a fizikálisan fitt betegek ORR-t, a CRR-t, a PFS-t és túlélését is. (II,A).
Az FDA és az EMEA 2009-ben regisztrálta a rituximabot kemoterápiával kombinálva a CLL első vonalbeli kezelésére. Új standard kezelési ajánlás lett az R-FC kombináció go-go betegek első vonalbeli kezelésére. Hazánkban 2010-től az OEP az R plusz kemoterápia kombinációk közül csak az R-FC kezelést finanaszírozza első vonalban, jó általános állapotú (go-go) betegek számára, mint a legeredményesebb első vonalbeli kezelést. Ez azonban nem tesz lehetővé az "egyes betegre adaptált" kezelést, mivel az R-FC nem adható minden CLL-es betegnek. Ezért kívánatos lenne, hogy a R-t más citosztatikummal is lehessen kombinálni, finanszírozott formában, és ezzel a CR-s arány az R-FC kombinációra alkalmatlan betegekben is jelentősen fokozódna, mely egyenesen arányos a PFS-al és hosszú távon a túléléssel is.
Az is bebizonyosodott egy korábbi vizsgálatban, hogy akiknél sikerült MRD- negatív CR-t elérni, akkor a betegek túlélése szignifikánsan megnyúlt, az MRD- pozitív betegekhez képest (19). Kérdés azonban, hogy az MRD negatív status megtartására elérhető lesz-e elviselhető mellékhatásokkal járó kezelés. Több vizsgálat folyik fenntartó kezelés értékelésére pl. R-al, almtuzumab-al (A), az előbbinél lényegesen kevesebb mellékhatással.
Biztató adat, hogy egy korábban befejeződött, nem kontrollált, de nagy betegszámot (300 beteg) magában foglaló vizsgálat 62 hónapos utánkövetési adatai azt mutatják, hogy az R-FC kezelés hatására 72%-ban CR-ba került betegek progresszióig eltelt időtartamának mediánja 80 hónap (6,6 év) volt, azaz ilyen hosszú ideig nem szorultak antileukemiás kezelésre, az első vonalban R-FC adásában részesült betegek.
A del17p-vel rendelkező betegknél az FC kezelés, és az R-FC kezelés után a PFS rövid marad, ezért nekik első kezelésként az allogén transzplantációt kell felajánlani, de csak klinikai vizsgálat keretében (III,B).
R-FC-Lite
Idősebb betegek rosszul tolerálják az immunokemoterápiát. A neutropenia csökkentése céljából redukálták a F és C dózisait és az eredményesség megtartására emelték a R dózisát, mely az első infúziótól eltekintve szövődménymentesen adható. Az első R adása előtt minden beteget előkezeltek 25 mg oralis diphenhydraminnal 650 mg oralis acetaminophennel, és 10 mg orális dexamethasonnal. Dózisok: F:20 mg/m2 + C:150 mg/m2 1-3 napig 4 hetente, R: 500 mg/m2 az 1. és a 14. napon 4 hetente, 6 ciklusban. Fenntartó kezelésnek szintén R: 500mg/m adagot adtak 3 havonta, progresszióig. Eredmények: CR: 70%, OR: 95% Toxicitás: 3/4 neutropenia a ciklusok 52%-ban alakult ki. A del17p esetében egyik beteg sem került CR-ba és mind CLL-el kapcsolatos komplikációban halt meg (12).
Orális FC + iv Rituximab kezelés > 65 éves betegeknek különböző sémák szerint.
A cytostatikumokat csökkentett dózisban és oralisan (po) adják az iv. R-kezeléssel kombinálva, idősebb betegeknek. Ausztrál-ázsiai Leukemia és Lymphoma munkacsoport klinikai vizsgálata 3 - féle kezelést hasonlított össze: 1. FR5, 2. FCR3, 3. FCR5 séma szerint. Dózisok: FR5: F 24 mg/m2 /nap p.o. 1-5 napig + R 375 mg/m2 az 1. ciklusban, utána 500 mg/m2 a 2-6 ciklusban i.v. az 1. nap, 28 naponta, összesen 6x. FCR3: F 24 mg/m2 /nap po és C: 150 mg/m2 1-3 napig po+ R iv 1. nap. FCR5: F 24 mg/m2 /nap po 1-5 napig po és C: 150 mg/m2 1-5 napig po+ R iv 1. nap, mindegyik sémát 6 ciklusban 28 naponként. Toxicitás esetén a következő kezelést 2 héttel elhalasztották. Jelenleg csak interim analízis áll rendelkezésre, eszerint 6 ciklus után a következő átlagos eredményeket kapták: CR: 19%, PR: 28% SD: 3% volt. A betegek a kezelést jól tolerálták.
R-FCM
Az FCM (R-FC+ mitoxantron 10 mg az 1. napi i.v.) kombinációt először relapsusba került/refrakter CLL-ben próbálták ki, jó eredménnyel. Ezt a sémát egészítették ki R-al és elsővonalbeli kezelésként adták 72 CLL-es betegnek. Dózisok: Azoknak a betegeknek, akik válaszoltak a kezelésre, fenntartó R-ot adtak, 3 havonta 375 mg/m2 dózisban, 2 évig. Eredmények: Mint legfontosabb mutatók, a CR: 82%, MRD- CR 46% voltak. Az OR,- MRD-CR, -MRD+ CR, ill- PR: 93, - 46, - 36 - ill. 11 %-ban alakult ki. Az alacsonyabb válaszarányok a B2M-szinttel, a del17p-el, és előrehaladott klinikai stádiummal korreláltak. A toxicitás elfogadható. Kontrolált vizsgálat indítására alkalmasak az eredmények (1).
FC-kezelésre nem alkalmasak a következő betegek: FC-refrakter állapot; AIHA (DAT+); többszörös opportunista infekciók; veseelégtelenség; No-go (unfit) betegek.
Ezeknek a betegeknek R + más kemoterápiás kombinációk igéretesnek látszanak.
R - CLB
Idősebb betegek részére, akik az R-FC kezelésre nem alkalmasak, a F-t mellékhatásai miatt. CLL208 vizsgálat. Idős, medián 70 éves életkorú (a mindennapi gyakorlataban észlelt beteganyagot reprezentáló), 100 betegen történt a vizsgálat, 12 angol központban. Dózisok: R: 375mg/m2 az 1 ciklusban, 500mg/m2 a 2-6 ciklusban, CLB: 10mg/m2/nap 1-7 napig, 28 naponként, 6x ismételve. Eredmények: ORR:82%, CR:9%. Mellékhatások 37%-ban fordultak elő, főleg hányinger, anaemia és myelotoxicitás formájában. Ezen belül a neutropenia (39%) és a thrombocytopenia volt a leggyakoribb. A betegek 37%-nál volt súlyos mellékhatás. Leggyakrabban myelotoxicitás: lázas neutropenia, neutropeniás szepszis (5 ill. 4 betegnél) és thrombocytopenia fordult elő. Az eredmények megfelelőek, az életkorhoz képest viszonylag kevés mellékhatással. Alemtuzumab (MabCampath, CAM, A). Rekombináns, teljesen humanizált IgG1 altípusú monoclonalis antitest, mely közel minden, normális és kóros T és a B-lymphocyta, monocyta, macrophag és eosinophil sejt CD52 antigénjéhez kötődik. A CD34+ őssejten nem expresszálódik ez a felszíni antigén, mely fontos az őssejttranszplantácó szempontjából. Hatását mind antitest-dependens, sejt - közvetített, mind pedig complement-dependens cytotoxicitással és a caspase-independes apoptózis fokozásával fejti ki. Első regisztrációja graft versus host betegség kivédésére és a graft rejekciójának meggátlására szólt, allogén őssejttranszplantációnál. A kezelés megkezdésekor fokozatos dózisemelés javasolt 3-10-30 mg adagra, az alkalmazási előírás szerint.
2001-től törzskönyvezte az FDA és az EMEA olyan CLL-es betegeknek, akiket alkiláló szerrel már kezeltek és a fludarabin kezelés is hatástalan volt, a következő megfogalmazással: "A MabCampath chronikus B-sejtes lymphocytás leukaemia (B-CLL) kezelésére javallt azoknak a betegeknek, akiknél fludarabin kombinációs kemoterápia nem megfelelő".
2007-ben regisztrálta, a korábbival azonos szöveggel az A-t első vonalban is az FDA, majd 2008-ban az EMEA, a CAM307 klinikai vizsgálat pozitív eredményei alapján. Ez a vizsgálat bizonyította, hogy az A első vonalbeli kezelésben a CLB-al összehasonlítva szignifikánsan jobb hatást fejt ki (17) ld. részletesen később.
Ma tehát az A indikált CLL-ben fludarabinra primeren vagy másodlagosan refrakter állapotokban (klinikai vizsgálatok szerint ilyen betegek kezelésére az A sokkal hatékonyabb, mint a kombinált kemo -, illetve más immunokemoterápia), nagy rizikójú, jó általános állapotú betegeknél; a nagy progressziós készséggel járó rosszindulatú cytogenetikai abnormalitással rendelkezőknél (del17p, ill. del 11q); olyan betegeknél, akiknek fludarabin nem adható, pl. kóros vesefunkció, vagy az alapbetegséghez társuló autoimmun cytopenia miatt; allogén őssejt-transzplantációnál preparatív kezelésként és in vivo purging céljára; T-sejtes malignomákban (mint pl. a T-sejtes prolymphocytás leukaemia, periferiás T-sejtes lymphoma).
Alemtuzumab monoterápia
Az A hatását CLB -al hasonlították össze a CAM307 fázis III vizsgálatban. Dózisok: A kezelés megkezdésénél dóziseszkaláció szükséges, 3-10-30 - mg i.v. infúzióban egymás utáni napokon. A kezelés megkezdése cytokin felaszbadulással jár, melyeket s.c. adással és előkezeléssel csökkenteni lehet. Ez után heti 3x30 mg az ajánlott dózis, max. 12 hétig. Szingifikánsan (p<0,0001) magasabb ORR-t (83 vs. 56%), CR-t (24 vs. 2%) és PFS-t értek el 24,5 hónap után A-al, mint CLB-al. A halál rizikóját 42%-al csökkentette. Mellékhatásként 3-as vagy 4-es fokú neutropenia (42%-ban, thrombocytopenia 18%-ban alakult ki. A lázas neutropenia azonban csak 5%-ban lépett fel az alemtuzumab karban és 3%-ban a CLB karban. Infekciós esetmények, 3. és 4. fokú, 16%-ban fordultak elő. A CMV reaktiváció 11% -ban jelentkezett.
A-al, az első, monoterápiában és sc módon adott klinikai vizsgálatot Lundin végezte 2002-ben. 18 hétig folytatva a kezelést. A korábbi második vonalbeli kezelésekhez képest magasabb ORR 81%-t, CR: 19%-t, és PR: 68%-t lehetett elérni, az iv. kezelésnél szokásos lényegesen kisebb "cytokin vihar" mellékhatással.
Bendamustin(B)
Alkiláló szer, mely benzimidazole gyűrűt tartalmaz. Kifejlesztése 30 évre tekint vissza, egyesíti a purin analógok és az alkiláló szerek tulajdonságait, jelenleg reneszánszát éli. Hatékony mind első, mind másodvonalbeli kezelésben. Nincs keresztrezisztenciája más alkiláló szerekkel. In vitro tartós DNS károsodást okoz, mely az apoptosis fokozásával és mitosisgátlással gyors sejthatált idéz elő. Az európai vizsgálatok aktívnak találták CLL-ben, más NHL-ban és myeloma multiplexben.
A legjelentősebb új gyógyszer monoterápiában, vagy méginkább kombinációban más gyógyszerekkel, elsősorban immuno-kemoterápiaként.
B vs. CLB
Kezeletlen CLL-es betegeken (n:319), randomizált fázis III (DCLLSG - által végzett) klinikai vizsgálatban. Dózisok: B:100 mg/m2, 1. és 2. napon, 4 hetente, maximálisan 6 ciklusban, CLB: 0.8 mg/kg az 1. és 15. napon 4 hetente maximálisan 6 ciklusban. Eredmények: az 54 hónapnál végzett kiértékelés szerint megnyújtotta az ORR-t (B: 68% CLB: 31%), a CR-t (B:31%, CLB:2%), a PFS-t (B:21.1, CLB:8,8 hónap) és a TTT-t (B:31,5, CLB:10,1 hónap). A különbség mind a négy paramétert illetően magasan szignikáns (P<0,0001) a B javára, jól tolerálható és kevés mellékhatásal. Ennek alapján az FDA 2008-ban, az EMA 2010-ben regisztrálta CLL kezelésére.
Mind a F-t, mind a B-t illetően a monoterápiaként való alkalmazás csak nem fitt beteg részére választható, mivel rendelkezésre állnak monoclonalis antitestek, amelyek mindkét gyógyszer hatékonyságát jelentősen fokozzák, viszonylag kevés mellékhatás mellett, ezek a kombinációk elsősorban go-go, esetleg slow-go betegek részére javasolt.
R - B
Hatékony első vonalbeli kezelés, 110 betegen végezte a DCLLSG. Dózisok: R: 375 mg/m2 az 1. ciklus 0. napján, 500 mg/m2 a 2-6 ciklusban 4 hetente, B: 90 mg/m2 az 1. és 2. napon, 6 ciklusban 4 hetente. Eredmények: ORR: 90%, CR:32,7%, nPR:2,7%, PR:55,5%, SD:9,1%. A kezelés mind go-go, mind slow-go betegek részére ajánlott.
A kezelések fertőzéses szövődményei.
CLL-ben az immunszupprimált állapot miatt (az ok az alapbetegség és/vagy a kezelés következménye), az infekciók gyakoriak.
A fertőzéseket minősíteni kell. Lehet "minor" (ezek csak oralis antibiotikus, és tüneti kezelést igényelnek), lehet "major" (hospitalizációt és szisztémás antimikróbás kezelést kell adni) és végül lehet "fatalis" (amikor a halál oka az infekció).
Az alkilálószerek elsőrban myelotoxicitást okoznak, főleg bakteriális infekciókra kell számítani (S. aureus, S. pneumoniae, H. influenzae, ritkábban E.coli, K. pneumoniae, P. aeruginosa). A steroiddal való együtt adás fokozza az infekciós készséget.
Infekcióprofilaxis nem szükséges, csak a HBV reaktiváció veszélyének kitettek számára szükséges lamivudin profilaxist kell alkalmazni.
A purin analog alapú kemoterápiák elsősorban immnosupressziv hatásúak, ezért jobban fokozzák az infekciók megjelenését, mint az alkilálók (RR: 1,83 [95% 1.30-2.58]). Az ott leírt bakterium fajtákon túlmenően, hajlamosítanak opportunista fertőzésekre is (Listeria monocytogenes, Nocardia spp, Mycobacteriumok, Cryptococcus neoformans, Pneumocystisjiroveci, Candida spp, Aspergillus spp, CMV). Rutinszerű profilaxist nem igényelnek. Azonban fertőzésekre való fokozott kockázatot jelentenek a következők: > 65 év, steroid kezelés társítása, másodvonalas kezelés, CD4 szám: < 50/ ul. Ilyen esetekben herpesvirus és Pneumocystis elleni profilaxis javasolt a kezelés alatt és utána még 6 hónapig (acyclovir és sulfamethoxasol/cotrimozasol a későbbiekben leírt dózisokban). Az első vonalban adott FC vs. F vizsgálat eredményei szerint infekciók 8,7%-ban jelentkeznek, mind az FC mind a F-karban. Előrehaladott stádiumokban és ha a beteg fludarabinra rezisztenssé válik, az infekicók kockázata nő.. Az alemtuzumab kezeléssel járó infekciókat és azok megelőzést, ill. kezelését lásd a második vonelbeli A kezelésénél.
Második vonalbeli kezelések
Az első vonalbeli kezelés ismételhető, ha a relapszus vagy a progresszió a kezdeti kezelés után legalább 12 hónappal, vagy immunokemoterápia után legalább 24 hónap elteltével következik be (III,B).
Immunokemoterápia R-FC kezeléssel második vonalban
A R hozzáadása kemoterápiához ebben a betegcsoportban is nagymértékben fokozza az ORR-t és a CRR-t is. A korábbi rituximab kezelés nem befolyásolta a kezelés kimenetelét.
REACH-GCLLSG vizsgálat.
Az első pivotalis, kontrollált, nemzetközi, randomizált multiklinikai vizsgálat, melyben relapszusba került, előrehaladott stádiumban levő, előzőleg egy kezelést kapott, F-ra és alkiláló szerre érzékeny, ECOG 0-1 állapotú CLL-es betegekben hasonlították össze az R-FC vs. FC kezelés hatását. Dózisok: A gyógyszeres kezelés azonos volt az első vonalban leírt R-FC ill. FC sémával.
Eredmények: Bebizonyosodott, hogy az R-FC kezelés lényegesen eredményesebb volt azt FC kezelésnél. Az általános válasz (ORR: 69.9% vs. 58%), a komplett remisszió (CR: 24% vs. 13%), a PFS mediánja a 2 éves kiértékelésnél: az R-FC karban 30,6 hónap, az FC karban 20,6 hónapnak bizonyult, a különbség 10 hónap, az R-FC kar javára, szignifikáns. Az általános túlélésre gyakorolt hatása (OS) még nem megítélhető (21).
Mellékhatások: a WHO 3/4 fokú mellékhatások mindkét karban közel egyformák voltak (R-FC: 65, ill. FC: 60%). A neutorpenia 42, ill.40%, a lázas neutropenia: 15, ill. 12%, a thrombocytopenia: 11, ill. 9%, a fertőzések: 17, ill. 19% volt az R-FC, ill. az FC karban. A két kar között az infekciók okozta mortalitás nem különbözött. A nagy rizikójú genetikai eltérések közül, a del11q és a nem mutált IGVH status, továbbá a Binet C stadium esetén is, az R-FC kezelés hatásos volt.
Az infekciók megelőzésére a kezelés alatt és annak befejezése után még 6 hónapig heti 3 alkalommal 2x1 tabl. trimethoprim sulfamethoxasole és acyclovir 2x400 mg javasolt.
Az R-FC kezelés eredményei alapján fogadta be az FDA és az EMEA a "R-t kemoterápiával kombinálva" a relabált CLL kezelésére. Hazánkban az R-FC kezelés ebben az indikációban még nem finanaszírozott.
A jó általános állaptú (go-go, ECOG 0,1) relapszusba került betegek kezelésére a R + kemoterápia standard kezeléssé vált.
R-FC-lite. lásd az első vonalbeli kezeléseknél. Második vonalban is hatékony.
R- Bendamustine
A bendamustine olyan kemoterápiás szer, mely az alkiláló szerek (mint a chlorambucil vagy cyclophosphamid) és a purin analógok (mint a fludarabin) tulajdonságait egyesíti. Fázis II klinikai vizsgálatot végeztek MabThera (500 mg/m2) plusz bendamustine alkalmazásával 62 betegben, akik relabált vagy refrakter CLL- ben szenvedtek. Az összesített válaszarány 77,4% volt, 14.5% komplett remisszióval. A haematológiai toxicitás csekély volt (leukocytopenia, neutropenia:12%, anaemia:6%) (11).
RF
A C kihagyása a sémából csökkenti a kombinált kezelés myelotoxicitását.
Dózisok: R: 375 mg/m2 4 hetente 4-szer; FL: 25 mg/m2 1-5 napig 4 hetente 4-szer.
Eredmények: RR: 90%, CR: 47%. A vizsgálat nem volt kontrollált.
FCD
Dóziok: FL: 25 mg/m2 1/2 órás infúzióban 1-3 napig; C: 350 mg/m2 infúzióban 1-3 napig; Dexamethasone: 20 mg/nap p.o. 1-3 napig.
Ismétlés: 4 hetente max. 6-szor. Eredmények: RR: 72%, CR: 32%.
CLB monoterápia: Másodvonalban ORR:29-39%, CR:0%. Cytoreduktív céllal, közepes dózisú CLB-al javasolt slow-go vagy no-go betegeknek.
F monoterápia: ORR: 35-51%, CR: 1-26%, TTP a CR-ba került betegeknél: 6-42 hónap, PR: 6-34 hónap, az eredmények elmaradnak az első vonalbeli kezeléstől. Ez a kezelés is csökkentett dózisban slow-go vagy no-go betegeknek javasolt, cytoreduktív céllal.
A relabált/refrakter CLL kezelése
Nehéz feladat és nem lehet minden betegre érvényes kezelési sémát ajánlani. Az alkiláló szerrel szemben rezisztens betegeknek még 46%-a reagál F-ra, a F- rezisztens betegeknek csak 7%-a reagál CLB-ra. Előkezelt CLL-ben nagyobb infekciós aránnyal kell számolni: Infekciók: 57%, ebből herpesvirus 26 %, gomba 7%.
Refrakter/rezisztens betegség kritériumai: purin analog kezelésre sem CR, sem PR nem alakul ki; purinanalog kezelés alatt vagy az azt követő PR/CR után 6 hónapon belül a betegség progrediál; őssejt-transzplantáció után a betegség progrediál vagy 12 hónapon belül relapszus következik be. Infekciók gyakorisága: 88%, a túlélést hónapokban lehet mérni.
Kettős refrakter beteg: aki sem F-ra, sem A-ra nem reagál. A betegek túlélése nagyon rövid, átlagban 9 hónap.
Mivel ezeket a kezeléseket általában idősebb és rosszabb általános állapotú betegeknél kell adni, a kísérőbetegségeket, a betegség stádiumát és a CLL rizikófaktorait fokozottan kell figyelembe venni.
FCM
Az FC kombináció hatását relapsusba került vagy rezisztens betegeken M-al kívánták fokozni. Dózisok: F: 25mg/m2 1-3 napig, C: 200 mg/m2 1-3 nap, M: 6 mg/m2 az 1. napon, mindhárom i.v. infúzióban, 4 hetente, 6 alkalommal. Eredmények: ORR: 76% CR: 50% (10/60 beteg, 17% MRD - negatívvá vált), PR-t 28% ért el. Az MRD-negatív betegek túlélése 4 évig követve, szignifikánsan megnyúlt az MRD pozitívokhoz képest. A válasz medián időtartama 19 hónap, amely viszont hasonló a más fludarabine kombinációkkal elért eredményekhez. Meg kell említeni, hogy az FCM séma mellett a myelotoxicitás fokozódott. Neutropenia, infekciók (8%), hányinger, hányás voltak a fő mellékhatások. A kezeléssel kapcsolatos mortalitás 5% volt.
További próbálkozások fludarabinnal kombinált kezelésekre a következő fázis II klinikai vizsgálatokban történtek: pl. fludarabine + Doxorubicin (Robertson et al 1995), Fludarabibe + epirubicin (Rummel et al 1999), ez a két kombinált kezelés myelotoxicus. Fludarabine + Mitoxantrone + Dexamethasone (McLaughlin et al, 1996), nem jobbak az eredmények, mint F-al önmagában, rutinszrű második vonalbeli kezelésre nem ajánlottak. Kiderült, hogy a kemoterápiák további kombinációjától nem várható átütő siker, ezért a kezelés más útjait kellett keresni.
R+HDMP
Fludarabine refrakter, Rai III-IV. St.-ú betegeket kezeltek ezzel a sémával. Dózisok: MP 1g/m2/nap 1-5 napig i.v; R: 375 mg/m2 az első ciklusban az 1, 3, 5, 8 és 22. napon, a 2. és 3. ciklusban az 1, 7, 14 és 21. napon, 4 hetente ismételve. Eredmények: ORR: 93%, CR: 36%, TTP: 15 hónap, medián TTT: 22 hónap. A medián túlélést nem érték el 40 hónap után sem. A protokollt a betegek jól tolerálták, nem volt 3-4 súlyossági fokozatú infekció.
R+ CHOP
34 fludarabine-refracter beteget vontak be a vizsgálatba (autoimmun haemolyticus anaemia, Richter-transformáció jelenléte). Az ORR: 70% (0% CR) volt. A gyakoribb mellékhatások: myelosupresszió hányinger, infekciók voltak. 4 esetben fordult elő grade 3-4 infekció. A válasz időtartama még nem ismert. Megjegyzés: A nagy válaszarány a súlyos, CLL-hez köthető betegségek ellenére bíztató, a fludarabine-refrakteritás ismeretében ez az eredmény elfogadható.
Ismételt R-FC kezelés
Relapszusba került, refrakter betegeknek. Köztük voltak olyanok, aki korábban R-FC kezelésben részesültek. Eredmény: ORR 74% CR 30%, részleges csontvelői válasz (nPR) 14% és PR 30%-ban alakult ki. A progresszióig eltelt idő medián értéke 31,8 hónap volt. A kezelést követő leggyakoribb hematológiai toxicitás a 3-as, ill. 4-es WHO fokozatú neutropénia, amely a kezelési ciklusok 22%, ill. 34%-ához társult. A korábbi rituximab kezelés nem befolyásolta a kezelés kimenetelét. Kivételt képeznek a 17p-al rendelkező betegek, akik nem kerültek CR-ba, a nPR-t elérő betegek aránya is elmaradt a komplex cytogenetikai eltéréssel rendelkezőktől
(5% vs. 27%).
Alemtuzumab (A) második vonalban A-monoterápia
A pivotális vizsgálatot F-ra rezisztens/refrakter betegnél (n:93), Keating M végezte 2002-ben (18). Az ORR: 33%, CR: 2% volt. A válasz tartama: 4,7 hónap, a reszpondereknél 9,5 hónap. A medián OS a kezelésre válaszoló betegeknél 32 hónap, az összes betegre vonatkozóan 16 hónap volt, mely ebben a beteganyagban a korábbi kezelésekhez képest előrehaladást jelentett. Más klinikai vizsgálatok sem hoztak jobb eredményt. Ismeretes, hogy a F-ra refrakter esetekben az infekciós arány nagyon magas: 50-89%, a várható túlélés kedvezőtlen: 10 hónap, a P53 mutáció nagyon gyakori: 40-50%. A F rezisztencia kialakulása után 4 hónappal a betegek 89%-ának kórházi kezelést igénylő infekciója van.
A kezelés eredményét negatívan befolyásolja a nagy nyirokcsomók jelenléte (átmérő > 5 cm), a rossz általános állapot (ECOG > 2), ha a betegek > 3 előző kezelésben részesültek.
Az A hatékonysága csökkenő arányban: legjobban hatékony a vérben, a csontvelőben, a nyirokcsomókban és a lépben. Mellékhatások: A kezelés megkezdésénél dóziseszkaláció szükséges, 3-10-30 mg i.v. infúzióval egymás utáni napokon. A kezelés megkezdése cytokin felaszbadulással jár, melyeket s.c. adással és előkezeléssel csökkenteni lehet. Ez után heti 3x30 mg az ajánlott dózis. Immunosupresszív hatása miatt az infekciós készség fokozódik, maximuma a kezelés 4-8 hete között a legkifejezettebb. Klasszikus baktériumok (S. aureus, S. pneumoniae, H. influenzae E.coli, K. pneumoniae, P. aeruginosa) és opportunista kórokozók (Listeria monocytogenes, Nocardia spp, Mycobacteriumok), továbbá gombák (Candida spp, Aspergillus spp) és vírusok (HSV, VZV, CMV) által okozott infekciók várhatók.
A magyar lakosság kb. 70%-a CMV-vel átfertőződött. A CMVreaktiváció a kezelés alatt (10-30%), ezért azt monitorozni kell (early antigén és/vagy PCR). A diagnosztikus aktivitás fenntartása mellett valganciklovír profilaxist is adható, 2x450 mg adagban két hónapig. Ebben az esetben számítani kell neutropenia kialakulásának veszélyére és valganciklovír profilaxist kell adni 2x450 mg formájában két hónapig. Ha a monitorozás emelkedő pp65 antigenaemia titert (early antigén értékelhető, ha a fvs szám 0,5x109) mutat és klinikai jelei vannak a fertőzésnek, ganciklovirral kell kezelni a beteget, 2x5 mg/kg napi dózisban, 14-21 napig, ill. amíg a klinikai tünetek el nem múlnak, ill. két egymás utáni negatív CMV leletig. Ha csak a titer emelkedik, de nincsenek klinikiai tünetek, preemptiv kezelésként ganciklovirt kell adni a fenti dózisban 7-14 napig, de az A- kezelést folytatni lehet.
Ha a laboratóriumi lelet negatív, de infekcióra utaló klinikai tünetek vannak, más kórokozókra is kell gondolni. Ha egyéb infekció nem bizonyítható, és a tünetek fennmaradnak, a fentiek szerint empirikus CMV ellenes kezelést kell alkalmazni. Amíg a tünetek el nem múlnak az A kezelést folytatni lehet. Az A terápia megszakítása akkor indokolt, ha az antivirális kezelés ellenére a tünetek/markerek perzisztálnak. Negaív lelet birtokában és tünetmentes állapotban folytatni kell az A kezelést (20). A pneumocystis carini fertőzés kivédésére antibiotikum profilaxis (másnaponta napi 2x1 tabl. trimethoprim/sulfamethoxasole) HSV,VZV ellen antiviralis profilaxis (napi 2x400 mg acyclovir) szükséges. HBV reaktiváció veszélye esetén lamivudin adása szükséges. Antifungális prophylaxis rutinszerűen nem javasolt.
A profilaxist a kezelés egész tartama alatt és még utána 6 hónapigt kell adni, ill. addig, amíg a CD4+ lympocyták száma nem lesz >400 A transzfúzióhoz kapcsolódó graft versus host betegség kivédésére az A-al kezelt betegek csak választott és besugárzott vérkészítményeket kaphatnak.
Többedik kezelésként adva a mellékhatások szignifikánsan emelkednek.
Alemtuzumab Fludarabinnalkombinációban (FluCam) vs. Fludarabin, relapsusba került, /refrakter CLL -ben. Dózisok: A: 335 betegen végzett fázis III vizsgálat eredménye szerint a F+A kombináció hatékonyabb, mint a monoterápiában adott F. A median PFS a F+A vs F karban szignifikánsan hosszabb volt (23,8 vs. 18,1 hónap). Különösen nagy volt a különbség ezen belül a Rai III/IV st.-ú betegeknél (26,1 vs. 12,1 hónap), úgyszintén az OR, a CR és a PR magasabb volt a F+A karban vs. a F-karban (84,8 vs. 68% , a CR ( 30,4 vs. 16,8%), PR (54,4 vs. 51,6%). Az összes infekció nem különbözött szignifikánsan a két kar között (47,8 vs 35,2%), a leukopenia a FluCam karban magasabb volt (73.8% vs 32.7%). Nem volt lényeges különbség a neutropenia, a thrombocytopenia, az anaemia, a súlyos mellékhatások (33 vs 26%) és az infekciók tekintetében, az ajánlott antibacterialis, antivirális profilaxis és CMV reaktiváció monitorizálás mellett történő idejekorán megkedett kezelés mellett. A FluCam karban nem növekszik a halálozás az F-karhoz képest. Ez a kombináció ajánlható relapsusba került előrehaladott állapotú betegeknek is (9).
Mentő kezelések
Nagy dózisú methylprednisolon (HDPM)
A kemoterápiára resistenssé vált betegeken. Dózis: MP 1g/m2/nap 1-5 napig i.v./4 hét. Eredmények: RR:77%, mely átlagosan 12 hónapig tart. Aki a kezelés után relapsusba kerül, ismét reagálhat ugyan erre a kezelésre.
CFAR
Mentő kezelésként adták előrehaladott stádiumú, nagy citogenetikai rizikójú relabált és rezisztens 80 betegnek. Dózisok: C:250 mg/m2 3-5 napig, F:25mg/m2 3-5 napig; A: i.v. az 1.3. és 5 napon minden héten 30 mg; R: 375 mg/m2 az 1. cikusban, majd 500 mg/m2 a 2. ciklusban, mindig a 2. napon. Maximum 6 ciklus ajálott, 4 hetente. Filgrastim adása szükséges továbbá infekció profilaxisként trimethoprim/sulphamethoxazole másnaponta 2x1, és valgancyclovir a kezelés alatt. Eredmények: ORR: 67%, CR:27%, TTF: 10,6 hónap, OS:16,6 hónap. A del17p/complex genetikai eltéréssel rendelkező 22 betegnél az ORR: 41%, a CR: csak 9%, OS: 10 hónap volt.
Őssejttranszplantáció (HSCT)
CLL-ben is törekvés van az utóbbi években kuratív terápiára, ezért az autolog és az allogén HSCT egyre jobban az érdeklődés középpontjába kerül.
Az autolog HSCT esetén teljes test besugárzás és cyclophosphamid kondícionálás után a relapszusok folyamatosak 10 éven át, a PFS 6 évnél 30%. A túlélési görbében nincs plateau. Két nagy, nem kontrollált, a túlélést a vizsgáló tanulmányban (MRC és GCLLSC CLL3) azt találták, hogy 5 év után is folyamatosak a relapszusok, bár a PFS a két vizsgálatban 54 illetve 59 hónap volt. Az eredmények nem jobbak, mint az effektív, purin analog kombinációval történő nem-transzplantációs kezelésekkel. Tehát a betegséget ezzel az intenzív beavatkozással nem lehet eradikálni. Bár a PFS-t az alkilálók és a F átlal okozott MDS illetve AML-be történő transzformációk nem rövidítik, az autolog HSCT ma már kevéssé javasolható beavatkozás (III,B).
Allogén HSCT. Az allogén HSCT az egyetlen kuratív kezelés. CLL-ben. A konvencionális kezeléssel szemben a HSCT hosszú betegségkontrollt jelent olyan betegek számára, akik nagy rizikójú csoportba tartoznak és 55 évnél fiatalabbak. Ilyenek az EBMT CLL Transplant Consensus szerint a következők:
1. Akik nem reagálnak purin analog tartalmú kezelésre, vagy az után 12 hónapon belül relabálnak.
2. Akik kombinált purin analog terápia vagy hasonló hatékonyságú kezelés (pl. autolog HSCT) után 24 hónapon belül relapsusba kerülnek.
3. Akiknek p53 deléciójuk/mutációjuk (del 17p13) van és kezelést igényelnek.
CLL-ben a legfontosabb terápiás hatás a "graft-versus leukaemia" (GvL) effektus. A rossz prognózisú betegeknél is hosszas klinikai remissziót lehet elérni allogén HSCT-vel, mivel a TP53 mutáció és a 17p deletio elveszti terápia rezisztenciát okozó hatását (a GCLLSC CLL3X vizsgálat szerint). A relapsusok incidenciája évek után csökken. Ez támasztja alá az a tényt, hogy a beavatkozás hatékonysága arányos a betegnél kialakult krónikus GvHD-vel, ezért a T-sejt depléció fokozza a relapszusokat és a donor lymphocyta transzfúzió (DLI) ezek ellen hatékony. A transzplantációk kb. 2/3-a csökkentett dózisú kondicionálással történik (RIC). A HLA indentikus HSCT mortalitása jelentősen csökkent és független a donor típusától és a kondícionáló kezeléstől. Ezért a MUD-HSCT a tesvérdonor transzplantációhoz hasonlóan standard beavakozásnak számít nagy rizikójú CLL-ben. Az 5 éves EFS és
OS 30-70% között mozog a prospektív, RIC kondícionálással és kontrollált T-sejt visszadással kiegészített tanulmányok eredményei szerint. Az idegen donoros (MUD), ill. az alternatív őssejt-HSCT eredményei között sincs jelentős különbség. A teljes gyógyulás a nagy rizikójú betegek 1/3-2/3 részére biztosított. Az 5 éves túlélés RIC-el 63%, a teljes dózisú kondicionálással 18%. A betegek idős átlagos életkora miatt a haploidentikus transzplantációval és a köldökvér HST-val nincs még elég tapasztalat (13, 6).
Új gyógyszerek
A terápiában új hatásmechanizmusú gyógyszerek és gyógyszer-kombinációk kerültek bevezetésre, melyek lehetővé teszik a nagyobb mértékben rizikó adaptált és egyénre szabott kezelést.
Új monoclonalis antitestek (MoAb)
Ofatumomab (O): új CD20 ellenes, teljesen humán MoAb, mely egy kicsi és egy nagy hurokból áll. A kisebb, a CD20 antigén sejtmembran közeli epitopjához kötődik, ez nem különbözik a rituximab kötődési helyétől és hatékonyabbá teszi az antitestet. Fokozottan köti a C1q-t és ezért sokkal erélyesebb komplement-dependens cytotoxicitással rendelkezik, mint a rituximab. F-ra és alemtuzumabra refakter/relabált és "bulky" FR 79 betegeknél fázis I/II vizsgálatban 47, ill. 58%-os ORR-t ért el, előzőleg már R-al kezelt betegeken. Jelenleg nyílt, fázis III, randomizált vizsgálat folyik, relabált/rezisztens CLL-es betegekben, melyben az O+FC hatását az FC-vel hasonlítják össze. Az O-ot, 500, ill. 1000 mg-os két dózisban is vizsgálják. ORR: 77% az O-FC 500 mg, vs. 73% az O-FC 1000 mg-os karban, a CR 32% vs 50% az O-FC 500 mg vs. O-FC 1000-os kaban -os karban. A 3-as és 4-es fokozatú mellékhatások gyakoribbak a nagyobb O dózisnál. Neutropenia (35 vs, 60%), thrombocytopenia (6 vs. 23%), anaemia (6 vs 20%) és az infekciók (13 vs. 23%) nagyobbak voltak az O-FC 500 mg vs. O-FC 1000 mg karban. Az O monoterápiában, a R-hoz hasonlóan jól tolerálható kezelés, 1-es és 2-es fokozatú infúziós reakciókat és infekciós készséget okoz. Vizsgálják az O+L kombinált kezelést is ugyanebben a betegcsoportban.
GA101
Új, genetkailag tervezett, II típusú, glycosisált, igen hatékony CD20 ellenes MoAb. Monoterápiában és kombinációban is vizsgálják R-al, B-al, F-al, CLB-al és az ABT-737-el (Bcl-2 inhibitor). Direkt sejthalált vált ki, ezen kívül az FcvRIIIa -hoz való fokozott kötődési készsége miatt fokozza mind a cellularis, mint a komplement mediálta cyctotoxicytást. Monotherapiában is hatékony, de kombinált citosztatikus protokollokhoz adva az eddig használt MoAb-hoz képest jelentősebben fokozza azok tumor-ellenes hatását. Ezt vizsgálja a GCLLSG a CLL11 elnevezésű, három karú klinikai vizsgálat, melyben összehasonlítják a CLB, az R-CLB és a GA-CLB plusz Bcl2- inhibitorok (ABT-737, ABT-263) együttes hatását.
Lumiliximab
A CD23 transmembran glycoprortein ellen termelt genetikailag tervezett MoAb. Human IgG1 konstans és majom (macacus) variabilis regiója van. A nyirokcsomók nagyságát a betegek 52%-ban és az abszolut lymphocyta számot a betegek 91%-ban csökkentette. Mellékhatások: fejfájás, obstipáció, 3. és 4. fokozatú neutropénia, dyspnoe. R-FC-vel való kombinációban vizsgálják tovább. Mind a R, mind a F mediált apoptosist fokozza. Az R-FC protokollhoz hozzáadva, növeli a CR-k arányát.
R-lenalidomid (L)
Indikáció: purin analog kezelés után relabált/refracter, előrehaladott stádiumú (kb.50% Rai III-IV st.-ban volt, PS: 0-2), előkezelt betegek, legalább két előző protokollt kaptak (1-9). Egykarú, Fázis II vizsgálat. Végpontok: válaszarányok, biztonságosság, T-sejt szám és funkció. A L immunmoduláló hatásától remélik a CLL-es betegek immunfunkcióinak javulását. Aktiválja a B-sejteket (NF-kB-gént) és számos antigént "up-regulál": CD80, CD86, CD154 (mely a CLL-es sejtek immundefektusát hivatott helyrehozni). Cytokin relase-t is okoz. Dózisok: L: 10 mg/nap folyamatosan, az 1. ciklus 9. napján kezdve naponta 1-szer, 12 ciklusig. R: 375 mg/m2 az 1. 28 napos ciklusban az 1, 8, 15 és a 22. napon, majd a 3-12 ciklusban mindig csak az 1. napon. Az R-L kombináció aktiv, relapsusba került CLL-ben. Eredmények 6 ciklus után: OR 68%, PR: 51%, nPR: 16%. Magasabb a válaszarány és gyorsabb a hatás, mint lenalidomide monotherápiával. A R csökkenti a lenalidomide-asszociált "tumor flair" szindromát 25%-ra (fájdalmas, gyulladt megnövekedett nyirokcsomók, leukocytosis, arcpír), FUO-t 18%-ban, tumor szétesési reakciót csak 5%-ban észleletek, thrombosist kb.20%-ban okozott. A leggyakoribb haematológiai toxicitás a myelosupresszió, a neutropenia: 31%, a thrombocytopenia: 5% de az anaemia csak 1% alatti volt. Nem haematológiai toxicitás: WHO Gr. 3/4 fáradtság: 27%, láz: 18% volt. Jó hatékonyság kevés mellékhatással (10).
Oblimersen
A bcl-2 mRNA-szintet és a Bcl-2 protein -t is csökkentő "antisense" gyógyszer. 2007-től vizsgálják előzőleg F-al kezelt, relapszusba került vagy refrakter CLL-ben. Az FC + Oblimersen -t összehasonlították FC-vel, 241 betegen. Az ORR-t 7 ről 17%-ra, (p=0.025) a CR-t 2-ről 9%-ra emelte (p=0.03). A hatás tartós volt és megnyújtotta a TTP-t és a túlélést is (p<0.0001). Mellékhatások: thrombocytopenia, tumor-lízis szindroma. Az infekciók nem különböztek a két kar között. Más gyógyszerekkel való kombincióját is tanulmányozzák.
Flavopiridol
Szintetikus flavone, mely gátolja a ciklin-dependens kinázokat, az RNA polymerase II foszforilációját, az Mcl-1-t downregulálja, P53 +, caspase independens apoptosist indukál
(4-hr LC50 = 1.15 mM). Ezért hatékony a P53 génműködés zavaraiban is. 52 betegen végzett klinikai vizsgálat szerint 50% partialis remissziót idéz elő, relapsusba került/refrakter CLL-ben, a del 17p esetén ez az arány 47%, del 11q-nál 81%, a komplex kariotípus abnormalitásoknál 48%, bulky nyirokcsomó-megnagyobbodással járó esetkben 54%. A reszponderek median PFS-e 11hónap. Tumorlízis szindromát okozhat. Igéretes új szer ebben a beteganyagban.
Szupportív kezelések
Intravénás immunglobulin. (Csak ismétlődő infekciók esetén javasolt)
Dózis: 400 mg/kg 3 hetente, hatásos a kis és közepes infekciók ellen. Megrövidíti a kórházi tartózkodást, javítja az életminőséget. A nagyon súlyos infekciókat nem védi ki (5).
Vér és plazmakészítmények: Ha vörösvérsejt vagy thrombocyta pótlásra van szükség és purin analógokkal folyik a kezelés, vagy a beteg transzplantáció várományosa, csak választott, besugárzott készítményeket kaphat.
Vakcináció: influenza, pneumococcus, haemophilus, diphteria ellen ajánlott. Hatásossága kétséges, mert az antitesttermelés károsodott és a hatékonyságról kevés evidencia áll rendelkezésre. Védő hatása függ: a remissziós statustól, az Ig szinttől (>7g/l), fehérje és konjugált vakcinák eredményesebbek (ranitidin tovább fokozza a hatást), mint a bakteriális polysaccharidok.
Haemopoetikus növekedési faktorok:
Granulocyta növekedési faktor (G-CSF).
Súlyos neutropeniában: amíg az abszolút neutrophil szám el nem éri az 1,0 G/l-t.
Erythropoesist stimuláló protein (ESP). Citosztaikus kezelés okozta anémiában az alkalmazási előirásban szereplő feltételekkel, melyek mindegyik készítményre egységesen vonatkoznak 2008 júl-tól.
Egyéb kezelések
Splenectomia: nyomási tüneteket okozó extrém lépmegnagyobbodás, refracter cytopeniában (autoimmun vagy hypersplenia miatt) vagy ruptura esetén
Sugárkezelés: Kiegészítő kezelés nagy tumortömeg esetén, ha annak gyors megkisebbítése szükséges.
A CLL felújított kezelési javaslata"
Meghatározók: Fizikai kondíció
Prognosztikai faktorok (genetikai és egyéb) A betegség stádiuma
Kezelést csak aktív betegség esetén szabad kezdeni
A javasolt kezelési algoritmus a következő:
Go-Go betegek részére első vonalbeli kezelés:
del17p nincs Standard kezelés: R-FC (II,A), FC, HD-CLB
Alternatív*: BR; FR; FA; FCA ; FCM és egyéb kezelések del 17p kimutatható
Standard kezelés: R-FC, A, vagy FA, -> allogén SCT (III,B)
Standard kezelés "bulky" lymphadenopathiánál: A-F, R-FC, R-CHOP, R-DHAP
Alternatív*: R-FCM és egyéb kezelések
Slow-Go beteg részére első vonalbeli kezelés:
deli 7p nincs Standard kezelés: CLB (II,B), redukált dózisú F vagy FC vagy R-FC (III,B), R-FC lite
Alternatív*: CLB+R, B (II,B), CLB+GA101 és egyéb kezelések Deli7p kimutatható: A
No-go betegek részére:
Palliatív kezelések: transzfúzió, thrombocyta pótlás, IVIG, ESA, G-CSF, stb.
Cytoreduktiv kezelések: ha a proliferációs készség nagy, CLB intermittálóan vagy csökkentett dózisú F monotherapia.
Relapsus - kezelések PR vagy CR után:
12 hónapon belül relapszus monoterápia után vagy 24 hónappal immunokemoterápia után, vagy ha az elkső vonalbeli kezelésre nincs válasz, a kezelést váltani kell az alkábbi gyógyszeres lehetőségek közül az egyikre (III,B). Előtte ismételt interfázis citogenetikai és egyéb rizikófelemérés ajánlott.
Go-Go betegek részére:
del17p nincs
Standard: A vagy FA - allogén SCT; R-FC (ha az első vonalbeli kezelés alkilálószer volt)
Alternatív*: BR, Flavopiridol, Lenalidomide, R-Lenalidomide és egyéb kezelések
Del17p kimutatható
Standard: A vagy FA - allogén SCT;
Alternatív*: Flavopiridol, lenalidomide, R-lenalidomide és egyéb kezelések
Slow-Go betegek részére:
del17p nincs
Standard: A, nagy dózisú Ofatumomab vagy R + HDMP Alternatív*: BR, B, lenalidomide és egyéb kezelések
Del17p kimutatható Standard: A,
Alternatív*: lenalidomide és egyéb kezelések
12 hónapon túl: Go-Go és Slow-Go: Az első kezelést meg lehet ismételni.
Az "alternatív*"-ként feltüntetett kezelések fázis II/III klinikai vizsgálatokon estek át, Magyaroroszágon csak részben vannak regisztrálva.
* lásd. irod. 16 és 8, módosítva
IV. Rehabilitáció
Az idős átlagos életkor miatt az ízületii panaszok mindennaposak, amelyek fokozódnak a kórházi kezelések alatt bekövetkező immobilizáció következtében. Ideális lenne gyógyfürdő-kórházakban utókezeléseken javítani a mozgásszervi státuszt. A kórházhoz csatlakoztatott rheumatológiai szakrendelések majd a fizikoterápiás kezelések szintén csökkentenék a panaszokat és javítanák a betegek életminőségét. Külön problémát jelent a kórházi kezelések alatt keletkezett bőr-és ízületii elváltozások gyógyulása, melyek okai az intravénás kanülök használatánál időnként bekövetkező felületes thrombophlebitisek, bőrfekélyek, esetleg decubitusok, melyek mind szakellátást majd rehabilitációt igényelnek.
V. Gondozás
VI. Irodalomjegyzék
1. Bosch F, Abrisqueta P, Villamor N et al.: Rituximab, fludarabine, cyclophosphamide, and mitoxantrone: a new, highly active chemoimmunotherapy regimen for chronic lymphocytic leukemia. J Clin Oncol 2009; 27:4578-4584.
2. CLL Trialists' Collaborative Group.Chemotehrapeutic options in chronic lymphocytic leukemia. J Ntl Cancer Inst. 1999; 9:861-868.
3. Crowther-Swanepoel D, Broderick P, Di Bernando MC et al.: Common variants at 2q37.3, 8q24.21, 15q21.3 and 16q24 influence chronic lymphocytic leukemia risk. Natl Genet. 2010; 42:132-136.
4. Döhner H, Stilgenbauer S, Benner A et al.: Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343:1910-1916
5. Cooperative group for the study of immunoglobulin in chronic lymphocytic leukemia. Intravenopus immunglobulin for the prevention of infection in chronic lymphocytic leukemia - a randopmized cntrolled tiral. N Engl J Med 1988; 319:902-907.
6. Dreger P, Corradini P, Kimby E et al.: Indications for allogeneic stem cell transplantation in chronic lymphocytic leukemia; the EBMT transplant consensus. Leukemia 2007;21:12-17.
7. Eichhorst BF, Busch R, Hopfiner G et al.: Fludarabine plus cyclophosphamide versus fludarabine alone in first-line therapy of younger patients with chronic lymphocytic leukemia. Blood 2006;107:885-891.
8. Eichhorst B, Hallek M, Dreyling M, on behalf of the ESMO Guidelines Working Group: Chronic lymphocytic leukaemia: ESMO clinical practicw guidelines for diagnosis, treatment and follow-up. Ann of Oncology 21 (Supplement 5) v162-164, 2010
9. Elter T, Borchmann P, Schultz H et al.: Fludarabine in combination with alemtuzumab is effective in combination with alemtuzumab is effective and feasible in patients with relapsed or refractoty B-cell chronic lymphocytic leukemia: results of phase II trial. J Clin Oncol 2005; 23: 7024 -31.
10. Ferrajoli A, Badoux XC, O'Brien S et al.: Combination therapy with lenalidomide and rituximab in patients with relapsed chronic lymphocytic leukemia (CLL). Blood 2009; 114: Abstract 206.
11. Fischer K, Stilgenbauer S, Schweighofer CD et al.: Bendamustin in combination with rituximab (BR) for pateints with relapsed chronic lymphocytic leukemia (CLL): a multicentre phase II trial of the German CLL study Group (GCLLSG) (abstract.) Blood 2008;112:330.
12. Foon KA, Boyiadzis M, Land SR et al.: Chemoimmunotherapy with low-dose fludarabine and cyclophosphamide and high dose rituximab in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 2009;27:498-503.
13. Haematopoetic stem cell transplantaion. The EBMT handbook 5th Edition.. Eds: J Apperley, E. Carreras, E.Gluckman, A.Gratwohl, T.Masszi, 2008. Chapter 25. Dreger P.: CLL in adults: 407-411.
14. Hallek M, Cheson BD, Catovsky D et al.: Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on chronic lymphocytic leukemia updating the National Cancer Institute Working Group 1996 guidelines. Blood 2008; 111:5446-5456.
15. Hallek M, Fischer K, Fingerle-Rowson G, et al.: Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomized, open-label, pohase 3 trial. Lancet 2010; 376> 1167-1174.
16. Hallek M.: Therapy of chronic lymphocytic leukaemia: Best Practice &Research Clinical Haematology 2010; 23: 85-96.
17. Hillmen P, Skotnicki AB, Robak T et al.: Alemtuzumab compared with chlorambucil as first-line therapy for chronic lymphocytic leukemia. J Clin Oncol 2007; 25:20-30.
18. Keating MJ, Flinn I, Jain V et al.: Therapeutic role of alemtuzumab (Campath-1H) in patients who have filed fludarabine:results of a large international study. Blood 2002; 99:3554-3561.
19. Morteon P., Kennedy B, Luccas G et al.: Eradication of minimal residual disease in B-cell chronic lymphocytic leukemia after alemtuzumab therapy is associated with prolonged survival. J Clin Oncol 2005;23:2971-2979.
20. O'Brien SM, Keating MJ, Mocarszki ES et al.: Updated guidelines on the management of cytomegalovirus reactivation in patients with chronic lymphocytic leukemia treated with alemtuzumab. Clin Lymphoma Myeloma 2006;7:125-30.
21. Robak T, Dmoszynska A, Solal-Céligny P et al.: Rituximab plus fludarabine and cyclophsphamide prolongs progression-free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28:1756-1765.
HAJAS SEJTES LEUKÉMIA (HSL) ÉS A ROKON BETEGSÉGEK
Bevezetés
A hajas sejtes leukémia (HSL) és a rokon betegségek típusos klinikai és morfológiai jellemzőkkel rendelkező malignus, B-sejtes, lymphoproliferatív kórképek. A HSL és a splenicus marginalis zóna lymphoma (SMZL) a 2008-as WHO felosztás szerint önálló entitásként tartoznak az érett kis B-sejtes lymphomák közé. Ezen két jól definiált entitás mellett több olyan B-sejtes klonális lymphoproliferatív, a lépet érintő megbetegedés ismert, amely a WHO 4. felosztás szerint egyik B-sejtes lymphoid neoplasia kategóriájába sem illik bele.
Két további ritka, de relatíve jól definiált entitást, a lép diffúz, vöröspulpa lymphomáját (SRP-SBL) és a hajas sejtes leukémia variánst (HSL-v) a 2008-as WHO felosztás még provizionálisnak tekint.
A HSL és a rokon entitások, az SMZL, az SRP-SBL és a HSL-v kezelésének irányelvei gyökeresen különböznek, ugyanakkor a differenciáldiagnosztika sok esetben nehéz. A fenti kórképek ritkák, a lymphomák kb. 2%-a tartozik ebbe a csoportba. Sem a HSL, sem a rokon betegségek normális prekurzor sejtje nem ismert, a legtöbb adat az érés késői stádiumában levő aktivált B-sejtes eredet mellett szól.
HAJAS SEJTES LEUKÉMIA (HSL)
I. Alapvető megfontolások
A HSL kis, érett lymphoid sejtek mérsékelt malignitású (indolens) daganata. A HSL elnevezését ezen, a perifériás vérkenetben látható hajas (citoplazma-nyúlványokkal rendelkező, szőrös) kóros lymphoid sejtekről kapta. A hajas sejtek ovalis maggal és bőséges, "szőrösen" nyúlványos citoplazmával rendelkeznek és a perifériás véren kívül a csontvelőt és a lép vörös pulpáját is diffúzan infiltrálják.
Előfordulás, incidencia
Főként középkorú férfiak betegsége, az átlagéletkor a betegség jelentkezésekor 52 év. (Hazai epidemiológiai vizsgálatunk során az életkori szélső értékek 22 és 85 év voltak.) A férfi-nő arány: 4:1 (hazai adatok szerint 3:1). A felnőttkori leukémiák 2%-át teszi ki, becsült hazai incidenciája 2 beteg/egymillió lakos. Hazánkban évente kb. 20 új beteggel lehet számolni. A Nemzeti Rákregiszter adatai szerint Magyarországon 2008-ban: 20 férfin és 5 nőbetegen, 2009-ben: 15 férfin és 6 nőbetegen diagnosztizáltak HSL-t. Mivel a betegség prognózisa az 1980-as évek vége óta lényegesen javult, a prevalencia növekedett. A becsült prevalencia ma Magyarországon kb. 280-320 beteg, a kezelés javulásával ennek további növekedése várható.
II. Diagnózis
Klinikai tünetek
Az esetek jelentős részében nincsenek klinikai tünetek vagy azok nem jellemzőek (75%). Előfordulnak infekciók (30%), vérzés (20%) és a splenomegalia következtében hasi nyomásérzés (10%). Csontfájdalom azokban a ritka esetekben jelentkezik, amelyekben csontelváltozás észlelhető. Ez lehet lytikus csontelváltozás, általában a femurnyakon, kivételes esetekben pedig osteosclerosis.
A betegség előrehaladásával pancytopenia alakul ki, fizikális vizsgálat során a splenomegalia jellemző, perifériás lymphadenomegalia nélkül. A betegek egy részében hasi CT vizsgálat során retroperitoneális lymphadenomegalia ismerhető fel, ez prognosztikusan kedvezőtlen. A szisztémás ún. B-tüneteknek nincs önálló prognosztikus jelentősége. Autoimmun hemolyticus anemia (AIHA) csak igen kivételesen fordul elő, de egyéb autoimmun betegségek pl. vasculitis lehetőségére gondolnunk kell.
Az immunglobulin-szintek mindvégig normálisak, a kialakuló infekciók a secundaer immundeficiencia következményei, ebben a granulocytopenia és a monocytopenia mellett a natural killer (NK) sejtek csökkent aktivitása, valamint a dendritikus sejtek számának csökkenése játszik szerepet. A második malignomák nem gyakoribbak HSL-ban (a cladribinnel kezelt betegekben vannak ennek ellentmondó közlések is).
Laboratóriumi diagnózis
Jellemző a pancytopenia, domináló granulocytopeniával és monocytopeniával. A perifériás vérben mindig megtalálhatóak a jellegzetes nyúlványos sejtek. Leukopeniás betegekben az "buffy coat" készítmény, az alvadásgátolt vér fvs gyűrűjének kikenése és mikroszkópos vizsgálata (akár MGG-vel festett, akár immunperoxidáz festéssel) még ma is a gyors diagnózis kulcsa lehet, hiszen leukopeniás betegekben, a kóros sejtek kis aránya esetén, az áramlási citometria nem kellően informatív. Mindössze az esetek 8-10 %-a jár leukémiás vérképpel. A diagnózis alapja a jellegzetes, kóros morfológiájú sejtek kimutatása vérkenetben és/vagy a csontvelőben (hisztológiai vizsgálattal). A cristabiopsiás minta histológiai vizsgálata során lépesméz-szerű szerkezet ismerhető fel. Egyes, hypoplasztikus csontvelőképpel járó esetekben a diagnózist az immunhisztológiai vizsgálat teszi lehetővé. Jellemző, de nem specifikus, hogy a hajas sejtek tartarátrezisztens acid foszfatáz (TRAP) pozitívak. Elektronmikroszkópos vizsgálattal gyakran kimutatható a riboszóma lamelláris komplexum, de ez sem specifikus. A modern diagnosztika, a sejtfelszíni markervizsgálat és a csontvelő immunhisztológia birtokában a cytokémiai vizsgálatra (TRAP) és az elektronmikroszkópiára általában már nem kerül sor. Tankönyvi adat, hogy a csontvelő HSL-ben gyakran nem aspirálható (punctio sicca), a betegség gyanúja esetén azonban eleve csontvelő-biopszia indokolt.
Immunológiai szempontból a HSL kóros sejtjei aktivált állapotú B sejtek, melyekre jellemző az erős sejtfelszíni immunglobulin pozitivitás, az erős CD20+, CD22+, CD11C+, valamint a CD103+, CD25+, CD123+ immunfenotípus. Ezen markerek változó mértékben, de kevésbé pozitívak SMZL-ben ill. HSL-variánsban, ami a differenciáldiagnosztikát elősegíti (7. táblázat). Immunhisztokémiailag az elmúlt évek új kutatási eredménye az annexin-A1 erős specifikus pozitivitásának felismerése. Ez a legspecifikusabb immunhisztokémiai marker, mert más B-sejtes lymphomákban nem mutatható ki. Mivel azonban az annexin-A1 a myeloid sejteken és a T-sejtek egy részén is jelen van, ezért a minimális residuális betegség monitorozására nem alkalmas. A residuális betegség kimutatására az áramlási cytometria, ill. immunhisztokémiailag a CD20, a DBA44 és a T-bet. pozitivitás, ill. ezek kombinációja alkalmasak. Nem egyértelmű még a residuális betegség kimutatásának a klinikai értéke.
1. táblázat. A HSL egyes differenciáldiagnosztikai jellemzői
| HSL | SMZL-SVLV | SRP-SBL | HSL-variáns | |
| Előfordulás | 50 év (fiatal felnőttben is) | 54-72 év | 77 | 70 év |
| Nemek szerinti | Férfi/nő:5:1 | Több férfi mint nő | férfi/nő:l:l | férfi/nő:l:l |
| megoszlás | ||||
| Immunglobulinok | normális vagy növekedett, IgG vagy több nehéz lánc izotípus, minden osztály lehet, kivéve IgE, IgG3 a leggyakoribb, kappa=lambda | Monoklonális IgM (vagy IgD, IgG) kappa>lambda | Normális | Normális |
| Sejtszám | pancytopenia 90% | Pancytopenia vagy norm. | Enyhe lymphocytosis, | Fvs -.50-100 G/l, de lehet |
| leukémiás vérkép 10% | sejtszám, enyhe | neutro- és | lymphocytosis is | |
| neutopenia, | lymphocytosis lehet | monocytopenia nem | ||
| monocytopenia | jellemző | |||
| CD11c | +++ | + | ++ | |
| CD25 | +++ | + | + | + |
| HC2 | ++ | + | + | |
| CD103 | +++ | + | + | + |
| CD20 | +++ | +++ | +++ | +++ |
| CD22 | +++ | ++ | +++ | +++ |
| CD76 | +++ | ++ | ++ | +++ |
| CD123 | +++ | - | + | + |
| CD27 | - | Normális | - | - |
| Annexin-AI | +++ | - | - | - |
| Morfológia | ||||
| Sejtmag | Ovoid, bab alakú | Kerek | Kerek | Kerek |
| Chromatin | reticularis+nucleolus | rögös+nucleolus | rögös+nagy nucleolus | rögös+centrális nucleolus |
| Citoplazma | Kékesszürke, Széles | basofil, keskeny-közepes | Basofil, széles | kékesszürke, széles |
| Sejtfelszíni | számos hosszú | egyenetlenül elhelyezkedő | egyenetlenül | hosszú karcsú |
| nyúlványok | citoplazmanyúlvány a | keskeny, rövid | elhelyezkedő nagy, | citoplazmanyúlványokkal |
| teljes sejtfelszínen | citoplazmanyúlványok | széles citoplazmanyúlványok | rendelkező hajas sejtek m mellett ún. villosus lymphocyták is | |
| HSL | SMZL-SVLV | SRP-SBL | HSL-variáns | |
| Előfordulás | 50 év (fiatal felnőttben is) | 54-72 év | 77 | 70 év |
| Monocitopenia | + | - | - | - |
| Cytologia | Homogén | Heterogén | homogén | heterogén |
| Csontvelő morphologia | "lépesméz" szerű szerkezet, reticulin fibrosis | intrasinusoidalis és nodularis, ritkán interstitialis | enyhe fibrosis, interstitialis vagy intrasinusoidalis | enyhe fibrosis, interstitialis vagy intrasinusoidalis |
| Lépinfiltráció | diffúz vörös pulpa infiltráció, atrophias fehér pulpa | fehér pulpa | vörös pulpa | vörös pulpa |
| HSL | SMZL-SVLV | SRP-SBL | HSL-variáns | |
| Abnormális karyotypus | Ritka | 80% | 32% | ritka |
| Visszatérő kromoszóma abnormalitások | del17p, +12, | +3, + 18, del7q | +3, del7q | del17p, + 12 |
HCL-V: HCL-variáns
SMZL: splenicus marginalis zóna lymphoma, SLVL: splenikus lymphoma villosus lymphocytákkal SRP-SBL: splenicus diffúz vöröspulpa kis B-sejtes lymphoma
Szükséges vizsgálatok
a HSL (és a rokon betegségek) diagnosztikájához elengedhetetlenek a következők:
- fizikális vizsgálat
- teljes vérkép (reticulocyta-számmal) és a lymphoid sejtek morfológiájának leírásával
- perifériás vér mononukleáris sejtek flow citometriás vizsgálata (CD103, CD19, CD20, CDIIc)
- immunelektroforézis
- Coombs teszt
- csontvelő-hisztológia
- hasi echographia
Differenciáldiagnosztika
- aplasticus anaemia
- Splenicus marginális zóna lymphoma
- a lép diffúz, vörös pulpa lymphomája (SRP-SBL)
- HSL-variáns
- myelofibrosis
A HSL ún. funkcionális stádiumbeosztásának kritériumait és a kezelésre adott válasz kritériumait ld. a 2. és 3. táblázatban
2. táblázat. A HSL stádiumbeosztásának ún. funkcionális kritériumai
TÜNETMENTES STABIL BETEGSÉG (non-symptomatic stable disease, nSD) Tünetmentes (ns)
- nincsenek recidiváló infekciók
- nincsenek anaemiára utaló tünetek
- nincs szükség transzfúzióra
- nincsenek B-tünetek
Stabil betegség (SD)
3. táblázat A HSL gyógyszeres kezelésére adott válasz kritériumai
Komplett remisszió (CR)
- a szervnagyobbodások teljes megszűnése
- Hb>12g/100ml
- thrc>100x109/l
- neutrophil granulocyta>1,5x109/l
- a perifériás vérben nincs hajas sejt
- a csontvelő-aspirátumban, illetve a csontvelő-biopsziás mintában nem ismerhető fel hajas sejt Parciális remisszió (PR)
- a szervnagyobbodások legalább 50%-os csökkenése a kiindulási értékhez képest, fizikális vizsgálattal
- Hb-, thrombocyta- és granulocyta-értékek, mint komplett remmisszióban
- a csontvelői hajas sejtes infiltráció legalább 50%-os csökkenése
- a keringő hajas sejtek aránya 5% alatti
Minor válasz (MR)
- a keringő hajas sejtek számának legalább 50%-os csökkenése
- egy vérsejtadat javulása (Hb, neutrophil granulocyta vagy hajas sejtek száma)
Nincs válasz (NR)
Kevesebb, mint minor válasz stabil vérsejtadatok (Hb, granulocyta-, thrombocyta-szám) az utóbbi három hónapban (a normáltartományon belüli ingadozás figyelmen kívül hagyható)
AKTÍV KLINIKAI STÁDIUMOK
átmeneti
klinikai
stádiumok
Tünetekkel járó stabil betegség (symptomatic stable disease) sSD
- a "tünetmentesség" kritériumai közül egy vagy több hiányzik
- a "stabil betegség" kritériumai teljesülnek Tünetmentes progresszív betegség (non-symptomatic progressive disease) nsPD
- a "tünetmentesség" valamennyi kritériuma teljesül
- a betegség nem stabil Tüneteket okozó progresszív betegség
(symptomatic progressive disease) sPD
- a "tünetmentesség" egy vagy több kritériuma hiányzik
- a betegség nem stabil
III. A HSL kezelése
Általános irányelvek
A HSL prognózisa az újabb kezelési lehetőségek birtokában lényegesen megjavult, a legtöbb esetben a várható életkilátás az egészségesekéhez közelít.
A diagnózis megállapítását követő fő kérdések:
1. Szükség van-e kezelésre?
2. Mi legyen az elsődleges kezelés?
3. Mi a másodlagos kezelés?
4. Mi a kezelési javaslat relapsus esetén?
Ad 1. Szükség van-e kezelésre?
Nem szükséges a kezelés (kb. az esetek 10%-ban): panasz és tünetmentes betegek esetében, általában idősebb korban. E betegek rendszeres hematológiai ellenőrzése, megfigyelése indokolt.
A kezelés fő indikációi
- Ismételt vagy súlyos infekciók az anamnézisben
- Jelentős anaemia ( Hb <12 x109/l, transzfúzió-dependens állapot)
- Granulocytaszám <1,5 x109/l
- Vérzéshajlam ill. thrombocytaszám <100 x109/l
- tüneteket okozó és / vagy progresszív betegség (2 táblázat szerint)
A kezelés ritkább indikációi
- nagy keringő hajas sejt szám
- panaszt okozó splenomegalia
- csontérintettség
Ad 2. Mi legyen az elsődleges kezelés?
A HSL kezelésében a "treatment of choice" egy purinnukleozid-analóg, a cladribin. A hazai gyakorlatban e készítmények elérhetőségét magas ára még mindig korlátozza, így elsődleges kezelésként általában interferon-alfa kezelés történik, ami immunológiai szempontból kedvező ugyan, de. 2-3 hónapos interferon-alfa kezelés után a kezelést az esetek többségében cladribinnel lenne szükséges folytatni. Néhány hónapos interferon előkezelés nem csökkenti az azt követő purinnukleozid-kezelés eredményességét, de egyes adatok szerint a tartós interferon-alfa előkezelés növelheti a későbbi cladribinkezelést követő relapszus valószínűségét.
Ad 3. Mi a másodlagos kezelés?
Második szerként (maximum néhány hónapos interferon-alfa kezelés után) HSL-ban cladribinkezelés javasolt, de hangsúlyozzuk, hogy valójában a purinnukleozid-analógok (cladribin vagy pentostatin) elsővonalbeli kezelésként indikáltak. Cladribinkezelést követő relapszus esetén újabb cladribinkezelés vagy pentostatinkezelés javasolt. Az interferon-alfa kezelés is eredményes lehet ilyen esetekben, de a nem nagy tumortömeggel járó relapszus kezelésében az utóbbi években a rituximab adása került előtérbe. Amennyiben a cladribin kezelés ismétlésre kerül sor, úgy a várható remissziók ideje minden egyes újrakezeléskor egyre rövidül. Fontos szempont, hogy az első cladribin kezelést követően egy éven belül, vagy azon túl válik újra szükségessé a kezelés.
Ad 4. Mi a kezelési javaslat relapszus vagy rezisztencia esetén (1. ábra)?
IFN-kezelést követő relapsus esetén purinnukleozid-analóg kemoterápia ajánlható. Cladribin utáni késői (1 éven túli) relapsus esetén újabb cladribin kezelés vagy (kis tumortömeg esetén) méginkább rituximab adása, más esetekben interferon-alfa kezelés javasolt. A rituximab kezeléshez OGYI engedély szükséges (off-label kezelés), de számos közlemény igazolja, hogy 4-8 ciklus rituximab (375mg/m2 adagban) másod- vagy harmadvonalban is tartós remisszió (komplett vagy parciális) létrehozásra képes. A kétféle purinanalóg közt nincs keresztrezisztencia, így eredménytelen purinanalóg kezelés esetén a másik szer (cladribin vagy pentostatin) eredményes lehet. Ha a kemoterápiát és a biológiai kezelésmódokat követően is még tüneteket okozó splenomegalia és pancytopenia észlelhető, splenectomia válhat szükségessé.
PURINNUKLEOZID-ANALÓGOK A HSL KEZELÉSÉBEN
(2-chlorodeoxyadenozin, cladribin és 2-deoxycoformycin, pentostatin)
Purinnukleozid-analóg kezelés hatásmechanizmusa HSL-ben: a PA-k hatására az adenozin-dezamináz enzim (ADA) aktivitásával való interferencia útján a kóros lymphoid sejtekben a dezoxiribonukleotidok koncentrációja olyan mértékben növekszik, hogy az a sejtek pusztulását eredményezi. Osztódó és nyugalmi állapotban levő sejtekre egyaránt citotoxikus hatásúak. Igen hatásos kezelési mód, ezért a tumor-lízis szindróma megelőzésére minden esetben bőséges orális folyadékbevitel is szükséges. Míg néhány éve a cladribint tekintették a "treatment of choice"-nak HSL-ben, addig ma újra nyitott kérdés, hogy a cladribin vagy a pentostatin kezelés tekinthető a fő választandó kezelési módnak, mivel a válaszolók aránya és a toxicitási adatok is hasonlóak. Így a szer megválasztása attól is függ, hogy melyik elérhető, mik a költségek és melyik adagolási mód felel meg jobban a betegnek. A cladribin kezelés eredményességét előrejelző tényezők közt a lép mérete (igen jelentős splenomegalia kedvezőtlen) és az anaemia mértéke mellett az Ig-nehézlánc gén variábilis régió mutált vagy nem mutált volta (a mutált IGVH prognosztikailag kedvező) játszanak szerepet.
2-chlorodeoxyadenozin, cladribin (Litak sc.) 10 mg/porampulla, 5 ampulla/doboz 2-chlorodeoxyadenozin, cladribin, (Leustatin), 10 mg/porampulla, 7 ampulla/doboz A szer az adenozindezamináz (ADA) hatásával szemben rezisztens.
Rendszerint egyetlen kezelési ciklusra van szükség. Európai törzskönyve csak a sc. adagolandó cladribinkészítménynek van, ez az adagolási mód kényelmes és biztonságos, a cladribin bioavailabilitása sc. adva 100%-os. A sc. cladribin kezelés ambulanter adható (bár hazánkban a finanszírozás jelenleg még nem ebbe az irányba hat), természetesen naponta történő hematológiai kontroll mellett.
Az infuziós készítmény, amelyet a korábbi évek során alkalmaztunk, kétféle módon adható: A: 0,1 mg/kg/nap 24 órás folyamatos iv. infúzió 7 napon át B: 0,14 mg/kg/nap, napi egyszeri 2 órás iv. infúzió 5 napig
(Amennyiben az infúziós készítmény alkalmazására kerül sor, ez utóbbi adagolási mód javasolt.) RR: 94%, CR: 82-83%, PR: 12%-17%
A cladribin kezelés nem okoz sem alopeciát, sem hányingert.
Mellékhatások
Láz, myelosuppressio (az esetek több mint 90%-ában neutropenia), immunsuppressio (infekciók aránya 2 hónapon belül: 25%) A kezelés utáni néhány héten belül hypereosinophilia A májfunkciós paraméterek átmeneti romlása Nephrotoxicitás, neurotoxicitás, polyneuropathia Urticaria, arthralgia
Ellenjavallatok
Akut fertőzések Terhesség
Súlyos máj- vagy veseelégtelenség Súlyos csontvelő-elégtelenség
Fontos megjegyzés: A cladribinnel párhuzamosan allopurinol kezelésben részesülteken egy (kis esetszámú) tanulmány szerint nagyobb a toxicoderma kialakulásának valószínűsége. Ennek figyelembevételével kell eldönteni, hogy valóban elengedhetetlen-e az allopurinol alkalmazása, a bőséges hidráláson kívül nagy tumortömeg esetén rasburicase adása jön szóba hyperuricaemia esetén.
2-deoxycoformycin, pentostatin, Nipent
Az adenozindezamináz (ADA) irreverzibilis inhibitora.
Dózis: 4 mg/m2 2 hetente adott rövid infúzióban a maximális válasz létrejöttéig (legalább 5-6 ciklus, sokszor 8-10 ciklus), majd még 2 további kezelési ciklus.
Mellékhatások
Hányinger, hányás
Bőrkiütés, láz, fáradékonyság, conjunctivitis, máj és/vagy vesefunkció-zavar
fényérzékenység - az így kezelt betegeket figyelmeztetni kell, hogy kerüljék a direkt napfényt Myelosupressio (neutropenia az esetek 40-50%-ban) Immunsuppressio ( az infekciók aránya 6-30%)
Ellenjavallatok
Terhesség
Súlyos máj- vagy veseelégtelenség
Kezelési eredmények
A cladribinnel kezelteken a CR aránya 79-82%, a 12 éves progressziómentes túlélés aránya 54%, a relapszus esetén adott adott második cladribinkezelést követő CR arány: 52%.
A pentostatin kezelés várhatóan kevésbé eredményes voltát (CR kevésbé valószínű, betegségmentes túlélés rövidebb) előrejelző
főbb tényezők az anaemia (Hb<100 g/l ) és a leukopenia (fvs<2,0 x 109/l)
RR: 85-97% CR: 83% PR: 11% refrakter: 3-6%.
A 10 éves relapsusmentes túlélés DCF kezelés után: 85%-89%.
A pentostatin IFN-alfával előkezelt (vagy splenectomizált) betegekben ugyanolyan hatásos, mint a kezeletlenekben.
INTERFERON-ALFA KEZELÉS JELLEMZŐI HSL-BAN
Interferon-alfa javasolt HSL-ban
- az alapbetegség kezelésére, ha egyidejűleg infekció zajlik
-ha a myelosuppressio és /vagy az immundeficiencia igen jelentős
Ha a purinanalóg kezelés valamilyen okból ellenjavallt és csak interferon-alfa kezelés történik, úgy annak javasolt tartama általában egy év. A géntechnológiával előállított rekombináns interferon alfa készítmények elérhetőek (interferon-alfa2a, interferon-alfa2b). A természetes humán interferonok használata teljesen háttérbe szorult, a hazai készítmény gyártása már évekkel ezelőtt megszűnt.
Az interferonkezelés megkezdése után 1-2 hónappal a cytopenia mérséklődik és az immunfunkciók javulnak. Dózis: 2x 106 E/m2 heti 3 alkalommal subcutan bolus injekció, ennél nagyobb adagra csak ritkán van szükség. A fentinél kisebb adagok is hatásosak lehetnek, súlyosan granulopeniás és/vagy thrombopeniás betegben a kezelés kezdetén kis adag pl. heti 3x 1,5 M interferon-alfa javasolható.
Az interferon-alfa kezelés a betegek 65%-ban eredményez remissiót (CR: 10%, parciális remissio, PR: 55%). A hatásmechanizmus nem teljesen ismert. Az interferon-alfa kezelés nem kurativ. Az IFN kezelés abbahagyását követő két és fél éven belül az esetek több, mint 50%-ában a folyamat progrediál. A kialakuló relapsus is jól reagál az újabb IFN kezelésre.
Az interferon-alfa kezelés főbb mellékhatásai
Hajhullás Fáradékonyság
Izomfájdalom, ízületi panaszok a kezelés kezdetén influenzaszerű szindróma központi idegrendszeri zavarok étvágytalanság, gastrointestinalis zavarok ritmuszavar, tachycardia, szívelégtelenség
Ellenjavallatok
Egyes központi idegrendszeri betegségek
Depresszió
Súlyos májfunkciózavar
Veseelégtelenség (progrediálhat)
Biológiai kezelési módok HSL-ben
Monoklonális anitestek:
MabThera (rituximab, humanizált egér eredetű monoklonális antitest)
A hajas sejtek felszínén a CD20 expresszié nagyon erős, ezért a más kezelési formákkal szemben refrakter HSL-ban ez a kezelés nagyon hatásos lehet. 4-8 kezelési ciklus javasolt 375mg/m2 adagban, OGYI engedélyt követően (off-label indikáció). Az eddigi adatok szerint relabálé/refrakter HSL-ban a RR: 50-60%, ez a kezelési méd elsősorban kisebb tumortömeg esetén eredményes.
Rekombináns immunotoxinkezelés
Egyelőre experimentális kezelési méd, de elméleti szempontból nagyon érdekes kétfajta rekombináns immunotoxinkezelés, az egyik a hajas sejtek CD25 antigénje, a másik a CD22 molekula ellen irányul.
Splenectomia
Míg az 1980-as évek közepéig a splenectomia volt HSL-ban az elsőként választandé kezelési méd, mára - a hatásos gyégyszeres kezelési lehetőségek birtokában - a splenectomia szerepe a HSL kezelésében teljesen háttérbe szorult. Bár a beavatkozás aktív thrombocytopeniás vérzés és kizárélag a lépre lokalizált betegség esetén mérlegelhető, a lép műtéti eltávolítása valéjában csak a szisztémás kezelés kontraindikáciéja (pl. súlyos máj- vagy vesebetegség társulása) esetén jön széba.
Splenectomiát követően a parciális remisszié aránya 40-60%. A csontvelőben nem jön lére patolégiai remisszié. Mellékhatás: műtéti riziké, infekciéveszély.
A splenectomiát megelőzően legalább két héttel (mint bármely egyéb okú tervezett splenectomia előtt is) kerüljön sor a Pneumococcus, Haemophilus influenzae és Neisseria meningitidis elleni védőoltásokra.
Kiegészítő (szupportív) kezelés
A nukleozid-analég kezelést követő napokban észlelt láz az esetek döntő többségében nem infekcié következménye, hanem a pusztulé kéros sejtekből felszabadulé cytokinek okozzák. A cladribinnel párhuzamosan allopurinol kezelésben részesülteken egy (kis esetszámú) tanulmány szerint nagyobb a toxicoderma kialakulásának valészínűsége. A cladribinkezelést az esetek kb. 40%-ban neutropenia és láz együttese követi. Bár G-CSF profilaktikus alkalmazása nem csökkenti HSL-ben a lázas epizédok arányát, ill. a lázas napok számát, a preventív indikáciéjú pegfilgastrim készítmény adása a cladribin kezelést követő első két hénapon belül, súlyos granulopenia esetén javasolhaté. Amennyiben a lázas, granulocytopeniás betegen infekcié alakul ki, úgy természetesen szükség van G-CSF adására.
Az antibiotikum választás mérlegelésekor szem előtt kell tartani, hogy a HSL-ás betegek mortalitásának fő oka az infekcié. Opportunista infekciék is előfordulhatnak, elsősorban a kezeletlen, ill. a nukleozid-analéggal kezelt betegeken. A splenectomizáltakon pedig a betegségre jellemző sejtes immundeficienciához még a léphiány-állapotra jellemző immunhiány is társul. Mivel a nukleozid-analég kezelést követő hetekben az immunsuppressio mértéke jelentős, ezért, ha transzfúzié szükséges, úgy szűrt, irradiált készítmény alkalmazása javasolt. Lokális irradiácié jön széba gécos csontérintettség esetén a szisztémás kezelés mellett.
A hajas sejtes leukémia kezelése idős és agg korban
Nagyon előrehaladott életkorban vagy súlyos kísérőbetegségek esetén, ha a kezelés javallt, úgy elsősorban interferon-alfa adása jön széba (esetleg kissé csökkentett adagban), mivel ez úgy hatásos a betegségben, hogy közben az immunfunkciékat javítja. A purinnukleozid analégok immunsuppressiv volta és toxicitása miatt ezekben az életkoruk és alapbetegségük amúgy is immundeficiens emberekben egy potenciálisan kuratív cytostatikus kezelés esetén a riziké/haszon arány nagyobb, mint ami elfogadhaté.
A hajas sejtes leukémia kezelése terhességben
Amennyiben a kezelés progresszív betegség miatt nem halaszthaté, úgy rekombináns interferon-alfa kezelés javasolt.
Prognózis
A medián betegségmentes túlélés pentostatinnal kezelteken 15 év, cladribinnel kezelteken 11+év volt. Az össztúlélés pentostatinnal kezelteken 10,8 éves nyomonkövetésnél 96%, míg cladribinnel kezelteken 7,2 évnél 100%-os. Ennek ellenére minden egyes purin nukleozid analég (PA) kezelési ciklus után egyre rövidül a betegségmentes túlélési idő. Egyértelmű, hogy a PA kezelést követő komplett remisszié (CR) esetén nagyobb a betegségmentes túlélés esélye. A minimális reziduális betegség (MRD) jelentősége nem egyértelmű, egyes adatok szerint a MRD esetén nagyobb a relapsus esélye, míg más adatok szerint cladribin kezelést követő MRD, sőt egyértelmű csontvelő-manifesztáciét akár évekig sem követ hematolégia relapsus. Az újabb adatok alátámasztják a PA kezelést követő rituximab kezelés szerepét a remisszié elmélyítésében, a MRD eliminálásában.
1. ábra. A HSL kezelésre vonatkozó algoritmus
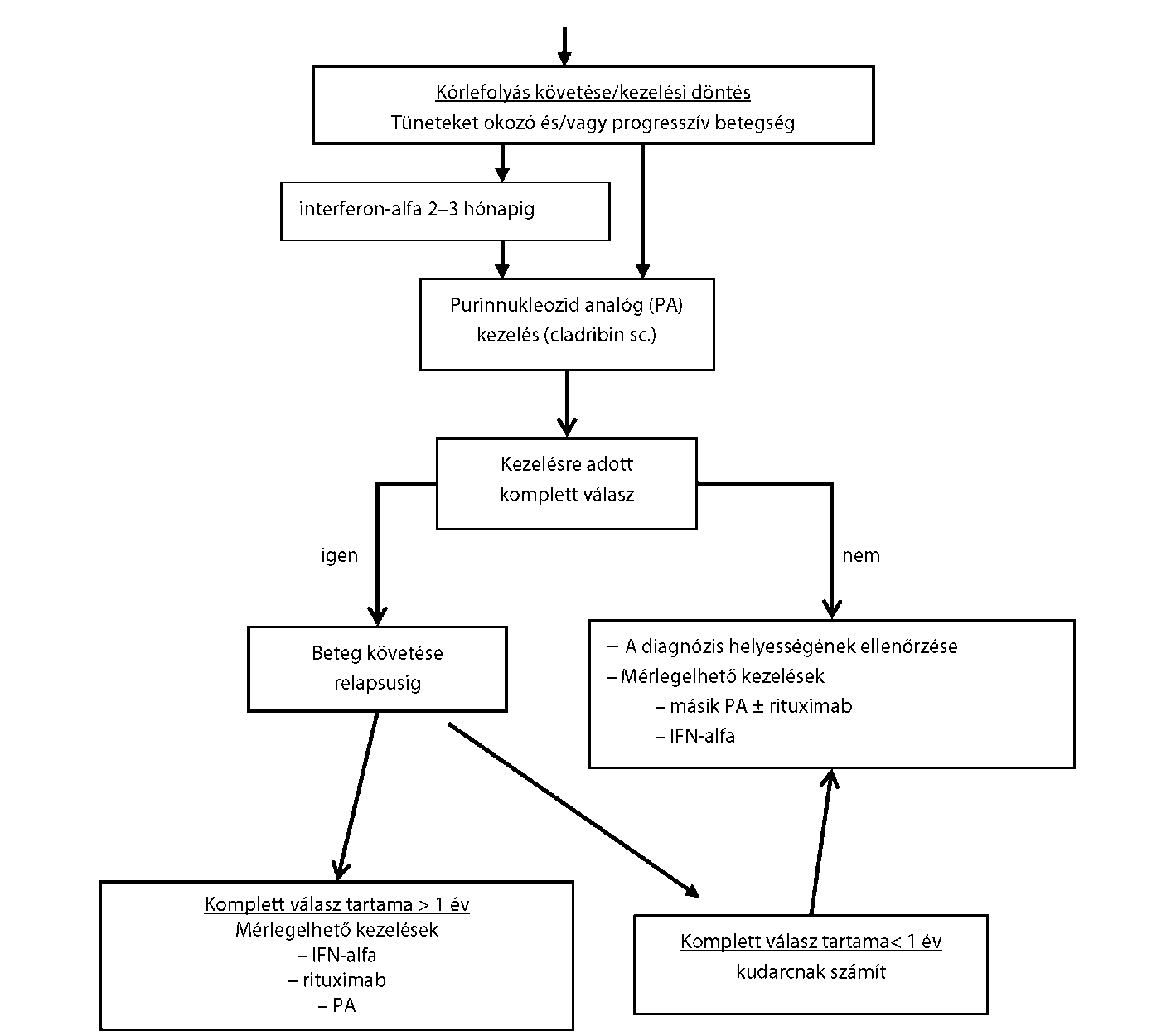
Bizonyítékokon alapuló orvoslás (EBM) a hajas sejtes leukaemia (HSL) kezelésében
A kezelési ajánlások kettes-hármasszintű bizonyítékokon alapulnak, metaanalízis nem áll rendelkezésre. Több EBM bizonyított megállapítás túlhaladottá vált. Érvényes megállapítások:
1. A kisdózisú IFN-alfa is hatásos.
2. A pentostatin kezelésre válaszolók aránya szignifikánsan nagyobb és ezen betegek relapsusmentes túlélése szignifikánsan hosszabb, mint az interferon-alfával kezelteké.
3. Cladribin 2 órás infúziós kezelés hetente egyszer adva, a kezelés toxicitása nem csökken a naponta adott infúziós kezeléshez képest, a kezelés hatásossága azonos. Azonos eredményre jutottak a cladribint sc adva, a heti sc cladribin kezelés nem előnyösebb, mint a naponta adott sc cladribin kezelés (Zehnausern, 2009). (Randomizált multicentrikus fázis III vizsgálat)
4. 6 hónapos interferon-alfa kezelés nem növeli a pentostatin kezelést követő remissziók arányát (Marotta G, Frassoldati A). (randomizált kontrollált)
5. Azt a tankönyvi megállapítást, miszerint a HSL leghatásosabb gyógyszere a cladribin, nem támasztják alá randomizált klinikai vizsgálatok. Nincsen olyan vizsgálat, amely a HSL kezelésében rendkívül hatásos két purinnukleozid-analógot egymással randomizált módon hasonlítaná össze. Az egyetlen olyan tanulmány, ahol azonos centrumban vizsgálták a kétféle szer hosszútávu eredményességét, hosszabb távon végül is egyformán eredményesnek ítélte meg a kétféle purinnukleozid-analógot. Bár a két szer közül bármelyik alkalmas a betegség potenciálisan gyógyító szándékú kezelésére, a betegségmentes túlélés görbéje nem ér el platót, visszesés még sok év múlva is előfordulhat.
SPLENICUS MARGINALIS ZÓNA LYMPHOMA (SMZL),
szinonimája: SPLENIKUS LYMPHOMA keringő VILLOSUS LYMPHOCYTÁKKAL (SLVL)
I. Alapvető megfontolások
Általános jellemzés
Az SLVL egy ismeretlen etiológiájú, malignus lymphoproliferatív betegség. Elnevezését domináló lokalizációjáról valamint a perifériás vérkenetben látható kis citoplazma-nyúlványokkal rendelkező kóros lymphoid sejtekről kapta. A betegség a lépet, a léphilusi nyirokcsomókat, a csontvelőt és gyakran a perifériás vért is érinti. Az esetek egy (kis) részében a betegség HCVpozitivitással és kevert típusú cryoglobulinaemiával társul.
II. Diagnózis
Klinikailag jellegzetes a splenomegalia, emellett előfordulhat lymphadenomegalia is, de ez kevésbé jellemző. Autoimmun eredetű thrombocytopenia, vagy anaemia is előfordulhatnak.
Laboratóriumiailag mérsékelt lymphocytosis, thrombocytopenia, különböző fokú anaemia vagy mindkettő jellemzőek. A perifériás kenetben jellegzetes módon nyúlványozott lymphoid sejtek láthatóak, a nyúlványok általában a sejt két szembenálló pólusának közelében helyezkednek el, szemben a HSL-ban látott, általában körkörös nyúlványozottsággal. A perifériás vérben a sejtek egy része plasmocytoid megjelenésű. A csontvelő-infiltráció mintázata a biopsziás mintában noduláris vagy intrasinusoidalis típusú. A savóban gyakran mutatható ki monoklonális immunglobulin, az esetek többségében ez IgM. Hepatitis C ellenanyagvizsgálat és PCR javasolt minden betegen, valamint cryoglobulin vizsgálat.
Immunfenotípus: a kóros sejtek felszínén IgM mindig jelen van, jellemző a CD20+, CK79a+, CD5-, CD10-, CD23-, CD43- és annexin-Al neg. immunfenotípus. A CD103 és általában a Cyclin-DI is negatív.
Kórlefolyás és prognózis: A betegség kórlefolyása indolens, még akkor is, ha a csontvelő is érintett. Az 5 éves túlélés 65-72%-os, azonban a betegek harmadánál a kórlefolyás ennél agresszívebb. SMZL-ban az autoimmun hemolitikus anaemia jelenléte önálló, prognosztikusan kedvezőtlen tényező. SMZL-ben a 7q deléció jelenléte és az IGHV gének nem mutált volta kedvezőtlen kórlefolyásra utalnak. Az esetek kb 10%-a nagy B-sejtes lymphomává transzformálódik.
Differenciáldiagnosztika ld. 1. táblázat
- idült lymphoid leukémia
- HSL
- splenicus diffúz vöröspulpa kis B-sejtes lymphoma (SRP-SBL)
- HSL-variáns
III. SMZL kezelése
Elsődleges kezelés: splenectomia. Ennek elvégzése különösen immunhaemolízissel társuló esetekben sürgető. Bár ez a kezelés nem gyógyítja meg a betegséget, de a splenectomizált betegek prognózisa lényegesen jobb.
A HCV pozitív esetekben elsődlegesen antiviralis kezelést javasolnak (interferon-alfa monoterápia vagy interferon-alfa és ribavirin kezelés formájában).
Másodlagos kezelés: rituximab (OGYI engedély szükséges, off-label indikáció). Heti egyszer, 4 héten át adott 375 mg/m2 rituximab az SMZL-es betegek 88-100%-ában hatásos. A rituximab kezelés eredményes az SMZL-hez társuló autoimmun hemolitikus anaemia, ill. tiszta vörösvértest aplasia kezelésben is. A rituximab ezekben a betegekben egyrészt az alapbetegségre, másrészt az ahhoz társuló autoimmun szövődményre is kedvező hatású.
HCV pozitív esetekben az eredményes antiviralis kezelést, a HCV RNS kimutathatatlanná válását követően 14/18 betegben (78%) alakult ki komplett hematológiai válasz.
SPLENICUS DIFFÚZ VÖRÖSPULPA KIS B-SEJTES LYMPHOMA (SRP-SBL)
I. Alapvető megfontolások
Általános jellemzés
Ritka lymphomaféleség, az összes non-Hodgkin lymphoma kevesebb mint 1%-a. Ebben a betegségben a lép vörös pulpája kis monomorf B-lymphocytákkal diffúzan infiltrált. A daganat a csontvelő sinusoidokat és a perifériás vért is érinti, citologiailag a sejtek általában nyúlványosak. Provizionális entitásról van szó, amelyben a differenciáldiagnosztika rendkívül fontos.
II. Diagnózis
Klinikai jellemzők: A betegség mindig előrehaladott klinikai stádiumban derül ki, lép-, csontvelő- és perifériás vér érintettséggel, a periferiás nyirokcsomó érintettség ritka. A splenomegalia általános, sok esetben igen kifejezett. Laboratóriumi jellemzők: A vérkép leukémiás, de a lymphocytosis általában relatíve mérsékelt. A perifériás vérben az SMZL-ban leírtakhoz hasonló nyúlványos lymphocyták láthatók (3. ábra). Gyakoriak a thrombocytopenia és a leukopenia, anaemiáról ritkábban számoltak be. Paraproteint nem írtak le.
Immunfenotípus: CD20+, DBA44+, IgG+, IgD-, AnnexinA1 neg. CD25-, CD5-, CD103-, CD123-, CD11C-, CD10-, CD23-. Patológiai jellemzők: A lépben szövettanilag a vöröspulpa diffúzan infiltrált, előfordulnak tumorsejtektől övezett pseudosinusok is. A hisztológiai kép különbözik az SMZL-tól, amennyiben nincs follicularis átépülés, sem bifázisos cytologia, vagy marginalis zóna infiltráció.
Prognózis és prediktív tényezők: A betegség indolens, gyógyíthatatlan, de a splenectomiára adott válasz kedvező.
HSL VARIÁNS
I. Alapvető megfontolások
Általános jellemzés
Az 1980-ban leírt HSL variáns egy nagyon ritka lymphoproliferatív betegség, amelyet a HSL prolymphocytás variánsának is neveztek. A betegségre a kóros, nyúlványos morfológiájú lymphoid sejtek jellemzőek, a sejtek többségében egy nucleolus is látható, e lymphoid sejtek száma növekedett. A WHO 2008-as álláspontja szerint a betegség biológiai szempontból nem tekinthető a HSL rokonának. A HSL-v csoportba olyan B-sejtes lymphoproliferatív betegségek tartoznak, amelyek a klasszikus hajas sejtes leukémiára emlékeztetnek, de a citohematológiai vonások különbözőek (pl. leukocytosis, monocyták jelenléte, a sejtek magjában nagy nucleolusok), az immunfenotípus is különbözik (pl. a sejtek CD25 negatívak, annexin A-1 és TRAP negatívak). Klinikailag jellemzőjük a HSL konvencionális kezelésével szembeni rezisztencia, pl. a cladribinre adott drámaian jó válasz hiánya.
Előfordulás, incidencia
A betegség ritka, mindössze a krónikus lymphoproliferatív betegségek 0,4%-a, a betegség tízszer ritkábban fordul elő, mint a HSL, főleg középkorú és idősebb férfi betegekben.
II. Diagnózis
Klinikai tünetek: hasi nyomásérzés a splenomegalia következtében, ill. a cytopeniák okozta tünetek, ritkán tünetmentes. Fizikális lelet: splenomegalia (85%), hepatomegalia (19%), lymphadenomegalia (4%)
Laboratóriumilag: A perifériás kenetben a sejt morfológia a prolymphocytás leukémia és klasszikus hajas sejtes leukémia közti hibrid vonásokat mutat. A sejtmagban kifejezett centralis nucleolus látható, a sejtek általában nyúlványosak. A kóros sejtek száma növekedett, átlagosan 30-34 x 109/l. Szemben a HSL-val, a monocytopenia nem jellemző. A diagnosztikai és differenciáldiagnosztikai aspektusokat az 1. táblázat tartalmazza
A csontvelő aspirálható (de mint más lymphomákban itt is csontvelő-biopszia szükséges), atípusos hajas sejtekkel különböző mértékben infiltrált, a rostszaporulat csak mérsékelt.
Histológiailag a lép vörös pulpája diffúzan infiltrált. Sinusoidalis infiltráció, ill. vörösvértestekkel teli pseudosinusok is láthatóak. A HSL-variáns kóros sejtjeinek jellemző immunfenotípusa: CD19+, CD20+, CD22+, CD11c+, CD79a+, CD103+, FMC7+, kifejezett monotipikus sejtfelszíni immunglobulin (általában IgG). HSL-val szemben HSL-variánsban a kóros sejtekre CD25-, annexin-A1-, CD123- immunfenotípus jellemző.
Differenciáldiagnosztika
- idült lymphoid leukémia
- HSL
- splenikus lymphoma villosus lymphocytákkal
- B-prolymphocytás leukémia
Mivel a csontvelő-biopsziás kép (és a lépszövettan) egyezik a HSL-val, elsősorban a perifériás kenet morfológia és az immunfenotípus pontrendszere segít az elkülönítésben.
III. A HSL variáns kezelése
A kórlefolyás krónikus, a lymphocyta kettőződési idő hosszú.
Elsődleges kezelés: splenectomia RR: 60-70% (PR)
Másodlagos kezelés: progresszió esetén biztosan hatásos szer nem ismert, a betegség interferonnal szemben rezisztens, de a legtöbb beteg sem pentostatinra, sem cladribinre nem reagál. Ugyanakkor hazánkban beszámoltak már cladribinnel sikeresen kezelt esetről. Előzetes adatok szerint a rituximab kezelés HSL-variánsban is kedvező hatású.
Prognózis: az átlagos túlélés 9 év, sokkal rövidebb, mint HSL-ban.
A hajas sejtes leukaemiások (HSL) és a rokon betegségek
IV. Rehabilitáció
V. Gondozás
A hajas sejtes leukémia (HSL) és a rokon betegségek típusos klinikai és morfológiai jellemzőkkel rendelkező, általában idősebb korban előforduló, mérsékelt malignitású, lymphoproliferatív kórképek. A gyógyító kezelések számos lehetőségét alkalmazva, a betegségmentes medián túlélés lehet 7-15 (vagy ritkán még több) év. De a betegségmentes túlélés görbéje nem ér el platót, visszaesés még sok év múlva is előfordulhat. Ezért a kezelésre nem szoruló, illetve a kezelésre remisszióba (PR, CR) kerülő betegek rendszeres hematológiai ellenőrzése, megfigyelése, gondozása szükséges.
Célszerűen a betegek gondozása a kezelést végző hematológiai centrumokban vagy decentrumokban történjen. A kezeléséért, gondozásáért a szakrendelést végző hematológus, vagy klinikai onkológus szakorvos felelős. Az adott kezelést hematológus vagy onkológus szakorvos rendelheti el. Az ellenőrzések ajánlott intervalluma 2-4 hónap.
VI. Irodalomjegyzék
1. Angelopoulou MK, Pangalis GA, Sachanas S, Kokoris SI, Anargyrou K, Galani Z, Kalpadakis C, Vassilakopoulos TP. Outcome and toxicity in relapsed hairy cell leukemia patients treated with rituximab. Leuk Lymphoma. 2008;49:1817-20.
2. Demeter J. A hajas sejtes leukémia és rokon entitások. Hemat Transzf 2010;43: 21-26.
3. Demeter J, Kenéz A, Varga F. Bizonyítékokra alapozott orvoslás (EBM) a hajas sejtes leukaemia (HSL) kezelésében Magyar Belorv Arch 2000; 53: 312-317.
4. Demeter J. Initial treatment of hairy cell leukemia. Blood e-letter (Grever M közleményéhez), 2010 április 8.
5. Else M, Dearden CE, Matutes E, Garcia-Talavera J, Rohatiner AZ, Johnson SA, O'Connor NT, Haynes A, Osuji N, Forconi F, Lauria F, Catovsky D. Long-term follow-up of 233 patients with hairy cell leukaemia, treated initially with pentostatin or cladribine, at a median of 16 years from diagnosis. Br J Haemat 2009;145:733-40. Epub 2009 Mar 29
6. Fodor A, Molnar MZ, Krenacs L, Bagdi E, Csomor J, Matolcsy A, Demeter J. Autoimmune hemolytic anemia as a risk factor of poor outcome in patients with splenic marginal zone lymphoma. Pathol Oncol Res. 2009; 15:597-603.
7. Grever MR. How I treat hairy cell leukemia. Blood. 2010;115:21-8.
8. Kalpadakis C, Pangalis GA, Dimopoulou MN, Vassilakopoulos TP, Kyrtsonis MC, Korkolopoulou P, Kontopidou FN, Siakantaris MP, Dimitriadou EM, Kokoris SI, Tsaftaridis P, Plata E, Angelopoulou MK. Rituximab monotherapy is highly effective in splenic marginal zone lymphoma. Hematol Oncol 2007; 25:127-31.
9. Lauria F, Forconi F. Combination therapies to improve the long-term outcome in hairy cell leukemia. Leuk Lymphoma. 2009;50: Suppl 1:18-22.
10. Lauria F, Lenoci M, Annino L, Raspadori D, Marotta G, Bocchia M, Forconi F, Gentili S, La Manda M, Marconcini S, Tozzi M, Baldini L, Zinzani PL, Foa R: Efficacy of anti-CD20 monoclonal antibodies (Mabthera) in patients with progressed hairy cell leukemia. Haematologica 2001;86:1046-1050
11. Legrand O, Vekhoff A, Marie JP, Zittoun R, Delmer A: Treatment of hairy cell leukaemia (HCL) with 2-chlorodeoxyadenosine (2-CdA): identification of parameters predictive of adverse effects. Br J Haemat 1997;99:165-167
12. Malfuson JV, Fagot T, Konopacki J, Souleau B, Cremades S, de Revel T. Which role for rituximab in hairy cell leukemia? Reflections on six cases. Acta Haemat 2010;123:110-116.
13. Saadoun D, Suarez F, Lefrere F, Valensi F, Mariette X, Aouba A, Besson C, Varet B, Troussard X, Cacoub P, Hermine O. Splenic lymphoma with villous lymphocytes, associated with type II cryoglobulinemia and HCV infection: a new entity? Blood. 2005;105:74-6.
14. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H, ThieleJ, Vardiman JW. WHO classification of Tumours of haematopoietic and lymphoid tissues. IARC Lyon 2008
15. Traverse-Glehen A, Baseggio L, Bauchu EC, Morel D, Gazzo S, Ffrench M, Verney A, Rolland D, Thieblemont C, Magaud JP, Salles G, Coiffier B, Berger F, Felman P. Splenic red pulp lymphoma with numerous basophilic villous lymphocytes: a distinct clinicopathologic and molecular entity? Blood 2008;111:2253-60.
MYELOMA MULTIPLEX (MM)
I. Alapvető megfontolások
Plazmasejtes
DAGANATOK
A plazmasejtes daganatok (immunszekretoros megbetegedések) a B-sejt differenciáció terminális fázisát képviselő plazmasejtek monoklonális, daganatos megbetegedései. A betegségcsoportra jellemző a monoklonális Ig-termelés, mely a szérum és vizelet elektroforézise során mint M-komponens jelenik meg.
A plazmasejtes daganatok osztályozhatók a morfológiai megjelenésük (pl.: plazmasejtes, plazmasejtes-plazmablasztos, plazmablasztos, kissejtes), szervi érintettségük (pl.: medulláris, extramedulláris, leukaemiás), laboratóriumi paramétereik (pl.: könnyű és/vagy nehézlánc szekréció), klinikai megjelenésük (parázsló, POEMS) és biológiai viselkedésük alapján. Ilyen megfontolások alapján a WHO-osztályozás a betegségcsoporton belül 5 entitást és számos klinikopatológiai variánst különített el (1. táblázat).
PLAZMASEJTES MYELOMA
A plazmasejtes myeloma - régebbi elnevezés szerint myeloma multiplex - a csontvelő multifokális, monoklonális, plazmasejtes daganata, melyet a szérumban monoklonális Ig-szaporulat (monoklonális gammopathia), osteolytikus csontléziók, patológiás törések és anémia kísérnek. A plazmasejtes myeloma spektruma a parázsló formától az agresszív, disszeminált betegségen keresztül a plazmasejtes leukaemiáig, illetve a kóros immunglobulin lerakódás következtében kialakult betegségekig terjed.
EPIDEMIOLÓGIA
A myeloma az időskor betegsége. Az átlagos életkor a diagnóziskor 60-70 év; a betegek kevesebb, mint 2%-a a 40 év alatti. Előfordulási gyakorisága függ a földrajzi helyzettől, egy adott populáció etnikai hovatartozásától és a nemtől. Incidenciája a nyugati világban 4 új eset/100 000 lakos/év, de afroamerikaiak körében ennek több mint kétszerese. A férfiak körében valamivel gyakoribb. Az összes rosszindulatú daganat 1%-át, a malignus hematológiai betegségek kb. 10%-át (az afroamerikaiak körében 20%-át) teszi ki, így a myeloma az egyik leggyakoribb lymphoid daganat. Gyakorisága az elmúlt mintegy 60 évben közel másfélszeresére emelkedett.
Megbízható hazai epidemiológiai adatok a malignus hematológiai betegségek vonatkozásában alig állnak rendelkezésünkre, és azok is csak egy-egy régióra vonatkoznak. Ezek alapján Magyarországon évente kb. 300-350 új beteg jelentkezésével lehet számolni. A vártnál némileg magasabb számokat mutatnak a Nemzeti Rákregiszter nem tisztított adatai, mely szerint hazánkban 2008-ban 536 új myelomás beteget ismertünk fel és a regisztrált összes élő betegek száma 1382 volt.
ETIOLÓGIA ÉS PATOGENEZIS
A MM etiológiája nem ismert. A feltételezett kockázati tényezőket tünteti fel a 2. táblázat. A betegség patogenezisét illetően az elmúlt években számos új adatot ismerhettünk meg, azonban a betegség kialakulásának számos mozzanata továbbra is ismeretlen. Az interleukin 6 (IL-6) kulcsszerepe a patogenezisben ma már nyilvánvaló, de feltehetően fontos szerepet játszanak további citokinek is (IL-1(3, VEGF, MIP-1a, TNF- a, MMP-9, IGF, stb.)
MORFOLÓGIA
Csontvelő kenet: A daganatos csontvelői plazmasejtek citomorfológiája széles határok között változhat a normálistól nem, vagy alig elkülöníthető sejtektől, az éretlen, multinukleált sejteken keresztül, a pleiomorf, vagy anapláziás plazmablasztokig.
Csontvelő biopszia: A plazmasejtek száma és topográfiája kritikus faktor a diagnózisban, melynek megítéléséhez a legpontosabb adatokat a crista biopsia értékelése szolgáltathatja.
IMMUNFENOTÍPUS
A plazmasejtek terminálisan differenciált Ig-t termelő ("effektor") B-sejteknek felelnek meg, és ez tükröződik a myelomasejtek immunfenotípusában is. A myelomasejtek monotípusos citoplazmatikus Ig-t tartalmaznak, ugyanakkor hiányzik a felszíni Ig-expresszió. A termelt Ig leggyakrabban (60%) IgG, alkalmanként (20%) IgA, ritkán (2%) IgD, IgE, vagy IgM. Az esetek több mint 80%-ában mind nehéz-, mind könnyűláncok képződnek, míg a maradék esetekben, az ún. Bence-Jones myelomában csak a könnyűlánc fejeződik ki.
Legtöbb esetben a B-sejt-asszociált felszíni antigének (CD19, CD20, CD22), valamint a CD45 expressziója csökken, vagy hiányzik, ugyanakkor erős a CD38 és CD138 (syndecan-1) pozitivitás. A B-sejtek differenciálódásában kulcsszerepet játszó Pax-5 (B-sejt specifikus aktivátor protein - BSAP) transzkripciós faktor konzekvensen hiányzik. Az Ig-heterodimer antigén CD79a az esetek jelentős részében pozitív. Néhány esetben epitheliális membránantigén (EMA) expresszió figyelhető meg. A myelomás esetek jelentős részében, a normális plazmasejtekkel ellentétben, hiányzik a CD19 antigén, ugyanakkor felszíni CD56/58 expresszió észlelhető, mely a minimális reziduális betegség észlelésében nyújthat segítséget. A CD56 különösen az oszteolítikus folyamatokra jellemző, ugyanakkor a plazmasejtes leukémia esetekben általában hiányzik. Alkalmanként a daganatsejtekben CD10, CD43, és egyéb leukocyta-antigének is jelentkezhetnek. (3. táblázat)
Egyes közlemények szerint rossz prognosztikus jelnek tekinthető az IgD, IgE, vagy a CD10 pozitivitás, továbbá a nehézlánctermelődés hiánya; ezek a plazmasejtes leukaemiában gyakrabban jelentkeznek.
GENETIKAI ELTÉRÉSEK ÉS TUMORGENESIS MYELOMA MULTIPLEXBEN
A myeloma multiplex (MM) a második leggyakoribb, de egyben az egyik legkomplexebb tumorbiológiájú haematológiai malignoma. A betegség molekuláris megismerése sokáig elmaradt a leukaemiák mögött, de az elmúlt évtized forradalmi változást hozott a területen. Az új csoportosításra égető szükség volt, mert az új terápiás eljárások térnyerésével a betegek egy része >10 éves túlélő lett, míg mások változatlanul csak néhány hetet élnek a diagnézis felállítása után. A terület fejlődésében meghatározé volt a fluoreszcens in situ hibridizácié (FISH) elterjedése, a CD138-szelekcié, a közelmúltban pedig a komparatív genomikus hibridizácié (cGH) és a génexpressziés profilvizsgálat (GEP). Bár a médszerek teljessége csak a legnagyobb myeloma-centrumokban művelhető, a megszerzett informácié és azok következményei mindannyiunknak hasznosak. Bár az egyes centrumok eltérően fogalmazzák meg eredményeiket, bizonyos, hogy ugyanazt a 7-8 eltérő biolégiai viselkedésű MM altípust azonosították mindannyian. Először a csoportosítás alapja a cyclin D-expresszié és az azonosított immunglobulin-nehézláncgént érintő transzlokácié típusa volt (TC-klasszifikácié, 4. táblázat), ezt a rendszert árnyalta tovább a génexpressziés profilvizsgálat.
MS v. 4p16/TC3 v. t(4;14) transzlokációval jellemezhető altípus
A MM esetek 15%-t kitevő MMSET típust a t(4;14)(p16;q32) reciprok transzlokácié jellemzi, egészében tekintve kedvezőtlen prognézisú, agresszív, akcelerált klinikai kérlefolyást mutaté MM-forma.
A transzlokácié következtében az MMSET/WHSC1 hiszton-metiltranszferáz gén és a fibroblaszt-növekedési faktor-receptor tirozinkináz FGFR3 gén hiperaktiválédik. Az esetek mintegy 25-30%-ban az FGFR3-expresszié elveszhet, bár állatkísérletek alapján a patogenezisben fontos tényező. GEP vizsgálatok 127 gén megváltozott kifejeződését mutatták ki. Magas expressziéjú az MMSET, CCND2, N-cadherin/CDH2, dezmoglein-2/DSG2, a PBX1 B-sejt-onkogén és a Wnt-receptorok közül az FZ2 és FZD8. Csökkent kifejeződésű az ICAM4, a cadherin-7/CDH7 és a PAX5 transzkripciés faktor.
Az érintett betegek zöme IgA nehézláncot, lambda könnyűláncot termel, csaknem minden (>90%) esetben észlelhető a 13-s kromoszéma deléciéja vagy monoszémiája. Ezek a betegek kevésbé profitálnak a nagydézisú kemoterápiát követő őssejtátültetésből. A válasz rövid, a medián remisszié csak 8 hénapos. A betegek alkilezőszerekre, thalidomidra és szteroidokra gyakran és gyorsan rezisztenssé válnak vagy eleve azok. Alacsonyabb b2-microglobulinnal jellemezhető egy olyan MS alcsoport, melynek biolégiai viselkedése megegyezik, de az események lassúbb kinetikája következtében kedvezőbb klinikumú. Az allogén őssejtátültetés és a bortezomib bázisú kombináciék (pl. MPV), valamint a lenalidomid-bázisú kezelés képes lehet az IgH/MMSET transzlokácié negatív hatását részben vagy egészben felülírni.
MF v. maf/TC4 v. t(14;16) transzlokációval jellemezhető altípus
A MM betegek mintegy 5-7%-ban a MAF/MAFB transzkripciés factor tulajdonságú proto-onkogéneket érintő t(14;16)(q32;q23) vagy t(14;20)(q32;q11) reciprok transzlokácié mutathaté ki. Ritkábban a MAF géncsalád más tagjai is aktiválédhatnak. A c-maf gén kifejeződése is általában magas.
GEP vizsgálatok 284 gén megváltozott kifejeződését igazolták. Ezek közül kiemelhető a DKK1 alacsony expressziéja, ami magyarázza a csontléziék jellemző hiányát. Magasan kifejezett a CCND2, a CX3CR1 és az ITGB7 gén. Az utébbi fokozza a myelomasejtek strémához kötődését és annak VEGF-termelését, ami drogrezisztenciához és angiogenezishez vezethet. Klinikailag a csoport tagjaiban gyakori az IgA altípus, a 13-s kromoszéma érintettsége és az agresszívabb klinikai viselkedés, kedvezőtlen prognézissal.
CD-1 és CD-2 v. 11q13/TC1 és 6p21/TC2 altípusok
A t(11;14)(q13;q32) és t(6;14)(p21;q32) reciprok transzlokáciék következtében közvetlenül és magas szinten aktiválédik a cyclin D1 (CCND1) vagy a cyclinD3 (CCND3) gén kifejeződése. A MM betegek 18-20%-a hordozza ezeket a primer cytogenetikai eltéréseket.
A két cyclin D gén megnövekedett expressziéja nagyjábél hasonlé következményekkel jár, ezért különbségeik ellenére együtt tárgyalhatéak. Jellemzőjük pl. az IL-6R a-alegység alacsony expressziéja. Ugyanakkor és a cyclin D fajtájátél függetlenül a csoportban két különböző GEP mintázat figyelhető meg eltérő klinikummal. A CD-1 alosztályban hiányzik a CD59, a NOTCH2NL és a notch célgén HES-1 kifejeződése, viszont magasan kifejezett a KLHL4 transzkripciés faktor, a FYN proto-onkogén és a CEBPB/NF-IL6. A CD-2 alosztályra jellemző a B-sejt-specifikus CD20, VPREB3 és PAX5 gének kifejeződése (ezek a terminálisan differenciált plasmasejtekben normálisan már kikapcsolt B-sejt-transzkriptumok).
A csoport plazmasejtjeire jellemző a CD20-pozitivitás, a lymphoplasmocytoid morfolégia és a hyposecretor betegség. Az IgM-myelomások többsége (ez WM-től elkülönítő ismérv), míg a könnyűlánc-amyloidosisos betegek mintegy fele hordozza ezt a transzlokáciét. A legtöbb MM vizsgálatban a t(11;14) transzlokácié kedvezőbb prognézis hírnöke (egyesek szerint a csoport különösen profitál a nagydézisú kemoterápiát követő őssejt-átültetésből), de legtöbbször ez nem éri el a statisztikai szignifikanciát. Ennek oka az, hogy néhány esetben különösen agresszív lefolyás, pl. primer plasmasejtes leukaemia észlelhető t(11;14) mellett. Specifikus terápiás következménye e transzlokácié azonosításának jelenleg nincsen, több megfigyelés szerint a bortezomib monoterápiára adott válasz az átlagosnál rosszabb.
HY v. D1/TC5 és D1+D2/TC6 v. hyperdiploid altípus
A hyperdiploid myeloma-típus jellemzője a 3,5,7,9,11,15,19 és 21-s kromoszómák triszómiája. Ez a biológiai forma a frissen felfedezett MM esetek mintegy felét jellemzi. GEP alapján ide tartozhat még egy további csaknem 10%-os gyakoriságú, páratlan kromoszómák triszómiájával járó, de egyidejű kromoszóma-vesztések miatt gyakorlatilag diploid forma is. A csoport tagjainak közös jellemzője a CCND1 jelzett, de nem nagyon magas kifejeződése, az IL6-R hiánya és a standard klinikai prognózis. A GEP eredményekből kiemelhető a magasan kifejezett FRZB és DKK1 Wnt-antagonisták valamint EDNRB endothelin csalireceptor - következményes sok klasszikus csontlézióval. Magas az interferon-indukálta gének expressziója is. Ugyanakkor alacsony a CD52 és az 1q-n elhelyezkedő TAGLN2, CKS1B és OPN3 gének kifejeződése. Ebben a GEP-altípusban ritka az 1q-nyerés és a 13-s kromoszóma deléciója. A hiperdiploid csoporton belül a francia (IFM) munkacsoport azonosította az 5-s kromoszóma nyerését, mint a kedvezőbb prognózisért felelős triszómiát, de ez a megfigyelés még megerősítést kíván.
Klinikailag a csoport tagjai gyakrabban fordulnak elő idősebb korban, jó a válasz mind a hagyományos, mind az új szerekre, mind pedig a nagydózisú kemoterápiát követő őssejt-átültetésre.
LB vagy alacsony csontérintettségű altípus
A MM betegek mintegy 12%-a tartozik ebbe a GEP alapján felismert altípusba. Közös jellemzőjük az MRI-vel felismerhető fokális léziók hiánya és alacsony intenzitású FDG-felvétel PET-vizsgálat során.
Egyesítő molekuláris jellemzőjük az endothelin-1 magas expressziója, ami osteoblast-képződéshez vezet. Magas továbbá az IL-6R és a BIK apoptózisgén valamint a CCND2 kifejeződése, míg alacsony a CCR2 kemokinreceptor, a MIF-1a és a SMAD1 expressziója. A klinikai prognózis relatíve kedvező.
PR vagy proliferatív altípus
A proliferatív MM-altípus jellemzője a sejtciklus-progresszió és a sejtproliferáció génjeinek magas szintű kifejeződése (CCNB2, CCNB1, MCM2, CDCA2, BUB10, CDC2, TYMS) és a carcinoma/here antigének (MAGEA6, MAGEA3, GAGE1 és GAGE4) expressziója. Diagnóziskor a myelomás esetek 10%-a tartozik ebbe a csoportba. A myelomasejtek magas proliferációs indexet mutatnak és gyakran eredményes a metafázis cytogenetika. Ennek eredményeként mind hyperdiploid mind nem hyperdiploid karyotípus előfordul. Az altípus a kórlefolyás során progressziós eseményként is létrejöhet, hátterében másodlagos transzformációs esemény áll. A túlélés rossz, az új szerek érdemi áttörést itt nem hoztak, jelenleg vizsgálatok tárgyát képezi, hogy agresszív lymphomákhoz hasonlóan a "dose-dense" kezelés alkalmazása javíthat-e ezen betegcsoport sötét kórjóslatán.
Nem besorolható "kontaminált" altípus
A myelomás betegek mintáinak mintegy ötöde a mai GEP-t is magába foglaló módszerekkel sem besorolható. Ennek oka a minták alacsony plasmasejtszáma, tisztítás ellenére fennmaradt egyéb sejtes szennyeződés. Mindazonáltal a "kontaminációs" jel kimutatása alacsony plasmocytosis, alacsonyabb b2-microglobulin és kedvezőbb prognózis előhírnöke lehet.
Jelent-e valamit a A13 azonosítása?
Történetileg a A13 volt az elsőként azonosított kedvezőtlen genetikai prognosztikai tényező (85% monoszómia, 15% deléció). Későbbi adatok arra utaltak, hogy ez az eltérés más kromoszóma-aberrációk jelenlétének kísérőmarkere. Adatok utaltak arra, hogy hyperdiploiditás esetén a FISH-sel azonosított A13 nem kedvezőtlen. Ezt a képet a GEP vizsgálatok érdemben árnyalták. A13 esetén 67 csökkent kifejeződésű gént találtak, ebből 44 nem meglepő módon a 13-s kromoszómára lokalizált, 7 gén a 11-esre. Kiemelkedő fontosságú lehet az RB1 csökkent, míg az IGF-1R magas kifejeződése. Az 1q21-1q24 régió génjei viszont jellemzően magas expressziójúak. Az adatok arra utalnak, hogy az 1q-addíciós esetek általában A13 rendellenességgel is bírnak, míg a 11-s triszómia ilyenkor viszonylag ritka. Amennyiben csak a hyperdiploid formákat vizsgáljuk, úgy két eltérő molekuláris profilt találunk. Az egyikre a 11-s triszómia jellemző, a másikra pedig az 1q-többlet és a 13q-deléció, viszont ritka a 7-s és 11-s triszómiája. Ez a csoport klinikai evolúciót gyakran mutató MM betegség.
Összefoglalva: a A13 eltérés nemcsak a kedvezőtlen hypodiploid transzlokációk kísérője, hanem egy hyperdiploid altípus jellemzője is lehet, melynek bár közvetlen prognosztikai következménye bizonytalan, további vizsgálatokat és terápiát irányíthat.
A A17p13/TP53 deléció jelentősége
A TP53 tumorszuppresszorgén károsodása / elvesztése a sejtciklus-progresszió és a DNS-károsodásra adott apoptózis zavarához vezet. Ez az eltérés az új betegek <10%-ban van jelen és kedvezőtlen prognózis független rizikofaktora valamennyi vizsgálatban, melyet még allogén őssejt-átültetés sem képes áttörni. A GEP vizsgálatok eredménye arra utal, hogy MM-specifikus p53-célgének deregulációja áll az agresszív klinikai viselkedés hátterében.
Klinikailag e formát jellemzi az agresszív betegség-természet, gyakori extramedullaris betegség, gyakori hypercalcaemia és plasmasejtes leukaemia; következményes rövid túléléssel. A 17p53 delécié nemcsak rövid progressziémentes túlélésre, hanem központi idegrendszeri manifesztáciékra is hajlamosít. A modern kezelési médokkal is csak szignifikánsan ritkábban érhető el a szokottnál rövidebb ideig tarté CR. A kezelésben nem hasznosak a DNS-károsíté hagyományos citosztatikumok, az irradiácié, a thalidomid vagy a lenalidomid. Hatásos lehet a nagydézisú szteroid, a bortezomib, a bendamustin és az mTOR-gátlék vagy ezek valamilyen kombináciéja. Nagyobb esetszámú klinikai vizsgálatok közül csak a VDT-PACE alapú "totál kezelés 3" eredményei elfogadhatéak ebben a cytogenetikai csoportban.
II. Diagnosztika
KLINIKAI MEGJELENÉS
A plazmasejtes myeloma klinikai tüneteinek kialakításáért a monoklonális Ig-ok termelődése, a szérumban és a vizeletben való felszaporodása, esetleg a szövetekben történő lerakódása, az anémia, lítikus csontfolyamatok, hiperkalcémia, veseelégtelenség, továbbá a dysgammaglobulinaemiával kapcsolatba hozható immundeficiencia a felelősek. A vezető tünetek közül a csontfájdalmak, a gyorsult süllyedés, a vesekárosodás és az anémia emelhetők ki. Myelomára gyanút keltőek a megmagyarázhatatlan hátfájdalmak, a magasság csökkenésre, a radiológiailag kimutatható osteoporózisra utaló eltérések, illetve visszatérő fertőzések. A tünetmentes betegek rutin vizsgálatokkal véletlenszerűen diagnosztizálhatók.
AJÁNLOTT LABORATÓRIUMI VIZSGÁLATOK A DIAGNÓZIS, PROGNÓZIS ÉS KOCKÁZAT MEGÍTÉLÉS CÉLJÁBÓL
A diagnézist a szerum- és vizeletfehérje eltérései, a csontvelői plazmasejt szaporulat és a csontok radiolégiai eltérései biztosítják. A betegségcsoport megjelölésére használt monoklonális gammopathia a kéros fehérjeszaporulatra is utal. Monoklonalis fehérje, M-protein, illetve paraprotein elnevezéssel azt az immunglobulin-eltérést jelöljük, amely csak egy osztályba és alosztályba tartozé nehéz (y, a, ritkán 8, e, u.) és egy típusú könnyű láncot (k vagy X) tartalmazé fehérje megszaporodásával jár.
A diagnézis felállításához az alábbi vizsgálatok elvégzése szükséges, illetve lehetséges:
- Rutin laboratériumi vizsgálatok:
vérkép, We, CRP, KN, Kreat, LDH, albumin, húgysav, Ca, P, 132-mikroglobulin
- Immunglobulin vizsgálatok:
= Első vizsgálat: agaréz elektroforézis
(keskeny alapú magas tüske a y vagy a (3 hullám területén) = További vizsgálat:
- Az Ig osztály meghatározására
-Immunfixácié (a dg megerősítésére: klinikai gyanú, de negatív elfo esetén és a kezelés eredményének megítélésére) -Nephelometria
- Szabad könnyűlánc (FLC) meghatározás
- Ig Mennyiségi meghatározás (szekunder antitesthiány?)
- Csontvelő vizsgálat:
= első vizsgálat: aspirácié
- Morfolégiai vizsgálat = további vizsgálatok:
- Aspirátumbél:
- Genetika (FISH jobb, mint a klasszikus cytogenetika)
- Flow cytometria: phenotípus
- Proliferáciés index (S fázis)
- Biopsiából:
- MRD (összehasonlíté vizsgálat)
- Klonalitás vizsgálat immunhistokémiával, immunfluorescenciával.
- Radiolégiai.vizsgálatok:
= Első vizsgálat: csont(gerinc, koponya, medence, humerus, femur) röntgen felvételek
= További vizsgálatok- CT: érzékenyebb, mint a rtg., extramedulláris részvétel igazolására is jó lehet
- MRI: gócos vagy diffúz, szoliter vagy multiplex myeloma,poroticus vagy myelomás csigolya collapsus, gerincvelő compresszió kérdéseit is megválaszolja
- Scintigraphia: myelomában kevéssé informatív
- 99m Tc-sesta MIBI scintigráfia (technetium - 2 metoxy - isobutil -isonitril): Kezelés utáni status megítélése: pl. non secretoros betegség esetén
- PET: reziduális betegség (MRD) és transzplantáció utáni remisszió megítélésére is jó (plasmocytomákkal járó betegségekben)
DIAGNOSZTIKUS KRITÉRIUMOK
A Nemzetközi Myeloma Munkacsoport (IMWG) meghatározása szerint a kezelést igénylő szimptomás MM diagnózisának kimondásához az 5. táblázatban feltüntetett mindhárom feltételnek teljesülnie kell.
Fontos az MGUS (monoclonal gammopathy of undetermined significance) és a lappangó (smoldering) myeloma elkülönítése a szimptómás myelomától, mivel az előbbieket nem kell kezelni, csak fokozottan megfigyelni. (6. táblázat)
A MGUS (régebben benignus gammopatiával jelölt laboratóriumi szindróma) évente 1%-a myelomába transzformálódik. Az aszimptomatikus (smoldering, indolens) myelomák általában 12-36 hónap alatt torkollanak kezelést igénylő formákba.
DIFFERENCIÁLDIAGNOSZTIKA
REAKTÍV PLAZMASEJT SZAPORULAT A CSONTVELŐBEN
Emelkedett We esetén gyakran kerül sor klinikai kivizsgálásra myeloma irányába. A csontvelőben ilyenkor reaktív csontvelői plazmocytosis fordulhat elő, melynek természetét a plazmasejtek klonalitásának a vizsgálatával lehet tisztázni.
WALDENSTRÖM-MACROGLOBULINAEMIA
(LYMPHOPLASMOCYTOID LYMPHOMA)
A klinikai kép és az immunfenotípus alapján a myeloma és a WM/LPL általában jól elkülöníthetők. WM esetén a következő két kritériumnak egyaránt jelen kell lenni:
1. IgM monklonalis gammopathia (tekintet nélkül az IgM protein méretére)
2. > 10% csontvelői lymphoplasmocytás beszűrődés (rendszerint intertrabecularis), amelyek plasmocytoid vagy plazmasejtes differenciálódást mutatnak egy tipikus immunfenotípussal: felületi IgM +, CD 5+/-, CD10-, CD19+, CD20+, CD23-. A fenti konstelláció biztonsággal kizárja az egyéb lymphoproliferatív betegségek (így a CLL vagy mantle cell lymphoma) lehetőségét. A myeloma sejtek CD56, CD38, CD138 pozitivitása, illetve a kissejtes myeloma cyclin D1 pozitivitása szintén segíthet a differenciáldiagnosztikában. A CD38 és CD56 coexpressziója diagnosztikus eltérésként értékelendő myeloma vonatkozásában. (3. táblázat)
LOKÁLIS PLAZMOCYTOMA
A következő négy kritériumnak kell megfelelni:
1. biopsziával igazolt csont vagy lágyszövet klonalis plazmasejt tumora
2. normális csontvelői kép klonalis plazmasejt szaporulat nélkül
3. negatív csont MRI (gerinc és medencecsont) az érintett régió kivételével
4. myelomára jellemző célszerv károsodás (CRAB) hiánya
SZISZTÉMÁS AMYLOIDOSIS
A következő négy kritériumnak kell megfelelnie:
1. Amyloid-"related" szisztémás szindroma jelenléte (pl. vese, máj, szív, gyomor-bél traktus vagy perifériás ideg érintettség)
2. Kongóvörös amyloid festés pozitivitása bármely szerv szövettani metszetében (pl. zsír aspiratum, csontvelői aspiratum, vagy szerv biopszia)
3. könnyűlánc amyloid direkt bizonyíthatósága (immunhisztokémia stb.)
4. monoklonalis plazmasejt proliferatív betegség bizonyíthatósága (szérum vagy vizelet M-protein, kóros szabad könnyűlánc arány, klonalis plazmasejt a csontvelőben)
Megjegyzés: Az AL-amyloidosis-ban szenvedő betegeknek kb. 2-3%-nál nem teljesülnek a monoklonalis plazmasejt rendellenesség megállapításához szükséges fenti kritériumok. Ezen betegeknél csak nagy óvatossággal lehet kimondani az AL amyloidosis diagnózisát.
"POEMS" SZINDROMA (polyneurpathia, organomegalia, endocrinopathia, monoklonalis protein, bőrelváltozások ["skin changes"])
A következő három kritériumnak kell megfelelni:
1. monoklonalis plasmasejt szaporulat
2. perifériás neuropathia
3. legalább egy a következő hét jellemző közül:
a) osteoslcerotikus csont laesio
b) Castleman betegség
c) organomegalia
d) endocrinopathia (kivéve diabetes mellitus és hypothyreosis)
e) oedema
f) tipikus bőrelváltozások
g) papilla oedema
Megyjegyzés: Nem mindegyik POEMS szindrómában szenvedő beteg felel meg a fenti kritériumoknak; a jellemzők időszakos kapcsolatban lehetnek egymással és más oknak nem tulajdoníthatók. Az osteosclerotikus léziók hiánya gyanússá teheti a diagnózist. A szindróma közös jellemzői a vascularis endothelialis növekedési faktor plazmaszintjének a növekedése és a thrombocytosis. Ezek a jellemzők sokat segítenek, ha a diagnózis felállítása nehézségekben ütközik.
A fentieken kívül M-protein jelen lehet még számos egyéb betegségben is, mint pl.: CLL, egyéb B-sejtes non Hodgkin lymphomák, autoimmun betegségek, chr. hepatitis, metastatikus szolid tumorok stb.
STÁDIUM BESOROLÁS
A Durie-Salmon klinikai stádium beosztást 1975-ben dolgozták ki a MM tumor-terhelés mérés gyakorlati módjának megvalósítása céljából. (7. táblázat)
Bár a Durie-Salmon rendszer prognosztikai értéke jól kiegészíthető MRI és /vagy FDG-PET vizsgálattal, ez utóbbiak magas áruk és nehezebb hozzáférhetőségük miatt a gyakorlatban nem terjedtek el. (8. táblázat)
Számos korábbi helyett ma két paraméter (szérum albumin és P2 mikroglobulin) segítségével definiálható nemzetközi prognosztikus index meghatározását javasolja az IMF. (9. táblázat)
A megfelelő therapia megválasztása érdekében a fokozott rizikót jelentő genetikai és sejtkinetikai eltéréseket is tisztázni kell. Fokozott rizikót jelent a t(4;14), t(14;16), -13, del 13q, 17p-, nem hyperdiploid kromoszómaszám, illetve magas proliferációs ráta (plazmasejt labeling index). (10. táblázat)
Természetesen az idősebb, rossz általános állapotú, anémiás, thrombocytopeniás, azotaemiás, emelkedett LDH vagy CRP szintű, plazmoblastos morphológiájú betegek prognózisa rosszabb.
III. A myeloma multiplex kezelése
Alapelv: csak az aktív és progresszív szakban lévő beteget kell (és szabad) kezelni!
Leggyakrabban a fájdalom, máskor a cytopenia következményei, idegrendszeri, vagy más szervi károsodás, veseelégtelenség, hypercalcaemia, az M-protin növekedése jelenti a javallatot. MGUS, SMM ("smoldering myeloma"), indolens myeloma esetén kezelés nem, de gondos megfigyelés szükséges. Tünetmentes betegeknél stabil állapot lehetséges hosszú időn keresztül. Azoknál a betegeknél, akiknél radiológiai csontbetegség mutatható ki, a kezelést meg kell kezdeni. A kezelésre adott válasz, valamint a túlélési idők meghatározására alkalmas kritériumrendszereket a 11.12. és 13. táblázatok-ban foglaltuk össze.
A KEMOTERÁPIÁS KEZELÉS STRATÉGIÁJA
Ma a MM induló terápiájának kiválasztása alapvetően attól függ, hogy a beteg potenciálisan alkalmas-e a nagydózisú (high-dose therapy, HDT) kezelésre és őssejt átültetésre, vagy nem. Ennek megítélése pedig alapvetően a beteg életkorától és általános állapotától, esetlegesen a társbetegségektől (és a beteg együttműködésétől) függ. Meg kell azonban jegyezni, hogy az előrehaladott életkor és a veseelégtelenség nem jelenti automatikusan az őssejt átültetés ellenjavallatát. Korábban
Magyarországon az autológ őssejt átültetés életkori határa a 65 év volt, amely életkori határ fokozatosan kitolódik a 70 év felé, hangsúlyozva ezen a területen sokkal inkább a biológiai állapot (comorbiditási adatok) megítélésének a fontosságát. A myeloma multiplex kezelésének ma javasolt algoritmusát a 14. táblázatban foglaltuk össze.
PRIMER INDUKCIÓS KEZELÉS A TRANSZPLANTÁCIÓRA NEM JELÖLT BETEGEKEN
A transzplantációra nem alkalmas betegek kezelésére a legutóbbi évekig csak a melphalan + prednisolon (MP) vagy a cyclophosphamid + prednisolon (CP) állt rendelkezésre. Erre a betegeknek csak kb. 50%-a reagált valamilyen mértékben, de teljes (CR) vagy csaknem teljes (nCR) reagálás már csak 7%-ban következett be. Az utóbbi években számos tanulmányban vizsgálták az új myeloma ellenes gyógyszerek hasznát (thalidomid, bortezomib, lenalidomid) a hagyományos MP-hez képest. A Melphalan + Prednisolon (MP) kezelést volt javasolt választani az új szerek megjelenése előtt a kezdeti kezelés céljából azon betegek legtöbbjén, akiken HDT-t nem terveztünk. Vesekárosodás esetén a melphalan csak óvatosan adható. A cyclophosphamid azoknál a betegeknél volt induló kemokezelés, akik egyébként melphalant kaptak volna, de az utóbbi nem volt lehetséges az alacsony neutrophil és/vagy thrombocyta szám miatt. A cyclophosphamidot csak óvatosan lehet adni vesekárosodott betegeknek. Az új gyógyszerek megjelenése óta ez a kezelési forma gyakorlatilag kivonult a terápiás repertoárból.
Az új antimyelomás szerek megjelenése előtt számos alkiláló alapú kombinált protokollt alkalmaztak a világban a jobb válasz reményében. Őssejt átültetésre nem alkalmas betegeknél később bebizonyosodott, hogy ezen kombinációknak nincs előnyük a MP-vel szemben, a kedvezőbb remissziós arányt lerontotta a lényegesen magasabb mellékhatás arány.
Thalidomid
A legutóbbi időben öt randomizált klinikai tanulmány vizsgálta az MP + thalidomid hasznát az MP kezeléshez képest. Minden tanulmány arra a következtetésre jutott, hogy az ORR jelentős mértékben megnövekedett, továbbá a TTP, PFS, illetve EFS idő jelentősen meghosszabbodott. Az OS jelentős mértékű javulásáról azonban csak két tanulmány számol be.
Bortezomib
A bortezomib és MP (VMP) összehasonlító vizsgálatát az MP kezeléssel a "Vista" tanulmány végezte el. Megállapították, hogy a VMP minden előre meghatározott szempontból lényegesen előnyösebb, mint az MP, beleértve a CR arányt, az ORR, TTP és OS időtartamokat is. A VMP előnyösebb az MP-nél a következő kezelésig eltelt idő (TTNT) és kezelésmentes időszak (TFI) vonatkozásában is. A TTNT a VMP kezelési módnál 28 hónap volt a VMP-nél tapasztalt 19 hónappal szemben, a TFI pedig 16,6 hónap a 8,4 hónappal szemben. A tanulmány szignifikáns összefüggést igazolt a komplett remisszió (CR) és a betegek életminőségi adatai (HRQL: health-related quality of life) között is. A rossz általános állapotú, idős betegek esetében hasznos lehet a bortezomib csökkentett gyakorisággal történő adása (heti 1x).
Lenalidomid
A lenalidomidot szintén vizsgálták a transzplantációra nem tervezett újonnan diagnosztizált myelomás betegek elsődleges kezelésére. Egy I/II. fázisú tanulmányban azt találták, hogy a lenalidomide kombinálása MP-vel (MPR) 81%-os ORR és 24%-os CR arányt eredményezett (Palumbo és mtsai). A 29,5 hónapos nyomon követési idős során az átlagos TTP és PFS idő 28,5 hónap, a 2 éves OS arány pedig 90,5% volt. A leggyakoribb súlyos mellékhatás a neutropenia, thrombocytopenia és thromboembólia volt. Az előzetes eredmények arra engednek következtetni, hogy az MPR kezelés hasznos lehet a transzplantációra nem kerülő betegek kezelésére.
Egy másik III. fázisú tanulmány a lenalidomid + szokványos dózisú dexamethasone (RD) kezelést hasonlította össze a lenalidomide + csökkentett dózisú dexamethasone (Rd) kezeléssel 65 év feletti myelomás betegeknél. Megállapították, hogy az 1 éves túlélési arány magasabb az Rd kezelésben részesülő betegeknél, mint az RD kezelésben részesülőknél (94%, illetve 83%, p=0,04)
Az előzőekben leírt protokollok mellett a transzplantációra jelölt betegek esetében alkalmazott kezelési módok is használhatók a transzplantációra nem jelölt betegeknél is indokolt esetekben.
Nagy dózisú dexamethasone (HDD)
A HDD kezelés terápiás indikációja egyre szűkebb, olyan betegeknél jön szóba, akiknél a cytotoxicus kemokezelés kontraindikált (pl. súlyos pancytopenia), vagy akiknél extensív helyi radiokezelés válik szükségessé. Kiinduló kezelésként hasznos lehet a HDD súlyos vesekárosodásban szenvedőknél is. A dexamethason (vagy ekvivalens dózisú egyéb szteroid) pulzus súlyos, rezisztens relapsusok sürgősségi kezeléseként ma is elfogadott. Legfőbb gond a magas toxicitási ráta, ezért egyre több próbálkozás van a dózis lényeges (felére-harmadára) csökkentésére vagy kevésbé toxicus szteroid készítménnyel való helyettesítésére. (Biológiai ekvivalens dózisok: 40 mg dexamethasone=213 mg metylprednisolon=270 mg prednisolon.)
PRIMER INDUKCIÓS KEZELÉS AZ ŐSSEJT TRANSZPLANTÁCIÓRA JELÖLT MYELOMÁS BETEGEKEN
A 65 (70) évnél nem idősebb, ellenjavallatot képező társbetegség nélküli betegeknél minden esetben fontolóra kell venni az ASCT-t egy rövid ideig tartó (3-4 ciklus) indukciós kezelés után. Az utóbbi években számos tanulmányban kiemelték, hogy a betegség transzplantáció utáni kimenetele javult az új gyógyszerek alkalmazásával, mivel ezekkel lényegesen nagyobb arányban lehet komplett remissziót (CR) vagy nagyon jó minőségű részleges remissziót (VGPR) elérni, mint a korábban standard VAD indukciós kezeléssel. Randomizált III. fázisú vizsgálatok alapján a következő ASCT-t megelőző kezelési prtokollok javasolhatók: bortezomib + dexamethasone, VTD, CTD, PAD, TAD (l. 14. táblázat). A thal/dex hatékonysága úgy tűnik, elmarad a fentiektől (hasonlóan a VAD-hoz).
A kezelési terv elkészítésénél figyelembe kell venni a beteggel, illetve a betegségével kapcsolatos tényezőket, pl. nagykockázatú betegség fennállását, a kísérő betegségeket és egyéb komplikációkat. Veseelégtelenség esetén a bortezomib-alapú kezelési módokat kell választani, mivel az eddig összegyűjtött adatok azt mutatják, hogy ennek a gyógyszernek pozitív hatása van a betegség lefolyására. A már előzetesen meglévő polyneuropathia (PN) esetében a lenalidomidot tartalmazó kombináció előnyös lehet, mivel az nem neurotoxikus. A kórelőzményben vénás thromboembólia megléte a bortezomib használatát indikálhatja. A nagy-kockázatú cytogenetikai rendellenességben szenvedő betegeknél, különösen a del(17p) és t(4;14) esetében a bortezomib hatékony és a prognosztikai hátrányt kiegyenlítheti.
NAGYDÓZISÚ KEMO-KEZELÉS ÉS ŐSSEJT-ÁTÜLTETÉS
A myeloma multiplex kezelésében az első áttörést a nagydózisú melphalan adása és az ehhez szükséges őssejt-átültetés (HDT+ASCT) rutinná válása hozta. Az új myeloma-ellenes szerek megjelenése és elterjedése sem módosította a korábbi megfigyeléseket: mivel a kezelés célja a minél nagyobb arányú és minél mélyebb (komplett) remisszió elérése, nagydózisú melphalan adása és az ezt követő ASCT az erre alkalmas betegek kezelésének fontos része maradt. A HDT-ASCT javasolt a primer kezelés részeként erre alkalmas beteg indukciós kezelésének konszolidáló lépéseként, első vonalban (evidencia 1). Alkalmasnak tekinthető a súlyos/életveszélyes kísérőbetegséggel nem rendelkező 65 éven aluli és a jó általános állapotú, fitt 65-70 éves beteg, 70 év felett az alternatív kezelési módok már előnnyel bírnak. Veseelégtelenség az őssejt-átültetésnek nem ellenjavallata, egyes esetekben a beavatkozás a vesefunkciók javulását eredményezheti. Az őssejt-átültetést megfelelő tumortömeg-csökkentő indukciós kezelésnek és őssejt-mobilizációnak, -gyűjtésnek kell megelőznie. Az indukciós kezelésnek nem őssejt-toxikus terápiát kell választani. Az autológ transzplantációt megelőző kondícionálásnak standard módja a 200 mg/m2 dózisú melphalan, a teljestest-besugárzás túl toxikusnak bizonyult. A kondícionáló melphalan bortezomibbal történő kiegészítése ma még nem standard. In vitro purging alkalmazása nem nyújt eredményt, az őssejtgyűjtést megelőzően elért minél jobb remisszió in vivo purgingnek tekinthető. Kettős vagy tandem autológ őssejt-átültetés nem standard eljárás, akkor alkalmazható, ha a myelomás beteg az első átültetés kapcsán nem került legalább VGPR-be (evidencia 2B). A transzplantációt követő konszolidáló kezelés a tandem átültetés reális alternatívája lehet.
Allogén őssejt-átültetés: myeloma multiplexben az elsővonalban alkalmazott allogén őssejtátültetés nem standard beavatkozás. Allogén őssejt-átültetés jó általános állapotú, 55 év alatti olyan beteg második remissziójában javasolható, akinek van családi (testvér) donora (evidencia 3). A redukált intenzitású kondícionálás nem váltotta be a hozzá fűzött reményeket ebben a betegségben, a teljes dózisú kondícionálás toxicitása igen nagy (25-40% 1 éves mortalitás), a beavatkozást csak a beteg teljes körű tájékoztatása keretében szabad felajánlani. Nem rokon donoros (MUD) átültetés a transzplantáció rizikoját kis mértékben tovább növeli. Donorlymphocyták transzfúziója a transzplantációt követően a graft-versus-myeloma hatásnak köszönhetően képes lehet kezdeti relapsust ismételt komplett remisszióvá konvertálni.
FENNTARTÓ-KONSZOLIDÁLÓ KEZELÉS
Az elsővonalbeli kezeléssel elért remisszió fenntartására, a remisszió fokának mélyítésére szolgálhat a fenntartó kezelés. A fenntartó kezelés csak viszonylag kis tumortömeg mellett hatékony, célja a progresszióig eltelt idő meghosszabbítása. Autológ őssejt-átültetést követően elért remisszióban a fenntartó/konszolidáló kezelés a progressziómentes túlélést - addícionális költségek és toxicitás mellett - megnövelni képes lehet, a teljes túlélésre gyakorolt hatás bizonytalan. Fenntartó myelotoxikus kemoterápiás kezelés ellenjavallt, nem hatásos.
Fenntartó kortikoszteroid-kezelés (másodnaponta 50 mg methylprednisolon) egy régebbi nagy vizsgálat szerint hatékony lehet, de toxikus, ma már jobb alternatívák birtokában csak ritkán javasolható.
Fenntartó a-interferon-kezelés nagy vizsgálatok szerint a progressziómentes túlélés mintegy féléves nyújtására lehet képes, sok mellékhatással, a teljes túlélésre gyakorolt szignifikáns hatás nélkül. A szokásos adag másnaponta 1.5-3 MIU s.c. Ugyanakkor a betegek egy kisebb részében a szer alkalmazása igen hosszú remissziós időt és ezáltal a teljes túlélésben szignifikáns előnyt eredményezhet.
Egy vizsgálat eredményei szerint az IFN-kezelésre adott választ az NFKBI-gén 94ins/delATTG polimorfizmusa határozza meg; amennyiben ez az eredmény megerősítésre kerül, úgy kiválaszthatóakká válhatnak a kezelésből leginkább profitáló betegek. Az autológ átültetést követően alkalmazott thalidomid fenntartó kezelés hatékonyan képes megnövelni a progressziómentes túlélést és egyes vizsgálatokban a teljes túlélést is. Nincs egységesen javasolható thalidomid-dózis: 50-200 mg közötti dózisokkal történtek a meghatározó klinikai vizsgálatok. Az eredményekből kitűnik, hogy transzplantációval elért komplett remisszió esetén a fenntartó kezelésnek nincsen érdemi előnye. Ugyanez elmondható az egy évnél hosszabb thalidomid-kezelésről is, a legtöbb nemzetközi ajánlás ma 6-12 hónapos fenntartó terápiát javasol. Legnagyobb előnyt a thalidomid-kezelés azon betegek számára nyújt, akiknél a kezelés hatására a remisszió foka mélyül és komplett remisszió jön létre, vagyis nem annyira fenntartó, mint poszt-transzplantációs konszolidáló kezelésről van szó.
Az igen költséges thalidomid-analóg lenalidomid fenntartó kezelésként való alkalmazása előzetes vizsgálati eredmények szerint igen kedvező lehet, e korai eredmények megerősítése szükséges a rutinszerű ajánláshoz. Ugyanez mondható el a poszttranszplantációs VTD (brtezomib-thalidomid-dexamethason) konszolidációs terápiáról: egy vizsgálatban kiemelkedő eredményeket (molekuláris komplett remissziók létrejötte és fennmaradása) mutatott fel, megerősítő vizsgálatok szükségesek a rutinszerű ajánláshoz.
SPECIÁLIS KEZELÉSI HELYZETEK
A vese károsodása komoly és súlyos komplikáció myelomában. A vesekárosodás gyors kezelést igényel a tumorterhelés csökkentése céljából, amely így nem károsítja tovább a vesét, sőt bizonyos esetekben lehetővé teszi a veseműködés helyreállítását.
Számos tanulmány igazolta, hogy a bortezomib hasznos a vesekárosodásban szenvedő myelomás betegek kezelésében. Gyorsan hat, eliminációja nem függ a vese kiválasztó képességétől, nem szükséges dózis redukció még azon betegeknél sem, akik dialízisre szorulnak. Ezen kívül a bortezomib közvetlen hatással van a myelomás vesére, mivel gátolja a NF7KB-t, melynek fokozott aktivitása szerepet játszik a progresszív vesebetegség kialakulásában. Egy II. fázisú klinikai vizsgálatban az akut veseelégtelenségben szenvedő myelomás betegek 62%-nál a bortezomib, doxorubicin, dexamethasone (PAD) kezelés lényeges vesefunkció javulást hozott, 31%-nál pedig a veseműködés csaknem helyreállt (GFR>60 ml/perc).
A thalidomid szintén ésszerű választási lehetőség lehet a veseelégtelenségben szenvedő betegek kezelésére. Farmako-kinetikai vizsgálatok igazolták, hogy nincs korreláció a vese thalidomidra vonatkozó kiválsztóképessége és a veseműködés között, valamint a reagálási arány és a tolerálhatóság nem különbözik a veseelégtelenségben szenvedő és a normális vesefunkcióval bíró betegek között. A veseműködés helyreállása volt megfigyelhető azon betegek többségénél, akiknek a betegsége reagált thalidomid kezelésre.
A lenalidomidott elsődlegesen a vesék választják ki, ezért nagyon lényeges a megfelelő dózisredukció vesekárosodás esetén. A melphalan, cyclophosphamid, idarubicin (illetve metabolitjaik) egyaránt a vesében választódnak ki és nephrotoxikusak. A cyclophosphamid dózisát 50%-al kell csökkenteni ha a GFR 10 ml/perc alatt van és 25%-al ha a GFR 10-50 ml/perc. A melphalan ellenjavallt, ha a GFR 20 ml/perc alatt van, 50 ml/perc alatt 50%-os dózisredukció szükséges. Veseelégtelenségben az MM kezdő terápiájának jelenleg legjobban a VDT kezelés ajánlható.
CITOGENETIKAI RENDELLENESSÉGEK HATÁSA A KEZELÉS MEGVÁLASZTÁSÁRA
A MM betegséget különböző kromoszóma eltérések jellemezhetik, amelyek prognosztikai információkat hordoznak. A nagy kockázatú betegség jellemzői a 17. kromoszóma deletio [del(17)], a 4. és 14. kromoszóma transzlokáció, [t(4;14)], a 14. és 16. kromoszóma transzlokáció [(t14;16)], amelyet fluorescens in situ hybridizációval (FISH) lehet a legegyszerűbben kimutatni, továbbá a metafázis citogenetikai vizsgálattal kimutatható 13. kromoszóma deletio [(del(13)], valamint a hypodiploiditás jelenléte. (10. táblázat)
Az új gyógyszerek alkalmazásával lehetőség van arra, hogy javítani lehessen a betegség kimenetelét azon betegeknél, akiknél kedvezőtlen prognosztikai tényezők figyelhetők meg. Úgy tűnik, hogy a bortezomib hatékony lehet a cytogenetikai rendellenességekben szenvedő betegek esetében is , amit számos tanulmányban megfigyeltek.
Azoknál betegeknél, akiknél a betegséget újonnan diagnosztizálták és bortezomib tartalmú kezelést kaptak, a reagálási arányt, a TTP-t és OS időtartamot nem befolyásolta negatívan a t(4;14), vagy del(17p). Megállapításra került, hogy a transzplantációra jelölt betegeknél a bortezomib tartalmú indukciós kezelés hatékonyabb a cytogenetikai abnormalitásokat hordozó betegeknél, mint a VAD kezelés. Az IMF által végzett tanulmány - melynek során bortezomib + dexamethasone kezelést alkalmaztak szemben a VAD protokollal - megállapították, hogy a bortezomib + dexamethasone kombináció eredményeként a >VGPR arány jelentősen nagyobb volt a VAD kezelési módnál azon betegeknél, akiknél t(4;14) és/vagy del(17p)-t detektáltak.
Ehhez hasonlóan egy Olaszországban végezett tanulmány során a bortezomib alapú induló kezelés tanulmányozása folyamán megállapították, hogy a VTD kombináció a CR + nCR arány tekintetében sokkal előnyösebb a TD-nél azon betegek esetében, akiknél t(4;14)-et és/vagy del(17p)-t állapítottak meg.
A thalidomid adása a TT2 (total therapy 2) tanulmány során sokkal hosszabb túlélési időt eredményezett bizonyos cytogenetikai rendellenességben szenvedő betegeknél, mint azon betegeknél, akik nem kaptak thalidomidot. Másrészt Cavo és munkatársai rámutattak arra, hogy a TD esetében a reagálás valószínűsége sokkal kisebb volt azoknál a betegeknél akiknél kimutatható volt a del(13) is.
A lenalidomidot szintén vizsgálták a cytogenetikai abnormalitásokban szenvedő betegek esetében. Reece és munkatársai vizsgálatai, melyet relapsusos/refractaer myelomás betegek bevonásával végeztek azt mutatták, hogy a t(4;14) nem befolyásolja a reagálási arányt, a TTP, illetve OS időtartamot, míg azoknál a betegeknél akiknél del(17)-et detektáltak, a TTP és OS időtartam jelentősen rövidebb volt.
Az IMF által nemrégiben közölt adatok szerint a relapsusos vagy refractaer MM-ben szenvedő erőteljesen előkezelt betegek esetében a t(4;14) jelenléte sokkal alacsonyabb reagálási arányt és rövidebb PFS és OS időtartamokat eredményezett, mint a cytogenetikai rendellenességben nem szenvedő betegek esetében.
Kapoor és munkatársai által közzétett adatok szerint a lenalidomid adásával történő kezelés hasonló reagálási arányokat eredményezett az újonnan diagnosztizált nagy kockázatú és szabvány kockázatú betegségben szenvedő betegeknél, a reagálás azonban nem volt olyan hosszú ideig tartó a nagy kockázatú betegeknél és a PFS időtartam jelentősen rövidebb volt ezen betegeknél. Az OS időtartama azonban nem különbözött jelentősen a nagy kockázatú és a normál kockázatú csoportok esetében (A cytogenetikai anomáliák és az egyes antimyelomás szerek hatékonysága közötti összefüggéseket foglalja össze a 15. táblázat.)
RELAPSUS KEZELÉS
Az új gyógyszereket (thalidomid, bortezomib, lenalidomid) egyre növekvő mértékben alkalmazzuk elsővonalbeli kezelésként, ami jelentősen befolyásolja a betegség relapsusakor a rendelkezésre álló választási lehetőségeket és befolyásolhatja a különböző kezelések hatékonyságát. Relapsuskor el kell dönteni, hogy megismételjük-e a kiinduló kezelést, vagy áttérjünk egy olyanra, amely különbözik az előzőtől.
A döntésünket mindenképpen befolyásolja az előzetes kezelés remissziós időtartama, valamint a toxikus mellékhatások megléte vagy kockázata.
Ha a remissziós idő hosszú (>12 hónap) egy viszonylag rövid kezelést követően és nem volt (vagy csak elfogadható mértékű) mellékhatás az előző kezeléskor, kézenfekvő a kiinduló kezelés megismétlése. Amennyiben a remisszió rövid volt (<6 hónap) egy viszonylag hosszú kiinduló kezelés után, ajánlatos egy másfajta kezelési módot választani. Amennyiben a relapsus hosszú ideig adott thalidomide kezelés után következett be, akkor ajánlatos megváltoztatni a kezelést és fontolóra venni a bortezomib alapú kezelési módot alkiláló szerekkel kombinálva. Amennyiben a kezdeti kezelés bortezomib alapú volt, javasolt az IMID-tartalmú gyógyszereket tartalmazó kombinációra való áttérés. Amennyiben a primaer bortezomib terápiára jó volt a reagálás, valamint a kezelés-mentes időtartam hosszú volt, fontolóra lehet venni a bortezomib-al történő ismételt próbálkozást. Relapsusban a korábban alkalmazott gyógyszer toxikus mellékhatása, vagy hiánya befolyásolja a kezelési mód megválasztását és szükségessé válhat az eredeti kezelés megváltoztatása. Ha pl. polyneuropathia alakult ki a kiinduló kezelés eredményeképpen, szükségessé válhat áttérni egy nem neurotoxikus gyógyszer, pl. a lenalidomid adására A lenalidomid-dexamethason kombinációt kell átgondolni mint lehetséges kezelési módot azon betegeknél, akik rezisztensek a thalidomidra és polyneuropatiájuk van.
A tromboembolia nagy kockázata indikálhatja az IMID alapú kezelési módról bortezomib alapú terápiára való áttérést. A betegség specifikus, jellemző tulajdonságai szintén befolyásolják a kezelési móddal kapcsolatos döntést relapsus esetén (pl. agresszív relapsus és nagy kockázatú cytogenetika esetén bortezomib alapú kezelés javallt). Veseelégtelenség esetén hasznos a bortezomib-ot (is) tartalmazó kombináció.
A relapsusban lévő myelomás beteg optimális kezelésének a kiválasztásakor a döntést egyénre szabottan kell meghozni a beteg sajátos jellemző tulajdonságai alapján. Figyelembe kell venni a beteg életkorát, a társbetegségeket, az előző kezelés típusát, a kezelésre való reagálás minőségét és időtartamát, a beteg kezeléssel szembeni tolerabilitását, a kezelésmentes időtartam hosszát. Amennyiben megvalósítható, a kezelési stratégiába be kell vonni azokat az új gyógyszereket, melyek eredményeként a betegség várható kimenetele jobb, mint a hagyományos kezelési módok esetében. (A relapsusos MM ajánlott kezelési algoritmusát a 16. és 17. táblázatok mutatják be.)
SZUPPORTÍV KEZELÉS, SZÖVŐDMÉNYEK KEZELÉSE
A támogató kezelés fontossága a sok szerv érintettsége és a komplex immunhiányos állapot miatt a myelomában különös jelentőségű, a kezelés sikerességének egyik alapvető feltétele.
A hypercalcaemia sürgősségi állapot. A veseelégtelenség kialakulásának egyik legfontosabb generálója. Első feladat a hidrálás, ezt steroid, bisphosphonat és saliuretikum adása követheti.
A veseelégtelenség lehet reverzibilis is. Kialakulásában, keletkezésében több tényező szerepet játszhat. Veszélye miatt minden myelomás betegnek javasoljunk bőséges folyadékfogyasztást. Nem ritkán a dialysis elkerülhetetlen. Minden precipitáló tényező kiiktatása ("cave" kontrasztanyag, NSAID) és természetesen az alapfolyamat befolyásolására is törekedni kell. A veseelégtelenség számos gyógyszer, így az alkiláló szerek és a bisphosphonatok metabolizmusát is befolyásolja és ezért dózisuk módosítására van szükség.
Nem-szteroid gyulladásgátlók adása kerülendő. Az anaemia gyakori tünet. Súlyos esetben és prompt hatás céljára transzfúzió szükséges, krónikus esetben ezt az EPO kiválthatja. Az EPO-tól 2-3 hét alatt várhatunk hatást, 4-6 hetes hatástalanság után nem érdemes, indokolatlan tovább adni.
A csontok porozisa a myelomás fájdalom fő oka. Az osteoclastok fokozott működését előnyösen befolyásolják a bisphosphonátok. Ezek egyik mellékhatása az állcsont osteonecrosisa lehet. Neurológiai deficitet okozó vagy nem szűnő gerincfájdalmak esetén neurológus és orthoped szakorvos segítségét kérjük. (A legfontosabb teendőket a 18. táblázat foglalja össze.)
A LEGGYAKORIBB GYÓGYSZER MELLÉKHATÁSOK
A thrombo-emboliás események a thalidomid, illetve lenalidomid gyógyszerek alkalmazásával együttjáró legfontosabb mellékhatások, különösen ha szteroiddal és/vagy kemoterápiával kombinálva alkalmazzuk. A thrombo-emboliás rizikót tovább fokozza az IMID-ek és EPO együttes alkalmazása. A thromboprofilaxis teljes vagy alacsony dózisú aspirin, LMWH vagy kumarin adásából állhat.
LMWH javallt azon betegeknél akiknél a thrombo-embolia kockázata nagy, illetve nagydózisú dexamethasont és/vagy doxorubicint kapnak. Nagy thrombo-embolia kockázatú betegeknél hasznos választás lehet a bortezomib, mivel az nem fokozza a thrombo-embolia veszélyt még EPO együttes alkalmazása esetén sem.
Mind a bortezomib, mind a thalidomid okozhat polyneuropathiát (PN). Tapasztalat, hogy azon betegeknél, akikn a bortzomib kezelés első 4-6 ciklusa során nem alakul ki PN, nagy valószínűséggel a további kezelések során sem fog kialakulni. Lényeges, hogy a bortezomib okozta PN reverzibilis lehet! Fontos a PN korai jeleinek a felismerése, és szúró, csípő fájdalomérzés első jeleire a gyógyszer dózisának és adagolási sűrűségének csökkentése.
Thalidomid adásával a PN kialakulásának a kockázata az eltelt idő függvényében növekszik és az idegkárosodás általában irreverzibilis.
A lenalidomid nem okoz PN-t, ezért ez a gyógyszer igen hasznos lehet azon betegek kezelésére akiknél már előzőleg kialakult a PN.
A bortezomib therapia reaktiválhatja a varicella-zoster vírust, ezért fontolóra kell venni az antivirális profilaxis rutin alkalmazását különösen hosszabb bortezomib kezelés esetén.
Neutropenia gyakran előfordul lenalidomid kezelés hatására és szükségessé válhat a dózis csökkentése, a kezelés megszakítása, illetve növekedési faktor adása. A bortezomib kezelés thrombocytopenia kialakulásához vezethet és dóziscsökkentés, illetve a kezelés időleges megszakítása válhat szükségessé. A bortezomib okozta thrombocytopenia azonban ciklikus és a thrombocytaszám rendszerint normalizálódik a kezelési ciklusok szüneteiben, thrombocyta pótlásra csak ritkán van szükség. A MM egyik fontos jellemzője a csontbetegség és a bisphosphonatok fontos szerepet játszanak a csontbetegség kezelésében. A bisphosphonatok alkalmazása a lyticus csontbetegségben szenvedő betegeknél javallt és körültekintő kezelésre van szükség a vesefunkció romlás és az állkapocs necrosis elkerülése céljából.
(Az új antimyelomás gyógyszerek leggyakoribb mellékhatásait a 19. táblázatban foglaltuk össze.)
LEGÚJABB ÉS ÍGÉRETES JÖVŐBENI KEZELÉSI LEHETŐSÉGEK
Számos megválaszolatlan kérdés maradt az új gyógyszerek felhasználásával kapcsolatosan is a myeloma multiplex kezelésében. Hosszútávú nyomonkövetésre van szükség, hogy átfogó és biztos túlélési adatok alapján lehessen megtenni a kezeléssel kapcsolatos döntéseket. A myeloma ellenes gyógyszerek újcsoportjai, pl. a hő-shock protein-90 és a hiszton deacetylase inhibitorok ígéretes eredményeket mutatnak a preklinikai és klinikai vizsgálatok során. Kombinálásuk a korábban említett új gyógyszerekkel (thalidomid, lenalidomid, bortezomib) nagyon előnyösnek tűnik. További klinikai vizsgálatok vannak folyamatban a konszolidációs és fenntartó kezelés szerepének tisztázására, valamint a kockázat-adaptált kezelési megközelítések vonatkozásában (cytogenetikai rendellenességek szerepe a kezelés megválasztásában).
Az olyan eljárások mint a gén-expressziós profil és a nucleotid polymorfizmus analízis továbbfejlesztésével a kezelések egyre inkább betegre szabhatók. Fontos szerepet játszhat a kiinduló kezelés milyenségének és intenzitásának, valamint a fenntartó kezelés szükségességének és időtartamának a meghatározásában a molekuláris biológiai módszerek további tökéletesedése, a minimális reziduális betegség (MRD) egyre pontosabb meghatározhatósága, az életminőség fontosságának egyre növekvő figyelembevétele.
Az új és kipróbálás alatt lévő legújabb antimyelomás gyógyszereket foglalja össze a 20. táblázat.
A napi gyakorlatban használt terápiás protokollokat a 21., 22., 23. és 24. táblázatban foglaltuk össze, az egyes kezelési módok evidencia-szintjeit a 25. táblázat tartalmazza.
OSZTEOSZKLEROTIKUS MYELOMA (POEMS SZINDRÓMA)
A kórkép jellemzőit a differenciáldiagnosztikai fejezetben részleteztük.
Általában fiatalabb korban jelenik meg (átlag életkor 51 év), mint a myeloma, és az átlagos túlélés hosszabb (8 év). A klinikai lefolyást általában a neuropathia progressziója határozza meg.
Kezelés: körülírt oszteoszklerotikus elváltozás jól reagálhat sugárkezelésre (40-50 Gy gócdózis). Ha helyi szklerotizáló bőrléziók okoznak neuropathiás tüneteket sebészi megoldás és/vagy sugárkezelés lehet a palliatív megoldás.
Ha kiterjedt csontelváltozások vannak, a myelomával azonos szisztémás kezelésre van szükség. Plazmaferezisnek, vagy önmagában szteroidnak nem sok haszna van. Fiatal betegnél kiterjedt csontléziók esetén meg kell fontolni az autológ őssejt transzplantáció lehetőségét.
SZOLITER CSONT-PLAZMACYTOMA
A plazmasejt dyscrásiák kb. 3%-a.
A betegség jellemzőit a differenciáldiagnosztikai fejezetben összefoglaltuk.
A betegség a legtöbb esetben (10 év elteltével 80%-ban)
myeloma irányába progrediál átlagosan 2 éven belül.
(A diagnosztikus technikák érzékenyebbé válásával a szoliter plazmacytoma incidenciája csökken, és növekszik a relapszus, illetve progressziós ráta.)
Kezelés: Helyi besugárzás (45 Gy), generalizálódás esetén azonos a myelomával.
EXTRAMEDULLARIS PLAZMACYTOMA
A plazmasejt daganatok mintegy 3%-a, az esetek döntő többségében valóban lokalizált betegség (szemben az intramedullaris plazmacytomával).
Klasszikus myeloma 10 év alatt csak mintegy 15%-ban alakul ki belőle. Bármely szervet érintheti, leggyakoribb előfordulása: felső légutak, tüdő, nyirokcsomók, gastrointestinális traktus, máj, lép, here, emlő, bőr. Kezelés: Helyi besugárzás (45-50 Gy). Adjuváns kemokezelés általában nem szükséges.
IV. Követés, V. Gondozás
A plasmasejtes daganatok az időskor betegsége, mely a csontrendszert és más szerveket is súlyosan károsíthatja, nagy az esélye, hogy háttérbetegséghez társul.
Kemoterápiára a betegek kb. fele reagál valamilyen mértékben, de teljes (CR) vagy csaknem teljes (nCR) reagálás csak ritkán következik. Ezeken is gyakori a relapsus. A betegek egy részén haemopoetikus stem cell transzplantációra is sor kerül. Ezért szükséges minden beteg, a kezelésre nem szoruló, illetve kezelésre remisszióba (PR, CR) került betegek rendszeres ellenőrzésre. Célszerű, hogy a myeloma multiplexes beteg gondozása a kezelést végző hematológiai centrumokban vagy decentrumokban történjen. Az ellenőrzések szükség szerint, de legalább 2-4 hónapos intervallumokban történnek. A beteg kezeléséért és gondozásáért az osztályvezető, illetve a szakrendelést vezető hematológus vagy klinikai onkológus szakorvos felelős.
VI. Irodalomjegyzék
1. Anderson KC, Jaganath S, Kaubowiak A et al. Lenalidomide, bortezomib, and dexamethasone in relapsed/refractory multiple myeloma (MM): Encouraging outcomes and tolerability in a phase II study [abstract 8536]. J Clin Oncol 2009;27(18 suppl):442s.
2. Anderson KC, Kyle RA, Rajkumar SV, Stewart AK, Weber D, Richadson P. Clinically relevant end points and neew drug approvals for myeloma. Leukemia 2008; 22:231-239.
3. Avet-Loiseau H et al.: Genetic abnormalities and survial in multiple myeloma: the experience of the Intergroupe Francophone du Myélome Blood, 2007, 109, 3489-3495
4. Barlogie B, Anaissie EJ, Shaughnessy JD et al. Ninety percent sustained complete responce (CR) rate projected 4 years after onset of CR in gene expression profiling (GEP)-defined low-risk multiple myeloma (MM) treated with Total Therapy 3 (TT3): Basis for GEP-risk-adapted TT4 and TT5 [abstract 162]. Blood 2008b;112:66.
5. Bradwell AR.: Serum Free Light Chain Analysis The Binding Site Ltd, 2008.
6. Cavo M, Testoni N, Terragna C et al. Superior rate of complete response with up-front Velcade-thalidomide-dexamethasone versus thalidomide-dexamethasone in newly diagnosed multiple myeloma is not affected by adverse prognostic factors, including high-risk cytogenetic abnormalities [abstract 1662]. Blood 2008;112:586
7. Dimopoulos MA, Chen C, Spencer A et al. Long-term follow-up on over-all survival from the MM-009 and MM-010 phase III trials of lenalidomide plus dexamethasone in patients with relapsed or refractory multiple myeloma. Leukemia 2009;23:2147-2152.
8. Dimopoulos MA, Richardson PG, Schlag R et al. VMP (bortezomib, ,melphalan, and prednisone) is active and well tolerated in newly diagnosed patients with multiple myeloma with moderately impaired renal function, and results in reversal of renal impairment: Cohort analysis of the phase III VISTA study. J Clin Oncol 2009;27:6086-6093.
9. Dispenzieri A, Kyle RA, Katzmann JA, Therneau TM, Larson D, Benson J et al. Immunoglobulin free light chain ratio is an independent risk factor for progression of smoledering (asymptomatic) multiple myeloma. Blood 2008; 111:785-789.
10. Durie BG, et al.: A clinical staging system for multiple myeloma. Correlation of measured myeloma cell mass with presenting clinical features, response to treatment and survival. Cancer;1975, 36, 842-854
11. Durie BGM, Harousseau J-L, Miguel JS, Blade J, Barlogie B, Anderson K et al. International unifirom response criteria for multiple myeloma. Leukemia 2006; 20:1467-1473.
12. Fonseca R et al.: International Myeloma Working Group molecular classification of multiple myeloma: spotlight review. Leukemia, advance online publication, 2010.
13. Harousseau JL, Attal M, Avet-Loiseau H. The role of complete response in multiple myeloma. Blood 2009;114:3139-3146.
14. Harousseau JL, Mathiot C, Attal M, et al. VELCADE/dexamethasone (Vel/D) versus VAD as induction treatment prior to autologous stem cell transplantation (ASCT) in newly diagnosed multiple myeloma (MM): Updated results of the IFM 2005/01 trial. Presented at the 2008 meeting of the American Society of Hematology, San Francisco, California, December 7, 2008.
15. Kumar S, Flinn IW, Noga SJ et al. Safety and efficacy of novel combination therapy with bortezomib, dexamethasone, cyclophosphamide, and lenalidomide in newly diagnosed multiple myeloma: Initial results from the phase I/II multi-center EVOLUTION study [abstract 93]. Blood 2008;112:41.
16. Kumar S, Hayman S, Buadi F et al. Phase II trial of lenalidomide (RevlamidTM) with cyclophosphamide and dexamethasone (RCd) for newly diagnosed myeloma [abstract 91 ]. Blood 2008;112:40.
17. Kumar SK, Rajkumar SV, Dispenzieri A et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008;111:2521-2526.
18. Kyle RA and SV Rajkumar. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia 2009;23:3-9.
19. Ludwig H, Beksac M, Bladé J et al. Current Multiple Myeloma Treatment Strategies with Novel Apents: A European Perspective. The Oncologist 2010;15:6-25.
20. Ludwig H, Hajek R, Tóthova E et al. Thalidomide-dexamethasone compared with melphalan-prednisolone in elderly patients with multiple myeloma. Blood 2009;113:3435-3442.
21. Mateos MV, Oriol A, Martinez J et al. Bortezomib (Velcade)/melphalan/prednisone (VMP) versus Velcade/thalidomide/prednisone (VTP) in elderly untreated multiple myeloma (MM) patients [abstract 471 ]. Haematologica 2009;94(2 suppl):190.
22. NCCN Clinical Practice Guidelines in Oncology: Multiple Myeloma V.2. 2010. www.nccn.org.
23. Owen RG, Morgan GJ, Jackson H et al. MRC Myeloma IX: Preliminary results from the non-intensive study [abstract 547]. Clin Lymphoma Myeloma 2009;9(1 suppl):79.
24. Palumbo A, Bringhen S, Rossi D et al. Bortezomib, melphalan, prednisone and thalidomide (VMPT) versus bortezomib, melphalan and prednisone (VMP) in elderly newly diagnosed myeloma patients: A prospective, randomized phase III study [abstract 472]. Haematologica 2009;94(2 suppl):190.
25. Palumbo A, Falco P, Falcone A et al. Melphalan, prednisone, and lenalidomide for newly diagnosed myeloma: Kinetics of neutropenia and thrombocytopenia and time- to-event results. Clin Lymphoma Myeloma 2009;9:145-150.
26. Palumbo A, Sezer O, Kyle R et al. International Myeloma Working Group guidelines for the management of multiple myeloma patients ineligible for standard high-dose chemotherapy with autologous stem cell transplantation. Leukemia 2009; doi:10. 1038/len. 2009.122
27. Radványi G., Masszi T., Tarkovács G.: Myeloma Multiplex (MM) Hematológiai Betegségek Kezelése; Szerk.: Lehoczky D., Documed (2006) 115-133.
28. Radványi G., Masszi T., Tarkovács G.: Plazmasejtes daganatok - Myeloma Multiplex. Hatóanyagok, készítmények, terápia: Fókuszban az onkológia és az onkohematológia; Szerk.: Dank M.-Demeter J., Melinda Kiadó és Reklámügynökség, Budapest (2006) 573-596
29. Radványi G., Tarkovács G., Krenács L.: Plazmasejtes Daganatok Hematológiai Betegségek Atlasza; Szerk.: Matolcsy A., Udvardy M., Kopper L., Medicina Könyvkiadó Rt., Budapest (2006) 241-253.
30. Rajkumar SV et al.: Guidelines for the Uniform Reporting of Clinical Trials: Report of the 2008 International Myeloma Workshop Consensus Panel I hettp://www.mw-delhi09.com/spargoDocs/Consensuspanelone.pdf
31. Rajkumar SV, Jacobus S, Callander NS et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma: An open-label randomised controlled trial. Lancet Oncol 2009 Oct 21 [Epub ahead of print].
32. Richardson PG, Sonneveld P, Schuster MW et al. Reversibility of symptomatic peripheral neurapathy with bortezomib in the phase III APEX trial in relapsed multiple myeloma: Impact of a dose-modification guideline. Br J haematol 2009;144:895-903.
33. San Miguel J, Schlag R, Khuageve N et al. Updated folow-up and results of subsequent therapy in the phase III VISTA trial: Bortezomib plus melphalan-prednisone versus melphalan-prednisone in newly diagnosed multiple myeloma [abstract 650]. Blood 2008;112:242.
34. San-Miguel J, Harousseau JL, Joshua D et al. Individualizing treatment of patients with myeloma in the era of novel agents. J Clin Oncol 2008;26:2761-2766.
35. San-Miguel JF, Richardson PG, Sonneveld P et al. Efficacy and safety of bortezomib in patients with renal impairment: Results fromt the APEX phase 3 study. Leukemia 2008;22:842-849.
36. Snozek CLH, Katzmann JA, Kyle RA, Dispenzieri A, Larson D, Therneau TM et al. Prognostic value of the serum free light chaiin ratio in newly diagnosed myeloma: proposed incorporation into the International Staging System. Leukemia 2008; 22:19331937.
37. Zhou Y, Barlogie B, Shaughnessy JD:: The molecular characterization and clinical management of multiple myeloma in the post-genome era. Leukemia, 23: 1941-1956, 2009.
VII. Melléklet
Felelős személy
A myeloma multiplexes beteg kezelése hematológiai centrumokban vagy decentrumokban történhet, elvárt, hogy évente legalább új MM-es beteg kezelése történjen. A beteg parenteralis kezelése a hematológus szakorvos irányításával olyan onko-hematológiai osztályon történjen, amely jártas a citosztatikus kezelésekben, illetve azok mellékhatásainak, szövődményeinek kivédésében és kezelésében. A beteg kezeléséért, gondozásáért az osztályvezető, illetve a szakrendelést vezető hematológus vagy klinikai onkológus szakorvos felelős. Az adott terápiát (radioterápiát a sugárterápiás szakorvossal történt konzultáció után) hematológus szakorvos rendelheti el.
1. táblázat. Plazmasejtes daganatok WHO osztályozása (2008.) MGUS
PLAZMASEJTES MYELOMA
Variánsok: Smoldering (aszimptomatikus) myeloma Non-szekretoros myeloma Plazmasejtes leukémia
PLAZMOCYTOMA
Szoliter csontplazmocytoma Extramedulláris plazmocytoma
IMMUNGLOBULIN DEPOZÍCIÓS BETEGSÉGEK
Primer amiloidózis
Szisztémás könnyű és nehézlánc depozíciós betegségek
OSZTEOSZKLEROTIKUS MYELOMA
(POEMS szindróma)
2. táblázat. Myeloma multiplex etiológiája Ismeretlen
Feltételezett kockázati tényezők:
- Tartós immunstimulus
- Autoimmun betegség
- Ionizáló sugárzás
- Kémiai ágensek
= Dioxin
= Gyom- és rovarirtók = Festékek Oldószerek
- Vírusok (HIV, HHV-8 stb.)
- Örökletes tényezők (genetika)
3. táblázat. A myeloma multiplex és a Waldenstrom macroglobulinaemia elkülönítése immunfenotípus alapján
| Antigén Waldenström macroglobulinaemia | Myeloma multiplex | |
| CD10 | + | + |
| CD19 | ++ | + |
| CD20 | ++ | - |
| CD21 | + | - |
| CD22 | ++ | - |
| CD38 | + | ++ |
| PCA-1 | + | + |
| CD5 | + | - |
| CD138 (Syndecan-1) | - | ++ |
| CD56 | - | ++ |
| Immunglobulin antigén | ||
| Sejthártya | ++ | - |
| Cytoplasma | + | ++ |
4. táblázat. A myeloma multiplex molekuláris (TC) klasszifikációja
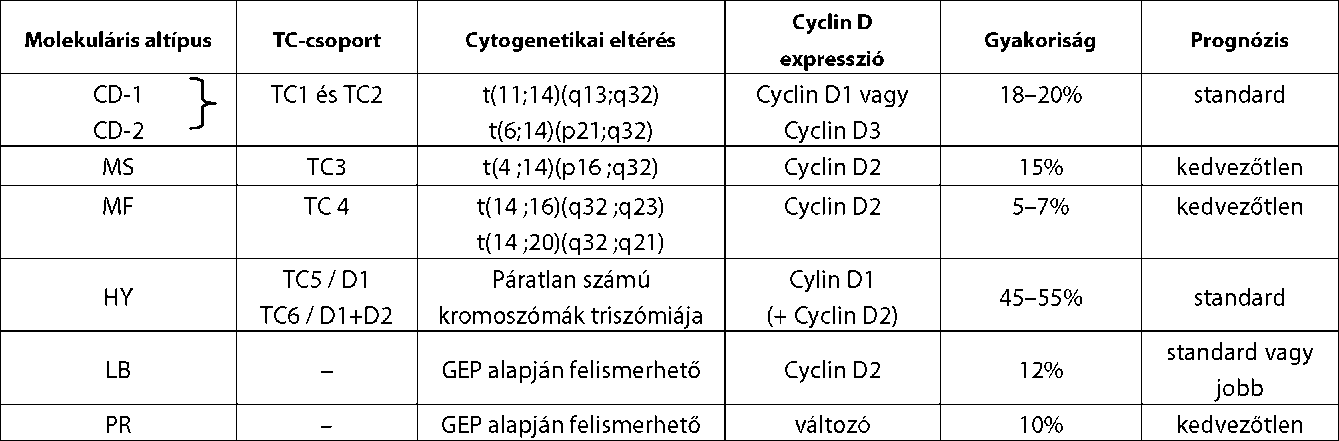
5. táblázat. Szisztémás kezelést igénylő MM diagnosztikus kritériumai
- M-protein jelenléte a szérumban és/vagy vizeletben
- Klonális plazmasejtek a csontvelőben (>10%) és/vagy
- Igazolt klonális plazmocitoma
- + célszerv károsodás: (legalább 1 az alábbiak közül)
| Rövidítés | Angol megnevezés | Célszerv károsodás | Kritérium |
| C | Calcium elevation | emelkedett kalcium | Serum Ca>2.75 mmol/l vagy a normál felső határérték |
| R | Renal insufficiency | vesekárosodás | Serum kreatinin > 173 |imol/l |
| A | Anaemia | anaemia | Haemoglobin < 100 g/l vagy 20 g/l < normálérték |
| B | Lytic bone lesions | litikus csontléziók | Litikus csontléziók vagy osteoporosis* |
* Ha soliter plasmacytoma vagy törés nélküli osteoporosis áll fenn, akkor > 30% plasmasejt szükséges
6. táblázat. Myeloma és premyeloma
| Entitás | MGUS* | Aszimptomatikus (smoldering,indolens) myeloma | Szimptomatikus myeloma | Non-secretoros myeloma |
| M protein a szérumban és/vagy vizeletben | <10g/l | >30g/l | + | - (IF-val is) |
| Klonális plasmacytosis a csontvelőben vagy extramedullárisan | <10% | vagy >10% | + | + |
| Hypercalcaemia | ||||
| Azotémia Anémia | nincs | nincs | van | van |
| Csontlézió | ||||
| * Monoclonal gammopathy of undetermined significance (Bizonytalan jelentőségű gammopathia) | ||||
7. táblázat. Durie-Salmon klinikai stadium beosztás
I.Stádium: A sejttömeg kicsi (0,6 x 1012/m2)
- haemoglobin > 100g/L
- szérum kalcium < 2,7 mmol/L
- osteolyticus góc nincs, vagy egyetlen csont-plasmocytoma
- monoklonális szérum IgG < 4g/dl, IgA < 3g/dl
- vizelet könnyűlánc-ürítés < 4g/24 óra
II.Stádium: A sejttömeg közepes (0,6-1,2x1012/m2)
- Nem felel meg sem az I. sem a III. stádiumnak.
III.Stádium: A sejttömeg nagy (1,2 x 1012/m2)
- haemoglobin < 100 g/L
- szérum kalcium > 2,7 mmol/L
- előrehaladott csontdestrukció
- monoklonális szérum IgG > 7 g / dl, IgA > 5 g/dl
- vizelet könnyűlánc-ürítés > 4 g / 24 óra
A: Se kreatinin < 173 umol/l (<2 mg/dl)
B: Se kreatinin > 173 umol/l (>2 mg/dl)
8. táblázat. Durie-Salmon PLUS Staging Rendszer

9. táblázat. International Staging System beosztás (ISS)
| A betegek megoszlása | 1 ß-2 mikroglobulin | Szérum albumin | Várható túlélés (hónap) | |
| I. Stádium | 28% | <3,5 mg/dl | >3,5g/dl | 62 |
| II. Stádium | 33% | <3,5 mg/dl 3,5-5,5 mg/dl | <3,5 g/dl | 45 |
| III. Stádium | 39% | >5,5 mg/dl | 29 |
10. táblázat. MM molekuláris osztályozása (mSMART)1
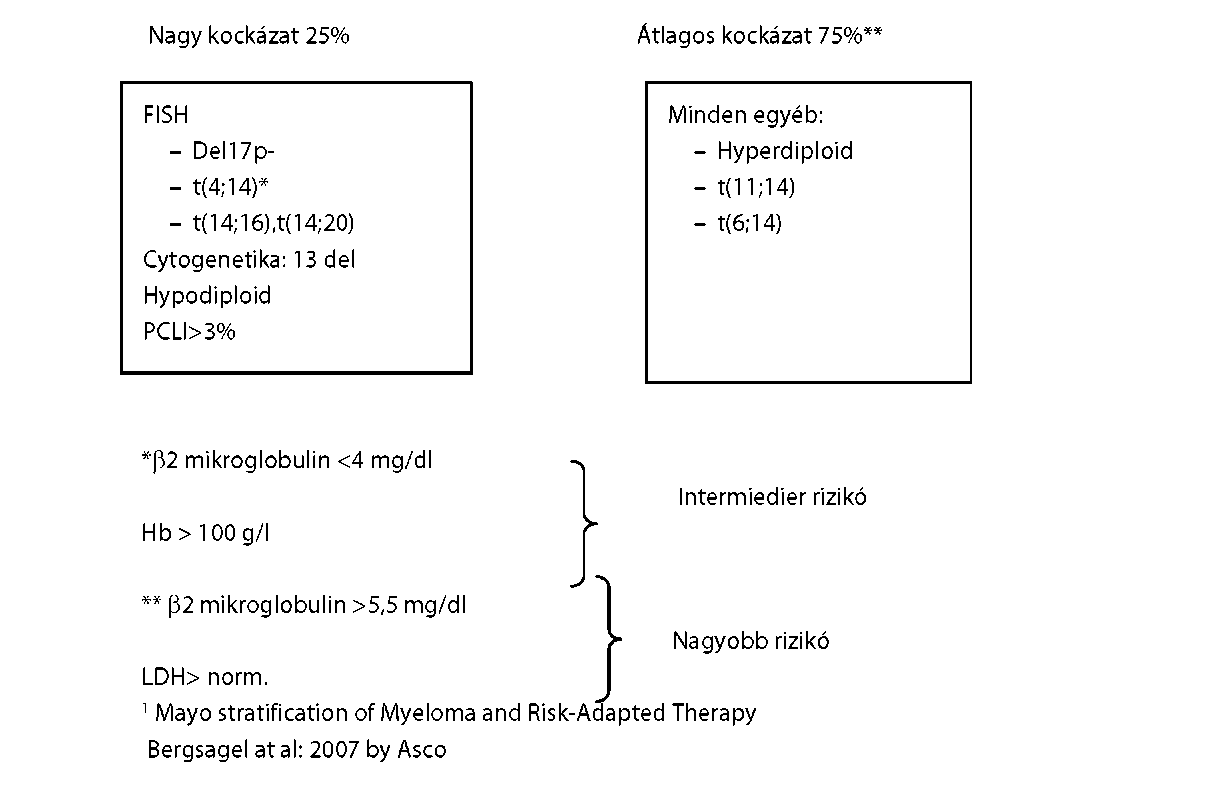
11. táblázat. A myeloma kezelésére adott válasz értékelése az EBMT kritériumai szerint
| Válasz kategóriák | Válasz feltételek |
| Teljes válasz (Complete response - CR) | Az alábbiak közül mindegyik: - a szérumból és vizeletből immunfixációval sem mutatható ki az M-protein, és ez fennmarad 6 hétig - <5% plazma sejt a csontvelőben, crista biopsziás anyagban, ha az M-protein hiánya 6 hétig fennmarad, nem kell megismételni a csontvelő biopsziát - nem növekszik a lítikus léziók száma vagy mérete (kompressziós fraktura kialakulása nem zárja ki a választ) - eltűnik a lágyrész plazmocitóma |
| Közel teljes válasz (Near - Complete response - nCR)* | Megegyezik a CR kritériumaival, kivéve, hogy immunfixációval kimutatható az M-protein |
| Részleges válasz (Partial response - PR) | Az alábbiak mindegyike: - >50°%-os csökkenés a szérum M-proteinszintben és ez fennmarad 6 hétig - a 24 órás könnyűlánc ürítés >90%-kal vagy <200 mg alá csökken és ez 6 hétig fennmarad - csak a nem szekretoros myelomák esetében, a plazmasejtek számának >50%-os csökkenése a csontvelő aspirátumban és crista biopsziás anyagban (ha történt) és ez 6 hétig fennmarad - >50%-os csökkenés a lágyrész plazmocitóma méretében - nem növekszik a lítikus léziók száma vagy mérete (kompressziós fraktura kialakulása nem zárja ki a választ) |
| Minimális válasz (Minimal response - MR) | A következők mindegyike: - 25-49%-os csökkenés a szérum M-proteinszintben és ez 6 hétig fennmarad - a 24 órás könnyűlánc ürítés 50-89%-os csökkenése, ami meghaladta a 200 mg/24 h-t, és ez 6 hétig fennmarad - csak a nem szekretoros myelomák esetében, a plazmasejtek 25-49%-os csökkenése a csontvelő aspirátumban és crista biopsziás anyagban és ez 6 hétig fennmarad - 25-49%-os csökkenés a lágyrész plazmocitóma méretében - nem növekszik a lítikus léziók száma és mérete (kompressziós fraktura kialakulása nem zárja ki a választ) |
| Nincs változás (No change) | Nem meríti ki sem az MR, sem a PD kritériumait |
| Plató (plateau) | Stabil értékek (az értékelésekkor mért ±25%-os tartományon belül) és ezek 3 hónapig fennmaradnak |
| Visszaesés CR-ből (Relapse) | Az alábbiak mindegyike: - a paraprotein ismételt megjelenése a szérumban és vizeletben immunfixációval vagy elektroforézissel meghatározva - >5% plazmasejt arány csontvelő aspirátumban és koponya biopsziás anyagban - új lítikus léziók vagy lágyrész plazmocitóma megjelenése, vagy a reziduális csontléziók növekedése - egyéb okkal nem magyarázható hiperkalcémia kialakulása |
11. táblázat. - folytatás
| Válasz kategóriák | Válasz feltételek |
| Betegség progressziója | Egy vagy több az alábbiak közül: |
| (Progressive disease PD) | - a szérum paraprotein >25%-os emelkedése, ami eléri az 5 g/l-t és ezt legalább egyszer |
| megerősítik | |
| - a 24 órás könnyűlánc ürítés >25%-os emelkedése, ami meghaladja a 200 mg/24 h-t és ezt | |
| legalább egyszer megerősítik |
| Válasz kategóriák | Válasz feltételek |
| - plazmasejtek >25%-os emelkedése a csontvelő aspirátumban vagy crista biopsziás anyagban, ami abszolút értékben meghaladja 10%-ot - a meglévő lítikus léziók vagy lágyrész plazmocitóma méretének egyértelmű növekedése - új lítikus léziók vagy lágyrész plazmocitóma megjelenése - egyéb okkal nem magyarázható hiperkalcémia kialakulása (korrigált szérum Ca >11.5 mg/dl vagy 2.8 mmol/l) | |
| * Az nCR nem tartozik az EBMT kategóriái közé, de ide bevettük, mert a mindennapi gyakorlatban és az utóbbi időben végzett vizsgálatokban használják | |
12. táblázat. International Myeloma Working Group (IMWG) egységesített válasz feltételei: CR és egyéb válasz kategóriák
| Válasz kategóriák | Válasz feltételek |
| Teljes válasz (CR-complete response) | - negatív immunfixációs eredmény a szérumban és vizeletben - és a lágyrész plazmocitómák teljes eltűnése, - és <5% plazmasejt a csontvelőben |
| Szigorú értelemben vett teljes válasz (sCR-stringent CR) | CR definíció mint fent, plusz - normális FLC arány - nincsenek fenotípusosan eltérő plazmasejtek a csontvelőben, mikor legalább 3000 plazmasejtet analizáltak multiparaméteres flow citometriával (több, mint 4 színnel) |
| Molekuláris teljes válasz (mCR-molecular CR) | A szigorú értelemben vett teljes válasz definíciója mint fent, plusz - negatív ASO-PCR*, érzékenység 10-5 |
| Nagyon jó részleges válasz (VGPR-Very good partial response) | - M-protein a szérumban és vizeletben immunfixációval kimutatható, de elektroforezissel nem - vagy >90%-os csökkenés a szérum M-protein szintben és a vizelet M-protein szint <100 mg/24h |
| Részleges válasz (PR-partial response) | - >50%-os csökkenés a szérum M-protein szintben és a 24 órás gyűjtött vizelet M-protein szint 90%-os csökkenése vagy a vizelet M-protein szint <200 mg/24h - ha a szérumban és a vizeletben sem mérhető az M-protein, akkor >50%-os csökkenés az érintett FLC szint különbségben, az M-protein kritériumok helyett - ha a szérum és vizelet M-protein nem mérhető és a szérum szabad könnyűlánc sem mérhető, a plazmasejtek számának >50%-os csökkenése az elvárás az M-protein helyett, feltéve, hogy a kiindulási plazmasejt arány >30%-volt. - az itt felsorolt feltételeken kívül, a lágyrész plazmocitómák >50%-os csökkenése is elvárt, ha a diagnóziskor kimutatható volt. |
| Kisebb válasz (MR-Minor response) | - >25% de <49% M protein redukció és a 24 órás gyűjtött vizeletben az M-protein szintje 50-től 89%-ig csökken, ami még mindig meghaladja a 200 mg/24 óra értéket - a lágyrész plazmocitómák 25-49%-os csökkenése is elvárt, ha a diagnóziskor kimutatható volt - a litikus csontléziók számában és méretében nincs növekedés (a kompressziós törés kialakulása nem zárja ki a választ) |
| Stabil betegség (SD-Stable disease) | Nem teljesíti sem a CR, VGPR, PR, sem a PD kritériumait |
| Betegség progressziója (PD-progressive disease) | - a válasz legalacsonyabb értékei, az alább felsoroltak közül egy vagy több paraméter 25%-os növekedése: - szérum M-komponens (az abszolút növekedés >0.5 mg/dl) - vizelet M-komponens (az abszolút növekedés >200 mg/24 h) - csak azoknál a betegeknél, akiknél a szérum és vizelet M-komponens nem mérhető: az érintett FLC szint (az abszolút növekedés 10 mg/l) - csontvelői plazmasejt arány (az abszolút% >10%) |
| Válasz kategóriák | Válasz feltételek |
| - az új csontléziók vagy a lágyrész plazmocitómák méretének határozott növekedése | |
| - hiperkalcémia kifejlődése (a korrigált szérum calcium >11.5 mg/dl, ill. 2.8 mmol/l), ami | |
| kizárólagosan a plazmasejt proliferációs betegségének tulajdonítható | |
| * allele-specifikus oligonucleotide polymerase chain reaction | |
13. táblázat. Túlélési ("esemény" végpontig) idők meghatározása
| Végpont | Meghatározás | Megjegyzés |
| A betegség előrehaladásáig eltelt idő (TTP) (time to progression) | A kezelés megkezdésétől a betegség progressziójáig eltelt idő, a betegség progressziójától eltérő okok miatt bekövetkezett elhalálozással együtt | A TTP nagyon hasznos a gyógyszerek hatásának és a kezelés hatásfoka tartósságának értékelésére, de nem veszi figyelembe azt a tényt, hogy a kezelés következményeként az elhalálozások száma megnőhet és ettől kezdve azt progresszio- mentes túléléssel kapcsolatosan kell értékelni. |
| Progresszió-mentes túlélési arány (PFS) (Progression-free survival) | A kezelés elkezdésétől a betegség progresszióig vagy a halál bekövetkeztéig eltelt idő (bármelyik is következik be hamarabb, tekintet nélkül a halál okára) | A TTP-vel kapcsolatosan kell meghatározni és értkelni. |
| Esemény-mentes túlélés (EFS) (Event-free survival) | Az EFS meghatározása attól függ, hogy az "esemény"-t milyen módon határozzuk meg. Sok tanulmányban az EFS meghatározását ugyanolyan értelemben használják, mint a PFS meghatározását. Az EFS további "eseményeket" tartalmazhat, amelynek nem tulajdonítanak nagy jelentőséget kivéve a halált és a betegség-progresszióját, a komoly gyógyszer-toxikusságot is beleértve. | Általánosságban a myeloma betegségnél a legtöbb tanulmányban, amelyben az EFS-t említik meg, a PFS-t értik alatta. A PFS specifikusabb fogalom és használatát jobban kedvelik, hacsak az EFS meghatározása nem foglal magába olyan további "eseményeket" a betegség előrehaladásán és az elhalálozáson kívül, amelyeket fontos figyelembe venni. |
| Betegség-mentes túlélés (DFS) (Disease-free survival) | A CR kezdetétől a CR-ből való visszaesésig eltelt idő. A DFS értéket csak azoknál a betegeknél használják, akik elérték a teljes reagálást. | A TTP-től és a PFS-től eltérően a DFS meghatározást csak olyan betegeknél használják, akik elérték a teljes reagálást és ez a myelománál jelenleg csak korlátozott értékű |
| A reagálás időtartama (DOR) (Duration of response) | A részleges reagálás első észlelésétől a betegség progressziójáig eltelt idő, beleértve a nem a betegség progressziójával kapcsolatos elhalálozást is. A CR és PR időtartamáról egyaránt nyilatkozni kell. | A TTP-vel és PFS-el ellentétben a DOR definiciót csak azoknál a betegeknél használják a tanulmányokban, akik legalább részleges reagálást értek el. Ez a fogalom kifejezi a reagálás időtartamát. |
14. táblázat. MM ajánlott kezelési algoritmusa I.
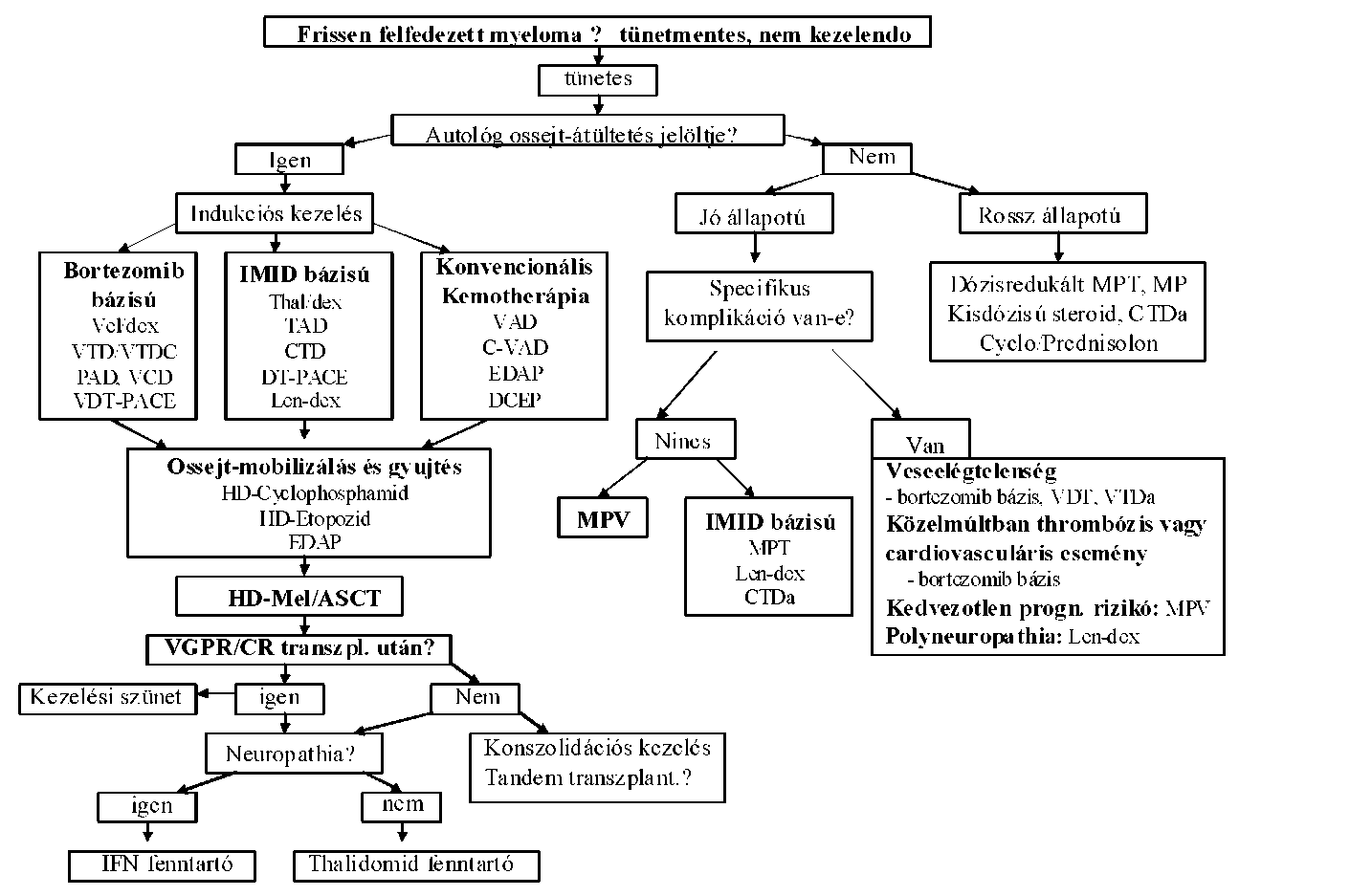
Bendamustin VTD: Bendamustin, Velcade, Thalidomid, Dexametazon; CR: Complete response, teljes válasz; CRD: Cyclophosphamid, Revlimid, Dexametazon; CTD: Cyclophosphamid, Thalidomid, Dexametazon; CTDa: attenuált Cyclpohosphamid, Thalidomid, Dexametazon; C-VAD: Cyclophosphamid, Vincristin, Docorubicin, Dexametazon; Cyclo/Dex: Dyclophosphamid, Dexametazon; Cyclo/Pred: Cyclophosphamid, Prednizolon;DCEP: Dexametazon, Cyclophosphamid, Etopozid, Cisplatin, GCSF; DT-PACE: Dexametazon, Thalidomid, Cisplatin, Doxorubicin, Cyclophosphamid, Etopozid, GCSF;EDAP: Etopoid, Dexametazon, ARA-C, Cisplatin; HD-Mel/ASCT: Nagydózisú Melphalan/allogén őssejt tanszplantáció; IFN: interferon; IMID: immunomodulátor gyógyszercsoport; Len/Dex: Lenalidomid/dexametazon; MP: Melphalan, Prednislon; MPT: Melphalan, Prednisolon; Thalidomid; MPV: Melphalan, Prednisolon, Velcade; MPVT: Melphalan, Prednisolon, Velcade, Thalidomid; PAD: Velcade, Doxorubicin, Dexametazon; RCD: Revlimid, cyclophosphamid, Dexametazon; TAD: Thalidomid, Doxorubicin, Dexametazon; Thal/Dex: Thalidomid, Dexametazon; VAD: Vincristin, Doxorubicin, Dexametazon; VCD: Velcade, Cyclophosphamid, Dexamethason; VDT-PACE: Velcade, Dexametazon, Thalidomid, Cisplatin, Doxorubicin, Cyclophosphamid, Etopozid, GCSF; Vel/Dex: Velcade, Dexametazon; Vel/PEG-doxo: Velcade, Pegilált liposzómás doxorubicin; VGPR: Very Good Partial Remission, nagyon jó részleges válasz; VRD: Velcade, Revlimid, Dexametazon;VTD: Velcade, Thalidomid, Dexametazon; VTDC: Velcade, Thalidomid, Dexametazon, Cyclophosphamid; VTDa: Velcade, Thalidomid, alacsony dózisú Dexametazon
15. táblázat. Myeloma Multiplex genetikai osztályozásának terápiás haszna
Prognózis
| Genetika | Előfordulás(%) | Del13 | Melphalan | Thalidomide | Bortezomib |
| Hyperdiploid | 45 | - | +++ | ++ | + |
| t(11;14) t(6;14) | 20 | - | ++ | ++ | + |
| t(14;16) t(14;20) | 10 | - | + | ||
| t (4;14) | 15 | +++ | - | + | +++ |
(Bergsagel: 2007 by ASCO)
16. táblázat. MM ajánlott kezelési algoritmusa II.

17. táblázat. MM ajánlott kezelési algoritmusa III.
(Rövidítések: l. 14. táblázat)
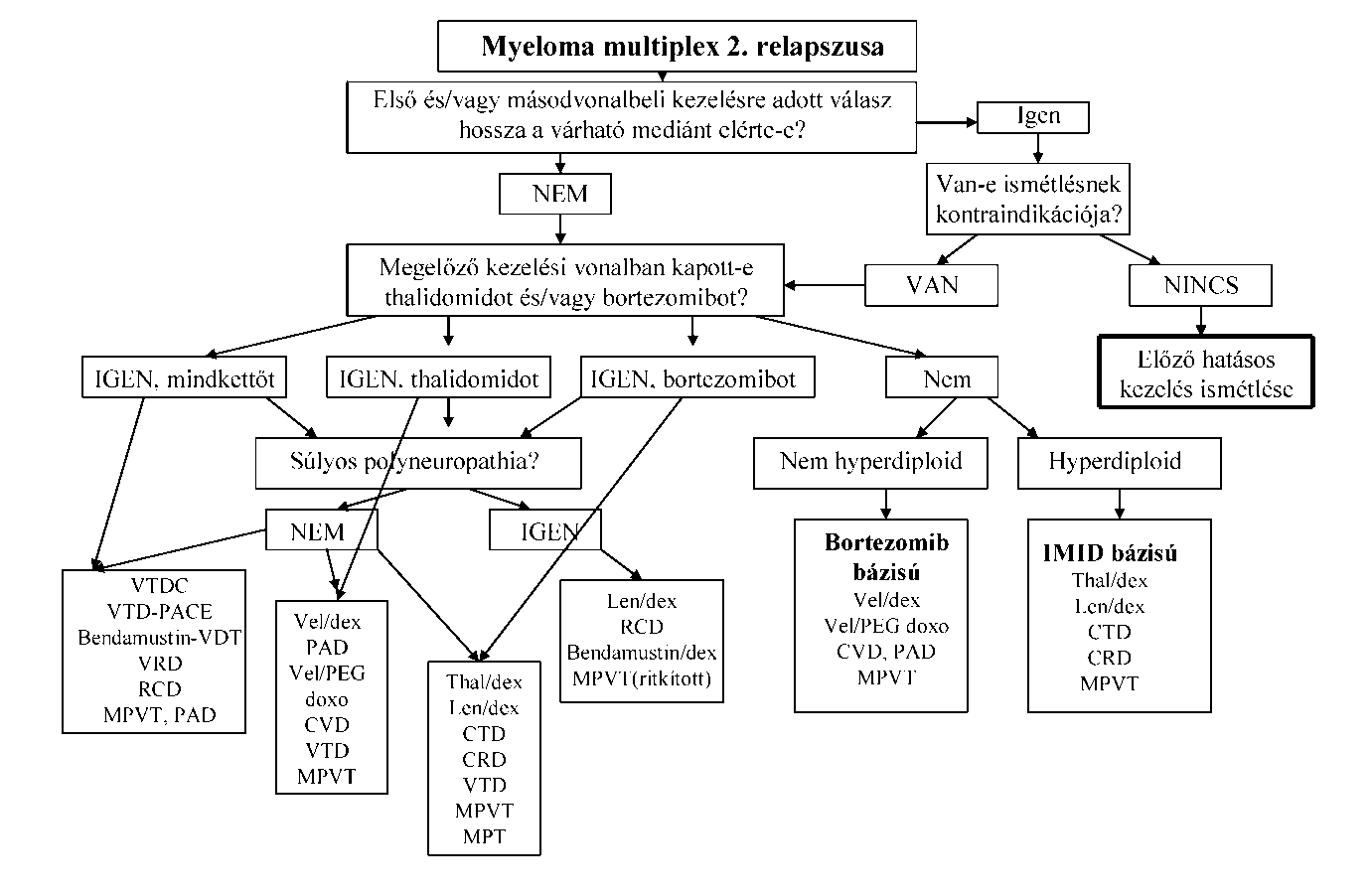
18. táblázat. Komplikációk kezelése myelomában
| Komplikációk (szövődmények) | Terápiás lehetőségek |
| Myelomás csontelváltozások | - A bisphosphonatok kedvező hatása a myelomás csontbetegségekre egyértelműen bizonyított. - Mozgásaktivitásra serkentés az osteopenia és thrombosis megelőzés érdekében. - Fájdalomcsillapítás, ha szükséges kábító fájdalomcsillapítókkal. Kerülni kell a non-steroid gyulladáscsökkentőket. - Radioterápia a fájdalmas csont laesiókra, ha az nem reagál fájdalomcsillapítókra, vagy ha gyöki tünetek vannak. - Sebészi beavatkozás a patológiás fracturák megelőzésére, vagy kezelésére. - A lokalizált csigolya laesióknál vertebroplastica, vagy kyphoplastica fájdalomcsillapítás, vagy nyomáscsökkentés céljából. |
| Anaemia | - Reverzibilis okok kezelése, pl.: vashiány, B12-vitamin, fólsav hiány. - Erythropoetin (EPO) a kemoterápia alatt kialakuló anaemia kezelésére (Thrombosis veszély!). - Szükség esetén transzfúzió. |
| Infekciók | - Streptococcus pneumonia, Haemophilus influenzae, influenza védőoltás. - Profilaktikus széles-spektrumú antibiotikus kezelés mérlegelése, amikor corticosteroid terápia szükséges. - Intravénás immunglobulin (IVIG) hypogammaglobulinaemiához társuló ismétlődő súlyos infekciókban. - Penumocystis carinii elleni profilaxis mérlegelése tartós corticosteroid, valamint thalidomid kezelés esetén (trimethoprim - sulfamethoxazole) |
| Komplikációk (szövődmények) | Terápiás lehetőségek |
| Hypercalcaemia | - Hydrálás és corticosteroid (dexamethason). - Intravénás bisphosphonate |
| Vesekárosodás | - A reverzibilis okok (dehydráció, hypercalcaemia, hyperuricaemia) korrekciója. - Kemoterápia (pl.: VAD, dexamethason, vagy bortezomib + dexamethason) a tumor tömeg gyors csökkentésére. - Lúgos diuresis "cast nephropathia" okozta heveny veseelégtelenség esetén (Bicarbonat). - Hpercalcaemiás betegnél a metabolikus alkalózis elkerülése. - Plazmaferezis heveny veseelégtelenség kialakulásakor (szükség esetén dialízissel kombinálva). |
| Hyperviscositas syndroma | - Jellegzetes klinikai tünetek fellépte esetén azonnali plazmaferezis + kemoterápia (A szérum viszkozitás nem korrelál mindig teljesen a tünetekkel). |
19. táblázat. Az új antimyelomás gyógyszerek leggyakoribb mellékhatásai
| Bortezomib | Thalidomide | Lenalidomide | |
| PN | Igen Reverzibilis | Igen Irreverzibilis | Nem jellemző |
| DVT | Nem jellemző | Igen | Igen |
| Pulmonális Embólia | Nem számoltak be róla | Igen | Igen |
| DVT PE profilaxis kell | - | Igen | Igen |
| Thrombocytopenia | Igen Dóziscsökkentéssel kezelhető | Ritka | Igen |
| Neutropenia | Igen | Igen | Igen |
| Gastrointestinális toxicitás | Igen | Igen | Igen |
| Teratogén | Nem | Igen | ? |
20. táblázat. Új gyógyszerek a MM kezelésére
I. Régi gyógyszerek új származékai: pegilált liposomalis doxorubicin (Caelyx).
II. Új biológiai megfontolásokon alapuló gyógyszerek.
Specifikusan azon mechanizmusokat helyezik a középpontba, melyeknek fontos szerepe van a sejtek növekedésében és életben maradásában a csontvelőben.
1. Thalidomide (Myrin)
2. Thalidomide analógok: Revlimid, Actimid
3. Proteasoma inhibitorok (PS 341, bortezomib): Velcade Carfilzomib: potensebb, nincs neuropathia
4. As2O3 (ATO): Trisenox: - anti CD38 hatás
- anti angiogén hatás (C-vitamin a hatást fokozza)
Kipróbálás alatt lévő szerek a MM kezelésére (fázis II-III. szint)
- Farnesyl - transferase gátlók: Zarnestra (tipifarnib)
- Egyéb jel-átvivő gátlók: Perifosine, Atiprimod
- Bcl - 2 oligonucleotid antisenz: Genasense (oblimersen): apoptosis^
- Immun - válasz stimuláló vakcinák:
= "idiotype / dentritic cell": Mylovenge (dentitikus sejt elleni vakcina)
= myeloma vakcina: Gvax (Cell Genesys): tisztított myeloma sejtek elleni vakcina
= DNA vakcinák: "encode specific myeloma proteins"
= Gén - módosított vakcinák (vírus vektor)
- Monoclonalis antitestek
= Humanizált Anti IL - 6 (tocilizumab)
= Anti RANKL (osteoprotegerin, AMG 162) (Denosumab)
= Anti HM1.24 (Chugai)
= TRM-1: TNF-alfa ligand receptor ellen
- Histon deacetylase inhibitorok (HDAC): valproinsav (Convulex), hidroxaminsav /SAHA, LBH 589/
- HSP (heat shock protein) inhibitorok (tanespimycin)
- IGF (insulin - like growth factor) receptor inhibitor
- VEGF - receptor inhibitor (Bevacizumab)
- TRAIL : TNF - related apoptosis inducing ligand
- Csontrendszer célzott radioterápiája: STR (skeletal targeted radiotherapy) [166Holmium, 153Samarium]
- Antiösztrogének (2-methoxyöstradiol)
- Clarithromycin (anti IL-6 hatás)
- Neovastat (cápaporc kivonat): angiogenesis gátlás
- Defibrotid (mikrokörnyezetet befolyásolja) (p.o. alkalmazható MPT-vel kombinációban)
- FGFR3 inhibitorok: t(4;14) MM-ben (bortezomib-al kombinálva)
21. táblázat
KONVENCIONÁLIS KEMOTERAPIÁS PROTOKOLLOK
| Protokoll neve | Gyógyszer | Dózis/nap | Beadás módja | Napok | Ismétlés (megjegyzés) |
| MP | Melphalan | 7-12 mg/m2 | p.o. | 1-4. | 4-6 hetenként |
| Prednisolon | 40 mg/m2 | p.o. | 1-4. (7) | ||
| CP (kis dózis) | Cyclophosphamid | 150 mg/m2 | p.o. | 1-5. | |
| Prednisolon | 60 mg/m2 | p.o. | 1-5. | 3 hetente | |
| CP (közepes dózis) | Cyclophosphamid | 600 mg/m2 | i.v. | 1-4. | |
| Prednisolon | 50-100 mg | p.o. | 1-4. | 4 hetente | |
| Nagydózisú cyclophosphamid | Cyclophosphamid | 3000.0 mg/m2 | i.v. | 1. | |
| Mesna | 3000.0 mg/m2 | i.v. | 1. | 4 hét | |
| VMCP | Vincristin | 1 mg/m2 | i.v. | 1. | 3 hetenként |
| Melphalan | 6 mg/m2 | p.o. | 1-4. | ||
| Cyclophosphamid | 125 mg/m2 | p.o. | 1-4. | ||
| Prednisolon | 60 mg/m2 | p.o. | 1-4. | ||
| VCAP | Vincristin | 1 mg | i.v. | 1. | 4 hetenként |
| Cyclophosphamid | 100 mg/m2 | p.o. | 1-4. | ||
| Adriamycin | 25 mg/m2 | i.v. | 2. | ||
| Prednisolon | 60 mg/m2 | p.o. | 1-4. | ||
| VMCP-VCAP | Lásd, mint előbb. | VMCP a VCAP-vel alternálva, 3 hetenként adva, 6-12 hónapon át. | |||
| VBAP | Vincristin | 1 mg | i.v. | 1. | 3 hetenként |
| BCNU (carmustine) | 30 mg/m2 | i.v. | 1. | ||
| Adriamycin | 25 mg/m2 | i.v. | 1. | ||
| Prednisolon | 60 mg/m2 | p.o. | 1-4. | ||
| VMCP-VBAP | A gyógyszerek és a protokoll lásd, mint előbb. | VMCP 3 hetenként, 3x ciklus, majd VBAP 3 hetenként, 3x ciklus. Az egész kétszer ismételve. |
| Protokoll neve | Gyógyszer | Dózis/nap | Beadás módja | Napok | Ismétlés (megjegyzés) | |
| ABCM | Adriamycin | 30 mg/m2 | i.v. | 1. | 6 hetenként | |
| Carmustine | 30 mg/m2 | i.v. | 1. | |||
| Cyclophosphamid | 100 mg/m2 | p.o. | 22-25. | |||
| Melphalan | 6 mg/m2 | p.o. | 22-25. | |||
| VBMCP (M2) | Vincristin | 1,2 mg/m2 (max. 2,0 mg) | i.v. | 1. | 5 hetenként | |
| BCNU | 20 mg/m2 | i.v. | 1. | |||
| Melphalan | 8 mg/m2 | p.o. | 1-4. | |||
| Cyclophosphamid | 400 mg/m2 | i.v. | 1. | |||
| Prednisolon | 40 mg/m2 | p.o. | 1-7. | |||
| 20 mg/m2 | p.o. | 8-14. (1-3 ciklusban) | ||||
| EDAP | Etoposide | 100 mg/m2 | Cont. inf. | 1-4. | 3-4 hetenként | |
| Dexamethason | 40 mg | i.v./p.o. | 1-5. | |||
| ARA-C | 1000 mg/m2 | i.v. | 5. | |||
| Cisplatin | 20 mg/m2 | Cont. inf. | 1-4. | |||
| CyE | Cyclophosphamid | 600 mg / m2 | i.v. | 1-5. | 3-4 hetenként | |
| Etoposide | 180 mg | i.v. | 1-5. | |||
| DCEP | Dexamethason | 40 mg | p.o. | 1-4 | 4 hetenként | |
| Cytoxan | 750 mg | Cont. inf. | 1-4. | |||
| Etopozide (VP - 16) | 75 mg | Cont. inf. | 1-4. | |||
| Platinol (cisplatinum) | 25 mg | Cont. inf. | 1-4. | |||
| G-CSF | 300 ug | s.c. | Naponta, míg a granulocyta szám rendeződik | |||
| VAD | Vincristin | 0,4 mg | Cont. inf. | 1-4. | 4 hetenként | |
| Adriamycin | 9 mg/m2 | Cont. inf. | 1-4. | |||
| Dexamethason | 40 mg | i.v./p.o. | 1-4. | |||
| 9-12. | ||||||
| 17-20. | ||||||
| VAMP | Vincristin | 0,4 mg | Cont. inf. | 1-4. | 3-4 hetenYként | |
| Adriamycin | 9 mg/m2 | Cont. inf. | 1-4. | |||
| Methylprednisolon | 1000 mg | i.v./p.o. | 1-5. | |||
| C-VAMP | Cyclophosphamid | 500 mg | i.v. | 1.; 8.; 15. | 3 hetenYként | |
| Vincristin | 0,4 mg | Cont. inf. | 1-4. | |||
| Adriamycin | 9 mg/m2 | Cont. inf. | 1-4. | |||
| Methylprednisolon | 1000 mg | i.v./p.o. | 1-5. | |||
| DVD | Liposomalis doxorubicin (Caelyx) | 40 mg/m2 | i.v. | 1. | 4 hetenYként | |
| Vincristin | 2 mg | i.v. | 1. | |||
| Dexamethasone | 40 mg | i.v./p.o. | 1-4. | |||
| Z-Dex | Idarubicin (Zavedos) | 10 mg/m2 | p.o. | 1-4. | 4 hetenYként | |
| Dexamethasone | 40 mg | p.o. | 1-4. | |||
| VID | Vincristin | 0,4 mg | 24h infúzió | 1-4. | 4 hetenkYént | |
| Idarubicin (Zavedos) | 10 mg/m2 | p.o. | 1-4. | |||
| Dexamethasone | 40 mg | i.v./p.o. | 1-4. | |||
| MOP | Vincristin | 2 mg | i.v. | 1. | 4 hetenként | |
| Mitoxantrone | 16 mg/m2 | i.v. | 1. | |||
| Prednisolon | 250 mg/m2 | p.o. | 1-4. | |||
| MOD | Vincristin | 2 mg | i.v. | 1. | 4 hetenként | |
| Mitoxantrone | 16 mg/m2 | i.v. | 1-4. | |||
| Dexamethason | 40 mg | p.o. | 1-4. | |||
22. táblázat
BORTEZOMIB ALAPÚ PROTOKOLLOK
| Protokoll neve | Gyógyszer | Dózis/nap | Beadás módja | Napok | Ismétlés (megjegyzés) |
| Bortezomib monoterápia | Bortezomib (Velcade) | 1.3 mg/m2 | i.v. | 1. 4. 8. 11. | 10 nap szünet után |
| Vel-Dex. | Bortezomib | 1.3 mg/m2 | i.v. | 1., 4., 8., 11. | 3 hét |
| Dexamethasone | 20 mg | i.v./p.o. | 1-2., 4-5., 8-9., 11-12. | ||
| MPV | Melphalan | 9 mg/m2 | p.o. | 1-5. | 6 hét |
| Prednisolon | 60 mg/m2 | p.o. | 1-5. | ||
| Velcade (bortezomib) | 1.3 mg/m2 | i.v. | 1-4. ciklusban: 1., 4., 8., 11., 22., 25., 29., 32. | ||
| 5-9. ciklusban: Hetente 1x (1., 8., 22., 29.) | |||||
| PAD | Bortezomib(PS 341) | 1.3 mg/m2 | i.v. | 1., 4., 8., 11. | 3 hét |
| Doxorubicin (Adriamycin) | 9 mg/m2 | 1 órás inf. | 1-4. | ||
| Dexamethasone | 40 mg | i.v./p.o. | 1-4 és 8-11. | ||
| Dexamethasone | 20 mg | i.v./p.o. | 5., 12. | ||
| PAD Csökkentett dózisú | Bortezomib | 1.0 mg/m2 | i.v. | 1., 4., 8., 11. | 3 hét |
| Adriamycin | 9 mg/m2 | Cont. inf. | 1-4. | ||
| Dexamethasone | 40 mg | i.v./p.o. | 1-4., 8-11., 15-18. első ciklusban; csak 1-4 napon 2.3.4. ciklusban | ||
| PAD-liposomalis doxorubicin (pegylalt) | Bortezomib | 1.3 mg/m2 | i.v. | 1., 4., 8., 11. | 3 hét |
| Pegylalt liposomalis doxorubicin | 30 mg/m2 | inf. | 4. | ||
| Dexamethasone | 40 mg | i.v./p.o. | 1. ciklus: 1-4.8-11.15-18. 2-4 ciklus: 1-4. | ||
| PID | Bortezomib | 1.3 mg/m2 | i.v. | 1., 4., 8., 11. | 3 hét |
| Idarubicin | 10 mg/m2 | p.o. | 1-4. | ||
| Dexamethasone | 40 mg | i.v./p.o. | 1-4 és 8-11. | ||
| Dexamethasone | 20 mg | i.v./p.o. | 5. és 12. | ||
| Cy-Bor-D | Cyclophosphamid | 300 mg/m2 | p.o. | 1., 8., 15., 22. | 4 hét |
| Bortezomib | 1.3 mg/m2 | i.v. | 1., 4., 8., 11. | ||
| Dexamethasone | 40 mg | 1-4. 9-12. 17-20. | |||
23. táblázat
IMID ALAPÚ PROTOKOLLOK
THALIDOMIDE
| Protokoll neve | Gyógyszer | Dózis/nap | Beadás módja | Napok | Ismétlés (megjegyzés) | |
| Thalidomid (monoterápia) | Thalidomid | 200-400 mg | p.o. | folyamatos | ||
| Thal-Dexa/A | Thalidomid | 200 mg | p.o. | 1-28. | 4 hét | |
| Dexamethasone | 40 mg | p.o. | 1-4. 9- 2. 17-20. | |||
| Thal-Dexa/B | Thalidomid | 200 mg | p.o. | 1-28. | 4 hét | |
| Dexamethasone | 40 mg | p.o. | 1. 8. 15. 22. | |||
| MPT | Melphalan | 6 mg/m2 | p.o. | 1-5. | 4 hét | |
| Prednisolone | 60 mg/m2 | p.o. | 1-5. | |||
| Thalidomid | 200 mg | p.o. | 1-28. | |||
| CTD | Cyclophosphamid | 50 mg | p.o. | 1-21. | 4 hét | |
| Thalidomid | 200 mg | p.o. | 1-21. | |||
| Dexamethasone | 40 mg | p.o. | 1-4. | |||
| CTDa | Cyclophosphamid | 100 mg | p.o. | folyamatos | 4 hét | |
| Thalidomide | 100 mg | p.o. | folyamatos | |||
| Dexamethasone | 20 mg | i.v./p.o. | 1-4 és 15-18 | |||
| Hyper-CTD | Cyclophosphamid | 600 mg/m2 | i.v. | 1-3. | 4 hét | |
| Dexamethason | 40 mg | i.v./p.o. | 1-4.és 9-12. | |||
| Thalidomid | 200 mg | p.o. | 1-28. | |||
| TAD | Thalidomide | 100 mg | p.o. | folyamatos | 3 hét | |
| Adriamycin | 9 mg/m2 | Cont. inf. | 1-4. | |||
| Dexamethasone | 40 mg | i.v./p.o. | 1., 8., 15., 22. | |||
| TCED | Thalidomide | 400 mg | p.o. | folyamatosan | 4 hetenként | |
| Cyclophosphamide | 400 mg/m2 | Cont. inf. | 1-4. | |||
| Etoposide | 40 mg/m2 | Cont. inf. | 1-4. | |||
| Dexamethasone | 40 mg | i.v. / p.o. | 1-4. | |||
| BLT-D (módosított) | Biaxin (clarithromycin) | 250 - 500 mg | p.o. | naponta | folyamatosan | |
| Alacsony dózisú thalidomide | 50 mg | p.o. | naponta | |||
| Dexamethasone | 40 mg 40 mg 40 mg | p.o. p.o. p.o. | 4 napig, másodnaponta 2 hétig, heti 1x folyamatosan | |||
| DT-PACE | Dexamethason | 40 mg | naponta p.o. | 1-4. | 4 hetenként | |
| Thalidomide | 400 mg | naponta p.o. | folyamatosan | |||
| Platinol (cisplatinum) | 10 mg/m2 | Cont. inf. | 1-4. | |||
| Adriamycin | 10 mg/m2 | Cont. inf. | 1-4. | |||
| Cytoxan | 400 mg/m2 | Cont. inf. | 1-4. | |||
| Etopozide (VP -16) | 40 mg/m2 | Cont. inf. | 1-4. | |||
| G-CSF | 300 |ig | s.c. | Naponta, míg a granulocyta szám rendeződik | |||
| Protokoll neve | Gyógyszer | Dózis/nap | Beadás módja | Napok | Ismétlés (megjegyzés) |
| Bendamustin-PT Protokoll | Bendamustin | 100 mg/m2 | i.V. | 1. és 8. | 3 hét |
| Prednisolon | 60 mg/m2 | p.o. | 1-5. | ||
| Thalidomid | 100 mg | p.o. | 1-28. |
LENALIDOMIDE
| Protokoll neve | Gyógyszer | Dózis/nap | Beadás módja | Napok | Ismétlés (megjegyzés) |
| Len-Dex | Lenalidomid | p.o. | 1--21. | 4 hét | |
| Dexamethasone | p.o./i.v. | 1-4., 9-12., 17-20. | |||
| Revlo-dex | Lenalidomid | p.o. | 1-21. | 4 hét | |
| Dexamethasone | i.v./po. | 1., 8., 15., 22. |
24. táblázat
EGYÉB (VEGYES ALAPÚ) PROTOKOLLOK
| Protokoll neve | Gyógyszer | Dózis/nap | Beadás módja | Napok | Ismétlés (megjegyzés) |
| HDMP | Methylprednisolon | 1000 mg/m2 | i.v./p.o. | 1-4. | - |
| Nagydózisú Dexa | Dexamethasone | 40 mg | i.v./p.o. | 1-4., 9-12., 17-20. | 4 hét |
| VTD | Bortezomib | 1.3 mg/m2 | i.v. | 1. 4. 8. 11. | |
| Thalidomide | 200 mg | p.o. | 1-21. | 4 hét | |
| Dexamethasone | 20 mg | i.v./p.o. | 1-2., 4-5., 8-9., 11-12. | ||
| VTDa | Bortezomib | 1.3 mg/m2 | i.v. | Hetente 1x (4 alkalom) | |
| Thalidomide | 100 mg | p.o. | folyamatosan | 5 hét | |
| Dexamethasone | 40 mg | i.v./p.o. | Hetente 1x (4 alkalom) | ||
| VTDC | Bortezomib | 1.3 mg/m2 | i.v. | 1., 4., 8., 11. | |
| Thalidomide | 200 mg | p.o. | 1-21. | 4 hét | |
| Dexamethasone | 40 mg | i.v./p.o. | 1-4 és 9-12 | ||
| Cyclophosphamide | 400 mg/m2 | i.v. | 1 és 8. | ||
| MPVT | Melphalan | 6 mg/m2 | p.o. | 1-5. | |
| Prednisolon | 60 mg/m2 | p.o. | 1-5. | ||
| Velcade (bortezomib) | 1.3 mg/m2 | i.v. | 1., 4., 15., 22. | 4 hét | |
| Thalidomid | 100 mg | p.o. | 1-28. (folyamatos) | ||
| VDT-PACE | Velcade | 1.3 mg/m2 | i.v. | 1., 4., 8. | 4 hét (LMWH, G-CSF, centralis kanül szükséges) |
| Doxorubicin | 10 mg/m2 | 24 órás inf. | 1-4. | ||
| Cisplatin | 10 mg/m2 | 24 órás inf. | 1-4. | ||
| Etopozid | 40 mg/m2 | 24 órás inf. | 1-4. | ||
| Cyclophosphamid | 400 mg/m2 | 24 órás inf. | 1-4. | ||
| Thalidomid | 400 mg | p.o. | 1-4. | ||
| Dexamethasone | 40 mg | i.v./p.o. | 1-4. | ||
| Bendamustin-PVT | Bendamustin | 100 mg/m2 | i.v. | 1. és 8. | |
| Bortezomib | 1.3 mg/m2 | i.v. | 1., 4., 8., 11. | 3 hét | |
| Prednisolon | 60 mg/m2 | p.o. | 1-5. | ||
| Thalidomid | 100 mg | p.o. | folyamatosan |
25. táblázat. A MM kezelésének evidencia-szintjei*
Primer indukciós kezelés transzplantációra jelölt betegen
- Evidencia 1:
- Bortezomib/Dexamethasone (Vel/Dex.)
- Bortezomib/doxo/Dexa. (PAD)
- Bortezomib/thal./Dexa. (VTD)
- Lenalidomide/Dexa. (Len-Dex)
- Evidencia 2B:
- Bortezomib/lenalidomid/Dexa. (VLD)
- Dexamethasone (Dexa.)
- Liposom.doxo/vincristin/Dexa. (DVD)
- Thalidomide/Dexamethasone (Thal-Dexa)
Primer indukciós kezelés transzplantációra nem jelölt betegen
Evidencia 1:
- Melphalan/prednisolon/bortezomib (MPV)
- Melphalan/prednisolon/thalidomide (MPT)
- Lenalidomide/low dose dexa. (Revlo-dex) Evidencia 2A:
- Melphalan/prednisolon (MP)
Evidencia 2B:
- Dexamethasone (Dexa.)
- Liposom.doxo/vincristine/Dexa. (DVD)
- Thalidomide/Dexa (Thal.-Dexa.)
- Vincristine/doxo./Dexa. (VAD)
Fenntartó kezelés:
Evidencia A: Thalidomide (Thal.)
Evidencia 2B: Interferon Prednisolon
Thalidomide + prednisolon
Mentő (salvage) kezelés
- Evidencia 1:
- Bortezomib
- Bortezomib/liposomalis doxo. (Vel/PEG-doxo.)
- Lenalidomide/Dexa. (Len-Dex)
- Evidencia 2A:
- Bortezomib/Dexa. (Vel-Dex.)
- Cyclophosphamid-VAD (C-VAD)
- Dexamethasone (Dexa.)
- Dexa./cyclo./etop./cispl. (DCEP)
- Dexa./thal./cispl./doxo./cyclo./etop. (DT-PACE)
- High-dose-cycloph.
- Lenalidomide
- Primer indukciós kezelés ismétlése (ha a relapsus >6 hónap utáni)
- Thalidomide
- Thalidomide/Dexamethasone (Thal-Dexa.)
- Evidencia 2B
- Bendamustin
- Bortezomib/lenalidomide/Dexa. (VLD)
Őssejt-átültetés
Autolog: evidencia 1.
2. autolog: evidencia 2B (vagy tanulmány)
Allogen: evidencia 3 (vagy tanulmány)
*(NCCN Clinical Practice Guidlines in Oncology Multiple Myeloma V.2.2010 alapján)
A FELNŐTTKORI HODGKIN-LYMPHOMA
I. Alapvető megfontolások, bevezetés
A Hodgkin-lymphoma (HL) a nyirokrendszer rosszindulatú - nyirokcsomók és gyakran máj-lép megnagyobbodással járó -daganatos, csaknem kizárólag klonális B-lymphocyta eredetű megbetegedése, mely nemcsak típusos klinikai és morfológiai, hanem kezelési jellemzőkkel is bír, mely megkülönbözteti a többi lymphomától. Ezek a sajátosságok indokolják az önálló szakmai ajánlást, melyet alkalmazni kell a hazai egészségügyi ellátó rendszer szintjein, az alapellátás és a járó/fekvőbeteg szakellátás feladatait - ÁNTSZ engedéllyel - végző, a minimum feltételeknek megfelelő intézményekben; a 18 év feletti Hodgkin-lymphomás betegek diagnosztizálása, vizsgálata gyógykezelése és követéses gondozása során, valamint a közreműködő diagnosztikai és klinikai társszakmák működési engedéllyel rendelkező szolgáltató egységei munkájában. Célja, hogy egységes diagnosztikus, terápiás és gondozási irányelveket javasolva a Hodgkin-lymphoma (BNO-C81) Magyarországon is elérje a fejlett ipari országok adataiból ismert 80-85%-os gyógyulási arányt. Tartalmazza a diagnózishoz, stádium és prognosztikai faktorok megállapításához szükséges vizsgálatokat. Ezek alapján alkalmazandó alapterápiának minősülő gyógyszeres, polikemoterápiás kombinációkat és radioterápiát, mind a betegség elsődleges vagy ismételt kezelésének eseteire. Egységes irányelveket ad a kezelés hatásának megítélésére és a gondozásra, készítése során a legújabb nemzetközi (Medline) és hazai megjelent ajánlásokat, közleményeket, valamint külföldi és hazai konszenzus megbeszélések eredményeit használtuk fel. Az evidencia szintjének (I-IV) és az ajánlás fokának (A-D) megadásával, melyhez az Amerikai Klinikai Onkológiai Társaság javaslatát használtuk.
Definiciók, rövidítések
A HL az összes lymphoma 12-18%-a, sajátságos klinikai és morfológiai tulajdonságokkal és kezelési jellemzőkkel bír. A 2008-as WHO 4. osztályozás az etiológiai, morfológiai és klinikai különbözőségek alapján a (BNO-C81) noduláris lymphocyta predomináns (NLPHL) és a klasszikus (cHL) Hodgkin-lymphoma csoportot különít el, melynek alcsoportjai a már régről ismert szövettani formák, mint: a lymphocyta-gazdag (LRcHL), noduláris sclerosis (NS), kevert sejtes (MC) és lymphocyta szegény (LD). Ritkán az alcsoport nem határozható meg (ND), máskor a szövettani vizsgálat (és a klinikai viselkedés is) átmeneti jelleget mutat a (BNO-C83) HL és a diffúz nagy B-sejtes lymphoma között (DLBCL), mely új entitásként jelenik meg a fenti legújabb, jelenleg használt klasszifikációban. Lokalizált-korai (I-II stádium) vagy disszeminált-előrehaladott (III-IV stádium) formában jelentkezhet, gyakran típusos panaszokkal, mint láz, fogyás, éjszakai izzadás (B tünetek) és bőrviszketés. A kezelés a szövettani altípus mellett a HL stádiumán és a prognosztikai tényezőkön (illetve az utóbbi időben a korai kezelési válaszon is) alapul(hat). Gyógyultnak - definíció szerint - azt a Hodgkin-lymphomás beteget nevezzük, aki kezelést követő 10 éven keresztül tünet és betegségmentes marad.
ABVD = adriamycin, bleomycin, vinblastin, dacarbazin; AHSCT = autológ hemopoetikus őssejt transzplantáció; BEACOPP = bleomycin, etoposid, adriamycin, cyclophosphamid, vincristin, procarbazin, prednison; CEP = CCNU, etoposid, chlorambucil, prednison; CMT = kombinált kemo- és radioterápia; CT = computer tomographia; KS = klinikai stádium; NLPHL = noduláris lymphocyta predomináns Hodgkin lymphoma, cHL = klasszikus Hodgkin lymphoma; EBVP = epirubicin, bleomycin, vinblastin, prednison; COPP = cyclophosphamid, vincristin, prednison, procarbazin; CVPP = cyclophosphamid, vinblastin, prednison, procarbazin; DHAP = dexamethason, cytarabin, cisplatin; EFS = event-free survival (eseménymentes túlélés); EORTC = European Organization for the Research and Treatment of Cancer; FDG-PET = 18F-dezoxy-glükóz-pozitron emissziós tomographia; EF-RT = kiterjesztett mezős irradiáció; FFP = freedom from progression (progressziómentes túlélés); FFF = freedom from treatment failure; G-CSF = granulocyta-colonia stimuláló faktor; GHSG = German Hodgkin's Lymphoma Study Group; HDT = nagydózisú kezelés; HL = Hodgkin lymphoma; IF-RT = érintett mezős irradiáció; IPS = Nemzetközi prognosztikai érték;
KR = komplett (teljes) remisszió; KRu = bizonytalan KR; KT = kemoterápia; OS = teljes túlélés; RT = radioterápia; STNI = subtotal-nodal irradiáció; TNI = total-nodal irradiáció; VBM = vinblastin, bleomycin, methotrexat.
A betegség/állapot leírása
A Hodgkin lymphomák közös jellemzője, hogy: (1) a betegség a nyirokcsomókból indul ki és ezt követően disszeminálódik további nyirokszövetekbe vagy más extra-lymphatikus szervekbe; (2) a betegség többnyire fiatalokat érint; (3) a tumorsejtek (Hodgkin és, Reed-Sternberg (HRS) sejt, lacunaris sejt, L&H sejt) száma/aránya a tumoros szövetben kevés; (4) a tumorsejtek környezetében tömeges nem-daganatos, reaktív sejtek (epitheloid sejtek, histiocyták, lymphocyták, eozinofil granulocyták, plazmasejtek) azonosíthatók; (5) a tumorsejteket gyakran T-sejtek övezik rozetta alakzatban.
1. Kockázati és kiváltó tényezők
Annak ellenére, hogy a HRS-sejtek eredete már nyilvánvaló, a HL egyértelmű oka továbbra sem tisztázott. Kialakulásában endogén (genetikai és immunológiai) és környezeti tényezők együttes kölcsönhatása feltételezhető. Endogén okokra utalhat a HL-es betegek ikertestvér-vizsgálata, azaz a homozygota testvéreknél a HL előfordulásának valószínűsége a százszorosa volt a kétpetéjű ikertestvérekhez képest. HL-re jellemző, a betegség patogenezisében szerepet játszó típusos genetikai eltérés nem mutatható ki. Az immunológiai tényezők jelentőségére mutat a HL-es betegeknél észlelt, döntően celluláris jellegű immunhiány, immunregulációs zavar, amely nemcsak a kezeletlen, hanem a tartósan remisszióban lévőknél vagy gyógyultaknál is kimutatható. Feltételezhetően megelőzi és szerepet játszik a HL kialakulásában, amelyet megerősít az a tény is, hogy a HL gyakoribb a primer és az olyan szerzett immunhiányos állapotokban, mint az AIDS vagy a tartós immunszuppresszív kezelésben részesülő transzplantáltak. Congenitalis CD95/FAS mutáció talaján kialakuló autoimmun-lymphoproliferativ szindrómában a cHL rizikója ötvenszeres. Több korábbi - főleg epidemiológiai adat - arra utalt, hogy a HL kiváltásában infektív ágens, leginkább ubiquitaer vírus szerepet játszhat. Az EBV etiológiai szerepe a cHL esetek egy részében a következők alapján mindenképpen felvethető: 1. A cHL háromszor gyakoribb a mononucleosis infectiosán fiatal felnőttkorban átesettek között; 2. A HL-es betegeknél az EBV-ellenes antitesttiter magasabb; 3. A klonális EBV-genom, illetve annak terméke (LMP - latent membrane protein, latens membránprotein) a cHL esetek 20-60%-ában a daganatos HRS-sejtekben kimutatható (főleg az MC altípusban, gyermek- és késő felnőttkorban), az NLPHL-esetek azonban negatívak. Az EBV-genom klonalitása arra utalhat, hogy a HL egyetlen megfertőzött sejtből alakult ki. Az EBV-negatív esetekben az EBV "hit and run" mechanizmusa és más lymphotrop vírusok etiológiai szerepe eddig nem nyert megerősítést.
2. Patogenezis
A NLPHL esetek identikus IgVH-régióval rendelkező L&H-daganatsejtjeiben szomatikus hipermutáció mellett 80%-ban folyamatos (ongoing) mutáció, valamint a funkcionálisan aktív Ig-gén is kimutatható volt. Ez azt jelenti, hogy az L&H-sejtek fenntartják Ig-expressziójukat, megfelelő affinitású B-sejt-receptorral (BCR) rendelkeznek, és antigénszelekciós hatás alatt állnak, azaz a geno-és fenotípus alapján is centroblastként viselkednek centrum germinatívum szerű mikrokörnyezetben, melynek megléte fontos lehet a klonális populáció expanziója szempontjából. Jelenleg azonban a kiváltó tényezőről és a kialakulás lépéseiről semmilyen további információval nem rendelkezünk. Más a helyzet a cHL esetében, klonálisan átrendezett, nem funkcionális, azaz nem leíródó Ig-gének szomatikusan hipermutáltak, de ongoing mutáció már nem mutatható ki. Ez azt jelenti, hogy a HRS-sejtek is tüszősejtekből keletkeztek, de már nem állnak antigénhatás alatt, másrészt megfelelő affinitású sIg-t nem jelenítenek meg, melyből következik, hogy a HRS-sejtek kialakulását okozó transzformáló hatásnak meg kellett előznie vagy egybe kellett esnie azzal a mutációval, amely a nem funkcionális Ig-gén kialakulásához vezetett. Egyes vizsgálatok a HRS-sejtekben nem funkcionális Ig-gének okaként az esetek 25%-ában IgVH váz szegmentumaiban stop kodonok vagy out-of-frame mutáció eredményeként létrejövő "bénulásról" (crippling mutation) számolnak be, mások a gén promoter régiójában a transzkripciós faktorok kötésének gátlását okozó mutációkat közöltek. Harmadsorban az esetek egy részében az Ig-gén funkcionális lenne, de a transzkripciós program az Oct2, OB1/OBF1, PU1, EA2 faktorok hiánya miatt nem működik.
3. Genetikai háttér
HL-re jellemző, a betegség patogenezisében szerepet játszó típusos genetikai eltérés - ellentétben számos NHL típussal - nem mutatható ki. Egyes esetek HRS-sejtjeinek vizsgálata során többféle kromoszóma, illetve kromoszómarégió (leginkább 2p, 4p, 9p, 12p, 16p) eltérését észlelték. FISH-technikával a cHL minden típusában kimutathatók klonális numerikus aberrációk. Ismert a HRS-sejtek gyakori aneuploiditása. A p53 mutációja ritkán detektálható. Az immunregulációs zavar egyértelmű eredete tisztázatlan. Congenitalis CD95/FAS mutáció talaján kialakuló autoimmun-lymphoproliferativ szindrómában a cHL rizikója ötvenszeres. Familiáris esetek - nagyon ritkán - előfordulnak.
4. Incidencia/Prevalencia/Morbiditás/Mortalitás Magyarországon
A HL az egész világon előfordul, nemzetközi előfordulása - Ázsiától eltekintve, ahol ritka - mindkét nemben viszonylag kis eltéréseket mutat. Hazai incidenciája 2-3/100 000 lakos/év, mely nemzetközileg átlagosnak tekinthető. Incidencia Magyarországon 2008-ban: férfi: 122, nő: 124, 2009-ben: férfi 136, nő: 121 (Nemzeti Rákregiszter)
Mortalitás: 2004-2008 között férfi: 37-16 között évente, nő: 34-10 között évente, Prevalencia: Ma Magyarországon kb. 2300-2500 Hodgkin lymphomás van (ide már nem számolva a 10 éven túli, ún. "gyógyult" betegeket).
5. Jellemző életkor és nem
Általában 1,2-1,5:1 arányú férfi dominancia észlelhető, halmozottan fordul elő a 20-30, illetve az 50-60 életév között. Ellentétben az incidenciával a HL-es betegek és a betegség különböző jellemzőiben jelentős földrajzi és szocio-gazdasági eltérések vannak. Az első korcsúcsnál mérsékelt női túlsúly és jelentős NS dominancia figyelhető meg. A fejlődő országokban jellemző a gyermekkori halmozódás, felismeréskor észlelt előrehaladott stádium, valamint az MC nagyobb aránya. Magyarországon napjainkban összességében az NS szubtípus a leggyakoribb, ezt követi az MC, de férfiaknál MC túlsúly van. A cLP és LD aránya hasonló, 5% körüli, kevés NLPHL és ND fordul elő.
6. Panaszok, Tünetek, Általános jellemzők
A HL felismerésekor a betegek fele panaszmentes, leggyakoribb tünet a fájdalmatlan nyirokcsomó megnagyobbodás, ritkábban hepatosplenomegalia is észlelhető. Inkább az előrehaladott stádiumú betegeknél szisztémás, ún. B-tünetek, mint fogyás, éjszakai izzadás és láz jelentkeznek, a láz gyakran Pel-Ebstein, unduláló típusú. A betegek bőrviszketésről számolhatnak be, ritka, sajátos panasz az alkoholfogyasztás után a megnagyobbodott nyirokcsomóknak megfelelően jelentkező fájdalom. A HL-t általában szabályos terjedés jellemzi az egyik nyirokcsomó régióról a szomszédos másikra, de a véráram útján is terjedhet. A rekesz feletti területen a megjelenés gyakoribb, az esetek 60-80%-ában nyaki vagy supraclavicularis, az esetek felében mediastinális-hiláris lymphadenomegalia észlelhető, amely gyakran jelentős, ún. "bulky" méretű és közvetlenül terjedhet a tüdőre, pericardiumra és a mellkasfalra. A rekesz alatt általában lép és a coeliaca menti nyirokcsomók érintettek először majd progresszió során típusosan paraaortalis és kismedencei régiók következnek. A NLPHL és a cHL klinikai jellemzőiben eltér egymástól ezt a 1. táblázat mutatja be.
1. táblázat A cHL és NLPHL klinikai jellemzői
| cHL | NLPHL | |
| Kormegoszlás | Bimodális | Unimodális |
| Férfi arány | NS: 50%, MC 70% | 70% |
| Lokalizáció | Mediastinum, has, lép | Perifériás nyirokcsomók |
| Stádium | Gyakran II vagy III-IV | Általában I |
| B-tünetek | 40% | <20% |
| Lefolyás | Agresszív, gyógyítható | Indolens, késői relapszusok |
| DLCBL rizikója | 1% | 2-6,5% |
7. Érintett szervrendszer(ek)
Döntő többségben lymphadenomegalia, melyhez (hepato) - splenomegalia társulhat. Primer extranodalis kiindulás elvétve fordul elő, disszeminált esetekben leggyakrabban a máj, a csont, és a tüdő megbetegedése figyelhető meg. Az esetek 8-15%-ában HL-es infiltráció észlelhető a csontvelőben, ez gyakoribb előrehaladott stádiumban és B tünetek jelenléte esetén, ritkán pancytopeniával járhat. NS-típus esetén a mediastinalis, MC esetén a hasüregi lymphadenomegalia gyakoribb, az LD idősebbeknél, általában előrehaladott stádiumban kerül felismerésre. Leukémiás vérképpel szinte sohasem találkozunk, a központi idegrendszeri és gasztrointesztinális megjelenés rendkívül ritka. A megnagyobbodott nyirokcsomók kompressziós eltéréseket okozhatnak, így a nyaki sympathicus idegek, valamint a n. recurrens bénulása Horner-syndromát és a gégeizmok bénulását okozhatja. A mediastinális, hiláris eltérések tracheobronchialis kompressziót, véna cava superior syndromát, dyspnoet, obstructiv légúti tüneteket okozhatnak. Ha a tumor összenyomja az intra-vagy extrahepatikus epeutakat sárgaság alakul ki. A kismedencei vagy lágyék nyirokereinek obstructioját alsó végtagi oedema követi. Az ideggyökök nyomását neuralgiás fájdalmak kísérik, a gerincvelőt komprimáló epidurális terjedés paraplégiát okozhat. A csonteltérések gyakran tünetmentesek, azonban fájdalommal is járhatnak. Néha a csontvelői vérképzés kiszorítása anaemiát, pancytopeniát okozhat.
8. Gyakori társbetegségek
A betegek többsége immunhiányos (főleg celluláris), amely hozzájárul a gyakori bakteriális és szokatlan gomba és vírusos fertőzésekhez. Nem ritkán immunthrombocytopenia (ITP) és autoimmun hemolyticus anemia (AIHA) társulhat hozzá, paraneoplaziás jelenségként nephrosis, bőrtünetek (vasculitis, pemphigus), neurológiai eltérések, mint limbikus encephalopathia - Ophelia szindróma, vagy szubakut cerebelláris degeneráció jelentkezhet.
Ellátási folyamat leírása, ellátási algoritmus
I. (H) Lymphoma gyanúja (panasz és/v tünet és/v fizikális és/v képalkotói vizsgálati eltérés) 2. (szak)rendelés (anamnézis, fizikális vizsgálat, rutin labor és képalkotó diagnosztikai vizsgálatok) 3. A nyirokcsomó vagy az érintett szerv excisiója vagy core biopsziája - FNB/aspirációs cytologia nem elegendő. 4. Szövettani és immunhisztokémiai vizsgálat tapasztalt hematopatológusnál, a HL(ák) diagnózisa, 5. Hematológiai szakrendelés - stádium megállapítás, prognosztikai faktorok és társbetegségek felmérése kiegészítő képalkotó és labor diagnosztikai vizsgálatokkal. 6. Kezelési terv (alternatívák lehetőségei) - a beteg belegyezése 7. A beteg kezelése és a kezelés hatásosságának illetve a végén annak eredményének a lemérése 8. A HL-es beteg követése, gondozása.
II. Diagnosztikai eljárások
Elvégzendő (alapelv)
1. Anamnézis (I/A szint) A beteg első eltéréseinek és panaszainak kezdetét, jelentkezésének helyét, idejét, mértékét pontosan kell tisztázni, majd célzott kérdéseket kell feltenni a Hodgkin-lymphomában előfordulható tünetekre és panaszokra, mint láz/hőemelkedés, éjszakai izzadás, testtömeg csökkenés, bőrviszketés. Ki kell térni ezen túlmenően a szokványos belgyógyászati anamnézis minden lépésére, az alkohol-fogyasztásra és dohányzásra. Fokozott figyelmet kell fordítani a korábbi és jelenlegi társbetegségeire, általános állapotára, gyógyszerszedési szokásaira. A foglalkozási és környezeti anamnézis elengedhetetlen. A családi anamnézisben a halmozódó betegségek, onkológiai, hematológiai és immunológiai betegségek előfordulása fokozottan explorálandó.
2. Fizikális vizsgálat (I/A szint)
Megtekintés, bimanuális tapintás - nyirokcsomó régiók, hepatosplenomegalia, FOG vizsgálat.
3. Kötelező (minimálisan elvégzendő) diagnosztikai vizsgálatok és azok gyakorisága (felhasznált bizonyítékok, azok szintjei és forrásai)
3. 1. Laboratóriumi vizsgálatok
a) Szövettani mintavétel és vizsgálat (I/A)
A nyirokcsomó vagy egyéb szövet biopsziája (egyes esetekben core biopsziája) - aspirációs cytológiai vizsgálat nem elegendő - annak részletes szövettani (hisztomorfológiai, immunhisztokémiai, egyes esetekben genetikai) vizsgálata. Indokolt, hogy a szövettani feldolgozást hematopatológiában jártas szakember végezze, amennyiben erre nincsen mód konzultatív diagnózis szükséges. A WHO osztályozás a HL-eket patogenezisében, morfológiai megjelenésében, immunfenotípusában és klinikai viselkedésében két elkülönülő szubtípusra, a noduláris lymphocyta predomináns Hodgkin lymphomára (NLPHL) és a klasszikus Hodgkin lymphomára (cHL) osztja. Az NLPHL formára jellemző, hogy az érintett nyirokcsomó legalább részben noduláris jellegű (régi elnevezés: nodularis paragranuloma). Itt a daganatos sejtek a "popcorn" (pattogatott kukorica) vagy "L&H" (lymphocyta/histiocyta) néven ismertek, melyek B-sejt antigén, CD19, CD20, CD22, CD79a, bcl-6, J-lánc és CD45, EMA pozitívak, míg a cHL-ben a Reed-Sternberg, tükörkép, Hodgkin és lacunaris sejtek általában B-sejt antigén negatívak, viszont CD30 és/vagy CD15 pozitívak. A cHL-nek szövettani megjelenése alapján négy altípusa különíthető el. Mikrodisszekcióval izolált Sternberg-Reed sejtek Ig nehézlánc gén variábilis régiójának (VH) vizsgálata során igazolódott, hogy a cHL Sternberg-Reed sejtjeinek IgVH régiója nagyszámú szomatikus mutációt mutat. Ez azt jelenti, hogy Reed-Sternberg sejtek centrum germinativum (CG) eredetűek. A tumorsejtek további jellemzője, hogy az Ig gének nem funkcionálisak, azaz nem íródnak át, amely egyes vizsgálatok szerint az IgVH génekben észlelt stop-kodon vagy "in frame" mutáció eredményeként létrejövő "bénulással" (crippling mutation), mások szerint transzkripciós faktorok defektusával magyarázható. Fiziológiás körülmények között azok a B-sejtek, amelyek nem jelenítenek meg megfelelő affinitású Ig-t apoptotikus mechanizmussal elhalnak, ez a Reed-Sternberg sejteknél nem következik be, amely azzal magyarázható, hogy a transzformáló hatás megelőzi vagy egybeesik azzal a mutációval, amely a nem funkcionális Ig gén kialakulásához vezet. Az NLPHL esetek többségének L&H sejtjeiben az Ig gének intaktak és funkcionálnak, melyekben a szomatikus mutáció folyamatos (ongoing), amely azt jelenti, hogy a normális centrum germinatívum (CG) B-sejtjeihez hasonlóan a tumorsejtek antigén szelekciós hatás alatt állnak, és a L&H sejtek is CG eredetűek. A morfológiai és immunfenotípus különbséget a 2. táblázat mutatja be. Ajánlott immunhisztokémai panel a Hodgkin lymphomák diagnosztikájában CD3, CD15, CD20, CD21, CD30, EMA, CD45, CD57.
2. táblázat. A klasszikus (cHL) és nodularis lymphocyta predominans (NLPHL) Hodgkin-lymphoma morfológiai és immunfenotípus-jellemzői cHL NLPHL
Növekedési mintázat Diffúz, interfollicularis, nodularis (legalább részben) nodularis Tumorsejtek HRS, lacunaris L&H vagy "popcorn"
Sejtes háttér Lymphocyta, histiocyta, eosinophil, plazmasejt Lymphocyta, histiocyta
| Fibrosis | Gyakori (főleg NS) | Ritka |
| HRS-sejtek CD30 | + | - |
| CD15 | + | - |
| CD20 | -/+ (-25%) | + |
| CD45 | - | + |
| EMA | - | + |
| EBV | + (-50%) | - |
| Környezeti lymphocyták | T>B | B (poliklonális)>T |
| CD57+ T-sejtek | - | + |
| Ig-gének ("egy sejt" PCR) Átrendeződött, klonális, mutált Átrendeződő | ||
3. táblázat A Hodgkin-lymphoma szövettani altípus beosztására a WHO 4. kiadásának az útmutatása (2008) használandó, százalékosan az előfordulási gyakoriság van megadva.
1. Noduláris lymphocyta predomináns (NLPHL), 3-5%
2. Klasszikus (cHL)
- lymphocyta-gazdag (LRcHL), 3-5%
- nodularis sclerosis (NSHL), 40-80%
- kevert sejtes (MCHL), 20-50%
- lymphocyta szegény (LDHL), 1-2%
- nem osztályozható (NDHL), 3-5%
3. B-sejtes lymphoma, nem osztályozható, a klasszikus Hodgkin lymphoma és a diffúz nagy B-sejtes lymphoma jellemzői közötti átmenettel (ritka).
b) Vérkémiai vizsgálatok: We, mennyiségi és minőségi vérkép, szérum biokémia, HIV, Hepatitis serológia, B2-mikroglobulin, összfehérje, albumin, hemosztázis (II/A)
3.2. Képalkotó vizsgálatok
2 irányú mellkas rtg, hasi és kismedencei Uh, egésztest CT (nyaki, mellkasi, hasi, kismedencei) (I/A) vagy egésztest 18FDG-PET/CT vizsgálat ma már standardnak tekinthető (I/ A-B).
Csontvelő egyoldali crista iliaca biopszia (III-IV stádium, korai-kedvezőtlen prognózis, cytopenia) (I/A). Stádiummegállapító laparotomia nem ajánlott (II/A).
4. táblázat. A kezelési stratégia helyes megállapításához alapvető a Cotswolds-i klinikai stádiumbeosztás (KS) egységes alkalmazása (I/A), amelynek a lényege:
I. stádium: egyetlen kóros nyirokcsomó régió vagy nyirokszerv
II. stádium: a rekesz egyik oldalán 2 vagy több kóros nyirokcsomó régió (a mediastinum egy, a hilusok oldalanként külön régió. Az érintett régiókat a beosztás (arab)számszerűen is megadja.
III. stádium: érintett nyirokcsomó régiók a rekesz mindkét oldalán;
III/1. portális, lép-hilusi, coeliaka menti III/2. paraaorticus, mesenterium, iliaca, inguinalis
IV. stádium: disszeminált, extranodalis diffúz érintettség, mely nem közvetlen ráterjedésből ered
További osztályozás a szisztémás tünetek hiánya (A) vagy jelenléte (B) szerint: láz> 38C°, éjszakai izzadás, fogyás (6 hónap alatt legalább a testtömeg l0%-a). X jelzi a nagy tumortömeget (bulky disease). Ez a mediastinum esetében a mellkas felvételen mért harántátmérő harmadánál nagyobb méret, vagy nagyobb, mint 10 cm. Illetve bárhol, ha a nyirokcsomó konglomerátum átmérője nagyobb, mint 5 cm (nem egységes az állásfoglalás). Az E jelölés extranodalis szerv unifokális eltérése - ráterjedéssel - amely a kóros nyirokcsomó régióval szoros kapcsolatban van. KRu a kezelés utáni tisztázatlan komplett remisszió jelzésére volt korábban javasolt, azonban a PET/CT kiterjedt alkalmazása és a végleges kezelési válasz új kritériumrendszere ezt a meghatározást törölte.
5. táblázat. Prognosztikai tényezők (II-III/A evidencia szint)
Korai (I-II) stádium: - egy tényező jelenléte már kedvezőtlen prognózist jelent.
Kor> 50 év
Érintett régiók száma> 3 Bulky tumor jelenléte
We>50mm/h- A stádium, vagy >30mm/h-B stádium
Ez alapján korai kedvező (limitált) vagy korai nem kedvező (intermedier) stádium/csoport különíthető el.
Előrehaladott (III-IV) stádium: számszerűen megadva 0-7 között, minden tényező 1 pontot jelent. Legjobb a 0, legkedvezőtlenebb a 7.
Kor> 45 év
Férfi nem
IV. stádium
Albumin< 40g/l
Hemoglobin< 105 g/l
Fehérvérsejt> 15G/l
Lymphocyta< 0,6G/l vagy 8%
Továbbá tisztázni kell a beteg általános állapotát (ECOG), egyéb kísérő betegségeit és kezelési együttműködését.
3.3. Egyéb vizsgálatok, opcionális
Gerinc MRI - idegrendszeri és epiduralis megjelenés, csonteltérés Endoscopos vizsgálatok, endoscopos UH
EKG, echocardiographia (anthracyclin terápia előtt), tüdő funkcionális vizsgálata
Férfiaknál uroandrológiai vizsgálat és spermium cryopreserváció javasolt.
3.4. Kiegészítő diagnosztikai vizsgálatok, differenciál diagnosztika
A HL-t klinikailag számos lokális/regionális vagy generalizált nyirokcsomó megnagyobbodással járó betegségtől kell elkülöníteni, mint mononucleosis infectiosa szindróma, toxoplasmózis, macskakarmolásos betegség, autoimmun betegséghez vagy gyógyszerszedéshez társuló lymphadenopathia, sarcoidosis és tuberkulózisos lymphadenomegalia. A malignus betegségek közül a solid tumorok nyirokcsomó metastasisai mellett a nem-Hodgkin lymphomák egyes típusai (diffúz nagy B-sejtes lymphoma primer mediastinalis B-sejtes és Tsejt/histiocyta gazdag B-sejtes formája) komoly patohisztológiai differenciáldiagnosztikai nehézséget is jelentenek. Kiegészítő szerológiai, autoantitest, immunhisztokémiai vizsgálatok szükségesek.
3.5. Diagnosztikai algoritmusok
3.5.1. Diagnosztikai algoritmus a kivizsgálás során
1. (H) Lymphoma gyanúja (panasz és/v tünet és/v fizikális és/v képalkotói és/v laboratóriumi vizsgálati eltérés)
2. (szak)rendelés (anamnézis, fizikalis vizsgálat, rutin labor és képalkotó diagnosztika - UH, rtg, esetleg CT), F.O.G és/vagy altatás előtti konzíliumok.
3. A nyirokcsomó vagy az érintett szerv excisiója vagy core biopsziája - FNB / aspirációs cytologia nem elegendő.
4. Szövettani és immunhisztokémiai vizsgálat hematopatológusnál, a HL(ek) dg-a.
5. Stádium megállapítás, prognosztikai faktorok és társbetegségek felmérése kiegészítő képalkotó (lehetőség szerint egésztest 18FDG PET/CT) és labor diagnosztikai, csontvelő és egyéb (EKG, echocardiographia, tüdő funkcionális) vizsgálatokkal.
6. Kezelési terv (alternatívák?) - a beteg belegyezése.
3. 5. 2. Diagnosztikai algoritmus a betegkövetés során
7. A beteg kezelése és a kezelés hatásosságának 2. ciklus kemoterápia (KT) után (interim vizsgálat), illetve a végén (restaging vizsgálat) annak eredményének a lemérésére - egésztest 18 FDG PET/CT a Cheson kritériumoknak megfelelően. Restaging vizsgálat során minden olyan vizsgálat ismétlése szükséges, amely pozitív volt a stádium megállapításnál.
Használandó fogalmak: Interim PET/CT során: 1. Negatív - komplett metabolikus remisszió (KMR), 2. Minimális reziduális uptake (MRU). 3. Pozitív (kevert válasz, stabil betegség, progrediált).
Restaging vizsgálat során: 1. Negatív - Komplett metabolikus remisszió (KMR), 2. részleges remisszió (PR), 3. nem reagált/stabil betegség (NR v. SD) és 4. romlott/progrediált (PROG) definíció szerint értékeljük (Cheson ajánlás szerint).
Bizonytalan komplett remisszió (KRu) kifejezést a 18FDG PET/CT rutinszerű restaging alkalmazását követően ma már nem használjuk.
6. táblázat. A végleges terápiás válasz új kritériumrendszere lymphomákban (az ún. Cheson kritériumok)
| Válasz | Definíció | Nodalis érintettség | Lép, máj érintettség | Csontvelő |
| Komplett remisszió | Tumor és klinikai tünetek nincsenek | a) FDG-avid lymphoma: bármely tömegű PET neg. szövet szaporulat b) FDG-aviditás bizonytalan: csak normál méretű lgl. a CT-n | Nincs hepatosplenomegalia | Nincs lymphomás infiltráció |
| Részleges remisszió | Min. 50%-os csökk. a 6 legnagyobb lgl méretében, nincs új lézió | a) FDG-avid lymphoma: csak a korábban PET pozitív léziók pozitívak b) FDG aviditás bizonytalan: CT-vel regresszió látható | Min 50%-os csökkenés a tumor tömegben, ha volt érintettség | Nem releváns, amennyiben korábban is pozitív volt |
| Stabil betegség | Sem a CR, sem a PR, PD kritériumai nem teljesülnek | a) FDG-avid: csak a korábbi léziók PET pozitívak, nincs új lézió b) FDG aviditás bizonytalan: a CT-vel detektálható léziók mérte változatlan | ||
| Relapszus, progresszív betegség | Új lézió megjelenése, vagy a régiek min. 50%-os növekedése | 1.5 cm-nél nagyobb új lézió, vagy a korábban 1 cm-nél nagyobb lézió min. 50%-os növekedése | >50%-os növekedése a korábbi lézióknak | Új vagy visszatérő érintettség |
III. Kezelés
Alapelvek
Csaknem minden esetben kuratív célzatú. Alapelv, hogy a Hodgkin-lymphoma kezelésében a műtéti eltávolítás - a biopszia kivételével - általában nem jön szóba, mivel rendszerbetegségről van szó. Bár az immunterápia lehetőségei adottak, egyelőre kezelésének két alappillére ma a polikemoterápia (konvencionális, közép-, és nagydózisú) önmagában és/vagy (ma már ritkán) a radioterápia, ezen belül is az utóbbi időben előtérbe került a polikemoterápia. A kezelési stratégia kiválasztása függ a szövettani altípustól, a betegség kiterjedtségétől (stádiumától), a prognosztikai faktoroktól, a beteg korától, általános állapotától és társbetegségektől.
III.1. Sebészeti jellegű ellátás
Nyirokcsomó vagy az érintett szerv excisioja esetleg core biopsziája. Fenyegető paraplegia epiduralis manifesztáció esetén -főleg amennyiben a szövettani diagnózis még nem ismert laminectomia. Staging laparotomia nem végzendő, de bizonyos esetekben diagnosztikus laparotomia és nyirokcsomó eltávolítás hisztológiai vizsgálatokra indokolt. Hasonló indokból (mini)thoracotomia is szükségessé válhat. A műtéti előkészítés, érzéstelenítés, maga a műtét, a posztoperatív és perioperatív teendők nem különböznek más hasonló műtéti, de más indikációban végzett beavatkozásokról. Az általános műtéti irányelvek adhatók meg, de minden eset egyénileg mérlegelendő.
III.2. Gyógyszeres kezelés
Alaplev (I/A), hogy ma előtérbe került a polikemoterápia (KT) és másodlagossá vált a radioterápia (RT), a nagymezős RT (mantle, fordított Y, TNI) csaknem teljesen kiszorult a primer gyakorlatból, az elsődleges kezelésben alternatívaként maradt meg. Elsődleges standard terápiás választási javaslat Hodgkin-lymphomában a szövettani csoportok stádium és a prognosztikai tényezők alapján (alapelv) választható, definitív kezelési csoportok:
I - A szövettan alapján:
1. Noduláris lymphocyta predomináns (NLPHL),
2. Klasszikus Hodgkin lymphoma (kHL),
3. Ritka átmeneti forma a cHL és DLBCL között.
II - Stádium és a prognosztikai faktorok alapján:
1. Kedvező korai stádium,
2. Kedvezőtlen korai stádium,
3. Előrehaladott stádium (standard és 4. kedvezőtlen (IPS>4) prognózisú)
III - Kortól, társbetegségektől, speciális és általános állapotoktól függő helyzetek:
1. Gyermekkori (gyermek hematológiai részben részletezve)
2. Időskori HL,
3. Terhesek HL-ja,
4. Azon HL-es betegek, akiknél a súlyos társbetegség határozza meg az élettartamot. 5. Azok a HL-esek, akik a KT-vel nem kezelhetőek, (a társbetegségei miatt, vagy a beteg nem egyezik bele)
2.1. A gyógyszeres terápia részletes algoritmusai - Ellátási szintek, hematológiai centrum, decentrum, de refrakter és relabáló esetekben a decentrumoknak a centrumokkal konzultáció javasolt.
2.2. Ajánlott gyógyszeres kezelés (felhasznált bizonyítékok és azok szintjei)
Szövettani csoportok, stádium, prognosztikai faktorok szerinti ajánlások és alternatívák:
1. ábra. Klasszikus HL klinikai I/A és II/A kedvező stádiumok kezelési ajánlása (I/A evidencia) - 2-4 ciklus ABVD + IFRT
(a protokoll leírását lásd a "Függelékben")
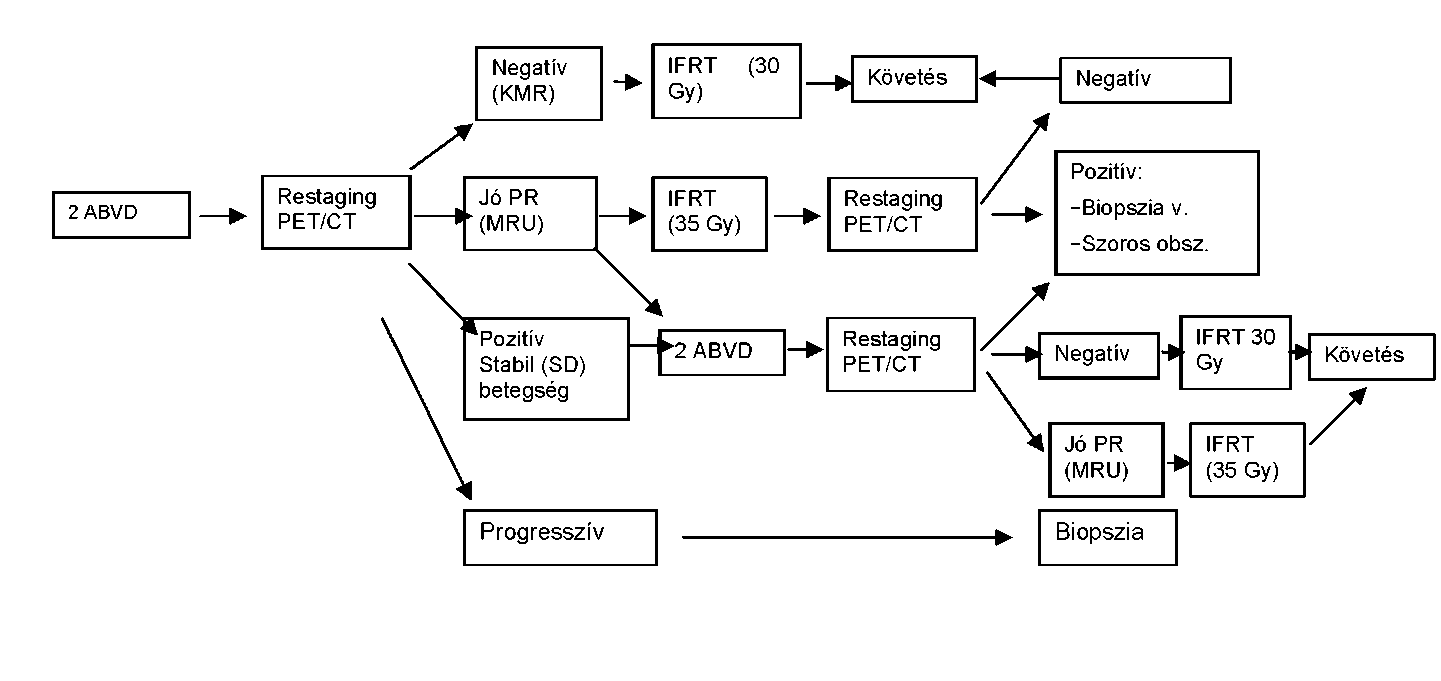
2. ábra. Klasszikus HL klinikai I/A és II/A kedvező stádiumok kezelési ajánlása (II/B evidencia) - 4-6 ciklus ABVD önmagában
(a protokoll leírását lásd a "Függelékben",)
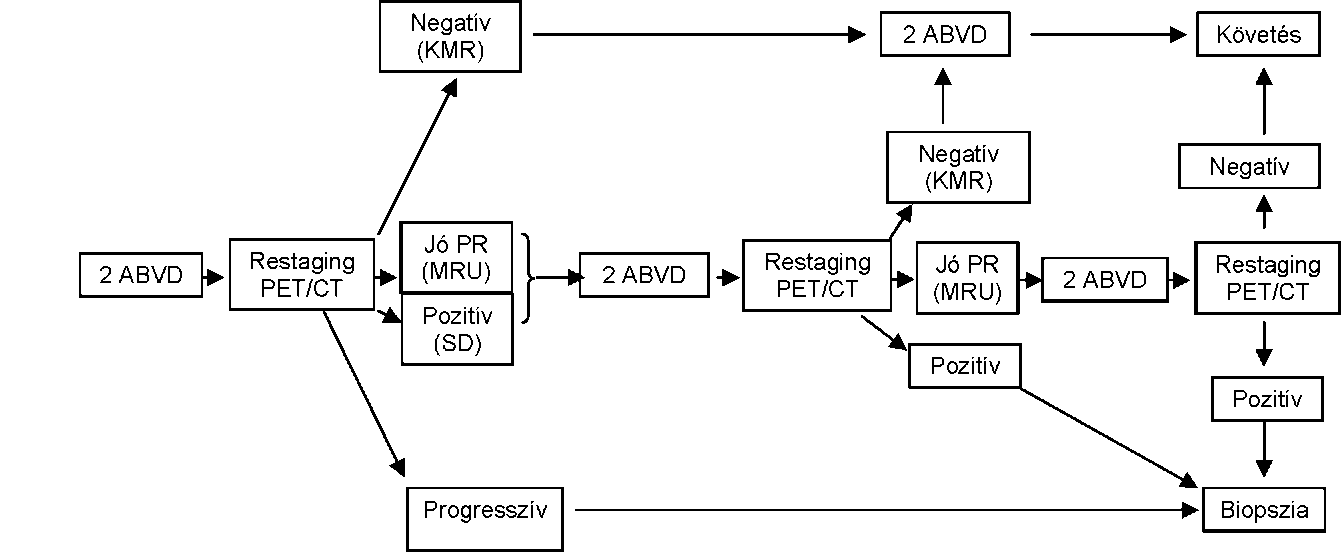
3. ábra. Klasszikus HL klinikai I-II st. kedvezőtlen (bulky) kezelési ajánlása (I/A evidencia) 4- 6 ciklus ABVD+IF RT
(a protokoll leírását lásd a "Függelékben")
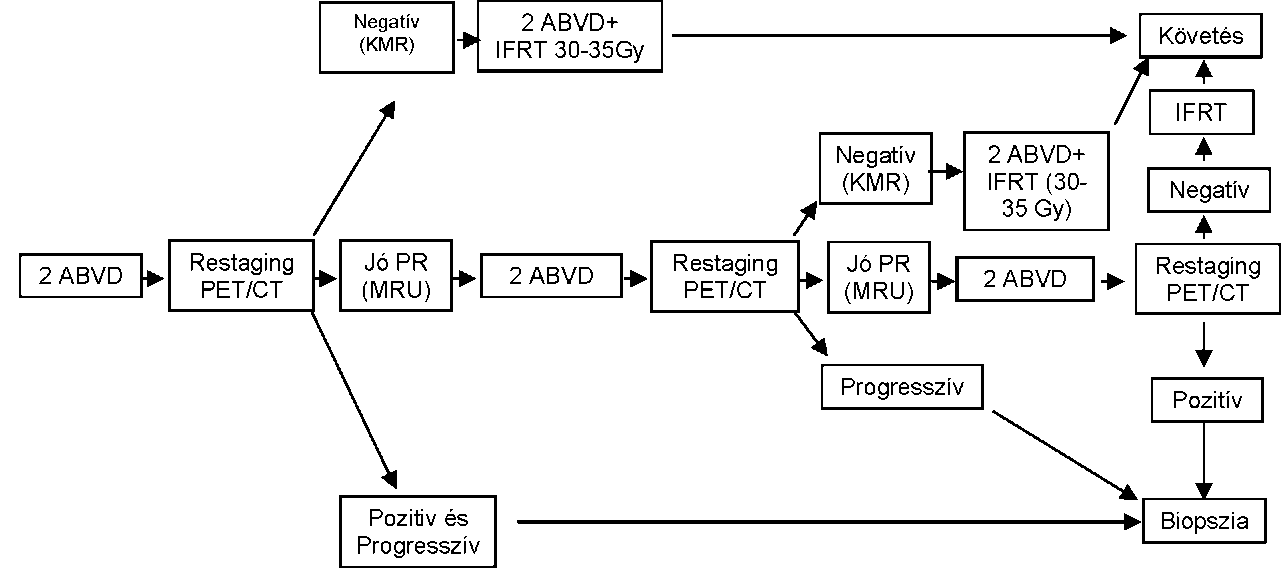
4. ábra. Klasszikus HL klinikai III-IV st. kezelési ajánlása (I/A evidencia) - 6 ciklus ABVD±IF RT
(a protokoll leírását lásd a "Függelékben",)
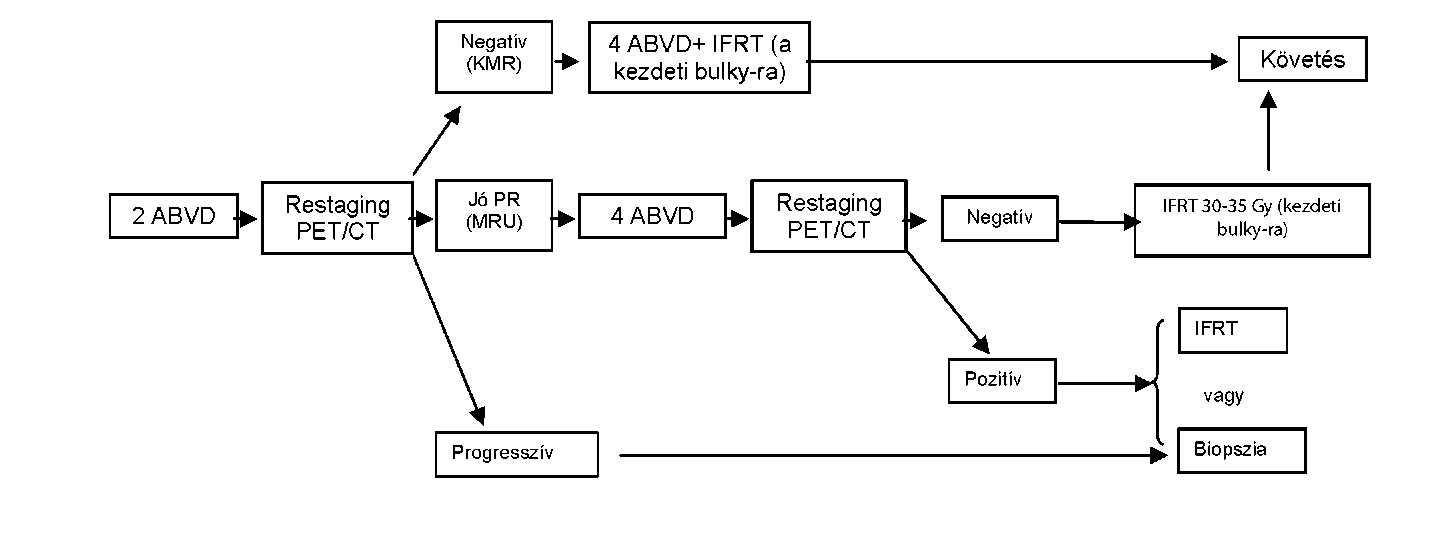
5. ábra. Klasszikus HL klinikai III-IV st. válogatott (rossz prognózisú) esetek ( IPS > 4, kor < 60 év) kezelési ajánlása BEACOPP (eszkalált) + ABVD + IFRT a kiindulási régiókra > 5cm (II/A evidencia).
(a protokoll leírását lásd a "Függelékben")
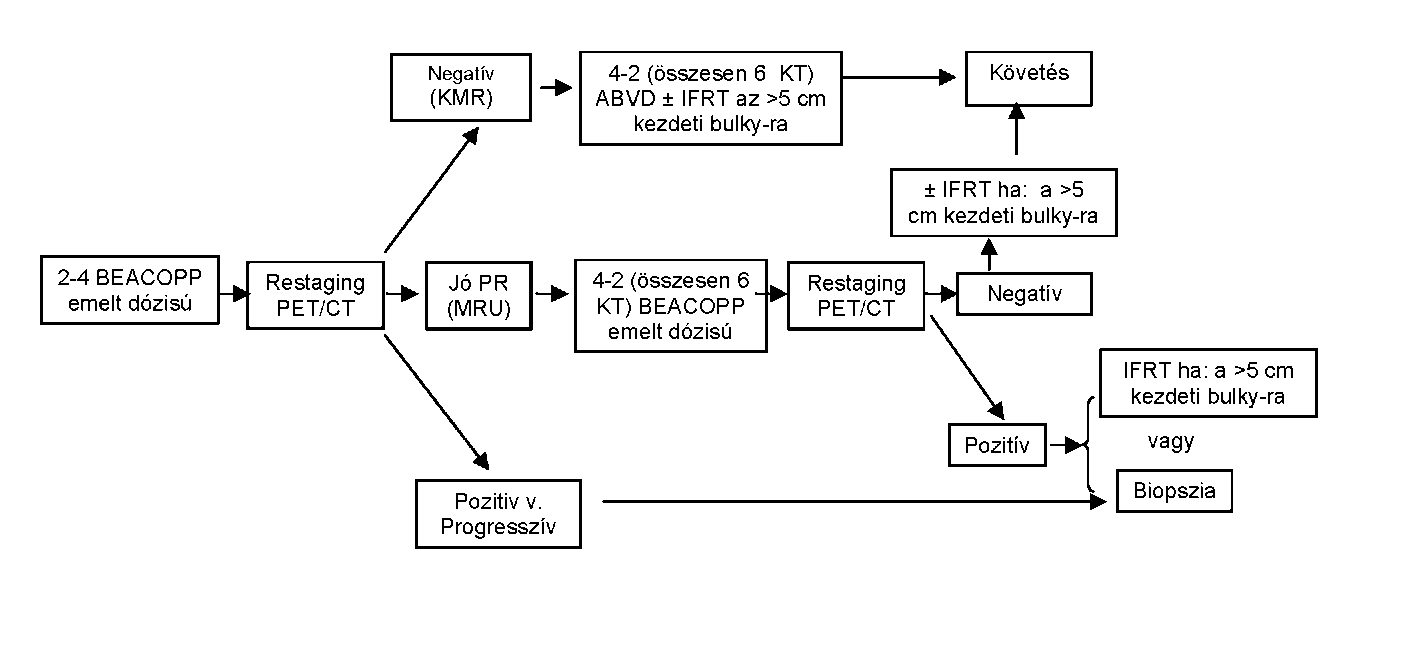
6. ábra. Nodularis lymphocyta predomináns HL kezelési ajánlása (II/A evidencia)
(a protokoll leírását lásd a "Függelékben")
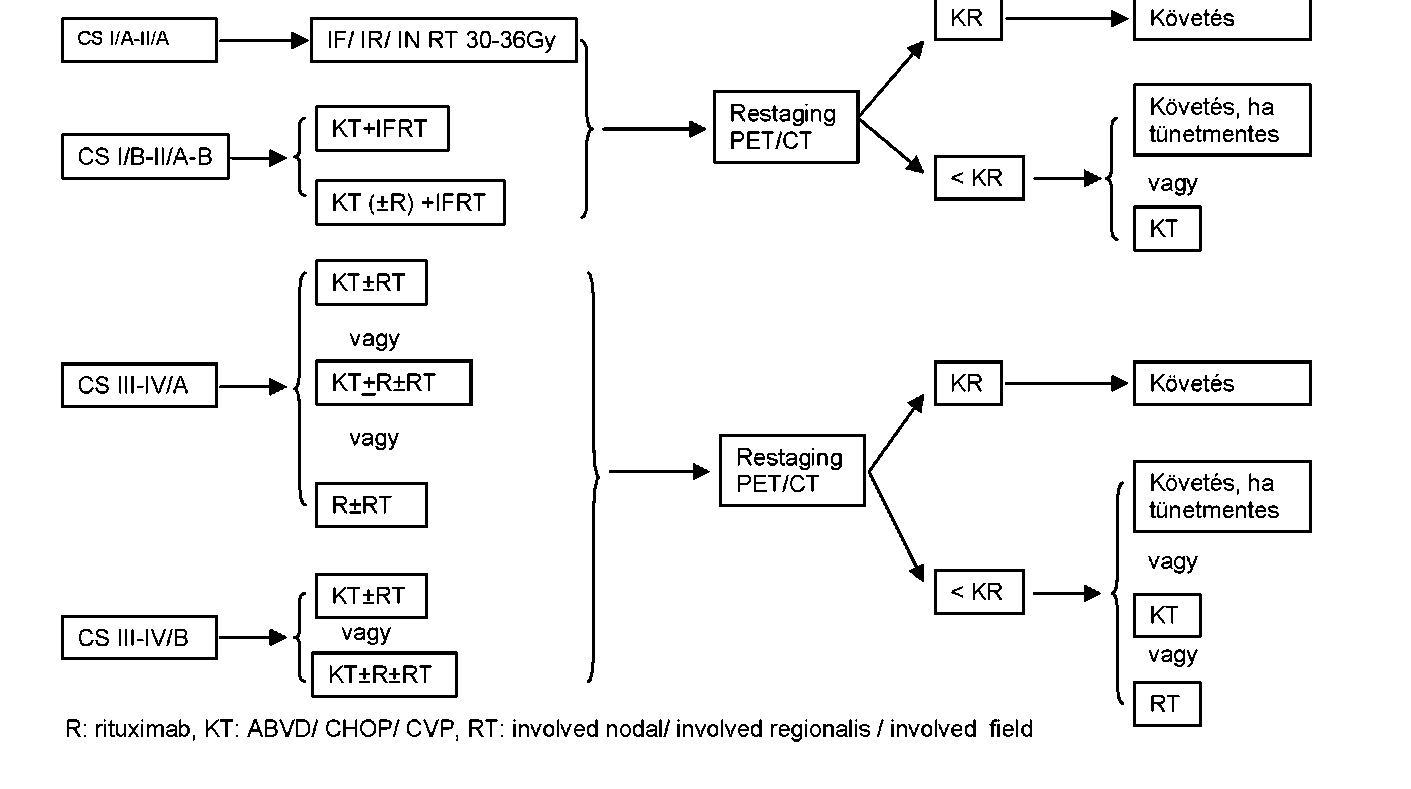
1. Nodularis lymphocyta predomináns (NLPHL) I/A stádium - kedvező prognózis
Érintett mezős (IF), érintett regionális (IR), az érintett nyirokcsomó (IN) - radioterápiája (RT) 35Gy dózisban (teljes excisio esetén 30Gy), egyéb NLPHL eset kezelése a klasszikus csoport kezeléséhez hasonló (I/A evidencia), Rituximab beépítése a kezelési protokollba off label (II/A evidencia).
2. Klasszikus és NLPHL (kivéve I/A st.- kedvező progn.) Antraciklin tolerálás esetén
A)Korai stádium-kedvező progn. - 2-4 ciklus ABVD (lásd "Függelék", ... oldal)+ IF-RT (30-35 Gy)
B)Korai stádium -kedvezőtlen prog. - 4-6 ciklus ABVD+IF-RT (30-35Gy)
C)Előrehaladott stádium-6-8 ciklus ABVD sze.e IF-RT 30Gy
D)Előrehaladott stádium és IPS>4 (II/A szint) Emelt dózisú BEACOPP 2-4 ciklus ezt követően a reagálástól függően még 2-4 ciklus emelt dózisú BEACOPP, vagy 2-4 ciklus ABVD (összesen 6 ciklus KT) és IFRT > 5cm kiindulási régiókra 35 Gy.
A sugárdózis további csökkentése KT utáni KR-ben szintén vizsgálat tárgyát képezi.
D) Bulky disease - minden esetben KT és RT (érintett mezős-IF) is ún. combined modality treatment (CMT) (I/A)
3. Átmeneti forma a klasszikus nodular sclerosis altipusú Hodgkin lymphoma és a primer mediastinális B-sejtes lymphoma között (BNO C83).
Rituximab (itt on label) és KT+IF RT (tekintettel a csaknem mindig jelen levő mediastinális bulky-ra), mely leginkább CHOP 14 v. 21 lehet (DA EPOCH KT opcionálisan), tekintettel az agresszívabb viselkedésre 2 ciklusonként interim PET/CT vizsgálat javasolt. Nem megfelelő reagálás esetés R-DHAP, vagy R-ICE salvage és ezt követően HDT és AHSCT javasolt. (a protokollok leírását lásd a "Függelékben",)
Idős (65 év feletti) betegek kezelése, a biológiai kor és társbetegségek figyelembe vétele alapján lehet palliatív vagy kuratív Kuratív: Korai stádium, kedvező progn:
a) csak IF-RT
b) 2-4 A(E)BVD+IF-RT
c) 4 CO(V)PP+IF-RT
Korai stádium, kedvezőtlen progn, előrehaladott stádium:
a) 4-6 EBVD+IF-RT
b) 6 CO(V)PP+IF-RT
(a protokoll leírását lásd a "Függelékben")
Terhesek Hodgkin lymphomájának kezelése
A: Első trimeszter Korai stádium:
1. várakozás és szoros megfigyelés
2. IF/IN-RT a nyaki v. axillaris megbetegedés esetén hasi védelemmel
3. vinblastin monoterápia
Várakozás, monoterápia, RT után a 2. és 3. trimeszterben sze. ABVD kezelés adható Előrehaladott stádium: Javasolt a terhesség befejezése, majd ABVD + RT kezelés. B: Második és harmadik trimeszter Korai stádium: várakozás, kezelés a szülést követően
ABVD kezelés egyéb esetekben, a szülést a nem cytopeniás időszakra kell időzíteni (a protokoll leírását lásd a "Függelékben")
Palliatív kezelési lehetőségek, súlyos - élettartamot meghatározó más alapbetegség esetén kezelési lehetőség:
1. Steroid, iv. vagy p. os
2. Radioterápia, EF RT; -30-35 Gy (mantle, fordított Y, (s)TNI)
3. Redukált dózisú KT (CVPP, CHOP, ABVD), csökkentett számú citosztatikumot tartalmazó: CVP, AVD, ABV, VBM (a protokoll leírását lásd a "Függelékben")
Azok a HL-sek, akik a KT-vel nem kezelhetőek, (a társbetegségei miatt, vagy a beteg nem egyezik bele) - Radioterápia
Korai stádium I/A - kedvező vagy igen kedvező IF-RT vagy EF-RT (mantle vagy fordított Y) Korai minden más eset: EF-RT (mantle, mantle+paraaortikus, fordított Y) Előrehaladott: EF-RT, (s)TNI)
III.3. Radioterápia
A HL-es beteg irradiációja során a sugárminőséget a testtájnak, illetve az ellátandó céltérfogatnak megfelelően kell megválasztani. A felszín közelében levő nyirokcsomó csoportok esetén maximalisan 6 MV nominalis fotonenergiát szabad alkalmazni (ennél nagyobb energia választásakor a bőr közelében levő nyirokcsomók aluldozírozottá válnak). További elvárás, hogy lehetőleg lineáris gyorsítóval történjék a kezelés, de felszín közeli maradék tumorok besugárzására a telekobalt-készülék vagy a gyors elektronok is alkalmasak lehetnek. Az egyszeri dózist célszerű 1,8 vagy 2,0 Gy-ben megszabni. Az összdózis a KT befejezését követően észlelt remisszió fokától függ: KR esetén 30 Gy reziduális tumor esetén 35 Gy. Nyomatékosan hangsúlyozzuk, hogy az alacsonyabb dózisértékek különösen megkívánják, hogy a sugárterápia technikai kivitelezése hibátlan legyen, szigorú minőségi kontroll szükséges. Az RT és a KT között ajánlatos 2-4 hét szünetet tartani, kisebb céltérfogat esetén rövidebb szünet is elegendő. Négy hetes várakozás szükséges, ha a maradandó sugárkárosodás szempontjából különösen kritikus szerv nagyobb térfogatának (pl. tüdő, szív, gerincvelő) besugárzása elkerülhetetlen. Kerülni kell a RT és a KT együttes alkalmazását, mert a mellékhatások szuperadditív módon összegeződhetnek, különösen a fentebb megnevezett, kritikus, későn reagáló szervek esetében. Az RT-t a KT-és program végére kell időzíteni. KT-és kezelések előtt a még gyermek után vágyó férfiak spermium cryoprezervációja javasolt. Fogamzóképes korú nőknél fogamzásgátlás szükséges.
III.4. Ismételt kezelések Hodgkin-lymphomában (I/A)
Az elsődleges kezelésre nem megfelelően reagáló betegeknél a terápiás módosítás függ a kezelési választól (nem került komplett remisszióba, vagy nem reagált, vagy progrediált, azaz terápia rezisztens (de definíciószerűen az első kezelés befejezését követően
6 hónapon belül visszaeső betegeket is ide tartoznak), az elsődleges kezelés formájától, a beteg általános állapotától. Függ a várható eredményességtől és kockázattól vagy, hogy kuratív vagy palliatív célzattal akarjuk alkalmazni.
Elsődleges kezelésre komplett remisszóba került de újra visszaeső betegek másodlagos kezelése függ a relapszus idejétől (a KR ideje: minél hosszabb annál jobb lehet a prognózis), formájától (lokalizált- disszeminált), az előző kezelés formájától és annak eredményétől. Relapszus esetén a korábban ajánlott kivizsgálási stratégia érvényes, azzal, hogy egy éven túli relapszus esetén újabb nyirokcsomó biopszia is indokolt.
1. Csak RT után a KT ugyanolyan jó eredménnyel alkalmazható, mint az elsődleges kezelésnél.
2. KT után lokális relapszus esetén RT mérlegelhető, de ritkán elegendő.
3. KT utáni egy éven túli relapszus esetén a reindukció megpróbálható az elsődlegesen alkalmazott KT-vel, de újabb nem keresztrezisztens KT is alkalmazható.
4. Az elsődleges KT-és kezelésre nem megfelelően reagáló, ún. stabil, a progrediáló azaz, ún. elsődleges KT-ra kemorezisztens vagy 3 éven belül visszaeső betegeket, vagy akiknél ismételt kemoszenzitív relapszusokat észlelünk a KR után akár 3 éven túl is középdózisú, ún. előkészítő/salvage kezelésben kell részesíteni, melyre a DHAP, ICE, IGEV KT-ás kezelések javasoltak (lásd a "Függelék"-ben). Amennyiben a beteg reagál, és kemoszenzitív - a Magyarországi lehetőségeket figyelembe véve - és a klinikai feltételek megfelelőek a beteget nagydózisú polikemoterápiára és autológ hemopoetikus őssejt trasnzplantációra kell javasolni és előkészíteni, mert az eredményei jobbak, mint a szokásos dózisú kezelésnek (7. táblázat).
7. táblázat. Gyógyulás esélye HL-ben szokásos dózisú (cKT) és nagydózisú kezelés esetén (HDT)
| Időpont | cKT | HDT+AHSCT |
| Első kezelésre nem kerül KR-be | 10% | 20-30% |
| Első relapszus (KR<1 év) | 10-20% | 30-50% |
| Első relapszus (KR>1 év) | 20-40% | 40-80% |
| Ismételt relapszusok | 0-5% | 10-30% |
5. Noduláris lymphocyta predomináns esetekben ismételt IF/IN/IR radioterápia végezhető lokalis/limitált relapszusok esetén. Szisztémás opcionális, de off label kezelési lehetőség a Rituximab
6. Amennyiben a nagydózisú kezelés klinikai feltételei nem adottak, más nem keresztrezisztens KT is választható
Másodlagos KT-ás választási lehetőség
a) ABVD után - DHAP, ICE, IGEV, BEACOPP, CO(V)PP
b) CO(V)PP után - ABVD, BEACOPP, DHAP, ICE, IGEV
(a protokollok leírását lásd a "Függelék"-ben, ... lapon)
7. Harmadlagos vagy későbbi KT-ék, valamint nagydózisú kezelés és AHSCT utáni terápia csak számos szempont figyelembe vételével individuálisan határozhatók meg. A korábban felsorolt kombinációkon kívül még szóba jövő kemoterápiák mini-BEAM, VIM (lásd a "Függelék"-ben. Az allogén transzplantáció mortalitása igen nagy 30-50%, ezért ha erre kényszerülünk redukált intenzitású kondicionálás (RIC) alkalmazandó, melynek a mortalitása kisebb.
III.5. Várható mellékhatások, szövődmények, megelőzésükre illetve kezelésükre alkalmazott gyógyszerek.
1. Citosztatikumok, irradiácó okozta hányinger, hányás megelőzésére-kezelésére antiemetikumok adandók iv. vagy p.os. (lásd megfelelő fejezet)
2. Tumoros fájdalom esetén analgetikumok
3. Minden antitumor kezelés során a sejtszétesés miatt húgysav-képződést gátló készítmények adandók (pl. allopurinol).
4. Steroid adása esetén proton pumpa gátló vagy H2-receptor antagonista és/vagy antacidum, kálium-pótlás szükséges.
5. Csontérintettség esetén bisphosphonát javasolt.
6. A kezelés következtében kialakult myelotoxicitás esetén, az anaemia miatt vvt. suspenzió (választott, sze. szűrt, irradiált), thrombocytopenia miatt thrombocyta (koncentrátum vagy feretizátum) adására van szükség. Lázas neutropenia kivédésére profilaktikusan illetve jelentkezése esetén intervenciós módon myeloid colonia stiumáló faktor és megfelelő antimikróbás kezelés indokolt.
7. Trombózis profilaxisra LMWH javasolt.
8. A KT következtében kialakult súlyos alopecia esetén paróka rendelendő.
9. Néhány ritka esetben sürgősségi ellátást igénylő egyéb eltérés is előfordulhat, mint vena cava superior szindróma, tumor lysis szindróma, DIC, ITP, AIHA.
10. Egyes citosztatikumok nephrotoxicitása miatt fokozott rehidráció szükséges.
11. Ezen túlmenően a vinca alkaloidák neuropathiát, az antraciklinek cardiomyopathiát, a bleomycin tüdőfibrózist és bőrpigmentációt, egyes citosztatikumok sterilitást okoznak. Az alkiláló típusú citosztatikumok alkalmazása után évekkel később második malignus hematológiai betegség, mint NHL, MDS, AML jelentkezhet.
12. Az irradiációnak megfelelően korai mellékhatásként radiodermatitis jelentkezhet, a besugárzási mezőnek megfelelően évek-évtizedek múlva gyakrabban jelentkezik második solid tumor, hypothyreosis, valvulopathia, pulmonális fibrózis, a korai coronariosclerosis kockázata nagyobb.
IV. Rehabilitáció
A kezelés alatt javasolt ellenőrző vizsgálatok (I/A)
Minden kezelés előtt ellenőrizendő a beteg általános állapota, teljes vérkép, fontosabb szérum biokémiai paraméterek. Javasolt az első KT-és kezelés után 7-10 nappal vérkép ellenőrzés, hogy átmeneti cytopenia észlelhető-e. Amennyiben nem jelentkezett, úgy a kezelési dózis 10-30%-os emelése javasolt. A kezelések előtti kisebb sejtszámok esetén a dózisredukciót és/vagy a kezelés halasztását kerüljük, mert a dózisintezitás csökkenése a kezelési és gyógyulási eredményeket jelentősen ronthatja, ilyenkor G-CSF adása szükséges.
A második KT-és kezelés után kezelés közbeni állapotfelmérés (fizikális vizsgálat, a kezelés előtti kóros laboratóriumi vizsgálatok illetve képalkotó vizsgálatok ismétlése - interim PET/CT) javasolt a kezelés hatásosságának mérésére illetve további kezelés megtervezéséhez.
Speciális rehabilitációs szempontok nincsenek. A beteg a kezelés alatt dolgozhat, korábbi életmódját hasonlóan vagy minimális változtatásokkal folytathatja.
V. A HL-es beteg követése, gondozása és ellenőrzése.
Várható prognózis
A kezelés befejezését követően egy hónappal a kezelés hatásának lemérésére ismételni kell minden olyan vizsgálatot, amelyen a kezelés kezdetekor eltérés volt. Kitüntetett szerepe van a 18FDG PET/CT vizsgálatnak, restaging PET/CT a kezelés befejezését követően 6-8 hét múlva javasolt. A kezelés hatásának megítélése a Cheson kritériumok szerint történik. A kezelés után komplett remisszióba került betegeket a relapszus veszélye miatt a kezelés befejezése utáni első évben 1-2 havonta, a 2-3. évben háromhavonta, majd ezt követő években élete végéig fél-egy évente indokolt ellenőrizni. Az első évben 2-3 havonta, a 2-3. évben 6 havonta, ezt követően évente mellkas rtg és hasi/és vagy nyaki UH vizsgálat is javasolt a mindenkori fizikális és labor vizsgálat mellett. PR esetén amennyiben további kezelés nem történik az első évben havonta a 2. évben 2 havonta történjen ellenőrzés. 18FDG PET/CT végzése csak a progresszió vagy relapszus gyanúja esetén indokolt. A későbbi évek folyamán az ellenőrzésnek az antitumor kezelés késői szövődményeire is ki kell terjednie. A nyaki régiók RT-ja után évente javasolt pajzsmirigy hormon vizsgálat, mellkasi-mediastinális irradiáció után évente EKG, ergometria, echocardiographia, légzésfunkció, 40 év alatti nőknél emlő Uh, 40 felett mammographia szükséges.
Prognózis
Összességében jó - de tovább kell javítani a tumorellenes kezelésünket és megelőzni a késői kezelési szövődményeket! Jelenleg a 10 éves betegségmentes túlélés, azaz a gyógyulás korai stádiumban 90%, előrehaladott stádiumban 70-75%. Rossz a prognózisa primeren kemorezisztens, nem reagáló betegeknek, és HDT+AHSCT után ismét visszaeső eseteknek (80%-uk 1 éven belül meghal).
Az ellátás megfelelőségének indikátorai
Mivel nem megelőzhető betegségről van szó a primer prevencióval kapcsolatos indikátorok nem jönnek szóba. Szűrés ebben a betegségben nem költség-hatékony. Használható mutatók:
1. Az első tünet és/vagy panasztól a Hodgkin lymphoma felismeréséig eltelt idő.
2. Az adott évben felfedezett (regisztrált) új betegek (incidencia) és az ellátottak aránya. 3. Kemoterápiával és/vagy sugárterápiával esetleg immunterápiával gyógykezelt betegek számának modalitások szerinti aránya.
4. Az egyes terápiás modalitásokon belül alkalmazott eljárások evidencia szintek szerinti megoszlása. 5. A stádium és prognosztikai tényezők alapján a javasolt terápiás algoritmusok alkalmazásával kezelt betegek számának aránya.
6. A transzlációs klinikai kutatások körébe tartozó legújabb eljárások alkalmazásának aránya. 7. A kezelés sikerességének mutatói, mint kezelésre válaszolók aránya, betegségmentes túlélés, és teljes túlélés. Alapbetegségből eredő, valamint a kezelés szövődményei miatt jelentkező mortalitás.
8. A secunder és tercier megelőzés céljából követett (gondozott) betegek számának aránya. 9. Az adott év daganatos mortalitásának és morbiditásának (incidencia, prevalencia) aránya. 10. Az adott évben elhalálozott daganatos betegek átlagos túlélési ideje a diagnózis felállítása és a halál bekövetkezése között.
VI. Irodalomjegyzék
1. Bartlett NL: Modern treatment of Hodgkin lymphoma. Curr Opin Hematol 2008; 15: 408-414.
2. Cheson BD, Pfistner B, Juweid ME et al: Revised response criteria for malignant lymphoma. J Clin Oncol 2007; 25: 579-586.
3. Connors JM: State-of-the-art therapeutics: Hodgkin's lymphoma. J Clin Oncol 2005; 23: 6400-6408.
4. Diehl V, Thomas RK, Re D: Hodgkin's lymphoma - diagnosis and treatment. Lancet Oncol, 2004; 5; 19-26.
5. Eberele FC, Mani H, Jaffe ES: Histopathology of Hodgkin's lymphoma. Cancer J 2009; 15: 129-137.
6. Engert A, Eichenauer A, Dreyling M: Hodgkin's lymphoma: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009; 20 (suppl. 4); 108-109.
7. Gallamini A, Hutchings M, Rigacci L, et al: Early interim 2-(18F)fluoro-2-deoxy-D-glucose positron emission tomography is prognostically superior to International Prognostic Score in advanced-stage Hodgkin's lymphoma: A report from a joint Italian-Danish study. J Clion Oncol 2007; 25: 3746-3752.
8. Hasenclever D, Diehl V: A prognostic score for advanced Hodgkin's disease. N Eng J Med 1998; 339: 1506-1514.
9. Illés Á, Udvardy M, Ésik O, Molnár Zs: Felnőttkori Hodgkin-lymphoma (HL). In: Hematológiai betegségek kezelése. Szerk: Lehocky D, Documed, 2006, pp 135-142.
10. Lister TA, Crowther D, Sutcliffe SB, et al: Report of a committee to convened discuss the evaluation and staging of patients with Hodgkin's disease: Cotswolds meeting. J Clin Oncol 1989; 7: 1630-1636.
11. NCCN Clinical Practice Guidelines in Oncology: Hodgkin Lymphoma (version V.1.2010).
12. Ng AK, Li S, Neuberg D, Silver B, Weeks J Mauch P: Factors influencing treatment recommendations in early-stage Hodgkin's disease: a survey of phisicans. An Oncol, 2004; 15: 261-269.
13. Straus DJ., Gaynor JJ, Myers J et al: Prognostic factors among 185 adults with newly diagnosed advanced Hodgkin's disease treated with alternating potentially noncross-resistant chemotherapy and intermediate-dose radiation therapy. J Clin Oncol 1990; 8: 1173-1186.
14. Swerdlow SH, Campo E, Harris Nl, et al: WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon, France: International Agency for Research on Cancer, 28.
15. Tubiana M, Henry-Amar M, Carde P et al: Toward comprehensive management tailored to prognostic factors of patients with clinical stage I and II in Hodgkin's disease. The EORTC Lymphoma Group Controlled Clinical Trials: 1964-1987. Blood 1989; 73: 47-56.
Kapcsolódó internetes oldalak
Magyar Hematológiai és Transzfuziológiai Társaság - www.mhtt.hu Lymphoma Research Foundation - www.lymphoma.org
Lymphoma Information Network-http://www.lymphomainfo.net/hodgkins/resources.html
VII. Mellékletek
Szükséges dokumentumok, bizonylatok (I/A)
A beteg ambuláns jelentkezéseit az ambuláns lap és napló, az intézeti kezeléseit a kórlap, a lázlap, az ápolási dokumentáció és zárójelentés rögzíti, amely tartalmazza a beteg felvilágosítását, beleegyezését (aláírásával hitelesítve) a vizsgálatokba és kezelésekbe. Minden vizsgálati eredményt, kezelést dokumentálni kell az ambuláns lapon vagy kórlapban (dekurzus, lázlap, ápolási napló), amelyeket intézeti elhelyezés esetén összefoglalóan a zárójelentés tartalmaz. A Hodgkin-lymphomás beteg esetében minden esetben tartalmaznia kell a korábbi betegségeket, az első tünetek és/vagy panasz jelentkezésének idejét, teljes státusát, a nyirokcsomó biopsia helyét, idejét, a szövettani vizsgálat(ok) számát, helyét, altípust, a betegség stádiumát és a prognosztikai értékeit. A kiválasztott kezelés indoklását, beadás idejét, dózisát, korai mellékhatásait, az alkalmazott szupportációs kezelést. Vérkészítmények adása esetén azok
számkódját is helyes rögzíteni. A RT-ről is sugárterápiás zárójelentést kell adni, amely tartalmazza a RT formáját, dózisát, volumenét, idejét, mellékhatásait. A beteg elbocsátása alkalmával egyértelmű javaslatot kell tenni az életmód, diéta és az otthon szedendő gyógyszerekre, dátumszerűen meg kell adni a következő kontroll, vagy kezelés időpontját is. Végül jelölni kell a betegnek vényre felírt gyógyszereket is. A zárójelentéseket legalább kettő példányban a beteg rendelkezésére kell bocsátani, amelynek egy példányát a háziorvosának adja le.
Felelős személy
A Hodgkin-lymphomás beteg kezelése hematológiai centrumokban vagy decentrumokban történhet, elvárt, hogy évente legalább 5 új HL-es beteg kezelése történjen. A HL-es beteg kezeléséért, gondozásáért a szakrendelést vezető, illetve osztályvezető hematológus szakorvos felelős. Az adott terápiát (RT esetén a sugárterápiás szakorvossal történt konzultáció után) hematológus szakorvos rendelheti el, a beteg parenteralis kezelése a hematológus szakorvos irányítása mellett olyan onko-hematológiai osztályon történjen, amely jártas a citosztatikus kezelésekben, illetve azok mellékhatásainak, szövődményeinek kivédésében és kezelésében.
FÜGGELÉK - Hodgkin lymphoma kezelési protokollok
| Elsődleges KT-és kezelésként javasolt kombináció (I/A) | |||
| A(E)BVD (28 naponként) | |||
| Gyógyszer | dózis (mg/m2) | adás módja | ideje(nap) |
| Doxorubicin | 25 | iv. | 1. és 15. |
| Bleomycin | 10 | iv. v im. | 1. és 15. |
| Vinblastin | 6 | iv. | 1. és 15. |
| Dacarbazin | 375 | iv. | 1. és 15. |
| Doxorubicin cardiotoxicitás csökkentésére azonos dózisú epirubicinnel helyettesíthető | |||
| Antraciklin tartalmazó KT kerülése esetén (idős, cardiotoxicitás, alopeciát nem vállalja a beteg) a választandó KT | |||
| CO(V)PP (28 naponként) | |||
| Gyógyszer | dózis (mg/m2) | adás módja | ideje(nap) |
| Cyclophosphamid | 650 | iv. | 1. és 8. |
| Vincristin | 1,4 | iv. | 1. és 8. |
| vagy Vinblastin | 6 | iv. | 1. és 8. |
| Procarbazin | 100 | p.os | 1-14 |
| Prednisolon vagy (methylprednisolon) | 40(32) | p.os | 1-14 |
| BEACOPP alap- (és zárórójelben az emelt) dózisú protokoll | |||
| Gyógyszer | dózis (mg/m2) | adás módja | ideje(nap) |
| Bleomycin | 10 | iv.v im. | 8. |
| Etoposid | 100 (200) | iv. | 1-3 |
| Doxorubicin | 25 (35) | iv. | 1. |
| Cyclophosphamid | 650 (1250) | iv. | 1. |
| Vincristin | 1,4 | iv. | 8. |
| Procarbazin | 100 | p.os | 1-7 |
| Prednisolon vagy (methylprednisolon) | 40(32) | p.os | 1-14 |
DA -EPOCH (dózis illesztett EPOCH kemoterápia )
| 1, 2, 3, 4 | |||
| (96 órán | |||
| Etoposide | 50 mg/m2/day | Foly. iv. | keresztül) |
| 1, 2, 3, 4 (96 órán | |||
| Doxorubicin | 10 mg/m2/day | Foly. iv. | keresztül) |
| 1, 2, 3, 4 | |||
| 1 | (96 órán | ||
| Vincristine | 0.4 mg/m2/day | Foly. Iv. | keresztül) |
| Cyclophosphamide | 750 mg/m2/day | iv. | 5. nap |
| Prednisone | 60 mg/m2/bid | p.os. | 1, 2, 3, 4, 5. nap. |
| G-CSF | 5 ug/kg/day | Sc. | 6. nap |
| 21. naponként ismételve, lehetőség szerint ciklusonként 20%-os dózisemeléssel | |||
| DHAP | |||
| Gyógyszer | dózis (mg/m2) | adás módja | ideje(nap) |
| Cisplatin | 100 | foly. iv. | 1. (24 óra alatt) |
| Cytarabin | 2x2 g/m2 | iv. | 2. (2x3 óra) |
| Dexamethason | 40 mg | p.os v. iv. | 1-4 |
| ICE | |||
| Ifoszfamid | 5g/m2+mesna+G-CSF | foly. iv. | 2. |
| Carboplatin | 5x(kreat. clearence+25)max 800mg iv. | 2. | |
| Etoposid | 100mg/m2 | iv. | 1-3 |
| IGEV | |||
| Ifoszfamid | 2000 +mesna+G-CSF | iv. | 1-4 |
| Gemcitabin | 800 | iv. | 1. és 4. |
| Vinorelbin | 20 | iv. | 1. |
| Prednisolon | 100 | p.os. | 1-4 |
| mini-BEAM | |||
| Gyógyszer | dózis (mg/m2) | adás módja | ideje(nap) |
| BCNU | 60 | iv. | 1. |
| Etoposid | 75 | iv. | 2-5 |
| Cytarabin | 100 | naponta 2x i | 2-5 |
| Melphalan | 30 | iv. | 6. |
| VIM | |||
| Etoposid | 100 | iv. | 1-3 |
| Ifosfamid | 1000 | iv. | 1-3 |
| Mitoxantron | 20 | iv. | 1. |
| CEP | |||
| CCNU | 80 | p.os | 1. |
| Etoposid | 100 | p.os | 1-5 |
| Chlorambucil | 3 | p.os | 1-5 |
| Prednisolon vagy (methylprednisolon | 25(20) | p.os | 1-5 |
A szakmai irányelv érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai irányelve
a hematológiai betegségek korszerű kezeléséről - a súlyos cytopeniák diagnosztikája és kezelése
- Aplasticus anaemia
- Felnőttkori immunthombocytopenia (ITP)
- A thrombotikus thrombocytopeniás purpura (TTP) és a haemolytikus uraemiás syndroma (HUS) Készítette: a Magyar Transzfúziológiai és Hematológiai Szakmai Kollégium és a Tudományos Társaság
APLASTICUS ANAEMIA
I. Alapvető megfontolások
1. Definíció: A csontvelői őssejtek megbetegedése, amely perifériás pancytopeniával és hypocellularis csontvelői képpel jár.
2. Etiológia: a betegség kiváltó okai részleteikben ismeretlenek. Az esetek 70-80% idiopathiásnak tekinthető, 10-20%-ban örökletes tényezők állhatnak a háttérben, ritka esetekben azonsíthatók környezeti ártalamak, úm.: fertőzések, toxinok, ionizáló sugárzás. A betegség mechanizmusa a csontvelői őssejtek kársodása, reaktív vagy elsődleges immunológiai történések és ezek eredményeképpen csökkent vagy hiányzó csontvelői hemopoesis.
3. Előfordulás: Magyarországi felmérésből származó adatok nem ismeretesek, a Nyugati Féltekén általánosan elfogadott a 2/1,000,000 gyakoriság.
II. Diagnosztikus kritériumok
1. Elvek
1.1.Pancytopenia igazolása (vérkép)
Az Aplasztikus Anaemia kritériumai a perifériás vérkép alapján (International Agranulocytosis and Aplastic Anaemia Study Group, 1987):
Hgb< 10 g/dl
Vérlemezke: < 50 G/l
Neutrofil granulocyta-szám: < 1.5 G/l
A Súlyos Aplasticus Anaemia (SAA) jellemzői, ha az alábbi 3 kritériumból legalább 2 teljesül:
Neutrofil granulocyta-szám: < 0.5 G/l
Vérlemezke: < 20 G/l
Retikulocyta-szám: < 20x109/l
Nagyon Súlyos Aplasticus Anaemia (vSAA) jelölése, ha:
Neutrofil szám: < 0.2 G/l
1.2.Csontvelői hypocellularitás igazolása (csontvelő szövettani vizsgálata)
Definíció: 25% alatti celularitás vagy 25-50% cellularitás 30% alatti rezidualis haemopoezissel
1.3. Diagnosztikus és kiegészítő vizsgálatok
Részletes fizikális vizsgálat és kórelőzmény (a veleszületett és környezeti okok célzott kutatásával)
Veleszületett okok kizárása:
Fanconi anaemia (felnőttekben is előfordulhat 40-50 éves korig, esetleg fizikális stigmák nélkül is)
Dyskeratosis kongenita (Mo.-n korlátozottan hozzáférhető)
TERC mutációk (Mo.-n korlátozottan hozzáférhető)
Környezeti faktorok kutatása
gyógyszerek, toxinok, sugárzás
Fertőzések (vírusok: hepatitisek: non-A, nonB, nonC A ritka másodlagos esetekben természetesen az ok lehetőség szerinti azonnali megszűntetése alapvető.
Perifériás vérkép és vérkenet
Csontvelő szövettani vizsgálata (legalább 2 cm szövethenger, lehetőség szerint a subcorticalis normálisan is hypocellularis terület csekély reprezentációjával)
Áramlási cytometria (lehetőség szerint PNH irányú vizsgálattal iegészítve a társuló vagy fejlődőben lévő Paroxysmalis nocturnalis heamoglobinuria azonosítása céljából)
Hairy cell leukemia (áramlási cytometria)
NK-sejtes csontvelői infiltráció (áramlási cytometria)
Hypoplastikus ALL (áramlási cytometria)
Cytogenetika
Csontvelői betegségek kizárása (a szövettanon kívüli vizsgálati lehetségek): Hypocellularis MDS/AML (cytogenetika)
45 évnél fiatalabb betegek esetében, ha édestestvérük van: HLA vizsgálat
III. A kezelés elvei
A kezelés a betegség súlyosságának azonosításán alapszik.
A Súlyos Aplasticus Anaemia és a Nagyon Súlyos Aplasztikus Anaemia halálozása kezeletlen esetekben a fertőzések és kisebb mértékben a vérzések miatt nagyon nagy. A normális vagy ahhoz közeli csontvelői funkció helyreállítása a cél.
A csontvelői funkció teljes helyreállítása jelen ismereteink szerint külső forrásból (őssejt donor) származó őssejtátültetéssel lehetséges.
A betegség kifejlődéséhez vezető immunválasz befolyásolásával a betegek nagy többségében a csontvelői funkciók jelentős javítása érhető el, hosszabb távon azonban ezen esetekben a szövődmények aránya magasabb.
A csontvelőátültetés szövődményei, elsősorban a Graft Versus Host Betegség idősebb betegekben jelentős kihívást jelenthetnek, így a csontvelőátültetés mint első választandó alternatíva a 40 alatti betegek számára javasolt, amennyiben HLA azonos testvér donoruk van.
1. A kezelés algoritmusa SAA és vSAA esetében
45 év feletti beteg: immunsuppressiv kezelés
40 év alatti beteg HLA azonos testvér donorral: csontvelő átültetés
40 év alatti beteg HLA azonos testvérdonor hiányában: immunsuppressiv kezelés
40-45 év közötti beteg HLA azonos testvérdonorral: egyedi mérlegelés csontvelőtranszplantációs centrumban társbetegségek, általános állapot, valamint a donor alapján
1.1. Az őssejtátültetés mikéntjéről rendelkezésre álló adatok
javasolt kondicionálás: Antithymocyta globulin + Cyclophosphamid javasolt őssejtforrás: csontvelő javasolt időpont: olyan korán, amennyire csak lehetséges
1.2. Immunszuppresszió kerülendők:
Steroid kezelés bármilyen formában (kivéve az ATG alkalmazásának idején
Csontvelőátültetés jelöltjei esetében az esetleges transzplantációt megelőzően, bizonytalan esetekben transzplantációs centrummal kell egyeztetni!
Javaslat: Antilymphocyta globulin + ciclosporin
1.2.1. ATG kezelés módja
*Az antithymocyta globulin kezelés leghatékonyabb módja a tartós, fenntartó ciclosporin kezeléssel történő kombináció.
Az európai kezelési standard korábban a ló eredetű antithymocyta globulin (ATGAM), majd az Antilymphocya globulin
(Lymphoglobuline) volt. Az antithymocyta globulin (ATGAM) hozzáférhetősége jelentősen megnehezült, ugyanakkor 2011-ben publikált randomizált prospektív vizsgálat szerint nyúl eredetű ATG-vel 33.3% válaszarányt értek el, míg a ló eredetű ATGAM-mal 62%-nak bizonyult a válaszarány 3 hónapos értékelésnél.
A jelenleg használatos adagolás 40 mg/kg/nap 4 napon át adva.
A javasolt nyúl ATG dózis 3.75 mg/kg 5 egymást követő napon át. Idősebb betegekben (60 év felett) dóziscsökkentés javasolt, 2.5 mg/kg/nap 5 napon át.
A beadás módja 12-18 órás infúzió, centrális vénás katéteren át.
A készítmény 2.5 mg/100 mL/1 órás tesztdózis alkalmazása után adható. Amennyiben súlyos toxikus reakció jelentkezik, más ATG készítmény választandó. Tekintettel az alternatív szerek beszerzési nehézségeire, és az ártalmatlan, de figyelemfelkeltő allergiás reakciók gyakoriságára, a tesztdózis során észlelt reakció elbírálása kritikus lehet!
Az ATG kezelés alatt a láz, hidegrázás, vérnyomásingadozás, folyadékretenció gyakori jelenségek, a kezelés hatékonyságát nem befolyásolják.
Az ATG kezelés a thrombocyta-szám csökkenésével jár, a thrombocytapótlás mennyisége megnövekszik, javasolt a 30 G/L alatti értékek esetén profilaktikus készítménypótlás.
Az ATG kezeléssel párhuzamosan a kezelés mellékhatásainak csökkentése céljából intravénás steroid, antihistamin és paracetamol kezelés javasolt.
A corticosteroid kezelés oki hatását nem igazolták, az ismert számos mellékhatása miatt azonban az ATG kezelés befejeztével gyors leépítése javasolt.
1.2.2. Cyclopsporin A
Az ATG kezeléssel minden esetben kombinálni kell. Kezdése általában az ATG kezelés 1. napja.
Kezdő dózisa: 5 mg/kg/nap, szájon át. Fenntartó dózisa vérszinttől függ, a cél vérszint 400 mikrog/L a maximális terápiás hatásig, 150-300 mikrog/L a maximális terápiás választ követő 12 hónapon át.
A Ciklosporin fenntartása a terápiás választ követően legalább 12 hónapig indokolt, korábbi abbahagyása a relapsus valószínűségét növeli. (Magyarországon a Ciclosporin A -Sandimmun alkalmazása Súlyos Aplasztikus Anaemiában sajnálatos módon off label alkalmazásnak minősül, ennek szabályai vonatkoznak rá!)
2. Szupportív kezelés
2.1. Vérkészítmény pótlás
Alapelvek: a csontvelőátültetés potenciális jelöltjeiben a vérkészítmények fehérvérsejt tartalma HLA ellenes alloimmunizációt okozhat, növelve ezzel a csontvelő-rejekció valószínűségét. A csontvelőátültetésig ezért a beteg lehetőség szerint minél kevesebb vérérkészítményt kapjon! A leukocytamentesített vérkészítmények ezt a rizikót jelentősen csökkentik, de nem szűntetik meg.
Nagy hatékonyságú immunsuppressiv kezelés mellett fennáll a veszélye a transzfúzióval bejutó immunkompetens sejtek expanziójának illetve transzfúziós graft versus host betegséget okozó hatásának! Annak ellenére, hogy Súlyos Aplasticus Anaemiában ilyen esetről nem számoltak be, a vérkészítmények irradiálása nem elhagyható!
Minden súlyos aplasztikus anaemiában szenvedő betegnek leukocyta mentesített és irradiált vérkészítményt adjunk!
Testvér donoros átültetés lehetősége esetén családi donortól semmiképpen ne kapjon vérkészítményt a beteg!
A transzplantációs döntésig és a potenciális donor valamint a beteg CMV státuszának tisztázásig a csontvelőtranszplantáció jelöltje CMV negatív vérkészítményeket kapjon. A serostatusz ismeretében a recipiens-donor CMV negatív-negatív páros esetében a CMV negatív készítménnyel történő transzfúziók fenntartandók, egyéb esetekbne ez nem indokolt.
A vörösvérsejtpótlás klinikai állapot függvénye, a cél hemoglobin érték 8 g/L feletti.
A thrombocytapótlás 10 G/l alatt priflaktikusan indokolt, lázas állapot esetén 20 G/L alatti érték esetében is.
Az ATG kezelés alatt 30 G/l a célérték.
Granulocya transzfúzió életveszélyes bakteriális és gombás infekciók esetében megfontolandó, amennyiben a granulocytaszám visszatérésére remény van (a beteg csontvelőátültetésben vagy ATG kezelésben részesült, vagy részesülni fog) Láztalan betegekben, illetve nem súlyos infekció esetén alkalmazásáról nincsenek tapasztalatok.
2.2. Antiinfektív kezelés: általánosságban a lázas neutropeniák kezelési elveit kell gyakorolni.
2.3. Antiinfektív prevenció: a neutropeniás betegek antiinfektív profilaxisát kell alkalmazni.
2.4. G-CSF+EPO
2.4.1. Erythropoiesis stimuláló ágens alkalmazásának jó hatásáról nincs adat.
2.4.2. Az EBMT Súlyos aplasticus Anaemia munkacsoportjának 6 esztendős (2002-2008) 192 beteg bevonásával zajló prospektív randomizált kontrollált vizsgálata a az ATG+CSA kezelés mellé adott vagy nem adott G-CSF kapcsán megállapította:
a G-CSF a teljes túlélést illetve az eseménymentes túlélést nem befolyásolja.
A G-CSF-et kapó betegek fertőzéses eseményei szignifikánsan ritkábbak, a kórházi ápolás rövidebb
A G-CSF-et kapó betegek között a 30. napon neutrofil választ mutató betegek teljes túlélése kedvezőbb. E szerint az infekciós szövődmények megelőzésében ésa a kórházi ápolási idő rövidítésében a G-CSF hasznos lehet. Ezen túlmenően G-CSF alkalmazása neutropeniás infekciós krízishelyzetben is megfontolandó.
2.5. Sikertelen immunsuppressiv kezelést követő eljárások
Az ATG- t követő kudarc: a minimális elbírálási időpont legalább három hónap a kezelést követően. (a jelenlegi Thymoglobulin készítmény alkalmazását követően egy vizsgálatban a betegek 111 nap medián idő után mutatták a legjobb hematolgógiai paramétereket.)
A kudarc kritériumai: a SAA kritériumai továbbra is fennállnak.
Részleges válasz: normális vérképadatokat a beteg nem ér el, de a SAA kritériumai már nem állnak fenn, ugyanakkor transzfúziómentes.
Siker: Hemoglobin normális tartományban, 150 G/L feletti vérlemezke szám, 1,5 G/L feletti neutrofil szám.
2.5.1. Második antilymphocyta globulin: korábban több, kereskedelmi forgalomban hozzáférhető antilymphocya globulin is könnyen elérhető volt. Racionális stratégia a második ATG kezelés az elsőtől eltérő speciesből származó globulin készítménnyel, ugyanakkor a nyúltól különböző készítmény beszerzése nehézkes lehet. Adatok vannak a ló-ló, a ló-nyúl és a ló-ló nyúl szekvenciákról.
2.5.2. Idegen donoros átültetés mérlegelése: korábbi javaslat szerint az idegen donoros csontvelőátültetés a nagy GVHD kockázat miatt a második kurzus ATG kezelést követően merült fel. Az immunsuppressiv stratégiák fejlődése és az eltérő speciesből származó ATG-k eltűnése a gyógyszerpiacról előrehozta a javaslatot. Az első ATG kezelés kudarcát követően az idegen donor keresése megfontolandó, azonban az átültetésre csak teljes mértékben HLA egyező donor fogadható el.
2.5.3. Egyéb immunsuppressiv kezelések
Klinikai vizsgálatok zajlottak illetve zajlanak nagy dózisú cyclophosphamid, MabCampath alkalmazására. A cyclophosphamid nem bizonyult megfelelőnek kockázat/haszon tekintetében, a MabCampath-al kapcsolatos eredmények még nem elegendőek egyértelmű ajánlás megfogalmazásához.
2.5.4. Oxymetholon: az ATG -Cyclosporin kezelés bevezetése előtt az egyetlen hatékonynak tekintett kezelés volt. Az ATG-Cyclosporin mellett is növeli a siker arányát ugyanakkor hepatotoxikus, nőkben vrilizációt okozó hatása gyakran korlátozza használatát. A többszöri ATG kezelésen átesett betegek esetében lehetséges kezelési alternatíva.
Hatása gyakra a vörösvérsejt vonalra kifejezett, esetenként mindhárom sejtvonalat stimulálhatja.
Az Oxymetholon hatása elsősroban congenitalis cytopeniákban és PNH-hoz társuló pancytopeniában kifejezett.
3. Nem súlyos aplasztikus anaemia kezelése
A tünetektől függő szupprotív kezelés, oxymetholon, transzfúzió dependecia vagy súlyos neutropenia esetében immunsuppressiv kezelés. Cyclosporin-A vagy ATG+ Cycopsorin A.
Táblázat. Aplastikus anaemiát okozó gyógyszerek és vegyszerek
| Gyógyszerek | |
| Antibiotikumok | Chloramphenicol Sulphonamidok, Cotrimoxazole, Linezolid |
| Gyulladás gátlók | Arany, Penicillamin, Phenylbutazone, Indomethacin, Diclofenac, Naproxen, Piroxicam, Sulphasalazine |
| Anti epileptikumok | Phenytoin, Carbamazepine |
| Anti thyreoidea szerek | Carbimazole, Thiouracil |
| Anti-depresszánsok | Dothiepin, Phenothiazinok |
| Gyógyszerek | |
| Anti-diabetikumok | Chlorpropamid, Tolbutamid |
| Anti-malariás szerek | Chloroquine |
| Egyebek | Mebendazole, Thiazidok, Allopurinol |
| Feltételezett környezeti tényezők és vegyi anyagok | Benzol és oldószerek Növényvédő szerek, rovarölők: Szeves foszfátok, szerves klór vegyületek, Pentachlorophenol DDT és Karbamátok Hűtőolajok és kenőanyagok Forralatlan viz, injekciós tű sérülés, kacsa és liba tenyésztők, állatgyógyászati termékenység fokozók methylenedioxy-methamphetamine, MDMA, Ecstasy |
IV. Rehabilitáció
V. Gondozás
A súlyos aplastikus anaemiás betegek kezelése gyakran hosszú ideig tartó, különösen, ha haemopoetikus őssejttranszplantációra is sor kerül. Így sem mindig sikeres. Hosszú távon relapsus, myelodysplasia heveny leukaemia keletkezése nem ritka. Ezért e betegek rendszeres hematológiai ellenőrzése, megfigyelése, gondozása szükséges.
Célszerűen a betegek gondozása a kezelést végző hematológiai centrumban vagy decentrumban történjen. A gondozásáért a kezelést végző hematológus szakorvos a felelős.
VI. Irodalomjegyzék
1. Guidelines for the diagnosis and management of aplastic anaemia British Committee for Standards in Haematology 2010 Marsh J, Ball SE, Cavenagh J, Darbyshire P, Dokal I, Gordon-Smith EC, Keidan AJ, Laurie A, Martin A, Mercieca J, Killick SB, Stewart R, Yin JAL
2. Ades L, Mary JY, Robin M, FerryC, Porcher R, Esperou H, Ribaud P, Devergie A, Traineau R, Gluckman E: Socie G. Long-term outcome after bone marrow transplantation for severe aplastic anaemia. Blood 2004;103: 2490-97.
3. Bacigalupo A, Hows JM, Gluckman E, Nissen C, Marsh J, Van Lint MT, Congiu M, De Planque MM, Ernst P, McCann S: Bone marrow transplantation (BMT) versus immunosuppression for the treatment of severe aplastic anaemia (SAA): a report of the EBMTSAA Working Party. Br. J. Haemat 1988;70: 177-182.
4. Bacigalupo A, Bruno B, Saracco P, Di Bona E, Locascuilli A, Gabbas A, Dufour C, ArceseW, Testi G, Broccia G, Marotenuto M, Coser P, Barbui T, Leoni P, Ferster A: For theEuropean Group for Blood and Bone Marrow Transplantation (EBMT) Working Party onSevere Aplastic Anemia and the Gruppo Italiano Trapianti di Midollo Osseo (GITMO).Antilymphocyte globulin, cyclosporine, prednisolone and granulocyte colony stimulatingfactor for severe aplastic anemia: an update of the GITMO/EBMT study on 100 patients. Blood 2000;95: 1931-34.
5. Deeg HJ, O'Donnell M, Tolar J, Agarwal R, Harris RE, Feig SA, Territo MC, Collins RH, McSweeney PA, Copelan EA, Khan SP, Woolfrey A, Storer B.Optimization of conditioning for marrow transplantation from unrelated donors for patients with aplastic anemia after failure of immunosuppressive therapy. Blood. 2006; 108:1485-91.
6. Di Bona E, Rodeghiero F, Bruno B, Gabbas A, Foa P, Locasciulli A, Rosanelli C, Camba L,Saracco P, Lippi A, Jori A P, Porta F, De R V, Comotti B, Iacopino P, Dufour C, Bacigalupo A: Rabbit antithymocyte globulin (r-ATG) plus cyclosporine and granulocyte colonystimulating factor is an effective treatment for aplastic anaemia patients unresponsive to afirst course of intensive immunosuppressive therapy. Br J Haemat 1999;107:330-334.
7. Tichelli A, Schrezenmeier H, Socie G, Marsh J, Bacigalupo A, Dührsen U, Franzke A, Hallek M, Thiel E, Wilhelm M, Höchsmann B, Barrois A, Champion K, Passweg JR. A randomized controlled study in newly-diagnosed severe aplastic anemia patients receiving antithymocyte globulin (ATG), cyclosporine, with or without G-CSF: a study of the SAA Working Party of the EBMT. Blood 2011. Jan. 13. DOI 10.1182/blood-2010-08-304071
8. Scheinberg P A randomized trial of horse versus rabbit antithymocyte globulin in severe acquired aplastic anemia ASH 2010; Abstract LBA-4.
9. Rosenfeld, SJ, Kimball, J, Vining, D, Young, NS. Intensive immunosuppression with antithymocyte globulin and cyclosporine as treatment for severe acquired aplastic anemia. Blood 1995; 85:3058.
FELNŐTTKORI IMMUN THOMBOCYTOPENIA
I. Alapvető megfontolások
BNO: D6930
Definíció
Az immun thrombocytopenia (ITP) autoimmun megbetegedés, melyben a thrombocyta destrukció mértéke jelentősen meghaladja a thrombocyta termelését, s ez a folyamat thrombocytopeniához, valamint vérzések (enyhétől súlyosig terjedő) kialakulásához vezet. Primer v. szekunder (utóbbi gyógyszer okozta, infekcióhoz, egyéb immunbetegségez, malignus betegséghez társuló) kórformákat különíthetünk el, valamint megkülönböztetjük a jellemzően gyermekkorban előforduló akut és a felnőttkori krónikus ITP-t. Klinikailag változó súlyosságú mucocután vérzések jellemzik. A thrombocytopenia fő oka a thrombocyták felszíni antigénjei elleni autoantitestek által előidézett thrombocyta destrukció, ami a reticuloendothelialis rendszerben zajlik le. Újabb kutatások szerint emellett a betegek jelentős részében a vérlemezkék csökkent termelődése, illetve bizonyos esetekben T-sejt mediált immunfolyamat is szerepel (Cines, 2009).
Patogenezis
Autoantitest termelés következtében, mely elsősorban a vérlemezkék glycoprotein receptorai ellen irányul (GPIIb-IIIa, GPIb-IX), létrejön a vérlemezkék szekvesztrációja és a lépben zajló destrukciójuk. Utóbbiban fontos szerep jut a lép macrophagjainak, melyek Fc felismerés révén távolítják el az antitesttel fedett thrombocytákat a keringésből. A thrombocytákhoz kötött thrombopoetin (TPO) ugyancsak áldozatául esik ennek a folyamatnak. Az endogén TPO alacsonyabb koncentrációban jelenik meg a vérben, így viszonylag kevesebb TPO fogja stimulálni a megakariocyták thrombocyta termelését, de főként relatív TPO hiány jön létre, közel normális TPO szintek és thrombocyta termelés mellett. ITP-ben azonban fokozott thrombocyta termelésre lenne szükség a periférián zajló szekvesztráció miatt, így pedig végül a szükségesnél kevesebb vérlemezke termelődik. Mindezek miatt a thrombocyta termelés érzékelhetően nem tud lépést tartani a fokozott thrombocyta destrukció folyamatával és állandósul a thrombocytopenia. Ezen kívül a megakariocytákhoz kötődő autoantitestek apoptosist indukálhatnak, és így kevesebb megakariocyta vesz részt a thrombocyták termelésében. Ezek az ismeretek felhívják a figyelmet a relatív TPO hiány és a szuboptimális thrombocyta termelés fontosságára ITP-ben.
Előfordulás
Felnőttkori ITP esetén az incidencia 58-66/ 1 millió lakos/év.
Leggyakrabban 18-40 éves kor között jelentkezik, nőkben 2-3x gyakoribb, de ez a nemi különbség az életkor előrehaladtával megszűnik.
II. Diagnózis
Nem áll rendelkezésünkre olyan vizsgálómódszer, mely egyértelműen bizonyítaná az ITP diagnózisát. A diagnózis felállítása anamnézis, fizikális vizsgálat, teljes vérkép és perifériás vérkenet vizsgálata alapján, a thrombocytopenia egyéb okainak
kizárásával történik Id. Differenciáldiagnózis. Spontán nyálkahártya és bőrvérzések (purpurák, petechiák) 10.0-30.0 G/l alatti thrombocyta szám esetén fordulnak elő. Splenomegalia nem jellemző (3%). Szekunder ITP-hez vezető okok keresése döntő fontosságú [szisztémás autoimmun betegség, SLE, antiphospholipid syndroma, immundeficiens állapotok, lymphoproliferatív betegségek, Helicobacter pylori infekció, vírusfertőzések (HIV, HCV), gyógyszerek (heparin, chinidin)].
Alapvizsgálatok:
Teljes vérkép, retikulocyta, thrombocyta szám, MPV, perifériás kenet vizsgálata, (thrombocytopenia, normális vagy nagyobb thrombocyták, de ITP-ben nincs óriás thrombocyta, a vörösvérsejt és fehérvérsejt morfológia ugyancsak normális). Anaemia fennállhat a vérzések következtében, a reticulocyta szám segít elkülöníteni a csökkent képzés, illetve a fokozott vesztés okozta anaemiát.
A diagnózis megerősítéséhez elvégzendő további vizsgálatok:
Csontvelő vizsgálat: megakaryocyta arány, morfológia, egyéb betegség kizárása céljából. Fiatal betegeken, típusos esetben nem feltétlenül szükséges, elvégzendő 60 éves kor felett (evidencia szint: IIa, ajánlás: gr. B), relapszusban, ha nem reagál az első kezelésre, amennyiben szisztémás tünetekkel rendelkezik és splenectomia előtt (evidencia szint: IIb, ajánlás: gr. C) Helicobacter pylori vizsgálata: urea légzési teszt, vagy széklet antigén teszt. (evidencia: IIa, ajánlás: gr. B) HIV, HCV szerológia: ezen betegségekben az ITP évekkel megelőzheti az egyéb tünetek megjelenését. (evidencia IIb) Immunglobulin meghatározás, direkt antiglobulin teszt (DAT). Az alacsony Ig szintek immundeficiencát, a DAT pozitivitás egyidejű hemolizist jelez. Vércsoport.
Egyéb, potenciális hasznosságú vizsgálatok:
Thrc antigén specifikus antitest vizsgálata: (nincs rutin, standard módszer, érzékenysége 50-65%-os, negatív eredmény nem kizáró).
Thrc glycoprotein elleni AT vizsgálata (PIFT (direct platelet immunfluorescens test, PaIgG kimutatására) rutinszerűen nem javasolt a legújabb ajánlás szerint, mivel a PaIgG emelkedett lehet immun és nem immun thrombocytopeniában egyaránt. GP IIb/IIIa AT: specifikus, de kevésbé szenzitív.
Antiphospholipid antitest (APLA): Anticardiolipin és lupus anticoagulans 40%-ban kimutatható, de nem befolyásolja a kórlefolyást.
Egyéb autoantitestek vizsgálata: Antinucelaris antitest: ANA, pajzsmirigy ellenes antitest.
Akut és perzisztáló infekciók keresése: akut vírusinfekciók (CMV, parvovirus), vakcináció (attenuált élő vírussal) okozhat thrombocytopeniát.
Bizonytalan hasznosságú vizsgálatok: (nem javasolt)
TPO, retikulált thrombocyta, PaIgG, thrombocyta élettartam, vérzési idő, szérum komplement
Differenciáldiagnózis
Szekunder, nem immun thrombocytopeniák, májbetegségek (pl. alkoholos májcirrhosis), infekciók (sepsis), microangiopathiás kórképek (TTP, DIC), elégtelen képzést okozó csontvelő betegségek (MDS, leukaemiák, egyéb malignus betegségek, fibrosis, aplasticus anaemia, megaloblastos anaemia), kongenitális thrombocytopeniák (pl. Wiskott-Aldrich szindróma, Bernard-Soulier szindróma, congenitális amegakaryocytás thrombocytopenia, IIB típusú von Willebrand betegség), pseudothrombocytopenia (EDTA agglutináció).
III. Kezelés
Bizonyítékokon alapuló, kontrollált mulitcentrikus tanulmányok csak az új kezelésekkel kapcsolatban állnak rendelkezésre. A kezelés megválasztásában alapvető a klinikai tünetek (vérzés) és a thrombocytopenia súlyossága, a beteg életkora, életvitele, komorbiditások fennállása (vérzésre hajlamosító, ill. a specifikus kezelés szövődményeit fokozó betegségek). Tünet és panaszmentes beteget nem kell kezelni. Egyénre szabott kezelés szükséges! Az új, modern gyógyszerek hozzáférhetősége jelenleg még korlátozott, viszont nem immunszupresszivek. Korábban több beteg halt meg infekcióban, mint vérzésben (Portielje, 2001).
Várható kórlefolyás: 60% tartós remisszió, 35% tartós kezelést igényel, fatális vérzés: 5% (leggyakrabban intracranialis).
| Biztonságos thrombocyta értékek beavatkozásokhoz: (evidencia szint: IV) | |
| Fogászati kezelés: | > 20.0-30.0 G/l |
| Egyszerű foghúzás: | > 30.0 G/l |
| Komplex foghúzás: | > 50.0. G/l |
| Minor sebészet: | > 50.0 G/l |
| Major sebészet: | > 80.0 G/l |
| Major idegsebészet: | > 100.0 G/l |
| Nőgyógyászat: | |
| Sectio caesarea: | > 50 G/l |
| Sectio caesarea + epiduralis anaest.: | > 80 G/l |
Kezelés szükségessége:
50 G/l feletti thrombocyta szám esetén kezelés ritkán szükséges.
Kezelés abban az esetben válhat indokolttá, ha a thrombocyta szám < 30.0 G/l és/vagy vérzéses tünetek, ill. vérzés rizikó áll fenn (hypertonia, ulcus, veszélyeztető életmód stb.).
Hospitalizáció lehet szükséges:
Ha a thrombocyta szám < 20.0 G/l, és/vagy vérzéses tünetek vannak jelen.
ITP kezelési irányelvek
Sürgősségi kezelés:
Sürgősségi kezelés szükséges:
Nagyon alacsony thrombocyta szám és egy az alábbiak közül: Nedves purpura
Fennálló vérzés (pl: gastrointestinalis vérzés) Fejtrauma (minor is) Thrombocyta-gátló bevétele
Vérzékenység egyéb okból (pl: von Willebrand betegség, Xl-s faktor deficiencia)
Akut életveszély esetén:
Fenyegető vérzésveszély, vagy életet veszélyeztető vérzés (neurológiai tünetek, belső vérzés) jelenléte esetén, illetve ha műtéti beavatkozás válik szükségessé.
Javaslat:
Parenterális, nagydózisú glukocorticoid (Methylprednisolon 1 g/nap, 3 napig). Intravénás immunglobulin (Ivlg) (1 g/kg/nap, 1-2 napig), adható methylprednisolonnal együtt is.
Akut életveszélyben thrombocyta szupportáció szóbajön Ivlg-gel vagy anélkül (evidencia: III-IV). Akut splenectomia végezhető, Ivlg adásával kombinálva. Vérzésveszély csökkentésére antifibrinolitikum (tranexámsav 3x1 g/nap vagy epsilon-aminocapronsav (1-4 g/6 óra, max. napi 24 g) alkalmazása javasolható. Plazmaferezis nem javasolt.
Egyéb teendők: Thrombocyta funkciót gátló szerek azonnali elhagyása, vérnyomás monitorizálása, menstruáció felfüggesztése, traumák elkerülése.
Kezelés szükségessége:
50 G/l feletti thrombocyta szám esetén kezelés ritkán szükséges.
Kezelés abban az esetben válhat indokolttá, ha a thrombocyta szám < 30.0 G/l és/vagy vérzéses tünetek, ill. vérzés rizikó áll fenn (hypertonia, ulcus, veszélyeztető életmód stb.).
Hospitalizáció lehet szükséges:
Ha a thrombocyta szám < 20.0 G/l, és/vagy vérzéses tünetek vannak jelen.
ITP kezelési irányelvek
Sürgősségi kezelés:
Sürgősségi kezelés szükséges:
Nagyon alacsony thrombocyta szám és egy az alábbiak közül:
Nedves purpura
Fennálló vérzés (pl: gastrointestinalis vérzés) Fejtrauma (minor is)
Thrombocyta-gátló bevétele
Vérzékenység egyéb okból (pl: von Willebrand betegség, XI-s faktor deficiencia)
Akut életveszély esetén:
Fenyegető vérzésveszély, vagy életet veszélyeztető vérzés (neurológiai tünetek, belső vérzés) jelenléte esetén, illetve ha műtéti beavatkozás válik szükségessé.
Javaslat:
Parenterális, nagydózisú glukocorticoid (Methylprednisolon 1 g/nap, 3 napig). Intravénás immunglobulin (IvIg) (1 g/kg/nap, 1-2 napig), adható methylprednisolonnal együtt is.
Akut életveszélyben thrombocyta szupportáció szóbajön IvIg-gel vagy anélkül (evidencia: III-IV). Akut splenectomia végezhető, IvIg adásával kombinálva. Vérzésveszély csökkentésére antifibrinolitikum (tranexámsav 3x1 g/nap vagy epsilon-aminocapronsav (1-4 g/6 óra, max. napi 24 g) alkalmazása javasolható. Plazmaferezis nem javasolt.
Egyéb teendők: Thrombocyta funkciót gátló szerek azonnali elhagyása, vérnyomás monitorizálása, menstruáció felfüggesztése, traumák elkerülése.
Elsődleges kezelés Lásd az 1. táblázatot. A prednisolon dózisát 4 hét után fokozatosan csökkenteni kell, majd pedig elhagyni, hogy elkerülhetőek legyenek a steroid- indukálta súlyos mellékhatások.
Lásd az 1. táblázatot.
A prednisolon dózisát 4 hét után fokozatosan csökkenteni kell, majd pedig elhagyni, hogy elkerülhetőek legyenek a steroid-indukálta súlyos mellékhatások.
1. táblázat. Elsődleges kezelés ITP-ben
| Kezelési stratégia | Válasz arány (válaszig eltelt idő) | Toxicitások | Tartós válasz | |
| Kortikosteroidok | Dexamethason 40 mg naponta 4 napon át 2-4 hetente, 1-4 ciklusban | Max. 90% (több nap-hetek) | Az adagolás időtartamától függ A tolerancia ismételt adás esetén csökken. Rövid ideig bolusban alkalmazva a nemkívánatos események száma valószínűleg csökken | Max. 50-80% |
| Methylprednisolon 30 mg/kg/nap 7 napon át | Max. 95% (4.7 vs. 8.4 nap, HDMP+ vs. prednisolon) | 23% 39 hónapnál | ||
| Prednisolon 0,5-2 mg/kg/nap 2-4 hétig | 70-80% (több nap- hetek) | Bizonytalan - becsült 10 éves betegségmentes túlélés 13-15% | ||
| Intravénás anti-D 50-75 ug/kg | Az IVIg-hez hasonló (dózisfüggő) (4-5 nap) | Gyakori: hemolitikus anemia, láz/hidegrázás Ritka: intravaszkuláris hemolízis, DIC, veseelégtelenség, halál | Tipikusan 3-4 hét, de fennállhat hónapokig | |
| Kezelési stratégia | Válasz arány (válaszig eltelt idő) | Toxicitások | Tartós válasz |
| Intravénás immunglobulin 0,4 g/kg/nap 5 napon keresztül vagy infúzió 1 g/kg/nap 1-2 napig | Max. 80%, fele eléri a normális thrombocyta számot (gyors hatás, sokan 24 órán belül, általában 2-4 nap alatt) | A fejfájás gyakori; egyéb átmeneti mellékhatások | Általában átmeneti, 2-4 héttel a kezelés után visszatér a kezelés előtti szintre |
+: HDMP: nagydózisú methylprednisolon
Az intravénás immunglobulin alkalmazása akkor javasolt, ha a thrombocyta szám nem növekszik 5.0 G/l fölé néhány nap alatt a kortikosteroid kezelés ellenére.
Az intravénás anti-D Rh pozitiv, nem splenectomizált betegnek adható, IvIg-hez hasonlóan hatékony, de a válasz tartósabb. Az intravénás készitmény (WinRho) jelenleg nem hozzáférhető.
Második vonalbeli kezelés felnőttkori ITP-ben
A refrakter ITP-nek két formája ismeretes, az egyik típus az elsődleges kezelésre nem reagáló betegek (nincs válasz 6 hét után), a másik típus reagál ugyan a kezelésre, de folyamatos kezelést igényel. A felnőttkori ITP 30-40%-a nem reagál az elsődleges kezelésre vagy relapszusba kerül. Kezelés szükséges, ha a thrombocyta szám <30.0 G/l és/vagy vérzéses tünetek jelentkeznek. Cél: Minimális kezelés mellett biztonságos thrombocyta szám tartása, figyelembe véve a vérzés szempontjából fennálló rizikó faktorokat (egyéb gyógyszerek, életmód, foglalkozás). Nincs egységes terápiás algoritmus, splenectomia, vagy másodvonalbeli gyógyszeres kezelés jön szóba.
Splenectomia
Egyedi indikáció, függ a betegség súlyosságától, a kortikosteroid toleranciától, kontraindikáció jelenlététől. Javasolt akkor, ha nincs válasz a glukokortikoid kezelésre 4-6 hét alatt (thrombocyta szám <10.0 G/l), ha 3 hónapnál hosszabb ideig áll fenn <30.0 G/l thrombocyta szám, és megnő a vérzéses rizikó, valamint, ha folyamatos (>10-20 mg/nap) prednisolon alkalmazása szükséges a 30.0 G/l feletti thrombocyta szám fenntartásához. Manapság javasolt a splenectomia idejének kitolása, mivel spontán remissziók a diagnózist követő 6-12 hónapon belül még előfordulhatnak. Terápiás válasz várható a betegek kb. 80%-án napokon belül, ennek 2/3 része tartós (komplett remisszió: 66%, tartós válasz: 64%). A betegek 14%-a nem reagál splenectomiára, kb. 20%-uknál pedig kielégítő válasz után relapsus következik be. A splenectomiára adott válasz megítélésében a steroidra vagy az intravénás immunglobulinra adott válasz prediktív értéke alacsony, hasznos módszer lenne az Indiummal jelölt thrombocyták élettartam és szekvesztráció vizsgálata (ha splenikus, 90%-ban eredményes a splenectomia, evidencia: III, ajánlás: gr. B), azonban a módszer rutinszerűen nem hozzáférhető. Splenectomia előkészítése:
A thrombocyta számtól és a vérzékenységtől függően sürgősségi kezelés válhat szükségessé.
Vakcináció: 2-4 héttel az elektív műtét előtt polyvalens Pneumococcus, Haemophilus influenzae b (Hib) és Meningococcus vakcináció szükséges. Revakcináció 5 évente ajánlott, influenza vakcináció pedig évente. Rituximab kezelést követően 6 hónapon belül a vakcináció effektivitása kétséges.
A splenectomia utáni tartós antibiotikum profilaxis előnye nem bizonyított és nem ajánlott. A betegeket fel kell világosítani a poszt-splenectomiás infekciók kockázatáról. Lázas betegség esetén azonnal orvoshoz kell fordulni, antibiotikum alkalmazása szükséges. Célszerű a splenectomizált beteg otthonában antibiotikumot tartani, melynek alkalmazását a beteg láz esetén azonnal meg tudja kezdeni.
Gyógyszeres kezelési lehetőségek másodvonalban:
Azathioprin: 1-4 mg/kg dózisban, többnyire kortikoszteroiddal kombinációban, 40%-ban hatékony.
Cyclosporin A: 2,5-3 mg/kg/nap dózisban, önállóan vagy prednisolonnal kombinálva adható. 50-80%-ban eredményes, 42% komplett válasz, mely tartós lehet a gyógyszer elhagyása után is.
Cyclophosphamid: 1-2 mg/kg/nap p. os 16 hétig vagy iv. 0.3-1 g/m2 dózisban 1-3 alkalommal, 2-4 hetenként. Terápiás válasz 24-85%-ban várható, mely 50%-ban tartós.
Danazol (200 mg 2-4x/nap dózisban) 60-67%-ban hatékony.
Dapsone: 75-100 mg/nap dózisban 50%-ban hatékony, 2/3-uknál tartós válasz jön létre. Splenectomia után kevésbé hatékony.
Mycofenolat-mofetil (Cellcept): Szerv és őssejttranszplantációban használt antiproliferativ és immunszuppresszív szer. 250-1000 mg/die dózisban hetente 2x, három hétig 75%-ban hatékony, de a hatás nem tartós.
Rituximab: 375 mg/ m2 dózisban hetente 1x, 4 alkalommal. 60%-ban hatékony, 40%-ban komplett válasz, mely 15-20%-ban 3-5 éven túl is fennáll. Ismételve is hatékony, különösen, ha tartós választ (> 1 év) produkáló betegeken szükséges az ismételt alkalmazás. A mellékhatások enyhék.
Irodalmi adatok alapján a kisebb rituximab dózisokkal is jó eredmény érhető el (100 mg iv. hetente, összesen 4 alkalommal), de további vizsgálatok szükségesek a rituximab pontos dózisának megállapítására ITP-ben. Egy nemrégiben befejezett vizsgálat igen eredményesnek találta a rituximab és nagydózisú dexamethason kombinációját újonnan diagnosztizált, korábban nem kezelt ITP-s betegekben (a 6 hónapnál észlelt válasz arány a kombináció esetén 63 %, a nagydózisú dexamethasonnal kezelt betegekben pedig 36% volt).
A rituximab alkalmazása kontraindikált aktív B vírus hepatitisben. Néhány esetben SLE és ITP kapcsán progresszív multifokális leukoencephalopathia kialakulását is észlelték.
Vinca alkaloidok: Vincristin heti 1-2 mg, vagy vinblastin 5-10 mg/hét, 4-6 hétig, hatása átmeneti a betegek kb. 10-75%-ánál. A mellékhatások jelentősek lehetnek. Thrombopoetin receptor (TPO) agonisták:
Nem az immunrendszer modulálása révén, hanem a thrombocyta produkció fokozása révén hatékonyak. Stimulálják a megakaryocyták thrombocyta termelését, ugyanahhoz a TPO receptorhoz kötődnek (c-Mpl), mint az endogen TPO, de nem mutatnak szerkezeti homológiát az endogén TPO-val, így nem várható neutralizáló antitestek termelődése. Egyformán hatékonyak splenectomiát megelőzően és azt követően is. Romiplostim: 1-10 ug/ kg heti 1 subcutan injekció.
Eltrombopag: nem peptid TPO receptor agonista, 25, 50 vagy 75 mg/nap per os.
Mindkét szer hatékonyságát randomizált klinikai tanulmányok igazolták (evidencia szint: Ib/IIa), 70-80%-os válasz arány volt elérhető, de folyamatos kezelés szükséges. Hosszú immunszuppressziv kezelés után is eredményesen alkalmazhatók. Romiplostim esetében 5 éves, eltrombopag esetében 3 éves követési vizsgálatok eredményei állnak rendelkezésre. Mindezek alapján a készítmények biztonságosnak tűnnek, kevés mellékhatással rendelkeznek, az egyetlen felmerülő probléma a csontvelői reticulin rost szaporulat, melyet mindkét szer alkalmazása során észleltek. Ennek jelentőségét egy jelenleg folyó, hosszú-távú követéses vizsgálatban kívánják meghatározni. A TPO mimetikum leállítását követően a legtöbb betegnél a thrombocytopenia visszatér. Hátránya még, hogy költséges és tartós alkalmazás szükséges. Helicobacter pylori eradikáció igazolt fertőzés esetén igen fontos.
Splenectomia esetén melléklép keresése (izotóp módszerrel, előfordulása 12%) és eltávolítása ritkán eredményes. Járulékos lép gyanúját veti fel, ha a vérkenetben nem láthatók Howell-Jolly testek.
Relapszus esetén ismételt kortikosteroid kezelés eredményes lehet, az elsődleges kezelésnél alkalmazott dózisokban. Refrakter ITP-ben tartós kisdózisú prednisolon, másnaponkénti adagolással a mellékhatások csökkenése várható.
Nagydózisú parenterális glukocorticoid [methylprednisolon (1g/nap), dexamethason 40 mg/nap, 4 napig, 2-4 hetente] alkalmazása gyakran hatékony.
Az első és második vonalbeli kezelésre nem reagáló betegek terápiás lehetőségei
A betegek közel 20%-a nem reagál a fenti kezelésekre, vagy relapszusba kerül. Egy részük jól tolerálja a jelentős thrombocytopeniát (10.0 G/l körülit is), jó életminőség mellett. Akiken kezelés szükséges, a lehetőségek korlátozottak. Romiplostim, eltrombopag: Ha nem kaptak TPO receptor agonista kezelést, splenectomia után is eredményesen alkalmazhatók (79%) (evidencia: Ib, ajánlás: gr A). Hátránya, hogy költséges és tartós alkalmazás szükséges, viszont az egyetlen gyógyszercsoport, amelynek hatékonyságát randomizált klinikai vizsgálatok igazolják refrakter ITP-ben. Egyéb javaslatok: (nem bizonyított hatékonyság, potenciálisan jelentős toxicitás)
Kombinált kemoterápiás kezelés, (CVP jellegű).
Campath-1H egyes tanulmányokban hatékony. A fenti módszerek kombinálásával történtek próbálkozások súlyos refrakter esetekben, vérzés, krízis esetén. Haemopoetikus őssejttranszplantáció: autológ és allogén formája néhány esetben eredményes volt, de a potenciálisan nagyon súlyos mellékhatások korlátozzák alkalmazhatóságát. Kizárólag olyan esetekben jöhet szóba autológ átültetés, ahol a súlyos krónikus, refrakter, vérzéses komplikációkat okozó ITP semmilyen egyéb terápiás megoldásra nem reagál. Kevés a tartósan válaszolók aránya.
Thrombocytopenia terhességben
Fiziológiásán is lehet alacsonyabb thrombocyta szám a harmadik trimeszterben, hemodilúció, fokozott thrombocyta aktiváció és clearance miatt (gesztációs thrombocytopenia: enyhe, reverzibilis, késői terhességben jelentkezik, nem okoz magzati thrombocytopeniát).
A korábban ITP-s betegeken relapszus következhet be terhesség kapcsán.
Előfordulás
1/1000-1/10.000 terhesség. ITP-s nő esetén felvilágosítás ajánlatos a terhesség vállalásáról, annak kockázatairól.
Diagnózis
A thrombocytopenia egyéb okainak kizárásán alapul, hasonlóan, mint nem terhes betegeken, de különös tekintettel a terhességben előforduló egyéb thrombocytopeniákra (gesztációs thrombocytopenia, preeclampsia, HELLP szindróma, microangiopathiás haemolytikus kórképek, DIC, folát deficiencia, acut zsírmáj, antiphospholipd szindróma, massziv vérzés). Elvégzendő vizsgálatok: vérkép, kenet, reticulocyta szám mellett májfunkció, véralvadási vizsgálat (prothrombin, APTI, TI, fibrinogén), antiphospholipid antitest, SLE serologia. Csontvelő vizsgálat nem szükséges.
Kezelési irányelvek terhességben
Szülész, hematológus, aneszteziológus, neonatológus kollaborációján alapul. A harmadik trimeszterben csökken a thrombocyta szám, ezért gyakoribb vérkép vizsgálat szükséges.
Kezelés nem szükséges, ha a thrombocyta szám >50.0 G/l, valamint ha 30.0-50.0 G/l közötti az első és második trimeszterben, szoros ellenőrzés mellett.
Kezelés szükséges az első két trimeszterben, ha a betegnek vérzéses tünetei vannak, ha a thrombocyta szám 20.0-30.0 G/l alatti, vagy ha beavatkozást szükséges végezni. Ebben az esetben biztonságos szintre kell emelni a vérlemezke számot. Az aneszteziológus szempontjából a biztonságos thrombocyta szám a spinalis vagy epiduralis érzéstelenítéshez 80 G/l feletti. Ha nem történik spinalis vagy epiduralis érzéstelenítés, úgy sectio caesarea esetén haematologiai vélemény szerint elegendő az 50 G/l feletti vérlemezke szám.
Kezelési javaslatok terhességben
Az első vonalbeli kezelés hasonló, mint a felnőttkori ITP esetén, a kortikosteroid a mellékhatások miatt fokozott figyelmet igényel (gesztációs diabetes, hypertonia, psychosis, osteoprosis, az egyéb ismert mellékhatások mellett). A másik lehetséges első vonalbeli kezelés az intravénás immunglobulin (IvIg). Korlátozott evidenciájú az iv. anti-D, a splenectomia és az azathioprin alkalmazása terhességben. A vinca alkaloidák, a rituximab, a danazol, a TPO mimetikumok és a legtöbb immunszupresszív szer alkalmazása kontraindikált terhességben teratogenitás miatt. Kortikosteroidok, IvIg és azathioprin alkalmazhatók.
Kezelés módja:
Kortikosteroid: alacsony induló dózisban (10-20 mg/nap), majd a hemosztázis szempontjából effektív THRC szám fenntartásához szükséges legkisebb dózis javasolt. Az utolsó trimeszterben lassú dóziscsökkentés javasolt, mivel ilyenkor egyébként is romlik a thrombocytopenia.
IvIg (2g/kg) akkor javasolt, ha a kortikosteroid ineffektív, vagy gyors THRC szám emelkedés szükséges. A hatás átmeneti (3-4 hét), ismételhető.
Refrakter ITP kezelése terhességben:
Az első vonalban javasolt szerek kombinációja, nagydózisú methylprednisolon jön szóba (önmagában, illetve IvIg-nal vagy azathioprinnel kombinálva), splenectomia mérlegelendő a második trimesterben (laparoscopos), csak ha nagyon szükséges! Vakcináció ebben az esetben is javasolt.
Szülés módja:
Fő kockázat: a súlyos neonatalis thrombocytopenia és vérzés lehetősége, a korábbi 10-20%-os mortalitás újabban kevesebb, mint 1%. Nincs evidencia arra, hogy a sectio caesarea biztonságosabb a hüvelyi szülésnél. Ráadásul az újszülöttek vérzéses eseményei általában 24-48 órával a szülést követően jelentkeznek (a thrombocyta szám nadírján). Nőgyógyászati indikáció határozza meg a szülés módját.
Ha a thrombocyta szám >50 G/l, akkor a hüvelyi szülés biztonságos, ha nincs egyéb koagulációs eltérés. Sectio caesarea elvégezhető, ha a vérlemezke szám >80.0 G/l-re emelkedett kezelés után. Profilaktikus thrombocyta pótlás ajánlott, ha vérlemezke szám < 100 G/l és tervezett a császármetszés, v. vérzés áll fenn. Szülés után thrombosis profilaxis szükséges, ha a vérlemezke szám >100.0 G/l.
Az újszülöttek 3%-ában van neonatalis ITP, a kissúlyú újszülötteknél viszont 30% feletti is lehet, ami az intracraniális vérzésveszélyt jelentősen fokozza. Nem ajánlott a köldökből vagy fejvénából történő vérmintavétel!! Szoros vérképellenőrzés, intracranialis vérzés gyanú, 20.0 G/l alatti thrombocyta szám esetén kortikosteroid és/vagy IvIg adása (egyszeri 1 gr/kg) szükséges.
Mellékhatások és kockázati tényezők:
Glukokorticoid kezelés ismert mellékhatásai: hypercorticizmus, osteoporosis, asepticus combfej necrosis, psychiátriai tünetek,
cataracta.
Splenectomia :
Vérzés, infekció, thrombosis, ismételt műtéti beavatkozás. Laparotomia esetén 12.9%, laparoscopia esetén 9.6% a szövődmények előfordulása, idősebb korban gyakoribb. A mortalitás laparotomia mellett 1%, laparoscopia mellett 0.2%. Az ITP jelenléte és a splenectomia egyaránt megnövelik a posztoperatív thromboembolia rizikót, ezért hatékony prophylaxis alkalmazása feltétlenül indokolt.
IvIg kezelés: ritkán fejfájás, hányinger, láz, aseptikus meningitis, alloimmun hemolizis, veseelégtelenség, anaphylaxia (IgA hiány esetén), hepatitis C infekció.
Anti-D: Gyakori mellékhatások: láz, hidegrázás, haemolysis, néha fatális súlyos haemolysis,
Immunszupressziv kezelés: leukopenia, csontvelő szupresszió, immunszupresszióval összefüggő gombás, bakteriális és egyéb, néha fatális infekciók, malignitás, terhességben magzati károsodás.
Danazol: súlynövekedés, fejfájás, hajhullás, szőrnövekedés, myalgia, amenorrhoea, masculinisatio, acne, cholesterin emelkedés, transaminase emelkedés,
TPO agonisták: Mellékhatás 20%-ban enyhébb (fejfájás, orrvérzés), ritkábban csontvelői reticulin szaporulat, thrombocytopenia súlyosbodása a gyógyszer elhagyása után is, thrombosis.
IV. Rehabilitáció, V. Gondozás
A felsorolt kezelésekre a betegek 10-15%-a nem reagál megfelelően, vagy relapsusba kerül. Ezért az első 2-5 évben a gyógyult betegek 3-6 havonkénti ellenőrzése célszerű. Öt év után a tünettel jelentkezők vizsgálata szükséges. A thrombocytopeniát jól toleráló tünetmentesek folyamatos ellenőrzése szükséges és sebészeti (foghúzás is) beavatkozás előtt gyógyszeres előkészítés is történjen.
ITP kezelésért felelős személyek
Enyhe és középsúlyos esetek: hematológus szakorvos, decentrumok, haematológiai szakambulanciák.
Súlyos és refrakter ITP: IvIg kezelés, szupportáció, sürgős, ill. nagyobb kockázatú műtét szükségessége esetén hematológiai centrumok.
IvIg kezelés szükségessége esetén egyedi finanszírozás.
Egyes másod- harmadvonalban alkalmazható gyógyszerek hozzáférhetősége nem biztosított, nincsenek törzskönyvezve, ennek megoldása szükséges (sürgősségi egyedi méltányosság, OGYI engedély)
VI. Irodalomjegyzék
1. Andersen JC: Response of resistant idiopathic thrombocytopenic purpura to pulsed hig dose dexamethasone therapy. N Engl J Med 1994;330:175-177.
2. Boruchov DM, SGururangen, MC Driscoll, JB Bussel: Multiagent induction and maintenance therapy for patients with refractory immune thrombocytopenic purpura (ITP). Blood, 110: 3526-3531, 2007.
3. Bussel JB., DJ Kuter, V Pullarkat et al.: Safety and efficacy of long-term treatment with romiplostom in thrombocytopenic patients with chronic ITP. Blood. 113:2161-2171,2009.
4. Cines DB, V S Blanchette: Immune thrombocytopenic purpura. N. Engl. J. Med. 346: 995-1007, 2002.
5. Cines DB, Bussel JB, Liebman HA, Luning Prak ET: The ITP syndrome: Pathogenetic and clinical diversity. Blood, 113: 65116521, 2009.
6. Delgado J., JG Bustos, V. Jimenez-Yuste, FHernadez-Navarro: AntiCD20 monoclonal antibody therapy in refractory immune thrombocytopenic purpura. Haematologica, 87: 215-216, 2002
7. Emilia G., Morselli M, Luppi M es mtsai: Long term salvage therapy with cyclosporin A in refractory idiopathic thrombocytopenic purpura. Blood, 99: 1482-1485, 2002.
8. George JN., Woolf SH, Raskob GE, Wasser JS, Aledort LM, Ballem PJ, Blanchette VS, Bussel JB, Cines DB, Kelton JG, Lichtin AE, McMillan R, Okerbloom JA, Regan DH, Warrier I: Idiopathic thrombocytopenic purpura: A practice giudeline developed by explicit methods for the American Society of Hematology. Blood, 88: 3-40, 1996.
9. Godeau B, Bierling P, Oxenhendler et al: High dose dexamethasone therapy for resistant autoimmune thrombocytopenic pupura. Am. J. Hematol. 51: 334, 1996.
10. Godeau B, Zini JM, Schaeffer A, Bierling P: High dose methylprednisolone is an alternative treatment for adults with autoimmune thrombocytopenic purpura refractory to intravenous immunoglobulins and oral corticosteroids. Am. J. Hematol, 48: 282-284, 1995.
11. Giudelines for the investigation and management of idiopathic thrombocytopenic purpura is adults, childern and in pregnancy. Brit. J. Haematol, 120: 574-596, 2003.
12. Kuter DJ, Bussel JB, Lyons RM, es mtsai: Efficay pf romliplostim in patients with immune thrombocytopenic purpura: a doubleblind randomised controlled trial. Lancet, 371: 395-403, 2008.
13. Lichtin A.: The ITP practice giudeline: what, why, and for whom. Blood, 88: 1-2, 1996.
14. Manahoran A: Slow infusion of vincristine in the treatment of idiopathic thrombocytopenic purpura. Am. J. Hematol. 21: 405-407, 1991.
15. McCrae KR, Bussel JB, Mannucci PM, Remuzzi G, Cines DB: Platelets: An update on diagnosis and management of thrombocytopenic disorders. Hematology 2001, 282-305.
16. Provan D, R. Stasi, AC Newland et al.: International consensus report on the investigation and management of primary immune thrmbocytopenia. Blood, 115: 168-186, 2010.
17. Porileje JE, Westendorp, RG, Kliun-Nelemans HC, Brand A: Morbidity and mortality in adults with idiopathic thrombocytopenic purpura. Blood, 97: 2549-2554, 2001.
18. Quinquandon I, Feneaux P, Culier MT et al: Re-evaluation of the role of azathioprine in the treatment of adult chronic idiopathic thrombocytopenic purpura: A report on 53 cases. BrJ. Haematol. 74: 223-228, 1990.
19. Schreiber AD, Chien P, Tomaski A, Cines DB: Effect of danazol in immune thrombocytopenic purpura. N. Engl. J. Med., 316: 503-508, 1987.
VII. Melléklet
ITP kezelésében szereplő gyógyszerkészitmények:
| Név: | ATC: |
| Prednisolon | H02A |
| Metypred | H02A |
| Medrol | 02A |
| Oradexon | H02A |
| Immunglobulinok: | J06BA02 |
| Rhophylac (anti-D) | J06BB02 |
| Imuran | L04A |
| Cyclophosphamid | L01A |
| Vincristin | L01CA02 |
| Vinblastin | L01CA01 |
| Danazol | G03X |
| Sandimmun | L04A |
| Mabthera (rituximab) | L01XC02 |
| Cellcept | L01AA06 |
| Nplate (romiplostim) | B02BX04 |
| Revolade (eltrombopag) |
A THROMBOTIKUS THROMBOCYTOPENIÁS PURPURA (TTP) ÉS AHAEMOLYTIKUS URAEMIÁS SYNDROMA (HUS) KEZELÉSE
I. Alapvető megfontolások
A TTP és a HUS egyaránt a thrombotikus mikroangiopathiák közé sorolható, sok hasonlóságot mutató klinikai syndroma. Közös bennük a mikrovasculáris thrombocyta aggregáció, lényegesen eltérő azonban ennek kiterjedtsége és ennek megfelelően a klinikum. A pathomechanizmus megismerését célzó kutatások az elmúlt másfél évtizedben jelentős eredményt hoztak. A háttérben zajló molekuláris mechanizmusok keresése rutin gyakorlattá vált. Ezek eredményének ismerete ma már elengedhetetlen a helyes kezelési stratégia megválasztásához.
1. THROMBOTIKUS THROMBOCYTOPENIAS PURPURA (TTP) vagy MOSCHCOWITZ SYNDROMA
Incidencia
Korábban 1/1 millióra becsülték, mely utóbbi évtizedekben többszörösére emelkedett, ma kb. 3-10/1 millió. Ez csak részben köszönhető a kórkép jobb ismertségének, valamint a diagnosztikus kritériumok enyhülésének. A betegek kb. 2/3-a nő, a 30-40 éves korosztályt érinti leggyakrabban, de bármely életkorban előfordulhat.
A kórképre jellemző klinikai pentád
A típusos pentád (1. táblázat) csak az esetek kb. 40%-ban, míg a triád (az első 3 tünet) kb. 70-80%-ban fordul elő. Más okkal nem magyarázható mikroangiopathiás haemolytikus anaemia és consumptiós thrombocytopenia egyidejű jelenléte esetén a diagnózis már felállítható. Klinikuma nagyon színes, a mikrothrombosisok okozta ischaemia lokalizációjától függően sokféle kórképet utánozhat. Jellegzetes laboratóriumi eltéréseit a 2-es táblázatban foglaltuk össze.
1. táblázat. A TTP-re jellemző klinikai pentád
- Súlyos consumptiós thrombocytopenia
- Mikroangiopathiás haemolytikus anaemia
- Fluktuáló neurológiai tünetek
- Veseérintettség
- Láz
Mortalitása jelenleg 5-20%, mely a 70-es évek előtt meghaladta a 90%-ot. Idiopathiás, familiáris/congenitális, valamint másodlagos formái ismertek. A kórképet Moschcowitz írta le először 1924-ben.
Pathomechanizmus
Az ADAMTS13 (a distintegrin and metalloprotease with eight thrombospondin-1-like domains) metalloprotease enzim aktivitásának jelentős csökkenése mutatható ki az esetek többségében. (1,2)
Az enzim a von Willebrand faktor (vWF) fiziológiás degradációjáért felelős, a Tyr1605 és Met1606 közötti peptidkötést hasítja. Hiányában az endothelből származó vWF hasítása nem következik be, ún. szokatlanul nagy vWF (ULvWF) multimerek kerülnek a keringésbe. Ezek adhesivitása a normális multimerekénél jóval nagyobb. Nyíróerő hatására a thrombocyták direkt aggregációját indítják el a kis erekben. Az enzimaktivitás csökkenését inhibítorként viselkedő IgG típusú autoantitest vagy az enzim genetikus hiánya egyaránt okozhatja. Más esetekben az enzim relatív hiányáról lehet szó. TTP-re az 5% alatti enzimaktivitás jellemző, enyhébb csökkenés számos kórképben kimutatható. Ritkán a TTP egyes eseteiben semmilyen ADAMTS13 eltérést nem lehet kimutatni, ezen forma pathomechnizmusa még nem tisztázott. A feltételezett egyéb mechanizmusok közül említendő az anti-CD36 autoantitest, mely több munkacsoport szerint(3) a betegek 70-80 %-ban kimutatható. Pontos jelentősége még nem tisztázott.
Az ADAMTS13 enzimet döntően a máj termeli, génje a 9q34-es kromoszómán helyezkedik el. Az enzim in vitro felezési ideje kb. 1 hét, in-vivo mindössze 2-4 nap. Ugyanakkor genetikus enzimhiányban az enzim pótlása FFP transzfúzióval jóval hosszabb, 3-4 hetes tünetmentes állapotot eredményez. Az ellentmondás hátterében az endothelhez való lekötődést feltételezik, mely mintegy enzim reservoirként szolgálna. Előzetes adatok szerint ebben talán a CD36 receptornak(4) lenne szerepe. Fontos megjegyezni, hogy az ADAMTS13 enzimaktivitás hiánya önmagában nem okoz TTP-t. A folyamat elindításához diffúz endothel aktiváció vagy egyéb trigger mechanizmus is szükséges.
II. Diagnózis
A jellegzetes laboratóriumi eltéréseket a 2. táblázatban, a kizárandó legfontosabb kórképeket a 3.táblázatban foglaltuk össze.
2. táblázat. TTP-re jellemző laboratóriumi eltétések_
- Súlyos thrombocytopenia (<< 50 G/l)
- Változó mértékű haemolytikus anaemia, direkt Coombs teszt negatív
- Reticulocytosis
- Perifériás kenetben fragmentocytosis + magvas vörösvérsejtek, spherocyták, polychromasia, basophil punctatio
- Csontvelőben hypercellularitás, megakaryocytaszám normális vagy emelkedett
- Jelentősen emelkedett se-LDH
- Se-haptoglobinszint alacsony vagy nem detektálható
- Enyhén, közepesen emelkedett indirekt se-bilirubin
- Normális vagy közel normális coagulogram (prothrombin, PTI, fibrinogén)
- Se karbamid, kreatinin normális vagy változó mértékben emelkedett
- Haemoglobinuria, (mikro)haematuria, proteinuria
- CRP normális vagy enyhén emelkedett
- ADAMTS13 enzimaktivitás < 5%, ritkán magasabb vagy akár normális
3. táblázat. TTP differenciáldiagnózisa
- HUS
- DIC
- (Pre)eclampsia, HELLP syndroma
- ITP/Evans syndroma
- SLE, APA syndroma, egyéb autoimmun kórképek
- Thrombocytopenia és haemolysis egyéb okai
Klinikai formák Familiáris/congenitális TTP
Hátterében az ADAMTS13 enzim homozygota vagy dupla heterozygota génmutációja áll. Az öröklésmenet autoszóm recesszív. Eddig több mint 60 mutációt írtak le. Nagyon ritka. A legsúlyosabb esetek újszülöttkorban kezdődnek. Típusos klinikai megjelenési formája: krónikus ciklikus relabáló TTP. Jellegzetes periodicitást mutat, a shubok általában 3-4 hetente jelentkeznek. Mono, oligosymptomás formák is ismertek, a gyermekkori tünetek enyhék, ITP-re vagy atípusos (Coombs negatív) Evans syndromára emlékeztetnek, a jellegzetes klinikum csak fiatal felnőtt korban bontakozik ki, infekció, terhesség, stressz, stb hatására. Ilyenkor az idiopathiás formától kell elkülöníteni.
Idiopathiás (szerzett) TTP
Akut (egy epizódos) vagy intermittáló formák ismertek. Utóbbiban a shubok rendszertelenül követik egymást. A betegek 33-100%-nál az enzimaktivitás 5% alatti, ezek kb. 44-100%-nál mutatható ki inhibítor. Ez a betegcsoport a kezelésre általában jól reagál de gyakran relabál. A betegek egy részénél az enzimaktivitás nem vagy csak kis mértékben csökkent. Eddigi adatok alapján kezelésre az előbbi csoporthoz hasonlóan jól reagál, a késői relapsus viszont ritka.
Másodlagos (secunder) TTP
Lásd később, a másodlagos HUS-sal közösen tárgyalva.
III. Kezelés
A familiáris/congenitális TTP kezelésre(5,6)
Friss fagyasztott plazma (FFP) vagy kryofelülúszó (KF, hazánkban nem hozzáférhető készítmény) terápiás, ill. profilaktikus alkalmazása jön szóba klinikailag manifesztálódott TTP esetében, plazmacsere általában szükségtelen. Az enzimdefektus igazolása klinikai tünetek hiányában önmagában nem elegendő a kezelés elindításához.
Az idiopathiás TTP kezelésre(5,6) Elsődleges kezelés
A beteg kezelését lehetőség szerint azonnal, de legkésőbb 24 órán belül meg kell kezdeni. A diagnózis alapos gyanuja elegendő a kezelés megkezdéséhez. Kontrollált adatok(7,8) alapján az elsődlegesen választandó kezelés a plazmacsere (PEX), jellemzőit a 4. táblázatban foglaltuk össze. Hematológiai remissio elérésekor meglévő neurológiai vagy vese maradványtünet a kezelés folytatását nem indokolja. A PEX elhagyását követően gyakori a korai relapsus (exacerbatio: 30 napon belül), ilyenkor a kezelést újra kell indítani, akár többször is. A tartós remissio eléréséhez néha több hónapos kezelésre is szükség lehet. Alapszabály, hogy amennyiben a TTP PEX-re nem vagy nem jól reagál, a kórképet fenntartó egyéb okot (infekció, tumor, autoimmun betegség) kell keresni.
4. táblázat. Plazmacsere TTP-ben_
- Volumen: 40-60 ml/kg/nap
- Szubsztitúciós folyadék: FFP/KF
- Frekvencia: naponta
- Végpont: komplett hematológiai remissio*
* min. 2 egymást követő napon > 150 G/l-nél magasabb thrombocytaszám, hemolysis jele nélkül, emelkedő vagy normális hemoglobin érték mellett
Késői relapsus (30 nap komplett hematológiai remissiót követően) a betegek kb. 30-50%-nál észlelhető, elsősorban a csökkent enzimaktivitású betegeknél kell rá számítani, különösen magas inhibítorszint, remissióban is alacsonyan maradó vagy újra azzá váló enzimaktivitás esetén. Gyakran terhesség, műtét, infekció váltja ki, kezelésre az első epizódhoz hasonlóan, általában jól reagál.
Alternatív plazmakezelés
Amennyiben plazmacsere 24 órán belül nem elérhető, FFP (vagy KF) infúzió adandó. Szokásos dózisa 20-30 ml/kg. Amennyiben a beteg stabil, a folyadékterhelést jól tűri és 24 órán belül thrombocytaszáma jelentősen emelkedik, a kezelés komplett hematológiai remissióig folytatható, ha nem: a beteget apheresis központba kell küldeni vagy mobil PEX-et (Haemobil) kell kérni. Fontos azonban tudni, hogy kontrollált adatok alapján e kezelés hatékonysága szignifikánsan elmarad a PEX eredményességétől.
Immunszuppresszív kezelés (ISU)
Magas inhibítorszintű betegeknél a PEX mellett adott ISU elméletileg logikusnak látszik. Az alábbi szerek használatáról van irodalmi adat:
-Corticosteroid: leggyakrabban használt szer, dózis az 1 mg/kg/nap és a grammos lökéskezelés között változhat. Óvatosan kell leépíteni, mert a dózis csökkentésekor a visszaesés gyakori.
- Vincristin, azathioprin, cyclophosphamid, cyclosporin stb.: esetismertetések, kis esetszámú tanulmányok szólnak a hatékonyság mellett. Leginkább ajánlható szer a cyclophosphamid. Optimális adagolási módja nem ismert, systémás autoimmun kórképekben használt sémák alkalmazása javasolható. Cyclosporin maga is TTP-t indukálhat, ezért használata során fokozott óvatosság szükséges.
- Rituximab: nagyon ígéretesnek látszó szer. Dózis: 375 mg/m2 általában hetente, 4 héten át. Számos kis esetszámú vizsgálat és egy prospektív kontrollált fázis II. vizsgálat szól hatékonysága mellett. (9,10) Pillanatnyilag árán kívül off-label volta korlátozza használatát.
- Iv.Immunglobulin: szokásos adagja 2 g/kg 2-5 nap alatt adva. Hatékonyságát illetően az irodalmi adatok nagyon ellentmondóak.
Enzimaktivitás és inhibítor vizsgálati eredmény hiányában az alábbi esetekben érdemes az ISU-val kísérletet tenni:
- Eleve nagyon súlyos klinikai állapot.
- Néhány napos PEX kezelésre sem emelkedő thrombocytaszám.
- Átmeneti javulás után ismét csökkenő thrombocyta érték.
Thrombocyta-funkciót gátló szerek
A thrombocytaszám emelkedő fázisában (thr > 100 G/l) számos centrum alkalmaz aspirin + dipyridamol kezelést a hirtelen emelkedő thrombocytaszám okozta visszaesés kivédésére. A hatékonyságot igazoló kontrollált vagy nagy esetszámú tanulmány nem áll rendelkezésre, haszna elméleti megfontolás alapján is kérdéses.
Ticlopidin, clopidogrel önmagában is TTP-t indukálhat, a TTP aktív szakában mindenképpen, de TTP-s anamnesis esetén is általában kerülendő alkalmazásuk.
Splenectomia (11)
Fulmináns esetekben salvage kezelésként, illetve a gyakori relapsusok kivédésére alkalmazható, utóbbi esetben kifejezetten jó effektussal. Előtte legalább 2 héttel a beteget vaccinálni (Pneumococcus, Meningococcus, Haemophylus infl.) kell.
Az ADAMTSI3 vizsgálat jelentősége
Az eddigi adatok alapján a diagnózis felállításához az ADAMTSI3 enzimaktivitás és inhibitor vizsgálat nem szükséges, de segít kiválasztani az ISU-t is igénylő betegcsoportot, valamint jelzi a relapsus szempontjából nagy rizikójú betegeket.(12)
2. HAEMOLYTIKUS URAEMIÁS SYNDROMA (HUS)
A kórképre jellemző triád az 5.táblázatban látható. A diagnózis kimondásához mindhárom tünet egyidejű jelenléte szükséges. HUS-ban az ADAMTS13 aktivitás jellemzően normális vagy csak enyhén csökkent. A HUS gyűjtő név, a bevezető tünetek alapján 2 nagy csoport különböztethető meg.
5. táblázat. HUS-ra jellemző klinikai triád_
- Súlyos consumptiós thrombocytopenia
- Mikroangiopathiás haemolytikus anaemia
- Változó mértékű akut veseelégtelenség_
Típusos, diarrhoea asszociált (D+) HUS
Jól definiált klinikai entitás, verotoxint/shiga-toxint termelő enterohaemorrhagiás E.Coli (VTEC/STEC, leggyakrabban E.Coli 0157:H7), egyes trópusi helyeken Schigella dysenteriae, valamint ritkán Citrobacter freundii infekciókhoz társul. A kórképet Gasser írta le 1955-ben, de az E.Coli fertőzésekkel való összefüggését csak 1982-ben tisztázták. A gyermekkori akut veseelégtelenségek leggyakoribb oka. A fertőzés forrása a toxin termelő baktériummal kontaminált étel, víz, de foeco-oralis átvitel is lehetséges. A prodromális fázisban görcsös, vizes, majd gyakran véres hasmenés alakul ki, melyet kb. 7-10 nap múlva követ az akut veseelégtelenség. A tünetekért a bélből felszívódó toxin a felelős. Receptora a globotriaosylceramid (GB3), a receptor expressio mértéke szerepet játszik a szöveti károsodás lokalizációjában és súlyosságában. A toxin a fehérjeszintézis gátlásán keresztül közvetlenül endothel toxikus. Emellett a fehérvérsejt, thrombocyta, véralvadási rendszer aktivációja, cytokin (IL-6, IL-8, TNF) hatás, a stimulált endothelből megnövekedett ULvWF kiáramlás, valamint másodlagos ADAMTS13 enzimgátlás is szerepet játszik a pathológiás történések kialakulásában. A verotoxinnal és a CD36 struktúrával keresztreagáló autoantitestek kialakulását is leírták.(13)
Ritkán a D+HUS húgyuti infekció következménye is lehet. Ilyenkor a típusos hasmenés hiányzik, a toxin termelő kórokozó a vizeletből mutatható ki.
Leggyakrabban a veseelégtelenség uralja a klinikai képet, neurológiai tünet ritka, a hypertoniás és metabolikus encephalopathia következménye. Egyes adatok szerint a gyors LDH és kreatinin emelkedés (LDH > 1200 IU/l/nap, kreatinin > 0,5 mg%/nap) előhírnöke lehet a neurológiai komplikációknak. Összességében gyermekkorban jóindulatú forma, a mortalitás 3-5%. Gyógyulást követően relapsus nincs. Idősebb korban a kórkép sokkal rosszindulatúbb, magas halálozással jár.
Típusos (D+) HUS kezelése
Folyadék és elektrolitegyensúly biztosítása, vérnyomás kontroll, szükség szerint dialysis, parenterális táplálás, transzfúzió. Bél motilitást gátló gyógyszerek, antibioticum alkalmazása kerülendő. Plazmacsere a gyermekkori formában általában nem javasolható. Felnőtt korban nem megerősített adatok szerint a plazmacsere a mortalitást csökkentheti. Pre-klinikai fázisban van a toxin közömbösítését célzó monoclonális antitest kezelés. (14)
Atípusos, nem diarrhoea asszociált HUS (D- vagy aHUS)(15)
Heterogén betegségcsoport. Közös jellemzőjük, hogy az anamnesisből hiányzik a hasmenés. Minden életkorban előforduló, de főleg a gyermekeket és fiatal felnőtteket érintő betegség. Ritka, becsült incidenciája kb. 2/1 millió. Az alábbi, aethiológia szerinti alcsoportok ismertek:
Neuraminidázt termelő kórokozók által okozott atípusos HUS
Ez a mechanizmus újabb adatok alapján az aHUS kb. 40%-áért felelős. Neuraminidázt termelő kórokozóval (Streptococcus pneumoniae, Clostridium törzsek, influenza vírusok) történt fertőzést követően alakul ki. Leggyakrabban a 2 évnél fiatalabb gyermekeket érinti. Gyógyulást követő relapsus nem ismert. A vese szempontjából a hosszútávú prognózis jó, a vesefunkció a legtöbb betegen rendeződik.
A neuraminidáz a vörösvérsejt, thrombocyta, endothel sejtek felszinéről a sziálsavat hasítja le, melynek következtében rejtett, ún. Thomsen-Friedenreich antigének kerülnek a felszinre. Ezek ellen reguláris anti-T ellenanyagok találhatók a keringésben. A folyamatot T aktivációnak hívják, a vércsoportszerológiai vizsgálatok során észlelt polyagglutinatio, Coombs pozitivitás hívhatja fel rá a figyelmet. Általános nézet szerint plazma adása ebben a csoportban reguláris anti-T tartalma miatt nem javasolt, bár egyes szerzők az anti-T antitest klinikai jelentőségét vitatják. Mivel az alternatív komplement aktivációs út szabályozásában központi szerepet játszó H faktor a sziálsavhoz kötődik a sejtmembránon, másodlagos komplement regulációs zavar kialakulása sem kizárt.
Komplement reguláció zavara által okozott atípusos HUS
Az aHUS kb. felének hátterében komplement regulációs zavar áll. Az alternatív komplement rendszer jellegzetessége a lassú, spontán aktiváció, a folyamatos C3 hasadás. A komplement regulációs fehérjék feladata e folyamat fékentartása. Eddig a H faktor (HF), I faktor (IF), membran cofactor protein (MCP, CD46), B faktor (BF) és C3 mutációját írták le. Az HF, IF és MCP mutációk jellemzően funkció-vesztő mutációk, vagyis az érintett fehérje nem termelődik vagy nem működik. Az HF esetében a működést gátló autoantitest előfordulása is ismert. A BF és C3 esetében funkció-nyerő mutációról van szó, mely a fiziológiás regulációt nem engedi érvényre jutni. Bármely mechanizmus is áll a háttérben, a végeredmény az alternatív komplement kaszkád amplifikációja, a terminális reakcióút aktiválódása, követlezményes szöveti károsodással.
Klinikailag a lappangó kezdet, kifejezett hypertonia, fluktuáló klinikai tünetek és laboratóriumi leletek jellemzik e csoportot.
H faktor és I faktor mutációk
A HF a leggyakoribb (30%), IF jóval ritkább (5-10%) mutáció. Mindkét faktor esetében számos mutáció ismert. Mindkét fehérjét döntően a máj termeli. A HF feladata a C3 konvertáz gátlása és kofaktorként az IF segítése. Az IF az alternatív és klasszikus aktiváció szabályozásában egyaránt részt vesz, a C3b és C4b alfa láncát hasítja kofaktor jelenlétében. A HF gén az 1q32, az IF gén a 4q25 kromoszómán helyezkedik el. Penetranciájuk alacsony, kb. 40-50%. Bármely életkorban manifesztálódhatnak. A kiváltó ok leggyakrabban infekció vagy terhesség. Prognózisuk rossz, irreverzibilis veseelégtelenség kialakulásának valószínűsége 60-70%, veseátültetést követő relapsus a HF mutációknál kb. 80%-ban, IF mutációknál közel 100%-ban jön létre a transzplantációt követő 2 éven belül.
MCP mutációk
A vörösvérsejteken kívül minden sejten expresszálódó glycoprotein (CD46). Az IF működését elősegítő sejtfelszini kofaktor. Az ismert mutációk kb. 10%-ban mutatható ki. Penetranciája szintén alacsony. Leggyakrabban infekciót követően manifesztálódik. Jóindulatú forma, a betegek 20-30%-nál alakul ki irreverzibilis veseelégtelenség. Transzplantációt követően a relapsus gyakorisága alacsony, kb. 10%. A relapsus kiváltásában a poszt-transzplantációs ISU kezelésnek és endothel mikrochimerismus kialakulásának egyaránt szerepe lehet.
Egyéb komplement mutációk Még nincs elegendő klinikai adat.
Defektív cobalamin-Cmetabolizmus okozta HUS
Autoszomális recesszív HUS képében jelentkezhet. Már a születéskor kibontakozó fulminans vagy csak később manifesztálódó enyhébb lefolyású formák ismertek. Táplálási nehézség, növekedési elmaradás, hypotonia, lethargia, leukopenia, megaloblastos anaemia irányíthatják rá a figyelmet. Jellegzetes tünete a hyperhomocysteinaemia és metylmaloninuria. A vesebiopszia kórjelző. Kezelése: hyroxycobalamin naponkénti adása.
III. Atípusos HUS kezelése
Az atípiás jelként értékelendő klinikai tüneteket az 5. táblázatban foglaltuk össze. Ezek észlelése esetén még a plazmakezelés megkezdése előtt vérmintát kell venni részletes komplement diagnosztikai (C3, C4, HF, IF, BF szint, MCP expressio, anti-HF antitest szűrés és komplementgenetika) és ADAMTS13 (enzimaktivitás, inhibítor és genetika) vizsgálatok céljára(16). A kórházi szinten gyakran elérhető összkomplement és C3 vizsgálatok normál értéke a komplement defektus lehetőségét nem zárja ki, ezért a vérmintát speciális laboratóriumba (pl: Semmelweis Egyetem, III.sz. Belklinika, Kutatólaboratórium(17)) kell azonnal küldeni vagy a laboratórium utasítása szerint a szállításig le kell fagyasztani. Az eredmény megvárására természetesen általában nincs mód, az empírikus kezelés azonnal elkezdendő és a későbbiekben az eredménytől függően módosítandó.
5. táblázat. Atípusos HUS-ra utaló jelek_
- Hasmenés hiánya
vagy
- Hasmenés + az alábbiak közül bármelyik jelenléte:
- Életkor < 6 hónap vagy > 5 év
- Lappangó kezdet
- HUS relapsus
- Feltételezett korábbi HUS
- Korábbi tisztázatlan anaemia
- Bármely szervátültetést követő HUS
- Családban aszinkron előforduló HUS
HF és IF mutációkban a plazmacsere és plazma transzfúzió a hiányzó fehérje pótlása révén elméletileg hatásos lehet, kontrollált adat még nem áll rendelkezésre. A tisztán faktorhiányos mutációkban elméletileg a plazma transzfúzió is elegendő lehet, a funkcionális mutációkban viszont a kóros fehérje eltávolítása is kívánatos a pótlás mellett, ezért inkább a plazmacsere javasolható. A "European Pediatric Study Group for HUS" standardizált kezelési ajánlását a 6. táblázatban foglaltuk össze.
6. táblázat. Plazmacsere atípusos HUS-ban gyermekkorban
- Plasmacsere indítása 24 órán belül, kivéve:
= Más módon kezelendő alternatív diagnózis alapos gyanúja
= Kisgyermekeknél vénabiztosítás technikai nehézségei
= Enyhe veseérintettség esetén, ha a kockázat/haszon arány kedvezőtlen
- Szubsztitúció: FFP
- Volumen: 1,5 plazmavolumen (60-75 ml/kg/alkalom)
- Frekvencia:
= Naponta 5x
= Hetente 5x 2 hétig
= Hetente 3x 2 hétig
= Hatékonyság kiértékelése a kezelés 33. napján
- Végpont:
= Plazmacserével nem kezelhető alternatív diagnózis igazolódása = Plazmacsere elhagyását igénylő súlyos komplikáció
= Hematológiai remisszió*
* A plazmacsere folytatásához az aethiológia tisztázása szükséges
A felnőttkori esetek kezelésére vonatkozó külön ajánlás még nincs, ezért a TTP-nél leírt plazmacsere protokoll alkalmazása javasolható. A kezelésre reagáló betegeknél fenntartó plazmakezelés haszna nem kizárt, de az ajánlható kezelési séma még várat magára.
Ugyancsak a plazmacsere a választandó kezelés anti-HF antitest kimutatása esetén. Elméletileg ISU-val történő kiegészítés kívánatos lenne, az optimális protokoll azonban szintén nem ismert. Funkció-nyeréses mutációk (C3, BF) esetén a plazmabevitel a komplement aktivációt fokozhatja, ezért ezekben az esetekben a kezelés elején szubsztitúciós folyadéknak inkább albumint javasolnak. Az MCP mutációban a plazmaterápiától terápiás hatás nem várható.
Végstádiumú veseelégtelenség esetén, plazmacserére nem reagáló, súlyos, befolyásolhatatlan aktív thrombotikus mikroangiopathia és/vagy malignus hypertonia esetén bilaterális nephrectomia is szóba jön.(,9)
Vesetranszplantáció indikációja (19)
Atípusos HUS okozta irreverzibilis veseelégtelenség esetén izolált vesetranszplantáció indikációját a 7. táblázatban foglaltuk össze. A perioperatív időszakban végzett intenzifikált plazmacsere a transzplantáció eredményességét növeli. Anti-HF antitest esetén az antitestet szintet a lehető legalacsonyabbra kell csökkenteni a transzplantáció előtt. Izolált veseátültetést követő HUS recidiva esetén máj vagy kombinált máj-veseátültetés javasolható. Izolált májátültetés jöhet szóba igazolt mutáció esetén, ha fenntartó plazmakezelés mellett a vesefunkció megtartott. A HF és IF mutációkban kombinált máj-vese transzplantációval próbálkoznak. A C3, BF, valamint vegyes mutációkat hordozók optimális transzplantációs stratégiája pillanatnyilag még nem tisztázott. A jelenlegi elvek alapján a vérrokontól származó élő-donoros szervátültetés akkor is kontraindikált, ha a potenciális családi donorban komplement génmutáció nem igazolható.
7. táblázat. Izolált vesetranszplantáció indikációja atípusos HUS-ban_
- HF, IF, BF, C3 génmutáció hiánya
- MCP mutáció
- anti-HF antitest
- alacsony rizikójú mutációk (nemzetközi regiszterek adatai alapján)
- olyan mutáció, melyet sikeres veseátültetés követett a mutációt hordozó családtagban_
Egyéb kezelési lehetőségek (19)
A transzplantációnál reménykeltőbb kezelés lehet az Eculizumab, a C5 hasítását gátló humanizált monoklonális antitest, melynek HUS-ban történő klinikai vizsgálata folyamatban van.
3. SECUNDER TTP-HUS FORMÁK
A leggyakoribb okait a 8. táblázatban foglaltuk össze. Közös jellemzőjük, hogy a molekuláris pathomechanizmus még nem vagy nem kellően tisztázott. Az ADAMTS13 aktivitás a legtöbb kórképben normális vagy csak mérsékelten csökkent. A klinikai megjelenési forma gyakran HUS, de TTP is lehet. A kimenetel a kiváltó októl függ. Egyes gyógyszer-asszociált, terhességhez társuló esetek plazmacserére általában jól reagálnak, az AIDS, tumor és allogén haemopoietikus őssejt-transzplantáció-asszociált formákban a kimenetel nagyon kedvezőtlen. A kezelés egyéni elbírálást igényel. Amennyiben a kiváltó ok nem befolyásolható és a beteg plazmacserére nem reagál, a kezelés abbahagyandó.
8. táblázat. Másodlagos TTP-HUS kórképek
- Gyógyszerek:
= Kinin
= Thienopyridinek: ticlopidin, clopidogrel
= Calcineurin inhbítorok: cyclosporin, tacrolimus
= mTOR gátlók: sirolimus, everolimus
= Kemoterápiás szerek: mitomycin B, cisplatin, bleomycin, gemcitabin...
= Angiogenesis gátlók: bevacizumab
= Egyéb szerek: orális fogamzásgátlók, interferon...
- Disseminált tumorok: mucint termelő adenocarcinomák...
- Terhesség
- Infekciók:
= vírusinfekciók: HIV, CMV...
= sepsis: baktérium, gomba
- Allogén őssejt-átültetés
- Autoimmun kórképek:
= SLE,
= antiphospholipid syndroma
= egyéb kórképek
- Műtétek
IV. Rehabilitáció
V. Gondozás
Célszerűen a betegek gondozása a kezelést végző hematológiai centrumban vagy decentrumban történjen. A gondozásért a kezelést végző hematológus, vagy klinikai onkológus szakorvos a felelős. Fontos az Országos Vérellátó szolgálat területi állomásával, szükség esetén nefrológus szakorvossal együttműködés
VI. Irodalomjegyzék
1. Furlan M, Robles R, Galbusera M, Remuzzi G, Kyrle PA, Brenner B, Krause M, Scharrer I, Aumann V, Mittler U, Solenthaler M, Lämmle B: Von Willebrand factor-cleaving protease in thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome. New England Journal of Medicine. 1998;339:1578-1584.
2. Tsai HM, Lian ECY: Antibodies to von Willebrand factor-cleaving protease in acute thrombotic thrombocytopenic purpura. New England Journal of Medicine. 1998;339:585-1594
3. Porta C, Caporali R, Montecucco C: Thrombotic thrombocytopenic purpura and autoimmunity: a tale of shadows and suspects. Haematologica. 1999;84:260-9.
4. Davis AK, Makar RS, Stowell CP, Kuter DJ, Dzik WH: ADAMTS13 binds to CD36: a potential mechanism for platelet and endothelial localization of ADAMTS13. Transfusion. 2009;49:206-13.
5. Allford SL, Hunt BJ, Rose P, Machin SJ; Haemostasis and Thrombosis Task Force, British Committee for Standards in Haematology: Guidelines on the diagnosis and management of the thrombotic microangiopathic haemolytic anaemias. British Journal of Haematology. 2003;120:556-73.
6. Hovinga JAK & Meyer SC: Current management of thrombotic thrombocytopenic purpura. Hemostasis and Thrombosis. 2008;15:445-450
7. Rock GA, Shumak KH, Buskard NA, Blanchette VS, Kelton JG, Nair RC, Spasoff RA: Comparison of plasma exchange with plasma infusion in the treatment of thrombotic thrombocytopenic purpura. Canadian Apheresis Study Group. New England Journal of Medicine. 1991;325:393-7.
8. Henon P: Thrombotic thrombocytopenic purpura: Clinical results of a French controlled trial. Transfusion Science. 1992;13:63-72
9. Froissart A, Buffet M, Veyradier A, Poullin P, Provot F, Malot S, Schwarzinger M, Galicier L, Vanhille P, Vernant JP, Bordessoule D, Guidet B, Azoulay E, Rondeau E, Mira JP, Wynckel A, Clabault K, Choukroun G, Presne C, Pourrat J, Hamidou M, Gimeno L and Coppo P: First-line Rituximab efficacy and safety in patients with acquired idiopathic thrombotic thrombocytopenic purpura experiencing a non optimal response to therapeutical plasma exchange. Results of a prospective multicenter phase 2 study from the French Reference Center for the management of thrombotic microangiopathy. Blood. 2009;114:366 (abstract: 890)
10. Chemnitz J, Uener J, Hallek M and Scheid C: Long-term follow-up of Rituximab treatment of non-familiar idiopathic thrombotic thrombocytopenic purpura (TTP). Blood. 2009;114:1363 (abstract 3513)
11. Kappers-Klunne MC, Wijermans P, Fijnheer R, Croockewit AJ, van der Holt B, de Wolf JT, Löwenberg B, Brand A: Splenectomy for the treatment of thrombotic thrombocytopenic purpura. British Journal of Haematology. 2005,130:768-76.
12. Ferrari S, Scheiflinger F, Rieger M, Mudde G, Wolf M, Coppo P, Girma JP, Azoulay E, Brun-Buisson C, Fakhouri F, Mira JP, Oksenhendler E, Poullin P, Rondeau E, Schleinitz N, Schlemmer B, Teboul JL, Vanhille P, Vernant JP, Meyer D, Veyradier A; French Clinical and Biological Network on Adult Thrombotic Microangiopathies. Prognostic value of anti-ADAMTS 13 antibody features (Ig isotype, titer, and inhibitory effect) in a cohort of 35 adult French patients undergoing a first episode of thrombotic microangiopathy with undetectable ADAMTS 13 activity. Blood. 2007;109:2815-22.
13. Rock G, Clark W, Sternbach M, Kolajova M, McLaine P: Haemolytic uraemic syndrome is an immune-mediated disease: role of anti-CD36 antibodies. British Journal of Haematology. 2005:131:(2):247-52.
14. Tzipori S, Sheoran A, Akiyoshi D, Donohue-Rolfe A, Trachtman H: Antibody therapy in the management of shiga toxin-induced hemolytic uremic syndrome. Clinical Microbiology Review. 2004;17:(4):926-41.
15. Hirt-Minkowski P, Dickenmann M, Schifferli JA: Atypical Hemolytic Uremic Syndrome: Update on the Complement System and What Is New. Nephron Clinical Practice. 2010:114:(4):c219-c235.
16. Taylor CM, Machin S, Wigmore SJ, Goodship TH; working party from the Renal Association, the British Committee for Standards in Haematology and the British Transplantation Society: Clinical Practice Guidelines for the management of atypical Haemolytic Uraemic Syndrome in the United Kingdom. British Journal of Haematology. 2009:148:(1):37-47
17. Prohászka Z: A hemolitikus urémiás szindróma és a trombotikus thrombocytopeniás purpura molekuláris szemléletű klasszifikációja és diagnosztikájuknak aktuális kérdései. Orvosi Hetilap 2008:147:1251-1261
18. Ariceta G, Besbas N, Johnson S, Karpman D, Landau D, Licht C, Loirat C, Pecoraro C, Taylor CM, Van de Kar N, Vandewalle J, Zimmerhackl LB; European Paediatric Study Group for HUS: Guideline for the investigation and initial therapy of diarrhea-negative hemolytic uremic syndrome. Pediatric Nephrology. 2009:24:(4):687-96.
19. Saland JM, Ruggenenti P, Remuzzi G and the Consensus Study Group: Liver-kidney transplantation to cure atypical hemolytic uremic syndrome. Journal of the American Society of Nephrology. 2009:20:(5):940-9.
A szakmai irányelv érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai irányelve
a hematológiai betegségek korszerű kezeléséről - kiegészítő (supportiv) kezelések hematológiai betegségekben
- A haemopoeticus növekedési faktorok alkalmazása
- A thrombocyta transzfúzió módszertana
- Kemoterápia okozta hányás megelőzése és kezelése felnőtt onkohematológiai betegekben
- A neutropeniás beteg fertőzéseinek megelőzése és kezelése
Készítette: a Magyar Transzfúziológiai és Hematológiai Szakmai Kollégium és a Tudományos Társaság
A HAEMOPOETICUS NÖVEKEDÉSI FAKTOROK ALKALMAZÁSA MALIGNUS BETEGSÉGEKBEN
I. Általános megfontolások
A daganatos betegség kemoterápiája során kialakuló neutropenia és anémia kezelésében az utóbbi évtizedben döntő előrelépés történt. A vérképzés folyamatában szerepet játszó stimuláló faktorok pontos megismerése, azoknak rekombináns technikával nagy mennyiségben történő előállítása lehetővé tette ezek biztonságos felhasználását a mindennapi gyakorlatban. Ma a granulocyta-makrofág-sejtek képződését befolyásoló kolóniastimuláló faktorok és az erythropoesist befolyásoló eritropoetin/erythropoeticus fehérje használatosak a mindennapi gyakorlatban. Az anémia és a neutropenia kezelésében a granulocyta kolóniastimuláló faktor (G-CSF) és az eritropoezist stimuláló szerek (ESA) alkalmazását az American Society of Clinical Oncology (ASCO) először 1994-ben ajánlotta. Azóta az alkalmazási javaslatot többször módosították, jelen javaslat a National Comprehensive Cancer Network (NCCN) "Myeloid Growth Factors" v.1.2010 és a "Cancer- and Chemotherapy-Induced Anaemia" v.1.2011 verziójában foglalt elvek figyelembevételével készült.
II. A myeloid kolónia stimuláló faktorok alkalmazása Citosztatikumok okozta neutropenia
A daganatos betegségek egy részében a citosztatikus kezelés szinte törvényszerűen neutropeniához vezet. A jelenlegi definíció szerint neutropenia akkor áll fenn, ha az abszolút neutrophil szám (ANC) <500/ul, vagy ANC <1000/ul, de 48 órán belül az várható, hogy az ANC <500/ul lesz. A kezelés halasztása vagy a dózis csökkentése rontja a kezelés hatékonyságát. A betegek sorsa szempontjából a neutropenia megelőzése, a profilaxis sokkal előnyösebb, mintha akkor történik beavatkozás, ha már kialakult a neutropenia. A megelőzés jelentőségét az bizonyítja, hogy citosztatikus kezelések során a korai halálozás 60-70%-ban fertőzések miatt következik be. A neutropeniás beteg fertőzésének kimenetelét a kórokozó természetén és az antibiotikus kezelés elkezdésének időpontján kívül döntően befolyásolja, hogy a neutropenia milyen súlyos és mennyi idő alatt rendeződik.
A lázas neutropenia kockázatának felmérése
(1) kezeléssel és (2) a beteggel kapcsolatos tényezők vizsgálata
1.A kezeléssel összefüggő tényezők
A kemoterápia okozta neutropenia esetén a tennivalókat döntően meghatározza, hogy a kezelés kuratív célú, esetleg a túlélést, az életminőséget javítja, vagy csak a betegség tüneteit mérsékli. Ezen szempontokon túl igen fontos annak ismerete, hogy az alkalmazott kemoterápiás kombináció esetén mekkora a lázas neutropenia valószínűsége. Magasnak tekintjük a lázas neutropenia kockázatát akkor, ha az alkalmazott kemoterápia esetén a betegek >20%-ában, közepesnek ha 10-20%-ban és alacsonynak ha <10%-ban fordul elő neutropeniával járó lázas állapot a megfigyelések alapján..
2.A beteggel kapcsolatos tényezők
Célszerű figyelembe venni, hogy a beteg korábban részesült-e kemo- vagy sugárterápiában, neutropeniás-e a kezelés megkezdésekor, továbbá az idős kor, alultápláltság, rossz általános állapot kedvezőtlen jel. Az alapbetegség szempontjából döntő, hogy igen kiterjedt, előrehaladott betegségről, esetleg a csontvelőt is infiltráló kórképről van-e szó. Kedvezőtlen kísérő betegségnek tekintendő az obstruktív tüdő-, cardiovascularis és májbetegség vagy a diabétesz.
Rizikóbecslés: A lázas neutropenia kockázatát a kezelés megkezdése előtt, majd minden kemoterápiás ciklus előtt újra szükséges megítélni.
III. Kezelés
1. A myeloid kolónia stimuláló faktorok alkalmazási javallatai
Az alábbi javaslatok szolid tumorok és nem myeloid malignus haematológiai betegségekben szenvedő felnőtt betegekre érvényesek. A haemopoeticus növekedési faktorok közül a klinikai gyakorlatban neutropenia esetén a granulocyta kolónia stimuláló faktor (G-CSF, filgrastim) és a pegilált, hosszú hatású forma alkalmazása terjedt el. A pegilált G-CSF csak profilaxisra javasolt. A granulocyta-képzést befolyásoló kolónia stimuláló faktorok alkalmazása lehet profilaktikus (ha a nagy valószínűséggel várható neutropeniát kívánjuk megelőzni) és intervenciós (mely esetben a cél a már kialakult neutropenia mielőbbi megszüntetése). Külön elbírálást igényel az ún. tünetmentes, illetve a lázas neutropenia a kolónia stimuláló faktorok alkalmazása tekintetében.
A G-CSF profilaktikus alkalmazása
A primer profilaxis azt jelenti, hogy amennyiben a kemoterápia és egyéb tényezők miatt lázas neutropenia kialakulása nagyon valószínű, akkor annak létrejötte előtt kolónia stimuláló faktor alkalmazandó. A kialakulás valószínűségének megítélésében nemcsak az alkalmazott kemoterápiás protokoll, de a beteg életkora, kísérő betegségei is fontosak. Kedvezőtlen, ha a beteg 65 évnél idősebb, rossz az általános állapota, már korábban részesült kemo- vagy sugárterápiában, a malignus betegség a csontvelőt is érinti. Növeli a lázas neutropenia kockázatát, ha a beteg a közelmúltban műtéten esett át, infekciója vagy nyilt sebe van, eleve neutropeniás, vese-, illetve májbetegségben szenved. A primer profilaktikus alkalmazás mérlegeléskor figyelembe kell venni, hogy kuratív, palliatív vagy tüneti kezelés történik-e. Az ún. "dose dense" kezelések esetén a profilaktikus G-CSF alkalmazása nélkülözhetetlen. Ezen csoportba tartoznak az emlőrák adjuváns kezelésére használt kemoterápiás sémák (TAC, FEC100) és az agresszív lymphomás betegek CHOP-14 kezelése is. A G-CSF alkalmazása profilaktikus céllal azokban az esetekben költséghatékony, melyekben a citosztatikus kezelés összetétele és dózisa alapján a lázas neutropenia valószínűsége meghaladja a 20%-ot. Indokolt lehet a profilaxis akkor is, ha a fennálló kísérő betegségek miatt a kockázat 10-20%. Primer profilaxissal az esetek mintegy felénél kerülhető el a lázas neutropenia kialakulása. A betegek medián túlélését és betegségmentes túlélést a primer profilaxis döntően nem befolyásolja.
Másodlagos profilaxist akkor akkor alkalmazunk, ha a megelőző citosztatikus ciklusban lázas neutropenia alakult ki, és a kemoterápiás kezelés dózisának csökkentése döntően befolyásolná a betegségmentes és az átlagos túlélést. Nem szükséges rutinszerűen másodlagos profilaxis, ha a beteg neutropeniás volt ugyan, de nem lázas. G-CSF alkalmazható és indokolt a fentieken kívül minden olyan esetben, ahol ezt az elfogadott kemoterápiás protokoll tartalmazza, pl őssejt mobilizálás és transzplantáció.
A G-CSF intervenciós alkalmazás
Az intervenciós alkalmazás célja a már kialakult lázas neutropeniában a fertőzéses mortalitás csökkentése. A lázas neutropeniás betegek számára kevés kivételtől eltekintve intézeti kezelés szükséges. Pegilált G-CSF profilaxisban részesült betegnél a parenteralis antibiotikus kezelés bevezetésével egy időben további kolónia stimuláló faktor adása nem szükséges. Eltérő megítélés indokolt a kolónia stimuláló faktor alkalmazását illetően tünetmentes és lázas neutropeniában. Ha lázas neutropenia fennállásáról van szó, az antibiotikus kezelés kiegészítéseként indokolt a G-CSF adása, amikor >10 napig tartó, vagy súlyos neutropeniára (ANC <100/uL) lehet számítani, a beteg 65 évnél idősebb, szepszis, pneumonia vagy egyéb klinikailag dokumentált fertőzés vagy szisztémás gombás fertőzés esetén, illetve ha a beteg kórházban tartózkodott, mikor a fertőzés kialakult. G-CSF adását indokolja a korábbi lázas neutropenia is.
A myeloid kolónia stimuláló faktorkezelés dózisa és tartama
Filgrastim: Klinikai vizsgálatok alapján ismeretes, hogy a granulocytaszám-emelkedés üteme és mértéke függ az alkalmazott kolónia stimuláló faktor dózisától. G-CSF adása esetén 5 ug/kg a javasolt közepes dózis. A hatékonyság szubkután alkalmazás esetén sem marad el az intravénásétól. Profilaktikus alkalmazás esetén a citosztatikus kezelés után 24-72 órával már el kell kezdeni a kolónia stimuláló faktor adását. Ha a granulocytaszám normalizálódott, az adagolást fel lehet függeszteni. A G-CSF 10-12 napnál hosszabb ideig történő alkalmazása csak kivételes esetekben indokolt.
Pegfilgrastim: Az ajánlott dózis 6 mg, mely a kemoterápiát követően 24-72 órán belül alkalmazandó. A készítmény farmakológiai tulajdonságaiból következően nem kell attól tartani, hogy a granulocyta szám a kívánatosnál magasabb értéket ér el. neutropenia várható tartama általában függ a csontvelő állapotától (infiltráció), a citosztatikus kezelés dózisától, valamint attól, hogy elsődleges vagy ismételt citosztatikus kezelésről van-e szó. Azokban az esetekben, melyekben a csontvelőben megfelelő mennyiségű progenitor sejt áll rendelkezésre, a neutropenia általában 5-6 nap elteltével megszűnik. Ez a megfigyelés nem vonatkozik a nagydózisú citosztatikus kezelésekre, valamint a csontvelő átültetést követő állapotokra. A klinikai tapasztalat az, hogy amennyiben a neutropenia kolónia stimuláló faktor alkalmazása során 8-10 nap elteltével nem rendeződik, akkor vagy újabb csontvelő-infiltrációról (pl. akut leukémia), vagy a csontvelőben a megfelelő progenitorok hiányáról van szó.
2. A daganatos betegségekhez társuló anémiák okai és kezelési lehetőségei
A vérképzés folyamatában szerepet játszó stimuláló faktorok pontos megismerése és az erythropoesist stimuláló fehérjék (ESA) rekombináns technikával nagy mennyiségben történő előállítása lehetővé tette ezek biztonságos felhasználását a mindennapi gyakorlatban. Ahhoz azonban több év tapasztalatára volt szükség, hogy az alkalmazás pontos indikációit, a hatékonyságot meghatározó tényezőket jól megismerjük. A daganatos betegségekben a kemoterápia során a betegek több mint felénél alakul ki korrekciót igénylő anémia. Az anémia előfordulása nagymértékben függ a malignus betegség típusától és az alkalmazott kemoterápia fajtájától. A vérszegénység kialakulásában ezeknél a betegeknél egyszerre több tényező játszhat szerepet, leggyakrabban azonban ún. krónikus betegséghez társuló anémiáról van szó. Szolid tumorokban és hematológiai malignus betegségekben, elsősorban malignus lymphomákban a betegek 50-70%-ánál a transzfúzió elkerülhető vagy a transzfúziós igény jelentősen csökkenthető ESA alkalmazásával a kemoterápia során.
A krónikus betegségekhez társuló anémia fogalma és jellemzői
A krónikus betegségekhez társuló anémia (anemia of chronic disorders: ACD) leggyakrabban elhúzódó gyulladásos folyamathoz vagy malignus betegséghez társul, látszólag megmagyarázhatatlan ok miatt létrejött hypochrom, microcytás anémiáról van szó. A háttérben károsodott vasfelhasználás áll, melyet az alacsony szérum vas szint, alacsony vaskötő kapacitás, normális vagy magasabb ferritin szint jellemez. A kialakulás középpontjában a fertőző mikróba illetve a daganatsejtek által kiváltott fokozott makrofág-aktiváció és citokin (tumornekrózis faktor-alfa, interleukin-1, illetve hepcidin) termelés áll, melyek gátolják a vesében az eritropoetin- (Epo) termelést, illetve a vas újrahasznosítását. Ez a magyarázata annak, hogy a malignus betegségekhez társuló anémiák jelentős hányadában alacsony a szérum Epo szintje. A fokozott fagocitózis miatt a vörösvérsejtek élettartama csökken, melyet a csontvelő nem képes kompenzálni, illetve a makrofágokban vasfelhalmozódás jön létre. A kemoterápia a krónikus betegséghez társuló anémiát tovább fokozza a vérképző sejtekre kifejtett direkt károsító hatása miatt. A kemoterápia után a szérum Epo szintje ugyan átmenetileg emelkedik, majd 1 hét elteltével indokolatlanul alacsony szintre esik vissza, ami legalább 4 hétig eltart.
A kemoterápia által kiváltott anaemiák előfordulása
Citosztatikus kezelés során a kemoterápia következtében kialakult neutropenia és thrombocytopenia miatt alakulnak ki a súlyos, sokszor életet veszélyeztető klinikai tünetek, azonban az életminőség szempontjából a vérszegénység is igen figyelemre méltó és a betegek jelentős része kemoterápia után vörösvérsejt transzfúziót igényel. Gyakoribb a transzfúziós igény a kemoterápia alatt, ha idősebb a beteg, ha a kezelés előtt már anémia észlelhető, vagy az első ciklus után 10-20 g/L-rel csökken a hemoglobin szint. Ezek az anémiák általában normokrómok, normocyterek. Randomizált, prospektív vizsgálatok igazolták, hogy 150 E/kg ESA hetente háromszor alkalmazva szignifikánsan emelte a hemoglobinszintet és csökkentette a transzfúziós igényt a platinatartalmú és a platinát nem tartalmazó kezelések során is.
A hatékonyságot meghatározó tényezők
Az ESA alkalmazása költséges, ezért a kezelés megkezdése előtt a kedvező hatás valószínűségét bizonyos paraméterek meghatározásával célszerű felmérni. A kezdeti Epo szint és a reagálás közötti összefüggést a klinikai vizsgálatok nem erősítették meg. A magyarázat az lehet, hogy a kemoterápia során változik a szérum Epo szintje, tehát a kiindulási Epo érték és a reagálás mértéke között emiatt nincs szoros összefüggés. Megfelelő vaspótlás nélkül az ESA kezelés hatástalannak tűnhet.
ESA alkalmazása különböző malignus betegségekben
A forgalomban lévő rHuEpo-alfa, -béta és a darbepoetin alkalmazási lehetőségeit a gyógyszer törzskönyve tartalmazza. Általánosságban a szóba jövő szolid tumorok és vérképző szervi betegségek 70-90%-ában a transzfúziós igény lényegesen csökkenthető, illetve a betegek transzfúziómentessé válhatnak ESA alkalmazásával. Nagymértékben befolyásolja a hatékonyságot a csontvelő állapota, például a csontvelő infiltráció mértéke és az, hogy a beteg korábban részesült-e citosztatikus kezelésben. A csontvelő rezerv kapacitásának megítélésére leginkább a thrombocytaszám ajánlott: 150xG/L feletti thrombocytaszám esetén jó csontvelő működést lehet feltételezni. Fontosnak látszik a kemoterápiás kombináció típusa is, ebben az értelemben elsősorban a platina tartalmú kombinációk emelendők ki.
Az ESA alkalmazása akkor indokolt, ha tünetekkel járó, kemoterápia által kiváltott anémia van és a hemoglobin koncentráció < 100g/l. A hemoglobinszintnek legfeljebb 120g/l-ig történő emelése indokolt. Az anémia tünetei különbözőek lehetnek a beteg életkorától és a kísérő betegségektől függően. A 120g/l-t meghaladó hemoglobinértékek esetén dózis csökkentés szükséges.
ESA adagolása és dózisa
Az esetek többségében a 150 E/kg rHuEpo hetente 3 alkalommal szubkután alkalmazva hatékony. A dózist 300 E/kg-ra kell emelni 4 hét után, ha a Hb-szint még mindig <100 g/L, vagy ha a transzfúziós szükséglet megmaradt. Az utóbbi időben lehetővé vált a heti egyszeri adagolás. A darbepoetin felezési ideje lényegesen hosszabb a korábban kifejlesztett molekulákhoz képest, így ezt a készítményt heti egy alkalommal vagy 3 hetente egyszer a kemoterápiához illesztve is lehet alkalmazni. Ezen utóbbi készítmény esetén dózisemelés nem jön szóba.
Általánosságban megállapítható, hogy, amennyiben a beteg 4-8 hétig tartó ESA kezelésre nem reagál, a későbbiekben már hemoglobin emelkedésre nem lehet számítani. Fontos hangsúlyozni, hogy mindegyik készítmény alkalmazása során a fokozott erythropoesis funkcionális vashiányt eredményez, így előfordul, hogy a hatástalanság valódi oka az, hogy nem jut megfelelő mennyiségű vas az erythroid prekurzorokhoz. Vaspótlás ESA kezelés során akkor szükséges, ha a transzferrin szaturáció 20% alá csökken, vagy a perifériás vérképben >10% hipokróm vvt található.
Összegezve tehát, a kemoterápia során kialakuló anémia esetén ajánlott az ESA alkalmazása, ha a Hb 90-110 g/l. Az ajánlott dózis 150 E/kg hetente 3 alkalommal, illetve az ennek megfelelő hetente egyszeri vagy 3 hetente való adagolás legalább 4 hétig (epoetin-alfa, -béta). Az ESA kezelést célszerű a kemoterápia végét követően kb. négy hét után abbahagyni. Nem kuratív célú kemoterápiával kezelt emlő-, előrehaladott fej-nyak-, nem kissejtes tüdő- és méhnyakrákos, Illetve lymphomás betegeken az ESA-t körültekintően kell alkalmazni. Néhány tanulmányban a fenti betegcsoportokban ESA kezelés kapcsán a mortalitás emelkedését észlelték. Mindezek miatt a betegek tájékoztatása és az ESA-t alkalmazó személyzet képzése egyre nagyobb hangsúlyt kap.
Ha a beteg ellenőrzése során a hemoglobin szint meghaladja a 120 g/l-t, az adagot kb. 25-50%-kal csökkenteni kell. Az ESA kezelést átmenetileg abba kell hagyni, ha a hemoglobinszint meghaladja a 130 g/l-t . A kezelést újra lehet kezdeni 25%-kal csökkentett dózissal, ha a hemoglobin-szint 120g/l vagy az alá csökkent. Ha a hemoglobinszint emelkedése 4 hét alatt nagyobb, mint 20 g/l, az adagot 25-50%-kal csökkenteni kell.
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Ozer H, Armitage JO, Bennett CL et al. 2000 Update ofRecommendation for the Use of Hematopoietic Colony-Stimulating Factors: Evidence-Based, Clinical PracticeGuidelines. J Clin Oncol. 2000;18:3558-3585.
2. Rizzo JD, Lichtin AE, Woolf ST et al. Use of Epoetin in PatientsWith Cancer: Evidence-Based Clinical Practice Guidelines of the American Society of Clinical Oncology and the American Societyof Hematology. J Clin Oncol. 2002;20:4083-4107.
3. Hübel K, Engert A. Clinical applications of granulocyte colony-stimulating factor: an update and summary. Ann Hematol. 2003;82:207-213.
4. Bokemeyer C, Aapro MS, Courdi A et al. EORTC guidelinesfor the use of erythropoietic proteins in anaemic patients with cancer Eur J Cancer. 2004;15:2201-16.
5. Crawford J, Althaus B, Armitage J et al. Myeloid GrowthFactors. Clinical Practice Guidlines in Oncol J 2005; NCCN.
6. Smith TJ, Khatcheressian J, Lyman GH et al. 2006 update of recommendations for the use of white blood cell growth factors:an evidence based clinical practice guideline. J Clin Oncol. 2006;24:2975-7.
7. Aapro MS, Link H September 2007 update on EORTC guidelines and anemia management with erythropoiesis-stimulating agents. Oncologist 2008 13,33-36.
8. NCCN Myloid Growht Factors Guideline Panel: Myeloid growth factors v.1.2010. http://www.nccn.org/professionals/physician_gls/PDF/myeloid_growth.pdf)
9. NCCN Cancer- and Chemotherapy-induced anemia panel: Cancer- and Chemotherapy-induced anemia v1.2011. (http://www.nccn.org/professionals/physician_gls/PDF/anemia.pdf).
A THROMBOCYTA TRANSZFÚZIÓ MÓDSZERTANA
I. Alapvető megfontolások
1. Indikációk
Terápiás pótlás: Thrombocytopeniához vagy thrombocyta funkciózavarhoz társuló vérzések ("nedves purpura" vagy belszervi vérzés).
Preventív pótlás: (1) "Kritikus" thrombocytaszám (1. táblázat); (2) Thrombocyta funkciózavarban szenvedő beteg műtéti beavatkozása.
1. táblázat.
Kritikus thrombocytaszám, preventív thrombocyta transzfúzió javasolható*
| thrombocyta | |
| szám | |
| Láztalan, stabil beteg, ha: | < 5-10 G/l |
| Társuló láz, sepsis, DIC, súlyos anaemia, extrém leukocytosis, fokozódó thrombocytopenia, szemfenéki vérzés, ha: | < 20 G/l |
| Lumbalpunctio, intrathecalis gyógyszerbeadás vékony tű (27 G) alkalmazása esetén, ha: | < 30 G/l |
| Műtétek, invazív diagnosztikus beavatkozások (kivéve: sternum punctio, crista biopszia), ha: | < 50 G/l |
| Idegsebészeti, szemészeti műtétek, polytraumatizált betegek, ha: | < 100 G/l |
Kontraindikációk
Thrombocytapótlás általában kontraindikált
- TTP (thrombotikus thrombocytopeniás purpura)
- HIT (heparin indukálta thrombocytopenia)
A preventív thrombocytapótlás általában nem indikált
- ITP (autoimmun thrombocytopenia)
- PTP (poszt-transzfúziós purpura)
- Thrombocyta funkciózavar
- Thrombocyta transzfúziós refrakter állapot
Fenti indikációkban is megkísérelhető thrombocyta pótlás életet veszélyeztető vérzés esetén, szoros obszerváció mellett, PTP és refrakter állapot esetén, lehetőleg thrombocyta és HLA antigénekre nézve választott thrombocyta készítménnyel.
2. Thrombocyta készítmények
Poolozott készítmények
- Standard, poolozott készítmény: A rutin véradás során levett "teljes vérből" állítják elő, hazánkban "buffy coat" módszerrel. A standard 1 E-s előállítást az utóbbi években felváltotta a 4-5 E-es poolozott buffy coatból történő szeparálás, mely magasabb thrombocyta (0,6-0,8x10 11 thr/E), alacsonyabb fehérvérsejt számmal (107fvs/E) és végtérfogattal (40-50 ml/E) jár. Mivel a thrombocytát additív oldatban reszuszpendálják, mely a thrombocyta élettartam és funkció tárolás alatti jobb megőrzését biztosítja, csökken a készítmény plazma tartalma (15-20 %) is. Az alacsony plazma tartalom mérsékli a plazma okozta mellékhatások gyakoriságát. A rutin klinikai gyakorlatban ez a választandó standard készítmény.
- Szűrt, (fehérvérsejt-mentesített) poolozott készítmény: A gyártástechnológia módosításának talán legfőbb haszna, hogy lehetővé tette a poolozott thrombocyta készítmény tárolási periódus előtti fehérvérsejt-mentesítését (indikációját lásd később, ill. a 2.táblázatban), mely különösen az exogén cytokin típusú nem haemolytikus lázas transzfúziós reakció (a készítményben a fehérvérsejtek által a tárolás során in vitro termelt cytokin következménye) gyakoriságát csökkentheti, valamint általában javítja a fehérvérsejt-mentesítés hatékonyságát. Elterjedése jelentősen visszaszorította az apheresises készítmény alkalmazását. Az onkohaematológiai, neonatológiai, valamint tartósan thrombocyta készítményre szoruló betegek részére választandó standard készítmény.
Apheresissel előállított, "egyedi" készítmények
Vérsejtszeparátor segítségével, egy donor véréből szeparált készítmény. Csökkenti a donor expozíciót, de az a korábbi feltételezés, hogy alkalmazása esetén kisebb az immunizáció veszélye, kérdéses. Elsősorban választott készítményt igénylő betegeknél alkalmazandó. Thrombocyta tartalma 2-6x1011/készítmény, kötelezően fehérvérsejt-mentes.
- Szűrt minőségű, apheresises készítmény: a fehérvérsejt-mentes minőséget az apheresis készülék közvetlenül állítja elő.
- Szűrt (fehérvérsejt-mentesített), apheresises készítmény: a fehérvérsejt-mentes minőséget utólagos szűréssel (filtrációval) érik el. Ez napjainkban már alig fordul el.
Szűrt (fehérvérsejt-mentes) készítmények
A fehérvérsejt-mentesítés célja a fehérvérsejt-asszociált szövődmények kivédése. A megengedett maximális fehérvérsejt tartalom < 1x106/készítmény. Poolozott készítmény esetében ez csak szűréssel (filtrációval) érhető el, melyet jelenleg a klinikus kérése esetén végeznek el. Az apheresis készítmények többsége eleve ilyen tisztaságú, ha nem: utólag fehérvérsejt-mentesítik, melyet jogszabály ír elő. A bizonyított indikációkat a 2.táblázatban foglaltuk össze. A készítmények fehérvérsejt-tartalma és a transzfúziót követő immunmoduláció - posztoperatív infekció, tumor recidíva, endogén vírus reaktiváció, vörösvérsejt elleni alloimmunizáció, reperfúziós károsodás - közötti összefüggést illetően az irodalmi adatok ellentmondóak. Számos országban teljes körű fehérvérsejt-mentesítést vezettek be, melynek költséghatékonysága jelenleg nem egyértelmű. Közegcserélt (plazma-mentesített) készítmények
Közegcsere során centrifugálást követően a teljes plazma mennyiséget eltávolítják a készítményből, majd a thrombocytát fiziológiás sóoldatban vagy thrombocyta additív oldatban reszuszpendálják. Ezt követően a készítmény már nem tárolható, ezért közvetlen felhasználás előtt kell készíteni. Poolozott és apheresissel előállított készítmények esetében egyaránt alkalmazható eljárás. Az indikációkat a 3.táblázatban foglaltuk össze.
Besugárzott készítmények
A besugárzás célja a készítményben lévő donor eredetű immunkompetens sejtek proliferációjának irreverzibilis gátlása, a graft-versus-host reakció (GVHD) megelőzése. Ez gamma irradiációval érhető el. Csak e célra kifejlesztett, speciális berendezést szabad erre használni. Ajánlott minimális dózis: 35 Gy. Az indikációkat lásd a 4. táblázatban.
CMV "biztonságos" készítmények
CMV átvitel megelőzésére CMV negatív donortól származó (anti-CMV-IgG és IgM negatív, a vírusvizsgálat érvényességi ideje 8 nap, azonos a hepatitis és HIV vírusok vizsgálatának érvényességi idejével), mely nehezen biztosítható vagy fehérvérsejtmentesített (fvs <1x106/készítmény) készítményt alkalmazhatunk, a kettő egyenértékű. Az indikációit lásd a 2. táblázatban.
2. táblázat. Fehérvérsejt-mentesítés (fvs <1x106 / készítmény) indikációi:
NHLTR - nem haemolytikus, lázas transzfúziós reakció megelőzése
- Két egymást követő alkalommal fellépő NHLTR sejtkészítmény (vörösvérsejt, thrombocyta vagy fehérvérsejt készítmények) adását követően.
Primer HLA immunizálódás megelőzése
- Tartósan thrombocyta készítményre szoruló betegek
- HLA antitest miatt választott thrombocyta készítményre szoruló betegek CMV átvitel megelőzése
- CMV szeronegatív, szerv vagy őssejt-transzplantációra váró vagy transzplantált betegek, ha a szerv vagy őssejt donor is CMV szeronegatív.
- CMV szeronegatív, őssejtet vagy élő szervet (pl, vese) adó donorok.
- CMV szeronegatív, malignus betegség miatt nagy dózisú kemoterápiában részesülő betegek.
- CMV negatív splenectomizált betegek.
- CMV negatív HIV fertőzött betegek.
- CMV negatív terhesek.
- CMV negatív anyától született koraszülöttek.
- CMV negatív anyától született újszülöttek vércseréje.
- Magzat (intrauterin transzfúzió), függetlenül az anya CMV szerostátuszától.
3. táblázat. Közegcsere (plazmamentesítés) indikációi:
Anamnesisben szereplő anaphylaxia vagy súlyos, ismétlődő allergiás reakció transzfúziót követően ABO nem azonos (ABO kompatibilis vagy ABO inkompatibilis) thrombocyta készítmények alkalmazása Ismert IgA hiányos beteg transzfúziója_
4. táblázat. Besugárzás (gamma irradiáció) indikációi:
Potenciális őssejt-transzplantációs recipiens
Őssejt-transzplantált betegek
Szív-, tüdő- és májtranszplantáció
Veleszületett vagy szerzett súlyos cellularis immundeficiencia
Intrauterin transzfúzió
Koraszülöttek
Egyenes ági vérrokontól származó vérkészítmény alkalmazása
HLA kompatibilis vérkészítmény alkalmazása
Fagyasztott-felolvasztott készítmények
Sürgősségi tartalék képzés céljából történik a fagyasztás a vérellátó transzfuziológusának javaslatára. Egyéb készítmény hiányában alkalmazható. A feldolgozási veszteség miatt általában nagyobb dózis alkalmazása szükséges.
Választott készítmény
Thrombocyta szerológiai kivizsgálás (indikációit lásd az 5. táblázatban) pozitivitása esetén (HLA- és/vagy thrombocyta-ellenes antitest miatt) a beteg számára választott készítmény biztosítható. Ilyenkor a kompatibilitási vizsgálatot a potenciális donorokkal végzik el, és készítményt csak az alkalmasnak ítélt donortól állítanak elő, apheresissel. A donor kiválasztása történhet:
- Keresztpróbával (hazánkban végzett módszer) szükség esetén thrombocyta antigén vizsgálattal kiegészítve
- HLA-A,B kompatibilis vagy identikus donor kereséssel
- fenti 2 módszer kombinálásával (ez a leghatékonyabb)
Immunizált beteg apheresises készítményt csak választott donortól kaphat, ha ilyen nem áll rendelkezésre, akkor a beteg kizárólag poolozott készítménnyel transzfundálható.
5. táblázat. Thrombocyta szerológiai kivizsgálás indikációi:
Ismételt NHLTR-k az anamnézisben sejtes készítmény adását követően.
Egymást követő két alkalommal a thrombocyta increment elmaradása, a nem immunológiai okok kizárhatósága esetén.
Szerv vagy őssejt-transzplantációra váró betegek, ha az alloimmunizációs anamnesis pozitív (korábbi transzfúziók vagy terhesség az anamnézisben).
Tartós thrombocyta szubsztitúcióra szoruló betegek, ha az alloimmunizációs anamnesis pozitív (korábbi transzfúziók vagy terhesség az anamnézisben).
PTP alkalmával
Neonatális thrombocytopenia esetén (a vizsgálathoz az anya savója és apai thrombocyta szükséges)
Gyógyszer indukálta thrombocytopenia
VÉRCSOPORTKOMPATIBILITÁS
ABO
A rutin klinikai gyakorlatban ABO azonos, vagy ABO kompatibilis készítmény alkalmazandó. Az ABO kompatibilis készítményt beadás előtt plazma mentesíteni kell. Életveszély esetén ABO inkompatibilis készítmény (közegcserélt formában) is alkalmazható (ez esetben a mintegy 25% hatékonyság-csökkenést figyelembe kell venni), ha egyéb készítmény nem áll rendelkezésre, transzfuziológussal történt konzultáció alapján.
RhD
Férfiaknál vagy gesztációs koron túli nőknél az RhD csoportot nem kell figyelembe venni. Szülőképes korú, RhD negatív nőknél Rh negatív készítmény alkalmazandó, ennek hiányában az RhD pozitív készítmény beadását követően anti-D IgG prophylaxis adandó. Az indikáció felállítása és az injekció beadása során figyelemmel kell lenni az intramusculáris alkalmazás lehetséges szövődményére. Javasolt dózis: 50 ug véregységekként, 10 E thrombocyta felett 500 ug.
3. Thrombocyta dózis
Standard
- Poolozott készítmény: 4 E/70 kg (1 E: kb. 0,6-0,8x1011 thr)
- Apheresises készítmény: 0,5x10 11 thr/10 kg
Alacsony
Az utóbbi időben nem csak a transzfúziós küszöb, de a transzfúzió során adott thrombocyta mennyiség is csökkenő tendenciát mutat. Egy több mint ezer onko-hematológiai beteget magába foglaló klinikai vizsgálatban(4), 10 G/l alatti thrombocytaszám esetén, preventív céllal adott thrombocyta transzfúziós során 1,1x10 11 thr/m2 (1,9x10 11 thr/transzfúzió 1,73 m2 testfelület esetén) és 4,4x1011 thr/m2 (7,6x1011 thr/transzfúzió 1,73 m2 testfelület esetén) közötti thrombocyta dózis tartományban a transzfundált thrombocytaszám és a vérzés között nem találtak összefüggést. Ez a preventív céllal adott alacsony dózisú thrombocyta transzfúzió klinikai biztonságát támasztja alá. Ezen adatok alapján, egy apheresises készítmény, a thrombocyta tartalomtól függően, osztott formában a beteg 2 egymást követő transzfúziójához is elegendő lehet.
Emelt
Fokozott thrombocyta pusztulással járó állapotokban (sepsis, DIC), splenomegaliában, fagyasztott készítmény alkalmazásakor a standard dózis másfél-kétszerese alkalmazandó terápiás indikáció esetén.
THROMBOCYTA TERÁPIA HATÉKONYSÁGÁNAK MEGÍTÉLÉSE
A klinikai tünetek megfigyelése mellett a thrombocytaszám 24 órán belüli ellenőrzése kötelező. Amennyiben jelentős thr-szám emelkedés nem észlelhető, increment számítást (CCI) kell végezni, melynek képlete az alábbi:

Mintaszámítás (példa):
- Poolozott készítmény 4 E poolozott buffy coatból előállítva, thrombocyta tartalom kb. 2,8x10" (1 E átlagos thrombocyta tartalma - számított statisztikai átlag - 0.7x10 11.)
Beteg thrombocyta-száma transzfúzió előtt: 10 G/l Beteg thrombocyta-száma transzfúzió után : 40 G/l Beteg testfelülete 1.8 m2 CCI poolozott = [(40-10)x1.8] / 4 = [30x1,8] / 4 = 13,5 (>5.0, jó increment!)
- Apheresiskészítmény,thrombocyta tartalom 3.6x10" (automata sejtszámlálóval meghatározott, mért érték!).
Beteg thrombocyta-száma transzfúzió előtt: 10 G/l
Beteg thrombocyta-száma transzfúzió után : 40 G/l Beteg testfelülete 1.8 m2
CCIpoolozott = [(40-10)x1.8] / 3,6 = [30x1,8] / 3,6 = 15.0 (>7.5, jó increment!)
THROMBOCYTA REFRAKTER ÁLLAPOT OKAI Immunológiai okok
- Thrombocyta specifikus antitest
- HLA specifikus antitest
- ABO major inkompatibilitás
- Infekciókhoz társuló, vírus, baktérium, parazita ellenes, a thrombocyta antigénekkel keresztreagáló antitestek
Nem immunológiai okok
- Splenomegalia
- Sepsis
- DIC
- Láz
- Gyógyszerek (Amphotericin B, antibiotikumok.. )
- Masszív vérzés
THROMBOCYTA REFRAKTER ÁLLAPOT KEZELÉSE
- A thrombocyta refrakter állapotot okozó nem immunológiai okok tisztázása, ill. kezelése, ha lehetséges.
- Thrombocyta szerológiai kivizsgálás elvégzése. Pozitivitása esetén szűrt vagy szűrt minőségű, választott (apheresises) készítmény alkalmazandó. Közel 100%-os HLA panel reaktivitás, vagy nagy gyakoriságú thrombocyta-specifikus antitest esetén, ha HLA identikus, ill. a kérdéses thrombocyta antigénre nézve negatív készítmény nem biztosítható, poolozott készítmény javasolt, ismétlődő NHLTR esetén, szűrve.
- ABO azonos vagy ABO kompatibilis készítmény alkalmazása.
- A preventív indikációjú thrombocyta transzfúzió kerülése.
- Terápiás indikáció esetén a legrövidebb ideig tárolt (friss) készítmény alkalmazása.
- Terápiás indikáció esetén a thrombocyta dózis növelése.
- A beteg haematokritjának 30% fölé emelése (újabban vitatják).
THROMBOCYTA TRANSZFÚZIÓ SZÖVŐDMÉNYEI
- NHLTR (nem haemolytikus lázas transzfúziós reakció)
- Alloimmunizáció (vörösvérsejt, HLA, thrombocyta antigének ellen)
- Allergiás, anaphylaxiás reakció
- PTP (poszt-transzfúziós purpura)
- TRALI (transfusion related acute lung injury)
- Poszt-transzfúziós GVHD (graft versus host disease)
- Infekcióátvitel
- Thrombocyta refrakter állapot kialakulása
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. British Council of Standardisation Hematology (BCSH): Guidelines for Platelet Transfusion. Transfusion Medicine, 1992; 2: 311.
2. Sherrill J. Slichter: Evidence-Based Platelet Transfusion Guidelines. ASH, 2007;172-178
3. Transzfúziós Szabályzat, 2. kiadás. 2008.
4. Slichter SJ, Kaufman RM, Assmann SF, McCullough J, Triulzi DJ, Strauss RG, Gernsheimer TB, Ness PM, Brecher ME, Josephson CD, Konkle BA, Woodson RD, Ortel TL, Hillyer CD, Skerrett DL, McCrae KR, Sloan SR, Uhl L, George JN, Aquino VM, Manno CS, McFarland JG, Hess JR, Leissinger C, Granger S: Dose of prophylactic platelet transfusions and prevention of hemorrhage. N Engl J Med. 2010;362(7):600-13.
5. Schrezenmeier H, Höchsmann B, Wiesneth M: How do we treat? Clinical haemotherapy: platelet transfusion, ISBT Science Series 2010;5 107-113
6. U.J.H. Sachs. Side-effects of blood products, ISBT Science Series 2010;5 267-273
7. Lozano M, Heddlel N, Williamson L.M, Wang G, AuBuchon J.P, Dumont L.J: Practices associated with ABO-incompatible platelet transfusions: a BEST (Biomedical Excellence for Safer Transfusion) Collaborative international survey, Transfusion 2010;50 1743-1748
KEMOTERÁPIA OKOZTA HÁNYÁS MEGELŐZÉSE ÉS KEZELÉSE FELNŐTT ONKOHEMATOLÓGIAI BETEGEKBEN
I. Alapvető megfontolások
Kemoterápia indukálta hányásról akkor beszélünk, ha a hányás a citosztatikum alkalmazását követően 24 órán vagy néhány napon belül fellép és egyéb kiváltó tényezők (pl. alapbetegség okozta komplikációk: meningeális infiltráció, gasztrointesztinális elzáródás stb., vagy metabolikus okok: magas szérum kálcium szint stb.) kizárhatók. Megkülönböztetünk akut, késleltetett és anticipációs (tanult válaszreakción alapuló) hányást.
A kemoterápia indukálta hányás kialakulásának mechanizmusa
A citotoxikus szerek elsősorban az aktívan osztódó sejteken hatnak. A bélrendszer enterokromaffin sejtjeiben létrehozott morfológiai változás és következményes szerotonin release indítja el a hányinger, hányás folyamatát, részben a nervus vagus, részben a kemoreceptor trigger zóna (KTZ) receptorain keresztül. Kemoterápia indukálta hányás esetében az afferentációk a KTZ-ból, az agykéregből, a pharynxból és a gasztrointesztinális rendszerből a hányásközpontba jutnak. A gyomor-bélrendszer a nucleus tractus solitariuson keresztül kapcsolódik a hányásközponthoz, az afferens rostok egy része a KTZ-ban végződik. A KTZ a IV. agykamrához közeli area postremában található, így mind a cerebrospinális folyadékkal, mind a szisztémás vérkeringéssel kapcsolatba kerülhet. A KTZ számos neurotranszmitter anyag (dopamin, acetilkolin, hisztamin és szerotonin) elválasztásáért felelős. Ezek receptorai megtalálhatók mind a gasztrointesztinális rendszerben, mind a KTZ-ben, mind a a hányásközpontban. A kemoterápiás szerek és azok metabolitjai aktiválják ezeket a receptorokat, és létrehozva ezzel a kemoterápia indukálta hányingert/hányást. Hányás akkor lép fel, ha a központból efferens impulzusok jutnak a nyálelválasztás, a hasizmok, a légzőközpont és a különböző agyidegek felé.
II. Diagnózis
1. AKUT HÁNYÁS
Az akut hányás definíciója:
A kemoterápia alkalmazását követően 24 órán belül kezdődik, elsősorban szerotonin mediálta folyamat, mely gyakran igen súlyos, de jól reagál szokásos antiemetikumokra.
Az akut hányás rizikó faktorai:
1.a hányás kialakulása függ a beteg tulajdonságaitól
a fiatal életkor, a női nem, az alacsony alkohol fogyasztás, a korábbi terhességi hányás, az előzetes kezelések negatív tapasztalata, az ideges, feszült alkat - hajlamosító tényezők; a rendszeres, kis mennyiségű alkoholfogyasztás, a korábbi kemoterápiás tapasztalat pedig rizikó csökkentő;
2.az alkalmazott citosztatikum tulajdonságaitól
a citosztatikumok emetogén potenciálja (1. sz. táblázat, mindhárom érvényes nemzetközi ajánlásban hasonló), dózisa, alkalmazási módja (ugyanazon dózis folyamatos infúzióban alkalmazva kevésbé emetogén, mint bólusban) ugyancsak befolyásolja a hányinger, hányás kialakulását.
| 1. táblázat. Az intravénás kemoterápiás szerek emetogén potenciálja.(NCCN 2011.) | |
| Nagy rizikó (a hányás rizikója >90% - antiemetikumok alkalmazása nélkül): | |
| Carmustin >250 mg/m2 | Ifoszfamid >10 mg/m2 |
| Cisplatin | >50 mg/m2 Lomustin |
| Cyclophosphamid >1.500 mg/m2 | Mechlorethamin |
| Dacarbazin | Pentostatin |
| Doxorubicin >60 mg/m2 | Streptozotocin |
| Epirubicin >90 mg/m2 | |
| Közepes rizikó (a hányás rizikója 30%-90% | - antiemetikumok alkalmazása nélkül): |
| Aldesleukin > 12-15 M IU/m2 | Dactinomycin |
| Altretamin | Daunorubicin |
| Amifostin >300 mg/m2 | Doxorubicin <60 mg/ m2 |
| Arzén trioxid | Epirubicin <90 mg/ m2 |
| Azacitidin | Idarubicin |
| Bendamustin | Ifosfamid <10 mg/ m2Oxaliplatin |
| Busulfan | Irinotecan |
| Carboplatin | Interferon-alfa > 10M IU/m2 |
| Carmustin <250 mg/ m2 | Melphalan |
| Cisplatin <50 mg/ m2 | Methotrexat |
| Clofarabin | Oxaliplatin |
| Cyclophosphamid <1.500 mg/ m2 | Temozolomid |
| Cytarabin >200 mg/ m2 | Mitoxantron (>12 mg/ m2) |
| Kis rizikó (a hányás rizikója 10%-30% - antiemetikumok alkalmazása nélkül) | |
| Amifostin < 300 mg/m2 | Methotrexat (50-250 mg/ m2) |
| Aldesleukin < 12-15 M IU/m2 | Mitomycin |
| Cytarabin (100-200 mg/ m2) | Mitoxantron (<12 mg/ m2) |
| Docetaxel | Paclitaxel |
| Doxorubicin (liposomalis) | Pemetrexed |
| Etoposid | Pentostatin |
| 5-Fluorouracil | Pralatrexate |
| Floxuridin | Ronidepsin |
| Gemcitabin | Thiotepa |
| Interferon alfa 5-10 M IU/m2 | Topotecan |
| Minimális rizikó (a hányás rizikója <10% - antiemetikumok alkalmazása nélkül) | |
| Alemtuzumab | Interferon alfa < 5 M IU/m2 |
| Asparaginase | Methotrexat < 50 mg/ m2 |
| Bevacizumab | Nelarabin |
| Bleomycin | Pegasparaginase |
| Bortezomib | Rituximab |
| Cetuximab | Temsirolimus |
| Cladribin | Methotrexat (<100 mg/ m2) |
| Cytarabin (<100 mg/ m2) | Trastuzumab |
| Decitabin | Vinblastin |
| Denileukin | Vincristin |
| Dexrazoxran | Vinorelbin |
| Fludarabin | |
| 2. táblázat. A per os kemoterápiás szerek emetogén potenciálja (NCCN 2011.) | |
| Nagy és közepes rizikó: | |
| Altretamin | Lomustin |
| Busulfan > 4 mg/nap | Procarbazin |
| Cyclophosphamid > 100 mg/m2/nap | Temozolomid > 75 mg/m2/nap |
| Estramustin | |
| Kis és minimális rizikó | |
| Bexaroten | Imatinib |
| Busulfan < 4 mg/nap | Lenalidomid |
| Capecitabin | Melphalan |
| Chlorambucil | Mercaptopurin |
| Cyclophosphamid < 100 mg/m2/nap | Methotrexat I |
| Dasatinib | Nilotinib |
| Erlotinib | Sorafenib |
| Etoposid | Sunitinib |
| Everolimus | Temozolomid < 75 mg/m2/nap |
| Fludarabin | Thalidomid |
| Gefitinib | 6-Thioguanin |
| Hydroxyurea | Topotecan |
| Vorinostat | |
Az eredeti ajánlásban még közepes rizikójú csoportban szerepelt a per os etoposid, miközben vénás készítménye az alacsony rizikójúban. Einhorn 2006-ban megjelent közleményében vizsgálta a per os alkalmazott etoposid emetogén potenciálját, és tanulmányában alacsony emetogén potenciált igazolt, megegyezően a vénás alkalmazással, ezért mi ennek a közleménynek megfelelően módosítottuk a per os etoposid rizikó csoportját.
III. Kezelés
A) ANTIEMETIKUMOK (magas terápiás index)
A.1. Szerotonin receptor antagonisták
Igen hatékony hányáscsillapítók. Nincs kedvezőtlen antidopaminerg mellékhatásuk.
Képviselőik az ondansetron, a tropisetron és a granisetron a hazai gyógyszerpiacon való megjelenés sorrendjében, és az újabb készítmények a dolasetron és a palonosetron. Receptor kötődésüket illetően vannak különbségek az egyes készítmények között. Alig rendelkeznek mellékhatásokkal, ezek közül a legfontosabbak: a fejfájás, az enyhe transzamináz emelkedés és a székrekedés. Del Giglio 14 granisetront az ondansetronnal összehasonlító randomizált, kontrollált vizsgálat meta-analízise során a két szert egyformán hatékonynak találta a kemoterápia indukálta hányinger és hányás kivédésében 6467 értékelhető betegben. A Cancer Care Ontario 12 randomizált kontrollált vizsgálat meta-analízise során az ondansetron, a dolasetron és a granisetron hatékonyságát találta egyformának. Mások összehasonlították a palonosetron és az ondansetron egyszeri intravénás alkalmazásának hatékonyságát is ciszplatin kezelés kapcsán kettős vak, kontrollált vizsgálatban. A 667 bevont beteg kétharmada kortikosteroidot is kapott, a vizsgálatban a palonosetron és az ondansetron egyformán hatékonynak bizonyult. A palonosetron szerepére vonatkozó megállapítások nem egységesek a három említett ajánlásban.
Ekvivalencia: Ekvivalens dózisban alkalmazva, a szerotonin receptor antagonisták egyformán hatékonynak és biztonságosnak bizonyultak, egymással kicserélhetők az elérhetőség és a költségek figyelembe vételével.
Evidencia szint: I. A szintű ajánlás
Gyógyszerdózisok: Az alkalmazási előírásoknak megfelelően választhatók meg. Számos tanulmány vizsgálta a készítmények dozírozását. Minden készítmény esetében a legalacsonyabb, teljes effektivitást okozó dózis ajánlható. Úgy tűnik, hogy a szerotonin receptorok antagonizálásában létezik egy határ, mely fölé hiába emeljük a gyógyszerdózist, nem lehetséges további hatást elérni. Ezen a szinten a szerotonin receptorok telítetté válnak.
Evidencia szint: I. A szintű ajánlás
Ondansetron
Az Antivom 4 és 8 mg-os filmtabletta, az Emetron 4 és 8 mg-os filmtabletta, valamint 2 mg/ml oldatos injekció, az Ondagen 4 és 8 mg-os filmtabletta, valamint 2 mg/ml oldatos injekció, az Ondansetron "Ebewe" 4 és 8 mg-os filmtabletta, az Ondansetron Kabi 2 mg/ml oldatos injekció, az Ondansetron Pliva 8 mg-os filmtabletta, valamint 2 mg/ml oldatos injekció, az Ondansetron Sandoz
4 és 8 mg-os filmtabletta, valamint 2 mg/ml oldatos injekció, a Zofran 4 mg és 8 mg-os filmtabletta, 2 mg/ml oldatos injekció, valamint 16 mg-os végbélkúp formában áll rendelkezésre. Így az alkalmazás módja és az adag rugalmasan, egyénre szabottan határozható meg.
Az adagolás a citosztatikus kezelés emetogén potenciáljától függ. A napi adag általában minimum 8 mg, szükség esetén legfeljebb 32 mg az alábbi szempontok szerint:
1.Emetogén kemo- és radioterápia esetén:
Oldatos injekció: 8 mg lassú iv. vagy im. injekcióban közvetlenül a kemoterápia előtt,
Filmtabletta: 8 mg per os 1-2 órával a kemoterápia megkezdése előtt, majd 12 óra múlva újabb 8 mg,
Végbélkúp: 1 végbélkúp (16 mg) 1-2 órával a kemoterápia megkezdése előtt.
2.Erősen emetogén kemoterápia esetén:
Oldatos injekció: 8 mg egyszeri adag lassú iv. vagy im. injekcióban közvetlenül a kezelés megkezdése előtt. 8 mg-nál nagyobb, legfeljebb 32 mg-os egyszeri adag csak iv. infúzióban adható (50-100 ml megfelelő infúziós oldatban). Az infúzió időtartama legfeljebb 15 perc legyen.
További lehetőségként: 8 mg lassú iv. vagy im. injekcióban közvetlenül a kemoterápia előtt, majd 2 további 8 mg-os adag iv. vagy im. 2-4 órás időközökben vagy folyamatos 1 mg/órás sebességű 24 órás infúzió, vagy 1 végbélkúp (16 mg) 1-2 órával a kemoterápia megkezdése előtt.
Erősen emetogén kemoterápia esetén az ondansetron hatékonysága növelhető 20 mg dexametazon nátrium-foszfát egyszeri intravénás alkalmazásával a kemoterápia megkezdése előtt.
Filmtabletta: Az ajánlott per os dózis 24 mg 1-2 órával a kezelés megkezdése előtt, 12 mg dexametazon nátrium-foszfáttal együtt bevéve.
Granisetron
A Granegis 1 és 2 mg-os filmtabletta, a Granigen 1 mg-os filmtabletta, a Granisetron Kabi 1 mg/ml injekció, a Kytril pedig 1 mg-os filmtabletta és 3 mg/3 ml injekció formájában elérhető.
Injekció: Javasolt adagolása a citosztatikus terápia megkezdése előtt 1-3 mg, melyet 15 ml-es lassú iv. injekcióként minimum 30 másodperc alatt kell beadni, vagy kompatibilis infúziós oldatban 20-50 ml-re hígítva 5 percen át kell beadni. Szükség esetén az első 24 órában maximum 2 alkalommal további 3 mg adható. A napi adag nem haladhatja meg a 9 mg-ot. A kezelés
5 egymást követő napon ismételhető.
A nemzetközi guideline-ok a granisetron intravénás dózisát 1 mg-ban vagy 0.01 mg/kg-ban határozzák meg. Per os alkalmazás: naponta 2 mg (2x1, vagy 1x 2 mg) per os maximum 1 hétig.
Tropisetron
A Navoban 5 mg-os kemény kapszula és 5 mg/5 ml oldatos injekció vagy infúzió formájában elérhető.
6 napos kezelés javasolt. Első napon a kemoterápia megkezdése előtt 5 mg iv. infúzióban vagy lassú, minimum 1 perces iv. injekcióban. Második naptól 5 napon keresztül per os kezelés javasolt, napi 1x5 mg tropisetron reggel, étkezés előtt legalább 1 órával.
Dolasetron
Hazánkban nincs törzskönyvezett készítmény. Dózisa 100 mg vagy 1.8 mg/kg intravénásan vagy 100 mg per os naponta. Az Amerikai Gyógyszerhatóság (FDA) 2010. december 17-ei közleményében felfüggeszti a dolasetron mesylat alkalmazhatóságát a kemoterápia indukálta hányinger és hányás megelőzésére, mivel az arrhythmiákat provokálhat!! A legújabb információk alapján a dolasteron fokozza a potenciálisan halálos torsade de pointes kialakulásának rizikóját, valamint dózisfüggő módon megnyújtja az EKG-n a QT, a PR, és a QRS időtartamokat.
Palonosetron
Hazánkban nincs törzskönyvezett készítmény. A palonosetron kb. 5x hosszabb féléletidővel és nagyobb receptor kötő affinitással rendelkezik, mint az osztályába tartozó többi szer. Az elhúzódó hányás kezelésében a leghatékonyabbnak bizonyult az 5-HT3 antagonisták közül. 0.25 mg a javasolt dózisa intravénásan 30 perccel a kemoterápia megkezdése előtt, vagy per os 1x 0.5 mg-os kapszula 1 órával a kemoterápia megkezdése előtt.
Egyszeri vagy többszöri alkalmazás: Egyszeri dózisok alkalmazása javasolt, ez hatékony, kényelmes és költség kímélő.
Evidencia szint: I. A szintű ajánlás
Alkalmazási mód: Valamennyi készítmény esetében rendelkezésünkre állnak a farmakológiai vizsgálatok eredményei, melyek alapján a per os készítményeket jól felszívódónak tekintjük, biológiai elérhetőségük 50-80%. Mivel 5-HT3 receptorok a bélrendszer enterokromaffin sejtjeiben is találhatók, ezért különösen előnyös lehet a per os alkalmazás. Mind erősen, mind közepesen emetogén kemoterápia esetében 2 mg per os granisetron hatékonysága megegyezett 32 mg intravénás ondansetronéval. Az ondansetron, a tropisetron és a dolasetron (!) esetében is ismert, hogy per os alkalmazva igen hatékonyak.
Biológiailag ekvivalens dózisban alkalmazva a per os készítmények ugyanolyan hatékonyak és biztonságosak, mint az intravénás antiemetikumok. A legtöbb vizsgálatban a per os készítményeket kényelmesebbnek és költséghatékonyabbnak találták.
Evidencia szint: I. A szintű ajánlás
A.2. Kortikosteroidok
Ekvivalencia: A legtöbbet tanulmányozott kortikosteroidok a dexamethason és a methylprednisolon.
Hatékonyságukat számos tanulmány bizonyította, de nem rendelkezünk valódi összehasonlító vizsgálati eredményekkel. A per os és intravénás készítményformákra vonatkozó összehasonlítások is hiányoznak.
Ekvivalens dózisban alkalmazva a kortikosteroidok hatékonysága és biztonságossága megegyezik és egymással kicserélhetők.
Evidencia szint: IV. C szintű ajánlás
Gyógyszerdózisok és alkalmazási terv: Itt már rendelkezünk összehasonlító vizsgálati eredményekkel, egyszeri dózisok alkalmazása ugyanolyan hatékony, mint a többszöri dózisoké. Nem hatékonyabbak abban az esetben, ha a kemoterápia megkezdése előtt 1 nappal megkezdik alkalmazásukat. Nincs arra vonatkozó adat, hogy dexamethason esetében a 20 mg-ot meghaladó dózis eredményesebb lenne. Mellékhatásaik egyszeri dózisban nem jelentősek, de a szénhidrát háztartás zavarai és alvászavarok előfordulhatnak. Egyszeri dózisok javasoltak.
Evidencia szint: II. B szintű ajánlás
Dexamethason
Dexa-ratiopharm 4 mg/ml oldatos injekció, a tablettás formák hazánkban forgalombahozatali engedéllyel nem rendelkeznek. Egyedi importra rendelhetők.
Javasolt dózis akut hányás megelőzésére: erősen emetogén kemoterápia esetén 20 mg iv. (aprepitanttal együtt adva 12 mg, mivel a dexamethason szenzitív szubsztrátja a CYP3A4 enzimnek), közepesen emetogén kemoterápia esetén 8 mg.
| 3. táblázat. A dexamethason dózisa emetogén rizikók és különböző hányás típusok esetében: | ||
| Rizikó mértéke | Hányás típusa | Dexamethason dózis, alkalmazási mód |
| Nagy rizikó | Akut hányás Késleltetett hányás | 1x20 mg/nap (aprepitant esetében 1x 12 mg) 2x 8 mg/nap 3-4 napon át |
| Közepes rizikó | Akut hányás Késleltetett hányás | 1x8 mg/nap 1x 8 mg/nap 2-3 napon át |
| Kis rizikó | Akut hányás | 1x 4-8 mg/nap |
A.3. Neurokinin-1 receptor antagonisták:
A neurokinin-1 (NK1) neurotransmitter receptor a regulátor peptid P anyag kötőhelye. A P anyag mind szisztémás, mind pedig intracerebralis adagolás mellett képes akut és késleltetett hányást létrehozni. NK1 receptorok a centrális és a perifériás idegrendszerben egyaránt megtalálhatók, jelen vannak az idegsejteken, az endothel sejteken, különböző immunsejteken, az izomszövetben, a gyomor-bélrendszerben, a tüdőszövetben, a húgy- és ivarszervekben, valamint a pajzsmirigyben, nagy számban fordulnak elő a nucleus tractus solitarii-ben is. A P anyag kötődése az NK1 receptorhoz az emezisen kívül stressz szignálokat, fájdalmat, símaizom összehúzódást és gyulladásos reakciót vált ki.
Az elmúlt években jelentős számú klinikai vizsgálat történt az NK1 receptor antagonistákkal, mint új antiemetikum csoporttal. Legtöbbet vizsgált képviselőjük az aprepitant. Az aprepitantról igazolták, hogy a cytochrom P 450 3A4 és/vagy 2B6 izoenzymek inhibitora, gátolja a cyclophosphamid és a thiotepa metabolizmusát. Nem önálló szerként, hanem a korábbi hatékony hányáscsillapító protokollok kiegészítéseként vizsgálták és mind a kemoterápia indukálta akut emezisben, mind a késleltetett hányás esetében jelentősen fokozta az eddigiekben alkalmazott hányáscsillapítók hatékonyságát (kb. 20%-kal). Manapság a jelentősen emetogén kemoterápiák okozta akut és késleltetett hányás megelőzésében és kezelésében a nemzetközi ajánlások alapvető része.
Hazánkban indikációhoz kötött, kiemelt társadalombiztosítási támogatással rendelhető készítmény az Emend, mely alkalmazási előírása szerint indikált mind erősen, mind közepesen emetogén kemoterápiák alkalmazása esetén.
A jelenleg érvényben levő szabályozás "Rosszindulatú daganatos betegségben (BNO: C00-C97) a ciszplatin-alapú, erősen emetogén (ciszplatin dózis nagyobb, mint 50 mg/m2) daganatellenes kezelés okozta hányinger és hányás megelőzésére és kezelésére azokban az esetekben, amikor a korábbi kemoterápia során alkalmazott serotonin-antagonista készítmények hatástalannak bizonyultak, ondansetron injekcióval és per os steroiddal kombinálva". 125 mg-os és 80 mg-os kapszula formájában érhető el (közös kiszerelésben bliszterben).
Gyógyszerdózis:
Emend: 1. nap: 125 mg per os 1 órával a kemoterápiás kezelés megkezdése előtt 2. és a 3. napon: reggel 1x 80 mg per os
Evidencia szint: I. A szintű ajánlás
B) ANTIEMETIKUMOK (alacsonyabb terápiás index)
Képviselőik: dopamin antagonisták: butyrofenonok, fenotiazinok és a szubsztituált benzamidok.
Az alacsonyabb terápiás index-szel rendelkező antiemetikumok nem eléggé hatékonyak ahhoz, hogy akut, kemoterápia indukálta emezis esetében, különösen nagy rizikójú betegekben elsővonalbeli szerként alkalmazzuk őket. Helyük lehet azonban ott, ahol a betegnél a hatékony antiemetikumok mellett intolerancia lép fel, vagy refrakterré válik az 5-HT3 receptor antagonistákkal szemben.
B.1. Fenotiazinok
A dopamin receptorok antagonizálása révén hatnak. Hatásuk a dózis emelésével fokozható. Mellékhatásaik: szedáció, hipotónia, álmatlanság, szájszárazság, extrapiramidális reakciók. Képviselőik: proklorperazin, tietilperazin.
Aprepitant
B.2. Butyrofenonok
Antiemetikus hatásuk mérsékelt, ugyancsak a dopamin receptorok antagonistái. Képviselőik: haloperidol, droperidol, domperidon.
B.3. Szubsztituált benzamidok
Az erősen emetogén kemoterápia okozta hányingert, hányást mintegy 40%-ban kivédik. Mind antidopaminerg-, mind 5-HT3 receptor antagonizáló hatással rendelkeznek. Antidopaminerg mellékhatásokkal rendelkeznek, melyek megjelenése gyakoribb fiatal betegben és per os alkalmazás esetén.
Metoklopramid:
Cerucal 5 mg/ml oldatos injekció
Dózisa kemoterápia indukálta hányás megelőzésére: 2 mg/ttkg 30 perccel a kemoterápia megkezdése előtt, majd 1.5, ill. 3.5, ill. 5.5, valamint 8.5 órával a kemoterápia befejezése után rövid ideig tartó (15 perces) infúzióban. A 24 óra alatt beadott metoklopramid összdózisa a 10 mg/ttkg adagot ne haladja meg.
C) ADJUVÁNS SZEREK
A benzodiazepinek és az antihisztaminok kiegészíthetik a hatékony antiemetikus terápiát, önálló alkalmazásuk azonban nem javasolható.
Evidencia szint: II. B szintű ajánlás
C.1. Benzodiazepinek
Elsősorban anxiolitikus, szedatív és amnéziát okozó hatásaik miatt alkalmazásuk kedvező lehet a tanult válaszreakción alapuló, vagy anticipációs hányás kivédésében, valamint a késleltetett hányás kivédésében és kezelésében.
C.2. Antihisztaminok
Antiemetikus szerként hatásuk csekély. A dyphenhydramin kivédi a dopamin antagonisták okozta extrapyramidális reakciókat.
D) AZ ANTIEMETIKUMOK KOMBINÁCIÓI
Javasolt a szerotonin receptor antagonisták kombinációja kortikosteroidokkal. Számos randomizált vizsgálat bizonyítja hatékonyságukat együttes alkalmazás esetén.
Evidencia szint: I. A szintű ajánlás
E) AJÁNLÁSOK KOMBINÁLT KEMOTERÁPIA ESETÉN
Minden esetben a legnagyobb emetogenitású készítménynek megfelelően kell megválasztani az antiemetikus kezelést. Evidencia szint: IV. D szintű ajánlás
F) AJÁNLÁSOK TÖBB NAPOS CITOSZTATIKUS KEZELÉS ESETÉN
Több napon át folytatott cytosztatikus kezelés esetében a beteg mind az akut, mind pedig az elhúzódó hányinger/hányás hatásainak ki van téve. Ráadásul a két hányás típus (heveny és elhúzódó) átfedést is mutathat. A kemoterápia minden napján javasolt a fenti táblázatban ismertetett, az alkalmazott kemoterápiás szerek emetogén potenciáljától függő rizikó kategóriáknak megfelelő hányáscsillapítás.
Evidencia szint: II. III. B szintű ajánlás
EVIDENCIA ALAPÚ AJÁNLÁS AZ AKUT HÁNYÁS MEGELŐZÉSÉRE ÉS KEZELÉSÉRE A CITOSZTATIKUMOK EMETOGENITÁSA ALAPJÁN
1.NAGY RIZIKÓ (a hányás rizikója > 90%):
- 5 HT3 receptor antagonista + dexamethason + aprepitant
Mindhárom nemzetközi ajánlás hármas gyógyszer kombinációt javasol és az 5-HT3 receptor antagonisták bármelyike alkalmazható a kombinációban az ajánlások szerint. Aprepitant alkalmazása esetén hazánkban az 5-HT3 receptor antagonista az ondansetron (ld. aprepitant fejezet).
Evidencia szint: I. A szintű ajánlás
vagy
- 5-HT3 receptor antagonista + dexamethason ± benzodiazepin származék
2.KÖZEPES RIZIKÓ (a hányás rizikója 30-90%):
- Anthracyclint és cyclophosphamidot tartalmazó kemoterápia esetében:
5-HT3 receptor antagonista + dexamethason ± aprepitant
A nemzetközi ajánlások hármas gyógyszer kombinációt javasolnak.
Aprepitant alkalmazása esetén hazánkban az 5-HT3 receptor antagonista: ondansetron.
- Anthracyclint és cyclophosphamidot nem tartalmazó kemoterápia esetében:
5-HT3 receptor antagonista + dexamethason
Az evidencia szint készítményenként különböző. Cyclophosphamidra és anthracyclinekre A szintű ajánlás áll fenn, ezekben az esetekben 85-90%-ban teljes hányáscsillapító hatás érhető el a fenti protokoll segítségével.
Evidencia szint: I. II. A. B szintű ajánlások
3.KIS RIZIKÓ (a hányás rizikója 10-30%):
- dexamethason ± benzodiazepinek
vagy
- metoclopramid ± benzodiazepinek
A betegek 10-30%-ánál alakul ki hányás ebben a csoportban, a hányás kontrollja is egyszerűbb. Kortikosteroiddal a betegek több mint 90%-ánál teljes hányáscsillapító hatást lehet elérni. Amennyiben a steroidok alkalmazása kontraindikált, illetve intolerancia vagy refrakteritás lép fel velük szemben, úgy metoclopramid vagy 5-HT3 receptor antagonisták alkalmazása javasolt.
Evidencia szint: III. IV. B. D szintű ajánlások
4.MINIMÁLIS RIZIKÓ (hányás rizikója <10%):
Nem szükséges rutinszerűen antiemetikumot alkalmazni.
Ebben a csoportban az antiemetikus kontroll hatékonyságának meg kell haladni a 95%-ot. Ritkán szükség lehet kortikosteroid egyszeri alkalmazására, vagy per os metoclopramid adására.
Evidencia szint: V. D szintű ajánlás
2. KÉSLELTETETT HÁNYÁS
Definíció:
A hányás a citosztatikum alkalmazását követően több mint 24 óra múlva kezdődik, gyakran napokig eltart, rosszul reagál szokásos antiemetikumokra.
A) RIZIKÓ FAKTOROK A KÉSLELTETETT HÁNYÁS KIALAKULÁSÁBAN:
A)1. A beteg tulajdonságai
A legfontosabb, hogy az akut hányást mennyire sikerült uralni. Ahol nem sikerült, ott a késleltetett hányás kialakulásának esélye jelentősen megnő. Egyéb rizikó faktorokat ld. az akut emezisnél.
B) Az alkalmazott citosztatikum tulajdonságai Leggyakoribb ciszplatin kezelések kapcsán (60-90%).
B) JAVASOLT ANTIEMETIKUMOK KÉSLELTETETT HÁNYÁS ESETÉN:
B.1. Kortikosteroidok
Ezek a szerek bizonyultak a leghatékonyabbnak a késleltetett hányás megelőzésére.
Dexamethason
Dózisa erősen emetogén kemoterápia esetén 20 mg iv. (aprepitanttal együtt adva 12 mg, mivel a dexamethason szenzitív szubsztrátja a CYP3A4 enzimnek), közepesen emetogén kemoterápia esetén 8 mg
B.2. Szubsztituált benzamidok:
Metoclopramid (Cerucal)
A metoclopramid a korábbi ajánlásokban az elhúzódó hányás kezelésére ajánlott készítmény volt. Számos, kisebb betegszámon elvégzett tanulmányban a metoclopramid + kortikosteroid kombináció hatékonysága megegyezett az 5-HT3 receptor antagonistákéval késleltetett hányás esetében. A metoclopramid dózisa ezekben a vizsgálatokban 2-4 x 20-40 mg (vagy 0.5 mg/kg) volt 3-4 napon át.
Az ASCO ajánlásban a metoclopramid nem szerepel a kemoterápia indukálta hányás kezelésében és megelőzésében alkalmazható szerek között, viszont a legújabb, 2010-es MASCC és a 2011-es NCCN ajánlás ismét tartalmazza. Az ellentmondás oka, hogy nem állnak rendelkezésre megfelelő randomizált klinikai vizsgálatok, melyek az akut hányáson kívül hatékonyságát nagy betegszámon bizonyítanák. Nem ismert a szer késleltetett hányás esetén alkalmazható ideális dózisa és az optimális kezelési idő sem.
A legújabb ajánlások abban az esetben is javasolják a metoclopramid alkalmazását, ha a beteg intoleráns 5-HT3 receptor antagonistákra vagy steroidra. A hazai lehetőségeket figyelembe véve a metoclopramid lehetséges alternatíva a késleltetett hányás kezelésére kombinációban.
B.3. Szerotonin receptor antagonisták
Több vizsgálat áll rendelkezésre ondansetronnal és granisetronnal önmagukban vagy dexamethasonnal kombinációban, de az eredmények megoszlanak. Mindegyik készítmény alternatívaként alkalmazható a késleltetett hányás kezelésére.
Ondansetron
A hazánkban elérhető készítmények felsorolását ld. az Acut hányás fejezetben.
Az első 24 óra után jelentkező késleltetett hányás megelőzésére - mind az erősen emetogén, mind az emetogén kezelés esetén - per os vagy rectalis kezelést kell alkalmazni a kemoterápiát követően 5 napig.
Az ajánlott per os adag naponta 2-szer 8 mg. Az ajánlott adag végbélkúp esetében egyszer 16 mg naponta.
Granisetron
A hazánkban elérhető készítmények felsorolását ld. az Acut hányás fejezetben. 2x1 vagy 1x2 mg per os naponta 4-5 napon át.
Palonosetron
Hazánkban nincs törzskönyvezett készítmény. A palonosetron kb. 5x hosszabb féléletidővel és nagyobb receptor kötő affinitással rendelkezik, mint az osztályába tartozó többi szer. Az 5-HT3 antagonisták közül a leghatékonyabbnak bizonyult az elhúzódó hányás kezelésében. 0.25 mg a javasolt dózisa intravénásan 30 perccel a kemoterápia megkezdése előtt elhúzódó hányás megelőzésére. A per os készítmény a késleltetett hányás esetében kevésbé bizonyult hatékonynak.
B.4. Neurokinin- 1 (NK-1) receptor antagonisták
A legújabb nemzetközi ajánlások a kortikosteroidok és az NK-1 receptor antagonista aprepitant kombinációját ajánlják késleltetett hányás esetén nagy emetogén potenciállal rendelkező kemoterápia esetén. Közepesen emetogén kemoterápia kapcsán kialakuló késleltetett hányás során pedig vagy kortikosteroid vagy pedig aprepitant a választandó szer.
EVIDENCIA ALAPÚ AJÁNLÁS KEMOTERÁPIA INDUKÁLTA KÉSLELTETETT HÁNYÁS ESETÉN
1. NAGY RIZIKÓ:
dexamethason + aprepitant
Mindhárom nemzetközi ajánlás szerint e két szer kombinációja a leghatékonyabb, hazánkban azonban az aprepitant finanszírozása jelenleg csak ondansetronnal és dexamethasonnal kiegészítve megoldott. A fenti kombinációval a betegek 50-70%-ánál lehet uralni a kialakult késleltetett hányást.
Evidencia szint: I. A szintű ajánlás
Kevésbé hatékony alternatíva: dexamethason + 5-HT3 receptor antagonista
2. KÖZEPES RIZIKÓ:
Közepesen emetogén kemoterápia esetén, ahol gyakori a késleltetett hányás kialakulása, megelőzésként hatékony antiemetikumok alkalmazása szükséges.
Evidencia szint: I. A szintű ajánlás
Elsősorban kortikosteroidok (dexamethason) alkalmazása jön szóba.
Evidencia szint: II. B szintű ajánlás
Alternatívaként 5-HT3 receptor antagonisták alkalmazása javasolható.
Evidencia szint: II. B szintű ajánlás
Alternatívaként az NKi receptor antagonista aprepitant hatékony és javasolt, de hazánkban a finanszírozási helyzet beszűkíti alkalmazási lehetőségeit.
Kortikosteroid + metoclopramid alkalmazása is szóba jöhet, de erre nincs érvényes nemzetközi ajánlás.
3. KIS RIZIKÓ ÉS MINIMÁLIS RIZIKÓ:
Nem szükséges rutinszerű hányás prevenció.
Evidencia szint: V. D szintű ajánlás
3. ANTICIPÁCIÓS (TANULT VÁLASZREAKCIÓN ALAPULÓ) HÁNYÁS Definíció:
A hányási epizódok ízekre, szagokra, bizonyos gondolatokra, vagy félelemre (anxietásra) alakulnak ki. Az előzetes kemoterápiás kezelések negatív tapasztalatai folytán ugyancsak létrejöhet (félelmi reakció), hatékony antiemetikus kontroll nélkül a betegek kb. 70%-át érintheti.
A) AZ ANTICIPÁCIÓS HÁNYÁS MEGELŐZÉSE
Megfelelő antiemetikus kontroll szükséges az akut és a késleltetett hányás kialakulásának megelőzésére. Az első kemoterápia esetén is megfelelő antiemetikumok alkalmazása indokolt, mert kialakulását követően igen nehezen kezelhető.
Evidencia szint: III. D szintű ajánlás
B) AZ ANTICIPÁCIÓS HÁNYÁS KEZELÉSE
Amennyiben az anticipációs hányás kialakul, úgy pszichoterápia, valamint anxiolitikumok alkalmazása jön szóba.
Relaxációs terápiák, hypnózis, zeneterápia, akupunktúra, akupresszúra alkalmazható eredményesen. Az ajánlásokban alprazolam naponta 3 x 0.5-2 mg szerepel, a kezelés előtti este elkezdve.
4. AZ ANTIEMETIKUS PROPHYLAXIS ELLENÉRE KIALAKULÓ UN. ÁTTÖRÉSES HÁNYÁS KEZELÉSE
Igen nehezen kezelhető hányás típus, felhívja a figyelmet a hatékony antiemetikus kontroll nagy fontosságára. Áttöréses hányás esetében az általános elv az, hogy olyan antiemetikumot kell alkalmazni, melynek csoportja eltér az eddigiekben használt készítményekétől. Egyetlen antiemetikus gyógyszercsoport sem bizonyult eredményesebbnek a többihez képest az áttöréses hányás kezelésében.
Az áttöréses hányás kezelésében alkalmazható fontos irányelvek:
1. a kezelés folyamatos legyen, ne pedig a hányásokat kövesse,
2. az intravénás alkalmazás preferálandó a per os alkalmazással szemben,
3. dopamin antagonisták és anxiolitikumok beillesztése a terápiába ugyancsak szóbajön,
4. figyeljünk a folyadék és elktrolyt háztartása egyensúlyára,
5. mielőtt az újabb kemoterápiás kezelést megkezdenénk, zárjuk ki a hányás egyéb lehetséges okait,
6. amennyiben a beteg hyperacid, úgy H2 receptor blokkoló, vagy proton pumpa bénító alkalmazása is szóba jön,
7. az újabb kemoterápiás kezelést megelőzően gondoljuk át még egyszer az antiemetikus prophylaxist és
- amennyiben nem kapott a beteg aprepitantot, úgy illesszük be a protokollba,
- egészítsük ki a kezelést nem szokványos antiemetikumokkal (pl. dopamin antagonistákkal, vagy anxiolitikumokkal),
- fokozzuk az 5-HT3 antagonistával végzett prophylaxis hatékonyságát és frekvenciáját, akár dózis emeléssel,
- váltsunk másik 5-HT3 receptor antagonistára, bár ismert, hogy ez sem feltétlenül oldja meg a problémát,
- ha nem kuratív a terápia, akkor gondolkodhatunk másik kemoterápiás protokoll alkalmazásában, mely kevésbé emetogén, de ugyanolyan hatékony betegünk számára.
A fenti ajánlások figyelembevételével betegeink többségén kivédhető a kemoterápia egyik rettegett szövődménye a hányinger, hányás. Mindez azonnal megmutatkozik betegeink életminőségének javulásában. Lényegesen ritkábban fordul elő a kezelés visszautasítása, így a kemoterápiás kezelések dózisintenzitása fenntarthatóvá válik. Utóbbi pedig döntő szempont a sikeres, hatékony onkoterápia szempontjából. Az ajánlás elkészítésekor a Multinational Association of Supportive Care in Cancer (MASCC, 2010), az American Society of Clinical Oncology (ASCO, 2006) és a National Comprehensive Cancer Network (NCCN, 2011) ajánlásait vettük figyelembe.
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Mantovani G, Maccio A, Bianchi A, et al: Comparison of granisetron, ondansetron, and tropisetron in the prophylaxis of acute nausea and vomiting induced by cisplatin for the treatment of head and neck cancer: A randomised controlled trial. Cancer 1996; 77: 941-948.
2. del Giglio A, Soares HP, Caparroz C, et al: Granisteron is equvalent to ondansetron for prophyalxis of chemotherapy-induced nausea and vomiting. Cancer 2000; 89: 2301-2308.
3. Warr D, Bramwell V, Anderson D, Charette M, and the Systemic Treatment Disease Site Group. Use of 5-HT3 receptor antagonists in patient receiving moderately or highly emetogenic chemotherapy. Curr Oncol 2001;8:69-82.
4. Aapro M, Bertoli, L, Lordick, F, et al: Palonosetron is effective in preventing acute and delayed chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy. Supp. Care Cancer 2003, 11: 391 (Abstr. A17).
5. The Italian Group for Antiemetic Research: Dexamethasone alone, or in combination with ondansetron for the prevention of delayed nausea and vomiting induced by chemotherapy, N Engl J Med 2000; 342: 1554-1559.
6. Antiemetic Subcommittee of the Multinational Association of Supportive Care in Cancer: Prevention of chemotherapy- and radiotherapy-induced emesis: results of the Perugia Consensus Conference. Ann Oncol 1998; 9: 811-819.
7. Kris MG, Hesketh PJ, Herrstedt J, et al: Consensus proposals for the prevention of acute and delayed vomiting and nausea following high-emetic-risk chemotherapy. Support Care Cancer 2005; 13: 85-96.
8. Roila F, Warr D, Clark-Snow RA, et al: Delayed emesis: moderately emetogenic chemotherapy. Support Care Cancer 2005; 13: 104-108.
9. Ossi M, Anderson E, Freeman A: 5-HT3 receptor antagonist in the control of cisplatin-induced delayed emesis. Oncology 1996; 53: 78-85.
10. Einhorn L, Rapoport B, Koeller J, et al: Antiemetic therapy for multiple day chemotherapy and high-dose chemotherapy with stem cell transplant: review and consensus statement. Support Care Cancer 2005; 13: 112-116.
11. Warr G, Hesketh PJ, Gralla RJ, et al: Efficacy and tolerability of aprepitant for the prevention of chemotherapy induced nausea and vomiting in patients with breast cancer after moderately emetogenic chemotherapy. J Clin Oncol. 2005; 23: 2822-2830.
12. Jordan K, Sippel C, Schmoll H-J: Guidelines for Antiemetic Treatment of Chemotherapy-Induced Nausea and Vomiting: Past, Present, and Future Recommendations. The Oncologist 2007; 12:1143-1150.
13. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Antiemesis, V.1.2007. Elérhető: http://www.nccn.org/professionals/physician_gls/PDF/antiemesis.pdf. 2011. I. verzió
14. Kris MG, Hesketh PJ, Somerfield MR et al. American Society of Clinical Oncology guideline for antiemetics in oncology: Update 2006. J Clin Oncol 2006;24:2932-2947.
15. MASCC/ESMO Antiemetic Guidelines 2010.
Elérhető: http://data.memberclicks.com/site/mascc/MASCC_Guidelines_English_2010.pdf
A NEUTROPENIÁS BETEG FERTŐZÉSEINEK MEGELŐZÉSE ÉS KEZELÉSE
I. Alapvető megfontolások
Előzmények és módszer
A neutropeniás betegek infekciónak kezelésével foglalkozó szakmai ajánlás korábban 2003-ban, majd átdolgozva 2005-ben jelent meg a Transzfúziológiai és Hematológiai Szakmai Kollégium valamint az Infektológiai Szakmai Kollégium közös protokolljaként.
A vezérfonal jelen frissítését a szöveg időszakos karbantartásán túl elsősorban új nemzeti és nemzetközi ajánlások megjelenése, az epidemiológiai környezetben bekövetkezett változások és a terápiás szemlélet hangsúlyváltozásai indokolják. Az alábbiakban megfogalmazott megállapítások és ajánlások főként a súlyosan neutropeniás (elsősorban malignus alapbetegség miatt kemoterápiával kezelt) betegcsoportokra vonatkoznak. A gombák okozta megbetegedések tárgyalása során esetenként kitérnek a granulocytaszámtól függetlenül előforduló kórképekre, továbbá azokra az infekciókra, melyek jellemző módon a neutropeniát követő szakaszban alakulnak ki. A hemopoetikus őssejt átültetésben részesülők kezelése annak korai, neutropeniás időszakában, a leírtakhoz hasonló elvek szerint történik. Ugyanakkor e betegek ellátása során számos olyan
speciális szempont (kockázati tényező, immunológiai szövődmény, gyógyszerkölcsönhatás) merül fel, melynek részletes ismertetése meghaladja a jelen dokumentum kereteit.
A szerzők felhívják a figyelmet arra, hogy a megfogalmazott ajánlások általános jellegűek, ezért konkrét klinikai helyzetben történő alkalmazásuk során körültekintően kell eljárni. Nem ismert ugyanis olyan kezelési séma, gyógyszer vagy gyógyszer kombináció, mely valamennyi neutropeniás beteg esetében - válogatás nélkül - azonos hatékonyságú volna. A betegek komplex ellátásába célszerű a témában járatos infektológust is bevonni. Az alábbiakban felsorolt antimikróbás szerek javallatait, ellenjavallatait, mellékhatásait, interakcióit illetően nem mellőzhető az alkalmazási előíratok és a vonatkozó szakirodalom gondos tanulmányozása.
Evidenciaszintek
Az ajánlás megalapozottsága
A A rendelkezésre álló adatok a módszer alkalmazását egyértelműen alátámasztják.
B A rendelkezésre álló adatok a módszer alkalmazását nagyrészt alátámasztják.
C A rendelkezésre álló adatok a módszer alkalmazását csak csekély mértékben támasztják alá.
D A rendelkezésre álló adatok nagyrészt a módszer alkalmazása ellen szólnak.
E A rendelkezésre álló adatok egyértelműen a módszer alkalmazása ellen szólnak.
Az evidencia forrása
I Egy vagy több, randomizált, kontrollált vizsgálat.
II Egy vagy több, megfelelően tervezett, nem randomizált vizsgálat.
III Szakértők, bizottságok véleménye, klinikai tapasztalat.
A lázas neutropenia jelentősége
A neutrophil granulocyták számának jelentős csökkenésének hátterében különféle tényezők állhatnak: kezeletlen hematológiai betegség okozta csontvelői infiltráció vagy aplasia, nem várt gyógyszer mellékhatás (agranulocytosis), citosztatikus kezelés vagy irradiáció. Súlyos neutropenia kialakulásakor - azaz, ha a keringő neutrophilek abszolút száma 0,5 G/l alatti, vagy 1-0,5 G/l között van, és csökken - az infekciók gyakorisága és a következményes halálozás jelentősen növekszik. Adott beteg esetében súlyos/fatális infekció kialakulásának kockázata az alábbi tényezők függvénye: a neutropenia tartama, mélysége, a neutrophilek számának emelkedő vagy csökkenő tendenciája, az egyidejű barriersérülés (mucositis) mértéke, a kolonizáció és a nozokomiális környezet jellege, az esetleges malignus alapbetegség statusa, és az előforduló kísérő betegségek. Mindenképp fokozott kockázatúnak kell tekinteni a nagydózisú kemoterápiával kezelt acut myeloid leukaemiás betegeket, illetve a bármely kórkép miatt őssejt átültetésben részesülőket.
Gyakran az infekció egyetlen tünete a láz. A lázas, neutropeniás betegek mintegy felében kimutatható, vagy okkult infekció zajlik. Ha az abszolút neutrophilszám <0,1 G/l, a betegek ötödében bacteriaemia alakul ki. Hypothermia ritkán fordul elő, rossz prognózisra utal. A neutropeniás beteg lázának egyéb oka is lehet (vérkészítmény, gyógyszer), kérdéses esetben azonban fertőzést kell feltételezni.
Klinikai tünetek
A gyulladás klasszikus jeleinek hiányában a neutropeniás betegek fertőzései tünetszegények. A bőr és a lágyrészek bakteriális fertőzéseiben hiányozhat az induratio, az erythaema és a suppuratio, pneumoniában a jellegzetes infiltrátum, meningitisben a liquor sejtszaporulata. A húgyúti infekciók - bár ritkák - pyuria nélkül is kialakulhatnak. Mindezek ellenére keresni kell az infekció bármily diszkrét jelét, különösen a leggyakrabban érintett testtájakon. Ezek: a szájüreg és a garat, az oesophagus alsó szakasza, a tüdő, a gáttájék, a szemfenék, a bőr (különösen a punkciók helyén), az intravascularis műanyag eszközök bemenete és a körömágy.
II. Diagnosztika
Lázas neutropenia észlelésekor az 1. táblázat-ban ismertetett vizsgálatok elvégzése szükséges.
III. Kezelés
Kezdeti antibakteriális kezelés
Mivel a neutropeniás betegek infekciói gyorsan progrediálhatnak, megfelelő ellátás nélkül halálozási arányuk magas, klinikai tünetek esetén pedig a fertőzés kizárására biztonságos módszer nem áll rendelkezésre, a neutropéniás láz felléptekor valamennyi beteget azonnal empirikus antibakteriális kezelésben kell részesíteni. A terápia a leggyakrabban előforduló, ezen belül a legnagyobb letalitást előidéző bakteriális kórokozók (P. aeruginosa, Klebsiella spp., E. coli, viridans streptococcusok, S. aureus) ellen irányul. Az antibiotikum választás során a baktériumok természetes rezisztenciáján kívül figyelembe kell venni a helyi epidemiológiai és rezisztencia viszonyokat, valamint a betegnél fennálló speciális korlátozó tényezőket (pl. veseelégtelenség, allergia). A perifériás és centralis vénás eszközök (kanülök) használatára, gondozására, esetleges infekcióik nyomon követésére és kezelésére a betegeket ellátó centrumok - a nemzetközi standardok figyelembe vétele mellett -helyi protokollokat dolgoznak ki
Parenterális terápia
A betegek parenterális antimikróbás kezelésére két lehetőség kínálkozik: a béta-laktám monoterápia, és a glikopeptidet tartalmazó kombináció. A hatóanyagok tekintetében részletesen ld. 1. ábrát és 2. táblázatot. A béta-laktám + aminoglikozid kombináció előnyeit az e tárgykörben végzett klinikai tanulmányok metaanalizise nem bizonyította, az aminoglikozidok okozta nephrotoxicitás pedig reális veszélynek bizonyult. Ugyanakkor az utóbbi évek során egyes nozokomiális Gram-negatív baktériumok körében megnőtt a béta-laktám antibiotikumokra kevésbé érzékeny speciesek aránya. Ezt szem előtt tartva, súlyos szepszisben, szeptikus sokkban illetve rezisztens Gram-negatív baktérium okozta infekció gyanúja esetén a primer kombináció részeként aminoglikozidot is lehet alkalmazni (CIII).
Orális terápia
Számos klinikai vizsgálat bizonyította, hogy megfelelő szempontok értékelésével a felnőtt, lázas neutropeniás betegek körében elkülöníthető egy olyan kis kockázatú csoport, amelyben a súlyos lefolyású vagy fatális kimenetelű infekció kialakulásának esélye elenyésző. Megfelelő feltételek teljesülése esetén ezek a betegek kizárólag orális antibiotikumokkal is eredményesen kezelhetőek (A-I). Szintén megfelelő feltételek mellett ellátásuk járóbetegként is történhet: kórházi megfigyelést követően a betegek rövid idő elteltével hazabocsáthatóak. A kockázat megítélésre több értékelési rendszert dolgoztak ki. A klinikai gyakorlatban is validált MASCC pontrendszert a 3. táblázat ismerteti. A felsorolt kritériumok mérlegelésén kívül a beteget az alábbi tényezők fennállása esetén is a nagy kockázatú csoportba kell sorolni: súlyos kísérőbetegség, nem kontrollált alapbetegség, máj- vagy veseelégtelenség, tüdőinfiltratum vagy az infekcióval összefüggésbe hozható egyéb lokalizált folyamat valamint a kórelőzményben szereplő alemtuzumab terápia. A kis kockázatú csoportban amoxicillin-klavulánsav plusz ciprofloxacin adható per os. Ez a terápiás lehetőség természetesen nem alkalmazható, ha a beteg profilaxisként fluorokinolont kapott.
FIGYELMEZTETÉS: A lázas, neutropeniás beteg hazabocsátása illetve ambuláns kezelése csak akkor engedhető meg, ha az alábbi feltételek maradéktalanul érvényesülnek:
1. A kockázat pontos értékelése a kérdésben járatos szakember(ek) által.
2. A beteg képes legyen orális gyógyszer szedésére. A súlyos mucositis, hányás vagy hasmenés az antibiotikumok bizonytalan felszívódása miatt az intézményen kívüli kezelést ellenjavallja.
3. A beteg és az otthoni környezet (család) megfelelő felvilágosítása és beleegyezése. A beteggel egy háztartásban éljen olyan felelős személy, aki állapotromlás esetén intézkedni képes.
4. A beteg megfelelő ítélőképessége.
5. Megfelelő telekommunikáció és szállítóeszköz háttér.
6. Megfelelő gyógyintézeti háttér, mely a nap 24 órájában a beteg rendelkezésére áll telefonon, ambuláns vizsgálattal és szükség szerint kórházi felvétellel.
Az antibakteriális kezelés folytatása
A kezdeti antibiotikum kezelés hatékonyságának megítélésére neutropeniás beteg esetében rendszerint 3-5 (esetleg több) napra van szükség. Ha a beteg állapota romlik, az infekció tünetei súlyosbodnak, vagy új tünetek jelennek meg, szükség lehet az empirikus terápia korai módosítására. Ilyenkor új szer(ek) hozzáadásával, vagy az antibiotikum kicserélésével a spektrumot olyan irányba kell kiterjeszteni, hogy az azokat a specieseket is lefedje, melyekre a kezdeti terápia kevésbé hatásos (pl. glikopeptid hozzáadása). Releváns mikrobiológiai lelet birtokában a kórokozó antibiogramjának megfelelő, leghatékonyabb, célzott terápiára kell áttérni. Gram-negatív illetve Pseudomonas-ellenes hatékonysággal rendelkező vegyület adása még akkor is kötelező, ha a célzott kezelés dokumentált Gram-pozitív infekció ellen irányul. Az empirikus terápia első hetében a klinikai választ illetően az alábbiakat tapasztalhatjuk:
A beteg a terápia 3-5. napján láztalanná válik (2. ábra)
Ha a kórokozó ismert, a célzott terápiát addig kell folytatni, amíg az infekció tünetei megszűnnek, a hemokultúrák sterillé válnak és az abszolút neutrophilszám meghaladja a 0,5 G/l-t. Ha az utóbbi feltétel nem teljesül, az antibiotikum csak a beteg szoros megfigyelése mellett hagyható el. A kezelés időtartama ne legyen 7 napnál rövidebb.
Amennyiben a láz hátterében kórokozót identifikálni nem lehetett, szervi érintettségre utaló jelek (pl. pneumonia) hiányában a kis kockázati csoportba tartozó, legalább két napja láztalan beteg esetében mérlegelni lehet szekvenciális, orális terápia (amoxicillin-klavulánsav plusz ciprofloxacin) alkalmazását. Egyéb esetben a megkezdett parenterális terápia folytatása ajánlott.
A beteg a terápia 3-5. napján még lázas (2. ábra)
Ha kórokozó baktériumot nem sikerült kimutatni, a perzisztáló láz hátterében az alábbi lehetőségek merülnek fel: 1. A fertőzés nem bakteriális eredetű. 2. A fertőzést a választott szerrel szemben rezisztens baktérium okozta. 3. Nem megfelelő az antibiotikum koncentráció az infekció helyén (okai: farmakokinetikai tényezők, nem vascularisált területen [kanül, abscessus] zajló infekció 4. Sejtfal-deficiens baktérium jelenléte valószínűsíthető. 5. A láz nem infekciós eredetű.
A tartósan lázas beteg megelőző és aktuális klinikai tüneteinek, mikrobiológiai és egyéb vizsgálati eredményeinek gondos újraértékelése után az alábbi terápiás döntéseket hozhatjuk:
1. Ha a beteg állapota nem változott (stabil), folytathatjuk a korábban megkezdett antibakteriális terápiát. Ha glikopeptid adásának indikációja nem áll fenn, és a beteg empirikus glikopeptid terápiában részesült, a szert el kell hagyni.
2. Ha az infekció progrediál, szükségessé válik a kezdeti terápia módosítása vagy kiegészítése. A változtatás során szem előtt kell tartani az empirikusan adott szerek antibakteriális spektrumának hiányosságait, és a feltételezett kórokozó várható érzékenységét. Ha a beteg empirikusan nem kapott vancomycint vagy teicoplanint, és a glikopeptid adásának indikációja fennáll, kiegészítésként e szerek valamelyikét választhatjuk (C-III). A perzisztáló láz miatt, ha azt egyéb új tünet nem indokolja, glikopeptid vagy aminoglikozid empirikus adása nem javasolt (DI, CIII)
Az antibakteriális kezelés időtartama
(3. ábra)
A lázas, neutropeniás beteg empirikus antibakteriális kezelése biztonságosan akkor függeszthető fel, ha az infekció jelei és tünetei elmúltak, és a neutropenia megszűnt (B II). Ha a beteg abszolút neutrophilszáma két alkalommal > 0,5 G/l, és legalább két napja láztalan, a terápia abbahagyható. Láztalan, de tartósan neutropeniás beteg esetében a kezelést tovább kell folytatni, kivéve a kezdetben alacsony kockázati csoportba tartozó, klinikailag stabil betegeket, akiknél 5-7 nap után szekvenciális per os terápiára lehet áttérni. Nagyobb problémát jelent, ha a beteg láza 5-7 nap után sem szűnik meg. Ha időközben a neutrophilek száma 0,5 G/l fölé emelkedik, stabil állapotú betegben további 4-5 nap után az empirikus terápiát el lehet hagyni. A láz okának felderítésére (alapbetegség, nem bakteriális fertőzés, gyógyszer indukálta láz) azonban további diagnosztikus erőfeszítéseket kell tenni. A tartósan lázas és továbbra is neutropeniás beteg számára nem könnyű optimális terápiát javasolni. Kétheti kezelés után egyesek az empirikus antimikróbás terápia elhagyását ajánlják. A beteget ezt követően is szoros megfigyelés alatt kell tartani, és szükség esetén az antiinfektív kezelést haladéktalanul újra kell kezdeni. Az empirikus antibakteriális terápia folyamatát ld. 1. ábrán.
Antifungális terápia
Elhúzódó neutropeniában, különösen onkohematológiai és őssejt-transzplantált betegek esetében jelentősen megnő a gombainfekciók kialakulásának kockázata. Az invazív mycosisok döntő többségét (>90%) Candida és Aspergillus speciesek okozzák, de nem elhanyagolható az u.n. "emerging" gombák okozta fertőzések (fusariosis, trichosporonosis, scedosporiosis) jelentősége sem.
A gombák okozta szisztémás kórképek kezelésére növekvő számban állnak rendelkezésre antifungális gyógyszerek. Ezek hazánkban törzskönyvezett indikációit a 4. táblázatban összegezzük.
Candida infekciók
A candidák okozta fertőzések döntő többsége endogén eredetű, elsődleges forrásuk a gyomor-béltraktus. Fluconazol profilaktikus vagy terápiás alkalmazása következtében ritkábban alakul ki véráram fertőzés, és ritkábbá váltak a C. albicans és C. tropicalis infekciók. A fluconazol kiterjedt használata ugyanakkor hozzájárul a fluconazol rezisztens vagy csökkent érzékenységű non-albicans Candida speciesek (C. krusei, C. glabrata, C. inconspicua, C. norvegensis, C. rugosa) gyakoribb izolálásához. Az intravascularis eszközök többnyire hematogén úton fertőződnek.
A candidosis felismerése a klinikai jelek észlelésén, igazolása mikrobiológiai vizsgálatokon múlik. Az elváltozások etiológiáját tenyésztésre vett minta, biopsiás anyag feldolgozása tisztázhatja. Kulcsfontosságú a hemokultúra. A steril helyről kitenyészett sarjadzó gombákat a mikrobiológiai laboratórium köteles species szintig identifikálni. A species meghatározása alapján megjósolható az érzékenység, ami segítséget jelent a célzott antifungális kezelésben. Mindemellett az invazív folyamatokból izolált candidák esetében ajánlott in vitro érzékenységi vizsgálat, megfelelő, standardizált módszerekkel történő elvégzése is. Ennek előnye elsősorban az alábbi esetekben igazolható: 1. Ha az alkalmazott terápia mellett nem tapasztalható megfelelő klinikai vagy mikrobiológiai válasz (szepszis illetve infekció tüneteinek visszafejlődése, hemokultúrák sterillé válása) (A II). 2. A kiinduláskor alkalmazott terápia módosításának alátámasztására (B II). 3. Szekvenciális, orális azolterápiára való áttérés előtt (A II). Oropharyngealis candidosis, oesophagitis
Oropharyngealis candidosis rendszerint a neutropenia idején jelentkezik, de antifungális kezelésben nem részesülő betegekben az immunszupresszív kezelés következtében bármikor felléphet. Az oesophagitis rendszerint az oropharyngealis folyamat tovaterjedése, de jelentkezhet önmagában is.
Az oropharyngealis candidosis kezelésére lokálisan alkalmazott polién készítmény (amphotericin B orális szuszpenzió), vagy szisztémás hatással is rendelkező fluconazol (napi 100-200 mg) választható (B II, A I). Oesophagitis esetén nem elegendő lokális hatású szereket adni (B-II): elsősorban a 200-400 mg fluconazol i.v. vagy per os (A-I), refrakter esetben 0,3-0,7 mg/kg amphotericin B (B-II) adható infúzióban. A klinikai gyógyulást követően egy hétig illetve a neutropenia végéig kell folytatni a kezelést.
Candidaemia, heveny disseminált candidosis
Candidaemia felléptével a neutropenia idején kell számolni. Az esetek egy részében a candidaemia következtében sokszervi elégtelenség tünetei jelentkeznek. Klinikai jelek alapján, instabil betegnél a candidaemia és a bacteriaemia nem különíthető el. A mikrobiológiai laboratórium jelzése az irányadó, a hemokultúrák 50-90%-ban pozitívak. Heveny disseminált candidosisban érintett lehet a tüdő, kialakulhat központi idegrendszeri folyamat. Steril helyről származó mintából izolált sarjadzó gomba szintén disseminált candidosist bizonyíthat.
Az invazív candida fertőzések preemptív kezelésében az antifungális terápia kiválasztása során tekintettel kell lenni a lokális epidemiológiai viszonyokra, a szervezetet kolonizáló speciesekre, a korábban alkalmazott antifungális vegyületekre és a beteg általános állapotára.
Fluconazol csak klinikailag stabil és azol profilaxisban nem részesülő beteg esetében választható, dózisa első nap 800 mg (12 mg/kg) majd napi 400 mg (6 mg/kg) i.v. (A-I). Ha a beteg állapota stabilizálódott, a kezelés per os fluconazollal is folytatható. Egyéb esetekben az első választás caspofungin (első nap 70 mg, majd napi 50 mg i.v.) (A I) vagy amphotericin B (0,7-1 mg/kg/nap infúzióban) kell legyen. Ha az amphotericin B deoxikolát adása ellenjavallt, vagy alkalmazása során nem tolerálható mellékhatások jelentkeznek, a szer lipid formulációira kell áttérni. Ha lehetséges, el kell távolítani az intravascularis kanülöket (B-III), különösen ha a kórokozó C. parapsilosis (A II).
A vérből izolált Candida species szintű identifikálása és/vagy az in vitro érzékenység ismeretében kell dönteni a további kezelésről. A C. albicans, C. tropicalis és C. parapsilosis véráram fertőzések egyaránt kezelhetők amphotericin B deoxikoláttal (0.5-1 mg/kg/nap) vagy fluconazollal (12-6mg/kg/nap) (B III). C. glabrata fertőzésben csökkent amphotericin B érzékenységgel kell számolni. Azolokkal szemben e fajok szintén csökkent érzékenységűek vagy rezisztensek. A választandó terápia a fentiek értelmében caspofungin (első nap 70 mg, majd napi 50 mg i.v.) vagy 1 mg/kg amphotericin B infúzióban. Voriconazol (első nap 2x400 mg /2x6 mg/kg/, majd napi 2x200 mg /2x3 mg/kg/) i.v. csak in vitro érzékenység meghatározás után jöhet számításba. A C. krusei fluconazol rezisztens, ezért izolálása esetén a javasolt terápia caspofungin (első nap 70 mg, majd napi 50 mg i.v.), vagy 1 mg/kg amphotericin B infúzióban. Ha az amphotericin B deoxikolát adása ellenjavallt, vagy alkalmazása során nem tolerálható mellékhatások jelentkeznek, a szer lipid formulációira kell áttérni. Invazív candidiasisban a caspofungin alternativája lehet a micafungin (A II), mely szintén az echinocandin csoportba tartozó antifungális vegyület. Esetében az Európai Gyógyszerhatóság (EMEA) előírja az esetlegesen előforduló hepatikus mellékhatások kockázatának mérlegelését. Az Egyesült Államok Gyógyszerhatósága (FDA) ugyanakkor nem látta szükségesnek hasonló figyelmeztetés kibocsátást. A micafungin dózisa 100 mg/nap infúzióban. Az echinocandin csoport további képviselője, az anidulafungin, jelenleg nem-neutropeniás betegek invazív candida infekcióiban törzskönyvezett szer. Bár neutropeniás betegek candidiasisában alkalmazásáról kevés adat áll rendelkezésre, regionális és nemzetközi ajánlásokban az echinocandin terápia egyik módozataként szerepel (A III - B II). Dózisa az első napon 200 mg, majd naponta 100 mg i.v. Ha a felsorolt szerek ellenjavalltak, vagy nem hozzáférhetők, voriconazol (első nap 2x400 mg /2x6 mg/kg/, majd napi 2x200 mg /2x3 mg/kg/) i.v. is adható.
Amennyiben a beteg állapota megengedi és a terápia időtartama ezt szükségessé teszi, szekvenciálisan orális szer adására (fluconazol, voriconazol) át lehet térni. Erre azonban csak akkor kerülhet sor, ha az elvégzett in vitro rezisztencia vizsgálat eredménye ezt nem ellenjavallja.
A beteget a neutropenia és az infekcióra utaló tünetek megszűnése, illetve az utolsó pozitív hemokultúra után még két hétig kell kezelni (A-III).
Minden fungaemia esetén a kezelés befejezése előtt ki kell zárni endophtalmitis lehetőségét (A-II). A szemfenék vizsgálata neutropeniás betegek esetében a neutropenia elmúltával javasolt.
Idült disseminált (hepato-splenicus) candidosis
A krónikus disseminált candidosis a neutropeniás időszakban fellépő fungaemia következménye. A klinikai kép a neutropenia elmúltával kerül felismerésre. Perzisztáló láz, jobb bordaív alatti fájdalom, a szérum alkalikus foszfatáz és gamma glutamilsav-transzpeptidáz szintjének emelkedettsége alapján merül fel a kórkép lehetősége. Képalkotó eljárások, CT és MRI erősíthetik meg a gyanút.
Az antifungális kezelésben figyelembe kell venni, ha rendelkezésre áll, a neutropenia alatt vérből izolált Candida spp. érzékenységét. A képalkotó eljárásokkal talált elváltozásokból végzett célzott biopsia ritkán tisztázza az etiológiát. Amphotericin B deoxikolát (0,5-0,7 mg/kg/nap), az amphotericin B lipid formulációi (3-5 mg/kg/nap) és a fluconazol (6 mg/kg/nap) (A-III) egyaránt adható. Súlyosabb állapotú betegek esetében megfelelő választás lehet 1-2 hétig alkalmazott caspofungin (első nap 70 mg, majd napi 50 mg i.v.), melyet per os 6 mg/kg/nap fluconazol tartós adása követ (B III).
A betegek állapota többnyire stabil. A chronicus disseminált candidosis tartós, gyakran több hónapos (egy éves) kezelést igényel. A folyamat gyógyulását az elváltozások eltűnése, vagy elmeszesedése jelzi. Ha a betegek ismételt kemoterápiára szorulnak, vagy őssejt transzplantációra kerülnek, az antifungális terápiát tovább kell folytatni a kezelés teljes időtartama alatt (A III).
Aspergillosis
Az acut invazív aspergillosis az alsó és felső légutakat érintő fonalasgomba infekció, mely főleg elhúzódóan neutropeniás, súlyos aplasticus anaemiás, allogén hemopoeticus őssejt átültetésen, solid szervtranszplantáción átesett, graft-versus-host betegségben szenvedő, corticosteroidokkal, a T-lymphocytákra ható immunszupresszív szerekkel, tumornecrosis faktor alfa antagonistákkal kezeltekben, továbbá idült tüdőbetegek valamint chronicus granulómás betegség (CGD) miatt csökkent immunitású személyek körében okoz súlyos megbetegedéseket. A hagyományos gombaellenes terápia alkalmazásával, illetve ha a háttérben álló immunhiány nem korrigálható, a következményes halálozás igen nagyarányú.
Diagnózis és definíciók
A betegség fennállása kétséget kizáró módon (bizonyított invazív aspergillosis) csak invazív diagnosztika alkalmazásával, vagyis az érintett szervből, szövetből történő mintavétellel állapítható meg. A biopsia elvégzése azonban számos okból ellenjavallt lehet, vagy megvalósítását technikai korlátok hátráltathatják. Emiatt szükséges a valószínű, illetve lehetséges invazív gombabetegség (aspergillosis) fogalmának bevezetése. E kórképek definíció rendszerét 2002-ben nemzetközi munkacsoport állította össze, majd 2008-ban sor került a meghatározások átdolgozására. Ezek az információk elsősorban tudományos vizsgálatok, illetve klinikai tanulmányok céljait szolgálják, lényegük ismerete azonban elengedhetetlen az érintett betegek gyakorlati ellátásához. Adott beteg esetében mechanikus alkalmazásuk mindezek ellenére nem javasolt és nem pótolja az orvosi gondolkodást. Az alábbiakban a definíciók legfontosabb szempontjait emeljük ki: 1. Bizonyított invazív aspergillosis
a) A normálisan steril szövetből (tű)biopsiával nyert minta histológiai, cytologiai vagy direkt mikroszkópos vizsgálata során jellegzetes morfológiájú gombaelemek kimutatása a következményes szöveti károsodás jeleivel együtt. Megjegyzés: a módszer önmagában az invazivitást bizonyítja, a gomba pontos meghatározására azonban nem alkalmas. Morphologiai alapon az aspergillosis más fonalasgomba infekcióktól nem különíthető el. Ilyenkor célszerű a bizonyított invazív gombabetegség meghatározást használni (mely egyben valószínű invazív aspergillosis).
b) A fenti, normálisan steril anyagból Aspergillus spp tenyészik. Nem bizonyító erejű, ha a gomba bronchusmosó folyadékból (BAL), orrmelléküreg punctatumból vagy vizeletből nő ki. Megjegyzés: a tenyésztés önmagában a gomba jelenlétét bizonyítja, az invazivitást azonban nem.
2. Valószínű invazív aspergillosis (az alábbi kritériumok valamennyi csoportjából legalább egy -egy megléte esetén)
a) Hajlamosító tényezők
i. Neutropenia (<0,5 G/l, > 10 napig) a betegséghez időben kapcsolódóan
ii. Allogén őssejt átültetés
iii. Tartós corticosteroid terápia (legalább 0,3 mg/kg/nap prednisonnal egyenértékű szer, > 3 hétig).
iv. T-lymphocytákra ható immunszupresszív terápia (pl.: cyclosporin, tumornecrosis faktor alfa antagonista, specifikus monoclonalis antitestek [így pl. alemtuzumab] illetve nucleosid analóg kezelés az elmúlt 90 napban
v. Veleszületett immunhiány (CGD, súlyos kombinált immundefektus).
b) Klinikai tényezők
i. Alsólégúti betegségben az alábbi CT jelek közül legalább egy
1. Denz, jól körülírt elváltozás, halo jellel vagy anélkül
2. Légsarló jel.
3. Üregképződés
ii. Tracheobronchitisben
1. Bronchoscopiával exulceratio, nodulusok, álhártya, plakk vagy pörk a tracheában és a bronchusokban.
iii. Az orrmelléküregek érintettsége esetén: sinusitist igazoló képalkotó lelet és az alábbiak közül legalább egy
1. Lokalizált (szembe sugárzó) akut fájdalom
2. Orrnyálkahártyán fekete pörk
3. A csontos határokat áttörő folyamat
iv. Központi idegrendszeri infekcióban: az alábbiak közül legalább egy
1. Képalkotókkal igazolt fokális elváltozások
2. MR, CT: meningealis kontraszthalmozás
c) Mikológiai tényezők
i. Direkt vizsgálat (cytológia, direkt mikroszkópia vagy tenyésztés): fonalasgomba jelenléte a bronchusmosó folyadékban, bronchuskefével vett mintában, sinus aspirátumban melyet az alábbi leletek legalább egyike bizonyít
1. Gombaelemek kimutatása
2. Aspergillus spp. kitenyésztése
ii. Indirekt vizsgálatok (sejtfal alkotóelemek kimutatása)
1. Aspergillosis: galactomannan kimutatása plazmából, szérumból, BAL-ból, liquorból
2. Aspergillosis, vagy más invazív gombabetegség (kivéve cryptococcosis ill. zygomycosis): béta-D-glukán kimutatása szérumból.
3. Lehetséges invazív aspergillosis: csak a hajlamosító és a klinikai tényezők megléte állapítható meg, mikológiai bizonyíték nem áll rendelkezésre.
Az invazív aspergillosis terápiája
Bizonyított vagy valószínű invazív aspergillosis esetén a kezelés célja: lehető legkisebbre csökkenteni az infekció okozta halálozást, megelőzni a fenyegető szervkárosodásokat, javítani, illetve megőrizni az érintett beteg életének minőségét, és szükség esetén biztosítani a fennálló alapbetegség további kezelhetőségét. (5.táblázat). Toxicitás és nem megfelelő hatékonyság miatt nem javasolt az amphotericin B-deoxikolát, illetve az amphotericin B kolloid diszperzió (D-I).
A terápiára vonatkozó fontos megjegyzések:
- A gombaellenes vegyületek alkalmazása során különös figyelmet kell fordítani a mellékhatásokra, a gyógyszerkölcsönhatásokra és orális készítmény esetében a felszívódási viszonyokra. Ez utóbbi megítélésére, ha a feltételek adottak, szérum gyógyszerszint meghatározást lehet végeztetni (posaconazol, voriconazol).
- A kezelés hatékonyságát általában10-14 nap után kell megítélni. Amennyiben a neutrophil granulocyták megjelenésével párhuzamosan a tüdőinfiltrátumok radiológiai progressziója igazolódik, ez nem jelenti feltétlenül a kezelés ineffektivitását.
- A súlyos, a kezdeti terápiára nem megfelelően reagáló infekciókban az alkalmazott szer kicserélése vagy kiegészítése kínálhat megoldást. Az előbbi esetben elméletileg célszerűnek látszik olyan hatástani csoportra való áttérés, melyet a primer terápia nem tartalmazott. A gombaellenes szerek kombinációjával kapcsolatosan jó minőségű, randomizált vizsgálatokból származó evidenciák nem állnak rendelkezésre. Ugyanakkor klinikai megfigyelésekből gyűjtött adatok szólnak a módszer alkalmazhatósága mellett. Primer terápiában több antifungális szer együttes adása általában nem javasolt. Mentő kezelésként echinocandin + polién (pl. caspofungin + lipid formulációjú amphotericin B), illetve echinocandin + triazol (pl. caspofungin + voriconazol) jön számításba.
- A betegek jelentős része a kórházból való távozás után még fenntartó orális terápiát igényel. Stabil állapotú betegben, szekvenciális, fenntartó kezelés céljából per os voriconazol adható.
- Ahol erre lehetőség van, csökkenteni kell az immunszupresszív hatású szerek, különösen a corticosteroidok alkalmazását (A III).
- A kezelés ideális időtartamát pontosan nem lehet meghatározni. Általánosságban a kezelést addig kell folytatni, amíg klinikai és radiológiai regresszió következik be, a mikrobiológiai leletek (ha voltak ilyenek) negatívvá válnak, és a rizikótényezőket (ha azok befolyásolhatóak) lehetőség szerint kiküszöböltük. Ez rendszerint minimálisan 6-12 hetet vesz igénybe. Ha az immunszupresszió alkalmazására tartósan szükség van, a gombaellenes terápia folytatása a kockázatos időszak egésze során kedvezően befolyásolja a kimenetelt (A III). A kezelés során a galactomannan antigenaemia mértékének alakulásából következtetni lehet a folyamat gyógyhajlamára.
- Alsólégúti aspergillosisban tüdőműtét indikációját képezi: a) a jelentős haemoptoe (10%-ban fordul elő), b) a diagnosztikus mintavétel szükségessége, c) relapsus megelőzése immunszupresszió/kemoterápia/transzplantáció előtt, d) vérzés profilaxis, amennyiben a képalkotó vizsgálatok nagy érképlet érintettségét valószínűsítik, e) a pericardiumra, mellkasfalra terjedő infekció vagy empyema.
- Az orrmelléküregek és a központi idegrendszer betegségeiben a műtét általában javasolt. Annak kockázatát, technikai elvégezhetőségét, a betegre vonatkozóan a kockázat (pl. vérzés) és hasznon arányát egyedileg kell mérlegelni.
Empirikus antifungális kezelés
Ha megfelelő antibakteriális kezelés ellenére a lázas neutropenia >72-96 órája fennáll, számos centrumban empirikus amphotericin B deoxikolát terápiát alkalmaznak. Ez a gyakorlat az 1980-as években, kisszámú betegcsoporton végzett tanulmányok eredményére támaszkodik. Az azóta eltelt évtizedek tapasztalatai megmutatták, hogy a kezelés során a betegek jelentős része indokolatlanul kap amphotericin B. A vegyület mellékhatásai ugyanakkor kedvezőtlenül befolyásolják az életminőséget, a kezelés kimenetelét és a költségeket. A későbbiekben az ellentmondás feloldására az ún. preemptív gombaellenes terápia kínált megoldást. Ez a gyakorlatban az immunstatus és klinikai kép folyamatos követése mellett első sorban a szérum galactomannan rendszeres (hetente két alkalommal történő) meghatározását és nagy felbontóképességű mellkas CT vizsgálat elvégzését, a lelet pozitívvá válása esetén pedig haladéktalanul Aspergillus spp-szel szemben is hatékony terápiát jelent. A kérdést számottevően befolyásolták azok a klinikai vizsgálatok, melyekben kevésbé toxikus szerek hatékonyságát igazoltak az elhúzódó lázas neutropenia empirikus antifungális terápiájában. Főként a liposzómális amphotericin B és a caspofungin alkalmazhatósága nyert bizonyítást. Nemzetközi ajánlásokban az amphotericin B egyéb lipid formulációi és a voriconazol is megtalálhatóak.
Mindezek értelmében jelenleg célszerű, ha a kockázati tényezők elemzése után, a kezelés nyújtotta előnyök és a lehetséges mellékhatások értékelése után az adott centrumok döntenek a preemptiv vagy az empirikus módszer előnyben részesítéséről. Általánosságban megfogalmazhatjuk, hogy a csökkent immunitású betegben a kifejlődőben lévő invazív mycosist ismételt képalkotó, mikrobiológiai és egyéb kiegészítő vizsgálatokkal rendszerint időben fel lehet ismerni. Empirikus antifungális kezelés - mindezek ellenére - indokolt lehet az alábbi esetekben: a) kiemelkedő kockázatú betegcsoportokban (acut leukaemia indukciós kezelése, allogén őssejt átültetés, magas fokú GVHD, rezisztens vagy relabáló malignus betegség), b) olyan centrumokban, ahol invazív aspergillosis időszakosan vagy rendszeresen nagy gyakorisággal fordul elő.
Alkalmazható szerek: amphotericin B deoxikolát (B I, veseelégtelenség veszélye esetén azonban ellenjavallt: D I), caspofungin (A I), liposzómális amphotericin B (A I).
Egyéb empirikus infekcióelleni kezelés
Neutropenia önmagában, ép T-sejtes immunválasz esetén, nem jelent fokozott hajlamot vírusok és paraziták okozta fertőzések kialakulására. Lázas neutropeniában e kórokozó csoportokra ható terápia alkalmazása ezért csak megfelelő bizonyítékok birtokában indokolt.
A neutropeniás infekciók megelőzése
Általános profilaxis
A neutropeniás beteg számára, kórházi kezelése során, protektív környezetet kell biztosítani. A neutropenia időtartamára a beteget olyan (optimális esetben egyágyas) kórteremben kell elhelyezni, ahol az esetlegesen betegről betegre átvihető kórokozók terjedésének veszélye minimálisra csökkenthető. Számára, a megfelelő nemzetközi ajánlások figyelembe vétele mellett, standard neutropeniás étrendet kell előírni. A nagy kockázatú beteg spóraszegény levegőjű kórteremben való elhelyezése (HEPA filter alkalmazása) csökkentheti az invazív aspergillosis kialakulásának rizikóját. Amennyiben a gyógyintézményen belül, vagy annak közvetlen környezetében építkezésbe kezdenek, külön intézkedési terv keretében gondoskodni kell a betegek fokozott védelméről (szorosabb kórházi infekció kontroll, az épületrész izolálása, szükség esetén a centrum számára átmenetileg új működési hely kijelölése).
A kórházi infekciókat okozó baktérium és gomba speciesek körében egyre nagyobb gyakorisággal találkozhatunk az antimikróbás szerekkel szemben csökkent érzékenységű patogénekkel, Ugyanakkor a károsodott immunitású betegcsoportok ellátása során jelenleg elkerülhetetlennek látszik az antibiotikumok és gombaellenes szerek kiterjedt és tartós használata. A kockázatelemzés és a diagnosztika módszereinek alkalmazásával mindent meg kell tenni e szelekciós nyomás csökkentése érdekében. Mindezek mellett az epidemiológiai folyamatok monitorozásának és a probléma kórokozók által létrehozott infekciók megelőzésének leghatékonyabb eszköze az infekció kontroll rendszer, melynek minden neutropeniás betegek kezelésével foglalkozó intézményben folyamatosan, szervezetten és aktívan működnie kell.
Antimikróbás profilaxis
A neutropenia idején alkalmazott antibakteriális profilaxis ellentmondásos: alkalmazásával csökkenthető a Gram-negatív és részben a Gram-pozitív baktériumok okozta véráram infekciók gyakorisága, a lázas epizódok aránya, az empirikusan adott antibiotikumok felhasználása és a halálozás (A-I). Ugyanakkor rezisztens törzsek szelektálódásának veszélye fenyeget. Nagy kockázatú betegekben, különösen, ha a neutropenia várható időtartama meghaladja a 7 napot napi 2x500 mg ciprofloxacin p.o., vagy 1x500 mg levofloxacin p.o. profilaktikus alkalmazása javasolt. A profilaxist a neutropenia megszűnéséig, vagy az empirikus antimikróbás terápia megkezdéséig kell folytatni. A profilaxis hatékonyságát rendszeresen monitorozni kell. Ez a véráram infekciók gyakoriságának nyomon követését és azok következményeinek klinikai megfigyelését (lázas epizódok, halálozás, parenterális antibiotikum felhasználás) jelenti. Az izolált törzsek antibiotikum rezisztenciájának alakulását figyelemmel kell kísérni, nemcsak a fluorokinolon rezisztencia, hanem más multirezisztens (ESBL termelő Gram-negatívok, MRSA) kórokozók előfordulása tekintetében is. A kitűzött célok elérése érdekében infekció kontroll rendszert kell működtetni. Főleg Gram-pozitív baktériumokra ható szerek (különösen vancomycin) profilaktikus adása nem ajánlott.
Az antifungális profilaxis hatékonysága elsősorban a Candida fertőzések megelőzésében bizonyított. Acut leukaemia nagydózisú kemoterápiás kezelése (C-I), valamint őssejt átültetés során (A-I) napi 200-400 mg fluconazol csökkenti a felszínes és invazív candidosisok előfordulási gyakoriságát A fluconazol profilaxis kedvezőtlen következménye a fluconazol rezisztens non-albicans Candida speciesek megjelenése a surveillance kultúrákban, elsősorban a székletben. Az invazív aspergillosis incidenciájának növekedtével szükségessé vált az antifungális profilaxis spektrumának szélesítése. Randomizált klinikai tanulmányban igazolták, hogy a posaconazol 3x200 mg p.o.. napi adagolás mellett szignifikánsan csökkenti az invazív mycosisok és ezen belül az invazív aspergillosis incidenciáját a hagyományos azol profilaxishoz képest, acut myeloid leukaemiában illetve myelodysplasiában szenvedő betegekben. Mindezek értelmében fokozott kockázat esetén napi 200-400 mg fluconazolt i.v./p.o. javasolunk. Ha a centrumban magas az invazív aspergillosis előfordulási gyakorisága (~10%), ha környezeti faktorok növelik az infekció kialakulásának veszélyét (építkezés), illetve ha a betegnél allogén őssejt átültetés tervezett, mérlegelni kell posaconazol 3x200 mg p.o.. profilaktikus adásának lehetőségét.
Ha a beteg anamnézisében invazív gombainfekció, különösen aspergillosis szerepel, a tervezett újabb neutropeniát okozó terápia illetve immunszupresszív kezelés során másodlagos profilaxis alkalmazása ajánlatos. Az optimális gombaellenes szer kiválasztásához evidenciák nem állnak rendelkezésre. A hatásspektrum és a tolerálhatóság figyelembe vételével elsősorban voriconazol, posaconazol, alternatívaként caspofungin vagy lipid formulációjú amphotericin B jöhet számításba. Neutropeniás betegek rutinszerű antivirális profilaxisát nem javasoljuk.
Kiegészítő terápiás lehetőségek a neutropeniás betegek infekcióinak kezelésében és megelőzésében
Mind a megjelent nemzetközi ajánlásokban, mind a klinikai gyakorlatban eltérő megközelítésekkel találkozhatunk a myeloid növekedési faktorok, a granulocyta transzfúzió és az intravénás immunglobulin készítmények használatára vonatkozóan. Myeloid hemopoeticus növekedési faktor (granulocyta kolóniastimuláló faktor [G-CSF, pegilált G-CSF]) kemoterápiás kezelést követő, profilaktikus adása indokolt lehet, ha az alkalmazott protokoll mellett a lázas neutropenia kialakulásának kockázata >20%.
Mérlegelhető G-CSF alkalmazása 10-20% közötti rizikó esetén is, ha a neutropeniás infekció kialakulásának kockázatát egyéb tényezők (pl. idős kor, műtét utáni állapot, csökkent csontvelői tartalék) növelik. A már kialakult infekció intervenciós kezelésében G-CSF adásának előnyeit nem bizonyították. Alkalmazását ennek ellenére a granulocyták visszatérésének gyorsítása érdekében mérlegelni lehet, ha a neutropeniás betegben pneumonia, szepszis, invazív mycosis vagy egyéb súlyos, progresszív fertőzés alakult ki.
Granulocyta transzfúzió profilaktikus és terápiás adása - megfelelő evidencia híján - továbbra is experimentális kezelésnek tekinthető, ezért alkalmazásának módját és körét tekintve ajánlás nem fogalmazható meg.
Intravénás immunglobulin rutinszerű adása neutropeniás infekciókban nem javasolt. Használata megfontolható jelentősen hypogammaglobulinaemiás betegek súlyos infekcióiban.
1. táblázat
Lázas neutropeniában szükséges vizsgálatok.
| Vizsgálat | Feltétel |
| Fizikális vizsgálat | Minden esetben |
| Mennyiségi és minőségi vérkép | Minden esetben |
| Szérum kreatinin, karbamid nitrogén, transzaminázok | Minden esetben |
| Hemokultúra (kétszer, perifériás vénából +/- centrális vénás kanül valamennyi lumenéből) | Minden esetben |
| Kanülkörnyék leoltása + Gram festés | Kanülinfekció gyanúja esetén |
| Vizelettenyésztés | Klinikai tünetek esetén |
| Széklettenyésztés (enterális patogén baktériumok) | Területen szerzett hasmenés, kórházi járvány gyanúja esetén |
| Széklet Clostridium difficile toxin kimutatás | Klinikai gyanú esetén |
| Széklet protozoon | Egy hétnél hosszabb hasmenés esetén |
| Liquor vizsgálat | Klinikai tünetek esetén |
| Bőrléziók aspirációja/biopsziája | Klinikai tünetek esetén |
| Mellkas rtg. | Minden esetben |
| Mikrobiológiai mintavétel, biopszia egyéb anatómiai régióból | A területet érintő infekcióra utaló klinikai tünetek esetén |
| Nagy felbontóképességű mellkasi CT | > 5 napig tartó lázas neutropeniában ill. pulmonalis mycosis gyanújakor |
| Surveillance mikrobiológiai vizsgálatok (orrváladék, garatváladék, rectalis leoltás) | Infekció kontroll céljából (MRSA, VRE, rezisztens Gram-negatív törzs okozta kolonizáció) |
2. táblázat
Empirikus, parenterális antibiotikum terápia lázas neutropeniában.
| Csoport | Vegyületek | Megjegyzés |
| ceftazidim | A ceftazidim G+ törzsek elleni | |
| VAGY | hatékonysága csekély, egyes | |
| cefepim | ajánlásokban alacsonyabb | |
| VAGY | evidencia szinttel szerepel. | |
| Monoterápia | imipenem-cilasztatin | |
| VAGY | ||
| meropenem | ||
| VAGY | ||
| piperacillin-tazobactam | ||
| Glikopeptid tartalmú kombináció | mint a monoterápiánál PLUSZ vancomycin VAGY teicoplanin | Indikációi: 1. Lágyrész- ill. kanül-infekció. 2. Kolonizáció rezisztens G+ baktériummal (pl. MRSA). 3.Hemokultúrában G+ baktérium, identifikálás folyamatban. 4.Hipotenzió. |
3. táblázat
Pontrendszer a felnőtt, lázas neutropeniás betegek kockázati tényezőinek jellemzésére (MASCC pontrendszer)
| Jellemzők | Pont | |
| Tünetek súlyossága (csak egy választható) | tünetmentes | 5 |
| enyhe tünetek | 5 | |
| súlyos tünetek | 3 | |
| Nincs hypotensio | 5 | |
| Nincs chronicus obstructiv tüdőbetegség | 4 | |
| Alapbetegség: szolid tumor. Hematologiai alapbetegség esetén: az előzményben nincs invazív gombainfekció | 4 | |
| Nincs dehidrált állapot | 3 | |
| A láz kezdetén a beteg nem fekszik kórházban | 3 | |
| Életkor < 60 év | 2 | |
Értékelés: >21 pontszám esetén a beteg szövődmények tekintetében a kis kockázati csoportba tartozik. Megjegyzés: Ld. a szövegben a FIGYELMEZTETÉS-t.
4. táblázat
A Magyarországon forgalomban lévő, invazív mycosisokban adható gombaellenes szerek törzskönyvezett indikációi.
| Vegyület | Indikáció |
| Fluconazol | Invazív candidiasis, candidaemia, (már gyanújelek alapján is adható). Invazív cryptococcosis. Gombainfekciók megelőzése (kemoterápia, radioterápia mellett). |
| Itraconazol * | Aspergillosis *. Candidiasis *. Cryptococcosis *. |
| Voriconazol | Invazív aspergillosis. Candidiaemia (csak nem-neutropeniás beteg). Scedosporium spp, Fusarium spp. okozta invazív mycosis. |
| Posaconazol | Invazív aspergillosis (amphotericin B-re vagy itraconazolra rezisztens vagy ezeket nem toleráló betegek, másodvonalbeli kezelés.) Fusarium spp. okozta invazív mycosis (amphotericin B-re rezisztens vagy azt nem toleráló betegek, másodvonalbeli kezelés.) Invazív gombainfekciók megelőzése (akut myeloid leukaemia, myelodysplasia, hemopoetikus őssejt átültetés esetén). |
| Amphotericin B (deoxikolát) | Invazív infekciók általában, ezen belül: aspergillosis, candidiasis, cryptococcosis, mucormycosis. Lázas neutropeniában empirikus gombaellenes kezelés céljából. |
| Amphotericin B (liposzómális) | Invazív infekciók általában, köztük candidiasis, cryptococcosis. mucormycosis (ha a deoxikolát formuláció adása kockázatos vagy nem tolerálható). Lázas neutropeniában empirikus gombaellenes kezelés céljából. |
| Amphotericin B (kolloid diszperzió) | Invazív infekciók általában, különösen: aspergillosis, candidiasis. Ha a beteg a deoxikolát formulációt nem tolerálja. Lázas neutropeniában empirikus gombaellenes kezelés céljából. |
| Amphotericin B (lipid komplex) | Első vonalban: invazív candidiasis. Második vonalban: invazív gombainfekciók, ha a deoxikolát formuláció nem elég hatékony, vagy toxicitás miatt ellenjavallt. Második vonalban: invazív aspergillosis, cryptococcosis. |
Vegyület__Indikáció
| Caspofungin | Invazív candidiasis. Második vonalban: invazív aspergillosis (ha a beteg amphotericin B formulációkra vagy itraconazolra nem reagál, vagy ezeket nem tolerálja). Lázas neutropeniában empirikus gombaellenes kezelés céljából. |
| Micafungin | Candidaemia |
| Anidulafungin | Candidaemia (nem-neutropeniás betegek). |
*Az itraconazol kapszulás kiszerelésben, változó biohasznosulása miatt, akut invazív gombainfekciók kezelésére nem javasolt!
5. táblázat
Az invazív aspergillosis terápiája
| Kórkép | Terápia | Alternatíva |
| Inavasiv pulmonalis aspergillosis (bizonyított illetve valószínű) | voriconazol (1. nap: 2x6 mg/kg i.v. majd 2x4 mg/kg/nap i.v./p.o.) (A I) | liposzómális amphotericin B, 3-5 mg/kg/nap, infúzióban (A I) |
| Inavasiv pulmonalis aspergillosis, ha a primer terápia hatástalan illetve azt a beteg nem tolerálja | caspofungin (1. nap 70 mg/nap majd 50 mg/nap), infúzióban (B-II), vagy posaconazol 4x200 mg p.o. B II), vagy amphotericin B lipid formuláció 3-5 mg/kg (B II) | antifungális kombináció (B II) |
| Heveny orrmelléküreg aspergillosis | Mint fent + műtét | Mint fent + műtét |
| Központi idegrendszeri aspergillosis | Mint fent + műtét | Mint fent + műtét |
Az egyes szerek alkalmazásának részleteit és korlátait ld. a szövegben !
1. ábra
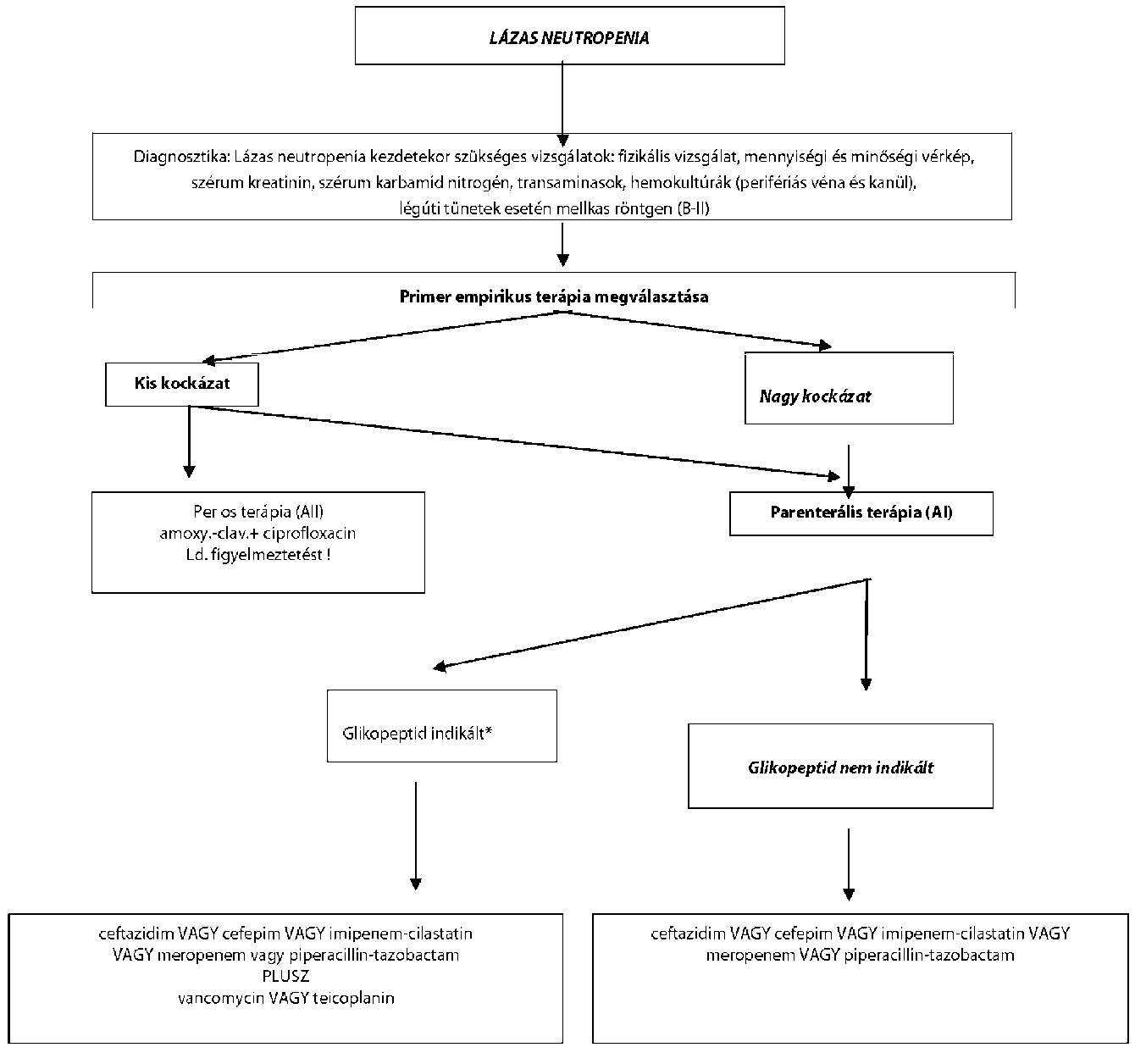
* Indikációkat ld.: 2. táblázatban.
2. ábra
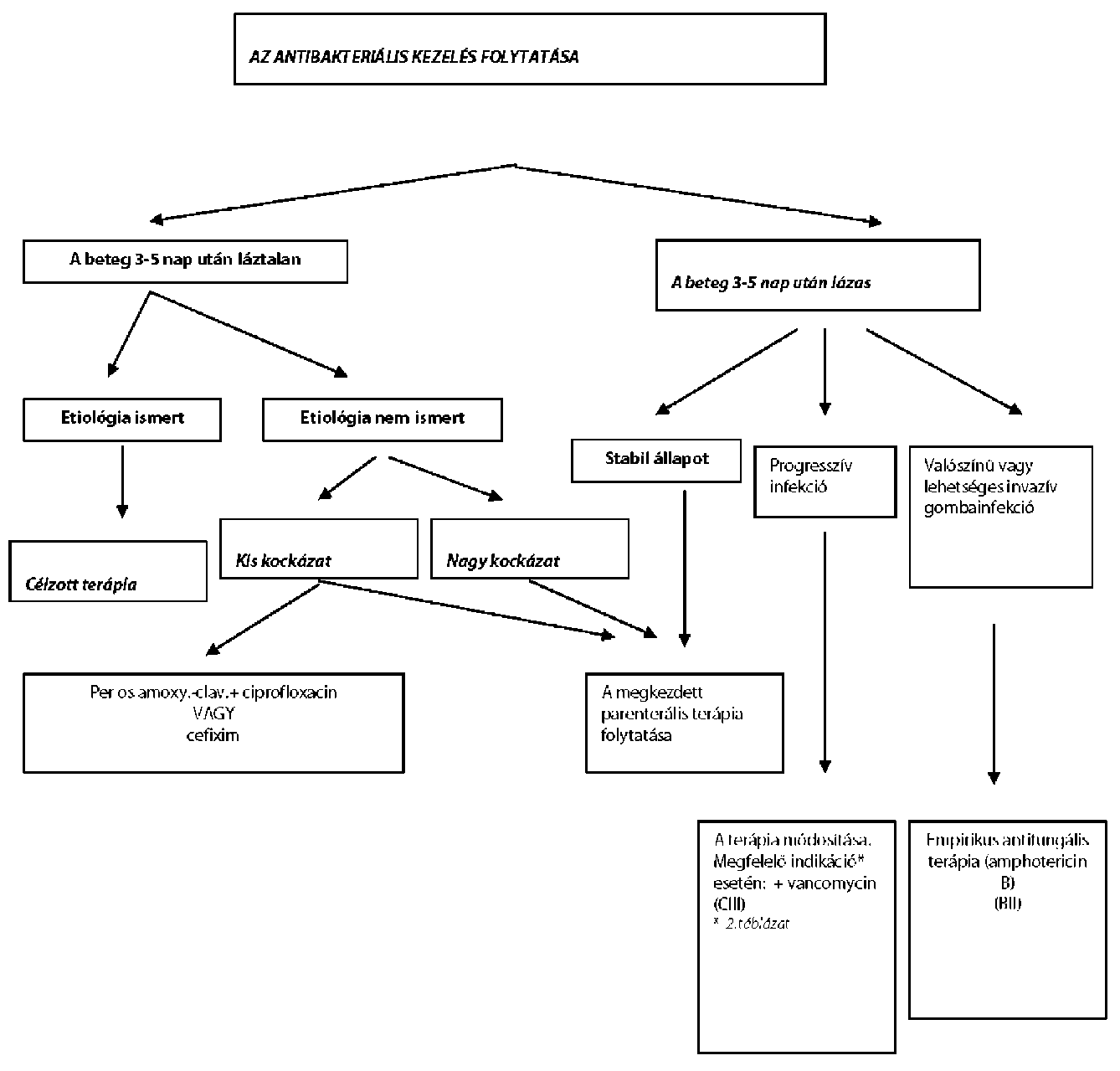
3. ábra
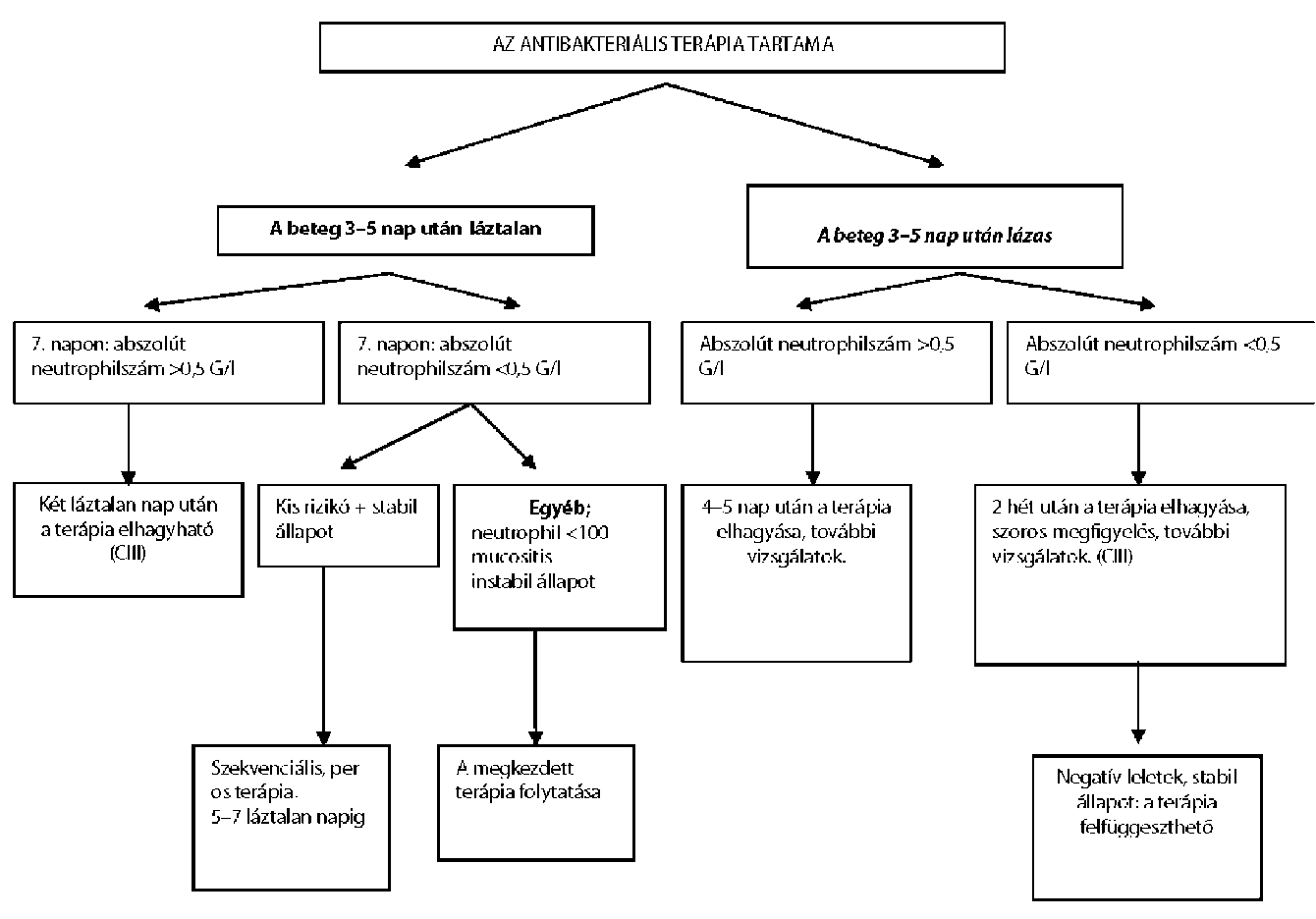
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Hughes WT, Armstrong D, Bodey GP et al: 2002 guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 2002;34:730-51.
2. Prevention and treatment of cancer-related infections. In: National Comprehensive Cancer Network ® NCCN Clinical Practice Guidelines in Oncology TM. (Co-chairs: Segal BH, Baden LR.) 2008.V.1, www.nccn.org.
3. Bucaneve G, Castagnole E, Viscoli C et al.: Quinolone prophylaxis for bacterial infections in afebrile high-risk neutropenic patients. Eur J Cancer 2007;Suppl.5:7-12.
4. Drgona L, Paul M, Bucaneve G et al.: The need for aminoglycosides in combination with betalactams for high-risk, febrile neutropaenic patients with leukaemia. Eur J Cancer 2007;Suppl.5:13-22.
5. Marchetti O, Cordonnier C, Calandra T: Empirical antifungal therapy in neutrpaenic cancer patients with persistent fever. Eur J Cancer 2007;Suppl.5:32-42.
6. Maertens JA, Frére P, Lass-Flörl C et al.: Primary antifungal prophylaxis in leukaemia patients. Eur J Cancer 2007;Suppl.5:43-48.
7. Herbrecht R, Flückinger U, Gachot B et al.: Treatment of invasive Candida and invasive Aspergillus infections in adult haematological patients. Eur J Cancer 2007;Suppl.5:49-59.
8. Cordonnier C, Pautas C, Maury S et al.: Empirical versu preemptive antifungal therapy for high-risk, febrile, neutropenic patients: a randomized, controlled trial. Clin Infect Dis 2009;48:1042-51.
9. Sinkó J, Ludwig E, Nikolova R, Masszi T, Prinz Gy, Rókusz L, Sréter L, Tímár L: A neutropenias beteg fertőzéseinek megelőzése és kezelése. Az Infektológiai Szakmai Kollégium és a Transzfúziológiai és Hematológiai Szakmai Kollégium közös szakmai protokollja. In: Útmutató, Klinikai Irányelvek Kézikönyve,Infektológia Medition Budapest,2007.nov:165-177.
10. Sinkó J, Ludwig E, Masszi T, Prinz Gy, Rókusz L, Sréter L, Tímár L: A neutropeniás beteg fertőzéseinek megelőzése és kezelése. Az Infektológiai Szakmai Kollégium és a Transzfúziológiai és Hematológiai Szakmai Kollégium közös szakmai protokollja. In: Hematológiai betegségek kezelésének módszertana. (Szerk: Lehoczky D) Documed, Budapest, 2004, 161-9.
11. De Pauw BE, Walsh TJ, Donnelly JP et al.: Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008;46:1813-21.
12. Ascioglu S, Rex JH, de Pauw BE et al: Defining opportunistic invazíve fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin Infect Dis 2002;34:7-14.
13. Pappas PG, Kauffman CA, Andes D et al: Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis 2009;48:503-35.
14. Walsh TJ, Anaissie EJ, Denning DW et al: Tretment of Aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis 2008;46:327-60.
A szakmai irányelv érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai irányelve
a hematológiai betegségek korszerű kezeléséről - a véralvadási zavarok korszerű kezelése
- A haemophilia előfordulása, öröklődése, előfordulása, diagnosztikája, szövődményei és kezelése
- A haemophilia A és B kezelése
- Veleszületett vérzékeny betegek sürgősségi ellátása
- A haemophilia perioperatív szubsztitúciós kezelése
- Inhibitoros A és B típusú haemophilia kezelése
- Szerzett (gátlótest) haemophilia diagnózisa és kezelése
- Thrombocytopathiák okozta vérzékenységek kezelése
- Ritka faktorhiányok okozta vérzékenységek kezelése
- A von-Willebrand-betegség kezelése
- A gyermekkori haemophilia etiológiája, tünettana és kezelése
- Thromboemboliás megbetegedések kezelése csecsemő- és gyermekkorban
Készítette: a Magyar Transzfúziológiai és Hematológiai Szakmai Kollégium és a Tudományos Társaság
A HAEMOPHILIA ÖRÖKLŐDÉSE, ELŐFORDULÁSA, DIAGNOSZTIKÁJA, SZÖVŐDMÉNYEI ÉS KEZELÉSE
I. Alapvető megfontolások
1. Definíció
A Haemophilia "A" a VIII-as véralvadási alvadási faktor X kromoszómára lokalizálódó génjében bekövetkező mutáció következtében létrejövő veleszületett vérzékenység. A IX-es faktor génje ugyancsak az X kromoszómán helyezkedik el, mutációi okozzák az ún. "B" típusú haemophiliát. A VIII- (IX-) faktor gén heterogén genetikai eltérései csökkent faktor termelődéssel vagy dysfunkcionális faktor képződésével járnak.
2. Mechanizmus
A IX-es faktor aktivált formája (IXa) szerin proteáz enzim, mely képes a X-es faktor aktiválására. A VIII-as faktor nem rendelkezik enzimatikus aktivitással, hanem a fenti reakcióban a foszfolipid (thrombocyta-) felszíneken a IXa kofaktoraként jelentősen katalizálja a Xa termelődést. A VIII-as és IX-es faktor deficiencia következménye tehát azonos: a csökkent Xa képződés miatt a véralvadás aktivációjakor drámaian csökken és elhúzódik a thrombin termelődés, ami miatt a végül is kialakuló fibrinháló gracilis, a véralvadék kicsiny és sérülékeny, a fibrinolítikus rendszer gyorsan eliminálja. A közös pathomechanizmus alapján érthető, hogy az "A" és "B" haemophilia klinikai képe és természetes lefolyása nem különböztethető meg egymástól.
3. Öröklődés
A haemophilia az X kromoszómához kötött recesszív öröklésmenet típuspéldája, tehát a heterozygóta nők a betegség carrierjei, míg az érintett férfiak hemizygóták. A hordozó nők általában tünetmentesek, csupán kb. 20 százalékuk faktoraktivitása csökken klinikailag is jelentős mértékben (<40 %). A VIII-a vagy IX-es faktort kódoló génszakaszok az X kromoszóma hosszúkarján találhatók.
A családi anamézisben feltárandó az érintett családtagok száma a részletes családfa, amely birtokában az öröklődésmenet megállapítható. A betegek közel 1/3-nál új mutáció keletkezik így családi anamnézisük: negatív.
A súlyos "A" haemophiliás esetek kb. 45 százalékában egyazon mutáció, az intron 22 inverzió okozza a betegséget, azonban a többi súlyos A haemophiliás családban, a középsúlyos és mérsékelt A hamophiliában valamint "B" haemophiliában a betegség genetikai háttere rendkívül heterogén. Nagy és kis deléciók, inszerciók, frame-shift-, nonszensz- és misszensz mutációk egyaránt előfordulnak. Így a rutin carrier- és prénatális diagnosztikában a direkt mutáció meghatározáson (az intron 22 inverzió southern blotting kimutatása) kívül az indirekt családvizsgálaton alapuló molekuláris géndiagnosztikai módszerek is használatosak. Utóbbi különféle indirekt, a VIII-as faktor, IX-es faktor génjére lokalizálódó intragenikus, vagy annak közvetlen közelében elhelyezkedő extragenikus polimorf markerek alkalmazását jelenti a betegséget hordozó X kromoszóma öröklődésének nyomonkövetésére.
A haemophilia "A" gén lókusz: Xq28, számos mutációja ismert. Pontmutációk
Minden olyan pontmutáció, mely a kódoló sequentián belül van és nonsense, stop kódont eredményez lehetetlenné teszi a transzláció során az érett fehérje kialakulását. Klinikailag súlyos megbetegedést eredményez. A missense mutációk, melyek során egy bázis cserélődik ki és ezáltal aminósavcsere történik általában közepesen súlyos, vagy enyhe klinikai kép formájában mutatkoznak. A súlyos eseteket leszámítva a megbetegedés 80%-át ez a mutációs típus okozza. Néhány pontmutáció a haemophiliások körében több betegnél is megfigyelhető. A visszatérő missense mutációk nem feltétlenül mutatják ugyanazt a klinikai képet a különböző pácienseknél. Ez a tény azt mutatja, hogy a fenotípust a genetikai struktúrán kívül más tényezők is meghatározzák. Ide sorolhatók az egyedi biokémiai, fiziológiai jellemzők, de a beteg pszichés és életkörülményeiből adódó sajátosságai is. Továbbá szerepet játszhatnak a neutrális aminosavak különböző polymorphismusai, vagy esetlegesen egy második, nem felismert mutáció. A recurráló mutációk elsődlegesen a CG nukleoidokat érintik, ami nem meglepő, hiszen ezek jól ismert hypermutabilis helyei a DNS-nek. A VIII-as faktor kódoló régiója (exonok) 12 CGA típusú Arginit tartalmaznak. A C-T okozta nonsense mutációt mindegyiknél kimutatták és kivétel nélkül súlyos megbetegedés társult hozzá.
Deléciók
A több mint 60 leirt deléció a gén minden régiójában előfordulhat. Előfordulási gyakoriságuk nem mutat korrelációt egyik génszakasszal sem. Gyakran érintik a 6 legnagyobb intront. A deléciók az esetek nagy részében lehetetlenné teszik a gén működését, ilyenkor nincs mód fehérje képződésére. Ezekben az esetekben a beteg súlyosan vérzékeny és nem találunk keringő kereszt-reagáló antigént. Ennek dacára nem minden betegnél alakul ki inhibitor a VIII-as faktor szubsztitúciós kezelés során. Deléciók esetében 5%-nál magasabb VIII-as faktor szint ritkán található.
Inversió
A VIII-as faktor génen egy több szempontból különleges 22-es intron régió található, mely 32 kilobázis nagyságú. Itt helyezkedik el az úgynevezett "A" gén . Két további kópiája kb. 500 kilóbázisnyira proximális irányban ( a gén 5' irányában) található, de ezek transzlációjának iránya az előbb említett "A" génnel ellentétes irányú. Vagyis a génben a bázissorrend ugyanaz, csak fordított irányban, amit szokás palidrom szekvenciaként is nevezni. Jól ismert jelenség hogy bizonyos körülmények között a DNS láncok normálisan is szétválnak, majd rekombinálódnak. Abban az esetben, ha palidrom szekvenciák vannak egymáshoz közel, a rekombináció nem kötelezően a komplementer DNS lánccal jön létre, hanem a palidromok között, aminek az eredménye egy DNS hurok képződése. A 22-es intronban elhelyezkedő "A" gén a VIII faktor géntől távolabb található két homológ, de ellentétes szekvenciájú "A" régió valamelyikével is képes kapcsolódni. Amennyiben a párosodást "crossing over" követi az összekapcsolódott palidromban, egy a VIII faktor hurokba került részét megfordító inversio következik be. Az elváltozás világszerte homogenitást mutat és a haemophiliás súlyos haemophiliás betegek kb. 40%-át érinti.
A haemophilia "B" gén lókusza: Xq27.1-q27.2.
Nincs olyan jellegzetes nagy betegcsoportot érintő mutációs típus mint haemophlia A betegségben az inverzió. Közel 400 féle ismert egyedi mutációs típust írtak le melyek közel 40%-a új mutáció, ez döntően a középsúlyos és enyhe haemophilia "B"-s betegekre jellemző. Jelentősek a deléciók és a nonsense mutációk melyek nagyobb gyakorisággal inhibitor képződéshez vezethetnek. Az inhibitor képződés 3% gyakorisággal fordul elő.
Hordozó nők
Biztos (obligát) hordozó:
- Haemophiliás férfi lánya
- Minden olyan anya, akinek több haemophiliás fia van
- Minden olyan anya, akinek egy haemophiliás fia van és a családban anyai ágon előfordul haemophiliás beteg
Potenciális (lehetséges) hordozó:
- Minden olyan nő, akiknek a családjában anyai ágon előfordult haemophilia
- Minden olyan nő, akinek haemophiliás fia születik és a betegség a családban nem fordult elő
Az obligát és potenciális carrierek további vizsgálata ajánlott: fenotípus meghatározás, genotípus meghatározás.
Genetikai tanácsadás keretében a carriereket tájékoztatni kell az állapottal együttjáró lehetséges következményekről.
A vérzékeny carriereket a haemophilia regiszterben nyilván kell tartani.
4. Előfordulás
Átfogó USA-beli epidemiológiai vizsgálatok szerint a haemophiliák előfordulása 15-25/100 000 férfilakos. Minden 5000. fiúgyermek születésére esik egy A haemophiliás újszülött, míg B haemophiliában ez az arány 1:30 000-hez. A VIII-as faktor génjének mutációi 6-7x gyakoribbak a IX-es faktor defectusainál. A vérzékenyek megközelítőleg 80%-a A haemophiliás, míg 20%-a B haemophiliás. A haemophiliák teljes populációban való előfordulása tehát kb. 1:10 000, és az esetek 80-85 százaléka A típusú haemophilia. A magyarországi incidencia adatok a következőképpen alakulnak. Haemophilia A: Magyarországon 838 ismert beteg, prevalencia: 8,38/100 000,
Haemophilia B: Magyarországon 192 ismert beteg , prevalencia: 1,92/100 000.
II. Diagnózis
5. Laboratóriumi diagnosztika
A VIII (IX-) faktor hiány az APTI normál plazmával korrigálható izolált megnyúlását okozza. A szűrő véralvadási vizsgálatok közül a vérzési idő, prothrombin és thrombin idő normálisak. Az "A" és "B" típusú haemophilia között a VIII és IX faktor aktivitás szintén APTI-alapú meghatározásával tehetünk különbséget. A szubsztitúciós kezelés (a hiányzó VIII-as vagy IX-es faktor transzfúziós bevitele) súlyos szövődményként alloantitest inhibitor képződéséhez vezethet, ilyenkor az ún. keverési tesztben a normál plazma hozzáadása a megnyúlt APTI értéket nem korrigálja. A utóbbi esetben az inhibítor titerét higítási sorral kell megmérni, majd Bethesda egységben kell megadni.
6. Differenciál diagnosztika
Az "A" és "B" haemophiliát az intrinsic út egyéb "kontakt" faktor deficienciáitól (pl.: XII-es faktor, Fletcher- és Fitzgerald faktor, HMW kininogén, prekallikrein, XI-es faktor) a specifikus faktor meghatározásokkal lehet elkülöníteni. Vérzékenység szempontjából ezek közül egyedül a XI-es faktor hiány bír jelentőséggel.
Az "A" haemophiliát ezen kívül még a ritka VIII-as faktor elleni kóros autoantitest termelődésen alapuló ún. szerzett, gátlótestes haemophiliától (APTI keverési tesztek és az inhibitor Bethesda méréssel való meghatározása) és a gyakori von Willebrand betegségtől kell elkülöníteni. A VIII-as faktor fiziológiás carrier fehérjéje a von Willebrand faktor (vWF), amely stabilizálja a keringésben, és megvédi a korai proteolízistől. Így érthető, hogy a vWF hiányában a VIIIF:C is csökken. A ritka, súlyos, 3-as típusú von Willebrand betegségben, amire a vWF teljes hiánya jellemző, a VIII-as faktor aktivitás is jelentősen csökken - általában 3% alatt van - és típusosan haemophiliás vérzéses manifesztációk is előfordulnak a megfelelő mozgásszervi következményekkel. A von Willebrand betegség ugyancsak ritka 2N (Normandy-) variánsát különösen nehéz elkülöníteni a mérsékelt A haemophiliától, hiszen itt a klassszikus vWF paraméterek (RiCof, RIPA, CBA, Ivy, PFA 100, vWF:Ag) mind normálisak és csupán a specifikus vWF VIII-as faktor kötő képességét vizsgáló teszttel lehet a diagnózishoz eljutni, mely különösen az továbbörökítés kérdésében lehet fontos.
A "B" típusú haemophilia differenciál diagnosztikájában a IX-es faktor csökkenés szerzett okait kell elsősorban figyelembe vennünk: K-vitamin hiány, kumarin és indandion kezelés, májbetegséghez kapcsolódó komplex coagulopathia és rendkívül ritka IX-es faktor elleni autoantitest. A prothrombin idő mérése, a többi K-vitamin dependens véralavadási faktor szintjének specifikus meghatározása, APTI korrekciós és Bethesda inhibitor teszt alkalmazása lehet szükséges a korrekt diagnózis felállításához.
7. Klasszifikáció
Az alvadási faktorok hiányának ill. aktivitásának mértéke párhuzamos a klinikai kép súlyosságával (1. táblázat).
1. táblázat. A haemophilia súlyosság szerinti besorolása
| Súlyosság | Faktorszint % aktivitás (IU/ml) | Vérzés jellege |
| Súlyos | 1% (<0.01) | Spontán vérzés, főként az ízülettekben és izmokban |
| Középsúlyos | 1%-5% (0.01-0.05) | Spontán vérzés ritka, de súlyos vérzés traumánál, műtétnél |
| Enyhe | 5%-40% (0.05-0.40) | Súlyos vérzés nagy traumánál vagy műtétnél |
A reziduális VIII-as, ill. IX-es faktor aktivitáson alapul, amely jó korrelációt mutat a klinikai súlyossággal. A súlyos haemophiliások faktoraktivitása <1%, és a rendszeres ízületi és izomközti vérzések következtében adekvát profilaxis nélkül hosszútávon kialakul a jellemző mozgáskorlátozottság a nagyízületek haemophiliás arthropathiájával, tengelyeltérésekkel, perifériás neuropathiával és izomatrófiával. Középsúlyos haemophiliában a maradék faktoraktivitás 2-5% és spontán vérzésekkel már nem kell számolnunk, így a mozgásszervi következmények jóval enyhébbek, vagy akár hiányozhatnak is. Mérsékelt haemophiliában a faktoraktivitás 5 és 30% között van, általában csak traumák és sebészeti beavatkozások vagy belsőszervi "locus minoris resistentiae" (pl.: ulcus, polyp, tumor, angiodysplasia) kialakulásakor véreznek. A faktorszintek a beteg teljes élete folyamán változatlanok (a ritka Leyden B haemophilia variáns kivételével) és egy adott család érintett férfitagjaiban is azonosan alakulnak.
8. Klinikai kép
Az "A" és "B" típusú haemophilia klinikai megjelenésében nem különíthető el egymástól, mivel mind a FVIII, mind a FIX a véralvadás folyamatának ún. intrinsic mechanizmusában vesz részt. Hiányuk (vagy diszfunkciójuk) következtében csökkent mértékű lesz az endogen thrombin képződése, ennek következtében nem képződik stabil térhálós fibrinrög és az alvadék sérülékenysége miatt gyakori az újravérzés.
A vérzés helye szerint súlyos ill. életveszélyes vérzések különíthetők el. Bár a haemophiliás betegekben mindenütt kialakulhat vérzés, mégis a vérzések leggyakoribb lokalizációja az ízületek (2. táblázat). Az érintettség gyakorisági sorrendje: térd, könyök, boka, váll, csípő (2. táblázat). A vérzékeny beteg életminőségét hosszútávon még napjainkban is az ismételt (manifeszt, vagy szubklinikai) vérzések okozta arthropathia határozza meg, mely egyike a haemophilia krónikus szövődményeinek.
2. táblázat.
A Haemophiliás vérzések jellemzői
| Vérzésforrás szerint: | |
| Súlyos vérzések | Életveszélyes vérzések |
| - Ízületek | - Központi idegrendszeri (CNS) |
| - Izomzat/lágyrész | - Gastrointestinalis (GI) |
| - Száj/orr/bél | - Nyak/garat |
| - Haematuria | - Súlyos trauma |
| Vérzéstípusok: | |
| - Haemarthrosis | 70-80 % |
| - Izomzat / lágyrész | 10-20 % |
| - Egyéb nagy vérzés | 5-10 % |
| - Központi idegrendszeri vérzés (CNS) <5 % | |
A kisebb sebzések után nem jelentkezik azonnali típusú fokozott vérzés, hiszen a thrombocyta funkció megtartott. Ugyancsak nem jellemzőek a vérlemezke-típusú bőr- és nyálkahártya-vérzések (pl.: purpura, petecchya, gingiva vérzés); a szuffúziók, szubkután haematómák ("easy bruising") azonban gyakoriak.
Szinte kizárólagosan csak a súlyos haemophiliában fordulnak elő rendszeresen a nagyízületiekben haemarthrosok és a vázizomzatban inter- és intramuscularis haematómák. A recidív haemarthrosok következtében ún. "target" ízületiek alakulnak ki krónikus synovitissel, "circulus vitiosusként" visszatérő vérzésekkel, irreverzibilisen progrediáló porcdestrukcióval, az ízületii rés beszűkülésével, degeneratív csontcysták kialakulásával, contractura létrejöttével, a körülvevő izmok atrófiájával. Végül is, a haemophiliás arthropathia ún. "kiégett", végső stádiumában friss haemathrosok már nem jelentkeznek, jelentős fokú contractura vagy ankylosis alakul ki általában súlyos fájdalmassággal. Az ízületii érintettség a gyakoriság sorrendjében a következő: térd, könyök, boka, csípő, csukló, váll.
Az izomhaematómák következtében veszélyes compartment szindrómák jöhetnek létre, mint pl. az alkar ischaemiás Volkmann contracturája, az inguinális haematoma után kialakuló nervus femorális laesio quadriceps izom atrófiával és a peroneus laesio által okozott "dropped foot". Sokszor életveszélyes a retroperitonealis haematoma, mely subileussal, paralítikus ileussal, reflexes anuriával, vérvesztéses shockkal járhat. Légúti obstrukció veszélyét hordozzák magukban az elsősorban inhibitoros betegekben előforduló retropharyngealis, sublingualis haematomák. Kiterjedt intramusculáris haematomák következményeként ún. haemophiliás pseudotumorok is kialakulhatnak jellegzetes, durva csont- és lágyrész-destrukciókkal.
A belsőszervi vérzések közül gyakori a makroszkópos haematuria, sokszor vesekőszerű colicával. Nem minden esetben lehet organikus okot kimutatni a hátterében, igen gyakran banális felsőlégúti lázas betegség lezajlása után 1-2 héttel jelentkezik. Recidív haematuria esetén indokolt képalkotó eljárásokkal a vérzés forrása után kutatni. Ezzel szemben a haemophiliások gasztrointesztinális vérzéseinek hátterében minden esetben organikus okot kell keresnünk, bár gyakran csak ventrikuláris vagy duodenális felületi eróziókat találunk. A központi idegrendszeri, elsősorban agyállományi vérzések jelentik haemophiliában a vérzéses mortalitás leggyakoribb formáját. A sebészeti beavatkozások utáni elhúzódó és adekvát kezelés nélkül gyakran fatális kimenetelű utóvérzés nemcsak a súlyos, hanem a középsúlyos-mérsékelt haemophiliára is jellemző.
III. A haemophilia kezelésének általános szempontjai
A haemophilia kezelésének alapja a hiányzó véralvadási fehérje pótlása (szubsztitúció), mely jelenleg kizárólag parenterális (intravénás) úton történhet.
A vérzések kezelésére illetve prophylaxis céljából plasma eredetű és rekombináns készítmények adhatók.
Szubsztitúciós kezelés a következő esetekben szükséges:
- vérzések fellépésekor
- vérzések veszélyének fennállása esetén (invazív beavatkozások, műtét, foghúzás)
- prophylaxis céljából.
A szubsztitúciós kezelés megtervezésekor a kiindulási faktorpótlás dózisát az alábbiak határozzák meg:
- beteg kiindulási faktorszintje = a haemophilia súlyossága
- vérzés lokalizációja és súlyossága
- beteg testtömege
- korábbi hasonló vérzés lefolyása
- VIII és IX faktor eltérő farmakokinetikai tulajdonsága
B - haemophiliában a szövetekbe történő kiáramlás miatt a kezdő adag nagyobb, a biológiai felezési idő viszont a ritkább alkalmazást is lehetővé teszi. A VIII-as faktor recovery- (= biológiai hasznosulás) értéke 90-100 %, szemben a IX-es faktor mindössze kb. 50%-os értékével. Az ismételten szükséges faktorpótlást a biológiai "felezési idő" (T 1/2) is befolyásolja. Miután a VIII-as faktor félélet ideje 8-12 óra, a fenntartó FVIII pótlás során naponta általában 2 x-i bolus injekciót alkalmazunk. A IX-es faktor félélet ideje hosszabb a VIII-as faktorénál (T 1/2 =16-18 óra), így B- haemophilia esetén naponta egyszeri FIX pótlás is elegendő lehet.
IV. Rehabilitáció - V. Gondozás
A haemophilia "A" és "B" betegség ellátása tehát részben a vérzések kezeléséből és a vérzések megelőzéséből áll. Tekintettel arra, hogy súlyos és ritka betegségről van szó, az ellátás nem merülhet ki csupán az előbbiekben. Szükséges a hemophiliás betegek adatbázisának létrehozása, karbantartása, és azoknak a team-eknek a felállítása, akik a haemophilia ellátásban gyakorlottak. A betegség örökletes jellege és a súlyos potenciális szövődmények összehangolt egészségügyi munkát követelnek. Fontos, hogy a betegek ellátásában a haemophilia kezelésben jártas hematológus orvos és nővér vegyen részt. A haemofília kezelésének két alapvető módja ismert.
1. az aktuális vérzés ellátása, on-demand kezelés. A kezelés ezen módja a hosszú távú szövődmények elkerülését nem teszi lehetővé.
2. A profilaxis, heti több alkalommal jelent faktorpótlást. A kezelésnek ez a módja a vérzések megelőzésére és a hosszú távú szövődmények, elsősorban az arthropathia kivédésére szolgál. Primer profilaxisról beszélünk, ha olyan kisgyermeknél alkalmazzuk a profilaxist akinek még nem volt több ízületii vérzése és nincsen ízületi deformitása, és/vagy a kezelés a 2 éves kor előtt megkezdődött. Secunder profilaxisról akkor beszélünk amikor a korábban már többször vérző ízületek újabb vérzései megelőzése céljából alkalmazunk rendszeres kezelést. A betegek kezelése történhet egészségügyi intézményben és kontrollált otthoni kezelés (KOK) formájában. [24/1998. (XII. 27.) EüM rendelet]
A HAEMOPHILIA "A "ÉS "B" KEZELÉSE
I. Alapvető megfontolások
1. Az irányelv alkalmazási / érvényességi területe
Felnőttgyógyászat 18 év felett BNO: D6600; D6700 Haemophilia "A" Haemophilia "B"
A szakmai protokoll vonatkozik a hematológusok, transzfúziológusok tevékenységi körére
2. Az irányelv bevezetésének alapfeltétele
Az irányelv alkalmazásának alapfeltétele a haemophilia "A" és "B" diagnosztizálása. A betegek olyan haemophilia kezelőhelyen kerüljenek kezelésre ahol teljesülnek a legmagasabb szintű betegellátáshoz szükséges szakmai minimumfeltételek, beleértve laboratóriumi diagnosztika, kísérő betegségek, szövődmények ellátásának lehetőségét.
Szükséges a haemophiliás betegek adatbázisának létrehozása, karbantartása és azoknak a teameknek a felállítása, akik a haemophilia ellátásban gyakorlottak. A betegség örökletes jellege, a súlyos szövődmények összehangolt egészségügyi munkát követelnek. Fontos, hogy a betegek ellátásában a haemophilia ellátásban jártas hematológus orvos és nővér vegyen részt.
3. Panaszok, tünetek, általános jellemzők
A VIII-as és IX-es véralvadási faktorok (továbbiakban FVIII ill. FIX) örökletes eltérései vérzékenységben nyilvánulnak meg. A FVIII gén defektusait és az általuk okozott klinikai tünetegyüttest "A" haemophiliának , míg az FIX gén defektusait pedig "B" haemophiliának nevezzük.
A két betegség tünetei és kezelésük elméleti alapja megegyezik. Vezető klinikai tünet a változatos lokalizációjú vérzés és a következményes szervi károsodások. A vérzések által okozott tartós szervi károsodások közül az ízületi károsodás a legjellemzőbb. A visszatérő vérzések okozta fájdalom, mozgásszervi korlátozottság következményes szociális problémákat és lelki károsodást is okozhatnak.
4. A betegség leírása
A haemophilia "A" és "B" betegség a VIII-as és IX faktorok reziduális aktivitása alapján súlyossági csoportokra oszthatók, melyek jól korrelálnak a klinikai képpel (1. táblázat.). A haemophilia "A" és "B" klinikai megjelenése azonos.
1. táblázat. A haemophilia súlyosság szerinti besorolása
| Súlyosság | Faktorszint % aktivitás (IU/ml) | Vérzés jellege |
| Súlyos | 1% (<0.01) | Spontán vérzés, főként az ízületekben és izmokban |
| Középsúlyos | 1%-5% (0.01-0.05) | Spontán vérzés ritka, de súlyos vérzés traumánál, műtétnél |
| Enyhe | 5%-40% (0.05-0.40) | Súlyos vérzés nagy traumánál vagy műtétnél |
A súlyos és középsúlyos betegek rendszeres faktorpótlásra szorulnak. Az enyhe haemophiliás betegek ritkán véreznek spontán, de nagy műtét beavatkozások, vagy trauma kapcsán vérezhetnek. Enyhe vérzékenyek lehetnek a carrier nők is, az ő kezelésük azonos a férfi enyhe haemophiliásokéval.
5. Érintett szervek
Haemophiliában gyakran ízületi, izomközti vérzések alakulnak ki. A beteg panasza az érintett terület fájdalma, melegsége, végtagok esetén az ízület korlátozott mozgása lehet. Compartment szindróma alakulhat ki nagyobb vérzések esetén, ez veszélyeztetheti a végtag keringését és beidegzését. A koponyaűri vérzés ritka rettegett tünet, gyakran fatális. A fej-nyak régió vérzései veszélyeztethetik a beteg életét. A fogászati beavatkozások, ha nem a megfelelő faktorpótlás mellett történnek, gyakran járnak utóvérzéssel. A vérzés lokalizációja szerint lehet még oropharingeális, mellkasi-, trachea-, tüdő-, gastrointestinalis és urogenitalis vérzés. Továbbá a vérzés lehet mellűri, hasűri intraperitonealis, retroperitonealis, létrejöhet hasűri szerv rupturája, iliopsoas bevérzés. A vérzések veszélyeztethetik a vérzésforrásként szereplő szerveket. Hordozó nőknél hypermenorhoea, nőgyógyászati vérzés előfordulhat.
6. Gyakori társbetegségek
- Haemarthrosis, haemophiliás arthropathia
- Chronikus C hepatitis azoknál a betegeknél, akik évtizedekkel ezelőtt még nem vírusinaktivált készítményt kaptak
- HIV/azoknál a betegeknél, akik évtizedekkel ezelőtt még nem vírusinaktivált készítményt kaptak
- Vashiányos vérszegénység
II. Diagnózis
Anamnézis
A családi anamézisben feltárandó az érintett családtagok száma, a részletes családfa, amely birtokában az öröklődés menet megállapítható. A betegek közel 1/3-nál újmutáció keletkezik így családi anamnézisük negatív. A beteg személyes kórtörténetének dokumentálása kulcsa a diagnosztikának, a klinikai kép leírását adja. Részei: első bevérzés időpontja, lokalizációja, a bevérzés körülményei, ismert társbetegségek. Fontos része az anamnézisnek a bevérzések gyakorisága, az alkalmazott terápia hatékonysága, a célízületiek feltárása, a társbetegségek számbavétele, az oltási bizonyítvány és a vírushordozás ismerete.
Fizikális vizsgálatok
Belgyógyászati vizsgálat, az esetleges változások feljegyzése célízületiek dokumentálása. Időszakos orthopaediai vizsgálat, egyéb szakorvosi vizsgálatok a klinikum alapján.
Laboratóriumi vizsgálatok:
Prothrombin idő (PI), aktivált parciális thromboplasztin idő (APTI), thrombin idő (TI), thrombocyta szám, APTI függő faktorok, von Willebrand betegség diff. dg. legalább 1x szükséges.
Faktor aktivitás mérés: Egylépcsős vagy kétlépcsős módszerrel, illetve chromogen teszttel. Koagulációs teszteknél az APTI faktorérzékenysége döntő, mert a nem megfelelő reagens választás tévesen negatív eredményt ad.
Inhibitor szűrés: keveréses teszttel történik, a vizsgált plazmához ún. normal plazmát adunk, ha nincs inhibitor, akkor a normál plazma mérési rendszerhez adása után az APTI korrigálódik (a mérési kontrollhoz viszonyítva normális határon belüli lesz). Inhibitor és lupusz antikoaguláns esetén a normál plazma hozzáadása nem korrigálja a APTI megnyúlást. Ebben az esetben lupusz antikoaguláns vizsgálata differenciál diagnosztikai jelentőségű lehet. Az inhibitor mennyiségi meghatározás Bethesda módszerrel történik. Csökkent FVIII/FIX féléletidő is inhibitorra utalhat.
Inhibitorszűrés felnőtt betegeknél 50 expozición túl is ajánlott
- évente 4 alkalommal (keveréses teszt)
- gyanújelek fennállta esetén
- készítmény váltás esetén
- minden elektív műtéti beavatkozás előtt és utána egy hónappal Részletesen lásd a megfelelő fejezetet
Képalkotó vizsgálatok: gyermekeknél ízületi ultrahang, felnőtteknél ízületi röntgen sz.sz. MRI vizsgálat (ha terápiás következménye van). Testüregi vérzések diagnosztizálása CT lumenes szerveknél endoscopia, bronchoscopia. Fül-orr-gégészeti, urológiai, nőgyógyászati területeken speciális eszközös vizsgálatok és a szakmai követelményeknek megfelelő képalkotó vizsgálatok
Egyéb: Vírus szűrés: hepatitis vírusok (HBsAg, anti-HBc, anti-HCV) és pozitivitás esetén HCV RNS meghatározás, ill. pozitivitás esetén verifikáló vizsgálatok javasoltak. HCV pozitív betegeknél GPT értéktől függetlenül hasi ultrahang, a májfibrosis noninvazív megítélésére fibroscan javasolt. HBsAg szűrés negatí esetben a védőoltás szükséges. Vírusszűrés évente tervezetten 1-2 alkalommal és készítmény váltáskor szükséges.
A HIV pozitív betegek gondozása javasolt az Országos Központban (Budapest, Szent László Kórház).
III. Kezelés
1. Nem gyógyszeres kezelés
RICE: (rest, ice, compression, and elevation ) A hemophiliás betegeknél a faktorpótlás mellett gondot kell fordítani arra, hogy a bevérzett izom, vagy ízület nyugalomba kerüljön, a területet jegelni kell 20 percig 6 óránként, de nem direkt a bőrrel érintkező módon. A végtagot fel kell polcolni.
2. Gyógyszeres kezelés
A megfelelő egészségügyi ellátás szintje
OEP által kijelölt kezelőhelyek, sürgősségi ambulanciákon konzultálva haematológussal. Haematologiai kezelőhelyek, fekvőbeteg osztályok.
Kezelési alapelvek
A haemophilia "A" betegségben a vérzékenység VIII-as faktor adásával korrigálható, "B" hemofíliás beteg vérzékenysége IX-es faktor adásával korrigálható. (Level I, Grade A)
VIII-as és IX-es faktor farmakokinetikai tulajdonságai különböznek, a IX-es faktor visszanyerése faktorpótlás után alacsonyabb, mint VIII-as faktor esetében. A farmakokinetikai tulajdonságok az egyes betegek esetében is eltérőek, ezért minden betegnél legalább 1 alkalommal javasolt elvégezni a faktor visszanyerés, és a fél-élettartam vizsgálatot. Ezen adatok ismerete mind a hatékony terápia mind a profilaktikus dózis tervezéséhez fontos lehet. A fél-élettartam lerövidülése informatív lehet kis titerű inhibitor jelenlétére.
A haemophiliás vérzés kezelését lehetőség szerint minél hamarabb, de legalább 2 órán belül el kell kezdeni kezelni. Nem szabad megvárni a klinikai tünetek kialakulását.
Felnőtt betegek rendszerint jelzik a vérzés megindulását, amit "aura" szerűen élnek meg. A kezelés korai megkezdése gyakran megállítja a vérzést és ezzel megelőzi szöveti károsodás kialakulását.
Sérülés esetén a haemophiliás nagy valószínűséggel vérezhet. A korai kezelés kevesebb faktorfelhasználást igényel, és a beteg is hamarabb felgyógyul.
Szubsztitúciós kezelés szükséges
A FVIII és FIX veleszületett hiányában/csökkent faktorszint esetén szubsztitúciós kezelés szükséges az alábbi esetekben:
- vérzések fellépésekor,
- vérzés veszélyének fennállása esetén,
- invazív beavatkozások/foghúzás előtt,
- profilaxis céljából.
A kiindulási faktorszint emelkedése
A kiindulási faktorszintet a szubsztitúciós kezelés az alábbi mértékben emeli:
- 1 E FVIII/ttkg 1,5-2%-kal,
- 1 E FIX/ttkg 1%-kal.
Az alvadási faktor pótlásának dózisa
A véralvadási faktorpótlás dózisát meghatározzák az alábbiak:
- a beteg kiindulási faktorszintje
- a vérzés lokalizációja, súlyossága
- a beteg testsúlya
- korábbi, hasonló vérzés lefolyása
A szükséges faktorpótlást befolyásolja a biológiai recovery és a felezési idő.
Inhibítorral nem rendelkező betegnél a következőképpen alakul, de ettől eltérő egyéni variációt is mutathat.
A faktorpótlás egyszeri adagja:
FVIII NE =ttkg x elérni kívánt faktor %x0,5 (1 E/ttkg = ca. 2% -kal emeli a FVIII aktivitást) FIX NE = ttkg x elérni kívánt faktor% x1 (1 E/ttkg = ca. 1% -kal emeli a FIX aktivitást)
A faktorpótlás gyakorisága:
FVIII naponta 2x (recovery 90-100%, féléletidő 8-12 óra)
FIX naponta 1x (recovery 50%, féléletidő 16-18 óra).FIX hiányában a fenti ajánlás megfelelő, de a szövetekbe történő kiáramlás miatt a kezdő adag nagyobb
Recovery
A recovery számítása fontos a terápia tervezéséhez, valamint az immuntolerancia indukció követéséhez. A FVIII v. FIX recoveryt, azaz "visszanyerést" a specifikus faktor adása után mérjük.
A vizsgálatot általában kétévente ajánlott elvégezni, gyakrabban szükséges gyermekeknél a növekedés miatt, felnőtt esetében pedig inhibítor kialakulásának gyanúja esetén.
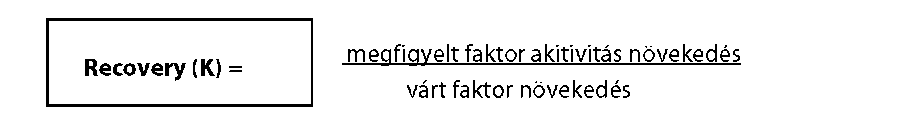
Megfigyelt faktor aktivitás növekedés = faktor beadás előtti faktor aktivitás - faktor beadás utáni faktor aktivitás
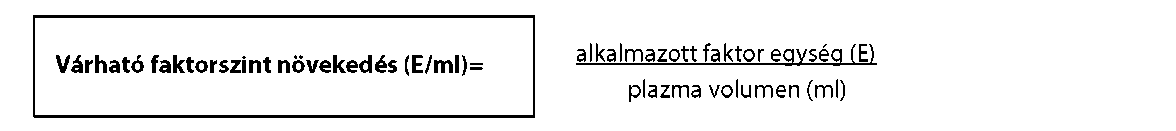
Plazma volumen(ml) = 41x ttkg felnőtt esetében, 50x ttkg gyermek esetében Cél K érték = 0,8-1,2 FVIII esetében
Biológiai felezési idő:
Sorozat FVIII/FIX méréssel grafikusan kalkulálható. Mérési pontok a faktor beadás előtt, után 2 óra múlva és 12 óra múlva. Amennyiben több mérési pontot alkalmazunk, a kalkuláció pontosabb lehet.
A hemophilia kezelésének két alapvető módja ismert az on demand kezelés és a profilaxis. On-demand kezelés
A vérzés kezelése profilaxisban nem részesülő beteg esetében.
Az aktuális vérzés ellátása on-demand kezelés. A kezelés ezen módja a hosszú távú szövődmények elkerülését nem teszi lehetővé.
Ajánlás a 2. táblázatban olvasható
2. táblázat. Faktorpótlás különböző vérzéstípusokban
| Hemofília A | Hemofília B | |||
| A vérzés típusa | kívánt faktorszint | napok száma | kívánt faktorszint | napok száma |
| ízületi | 40-60% | 1-2, de lehet hosszabb | 40-60% | 1-2, de lehet hosszabb |
| is rossz válasz esetén | is rossz válasz esetén | |||
| izom (kivéve iliopsoas) | 40-60% | 2-3, de lehet hosszabb | 40-60% | 2-3, de lehet hosszabb |
| is rossz válasz esetén | is rossz válasz esetén | |||
| Iliopsoas | ||||
| kezdeti | 80-100% | 1-2 | 60-80% | 1-2 |
| fenntartó | 30-60% | 3-5, de lehet hosszabb | 30-60% | 3-5, de lehet hosszabb |
| is rossz válasz esetén | is rossz válasz esetén | |||
| A vérzés típusa | Hemofília A kívánt faktorszint | napok száma | Hemofília B kívánt faktorszint | napok száma |
| KIR, fej | ||||
| Kezdeti | 80-100% | 1-7 | 60-80% | 1-7 |
| fenntartó | 50% | 8-21 | 30% | 8-21 |
| Mellkas és nyak | ||||
| kezdeti | 80-100% | 1-7 | 60-80% | 1-7 |
| fenntartó | 50% | 8-14 | 30% | 8-14 |
| Gastrointestinalis | ||||
| kezdeti | 80-100% | 1-6 | 60-80% | 1-6 |
| fenntartó | 50% | 7-14 | 30% | 7-14 |
| Vese | 50% | 3-5 | 40% | 3-5 |
| Mély zúzott seb | 50% | 5-7 | 40% | 5-7 |
| Sebészet (nagy) | ||||
| Pre-op | 80-100% | 60-80% | ||
| Post-op | 60-80% | 1-3 | 40-60% | 1-3 |
| 40-60% | 4-6 | 30-50% | 4-6 | |
| 30-50% | 7-14 | 20-40% | 7-14 |
Kiegészítő javaslatok:
Gastrointestinalis vérzésnél antifibrinolítikus kezelés javasolt.
Haematuria esetén bő folyadékfogyasztás, sz.e. spazmolytikum. Antifibrinolyticus kezelés kontraindikált.
Felnőttkorban a terápia dózisa és gyakorisága kialakításánál figyelembe kell venni a vérzékenység mértékét és az egyéni farmakokinetikai tulajdonságokat. (Level II, Grade C)
Profilaxis Tartós profilaxis
1. Azoknál a betegeknél, akik 18 éves koruk előtt is tartós profilaxisban részesültek (primer profilaxis) a felnőttkor elérése után is javasolt folytatni a profilaxist. (Level III, Grade B)
2. FVIII profilaxis esetében két profilaktikus inj. alkalmazása között nem legyen több mint 48 h (Level II, Grade B)
3. A felnőttkori secunder profilaxis hatékonysága az irodalomban kevesebbet vizsgált terület, mint a gyermekkori profilaxis. A kezelésnek ezen formája hatékony lehet.
4. Súlyos haemophiliás betegeknél egyéni mérlegelés alapján a beteggel történt megbeszélés alapján a kezelőorvos dönthet profilaxis bevezetéséről.
5. Javasolt a secunder profilaxis bevezetése azon felnőtt súlyos haemopiliás betegeknél akiknél több mint évi 10 vérzéses epizód van.
6. Felnőttkorban a fizikai érés elérése után amennyiben a fizikai aktivitás is csökken a profilaxis ideális dózisát egyéni elbírálás alapján mérlegelni kell.
7. Felnőttnél megnövekedhet a készítmény féléletideje, változhat a recovery is.
8. Ha korábban profilaxisban részesülő betegnél ismét gyakori vérzések tapasztalhatók - A profilaxis adásának módját 6 havonta ismételten értékelni kell.(Level II, Grade D)
9. Tartós secunder profilaxis javasolt KIR vérzés után, ha annak oka ismeretlen
10. Sikeres ITI után tartós profilaxis javasolt.
Korlátozott idejű profilaxis javasolt
1. műtéti beavatkozások után (2. sz. táblázat szerint)
2. ízületii protézisek után min. fél évig
3. visszatérően vérző célízületi esetén 4-8 hétig
4. gyógytorna, rehabilitációs kezelés során
5. életmód váltás tartós fizikai, pszichés megterhelés alkalmával
A profilaktikus terápia dózisa:
1. Haemophilia "A" 25-50 IU/kg FVIII heti 3x
2. Haemophlia "B" 25-50 IU/kg FIX heti 2x
Kontrollált otthoni kezelés (KOK) (24/1998.(XII.27) EüM rendelet)
- súlyos betegeknél
- gyakran vérző beteg is,- középsúlyos vérzékenység esetén is
- gondozó helytől távol lakó betegeknél alkalmazható
- a beteg kérésére, előzetes orvosi felkészítés és képzés alapján történik a kiválasztás
- kezelés napló vezetése szükséges a beteg otthonában
- 3 havonta ellenőrzés a gondozóhelyen
- szükség esetén szakmai tanácsadás
Kontrollált otthoni kezelés keretében kezelhető vérzéstípusok:
- ízületii vérzés (egy ízületi érintettség)
- izomvérzés (nem kiterjedt)
- nyitott sebek (sebészeti ellátást nem igénylő)
A készítmény kiválasztása
A haemophlia kezeléséhez alkalmazhatunk plazma eredetű és rekombináns faktorokat. Az egyes plazma eredetű faktorok a gyártási, illetve vírusinaktiválási módszerekben különböznek egymástól. A rekombináns VIII-as faktorok tartalmazhatják az egész cDNS-nek megfelelő fehérjét, vagy létezik B domén depletált recombináns faktor is. A forgalomban lévő faktorok hatékonysága és biztonságossága megfelelő.
1. Azon betegek esetében akik soha nem kaptak plazma eredetű faktort a rekombinánlt típusú faktorpótlás javasolt. Azoknál a fiatalabb betegeknél akik gyermekkorukban is rekombinánlt készítményt kaptak a kezelést rekombinált készítmény adásával kell folytatni.
2. A korábban sikeres immuntolerancia indukción átesett betegek esetében tartós profilaxis javasolt lehetőség szerint azzal a készítménnyel, amivel az immuntolerancia indukciót végezték.
Inhibítorral rendelkező beteg speciális ellátást kíván lásd megfelelő fejezet.
Inhibitor képződés
A haemophlia legrettegettebb szövődménye. Haemophilia A-ban inhibitor képződés a betegek 10-15%-nál is előfordulhat Magyarországon (nyugati országokban 25-30%), B haemophiliában 5%. Ezeknél a betegeknél a korábban alkalmazott VIII-as és IX-es faktor szokásos dózisban hatástalanná válik. Kis, <5% alatti BE esetében meg lehet kísérelni nagyobb dózisú faktor adását, de nagyobb inhibitor titer esetében csak bypass készítmények (aPCC, rFVIIa) adása jön szóba. Lásd a megfelelő fejezetet.
Ischaemiás szívbetegség kezelése
A haemophiliás betegek életkilátásainak javulásával, növekszik köztük a cardiovasculáris betegek száma. Ellátásuknál speciális szempontok érvényesülnek.
Thrombolysis. STEMI esetében haemophiliás betegeknél PCI javasolt, thrombolysis nem ajánlott. A PCI radiális behatolásból ajánlott, mivel a femorális behatolás 70%-ban oka a szövődményes vérzéseknek. PCI előtt a faktor szubsztitúciót meg kell adni. A szükséges faktor szubsztitúció telítő dózis 40U /ttkg Haemophilia "A"-ban és 80 U/ttkg haemophilia "B" esetében, amely szintet 48 óráig kell fenntartani. PCI-nál BMS (bare-metal stent) használata ajánlott, mert rövidebb idejű thrombocyta aggregáció gátló kezelést igényel.
Aszpirin: Kisdózisú Aszprin kezelés (80-100 mg) enyhe és középsúlyos haemophiliában Profilaxis nélkül alkalmazható szoros követés mellett. Ha a vérzések gyakorisága növekszik, akkor a kezelést le kell állítani. Súlyos haemophiliában az Aszpirin alkalmazása vitatott, lehetséges profilaxis mellett alkalmazni. Stabil anginában súlyos haemophiliás betegeknél az Aszpirin indikációja kétséges.
Clopidrogel
600 mg telítő dózist követően 75 mg/nap BMS stent beültetése után, súlyos vérzéses kockázatnál 2 hétig.
Heparin
Teljes faktor szupportáció mellett UFH adása standard cardiológiai protokollok szerint lehetséges. APTT kontrollja szükséges normál APTI reagenssel, hogy a heparin hatás mérhető legyen.
LMWH: alkalmazható faktor szubsztitúció mellett, dózisa: 100 U kg-1 sc. Naponta 2x
Desmopressin: alkalmazása coronaria betegség esetében nem ajánlott, növeli 10-20%-kal a szívfreqvenciát ami magasabb disztolés nyomáshoz vezet az antidiuretikus hatás jelentősen növeli a cardiocvasculáris kockázatot.
Fogászati ellátás
1. Fogászati beavatkozás előtt szükséges a gondozó orvossal konzultálni
2. Foghúzás esetén szövetragasztó alkalmazása cost effectív lehet
3. Súlyos haemophiliás betegnél a faktorkészítményt a beavatkozás előtt be kell adni, ne kapjon érzéstelenítő inj-t szubsztitúció nélkül
4. Enyhe haemophliás betegeknél a nem sebészeti fogászati beavatkozások elvégezhetők tranexamsav alkalmazása mellett
5. Enyhe hemophiliás betegeknél ( FVIII>5%) a fogászati beavatkozás elvégezhető Desmopressin (DDAVP) adása mellett
6. 5%-os tranexamsav 2 percig a szájban tartva napi 4 alkalommal szignifikánsan csökkenti a vérzést
7. Fájdalomcsillapításra nem ajánlott ASA vagy más nonsteroid adása Paracetamol/acetaminophen és codein alkelmazása biztonságos és hatékony alternatív gyógymódot jelent.
Vírus szűrés vakcináció
A hepatitis A és B elleni vakcináció hatékonyan megelőzi a fertőzést és alkalmazása megfontolandó olyan betegek számára, akik rendszeresen kapnak vérkészítményt, vagy immunszuprimáltak. A védőoltást subcutan kell adni a vérzésveszély csökkentése miatt.
Evidencia szint: (Level II, Grade B)
Az oltások megtörténtéről az oltottat egyéni dokumentációval is el kell látni. 15 évesnél fiatalabbak oltásait a "Gyermekegészségügyi kiskönyv"-be, a felnőttkori védőoltásokat a "Védőoltási könyv 14 évfeletti személyek részére" című személyi oltási könyvbe kell bejegyezni. 18/1998. (VI. 3.) NM rendelet
A rendszeres faktorpótlásban részesülő betegek vírusszűrése évente indokolt Hepatitis B és HCV-re A HCV pozitív betegek rendszeres hepatológiai ellenőrzése indokolt.
Kontraindikációk
Az adott típusú faktor beadásának kontraindikációja, ha a beteg a faktorra túlérzékeny, vagy inhibitor képződés miatt nem adható, mert a beteg nincs immuntolerancia kezelés alatt.
Lehetséges jelentős interakciók
Jelentős interakcióval nem kell számolni
Kiegészítő/Alternatív gyógyszeres kezelés
1. Desmopressin (DDAVP,1-deamino-8-D-arginine, vasopressin) Az antidiuretikus hormon szintetikus analógja. A DDAVP emeli a VIII-as és a von Willebrand faktor szintet (az alapszint 2-8x-ra) alkalmazása alternatív lehetőség enyhe és középsúlyos haemophiliában, ha a megelőző DDAVP teszt hatékonynak bizonyult Dózisa: 0,3 mikrogramm/ttkg. Többszöri alkalmazásakor a tachyphylaxis jelenségével kell számolni. A DDAVP adása rendkívül hasznos lehet carrierek esetében, mert el lehet vele kerülni a faktor szubsztitúciót. Idősebb artériás érbeteg haemophiliásoknál óvatossággal alkalmazható. Súlyos vérzékeny betegek kezelésére alkalmatlan.
2. Antifibrinolytikumok: Tranexamsav 3-4 g/nap dózisban 5-10 napig alkalmazva hatékony nyálkahártya vérzésekre (orrvérzés, fogászati vérzés). Urológiai vérzésnél kontraindikáltak. Kerülni kell az adásukat PCC és aPCC adása mellett a thromboticus komplikáció veszélye miatt. Gastrointestialis vérzésnél, kiegészítő antifibrinolyticus kezelés (tranexamsav,) szükséges, és hasznos. Az inj. gyors beadásakor hipotenzió, verítékezés előfordulhat.
3. Nem javasolt olyan készítmény használata, amelyek befolyásolják a TCT funkciót acetilszalicilsav (ASA), non-steroid gyulladáscsökkentők kivéve a COX-2 gátlók. A paracetamol/ acetaminophen biztonságos szerek a fájdalomcsillapításra
4. Nem javasolt intramuszkuláris injekció adása.
5. Spazmolitikum adása vesevérzés esetén indokolt bőséges folyadékfogyasztás mellett, tranexamsav kontraindikált.
Fizikai aktivitás
Acut bevérzés esetén nem ajánlott a fizikai aktivitás, a nem gyógyszeres terápiánál megadottak szerint kell eljárni. Vérzés után fokozatosan kell visszatérni a fizikai aktivitásra
Betegoktatás
Haemophilia nap évente 1 alkalommal megszervezhető egymáshoz közeli ellátó helyek esetében közösen. KOK-ra betanítás egyénileg Együttműködés a betegszervezetekkel
IV. Rehabilitáció
A rehabilitáció szükségességének paraméterei
Rehabilitáció szükséges, ha a beteg ízületi funkciói vagy általános állapota, ismétlődő vérzések következtében romlott. Tartós mozgásszervi rehabilitáció szükséges ízületi deformitások esetén.
V. Gondozás
A haemophiliás beteg gondozása az OEP által kijelölt Kezelőcentrumokban történik. A vérzékenység gyanúját felismerő orvos köteles a legközelebbi, vérzékeny betegek ellátására szakosodott intézményhez (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok) fordulni. A diagnosztikát az arra alkalmas, akkreditált laboratórium, a kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége. A tartósan kezelt beteg 3 havonta az időszakosan kezelt beteg évente jelenik meg. Évente hasznos (kötelező) vizsgálatok: fizikális vizsgálat, ízületi status felmérése, inhibitor szűrés.
Megelőzés
Profilaktikus kezeléssel megelőzhetőek a súlyos ízületi deformitások
Lehetséges szövődmények
Ízületii deformitások, haemophiliás arthropathia
A szövődmények kezelése
Mozgásszervi rehabilitáció
Inhibitor képződésnél immuntolerancia kezelés
Kezelés várható időtartama/Prognózis
A kezelt haemophiliás betegek életkilátásai megközelítik a nem haemophiliás populációét.
VI. Irodalomjegyzék
1. Az örökletes vérzékeny betegek kontrollált otthoni kezeléséről. 24/1998. (XII. 27.) EüM rendelet
2. 18/1998. (VI. 3.) NM rendelet a fertőző betegségek és a járványok megelőzése érdekében szükséges járványügyi intézkedésekről.
3. Swedish Guidlines for: The care and treatment of haemophiliacs Published 2003
4. Guidlines for the management of hemophilia World federation of Hemophilia 2005
5. National guidlines: Management of Haemophilia Treatment Protocols Copmlied by the Medical Advisory Committee of Haemophilia Fundation of New Zeland 2005
6. Guidlines For Dental Treatment Of Patinets With Inherited Bleeding Disorders Patients With Inherited Bleeding Disorders World Federation of Hemophilia, 2006
7. Richards M, Altisent C, Batorova A, Chambost H, Dolan G, de Moerloose P, Fraga M, Hermans C, Karafoulidou A, Klamroth R, Lassila R, Rothschild C. Should prophylaxis be used in adolescent and adult patients with severe haemophilia? An European survey of practice and outcome data. Haemophilia 2007;13:473-9.
8. Roosendaal G, Lafeber F. Prophylactic treatment for prevention of joint disease in hemophilia--cost versus benefit. N Engl J Med 2007;357:603-5.
9. Manco-Johnson MJ, Abshire TC, Shapiro AD et al: Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia. N Engl J Med. 2007; 357:535-44.
10. Hay CR:Prophylaxis in adults with haemophilia. Haemophilia. 2007;13 Suppl 2:10-5.
11. MASAC Recommendation Concerning Prophylaxis (Regular Administration ofFactor Concentrate to Prevent Bleeding) MASAC Document #179 (Replaces #170) Medical and Scientific Advisory Council (MASAC) on November 3, 2007, and Medical and Scientific Advisory Council (MASAC) on November 3, 2007, and adopted by the NHF Board of Directors on November 4, 2007. In view of the demonstrated benefits of prophylaxis (regular administration of clotting factor 7)
12. Roosendaal G, Lafeber F. Prophylactic treatment for prevention of joint disease in hemophilia--cost versus benefit N Engl J Med 2007; 357:603-5.
13. Keeling D, Tait C, Makris M. Guideline on the selection and use of therapeutic products to treat haemophilia and other hereditary bleeding disorders. A United Kingdom Haemophilia Center Doctors' Organisation (UKHCDO) guideline approved by the British Committee for Standards in Haematology. Haemophilia. 2008;14:671-84.
14. Tagliaferri A, Di Perna C, Rivolta GF.Secondary prophylaxis in adolescent and adult haemophiliacs.Blood Transfus. 2008;6: Suppl 2,17-20.
15. Coppola A, Franchini M, Tagliaferri A. Prophylaxis in people with haemophilia. Thromb Haemost. 2009; 101:674-81.
16. Coppola A, Franchini M, Tagliaferri A. Prophylaxis in people with haemophilia. Thromb Haemost. 2009;101:674-81.
17. Schutgens RE, Tuinenburg A, Roosendaal G, Guyomi SH, Mauser-Bunschoten EP Treatment of ischaemic heart disease in haemophilia patients: an institutional guideline Haemophilia. 2009;15:952-8.
18. Richards M, Williams M, Chalmers E, Liesner R, Collins P, Vidler V, Hanley J; Paediatric Working Party of the United Kingdom Haemophilia Doctors' Organisation. A United Kingdom Haemophilia Centre Doctors' Organization guideline approved by the British Committee for Standards in Haematology: guideline on the use of prophylactic factor VIII concentrate in children and adults with severe haemophilia A. Br J Haemat 2010;149:498-507.
Kapcsolódó internetes oldalak
VII. Melléklet
Szükséges dokumentumok és bizonylatok
A Regionális Vérellátó Központokból, az OEP véralvadási faktor különkeretének Felhasználó Centrumaiból szerzendők be a vérkészítmények rendelésére vonatkozó mindenkori szabályok szerint.
Felelős személy Felelős intézmények: Felhasználó centrumok, akikkel az OEP szerződést kötött. A kezelést az adott intézmény haematologus, transzfuziológus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
Érintett társszakmákkal való konszenzus
A következő szakmák együttműködése indokolt a hemofíliás beteg ellátása során: Orthopéd sebész, Rheumatologus, Fogorvos, Genetikus, Hepatológus, Fertőző szakorvos, Immunológus, Laboratóriumi szakorvos.
VELESZÜLETETT VÉRZÉKENY BETEGEK SÜRGŐSSÉGI ELLÁTÁSA
I. Alapvető megfontolások
1. Az irányelv alkalmazási/érvényességi területe
Felnőttgyógyászat 18 év: felett
BNO: D6600; D6700 , D6800, D6810, D6820
Haemophilia A, Haemophilia B, von Willebrand betegség, ritka faktorhiányok, thrombocytopathiák
2. Definíció
A vérzékeny betegek sürgősségi ellátása magában foglalja az ismert vérzékenyek speciális ellátási szempontjait, valamint a korábban nem diagnosztizált enyhe vérzékenységek klinikai gyanújeleit, további laboratóriumi vizsgálatainak javaslatait.
3. Az irányelv bevezetésének alapfeltétele
A sürgősségi ellátásban résztvevő orvosok ismerjék, hogy az OEP által kijelölt Felhasználó Centrum közül kivel kell felvenniük a kapcsolatot a vérzékeny beteg ellátása során. Ehhez szükséges, hogy a sürgősségi helyszínek ismerjék, hogy hol vannak a Felhasználó Centrumok. Egyértelművé kell tenni, hogy a távolabbi kezelőhelyen gondozott beteg sürgősségi ellátásához szükséges faktort is a legközelebbi Felhasználó Centrumból kaphatja meg. A sürgősségi helyszínnek a Felhasználó Centrumból, az ellátáshoz szükséges faktort, lehetőleg egy órán belül be kell szereznie.
Vérzékeny betegek sürgősségi ellátásakor a vérzékenységből adódó teendők az elsődlegesek.
Ha egy vérzékeny beteg sürgősségi ellátása nem a vérzékenységével kapcsolatos, de az ellátáshoz invazív beavatkozásra, vagy műtétre van szükség, arra a hemosztázis rendezése után kerülhet sor. A procedúra során a beteg nem kerülhet késedelmes helyzetbe.
3.1. Ismert vérzékeny beteg diagnózisát nem kell megerősíteni, a kezelést véralvadási vizsgálatok nélkül mindig haladéktalanul meg kell kezdeni.
3.2. Korábban nem diagnosztizált középsúlyos, vagy enyhe veleszületett vérzékenység gyanúja merül fel a traumával nem arányos vérzésvesztés, szokatlan vérzéses lokalizáció, ismeretlen helyről induló mellkasi vagy hasűri vérzéskor. Ezekben az esetekben diagnosztikus tevékenységre is szükség van: azonnali vizsgálatok: PT, APTT, TI, fibrinogén, vérkép. 24 órán belül szükséges lehet faktorszint meghatározásra, ill. részletesebb véralvadási diagnosztikára. Ezek kivitelezését a haemophilia kezelőhely hematológus szakorvosa irányítja. Az antithromboticus kezelésben részesülők vérzékenységére vonatkozó kezelési protokoll nem tartozik jelen ajánlás alkalmazása területébe.
4. Kiváltó tényezők:
A) Veleszületett vérzékenység +trauma
B) Örökletes vérzékenység talaján spontán vérzés indulhat a test bármely részéről
C) Veleszületett vérzékenység + komorbiditás
Gyakori komorbiditás sürgősségi helyzetben: GI vérzés ulcus, oesophagus varicositas talaján, cerebralis vérzés magas vérnyomás vagy érmalformáció miatt, orrvérzés lokális okból, urogenitális vérzés a vese, vagy a hólyag megbetegedéséből, nőgyógyászati vérzés bármely okból. Kockázati tényezők: trauma, műtét, társbetegségek
5. Panaszok, tünetek általános jellemzők
A panaszok és tünetek két fő csoportra oszthatók.
A vérzés lokalizációja olyan, hogy nyilvánvaló klinikai tünetet ad a fejen, a nyakon, a törzsön és a végtagokon. A vérzés traumás, vagy nem traumás eredettel a következő tüneteket okozhatja még: duzzadt, fájdalmas ízület, vérköpés, vérhányás, vérvizelés, vérszékelés, nőgyógyászati vérzés. Compartment szindróma kialakulása.
A vérzés nem okoz nyilvánvaló tünetet, ebbe a csoportba tartozik az életet veszélyeztető vérzések jelentős része. Új neurológiai tünet jelentkezése, látásvesztés, nyelési nehezítettség, ismeretlen eredetű mellkasi fájdalom, aszimmetria a mellkasfalon, ismeretlen eredetű hasi fájdalom, jelentős oldalkülönbség a végtagok átmérőjében. A vérvesztés tünetei: sápadtság, gyengeség, szapora szívverés, alacsony vérnyomás ismeretlen vérzésforrás mellett.
Érintett szervek leggyakoribb vérzései:
Központi idegrendszeri vérzés
intracranialis
gerincvelői
Légzést akadályozó lágyrész vérzések
retropharyngealis vérzés fogászati beavatkozás után
dissecaló haematoma a nyakon
trachea vérzés, mesterséges lélegeztetés tubus használata mellett nagy nyelv haematoma
Gastrointestinalis vérzés
haematemesis oesophagus sérülés, gyomor, vagy duodenum fekély miatt rupturált oesophagus varixvérzés
hematochesia, melaena, teleangiectasia, polyp- vagy egyéb eredetű vérzés miatt
Rupturált parenchymas szerv
lép, vese, májruptura bélfal haematoma rupturált appendix
rupturált medencei, vagyhasi pseudotumor
Acut compartment szindróma
haematoma okozta keringés, és idegkárosodás, gyakori végtagon
Szem körüli vérzés
üvegtesti vérzés
orbita haematoma törés miatt
kötőhártya vérzés
II. Diagnózis
Anamézis: Ismert vérzékenység esetében a betegtől vagy a hozzátartozótól információt kell szerezni a vérzékenység típusára, súlyosságára vonatkozóan. Amennyiben a betegnél van a gondozási könyve abban ezek az adatok szerepelnek. A gondozási könyvben megtalálható még az alkalmazott faktorkészítmény típusa, a gondozást végző orvos neve és telefonszáma is. Ha az adatok nem hozzáférhetőek (pl. súlyos baleseti sérülésnél) de a kezelés megkezdéséhez elkerülhetetlenül szükségesek, kapcsolatba kell lépni valamely Felhasználó Centrummal, ahonnan a TAJ szám alapján a beteg adatai lekérhetők.
Fizikális vizsgálatok: Alap belgyógyászati vizsgálat. Az érintett régió szerinti szakvizsgálat: neurológiai, traumatológiai, ortopédiai, fül-orr-gégészeti, szemészeti fogászati, sebészeti, kardiológiai, urológiai, nőgyógyászati.
Laboratóriumi vizsgálatok PI, APTI, TI, fibrinogén, vérkép. Faktorérzékeny APTI reagenseket használjunk, mert egyébként már 30%-os faktorszint mellett sem kapunk kórjelző APTI megnyúlást, és a vérzékenység nem diagnosztizálható. A laboratóriumi vizsgálatok a kezelés követésére, új eset diagnosztizálására kiegésztítő faktorpótlás tervezéséhez szükségesek (pl. kisérő májbetegség esetében faktorpótlás+ FFP adása szsz. thrombocyta adása). Ismert beteg esetében a faktor adásának meg kell előznie a laboratóriumi vizsgálatokat.
Gyógyszerek, amelyek befolyásolhatják a laboratóriumi eredményeket:
Non-steroid gyulladás gátlók, heparin készítmények, kumarinok
Betegségek amelyek befolyásolhatják a laboratóriumi eredményeket
májbetegség, immunológiai betegség, tumorok, acut haemorrhagiás állapotok, infectio, DIC
Képalkotó vizsgálatok:
Központi idegrendszeri bevérzés gyanújakor a faktor kezelés megkezdése után CT és MRI vizsgálat javasolt.
GI vérzés esetén a shocktalanítás, a vérzés lokalizációjának megállapítása elengedhetetlen (CT, MR, endoscopia, angiographia
vagy egyéb).
Súlyos állapotú betegnél CT vizsgálat indokolt mellűri, hasűri vérzés gyanújakor. Ízületii vérzés esetében röntgen vizsgálat nem szükséges.
Nagy izombevérzés esetében monitorozni kell a beteget compartment szindróma irányába ultrahang, CT, MR indokolt.
Kiegészítő laboratóriumi diagnosztikai vizsgálatok
Faktor meghatározás. Inhibitor szűrés keveréses módszerrel, thrombocyta aggregáció vizsgálata.
Differenciál diagnosztika:
DIC, TTP, HELLP, ITP, véralvadás és trombocyta aggregációt gátló gyógyszeres kezelés. Iliopsoas bevérzést el kell különíteni az appendicitistől.
III. Kezelés
Nem gyógyszeres kezelés
A sérült végtag nyugalomba helyezése, felpolcolása, jegelése. Szivárgó vérzés esetén kompresszió alkalmazása.
Általános rendelkezések
Vérzékeny betegek sürgősségi ellátásánál az általános elvek (pl. a shocktalanítás, szabad légutak biztosítása, vitális paraméterek monitorozása) megegyeznek a sürgősségi betegellátás szabályaival. Ismert vérzékeny beteg esetében vérzés, a véralvadási faktor pótlása előzze meg a diagnosztikus és laboratóriumi vizsgálatokat.
El kell kerülni lehetőség szerint az invazív beavatkozásokat, hacsak a beteg nem részesült már faktorpótlásban. Amennyiben a sürgősségi ellátás előtt nem ismert biztosan a reziduális faktor aktivitás azt 1% alattinak kell tekinteni. Ne kapjon a beteg intramuscularis injectiót. Ne kapjon a beteg ASA-t.
A beteg, vagy a kísérője a legnagyobb segítség lehet, hogy információt adjon az alkalmazott protokollról.
A faktor adása nem pótolja a szükséges transzfúziót, FFP vagy thrombocyta szuszpenzió adását életet veszélyeztető vérzések esetében. Ilyenkor a masszív vérzés ellátásának szabályait is szem előtt kell tartani. A szubsztitúciós kezeléshez 23 vagy 25 G-s szárnyastűk használata javasolt. A vénapunkció után 3-5 percig szorítani kell a punkció helyét.
Fel kell venni és folyamatosan tartani kell a kapcsolatot a beteget gondozó centrum orvosával.
Gyógyszeres kezelés
A vérzékenységnek megfelelő faktor adásának indikációja
Izom, vagy ízületi vérzés gyanúja
Minden új, vagy szokatlan fejfájás, ami lehet esetleg traumával összefüggő, vagy anélkül
Erős fájdalom, vagy duzzanat jelentkezése bármely régióban
Minden nyitott seb, ami sebészeti ellátást igényel
Baleset, vagy trauma a kórelőzményben ami belső vérzéshez vezethet
Bármilyen invazív, vagy sebészeti beavatkozást megelőzően
Erős, vagy elhúzódó vérzés bármely testtájékról
Gyomor bélrendszeri vérzés
Törés, diszlokáció, vagy ficam
Haemophilia A és B: Életet veszélyeztető vérzés:
fej (intracranialis) nyak mellkas, has, medence, gerinc ilipsoas izomzat, medence masszív hüvelyi vérzés extrém izombevérzés diszlokációval járó törés bármely mély zúzott seb nem kontrollálható vérzés
Javasolt dózisok: Életveszélyes vérzés esetén a faktorszintet minimum 80%-ra kell növelni, a faktorpótlást azonnal meg kell kezdeni
Haemophilia A: (súlyosságtól függetlenül )
40-50 E /tskg FVIII (lehetőség szerint abból a faktorból amire a beteg be van állítva)
Haemophilia B: (súlyosságtól függetlenül) 100-120 E/tskg, ha a beteg életkora >15 év 130-160 E/tskg, ha a beteg életkora <15 év
A IX-es faktor dózisa lényegesen nagyobb, mivel alacsonyabb a visszanyerése recovery, különösen gyermekek esetében. Életveszélyes vérzés esetén a bólus faktorpótlás után kontinuus pótlás javasolt haemophilia A esetében 3,0 IU/ttkg/h, Haemophilia B esetében 3,5 IU/ttkg/h. dózisban.
Haemohilia A és B: Közepes illetve kis vérzések ellátása Kis vérzések:
Orrvérzés, epistaxis
szájüregi vérzés, beleértve a fogakat is
ízületi vérzés hemarthros
menorrhagia
horzsolás, vagy zúzott seb
Kezelés: A faktort lehetőség szerint 30 percen belül meg kell kapnia a betegnek
Haemophilia A: súlyos, középsúlyos, enyhe:
20-30 E/ ttkg naponta 2x
Haemophilia B: súlyos, középsúlyos, enyhe,
30-50 E/ ttkg, ha a páciens életkora > 15 év naponta 1x
Von Willebrand betegség:
Súlyos vérzés esetén faktorszinttől függetlenül
Hemate P 60-80 E/ttkg
Enyhe vérzés esetében:
1. I-es II/A, altípusokban , ha az desmopressin (DDAVP) ismerten effectív akkor 0,3 ug/ttkg max. 20 mcg sc.iv dózisban javasolt
2. II/B altípusban DDAVP kontraindikált
3. III-as altípusú betegeknek 60-80 Ristocetin cofactor E /ttkg Hemate P
Nyálkahártya vérzés esetén a fentieken túl 25 mg/ tskg tranexamsav 1-7 napig, hematuria esetében kontraindikált.
Inhibitoros haemophilia sürgősségi kezelése:
Bypass készítmény adása:
FEIBA(APCC): 75-100 E/ttkg max 200 E/ttkg/nap (tranexamsavval ne kombináljuk)
NovoSeven (rFVII) : 90 ug/ttkg 2 óránként vagy 270 ug/ttkg
B haemophiliás inhibitoros betegeknél rFVII adása javasolt. Korábbi anafilaxiás reakció esetén lehetőség szerint kerülni kell a plazmaeredetű készítmények adását. FFP is allergiás reakciót okozhat.
Ritka vérzékenységek, thrombocytopathiak sürgősségi ellátása
VII-es faktor hiány: rFVIIa adása (Level IV, Grade C), ha nem érhető el akkor VII-es faktor tartalmú prothrombin complex concentrátum
II-es X-es faktorhiány nincs specifikus faktorkészítmény, prothrombin komplex koncentrátum adható (Level IV, GradeC)
V-ös faktorhiány: nincs specifikus készítmény, ha FFP adása javasolt (Level IV, Grade C).
XI-es faktorhiány XI-es faktor koncentrátum, (Level IV, Grade C), ha nem érhető el akkor FFP
XIII-as faktorhiány: XIII-as faktorkoncentrátum javasolt (level IV, Grade C)
Fibrinogén hiány: Fibrinogén koncentrátum adása javasolt (Level IV, Grade C), ha nem elérhető FFP adása javasolt.
Készítmények ritka vérzékenység esetében:
Friss fagyasztott plasma (FFP)
Adagja: 15-20 mL/tskg, ismétlése a hiányzó faktor felezési idejétől függ. Átlagosan 1 ml FFP 1 E alvadási tényezőt tartalmaz, de ez függ a donor alvadási tényezője kiindulási szintjétől és a donor plazma alvadásgátlójától. Felolvasztás után 24 óráig + 4 °C fokon tárolható.
Vérzékeny betegek esetében víruinaktivált FFP adása lenne javasolt, de ez Magyarországon rutinszerűen nem érhető el.
rFVIIa (NovoSeven)
Általában 90 ug/tskg iv. a kezdeti adag, ami 2-3 óránként ismétlendő, a vérzés megszűntéig. Veleszületett FVII-hiány esetén kisebb adagok is elégségesek lehetnek.
Prothromplex Total 600 NE Fibrinogen (Haemocomplettan-P)
Human plasma eredetű. 1-2 g kezdeti adag, iv., folytatva szükséglet szerint, amit a fibrinogen szint Clauss szerinti meghatározásával ellenőrizhetünk.
FXIII (Fibrogammin-P)
Human plazma eredetű. 250 E és 1250 E kiszerelésben.
Thrombocytopathiák sürgősségi ellátása
Enyhébb esetekben
DDAVP (0,3 ug/tskg, 100 ml Salsolban) adható, 20 perc alatt (kivéve Glanzmann thrombasthenia).
Thrombocyta szuszpenzio
rFVIIa iv., 60-90 ug/tskg, 2-3 óránként ismételve, a vérzés megszűntéig
Kiegészítő kezelés
1. Antifibrinolyticum (aminocapron sav vagy tranexamsav) iv (lassan) vagy oralisan (tabletta, ivóoldat formájában). Adagolása, mind a napi dózist, mind az időtartamot illetően széles határok közt változhat. Beszűkült vesefunkció esetén az adagok a serum creatinin értéktől függően csökkentendők, a mellékelt alkalmazási irat útmutatása szerint. Tranexamsav lokális kezelésre is alkalmas, kivéve B hemophilia
2. Kontraindikációk
Non-steroid gyulladáscsökkentők adása fájdalomcsillapítás céljából Fibrinolysis-gátló (pl.tranexamsav) vesevérzés esetén.
3. Fájdalomcsillapítás
Paracetamol/acetaminophen codein kellően hatékony és biztonságos alternatívát jelentenek.
IV. Rehabilitáció és V. Gondozás
A beteg lakása szerinti gondozóhelyen folytatódik (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok). A diagnosztikát az arra alkalmas, akkreditált laboratórium, a kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
VI. Irodalomjegyzék
1. Protocols for the treatment of hemophilia and von Willebrand disease. Hemophilia of Georgis, Inc. Published by thr World Federation of Hemophilia (WHF), 2008.
2. Pier M Mannucci, Roger E, G. Schutgens, Elena Santagostino, Evelien P, Mauser-Bunschoten: How I treat age-related morbidities in elderly persons with hemophilia. Blood 2009; 114:5256-63.
3.Witmer CM, Raffini LJ, Manno CS: Utility of computed tomography of the head following head trauma in boys with haemophilia. Haemophilia. 2007; 13:560-6.
4. Colvin BT, Astermark J, Fischer K, Gringeri A, Lassila R, Schramm W, Thomas A, Ingerslev J. For the Interdisciplinary Working Group: European principles of haemophilia care. Haemophilia 2008; 14: 361-374
5. Guidlines for emergency department management of individuals with Hemophilia Medical and Scientific Advisory Council (MASAC) of the National Hemophilia Foundation on October 14, 2006.
6. John Hanley, Mary Mathias, Emma Franklin, Chris Harrington, Oliver Chapman, Kate Talks and Stephanie Smith Emergency and out of hours care for patients with bleeding disorders - standards of care for assessment and treatment - Approved by UKHCDO advisory committee April 2009
Kapcsolódó internetes oldalak:
http://www.hemophiliaemergecycare.com
VII. Melléklet
1. Érintett társszakmákkal való konszenzus Sürgősségi
2. Egyéb megjegyzések
Dokumentáció bizonylat
A Regionális Vérellátó Központokból, az OEP véralvadási faktor különkeretének Felhasználó Centrumaiból szerzendők be a vérkészítmények rendelésére vonatkozó mindenkori szabályok szerint.
A HAEMOPHILIA PERIOPERATÍV SZUBSZTITÚCIÓS KEZELÉSE
I. Általános megfontolások
1. A szakmai irányelv érvényességi területe:
Felnőttgyógyászat 18. életév felett. BNO:D6600, D6700.
Haemophiliás betegek műtéti (invazív) ellátása.
Célja a műtéti beavatkozások feltételeinek és a faktorpótló (gyógyszeres) kezelés egységes szempontok szerinti rendjének kijelölése.
Célcsoportjai: Haemophiliás betegek ("A" "B"), ellátást végző orvosok.
Inhibitoros betegek ellátására jelen protokoll nem terjed ki
2. Definíció
A haemophilia veleszületett örökletes véralvadási rendellenesség. Az "A" haemophilia a VIII-as faktor (FVIII), a "B" haemophilia a IX-faktor (FIX) hiánya, vagy biológiai csökkent aktivitásának a következménye.
3. A betegség leírása
3.1.A haemophiliák X kromoszómához kötött, recesszív öröklésmenetű betegségek.
Klinikailag vérzékenységben nyilvánulnak meg.
3.2. Előfordulása a teljes lakosságban 1:10 000-hez.
3.3. Panaszok és tünetek súlyossága párhuzamos az alvadási faktorok hiányával ill. aktivitásával. A faktoraktivitás alapján súlyos (1% faktoraktivitás alatti), középsúlyos (1%-5% faktoraktivitás), enyhe (5%-40% faktoraktivitás) haemophiliát különböztetünk meg.
Vérzés bármely szervrendszerben előfordulhat, a leggyakrabban ízületii, izomközti vérzések alakulnak ki. A gastrointestinalis, urogenitalis, oropharyngealis, központi idegrendszeri vérzések ritkábbak, de potencialisan életet veszélyeztetők.
II. Diagnózis
1. Laboratóriumi vizsgálatok
Laboratóriumi szűrőteszteknél megnyúlt aPTI, normális vérzési idő, prothrombin és thrombin idő jellemző. Az aPTI vizsgálathoz faktorokra (FVIII, FIX) érzékeny aPTI reagenst kell használni, mert különben már 30% faktorszintek mellett sem észlelhető releváns aPTI megnyúlás, és tévesen negatív diagnózist állíthatunk fel. A haemophiliákra jellemző, hogy az aPTI megnyúlás normál plasma hozzáadásával korrigálható (keveréses teszt)
Faktoraktivitás mérés hiányplasmával (FVIII, FIX hiányplasma) egy lépcsős vagy kétlépcsős módszerrel, koagulációs, vagy chromogen módszerrel történhet.
Immunantikoaguláns gyanúja (keveréses tesztben nem korrigálható az aPTI megnyúlás és/vagy klinikai gyanújelek), elektív műtéti beavatkozások esetén Bethesda módszerű inhibítor meghatározást kell végezni. Inhibítor meghatározás évente egy alkalommal minden betegnél indokolt
III. Kezelés
Kezelés feltételei
Haemophiliás beteg műtéti ellátása biztonsággal elvégezhető, amennyiben az alábbi ajánlások teljesülnek:
- A műtétet vérzékeny betegek ellátásában járatos egészségügyi intézményben végezzék, ahol megfelelő, a véralvadási faktorszint mérésére alkalmas laboratóriumi háttér áll rendelkezésre (24 órás haemostasis labor)
- A műtétet lehetőleg a munkahét első felében, délelőtti órákban végezzék az optimális laboratóriumi és vérellátási feltételek biztosítása érdekében
- A műtéti beavatkozás nem kezdhető meg, amíg a műtét és postoperatív időszak (a rehabilitációs kezelés is) teljes időtartamára elegendő véralvadási faktorkészítmény nincs biztosítva (koordináló szerepük van a Haemophilia Gondozóknak).
A Haemophiliás beteg műtétje mindig team munka.
Az operatív és postoperatív faktorpótlást meghatározó tényezők
Az operatív és postoperatív faktorpótlást meghatározó tényezőket az 1. táblázatban soroljuk fel.
1. táblázat. Az operatív és postoperatív faktorpótlást meghatározó tényezők
- a beteg kiindulási faktorszintje
- a beteg testtömege (kg)
- műtét nagysága: kis műtét (pl: endoscopia, bőr biopsia, bronchoscopia, fogextractió), nagy műtét. A nagy műtét fogalmát haemophiliás betegnél kimeríti, ha az alábbi feltételek közül egy is teljesül:
= 30 percen túli altatás
= üregi vérzés veszélye
= lokális vérzéscsillapítás nem megoldható
= kis mértékű vérzés is nagy egészségkárosodással járhat
- a műtét lokalizációja
- az alternatív vérzéscsillapítás lehetőségei: fibrinragasztó, antifibrinolitikum rendelkezésre áll-e
- a beteg számított faktor recovery-je (plazmából történő véralvadási faktor visszanyerhetősége)
- az adott faktor farmakokinetikai tulajdonsága Haemophilia "A" VIII. faktor 8-12 óra Haemophilia "B" IX. faktor 16-18 óra
Elektiv és sürgős műtét előtt ajánlott haemostasis vizsgálatok
Az elektív és sürgős műtét előtt ajánlott haemostasis vizsgálatokat a 2. és 3. táblázatban soroljuk fel.
2. táblázat. Elektív műtét előtt ajánlott haemostasis vizsgálatok
- szűrő véralvadási tesztek: aPTI, PT, TI, fibrinogen
- a beteg faktorszintjének meghatározása
- adott faktor recovery meghatározás: számított dózisú ív faktorpótlást követően 30 perccel levett vérmintából végzett faktoraktivitás meghatározással
- immuninhibítor meghatározás (Bethesda módszerrel)
- teljes vérkép meghatározás
3. táblázat. Sürgős műtét előtt ajánlott haemostasis vizsgálatok
- szűrő véralvadási tesztek: aPTI, korrigált aPTI , PT, TI, fibrinogen
- teljes vérkép meghatározás
Gyógyszeres kezelés alapelvei
Faktorpótló kezelés (IA)
Bólus
A bólusban történő faktorpótlás (4. táblázat) napi adagolása a véralvadási faktorok felezési idejének figyelembe vételével úgy történik, hogy az egyes bólus injekciók beadása közti legalacsonyabb faktorszint ne csökkenjen a sebbiztosító faktorszint (40%) alá. Az adott faktor recovery betegeknél individuálisan változhat. Az elméletileg számított dózist ennek megfelelően korrigálni kell. A korrekció alapja a tervezett szubsztitúció előtt levett vérminta faktor koncentrációja és a beteg elérni kívánt faktorkoncentrációja. A műtét napján és a postoperatív 2. napig faktor meghatározás ajánlott minden szubsztitució előtti vérmintából A továbbiakban az első postoperatív héten napi 1 alkalommal, a sebgyógyulásig 2-3 naponta javasolható a beteg faktoraktivitás szintjének meghatározása.
Ortopédiai műtéteknél a postoperatív 5-7 napon az utóvérzés veszélye nagy.
4. táblázat. Bólusban történő faktorpótlás
| műtéti faktorszint | sebbiztosító faktorszint | alkalmazási gyakoriság | |||
| FVIII. | F IX | időtartam nap | |||
| > 50%, tranexamsav | |||||
| foghúzás | 7 napig 3-4 g/nap po. (+fibrinragasztó) | 1/nap | 1/nap | 1 | |
| kis műtét , biopsziák | > 50% (B.III.) | > 40% | 1-2/nap | 1/nap | 3-5 |
| nagy műtét | > 80% (B.III.) | >40% | 2-3/nap | 1-2/nap | 7-14 (sebgyógyulásig) |
Haemophiliás beteg nagy thrombosis rizikójú műtétjeinél (pl.: ortopédiai műtétek: csipő, térdprotézis műtétek) thrombosis profilaxis javasolt LMWH gyári felhasználási utasítás szerinti dózisban
Ortopédiai műtétet követő mozgásszervi rehabilitáció teljes időtartama alatt on demand kezelt betegnél is profilaxist kell alkalmazni
- Haemophilia "A" heti 3x 25-50 IU/ttkg
- Haemophilia "B" heti 2x 25-50 IU/ttkg
NSAID hatáscsoportú (kivéve a szelektív ciklooxigenáz-2 gátlószerek) és bármely trombocyta-aggregatio gátló gyógyszer adása az operatív és postoperatív időszakban kerülendő
Folyamatos (kontinuus) infúzió Indikáció: nagy műtét.
Feltételei: infúziós pumpa. Oldás után legalább 12 óráig stabil faktorkészítmény. Az adagolást az 5. táblázatban mutatjuk be.
5. táblázat. Folyamatos (kontinuus) infúzió:
| műtét | műtéti faktorszint post. op. 48 óráig fenntartandó | sebbiztosító faktorszint | infúziós ráta IU/kg/h | Időtartam |
| típusa | nap | |||
| nagy műtét | a műtéti faktorszintet bólus inj. kell beállítani, ezt követi a folyamatos | > 40% | clearance* x ttkg a célfaktorszintet figyelembe véve | 7-14 |
| inf. | (sebgyógyulásig) | |||
| faktorszint> 80% | ||||
| * Haemophilia "A":FVIII eliminációs clearence 3,0 IU/ttkg/h, h Haemophilia "B":FIX eliminációs clearence 3,5 IU/ttkg/h. | ||||
Számítási példa:
Beteg: Dg: haemophilia "A" ttkg: 70 kg faktoraktivitás: 1%
Kívánt műtéti faktorszint: 80%
Haemophilia "A" eliminációs clearance: 3,0 IU/ttkg/h
Bólus inj. dózisának kiszámítása: [70 x(80-1)] /2 = 5530/2 = 2765 IU
(a faktorkészítmények kiszerelése miatt - 250,500,1000 IU - a bólus inj. dózisa: 2500 vagy 2750 IU)
Kontinuus infúzió infúziós rátájának kiszámítása:
70x 3=210 IU/h, azaz 24x 210 IU = 5040 IU/nap
(a faktorkészítmények kiszerelése miatt - 250,500,1000 IU - az infúziós ráta dózisa 200 IU/h, azaz 4750 vagy 5000 IU/nap) A kontinuus infúzió időtartama alatt naponta faktoraktivitás meghatározás szükséges.
Kontinuus infúzió egyszerűsített protokollja (Haemophilia Világszövetség ajánlása alapján):
A kontinuus VIII. faktor infúziót gyakorlott hematológus irányításával kell végezni. Az 50 IU/ ttkg bólus injekciót követően 4-5 IU/ttkg/h VIII. faktor kontinuus infúziója a VIII faktorszintet megközelítően 100% körül tartja.
Kiegészítő/alternatív gyógyszeres kezelés
1-deamino-8-D- arginine vasopressin - DDAVP (Octostim inj.,orrspray)
Indikácó: enyhe és mérsékelt haemophilia "A" kis műtéti beavatkozásaihoz ajánlott. Szintetikus gyógyszer, mely átlagosan 3 szorosára emeli a beteg FVIII.szintjét.
Dózisa:
Inj.: 0,3/-ug/ttkg 0,9% NaCl infúzióban kb. 50 ml-re hígítva 20 perc alatt közvetlenül a sebészeti beavatkozás előtt. Orrspray: felnőttnek: 300 ug gyermeknek: 150 ug
DDAVP kezelést 24 óránként lehet ismételni. Az adagolás 3. napja után tachyphylaxia jelenségével számolhatunk!
6. táblázat. DDAVP kontraindikációi és relatív kontraindikációi
Kontraindikációk:
- 2 éves életkor alatt
-* egyeztetés a gyermekprotokollal!!
- primer vagy psychogen polydipsia
- instabil angina pectoris
- dekompenzált szívelégtelenség Relatív kontraindikációk:
- idősek
- terhesek
- arteriosclerosis betegség
- súlyos (1% alatti maradék faktoraktivitású) haemophiliák
Mellékhatások:
Gyakori (> 1/100)
- Általános: fejfájás, nagy dózis esetén fáradság.
- Keringés: nagy adagban átmeneti vérnyomásesés reflex tachycardiával, a beadáskor arckipirulással.
- Gyomor-bélrendszeri: gyomorfájdalom, hányinger.
Ritka (1/1000)
- Nagy adagnál: szédülés.
- Ha a kezelés nem jár együtt a folyadék bevitel megfelelő korlátozásával, tünetekkel (fejfájás, hányinger, hányás, Na-szint csökkenése, testtömeg növekedése, súlyos esetben konvulzió) járó vizeletretenció/ hyponatraemia alakulhat ki.
Tranexamsav (exacyl):
Hatóanyaga tranexaminsav, a plasmin fibrinolyticus aktivitásának gátlásán keresztül fejti ki antihaemorhagiás hatását. A tranexaminsav és a plasminogen komplexet képez: ez a kötés fennmarad a plasminogen - plasmin transzformációt követően is. A tranexaminsavhoz kötődött plasmin fibrinre kifejtett hatása jelentős csökkent a szabad plasminéhoz képest.
Kimutatták, hogy in vivo a nagy dózisú tranexaminsav gátolja a komplement rendszer aktiválódását is.
Indikáció:
Szájüregi beavatkozások (faktorpótlással vagy DDAVP-vel együtt adható), Orrvérzés
Gastrointestinalis vérzés-beavatkozás . Dózisa: iv.: 2-3x 10 ug/ttkg/die, po. 2-3x25 ug/ttkg/die.
7. táblázat.
Tranexamsavkontraindikációi:
thromboemboliás kórképek
- haematuria - renalis haematura és esetén fennáll a mechanikus anuria veszélye ureteralis alvadékképződés
következtében
- FEIBA-val együttadása
- Disseminalt intravascularis coagulatio (DIC)
- Hatóanyag iránti túlérzékenység
Figyelmeztetés: beszűkült vesefunkció esetén a tranexaminsav dózisát az akkumuláció kockázata miatt a se. Creatinin szinthez igazodva csökkenteni kell (lásd alkalmazási előírat adagolási előírása). Perioperatív faktorszubsztitúció szövődménye az inhibitor képződés lehet.
Kockázata nagyobb ha az első szubsztitúció műtét kapcsán történik, ha a szubsztitúcós dózis>50E/ttkg. Postoperatív thrombosis profilaxis nagyobb infectios veszély (whf knee prothesis résznél) Perioperatív fájdalom csillapítás whf előbbi
IV. Rehabilitáció és V. Gondozás
A beteg lakása szerinti gondozóhelyen folytatódik (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok) fordulni. A diagnosztikát az arra alkalmas, akkreditált laboratórium, a kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
VI. Irodalomjegyzék
1. Björkman S. Carlsson M.:The pharmakokinetics of faktor VIII and IX: methodology, pitfalls and aplications. Haemophilia 1997;3:1-8.
2. Clinical Practice Guidelines. Haemophilia .http://www.rch.org.au/clinicalguide
3. Ewnstein BM.: Continuous Infusion of rFVIIa continue or not. Thromb Haemost 2001;86:942-944.
4. Guidelines on Therapeutic products to treat haemophilia and other hereditary coagulation disorders. Haemophilia 1997;3:63-77.
5. Guidelines for Emergency Department Management of Individuals with Hemophilia Medical and Scientific Advisory Council (MASAC) of the National Hemophilia Fundation 2006.
6. Guidelines for the Management of Hemophilia. Publisched by World Federation of Hemophilia 2005.www.wfh.org
7. Guideline for the Treatment of Haemophilia in South Africa. SAMJ 2007,Vol.97, No.12
8. Heeg M, Meyer K, Smid WM, Van Horn JR.: Total knee and hip arthroplasty in haemophilia patients. Haemophilia 1998;4:747-51.
9. Kasper C, Boylen AL, Ewing N, Luck J, Dietrich L.: Haematologic Management of Hemophilia A for Surgery. J Amer Med Ass 1985;253:1279-83.
10. Králl G.: A hemofiliások és ritka véralvadási faktorhiányosok perioperatív szubsztitúciós kezelése. In: Hematológiai betegségek kezelése. Szerk: Lehoczky D. Melania és Dictum, Budapest, 2001, 147.
11. Longo L, Matucci M, Morfini M, Vannini S, Messori A.: A calculator program for individualising factor VIII dosage. Drug Intelligence and Pharmacy. 1984;18:726-7.
12. Pfliegler Gy: Haemophilia. In: Boda Z, Rák K, Udvardy M.: Klinikai Hemosztazeológia. Springer Budapest 2000, 2. kiadás, 324-348.
13. Protocols for the Treatnebt of Hemophilia and Von Willebrand Disease (Revised March, 2009). Hemophilia of Georgia.
14. Reichel H, Birke A, Wolf H.: Knieendorprothetik bei hämophilier artropathie: Ergebnisse, Probleme und Komplikationen. Z Orthop 2001; 139:120-6.
15. Schulman S.: Protokols for the treatment of hemophilia and von Willebrand disease. Revised Edition. World Federation of Hemophilia, 2004.
16. Woloschuk Donna M.M.: Factor Replacement by Continuous infusion (Second Edition) 2002 Bleeding Disorders Program, Winipeg, Manitoba, Canada
17. Ragni MV, Ojeifo O, Feng J, Yan J, Hill KA, Sommer SS, Trucco MN, Brambilla DJ: Risk factors for inhibitor formation in haemophilia: a prevalent case-control study.Haemophilia. 2009; 15:1074-82.
INHIBITOROS A ÉS B TÍPUSÚ HAEMOPHILIA KEZELÉSE
I. Alapvető megfontolások
Meghatározás
A vagy B típusú haemophiliában a VIII/IX faktor veleszületett hiánya/csökkent volta miatti rendszeres faktorpótlásra (fehérjebevitelre) adott válaszként alloantitest inhibitor termelődhet (inhibitoros vagy gátlótestes haemophiliák). BNO: D6890, D6820, D6840, D6941. Epidemiológia és incidencia, rizikófaktorok. A faktorok elleni gátlótestek a ritka betegségek közé tartoznak, vagyis incidenciájuk a teljes népességben 5:1.000,000 vagy annál kisebb. Felléptük az esetek túlnyomó többségében súlyos, életveszélyes vagy az élet minőségét jelentősen rontó kórállapotot eredményez. Egy adott betegcsoporton belül előfordulásuk jóval gyakoribb is lehet. Veleszületett vérzékenyekben a kumulatív incidencia "A" haemophiliában 30%, "B" haemophiliában 3-8%. A prevalencia (a sikeres eradikáció, ill. spontán eltűnés - átmeneti inhibitor - miatt) kisebb: 3.6-21% ("A" haemophilia). Az gátlótest termelődés a haemophilia kezelésének legfontosabb komplikációját jelenti. Megjelenésük átlagosan a másfél-három éves korra, a faktorpótlás kezdetétől számított 50 expozíciós napon belülre esik (medián: 9-12 expozíciós nap). A gátlótest megjelenése és az alkalmazott faktorkészítmény között nem lehetett biztos összefüggést igazolni, de megjelenése valamivel gyakrabban a súlyos (1% alatti faktoraktivitás) haemophiliásokban várható és függ az egyénben meglevő FVIII molekuláris zavarának milyenségétől, az immunreaktivitás gének egyes polimorfizmusaitól és a major histocompatibilitási (MHC) fenotípusától, azaz a sejtes immunválasztól. Az inhibitor kialakulása súlyos, 1 5 alatti VIII faktor aktivitású haemophiliában négyszerte gyakoribb, mint a középsúlyos és mérsékelt A haemophiliában. Az éves incidencia 0.35% a súlyos formában, míg 0.084% a középsúlyos és mérsékelt betegségben. Az összes gátlótestes eset 28%-a kerül ki a középsúlyos/mérsékelt kategóriából. Ebben a betegcsoportban az inhibitor kialakulása eltolódik a felnőttkorra. Rizikófaktorai az intenzív, nagyadagú VIII faktor szubsztitúció major vérzések vagy műtétek alkalmával ("danger szignál"), ha nagyrizikójú misszensz mutáció okozza a vérzékenységet. Példák a nagyrizikójú mutációkra: Arg593Cys, Arg2150His és Trp2229Cys.
Klinikai megjelenés
Gátlótestes haemophiliában a vérzés megszokott megjelenési helyének (pl. nagyízületii vérzés "A" haemophiliában), formájának és intenzitásának megváltozása, a korábban effektív faktorpótlás hatástalansága a legfontosabb gyanújelei. A VIII faktor szubsztitúcióra adott válasz nem kielégítő vagy teljesen elmarad. A középsúlyos és mérsékelt A haemophiliában termelődő gátlótestek nagyobb részében a vérzéses fenotípus a szerzett haemophiliára jellemző módon változik meg nagykiterjedésű szubkután és izomközti haematomákkal gasztrointesztinális vérzésekkel, haematuriával.
II. Diagnosztika
Az inhibitor képződést a szubsztitúciós kezelések kapcsán rendszeres időközönként ellenőrizni kell. A koagulációs ellenőrzés gyakorisága függ a haemophilia típusától és súlyossági fokától, a beteg életkorától és a megelőző expozíciók számától. A korábban nem kezelt (PUP) súlyos A haemophiliás gyermekeknél az 20. expozíciós nap eléréséig pl. minden 5. VIIIF beadás után esedékes az inhibitor szűrés, majd 2 havonta a 150. expozíciós napig. Felnőtteknél súlyos haemophiliában negyedévente, kp. Súlyos és mérsékelt haemophiliában félévente javasoljuk elvégezni az inhibitor szűrővizsgálatokat. Műtétek, invazív beavatkozások előtt is mindig kötelező az inhibitor termelődés kizárása.
1. lépés. Alvadási szűrőtesztek meghatározása: normális prothrombin idő (PI) mellett megnyúlt aktivált partialis thromboplastin idő (APTI) - FVIII/IX fdeficienciának megfelelően.
2. lépés. Keverési teszt a beteg plasmájához 1:1 arányban normál plasma keverése és 2 órás, 37 oC-os inkubálást követően meghatározott APTI. Ha az így meghatározott APTI 5 másodperccel hosszabb, mint az azonos ideig inkubált normál, kontroll plazmáé, valószínű a gátlótest jelenléte. Ha rövidebb, akkor valószínűleg csak faktorhiány áll fenn.
3. lépés. Az adott faktor és a gátlótest titerének meghatározása. Alapja, hogy a gátlótest hígításával a rendszerbe bevitt normál faktor (FVIII vagy FIX) aktivitása nőni fog. Értékét ún. Bethesda egységben (BU) adjuk meg. 1 BU a gátlótest azon mennyisége, mely a kiindulási, normál plazma faktor aktivitásának 50%-át inaktiválja, a gátlótestet tartalmazó plasmával történő, 2 órás, 37 oC-os inkubáció végére. A meghatározáshoz a beteg plasmájából hígítási sort kell készíteni IBS pufferral (2x, 5x, 10x, 20x, 50x, 200x, 500x-os). Az inkubálás után meg kell határozni a minták reziduális faktor aktivitását. A számoláshoz a hígítás mértékének reciprokát használjuk, pl. ha 1/100 hígítás eredményez 50%-ot, 100 BU a gátlótest titere. 5 BU alatt kis, 5(-10) BU felett nagy titert értünk (1-2.ábra).
4. VIII/IXFrecovery vizsgálata. A beadás után V2-I órával mért incrementális érték, melyet a preinfúziós faktoraktivitás levonása után kapunk meg. A várható recory értéknél jelentősen kisebb mérés bizonyitja az alloantitest inhibitor jelenlétét, és az eradikációs kezelés sikerének megítélésében is szerepet játszik, a remissziós kritériumok közé tartozik.
5. "Trough" VIII/IX faktor aktivitás mérése. A következő faktor szubsztitúció beadása elött mért (minimális) VIII/IX faktor aktivitást értjük alatta. Különösen profilaxis vagy Immun Tolerancia Indukció során nélkülözhetetlen.
6.VIII/IX faktor félélet-idő vizsgálatok. Általában 50 E/kg VIIIF vagy 75 E/kg IXF legalább 72 órás "kimosási" periódus utáni adásával határozzák meg. Immun Tolerancia Indukciós (ITI) kezelés során szintén fontos remissziós kritérium a félélt-idő normalizálódása.
7.VIII/IXF génmutációs vizsgálatok. Mind az A, mind pedig a B típusú haemophilia eseteiben is inhibitorképződés szempontjából nagyrizikójú mutáció csoportokat azonosítottak. Ilyenek a mulidomén nagydeléciók, inverziók, illetve középsúlyos és mérsékelt A haemophiliában az A2 és C1-C2 domén junkciót érintő misszensz mutációk. A betegség genetikai hátterének felderítése prognosztikai szempontból lehet fontos, sőt megszabhatja a szubsztitúciós tevékenységünk stratégiáját (pl. korai kisadagú profilaxis vesus on demand kezelés, mérsékelt haemophiliában DDAVP VIIIF alapú kezelés helyett). Új betegeknél javasolt a vérzékenységet okozó mutáció meghatározása.
1. ábra. A Bethesda egység (BU) számítása_
| Reziduális FVIIIC (%) | Konvertáló faktor |
| 25 | 2.00 |
| 26 | 1.90 |
| 27 | 1.85 |
| 50 | 1.00 |
| 51 | 0.95 |
| 52 | 0.90 |
| 97 | 0.05 |
Reziduális FVIIIC (%) = FVIIIIC (beteg) x 100 % FVIIIC (kontroll)
FVIIIC inhibitor (Bu/ml plasma = a beteg plasmájának hígítása x az adott FVIIIC konvertáló faktorával.
2. ábra.A FVIII elleni gátlótestek inaktiválásának kinetikája.
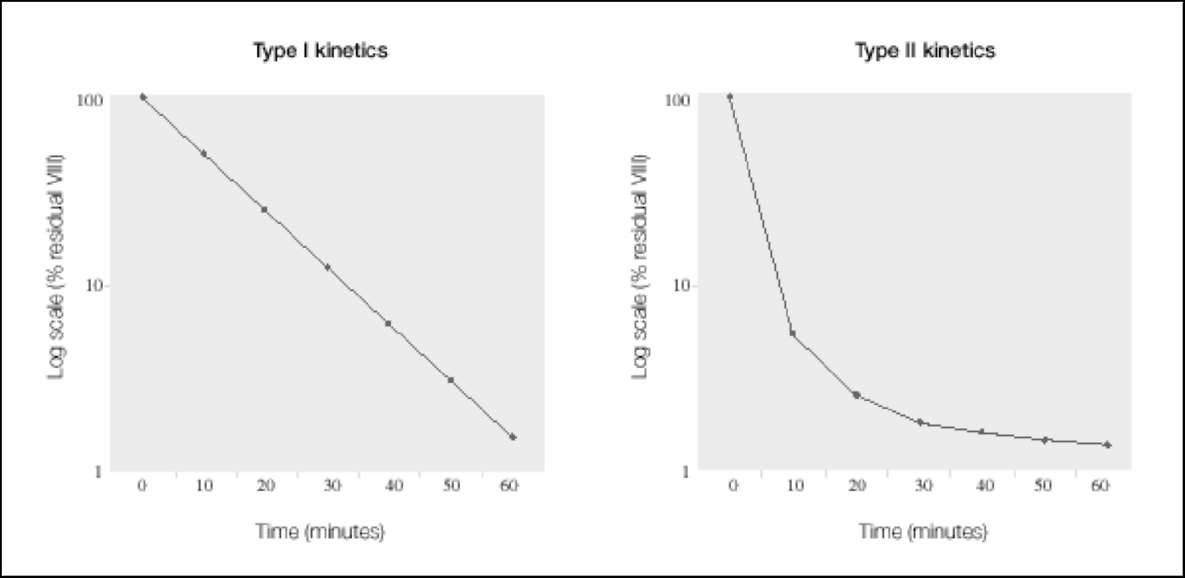
a) Lineáris inaktiválódás (I. typus): idetartoznak általában az alloantitestek.
b) Nem lineáris inaktiválódás (II. typus): idetartoznak az autoantitestek túlnyomó többsége és a középsúlyos/mérsékelt A haemophiliás inhibitorok egy része.
(Boggio LN és Green D Rev. Clin. Experiment. Hematol, 2001; 5: 389-406.)
III. Az inhibitoros haemophilia kezelése
Cél
1.A gátlótest(e)k okozta vérzés csillapítása, újabb vérzés megelőzése.
2.A gátlótest(e)k megszűntetése, képződésük megakadályozása
Kezelés inhibitoros veleszületett "A" és "B" haemophilia (FVIII, FIX elleni alloantitest inhibitor) esetén
A vérzés megszűntetése (azonnali cél)
A választandó kezelést a vérzés súlyossága és a gátlótest titer valamint a korábbi anamnesztikus válaszkészség szabja meg. Az egyes betegeknél, sőt az egyes vérzéstípusokban a kezelés sikeressége eltérő lehet rekombináns VIIa-ra és APCC-re. Az akut vérzés kezelése ezért az egyéni válaszkészség maximális figyelembe vételével történhat csupán.
"A" haemophilia.
Kis titer (<5 BU) esetén az első választandó szer a FVIII (75-100 E/tskg/nap). Adható ezenkívül, ill. nagy titer (>5 BU) vagy veszélyes vérzés esetén elsőként is rFVIIa (90 ug/tskg intravénás bolusban, 2-3 óránként a vérzés megszűntéig vagy aktivált prothrombin komplex koncentrátum (APCC-, FEIBA) 50-100 E/tskg, naponta 1-2x, a vérzés megszűntéig. APCC-ből az egynapi adag nem lehet több mint 200 E/tskg. FEIBA mellett antifibrinolítikum (tranexamsav) a leírás szerint szimultán nem adható. rFVIIa-ból esetenként, refrakter vérzésben nagyobb adagokra lehet szükség. Az ún. "megadózis": 270 |ig/tskg.
Korábban sertés eredetű FVIIIC-t (Hyate C; 50-100 E/tskg, naponta 2x) is adhattunk (autoantitest esetén is), a készítmény előállítását azonban porcin parvovirus kontamináció miatt 2004-ben megszűntették Rekombinált formájával jelenleg folynak a klinikai vizsgálatok . A FEIBA melletti másik, sokban hasonló tulajdonságokkal rendelkező APCC készítmény (Autoplex) gyártását 2005-ben függesztették fel.
"B" haemophilia.
rFVIIa (90 ug/tskg, 2-3 óránként a vérzés megszűntéig) vagy FEIBA (50-100 E/tskg, naponta egyszer vagy kétszer) szükséges. Az előbbi szer választandó a korábban alkalmazott FIX tartalmú koncentrátumokkal összefüggésbe hozható nephrosisban, ill. anaphylaxia esetén. APCC-ből az egy napi adag nem lehet több, mint 200 E/tskg.
Műtéti profilaxisra: nagy, súlyos vérzésveszéllyel járó műtétek alkalmával elsőként választható a rFVIIa is (90 E/tskg, 2-3 óránként) 4-6 napig. Alternatív megoldásként választható - elsősorban kisebb vérzésveszéllyel járó műtétek kapcsán - APCC (50-100 E/tskg), naponta 2x ismételve a vérzésveszély megszűntéig. A napi adag a 200 E/kg-ot nem haladhatja meg. Kiegészítő kezelés: antifibrinolyticum (aminocapron-sav, tranexamsav) iv. (lassan) vagy oralisan (tabletta, ivóoldat formájában) naponta 2-4 x. Adagolásuk, mind a napi dózist, mind az időtartamot illetően széles határok közt változhat. Aminocapron-sav: az első órában 5 g iv./po. telítő adag után 1 g/h infúzió/po., 8 órán át. Normál veseműködés esetén gyermekeknek általában 20-30 mg/tskg/nap 8 óránként. Beszűkült vesefunkció esetén az adagok a serum creatinin értéktől függően csökkentendők, a mellékelt alkalmazási irat útmutatása szerint. Tranexam-sav: 10-15 mg/tskg, po. vagy iv., 8 óránként.
A relapsusok (ismételt vérzések) kezelése hasonlóképpen történik. Szekvenciális terápia (hatástalanság vagy elérhetőségi szempontok miatt váltás a másik "by-pass" módszerre) vagy refrakter, életveszélyes esetben kombinált (rFVIIa + APCC) kezelés is lehetséges. Ilyenkor különös figylemmel kell lenni a lehetséges thromboemboliás szövődményekre, és az alvadás aktivációt jelző markarek monitorozása javasolt. Emellet adjuváns antifirinolítikum már nem adható.
Immuntolerancia indukálása (hosszútávú cél)
Indikált: minden újonnan felfedezett gátlótest esetén, minden gyermekkori inhibitoros haemophiliásnál, az inhibitor titertől függetlenül, ha a vérzéses fenotípus indokolja és a beteg együttműködik, valamint, ha a vénás "hozzáférhetőség" lehetővé teszi. Felnőtteknél és nagy inhibitor titer esetén esetén, ha gyakorta jelentkeznek vérzések és a bypass módszerekkel nem jól uralhatók, így a mozgásszervi szövődmények progrediálnak.
Adagolás: kis titerű (<5 BU) gátlótest esetén 50-100 E/tskg/nap, nagy titer (>5 BU) alkalmával 150-200 E/tskg/nap FVIII/FIX készítmény. Praktikus szempontból előnyös, és hazánkban jó eredmények voltak elérhetőek a napi egyszeri 150 E/kg nagydózisú protokollal.
Időtartama: pontosan nem adható meg, a beadott FVIII/FIX farmakokinetikája, recovery értéke, féléletideje normalizálódásáig, illetve a gátlótest eltűnéséig - esetenként hónapokig, akár 1-1.5 évig - kell alkalmazni. Az immuntolerancia kialakulását elősegíti az alloantitestek felléptét követően hamar elkezdett tolerancia indukció, kis titerű, "low responder" (nem anamnesztikus) gátlótest, Willebrand faktorban gazdag plasma eredetű készítmények alkalmazása, kimutatható FVIII aktivitás, nagy gátlótest titer esetén nagy adag (200 E/tskg/nap), kisebb titer esetén kisebb dózisú FVIII alkalmazása. Az immuntolerancia elérését követően heti 3x-i FVIII profilaktikus adása megelőzi a gátlótest ismételt kialakulását.
FIX elleni gátlótest esetén nagy a veszély anaphylaxiás reakció vagy nephrosis szindróma kialakulására a fenti immuntolerancia indukcióval, feltehetően elsősorban a nagy gén deléciók miatt, így ezen betegek kezelése a továbbiakban csak rFVII-tal történhet, kerülni kell a FIX-antigén expozíciót.
Humafactor-8, Humafactor-9, Immunine, Berinine, Immunate SD, Haemate P, Haemoctin SDH, Recombinate, FEIBA, Kogenate, Octonate, Refacto AF, Advate, Fibrogammin, human immunglobulin stb.
Tünetek: allergiás reakciók, anaphylaxiás shock. Nagy adagban történő alkalmazáskor A, B, illetve AB csoportú betegnél haemolysis kizárólag a közepes tisztaságú (intermediate-purity) készítmények esetében. Megelőzés: allergiás diathesisű egyénnél corticosteroid, antihisztamin profilaktikus adása.
Kezelés: a készítmény adásának felfüggesztése, corticosteroid, sz.e. shocktalanítás (nagy adagú iv corticosteroid, kálcium, volumenpótlás, oxigén).
A plasma eredetű készítmények esetén bár igen csekély, de teljes biztonsággal ki nem zárható a lehetősége a nem-lipid burkú kórokozók (Parvovirus B19, prionok) átvitelének. rFVIIa (Novoseven)
Tünetek: a súlyos, nemkívánatos mellékhatások tünete 1% alatt, az enyhébbeké 8%. Fájdalom, láz, fejfájás, hányás, allergiás bőrjelenségek. Thrombocytopenia, fdp felaszaporodás, fibrinogen csökkenés (disszeminált intravasalis coagulatio), igen ritkán thrombosisos események, köztük szívinfarktus. Antitest alakulhat ki ellene.
Terhesség és szoptatás. Kifejezett indikációval adható, magzatkárosító hatás eddig nem ismert, az anyatejbe nagy valószínűséggel nem jut át.
Kezelés: az adás felfüggesztése, allergia esetén steroid, antihistamin.
Egyéb készítmények
DDAVP (dearginin vasopressin, desmopressinum aceticum, Minirin, Octostim).
Súlyos haemophiliában és B típusú haemophiliában nem hatékony. Mérsékelt A haemophiliában kísérelhető meg alkalmazása kis inhibitor titer esetén.
Tünetek: fejfájás, fáradtság, tachycardia, átmeneti vérnyomásesés, arc kipirulás, gyomorfájdalom, hányinger, ritkán, nagy adagban alkalmazva szédülés. Ha a bevitel nem jár együtt a folyadékbevitel korlátozásával: vízretenció, hyponatraemia. Allergia, anaphylaxia egy-egy esetben előfordult.
Terhesség és szoptatás: kontrollált humán vizsgálatok nem állnak rendelkezésre, de - mérlegelést követően - adható, magzatkárosító hatása eleddig nem merült fel, az anyatejbe a szokásos adagok mellett nem jut át.
Megelőzés és kezelés: megfigyelés, fokozott óvatosság idősekben és nagyon fiatalokban. Folyadékbevitel korlátozása, testtömeg és serum nátrium szint ellenőrzés. Az alkalmazás felfüggesztése, tünetek esetén izotóniás vagy hypertoniás sóinfúzió, súlyos folyadékretenciókor furosemiddel kiegészítve.
Porcin VIII faktor
Korábban a plazmaeredetű porcin VIIIF sikeresen volt alkalmazhatő alloantitest inhibitoros betegeknél, ha a porcin-humán keresztreaktivitás alacsony volt. Porcin parvovírus kontamináció miatt a plazmaeredetű terméket visszavonták, az újonnan kifejlesztett beta domén depletált rekombináns porcin VIII faktor (BDD-r-po-FVIII) a klinikai vizsgálatok stádiumában van, jelenleg rutin kezelések céljára nem elérhető.
Tranexaminsav (Exacyl)
Tünetek: ritkán szédülés, hányinger, iv adás során hypotonia fordulhat elő. Nagyon ritkán allergiás bőrkiütések. Kis mennyiségben megjelenik az anyatejben és átjut a placentán. Kezelés: a gyógyszer elhagyása, tüneti. Terhességben ellenjavallt.
IV. Rehabilitáció és V. Gondozás
A beteg lakása szerinti gondozóhelyen folytatódik (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok). A diagnosztikát az arra alkalmas, akkreditált laboratórium, a kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
VI. Irodalomjegyzék
1. Boggio, LN, Green D: Acquired hemophilia. Rev. Clin. Experiment. Hematol. 2001; 5: 389-406.
2. Brackman HH, Lenk H, Scharrer I és mtsai. German recommendations for immune tolerance therapy in type A haemophiliacs with antibodies. Haemophilia, 1999; 5: 203-206.
3. Dimichelle D. Management of factor VIII inhibitors. Int J Hematology 2006; 83: 119-25.
4. Kempton CL., White GC II.: How we treat a hemophilia A patient with a factor VIII inhibitor. Blood 2008;doi:10.1182/2008-06-160432.
5. Feinstein D.I. Acquired disorders of hemostasis. In: Hemostasis and Thrombosis. Colman, Hirsh, Marder, Salzman (szerk.) J.B. Lippincott Co., Philadelphia, 1994. pp. 881-898.
6. Grossmann R, Mansouri-Taleghani B: Diagnostik und Therapie eworbener Faktoreninhibitoren. Dtsch. Med. Wschr. 1999; 124: 740-745.
7. Kessler CM. New perspectives in hemophilia treatment. Hematology 2005; 429-435.
8. Monahan PE, Aledort LM, Hemophilia Inhibitor Study Group: Factors affecting choice of hemostatic agent for the hemophilia patient with an inhibitor antibody. Am J Hematol 2004; 77: 346-350.
9. Kardos M.: Új terápiás irányelvek a korábban még nem kezelt haemophiliás gyermekek ellátására. 2008.
10. Pfliegler G.: Gátlótestes A és B haemophilia, ill. gátlótest haemophilia. In: Boda-Rák-Udvardy (szerk.): Klinikai haemostaseologia. Springer, Budapest, 2. Kiadás, 2000; pp. 324-348.
11. Triplett D, Harms CC. Factor VIII inhibitor assay. In: Triplett DA, Harms CS (szerk.): Procedures for the coagulation laboratory, pp. 72-75, Am Soc Clin Pathol, Chicago, 1981.
12. Turecek PL, Varadi K, Gritsch H, Schwarz HP. FEIBA: mode of action Haemophilia. 2004; Suppl.2, 3-9.
13. White GC, Kempton CL, Grimsley A, Nielsn B, Roberts HR. Cellular immune responses in hemophilia: why do inhibitors develop in some, but not all hemophiliacs? J Thromb Haemost 2005; 3: 1676-1681.
14. Hay CM., Brown S., Collins PW., et al. The diagnosis and management of factor VIII and IX inhibitors: a guidline from the United Kingdom Haemopilia Centre Doctors Organisation. Br J Haematol 2006;133:591-605.
15. Hay CR et al. Factor VIII inhibitors in mild and moderate-severity haemophlia A. TH 1998;79:762-6.
16. Eckhardt CL et al. Intensive perioperative use of factor VIII and the Arg593e cysmutation are risk factors for inhibitor development in mild/moderate haemophilia A. JTH 2009;7:926-33.
17. Aledort LM. Mild and moderate factor VIII deficiency: inhibitor risk. JTH 2009;7:938-9.
18. Gringeri A., Manucci PM. Italian giudlines for the diagnosisd and treatment of patients with haemophilia and inhibitors. Haemophilia 2005;11:611-9.
VII. Melléklet
Szükséges dokumentumok, bizonylatok
A Regionális Vérellátó Központokból, az OEP véralvadási faktor különkeretének Felhasználó Centrumaiból szerzendők be a vérkészítmények rendelésére vonatkozó mindenkori szabályok szerint.
Felelős személy
A gátlótest gyanúját felismerő orvos köteles a legközelebbi, vérzékeny betegek ellátására szakosodott intézményhez (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok). A kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
Formai követelmények Az alkalmazott módszer
1. Az irodalomkutatást a rendelkezésre álló nagy, internet kutatórendszerekkel (MedLine, Winspirs, PubMed) végezték.
2. A protokoll összeállítása során in extenso impakt faktoros lapokban, vezető szakemberek és centrumok által publikált közleményekre támaszkodtak.
A szerzők egyik készítmény terjesztésében sem érdekeltek.
SZERZETT (GÁTLÓTEST) HAEMOPHILIA DIAGNÓZISA ÉS KEZELÉSE
I. Alapvető megfontolások
Meghatározás
Vérzékenység, amely korábban nem vérzékeny egyénben spontán, az endogén alvadási faktorok (leggyakrabban a VIII-as) ellen kialakuló autoan titestek (gátló testek vagy inhibitorok) következtében lép fel.
BNO: D6890, D6820, D6840, D6941. Gátlótestek okozta vérzékenység
Kóroktan
A szerzett haemophilia (AH) oka autoantitest (IgG, rendszerint IgG4) kialakulása valamelyik (túlnyomórészt a FVIII) alvadási faktorral szemben. Ennek eredményeképpen az adott faktor aktivitásának csökkenése jön létre és ezáltal, a véralvadásban betöltött funkciója (pl. a FVIII esetén a FIXa és a FVIIIa komplex képződése) elégtelenné válik. FVIII elleni antitestek leggyakrabban a molekula nehézláncának A2 doménjén levő 459-509-es és 593-as; az A3-as doménjén található 1804-es és 1819-es; valamint a könnyű lánc C2 doménjén levő 2181-2243-as aminosavak közé kötődnek. Az anti-C2 antitestek a FVIII-nak a foszfolipidekhez és a vWF-hoz kapcsolódását, míg a nehéz lánc elleni antitestek a FVIIIa-nak a FX-hez és FIX-hez kötődését (az ún. tenáz komplex képződését) gátolják. Bár ugyanezen epitópokkal lépnek kapcsolatba a veleszületett A típusú haemophiliában kialakuló gátlótestek (ld. inhibitoros haemophilia) is, a FVIII inaktiválás kinetikája eltér egymástól: AH esetén II-es típusú (gyors kezdeti majd lapos szakaszt eredményező lassú inaktiváció), veleszületett haemophiliában pedig I-es típusú (lineáris) kinetikát követ.
Epidemiológia, incidencia, kísérő betegségek
A klinikai tünetekkel is járó esetek incidenciája 0,2-1,5:1 000 000 lakosra, s ezek 80-90%-ában súlyos, 8-22%-ában fatális vérzés lép fel. Az esetek mintegy felében alap/kísérőbetegséghez társulva, a másik felében idiopathiásan jelentkezik. A fentebbi relatív gyakoriságban észlelhető jelentős irodalmi különbségek a vizsgált populációk különbözőségén túlmenően, abból is adódnak, hogy a kórállapot esetenként helytelenül egyéb, súlyos, szerzett vérzékenységként (pl. disszeminált intravasalis alvadás; DIC) kerülhet kórismézésre. Az incidencia az elmúlt években növekszik, aminek oka összetett: szerepet játszhat benne a gátlótest haemophilia egyes alapbetegségeivel (pl. daganatos, autoimmun betegségek) élők számának és túlélési idejének, az antibiotikum kezelések gyakoriságának növekedése, de egyéb, ismeretlen tényezők sem zárhatók ki. Különböző előfordulási adatokhoz, átfedésekhez vezetnek az eltérő csoportosítási szempontok is, mert pl. "gasztrointesztinális megbetegedésekhez társuló" szerzett haemophilia esetén nyilvánvaló, hogy a csoportba kóroktani szempontból autoimmun vagy fertőző betegségek éppúgy beletartoznak mint a gyomor-bélrendszeri daganatok stb. Az egyes alapbetegségek általában nem faktor-specifikusak, vannak azonban speciális, csak egy vagy néhány faktor elleni gátlótest kialakulásában szerepet játszó tényezők is, mint például a FII vagy a FV-elleni gátlótest kialakulását kiváltó thrombin-szivacs.
Az egész világon és bármely etnikumban előfordulhat, incidenciája azonban bizonyos fokig különböző az egyes népcsoportokban, aminek oka - újabb adatok szerint - az immunszabályozó gének különböző polymorphismusában, nevezetesen a cytotoxikus T-lymphocyta asszociált 4-es fehérje; CTLA-4 génben keresendő. A megfigyelés még további megerősítést igényel. Megjelenési ideje szerint az idősek (60-80 év között) érintettek a leggyakrabban, de fiatal (20-30 év között) nőkben szülés után vagy autoimmun alapbetegséghez csatlakozóan ugyancsak megfigyelhető egy kisebb csúcs. Az epidemiologiai adatok rendszerint a FVIII-elleni gátlótestre (szerzett "A"-haemophilia) vonatkoznak, ennél bizonyosan sokkal ritkább a szerzett "B"-haemophilia, míg a többi faktor elleni gátlótest okozta vérzékenységekről csak néhány vagy néhány tucat esetközlés ismert.
A szerzett haemophiliákhoz társuló kórképeket az 1. táblázatban foglaltuk össze.
1. táblázat. A szerzett haemophiliákhoz társuló kórképek/alapbetegségek.
| Állapot/alapbetegség (a társulás gyakorisága: %) | Kórkép |
| Idiopathiás (45-50) | Nem ismert |
| Autoimmun kórképek (16--23) | Rheumatoid arthritis, systemás lupus enrythematosus, Sjögren syndroma, autoimmun pajzsmirigy betegségek, myasthenia gravis, asthma bronchiale, psoriasis, pemphigus, gyulladásos bélbetegségek |
| Állapot/alapbetegség (a társulás gyakorisága: %) | Kórkép |
| Onkológiai kórképek (3-15) | Tüdő-, emlő, vastagbél rák, melanoma, méhnyakrák, lymphoproliferatív kórképek, plasma- sejt idiosyncrasiák, myelodysplasia, myeloproliferatív syndroma, erythroleukaemia |
| Fertőzések (?) | Akut B-, akut C-hepatitis, tuberculosis |
| Egyéb (vitatott vagy multiaetiologiájú) kórképek (?) | Krónikus obstruktív tüdőbetegség, diabetes mellitus, sclerosis multiplex, amyloidosis |
| Gyógyszerek (3-6) | Penicillinszármazékok, sulfonamidok, phenytoin, interferon alpha, fludarabin, BCG vakcináció, lokálisan alkalmazott thrombin* |
| Terhesség, postpartum (2-11) | A post partum időszak első néhány hónapjában; többnyire elsőszülő nőkre vannak adatok |
*FII vagy FV elleni gátlótest
II. Diagnózis
Klinikai megjelenés
A klinikai kép, vagyis a fenotípus AH-ban igen változatos és nem korrelál a laboratóriumi leletekkel. Jellegzetes a műtét utáni, vagy spontán, negatív vérzékeny anamnézis mellett megjelenő, a szokásos beavatkozásokkal rendszerint csillapíthatatlan vérzés, amely elsősorban a lágyrészeket, a bőrt és a nyálkahártyákat érinti. A szövetközti vérzés hamar kompartment szindrómát (a neurovascularis kötegek nyomását) okozhat. Jellemző a garatkörüli, a retroperitonealis haematoma és a nagykiterjedésű suffusio. A nyálkahártya vérzésekre melaena, hüvelyi vérzés, haematuria hívhatják fel a figyelmet. Nem ritka a kisebb orvosi beavatkozást (pl. vérvételt) követő elhúzódó vérezgetés sem - hasonlóan a DIC-hez, ami az elkülönítő kórismében okozhat nehézséget. A súlyos, veleszületett haemophiliával ellentétben ritka az ízületii vérzés, a predilekciós helyben észlelt különbség pontos oka nem ismert. A vérlemezke szám és működés rendszerint megtartott, ezért a nyálkahártya vérzések nem thrombocyta eredetűek. Idősebb betegekben a társult betegségek mellett gondolni kell arra is, hogy nagy százalékban szedhetnek thrombocyta működést gátló gyógyszereket.
A betegség kimenetele gyakorta súlyos, a közvetlenül, vérzés miatt bekövetkező halálozást 8 és 22% közé teszik, aminek főként az első hetekben nagy a kockázata.
Post partum AH-ban (mely leggyakrabban az első szülést követően alakul ki és többnyire nagy titerű gátlótesttel jár) az első jel rendszerint a hüvelyi vérzés. Újabb terhesség során a kialakulás valószínűségének pontos előrejelzése nem lehetséges, de mindenképpen célszerű gondolni rá. Több, nemzetközi felmérésben nem találtak ismétlődésre adatot, ezek azonban - érthető módon - kis esetszámokon alapultak. (Bár ilyen felmérés nem készült, feltehető az is, hogy a gátlótest haemophilián átesett nők ritkábban vállalkoznak további terhességekre). Egy amerikai, multicentrikus tanulmányban, amelynek során a vizsgált 14 post partum AH-on átesett nőből hárman vállaltak újabb, összesen hat terhességet, négy alkalommal figyeltek meg az újabb terhesség alatt átmeneti gátlótest titer növekedést) és két esetben a betegség kiújulását.
Klinikai gyanú
Minden olyan esetben fel kell merülnie a AH lehetőségének, amikor korábbi negatív vérzéses kórelőzmény ellenére, hirtelen vérzékenység lép fel. Különösen idősebb, autoimmun vagy malignus alapbetegségben szenvedők, vagy néhány hónappal korábban szült nők esetén kell erre a lehetőségre is gondolni, minden, a beteget ellátó orvosnak, függetlenül szakterületétől. Izolált, megmagyarázhatatlan alvadási szűrő teszt (leggyakrabban APTI) ugyancsak fel kell keltse az AH gyanúját. Ez esetben a laboratóriumnak el kell végezni a keverési tesztet. A klinikus és a laboratórium együttműködése elengedhetetlen.
Laboratóriumi diagnózis
1. Az adott faktorhiányra jellemző alvadási szűrőteszt/ek (prothrombin idő; PI, aktivált partialis thromboplastin idő;
APTI, thrombin idő; TI) értéke megnyúlik
FVIII-, FIX-, FXI-szerzett haemophilia esetén: APTI
FVII-szerzett haemophilia esetén: PI
FV-szerzett haemophilia esetén: PI, APTI
FII-szerzett haemophilia esetén: PI, APTI, TI Kivétel a FXIII-szerzett haemophilia, amelyben valamennyi szűrőteszt értéke normális marad.
2. A beteg és a kontroll plasma 1:1 arányú keverése és 2 órás, 37 C fokon történő inkubációja. Normálisan az APTI, a FVIII bomlása miatt kismértékben megnyúlik, gátlótest jelenléte esetén azonban ez a megnyúlás sokkal kifejezettebb. A kontroll plasmához viszonyítva 10-15 másodperces vagy nagyobb különbség utal gátlótestre. Lupus antikoagulánstól az különti el, hogy az utóbbi esetben a megnyúlás azonnal bekövetkezik és mértéke érdemben a 2 órás inkubációs idő múltán sem változik.
3. Az APTI megnyúlást - mint utaltunk rá - a FVIII-on kívül ritkán más faktor elleni gátlótest okozza. Azt, hogy melyik faktor ellen termelődött gátlótest, speciális faktortitrálással (kezdve a leggyakoribb FVIII-cal) azonosíthatjuk be.
4. A gátlótest titerét - hasonlóan a veleszületett haemophiliák inhibitoraihoz - Bethesda egységben (BE) adjuk meg: A beteg plasmájának antitest titere akkor 1 BE, ha a normál, gyűjtött plasma (1:1 arányban hozzákeverve, 2 h 37 C fokos inkubáció végén) eredeti FVIII aktivitását a felére csökkenti. A teszt pontos kivitelezéséhez a normál plasmát (megelőzendő a pH-függő inaktiválódást) stabilizáljuk és sorozathígítást alkalmazunk. A maradék (residuális) FVIII aktivitást határozzuk meg. (Residuális aktivitással az antitest II-es típusú, nem lineáris inaktivációs mechanizmusa miatt számolhatunk.)
5. Nemzetközi megegyezés értelmében "nagy" antitest titer az 5 BE feletti, "kis" antitest titer az 5 BE alatti gátlótest. Előbbi betegek az ún. "high-responder"-ek, az utóbbiak a "low-responder"-ek.
A további részleteket illetően Id. a Gátlótestes haemophilia c. fejezetet!
III. Kezelés
Azonnali (elsődleges) cél minden esetben a vérzés megszűntetése. Ezt, elviekben három módon érhetjük el: 1. "megkerüljük" a gátolt faktort, tehát nélküle jön létre az alvadás (ez, jelenleg az elsőként ajánlott kezelési mód), 2. a gátolt/hiányzó alvadási faktort olyan nagy mennyiségben juttatjuk be, amely kimeríti és "túllövi" (legalábbis ideiglenesen) a gátlótestet, 3. sürgősséggel eltávolítjuk (legalábbis ideiglenesen) a gátlótestet a beteg keringéséből, ami plasmapheresissel, adsorptioval történhet és a megfelelő faktorkoncentrátummal biztosítjuk a hemosztázist.
A távolabbi (másodlagos) cél az autoantitest képződésének megakadályozása, amibe, ha nem idiopathiás esetekről van szó, beletartozik az alapbetegség kezelése is. Míg a vérzés megszűntetésére rendelkezésünkre álló lehetőségek bizonyos mértékig faktor-specifikusak (pl. FIX, FVIII koncentrátumok), a gátlótest képződésének szuppressziójában az autoimmun betegségek kezelésekor általánosan alkalmazott készítményeket (pl. corticosteroid, azathioprin, cyclophosphamid, cyclosporin, immunglobulin) alkalmazzuk. Az alapbetegség kezelése természetesen betegségfüggő, de "átfedések" itt is előfordulhatnak, hiszen például a corticosteroidok lymphoproliferatív kórkép esetén immunszuppresszív hatásuk mellett, "oki" terápiás szereppel is bírnak. Az alkalmazott kezelés és annak intenzitása számos tényezőtől függ, mint a beteg kora, alap-, illetve kísérő betegségei, az ún. prognosztikai tényezők: az immunválasz, a spontán titer-csökkenés valószínűsége, a kezelés mellékhatásai stb. Az eredményes kezelést jól egészítik ki a fibrinolysis gátlók (tranexam sav; epsilon-amino capronsav), amennyiben alkalmazásuk nem ellenjavallt (pl. vesevérzés).
Az elsődleges és másodlagos kezelési cél megvalósítását általában egyidőben kezdjük el. A terápiás válasz lemérésére a klinikum (ti. a vérzés megszűnése) mellett az adott faktorra jellemző, megnyúlt alvadási idő (pl. APTI) rövidülése, illetve a gátlótest titerének csökkenése/eltűnése használható.
Fontos szem előtt tartani azt is, hogy a terápiás ajánlások általában szerzett "A"-haemophiliára (FVIII elleni gátlótest) vonatkoznak, míg a többi esetben a javaslatok, ritkaságuk miatt olykor csak anekdotikus közléseken, néhány betegen nyert megfigyeléseken alapulnak.
A vérzés megszűntetése (azonnali cél)
Az egyes faktorok elleni gátlótestek okozta vérzékenység megszűntetésének lehetőségeit a 2. táblázat foglalja össze.
2. táblázat. A vérzés megszűntetésének lehetőségei szerzett haemophiliában
| Faktor elleni gátlótest | Kezelés: aktív vérzés esetén azonnal el kell kezdeni, mind a gátlótest titerétől, mind a reziduális faktor aktivitástól függetlenül |
| FVIII/FIX | Ismeretlen vagy magas (> 5 BE) gátlótest titer, közepes vagy annál nagyobb vérzés esetén by-passing kezelés javasolt: rFVIIa*: 90 ng/tksg 2-3 óránként ismételve, a vérzés megszűntéig vagy: APCC**: 50-100 E/tskg, 8-12 óránként, bolusban (max. 200 E/tskg/24 h) |
| a kezelés eredménytelensége esetén, ha a feltételek adottak: plasmapheresis (+ sepharose A oszlop, az immunadsorptio növelésére) 5%-os albuminnal, nagyadagú VIII-as faktorral cserélve. | |
| életveszélyes vagy végtag elvesztésével fenyegető vérzés esetén: APCC (50-100 E/tskg) + rFVIIa (90 ug/tksg) együttes adása**** | |
| Alacsony (<5 BE) gátlótest titer, kis vérzés esetén vagy ha a by-passing készítmény nem elérhető substitutiós kezelés FVIIIC/FIXC koncentrátum, az alábbi adagolási módok valamelyikével: a) 100-200 E/tskg. Ha eredményes, folytatandó, naponta 2-3x. b) "inhibitor semlegesítő" adag 20 E/tskg/BE + 40 E/tskg; cél: 20-50 E/ml FVIII/FIX aktivitás elérése; azt követően 6-8 óránként 20-50 E/tskg bolusban vagy 3-4 E/tskg folyamatos infúzióban a FVIII/IX érték alakulásától függően. ha a kezelés az első 24 órában nem eredményes, át kell térni bypassing készítményre (ennek biztosítására vagy a beteg megfelelő központba juttatására az időnek elegendőnek kell lennie) | |
| Igen alacsony gátlótest titernél, enyhe vérzéskor, csak FVIII-elleni gátlótest esetén: DDAVP*** (0,3 ug/tskg); egy alkalommal 12 h múlva ismételhető | |
| FII | APCC, rFVIIa, FFP****, immunadsorptio + plasmapheresis |
| FV | FFP, rFVIIa, immunadsorptio + plasmapheresis |
| FVII | rFVIIa, APCC, FIX, FVII |
| FX | APCC, FFP |
| FXI | FFP, FXI koncentrátum, rFVIIa |
| FXIII | FXIII, FFP |
* rFVIIa: rekombinált aktív VII-es faktor: veleszületett haemophiliásokban, gátlótest fellépése esetén, főként fiatal betegekben egyszeri nagy adag (270 ug/tksg) rFVIIa adásával is vannak kedvező tapasztalatok. Szerzett haemophiliában azonban nem rendelkezünk adatokkal és, tekintve, hogy általában idősebb betegekről van szó, akiknek gyakran súlyos társbetegségeik is vannak, az artériás thromboembolia veszélye miatt az egyszeri, nagy adag nem ajánlott.
** APCC: aktivált prothrombin complex concentratum
*** DDAVP: deamino-D-arginin-vasopresszin: idősebbekben a mellékhatások miatt (ld.ott) nem ajánlott.
**** rFVIIa+ APCC együttadása a korábbi kezelések sikertelensége esetén, életveszélyes vérzésben jöhet szóba, de idősebb betegeknél, súlyos társbetegségek esetén a thromboembolia aránytalanul nagy veszélye miatt nem ajánlott.
***** ffP: friss fagyasztott plasma
A kezelés eredményességének/eredménytelenségének lemérése, követés:
- Vérzés megszűnte/csillapodása (24 h elteltével kritikus, 48 h elteltével enyhe vérzés esetén)
- Képalkotókkal a vérzés változatlan volta/növekedése
- Új helyen bekövetkező vérzés
Prophylaxis
AH betegekben a remisszió eléréséig lehetőleg kerülni kell minden invazív beavatkozást. Ha mégis elkerülhetetlenné válik (pl. életmentő műtét, centralis véna biztosítás stb.) by-passing készítménnyel biztosítsuk a megfelelő védelmet, a műtét megkívánta dózis alkalmazásával. Kis gátlótest titer esetén, ha a teszt dózisban adott FVIII/FIX kellő faktoraktivitás emelkedéssel jár, alternatív megoldásként faktorpótlás is szóbajön, szoros monitorozás mellett.
Az antitest eradikálása (hosszútávú cél)
Bár az autoantitest spontán eltűnése is előfordul, az IS-t lehetőleg haladéktalanul meg kell kezdeni. A gátlótest szint nem pontos előrejelzője az esetlegesen bekövetkező vérzés súlyosságának! Hosszútávú kezelés és követés elengedhetetlen a relapszus veszélye (kisebb a post partum és a gyógyszer indukálta esetekben) miatt.
Mind a remissziós ráta, mind a relapszusok aránya kedvezőbb a kombinált kezelésekkel, mint a monoterápiával. A választott készítmény(ek) és kezelés mindig személyre szabott legyen (pl. ellenjavallat, életkor stb.)
Ma, első választásként a 2.1. (corticosteroid+cyclophosphamid) és a 3.1. (corticosteroid + cyclophosphamid + FVIII-koncentrátum) ajánlható.
1. Monoterápia
1.1.rituximab
375 mg/m2, négy-hat héten keresztül, heti egy alkalommal. A klinikai és laboratóriumi válasz rendszerint az első hét végén jelentkezik. "Off-label" alkalmazás. Lehet első vagy másodvonalbeli kezelés. Monoterápiában alkalmazva az újabb adatok szerint hatékonysága nem éri el a hagyományos immunszuppressziót.
1.2.cyclosporin mint 2.2 alatti dózis
2. Kettős kombinációk
2.1. corticosteroid + cyclophosphamid
prednisolon (1 mg/tskg/nap) per os hat hétig, majd fokozatosan csökkentve
+
cyclophosphamid, amely kétféleképpen adható:
a) per os 1,5-2,0 mg/tskg/nap legfeljebb 3-4 hónapig vagy
b) iv 10 mg/tskg 2 napig, folytatva per os 8 napig
Első vonalbeli kezelés, ezideig a monoterápiánál magasabb remissziós rátát eredményez, amely azonban nem mindig a legtartósabb is egyben.
Az alkiláló szerek ismert mellékhatásai miatt, a potenciálisan még szülhető nőkben a cyclophosphamid helyett azathioprin (1-3 mg/tskg/nap, 6-8 hétig, fokozatos csökkentéssel törekedve a lehető legkisebb dózisra) ajánlott.
2.2. corticosteroid + cyclosporin
methilprednisolon (100 mg/nap), fokozatosan csökkentve, majd hónapokig másnaponta 8 mg vagy elhagyva +
cyclosporin: 5 mg/tskg/nap, vagy 200-300 mg/nap (serum szint 150-350 ng/ml) naponta kétszerre elosztva, fokozatosan, két-három hetente csökkentve, hónapokig.
Megjegyzés: a cyclosporint az Egyesült Államok Szövetségi Gyógyszerbiztonsági Hivatala (FDA; Federal Drug Administration) az ún. "C" terhességi kategóriába sorolja, ami azt jelenti, hogy bár a gyógyszer nem bizonyult teratogénnek és nem abszolút ellenjavallt terhességben, alkalmazásának lehetnek veszélyei (koraszülés, kis súly), ezért terhesekben/szoptatás alatt csak az előnyök és a kockázatok gondos, egyénre szabott mérlegelése után szabad alkalmazni.
2.3. corticosteroid +rituximab
< 5 Bu antitest titer esetén, a szokásos dózisokkal.
3. Hármas kombinációk
3.1.Corticosteroid + cyclophosphamid + FVIII-koncentrátum ("Budapest"- protokoll)
methilprednisolon 100 mg/nap p.o., fokozatosan csökkentve +
cyclophosphamid 200 mg/nap, max. 2-3 g-ig +
FVIII-koncentrátum 30 E/tskg/nap az 1. héten 20 E/tskg/nap a 2.héten 10 E/tskg/nap a 3.héten
A 3 hétig tartó kezelés (fenntartó terápia nem szükséges), mely gyakran gyors remissziót eredményez, ezért előnyösen alkalmazható kritikus vérzéses manifesztációkkal jelentkező betegek esetében is.
3.2.corticosteroid + cyclophosphamid + vincristin
a prednisolon + cyclophosphamid kezelés (ld.fent) valamelyik alkalmazási formája + vincristin (1,4 mg/m2 iv, négy hetente) adása
3.3.corticosteroid + cyclophosphamid + rituximab
kombinációt - szokásos adagokkal - 5-30 BE antitest titer esetén ajánlják.
4. Ötös kombináció
4.1. corticosteroid + cyclophosphamid + adsorptio + IVIG + FVIII Prednisolon (1 mg/tskg/nap, p.o.) +
Cyclophosphamid 1-2 mg/tskg/nap a remisszióig +
FVIII: 100-200 E/tskg, 6 óránként, a remisszióig +
Adsorptio: 2,5-3x plasmatérfogat, 1-5. napig
A kezelési ciklusok (1-7 nap) ismétlése a klinikai és laboratóriumi remisszióig. Ún. "katasztrófa-kombináció", csak a többi kezelés eredménytelensége, illetve a tárgyi-anyagi feltételek biztosított volta esetén jön szóba.
Egyéb
Human immunglobulin intravénás (IVIG): polyvalens immunglobulin. 2,0 g/tskg/2 nap vagy 0,5 g/tskg, 5 napig. Önmagában nem bizonyult hatásosnak, egyéb immunszupresszív kezelés adjuvánsaként, főként idősebbekben jön szóba.
2-chlorodeoxyadenosin (2-CDA): alkalmazása ugyancsak szóbajöhet, egyéb kezelési módok sikertelensége esetén. 0.1 mg/tskg, 24 h infúzióban, 7 napig. Szintén "off-label" indikáció!
Kiegészítő kezelés
Tranexam-sav: fibrinolysis gátló.
Fibrin glue (ragasztó)
Thrombin-szivacs
Készítmények, mellékhatásuk és elhárításuk
A készítmények a regionális haemophilia ellátó központokban állnak rendelkezésre. Az itt felsorolt szempontokon túl, minden esetben javasolt a gyógyszer előiratokban foglaltak teljes körű ismerete és figyelembe vétele!
A friss fagyasztott plasma nem virus mentesített, az önkéntes donorok vizsgálatával a fertőzés veszélye azonban nem jelentős. A faktorkészítmények esetén a virusfertőzés veszélye már igen csekély, de teljes biztonsággal a nem-lipid burkú kórokozók (Parvovirus B19, prionok) átvitelének lehetősége itt sem zárható ki.
Friss fagyasztott plasma
Előállítása teljes vérből centrifugálással vagy plasmapheresissel történik. Mind a labilis, mind a stabil alvadási faktorokat tartalmazza. ABO kompatibilisen kell alkalmazni. Általában 10-30 ml/tskg adagban kell adni.
AH-indikációk: csak a megfelelő faktorkészítmény elérhetetlensége esetén, FV, FX, FXI, FXIII elleni gátlótest okozta, aktív vérzés esetén. Mellékhatás: a virus fertőzésen túl, nagy adagok esetén, főként idősebb betegekben a volumenterhelés veszélye. A sejtkontamináció miatt pyrogén reakció léphet fel. Ellenjavallt: IgA hiányban, szívelégtelenségben. Faktor készítmények
FVIII-koncentrátumok: Humafactor-8 (Kedrion), Recombinate (Baxter), Immunate SD (Baxter), Refacto AF (Pfizer), Haemate P (CSL Behring), Haemoctin SDH (Biotest), Advate (Baxter), Octanate (Octopharma), Kogenate (Bayer)
Rekombinált és plasma eredetű, virus inaktivált készítmények. Hatásosságuk függ az antitest titertől, a vérzés nagyságától, helyétől és a készítményre a beteg által adott korábbi választól. Nagy antitest titerek esetén általában nem hatékonyak.
Hatáskövetés: klinikai, faktorszint (legalább naponta egyszer meghatározandó), de az autoantitestek Il-es típusú kinetikája miatt nincs szoros összefüggés a faktor plasma szintje és a klinikai válasz között, ezért az utóbbinak van nagyobb súlya a kezelés eredményességének lemérésében.
FIX-koncentrátumok: Humafactor-9 (Kedrion), Immunine (Baxter), Berinin (CSL Behring), BeneF-IX (Pfizer). Mint FVIII-koncentártumoknál.
Prothrombin Complex Concentratumok; PCC: Prothromplex Total/STIM: FII, FVII, IIX, FX (Baxter), Protthromplex TIM: FII, FIX, FX (Baxter), Beriplex P/N (CSL Behring)
Aktivált Prothrombin Complex Concentratum; APCC: FEIBA NF (Baxter)
Plasma eredetű, virus inaktivált készítmény, amely kikerüli a gátolt alvadási tényezőt.
Relatív ellenjavallatok: előrehaladott érelmeszesedés, súlyos fertőzés. Adása és szisztémás tranexam-sav bevitel vagy más készítményre (rFVIIa) váltás között legalább hat óra különbség legyen. rFVIIa: NovoSeven (NovoNordisk)
Rekombinált, aktivált VII-es faktor, a véralvadás erőteljes aktivátora.
Mellékhatások: a súlyos, nemkívánatos mellékhatások tünete 1% alatt, az enyhébbeké 8%. Fájdalom, láz, fejfájás, hányás, allergiás bőrjelenségek. Thrombocytopenia, fdp felszaporodás, fibrinogen csökkenés (disszeminált intravasalis coagulatio), igen ritkán thrombosisos események, köztük szívinfarktus. Antitest alakulhat ki ellene.
Terhesség és szoptatás. Kifejezett indikációval adható, magzatkárosító hatás eddig nem ismert, az anyatejbe nagy valószínűséggel nem jut át.
Kezelés: az adás felfüggesztése, allergia esetén steroid, antihistamin.
Fibrinogen; FI: Haemocomplettan P 1 g (CSL Behring) Tisztított fibrinogen koncentrátum, humán plasmából állítják elő. Adagja (kezdő) általában 1-2 g, de súlyos vérzésnél 4-8 g is lehet. Követése: klinikum, fibrinogen szint.
Mellékhatások: thrombosis, mely elsősorban idősebbekben, érbetegekben jelenthet kockázatot. Allergia.
FXIII: Fibrogammin P (CSL Behring)
Tisztított FXIII koncentrátum, humán plasmából állítják elő.
Adagolás: terápiás adagja 10-20 E/nap, de súlyos vérzés, gátlótest eset ennél nagyobb adagok is szükségesek lehetnek.
Törekedni kell az 50 E/ml szint elérésére, különösen életveszélyes (pl. koponyaűri) vérzés esetén.
Mellékhatások:allergia, anaphylaxia fordulhat elő, mint minden fehérje készítmény adásakor.
Porcin VIII faktor
Korábban a plazmaeredetű porcin VIIIF sikeresen volt alkalmazható allo- és autoantitest inhibitoros betegeknél, ha a porcinhumán keresztreaktivitás alacsony volt. Porcin parvovírus kontamináció miatt a plazmaeredetű terméket visszavonták, az újonnan kifejlesztett beta domain depletált rekombinált porcin VIII faktor (BDD-r-po-FVIII) a klinikai vizsgálatok stádiumában van, jelenleg rutin kezelések céljára nem elérhető.
Egyéb készítmények
Rituximab (Mabthera)
Rekombinált monoklonális antitest, specifikusan kötődve mind a pre-B, mind az érett B-sejtek CD20 antigénjéhez, csökkent a sejtek számát, s ezáltal a termelt antitest mennyiségét.
Mellékhatások: (szerzett haemophiliában ritkábban jelentkeznek és enyhébbek, mint daganatos indikációval alkalmazva) láz, hidegrázás, asthenia, fejfájás, torokkaparás, hasfájás, hátfájás, kipirulás, mellkasi fájdalom, elesettség, hypotensio, hypertensio, tacyhcardia, arrhythmia, émelygés, hányás, hasmenés, dyspepsia, anorexia, leukopenia, neutropenia, thrombocytopenia, anaemia, angioedema, hyperglycaema, perifériás oedema, myalgia, arthralgia, szédülés, paraesthesia, szorongás, álmatlanság, bronchospasmus, rhinitis, köhögés, dyspnoe, pruritus, kiütés, urticaria. Adásakor szoros monitorozás szükséges. Kezelés: az adás felfüggesztése, tünetorientált kezelés.
DDAVP (deamino-D-arginin vasopressin, desmopressinum aceticum, Minirin, Octostim).
Az érfalban raktározott von Willebrand-faktor (vWF) és FVIII felszabadulása, valamint vasoconstrictio révén csillapítja a vérzést.
Másodlagos hatásként a fibrinolysist is fokozza. A tachyphylaxia jelensége miatt - a vWF/FVIII raktárak kiürültével - nem ismételhető. Enyhe, A"-típusú szerzett haemophiliában kísérelhető meg.
Mellékhatások: fejfájás, fáradtság, tachycardia, átmeneti vérnyomásesés, arc kipirulás, gyomorfájdalom, hányinger, ritkán, nagy adagban alkalmazva szédülés. Ha a bevitel nem jár együtt a folyadékbevitel korlátozásával: vízretenció, hyponatraemia. Allergia, anaphylaxia egy-egy esetben előfordult.
Terhesség és szoptatás: kontrollált humán vizsgálatok nem állnak rendelkezésre, de - mérlegelést követően - adható, magzatkárosító hatása eleddig nem merült fel, az anyatejbe a szokásos adagok mellett nem jut át.
Megelőzés és kezelés: megfigyelés, fokozott óvatosság idősekben (>50 év) és nagyon fiatalokban (< 3 év). Ischaemiás szívbetegségben ellenjavallt. Folyadékbevitel korlátozása, testtömeg és serum nátrium szint ellenőrzés. Az alkalmazás felfüggesztése, tünetek esetén izotóniás vagy hypertoniás sóinfúzió, súlyos folyadékretenciókor furosemiddel kiegészítve.
Tranexamsav (Exacyl)
A plasminogen aktivátorok gátlása révén késlelteti a fibrinolysist.
Ellenjavallatok: APCC-vel együttes szisztémás adása a fokozott thrombosis veszély miatt nem javasolt (legalább 6 óra különbség legyen a két szer bevitele közt).
Mellékhatások: ritkán szédülés, hányinger, iv adás során hypotonia fordulhat elő. Nagyon ritkán allergiás bőrkiütések. Kis mennyiségben megjelenik az anyatejben és átjut a placentán.
Kezelés: a gyógyszer elhagyása, tüneti. Terhességben, illetve vesevérzésben (lument elzáró alvadék veszélye miatt) ellenjavallt.
Immunszupresszánsok
Cyclophosphamid (Cytoxan, Endoxan)
A májban aktiválódik. Alkiláló szerként a daganatos (és az antitest termelő) sejtek apoptosisát fokozza.
Mellékhatások: karcinogenezis, mutagenezis, a fertilitás csökkenése, húgyúti károsodás, szív toxicitás, fertőztésekkel szembeni fokozott érzékenység, interstitialis pneumonia, allergia, leukopenia, thrombocytopenia, anaemia. Bélgyulladás (haemorrhagiás colitis), hányinger, hányás, szájnyálkahártya fekélyek.
Terhesség és szoptatás: magzatkárosodást okozhat, az anyatejbe átjut, később infertilitást okozhat. Alkalmazása csak az anyai élet megmentése érdekében megengedhető. Kezelés: adásának felfüggesztése, supportív terápia.
Azathioprin (Imuran)
Prodrug, a szervezetben metabolizálódik az aktív hatóanyaggá (mercaptopurin). A T- és B-lymphocyták proliferatioját gátolja.
Mellékhatások: túlérzékenységi reakció, csontvelő depresszió, fokozott fertőzésveszély, gyomor-béltraktus zavarok, pancreatitis, májműködés romlása, pneumonitis, alopecia. A magzatba átjut, az anyatejben is kimutatható.
Kezelés: tüneti (pl. antibiotikum, fehérvérsejt képzésstimulálás, thrombocyta szuszpenzió stb.)
Cyclosporin-A (Sandimmun, Sandimmun Neoral)
Gátolja az immunkompetens lymphocytákat, a lymphokin képződést és az interleukin-2 felszabadulást.
Mellékhatások (általában dózisfüggőek): hypertrichosis, tremor, veseműködés károsodás, hypertonia, gyomor-bélpanaszok, gingiva hyperplasia, allergia, paraesthesiák, izomgörcsök thrombocytopenia, thrombotikus microangiopathia, ritkán lymphoproliferatív kórkép.
Megelőzés és kezelés: az adag csökkentése, a cyclosporin szint monitorozása. Tüneti ellátás.
2. chlorodeoxyadenosine (CDA): Cladribine, Leustatin
Adenosin deaminase gátló, az (antitest termelő) B-lymphocyták számát csökkenti.
Mellékhatások: láz, neutropenia, anaemia, hányinger, hányás, hidegrázás, főfájás, székrekedés, köhögés, fáradékonyság.
Terhesség és nemzés is ellenjavallt alkalmazása alatt.
Immunglobulin (Humaglobin, Pentaglobin, Endobulin
Polyvalens immunglobulin. Anti-idioípus reguláció, a CD8 sejtszám növelése révén fejti ki - nem specifikus - immunszupresszor hatását.
Mellékhatások: allergiás reakciók, anaphylaxiás shock (pl. IgA hiányos betegnél).
Megelőzés: allergiás diathesisű egyénnél corticosteroid, antihisztamin profilaktikus adása.
Kezelés: a készítmény adásának felfüggesztése, corticosteroid, sz.e. shocktalanítás (nagy adagú iv corticosteroid, kálcium, volumenpótlás, oxigén).
A plasma eredetű készítmények esetén bár igen csekély, de teljes biztonsággal ki nem zárható a lehetősége a nem-lipid burkú kórokozók (Parvovirus B19, prionok) átvitelének.
IV. Rehabilitáció és V. Gondozás
Eljárás, felelős személy
A gátlótest gyanuját felismerő orvos köteles a legközelebbi, vérzékeny betegek ellátására szakosodott intézményhez (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok) fordulni. A kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
VI. Irodalomjegyzék
1. Ajzner É, Schlammadinger Á, Kerényi A, Bereczki Z, Katona É, Haramura G, Boda Z, Muszbek L.. Severe bleeding complications caused by an autoantibody against B subunit of plasma factor XIII:a novel form of acquired factor XIII deficiency. Blood 2009; 113: 723-725.
2. Boggio, LN, Green D: Acquired hemophilia. Rev. Clin. Experiment. Hematol. 2001, 5, 389-406.
3. Brackman HH, Lenk H, Scharrer I és mtsai. German recommendations for immune tolerance therapy in type A haemophiliacs with antibodies. Haemophilia, 1999, 5, 203-206.
4. Collins PW, Baudo F, Knoebl P, Levesque H, Nemes L, Pellegrini F, Tengborn L, Huth-Kuehne A. Inhibitor eradication in acquired haemophilia A: final results of European Acquired Haemopholia Registry (EACH2). Blood 116;21 315, 2010.
5. Collins PW, Hirsch S, Baglin TP et al. A 2-year national surveillance study by the united Kingdom Haemophilia Centre Doctor's Organisation. Blood 2007, 109, 1870-1877.
6. Collins PW. 715 inhibitor eradication in acquired haemophilia A: final results of European Acquired Haemophilia Registry (EACH2).
7. http://ash.confex.com/ash/2010/webprogram/Paper26731.html
8. Delgado J, Jimenez-Juste V et al. Acquired haemophilia: review and meta-analysis focused on therapy and prognostic factors, Br J Haematol 2003, 121, 21-35.
9. Dimichelle D. Inhibitors: resolving diagnostic and therapeutic dilemmas. Haemophilia, 2002, 8, 280-287.
10. Franchini M, Lipi G. Acquired factor VIII inhibitors. Blood, 2008, 112, 250-255.
11. Giangrande P. Acquired hemophilia. Treatment of Hemophilia 2005, 38, 1-8.
12. Grossmann R, Mansouri-Taleghani B: Diagnostik und Therapie erworbener Faktoreninhibitoren. Dtsch. Med. Wschr. 1999, 124, 740-745.
13. Green D, Lechner K. A survey of 215 non-hemophilic patients with inhibitors to factor VIII. Thromb Haemost 1981, 45, 200-203.
14. Gringeri A, Mannucci PM, for the Italian Association of Haemophilia Centres. Italian guidelines for the diagnosis and treatment of paients with haemophilia and inhibitors. Haemophilia 2005, 11, 611-619.
15. Huth-Kühne A, Baudo F, Collins P et al. International recommendations ont he diagnosis and treatment of patients with acquired haemophilia A. Haematologica 2009, 94, 566-575.
16. Ilonczai P, Schlammadinger Á, Oláh Z, Rázsó K, Berezcky Z, Boda Z. Temporarily succesful eradication therapy in acquired haemophilia with high inhibitor titer: a case report with a new protocol. Thromb Haemost 2008, 100, 149-150.
17. Kessler CM. New perspectives in hemophilia treatment. Hematology 2005. 429-435.
18. Kessler CM, Nemes L. Acquired inhibitors to factor VIII. In: Rodriguez-Merchan EC, Lee CA (szerk.) Inhibitors in patients with haemophilia. Blackwell, 2002. pp. 98-111.
19. Knoebl P, Baudo F, Collins PW, Huth-Kuehne A, Levesque H, Marco P, Nemes L., Pellegrini F, Tengborn L. Management of bleeding in Acquired Hemophilia: results of the European Acquired Haemophilia Registry (EACH2). Blood 116;21 315, 2010.
20. Ma AD, Carrizosa D. Acquired factor VIII inhibitors: pathophysiology and treatment. Hematology 2006.
21. Marco P, Collins P, Knoebl P, Levesque H, Baudo F, Nemes L, Tengborn L, Huth-Kuehne A, Pellegrini F. Acquired Haemophilia: clinical and demographic data. Results of European Acquired Haemophilia Registry (EACH2). Blood 116;21:601, 2010.
22. Molnar Z., Farkas V., Nemes L., Reusz S. Gy., Szabo J. A.: Hyponatraemic seizures resulting from inadequate post-operative fluid intake following a single dose of desmopressin. Nephrology Dialysis Transplantation 20: 2265-2267, 2005.
23. Nemes L., Pitlik E. New protocol for immune tolerance induction in acquired hemophilia. Haematologica 2000, 85, 64-68.
24. Nemes L., Pitlik E.: Ten years experience with immune tolerance induction therapy in acquired hemophilia. Haematologica, 2003; 88: 106-110 (IF: 3,453).
25. Nemes L. The use of immune tolerance induction regimens for acquired hemophilia. Abstracts of the XXVIth international Congress of the World Federation of Hemophilia. Hemophilia 2004, 10(S3), 54.
26. Nemes L., Pitlik E.: Haemophilia. In: Thrombosis és vérzékenység. Szerkesztette: Boda Z. Medicina Könyvkiadó Rt. Budapest, 119-164, 2006.
27. Nemes L, Tengborn L, Collins PW, Baudo F, Huth-Kuehne A, Knoebl P, Marco P, Levesque H. Acquired haemophilia A and pregnancy/postpartum - a report from a European Registry. Blood 116;21:316, 2010.
28. Pavlova A, Diaz-Lacava A, Zeitler H et al. Increased frequency of the CTLA-4 49 A/G polymorphism in patients with acquired haemophilia A compared to healthy controls. Haemophilia 2008, 14, 355-360.
29. Pfliegler G.: Gátlótestes A és B haemophilia, ill. gátlótest haemophilia. In: Boda-Rák-Udvardy (szerk.): Klinikai haemostaseologia. Springer, Budapest, 2. Kiadás, 2000. pp. 324-348.
30. Pfliegler G, Boda Z, Hársfalvi J, Flóra-Nagy M, Sári B, Pecze K, Rák K. Cyclosporin treatment of a woman with acquired haemophilia due to factor VIII:C inhibitor. Postgrad Med J 1989, 65, 400-402.
31. Sallah S, Wan JY. Efficacy of 2-chlorodeoxyadenosine in refractory factor VIII inhibitor in persons without hemophilia. Blood, 2003, 101, 943-945.
32. Tengborn L, Ingerslev J, Maekipernaa A és mtsai. (Working Group on Acquired Haemophilia of the Nordic Haemophilia Centers) Acquired haemophilia. Nordic guidelines for diagnosis and treatment. Version 2009-06-23, valid until 2012-12-31.pp. 1-17.
33. Triplett D, Harms CC. Factor VIII inhibitor assay. In: Triplett DA, Harms CS (szerk.): Procedures for the coagulation laboratory, pp. 72-75, Am Soc Clin Pathol, Chicago, 1981.
34. Turecek PL, Varadi K, Gritsch H, Schwarz HP. FEIBA: mode of action Haemophilia. 2004, Suppl.2, 3-9.
VII. Melléklet
Formai követelmények Az alkalmazott módszer
1. Az irodalomkutatást a rendelkezésre álló nagy, internet kutatórendszerekkel (MEDLINE, PubMed) végezték.
2. A protokoll összeállítása során in extenso impakt faktoros lapokban, vezető szakemberek és centrumok által publikált közleményekre támaszkodtak.
A szerzők egyik készítmény terjesztésében sem érdekeltek.
A protokoll a Hematológiai betegségek kezelésének módszertana c. kiadványban (Documed, 2004, pp. 199-204, ill. Documed, 2006, pp. 205-211) levő fejezet átdolgozott és kiegészített változata. A protokoll megújítása kétévente célszerű.
THROMBOCYTOPATHIÁK OKOZTA VÉRZÉKENYSÉG KEZELÉSE
I. Alapvető megfontolások
Meghatározás
Thrombocytopathiának nevezzük a vérlemezkék működési zavara (adhaesio és/vagy aggregato) következtében kialakuló vérzékenységet. A thrombocytopathia diagnózisa csak 50 G/L feletti thrombocyta szám esetén értelmezhető. A fejezetnek nem tárgya a megelőzően thrombotikus események kapcsán (pl. DIC, heparin indukálta thrombocytopenia) kialakuló, következményes thrombocytopathia (pl. fibrin degradációs termékek; fdp hatására), mivel ezekben a thrombocytopenia a domináló tényező.
Epidemiológia és incidencia
A veleszületett thrombocytopathiák (I. táblázat) ritka betegségek, incidenciájuk <5:1.000,000 és az esetek egy részében egyéb fejlődési rendellenességekkel együtt fordulnak elő. A szerzett vérlemezke működési zavarok (2.táblázat) gyógyszer okozta (pl. antithrombocyta kezelés: aszpirin, nem-steroid gyulladásgátlók kapcsán, de egyéb készítmények, pl. penicillinek mellékhatásaként is) vagy különböző alapbetegségekhez (pl. uraemia, májzsugor, myeloma multiplex, myeloproliferatív betegségek stb.) társuló formái gyakoriak. Mivel az esetek jelentős részében a vérzékenység enyhe, illetve a kivizsgálás feltételei nem mindenütt adottak, a betegek valós száma sokkal nagyobb lehet.
Klinikai megjelenés
A thrombocyta eredetű vérzékenységre jellemzőek a nyálkahártyavérzések (pl. menorrhagia, epistaxis), amelyek rendszerint kis, pontszerű megjelenésűek (petechiák, purpura). A vérzés spontán vagy sebészi beavatkozásra, kisebb traumára jelentkezhet, az utóbbi esetekben a vártnál hevesebb és tovább tart.
1. táblázat. Örökletes trombocytopathiák.


Megjegyzés. Thrombocytopathiák az örökletes thrombocytopeniák (pl. May-Hegglin anomalia, MYH9-függő betegségek, TAR syndroma stb. zömében is előfordulnak.
2. táblázat. Szerzett thrombocytopathiák
| I. THROMBOCYTA GÁTLÁS CÉLJÁBÓL ADOTT "ANTIPLATELET" GYÓGYSZEREK | ||
| Gyógyszer | Támadáspont, hatás | Következmény/mellékhatás |
| Aspirin | Cyclooxygenase gátlás | A második aggregatiós hullám 0/ |
| gyakran: gyomor-bél vérzés | ||
| Thyenopyridinek: clopidogrel, | ADP-receptor gátlás | A második aggregatiós hullám 0/ |
| ticlopidin, prasugrel | ritkán: agranulocitózis | |
| Monoklonális antitestek: abciximab, | GPIIblIIa (fibrinogen receptor) gátlás | aggregatio 0 /vérzés, |
| tirofiban, eptifibatid | thromboytopenia | |
| Dipyridamol | Phosphodiesterase gátló | aggregatio 0 |
| Kombinációk (pl. stentek esetén) | A fentiek közül általában kettő | aggregatio, 0 /vérzés, |
| II. NEM THROMBOCYTA GÁTLÁS CÉLJÁBÓL ALKALMAZOTT GYÓGYSZEREK, "ANTIPLATELET" MELLÉKHATÁSSAL | ||
| Nem steroid gyulladásgátlók (NSAID) | Cyclooxygenase gátlás | A második aggregatiós hullám 0 |
| gyakran gyomor-bél vérzés társul | ||
| Antibiotikumok (pl. penicillin, | Lipid membran affinitás | Aggregatio csökkenés, vérzékenység |
| cephalosporinok) | ||
| Theophyllin, coffein, vinca alkaloidok | Phosphodiesterase gátlás | Aggregatio, adhaesio csökken |
| Heparin, chinin, gombaellenes | Thrombocyta elleni antitest | Aggregatio fokozás, |
| szerek (pl. amphotericin B), | indukálása | mikroaggregatumok, |
| antibiotikumok (pl. vancomycin, | következményes thrombocytopenia | |
| rifampycin) | ||
| III. KÓRKÉPEK, AMELYEKHEZ GYAKORTA TÁRSUL THROMBOCYTA MŰKÖDÉSZAVAR | ||
| Kórkép | Hatásmechanizmus | Következmény |
| Myeloproliferatív syndroma | Kóros klón | Aggregatio-zavarok |
| Dysproteinaemiák | Vérlemezke-paraprotein kölcsönhatás | Aggregaio-zavarok |
| Máj-, vesebetegségek | Thrombocyta-gátló tényezőkt | Adhaesio-, aggregatio-zavarok |
| Thrombocyta prostaglandin szintézise | aggregatios zavarok | |
II. Diagnosztika
Kórelőzmény: kiemelt jelentősége van. Elengedhetetlen minden, a vérlemezkék működését esetlegesen befolyásoló, a megelőző 10 napban szedett készítmény ismerete. A családi kórelőzmény pozitivitása csak autósom domináns öröklésmenet esetén várható! A veleszületett thrombocytopathiák egy részének (granulum defektusok) a diagnózisa csak ismételt, azonos eredményű, a fenti ideig biztosan gyógyszermentes időszak után végzett vizsgálattal mondható ki.
Fizikális vizsgálat: a vérzések jellegzetessége (nyálkahártya), ill. az egyes, veleszületett thrombocytopathiák egyéb tüneteinek keresése (pl. Hermansky - Pudlak syndromában oculocutan albinizmus) fontos segítséget adnak.
Thrombocyta szám, alvadási szűrőtesztek (prothrombin idő; PI, aktivált thromboplastin idő; APTI és thrombin idő; TI), perifériás vérkenet és az átlagos thrombocyta térfogat (MPV). Az MPV és a perifériás kenet fontos az óriás thrombocyták (pl. Bernard-Soulier syndroma) felismerésére, az utóbbi pedig az ún. pseudothrombocytopenia (az EDTA in vitro összecsapja a vérlemezkéket, aminek következtében az automaták a valós számnál kisebb értéket adnak meg.) kizárására is. Az azurophil granulatio hiánya típusos gray platelet syndromában. A vérvételtől eltelt idő a vizsgálatokig nem haladhatja meg a két órát és valamennyi egyéb (hőmérséklet, szállítás stb.) feltétel megfelelő betartása is elengedhetetlen a megbízható diagnózishoz.
A thrombocyta működés vizsgálata.
Fontos a helyes mintavétel (pangatás nélkül, szobahőmérsékleten, nagyobb vénából származó, általában citráttal alvadásgátolt vér) és a preanalítikai eljárás: 2 órán belül, szobahőmérsékleten tartott minta vizsgálata.
Vérzésidő. Az alkaron 40 Hgmm nyomáson 1 mm mély és 1 cm hosszú sebzésből a vérzés megállásának ideje, 30 másodpercenként szűrőpapírral felitatva. Normál érték: 3-7 perc, biztosan kóros 10 perc felett. Befolyásolja a beteg kora, a bőr rugalmassága, a vizsgáló személye. Normális értéke nem zárja ki a thrombocyta működés zavarát. További hátrányok: invazív, hegesedéssel gyógyul. Alkalmazása egyre inkább háttérbe szorul.
Thrombocyta aggregatio mérése:
- turbidimetriás módszer, a thrombocyta-dús, illetve a thrombocyta-szegény plasma eltérő fényáteresztőképességén alapul. Az alábbi agonistákat használjuk: ADP, adrenalin, arachidonsav, collagen, ristocetin. Kórjelzők: a válasz (aggregatiós görbe) alakja, létrejötte/elmaradása, sebessége/meredeksége, a küszöbkoncentráció változása. Hátrányok: mesterséges körülmények, alacsony shear rate, hosszadalmas előkészítés, munkaigényesség.
- Impedancia aggregometria: teljes vért használ, számos agonista áll rendelkezésre, nem kell thrombocyta-dús plasmát előállítani. Hátrányok: nem fiziológiás körülmények, alacsony shear rate.
PFA (platelet function analyser). Automata eszköz: shear stressz körülmények között, collagen/ADP és collagen/adrenalin indukáló szereket tartalmazó membránon átáramoltatva a vérlemezkék aktiválódnak. A membrán aggregatumok általi elzáródásának (az áramlás megszűntének) ideje, az ún. záródási idő megnyúlása jelzi a kóros működést. Előnyök: egyszerű, gyors. Hátránya, hogy pozitív lehet az indukáló ágensnek megfelelő thrombocyta működés esetén, ha a haematocrit alacsony és normális záródási-idő sem zár ki minden thrombocytopathiát, illetve nem mindig elég érzékeny (pl. aszpirin hatásra) vagy alkalmas a hatás mérésére (pl.clopidogrel).
Thrombocyta secretio vizsgálata: ATP, Ca, thromboxan felszabadulás, vagy a dense testecskék tartalmának (beta-thromboglobulin, serotonin) meghatározása. Nem thrombocyta specifikus, érzékeny, időigényes. Thrombocyta aggregatio és secretio együttes mérése:
- lumiaggregometria.
Áramlási cytometria: az aktiválódás során exprimálódó thrombocyta fehérjék/receptorok pl. CD62 mérésére szolgál. Előnyei: in vivo, kis vérmennyiség elegendő. Hátrányok: drága, érzékeny műtermékekre, ezért igen gondos mintakezelést igényel.
Alvadék retrakció: egyszerű, nem-specifikus módszer a thrombocyta-fibrinogen/fibrin kölcsönhatás vizsgálatára.
Elektronmikroszkóp: vérlemezke ultrastruktúra vizsgálatára szolgál.
Globális tesztek: thromboelastograph (TEG), thrombelastometria (ROTEM). Előnyei: ágy melletti ("point-of-care") teszt, teljes vért használ. Hátrányok: az alvadási végpontot mérik, nem thrombocyta specifikusak.
Aszpirin és Clopidogrel rezisztencia.
Meghatározás: a készítményekkel szembeni ellenállás, azaz a gyógyszerek közvetlen farmakodinámiás hatástalansága, vagyis a thrombocyta gátló hatás elmaradása. Oka
Aszpirin rezisztencia és clopidogrel rezisztencia mérése.
- Aszpirin rezisztencia mérése
= Thromboxan koncentráció
= Arachidonsav indukálta aggregatio (thrombocyta-dús plasma, teljes vér)
- Clopidogrel rezisztencia mérése
= ADP indukálta aggregatio (thrombocyta-dús palsma, teljes vér) = Áramlási cytometria (CD62P vagy CD40L)
III. A thrombocytopathiás vérzékenység kezelése
CÉL
A thrombocyta eredetű vérzés megszűntetése, megelőzése.
A vérzés megszüntetése
Enyhébb esetekben DDAVP (0,3 ug/tskg, 100 ml Salsolban) adható, 20 perc alatt. Ha műtéti profilaxis céljából adjuk, fontos, hogy a beavatkozásra a rákövetkező két órán belül sor kerüljön. (Glanzmann thrombastheniában nincs értelme adni).
Thrombocyta suspensio. Apheretizált vagy poolozott thrombocyta készítmény adható. Fontos tudni, a műtéti megelőzés szempontjából, hogy a beadást követően elsődlegesen a reticuloendotheliális rendszerbe jutnak a vérlemezkék, tehát hatásuk csak néhány óra múlva lesz teljes. A thrombocyta pótlás vonatkozó tudnivalóit ld. az adott fejezetben.
rFVIIa. IV, 60-90 ug/tskg, 2-3 óránként ismételve, a vérzés megszűntéig.
Kiegészítő kezelés
Antifibrinolyticum (aminocapron sav vagy tranexamsav) iv (lassan) vagy oralisan (tabletta, ivóoldat formájában). Adagolása, mind a napi dózist, mind az időtartamot illetően széles határok közt változhat. Beszűkült vesefunkció esetén az adagok a serum creatinin értéktől függően csökkentendők, a mellékelt alkalmazási irat útmutatása szerint.
Az alapbetegség kezelés. Uraemiás thrombocytopathiában legeredményesebbnek a dialysis bizonyult.
Konjugáltoestrogenek. IV, 5 napon át, 6 mg/tskg/nap dózisban megkísérelhető.
A vérzés megelőzése
Antithrombocyta hatású/hatással is rendelkező készítmények adásának felfüggesztése. Fontos, hogy, mivel a vérlemezkék maggal/fehérjeszintézissel nem rendelkeznek, egy adott populációjuk gátlása irreverzibilis. Ezért, pl. elektív műtétek előtt, nem elégséges a beavatkozás reggelén a készítmény elhagyása, hanem már 4-5 nappal korábban. A vérlemezkéknek - normális csontvelői aktivitás mellett - mintegy 10%-a újul meg naponta, aszpirin szedőkben nyert adatok alapján a vérzés-idő három nappal az utolsó gyógyszer beszedése után normalizálódik (30% nem gátolt vérlemezke esetén, ami megfelel, átlagos thrombocyta szám esetén kb. 100 G/L-nek, vagyis a biztonságos invazív beavatkozásokhoz általában megkövetelt legkevesebb thrombocytaszámnak).
DDAVP, thrombocyta suspensio, rFVIIa - a fenti adagolásban - megelőző jelleggel is adható.
Mellékhatások és elhárításuk
Az egyes készítmények (thrombocyta suspensio, rFVIIa, DDAVP, antifibrinolyticumok) mellékhatásait és azok megelőzését, elhárítását illetően utalunk a vonatkozó fejezetekre.
IV. Rehabilitáció és V. Gondozás
Eljárás, felelős személy
A thrombocytopathiát felismerő orvos köteles a legközelebbi, vérzékeny betegek ellátására szakosodott intézményhez (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok) fordulni. A kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
VI. Irodalomjegyzék
1. Boda Z. Normális thrombocytaszám megnyúlt vérzésidővel. In: Boda Z, Rák K, Udvardy M.(szerk.) Klinikai hemosztazeológia.2. kiadás. Springer, 2000. pp.316-323.
2. Cattaneo M. Inherited platelet-based bleeding disorders. J Thromb Haemost 2000;1:1628-36.
3. Harrsion P. Assessment of platelet function in the laboratory. Haemostaseologia, 2009, 29, 25-31.
4. Kerényi A, Schlammadinger Á, Ajzner É és mtsai. Comparison of PFA-100 closure time and template bleeding time in patients with inherited disorders causing defective platelet function. Thromb Res 1999, 96, 487-92.
5. Klouche M. Diagnostic methods for platelet function analysis. Transfus Med Hemother 34, 20-32, 2007.
6. Lisman T, Adelmaier J, Heijnen HFG és mtsai. Recombinant factor VIIa restores aggregation of aIIbp3-deficient platelets via tissue factor-independent fibrin generation. Blood, 2004, 103, 1720-7.
7. Nurden AT. Qualitative disorders of platelets and megakaryocytes. J Thromb Haemost 3, 1773-1782, 2005.
8. Pfliegler G., Tornai I.: Vérlemezke működés gátlás mint gyógyszer mellékhatás. Magyar Belorv. Arch., 1983, 20, 134-139.
9. Poon MC. The evidence for the recombinant human FVII int he treatment of bleeding patients with qualitative and quantitative platelet disorders. Transfus Med Rec 2007, 17, 789-792.
10. Shapiro AM. Platelet function disorders. Tratment of Hemophilia. 1999, 1-12
11. Watson S, Daly M, Dawood B és mtsai. Phenotypic approaches to gene mapping in platelet function disorders. Haemostaseologie, 2010, 30, 29-38.
12. Weber AA, Adamzik M, Bachmann S és mtsai. Methoden zur Messung der Azetylsalizylsaeure- bzw.Clopidogrelresistenz. Haemostaseologie, 2008, 28, 66-76.
13. Zatik J, Póka R, Borsos A, Pfliegler G. Variable response of Hermansky-Pudlak syndrome to prophylactic administration of 1-desamino 8D-arginine in subsequent pregnancies. Eur. J Obstet Gynecol Reprod Biol 2002, 104, 165-166.
VII. Melléklet
Szükséges dokumentumok, bizonylatok
A thrombocyta suspensio Regionális Vérellátó Központokból szerzendő be a vérkészítmények rendelésére vonatkozó mindenkori szabályok szerint, az egyéb készítmények gyógyszertári forgalomból.
Felelős személy
Veleszületett thrombocytopathia gyanuját felismerő orvos köteles a legközelebbi, vérzékeny betegek ellátására szakosodott intézményhez fordulni. A diagnosztikát az arra alkalmas, akkreditált laboratórium, a kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
Formai követelmények Az alkalmazott módszer
1. Az irodalomkutatást a rendelkezésre álló nagy, internet kutatórendszerekkel (MedLine, Winspirs, PubMed) végezték.
2. A protokoll összeállítása során in extenso impakt faktoros lapokban, vezető szakemberek és centrumok által publikált közleményekre támaszkodtak.
A szerzők egyik készítmény terjesztésében sem érdekeltek.
RITKA FAKTORHIÁNYOK OKOZTA VÉRZÉKENYSÉG KEZELÉSE
I. Alapvető megfontolások
Meghatározás
Ritka faktorhiányok okozta vérzékenységek alatt a véralvadási kaszkádnak a FVIII és FIX-en kívüli faktorainak, tehát a fibrinogénnak, a prothrombinnak (FII), a FV-nek, a FVII-nek, a FX-nek, FXI-nek, FXIII-nak, a K-vitamin függő faktorok (FII, FVII, FIX, FX; VKDCF) csökkenéséből/elégtelen működéséből bekövetkező örökletes vagy gátlótest okozta szerzett alvadási zavart értjük, amely túlnyomórészt vérzékenységben, esetenként thrombosis-hajlamban nyilvánul meg.
A FV+FVIII együttes deficienciája a csak a FVIII-at érintő csökkenéshez ("A"-haemophilia) viszonyítva ugyancsak igen ritka, ezért ide sorolandó. A prokoaguláns faktorok deficiánciáin kívül az alfa 2-plazmin inhibitor és az alfa 1 -antitripszin (Pittsburgh) defektusok okoznak ritka, de jelentős vérzéses szindrómát.
Epidemiológia, incidencia
Veleszületett alakjaik ritka betegségek, incidenciájuk <5:1.000,000 és kevés kivételtől eltekintve egy faktort érintenek. Az egyes faktorhiányok gyakoriságát, a genetikai eltéréseket az I. táblázatban foglaltuk össze.
| 1. táblázat. Ritka alvadási faktorhiányok incidenciája, genetikai háttere | |||
| Faktor | Incidencia | Érintett gén (kb) | Kromoszóma |
| FI | 1: 1 000 000 | FGA (7.6) B (8.1) G (8.5) | 4q31.3 |
| FII | 1: 2 000 000 | F2 (20.3) | 11p11.2 |
| FV | 1: 1 000 000 | F5 (72.3) | 1q24.2 |
| FVII | 1: 500 000 | F7 (14.2) | 13q34 |
| FV+FVIII | 1: 2 000 000 | LMANI (29.4) MCFD2 (13.9) | 2p21 |
| FX | 1: 1 000 000 | F10 (26.7) | 13q34 |
| FXI | 1: 1 000 000 | F11 (22.6) | 4q35.2 |
| FXIII | 1: 2 000 000 | F13A (176.6), B (28.0) | 6p25.1; 1q31.3 |
| VKDCF | 1: 2 000 000 | GGXC(12.4) VKORC1 (5.1) | 16p11.2 |
Megjegyzés. A ritka, örökletes coagulopathiák egyes, zártabb népcsoportokban a fenti adatoknál gyakoribb előfordulásúak is lehetnek. Ilyen például a FXI-deficiencia, amelynek hordozói az Ashkenazi zsidók körében a 9 %-ot is elérhetik, másutt azonban ritka.
Nem ritka és nem sorolható ide több faktor egyidejű, nem specifikus csökkenése például májbetegségekben; a gátlótest indukálta faktor deficienciákat pedig a vonatkozó fejezetben tárgyaljuk. Ugyancsak nem ritka a FV thrombosis hajlammal járó ún. Leiden mutációja és a vitatott adatok szerint enyhén thrombogen FXII deficiencia (a kaukázusi eredetű véradókban 3, illetve 2,3%-os a gyakorisága; az utóbbié ázsiai népességben pedig még nagyobb). A FII G20210A mutáció szintén thrombogen, a népesség 1-2%-át érinti.
A WHO 2008. évi, 105 országra kiterjedő felmérése alapján (http:wfh.org/2/docs/Publications/Statistics/2008_Global_Survey_Report.pdf.) a FVII és FXI deficienciák az esetek egyharmadáért felelősek, a legritkábbak a hypoprothrombinaemia (FII) és a FV+FVIII deficiencia bizonyult (2-2,5%-ban). A fibrinogen, a FV, FX és FXIII deficienciák gyakorisága 6-8%.
Pathomechanizmus
Az egyes faktor-deficienciák hátterében a genetikai hiba (1. táblázat) következtében rendszerint csökken a gén által kódolt faktor mennyisége (l.típus), de kóros aktivitású, normális antigenitású/mannyiségű molekulák (2.típus) is képződhetnek. Egy adott faktor teljes hiányát az "a" fosztóképzővel (pl.afibrinogenaemia) jelöljük, csökkenését "hypo-", kóros működését "dys" előtaggal jelöljük (pl. hypoprothrombinaemia, dysproconvertinaemia stb.). A FV+FVIII kombinált deficiencia esetén a faktorok intracelluláris transzportja szenved zavart, míg a K-vitamin függő faktorok (FII, FVII, FIX, FX) együttes deficienciáját a poszttranszlációs enzymeket kódoló génhibák következtében fellépő elégtelen működésük és a K-vitamin anyagcsere módosulása okozza.
Genotypus-phenotypus összefüggése. A klinikailag jelentős vérzékenységgel járó esetekben a betegek többnyire homozygoták vagy compound-heterozygoták. A heterozygoták (a beteg szülei és gyermekei) faktorszintje kb. 50% körüli és ezért rendszerint tünetmentesek. A faktor teljes hiányát nagy valószínűséggel nagy gén deléció okozhatja csak, a trunkált fehérjével és labilis mRNS-val járó nagyobb mutációk (frame-shift, out-of-frame, splicing, noonsense, részleges deléció) rendszerint alacsony alvadási faktort és kifejezett klinikai tüneteket okoz. A missense mutációk phenotypusa változó.
A genetikai eltérések igen változatosak és az esetek mintegy 20 %-ában egyértelműen gyanúsítható gén nem ismert jelenleg, amire a nem kódoló régiókban vagy a poszttranszlációs, intracelluláris transzport mechanizmusokban bekövetkező hibák szolgálhatnak magyarázatul.
A ritka vérzékenységek európai regiszterének 2010-es adatai szerint a ritka faktorok hiányában a leggyakoribb tünet a nyálkahártya vérzés, tehát ún. thrombocyta-típusú (epistaxis, petechia, menorrhagia, bélvérzés), de lapszerinti vérzések, haemarthrosok, haematomák is előfordulnak. A súlyos vagy életveszélyes vérzések, mint központi idegrendszeri, gasztrointesztinalis vérzések általában ritkábban fordulnak elő, mint az "A vagy "B" haemophiliásoknál, a csoporton belül leginkább FXIII, fibrinogen, FVII és FX deficienciában kell vele számolni. Köldökcsonk vérzés elsősorban afibrinogenaemiában, FXIII és FX hiányban léphet fel, kombinált FV+FVIII deficienciában viszont még nem észlelték. Vérzések előfordulhatnak spontán is, többnyire azonban sebészi beavatkozások, traumák vagy szülés kapcsán lépnek fel. Klinikailag jelentős tünetek - mint fentebb utaltunk rá- homozygotákban vagy compound heterozygotákban várhatók. Egy részükben (főként FI, FXIII hiány) jellegzetes tünet a habitualis vetélés is. A faktorszintek és tünetek súlyossága alapján enyhe, közepes és súlyos deficienciát különböztethetünk meg, az egyes tényezők esetében azonban különbség lehet a határt jelentő faktorszintekben (2. táblázat. A ritka vérzékenységek európai regiszterének adatai alapján).
Tünettan
2. táblázat. A ritka faktorhiányok okozta vérzékenységek súlyosság szerint, az Európai Ritka Vérzékenységek Regisztere, 2009-es adatai alapján.
| Súlyossági fok | Faktor-koncentráció | Faktor-deficiencia |
| Súlyos | □ 1 % | FII, FV, FV+FVIII, FVII, FX, FXI |
| □ 5 % | FXIII | |
| □ 0,1 g/l | Afibrinogenaemia | |
| Közepes | 1-10 % | FII, FV, FV+FVIII, FVII, FX, FXI |
| 5-10 % | FXIII | |
| 0,1-0,5 g/l | Hypofibrinogenaemia | |
| Enyhe | □ 10 % | FII, FV, FV+FVIII, FVII, FX, FXI, FXIII |
| >0,5 g/l | Dysfibrinogenaemia |
II. Diagnózis
A véralvadás szűrőtesztjei (prothrombin idő; PI, aktivált partialis thromboplasztin idő; APTI, thrombin idő; TI). A laboratóriumi módszerek különböző alapúak (a thromboplastin forrástól függően). Faktorhiány gyanuja esetén az egyes faktorok meghatározására gyári hiány-plasmákat alkalmazunk, az aktivitás meghatározását a mennyiségi (immunológiai) mérés követi. A fibrinogen (FI) meghatározása többnyire gravimetriás módszerrel történik. Az egyes faktorok képződési helyét, funkcióját és a laboratóriumi diagnózishoz szükséges vizsgálatokat a 3. táblázat részletezi. Míg a szűrőtesztek rutin haemostasis laboratóriumban is elvégezhetők, a faktor-meghatározások speciálisabb felkészültséget igényelnek, az egyes faktorok molekuláris szerkezetének vagy a kódoló génnek vizsgálata ma tudományos vizsgálat tárgya és csak néhány, ilyen érdeklődésű intézményben elérhető, ezért a táblázatban nem jeleztük.
3. táblázat. A ritka faktorok képződési helye, funkciója és deficienciájuk laboratóriumi diagnózisa.
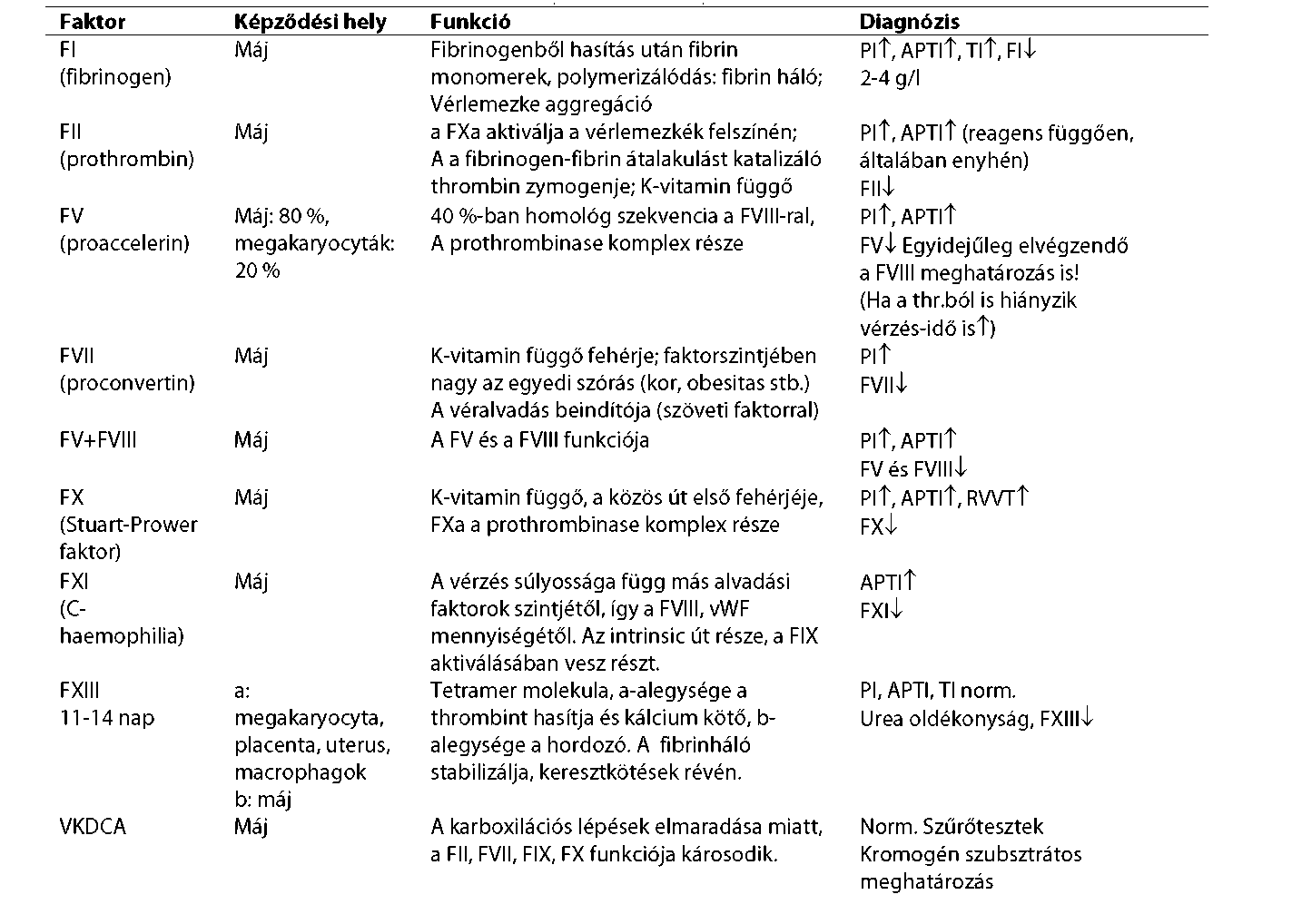
Az egyes faktor deficienciák klinikai jellemzőit és a terápiás lehetőségeket a 4. táblázatban tekintjük át.
4. táblázat. A ritka alvadási faktor deficienciák klinikai jellemzői és kezelése.
| Faktor/ felezési idő | Klinikum | Megfelelő haemostasist biztosító/cél faktorszint | Kezelés, készítmények |
| Fibrinogen | Vérzések: nyálkahártya, | >0.5 g/L | Fibrinogen koncentrátum (1-2 g kezdő adag, majd |
| (FI) | invazív beavatkozás | ismételve igény szerint), | |
| 2-4 nap | alatt/után | FFP (15-20 ml/tskg) | |
| Súlyos hiány: GI vérzés, | Profilaxis: 100 mg/tskg/hét | ||
| köldök, központi | Adjuváns: antifibrinolítikumok, orális antikoncipiensek | ||
| idegrendszer, haematoma, | |||
| haemarthros, | |||
| habituális abortus; | |||
| thrombosis (ritkán) | |||
| Prothrombin | Ízületii vérzések, izom- | 20-30% | FFP: 15-20 mL/tskg kezdő, majd 3 mg/kg 12-24 óránként, |
| (FII) | haematomák, nincs szoros | profilaktikusan: 4 hetente | |
| 2-3nap | korreláció a vérzés és a | APCC: 20 E/tskg kezdő, napi 1x 5 E/tskg | |
| faktorszint között; | |||
| Előfordult köldök- és | |||
| intracranialis vérzés is | |||
| FV | Enyhe-közepes: kevert | 10-15% | FFP: 15-20 ml/tskg kezdő, majd 3-6 ml/tksg/24 h fenntartó |
| 36 óra | (faktorhiányos és | FEIBA | |
| thrombocyta típusú) | rFVIIa: 90 ug/tskg, 2-3 óránként ismételve sz.sz. | ||
| nincs szoros korreláció a | Súlyos vérzés/nagyműtét + thrombocyta koncentrátum | ||
| vérzés és a faktorszint | adandó (FV forrás) | ||
| között | |||
| FVII | Enyhe-közepes: epistaxis, | 10-15% | rFVIIa: 15-30 ug/tskg, 2-3 óránként sz.sz., de legalább |
| 4 óra | nyálkahártya vérzés, | 3 adag. | |
| menorrhagia, de | "Tiszta" FVII koncentrátum (Baxter): 20-40 NE/tskg | ||
| haematoma, haemarthros | FFP: 15-20 ml/tskg napi 2-3x | ||
| is. | APCC: 20 E/tskg, napi 2-3x | ||
| Súlyos: köldökzsinór, | |||
| központi idegrendszeri | |||
| vérzés | |||
| FV+FVIII | Sebészi, fogászati | > 25% (FV, FVIII) | FFP: 15-20 ml/tskg kezdő adag, majd 6-8 ml/tskg/25 h |
| 36 óra, | beavatkozások után, | Nagyobb | fenntartó adag, FVIII szinttől függően |
| 15-19 óra | menorrhagia, Postpartum | beavatkozások: | |
| vérzés | FVIII >50% | ||
| FX | Epistaxis, menorrhagia, | 10-15%; | FFP: 15-20 ml/tskg kezdő, majd napi 1x 3-6 mL/tskg |
| 40 óra | haemarthros, | nagy műtét: 50 | APCC 20-30 E/tskg/nap |
| haematomák, gyomor-bél | % | ||
| traktus. Súlyos vérzések 1% | |||
| alatt | |||
| FXI | Inkább nyálkahártya | 10-15%, | FFP: 15-20 mL/tskg kezdő, majd 3-5 mL/tskg napi 2x |
| 40-80 óra | típusú, a spontán vérzés | műtét: 30% | fenntartó |
| ritka | FXI koncentrátum (AT-t, heparint, C1E-inhibitort is | ||
| tartalmaznak) | |||
| rFVIIa | |||
| adjuvánsként: antifibrinolyticumok | |||
| heterozygotákban DDAVP is szóbajön (0,3 ug/tskg) | |||
| FXIII | Köldökcsonk, központi | 2-5% | FXIII koncentrátum |
| 11-14 nap | idegrendszeri, habitualis | FFP 15-20 mL/tskg, 14 naponta | |
| vetélés: 1% alattiakban, | |||
| VKDCF | Súlyos esetben: | 10-20 % | Oralis K vitamin felnőttekben (15 mg/nap) egyes esetekben |
| köldökcsonk, intracranialis | elegendő; | ||
| (újszülöttek) | Súlyos esetben, műtétek előtt FFP, APCC | ||
| Enyhébb: nyálkaháryta-, | |||
| bőrvérzések, sebészi | |||
| beavatkozások után |
A ritka coagulopathiák szülészeti-nőgyógyászati vonatkozásai
Fontos a kórelőzmény ismerete, menorrhagia ezen nők mintegy felében fordul elő, visszatérő vetéléseknél - a szülészeti, egyéb okok kizárása után - ezen lehetőségekre (pl. FXIII deficiencia) is gondolni kell. Szülést követően, amennyiben szubsztitúció volt szükséges, azt két-három napig postpartum folytatni kell.
A vérzés mennyiségét, időtartamát oestrogen-progesteron készítményekkel (oralis fogamzásgátlók) csökkenteni lehet; fontos a vaspótlás is.
III. Kezelés
Készítmények (2010. júniusban Magyarországon törzskönyvezve).
A faktorpótlás gyakoriságához és mennyiségéhez a klinikai kép (a vérzés megszűnte), a kívánt hemosztatikus (hatékony) faktorszint és az egyes faktorok felezési ideje ad támpontot.
Friss fagyasztott plasma (FFP).
Adagja:15-20 mL/tskg, ismétlése a hiányzó faktor felezési idejétől (ld. fent) függ.
Átlagosan 1 mL FFP 1 E alvadási faktoraktivitást tartalmaz, de ez függ a donor alvadási tényezője kiindulási szintjétől és a donor plasma alvadásgátlójától.
Felolvasztás után 24 óráig + 4 C fokon tárolható.
Aktivált prothrombin complex concentratum; APCC
Prothrombin complex (Octapharma); Prothrombin TIM 4600 NE, Prothromplex total (600 NE) por és oldószer oldatos injekcióhoz.
Beriplex P/N 500 NE?
Faktor VII
rFVIIa. (Novoseven)
1 mg, 1.2 mg, 2,4 mg, 4,8 mg, 5 mg por és oldószeres oldat injekcióhoz. Általában 90 ug/tskg iv a kezdeti adag, súlyos vérzés vagy nagyobb műtétek, traumák eseteiben 2-3 óránként ismétlendő, a vérzés(veszély) megszűntéig. Veleszületett FVII, ill. FXI-hiány esetén kisebb adagok (ld. fenn!) is elégségesek lehetnek, de egyes, súlyosan vérző esetekben egyszeri nagy adag (270 ug/tskg) is szóbajön.
Faktor VII (Baxter). 600 NE por és oldószer oldatos injekcióhoz.
Fibrinogen (Haemocomplettan-P).
Human plasma eredetű. 1-2 g kezdeti adag, iv, folytatva szükséglet szerint, amit a fibrinogen szint Clauss szerinti meghatározásával ellenőrizhetünk.
FXIII (Fibrogammin-P). Human plasma eredetű. 250 E és 1250 E kiszerelésben áll rendelkezésre. Adagolása:
1. A vérzés megszüntetésére, műtéti előkészítésre:
a) amennyiben lehetőség van a FXIII mérésére, adagja: 100-beteg FXIII% x tskg x 0.5), 3 egymást követő napon.
b) A beteg FXIII szintjének ismerete nélkül: 20 ml három egymást követő napon.
2. Habitualis abortus esetén, prophylaxisra: 21 naponta.
Kiegészítő kezelés
Hasonlóan a FVIII, ill. FIXdeficienciához az antifibrinolyticumok (epsilon-aminocapronsav, tranexamsav) a szokásos adagban szükség esetén javasolt.
Prophylaxis - on-demand - kezelés.
A ritka vérzékenységek megelőző kezelésének megítélése és gyakorlata ezidőszerint nem egységes. Heti egy-kétszeri kis dózisú szubsztitúcióval vannak prophylactikus vizsgálatok súlyos hypoprothrombinaemiában (APCC), FVII-deficienciában (rFVIIa), FX-deficienciában (APCC, rFVIIa), FXIII-deficienciában terhesség esetén (FXIII, FFP).
Mellékhatások és elhárításuk
Az egyes készítmények mellékhatásait és azok megelőzését, elhárítását illetően utalunk a vonatkozó fejezetekre. Valamennyi készítményre vonatkozóan a túladagolásból bekövetkezhető thrombogenitást, a plasma származékoknál a fertőzésátvitel és az allergiás/anaphylaxiás reakció lehetőségét kell szem előtt tartani.
IV. Rehabilitáció és V. Gondozás
Eljárás, felelős személy
Veleszületett ritka vérzékenység gyanúját felismerő orvos köteles a legközelebbi, vérzékeny betegek ellátására szakosodott intézményhez (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok) fordulni. A diagnosztikát az arra alkalmas, akkreditált laboratórium, a kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
VI. Irodalomjegyzék
1. Acharya SS, Coughlin A, DimicheleDM. Rare bleeding disorder registry: deficiencies of II, V, VII, X, XIII, fibrinogen and dysfibrinogenemias. J Thromb Hemost 2004; 2: 248-256.
2. Brenner B. Hereditary deficiency of all vitamin K-dependent coagulation factors. Thromb Hemost 2000; 84: 935-6.
3. Bolton-Maggs PHB. The rare coagulation disorders- review with guidelines for management from the United Kingdom Haemophilia Centre Doctors' Organisation. Haemophilia 2004; 10: 593-628.
4. Bolton-Maggs PHB. The rare coagulation disorders. Treatment of hemophilia. April 2006, No39, pp. 1-11. World Federation of Hemophilia.
5. Inbal A, Muszbek L. Coagulation factor deifciencies and pregnancy loss. Semin Thromb Hemost 2003; 29: 171-4.
6. Karimi M, Bereczky Z, Cohan N, Muszbek L. FXIII deficiency. Semin Thromb Hemost 2009: 35, 426-438.
7. Mannucci PM, Duga S, Peyvandi F. Recessively inherited coagulation disorders. Blood, 2004; 104: 1243-1252.
8. Nemes L., Pitlik E. Veleszületett vérzékenység a szülészeti-nőgyógyászati gyakorlatban. In: Vérzékenység és thomboembolia a szülészeti és nőgyógyászati gyakorlatban. Szerk.. Rákóczi I. Oriold és tsai, 2010;14:245-88.
9. Peyvandi F., Duga S, Akhava S, és mtsa. Rare coagulation deficiencies. Haemophilia 2002; 8: 308-321.
10. Peyvandi F, Palla R, Menegatti M. European registry of rare bleeding disorders.Hematology Education: the education programme for the annual congress of the European Hematology Association. 2010; 4: 63-68.
VII. Melléklet
Szükséges dokumentumok, bizonylatok
A friss fagyasztott plasma (FFP), illetve az egyes vérkészítmények a Regionális Vérellátó Központokból, illetve a hatóságilag kijelölt depókból (pl. egyetemi gyógyszertár) szerzendők be a vérkészítmények rendelésére vonatkozó mindenkori szabályok szerint. Egyes gyári, stabil faktorkészítmények az Országos Egészségpénztár (OEP) véralvadási faktor különkeretéből, a kijelölt hivatalos felhasználó centrumokból szerezhetőek be. Megengedhetetlen, hogy vérzékeny betegek ellátását vállaló intézmény ne rendelkezzen az adott készítményekből ésszerű mennyiségű, állandó kontingenssel és/vagy - pl. plasma készítmények esetén -azok azonnali (1-2 órán belüli) elérhetőségével.
Formai követelmények Az alkalmazott módszer
1. Szerzők az irodalomkutatást a rendelkezésre álló nagy, internet kutatórendszerekkel (MedLine, Winspirs, PubMed) végezték.
2. A protokoll összeállítása során elsősorban in extenso impakt faktoros lapokban, vezető szakemberek és centrumok által publikált közleményekre támaszkodtak.
A szerzők egyik készítmény terjesztésében sem érdekeltek.
A VON-WILLEBRAND-BETEGSÉG KEZELÉSE
I. Alapvető megfontolások
Meghatározás
A von Willebrand-betegség (VWB) a leggyakoribb veleszületett vérzékenység.
Lényege, hogy veleszületett módon csökkent mennyiségű (1 -es és 3-as típusú betegségben), vagy kóros minőségű (2-es típus) von Willebrand faktor (VWF) képződik. Leggyakrabban autosomalis dominans öröklésmenet jellemzi (I-es típus; 2A, 2B és 2M altípusok). Autosomalis recessiv öröklődésű a ritka, de klinikailag legsúlyosabb 3-as típus és a 2N-altípus, valamint a 2A altípus egyik ritka variánsa (IIC). Férfiakat és nőket egyaránt érint, nőkben gyakrabban manifesztálódik.
A VWF-t kódoló, 52 exont tartalmazó óriásgén a 12. kromoszóma rövid karján helyezkedik el. A VWF a szervezetben található egyik legnagyobb glycoprotein, mely az endothel sejtekben és a megakaryocytákban szintetizálódik. Fő élettani funkciója, hogy érfalsérüléskor a subendothelium és a thrombocyták között kialakított kötés révén mediálja a thrombocyta thrombus képződését (primer haemostasis). Másik feladata, hogy a keringésben megköti, ezzel stabilizálja a FVIII-t. VWB-ben a FVIII szintézis normális, de a hiányzó, vagy csökkent VWF miatt a FVIII a keringésben hamar lebomlik.
Előfordulás, gyakoriság
A VWB valódi gyakorisága a klinikai kép változó súlyossága miatt nehezen állapítható meg pontosan. A betegség prevalenciája 1/10000 körülire tehető. Nem tisztázott diagnózisú, többnyire enyhe vagy középsúlyos fokban vérzékeny betegek között a VWB a leggyakrabban előforduló vérzékenység.
A VWB osztályozása
A VWB korábbi osztályozása (Ruggeri és Zimmerman 1987), az SDS-elektroforézis technikán, s az annak segítségével vizsgálható multimer-struktúra analízisen alapult. Az évek során bonyolulttá vált felosztást 1994-ben felváltotta egy áttekinthetőbb, korszerűbb klasszifikáció, melynek terápiás jelentősége is volt. Az 1994-es beosztás alapvető gondolatmenetét megtartva de néhány új ismeretet is beépítve a Nemzetközi Thrombosis és Haemostasis Társaság (ISTH) VWF Munkacsoportja 2006-ban közölte a jelenleg is használatban lévő beosztást (Sadler ás mtsai, 2006). Ezt a beosztást az I. táblázat foglalja össze.
I.táblázat. A VWB osztályozása és az altípusok jellemzése
Ezen osztályozás szerint a VWB-nek három nagy csoportja különíthető el: az 1-es és 3-as típus a mennyiségi, a 2-es típus a VWF minőségi defektusait tartalmazza.
Az 1-es típus (esetek 60-80%-a) a klasszikus, autosomalis dominans öröklődést mutató csoport, valamennyi multimer szintje arányosan alacsonyabb, a VWF multimer analízis során a nagyméretű multimerek aránya nem csökkent lényegesen. Az 1-es típusba soroljuk a csökkent szintézis és a gyorsult katabolizmus miatt létrejött VWB-et is.
A 2-es típust (esetek 15-30%-a) a nagy multimerek hiánya jellemzi (kivéve a 2M és 2N altípus), ezzel párhuzamosan a VWF:RCo szint lényegesen kisebb, mint a VWF:Ag szint. A 2-es típuson belül 4 altípus különíthető el. A 2A altípusban a VWF-függő thrombocyta adhézió csökkent, a 2B altípust a VWF fokozott affinitása jellemzi a thrombocyta GPIb receptorához, emiatt többnyire mérsékelt thrombocytopenia is észlelhető. Jellemző a fokozott válaszkészség ristocetinre. A 2M altípusban szintén csökkentek a VWF-függő thrombocyta-funkciók, ugyanakkor a nagy multimerek mégis kimutathatók. A 2N altípusra a csökkent FVIII:C-kötés a jellemző.
A 3-as típusra (esetek 1-5%-a) az autosomalis recesszív öröklésmenet és a mérhetetlenül alacsony VWF-szint jellemző. A legsúlyosabb vérzők ebbe a csoportba tartoznak. Valódi thrombocytopathia az ún. "platelet-type" VWB: a thrombocyta membrán GPIb receptora fokozottan megköti a VWF nagy multimereit, amelyek emiatt a keringésből hiányoznak.
II. Diagnózis
Klinikai tünetek
A tünetek lehetnek enyhék, közepesen súlyosak, illetve életet veszélyeztető vérzés is előfordulhat, főleg 3-as típusú VWB-ben. A VWB klinikai jellegzetessége a nyálkahártya típusú vérzés (epistaxis, postextractiós vagy gastrointestinalis vérzés). Ritka a haematuria, purpura nem fordul elő, a suffusiók viszont nem ritkák. Nőkben gyakori a menorrhagia és metrorrhagia, amely tartósan oralis kontraceptív szer és vas-pótlás együttes alkalmazását igényelheti. Ovulációt követően a corpus luteumba történő
bevérzés nőgyógyász-sebészi beavatkozást igénylő súlyos fájdalmat okozhat. A 3-as típusú és 2N altípusú VWB-ben a FVIII szint olyan alacsony lehet, hogy ízületi vérzés is előfordulhat. A tünetek kvantitatív megítélése végett vezették be a "bleeding score" használatát, mely egyre inkább elfogadottá válik a nemzetközi gyakorlatban (Tosetto és mtsai, J Thromb Haemost, 2006).
Laboratórumi diagnosztika
A VWB laboratóriumi diagnózisa nem egyszerű, olykor csak ismételt vizsgálatokkal lehetséges. Nem áll rendelkezésre olyan laboratóriumi teszt, mely önmagában alkalmas lenne a VWB valamennyi típusának kimutatására. VWB gyanúja esetén elvégzendő legfontosabb laboratóriumi diagnosztikai vizsgálatokat a 2. táblázat tartalmazza.
2. táblázat. A VWB laboratóriumi diagnosztikájában ajánlott tesztek
Szűrő tesztek
VWB gyanúja esetén végzendők, valamennyi centrum számára ajánlhatók, ahol vérzékeny betegeket vizsgálnak:
Aktivált partialis thromboplastin idő (APTI)
Az aktivált partialis thromboplastin idő (APTI) többnyire enyhén megnyúlt VWB-ben. Normális APTI azonban nem zárja ki VWB fennállását.
Thrombocytaszám
Von Willebrand-betegségben általában normális, de a 2B altípusban csökkent lehet.
Vérzésidő
A vérzésidő meghatározását Ivy-szerint, standardizált módon, egyszer használatos eszköz segítségével célszerű végezni. A Ratnoff-szerinti (Duke-szerinti vizsgálatnak is nevezik) ujjszúrásos vizsgálat a vérzésidő megítélésére nem alkalmas. Súlyos VWB-ben a vérzésidő mindig megnyúlt, de enyhébb formákban normális is lehet, sőt egy adott beteg esetében fluktuálhat is. Nem tekinthető érzékeny VWB szűrőtesztnek, és specificitása is alacsony.
PFA-100
A PFA-100 (platelet function analyzer-100) készülékkel végezhető automatizált thrombocyta funkciós analízis egyszerű, gyors, érzékeny, de költséges módszer a primer haemostasis vizsgálatára. A vérlemezkék működését nagy nyíróerejű áramlási körülmények között vizsgálja, egyfajta in vitro vérzésidőnek tekinthető. Nem specifikus VWB-re, thrombocytopenia, alacsony hematokrit érték, vérlemezke működést gátló gyógyszerek, egyéb thrombocyta funkció zavarok esetén is kóros lehet. Jelenleg ez a módszer a vérzésidő egyetlen alternatívája, de költségvonzata miatt nem terjedt el széles körben.
Specifikus tesztek
Megerősítik a VWB diagnózisát. A VWF/FVIII komplex kvantitatív és kvalitatív vizsgálatára alkalmazzák a VWF:Ag, VWF:RCo és FVIII:C meghatározásokat. A diagnózist nehezíti, hogy a plazma VWF és FVIII szintjét számos tényező befolyásolja. "0"-s vércsoportú egyéneknél fiziológiásan is alacsonyabb szintek észlelhetők, emellett egyéb tényezők (életkor, etnikai csoport, hormonális status, terhesség) szerepe is bizonyított. A VWF szintje normálisan is széles határok közt (40-240%) változhat.
A VWF antigén (VWF:Ag) szint mérése immunológiai módszerekkel [immunelektroforézis (Laurell), immunturbidimetria, illetve enzimmel kapcsolt immunadszorpció (ELISA)] történik. 3-as típusú VWB-ben a VWF:Ag teljesen hiányzik, vagy csak nyomokban van jelen, 1-es típusban pedig csökkent. A kvalitatív defektusokban a VWF:Ag mennyisége normális vagy közel normális.
Ristocetin kofaktor aktivitás (VWF:RCo) meghatározás. A ristocetin indukálta thrombocyta agglutináció létrejöttéhez a legnagyobb VWF multimerek szükségesek. A VWF legtöbb formájában csökkent, kivéve a 2N altípust és a 2B altípus egyes eseteit.
A VWF collagen kötő képességének vizsgálata (VWF:CB): ELISA módszer, melynek lényege, hogy III-típusú collagennel fedett lemezekhez kötődik a VWF, amelyet peroxidázzal jelzett polyclonalis anti-human VWF antitest segítségével detektálnak. A nagy VWF multimerek hiányát érzékenyen jelző laboratóriumi módszer. Reprodukálhatósága meghaladja a VWF:RCo vizsgálatét.
VIII faktor koagulációs aktivitás (FVIII:C): súlyos, 3-as típusú VWB-ben alacsony, 1-es típusban a VWF csökkenésével arányos. A többi altípusban a VWF:Ag szintjéhez hasonló.
Megkülönböztető tesztek
Az egyes altípusok elkülönítésére alkalmas módszerek tartoznak ide.
Ristocetin-teszt
A ristocetin-teszt (RIPA = ristocetin indukálta thrombocyta aggregáció): egyszerű thrombocyta-aggregáció vizsgálat, mely vérzékenység gyanúja esetén nem nélkülözhető. A VWB-re a ristocetin indukálta thrombocyta-aggregáció hiánya vagy csökkenése jellemző. Normális, egészséges egyén plazmája a ristocetin aggregáció hiányát korrigálja. A ritka 2B altípusban a RIPA fokozott. A fokozott RIPA jelenség a beteg plazmájával átvihető, normális thrombocyta dús plazmához 2B típusú VW-beteg thrombocyta szegény plazmáját adva megjelenik a fokozott RIPA. A VWB 2B altípusának diagnosztikája ma is ezzel az egyszerű vizsgálattal történik.
Plazma VWFmultimer analízis: SDS agaróz gélelektroforézissel végezhető, erre felkészült, speciális laboratóriumokban.
A VWF FVIII-kötő képességének vizsgálata (VWF:FVIIIB): szintén ELISA módszer. A 2N típusú von Willebrand-betegség diagnózisának felállítására, annak az enyhe A haemophiliától való elkülönítésére egyedül ez a módszer alkalmas.
A VWB diagnosztikájának algoritmusát, az egyes altípusok elkülönítését az 1. ábra foglalja össze.
1. ábra. VWB diagnózisának menete.
Differenciáldiagnózis
A veleszületett vérzékenységek közül a thrombocytopathiák és az enyhe haemophilia említhető, a haemostasis szerzett zavarai közül az aszpirin-szedés okozhat a Willebrand-betegséghez hasonló típusú vérzékenységet. Enyhe thrombocytopenia esetén (thrombocyta szám: 50-100 G/l közötti) is gondolni kell a VWB 2B variánsára, melyet olykor ITP-nek kórisméznek.
III. A VWB kezelése
A kezelés célja a fennálló vérzés megszüntetése, illetve egy esetleges vérzés megelőzése.
Két alapvető kezelési mód ismert:
1. DDAVP (desmopressin) alkalmazása,
2. Vírus-inaktivált faktorkoncentrátum (FVIII/VWF) alkalmazása.
DDAVP (desmopressin)
A VW-betegek 70-80%-a jól kezelhető DDAVP-vel. A DDAVP szintetikus vazopressin-származék, amely mind a vérzés megelőzésére, mind az akut vérzések megszüntetésére alkalmas VWB-ben. Elősegíti a VWF release-t az endothel-sejtekből, hatására a kezdeti VWF-szint 3-5-szörösére növekszik. A monocytákból thrombocyta aktiváló faktort (PAF) szabadít fel, amely vérzőkben előnyös haemostatikus hatású. A DDAVP hatásának időtartama 8-10 óra, ez tökéletesen elegendő lehet egy-egy fog-extractio, kisebb sebészeti beavatkozás elvégzéséhez.
Indikáció
1-es típusú VWB-ben elsőként választandó kezelési mód. A legtöbb esetben korrigálja a FVIII/VWF szinteket és a megnyúlt vérzésidőt. 3-as típusban a vWF szintézis teljes hiánya miatt hatástalan. 2B altípusban alkalmazása kontraindikált (a hyperaggregatiót fokozva a thrombocytopenia súlyosbodhat).
A DDAVP dózisa
0,3 ug/ttkg iv. 50-100 ml 0,9%-os fiziológiás NaCl infúzióban 30 perc alatt alkalmazva. Az infúzió 12-24 óránként ismételhető. Ismételt alkalmazás során a DDAVP hatása csökkenhet. Mivel a szer hatásosságában nagy egyéni különbségek vannak, ennek megítélésére a diagnózis felállítása után valamennyi betegnél, akiknél a DDAVP használata szóba jön próbainfúzió végzendő. A tesztinfúziót a fenti dózisban és módon kell végezni. Hatásának leméréséhez meghatározandó a VWF:RCo aktivitás és a FVIII:C kiinduláskor, valamint az infúziót követően egy és négy órával. Az egy órás érték a hatás mértékéről, a négy órás érték pedig a "clearance"-ről tájékoztat. Hatékonynak tekinthető a DDAVP, ha a VWF:RCo és a FVIII:C legalább háromszorosra emelkedik és eléri a 30NE/dl-t.
Elérhető DDAVP készítmény az Octostim injekció, egy ampulla hatóanyagtartalma 15 ug.
Mellékhatások
A szer jól tolerálható, mellékhatásai: fejfájás, hyponatraemia, arcpír, vérnyomáscsökkenés. Nem vérkészítmény, így vírusfertőzést nem közvetít, viszonylag olcsó. Mellékhatás észlelése esetén az infúzió sebességét csökkentsük. DDAVP alkalmazásával összefüggésben nagyon ritkán előfordult thrombotikus szövődmény urémiában és haemophiliában, ezért idős, artériás érbetegségben szenvedőknél óvatosan alkalmazható. Két éves kor alatt nem ajánlott a folyadékretenció és a következményes hyponatraemia okozta fokozott görcskészség miatt.
Vírus-inaktivált faktor koncentrátum
A VWB kezelésére olyan vírus-inaktivált faktor koncentrátum szükséges, amelynek készítése során a VWF óriásmolekula nem megy tönkre, s így a készítmény FVIII/VWF tartalma megtartott.
Indikáció
2A, 2B, 2M, 2N, 3-as típusú VWB, illetve bármely típusba tartozó VW-beteg életveszélyes vérzése, vagy nagy műtéte. Azon betegeknél is indikált, akiknél a próbainfúzió során a DDAVP hatástalannak bizonyult. Magyarországon törzskönyvezett és elérhető készítmények: Haemate P és Immunate
Adagolás
A faktorpótlás dózisa a vérzés típusától vagy a sebészeti beavatkozás természetétől függ. A faktorkoncentrátumban lévő VWF-nak az endogen FVIII-ra kifejtett stabilizáló hatása miatt a FVIII szint tovább marad emelkedett, mint az a biológiai felezési idő alapján várható lenne. Fog-extractio, vérzés esetén általában 20-30 NE/ttkg, kisebb sebészeti beavatkozásoknál 30-50 NE/ttkg, nagyobb műtéteknél 40-60 NE/ttkg adandó naponta egy alkalommal a teljes sebgyógyulásig (3. táblázat). A kezelés irányításában döntő a klinikai kép, a laboratóriumtól naponta csak a FVIII:C meghatározás várható.
3.táblázat. A VWB kezelése vírus-inaktivált FVIII/VWF koncentrátummal
Amennyiben a FVIII/VWF koncentrátum alkalmazásával nem tudjuk uralni a vérzést (elsősorban 3-as típusú VW-betegekben fordulhat elő, de olykor 2B altípusokban is), thrombocyta koncentrátum (cellularis VWF) és vírus-inaktivált magas VWF-tartalmú FVIII koncentrátum együttes alkalmazása indokolt. Ilyenkor a kezelést FVIII/VWF koncentrátum alkalmazásával kezdjük, majd közvetlenül ezt követően thrombocyta koncentrátumot adunk. Rekombinált VII faktor (rFVIIa) készítmény (NovoSeven) alkalmazása is indokolt lehet nehezen uralható vérzés csillapítására. A VW-variánsok kezelését a 4. táblázat foglalja össze.
4. táblázat. A VWB különböző altípusainak kezelése
Kiegészítő gyógyszerek a VWB kezelésében
Az antifibrinolyti kus szerek közül a tranexamsav (Exacyl tbl. szájvíz vagy inj.) alkalmazása ajánlható. A tranexamsav dózisa 20-25 mg/ttkg 8-12 óránként (500 mg-os filmtabletta, 500 mg/5 ml injekció és 1000 mg/ml szájvíz formában érhető el). A súlyos menorrhagia kezelésére folyamatosan szintetikus oestrogen és progesteron tartalmú kontraceptív szer adása ajánlott, vagy a menstruáció teljes felfüggesztése válhat szükségessé. Utóbbira elsősorban 3-as típusú VWB-ben lehet szükség.
Szerzett VW-szindróma (VWS)
Lymphoproliferativ-, myeloproliferativ megbetegedésekhez, autoimmun betegségekhez, uraemiához, Wilms-tumorhoz, hypothyreosishoz, aorta stenosishoz társulhat szerzett VWS, amelynek kezelése alapvetően eltér a veleszületett megbetegedésétől. Az alapbetegség kezelése mellett vérzés esetén FVIII/VWF tartalmú faktorkoncentrátum, valamint immun mechanizmus esetén intravénás immunglobulin (0.4-1.0 g/ttkg/nap öt napon át) alkalmazása ajánlott. Kontrollálhatatlan vérzés megállítására NovoSeven hatásos lehet.
VWF-ellenes alloantitestes Willebrand beteg kezelése
A 3-as típusú VWB 10-15%-ában fordul elő alloantitest. A VWF ellenes gátlótest (alloantitest) egyszerű módon kimutatható: a beteg plazmáját normál thrombocyta dús plazmához (PRP) adjuk, majd RIPA tesztet végzünk. Gátlótest jelenlétekor a RIPA a normál PRP-ben is kórossá válik. Klinikailag a vérzékenység igen súlyos lehet, VWF-t tartalmazó koncentrátum életveszélyes anaphylaxiás reakciót válthat ki, ezért alkalmazása szigorúan kontraindikált. Vérzés esetén nagy tisztaságú FVIII:C koncentrátum (rekombinált FVIII koncentrátum) vagy rekombinált FVIIa (NovoSeven) adása ajánlott. A rekombinált FVIII koncentrátum kontinuus infúzió formájában is alkalmazható, ekkor a FVIII:C-szint >50% legyen. Plasmapheresis és substitutiós kezelés is megkísérelhető. A kezelés lényegét a 5. táblázatban foglaltuk össze.
5.táblázat. A VWF-ellenes alloantitest kezelése
A VWB kezelésére ajánlható algoritmus
A VWB-ben szenvedők normális, az egészségesekkel azonos életmódot folytathatnak. Fizikai aktivitás, sport megengedett, természetesen sérülés esetén a vérzésveszély fokozott. Szülés, terhesség nem kontraindikált. Ellenjavallt nem-steroid gyulladáscsökkentők, mindenekelőtt aszpirin használata. A VWB kezelésére vonatkozó algoritmust a 2. ábra foglalja össze.
6.ábra. A VWB kezelésére ajánlott algoritmus vázlata
IV. Rehabilitáció és V. Gondozás
Kontrollált otthoni kezelés ("home treatment") VWB-ben
A VW-betegek otthoni kezelésére ma már desmopressin spray (Octostim) is rendelkezésre áll. A betegek azonnal alkalmazhatják, és kevésbé súlyos vérzés esetén (epistaxis, kisebb trauma, fog-extractió előtt, menorrhagia) nincs is szükség további kezelésre. A menorrhagia kezelését ajánlatos kiegészíteni fibrinolízis gátló (Exacyl) és hormonális (kontraceptív szer) kezeléssel is. Intranasalis kezelésre csak a nagy koncentrációjú készítmény (1.5 mg/ml DDAVP) használható - alacsonyabb koncentrációjú készítmények nem alkalmasak a VWB kezelésére.
Profilaxis VWB-ben
Sebészi beavatkozás előtt célzott profilaxis szükséges (lásd előbb). Súlyos vérzéssel járó 3-as típusú VWB esetén, valamint egyéb (pl. 2A), súlyos altípusokban indokolt lehet tartós profilaxis alkalmazása FVIII/VWF tartalmú koncentrátummal. Az ajánlható dózis 20-30 NE/ttkg hetenként kétszer-háromszor.
Terhesség, szülés, postpartum időszak VWB-ben
A terhesség 1-es és 2-es típusú VWB-ben a FVIII/VWF-szintet növeli, így terhesség során vérzéses komplikáció VWB-ben nagyon ritka. Mivel a faktoremelkedés betegenként különböző mértékű lehet, a betegeket a terhesség alatt ellenőrizni kell, invazív beavatkozások előtt, illetve a 3. trimeszterben. A szülésre való felkészüléshez a várható időpont előtt 10 napon belül kell ellenőriznünk a FVIII:C és VWF:RCof szinteket.
1-es típusú VWB-ben a FVIII:C szint a legjobb előrejelzője a szülést követő vérzés rizikójának: minimális a kockázat > 50% FVIII szint esetén, de nagy a vérzés valószínűsége < 20% FVIII szintnél.
3-as típusú vW-betegeknél nincs szignifikáns változás. 2B altípusú betegek thrombocytopeniája súlyosbodhat a terhesség alatt. A szülés után a VWF-szint gyorsan csökken, ezért a postpartum időszak 3-10. napja különösen veszélyes lehet. Emiatt a VW-beteg fokozott, 7-10 napos megfigyelése indokolt szülészeti osztályon.
A fentiek szerint invazív beavatkozásokhoz (pl. amniocentesis) a vérzés megelőzésére profilaxist kell alkalmazni, ha a FVIII és/vagy VWF:RCof szint <50 %. A profilaxis általában desmopressin, illetve 2B vagy 3-as típusú betegek esetében FVIII/VWF koncentrátum alkalmazása 40-60 NE/ttkg dózisban. Hasonlóan kell a szülést előkészíteni. Viszont a szülés után - számítva a VWF szint csökkenésére - ilyenkor megelőzésként ajánlott desmopressin infúzió azoknak a betegeknek, akiknél a terhesség előtti VWF/FVIII szint ezt indokolja. A DDAVP infúzió 12-24 órával később megismételhető. Nagyobb vérzés esetén FVIII/VWF koncentrátum alkalmazása szükséges, naponta kétszer ismételve.
Hepatitis-B elleni vakcináció
VWB-ben hepatitis-B elleni vakcináció ajánlott. Újonnan felismert betegség esetén DDAVP-tesztinfúzió végzése szükséges. Kórházi osztályon DDAVP infúzió, a beteg otthonában intranasalis vagy subcutan alkalmazható DDAVP-koncentrátum ajánlható. Ha DDAVP hatására a vérzés nem csökken, FVIII/VWF koncentrátum adása indokolt. Szemben a haemophiliával, a FVIII:C meghatározása csak tájékoztató értékű. Döntő a klinikai kép. Amennyiben a vérzés nem szűnik, a dózisok 12 óránkénti ismétlése, indokolt esetben thrombocyta koncentrátum és FVIII/VWF koncentrátum együttes alkalmazása, vagy rekombinált FVIIa (NovoSeven) és thrombocyta koncentrátum együttes alkalmazása ajánlható.
VI. Irodalomjegyzék
1. Berntorp E, Petrini P: Long-term prophylaxis in von Willebrand disease. Blood Coagul Fibrinolysis 2005; Suppl. S23-26.
2. Boda Z: Willebrand-betegség. In: Klinikai hemosztazeológia. Szerk.: Boda Z, Rák K, Udvardy M, 2. javított, bővített kiadás, Springer, Budapest, 2000; 349-369.
3. Boda Z, Pfliegler G, Hársfalvi J, Rák K: Treatment of the severe bleeding episode in type III von Willebrand" disease by simultaneous administration of cryoprecipitate and platelet concentrate. Blood Coag. Fibrinol., 1991; 2: 775-777.
4. Bodó I., Schlammadinger Á.: A von Willebrand betegség - klinikai és laboratóriumi vonatkozások. 168-180. old. In: Thrombosis és vérzékenység (szerk. Boda Zoltán.) Budapest: Medicina K. 2006. p. 562. ISBN 963-226-041-4.
5. Budde U, Bergmann F, Michiels JJ: Acquired von Willebrand syndrome: experience from 2 years in a single laboratory compared with data from the literature and an International Registry. Semin. Thromb. Hemost., 2002; 28: 227-237.
6. Federici AB, Mannucci PM: For the Italian Association of Hamophilia Centers AICE): Guidlines for the diagnosis and management of von Willebrand disease in Italy. Haemophilia, 2002; 8: 607-621.
7. Federici AB: Acquired von Willebrand syndrome: is it an extremely rare disorder or do we see only the tip of the iceberg? J Thromb Haemost 2008; 6:565-568.
8. Gézsi, A, Budde, U, Deák, I és mtsai: Accelerated clearance alone explains ultralarge multimers in VWD Vicenza. J Thromb Haemost 2010; 8:1273-1280.
9. Mannucci,PM: Treatment of von Willebrand disease. Thromb Haemost, 2001; 86: 149-153.
10. Mannucci,PM: How I treat patients with von Willebrand disease. Blood; 2001; 97: 1915-1919.
11. Mannucci PM, Franchini M, Castamann G és mtsai: Evidence-based recommendations on the treatment of von Willebrand disease in Italy. Blood Transfus 2009; 7:117-126.
12. Michiels,JJ, van de Velde,A, van Vliet,H. és mtsai.: Response of von Willebrand factor parameters to desmopressin in patients with type 1 and type 2 congenital von Willebrand disease: diagnostic and therapeutic implications. Semin Thromb Hemost, 2002; 28: 111-131.
13. Mohl A, Marschalek R, Masszi T, Nagy E, Obser T, Oyen F, Sallai K, Bodó I, Schneppenheim R.: An Alu-mediated novel large deletion is the most frequent cause of type 3 von Willebrand disease in Hungary. J Thromb Haemost. 2008 Oct;6 (10):1729-35.
14. Rodeghiero F, Castamann G, Tosetto: A How I treat von Willebrand disease. Blood 2009, 114:1158-1165.
15. Sadler,JE: A revised classification of von Willebrand disease. Thromb Haemost 1994; 71: 520-525.
16. Sadler, JE, Budde, U, Eikenboom JCJ ás mtsai: Update on the pathophysiology and classification of von Willebrand disease: a report of the Subcommittee on von Willebrand Factor. J Thromb Haemost 2006; 4:2103-2114.
17. Sadler,JE, Mannucci,PM, Berntorp,N et al: Impact, diagnosis and treatment of von Willebrand disease. Thromb Haemost, 2000; 84: 160-174.
18. Schlammadinger,Á., Boda,Z: Laboratory screening and diagnosis of von Willebrand's disease. Clin Lab, 2002; 48: 385-393.
19. Tosetto A, Rodeghiero F, Castamann G: A quantitative analysis of bleeding symptoms in type 1 von Willebrand disease: results from a multicenter European study (MCMDM-1 VWD). J Thromb Haemost 2006; 4:766-773.
VII. Mellékletek
Táblázatok, ábrák
1. táblázat. A VWB osztályozása (Sadler és mtsai nyomán; J Thromb Haemost 2006,4:2103)
| Típus | Jellemző |
| 1 | A VWF részleges hiánya, kvantitatív zavar |
| 2 | Kvalitatív VWF zavarok |
| 2A | Csökkent VWF-függő thrombocyta adhézió, mely |
| a HMWM szelektív hiányával jár | |
| 2B | Fokozott VWF affinitás a thrombocyták GP Ib receptora iránt |
| 2M | Csökkent VWF-függő thrombocyta adhézió, mely |
| nem jár a HMWM szelektív hiányával | |
| 2N | Jelentősen csökkent FVIII-kötő képesség |
| 3 | A VWF teljes hiánya |
| "Platelet type" | Thrombocytopathia, a thrombocyták GPIb-je fokozottan köti a HMWM-eket. |
| (HMWM: nagy molekulatömegű multimer) | |
2. táblázat. A VWB laboratóriumi diagnosztikájában ajánlott tesztek
| Szűrő tesztek: |
| - Aktivált partialis thromboplastin idő (APTI) - Thrombocyta szám - Vérzésidő (Ivy szerint) - PFA-100 |
| Specifikus tesztek: |
| - von Willebrand faktor antigén (VWF:Ag) - Ristocetin kofaktor aktivitás (VWF:RCo) - VIII faktor koagulációs aktivitás (FVIII:C) - collagen-kötő aktivitás (VWF:CB) |
| Megkülönböztető tesztek: |
| - Ristocetin-indukálta thrombocyta aggregáció (RIPA) - VWF multimer analízis - VWF:FVIIIB |
3. táblázat. A VWB kezelése vírusinaktivált magas VWF-tartalmú FVIII koncentrátummal*
| Indikáció | Dózis (NE/ttkg) | Infúziók száma | Elérendő cél |
| Nagy műtét | 40-60 | naponta egyszer | FVIII:C >50% a teljes sebgyógyulásig |
| Kis műtét | 30-50 | naponta egyszer | FVIII:C >30% a teljes sebgyógyulásig |
| Fog-extractio | 20-30 | 1-3 napig napi egyszer | FVIII:C >30% a beavatkozást követő 12 órán keresztül |
| Spontán vérzés | 20-30 | egy alkalommal | FVIII:C >30% |
* Magyarországon törzskönyvezett és elérhető készítmények: Haemate P és Immunate
4. táblázat. A VWB különböző altípusainak kezelése
| Típus | Ajánlott kezelés (bármely típusban) | Kiegészítő kezelés | |
| 1 | 0 | DDAVP (iv., sc., in.) | antifibrinolyticum, oestrogen, orális kontraceptív szer, vaspótlás |
| 2A | FVIII/VWF koncentrátum | ||
| 2B | FVIII/VWF koncentrátum | ||
| 2M | FVIII/VWF koncentrátum | ||
| 2N | FVIII/VWF koncentrátum | ||
| 3 | FVIII/VWF koncentrátum + thrombocyta koncentrátum; rFVIIa | ||
| 3 alloantitesttel | rFVIIa koncentrátum vagy rFVIII (tilos: FVIII/VWF koncentrátum!) | ||
| "Platelet type" | FVIII/VWF koncentrátum ± thrombocyta koncentrátum |
5. táblázat. A VWF-ellenes alloantitest kezelése
FVIII/VWF koncentrátum anaphylaxiás reakciót válthat ki, szigorúan kontraindikált! nagy tisztaságú FVIII:C tartalmú koncentrátum (rFVIII) vagy rFVIIa oestrogen/progesteron-tartalmú kontraceptív szer plasmapheresis és substitutiós kezelés
1. ábra. A von Willebrand-betegség diagnosztikája
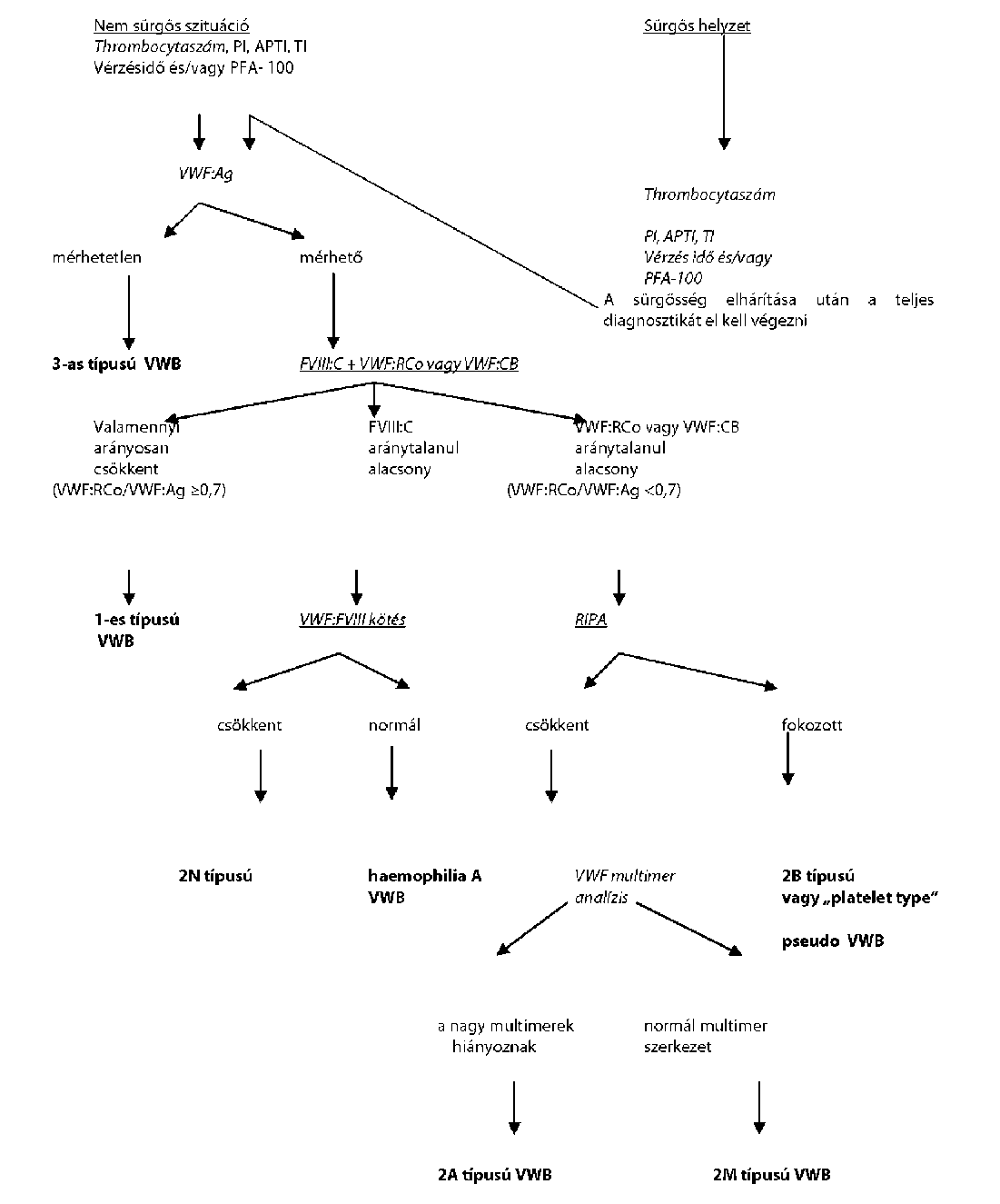
2. ábra. A VWB kezelésére ajánlott algoritmus vázlata
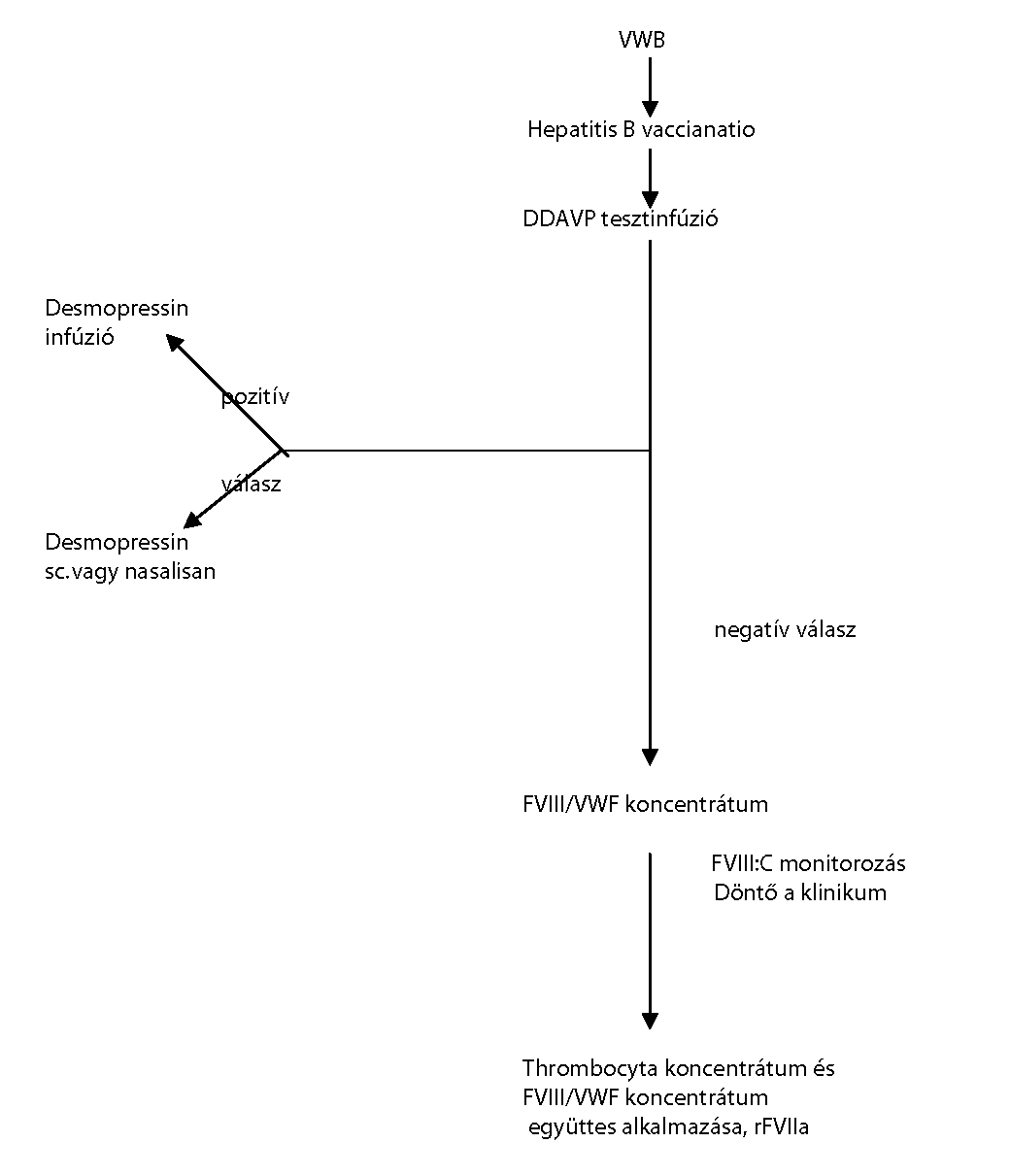
A GYERMEKKORI HAEMOPHILIA ETIOLÓGIÁJA, TÜNETTANA ÉS KEZELÉSE
I. Alapvető megfontolások
Az irányelvek alkalmazási, érvényességi területe
Csecsemő-gyermekgyógyászat, 0-18 éves kor között BNO: D6600; D6700; D6830
Definíció
A gyermekkori haemophilia -azonosan a felnőttkorival- veleszületett örökletes véralvadási rendellenesség, melynek oka a VIII-as (FVIII) vagy IX-es (FIX) véralvadási faktor hiánya vagy biológiai csökkent aktivitása, amelyeket a véralvadási faktorokat kódoló X kromoszóma hosszúkarján található génszakaszok mutációja eredményez (1). A FVIII hiányán, vagy biológiai csökkent értékűségén alapuló vérzékenységet A -haemophiliának, míg a FIX hiányán alapuló betegséget B - haemophiliának nevezzük.
Bár a megbetegedés etiológiáját, genetikai hátterét, öröklődését, klinikai sajátosságait, laboratóriumi diagnosztikáját és általános kezelési elveit tekintve azonos a felnőttkorival, a gyermekkori haemophilia az életkori és élettani sajátosságok miatt megkülönböztetett jelentőséggel bír.
II. Diagnosztika
Panaszok tünetek, általános jellemzők
Az alvadási faktorok hiányának, ill. aktivitásának mértéke párhuzamos a klinikai kép súlyosságával (1. táblázat). (2)
1. táblázat. A haemophilia súlyosság szerinti besorolása
| Súlyosság | Faktorszint | Vérzés jellege |
| % aktivitás (IU/ml) | ||
| Súlyos | 1% (<0.01) | Spontán vérzés, főként ízületben és izomban |
| Középsúlyos | 1%-5% (0.01-0.05) | Spontán vérzés ritka, de súlyos vérzés traumánál, műtétnél |
| Enyhe | 5%-40% (0.05-0.40) | Súlyos vérzés nagy traumánál vagy műtétnél |
Haemophilia gyanúja merül fel, ha az anamnézisben az alábbiak szerepelnek:
- nehezen felszívódó cephalhaematoma újszülöttkorban
- újszülöttkori központi idegrendszeri vérzés egyéb megmagyarázható ok nélkül fiúgyermekben
- haematomak, suffusiók a nyomásnak kitett helyen csecsemő-, kisgyermekkorban
- i.m. adott védőoltás helyén kialakuló, elszíneződéssel nem járó végtagduzzanat
- spontán ízületi vagy izomvérzések
- traumát, műtétet követő masszív vérzés
Súlyos haemophiliások döntő többségében csak a kisgyermek járni tanulásának idején a relatíve kis traumára bekövetkező boka vagy térdízületi vérzés okozta duzzanat hívja fel a figyelmet a betegségre. Életkori sajátosság, hogy a járás kezdetekor, az esések okozta ízületi vérzések gyakran eredményeznek a nyelv elharapásából, vagy a frenulum felszakadásából származó szájüregi vérzéseket is, melyek gyógyulása elhúzódó lehet.
Enyhe vagy közepesen súlyos haemophiliásokban elsősorban trauma, vagy műtét során alakulhat ki vérzés. A vérzés helye szerint súlyos, ill. életveszélyes vérzések különíthetők el. Bár a haemophiliás gyermekekben mindenütt kialakulhat vérzés, mégis a vérzések leggyakoribb lokalizációja az ízületek (2. táblázat). Az érintettség gyakorisági sorrendje: térd, könyök, boka, váll, csípő (2. táblázat). A vérzékeny beteg életminőségét hosszútávon még napjainkban is az ismételt (manifeszt, vagy szubklinikai) vérzések okozta arthropathia határozza meg, mely egyike a haemophilia krónikus szövődményeinek
2. táblázat. Haemophiliás vérzések jellemzői
| Vérzésforrás szerint: | |
| Súlyos vérzések Életveszélyes vérzések | |
| - Ízületek | - Központi idegrendszeri (CNS) |
| - Izomzat/lágyrész | - Gastrointestinalis (GI) |
| - Száj/orr/bél | - Nyak / garat |
| - Haematuria | - Súlyos trauma |
| Vérzéstípusok: | |
| - Haemarthrosis | 70-80% |
| - Izomzat/lágyrész | 10-20% |
| - Egyéb nagy vérzés | 5-10% |
| - Központi idegrendszeri vérzés (CNS)< 5% | |
Inhibitoros (gátlótestes) haemophilia
Az A és B típusú haemophilia szubsztitúciós kezelése során a FVIII/FIX antigén szerkezet ellen neutralizáló antitestek (inhibitorok) képződhetnek, melyek alloantitestek. Általános jellemzőiket a 3. táblázat szemlélteti.
3. táblázat. A gátlótest (inhibitor) általános jellemzői haemophiliában
- A szubsztitúció során képződnek a FVIII/FIX antigén struktúra ellen
- IgG típusú antitestek/alloantitestek
- Rendszerint IgG4 nehézlánc és a könnyűlánc alosztályú immunglobulinok
- Az antigén-antitest kötődés kapcsán nem aktiválják a komplement rendszert
- FVIII / FIX molekula különböző részeihez kötődnek:
Gátolják a koagulációs aktivitást, ill.
Lerövidítik az alvadási faktor féléletidejét a keringésben
- Genetikai és környezeti tényezők kölcsönhatása eredményezi
- Döntően az első 10-20 expozíciós napon belül alakulnak ki
- Súlyos géndefektus (deléció, inverzió, nonsense és frameshift mutáció) esetén gyakoribbak
Az inhibitor kialakulását, ill. jelenlétét több, klinikai tünet valószínűsítheti (4. táblázat), melyek észlelésekor azonnali inhibitor meghatározás indokolt.
4. táblázat. Inhibitorok jelenlétét valószínűsítő klinikai tünetek haemophiliában
- A vérzékenység váratlan fokozódása
- Az addig alkalmazott faktor mennyiségének hatástalansága
- A faktorigény fokozódása
- A vérzékenység jellegének megváltozása
- Szokatlan jellegű vérzés (nyelvgyök!, retroperitoneum!)
- Túlérzékenységi reakciók (különösen B-haemophiliában!)
Az inhibitoros haemophilia tehát potenciálisan életveszélyes szövődmény, mert a betegek a neutralizáló alloantitestek jelenléte miatt szokásos faktorpótlással szemben rezisztensek. A terápiás nehézségek mellett, a kezelésnek nagy a költségvonzata, így gazdasági konzekvenciával is bír.
Az inhibitorok jellemzői
A VIII-as vagy IX-es faktor ellen termelődött, keringő inhibitorok mennyiségét Bethesda (BE) vagy Nijmegen egységben határozzuk meg. Az inhibitorok lehetnek átmeneti - spontán eltűnő -, vagy perzisztáló (tartós) inhibitorok, mely utóbbiak között megkülönböztetünk enyhe (klinikai következmény nélkül), vagy klinikailag releváns inhibitorokat. A klinikailag releváns inhibitor kritériuma legalább két pozitív inhibitor titer fennállta csökkent VIII-as/IX-es faktor féléletidővel, ill. recoveryvel. A rendszeres faktorpótlás mellett mért alacsony inhibitor titer (5 BE) általában átmeneti inhibitor jelenlétét valószínűsíti, míg az 5 BE feletti inhibitor szint perzisztáló (tartós) inhibitorok fennálltára utalhat. Amennyiben a faktorpótlás - amely mellett az inhibitor kialakult - hosszabb ideje szünetel, az inhibitor titer csökkenhet vagy akár el is tűnhet. Ismételt faktorpótlásra azonban 3-5 napon belül ismét megjelenik és a titer emelkedhet is (anamnesztikus válasz).
Nagyon alacsony titerű inhibitorok a Bethesda inhibitor assay-vel nem mutathatók ki, de a faktorpótlást követően mért csökkent faktor recovery és rövid féléletidő inhibitor jelenlétére utal. (2)
Az inhibitor mennyisége és a VIII-as vagy IX-es faktor beadásra adott anamnesztikus válaszkészség szerint low és high responder (alacsony vagy magas titerben jelentkező) inhibitort különböztetünk meg. "High responder" erős anamnesztikus választ jelent, azaz nagymértékben megnő az antitest titer. "Low responder" anamnesztikus reakció esetén nincs, vagy jelentéktelen az antitest titer emelkedés. Határértékként (cut off érték) az 5 Bethesda érték (5 BE) az elfogadott. Magas inhibitor titerről beszélünk, ha a maximális inhibitor titer értéke legalább 5 BE/ml. A súlyos haemophiliások döntő többsége high responder.
Az inhibitorképződésnek környezeti és genetikai rizikófaktorai lehetnek (4. táblázat) (1,3,4,5,6)
Míg a genetikai faktorokat nehéz befolyásolni, addig a környezeti tényezők befolyásolhatók. Ezen alapszik a korábban még nem kezelt (previously untreated patients = PUPs) haemophiliás kisgyermekek inhibitor megelőzését célzó korai, rendszeres alacsony dózisú prophylaxisa.
4. táblázat. Inhibitor képződés rizikótényezői
| Hajlamosító genetikai tényezők | Hajlamosító környezeti tényezők |
| - FVIII mutáció típusa | - Életkor az 1. expozíciókor |
| - Inhibitorok a családban | - Immunológiai hatás (fertőzések, védőoltások) |
| - Haemophilia súlyossága | - Kezelés (prophylaxis/on demand) |
| - Fajta /etnikum | - Kezelés intenzitása (FVIII dózis és gyakoriság) |
| - Immunválasz-gének polimorfizmusa | - Invaziv klinikai beavatkozások (sebészeti műtét, port-a-cath beültetés) |
| (IL- 10 134 pozitív; | |
| TNF-alpha A2 pozitív; | |
| CTLA4-318 T negatív) |
Az inhibitor megjelenésének kockázata haemophiliában korfüggő, az első néhány expozíciós nap (exposure day = ED) után a legnagyobb. Az összes inhibitor fele a 15. ED előtt jelenik meg, míg a további 50%-a ezt követően egyre csökkenő gyakorisággal általában az 50. ED-ig kialakul. Az 50. expozíciós napon az inhibitorképződés kockázata 1% alá csökken. Expozíciós nap egy naptári nap, amelyen a beteg egy vagy több faktor infúzióban részesül.
Inhibitorszűrés indokolt:
- Gyanújelek fennállta esetén
- Minden műtéti beavatkozás (port-a cath is!) előtt
- Korai, alacsony dózisú rendszeres inhibitor prophylaxis során minden 5 ED-t követően
- Minden faktorpótlásban részesülő súlyos haemophiliás gyermekben 3 havonta
- Műtéten átesett, vagy egyéb okból nagy dózisú faktorpótlásban részesült enyhe haemophiliás gyermekben a faktorpótlás után 1 hónappal
III. A gyermekkori haemophilia kezelése
A gyermekkori haemophilia kezelésének alapja - azonosan a felnőttkorival - a hiányzó véralvadási fehérje pótlása (szubsztitúció), mely kizárólag parenterális (intravénás) úton történhet.
A vérzések kezelésére illetve prophylaxis céljából plasma eredetű és rekombináns készítmények adhatók.
Szubsztitúciós kezelés a következő esetekben szükséges: (2)
- vérzések fellépésekor
- vérzések veszélyének fennállása esetén (invazív beavatkozások, műtét, foghúzás)
- prophylaxis céljából.
A szubsztitúciós kezelés megtervezésekor a kiindulási faktorpótlás dózisát az alábbiak határozzák meg:
- beteg kiindulási faktorszintje = a haemophilia súlyossága
- vérzés lokalizációja és súlyossága
- beteg testtömege
- korábbi hasonló vérzés lefolyása
- FVIII és FIX eltérő farmakokinetikai tulajdonsága (5. táblázat)
5. táblázat. Faktorpótlás különböző vérzéstípusokban
| Elérendő faktorszint (%) | Dózis (NE/tskg) | Adagolás | Szubsztitúció | |
| Vérzés helye | gyakorisága | időtartama | ||
| (naponta) | (nap) | |||
| Ízületi és kisebb | 25-40 | 15-25 | 1-2 x | 1-3 |
| izomközti vérzés | ||||
| kivéve m. iliopsoas | ||||
| = Több izmot és ízületet érintő,kiterjedt | 40-60 | 25-35 | 1-2 x | 2-6 |
| haematoma, | ||||
| = m. iliopsoas, | ||||
| = speciális lokalizációjú vérzések: | ||||
| -szájüregi | ||||
| -torok, nyak | ||||
| -alkar | ||||
| Baleseti, nagyobb sérülés | 40-60 | 25-35 | 1-2 x | 4-8 |
| Gastrointestinalis vérzés | 60-80 | 30-40 | 1-2 x | 4-8 |
| Testüregi vérzések | 80-100 | 40-55 | 2 x | 4-12 |
| -intraabdominalis | ||||
| -retroperitonealis | ||||
| -intrathoracalis | ||||
| Központi idegrendszeri | 80-100 | 40-55 | 2 x | 6-14 |
| vérzés | ||||
| Fejtrauma | ||||
| Intraocularis vérzés | ||||
| Haematuria | 15-25 | 10-20 | 2 x | 2-8 |
A VIII-as faktor recovery- (= biológiai hasznosulás) értéke 90-100%, szemben a IX-es faktor mindössze kb. 50%-os értékével.
A készítmények alvadási faktor tartalmát egységben adjuk meg. Egy egység az a faktoraktivitás, amit egy egészséges ember 1 ml plasmája tartalmaz.
A - haemophiliás gyermekben a kiindulási faktorszintet testtömegkilogrammonként adott 1 E FVIII 1,5-2%-kal növeli, míg
B - haemophiliás betegben a testtömegkilogrammonként adott 1 E FIX a kiindulási faktorszintet 1%-kal növeli.
Ezeket figyelembe véve haemophiliás gyermekek esetén a szükséges faktorpótlás az alábbi képlet segítségével határozható meg:

Az ismételten szükséges faktorpótlást a biológiai "felezési idő" (T 1/2 ) is befolyásolja. Miután a VIII-as faktor félélet ideje 8-12 óra, a fenntartó FVIII pótlás során naponta általában 2 x-i bolus injekciót alkalmazunk. A IX-es faktor félélet ideje hosszabb a VIII-as faktorénál (T 1/2 = 16-18 óra), így B- haemophilia esetén naponta egyszeri FIX pótlás is elegendő.
Fontos hangsúlyozni, hogy a korrekt faktorpótláshoz fontos a rendszeres testsúlymérés és faktoraktivitás ismerete!
Általános irányelv, hogy minden típusú vérzést kezdetben KOK keretében lehet, és kell is kezelni. Vannak azonban olyan vérzések, amelyek a későbbiek során sürgős intézeti kezelést igényelnek.
Kontrollált otthoni kezelés keretében kezelhető vérzéstípusok:
- Ízületi vérzés (egy ízületi érintettség)
- Izomvérzés (nem kiterjedt)
- nyitott sebek (sebészeti ellátást nem igénylő)
Kezdetben kontrollált otthoni, majd sürgős intézeti kezelést igénylő vérzéstípusok
- Szájüreg, nyaki régió vérzése
- Izomvérzés (környéki struktúrák, idegek nyomásának veszélye)
- Fejsérülés vagy ismeretlen eredetű fejfájás
- Tompa hasi sérülés (parenchymas szerv laesio veszélye)
- Bármely helyről történő elhúzódó vérzés
- Bármely terület súlyos duzzanata
- m. ileopsoas bevérzésének gyanúja: jobb oldali m. ileopsoas vérzés appendicitis klinikai tüneteit utánozhatja!!
DDAVP
Enyhe A - haemophiliás gyermekek többségében kisműtétek vagy fogászati beavatkozások során megfelelő vérzéscsillapítás érhető el DDAVP (szintetikus vasopressin analóg) alkalmazásával.
A DDAVP szokásos dózisa: 0,3 ug/ttkg, melyet kb. 30 perccel a tervezett műtéti beavatkozás előtt 50-100 ml volumenű lassú (kb.félórás) infusioban 2-3 napig naponta 1 x vagy 2 x adható. A kezelés mellékhatásaként hypotonia ill. hyponatraemia léphet fel, mely kisgyermekek esetében convulsiot okozhat. A hyponatraemia kiváltotta agyoedéma lehetősége miatt 3 éves életkor alatt ne adjuk!
Adjuváns módszerek
Gastrointestinalis, szájüregi vagy egyéb nyálkahártyavérzésekben a faktorpótlás mellett kiegészítő antifibrinolytikus kezelés (tranexamsav) is adható.
Haematuria esetén gyermekkorban bő folyadékbevitel, kórházi körülmények között gyorsan lefolyatott infúzió javasolt, szükség esetén spasmolytikum adásával kiegészítve.
Antifibrinolytikus kezelés haematuriában kontraindikált az intraureterális alvadékképződés veszélye miatt. Elhúzódó haematuria esetén mérlegelhető alacsonyabb dózisú faktorpótlás (10-20 NE /ttkg). Acetil-szalicilátot és NSAID gyulladásgátlókat haemophiliában általában tilos alkalmazni. Ha NSAID adása elkerülhetetlen, szelektív COX-2-blokkolók adása megkísérelhető, miután a thrombocytafunkció gátlásával nem kell számolni.
Kezelési módok gyermekkori haemophiliában
A gyermekkori haemophilia szubsztitúciós kezelése intézeti körülmények között és ún. kontrollált otthoni kezelés (KOK) formájában történhet, mely különös jelentőséggel bír a súlyos haemophiliás, gyakran vérző és gondozási helytől távol lakó gyermekekben.
A kontrollált otthoni kezelés megkezdése minden esetben a haemophiliás beteg illetve szülője kérésére történik. A kiválasztás előzetes orvosi felkészítés és képzés alapján történik. A KOK-ban való részvételt a hatályban levő jogszabályok szerint dokumentálni kell. KOK keretében a faktorpótlást végezheti maga a haemophiliás, vagy - elsősorban kiskorúak esetén - a szülő ill. egészségügyi személyzet.
Magyarországon 1999. 01. 01. óta van lehetőség kontrollált otthoni kezelésre. A kontrollált otthoni kezelésnek két formája különíthető el: on demand kezelés és prophylaxis.
On demand kezelés és prophylaxis
Az on demand (vérzés esetén alkalmazott) faktorpótlás a haemophilia ellátás klasszikus formája. Lényege, hogy a haemophiliás egyén faktorpótlást csak vérzés esetén kap.
Ezzel ellentétben a prophylaxis a véralvadási faktorkoncentrátumoknak a vérzés megelőzését célzó rendszeres bevitelét jelenti, mellyel a haemophilia fenotípusát változtatjuk meg, a súlyos haemophiliát közepesen súlyos formába alakítjuk azzal a céllal, hogy a spontán ízületi és izomvérzések megelőzhetők legyenek. (7)
Az irodalmi adatok alapján mára egyértelművé vált, hogy a primer, rendszeres prophylaxis a súlyos haemophiliás gyermekek optimális kezelési módja (8), mely a WHO és WFH ajánlásában is szerepel.(9,10) Fontos megkülönböztetni folyamatos (állandó) és szelektív (átmeneti) prophylaxist.
A folyamatos prophylaxis az év legalább 46 hetében történik. Primer (elsődleges) és szekunder (másodlagos) formája különíthető el. (11)
A primer folyamatos prophylaxis esetén a szubsztitúciós prevenció általában 1,5-2 éves életkor körül kezdődik, azt követően, hogy a haemophiliás kisgyermek előzetesen kb. 50 héten keresztül olyan rendszeres, alacsony dózisú prophylaktikus faktorpótlásban részesült, melynek legfontosabb célja az inhibitor kialakulásának gátlása. A primér prophylaxis legfontosabb célja az ízületi károsodások megelőzése és ezáltal az életminőség javítása.
A szekunder prophylaxis több ízületi bevérzés után megkezdett terápiás beavatkozás, amikor a vérzések következtében már különböző súlyosságú arthropathiás jelek mutathatók ki. Az eredmény nagymértékben függ a beteg vérzéses anamnézisétől és az ízületek állapotától.
Korai, kis dózisú rendszeres prophylaxis (6-12 hónap)
Rrendszeresprophylaktikus kezelést kell elkezdeni azokban a haemophiliásokban, ahol
- súlyos FVIII génmutáció ill.súlyos haemophilia igazolható
- lehetőség szerint már az első vérzés után (1. ED), de
- legkésőbb a 2. ED után függetlenül vérzés jelenlététől
Az első 20 expozíciós napon kerülni kell: (12)
- a magas FVIII szint kialakulását, melyet gyakori FVIII infúzió, és magas FVIII dózis eredményezhet ajánlott szubsztitúciós FVIII dózis: < 25 NE/ttkg
- sebészeti beavatkozást
- faktorvédelemben történt védőoltásokat
- i.m. adott védőoltások (izomközti vérzés, fertőzés veszélye) helyett a védőoltás s.c. adása indokolt.
s.c. adott védőoltás esetén kisebb a szövetkárosodás kockázata, potenciálisan kisebb lesz a sérült sejtekből származó "vészjelző" molekulák aktiváló szerepe is.
- lázas állapotban történő faktorpótlást
Korábban nem kezelt (PUPs)* haemophiliás kisgyermekek alacsony dózisú rendszeres prophylaxisa: (13,14)
Korábban nem kezelt betegek (PUPs*: previously untreated patients) azok, akikben az alacsony dózisú rendszeres prophylaxis megkezdéséig még nem történt faktorexpozíció.
A haemophiliás csecsemő faktorpótlása szükség szerinti (on-demand) kezeléssel kezdődik.
6-12 hónapos kor között rendszeres, alacsony dózisú prophylaktikus kezelésre kell áttérni, lehetőleg már az 1. expozíciós nap (ED), de mindenképpen a 2. ED után. A kezdő rendszeres prophylaktikus dózist az ízületi vérzés fennállta vagy hiánya határozza meg.
A kezdő rendszeres prophylaktikus dózis: hetente 1 x 250 NE, ha
- nincs ízületi vérzés
- csak bőr- és kötőszöveti vérzések vagy többszörös haematomák vannak
- a rendszeres prophylaxist ebben a dózisban kell folytatni a 20. (legalább 14-16) expozíciós napig
- ha ízületi vagy egyéb vérzés nem lép fel, ebben a dózisban javasolt a prophylaxis további folytatása az 50. expozíciós napig
- amennyiben ízületi (vagy bármely lokalizációjú) vérzés lépne fel, a faktorpótlás dózisát emelni kell heti 2 x 250 NE-re
- súlyos ízületi vagy életveszélyes vérzés esetén a dózist 3 x 250 NE-re kell módosítani.
- az 50. expozíciós nap után a prophylaktikus dózis: hetente 3 x 500 NE
A kezdő rendszeres prophylaktikus dózis: hetente 2 x 250 NE, ha
- ízületi vérzés észlelhető
- a rendszeres prophylaxist ebben a dózisban kell folytatni a 20. (legalább 14-16) expozíciós napig. Amennyiben újabb ízületi vagy egyéb vérzések nem lépnek fel, ebben a dózisban javasolt a prophylaxis folytatása, 50. expozíciós napig
- súlyos ízületi vagy életveszélyes vérzés esetén a dózist 3 x 250 NE-re kell módosítani.
- az 50. expozíciós nap után a prophylaktikus dózis: hetente 3 x 500 NE
A kezdő rendszeres prophylaktikus dózis: hetente 3 x 250 NE, ha
- súlyos ízületi vagy életveszélyes vérzés van
- a rendszeres prophylaxist ebben a dózisban kell folytatni a 20. (legalább 14-16) expozíciós napig. Amennyiben áttöréses vérzések nem lépnek fel, ebben a dózisban javasolt a prophylaxis folytatása az 50. expozíciós napig.
- az 50. expozíciós nap után a prophylaktikus dózis: hetente 3 x 500 NE
A prophylaktikus dózis meghatározásánál általános irányelv, hogy az egyszeri FVIII dózis 25 NE/ttkg -ot ne haladja meg!
PUPs haemophiliások rendszeres, alacsony dózisú prophylaxisa rekombináns faktorkészítménnyel javasolt!
Az ÁNTSZ védőoltási szaktanácsadó (Egyesített Fővárosi Szent István és Szent László Kórház klinikai védőoltási szaktanácsadó;
Tel: 1/4558100) engedélyével - a nemzetközi ajánlásnak megfelelően - Magyarországon haemophiliás csecsemők védőoltásait s.c. kell adni i.m. adás helyett. A védőoltás beadása előtt szülői felvilágosítás (a védőoltás s. c. adása alumínium adjuvált tartalmánál fogva helyi reakciót, esetleg szövetkárosodást eredményezhet, mely oltási szövődmény, de gyógyul) ill. az oltás helyéről (beadás előtt és után) fényképes dokumentáció készítése szükséges az esetleges oltási reakció megítélése céljából.
A fényképes dokumentációt az inhibitor prophylaxis protokoll koordinátora részére meg kell küldeni.
Fontos hangsúlyozni, amennyiben fentiekben részletezett korai, alacsony dózisú rendszeres inhibitor prophylaxis nem megfelelően történik: pl. i.m. oltás faktor adásával egyidejűleg, műtét - esetleg port behelyezése - nagy adag faktor adásával, 3 napot meghaladó faktorpótlás vérzés esetén, illetve on demand kezelés prophylaxis helyett, a korai gyermekkorban inhibitor megjelenésével kell számolni.
A fent részletezett prophylaxis során minden további 5 expozíciós nap után inhibitor szűrés javasolt.
Az 50. expozíciós nap után a korábban még nem kezelt haemophiliás gyermek prophylaxisa heti 3 x-i faktorpótlással folytatódik. Azok a haemophiliás gyermekek, akiknek gyógykezelése még nem a korai, rendszeres alacsony dózisú prophylaxis szerint kezdődött, az ízületi károsodások megelőzése és az életminőség javítása céljából primer vagy secunder prophylaxisban részesülnek.
Rendszeres, folyamatos prophylaxis (primer vagy secunder)
A - haemophilia:
Ajánlott dózis: 25-50 NE/ttkg hetente 3 x.
B - haemophilia:
Ajánlott dózis: 25-50 NE/ttkg hetente 2 x.
Fontos hangsúlyozni, hogy a dózist a beteg individuális VIII-as, ill. IX-es faktor kinetikájának (felezési idő, recovery) megfelelően úgy kell módosítani, hogy elkerüljük azt, hogy a VIII-as, ill. IX-es faktor aktivitás a következő beadás előtt 2% alá csökkenjen. A célzott szelektív prophylaxis általában rövid idejű vagy epizodikus prophylaxis, mely a vérzés megelőzését szolgálja egy adott magas kockázatú esemény előtt: pl. trauma, sebészet, sporttevékenység, rehabilitáció.
A prophylaxis technikai feltétele a jól kanülálható perifériás véna. Ennek hiányában centrális vénás kanül, ill. port-a-cath beültetésével lehet próbálkozni.(15) Tekintettel arra, hogy mindkettő műtéti beavatkozás, mindenképpen csak az 50. expozíciós nap után ajánlott. Mindkét kanültípus esetén számolni kell részben infectios, részben thromboemboliás szövődmények lehetőségével, mely utóbbi kockázatát különösen növeli a bypass készítmények használata!
Legújabban az A-V fisztulák sikeres alkalmazásáról számolnak be, amelyek kialakítása elsősorban inhibitoros haemophiliás gyermekek szubsztituciója ill. immuntolerancia indukciós (ITI) kezelésében előnyös. (16)
Az inhibitoros haemophilia kezelése
Az inhibitoros betegek kezelésének két fő célkitűzése van:
- Az akut, súlyos vérzéses állapotok, vagy sürgős sebészeti beavatkozások ellátása
- Az inhibitor végleges eltüntetése és immuntolerancia kiváltása (indukálása) vagy legalább az antitest elimináció révén a "high responder "állapot "low responder"-ré való alakítása.
Az akut, súlyos vérzéses állapotok, vagy sürgős sebészeti beavatkozások ellátása
A vérzéses állapotok kezelésénél figyelembe kell venni, hogy nem minden készítmény hatékony valamennyi betegben. A készítmény megválasztását 4 tényező határozza meg: a vérzés súlyossága, a korábbi klinikai válasz, az inhibitor aktuális titere, és a faktorpótlásra adott korábbi anamnesztikus válasz.
Az alacsony inhibitor titerű (< 5 BE/ml) és low responder gyermekek vérzései általában nagy dózisú ("owercoming") plasmaeredetű, vagy rekombináns FVIII / FIX adásával megszüntethetők. Dózis: 50-100 NE /ttkg hetente 2-3-szor.
Ezzel szemben az alacsony inhibitor titerű, de high responder és a magas inhibitor titerű gyermekekben a vérzés eredményes kezelése csak "bypass" - módszerek alkalmazásával lehet, mint a hagyományos és aktivált prothrombin koncentrátumok (APCC inj. FEIBA), valamint a rekombináns aktivált VII-es faktor (rFVIIa inj. NovoSeven). (17,18) A kezelési algoritmust a 6. táblázat tünteti fel.
6. táblázat. Az inhibitoros haemophilia kezelésének algoritmusa (17)
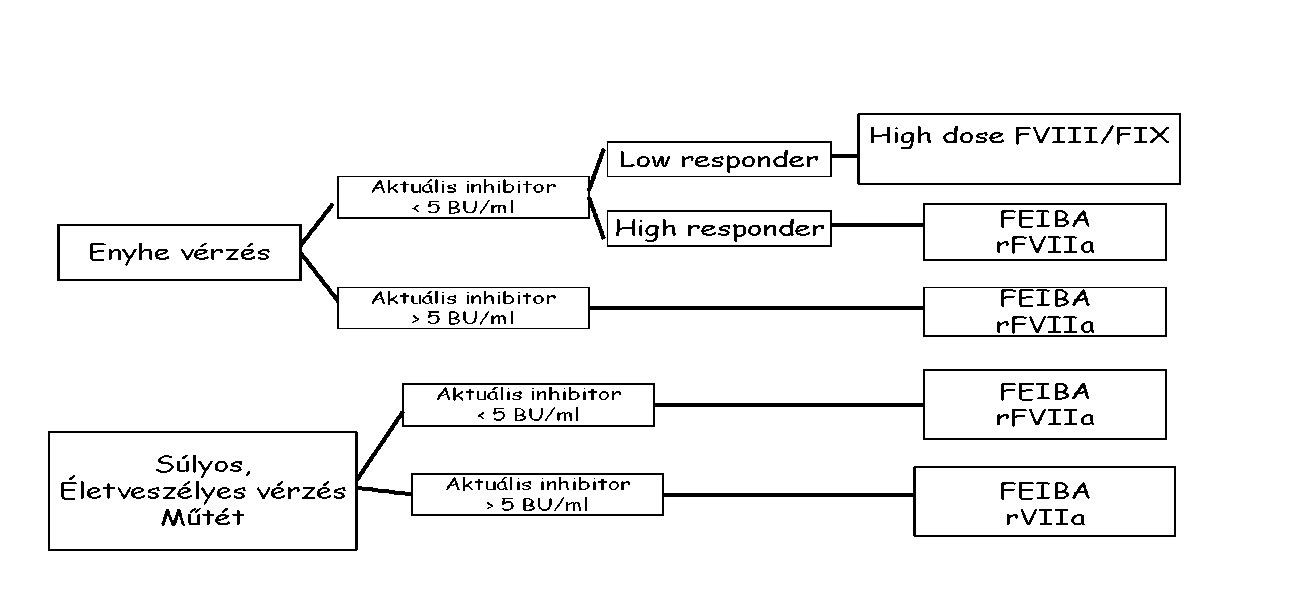
A "bypass" módszerek a thrombin képződés megkerülő útját jelentik. Hatásmechanizmusokban közös, hogy a létrejövő thrombin generáció nem függ az inhibitorok (gátlótestek) jelenlététől.
Factor Eight Inhibitor Bypassing Activity (FEIBA) aktivált prothrombin komplex koncentrátum. Azonnali thrombin generációt eredményez aktivált alvadási faktortartalma (FIX, FX, FVII, prothrombin) révén. A bypassing aktivitásban a legfontosabb a prothrombin és a FXa. A FEIBA egyidejűleg több különböző helyen hat, és ennek a multifaktoriális hatásnak köszönhetően alacsony dózisban 12-24 órás hatás érhető el. (19)
Terápiás dózis: 50-100 E/ttkg 6-12 óránként, maximális napi dózis nem haladhatja meg a 200 E/ttkg adagot.
A FEIBA nyomokban FVIII-at is tartalmaz, így adását követően anamnesztikus válasszal kell számolni, mely azonban a FEIBA terápiás hatékonyságát nem befolyásolja.
A NovoSeven® (rFVIIa) az érsérülés helyén fejti ki hatását, ahol a szöveti faktor megjelenik és az aktivált thrombocyták találhatók. A rFVIIa szöveti faktorhoz kötődése kis mennyiségű thrombin képződéshez vezet. A NovoSeven® farmakológiai dózisban közvetlenül aktiválja a X-es faktort az aktivált thrombocyták felszínén, és ugrásszerűen növekvő thrombin képződést eredményez, amely stabil véralvadék kialakulásához, és a vérzés megállításához vezet. Terápiás dózis: 90 ug/ttkg 2-3 óránként általában 3 alkalommal.
Hangsúlyozni kell azonban, hogy az adagolás és az alkalmazás módja függ a vérzés helyétől, súlyosságától és az életkortól.
Gyermekkorban a rövidebb féléletidő és a gyorsabb clearens miatt nagyobb rFVIIa dózis vagy gyakoribb adás válhat szükségessé.
A dózis ismétlés a vérzés klinikai javulásának eléréséig szükséges. (20)
A dózis intervallum csökkentése céljából adható "high -dose" bolusban is.
Dózis:270 ug/ttkg bolus (ez gyermekkorban kevésbé ajánlott)
Fontos, hogy a vérzés fellépte után a beteg az első NovoSeven injekciót azonnal (de legalább is 1 órán belül) megkapja. Fontos hangsúlyozni, hogy egyes egyénekben az APCC, másokban a rFVIIa hatékonyabb. Hatástalanság esetén váltás indokolt, ezért fontos, hogy mindkét készítmény rendelkezésre álljon az ellátó centrumokban. A gyakran vérző betegek mindkét készítményre rosszabbul reagálnak.
Súlyos életveszélyes (elsősorban központi idegrendszeri vagy végtagot veszélyeztető) vérzések esetén - amikor mindkét bypass készítmény maximális dózisban és gyakoriságban való alkalmazása ellenére nem sikerült hatékony vérzéscsillapítást elérni - szükségessé válhat kombinált szekvenciális terápia alkalmazása is, mely az APCC, ill. rFVIIa együttes adását jelenti 6 óránként alternálva (leggyakoribb alkalmazási mód). (21)
A bypass-készítmények hatékonysága biztonsággal nem jósolható meg, nem monitorizálható, egyes esetekben thromboemboliát okozhatnak. Különösen érvényes ez a kombinált szekvenciális kezelés esetére, mely csak intézeti körülmények között, véralvadási zavar kezelésében jártás szakember felügyelete mellett végezhető. Fontos, hogy a legalább napi egyszeri fizikális vizsgálat mellett laboratóriumi háttér is rendelkezésre álljon DIC vagy thrombosis irányába történő vizsgálatokhoz.
A nem inhibitoros haemophiliás gyermekek folyamatos, rendszeres prophylaxisának a muscolosceletalis rendszerre és az életminőségre gyakorolt rendkívül kedvező hatásai alapozták meg az inhibitoros haemophiliások rendszeres FEIBA prophylaxisának igényét mind gyermek, mind felnőttkorban. A prophylaxis szükségességét támogatja a European Study on Orthopaedic Status vizsgálat következtetése is, mely szerint az inhibitoros haemophliásokban - szemben a nem inhibitoros betegekkel - több a mozgásszervi szövődmény, gyakoribb az ízületi fájdalom, segédeszköz használat és kórházi kezelés, továbbá az ízületek mozgásterjedelmének beszűkülése.
A FEIBA prophylaxis minden esetben szekunder prophylaxist jelent. Időtartama szerint hosszú idejű és rövid idejű prophylaxis különíthető el.
Hosszú idejű, szekunder FEIBA prophylaxis megkezdése az alábbi esetekben javasolt: (22)
- életminőséget jelentősen rontó, gyakori spontán ízületi vérzések
- bypass készítmény gyakori adását igénylő, jelentős muscolo-skeletális vérzés vagy
- életveszélyes vérzés (intracraniális, intraabdominális, intrathoraracalis)
- sikertelen ITI-hez társuló, perzisztáló inhibitorok jelenléte vagy
- ITI-t nem vállaló betegek
FEIBA dózis, ill. dózis intervallum FEIBA prophylaxis során
- Kezdő dózis: 50 E/ttkg hetente 3-szor 12 héten keresztül
Ezt követően a beteget ellenőrizni kell és a hatékonyság (= terápiás válasz) függvényében a dózist módosítani kell.
Kritériumok:
Jó terápiás válasz:
- legalább 50%-os csökkenés a vérzések gyakoriságában és /vagy
- az életminőség szignifikáns javulása
Részleges terápiás válasz
- vérzéses epizódok számának csökkenése: > 50% és vagy
- nincs jelentős életminőség javulás
Jó terápiás válasz esetén a prophylaxist változatlan dózisban javasolt folytatni további 12 héten keresztül, melyet újabb ellenőrző vizsgálat követ a hatékonyság megítélésére.
Ha a kezdeti FEIBA terápiára a válasz csak részleges, a FEIBA dózisát emelni kell.
FEIBA dózis: 85 E/ ttkg hetente 3-szor,vagy másnaponta (ha szükséges) 12 héten keresztül.
Ha ez a további 12 hetes kezelés jó terápiás választ eredményez, a kezelést változatlanul ebben a dózisban kell folytatni 12 hétig, majd a beteget ellenőrizni kell.
Amennyiben azonban a válasz csak részleges, és vérzések főként azokon a napokon lépnek fel, amikor a beteg FEIBA adásban nem részesül, változatlan dózis mellett a FEIBA adás gyakoriságát növeljük. FEIBA dózis: 85 E/ttkg/naponta
Ha ez az emelt dózisú és gyakoriságú FEIBA prophylaxis jó terápiás válasszal jár, a kezelést ebben a formában változatlanul folytatjuk.
Részleges terápiás válasz esetén, egyéni megítélés alapján a FEIBA prophylaxis adagját maximum 100 E/ttkg/ nap dózisig emelhetjük.
Amennyiben ezzel a dózissal sem jön létre jó terápiás válasz, a FEIBA prophylaxist el kell hagyni, és más terápiás lehetőségben kell gondolkodni. A terápiás algoritmust a 7. táblázat tünteti fel. A FEIBA prophylaxis alatt 12 hetente inhibitor szűrés indokolt.
Rövid idejű FEIBA prophylaxis:
Megkezdése elsősorban azokban az inhibitoros haemophiliásokban javasolt, akikben target ízület vagy jelentős lágyrész haematoma (m.psoas) alakult ki nem kifejezett újravérzéssel. FEIBA dózis: 50-100 E/ttkg hetente 3-szor 4-12 héten keresztül
A kezelést akkor javasolt abbahagyni, ha vérzéses tendencia teljes regressziója következett be. Hasonló kezelési mód választandó sebészeti beavatkozásokhoz is.
Fontos: A FEIBA óvatosan adandó magas BMI (> 30) indexű kövérekben, vagy azokban, akikben fokozott az artériás vagy vénás thrombosis kialakulásának rizikója.
7. táblázat. FEIBA prophylaxis algoritmusa
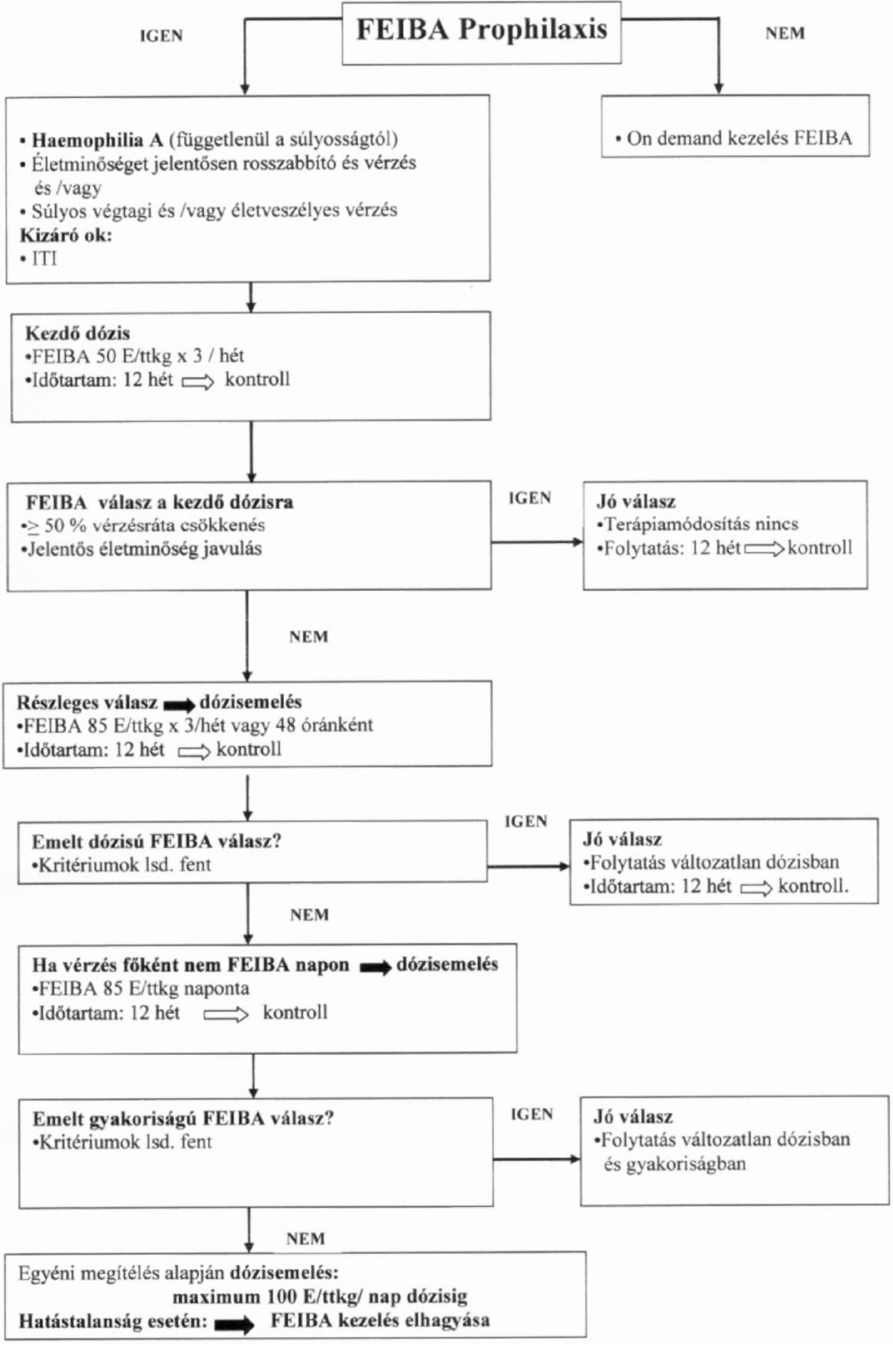
Immuntolerancia indukció, prophylaxis immuntolerancia indukció alatt
Az inhibitor kialakulása a legsúlyosabb szövődmény a haemophilia kezelése során.
Az inhibitor jelenléte a mortalitást nem emeli, de a kezelés lényegesen bonyolultabb a gyakori vérzéses epizód miatt, mivel standard folyamatos prophylaxis a kezelés eredménytelensége miatt nem végezhető.
A magas titerü inhibitorral bíró betegek esetén emelkedik a kontrollálhatatlan vérzések száma, és az ismételt vérzések az ízületek pusztulásához vezetnek.
A kockázatok csökkentése és az életminőség javítása érdekében az acut vérzés ellátásán kívül az inhibitoros betegnél elsőrendű
feladat az inhibitor közömbösítése. Ez az immuntolerancia indukcióval (ITI) kísérelhető meg.
Cél az inhibitor eliminálása és a hiányzó véralvadási faktor normális farmakokinetikájának helyreállítása.
Ajánlás az immuntolerancia indukció elkezdéséhez súlyos A - haemophiliában (23)
- Az ITI elkezdésének halasztása javasolt addig, amíg az inhibitor titere 10 BE/ml alá csökken
- A várakozási idő rendszerint rövid, és a gyermekek többsége még nagyon fiatal az ITI indításakor
- A várakozási periódus alatt az ellenanyag szint szoros monitorozása szükséges, hogy megfelelő titer esetén az ITI azonnal
elindítható legyen
- A várakozási idő alatt VIII-as faktor készítményt nem szabad alkalmazni
- Megfontolandó az ITI elkezdése, tekintet nélkül az inhibitor titerre
- - ha az inhibitor titer nem esik 10 BE alá a szoros observatio 1-2 éves periódusa alatt
- súlyos - életet vagy végtagot fenyegető - vérzés gyakorisága esetén
FVIII dózisa
A betegek két csoportra oszthatók:
Jó kockázatú csoportba tartozó betegek
- historicus legmagasabb inhibitor titere <200 BE
- ITI elkezdése előtt az inhibitor < 10 BE
- az inhibitor kialakulása és az ITI elkezdése között eltelt idő <5 év
Rossz kockázatú csoportba tartozó betegek
- historicus legmagasabb inhibitor titer > 200 BE
- ITI elkezdése előtt az inhibitor > 10 BE
- az inhibitor kialakulása és az ITI elkezdése között 5 évnél hosszabb idő telt el
Az ajánlott dózisok a különböző protokollok szerint változnak. A magas dózisú Bonn protokoll szerint javasolt dózis 150 NE/ttkg FVIII naponta 2 x. Az alacsony dózisú Creveldprotokoll 25 NE/ttkg FVIII adását javasolja másnaponta. E kettő között különböző ajánlások vannak, a dózis 50-200 NE/ttkg/nap lehet.
Az immuntolerancia sikeressége és a dózis nagyságának összefüggése nem egyértelmű. ITI megkísérelhető alacsony adagú FVIII. készítménnyel, de a rossz rizikó csoportba tartozó betegeknél a 200 NE/ttkg/nap adag ajánlott.
FVIII készítmények
- Az ITI sikeres lehet Willebrand faktort tartalmazó és nem tartalmazó készítménnyel is
- Nincsenek adatok arra, hogy valamelyik FVIII készítmény hatásosabb lenne, mint a többi
- A betegek többsége tolerálja azt a készítményt, amelyet az inhibitor kialakulása idején kapott. Nincs evidencia arra, hogy az ITI -ben készítményt kell cserélni.
Immuntolerancia alatti prophylaxis
- A prophylaxis megfontolandó, ha a beteg gyakran vérzik az ITI-re való várakozás illetve az ITI ideje alatt
- rFVIIa 90-270 ug/ttkg naponta adandó a várakozás ideje alatt, amíg az inhibitor 10 BE alá csökken
A várakozási idő alatt a FEIBA adása kerülendő, miután FVIII tartalma (nyomokban) anamnesztikus választ eredményezhet.
- ITI ideje alatt FEIBA prophylaxis alkalmazandó különösen korai ízületi - vagy intracranialis vérzés esetén
Dózis: 50-200 E/ttkg/nap hetente 2x
- A FVIII recoveryt monitorizálni kell, amikor az inhibitor 10 BE-re csökken
- A megfelelő FVIII recovery esetén a bypass terápia megszüntethető.
Általános ajánlások
A kezelés perifériás vénán vagy centrális vénakatéteren keresztül történhet. Ez utóbbira gyakran van szükség fiatal
gyermekeknél, különösen ha a kezelés magas dózisú protokoll szerint történik.
Az ITI terápiát nem szabad megszakítani, ezért alapvető fontosságú a megfelelő vénabiztosítás!
Immuntolerancia indukcióra adott részleges vagy hiányzó válasz
- Az az idő, amely alatt az ITI sikeres lehet rendkívül változó, néhány hónaptól két vagy több évig is terjedhet
- Próbálkozni lehet a dózis emelésével, ha korábban alacsony dózisú protokollt használtunk
- Cserélhető a rekombináns készítmény Willebrand faktort is tartalmazó (FVIII/VWF) készítményre
- Megkísérelhető rituximab vagy más immunmodulans alkalmazása
Az immuntolerancia indukció eredménye
Farmakokinetikai paraméterek alapján sikeres, ha
- Az inhibitor titer <0,6 BE
- Normál FVIII recovery > 66%
- Normál FVIII féléletidő > 6 óra 72 órás kimosási periódus után
Farmakokinetikai paraméterek alapján részlegesen sikeres, ha
- Az inhibitor titer < 5BE
- FVIII recovery <66 %
- FVIII féléletidő < 6 óra
- FVIII adására klinikai válasz van
- Az inhibitor titer nem emelkedik 5 BE fölé 6 hónapos on demand kezelés vagy 12 hónapos prophylaxis után Farmakokinetikai eredmények rosszak, ha a teljes vagy a részleges siker kritériumai 33 hónapon belül nem teljesülnek. Amennyiben az immuntolerancia indukció sikeres, a prophylaktikus dózis eléréséig a FVIII dózisát fokozatosan (legalább 6 hónap) kell csökkenteni. (23,24)
Immuntolerancia indukció enyhe A - haemophiliában
Inhibitor megjelenése lényegesen ritkább, mint súlyos A - haemophiliában.
Az inhibitor kialakulására jellemző a családi predispozicio és nagy rizikójú FVIII gén mutáció, amely funkcionális FVIII defektust eredményez.
Többnyire műtét, és az ezzel járó ismételt (nagy dózisú) FVIII terápia után alakul ki az inhibitor.
Az enyhe haemophiliások inhibitora - hasonlóan a szerzett haemophiliások autoantitestjéhez - rosszabbul reagál az ITI kezelésre, mint a súlyos haemophiliásokban kialakult inhibitor.
Immuntolerancia indukció B - haemophiliában
Átlagosan a betegek 3%-ban (1-6%) fordul elő csupán inhibitor, de ezek több mint 80%-a "high responder". FIX adása után gyakran alakul ki súlyos anaphylaxiás reakció és nephrosis syndroma. Mindezek alapján az ITI kezelés nem ajánlott B - haemophiliában.
IV. Rehabilitáció - V. Gondozás
Veleszületett vérzékenység gyanúját felismerő orvos köteles a legközelebbi, vérzékeny betegek ellátására szakosodott intézményhez (pl. Országos Haemophilia Központ, Regionális Haemophilia Központok) fordulni. A diagnosztikát az arra alkalmas, akkreditált laboratórium, a kezelést az adott intézmény haematologus szakorvosa (kezelőorvos) végzi. A készítmény bejuttatása a kezelőorvos feladata és felelőssége.
VI. Irodalomjegyzék
1. Oldenburg J, Pavlova A: Genetic risk factor for inhibitors VIII and IX. Haemophilia 2006; 12: Suppl 6:15-22.
2. Gudelines for the Management of Hemophilia. World Federation of Hemophilia, 2005.
3. Wight J, Paisley S: The epidemiology of inhibitors in haemophilia A: a systematic review. Haemophilia 2003; 9: 418-435.
4. Astermark J: Inhibitor development: patient-determined risk factors. Haemophilia. 2010; 16: 66-70.
5. Gouw SC, van der Born J, van der Berg HJ, for the CANAL Study group: Treatment-related risk factors of inhibitor development in previously untreated patients with hemophilia A: the CANAL cohort study: Blood 2007;109:4648-4654.
6. Astermark J et al: Non-genetic risk factors and the development of inhibitors in haemophilia: a comprehensive review and consensus report. Haemophilia 2010; 16:747-766.
7. Nilsson IM et al: Twenty-five years experience of prophylactic treatment in severe haemophilia A and B. J Intern Med 1992;232:25-32.
8. Manco-Johnson MJ et al: Prophylaxis versus episodic treatment to prevent joint disease in boys with severe hemophilia. N Engl J Med 2007;357:535-544
9. Chambost H et al: Changing pattern of care of boys with haemophilia in western European centres. Haemophilia 2005; 11: 92-9.
10. Berntorp E et al. Modern treatment of haemophilia. Bull World Health Organ 1995; 73: 691-701.
11. Coppola A et al: Prophylaxis in people with haemophilia. Thromb Haemost 2009; 101: 674-81.
12. Kurnik K et al: Meeting Report: Ninth and Tenth Workshops of the European Paediatric Network for Haemophilia Management (PedNet). Haemophilia. 2007; 13: 658-662.
13. Kurnik K et al: New early prophylaxis regimen that avoids immunological danger signals can reduc a FVIII inhibitor development. Haemophilia 2010;16: 256-262.
14. Valentino LA et al: Central venous access devices in hemophilia. Haemophilia 2004; 10: 134-46.
15. Mancuso ME, Berardinelli L: Arteriovenous fistula as stable venous access in children with severe haemophilia. Haemophilia 2010; 16 (Suppl.1.): 25-28.
16. Hay CRM et al: The diagnosis and management of factor VIII and IX inhibitors: a guideline from the United Kingdom Haemophilia Centre Doctors Organisation. Br J Haemat 2006; 133: 591-605.
17. Santagostino E et al: Paediatric haemophilia with inhibitors: existing management options, treatment gaps and unmet needs. Haemophilia 2009; 15: 983-989.
18. Négrier C et al. The history of FEIBA: a lifetime of success in the treatment of haemophilia complicated by an inhibitor. Haemophilia 2006; 12 (Suppl. 5.): 4-13.
19. Mathew P, Young G: Recombinant factor VIIa in paediatric bleeding disorders - a 2006 review. Haemophilia 2006; 12: 457-472.
20. Schneiderman J et al: Sequential therapy with activated prothrombin complex concentrate and recombinant factor VIIa in patients with severe haemophilia and inhibitors. Haemophilia 2004; 10: 347-351.
21. Perry D et al: FEIBA prophylaxis in haemophilia patients: a clinical update and treatment recommendations. Haemophilia 2009; 15:1-10.
22. Di Michele et al: International workshop on immune tolerance induction: consensus recommendations. Haemophilia 2007; 13 (Suppl.1): 1-22.
23. Astermark J et al: Current European practice in immune tolerance induction therapy in patients with haemophilia and inhibitors. Haemophilia 2006; 12: 363-371.
THROMBOEMBOLIÁS MEGBETEGEDÉSEK KEZELÉSE CSECSEMŐ- ÉS GYERMEKKORBAN
I. Alapvető megfontolások
1. Az irányelv alkalmazási / érvényességi területe
Csecsemő-, gyermekgyógyászat 0-16 éves kor között
2. Definíció, rövidítések
A thrombophilia (artériás vagy vénás thrombosis kialakulására való fokozott hajlam) alatt gyermekkorban is vagy a természetes anticoagulans rendszerek zavarát, vagy az endogén trombinképződés átmeneti, vagy folyamatos fokozódását értjük. Veleszületett (genetikai, örökletes) és szerzett rizikófaktorai különíthetők el. Az öröklött rizikófaktorok egész életen át működnek, a szerzett rizikófaktorok többsége átmeneti lehet.
3. A betegség/állapot leírása
3.1. Kockázati és kiváltó tényezők Veleszületett thrombophiliák
A gyermekkori örökletes thrombophiliák kóroki tényezői nem különböznek a felnőttkoriaktól (1. táblázat) l. táblázat. A csecsemő- és gyermekkori thromboemboliás megbetegedések örökletes rizikófaktorai
| Antitrombin deficiencia |
| Protein C hiány vagy defektus |
| Protein S hiány vagy defektus |
| FV GI69IA Leiden mutáció |
| Protrombin G202I0A Polymorphismus |
| Hyperhomocysteinaemia |
| Dysfibrinogenaemia |
A veleszületett thrombophilia egyes rizikótényezői nem azonos mértékben jelentenek veszélyeztetettséget. Míg az antitrombin hiány, vagy defektus, a protein C, a protein S hiány, a homozigóta FV Leiden mutáció súlyos, addig a FII polymorphismus és a heterozigóta FV Leiden mutáció csupán enyhe rizikótényezőt jelent. Előfordul azonban, hogy egy gyermekben egyszerre több veleszületett károsodás is fennáll, mely - mint kombinált defektus - már súlyos kockázatot jelent. A csecsemő- és gyermekkori thromboemboliákat döntő többségben azonban a veleszületett tényezők mellett egyidejűleg jelenlévő, egy vagy több, szerzett kockázati faktor eredményezi.
Szerzett thrombophiliák
A thrombosisra, thromboemboliára hajlamosító szerzett rizikófaktorok újszülöttkorban, illetve a későbbiek során különböznek egymástól. Az újszülöttkori rizikótényezők részben az anya megbetegedésével, részben az újszülött különböző patológiás állapotaival függenek össze (2. táblázat)
2. táblázat. Az újszülöttkori thromboemboliás megbetegedések szerzett rizikófaktorai
| Anyai okok | Újszülöttkori állapotok |
| Toxaemia | Hypoxia |
| Diabetes mellitus | Infectio |
| Autoimmun betegségek (SLE) | Hyperviscositas |
| HELLP syndroma | Acidosis |
| Hypovolaemia | |
| Hypotonia | |
| Koraszülöttség, méhen belüli sorvadás | |
| Tartós intravascularis katéter |
Az élet későbbi szakaszában, csecsemő- és gyermekkorban, a thrombosishoz vezető okok didaktikai szempontból 3 csoportba sorolhatók aszerint, hogy primeren az alvadási folyamatokat érintik-e, vagy olyan betegségek, patológiás állapotok, illetve terápiás beavatkozások, amelyek a haemostasis egyensúlyát a fokozott thrombosis készség irányába tolják el. (3. táblázat)
3. táblázat. A csecsemő- és gyermekkori thromboemboliás megbetegedések szerzett rizikófaktorai
| Elsődleges véralvadási rendellenességek | Terápiával összefüggők | Betegséggel összefüggők |
| Az anticoagulans proteinek szerzett | Tartós intravascularis katéter | Infectio, sepsis |
| defektusai | (endothel károsodás) | |
| Dehydratio | ||
| Lupus anticoagulans és | Tartós immobilizáció | |
| antiphospholipid-antitest syndroma | Trauma | |
| Nagy műtétek | ||
| Leukaemiák, tumorok | ||
| L-aszparagináz és más kemoterápia | ||
| Nephrosis syndroma | ||
| Oralis anticoncipiensek | ||
| (serdülőkorú lányok) | Autoimmun betegségek (SLE, JRA) | |
| Cyanosissal járó vitiumok |
A szerzett rizikótényezők jellemzője, hogy gyakran közös kóroki tényezőkre vezethetők vissza: érfali sérülések, kóros véráramlás, hypercoagulabilitás. Az endothel károsodás elsősorban endovascularis beavatkozások következményeként - leggyakrabban tartós intravascularis kanül használatából - alakulhat ki, mely a leggyakoribb thrombosisra hajlamosító szerzett rizikótényező gyermekkorban.
Endothel károsodást eredményeznek a különböző gyulladásos folyamatok is. A középfülben lezajló gyulladások gyermekkorban az agyi vénás sinusok thrombosisának okozói lehetnek.
A stasis leggyakrabban tartós immobilizáció vagy paralysis következménye, azonban dehydratio, gyulladások, egyes gyermekkori daganatok, kemoterápia, valamint hyperviscositással járó állapotok kapcsán is számolni kell kórosan meglassult véráramlással. Gyermekkorban leggyakrabban a cyanosissal járó szívbetegségek, chronicus myeloid leukaemia, valamint a magas abszolút blast számmal járó acut lymphoid leukaemiák társulnak hyperviscositással.
3.2. Incidencia, morbiditás, jellemző életkor
A thromboemboliás megbetegedések előfordulása - szemben a felnőttkori esetekkel -csecsemő- és gyermekkorban ritka, de számuk emelkedni látszik. A kórlefolyás ugyanakkor sokkal súlyosabb lehet, mint felnőttkorban. A betegség minden életkorban jelentkezhet, de halmozódásával - a 0-18 éves korosztályt tekintve - leggyakrabban újszülöttkorban, serdülőkorban (12-16 év), kell számolni.
Életkori sajátosság, hogy a véralvadás természetes inhibitorainak veleszületett hiánya - a homozigóta PC és PS hiány okozta purpura fulminanst kivéve - valamint az orális fogamzásgátlás, fizikai megterhelés és sérülések (szerzett tényezők) - döntően a pubertáskorban jelentkező vénás thromboembolia (VTE) kiváltói. Újszülöttkorhoz kötött jellegzetesség több speciális anyai megbetegedés és újszülöttkori patológiás állapot mint szerzett rizikótényező. A gyermekkori VTE incidenciája elsősorban kanadai és amerikai szerzők munkája nyomán ismert. A kanadai adatok szerint az 1-18 év közötti korosztályban az incidenciát 0,7-1,4/100.000 gyermek, ill. míg az USA adatok szerint 4.9/100.000 gyermek/év. Életkor szerinti megoszlásban az előfordulást az alábbiakban adják meg: <2 év 10.5/100 000 gyermek/év >15 év 11.4/100 000 gyermek/év 2-14 év 2.4/100 000 gyermek/év
Az újszülöttkori, tünetekkel is járó mélyvénás thrombosis incidenciáját a gyermekkorban felismertekkel összehasonlítva
háromszorosára becsülik: 5,1 / 100.000 születés.
Hazai adatok csak az újszülöttkori VTE incidenciára ismertek:
5-10/100.000 születés. A későbbi életkorra vonatkozó adatok nem állnak rendelkezésre.
3.3. Érintett szervrendszerek, panaszok, tünetek, általános jellemzők
Gyermekkori vénás thrombosisok
A vénás thromboemboliás megbetegedések - bár gyakoriságuk jóval kisebb a felnőttkorhoz viszonyítva - jelentős morbiditási és mortalitási tényezőt képviselhetnek. Döntően végtagi (elsősorban alsó végtag) lokalizációban lépnek fel és fő veszélyük a pulmonalis embolia. A végtagi érintettség mellett külön jelentősége van a központi idegrendszer vénás sinusaiban kialakuló thrombosisnak, mely elhelyezkedése révén nem csak maradandó károsodást eredményezhet, de életveszélyes állapot hordozója is.
Mélyvénás thrombosis és pulmonalis embolia
A gyermekkori mélyvénás thrombosisok döntő többsége (több mint 50%) tartós centrális vénás katéter (CVC) használat következménye, elsősorban a felsővégtagi vénákat érintik, és kialakulásuk nem függ a katéter használat időtartamától. Akut és krónikus klinikai tünetek formájában jelentkezhetnek. Az akut tünetek (duzzanat, fájdalom, elszíneződés, arc-fej duzzanat, légzési zavarok, v.cava suprior syndroma) leggyakoribb oka CVC elzáródás.
A krónikus tüneteket is - legtöbbször thrombolysist igénylő - ismételt CVC elzáródás eredményezi. Típusos tünetek a kollaterális vénás hálózat (mellkas, nyak, arc), katéter sepsis, chylothorax, chylopericardium, postthromboticus syndroma (különösen újszülöttkorban).
A modern, intenzív terápiás beavatkozások fejlődése mind újszülöttkorban, mind csecsemő- és gyermekkorban - különösen a hosszas, tartós kezelést igénylő krónikus betegségekben - megnöveli a CVC alkalmazásának szükségességét. A tartós kanül használat előnyei mellett így számolni kell a vénás thromboemboliák incidenciájának növekedésével.
Agyi sinus venosous thrombosis
Jelentős morbiditási tényező, gyakran életveszélyes állapottal. A betegség jellegzetes klinikai tünetegyüttes formájában akutan jelentkezik: fejfájás, hányinger, hemiparesis, convulsio, majd tudatzavar (stupor vagy coma). Kialakulásában gyermekkorban fontos szerepet játszanak a melléküregek és középfül gyulladásos folyamatai, fejsérülés, malignitások (elsősorban ALL). Ritkábban szívfejlődési rendellenesség, autoimmun betegség, vesebetegség oralis anticoncipiens szedés lehet a kiváltó tényező. A thrombosis kialakulásának kedvez az agyi vénás rendszer anatómiai felépítése (merev, trabeculált sinusok) és funkcionális sajátossága is. A betegség gyógykezelésében döntő fontosságú a kiváltó ok megszüntetése, valamint az antithromboticus terápia.
Gyermekkori artériás thromboemboliás megbetegedések
Az artériás thrombosisok kialakulása gyermekkorban leggyakrabban vascularis katéter használatának következménye (szívkatéterezés, perifériás artériákba helyezett katéter). Artériás thrombosis ritkán katéter használat nélkül is kialakulhat Takayasu arteritisben, coronaria aneurysmákban vagy szervtranszplantáció során az átültetett szerv artériáiban. Másodlagos következménye lehet a Kawasaki betegségnek, egyes congenitalis vitiumoknak, és az artériás erek helyi sérülésének vagy embolusának.
Antiphospholipid-antitest syndroma
Az antiphospholipid-antitest syndroma gyermekkorban vénás és artériás thrombosisok (stroke) formájában egyaránt előfordul. A thrombosisok kialakulását az antiphospholipid-antitestek okozzák, melyek különböző autoimmun betegségekhez - elsősorban szisztémás lupus erythematosus (SLE) - társulnak, de önállóan is előfordulnak. Nem veleszületettek, hanem szerzettek, és autoimmun eredetűek.
Az autoantitestek olyan antigén ellen termelődnek, melyet fehérje (fo glikoprotein) és anionikus phospholipid komplex alkot. Kötődni tudnak az endogén trombin generációban szerepet játszó "protrombináz-komplex" phospholipid részéhez, így az APTI, ill. protrombinidő megnyúlását eredményezik.
Az antiphospholipid-antitestek által kiváltott tünetek hozzák létre az antiphospholipid-antitest syndromát, mely primer és
- egyéb betegségekhez társultan - secunder megbetegedés is lehet.
II. Diagnosztika
1. Anamnézis
Veleszületett thrombophilia lehetősége az alábbi esetekben merül fel:
- Pozitív családi kórelőzmény
- Feltűnően fiatal életkorban jelentkező thromboembolia
- Visszatérő thromboemboliás epizódok
- Szokatlan lokalizációjú/multiplex thrombosis (hasüreg, központi idegrendszer)
- Cumarin necrosis (PC, PS hiány)
- Neonatalis purpura fulminans (homozigóta PC vagy PS hiány)
2. Laboratóriumi vizsgálatok
A VTE laboratóriumi kivizsgálása- csecsemő-gyermekkorban is - az igazolt hajlamosító tényezők vizsgálatán alapul.
Vénás thromboemboliák igazolt hajlamosító tényezői: antitrombin, PC, PS, FV (Leiden), FII20210A, APC rezisztencia,
dysfibrinogenaemia, hyperhomocysteinaemia és lupus anticoagulans (LA)/anticardiolipin antitestek (ACA).
Artériás thrombosisok igazolt hajlamosító tényezői: dysfibrinogenaemia, hyperhomocysteinaemia, LA és ACA.
A gyermekgyógyászati gyakorlatban azonban fontos megkülönböztetni indokolt, terápiás konzekvenciával bíró, ill. felesleges, terápiás konzekvenciával nem, vagy kismértékben bíró vizsgálatokat.
Indokolt, therápiás konzekvenciával bíró vizsgálatok:
- APC- rezisztencia (lehet átmeneti)
- FV Leiden mutáció
- Protrombin G20210A mutáció
- Plasma homocysteinszint
- Antifoszfolipid-antitestek (LA és ACA)
- Protein C (funkcionális assay)
- Protein S (funkcionális assay), csak a szabad PS antigennel értékelhető
Felesleges, terápiás konzekvenciával nem bíró vizsgálatok:
- 5-MTHFR mulokuláris vizsgálat
- Lp(a)
- Plasminogen
A thrombophilia vizsgálatok helyes értelmezhetősége miatt fontos a mintavétel időpontja. Azonosan a felnőttkori megbetegedésekkel, akut thrombosisban szenvedő gyermekben ne végezzünk kivizsgálást. A mintavétellel legalább 3 hónapot (esetenként többet is) várni kell, mindaddig, amíg a vizsgálatokat befolyásoló egyéb tényezők (CRP, vvt süllyedés) normalizálódnak. Fontos: Cumarin terápia alatt a PC, PS tesztek nem megítélhetők, így amennyiben a gyermek anticoaguláns kezelésre szorul, a thrombophilia vizsgálatok idejére a cumarin therápiát el kell hagyni, és LMWH-ra kell áttérni. A nem genetikai vizsgálatokon alapuló örökletes thrombophilia diagnózisa akkor állítható fel, ha azt 3 alkalommal, egymástól időben több hétre levő ismételt mintavételből igazolni lehet. A molekuláris genetikai vizsgálat bármikor elvégezhető és ismétlést nem igényel, 1 vizsgálat elegendő.
3. A vénás thromboembolia diagnosztikája
VTE klinikai gyanúja esetén elvégzendő: D-dimer meghatározás + (color) duplex ultrahang lineáris és convex fejjel (CD) történő vizsgálata. A D-dimer meghatározást a VTE kizárására használjuk. A D-dimer vizsgálatra többféle módszer áll rendelkezésre. A "pozitivitás" meghatározása a vizsgálatot végző laboratórium által, az adott reagens specifikációja alapján történik.. Az ún. nagyon érzékeny tesztek szenzitivitása közel 100%, ezért negatív előjelző értéke nagy, viszont a specificitása kicsi, ez utóbbi következménye, hogy nem thromboemboliás folyamatokban is pozitív eredményt kaphatunk pl. gyulladás, daganatos betegség. Így a klinikai gyanú nélkül, "szűrőjelleggel" végzett D-dimer meghatározás eredményének nincs relevanciája, elvégzésük indokolatlan és fölösleges. Mivel a D-dimer a VTE fellépte után néhány nappal negatívvá válhat, ha bármelyik képalkotóval igazolható a thrombosis, kezelés szükséges. A közepes-nagy érzékenységű D-dimer-tesztek szenzitivitása 85-98%, negativitásuk azonban nem elégséges a VTE kizárására. Amennyiben a klinikai kép indokolja, a vizsgálatot 24 óra múlva ismételni kell. Fontos hangsúlyozni, hogy a képalkotó vizsgálatok értéke jelentősen meghaladja a D-dimer prediktív értékét, hiszen a képalkotó pozitivitása esetén akkor is kezelés indokolt, ha a D-dimer negatív.
Ugyanakkor, ha csak a D-dimer pozitív, a CD viszont az egész vénás rendszer területén megbízhatóan negatív, nem szükséges kezelni.
Pulmonális embolia klinikai gyanúja esetén elsődleges az embolia forrás keresése color duplex ultrahang lineáris és konvex fejjel történő vizsgálattal. Újszülött-, és kisgyermekkorban mellkas CT vizsgálat ill. különösen tüdő scintigraphia nem az elsődlegesen választandó eljárás. Nagyobb gyermekek vagy fiatal felnőttek esetén azonban a klinikai eljárás azonos a felnőttekével, melyet a
4. táblázat foglal össze.
4. táblázat. Vénás tromboembolia diagnosztikai algoritmusa (forrás: A Thromboemboliák kockázatának csökkentése és kezelése. Az Egészségügyi Minisztérium Szakmai Irányelve. 2010.
| Klinikai gyanújelek (fájdalom, dyspnoe, tachycardia, tacyhapnoe, vérköpés stb.) | Laboratórium (D-dimer, kiegészítőként: pO2, pCo2) | Képalkotók (CD, ms-CT, TTE, TEE, tüdő scan, mellkasröntgen) | Antikoaguláns kezelés indikálása |
| MVT | D-dimer + | CD + | Igen |
| D-dimer - | CD + | Igen | |
| CD - | Nem | ||
| PE | D-dimer + | ms-CT, TTE, TEE tüdő-scan, CD: | Igen |
| D-dimer - | bármelyik pozitivitása esetén | ||
| D-dimer + | ms-CT, TTE, TEE, tüdő-scan, CD: | Nem | |
| negativitása esetén |
III. Gyermekkori antithromboticus kezelés
1. Gyógyszeres kezelés
A gyermekkori profilaktikus és terápiás antithromboticus kezelés különbözik a felnőttkori thromboemboliák kezelésétől. A terápia különbözőségét az újszülött- és gyermekkori véralvadási rendszer felnőttől eltérő működése és az antithromboticus terápiára adott válasz különbözősége határozza meg. Ezzel magyarázható, hogy újszülött-, gyermekkorban a kezelést és a profilaxist tekintve, sokkal kevesebb bizonyítékon alapuló tényre támaszkodhatunk. A megelőzésre, ill. kezelésre vonatkozó ajánlási szinteket az 5. táblázat tartalmazza:
Az 1.A,B,C,szint esetén a várható előny jelentősen meghaladja a potenciális hátrányokat. Megalapozottan, egyértelműen ajánlott, költséghatékony.
A 2.A,B,C szint esetén az anticoaguláns kezelés általánosságban ajánlott, azonban alkalmazása alapos elemzést igényel, esetenként más megoldás is meggondolandó.
Az 1A szint kivételével a többi szinten ajánlott beavatkozás mellett vagy helyett más megoldás is elfogadható, sőt esetenként az 1A ajánlástól is el lehet térni, de ennek elengedhetetlen feltétele: a döntést az ajánlás ismerétében, az attól való eltérést kellő súlyú érvekkel alátámasztva és dokumentálva kell meghozni!
5. táblázat. A megelőzésre, ill. a kezelésre vonatkozó ajánlási szintek (A Thromboemboliák kockázatának csökkentése és kezelése. Az Egészségügyi Minisztérium Szakmai Irányelve. 2010. szerk: Pfiegler György)
| Ajánlás | Az ajánlás alapjául szolgáló bizonyíték | Ajánlás érvényessége |
| 1A Erős, elsőrangú bizonyítékon alapuló erősen javallt | Alapja: jól megtervezett, jól kivitelezett, randomizált klinikai tanulmányok (RKT) egyértelmű eredményei vagy megfigyeléseken alapuló, de kivételesen erős bizonyíték | Legtöbb betegre, legtöbb esetben érvényes; nagyon valószínűtlen, hogy újabb vizsgálatok adatai ellentétes következtetésre vezetnének |
| 1B Erős- közepes minőségű bizonyítékon alapuló erősen javallt | Korlátozott értékű RKT-k (pl. nem következetes eredmények, metodikai hiányosságok stb.) eredményei vagy megfigyelésekkel nyert, de igen erős bizonyíték | Legtöbb betegre, legtöbb esetben érvényes; újabb, jobb minőségű kutatások eredményei jelentősen módosíthatják az ajánlást, ill. annak szintjét |
| 1C Gyenge vagy igen gyenge minőségű bizonyítékon alapuló, mégis erősen javallt | Megfigyelések, esetismertetések során nyert meggyőző bizonyíték vagy jelentős hiányosságokkal bíró, csak közvetett bizonyítékot adó RKT-k | Legtöbb betegre, számos esetben érvényes, de valószínű, hogy új, jobb minőségű kutatás jelentősen módosítani fogja az ajánlást, ill. annak szintjét |
| Ajánlási szint | Az ajánlás alapjául szolgáló bizonyítékok nyerésének módszere | Ajánlás mértéke |
| 2A jó minőségű bizonyítékon alapuló, mérsékel általánosságban ajánlottten ajánlható | Korlátozások nélküli RKT-k következetes eredménye vagy kivételesen erős bizonyítékot szolgáltató megfigyelés | A beteg és körülményei, a társadalmi megítélés szerint változhat a leghelyesebbnek tartott módszer megítélése; aligha valószínű, hogy további vizsgálatok módosítanák az ajánlás helyét |
| 2B Közepes minőségű bizonyítékon alapuló, mérsékelten ajánlható | RKT-k jelentős korlátokkal (pl. nem következetes eredmények, metodikai hiányosságok stb.); :Erős megfigyeléses tanulmányok | A körülmények, a beteg és a társadalom felfogása különbözhet a leghelyesebb eljárás megítélésében, újabb, jobb színvonalú kutatások eredményei valószínűleg módosítják majd az ajánlást és annak erősségét |
| 2C Gyenge vagy igen gyenge, bizonyíték támasztja alá, mérsékelten ajánlható | Megfigyelések, esetismertetések során nyert meggyőző bizonyíték vagy jelentős hiányosságokkal bíró, csak közvetett bizonyítékot adó RKT-k | Másféle kezelés hasonlóan észszerű lehet; újabb, jobb színvonalú kutatások eredményei valószínűleg módosítják majd az ajánlást és annak erősségét |
A kezelés megválasztásánál a gyermekgyógyászati gyakorlatban elsődlegesen a thrombus nagyságát és elhelyezkedését, a tünetek súlyosságát, az érintett ereket, illetve a terápia okozta potenciális vérzés rizikóját kell megítélni. A fibrinolyticus kezelés (indokolt esetben) a thrombus gyors oldását eredményezi és helyreállítja az érintett ischaemiás szervek perfúzióját. A további thrombosis megakadályozását és recidiváját az azonnali anticoagulans kezelés (heparin /kis molekulatömegű heparin, illetve oralis anticoagulansok) biztosítja.
1.1. Kis molekulatömegű heparin LMWH
Alkalmazása csecsemő-, gyermekkorban sokkal előnyösebb a standard heparinokénál (6. táblázat):
6. táblázat. Kis molekulatömegű heparinok (LMWH) jellemzői
| Kis molekulatömegű heparinok (LMWH) jellemzői |
| S.c. adható |
| Egyenletes felszívódás |
| Általában nem szükséges laboratóriumi monitorizálás |
| Kisebb vérzéskockázat és HIT incidencia |
| Kora-, újszülött és fiatal csecsemőkben is adható |
| Hatása nem függ a táplálkozástól és gyógyszerektől |
| Osteoporosis kialakulása ritkább |
| Rövid és hosszú kezelésre alkalmas |
1.2. Nem frakcionált heparin (UFH) terápia
Az antitrombin koncentrációban megnyilvánuló fiziológiás életkori különbségek továbbá az UFH eltérő farmakokinetikai sajátosságai miatt a gyermekkori heparin terápia - különösen újszülöttekben és koraszülöttekben - eltér a felnőttkorban megszokottól. Mindezekből adódóan a heparin telítő- és fenntartó dózisa gyermekekben magasabb, a felnőttkorban alkalmazott dózisoknál. (6. táblázat) A heparin hatás ellenőrzésére, monitorizálására az APTI-mérést használjuk. Az APTI l,5-2,5-szeresére való megnyújtása a kontroll (referencia) plazmához viszonyítva általában már biztosítja a terápiás szintet.(1C). A megkívánt anticoagulans hatás eléréséhez azonban szükségessé válhat a heparin terápia módosítása is az APTI-hez illesztett dózisban! Fontos, hogy APTI meghatározással a vérvétel a heparin telítő dózisának beadása után 4 órával, majd a fenntartó terápia után minden alkalommal az infúzió sebességének változtatása után 4 órával történjen! Az APTI megnyúlást mindig a referencia értékhez kell viszonyítani! Ha a heparin terápia laboratóriumilag hatástalan, gondoljunk AT defektusra! Újszülöttek, koraszülöttek heparin kezelése során a fiziológiásan csökkent AT aktivitás miatt szükséges az AT pótlás (AT koncentrátum, hiányában FFP).
7. táblázat. Nem frakcionált heparin kezelés gyermekkorban
| Életkor | UFH Telítő dózis | UFH Fenntartó dózis |
| Koraszülött < 28 hét | 25 NE/ttkg | 15 NE/ttkg |
| 28-36 hét | 50 NE/ttkg | 20 NE/ttkg |
| Érett újszülött | 100 NE/ttkg | 25 NE/ttkg |
| < 1 év | 75 NE/ttkg | 28 NE/ttkg |
| > 1 év | 75 NE/ttkg | 20 NE/ttkg |
Koraszülött-, újszülött-, és fiatal csecsemőkorban is adhatók, terápiás és profilaktikus célból egyaránt. Mind a profilaktikus, mind a terápiás dózisok életkorfüggők. A kezelés 12 óránként s.c. adandó. (8. táblázat)
8. táblázat. Kis molekulatömegű (LMWH) kezelés és profilaxis gyermekkorba
| Életkor <l2 hó | Életkor >12 hó-18 év | |
| Terápiás dózis Profilaktikus dózis | 170 antiXa NE kg 12 óránként 75 antiXa NE/kg 12 óránként | 110 antiXa NE/kg 12 óránként 55 antiXa NE/kg 12 óránként |
Monitorizálás általában nem szükséges, de a thrombocytaszámot ugyanúgy ellenőrizni kell, mint UFH adásakor! Tartós kezelés esetén elérendő cél: anti Xa 0,5-1,0 E/ml 4 órával az LMWH beadása után (1C)
Azonosan az UFH kezeléssel, a LMWH hatás is felfüggeszthető protamin-szulfáttal az adást követő 3-4 órán belül. Míg UFH terápia során l mg protamin-szulfát
1 mg (= 100 NE) heparint közömbösít, addig a LMWH-ok neutralizálásához a számított értéknél 30%-al több szükséges. A számított dózist 10 perc alatt lassan, i.v. kell beadni.
1.3. Oralis anticoagulans kezelés
Az oralis anticoagulánsok cumarin származékok, melyek fő hatásmechanizmusa, hogy gátolják a funkcionálisan aktív K-vitamindependens alvadásfaktorok (FII, FVII, FIX, FX) májban történő szintézisét. Széles körben alkalmazottak, de hatásukat több tényező befolyásolja: újszülöttkori K-vitamin-hiány a bifidus flóra kialakulásáig, az anyatej alacsony K-vitamin-tartalma, gyógyszerek, tumorellenes kezelés, per os táplálás és diéta megváltozása, teljes parenterális táplálás, felszívódási zavarok, az életkorral változó véralvadási rendszer, az ellenőrzés nehézsége, individuális hatás.
Az egyes - gyermekgyógyászatban gyakran alkalmazott - gyógyszerek cumarin terápiára gyakorolt hatását a 9. táblázat foglalja össze.
9. táblázat. A kumarin terápiát befolyásoló gyógyszerek
| A kumarin terápiát befolyásoló gyógyszerek | |
| Gyógyszer | Anticoagulans hatás változása |
| Cefaclor | Fokozódik |
| Trimethoprim-sulfamethoxazol | Fokozódik |
| Ranitidine | Fokozódik |
| Prednisone | Fokozódik |
| Aspirin | Fokozódik vagy változatlan |
| Amoxicillin/Erythromycin | Enyhén fokozódik |
| Carbamazepine | Csökken |
| Phenobarbital | Csökken |
A cumarin adását a heparin kezelés 1-2. napján, már bizonyított heparin hatás mellett el lehet kezdeni 0,05-0,1 mg/kg dózissal. A terápiás hatás ellenőrzésére (a felnőttel azonosan) az INR meghatározása szükséges. Elérendő cél az INR 2,0-3,0 közötti tartása. A gyermekgyógyászati gyakorlatban a cumarin hatást befolyásoló számos tényező miatt elsősorban a rövid felezési idejű acenocumarin adása javasolt.
Cumarin terápiában részesülő anya szoptathat, miután a cumarinok nem kerülnek aktív formában az anyatejbe.(IA) Nem kell megszakítani az UFH (1A), LMWH vagy danaparoid adását sem (2C) szoptatás alatt, a készítmények újszülöttre nézve biztonságosak.
1.4. Szisztémás thrombolysis
A gyermekkori antithromboticus kezelésben a thrombolyticus kezelés sohasem az első választandó módszer. Amennyiben mégis thrombolysis alkalmazása válik szükségessé, a thrombolyticus készítmények között az alábbi sorrendben javasolt a szerek megválasztása:
1. szöveti plazminogén aktivátor (tPA)
2. urokináz
1.4.1. Szöveti plazminogén aktivátor
Lokális és szisztémás thrombolysisre alkalmazhatjuk. Adása csak i.v. infúzióban javasolt 0,5 mg/ttkg/óra sebességgel 6 órán keresztül. Az infúzió alatt 20 U/ttkg/óra dózisban heparin adás is szükséges.
Amennyiben a plazminogén szint alacsony, vagy ha a szint meghatározása nem lehetséges 20 ml/kg FFP i.v. adása szükséges 8 óra alatt.
A rekombináns szöveti plazminogén aktivátor gyermekgyógyászati alkalmazásával kapcsolatban még mindig kevés a tapasztalat, így csak thrombolyticus terápiában jártas szakember alkalmazhatja megfelelő monitorizálási feltételekkel ellátott intézetben!
1.4.2.Urokináz
Lokális és szisztémás thrombolysisre alkalmazhatjuk.
Helyi lysis: dózis: 5000-25 000 NE urokináz l ml 0,9%-os NaCl-ben oldatban oldva 30 percenként. Maximális alkalmazási időtartama 2 óra. Szisztémás thrombolysis: telítő dózis 4000 U/ttkg 10 perc alatt, melyet fenntartó kezelés követ 4000 U/kg/óra dózisban 6 órán keresztül. Az urokináz infúzió alatt heparin adás is szükséges, dózisa: 20 U/ttkg/óra. Ha a 6 órás kezelést követően a thrombolysis nem hatékony, alacsony plazminogén szint feltételezhető és mérlegelendő az FFP adása. A thrombolysisre alkalmazott tPA, urokináz terápia esetén a fibrinogén, a trombocytaszám, trombinidő, D-dimer ellenőrzése szükséges! A trombinidő reagensek újabban nem érzékenyek a fibrindegradációs termékekre!
2. Az anticoaguláns kezelés újszülött-, és gyermekkori sajátosságai
2.1. Vénás thromboemboliák kezelése újszülöttkorban
2.1.1. Centrális vénás kanülhöz (CVC) ill. köldökvéna katéterhez (UVC) társuló vénás thromoembolia (VTE)
Mérlegelni kell, hogy a kanül eltávolítható-e vagy a gyógykezeléshez a kanülre még szükség van. Általános irányelv, hogy a kanült csak 3-5 napi anticoagulálást követően célszerű eltávolítani (2C). Az eltávolítás után vagy szoros radiológiai követés vagy azonnali anticoagulálás (2C) javasolt, amennyiben azonban a thrombosis progrediál, mindenképpen anticoagulálás szükséges (1B). Anticoaguláns kezelésre LMWH (2 x naponta, cél antiXa: 0,5-1,0 E/ml) vagy UFH folyamatos infuzió (3-5 napig; cél aPTI 1,5-2,5 vagy antiXa: 0,35-0,7 E/ml,ezt követően LMWH) adható. A kezelés időtartama mind LMWH mind UFH esetén 6-12 hét (2C).
Ha a kanül nem távolítható el, a therápiás dózisú anticoagulálás után, profilaktikus dózisú LMWH adása indokolt mindaddig, amíg a kanül el nem távolítható (2C).
Újszülött,- fiatal csecsemő korban lezajlott thromboembolia után a másodlagos prophylaxis céljára első helyen LMWH javasolt. (2C)
2.1.2.Köldökartéria katéterhez (UAC-)társuló thrombosis
A katétert haladéktalanul el kell távolítani (1B), és ezzel egyidejűleg legalább 10 napos anticoagulans kezelést (UFH vagy LMWH) kell kezdeni. Amennyiben a thrombosis az életet veszélyezteti, thrombolysis, ellenjavallata esetén sebészeti thrombectomia (2C) jön szóba.
2.2. Mélyvénás thromboemboliák kezelése gyermekkorban
I. thrombosisos epizód esetén terápiás dózisú anticoaguláns kezelés indítandó (LMWH vagy UFH) 5-10 napig (1B). Amennyiben további anticoaguláns kezelés szükségessége merül fel,
- elsősorban nagyobb gyermekben, megfelelő, a cumarin terápia gyakori ellenőrzésére alkalmas perifériás vénák birtokában - a terápia cumarin adással folytatható, melyet a heparin kezelés 1. napján javasolt elkezdeni. A heparin (LMWH vagy UFH) csak
akkor hagyható el, ha 2 egymást követő napon az INR a terápiás tartomány alsó határát (INR:2) eléri, de nem haladja meg a 3-at. (1B) Hangsúlyozni kell azonban, hogy a cumarin terápia gyermekkori alkalmazását jelentősen befolyásolja az életkor, a vénázási lehetőség és kezelés tervezett időtartama. Így kisgyermekkorban és /vagy jól kanülálható perifériás vénák hiányában - különösen egyéb, korábbiakban részletezett gyermekkori sajátosságok fennállta esetén - a cumarin kezelés hatékonysága ill. ellenőrzése nem biztonságos, így alkalmazása ezekben az esetekben nem javasolt, helyette elsősorban tartós LMWH kezelés választandó.(2C)
Idiopátiás thrombosis esetén a kezelés legalább 6 hónapig folytatandó (2C), amely cumarin vagy LMWH egyaránt lehet. Másodlagos thrombosis esetén, ha az átmeneti thrombophiliás tényező megszűnt, legalább 3 hónapos anticoagulálás szükséges. Perzisztáló rizikófaktor esetén meghatározatlan idejű anticoaguláns terápia szükséges, vagy legalábbis az átmeneti rizikófaktorok eliminálásáig.
Visszatérő idiopátiás vénás thromboembolia esetén határozatlan idejű, akár életre (1A) szóló anticoaguláns kezelés szükséges. Amennyiben tartós anticoagulálás szükséges, elsősorban VKA választandó, LMWH csak esetenként jön szóba. Amennyiben a mélyvénás thrombosis során antiphospholipid antitestek mutathatók ki, az antikoaguláns kezelésben a gyermekkori vénás thromboemboliák terápiája a követendő. Az életkor figyelembe vételével a későbbiekben a felnőtt betegekre vonatkozó útmutatás a mérvadó.
Tartós CVC-hez társuló mélyvénás thrombosis 1. epizódja esetén 3 hónapos terápiás dózisú antikoagulálás indokolt, melyet profilaktikus dózisú LMWH (antiFxa 0,1-0,3 u/ml) vagy VKA (INR: 1,5-1,8) kezeléssel kell folytatni a CVC eltávolításáig.(2C) Ha a profilaktikus terápia alatt ismételt thrombosis lép fel, és a kanül nem távolítható el, terápiás dózisú anticoagulálásra kell visszatérni legalább 3 hónapig vagy a kanül eltávolításáig (2C)
Önmagában a CVC anticoaguláns profilaxist nem indokol. (1B) Hosszantartó teljes parenterális táplálás esetén azonban antithrombotikus profilaxis (Cumarin) javasolt. (2C)
Amennyiben a CVC elzáródott és a thrombus csak a katéter lumenére terjed, rt-PA vagy urokinase lokális alkalmazásával megkísérelhető a lumen megnyitása (2C). Hatástalanság esetén fél óra múlva 1 x a megnyitás ismétmegkísérelhető. Sikertelenség esetén a CVC-t el kell távolítani az előzőkben részletezett útmutatás szerint. Tartós vénás katéter alkalmazása esetén a katéter átjárhatóságának biztosítására 1 NE/ml UFH infúziós oldat adása javasolt.
2.3. Thrombolysis
Újszülöttkorban thrombolysis csak életmentő jelleggel jön szóba (1B) és gyermekkori indikációját is elsősorban életveszélyes nagyér elzáródás (magasra terjedő alsó végtagi vagy kétoldali v. renalist érintő thrombosis esetén) képezi. (2C) Mind az újszülöttkori, mind a gyermekkori esetekben elsődlegesen rt-PA adása jön szóba heparin adással kiegészítve. Amennyiben a thrombolysis hatástalan, szérum plazminogén mérés indokolt. Alacsony szint esetén, vagy ha a plazminogén szint meghatározás nem kivitelezhető, FFP adása indokolt (2C)
Életveszélyes VTE esetén thrombectomia kísérlendő meg, melyet anticoaguláns kezeléssel kell folytatni.
2.4. Újszülöttkori acut ischaemiás stroke
Amennyiben nincs kardiális embóliaforrás, az 1. epizódot követően, antithrombotikus kezelés nem szükséges (1B). Újszülöttkorban a recurráló stroke nagyon ritka.
A tünetek recidivája esetén viszont anticoaguláns vagy ASA kezelés indítandó minimum 6 hétig (2C). (Chest 2008 is így adja meg, pontosan nem részletezi. Véleményem szerint:
A kezelés megválasztásánál figyelembe kell venni, hogy újszülöttkorban az aspirin clearance lassú, így hosszabb alkalmazás esetén potenciálisan fennáll a vérzés veszélye.
2.5. Gyermekkori acut ischaemiás stroke
Amennyiben kardiális embóliaforrás vagy érdissectio kizárható, anticoaguláns kezelés vagy ASA (1-5 mg/ ttkg) indítandó (1B), és legalább 2 évig folytatandó (2B). Ha érdissectio vagy emboliaforrás igazolható, legalább 6 hétig anticoagulálás szükséges radiológiai követéssel (2C).
Thrombolysis nem indokolt (1B). Amennyiben ASA kezelés mellett recurráló acut ischaemiás stroke vagy TIA lép fel, az aspirin kezelést clopidogrel vagy anticoaguláns terápiára javasolt váltani (2C).
*2.6. Agyi sinus venosus thrombosis
2.6.1.Újszülöttkori sinus venosus thrombosis
Agyi sinus thrombosis esetén, ha intracraniális vérzéssel nem jár, anticoagulans kezelés (UFH vagy LMWH) javasolt, melyet LMWH-val vagy VKA-val kell folytatni 6-12 hétig (2C). Ha a sinus thrombosis vérzéssel társul, 5-7 napig radiológiai követés javasolt. Progresszió esetén anticoaguláns kezelést kell elkezdeni, melyet teljes recanalisatio esetén 6 hétig, részleges recanalisatio esetén 12 hétig (de nem tovább) kell folytatni.
2.6.2. Gyermekkori sinus venosus thrombosis
Amennyiben a sinus thrombosis koponyaűri vérzéssel nem társul, anticoagulans kezelés (UFH vagy LMWH) indokolt legalább 3 hónapig, mely LMWH-val, VKA-val folytatandó (1B). Ha az agyi sinus thrombosis vérzéssel társul, 5-7 napig radiológiai követés javasolt, amennyiben a thrombosis progradiál, anticoaguláns kezelés megkezdése javasolt (2C). Azonosan az újszülöttkori sinus thrombosissal, teljes recanalistio esetén az anticoaguláns kezelés 3 hónapig, részleges recanalisatio esetén 6 hónapig folytatandó.
Amennyiben ismert kockázati tényezők (pl. L-asparaginase kezelés, nephrosis syndroma) miatt a thrombosis recidivája valószínűsíthető, azok fennálltának idejére a beteget profilaktikus anticoaguláns kezelésben javasolt részesíteni a rizikófaktorok eliminálásáig (2C). Amennyiben az agyi sinusok thrombosisa súlyos tünetekkel társul, és a az anticoaguláns terápia nem hatékony, thrombolysis vagy sebészi thrombectomia jöhet szóba. (2C)
2.7. Gyermekkori tumorokhoz társuló vénás thrombemboliák
Az anticoaguláns kezelés időtartamát egyéni megítélés alapján kell meghatározni. A kezelés időtartama a javaslatok szerint legalább 3 hónap, ill. mindaddig, amíg a kiváltó tényező fennáll (2C). vagy erősebb ellenjavallat (pl. gyomorvérzés) nem lép fel. Önmagában a gyermekkori malignus megbetegedés és / vagy a CVC használat profilaktikus anticoaguláns kezelést nem indikál (2C).
3. Egyéb beavatkozás
3.1. Vena cava filter
Alkalmazása magasra terjedő alsóvégtagi thrombosis esetén 10 kg-nál súlyosabb gyermekben az anticoaguláns kezelés ellenjavallatának fennállásákor jön szóba ideiglenes jelleggel. Amennyiben a filter kosara thrombus mentes, és a kockázati tényezők megszűntek, haladéktalanul el kell távolítani (2C), és az anticoaguláns kezelést a mélyvénás thrombosisokban irányadó kezelés szerint kell elkezdeni (1B).
3.2. Újszülöttkori homozigóta Protein C hiány
Amennyiben elérhető, protein C koncentrátum (20-60 E/ttkg) vagy FFP (10-20 ml/ttkg 12 óránként) adandó, a kilinikai tünetek megszűntéig. (1B) Ezt követően tartós anticoagulálás szükséges: cumarin vagy LMWH (2C), illetve protein C pótlás (1B) vagy májátültetés (2C).
IV. Rehabilitáció
V. Gondozás
1. VTE kockázatának szűrése gyermekkorban
Thrombophilia irányába kivizsgálás javasolt az alábbi esetekben:
- a kórelőzmény veleszületett thrombosis hajlamot valószínűsít
- ismert thrombophiliás felnőttek pubertás korú gyermekei
- thrombosisban szenvedő fiatal betegek testvérei (már kora gyermekkorban is!)
VI. Irodalomjegyzék
1. Monagle P, Chalmers E, Chan A, de Veber G, Kirkham F, Massicotte P, Michelson AD:Antithrombotic Therapy in Neonates and Children: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8 th Edition). Chest 2008; 133: 887-968.
2. de Veber G: Paediatric stroke. Who should be treated? Hámostaseologie 2009; 88-90.
3. Bonduel MM: Oral anticoagulation therapy in children. Thrombosis Research 2006; 118: 85-94.
4. Bauer KA: The thrombophilias: well-defined risk factors with uncertain therapeutic implications. Ann Intern Med. 2001; 135: 367-373.
5. Williams MD: Thrombolysis in children. Br J Haematol 2010;148: 26-36.
6. A thromboemboliák kockázatának csökkentése és kezelése. Szerkesztette. Pfliegler Gy. Az Egészségügyi Minisztérium Szakmai Irányelve. 2010.
7. Thromboemboliás megbetegedések csecsemő-, és gyermekkorban. Kardos Mária. In: Thrombosis és vérzékenység. Szerkesztette: Boda Zoltán. Medicina Könyvkiadó Rt. Budapest, 2006, 294-313.
VII. Melléklet
Rövidítések
| ACA | anticardiolipin antitestek |
| ACCP | American College of Chest Physicians |
| AIS | acut ishemiás stroke |
| ALL | akut lymphoid leukaemia |
| APA | antiphospholipid antitestek |
| ASA | acetilszalicil sav; aszpirin |
| AT | antitrombin (III) |
| anti-Xa E | aktivált X-es faktort közömbösítő egység |
| APTI | aktivált parciális tromboplasztin idő |
| CD | color duplex ultrahang |
| CSVT | központi idegrendszeri vénás sinus thrombosis |
| CT | computer tomographia |
| CVC | centrális vénás kanül |
| DIC | disszeminált intravasalis alvadás |
| EMEA | European Medicines Agency |
| FFP | friss fagyasztott plasma |
| HELLP | Haemolysis Elevated Liver Enzymes Low Platelet Count |
| HIT | heparin indukált thrombocytopenia |
| INR | nemzetközi normalizált ráta (International Normalized Ratio) |
| i.v. | intravénás |
| JRA | juvenilis rheumatoid arthritis |
| LA | lupus anticoagulans |
| LMWH | kis molekulatömegű heparin(ok) |
| LPa | lipoprotein-a |
| MRI | mágneses rezonancia vizsgálat |
| ms-CT | Multislice (többszeletes) computer tomograph |
| 5-MTHFR | 5-Metilén-Tetrahidrofolat Reductase |
| MVT | mély vénás thrombosis |
| NSAID | nem-steroid gyulladásgátlók |
| PC | protein-C |
| PCC | protrombin komplex koncentrátum |
| PE | tüdő embolia |
| PI | protrombin idő |
| p.o. | per os |
| PS | protein-S |
| PTS | postthrombotikus szindróma |
| RKT | randomizált kontrollált tanulmány |
| s.c. | subcutan |
| SLE | szisztémás lupus erythematosus |
| TF | szöveti faktor |
| TI | trombin idő |
| TIA | tranziens ischaemiás attack |
| t-PA | szöveti plazminogen aktivátor |
| UAC | köldökartéria katéter |
| UFH | frakcionálatlan heparin |
| UVC | köldökvéna katéter |
| VKA | K-vitamin antagonisták |
| VTE | vénás thromboembolia |
A szakmai irányelv érvényessége: 2014. június 30.
A Nemzeti Erőforrás Minisztérium szakmai irányelve
a hematológiai betegségek korszerű kezeléséről - a csecsemő és gyermekkori hematológiai betegségek diagnosztikája és kezelése
- Gyakoribb congenitális anemiák
- A granulocyták congenitális betegségei
- Akut leukaemiák
- Malignus lymphomák
- Immunthrombocytopenia
- A neutropéniás gyermek fertőzéseinek ellátása
Készítette: a Magyar Transzfúziológiai és Hematológiai Szakmai Kollégium és a Tudományos Társaság
GYAKORIBB CONGENITÁLIS ANEMIÁK
A) CONGENITÁLIS APLASTIKUS ANEMIA
I. Alapvető megfontolások
A ritka congenitális formák esetében legtöbbször a DNS-repair rendszer defektusáról van szó. Négy fő betegség tartozik a veleszületett csontvelő elégtelenség csoportba (1. tábl.).
Tekintettel arra, hogy a kórállapotok hátterében komplex genetikai zavar áll, mindegyik betegségre jellemző a malignitásokra való fokozott hajlam.
A hosszú távú túlélésre csak sikeres csontvelő átültetés esetén van reális esély. Részletesebben csak a leginkább előforduló formát, a Fanconi anemiát ismertetjük.
A/1. Fanconi anemia
II. Diagnózis, klinikai jellemzők
Autoszomális recesszív öröklődésű betegség.
A betegségre multiplex fejlődési rendellenességek együttes előfordulása jellemző, a fokozatosan kialakuló súlyos csontvelő elégtelenség mellett. A megfigyelhető congenitális malformációk a következők (nem mindegyik észlelhető minden betegben): növekedési zavar, bőrpigmentáció, csontrendszeri eltérések (hiányzó radius, hiányos kézcsontok stb.), vese fejlődési rendellenességek, központi idegrendszeri eltérések (mentális retardatio, microcephalia, ptosis, nystagmus, hyperreflexia), süketség, vitium, hypogonadizmus.
A pancytopenia fiúkban átlag 6-7, lányokban 8-9 éves korban manifesztálódik.
A diagnózis a klasszikus klinikai tünetek mellett cytogenetikai vizsgálattal lehetséges. Ezen betegek esetében fokozott spontán és indukált (mitomycin C, diepoxybutan) kromoszóma törékenység figyelhető meg. A betegségre jellemző gént (FACC) lokalizáltak a 9-es kromoszóma hosszú karján, míg egy másik jellemző gént a 20-as kromoszóma hosszú karján.
III. Kezelés
Végleges megoldást csak a csontvelő átültetés jelent. Még abban az esetben is indokolt a csontvelő átültetés (családi donor hiányában HLA-identikus idegen donor), ha a betegség konzervatív terápiával egyensúlyban tartható, mivel a malignus transzformáció valószínűsége igen nagy (8-10 %) és a kor előre haladtával nő.
Allogén csontvelő átültetéssel 65-80 %-os tartós túlélés érhető el. A transzplantációt megelőző kondicionáló kezelésnek redukált intenzitásúnak kell lennie (csökkentett adagú cyclophosphamid + teljes test besugárzás vagy ATG + procarbazin + csökkentett adagú teljes test besugárzás).
A konzervatív kezelés glucocorticoid (prednisolon vagy methylprednisolon 0,5-2 mg/kg/die) és/vagy androgén (fluoxymesteron 0,4-1 mg/kg/die per os, tesztoszteron 4 mg/kg/hét im., oxymetolon 2-6 mg/kg/die per os, nandrolon 25-50 mg im. 4 hetente) származékok adásából áll. Lehetőség szerint a kettő kombinációját érdemes alkalmazni a lehető legkisebb dózisban. A mellékhatások így is rendkívül súlyosak lehetnek, mivel tartós, folyamatos adagolás szükséges. Meg lehet kísérelni nagy-dózisú (20 mg/kg) methylprednisolon kezelést is. Konzervatív kezeléssel a túlélés általában 2-5 év között változik.
1. táblázat. A congenitális aplasticus anemia típusai és főbb jellemzői
| Típus | Főbb jellemzők |
| Fanconi anaemia | Autosomalis, recessziv öröklésmenet. |
| Súlyos pancytopenia és aplasia gyermekkorban. | |
| Csontrendszeri, bőr és vese abnormalitások. | |
| Mentalis retardáció. | |
| Különböző kromoszómális abnormalitások. | |
| 15-20%-ban myelodysplasia és leukemiás transzformáció . | |
| Dyskeratosis congenita | X-kromoszómához kötött öröklésmenet. |
| 90%-ban aplastikus anemia. | |
| Köröm dystrophia, nyálkahártya leukoplakia. | |
| Mentális retardáció. | |
| Gyakori laphámcarcinóma. | |
| Shwachman-Diamond sy. | Autosomális, recesszív öröklésmenet. |
| A betegség kezdetén neutropenia. | |
| 25%-ban aplasticus anemia. | |
| Metaphysealis chondrodysplasia. | |
| Exokrin pancreas elégtelenség. | |
| Constitucionalis | Késői megjelenésű csontvelő aplasia. |
| aplasztikus anemia | Congenitális malformációk hiánya. |
B) CONGENITÁLIS HYPOPLASTIKUS ANEMIA
I. Alapvető megfontolások
A csontvelő-elégtelenség ritka típusa, ahol az aplasia kizárólag az erytropoezisre korlátozódik, a granulopoezis és a thrombopoezis megtartott. A red cell aplasiáknak négy formája a congenitális red cell aplasia (Diamond-Blackfan anaemia), a tranziens erythroblastopenias betegség, a parvovírus okozta erythroblastopenia és a pure red cell aplasia ismert (2. táblázat). A gyermekkorra legjellemzőbb forma a congenitalis hypoplastikus anemia (Diamond-Blackfan syndroma.)
B/1. Blackfan-Diamond anemia
II. Diagnózis, klinikai jellemzők
A csontvelő erythroid progenitor sejtjeinek károsodása. Autoszomalis domináns és autoszomalis recesszív öröklésmenet is ismert. Az anemia már általában az első életévben manifesztálódik. A csontvelői károsodás csak a vörösvértest vonalat érinti, a thrombocyták és a fehérvérsejtek képzése normális.
Az esetek 25%-ában társult congenitális malformációk figyelhetők meg (csontrendszeri eltérések, retinopathia, kamrai szeptumdefektus, hypogammaglobulinemia).
Általában normochrom, macrocyter anemia jellemzi. A reticulocytaszám alacsony. A fetalis hemoglobin emelkedett. Az esetek többségében emelkedett az adenosin deamináz és a szérum erythropoetin.
A csontvelőben alig található magvas vörösvértest előalak, a myeloid-erythroid arány 50:1. A krónikus transzfúziók következményeként szekunder hemosiderosis alakul ki, annak klinikai jeleivel (szívmegnagyobbodás, diabetes, bőrpigmentáció, fibrózis a májban, pancreasban, pajzsmirigyben, gonadokban).
Hasonlóan az egyéb csontvelő elégtelenséggel járó állapotokhoz malignitások kialakulásának esélye nagyobb.
Az első választandó szer a prednisolon (methylprednisolon). A szteroidra adott válasz aránya kb. 60-70 %. A kezdő adag 2 mg/kg/nap, amit aztán a legkisebb fenntartó adagra kell csökkenteni a mellékhatások miatt (2-3 naponta adott 2-5 mg). Hatástalanság esetén methylprednisolon lökéskezelés kísérelhető meg (20-30 mg/kg/die, 3-4 naponta felezve az adagot). Androgének hatástalanok.
A szteroid kezelés eredménytelensége ill. súlyos mellékhatások esetén transzfúziók adása szükséges. A kialakuló szekunder hemosiderosis miatt rendszeres desferrioxamin kezelés javasolt (40-50 mg/kg/nap sc. pumpás infúzióban vagy vénásan legalább 2-3 hétig). Terápiás próbálkozások lehetségesek különböző növekedési faktorokkal (erythropoetin, GM-CSF, IL-3), változó eredménnyel. Spontán remisszió kb. az esetek 20 %-ában várható (a pubertás korig). Terápia rezisztens esetekben allogén csontvelő átültetés jön szóba.
2. táblázat. A vörösvértest aplasia típusai és klinikai jellemzői
III. Kezelés
| Típus | Klinikai jellemzők |
| Congenitalis red cell aplasia | Az anemia születéstől jelen van vagy az első |
| (Diamond-Blackfan anaemia) | életévben alakul ki. |
| Az esetek többségében sporadikus, de recesszív | |
| és domináns öröklésmenet is ismert. | |
| Gyakori vázrendszeri és arcfejlődési rendellenességek | |
| Egész életen át magas rizikó myeloid leukémia és myelodysplasiás syndroma | |
| kialakulására. | |
| Tranziens gyermekkori | A betegek többsége 1 évnél idősebb. |
| erythroblastopeniás betegség | A betegek jelentős részében az anemiához |
| neutropenia társul. | |
| Kialakulásában vírus etiológia a legvalószínűbb | |
| 1-2 hónap elteltével spontán gyógyulás. | |
| Parvovirus okozta | Parvovírus B19 okozta betegség. |
| erythroblastopenia | Immundeficiens betegekben az anemia elhúzódik. |
| Egyes esetekben agranulocytosis és thrombocytopenia | |
| is kifejlődik. | |
| A nem immundeficiens esetekben 1-2 héten belül | |
| spontán felépülés várható. |
| Pure red cell aplasia | Leggyakoribb serdülőkorban és felnőttkorban. |
| Kialakulásában gyógyszerek, infekciók és | |
| daganatos megbetegedések játszanak szerepet. | |
| Gyakran társul thymomához és T-sejtes tumorokhoz. | |
| A pathomechanizmusban T-sejt mediálta citotoxicitás és anti-erythroid | |
| antitestek szerepelnek. | |
C) Congenitalis haemolitikus anemia
C/1. VÖRÖSVÉRTEST MEMBRÁN RENDELLENESSÉGEK
I. Alapvető megfontolások
A veleszületett haemolyticus anaemiák csoportjába tartozó betegségek, melyekre a vörövértestmembrán struktúrfehérjéinek defektusa valamint különböző mértékű haemolysis és anaemia jellemző. A fehérjék genetikai károsodása következtében a membrán elveszti stabilitását, nem ad megfelelő támaszt a kettős lipidrétegnek, így azokból folyamatosan különböző részek szakadnak le. A vörösvértestek élettartama csökken és a RES sejtekben idő előtt elpusztulnak. Leggyakoribb formája a spherocytosis, de egyéb ritkább formák (elliptocytosis, stomatocytosis, xerocytosis) is előfordulnak.
A spherocytosis általában autoszomális domináns öröklésmenetet mutat, különböző penetranciával. Az esetek kb. 25%-ában új mutáció felelős a kórállapotért, a fennmaradó esetekben családi halmozódás mutatható ki. Általában a spektrin vagy az ankyrin molekula csökkent termelődése, vagy kóros kapcsolódása felelős a betegségért. Elliptocytosisban autoszomális domináns öröklésmenet áll fenn. A kórkép a membránban a spektrin kóros dimér-képződésével, vagy a 4.1 fehérje abnormalitásával vagy a glycophorin C defektusával jár. Stomatocytosisban a band 7 membránfehérje károsodását feltételezik. A xerocytosis genetikai háttere nem ismert, azonban a betegséget jellemzi a sejtek kálium tartalmának csökkenése, ami a sejtek dehydrációjához vezet.
II. Diagnózis, klinikai jellemzők
A klinikai kép változó, az enyhe hemolysistól a súlyos, transzfúziókat igénylő állapotokig tart. Az anemia sokszor már az első életnapokban jelentkezik, icterus kíséretében, de a betegségek bármely életkorban manifesztálódhatnak. Általában fluktuáló anemia és icterus jellemző. Splenomegalia szinte mindig megfigyelhető. A fokozott vörösvértest szétesés következtében epekövesség gyakori. Aplastikus krízisek előfordulhatnak.
A beteg gyermekekre jellemző diszkrét anemia, esetleg lassúbb súly- és hosszfejlődés, fertőzésekre való fokozottabb hajlam. Enyhe icterus általában megfigyelhető. Fizikai megterhelés, betegségek, nagy meleg, exsiccatio a tüneteket és a hemolízist fokozhatja.
Ritkábban (elsősorban felnőtt korban és súlyos spherocytosisban) lábszárfekély, orrvérzések, hemosiderosis (endokrinologiai és neurologiai elváltozásokkal) fordul elő.
A jellemző morphologiai eltérések a perifériás vérképben láthatók. Általában minden formára jellemző az anisocytosis és poikylocytosis. A vörösvértestek alaki eltérései általában szembetűnőek. Spherocytosis esetén kicsi, gömb alakú, sötétebbre festődő vörösvértestek láthatók. Elliptocytosis esetén a vörösvértestek több mint 15%-ának az alakja ovális. Stomatocytosisnál (hydrocytosis) a bikonkáv vörösvértestek középső világos foltja jellegzetes száj-alakot vesz fel. Xerocytosisban céltábla sejtek és echinocyták figyelhetők meg. Pyropoikylocytosisnál extrém anisocytosis, poikylocytosis, microspherocytosis. Minden formára jellemző a jelentősen megemelkedett (10-30%) reticulocytaszám, valamint a vörösvértestek eloszlási görbéjének kiszélesedése (nagy RDW érték).
A csontvelőben kompenzatorikus fokozott erythropoesis áll fenn. A csontvelőben még a normál bikonkáv vörösvértestek képződnek, és a perifériára történő kikerülésük során vesztik el a különböző membrán-alkotórészeket és veszik fel a betegségekre jellemző alakokat.
III. Kezelés
A lefolyás erősen változó, sok esetben csak diszkrét - kezelést nem igénylő - anemia áll fenn. Az elliptocytosis és a spherocytosis súlyosabb formáiban transzfúziók adása szükséges lehet, különösen lázas megbetegedések, infekciók kapcsán.
A splenectomia az esetek döntő többségében jó hatású, bár csak tüneti kezelés, az alaki rendellenességek természetesen megmaradnak, de a vörösvértestek élettartama megnő a lépkivétel után. Splenectomia csak 5-6 éves kor után végzendő (a fertőzésekre való fokozott hajlam miatt splenectomia után).
A kialakuló szekunder fólsav hiány miatt, folyamatos fólsav szedés ajánlott.
A gyakori transzfúziók miatt szekunder hemosiderosis alakulhat ki, ekkor tartósan (parenteralisan) alkalmazott vaskötő kelát (desferrioxamin) kezelés szükséges. Ma már elérhetőek oralis vaskötő kelát készítmények is (pl. deferazirox).
C/2. VÖRÖSVÉRTEST ENZIMDEFEKTUSOK
I. Alapvető megfontolások
A veleszületett hemolitikus anemiák másik nagy csoportját a vörösvértestek különböző enzimdefektusai okozzák. A veleszületett kórállapotok érinthetik a vörösvértest anyagcseréjét és energia termelő folyamatait (pentóz-foszfát shunt), a sejtmembrán stabilitását (glutation, NADPH) és a hemoglobin szintézisét (instabil Hb).
A betegségek általában hullámzó lefolyású icterussal és hemolitikus anemiával járnak. A hemolitikus krízisek általában oxidálószerek hatására következnek be. Több mint 60 különböző enzim károsodását írták már le. Magyarországon szinte kizárólag glukóz-6-foszfát dehidrogenáz (G-6-PD) hiány fordul elő.
A G-6-PD enzimnek központi szerepe van a sejtekre ható exogén és endogén oxidánsok semlegesítésében. A G-6-PD-t kódoló gén az X-kromoszómán helyezkedik el, és több mint 400 genetikai variánsa ismert. A genetikai variánsok közül a G-6-PD A-variáns jár hemolitikus anaemiával. Az ilyen genotípusú egyénekben normális mennyiségű enzim szintetizálódik, azonban lebomlása sokkal gyorsabb a fiziológiásnál. A betegségnek addig nincs klinikai jele, amíg a vörösvérsejteket nem érik gyógyszerek, toxinok vagy infekció okozta oxidatív károsodás.
II. Diagnózis, klinikai jellemzők
A betegség klinikai megjelenése változatos, általában az oxidatív hatást követően, 2-3 napos latencia után lép fel a haemolysis. A férfiakban ez súlyosabb, mivel az összes vörösvérsejt érintett. A nőkben kevésbé kifejezett, hiszen az X-kromoszóma alternatív inaktivációja miatt a vörösvérsejteknek csak a fele érintett. A betegekre jellemző még a fertőzések iránti fokozott fogékonyság és a thrombocytafunkciók zavara. A betegségre 4 fő klinikai megnyilvánulás jellemző:
1. Külső hatásokra, oxidálószerekre, fertőzésekre bekövetkező hemolitikus krízisek
2. Favizmus (általában 1-5 éves kor között fava típusú babfajták fogyasztása után súlyos hemolízis)
3. Neonatalis sárgaság
4. Krónikus congenitalis hemolitikus anemia
Számos tényező kiválthat hemolitikus rohamot. Különböző fertőzések játsszák a vezető szerepet a hemolízis súlyosbodásában, mint pl. sepsis, bakteriális pneumonia, hepatitisek, mononucleosis, felső légúti vírusfertőzések, typhus, rickettsia fertőzések, tuberculosis.
Egyéb kórállapotok is okozhatnak hemolízist, mint az akut veseelégtelenség, diabetes, egyéb acidosissal járó állapotok. A következő fő gyógyszerek és kémiai anyagok vezethetnek még ezen betegekben súlyos hemolízishez: antimalariás szerek (pamaquin, primaquin), sulfonamidok (sulfametoxazol, nitrofurantoin), antipiretikumok (acetanilid, acetaminophen, acetilszalicilsav), bizonyos antibiotikumok (chloramphenicol, streptomycin, nalidixsav), egyes citosztatikumok (adriamycin, BCNU), féreghajtók, K vitamin antagonisták, probenecid.
Oxidatív hatások nélkül a vérkép általában normális, ill. az enyhe haemolysisre, icterusra jellemző kép látható. Oxidatív hatásra a vörösvértestek globinláncai denaturálódnak (Heinz-testek).
III. Kezelés
A kezelés a különböző hemolízist kiváltó tényezők kerüléséből áll. Bizonyos esetekben transzfúzió szükséges lehet (főleg lázas állapotok, fertőzések kapcsán).
Súlyos neonatalis icterusban kékfénykezelés és vércsere jön szóba (l. morbus hemolitikus neonatorum). Súlyos, gyakori transzfúziókat igénylő krónikus állapotokban splenectomia indikált (5 éves kor felett). Szekunder hemosiderosisban desferrioxamin (vagy egyéb vaskötő kelát) kezelés javasolt. Cholelithiasisban kőoldó kezelés (uro-desoxi-cholsav), lithotripszia vagy cholecystectomia szükséges.
C/3. MORBUS HAEMOLYTICUS NEONATORUM
I. Alapvető megfontolások
Az újszülöttkor jellegzetes allo-immun hemolitikus betegsége, melyet az anya és magzata közötti inkompatibilitás hoz létre. A gravis icterustól, a súlyos anemián át egészen a hydropsig (oedemás, dekompenzált újszülött) terjedő súlyos klinikai képben nyilvánul meg. Azonnali beavatkozást igényel (vércsere, transzfúzió) az életveszélyes állapot megoldása ill. a késői károsodások megelőzése ("mag"-icterus) miatt.
Etiológiájában az anyai szervezet által a magzati vörösvértestek ellen beindított immunreakció játszik szerepet. Csak IgG típusú ellenanyagok képesek átjutni a placentán, így csak ezen ellenanyagok jelentenek klinikailag szignifikáns problémát. A betegség klasszikus formája az Rh izoimmunizáció (Rh negatív anya-Rh pozitív magzat), mely manapság a hatékony védelem (anti-D savó adása minden Rh negatív szülő nőnek) következtében elenyésző mértékben fordul elő. Gyakoribb a másik fővércsoport inkompatibilitás, az ABO következtében fellépő hemolízis és icterus.
A kórkép kialakulásáért manapság leginkább a minor vércsoport antigén tulajdonságok a felelősek (C, e, E, Kell, Duffy, Kidd stb.).
II. Diagnózis, klinikai jellemzők
A legtöbb hemolitikus betegségben szenvedő újszülöttben nincs kifejezett icterus a születés után, mivel a placenta jól képes kiszűrni a bilirubint. A sárgaság az első életnapokon fokozatosan és rohamosan mélyül, és a maximumát a 3.-5. életnapra éri el (kezelés nélkül). Hemolitikus betegségben a Coombs teszt mindig pozitív.
Amennyiben a szérum indirekt bilirubin szintje átlépi a véragy-gát határértékét akkor lerakódik a basalis ganglionokban és ún. mag-icterust okoz. Az encephalopathia enyhe formájában lethargia, táplálási nehézség, hypotonia figyelhető meg. Súlyosabb esetekben éles hangú sírás, spasticitás, opistotonus, irreguláris légzés alakulhat ki. A késői károsodások közül a süketség, dyslexia, beszédképzési zavarok, bénulások, mentális retardatio, ataxia emelendők ki.
Az anemia sem mindig kifejezett rögtön a születés után, kivéve a legsúlyosabb formát, ahol az anemia congesztív szívelégtelenséghez, oedema, ascites és pleuralis effúzió kialakulásához vezet hypoproteinemia kíséretében (hydrops fetus). A perifériás vérben súlyos anemia, reticulocytosis és a magvas vörösvértestek (normoblasztok) nagy száma figyelhető meg. Ezen túlmenően polikromázia és anizocytosis jellemző, esetenként spherocytákkal. A fehérvérsejtszám lehet emelkedett, kifejezett balra tolódással (fiatal alakok). A csontvelőben erythroid hyperplasia észlelhető, esetleg erythrophagocytosissal.
III. Kezelés
Enyhe esetekben a folyadékbevitel megemelése (napi 150-200 ml/kg) elegendő lehet. Elhúzódó, enyhe icterus esetén fenobarbitál kezelés is szóbajön (a májban a konjugáció fokozására, Sevenaletta 5-6 mg/kg/die).
Leginkább elterjedt a kékfény kezelés, mely a bilirubin direkt lebontása révén csökkenti a mag-icterus veszélyét.
Súlyos anemiában vörösvértest transzfúzió szükséges.
Igen kifejezett szérum indirekt bilirubin szint emelkedés és a kékfény kezelés hatástalansága esetén vércserére van szükség. A vércsere során (umbilicalis kanülön keresztül) választott, a materrel és a magzattal is kompatibilis vérrel, 10-20 ml-es frakciókban történik meg a szérum bilirubin szint csökkentése. Az alkalmazandó vérmennyiség a magzat vérének (80 ml/kg) 2-3-szorosa, érett újszülött esetén kb. 500-800 ml.
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Delaunay J: Red cell membrane and erythropoiesis genetic defects. Hematology J. 2003;4: 225.
2. Dokal I: Inherited aplastic anemia. Hematology J 2003;4: 3
3. Kannan K, Dennison D, Nusrat N: Fanconi's anemia. Br J Haemat 2003;122: 521.
4. Zanella A: Inherited disorders of red cell metabolism. Clin Haematol 2000;13: 1.
5. Nathan and Oski's: Hematology of infancy and childhood. Saunders Elsevier, Philadelphia, 2009
A GRANULOCYTÁK CONGENITÁLIS BETEGSÉGEI A GRANULOCYTÁK VELESZÜLETETT MENNYISÉGI ZAVARAI
I. Alapvető megfontolások - II. Diagnózis - III. Kezelés
A veleszületett neutropeniák viszonylag ritka hematológiai rendellenességek, amelyek szerteágazó genetikai háttérrel és változó klinikai megjelenéssel járnak. A congenitális neutropeniák a háttér genetikai defektusok alapján a következő csoportokra oszthatók:
| Mutáns gén | Megjegyzés | |
| 1. Súlyos congenitalis neutropenia (SCN) | ||
| ELANE/ELA-2 defektus | ELANE/ELA-2 | A kitekeredett protein válasz (unfolded protein response - UPR) |
| reakcióút aktivációja, fokozott myeloid sejt apoptosis, sporadikus | ||
| vagy AD öröklésmenet; gyakoriság: ~ 50% | ||
| HAX-1 defektus | HAX-1 | A mitokondrium membránpotenciál destabilizációja, fokozott |
| myeloid sejt apoptosis, a betegek egy részében neurológai | ||
| érintettség; AR öröklésmenet; előfordulás nem ismert | ||
| GKI1 defektus | GKI1 | A lymphocytaszám és működés defektusával társulhat; gátolt |
| neutrophil differenciálódás, ritka | ||
| X-hez kötött SCN | WAS | A WAS protein konstitutív aktivációja, kóros mitózis és |
| sejtvándorlás, fokozott apoptosis, lymphoid immundefektus | ||
| G6PC3 defektus | G6PC3 | UPR aktiváció, fokozott myeloid apoptosis, veleszületett szív |
| és urogenitális rendellenességek, feltűnő felületes vénák | ||
| Glikogén tárolási betegség 1b | SLC37A4 | Glikogén felhalmozódás, súlyos veleszületett neutropenia |
| G-CSF receptor defektus | CSF3R | Súlyos myeloid hypoplasia, sporadikus |
| 2. Congenitalis neutropenia hypopigmentációval | ||
| Chédiak Higashi szindróma | LYST/CHS1 | Óriás lizoszómák, neurológiai tünetek, esetenként makrofág |
| aktivációs szindróma, AR öröklésmenet | ||
| Griscelli szindróma, 2. típus | RAB27A | Kóros T sejt funkció, esetenként makrofág aktivációs szindróma |
| Hermansky-Pudlak szindr. | AP3B1 | Kóros T sejt és endoszoma működés |
| P14/ROBLD3/MAPBPIP defektus | P14/ROBLD3/MAPBPIP | Kóros T sejt funkció, növekedési zavar |
| 3. Congenitális neutropeniával társuló komplex rendellenességek | ||
| AK2 defektus | AK2 | Kóros lymphocyta differenciálódással és halláskárosodással járó |
| SCN (reticularis dysgenesis) | ||
| Shwachman Diamond szindr. | SBDS | Csontvelő és exocrin pancreas elégtelenség, |
| csontrendellenességek, máj és szívbetegség | ||
| WHIM szindróma | CXCR4 | Szemölcs (warts), hypogammaglobulinaemia, immun-defektus és |
| myelokathexis; CXCR4 gén aktiváló mutációja | ||
| Mutáns gén | Megjegyzés | |
| Porc-haj hypoplasia | RMRP | Immundefektus, rendellenes szőrzet, és porc dysplasia |
| Barth szindróma | G4.5/TAZ | A szív és a harántcsikolt izmok myopathiája |
| Cohen szindróma | VPS13B/COH | Veleszületett, intermittáló neutropenia, pszichomotoros retardáció, csontrendellenességek |
| Pearson szindróma | Mitochondrium deléció | Veleszületett csontvelő és exocrin pancreas elégtelenség, neuromuscularis érintettség |
| 4. Ciklikus neutropenia | ||
| ELA-2 | AD vagy sporadikus megjelenés | |
A normális granulocyta szám az életkor függvénye, 2 hetes-1 éves kor között az alsó határ 1 G/l, egy éves kor felett 1,5 G/l. A congenitális neutropeniák klinikai képére elsősorban a bakteriális fertőzésekkel szembeni fokozott érzékenység jellemző. Cellulitisek, felületes vagy mély bőrtályogok, furunculosis, pneumonia, szepszis, stomatitis, gingivitis, perirectális gyulladások, otitis media, mastoiditis alakulhat ki. A fertőzéseket leggyakrabban S aureus, streptococcusok, clostridiumok okozzák, de gyakori a gram negatívak és az anaerobok által okozott infekciók is. A betegek fogékonysága a vírus és parazitafertőzésekkel szemben általában nem növekszik. A gombafertőzések előfordulása rendszerint szintén nem emelkedik. Mindez talán a megtartott T sejt működéssel, és a monocyta-makrofág rendszer elemeinek relatív felszaporodásával, kompenzatorikus működésével magyarázható. A folyamatosan alacsony neutrophil szám ellenére a klinikai tünetek gyakorisága és súlyossága az életkor előrehaladásával csökken. A tünetek enyhülését az emelkedő immunglobulin szinttel együtt járó, javuló opszonizációs aktivitás, és a monocyták kompenzatorikus működésének erősödése magyarázza. Egyes esetekben az emelkedett számú eosinophilok, mint alternatív fagocita sejtek segítséget jelenthetnek a bakteriális fertőzések megakadályozásában.
Súlyos congenitális neutropenia
Az infantilis agranulocytosist először Kostmann írta le 1956-ban. A betegség rendszerint súlyos formában zajlik, az abszolút neutrophil szám 100/|il alatti. A granulocytopeniát monocytosis, eosinophilia, anaemia és thrombocytosis kíséri. A diagnózis csontvelőbiopsziával állítható fel. A szövettani vizsgálat a hypo-, vagy normocelluláris csontvelőben myeloid érésgátlást mutat a promyelocyták szintjén. A betegség incidenciája 1:200.000. A Kostmann által leírt kórkép öröklésmenete autoszomális recesszív, azonban ismert autoszomális domináns öröklődésű és sporadikus megjelenésű forma is. Utóbbiak hátterében a neutrophil elasztáz (ELA-2) gén mutációját feltételezik (lásd Táblázat).
Kezelés: G-CSF (1-5 |ig/kg/nap), amely szükség esetén akár 50 ^g/kg-ig emelhető. A cél az 1,0 G/l feletti abszolút neutrophil szám biztosítása. A dózist a szükséges terápiás hatás eléréséig kell emelni, az injekciókat naponta vagy másodnaponta subcutan kell alkalmazni.
Régóta ismert megfigyelés, hogy az esetek egy részében myelodysplasiás syndroma vagy akut myeloid leukemia alakul ki. A leukémiás transzformáció kockázata a kórképek ritkasága miatt nehezen becsülhető, azonban a Nemzetközi Súlyos Krónikus Neuropenia Regiszter adatai szerint az ELA-2 és a HAX1 mutációval társult súlyos congenitális neutropeniában és Wiskott-Aldrich szindrómában a kockázat elérheti a 20-30%-ot is. A malignus transzformáció számos esetben szerzett clonalis cytogenetikai rendellenességekkel társult. A G-CSF kezelés mellett évente a kezeltek kevesebb, mint 2%-ában figyeltek meg malignus transzformációt, azaz nem igazolható ok-oki összefüggés a kolónia stimuláló faktor terápia és a leukemia kialakulása között. Feltételezhető, hogy a G-CSF terápia hatására javuló túlélés időt enged a betegségre jellemző a leukemiás prediszpozíció kifejeződésére. A tartós G-CSF terápia congenitális neutropeniában kiváltotta az őssejt-átültetést, amelyet manapság csak néhány, jól megválasztott esetben végeznek el. Őssejt-átültetés javasolt, ha a G-CSF nem hat, vagy csak igen nagy adag (>40-50 ug/kg) mellett jelentkezik terápiás hatás. G-CSF receptor mutáció, vagy kromoszóma elváltozás a malignus transzformáció veszélyét vetíti előre, ezért ilyen esetekben szintén transzplantáció javasolt.
Ciklikus neutropenia
Sporadikusan vagy autoszomális dominánsan öröklődő ritka kórkép (incidencia 1-2/1.000.000), amelyre a neutrophil szám ciklikus ingadozása jellemző. A jelenséget 1910-ben Leale írta le először. A ciklusok rendszerint (az esetek 71%-ában) 21 napos periodicitást mutatnak, de előfordulnak rövidebb-hosszabb (14-36 nap) periódusok is. Az oszcillációk amplitúdója változó, de gyermekekben általában nagyobb. Az érintett családokban nagyfokú fenotípus változatosság figyelhető meg, egyes családtagok súlyosabban, mások alig érintettek. A neutrophilek mellett a reticulocyták, thrombocyták és más fehérvérsejtek (monocyták, lymphocyták) is ciklikus ingadozást mutathatnak. A neutropeniás időszakban (3-6 nap) vett csontvelőbiopsziás mintában myelocyta szinten érési gátlás figyelhető meg. A diagnózis felállítása sem a gyermek, sem az orvos számára nem könnyű feladat, hiszen 6-8 hétig heti 2-3x vérképvizsgálatot kell végezni. A klinikai képre a háromhetente jelentkező láz, gyengeség, szájnyálkahártya elváltozások, abscessusok megjelenése jellemző. Ritkábban cellulitis, komoly bőrfertőzések jelentkeznek. A kórkép egyik legsúlyosabb szövődménye a szepszis, amelyet gyakran clostridiumok okoznak. A ciklikus neutropenia hátterében szintén a neutrophil elasztáz (ELA-2) gén mutációja szerepel.
Kezelés: G-CSF, amely ciklikus neutropeniában nem szünteti meg a ciklicitást, azonban emeli a neutrophil számot, valamint rövidíti a ciklusok hosszát és súlyosságát. A ciklusok előtt néhány nappal megkezdett 3-5 ug/kg subcutan G-CSF megelőzi a jellegzetes szájnyálkahártya fekélyek és gingivitis kialakulását.
Krónikus idiopathias neutropenia
Gyermekkorban előfordulnak az előző kategóriák egyikébe sem sorolható krónikus (idiopathiás) neutropeniák is. A gyermekek egy részében korábban normális granulocyta számot mértek, sok esetben azonban nem áll rendelkezésre anamnesztikus adat. A neutropeniára leggyakrabban a kisdedkorban derül fény; az etiológia nem tisztázott. Valószínű, hogy többféle kórfolyamat, egyes esetekben immun-patomechanizmus okozza a neutrophil sejtek csökkenését. A neutropenia sok esetben igen súlyos, az abszolút neutrophil szám akár 100/|il alatti lehet. A vérképben jellegzetes monocytosis figyelhető meg, gyakran kisegítő jelleggel. A csontvelővizsgálat során myeloid érésgátlás látható. Az érésgátlás bármely stádiumban előfordulhat. A nagyfokú neutropenia ellenére a betegek sokszor meglepően jól vannak, a gyakori, súlyos fertőzések nem jellemzők. Néha láz, szájnyálkahártya tünetek, felső légúti hurutok, bőrfertőzések jelentkeznek. A fertőzések azonban hosszabb ideig tartanak, mint egészségesekben. A fertőzések alatt az abszolút neutrophil szám gyakran spontán is megemelkedik, majd az infekció elmúlásával ismét lecsökken. A kórképre nagyfokú klinikai változékonyság jellemző, gyakori remissziókkal, relapszusokkal. Az esetek többségében azonban a kisdedkor végére, néhány éves kórlefolyás után a neutrophil szám normalizálódik.
Kezelés: A rendszeres G-CSF terápia szükségtelen, a fehérvérsejt szám kozmetikázása felesleges és értelmetlen. A betegek gondozásba vétele és nyomon követése nagyon fontos. Az egyértelmű bakteriális fertőzések, elhúzódó infekciók alkalmával adott subcutan G-CSF injekciók lerövidíthetik a fertőzéseket, és megakadályozható a súlyosabb szövődmények kialakulása is.
A GRANULOCYTÁK VELESZÜLETETT FUNKCIONÁLIS DEFEKTUSAI
Chronicus granulomatosis (CGD)
A phagocyta sejtek veleszületett defektusa, amelyre a kataláz pozitív baktériumokkal és gombákkal (pl. S aureus, B. cepacia, Serratia, Nocardia, Aspegillus, Candida) szemben fokozott fogékonyság jellemző. A kórkép hátterében a 4 alegységből álló NADPH oxydase valamely alegységének génhibája áll. A mutációk következtében a phagocyta sejtekben nem képződik a kórokozók intracelluláris elpusztításához elegendő mennyiségű szuperoxid anion, azaz sérül a respirációs burst aktivitás. Granuloma képződéssel járó fertőzések keletkeznek, elsősorban a tüdőben, csontokban, és a gastro-intestinalis rendszerben. A kórkép krónikus lefolyású, az X-kromoszómához kötötten öröklődő forma morbiditása és letalitása nagyobb. A fertőzések mintegy 20%-a gombainfekció. A prognózist nagymértékben befolyásolja az alapos gondozás és fertőzések intenzív terápiája. A diagnózis után 5 évvel a betegek mintegy 80%-a van életben.
Öröklésmenet: Az esetek kétharmada X-hez kötötten, egyharmada autoszomális recesszív módon öröklődik. Az érintett gének az X és a 7. kromoszómán találhatók. Incidencia: 1:220.000-500.000
Diagnózis: NBT teszt, a szuperoxid anion termelés vizsgálata, mutációs analízis (gp91phox, p22phox, p47phox illetve p67phox).
Kezelés: primer és szekunder antimikróbás profilaxis (trimethroprim/sulfamethoxazole, posaconazole vagy voriconazole), tartós interferon gamma (a respirációs burst aktivitás részleges korrekciója), súlyos, életveszélyes infekciók vagy szteroid rezisztens enterális érintettség esetén allogén csontvelő-átültetés, esetleg génterápia.
Leukocyta adhéziós defektus (LAD)
Visszatérő bakteriális fertőzésekkel, csökkent gennyképződéssel és elégtelen sebgyógyulással jellemezhető klinikai tünetegyüttes. A klinikumra a köldökzsinórcsonk késői leválása, súlyos periodontitis, a nyálkahártyák és a bőr recidiváló fertőzései jellemzőek, amelyekből életveszélyes infekciók származhatnak. A leggyakoribb kórokozók a staphylococcusok, gram negatív baktériumok és egyes sarjadzó gombák (candida speciesek). A kórkép hátterében a sejt-sejt, sejt-matrix kölcsönhatásokban részt vevő, béta integrinek családjába tartozó CD18 molekula teljes vagy részleges (< 5%) hiánya áll. A LAD három típusa különíthető el:
A leukocytáknak az endothelen keresztüli migrációja gátolt, ezért a granulocyta szám 20-100 G/l közötti. Más funkcionális defektusok is jellemzőek: csökkent C3bi kötés, phagocytosis, chemotaxis, NK aktivitás, T sejtfunkció figyelhető meg. A betegek rendszerint csecsemőkorban fertőzések következtében meghalnak.
Kezelés: a fertőzések agresszív antimikróbás kezelése, granulocyta transzfúziók, allogén csontvelő-átültetés, génterápia (?).
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Rosenberg PS, Alter BP, Link DE és mtsai: Neutrophil elastase mutations and risk of leukemia in severe congenital neutropenia. Br J Haemat 2008;140:210-13.
2. Xia J, Link DE: Severe congenital neutropenia and the unfolded protein response. Curr. Opin Hematol 2008;15:1-7.
3. Boztug K, Klein C: Novel genetic etiologies of severe congenital neutropenia. Curr Opin Immunol 2009;21:472-80.
4. Dale DC: Recent progress in understanding the congenital neutropenias. Curr Opin Hematol 2010;17:1-2.
GYERMEKKORI AKUT LEUKÉMIÁK
I. Alapvető megfontolások
A gyermekkori leukémiák incidenciája 30-40/1.000.000 15 év alatti gyermek. Az esetek 80-85%-a ALL, 10-12% AML és 3-4% CML. Az akut leukémiák leginkább a 2-5 éves korcsoportban fordulnak elő, a fiú-lány arány: 1,3:1.
A kromoszóma instabilitással járó syndromák között a Fanconi anaemiában 15.000-szeres az akut myeloid leukaemia (AML), illetőleg a myelodysplasiás syndroma (MDS) előfordulása az átlagnépességhez viszonyítva. Bloom syndromában a myeloid, ataxia-teleangiectasia szindrómában a lymphoid malignitások halmozódnak.
I-es típusú neurofibromatosisban (Recklinghausen-kór) gyakoribb a gyermekkori AML továbbá a Myelodysplasia syndroma (MDS) és más myeloproliferatív syndromák, különösen a juvenilis myelomonocytaer leukaemia (JMML). A Li-Fraumeni syndroma egyik lehetséges malignitása a leukaemia.
II. Diagnózis
Az alapelvek megegyeznek a felnőttkori formánál leírtakkal.
A betegség beosztásában a klasszikus morphologia jelentősége csökkent, de a hagyományos citokémiai és hisztologiai eljárások ma is segíthetnek a diagnózis felállításában.
A korszerű immunologiai és genetikai eljárások elterjedésével a betegség különböző alcsoportjait jobban el tudjuk különíteni, és ennek a kezelés megválasztása, a prognózis szempontjából nagy jelentősége van. Ezen túlmenően a molekuláris genetikai vizsgálatok lehetőséget adnak a követésre és a relapsusok korai felismerésére (minimális reziduális betegség detektálása, immunglobulin gén ill. T-sejt receptor génátrendeződés vizsgálata PCR-rel).
III. Kezelés
III/1. Az ALL kezelése
A következő rizikócsoportokat állítja fel a BFM (Berlin-Frankfurt-Münster) német munkacsoport, melynek protokolljai Magyarországon használatosak (1. táblázat.).
1. táblázat.
SR (kis rizikó):1-6 éves életkor és a kezdeti fehérvérsejtszám < 20,0 G/l nem T-sejtes immunológia perifériás blaszt < 1,0 G/l a 8. napon és remisszió a 33. napon a csontvelőben
MR (közepes): 6 év feletti és 1 év alatti életkor kezdeti fehérvérsejtszám > 20,0 G/l T-sejtes immunológia perifériás blaszt < 1,0 G/l a 8. napon és remisszió a 33. napon a csontvelőben
HR (nagy rizikó): kedvezőtlen cytogenetika (t(9;22) és t(4;11)) több mint 1,0 G/l perifériás blaszt a 8. napon 33. napi csontvelőkép nem remissziós
A legújabb 2010-ben induló újprotokollban a 15. napi. flow cytometriás eredmény az egyik fő besorolási kritérium. A hagyományos cytomorphológia mellett (8. és 33. napon) a 15. napon a csontvelőben 0,1% alatt kell lennie a blasztaránynak, ahhoz, hogy a beteg a kis-rizikójú csoportba kerüljön. Ugyanebben az időpontban, ha 10% felett van a blasztok arány, akkor a beteg nagy-rizikójú. Minden más esetben közepes rizikóról beszélünk.
A standard kezelésnek Magyarországon az ALL-BFM-95-ös protokoll számít, ezért ezt ismertetjük részletesebben.
A közepes rizikójú (MR) betegek kezelése a következő fő periódusokból tevődik össze.
Indukció
4+4 hét, vincristin, prednisolon, daunorubicin, asparaginase, cytosin-arabinosid, cyclophosphamid (1. ábra).
1. ábra: Az ALL indukciós kezelése a BFM munkacsoport ajánlása alapján
Rövidítésjegyzék: PRED=prednisolon, VCR=vincristin, DNR=daunorubicin, L-ASP=asparaginase, CPM=cyclophosphamid, ARA-C=cytosin arabinosid, MP=merkaptopurin, MTX=methotrexat, i.th=intrathecalis, Lp=lumbálpunkció, csv=csontvelő vizsgálat, KIR=központi idegrendszer
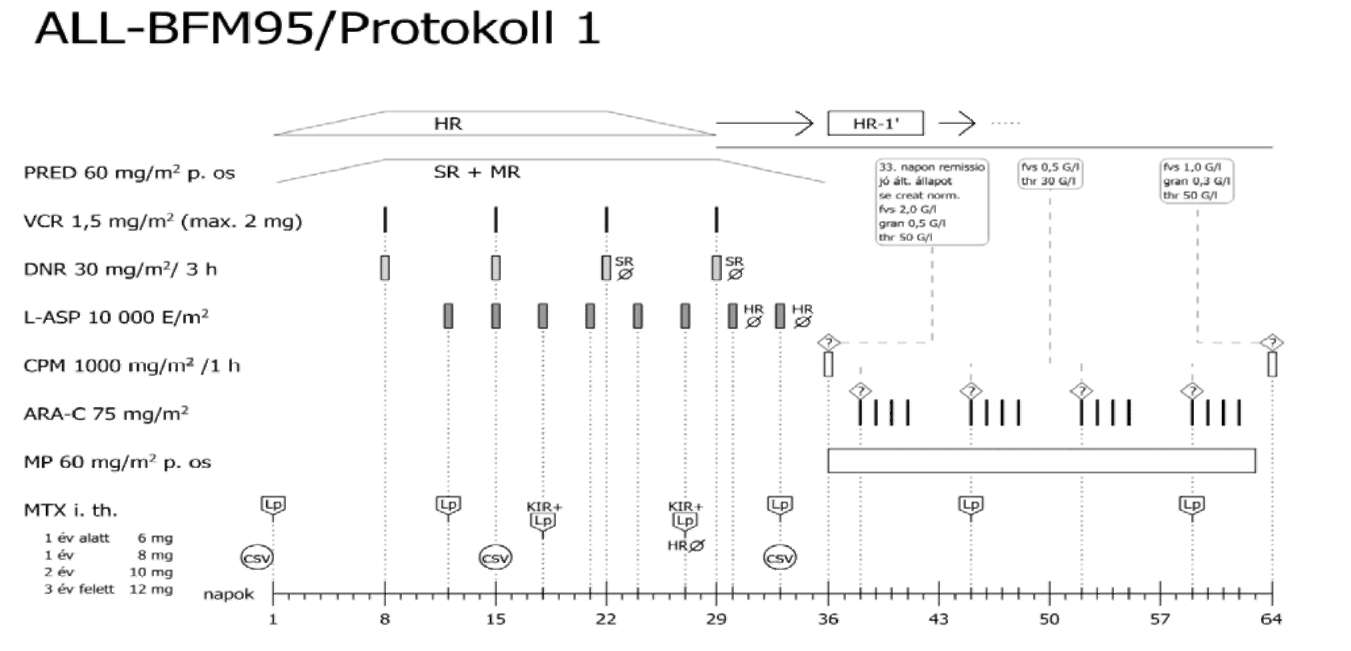
Meningeális profilaxis és konszolidáció
8 hét, nagy-dózisú methotrexát, 6-merkaptopurin, intrathecalis methotrexát. Ezen kezelési ciklusban a cél a rejtett blasztok eliminálása a központi idegrendszerből. Ez részben az intrathecalis gyógyszeradagolásból és a grammos nagyságrendű, nagydózisú (HD) MTX (5 g/m2/24 óra) kezelésből tevődik össze (összesen 4 alkalommal, 2 hetente alkalmazva). A HD-MTX kezelés (2-5 g/m2) szükséges ahhoz, hogy a gyógyszerkoncentráció a liquortérben is terápiás szintet érjen el. Természetesen ilyen nagy adagú MTX kezelésnél a fólsav antagonizáló hatás felfüggesztendő teljesen redukált folinsav (leucovorin) adásával a kezelés megkezdésétől számított 42, 48 és 54 óra múlva (Ca-folinát 15 mg/m2). Fontos még megemlíteni, hogy a HD-MTX kezelés csak olyan helyen végezhető, ahol a megfelelő szérum gyógyszerszint mérések elvégezhetők.
Reindukció
6 hét, ugyanazon gyógyszerekkel, mint az indukcióban. Ezen kezelési ciklusban a residualis leukemiás sejtek elpusztítására kerül sor (2. ábra). Az utóbbi évek klinikai kutatásai alapján a reindukciós kezelésnek alapvető jelentősége van a relapsusok megelőzésében. Az újabb terápiás protokollok már egy 2. vagy 3. késői (több hónappal a primer kezelés után) reindukciós blokkot is tartalmaznak a recidivák megelőzése céljából.
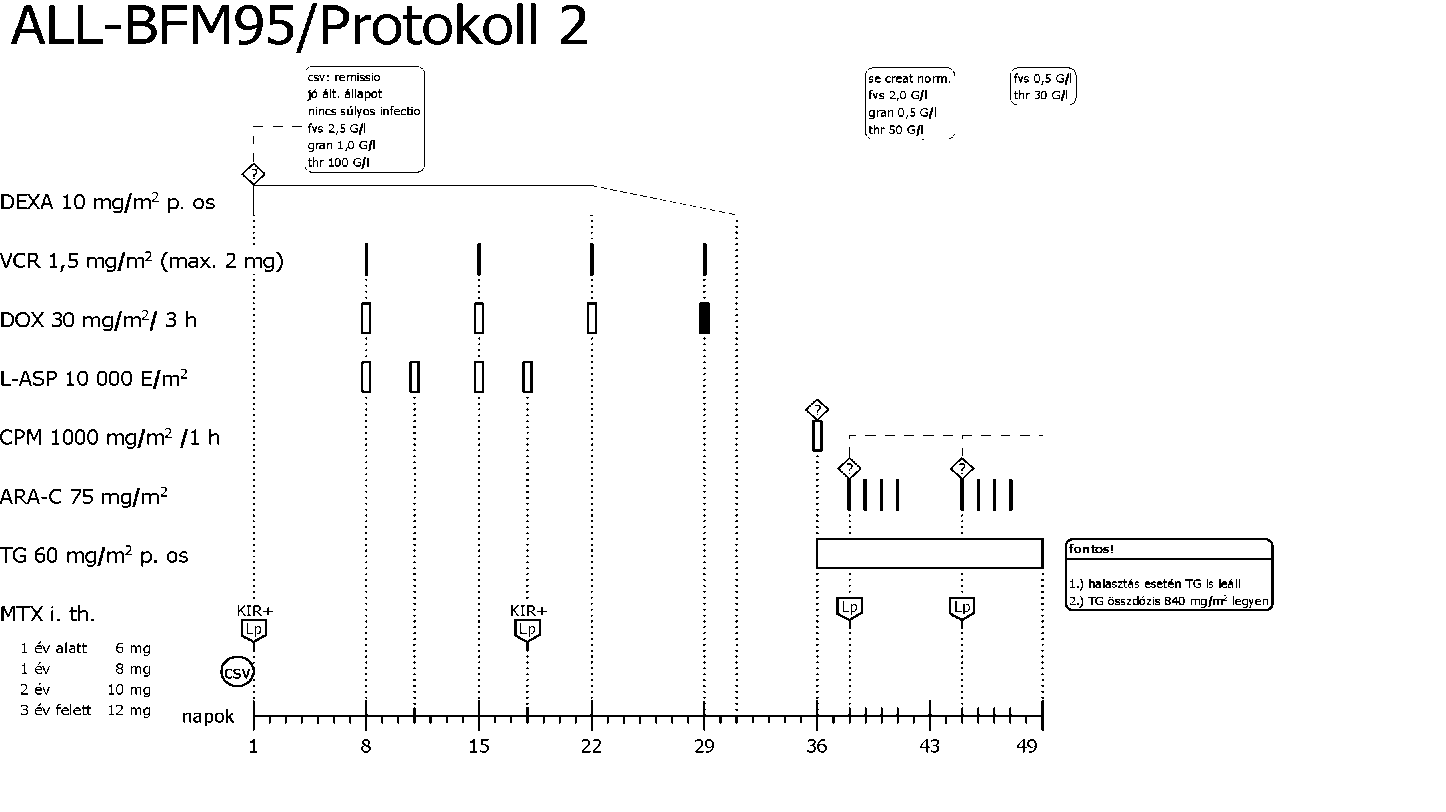
2. ábra: Az ALL reindukciós kezelése a BFM munkacsoport ajánlása alapján
Fenntartó kezelés
A kemoterápiás kezelés megkezdésétől számított 2. év végéig, per os methotrexát és 6-merkaptopurin, esetenként vincristin és dexamethason reindukciókkal.
A kis malignitású (LR) betegek nagyon hasonló kezelési séma szerint kapják a terápiát, csak bizonyos dóziscsökkentés mellett. Összesen 60 mg/m2 adaggal kevesebb antraciklint kapnak a reindukcióban.
A nagy malignitású (HR), és ezáltal rosszabb prognózisú betegek az indukciós kezelés befejeztével egy nagyon intenzív terápiás ciklusban részesülnek. Ún. 5-6 napos blokk-kezelések formájában 4-5 citosztatikus gyógyszer kombinációját kapják összesen 6 alkalommal (szteroid, vinca alkaloidák, alkilálók, antraciklin, nagy adagú cytosin arabinosid, etoposid, aszparagináz). A kezelés intenzifikálásával a cél a rosszul reagáló daganatsejtek tökéletes elpusztítása nagy adagú gyógyszerek kombinációban történő alkalmazásával (3., 4., 5. ábra).
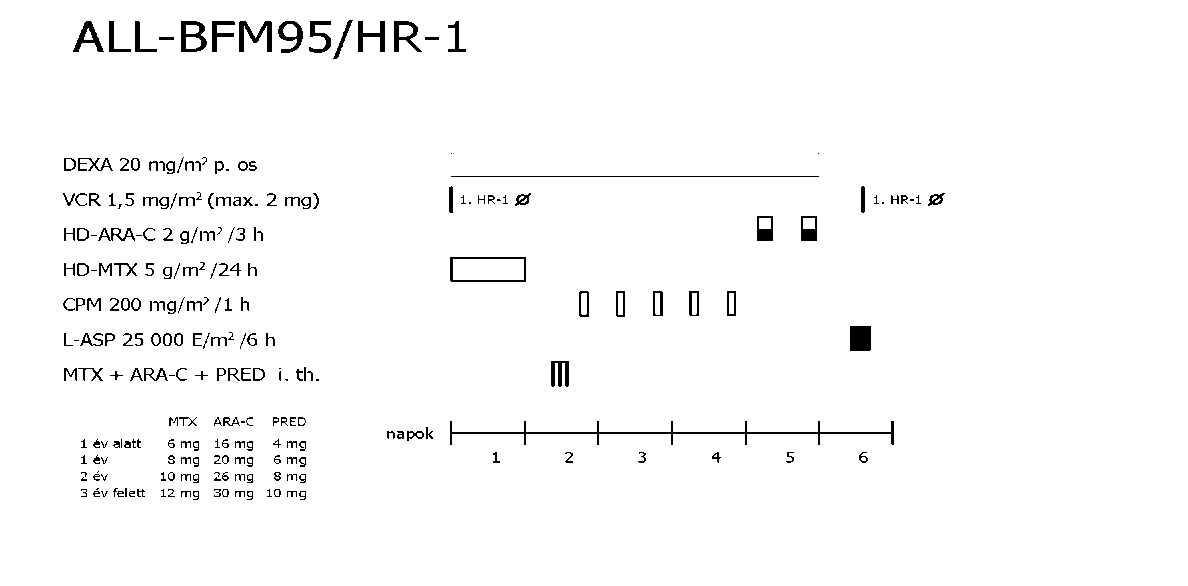
3. ábra: A nagy rizikójú ALL HR1-blokk kezelése
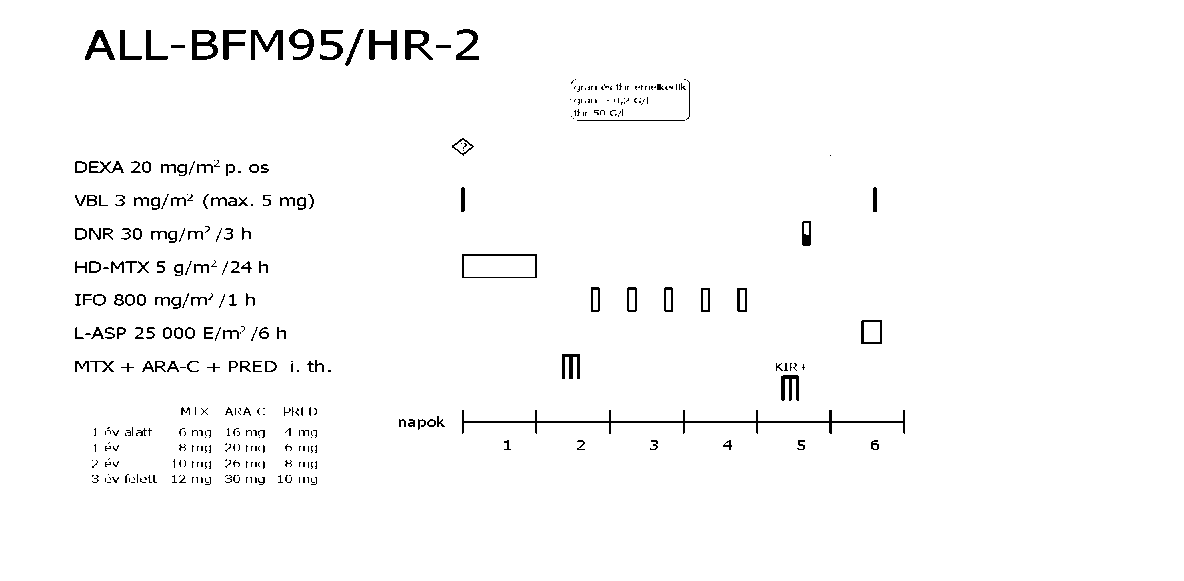
4. ábra: A nagy rizikójú ALL HR2-blokk kezelése
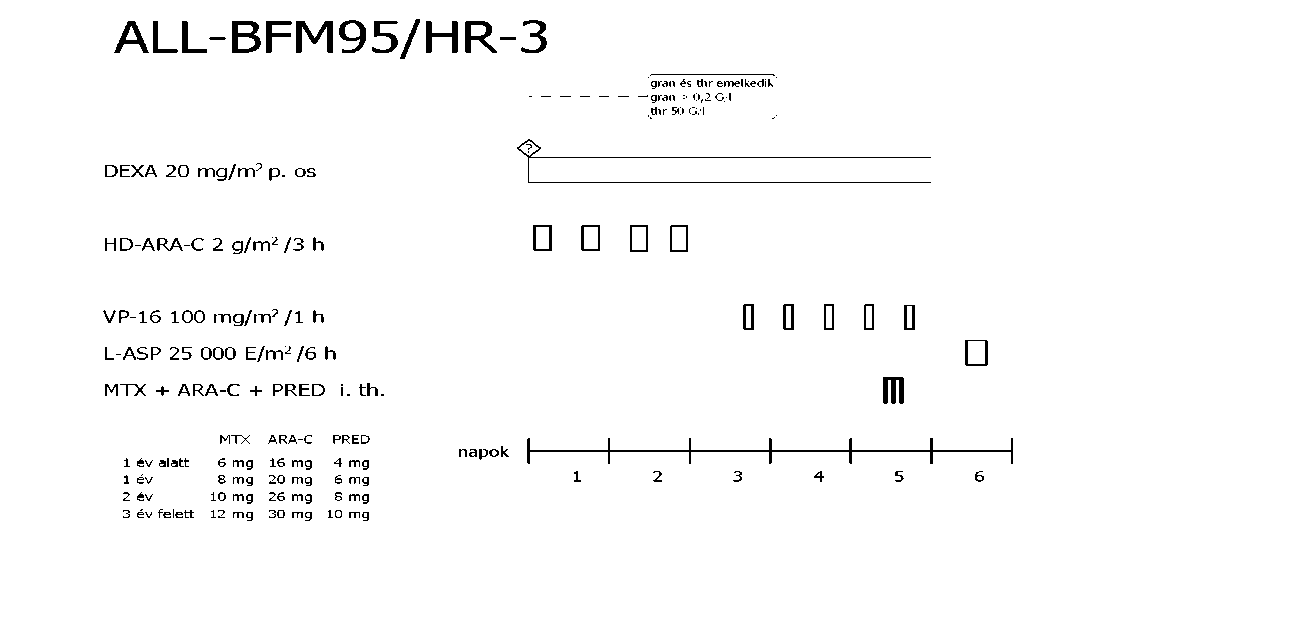
5. ábra: A nagy rizikójú ALL HR3-blokk kezelése
A nagy malignitású betegek, a kezdetben meningeális érintettségben szenvedők és a T-sejtes immunológiájú betegek koponya (gerincvelő) besugárzást is kapnak a későbbi meningeális recidiva kivédése céljából (12-18 Gy).
Recidiva esetén különös jelentősége van a recidiva idejének (korai v. késői) ill. helyének (csontvelő, egyéb szerv). A nagy rizikójú, korai csontvelő recidivák csak allogén TPL-val gyógyíthatók eredményesen (családi, vagy HLA-identikus idegen donor). Az igen rossz prognózist jelentő t(9,22) és t(4,11) esetén már az első komplett remisszióban indokolt a TPL, nem csak recidiva esetén.
Késői recidiva esetén ismételt kemoterápiás blokk-kezelések javasoltak. Szóba jön FLAG-IDA ill. clofarabine kombinációk adása (clofarabine, cyclophosphamid, etoposid). T-sejtes folyamatban nelarabine kezelés is adható.
Izolált meningeális relapsus esetén szisztémás kemoterápia, gyakori intrathecalis gyógyszeradagolás (methotrexat, cytosin-arabinosid, prednison, thiotepa) és teljes koponya és gerincvelő besugárzás (18 Gy) a választandó terápia. Izolált here recidiva esetén szintén szisztémás kemoterápia és herebesugárzás javasolt (viszonylag jobb prognózis).
Külön említést kell tenni a csecsemőkori leukémiákról (1 év alatt). Ezen betegségek nehezebben kezelhetők, sok esetben kedvezőtlen genetikai eltérés (a 11-es kromoszóma rendellenességei) észlelhető, több a kemoterápiára rezisztens forma és több a myeloid vonás a blasztokon. Klinikai és in vitro gyógyszerrezisztenciákon alapuló megfigyelések alapján speciális protokollal kezeljük ezen betegeket. Ismert, hogy ebben a betegcsoportban más a különböző gyógyszerek hatékonysága. Asparaginase ellenében bizonyos rezisztencia észlelhető, ugyanakkor a sejtek érzékenyebbek cytarabinra. Ennek megfelelően több cytosin-arabinosidot tartalmaz a kezelés. TPL ezen betegek esetében is elvégezhető és javíthatja a terápiás eredményeket.
Túlélés
Az összesített 4 éves túlélés, 2010-es, hazai adatok szerint, 83,1%.
A kis malignitású csoport túlélése 92 %, a közepes malignitásúaké 86%, míg a nagy malignitású betegek túlélése 60%.
A recidiváló esetek túlélése típustól és a recidiva idejétől függően 10-60%-os. A rossz prognózisú betegek esetében allogén csontvelő átültetés kísérelendő meg.
Csecsemő leukémiában a túlélés mindössze 40-50 %.
III/2. Az AML kezelése
A hazai munkacsoport az AML-BFM-2002 protokollt alkalmazza. Eszerint a kemoterápia vonatkozásában nem teszünk különbséget a rizikócsoportok között, csupán a promyelocytás (APL) és a Down-syndromás (DS) gyermekek AML kezelését folytatjuk eltérően. Az AML-BFM standard rizikócsoportjába (SR) az APL - t(15;17) - mellett azok a kedvező prognózisú eltérésekkel jellemzett esetek -t(8;21), inv(16)- kerülnek, akik kedvezően reagálnak a protokoll első indukciós blokkjára. A többi
eset magas rizikójúnak (HR) számít, akik a protokoll szerint, ha van HLA-identikus rokon donoruk, allogén hematopoetikus őssejtátültetésben részesülnek.
Az AML-BFM protokoll fő elemei a két indukciós kezelési blokk (AIE, HAM), a konszolidációs kezelés (két közepes adagú blokk cytosarral és antraciklinnel), a posztkonszolidációs intenzifikáció, koponya besugárzás és egy éves fenntartó kezelés. Az indukciós kezelési blokkok bázisgyógyszerei, más munkacsoportokhoz hasonlóan, a cytosin-arabinosid, az anthracyclin származékok (idarubicin és mitoxanthron) és az etoposid. A gyermekek központi idegrendszeri profilaxis során intrathecalis cytosin arabinosid kezelésben és cranialis irradiációban részesülnek (12-18 Gy). A konszolidációs kezelés közepes adagú cytosar és antarciklin kombinációjából áll (2 blokk). A reintenzifikáció nagydózisú cytosin-arabinosid és etoposid kombinációjából áll. Így minden gyermek általában 5 intenzív kemoterápiás blokkot kap, 3-4 hetente.
A felnőtteknél alkalmazott protokollal ellentétben gyermekkori AML esetén egy éves fenntartó kezelést is alkalmazunk (6-thioguanin folyamatosan naponta per os, ill. havonta 1x4 napos ciklusokban kisdózisú (40 mg/m2) cytosin-arabinosid subcutan).
2. táblázat: Az AML-BFM 2002 AIE blokkja
| Ara-C | 100 mg/m2/nap folyamatos infúzióban 48 órán át az első két napon |
| Ara-C | 100 mg/m2 iv. 12 óránként, 3. nap reggelétől a 8. nap estig |
| VP-16 | 150 mg/m2/nap iv., 1 órában, 6.-8. napon |
| Idarubicin | 12 mg/m2/nap iv. 3-4 órában, a 3., 5. és 7. napon |
| Ith. Ara-C | 1. és 8. napon életkortól függően: <1 év: 20 mg, 1-2 év: 26 mg, >2-3 év: 34 mg, >3 év: 40 mg |
3. táblázat: Az AML-BFM 2002 HAM blokkja
| HD-Ara-C | Napi 2x3 g/m2, 12 óránként, 3 órás infúzióban, 1 .-3. napig (össz. 6x) |
| Mitoxantron | 10 mg/m2/nap 30 perces infúzióban a 3. és a 4. napon |
| Ith. Ara-C | A 6. napon, az életkortól fügő adagban (l. előbb) |
4. táblázat: Az AML-BFM 2002 HD-AraC/VP-16 blokkja
| HD-Ara-C | Napi 2x3 g/m2, 12 óránként, 3 órás infúzióban, 1 .-3. napig (össz. 6x) |
| VP-16 | 125 mg/m2/nap 1 órás infúzióban, a 2.-5. napon |
| Ith. Ara-C | A 6. napon, az életkornak megfelelő adagban (l. előbb) |
Az APL-es betegek indukciós és fenntartó kezelésében szerepet kap a csupa-transz retinsav. Néhány munkacsoport az arsen-trioxidot gyermekkori APL-ben már az első manifesztáció idején alkalmazza, recidiva esetén mindenképpen szóba jön az alkalmazása.
A Down-syndromás betegek kevésbé intenzív kezelésben részesülnek (kevesebb anthracyclin, ennek ellenére jobb prognózis). Recidiva esetén liposzómás anthracyclin készítményt tartalmazó protokollal, vagy fludarabinnal és idarubicinnel (FLAG-IDA) lehet próbálkozni, de az eredmények nem jók. Egy új antimetabolit, a clofarabine szintén sikeresen alkalmazható bizonyos esetekben (pl. cytarabinnal, vagy idarubicinnal kombinálva). Ezen kívül anti-CD33 monoklonális ellenanyag kezeléssel (Mylotarg) vannak kedvező tapasztalatok. Amennyiben lehetséges allogén (autológ?) csontvelő átültetéssel kell próbálkozni.
Túlélés
A legintezívebb kezelésekkel, csontvelő átültetéssel is az 5 éves túlélés 40-60%. APL és Down syndroma esetén a túlélés 70% feletti.
A primer kezelésre nem reagáló formák, ill. a recidiváló esetek prognózisa igen rossz (0-5%).
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Pizzo PA, Poplack DG: Pediatric Oncology 4th edition, Lippincott Williams and Wilkins, 2002, Philadelphia: 489-544
2. Schrappe M, Beier R, Bürger B: New treatment strategies in childhood acute lymphoblastic leukaemia. Best Pract Res Clin Haematol 2002;15:729-40.
3. Schrappe M: Evolution of BFM trials for childhood ALL. Ann Hematol 2004;83 (suppl 1): S121-3,
4. Cario G, Stanulla M, Fine BM et al: Distinct gene expression profiles determine molecular treatment response in childhood acute lymphoblastic leukaemia. Blood 105: 821-6, 2005
5. Müller J, Kovács G, Jakab Zs, Rényi I, Galántai I, Békési A, Kiss Cs, Nagy K, Kajtár P, Bartyik K, Masát P, Magyarossy E: Hazai eredmények az ALL-BFM 95 protokollal akut limfoblasztos leukémiás gyermekek kezelésében. Orvosi Hetilap 146: 27-32, 2005
6. Creutzig U, Reinhardt D, Zimmermann M, Klingebiel T, Gadner H: Intensive chemotherapy versus bone marrow transplantation in pediatric acute myeloid leukaemia: a matter of controversies. Blood 97: 3671-5, 2001
7. Creutzig U, Zimmermann M, Reinhardt D, Dworzak M, Stary J, Lehrnbecher T: Early deaths and treatment-related mortality in children undergoing therapy for acute myeloid leukaemia: analysis of the multicenter clinical trials AML-BFM 93 and AML-BFM 98: J Clin Oncol 22: 4388-93, 2004
8. Reinhardt D, Diekamp S, Fleischhack G, Corbacioglu S, Jürgens H, Dworzak M, Kaspers G, Creutzig U, Zwaan CM: Gemtuzumab Ozogamicin (Mylotarg) in children with refractory or relapsed acute myeloid leukaemia. Onkologie 27: 269-72, 2004
9. Möricke A et al: Risk-adjusted therapy of acute lymphoblastic leukaemia can decrease treatment burden and improve survival: treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95. Blood 111: 4477-4489, 2008
10. Conter V et al: Molecular response to treatment redefines all prognostic factors in children and adolescents with B-cell precursor acute lymphoblastic leukaemia. Blood 115: 3206-14, 2010
MALIGNUS LYMPHOMÁK DIAGNÓZISA ÉS KEZELÉSE
I. Alapvető megfontolások
A gyermekkorban előforduló nem Hodgkin lymphomák (NHL-k) spektruma a felnőttkori formákétól eltérő: szinte kizárólag agresszív, nagy malignitású lymphomák fordulnak elő, leginkább 7-11 éves korban. A gyakori lymphoblasztos formák klinikai viselkedésüket tekintve az akut leukémiához állnak közel. Általában a leukemia/lymphoma közös elnevezést is szokás használni. Epidemiológia
A nyirokcsomó daganatos betegségei a gyermekkori rosszindulatú daganatok 8-10%-át alkotják. Az érintett fiú több, mint a leányt (fiú-lány arány= 3:1).
Körülbelül fele-fele arányban fordul elő Hodgkin betegség ill. non-Hodgkin lymphoma. Mindkét betegségcsoport incidenciája kb. 5-8/1.000.000 gyermek lakos (fiú-lány arány=1,8:1).
1. GYERMEKKORI HODGKIN LYMPHOMA
1/II. Diagnózis
A klinikai tünetek mindig az érintett nyirokcsomó régiótól függenek. Lokalizációt tekintve leggyakrabban a nyaki (40-50%) és a mellkasi (40%) nyirokcsomók érintettek. Izoláltan a hasban és egyéb területeken ritkán fordul elő. Jellemző a betegségre, hogy az extranodalis, extralymphatikus szerveket viszonylag ritkán érinti.
Az általános, ún. "B" tünetek a betegek kb. 1/3-ában figyelhetők meg, és a betegség előrehaladott állapotát jelzik: láz, fogyás, izzadás, viszketés, gyengeség.
A diagnózis minden esetben a nyirokcsomó szövettani vizsgálatán alapul.
Laboratóriumi tünetek: gyorsult vérsejt süllyedés, az emelkedett szérum LDH- és húgysavszint, anemia, lymphocytosis, eosinophilia, hypergammaglobulinemia, az esetek egy részében magasabb szérum réz szint.
Minden esetben CT vizsgálattal kell tisztázni a betegség kiterjedését (legalább mellkas + has). A betegség stádium-beosztását az
Ann-Arbor-i klasszikus rendszer szerint végezzük.
A szövettani besorolás megegyezik a felnőttkori formákkal.
Prognosztikai faktorok
Jó prognózis: izolált nyirokcsomó betegség, kedvező szövettan, jó terápiás válasz.
Rossz prognózis: disszeminált betegség, bulky mediastinális tumor, lymphocyta depletios szövettan, magas LDH, magas szérum ferritin, rossz terápiás válasz
Kezelés
Gyermekkorban a primer kezelésben döntő a kemoterápia. Még a lokalizált betegség esetében is ezt részesítjük előnyben a kevesebb késői mellékhatás miatt.
A kezelés stádiumtól függően 2-6 blokk-kezelésből áll.
Kezelési stratégia (1., 2. tábl.):
I. st., II.A st.: 2xOEPA
II.B st., III.A st.: 2xOEPA + 2xCOPP
III.B st., IV. st.: 2xOEPA + 4xCOPP
1. táblázat: OEPA kezelés protokollja
| Gyógyszer (OEPA, fiúk) | Dózis | Beadás módja | Kezelés napja |
| Vincristin (VCR) | 1,5 mg/m2 max: 2,0 mg! | iv. bólus | 1., 8., 15. |
| Adriamycin (DOX) | 40 mg/m2 | 3 órás infúzió dexrazoxannal (10-20x dózis) | 1., 15. |
| Prednisolon (PRED) | 60 mg/m2 folyamatosan | Per os, napi 3-4 részre elosztva | 1-15. |
| Etoposid (ETO) | 125 mg/m2 folyamatosan | Per os, napi 2-3 részre elosztva | 1-15. |
2. táblázat: COPP kezelés protokollja
| Gyógyszer (COPP) | Dózis | Beadás módja | Kezelés napja |
| Vincristin (VCR) | 1,5 mg/m2 max: 2,0 mg! | iv. bólus | 1., 8. |
| Cyclophosphamid (CP) | 500 mg/m2 | 30 perces infúzió + 3x200 mg/m2 uromitexan 0., 4., 8. órában +3000 ml/m2/die félizotóniás NaCl+5% glukóz infúzió | 1., 8. |
| Prednisolon (PRED) | 60 mg/m2 folyamatosan | Per os, napi 3-4 részre elosztva | 1-15. |
| Procarbazin (PROC) | 100 mg/m2 folyamatosan | Per os, napi 2-3 részre elosztva | 1-15. |
Második vonalbeli kezelés
Sugárkezelésre csak residualis tumor esetében ill. recidiva esetén kerül sor.
Amennyiben a kemoterápiás kezelés után a képalkotó eljárásokkal residualis tumorszövet sejthető, akkor az érintett nyirokrégió besugárzása szükséges (20-25 Gy). Általában késői recidivák esetén a sugárkezelés már fontos része a terápiának (a kemoterápia mellett, 36-45 Gy). Sokszor még a többszörös recidivák is jól kezelhetők.
Korai relapsusban és masszív residualis betegség esetén megaterápia javasolt őssejt védelemben (autolog csontvelő/perifériás őssejt átültetés).
Késői relapsusban alkalmazott kemoterápiás protokollok:
IEP, ABVD (l. felnőttek kezelése), Dexa-BEAM, IFO+Vinorelbin 3., 4., 5. tábl.).
3. táblázat: IEP kezelés protokollja
| Gyógyszer (IEP) | Dózis | Beadás módja | Kezelés napja |
| Ifosfamid (IFO) | 2000 mg/m2 5 napig | 24 órás infúzió + 2000 mg/m2 uromitexan +3000 ml/m2/die félizotóniás NaCl+5% glukóz infúzió | 1-5. |
| Prednisolon (PRED) | 60 mg/m2 folyamatosan | Per os, napi 3-4 részre elosztva | 1-15. |
| Etoposid (ETO) | 100 mg/m2 folyamatosan | Per os, napi 2-3 részre elosztva | 1-15. |
4. táblázat: DEXA-BEAM kezelés protokollja
| Gyógyszer (DEXA-BEAM) | Dózis | Beadás módja | Kezelés napja |
| Dexamethason (DEXA) | 12 mg/m2/die folyamatosan | Per os 3 adagban | 1-10. |
| Carmustin (BCNU) | 60 mg/m2 | 60 perces infúzió | 2. |
| Melphalan (MEL) | 20 mg/m2 | 15 perces infúzióban | 1-15. |
| Procarbazin (PROC) | 100 mg/m2 folyamatosan | Per os, napi 2-3 részre elosztva | 1-15. |
5. táblázat: IFOSFAMID ÉS VINORELBIN kezelés protokollja
| Gyógyszer | Dózis | Beadás módja | Kezelés napja |
| Vinorelbin (VIN) | 25 mg/m2 | 15 perces infúzióban, 100 ml sóoldatban | 1., 5. |
| Ifosfamid (IFO) | 3000 mg/m2/die | 96 órás infúzióban + 3000 mg/m2/die uromitexan +3000 ml/m2/die félizotóniás NaCl+5% glukóz infúzió | 1-4. |
2. GYEMEKKORI NON-HODGKIN LYMPHOMA (NHL)
2/II. Diagnózis
Minden esetben a nyirokcsomó szövettani vizsgálatán alapul. Nyirokcsomó eltávolítás vagy core-biopszia szükséges. Nagyon
fontos az immunhisztokémiai és genetikai vizsgálatok elvégzése!
Az általános, ún. "B" tünetek csak a betegek kb. 10%-ában figyelhetők meg.
Lokalizációt tekintve ritkább a nyaki (15%) és a mellkasi (25-30%) érintettség. Gyakori a hasban (30-35%). Jellemző a betegségre, hogy gyakori az extranodalis, extralymphatikus manifesztáció (15%).
A laboratóriumi tünetek közül megemlíthető a magas vérsejt süllyedés, az emelkedett LDH (fontos prognosztikai faktor!), anemia, növekedett szérum-húgysav, - bilirubin és CA-125 (tumormarker) szint.
Minden esetben CT vizsgálattal kell tisztázni a betegség kiterjedését, valamit kötelező a csontvelő biopszia és a lumbálpunkció. A betegség stádium-beosztását itt is az Ann-Arbor-i klasszikus rendszer szerint végezzük, azzal a különbséggel, hogy a nagy kiterjedésű mellkasi v. hasi betegség (bulky) a III. stádiumba sorolandó.
A szövettani beosztás nem a WHO kritériumok alapján, hanem klinikai viselkedést tekintve, terápiás csoportoknak megfelelően történik. A különböző csoportok (I., II., III.) eltérően kezelendők (6. táblázat).
Prognosztikai faktorok
Jobb prognózis: izolált nyirokcsomó érintettség, nasopharyngeális lokalizáció, körülírt extralymphatikus manifesztáció, lokalizált hasi érintettség, B-sejtes karakter, alacsony szérum LDH, ALK pozitivitás
Rossz prognózis: disszeminált betegség, KIR érintettség, csontvelő érintettség, nagy tumortömeg, tüdő- v. bőrérintettség, T-sejtes karakter, rossz terápiás válasz
6. táblázat. A gyermekkori NHL terápiás csoportok szerinti beosztása
| Terápiás csoport | I. non-B sejtes, leukémia-szerű | II. B-sejtes | III. Anaplastikus betegségek |
| Megoszlás | a betegek 25-30 %-a | a betegek 50-60%-a | a betegek 10-15%-a |
| Diagnózisok | Lymphoblasztos lymphoma (TdT+) Perifériás T-sejtes lymphoma | B-ALL Burkitt lymphoma Burkitt-szerű lymphoma Perifériás B-sejtes lymphoma. (centroblastos-centrocytás) immunoblastos ly. Diffúz nagy B-sejtes ly. Primer mediast. nagy B-sejtes lymphoma | Nagysejtes, anaplastikus (Ki1+) Lymphohistiocytas lymphoma |
| Immunologia | T-sejt, pre-B (FAB L1,2) | CD19+, SIg+ (FAB L3) | T-, B-, O-sejtes |
2/III. Kezelés
Gyermekkorban a primer kezelésben NHL esetén is döntő a kemoterápia. Sugárkezelésre csak igen ritkán kerül sor. Központi idegrendszeri érintettségnél koponya besugárzás ajánlott (a rendszeres intrathecalis kezelések mellett, 12-18 Gy).
A lymphoblasztos csoportban a kezelés a a leukémia protokoll szerint történik (I. terápiás csoport), és így összesen két évig tart (l. korábban).
Rizikócsoportok szerint a kezelés a következőképpen alakul:
- St.I. és II. esetén: Prot. I. és HD-MTX + fenntartó
- St. III. és IV esetén.: Prot. I., HD-MTX, Prot. II. + fenntartó
- Amennyiben a 33. napon >30% maradványtumor v. >5% blaszt a csontvelőben:
6x HR blokk, Prot.II. + fenntartó kezelés (Részleteket l. a gyermekkori heveny lymphoid leukémia kezelésénél!)
A B-sejtes betegségekben a kezelési algoritmus (II. csoport):
- Teljesen rezekált daganat: 1x"A" és 1x"B" blokk (17., 18. tábl.)
- StI., II. és LDH<500: Vorphase (V= 10 mg/m2 dexamethason 5 napig és 200 mg/m2 cyclophosphamid 2 napig) és 2x"A" + 2x"B" blokk
- St. III., IV. és LDH <1000: V és 2x"AA" + 2x"BB" +1x"CC" blokk (19. tábl.)
- StIII., IV. és LDH >1000: V és 2x"AA" + 2x"BB" +2x"CC" blokk
Az anaplastikus lymphomában kezelési algoritmus (III.csoport):
- Teljesen rezekált daganat: Vorphase (V) és 2x"A" + 1x"B" blokk
- StI., II., III.: V és 3x"A" + 3x"B"
- St. IV. és bőr, tüdő v. csontérintettség: V és 2x"AA" + 2x"BB" +2x"CC" blokk
7. táblázat. Az ún. A blokk protokollja
| Gyógyszer (A blokk) | Dózis | Beadás módja | Kezelés napja |
| Dexamethason (DEXA) | 10 mg/m2/die | per os, 3 részre osztva | 1-5. |
| Vincristin (VCR) | 1,5 mg/kg max. 2,0 mg! | iv. bolus | 1. |
| Etoposid (ETO) | 100 mg/m2/die | 2 órás infúzióban | 4.-5. |
| Cytosin arabinosid (ARA-C) | 2x150 mg/m2/die | 60 perces infúzióban | 4.-5. |
| Ifosfamid (IFO) | 800 mg/m2/nap | 30 perces infúzió + 3x300 mg/m2 uromitexan 0., 4., 8. órában +3 l/m2/die félizotóniás NaCl+5% glukóz infúzió | 1-5. |
| Methotrexat (MTX) | 1 g/m2 | 24 órás infúzióban +3 l/m2/die félizotóniás NaCl+5% glukóz infúzió + 40 mmol NaHCO3/1000 ml | 1. |
8. táblázat: Az ún. B blokk protokollja
| Gyógyszer (B blokk) | Dózis | Beadás módja | Kezelés napja |
| Dexamethason (DEXA) | 10 mg/m2/die | Per os, 3 részre osztva | 1-5. |
| Vincristin (VCR) | 1,5 mg/kg max. 2,0 mg! | iv. bolus | 1. |
| Doxorubicin (DOX) | 25 mg/m2/die | 3 órás infúzióban (+/- dexrazoxan) | 4.-5. |
| Cyclophosphamid (CP) | 200 mg/m2/nap | 30 perces infúzió + 3x300 mg/m2 uromitexan 0., 4., 8. órában +3 l/m2/die félizotóniás NaCl+5% glukóz infúzió | 1-5. |
| Methotrexat (MTX) | 1 g/m2 | 24 órás infúzióban +3 l/m2/die félizotóniás NaCl+5% glukóz infúzió 40 mmol NaHCO3/1000 ml | 1. |
Az "AA" blokk teljesen megegyezik az "A" blokkal, csak a MTX dózisa 5 g/m2/24 óra. A "BB" blokk teljesen megegyezik a "B" blokkal, de a MTX dózisa 5 g/m2/24 óra.
9. táblázat: Az ún. CC blokk protokollja
| Gyógyszer (CC blokk) | Dózis | Beadás módja | Kezelés napja |
| Dexamethason (DEXA) | 20 mg/m2/die | per os, 3 részre osztva | 1-5. |
| Vindesin (VDS) | 3 mg/kg max. 5,0 mg! | iv. bolus | 1. |
| Etoposid (ETO) | 5x100 mg/m2 12 óránként | 2 órás infúzióban | 3.-5. |
| Cytosin arabinosid (ARA-C) | 2x3 g/m2/die | 60 perces infúzióban + szteroidos szemcsepp és napi 150 mg/m2 B6 vitamin | 1.-2. |
Minden kezelési ciklusban intrathecalis (ITH) gyógyszeradagolás is szerepel (általában a 2. napon) a központi idegrendszerben megbújó daganatsejtek elpusztítása végett.
Az intrathecalis kezelés a következő gyógyszerekből áll (az adagok az életkortól függenek): Methotrexat 6-12 mg Cytosin-arabinosid 16-30 mg Prednisolon (Di-Adreson) 4-10 mg
Második vonalbeli kezelés
Recidivák esetén a felnőttkorban használt klasszikus protokollok is szerepet kapnak (CHOP, BACOP, DHAP, Dexa-BEAM) (l. korábban).elapsusban megaterápia őssejt védelemben (autolog csontvelő/perifériás őssejt átültetés) a feltétlenül javasolt kezelés, amennyiben a daganat kemoszenzitivitása megmaradt. Bizonyos esetekben allogén (idegen donoros) átültetés is szóbajön (rosszul reagáló formák).
Csontvelő átültetéssel a recidiváló betegek jelentős része meggyógyítható! Az 5 éves túlélés transzplantációval kb. 70%, míg csak kemoterápiával 10-20%.
Sugárkezelés általában nem indikált, de ha a terápia befejezése után kimutatható residuum van, akkor szóba jön. Primer mediastinalis nagy B-sejtes lymphoma esetén hosszabb kemoterápia és esetleg a primer tumor besugárzása jön szóba.
Monoklonális ellenanyag kezelést is alkalmazhatunk (anti-CD20 monoklonális antitest). CD20+ B-sejtes malignitások esetén residualis betegség ill. relapsus alkalmával.
A legelfogadottabb kezelési séma: rituximab (R) 375 mg/m2 2 órás infúzióban, hetente adva, összesen 4 alkalommal. Az ellenanyag terápiát általában kemoterápiával kombináljuk (pl. R-CHOP, R-DHAP).
2/IV. Rehabilitáció
2/V. Gondozás Túlélés
A legújabb hazai adatok alapján az összesített 4 éves általános túlélés 83%. A lymphoblasztos lymphoma csoportban az EFS 72%, a B-sejtesben 8%, míg az ALCL-ben 68%. A kezelésre nem szoruló, illetve a kezelésre remisszióba (PR, CR) kerülő betegek rendszeres hematológiai ellenőrzése, megfigyelése, gondozása szükséges.
Célszerűen a betegek gondozása a kezelést végző hematológiai centrumokban vagy decentrumokban történjen. A kezeléséért, gondozásáért a szakrendelést végző hematológus, vagy klinikai onkológus szakorvos felelős.
VI. Irodalomjegyzék
1. Pizzo PA, Poplack DG: Principles and Practice of Pediatric Oncology. Lippincott Williams and Wilkins, 2002, Philadelphia: 637-706
2. Kovács G, Müller J, Borgulya G, Koós Rozália: A gyermekkori Hodgkin lymphoma kezelési eredményei Magyarországon. Magyar Onkologia 2001;45: 397-401.
3. Schellong G, Potter R, Bramswig J et al: High cure rates and reduced long-term toxicity in pediatric Hodgkin's disease. J Clin Oncol 1999;17: 3736.
4. Reiter A, Schrappe M, Tiemann M et al: Improved treatment results in childhood B-cell neoplasms with tailored intensification therapy. Blood 1999;94: 3294-3306.
5. Reiter A, Schrappe M, Ludwig WD et al: Intensive ALL-type therapy without local radiotherapy provides a 90% event-free survival for children with T-cell lymphoblastic lymphoma. Blood 2000;95: 416-21.
6. Pinkerton R: Continuing challenges in childhood non-Hodgkin lymphoma. Br J Haematol 2005;130: 480-8
7. Seidemann K et al: Short-pulse B-non-Hodgkin lymphoma-type chemotherapy is efficacious treatment for pediatric anaplastic large cell lymphoma. Blood 2001;97: 3699-3706.
8. Pillon M et al: Long-term results of AIEOP LNH-92 protocol for the treatment of pediatric lymphoblastic lymphoma. Pediatr Blood Cancer 2009;53: 953-9.
9. van Beisen K et al: Unrelated donor hematopoetic cell transplantation for non-Hodgkin lymphoma. Biol Blood Marrow Transplant 2009;15: 554-63.
GYERMEKKORI IMMUN THROMBOCYTOPENIA
I. Alapvető megfontolások
Definíció BNO: D6930
Az idiopathias, más néven (auto)immun thrombocytopeniás purpura (ITP) izolált, immun-mediált thrombocyta (THRC) destrukció következtében kialakuló, vérzékenységgel járó, szerzett betegség. Gyermek- és felnőttkorban egyaránt előfordul. Előbbi korcsoportban az akut, utóbbiban a 6 hónapnál hosszabb kórlefolyású krónikusforma a gyakoribb. Az akut ITP 3-6 hónap alatt nem javuló, kezelést igénylő folyamáját refrakter/perzisztáló ITP-nek nevezzük.
A neonatális autoimmun, illetőleg alloimmun thrombocytopenia lehetősége miatt ITP-ről csupán 3 hónaposnál idősebb csecsemőkben beszélünk. Az ITP felléphet primer, vagy egyéb betegségekhez, állapotokhoz (egyéb autoimmun betegségek, neoplasztikus betegségek, fertőzések, egyes gyógyszerek szedése) társuló, szekunder formában. Az ITP-hez társuló autoimmun haemolyticus anaemia az Evans szindróma.
Epidemiológia
Gyermekkori ITP-ben kevés a megbízható epidemiológiai adat. Nagyobb populációt vizsgáló tanulmányok szerint az incidencia 20 -125/1.000.000. A betegek mintegy 5-8%-a csecsemő, 70-75%-a 1-10 év közötti, 17-20%-a 10-16 éves. Csecsemőkorban a fiú:lány arány"1,7:1,0, 1 éves kor fölött a fiúk aránya alig haladja meg a leányokét. Az ITP-s gyermekek nagyobb fele a vérzéses tünetek jelentkezése előtt 2-6 héttel fertőző betegségen esett át. Valószínűleg emiatt a gyermekkori ITP őszi-téli halmozódást mutat. A gyermekkori ITP az esetek többségében ("70%) 6 hónapon belül gyógyul. Az idült esetek aránya csecsemőkorban mintegy 20%, az 1-10 évesek között 30%, a 10-16 évesek között 50%. Teljes gyógyulás a krónikus esetek között is lehetséges: a gyermekkori ITP mintegy 80-90%-ban 1 éven belül gyógyul. A kórlefolyás többnyire enyhe, ritkán fordul elő súlyos, maradandó károsodást előidéző szövődmény. A lethalitás a mintegy 0,2-0,9%-ban előforduló, központi idegrendszeri vérzéssel társuló eseteket terheli. Az antibiotikum profilaxis és a védőoltások rendszeres alkalmazása mellett ritka a halálos kimenetelű postsplenctomiás sepsis.
Patogenezis
A kórfolyamat effektor fázisa során autoantitestek reagálnak a vérlemezkék glycoprotein receptoraival. Az opszonizált thrombocytákat macrophagok kebelezik be. A phagocytosist az immunglobulin molekulák Fc porciója, vagy az esetek egy részét jellemző komplement aktivációt követő sejtfelszíni C3b-fixálás triggereli. A döntően extravasculárisan zajló destrukció leggyakrabban és legkifejezettebb mértékben a lépen történik. A vérlemezkék pusztulása, aktivációjukkal vagy anélkül, ritkán intravasculárisan is bekövetkezik. Az antitest-indukált THRC aktiváció klinikai következményei súlyosak. Proinflammatorikus mediátorok szabadulnak fel, amelyek szisztémás lobos jelenségeket idézhetnek elő. A tartósan aktivált THRC-k kevésbé hatékonyak a vasculáris integritás megőrzésében. A CD40 ligand- és CD69-pozitív, aktivált vérlemezkék közvetlenül serkentik az autoagresszív B-lymphocyta klónokat. Az intravasculáris THRC aktiváció negyedik következménye intravasculáris (pulmonális, arteriális vagy intracardiális) thrombosis lehet. A humorális immunrendszer részvételén túl krónikus ITP-s gyermekekben THRC-reaktív T-sejt klónok mutathatók ki. A perifériás THRC destrukcióval párhuzamosan, de annak ütemétől és mértékétől elmaradva, az esetek többségében fokozódik a megakaryocytapoézis. Kísérletes adatok szerint, elsősorban krónikus ITP-ben, a betegek mintegy 40%-ában, a fokozott perifériás vérlemezke pusztulás mellett a csontvelői képzés is csökken. A THRC-ellenes autoantitestek termelődését kiváltó tényezőket kevéssé ismerjük. Az immunreguláció zavarához hozzájárulhat a "molekuláris mimikri" és az "epitop spreading" jelensége, valamint - elsősorban krónikus ITP-ben - a centrális és perifériás immuntolerancia mechanizmusok károsodása.
Neonatalis ITP-ben az autoantitestek az anya szervezetében termelődnek (akár splenectomián átesett, tünetmentes, normál THRC számmal élő asszony esetében is) és a placentán átjutva a magzatban okoznak THRC pusztulást. Neonatális alloimmun thrombocytopeniában a magzati THRC-k szenzitizálják az anya szervezetét, amely alloantitesteket termel a számára idegen, magzati THRC antigénnel (többnyire a HPA-1 antigénnel) szemben. A magzati, illetőleg újszülöttkori THRC destrukciót ebben az esetben a placentán átjutó anyai THRC-ellenes alloantitestek idézik elő.
II. Diagnózis
Az ITP kizárásos kórisme. Alapvető a nyilvánvaló thrombocytopenia (THRC<100 G/L) megállapítása és egyéb thrombocytopeniához vezető kórállapotok kizárása. A kórismézés alkalmával megállapított thrombocytaszám többnyire (a gyermekbetegek mintegy %-e) 10-20 G/L között van. A kórismézés a jellegzetes kórtörténeten, fizikális és laboratóriumi eltéréseken alapul.
Kórtörténet
A vérzéses tünetek hirtelen, váratlanul lépnek fel az egyébként egészséges gyermekben. A kórelőzményben gyakori (csecsemőkorban "50%, 1-10 éves korban "60%, 10-16 éves korban "40%) a vérzéses tünetek jelentkezését néhány héttel megelőző vírusfertőzés. VZV infekcióban a vérzés az erupciókkal egyidejűleg jelentkezhet.
Fizikális vizsgálat
Meg kell állapítanunk a vérzések jellegét és ki kell zárnunk az egyéb szervi elváltozásokat. Jellegzetesen thrompocytopeniás típusú vérzésekkel: mechanikus sérüléseket követő elhúzódó vérezgetéssel, sérülékenységgel (a traumás behatás mértékével arányban nem álló felszínes suffusiókkal), a bőrön és nyálkahártyákon látható purpurákkal, petechiákkal találkozunk. Gyakori az epistaxis, a menorrhagia. Előfordulhat gingiva és gastrointestinális vérzés. Ritka a súlyos kivérzéshez vezető, akár az életet veszélyeztető belső szervi vérzés, retinavérzés, központi idegrendszeri vérzés. Egyéb szervi eltérést nem találunk. A lép és a máj a betegek kis részében ("10%) tapintható. Evans szindrómában a beteg sápadt, icterusos lehet.
Laboratóriumi alapvizsgálatok
Teljes vérkép, reticulocyta szám (Re), MPV, perifériás kenet vizsgálata: kötelező eltérés a thrombocytopenia, a THRC-k mérete normális vagy annál mérsékelten nagyobb (fiatal THRC-k), de nem látunk óriás THRC-t. A vörösvérsejt és fehérvérsejt morfológia normális, enyhe eosinophilia előfordulhat, a kenetben néha aktivált, nagy lymphocytákat látunk. Anaemia lehet a vérzések, Evans szindrómában a társuló haemolysis miatt. Tartós vérezgetéssel járó, elhúzódó ITP-ben az anaemia hypochrom, microcytaer; vashiány igazolható. Az Evans szindrómához autoimmun neutropenia társulhat. Vércsoport meghatározás
Csontvelő vizsgálat. Elvégzésétől típusos, akut gyermekkori ITP-ben a legtöbb ajánlás eltekint. El kell végezni a vizsgálatot atípusos, tartósan fennálló, illetőleg intravenás immunglobulin (IVIG) kezelésre nem reagáló ITP-ben, valamint azokban az esetekben, amelyekben tartós kortikoszteroid kezelést tervezünk. A csontvelői kenet ITP-ben normál cellularitású, teljes, megtartott, proporcionált myeloid sorral, közepesen élénk (Evans szindrómában markánsabb), normoblastos erythropoézissel. A megakaryocaták előfordulási gyakorisága az esetek többségében jellegzetesen fokozott, ritkábban normális, de az annál alacsonyabb megakaryocyta arány sem zárja ki az ITP kórisméjét. Éretlen (poliklonális) lymphoblastok a szokásosnál mérsékelten fokozottabb gyakorisággal (5-10%) fordulhatnak elő.
Kiegészítő, nem kötelező laboratóriumi vizsgálatok (terhelő anamnesztikus adatok és leletek esetén, differenciáldiagnosztikai célból)
Infectiv ágensek keresése. HIV, HCV, Parvovírus B19, VZV, EBV, TORCH kimutatás. H. pylori fertőzés gyermekkori ITP-ben is előfordul. A kórokozó eradikációja nem változtatja meg a betegség kórlefolyását, szűrővizsgálat-szerű kimutatása nem indokolt. Immunglobulin (Ig) meghatározás, direkt antiglobulin (Coomb's) teszt (DAT). Az alacsony Ig szintek immundeficiencára utalnak, a DAT pozitivitás haemolysist jelez.
THRC elleni antitestek (AT) vizsgálata. Nem áll rendelkezésre megbízható standard, rutindiagnosztikai módszer, ezért kimutatásuk csak differenciáldiagnosztikai kétség esetén vagy klinikai tanulmány keretében jön szóba. A THRC-asszociált IgG (PaIg) és direkt immunfluoreszcencia teszt (PIFT) érzékeny, de nem specifikus vizsgálatok. A GPIIb/IIIa AT-ek és a monoklonális antitestekkel (MoAb) immobilizált egyéb THRC antigének (Ag) elleni AT-ek kimutatása ELISA esszével (MAIPA) specifikus módszerek, de érzékenységük alacsony.
Egyéb autoantitestek vizsgálata. Antiphospholipid antitestek (APLA): anticardiolipin és lupus anticoagulans nem befolyásolják a kórlefolyást. Egyéb autoantitestek (antinucelaris antitestek, pajzsmirigy ellenes antitestek, stb.) kimutatása egyidejű szisztémás autoimmun folyamat társulására utalhat.
Thrombopoetin (TPO) és glycocalicin koncentráció meghatározása vérben, csontvelőben: experimentális vizsgálatok, rutin diagnosztikai elvégzésük nem szükséges.
Egyéb vizsgálatok. Képalkotó vizsgálatok, kromoszóma vizsgálat, molekuláris genetikai vizsgálat, THRC aggregáció és "release" vizsgálatok végzése differenciáldiagnosztikai okokból válhat szükségessé.
Differenciáldiagnózis
- Hyporegeneratív thrombocytopeniák: constitutionális és aquirált aplasticus anaemiák (congenitalis amegakaryocytás thrombocytopenia, X-hez kötött thrombocytopenia, thrombocytopenia a radiusok hiányával /TAR/, Fanconi anaemia, Alport szindróma, Wiskott-Aldrich szindróma); sugárártalom vagy myelosuppressiv gyógyszeres kezelés következtében kialakuló thrombocytopenia; csontvelő infiltrációt okozó betegségek (akut leukaemia, myelodysplasiás szindrómák, csontvelőt infiltráló solid tumorok, raktározási betegségek); súlyos senyvesztő betegségek; súlyos malnutritio; újszülött/csecsemőkori folsav, illetve B12 vitamin hiány.
- Nem-immun THRC destrukció: microangiopathiás kórképek (HUS, TTP, DIC); macroangiopathiás destruktív thrombocytopenia (Kasabach-Merritt szindróma, vitium); hypersplenia; sequestratio. Előrehaladott sepsisben a képzés zavara és a fokozott pusztulás egyaránt fennállhat.
- Egyéb immunpathomechanizmusú thrombocytopeniák: alloimmun thrombocytopeniák (neonatalis alloimmun thrombocytopenia, posttransfusiós, posttransplantatios purpura); autoimmun kórképekhez társuló, drog-, terhesség-, HIV fertőzés-indukált immun thrombocytopeniák.
- Thrombocytopeniával járó THRC funkció zavarok: Bernard-Soulier szindróma, szürke THRC szindróma.
- Myosin nehéz lánc 9 (MYH9) mutációk és társuló betegségek (Epstein-s, Fechtner-s, Sebastian-s, May-Hegglin anomalia)
- Újszülöttekben, komplex etiológiával thrombocytopeniát okozhat a neonatális ITP, a neonatális alloimmun thrombocytopenia, intrauterin infectiók (TORCH szindróma, connatalis lues), súlyos perinatalis fertőzések, sepsis szindróma, DIC, NEC, vércsere transzfúzió, phototherápia.
- Pseudothrombocytopenia (EDTA agglutinatio).
III. Kezelés
A kezelés célja a súlyos, potenciálisan fatális vérzések megelőzése és a korlátozásmentes életmód biztosítása jelentős terápiás mellékhatások és szövődmények elkerülésével. Számos jól tervezett, randomizált, prospektív tanulmány hasonlította össze kezelési eljárások (vagy a kezelés elmaradásának - "várakozni és megfigyelni") hatékonyságát indirekt módon, többnyire a THRC-szám emelkedésének mértéke, illetőleg üteme alapján. Hiányzanak azonban a morbiditás és lethalitás közvetlen mutatóit (klinikailag jelentős vérzések csillapodása, életveszélyes, illetőleg fatális vérzések aránya, életminőség) valamint a súlyos mellékhatásokat, szövődményeket és a kezelési költségeket elemző hasonló tanulmányok, amelyek nélkül nem határozható meg bizonyossággal, hogy melyik ITP-s beteg szorul, és ha szorul, milyen kezelésre. A megfelelő evidenciaszint hiányában szakértői panelek (olasz, brit, amerikai, nemzetközi) tettek javaslatot a gyermekkori ITP kivizsgálásának és kezelésének elveire. Ezek figyelembevételével alakítottuk ki javaslatunkat a hazai betegellátás számára, amely szerint tekintettel kell lennünk a beteg vérzéses tüneteire, THRC számára, életkorára, esetleges komorbid állapotaira és a hazánkban hozzáférhető gyógyszerek és gyógyító eljárások alkalmazásának szabályaira. Mindezek alapján individuálisan kell döntenünk az adott beteg kezeléséről.
- THRC számtól függetlenül szükségesnek tartjuk az ITP kezelését súlyos, életveszélyes vérzés (intracraniális vérzés, retinavérzés, kivérzéssel járó belszervi vérzés) fellépése esetén.
- Szükségesnek tartjuk a mérsékelt thrombocytopeniával (50 G/L>THRC>30 G/L), de kiterjedt nyálkahártya vérzésekkel jelentkező beteg kezelését.
- A fenti két betegcsoportban akkor is szükségesnek tartjuk a kezelést ha a vérzéses tünetek kevésbé súlyosak, de a beteg életmódja veszélyeztető (járni tanuló kisded, aktívan sportoló gyermek/serdülő) vagy súlyos társuló, vérzésre hajlamosító betegsége van (pl.: A-V malformatio, súlyos hypertonia, ulcus pepticum, /akár minor/ kopnyatrauma, THRC-gátló gyógyszer alkalmazása, egyéb haemorrhagiás diathesis társulása).
- A vérzéses tünetek milyenségétől függetlenül szükségesnek tartjuk a súlyos thrombocytopeniás (THRC<10 G/L) beteg kezelését.
- Indokolatlannak tartjuk a kezelést és a "várakozni-és-megfigyelni" eljárást javasoljuk, ha THRC>50 G/L és a betegnek nincsenek spontán vérzései, társuló betegsége(i) és biztonságos az életvitele. Megengedhetőnek tartjuk a "várakozni-és-megfigyelni" eljárást (a beteg és a szülők/gondviselők beleegyezésének birtokában), ha THRC>20 G/L és a betegnek nincsenek nyálkahártya vérzései, kiterjedt bőrvérzései, társuló betegségei, nem folytat veszélyeztető életmódot és együttműködik a gondozását folytató egészségügyi személyzettel.
- Az 50 G/L-es THRC szám a sebészi beavatkozások többségéhez is elégséges haemostipticus hatást biztosít. Invázív fogászati kezelésekhez, lumbalpunctio elvégzéséhez elégséges 30 G/L THRC-szám. A csontvelőpunctio elvégzését az alacsony THRC szám nem korlátozza. Major sebészeti (orthopaediai műtétek, parenchymás zsigerek műtétei) beavatkozások biztonságos elvégzésének THRC célértéke >80 G/L, idegsebészeti, szemészeti műtéteké >100 G/L.
Kezelési javaslat gyermekkori akut és perzisztáló ITP-ben
- Parenterális, nagydózisú glucocorticoid (6-methylprednisolon 100 mg/m2/nap-10-30 g/ttkg/nap, 3 napig), amelyet csökkenő dózisban 2-4 hétig oralis glucocorticoid kezelés követ. Alternatív lehetőség a prednisolon orális alkalmazása 4 mg/ttkg dózisban 4 napon át, majd további 2-3 héten át, csökkenő dózisban, illetőleg a "hagyományos" (1-2 mg/ttkg) prednisolon per os alkalmazása 4-6 héten át. A mellékhatások megelőzése/mérséklése érdekében kálium-pótlás, H2-recetor antagonista, vagy protonpumpa gátló gyógyszer alkalmazása, rendszeres vérnyomás-ellenőrzés, a krisztalloid cukrok, a túlzó szénhidrát bevitel kerülése, ritkán antidiabetikus kezelés bevezetése szükséges. Egy éves életkor alatt nem javasoljuk a glucocorticoidok alkalmazását.
- Intravénás immunglobulin (IvIg) (0,8-1,0 g/ttkg, amely 72 ó múltán 1 alkalommal ismétlendő, ha THRC<30 G/L). Csecsemő- és kisdedkorban az IvIg kezelés az első választandó módszer. Életveszélyes vérzéssel járó ITP-ben adható 6-methylprednisolon alkalmazását követően.
- Akut életveszélyben, fenyegető intracraniális vérzés esetén THRC szupportáció szóbajön 6-methylprednisolonnal és IvIg-gel (evidencia: III-IV). Akut splenectomia, IvIg adásával kombinálva gyermekkorban igen ritkán szükséges. Transzfúzió adása csak súlyos anaemia társulása esetén indokolt.
- ITP kezelésére alkalmazható intravenás anti-D immunglobulin készítmény Európában nincs törzskönyvezve és nincs kereskedelmi forgalomban.
- Súlyos nyálkahártyavérzés (kivéve húgyúti vérzés!) csökkentésére antifibrinolítikum (tranexámsav, i.v.: 2-3x10 mg/ttkg/nap die, p.o.: 2-3X20-25 mg/ttkg/nap vagy epsilon-aminocapronsav, 4-6 óránként 0,05-0,07 g/ttkg, max. 0,43 g/ttkg/nap) alkalmazása javasolható. A menstruációs vérzés hormonális kezeléssel történő felfüggesztése javasolt.
- Második vonalbeli kezelés az első vonalbeli kezelésre nem reagáló, súlyos vérzéssel társuló, alacsony THRC számmal jellemzett, perzisztáló ITP-ben válhat szükségessé. A számításba jövő készítmények többsége - önmagukban vagy glucocorticoid kezeléssel együtt - ebben az életkorban és indikációban nincsenek törzskönyvezve: vincristine 0,02 mg/ttkg i.v., hetente 1X, 4-6 alkalommal; cyclosporin-A 2,5-3,0 mg/ttkg/nap per os (szérumszint ellenőrzés szükséges!), rituximab 375 mg/m2, hetente 1X, 2-4 alkalommal. Törzskönyvezett, jól használható, második vonalbeli gyógyszer az azathioprin (1-3 mg/ttkg/nap).
Kezelési javaslat gyermekkori krónikus ITP-ben
Gyermekkorban a 6 hónapnál tovább perzisztáló ITP is meggyógyulhat, a tényt a korai krónikus (6-12 hónapja fennálló) folyamat kezelési tervének kialakítása során mérlegelni kell. Krónikus, szimptómás gyermekkori ITP-ben nem rendelkezünk egységesen hatékony gyógyszerrel, illetőleg terápiás eljárással. Az akut és perzisztáló ITP-ben alkalmazott gyógyszerek krónikus ITP-ben is hatékonyak lehetnek.
- Kedvező IvIg terápiás effektus esetén a készítmény ismételt adása válhat szükségessé 3-4 hetenként.
- A glucocorticoidokat a mellékhatások csökkentése érdekében az effektív hemostiptikus hatást biztosító legkisebb dózisban, lehetőleg alternáló gyógyszerbevitel formájában alkalmazzuk. Újabb ajánlások szerint kedvezőbb terápiás effektus és mellékhatás-profil várható nagydózisú 6-methylprednisolon 3 napos, vagy nagydózisú dexamethason (28-40 mg/m2 - nem törzskönyvezett indikáció) egyszeri adásától. A hatás gyakran átmeneti, ismétlés válhat szükségessé.
- Glucocorticoid igényt csökkentő hatásuk miatt szóba jön a perzisztáló gyermekkori ITP másodikvonalbeli kezelésére ajánlott gyógyszerek alkalmazása, amely kibővíthető az explicit módon nem ellenjavallt cyclophosphamiddal (2,5-3 mg/ttkg/nap).
- Splenectomia csak életveszélyes vérzéssel járó, vagy elhúzódó, súlyos vérzéses epizódokkal, súlyos gyógyszermellékhatással terhelt, a beteg gyermek életminőségét egyértelműen rontó, életmódját korlátozó krónikus ITP-ben, lehetőleg 5 éves kor elérése után javasolt. A műtét napjainkban preferált formája a laparoscopos splenectomia. A beavatkozás előtt, lehetőleg nem immunszupprimált állapotban, tokképző kórokozók elleni vaccináció szükséges (Haemophilus, Pneumococcus, Meningococcus ellen). Amennyiben a beteg a védőoltásokat a műtét előtt nem kapta meg, azokat a műtét után 14 nappal követően szükséges pótolni. A védőoltások ismétlése 5 évvel az eredeti vaccináció után (szükség esetén infektológiai konzílium figyelembe vételével) mérlegelendő. A splenectomia után antibiotikum (penicillin származékok, túlérzékenység esetén makrolid készítmények) profilaktikus adása szükséges: sérült immunitású betegekben élethosszig, 5 éves kor alatt splenectomizált betegekben legalább 3-5 éven, 5 éves kor fölött splenectomizált betegekben legalább 2-3 éven át.
- A splenectomiára nem bocsátható vagy arra kedvezőtlenül reagáló krónikus ITP-s gyermekbetegek kísérleti terápiára szorulnak. A krónikus ITP kezelésében használt első- és másodvonalbeli gyógyszerek eredménytelensége esetén ígéretes terápiás lehetőségnek tartjuk a felnőtt korú betegek számára már törzskönyvezett thrombopoetin receptor serkentők alkalmazását. Az elthrombopag megbízható gyermekkori dózisa nem ismert, viszont egyedi engedély alapján (OGYI), a romiplostim "off-label" alkalmazása szóba jön. A kezdeti dózis 1 mcg/ttkg/hét, kéthetente 2 mcg/ttkg/hét dózissal emelve, legfeljebb 10 mcg/ttkg/hét dózis eléréséig. A kezdeti eredmények nagyon biztatóak, rezisztens esetekben is jó hatást érhetünk el, ill. a szteroid adag lényegesen csökkenthető. Bizonyos esetekben a splenectomia is elkerülhető lehet. További terápiás alternatívát jelentenek a mycophenolat mofetil, a nem virilizáló androgén készítmények, az autológ vagy az allogén hematopoetikus őssejt átültetés.
Kezelsi javaslat neonatális ITP-ben
Az újszülött klinikailag manifeszt vérzés vagy igen alacsony THRC szám esetén (THRC<20 G/L) IvIg kezelést igényel 1 g/ttkg dózisban. Az IvIg kezelés megfontolható 20<THRC<50 G/L THRC szám esetén. Életveszélyes vérzés, intracraniális vérzés esetén THRC szupplementáció, anaemizálódás esetén vvs koncentrátum adása szükséges. Kerülni kell az excesszív vérvételeket, különösen a kapilláris mintavételeket.
Kezelési javaslat neonatális alloimmun thrombocytopeniában
IvIg a neonatalis ITP-hez hasonló módon alkalmazható. Súlyos, életveszélyes vérzés, vagy annak veszélye esetén az újszülött a célantigént nem tartalmazó THRC koncentrátum adására szorul (amely például az anyától nyerhető ferezissel).
IV. Rehabilitáció
V. Gondozás
ITP kezelésért felelős személyek és alkalmazandó eljárások
- Enyhe és középsúlyos esetek ellátása, gondozása: hematológiai gyermekbeteg ellátásban járatos gyermekgyógyász szakorvos által, sürgősségi fekvőbetegellátó háttérrel rendelkező gyermekhematológiai szakambulanciákon.
- Súlyos, perzisztáló és súlyos krónikus ITP ellátása, IvIg kezelés kivitelezése, hemoszubsztitució, sürgős, ill. nagyobb kockázatú műtét szükségessége esetén: gyermekhematológiai centrumokban.
- Egyes másod- és harmadvonalban, illetőleg experimentális terápiás eljárásként alkalmazható gyógyszerek hozzáférhetősége nem biztosított, nincsenek törzskönyvezve: OGYI engedély beszerzése, többletfinanszírozás (egyedi méltányosság) eszközlése szükséges.
VI. Irodalomjegyzék
1. De Mattia D, Del Principe D, Del Vechio GC, et al.: Acute childhood idiopathic thrombocytopenic purpura: AIEOP consensus guidelines for diagnosis and treatment. Associazione Italiana di Ematologia e Oncologia Pediatrica. Haematologica 2000; 85: 420-424.
2. Kiss C: Immunthrombocytopeniák a gyermekkorban. In: Boda Z (szerk.): Thrombosis és vérzékenység. Medicina, Budapest, 2006; 208-218.
3. Tarantino MD, Bolton-Maggs PHB: Update ont he management of immune thrombocytopenic purpura in children. Curr Opin Hematol 2007; 14:526-534.
4. Provan D, Stasi R, Newland AC, et al: International consensus report on the investigation and management of primary immune thrombocytopenia. Blood 2010;115: 168-186.
5. Del Vecchio GC et al and the AIEOP ITP Study Group: Management of acute childhood idiopathic thrombocytopenic purpura according to AIEOP consensus guidelines. Acta Hematol 2008; 119: 1-7
6. Blanchette V, Bolton-Maggs P: Childhood immune thrombocytopenic purpura: diagnosis and management. Pediatr Clin N Am 2008; 55: 393-420
7. Bennett CM, Tarantino M: Chronic immune thrombocytopenia in children: epidemiology and clinical presentation. Hematol Oncol Clin N Am 2009; 23: 1223-38
VII. Melléklet
ITP kezelése 6 év felett

ITP kezelése 6 év alatt

A NEUTROPENIAS GYERMEK FERTŐZÉSEINEK ELLÁTÁSA
I. Alapvető megfontolások
A Magyar Gyermekonkológusok és Gyermekhematológusok Társasága, az Infektológiai Szakmai Kollégium és a Transzfúziológiai és Hematológiai Szakmai Kollégium közös szakmai irányelve
Előzmények és módszer
Neutropéniás betegek infekciónak ellátásával foglalkozó hazai szakmai protokoll utoljára 2009-ben jelent meg (1), ez azonban a korábbi kiadásokhoz hasonlóan nem tartalmaz speciálisan gyermekbetegekre vonatkozó ajánlásokat, javaslatai nem alkalmazhatók változatlan formában gyermekekre. A korcsoportra jellemző alapbetegségek, és az alkalmazott gyógymódok eltérő spektruma, a különleges kolonizációs viszonyok, fertőzések kapcsán a felnőttekétől eltérő formában jelentkező válaszreakciók, valamint a szintén különböző hemodinamikai és élettani paraméterek miatt szükségesnek látszik a gyermekbetegekre vonatkozó, nemzetközi evidenciákon alapuló, hazai viszonyokra adaptált protokoll kidolgozása (2). Jelen dokumentumban megfogalmazott megállapítások elsősorban a súlyosan neutropéniás, jellemzően malignus alapbetegség miatt kemoterápiás kezelésben részesült, gyermekek fertőzéseire vonatkoznak. Részben azonban érintik az egyéb ok (pl. kongenitális neutropéniák, aplasztikus anaemia) miatt neutropéniás, valamint a vérképző őssejt-átültetésben részesült betegek infekciót is. A szerzők felhívják a figyelmet arra, hogy a megfogalmazott ajánlások általános jellegűek, ezért konkrét klinikai helyzetben történő alkalmazásuk során körültekintően kell eljárni.
A lázas neutropenia jelentősége
Malignus betegségben szenvedő gyermekek körében az egyik legfontosabb morbiditási és mortalitási tényező a fertőzés. A láz a neutropéniás beteg fertőzésének első, gyakran egyetlen klinikai tünete. Adott esetben súlyos, akár életveszélyes fertőzések is játszódhatnak tünetszegény formában, ilyenkor a klinikus számára az egyetlen támpontot a neutropéniás időszakban jelentkező láz jelentheti. A hypothermia igen ritka, előfordulása rossz prognózist jelez. A kemokezelés-indukálta neutropéniák körülbelül egyharmadában jelentkezik láz. Az 1970-es években bizonyították, hogy lázas neutropénia esetén empirikusan alkalmazott széles spektrumú antibiotikumok jelentősen csökkentik ennek a kórképnek a halálozását. A széles körben alkalmazott antibiotikum kezelés ugyanakkor jelentős szervi toxicitással járhat és elősegíti rezisztens kórokozók elterjedését. Újabb epidemiológiai adatok birtokában lehetőség nyílik a neutropéniás populáció kockázati csoportokra való bontására és rizikóadaptált kezelés alkalmazására (3).
Evidenciaszintek
Az alább megfogalmazott irányelvek a bizonyítékon alapuló orvoslásban meghatározott kritériumokra támaszkodnak. Az evidenciaszintek értékeléséhez használatos rendszer az 1. táblázatban látható.
1. táblázat. Bizonyítékok értékelése
| A BIZONYÍTÉK | |
| FORRÁSA | |
| I | Egy vagy több randomizált, kontrollált vizsgálat |
| II | Egy vagy több, megfelelően tervezett, nem randomizált vizsgálat |
| III | Szakértők, bizottságok véleménye, klinikai tapasztalat |
| AZ AJÁNLÁS | |
| MEGALAPOZOTTSÁGA | |
| A | A rendelkezésre álló adatok a módszer alkalmazását egyértelműen alátámasztják |
| B | A rendelkezésre álló adatok a módszer alkalmazását nagyrészt alátámasztják |
| C | A rendelkezésre álló adatok a módszer alkalmazását csak csekély mértékben támasztják alá |
| D | A rendelkezésre álló adatok nagyrészt a módszer alkalmazása ellen szólnak |
| E | A rendelkezésre álló adatok egyértelműen a módszer alkalmazása ellen szólnak |
Definíciók
Neutropénia. Az infekciók jelentkezésének valószínűsége és azok súlyossága függ a neutropénia mélységétől és időtartamától. Jelen irányelv a NCI 4-es fokozatú, 0,5 G/l alatti neutropéniák kezeléséről szól (4). A 0,1 G/l alatti neutrofil-szám különösen hajlamosít infekciókra. Hozzáadódó kockázatot jelent az egyidejűleg jelenlévő barrier-sérülés (pl. mucositis), celluláris vagy humorális immunhiány. A gyermekonkológiai betegek fertőzései rendszerint a neutropéniás időszakban jelentkeznek, azonban jó neutrofil-szám mellett sem zárható ki életveszélyes infekciók fellépte. A gyermekek több mint 90%-a tartósan centrális vénás kanült visel, ami infekciók kialakulása szempontjából további állandó kockázatot jelent. A lázas onko-hematológiai gyermekbeteg a neutrofil-számtól függetlenül gondos elbírálást igényel.
Láz. A gyermek lázas, ha hónaljban mért testhőmérséklete a) egy alkalommal eléri vagy meghaladja a 38,0 Celsius-fokot, b) egy órán át folyamatosan 37,7 fokos, vagy c) 12 órán belül kétszer eléri a 37,7 fokot. Ha a testhőmérsékletet szájban vagy fülben határozzák meg, 0,3 Celsius fokkal magasabb értékek az irányadók. A mucosa sérülése és következményes bakterémia veszélye miatt a rektális lázmérés nem javasolt.
II. Diagnosztika
Fizikális vizsgálat. Az általános gyermekgyógyászati vizsgálat során keresni kell az infekció jeleit, különösen a neutropéniás betegekre jellemző predilekciós helyeken. Szükséges a bőr hajlatainak áttekintése, a centrális kanül bemenetének és bőralatti alagútjának tüzetes vizsgálata, a punkciók helyének megítélése. Fontos a szájnyálkahártya és a torokképletek megtekintése. Nem mellőzhető a gáttájék (pl. perianális gyulladás és fissura) illetve a körömágyak alapos vizsgálata sem. A fizikális vizsgálatot a szegényes tünetek miatt létfontosságú rendszeresen megismételni!
Javasolt vizsgálatok. A lázas neutropéniás beteg ellátása során a 2. táblázatban feltüntetett vizsgálatok elvégzése javasolt. Hemokultúra vétele az első láz észlelésekor, antibiotikum adása előtt, lehetőleg a láz felszálló ágában történjen. Az egyszerre levett vérmennyiséget két hemokultúra palackba kell elosztani. Minden palackba pontosan az előírt mennyiségű vér jusson. Szükséges a vérvétel valamennyi centrális vénás eszköz valamennyi lumenéből, valamint egy perifériás vénából is. Húsz perc elteltével javasolt újabb hemokultúra pár levétele. A hemokultúrákon kívül ajánlott a neutropéniás lázas kislányok vizeletleoltása, mert náluk ebben az állapotban húgyúti infekció tünetmentesen és pyuria nélkül is fellép (5). A mintavétel középsugarú vizeletből történjen, mivel a katéterezés neutropéniában kerülendő. Infekciós fókusz (tüdőinfiltrátum, bőrléziók, stb.) esetén törekedni kell a megfelelő mintavételre. A kockázat mérlegelése után ehhez akár invazív eljárásokat (aspiráció, biopszia) is igénybe kell venni (2).
A gyulladásos paraméterek meghatározása hasznos diagnosztikus információkat szolgáltat a klinikus részére. A fehérvérsejtszám értelemszerűen nem megfelelő marker ebben a betegcsoportban, a vörösvértest süllyedést lassú változása és aspecifikus volta szintén alkalmatlanná teszi. A C-reaktív protein (CRP), a prokalcitonin (PCT) és az interleukin-6 (IL-6) használata számos centrum általános gyakorlatának részét képezi. Ugyanakkor felhívjuk a figyelmet, hogy a neutropéniás lázas gyermekpopuláción végzett vizsgálatok tanúsága szerint ezen markerek szenzitivitása szepszisre vonatkoztatva nem haladja meg a 70 százalékot, csúcskoncentrációjuk eléréséhez órákra vagy napokra van szükség (6, 7, 8). Értéküket egyes sejt- és szövetszéteséssel, citokin felszabadulással járó egyéb gyulladásos reakciók is megváltoztathatják, így antithymocyta-globulin- és monoklonális antitestkezelés után nem használhatók. A kezdeti antibiotikum-kezelés indításához az akut fázis vizsgálatok eredményének megvárása felesleges és káros, a klinikai kritériumoknak megfelelő lázas neutropéniás gyermek kezelését haladéktalanul (1 órán belül) meg kell kezdeni (64.). A neutropéniás lázas gyermekek ellátásába infektológus szakorvos bevonása rendszeres konzultációk formájában elengedhetetlen.
2. táblázat. Neutropéniás láz esetén elvégzendő vizsgálatok (IIB)
| VIZSGÁLAT | FELTÉTEL |
| Fizikális vizsgálat | Minden esetben |
| Mennyiségi és minőségi vérkép | Minden esetben |
| Szérum elektrolitok, kreatinin, karbamid nitrogén, transzaminázok | Minden esetben |
| Akut fázis fehérjék vizsgálata (CRP, prokalcitonin) | Lehetőség szerint |
| Hemokultúra (kétszer, perifériás vénából +/- centrális vénás kanül | Minden esetben |
| valamennyi lumenéből) | |
| Kanülkörnyék leoltása + Gram festés | Kanülinfekció gyanúja esetén |
| Vizelettenyésztés | Klinikai tünetek esetén (lányoknál mindig) |
| Széklettenyésztés (enterális patogén baktériumok) | Területen szerzett hasmenés, kórházi járvány gyanúja esetén |
| Széklet Clostridium difficile toxin kimutatás | Klinikai gyanú esetén |
| VIZSGÁLAT | FELTÉTEL |
| Széklet protozoon | Egy hétnél hosszabb hasmenés esetén |
| Liquor vizsgálat | Klinikai tünetek esetén |
| Bőrléziók aspirációja/biopsziája | Klinikai tünetek esetén |
| Mellkas PA felvétel | Klinikai tünetek esetén (i) |
| Mikrobiológiai mintavétel, biopszia egyéb anatómiai régióból | A területet érintő infekcióra utaló klinikai tünetek esetén |
| Nagy felbontóképességű mellkasi és arckoponya CT | > 5 napig tartó lázas neutropéniában ill. pulmonális mycosis gyanújakor |
| Surveillance mikrobiológiai vizsgálatok (orrváladék, garatváladék, vizelet, | Infekció kontroll céljából megfontolandó |
| széklet, kanülkörnyék) a centrum helyi gyakorlatának megfelelően | (MRSA, VRE, rezisztens Gram-negatív törzs okozta |
| (pl. hetente) | kolonizáció) |
III. Kezelés
ANTIBAKTERIÁLIS KEZELÉS
Empirikus antibakteriális kezelés
Mivel a neutropéniás betegek infekciói gyorsan progrediálhatnak, megfelelő ellátás nélkül halálozási arányuk magas, klinikai tünetek esetén pedig a fertőzés kizárására biztonságos módszer nem áll rendelkezésre, a neutropéniás láz felléptekor valamennyi beteget azonnal empirikus antibakteriális kezelésben kell részesíteni. Mivel szepszis esetén minden óra késlekedés szignifikánsan csökkenti a túlélési esélyeket (65), javasolt a kezelést egy órán belül elkezdeni. Otthon ápolt gyermekek szüleit fel kell világosítani, hogy láz esetén haladéktalanul jelentkezzenek a gondozó intézetben.
Az empirikus kezelés a leggyakrabban előforduló, ezen belül a legnagyobb letalitást előidéző bakteriális kórokozók (P. aeruginosa, Klebsiella spp., E. coli, viridans streptococcusok, S. aureus) ellen irányul. A nemzetközileg elfogadott irányelvek öt, Pseudomonas-ellenes aktivitással is rendelkező antibiotikumot sorolnak fel, melyek lázas neutropénia esetén monoterápiában alkalmazhatók (IA, 10, 11). A gyógyszerek dózisai és jellemzői a 3. táblázatban találhatók. Bár az ajánlásoknak megfelelően a felsorolt szerek bármelyike választható, ceftazidim használata esetében figyelemmel kell lenni annak csekély Gram pozitívellenes hatékonyságra, imipenem alkalmazásakor pedig a szer központi idegrendszeri görcskészséget fokozó aktivitásra. Ha egyéb iránymutató vagy korlátozó tényező nem merül fel, a lázas neutropéniás gyermek empirikus antibakteriális kezelésére elsősorban piperacillin/tazobaktám, meropenem vagy cefepim ajánlható.
3. táblázat. Neutropéniás lázban monoterápiában, empirikusan használt antibiotikumok
| ANTIBIOTIKUM | DÓZIS | MEGJEGYZÉSEK |
| Cefepim | 50mg/kg (max 2g) 8 óránként, | Egyes Gram pozitív törzsekre is hat. Nem aktív MRSA, anaerobok és Enterococcus ellen |
| Ceftazidim | 50mg/kg (max 2g) 8 óránként, | Csekély Gram pozitív-ellenes aktivitás Nem aktív MRSA, anaerobok és Enterococcus ellen Alacsonyabb evidencia-szintű ajánlás (IIB) |
| Imipenem/cilastatin | 25mg/kg (max 1g) 6 óránként, | Számos Gram negatív és Gram pozitív kórokozó ellen hatásos. Anaerob törzsekre is hat, nem hat MRSA-ra és VRE-re Enterococcus speciesekkel szemben aktivitása marginális Fokozza a központi idegrendszeri görcskészséget |
| Meropenem | 20mg/kg (max 2g) 8 óránként, | Számos Gram negatív és Gram pozitív kórokozó ellen hatásos. Anaerob törzsekre is hat, nem hat MRSA-ra és VRE-re Enterococcus speciesekkel szemben aktivitása marginális |
| Piperacillin/tazobactam | 100mg/kg (max 4,5g) 8 óránként, | Számos Gram negatív és Gram pozitív kórokozó ellen Anaerob törzsekre is hat Nem hat MRSA-ra és VRE-re Álpozitív galactomannan eredményt okozhat |
A korábban arany standardként alkalmazott béta-laktám és aminoglikozid kombináció előnyeit az e tárgykörben végzett tanulmányok meta-analízise nem bizonyította, ugyanakkor a nephrotoxicitás reális veszélynek bizonyult. Másrészt az utóbbi évek során hazánkban is növekszik egyes nozokomiális baktériumok körében a béta-laktámokra kevésbé érzékeny fajok aránya, ezért súlyos szepszisben, szeptikus sokkban, illetve rezisztens baktérium okozta infekció gyanúja esetén, primer kombináció részeként aminoglikozidot is lehet alkalmazni (IIIC,12). Hasi panaszok, véres széklet vagy hasi fájdalom jelentkezése esetén metronidazol adása megfontolandó a kezelés kiegészítéseként (13).
Glikopeptidek
A lázas neutropéniás betegek dokumentált infekcióinak többségét Gram-pozitív baktériumok okozzák, ráadásul az izolátumok többsége béta-laktám szerekre rezisztens koaguláz-negatív Staphylococcus. Mindezek miatt logikus lépésnek tűnne a Gram-pozitív spektrum bővítése a kezdeti empirikus kezelés során. A témakörben végzett vizsgálatok azonban nem igazolták a kezdeti vancomycin kezelés előnyét (14,15,16). Ennek oka az lehet, hogy a leggyakoribb Gram pozitív baktériumok virulenciája általában alacsony. Meg kell azonban jegyezni, hogy a szintén Gram-pozitív zöldítő Streptococcusok, a S. aureus illetve esetenként az Enterococcusok súlyos infekciókat okozhatnak. A glikopeptid antibiotikumok széles körű használata rezisztens törzsek (így pl. vancomycin-rezisztens enterococcusok, VRE) elterjedését eredményezheti. A vancomycin rezisztencia egyes külföldi centrumokban a 30%-ot is eléri, évi 8%-os infekció-incidenciát okozva (17). Mindezeket figyelembe véve vancomycin vagy teicoplanin adása a kezdeti empirikus kezelés részeként csak a 4. táblázatban látható feltételek teljesülése esetén ajánlott az 5. táblázat leírt módon (18).
4. táblázat. Empirikus glikopeptid-kezelés indikációi
| Intravascularis kanülinfekció |
| Ismert kolonizáció meticillin-rezisztens Staphylococcus aureusszal |
| Ismert kolonizáció penicillin és cephalosporin-rezisztens Strepto-coccus pneumoniaevel |
| Hemokultúrából tenyésző Gram pozitív kórokozó |
| Keringésmegingás, súlyos szepszis, szeptikus shock (lásd később) |
| Súlyos mucositis, bőr- vagy lágyrészinfekció |
5. táblázat. Glikopeptid antibiotikumok alkalmazása
| GYÓGYSZER | DÓZIS | MEGJEGYZÉS |
| Vancomycin | Stabil beteg: | A terápiás |
| 4x15mg/kg 1 óra | mélyszint nem | |
| alatt, mélyszint | lehet kevesebb, | |
| 10-15mg/ml között | mint 10mg/ml | |
| Kritikus állapotú | ||
| beteg: telítő dózis | ||
| 25-30mg/kg 2 óra | ||
| alatt, majd 4x20mg | ||
| 1 óra alatt, mélyszint | ||
| 15-20mg/ml között | ||
| (19) | ||
| Teicoplanin | Első nap: 2x10mg/kg | Kevesebb |
| Második naptól: | nephrotoxicitás, | |
| 1x10mg/kg | nem kell szintet | |
| mérni |
Orális kezelés
Felnőttekben számos vizsgálat bizonyította, hogy a lázas neutropéniás betegek között egyértelműen elkülöníthető egy olyan csoport, melyben a súlyos, illetve fatális kimenetelű infekció kockázata kisebb. Az ide sorolható betegek kizárólag per os adott gyógyszerekkel, akár ambulánsan is kezelhetők (IA). A gyermekbetegek már említett, eltérő sajátságai folytán, a felnőttekben validált kockázatelemzési módszereket nem lehet a 18 év alatti korcsoportra alkalmazni (20). Az alacsony rizikójú csoport elkülönítésére gyermekek körében is történtek vizsgálatok (21,22,23,24,25,26). Fel kell hívni a figyelmet azonban arra, hogy egyik tanulmány sem vizsgálta a kezdeti orális kezelés biztonságosságát, és szinte mindegyik más beválasztási kritériumot alkalmazott. A legfontosabb kockázati tényezőket a 6. táblázatban foglaltuk össze. Kis kockázatú gyermekek körében több vizsgálat is elemezte, hogy akik a kezdeti parenterális antibiotikum-kezelés után láztalanná válnak, szekvenciális orális kezelés mellett hazabocsáthatók-e. A tanulmányok szerint a módszer biztonságos alternatívának bizonyult (27,28,29,30,31,32). A hazaengedés feltételeit a 7. táblázat foglalja össze. Erre legkorábban 48 óra, egyes tanulmányok szerint 72 óra parenterális kezelés után kerülhet sor. Az orális szekvenciális terápiában rendszerint cefiximet, ritkábban ciprofloxacint alkalmaztak. Meg kell jegyezni, hogy a felsorolt orális antibiotikumok, főleg a cefixim hatásspektruma a jelenlegi haza rezisztencia trendek tükrében kívánnivalót hagy maga után. Mindezek folytán a gyógyintézeten kívüli kezelés olyan lehetőség, mellyel csak minden szempont mérlegelése után, a biztonságosság valamennyi feltételének megléte esetén, a szülő/gondviselő felvilágosítása és bevonása után lehet, de semmiképp sem kötelező élni.
6. táblázat. Rizikóelemzés gyermekkori lázas neutropéniában
| JELLEMZŐ MAGAS KOCKÁZATÚ FELTÉTELEK (akár egy tényező jelenléte is magas rizikó, ha egy sincs jelen, akkor alacsony kockázat) |
| Gyenge általános állapot |
| Magas láz (39 fok felett) |
| Hemodinamikai instabilitás |
| Súlyos szövődmény jelenléte (pneumonia, mucositis, cellulitis, phlegmone, kanülinfekció, dehidráció) |
| Indukciós kezelés |
| Mély neutropénia (ANC<0,1G/l), várhatóan elhúzódó neutropénia |
7. táblázat: A hazabocsátás feltételei
| Láztalan állapot legalább 24 órán át |
| Emelkedő thrombocyta vagy abszolút fagocita-szám (neutrofil+monocyta) |
| Két évnél idősebb életkor |
| Megbízható gondviselő |
| Limitált távolság a kórháztól (érkezés 1 órán belül) |
| Nincs jelentős laboreltérés (akut fázis fehérjék, máj- és vesefunkció, elektrolitok) |
| Hemokultúrák sterilek |
| Nem volt korábban fluorokinolon profilaxis (rezisztens kórokozó) |
| Orális ciprofloxacin vagy cefixim nem ellenjavallt és adható |
Az antibakteriális kezelés folytatása
Az elmúlt évtizedek jellemző gyakorlata volt az empirikus széles spektrumú antibiotikum kezelést a neutropénia oldódásáig folytatni. Az adatok retrospektív elemzéséből azonban levonható következtetés, hogy a betegek jelentős részében nem előnyös a hosszú antimikróbás kezelés, és a szerek toxicitása és a terjedő rezisztencia sem elhanyagolható szempont. Bizonyos feltételek teljesülése esetén, az orális kezelésben leírtak figyelembe vételével a parenterális kezelés neutropénia alatt is abbahagyható. Magas rizikójú betegben a megkezdett kezelést láztalan állapotban is folytatni kell, kórokozó identifikálása esetén természetesen a rezisztencia-viszonyokhoz igazítva. Gram-negatív-, illetve Pseudomonas-ellenes aktivitással rendelkező szer adása akkor is szükséges, ha a releváns mikrobiológiai lelet csak Gram-pozitív kórokozó jelenlétét igazolja (két vagy több hemokultúrából is azonos baktérium tenyészik). Az empirikus antibiotikum-kezelés első hetében a következő klinikai válaszokat észlelhetjük.
A gyermek láztalan a 3-5. napon. a) A kórokozó ismert: Ha a kórokozó ismert, a célzott terápiát addig kell folytatni, amíg az infekció tünetei megszűnnek, a hemokultúrák sterillé válnak és az abszolút neutrofil-szám meghaladja a 0,5 G/l-t. Ha az utóbbi feltétel nem teljesül, az antibiotikum csak a beteg szoros megfigyelése mellett hagyható el. A kezelés időtartama ne legyen 7 napnál rövidebb. b) A kórokozó nem ismert: Amennyiben a láz hátterében kórokozót identifikálni nem lehetett, szervi érintettségre utaló jelek (pl. pneumonia) hiányában a kis kockázati csoportba tartozó, legalább két napja láztalan beteg esetében mérlegelni lehet szekvenciális, orális kezelés alkalmazását. Amennyiben az abszolút neutrofil-szám két egymást követő napon meghaladja a 0,5 G/l értéket, a gyermek 48 órája láztalan és infekciónak látható jele nincs, az antibiotikum-kezelés elhagyható.
Amennyiben a láztalan beteg még a hetedik napon is neutropéniás, a kis kockázatú beteg kezelését folytassuk öt-hét láztalan napon át, majd a gyógyszer gondos megfigyelés mellett elhagyható. Nagy rizikó esetén a kezelés folytatása javasolt a neutropéniás időszak végéig. A gyermek a kezelés 3-5. napján még lázas. Ha a beteg állapota nem változott (stabil), folytathatjuk a korábban megkezdett antibakteriális terápiát. Ha glikopeptid adásának indikációja nem áll fenn, és a beteg empirikus glikopeptid terápiában részesült, a szert el kell hagyni. Stabil lázas neutropéniás beteg kezelése két hétig folytatandó.
Ha az infekció progrediál, szükségessé válik a kezdeti kezelés módosítása vagy kiegészítése. A változtatás során szem előtt kell tartani az empirikusan adott szerek antibakteriális spektrumának hiányosságait, és a feltételezett kórokozó várható érzékenységét. Ha a beteg empirikusan nem kapott vancomycint vagy teicoplanint, és a glikopeptid adásának indikációja fennáll, kiegészítésként e szerek valamelyikét választhatjuk (IIIC). A perzisztáló láz miatt, ha azt egyéb új tünet vagy a beteg állapota azt nem indokolja, glikopeptid vagy aminoglikozid empirikus adása nem javasolt (ID, IIIC).
Instabil beteg, súlyos szepszis vagy szeptikus shock esetén az iniciális béta-laktám szer kicserélése (lásd 3. táblázat), illetve az antibakteriális spektrum aminoglikoziddal és glikopeptiddel történő kiszélesítése javasolt. Az ötödik napon perzisztáló láz esetén gombaellenes szer adása megfontolandó (lásd antifungális kezelés). Tartós láz, de csontvelői regeneráció jelei esetén az antibiotikum adása öt egymást követő napon át javasolt, amikor az abszolút neutrofil-szám meghaladja a 0,5 G/l értéket. Az empirikus antibiotikum-kezelés gyakorlatát a 8. táblázat foglalja össze.
8. táblázat. Antibiotikum-kezelés lázas neutropéniás gyermekekben (10)
| KEZDETI EMPIRIKUS KEZELÉS | ||
| Monokezelés | piperacillin/tazobaktám VAGY meropenem VAGY cefepim | |
| Aminoglikozid | Súlyos szepszis, szeptikus shock, gyanú rezisztens baktériumra (surveillance lelet | |
| alapján) | ||
| Glikopeptid | Ha teljesülnek a feltételek (4. táblázat) | |
| A GYERMEK LÁZTALAN A HARMADIK | ||
| NAPON | ||
| Nincs dokumentált infekció | Alacsony rizikó ÉS hazaadható beteg: orális ciprofloxacin vagy cefixim | |
| Magas rizikó ÉS/VAGY kórházi beteg: a megkezdett kezelés folytatása | ||
| Dokumentált infekció | Célzott kezelés (antipseudomonas spektrum fenntartása) | |
| Kezelés elhagyható, ha | ANC>0,5G/l két egymást követő napon, ÉS | |
| a beteg 48 órája láztalan, ÉS | ||
| infekciónak nincs klinikai jele | ||
| Tartós neutropénia a hetedik napon | Alacsony rizikó: kezelés folytatása öt-hét láztalan napig | |
| Magas rizikó: kezelés folytatása a neutropénia végéig | ||
| PERZISZTÁLÓ LÁZ A KEZELÉS HARMADIK- | ||
| ÖTÖDIK NAPJÁN | ||
| Újraértékelés a negyedik-ötödik napon | Neutrofil-szám, állapot, szepszis jelei, glikopeptid-indikáció, akut fázis fehérjék, | |
| hemokultúrák | ||
| Ha nincs állapotromlás | Antibiotikumok folytatása | |
| Glikopeptid elhagyása, ha hemokultúrák negatívak | ||
| Instabil beteg, súlyos szepszis, szeptikus | Antibiotikum-váltás, + aminoglikozid, + glikopeptid | |
| shock | ||
| Perzisztáló láz az ötödik napon | Antifungális kezelés megfontolása | |
| Abszolút neutrofil-szám > 0,5 G/l | Kezelés elhagyása négy-öt nap múlva megfontolandó | |
| Abszolút neutrofil-szám < 0,5 G/l | Két hét kezelés után újraértékelés | |
Multirezisztens kórokozók, infekciókontroll
A gyermek onkohematológiai osztályok betegeiben az őket érintő számos hajlamosító tényező hatására multirezisztens baktériumok okozta kolonizáció illetve infekció léphet fel. E kórokozók közé sorolhatók a széles spektrumú béta-laktamáz (ESBL) termelő Gram-negatív speciesek, a meticillin-rezisztens S.aureus (MRSA), a multirezisztens Gram-negativ baktériumok (elsősorban P. aeruginosa, A. baumannii, S. maltophilia) a vancomycin-rezisztens enterococcusok (VRE) valamint a csökkent glycopeptid érzékenységű S.aureus (GISA). Az általuk okozott infekciók gyakoribbá válása illetve a fertőzések helyi halmozódása szükségessé teheti az antimikróbás kezelés stratégiájának megváltoztatását.
A multirezisztens baktériumok okozta infekciók terjedésének megelőzésében szerepe van a betegek körében végzett mikrobiológiai szűrővizsgálatoknak (surveillance leoltások). A lázas neutropénia felléptét megelőzően ismertté váló kolonizáció támpontot ad az empirikus antibiotikum kezelés helyes megválasztásához. Ugyanakkor hangsúlyozzuk, hogy az ismert kolonizációjú gyermek láza nem jelent feltétlenül bizonyított infekciót (33). A nozokomiális terjedés megakadályozása érdekében, a vonatkozó közegészségügyi előírásoknak megfelelően, kezdeményezni kell a kolonizált gyermek elkülönítését (kontakt izoláció).
Tekintettel a multirezisztens speciesek aggasztó mértékű terjedésére és az onkohematológiai gyermekbetegek elkerülhetetlen és jelentős antibiotikum expozíciójára, elengedhetetlen, hogy a centrumok hatékony infekció kontroll rendszert működtessenek. A multirezisztens kórokozók ellen alkalmazható antibiotikumokat a 9. táblázat tartalmazza.
9. táblázat. Multirezisztens kórokozók estén használatos antibiotikumok
| KÓROKOZÓ | LEÍRÁS | GYÓGYSZER | DÓZIS |
| ESBL | Széles spektrumú béta-laktamázt termelő Gram- negatív baktérium | Carbapenemek | Lásd 3. táblázat |
| MRGNB | Multirezisztens Gram-negatív baktérium | Colistin | 50000 E/kg/nap, max 75000 E/kg/nap, 3 részre osztva |
| VRE | Vancomycin- rezisztens Enterococcusok | Linezolid | 10mg/kg 8 óránként |
| MRSA/MRSE | Meticillin- rezisztens Staphylococcusok | Glikopeptidek | Lásd 5. táblázat |
Nekrotizáló enterocolitis (neutropéniás typhlitis)
A citotoszatikus gyógyszerek toxikus hatásának következtében a neutropénia mélyén nektrotizáló enterocolitis alakulhat ki, melynek predilekciós helye a coecum (typhlon). Oka a bélfal különböző rétegeinek bakteriális invázió és védekezési képtelenség következtében létrejött elhalása. Első leírása gyermekekből származik (34), incidenciája ismeretlen (súlyos klinikai tüneteket okozó előfordulása 3,5%, diagnosztizálatlan előfordulását akát 46%-ra is becsülik). Kemokezelés után 10-14 nappal, mély neutropéniában hasi fájdalom, véres széklet esetén gondolni kell rá. A kórkép fennállása képalkotó vizsgálattal bizonyítható. Erre a célra nagyfelbontású CT vizsgálat alkalmas, ennek szenzitivitása ugyanis meghaladja az ultrahangét, vagy a natív hasi röntgenfelvételét.
A korábban javasolt vizsgálatokon kívül szükséges a széklet tenyésztése és C. difficile toxin vizsgálata. Kezelése többnyire konzervatív, sebészi beavatkozásra csak perforáció vagy kontrollálatlan vérzés esetén kerül sor. A bél nyugalomba helyezése, gyomorszonda lehelyezése, adekvát folyadék- és parenterális tápláláskezelés javasolt. A neutropéniás láz empirikus kezelését typhlitis esetén metronidazollal kell kiegészíteni.
ANTIFUNGÁLIS KEZELÉS
Empirikus gombaellenes kezelés tartósan fennálló lázas neutropeniában
Az onkohematológiai gyermekbetegek kezelése során jelentkező neutropénia és a tartós immunszuppresszív (különösen szteroid) kezelés sarjadzó- és fonalasgombák okozta fertőzésekre hajlamosít (35). Mivel az invazív mycosisok jelentős letalitással járnak, időben történő felismerésük pedig nem könnyű, az 1980-as évektől különféle stratégiákat dolgoztak ki kezelésükre. A szóba jövő megközelítések egyike az empirikus antifungális kezelés. Lázas neutropéniás betegekben, ha adekvát antibiotikumkezelés ellenére a láz 72-96 órája perzisztált, amphotericin-B deoxycholát terápiát kezdtek, mely csökkentette az invazív mycosisok letalitását. Az azóta eltelt évtizedek során gyűjtött adatokból azonban fény derült arra, hogy a betegek jelentős hányada indokolatlanul kapott empirikus amphotericin-B kezelést. Így a vegyület mellékhatás-profilja kedvezőtlenül befolyásolta az életminőséget, a kimenetelt és a költségeket.
Empirikus kezelésre mindezek ellenére szükség lehet az alábbi nagy kockázatú helyzetekben: allogén őssejt-átültetés, akut leukémia indukciós kezelése, magas fokú GvHD, rezisztens malignus betegség, építkezés a centrum közelében és olyan centrumokban, ahol invazív gombainfekció rendszeresen nagy gyakorisággal fordul elő.
Az empirikus antifungális kezelés optimális módját több tanulmány is vizsgálta, ezek összegzése irányelv formájában is megjelent (36). Az elmúlt évtizedekben számos, az amphotericin-B deoxycholátnál szignifikánsan kevésbé toxikus szer hatékonysága igazolódott (37). Ezekben a vizsgálatokban főként a liposzomális amphotericin-B (38), valamint a caspofungin alkalmazhatósága nyert bizonyítást, ezért a jelen ajánlás is ezek használatát helyezi előtérbe. A liposzómás amphotericin-B gyermekekre is törzskönyvezve van. Az empirikus antifungális terápiában használható szerek listáját a megfelelő evidenciaszintekkel a 10. táblázat sorolja fel. Az egyes gyógyszerek alkalmazhatóságát toxicitások és interakciók is befolyásolják. Az amphotericin B nephrotoxikus, ennek kockázata a liposzómás formuláció adásakor a legkisebb. Azol kezelés esetén, a szereknek a máj citokróm P-450 izoenzim rendszerére gyakorolt hatása miatt gyakran jelentkeznek gyógyszerinterakciók (kemoterápiás- és immunszuppresszív szerek, antibiotikumok, szteroid). Az echinocandinok máj- és vesetoxicitása alatta marad az azolok és a poliének hasonló hatásának. Az empirikus gombaellenes kezelés alternatívája vagy kiegészítője lehet a fertőzés korai markerei (antigén, CT eltérés) által vezérelt preemptív stratégia, vagy a kockázati csoportba tartozók körében általános alkalmazott profilaxis. Ezek részleteit az ajánlás későbbi szakaszaiban ismertetjük. Javasoljuk, hogy a centrumok a helyi epidemiológiai adottságok tükrében maguk döntsenek a megfelelő gombaellenes stratégia kidolgozásáról és alkalmazásáról.
10. táblázat. Empírikus antifungális kezelés gyógyszerei neutropéniás láz esetén
| GYÓGYSZER | DÓZIS | EVIDENCIA | MEGJEGYZÉS |
| AmB liposzómás | 3mg/kg | IA | Ritkábban infúzióhoz társult toxicitás (láz, hidegrázás) |
| Caspofungin | 70mg/m2 telítő az első napon, majd 50mg/m2 <3 hónapos kor: 25 mg/m2 | IA | Zygomycetes ellen nem hatásos |
| AmB lipid complex | 5mg/kg | IB | Infúzióhoz társult toxicitás (láz, hidegrázás) |
| Voriconazol | > 2 éves kor : 2x7mg/kg iv, vagy 2x200mg per os (46) | IB | Zygomycetes ellen nem hatásos; Egy klinikai vizsgálatban nem teljesítette a non-inferioritás kritériumait liposzómás AmB-vel szemben.; Candida elleni hatása korlátozott azol profilaxis esetén |
| Am B kolloid | 4mg/kg | IB | Infúzióhoz társult toxicitás (láz, hidegrázás, |
| diszperzió | hypoxia) | ||
| AmB deoxycholat | 0,5-1mg/kg | IB/ID | Veselézióra hajlamosító eltérések esetén ellenjavallt (pl. nefrotoxikus gyógyszerek együttadása, anamnézisben veselézió) Infúzióhoz társult toxicitás (láz, hidegrázás, hypoxia) |
Célzott gombaellenes kezelés
Mikrobiológiailag dokumentált gombafertőzések esetén eltérő megközelítésre van szükség. Az igazolt gombafertőzések részletes tárgyalása meghaladja a jelen ajánlás kereteit, azok gyermekkori kezelése megegyezik a felnőttek részére írt irányelvben foglaltakkal (1).
Oropharyngealis candidosis, oesophagitis. Bár a leggyakrabban a neutropénia idején jelentkeznek, az immunszuppresszív kezelés vagy kemokezelés során bármikor kialakulhatnak. A szájüregi mucosa elváltozásaira lokálisan amphotericin-B szuszpenziót (IIB), vagy szisztémásan ható azol származékot (fluconazol, IA ) adhatunk. Oesophagitis esetén nem elegendő lokális szert adni (IIB), per os vagy vénás fluconazol javasolt (IA), refrakter esetben vénás amphotericin-B formuláció (IIB) vagy micafungin (IIB).
Candidémia, heveny disszeminált candidosis. Klinikai megjelenése a bakterémia képétől nem megkülönböztethető. A hemokultúra vételének kulcsszerepe van, a vérből a sarjadzó gomba az esetek 50-90%-ában kitenyészthető. Fluconazol csak stabil és azol profilaxisban nem részesült beteg esetében válaszható (IA), egyéb esetben az első választandó szer a caspofungin, micafungin (IA) vagy amphotericin-B. A centrális vénás kanülöket el kell távolítani (IIIB), különösen C. parapsilosis esetén (IIA). A beteget a neutropénia, a klinikai tünetek megszűnte és az utolsó pozitív hemokultúra után még két hétig javasolt kezelni (IIIA). A neutropénia oldódásakor endophtalmitis kizárására szemészeti vizsgálat szükséges.
Krónikus disseminált (hepato-splenicus) candidosis. A neutropéniában rendszerint okkultan fellépő candidémia következménye, de a neutropénia oldódásakor okoz tüneteket. Kezelésében amphotericin-B vagy fluconazol az első választandó szer. A kórokozó sok esetben nem izolálható, ilyenkor a terápiás döntést a megelőző profilaxis, a kolonizáció és a helyi epidemiológiai adatok ismeretében kell meghozni. Bár a betegek állapota stabil, tartós kezelésre van szükség, mely nem ritkán hosszú hónapokig tart (39).
Invazív fonalasgomba-fertőzések. Az invazív fonalasgomba infekciók elsősorban a jelentősen immunszupprimált betegcsoportokat érintik (transzplantáció, súlyos aplasztikus anaemia, kombinált vagy celluláris immunhiányok, GvHD, CGD, stb). A fertőzések többségét az Aspergillus nemzetségbe tartózó fajok okozzák, de nem elhanyagolható ma már az úgynevezett "emerging" gombáknak nevezett kórokozók szerepe sem (Zygomycetes, Fusarium, Scedosporium, stb. fajok). A megbetegedés bizonyítása csak steril helyről, invazív módszerrel nyert mintával lehetséges, azonban e vizsgálatok elvégzését számos tényező hátráltatja (beteg állapota, vérlemezke-szám, stb.). A normálisan steril szövetből (tű)biopsziával nyert minta hisztológiai, citológiai vagy direkt mikroszkópos vizsgálata során a jellegzetes morfológiájú gombaelemek kimutatása, a következményes szöveti károsodás jeleivel együtt bizonyító erejű. Szövettani anyagban morfológiai alapon az aspergillosis néha nem különíthető el más fonalasgomba infekcióktól. Ilyenkor célszerű a bizonyított invazív gombabetegség meghatározást használni (mely egyben valószínű invazív aspergillosis). Ha a fenti, normálisan steril anyagból fonalas gomba tenyészik, az igazolja a gombainfekciót. Nem bizonyító erejű, ha a gomba bronchusmosó folyadékból (BAL), orrmelléküreg punctatumból vagy vizeletből nő ki. A magas rizikójú, és ezért agresszív terápiát igénylő betegek azonosítására meg kellett határozni a lehetséges, illetve a valószínű invazív gombabetegség (aspergillosis) fogalmát. A definíciókat 2008-ban frissítették (40), de megtalálhatók a 2009-es felnőtt neutropéniás irányelvben is (1). Az említett rendszert eredetileg tudományos célból, a klinikai vizsgálatok egységesítése érdekében alkották meg, elvei azonban napjainkban áthatják a klinikai gondolkodást és döntésmechanizmusokat is. A valószínű invazív aspergillosis kórisméjének felállításához szükség van egy hajlamosító tényezőre (pl. tartós mély neutropénia, allogén őssejt-transzplantáció, T-sejt ellenes antitest-kezelés, tartós szteroid kezelés), egy klinikai tünetre (pl. új körülírt eltérés mellkasi CT-n) és egy mikrobiológiai kritériumra (pl. szérum galactomannan pozitivitás). Lehetséges a gombafertőzés a hajlamosító tényező és a klinikai kép fennállása esetén, de mikrobiológiai lelet hiányában. Az invazív fonalasgomba infekciók klinikai kritériumrendszerét a 11. táblázat foglalja össze.
11. táblázat. Valószínű invazív fonalasgomba fertőzés feltételei
| HAJLAMOSÍTÓ | Neutropénia | <0,5G/l, >10napig, egyidőben a betegséggel |
| TÉNYEZŐ | ||
| Tartós szteroid-kezelés | Legalább 0,3mg/kg prednizonnal ekvivalens min. 3 hétig | |
| T-lymphocytákra ható immunszuppresszív kezelés | Ciklosporin, TNF-antagonista, monoclonalis antitestek, nukleozid analógok 90 napon belül | |
| Veleszületett immunhiány | CGD, SCID | |
| Allogén őssejt-átültetés | ||
| KLINIKAI | Alsó légúti betegségben | A következő CT jelek közül legalább egy |
| TÉNYEZŐK | 1. Denz, jól körülírt elváltozás, dicsfény (halo) jellel vagy anélkül 2. Légsarló jel 3. Üregképződés | |
| Tracheobronchitisben | Bronchoscopiával exulceratio, nodulusok, álhártya, plakk vagy pörk a tracheában és a bronchusokban. |
| Az orrmelléküregek érintettsége esetén | Sinusitist igazoló képalkotó lelet (MR vagy CT) és az alábbiak közül legalább egy 1. Lokalizált (szembe sugárzó) akut fájdalom 2. Orrnyálkahártyán fekete pörk 3. A csontos határokat áttörő folyamat | |
| Központi idegrendszeri infekcióban | Áz alábbiak közül legalább egy | |
| 1. Képalkotókkal igazolt fokális elváltozások | ||
| 2. MR, CT: meningealis kontraszthalmozás | ||
| MIKOLÓGIÁI | Direkt vizsgálat (cytológia, direkt mikroszkópia | Fonalasgomba jelenléte a bronchusmosó |
| TÉNYEZŐK | vagy tenyésztés) | folyadékban, bronchuskefével vett mintában, sinus aspirátumban melyet az alábbi leletek legalább egyike bizonyít 1. Gombaelemek kimutatása 2. Aspergillus spp. kitenyésztése |
| Indirekt vizsgálatok (sejtfal alkotóelemek | Aspergillosis: galactomannan kimutatása plazmából, | |
| kimutatása) | szérumból, BAL-ból, liquorból | |
| Aspergillosis, vagy más invazív gombabetegség | ||
| (kivéve cryptococcosis ill. zygomycosis): | ||
| béta-D-glukán kimutatása szérumból. |
A galactomannan az Aspergillus nemzetségbe tartozó fajok sejtfalának alkotóeleme, amely a gomba növekedése során kerül a vérbe. Értékelése csak komplex módon, a klinikai kép elemzésével együtt lehetséges. Rendszeres (hetente kétszer történő vizsgálata) lehetővé teszi preemptív gombaellenes stratégia alkalmazását, ennek hiányában inkább empirikus antifungális kezelést javasolunk. A szérum galactomannan antigén vizsgálata egyidejű szemiszintetikus penicillin (piperacillin, de akár amoxicillin is) alkalmazása esetén álpozitív eredményt adhat.
Gyermekkori invazív fonalasgomba infekció gyanúja esetén további életkor-specifikus diagnosztikus nehézségek jelentkezhetnek. A kisgyermek gyakran képtelen panaszainak pontos megfogalmazására, így például a szemüreg fájdalma rejtve marad a klinikus számára. A klinikai kritériumként szereplő képalkotó vizsgálatok specificitása gyermekekben nem éri el a felnőttekre jellemző prediktív értéket. Nagyfelbontású mellkasi CT-n gyakran csak aspecifikus eltéréseket lehet látni, a felnőttkorban jellemző és patognomikus halo (dicsfény)-jel gyermekkorban ritka (41,42). A gombainfekcióra jellemzőnek gondolt radiológiai kép mögött sok esetben más fertőzés (Toxoplasma, Nocardia, Mycobacterium, stb. okozta folyamat) áll. Az invazív diagnosztikai vizsgálatok elvégzése a kisebb testméretek, az altatás szükségessége, a gyermek-specifikus eszközök vagy megfelelő tapasztalat hiánya miatt gyermekkorban még több akadályba ütközik. Invazív vizsgálatok elvégzésére azonban gyermekkorban is égető szükség van (pl. bőrtünetek esetén bőrbiopszia). A betegek jelentős hányadában megfelelő mérlegelés és előkészítés után azok biztonságosan elvégezhetők és más módon meg nem szerezhető klinikai információt nyújtanak (2,43).
Az invazív aspergillosis kezelése
A terápiában alkalmazott szereket a 12. táblázat foglalja össze. Toxicitás miatt nem javasolt az amphotericin B-deoxikolát, illetve az amphotericin B kolloid diszperzió (ID). A kezelés hatékonyságát általában 10-14 nap után kell megítélni. Amennyiben a neutrofil granulocyták megjelenésével párhuzamosan a tüdőinfiltrátumok radiológiai progressziója igazolódik, ez nem jelenti feltétlenül a kezelés ineffektivitását (44).
A súlyos, a kezdeti terápiára nem megfelelően reagáló infekciókban az alkalmazott szer kicserélése vagy kiegészítése kínálhat megoldást. Az előbbi esetben elméletileg célszerűnek látszik olyan hatástani csoportra való áttérés, melyet a primer kezelés nem tartalmazott. A gombaellenes szerek kombinációjával kapcsolatosan jó minőségű, randomizált vizsgálatokból származó evidenciák nem állnak rendelkezésre. Ugyanakkor klinikai megfigyelésekből gyűjtött adatok szólnak a módszer alkalmazhatósága mellett. Primer terápiában több antifungális szer együttes adása általában nem javasolt. Mentő kezelésként echinocandin + polién (pl. caspofungin + lipid formulációjú amphotericin B), illetve echinocandin + triazol (pl. caspofungin + voriconazol) jön számításba.
A betegek jelentős része a kórházból való távozás után még fenntartó orális terápiát igényel. Stabil állapotú betegben, szekvenciális, fenntartó kezelés céljából per os voriconazol adható. Ahol erre lehetőség van, csökkenteni kell az immunszuppresszív hatású szerek, különösen a kortikoszteroidok alkalmazását (IIIA).
Elsősorban invazív aspergillosis korai kezelésében alkalmazható a korábban már említett pre-emptív antifungális stratégia. A szérum galactomannan antigenaemia rendszeres (hetente kétszer történő) meghatározása, perzisztáló neutropéniás láz esetén nagy felbontású mellkasi CT vizsgálat végzése révén felfedezhetőek az infekció korai jelei (45). Ha azonban a markerek vizsgálat eltérést nem igazol, az antifungális kezelés halasztható.
12. táblázat. Az invazív aspergillosis kezelése
| KÓRKÉP | KEZELÉS | ALTERNATÍVA |
| Invazív pulmonális | voriconazol | liposzómális amphotericin-B |
| aspergillosis | 2x7 mg/kg iv, vagy 2x200mg testsúlytól | 3-5 mg/kg/nap (IA) |
| (bizonyított illetve | függetlenül p.o. (IA), telítődózis nélkül (46) | |
| valószínű) | ||
| Invazív pulmonális | caspofungin | antifungális kombináció (IIB) |
| aspergillosis, | 1. nap 70 mg/m2 majd 50 mg/m2 (IIB) | |
| ha a primer kezelés | VAGY | |
| hatástalan illetve | amphotericin B lipid formuláció | |
| azt a beteg nem tolerálja | 3-5 mg/kg (IIB) | |
| Heveny orrmelléküreg | Mint fent + műtét | Mint fent + műtét |
| aspergillosis | ||
| Központi idegrendszeri aspergillosis | Mint fent + műtét | Mint fent + műtét |
EGYÉB EMPIRIKUS KEZELÉSEK
A neutropénia önmagában, ép T-sejtes immunválasz esetén, nem jelent fokozott hajlamot vírusok és paraziták okozta fertőzések kialakulására. Lázas neutropéniában e kórokozó csoportokra ható kezelés alkalmazása ezért csak megfelelő bizonyítékok birtokában indokolt.
ANTIMIKRÓBÁS PROFILAXIS
Protektiv környezet
A gyermek onkohematológiai ellátás során protektív környezet kialakítására kell törekedni. A részleg elhelyezése során kerülni kell a közvetlen kapcsolatot a gyermekcentrum egyéb betegeivel, különös tekintettel arra, hogy az általános gyermekosztályokon elsősorban infektológiai jellegű betegségeket kezelnek. A gyermekonkológiai osztály lehetőleg egykétágyas, saját fürdőszobával felszerelt kórtermekből álljon. A részlegen törekedni kell a kiemelt kockázatú betegek (akut leukémia indukciós kezelése, allogén őssejt-transzplantáció várományosa, stb.) izolált, egyágyas, zsilipes kórteremben való elhelyezésére. A nagy hatékonyságú részecskeszűrővel ellátott kórterem (HEPA-filter) bizonyítottan csökkenti az invazív aspergillosis incidenciáját.
Antimikróbás profilaxis
Antibakteriális profilaxis. A neutropénia idején alkalmazott antibakteriális profilaxis ellentmondásos: alkalmazásával csökkenthető a Gram-negatív és részben a Gram-pozitív baktériumok okozta véráram infekciók gyakorisága, a lázas epizódok aránya, az empirikusan adott antibiotikumok felhasználása és a halálozás (IA). Ugyanakkor a rezisztens törzsek szelektálódásának veszélye is bizonyított, ami nehezíti vagy lehetetlenné teszi a későbbi infekciók eredményes kezelését és veszélyt jelent a többi betegre. Gyermekkorban is ajánlatos meghatározni azt az infekcióra fokozottan hajlamos, magas rizikójú betegcsoportot, akik profitálhatnak az antimikróbás profilaxisból (lásd 13. táblázat, 11). A választható szerek közül elsősorban a ciprofloxacint javasoljuk 20-30mg/kg/nap dózisban, két részre osztva, orálisan vagy intravénásan (47). Öt éves kor felett szóba jöhet még a levofloxacin napi egyszer, 10mg/kg adagban , bár ezzel a szerrel még kevés a gyermekgyógyászati tapasztalat. A fluorokinolonok gyermekkori alkalmazása kezdetben aggályos volt, mivel fiatal állatokban végzett kísérletek során károsította a növekedési porcot. Az elmúlt évtizedekben összegyűlt nemzetközi tapasztalat megmutatta, hogy ha súlyos infekciók miatt (pl. cisztikus fibrózis, anthrax, pyelonephritis, neutropéniás láz) gyermekben fluorokinolon profilaxist vagy kezelést alkalmaztak, annak előnyei messze meghaladták a várható kockázatot (48). Alacsony rizikójú beteg rutin antimikróbás profilaxisát nem javasoljuk (IIB). Különösen ellenjavallt az elsősorban Gram-pozitív baktériumokra ható antibiotikumok, főleg a vancomycin profilaktikus adása.
13. táblázat. Súlyos bakteriális infekcióra fokozottan hajlamos gyermekek [profilaxis javasolt (IA), illetve megfontolandó]
| Allogén őssejt-transzplantáció (javasolt) |
| Akut leukémia indukció (megfontolandó) |
| GvHD nagy dózisú szteroid-kezeléssel (javasolt) |
| Súlyos aplasztikus anémia (javasolt) |
| Várhatóan 10 napnál hosszabb neutropénia (megfontolandó) |
Antifungális profilaxis. Akut leukémia indukciós kezelése és őssejt-transzplantáció során alkalmazott napi 3mg/kg fluconazol bizonyítottan csökkentette a felszínes és invazív Candida-fertőzések incidenciáját. Felnőttekben randomizált tanulmányban igazolták, hogy profilaktikusan adott posaconazol szignifikánsan csökkenti az invazív aspergillosisok előfordulási gyakoriságát is. Ezért fokozott kockázatú betegeknél (lásd 13. táblázat) javasoljuk a fluconazol-profilaxis bevezetését. Őssejt transzplantációban illetve tartós neutropeniában invazív candidiasis megelőzésére micafungin adható. Ha a centrumban magas az invazív aspergillosis előfordulási gyakorisága (~10%), ha környezeti faktorok növelik az infekció kialakulásának veszélyét (építkezés), illetve ha a betegnél allogén őssejt-átültetés tervezett, mérlegelni kell fonalasgombával szemben is hatékony profilaxis alkalmazásának lehetőségét. In vitro hatásspektuma és a már említett, felnőtt betegek köréből származó vizsgálati eredmények alapján a posaconazol előnyös választás lehet (13 éves kor alatt adagolása nincs megállapítva, felette 3x200mg per os, 49). Ha a beteg anamnézisében invazív gombainfekció, különösen aspergillosis szerepel, a tervezett újabb neutropéniát okozó kezelés, illetve immunszuppresszív kezelés során másodlagos profilaxis alkalmazása ajánlatos. Az optimális gombaellenes szer kiválasztásához evidenciák nem állnak rendelkezésre. A hatásspektrum és a tolerálhatóság figyelembe vételével elsősorban voriconazol, posaconazol, alternatívaként caspofungin vagy amphotericin B liposzómás vagy lipid komplex formuláció jöhet számításba.
KIEGÉSZÍTŐ KEZELÉSI LEHETŐSÉGEK
Granulocyta kolónia-stimuláló faktor
Egy meta-analízis szerint G-CSF profilaktikus adása a felnőtt vizsgálatokhoz hasonlóan gyermekekben is csökkentette a lázas neutropénia előfordulását (kb. 20%-al) és a kórházi tartózkodás idejét, de nem befolyásolta az infekció okozta halálozást (ii). A G-CSF profilaktikus adásának felnőttkori indikációja (20% feletti esély lázas neutropéniára) gyermekkorban nem alkalmazható, mivel a két korcsoportban alkalmazott myeloszuppresszív protokollok nem hasonlíthatóak össze. Nem szabad figyelmen kívül hagyni azt a tényt sem, hogy myeloid malignitások esetén a G-CSF a kóros sejteket is stimulálhatja. Ezért gyermekkorban a G-CSF profilaktikus célból gondos egyéni mérlegelést követően, individuálisan adható, 5 mikrogram/kg/nap adagban (51,52). Alkalmazható természetesen elfogadott kemoterápiás protokoll előírt részeként. Neutropéniás infekciók intervenciós kezelésére szövődménymentes esetekben nem javasolt. A granulocyták visszatérésének gyorsítása céljából mérlegelni lehet alkalmazását, amennyiben a beteg súlyos pneumoniában, szepszisben, szeptikus shockban, invazív mycosisban vagy egyéb progresszív infekcióban szenved (53).
Granulocyta transzfúzió profilaktikus és terápiás adása - megfelelő evidencia híján - továbbra is experimentális kezelésnek tekinthető, ezért alkalmazásának módját és körét tekintve ajánlás nem fogalmazható meg. Intravénás immunglobulin rutinszerű adása neutropéniás infekciókban nem javasolt. Használata javasolt jelentősen hypogammaglobulinaemiás betegek súlyos infekcióiban.
NEM KEMOKEZELÉS EREDETŰ NEUTROPÉNIA
A gyermekkori súlyos aplasztikus anaemia, a súlyos kongenitális neutropénia (Kostmann-szindróma) és a ciklikus neutropénia súlyos formái hasonló kockázatot jelentenek fertőzés szempontjából, mint a kemokezelés indukálta neutropéniák. Ezért az ilyen betegségben szenvedő gyermekek neutropéniás lázának ellátása is a fent vázolt alapelvek szerint javasolt. A gyermekkori neutropéniáknak van azonban egy kevésbé súlyos csoportja is. Ezekben a betegségekben a kritikus, életveszélyes fertőzések incidenciája alacsony, jelentősen különbözik a kemokezelés-indukálta neutropéniák infekcióitól. Egyes benignus, neutropéniával járó betegségek (átmeneti kisdedkori neutropénia, krónikus benignus neutropénia, ciklikus neutropénia enyhe formái) gyakorlatilag nem jelentenek nagyobb kockázatot, mint az egészséges populáció fertőzései. Mindezek következtében szükségesnek látszik ezeknek a kórképeknek a megkülönböztetése és külön protokoll szerint történő ellátása, melyet a 14. táblázat foglal össze.
14. táblázat. Alacsony kockázatú neutropéniás gyermekek kezelése az alapbetegség függvényében
| BETEGSÉG | LÁZ JELLEMZŐ OKA | ELLÁTÁS |
| Átmeneti, izolált | Vírusfertőzés | Az életkornak és a fertőzés lokalizációjának megfelelő |
| neutropénia egyébként | adekvát kezelés, gondos követés | |
| egészséges gyermekben | ||
| Krónikus benignus | Gyakori: felső légúti infekciók, otitis | Szükség esetén orális antibiotikum a klinikai képnek |
| neutropénia | media, bőrfertőzések, gingivitis, | megfelelően, sz.e. G-CSF alkalmazása; gondos követés |
| fekélyek a szájban, szeméremajak- | jó csontvelői tartalékkal rendelkező betegnél | |
| cellulitis | ||
| Ritka: pneumonia, periorbitális | Kórházi felvétel és adekvát parenterális antibiotikum, | |
| cellulitis, meningitis, szepszis | G-CSF. | |
| Ciklikus neutropénia | Gyakori: fekélyek a szájban, | G-CSF profilaxis a ciklus előtt 2-3 nappal elkezdve. |
| gingivitis, periodontitis, pharyngitis, | Általában nem igényel antibiotikumot a nadírban | |
| adenopathia | jelentkező láz és mucocutan léziókra | |
| Kevésbé gyakori: bakterémia, | Klinikai indikációnak megfelelő antibiotikum adása | |
| cellulitis, otitis media, sinusitis, | (otitis, pneumonia, sinusitis) | |
| pneumonia, appendicitis | ||
| Ritka: Clostridium-asszociált | Kórházi felvétel és Clostridium-ellen is ható | |
| nekrotizáló enterocolitis | antibiotikum adása. |
A kemokezelés indukálta neutropéniáktól eltérő módon, a granulocyta kolónia-stimuláló faktor jótékony hatása egyértelműen igazolódott bizonyos krónikus betegségekben (54,55,56). Használata csökkenti a súlyos infekciók incidenciáját, az antibiotikumhasználatot, a kórházi tartózkodást és a mortalitást. Adása súlyos infekciókkal járó krónikus idiopátiás neutropénia és ciklikus neutropénia eseteiben javasolt. Súlyos kongenitális neutropéniában (pl. Kostman-szindróma) a rendszeres G-CSF szubsztitúció alapjaiban változtatta meg a betegség gondozását, megfelelő életminőséget biztosítva a betegeknek (57).
KRITIKUS ÁLLAPOTÚ SZEPTIKUS GYERMEK ELLÁTÁSA
A neutropéniás epizódok harmadában alakul ki láz. A neutropéniás lázak nem több mint 40%-ában sikerül infekciót dokumentálni. Szepszis, súlyos szepszis és szeptikus shock megjelenése különösen a magas rizikójú betegcsoportban jellemző (pl. leukémia indukció, transzplantáció, súlyos aplasztikus anaemia), de minden gyermek onko-hematológiai betegnél fel kell készülni az adekvát, agresszív és azonnali szupportív terápiára is.
Első észlelés
Anamnézis. A beteggel való első találkozás, mint minden esetben, anamnézis-felvétellel kezdődik. Ez még súlyos állapotú gyermek esetén is kulcsfontosságú, mert már az első egy óra beavatkozásait is alapjaiban befolyásolhatja. A legutóbbi citosztatikus kezelés időpontja alapján, illetve az utolsó ismert vérkép adatainak birtokában már esetleg sejtető a neutropéniás állapot. A láz mértéke bizonyos tanulmányok szerint összefüggésben áll az infekció súlyosságával és magas kockázati tényezőnek számít (lásd 6. táblázat, 58). A láz kezdetének időpontja sürgősséget jelezhet (több órája lázas gyermek).
Fizikális vizsgálat. A betegvizsgálat általános szabályaira nem térünk ki, a neutropéniás gyermekek vizsgálatát alaposan és minden részletre kiterjedően végezzük el. Az immunrendszer állapota miatt nem alakulnak ki a fertőzésekre egyébként jellemző szöveti infiltrátumok, ezért az infekciók klasszikus tüneteit gyakran hiába keressük. A bőr és a lágyrészek bakteriális fertőzéseiben hiányozhat az induratio, az erythaema és a suppuratio, pneumoniában a jellegzetes infiltrátum, meningitisben a liquor sejtszaporulata. Mindezek ellenére keresni kell az infekció bármily diszkrét jelét, különösen a leggyakrabban érintett testtájakon. Ezek a szájüreg és a garat, a tüdő, a gáttájék, a bőr (különösen a punkciók helyén), az intravascularis műanyag eszközök bemenete és a körömágy. A szegényes tünetek gyakran atípusos módon és helyen jelentkeznek, gyakran egyáltalán nem találjuk meg az infekció forrását. Fontos megjegyezni, hogy amíg a negatív fizikális status normál immunitású gyermeknél nagy valószínűséggel kizárja a súlyos betegséget, neutropéniás gyermekekben az eltérések hiánya nem altathatja el az ellátó orvos éberségét.
Kritikus állapot megítélése. Az első fizikális vizsgálat során el kell dönteni, hogy a gyermek állapota stabil vagy kritikus. A kritikus állapotú gyermek ellátását ugyanis késlekedés nélkül meg kell kezdeni, hiszen a progresszív infekció keringési és légzési elégtelenséghez vezethet. A gyermekek szerveik működészavarát tartósan képesek kompenzálni. Ez szolgál magyarázatul arra a jelenségre, hogy a korábban látszólag jó általános állapotú gyermek a kompenzáló mechanizmusok kimerültével hirtelen omlik össze. A reszuszcitáció ilyen esetekben sajnos rossz eredménnyel jár. Az újjáélesztett gyermekek túlélése alig haladja meg a 20%-ot, míg az időben és adekvátan ellátott szeptikus shock túlélése 90% felett is lehet! Az összeomlást megelőző időszakban kompenzált keringési vagy légzési elégtelenségről beszélünk, melynek felismerése kulcsfontosságú, hiszen az időben indított adekvát oki és szupportív kezelés az esetek túlnyomó részében megfordítja a folyamatot. A szeptikus shock halálozása gyermekkorban az 1960-as években regisztrált 97%-ról napjainkban a korán indított és hatékony oki és szupportív terápiának köszönhetően 9%-ra csökkent. (59)
Tudatállapot vizsgálata. Az első és legfontosabb, kézenfekvő és egyszerűen elvégezhető vizsgálat a tudatállapot megítélése. Egyszerű kérdésekkel megítélhető, hogy a gyermek éber és tudatánál van, térben-időben orientált-e. Csecsemőnél és kisdednél is ismertek az adekvát viselkedés formái, illetve az ezektől való eltérés (szemkontaktus, adekvát sírás, mozgásluxus, stb.). A tudatállapot zavarának jele, ha a gyermek csak hangra, csak fájdalomra vagy arra sem reagál. A tudatállapot romlása súlyos jel, az agyi perfúzió zavarára utal, így mindig kritikus állapotot igazol. (15. táblázat)
15. táblázat: Vezérfonal a kritikus állapot fizikális megítéléséhez (55)
| TUDAT | Éber |
| Hangra reagál | |
| Fájdalomra reagál | |
| Eszméletlen, nem reagál | |
| LÉGÚT | Biztonságos, átjárható Veszélyben Elzáródott |
| LÉGZÉS | Légzésszám |
| Légzési térfogat (mellkasi kitérés) | |
| Légzési munka (dyspnoe, grunting) | |
| Oxigenizáció (szaturáció) | |
| KERINGÉS | Pulzusszám Pulzusamplitúdó (perifériás és centrális pulzus különbsége) Perifériás újratelődés (kapilláris telődés, 2 másodperc) Preload (máj, szörtyzörejek, juguláris vénák teltsége) Vérnyomás |
Légzés vizsgálata. A kritikus állapot megítélésében ugyanúgy ABC szerint kell haladni, mint újjáélesztés esetében. A légutak átjárhatóságáról meg kell bizonyosodni, azok veszélyeztetettsége vagy elzáródása sürgős intézkedést igényel (leszívni, helyzettől függően intenzív osztályra helyezni, stb.). Átjárható légutak esetén vizsgálhatjuk a légzést. A légzésszám (emelkedése kompenzációs jel), a légzési térfogat (mellkasi kitérések szimmetrikusak-e, felületesek-e), a légzési munka (nyögés, stridor, zihálás) fizikális vizsgálat során mind megítélhető paraméterek. A légzés értékelésének fontos eleme az oxigenizáció mérése, amely puszta megtekintéssel csak igen súlyos esetben ítélhető meg egyértelműen (cyanosis). Finomabb eltérések regisztrálására alkalmas eszköz a pulzoxyméter, melynek használata minden gyermek onkohematológiai centrum részére nyomatékosan ajánlott. Ha a fenti négy paraméter az életkori normálértéktől jelentősen eltér (akár kóros hallgatózási lelet vagy képalkotón látható abnormalitás nélkül is!) ez olyan patológiás tüdőfolyamatot jelöl, mely kompenzált légzési elégtelenségnek felel meg, és azonnali kezelést igényel (pl. oxigén, hörgőtágító, szteroid). (60) (16. táblázat)
16. táblázat: Légzésszám életkori normálértékei (60)
| ÉLETKOR (ÉV) | LÉGZÉSSZÁM (/PERC) |
| <1 | 30-40 |
| 2-5 | 24-30 |
| 5-12 | 20-24 |
| >12 | 12-20 |
Keringés megítélése. Ha a gyermek légzése fiziológiás, vagy megfelelő beavatkozással sikerül normalizálni, akkor (és csak akkor!) következhet a keringés vizsgálata. A pulzusszámolás a legegyszerűbb, de sokszor elhanyagolt feladat, pedig diagnosztikus értéke felbecsülhetetlen (17. táblázat)
17. táblázat: Pulzusszám életkori normálértékei (60)
| ÉLETKOR | TARTOMÁNY |
| Újszülött | 120-180 |
| < 1év | 120-180 |
| < 2 év | 120-160 |
| < 7 év | 100-140 |
| < 15 év | 90-140 |
Gyermekkorban a tachycardia a legkorábbi kompenzációs jel, mely a fenyegető légzési és keringési elégtelenséget egyaránt jelzi. Megítélésénél figyelembe kell venni, a tünet aspecifikus voltát, hiszen a gyermek számos noxára és külső ingerre tachycardiával válaszol (fájdalom, félelem, sírás, láz, stb.). Egyszerű és bátorítandó vizsgálat a perifériás keringés vizsgálatára a kapilláris telődési idő (capillary refill time, CRT). A körömágyra gyakorolt 5 másodperces nyomás után kell mérni azt az időt, ami után az elfehéredett terület ismét vértelt (rózsaszín) lesz. A perifériás újratelődés két másodperc alatt normális. Ennél hosszabb érték esetén azonban más perifériás keringésű szervek esetében is kóros perfúzióra számíthatunk. Ilyenkor beavatkozás nélkül nemsokára a centrális keringészavar is bekövetkezik. A pulzusamplitúdóról tájékoztat pl. a radiális és axilláris pulzus különbsége: a perifériásabb pulzus elmaradása is keringési zavart jelez. A preload megítélése az agresszív folyadékkezelés monitorozása szempontjából fontos: nagyobb máj, tüdőödéma hallgatózási jelei vagy telt juguláris vénák esetén óvatosan kell folyadékot pótolni. A gyermek szervezete az utolsó pillanatig kompenzál, tacycardiával és tachypnoéval, egészséges és rugalmas ereinek autoregulációja még jelentős intravasalis hypovolaemia esetén is képes a normális vérnyomás fenntartására. Így a vérnyomás esése, a felnőttkorban tapasztaltaktól eltérő módon, gyermekekben az utolsóként kialakuló jel, mely arra utal, hogy a keringés teljes összeomlása perceken belül bekövetkezhet! (18. táblázat)
18. táblázat: Normális és határérték szisztolés vérnyomásértékek életkor szerint (60)
| ÉLETKOR | NORMÁLIS | ALSÓ HATÁR |
| 0-1 hónap | >60 | 50-60 |
| 1-12 hónap | 80 | 70 |
| 1-10 év | 90 + 2 x életkor (év) | 70 + 2 x életkor (év) |
| >10 év | 120 | 90 |
A szepszis definíciója
Szisztémás gyulladásos reakcióról (systemic inflammatory response syndrome, SIRS) beszélünk, ha láz vagy hypothermia mellett tachycardiát vagy tachypnoét találunk (19. táblázat). Szepszisről akkor beszélhetünk, ha a SIRS hátterében dokumentált vagy feltételezett infekció áll (ezt lázas neutropéniás gyermek esetén mindig gyanítanunk kell). Súlyos a szepszis, ha szervperfúziós zavart észlelünk (tudatromlás, megnyúlt kapilláris telődési idő, a diurézis kevesebb, mint 1ml/kg/óra, magas szérum laktát-szint). Ezt gyermekkorban kompenzált szeptikus shocknak tekinthetjük, ha ugyanis a szervek oxigénellátását kompenzáló mechanizmusok kimerülnek, nincs messze a teljes keringés-összeomlás sem. A szeptikus shock definíciójához gyermekkorban ezért nem tartozik hozzá a hypotensio, bár jelenléte alátámasztja azt. Az alacsony vérnyomással járó szepszist dekompenzált szeptikus shocknak nevezzük.
19. táblázat: Gyermekkori szepszis kritériumai (59,60,64)
| INFEKCIÓ, és | Bizonyított, vagy Gyanított |
| SZISZTÉMÁS GYULLADÁSOS REAKCIÓ | Hyperthermia vagy hypothermia, és |
| Tachycardia (lásd 17. táblázat: Pulzusszám életkor normál értékei (60): vagy Tachypnoe (lásd 16. táblázat) | |
| CSÖKKENT SZERVPERFÚZIÓ (súlyos szepszis jelei, akár egy is elég) | Tudatállapot-változás (irritábilis, szülővel nem kommunikál, ébreszthetetlen), vagy Hypoxia, vagy |
| Emelkedett szérum-laktát, vagy | |
| Megnyúlt kapilláris telődési idő, vagy Peckelő pulzus (pulzusamplitúdó csökkent), vagy Csökkent diurézis (<1ml/kg/óra), vagy Hypotensio (nem kritérium, de alátámasztja) |
A kritikus állapot kezelése
Vénás kapcsolat. A súlyos állapotú gyermek kezeléséhez azonnali vénabiztosítás szükséges. Centrális vénás eszköz hiányában perifériás vénát kell kanülálni. Ha többszöri próbálkozás sem jár eredménnyel, megfelelő érzéstelenítés után intraosseális kanülálás javasolt. Az így nyert vénás kapcsolat teljes értékű, mintavételre és folyadékok, gyógyszerek beadására egyaránt alkalmas.
Laktát. Kritikus állapot esetén az első mintavétel terjedjen ki a szérum laktát-szint meghatározására is. Ez ugyanis szoros összefüggésben van a keringési elégtelenség kapcsán hypoperfundált szövetek anyagcseréjével, így alkalmas a szöveti hypoxia detektálására és a kezelés monitorizálására is. Nemzetközi irányelvek szerint a 4 mmol/l-nél magasabb szérum laktát szint önmagában is a szervek perfúziójának súlyos zavarára utal, és azonnali agresszív terápiát igényel (IIA). A laktátmérés lehetőségét minden onko-hematológiai centrumban biztosítani kell. Az eredménynek perceken belül rendelkezésre kell állnia, hiszen csak így biztosítható a kezelés megfelelő monitorozása (59, 64).
Folyadékbólus. Több tanulmány egybehangzó eredményeire alapozott, elfogadott tény, hogy az agresszív folyadék reszuszcitáció alapvető fontosságú a gyermekkori szeptikus shock túlélésében (IIA, 3, 4). A folyadékpótlás izotóniás krisztalloid oldattal vagy kolloid oldattal történhet. A kolloid-krisztalloid vita évtizedek óta zajlik, vizsgálatok nem találtak szignifikáns különbséget, így mindkét módszer alkalmazható (63). A folyadékbólust 5-10 perc alatt kell beadni. A beadás után újra fel kell mérni a gyermek állapotát, és fennálló kóros leletek esetén a folyadékbólus ismételhető. Általában 2-3 bólusra van szükség a szeptikus shock kezdeti ellátásában. Nem ritka, hogy a súlyos beteg órákon belül akár 200 ml/kg folyadékot is igényel. A folyadékbólusok között a gyermek állapotfelmérésénél különös figyelmet kell fordítani a preload változására (juguláris vénák, májnagyobbodás, szörtyzörejek). Ha nem találunk szívterhelésre utaló aggasztó jelet, az agresszív folyadékkezelés bátran folytatható. Az ismételt bóluskezelés egyetlen kontraindikációja, ha a károsodott szív nem képes továbbítani az azonnali hiánypótlás céljából bevitt jelentős mennyiségű folyadékot, ilyenkor ugyanis keringéstámogatásra is szükség van. Ha három folyadékbólus beadása után sincs érdemi javulás, folyadékrezisztens shockról beszélünk. A következő lépés a vazopresszor szerek adása, ez azonban már legtöbbször az intenzív osztályon történik (64).
Antibiotikum. Az antibiotikum-választás szempontjait jelen irányelv korábbi fejezetei taglalják. Ismétlésként itt mindössze azt kell hangsúlyozni, hogy kritikus állapotú gyermek esetében az empirikus kezelés részeként javasolt glikopeptid és megfontolandó aminoglikozid adása is. Az antibiotikum-kezelés elkezdésével nem szabad megvárni az akut fázis paraméterek meghatározását, mert ezek emelkedése órák alatt történik meg. Szepszisben szenvedő gyermekek esetén bizonyított tény, hogy minden óra késlekedés túlélési esélyben mérhető különbséggel jár (65), ezért az antibiotikumot az észlelés első órájában kell elkezdeni (IIA).
Gyermekintenzív osztály. A kritikus állapotú gyermek ellátásának korai fázisában ajánlott gyermekintenzív terápiában járatos konziliárius bevonása. Bár a betegek egy része adekvát ellátás, antibiotikum és folyadékbólus után stabilizálódó állapotának köszönhetően a gondozó osztályon marad, jelentős hányaduk (10-30%) ezt követően intenzív osztályos ellátást is igényel. Az intenzív osztállyal időben megkezdett párbeszéd, és állapotromlás esetén az áthelyezés életmentő lehet. A korán igénybe vett intenzív terápiás eljárások sikeresebbek, ha viszont összeomlott gyermeknél kerülnek csak alkalmazásra, már rossz esélyekkel kecsegtetnek.
Megfigyelés kórházi osztályon
Alap obszerváció. A lázas neutropéniás gyermekek osztályos ellátásában kétlépcsős megfigyelési rendszert alkalmazása javasolt. A napi egyszeri orvosi fizikális vizsgálaton kívül a stabil, láztalan, jó állapotú betegeknél is szükséges a gondos ápolói megfigyelés, a vitális paraméterek rögzítése. A betegeknél 12 óránként történik a folyadékegyenleg meghatározása és a súlymérés, 6 óránként pedig a láz, pulzus, vérnyomás ellenőrzése. Az alap obszerváció célja a kritikus állapotot időben történő felismerése. A vitális paraméterek romlása, új láz vagy légúti tünet jelentkezése, állapotromlás esetén szoros obszervációs protokollra kell váltani. (20. táblázat)
Szoros obszerváció. Kritikus állapotú gyermeknél javasolt a kibővített vitális paramétereket (láz, pulzus, vérnyomás, légzésszám, szaturáció) 2 óránként ellenőrizni, valamint 6 óránként folyadékegyenleget vonni. Állapottól függően 6-12 óránként érdemes súlyt mérni, meghatározni a centrális vénás nyomást (CVP), valamint az osztályon lévő kislabor-automatával vérgáz-, ion-, vércukor-, és laktátszinteket mérni. (20. táblázat). Ebben az állapotban napjában többszöri orvosi fizikális vizsgálat is szükséges, ennek gyakorisága kórkép súlyosságától függ. Előfordulhat, hogy egy órában akár többször is tájékozódni kell a csak fizikálisan megítélhető vitális paraméterekről (légzési munka, tudat, preload, kapilláris telődési idő, stb.)
A szoros obszerváció célja a kritikus állapot nyomon követése, információszolgáltatás a döntéshozó klinikus részére. Segítségével megakadályozható az összeomlás, illetve az esetleges fenyegető állapotromlás időben megjósolható. A szigorú megfigyelés lehetővé teszi a kompenzációs szakaszban indított agresszív szupportív kezelés monitorizálását. Ide tartozik a folyadékbólusok vagy éppen a vizelethajtás hatékonyságának felmérése, az elektrolit és sav-bázis státusz befolyásolása, valamint az alkalmazható légzéstámogatás értékelése (pl. oxigén adása). A megfigyelés jelzi a katasztrófa közeledtét, lehetővé teszi gyermekintenzív osztályos konzílium korai kezdeményezését és szükség esetén az időben történő áthelyezést.
20. táblázat: Obszervációs rutinok összehasonlítása (észlelés gyakorisága, óra)
| VITÁLIS ÉRTÉK | ALAP | SZOROS |
| Láz | 6 | 2 |
| Pulzus | 6 | 2 |
| Vérnyomás | 6 | 2 |
| Légzésszám | - | 2 |
| Szaturáció | - | 2 |
| Folyadékegyenleg | 12 | 6 |
| Testsúly | 12 | 6-12 |
| Centrális vénás nyomás | - | 6-12 |
| Kislabor (vérgáz, laktát) | - | 6-12 |
A szoros obszerváció kitűnő eszköze a többparaméteres betegőrző monitor, ami a vitális paraméterek folyamatos mérése és rögzítése révén sok terhet vesz le az osztályos ápoló válláról. Használata elengedhetetlen a kritikus gyermekeket ápoló onkohematológiai osztályokon.
ÁLLÁSFOGLALÁS AZ "OFF-LABEL" GYÓGYSZERHASZNÁLATRÓL
Valamennyi gyógyszer esetében az alkalmazási előirat rendelkezik annak indikációról az adott célcsoportban (felnőtt, gyermek), az alkalmazás módjáról (vénás, szájon át, stb.) és az adagolásról. Bármelyik előírástól való eltérés off-label gyógyszerhasználatnak minősül. A gyermekhematológiában jelenleg alkalmazott gyógyszerek 93%-a nem rendelkezik a korcsoportra vonatkozó hivatalos előirattal, így azokat a szakemberek folyamatosan és minden esetben off-label formában használják. Nincs ez másképp az antiinfektív és a szupportív szerek esetében sem. Ennek fő oka, hogy az egyszer már felnőtteken törzskönyvezett szerek esetében a piac, a szakmai szervezetek, a gyógyszerhatóság vagy a finanszírozó sem kényszeríti ki a gyerekeken történő klinikai vizsgálatot követő előirat-módosítást. Mind az Amerikai Egyesült Államok, mind az Európai Unió (Paediatric Regulation, iii) törvényben rendelkezett arról, hogy újgyógyszerek fejlesztése során kötelező elindítani a megfelelő gyermekgyógyászati vizsgálatot is, valamint bátorítja a meglévő gyógyszerek indikációjának bővítését.
Mivel az orvostudomány felfedezései óhatatlanul a szabályozás előtt járnak, néhány gyógyszer off-label rendelése korszerű kezelésnek tekinthető. Bizonyos esetekben, megfelelő evidenciaszint esetén egy-egy gyógyszer alkalmazása akár az elvárható gondosságot is jelentheti. A helyes orvosi gyakorlat és a beteg érdeke megkívánja, hogy az orvosok a törvényesen elérhető szereket a legjobb tudásuk szerint használják. Nem elfogadható az az álláspont, ami az évek, évtizedek óta változatlan előíratok
betartására hivatkozva, megfosztja a gyermekeket a bizonyítottan hatékony, biztonságos és elérhető innovatív gyógyszerektől. A neutropéniás gyermekpopuláció olyan súlyos alapbetegségben szenvedő betegcsoport, ahol az egyes off-label alkalmazott gyógyszerektől várható terápiás haszon számos indikációs körben meghaladja az esetleg felmerülő kockázatot. Jelen irányelvben szereplő, az Európai Unióban érvényes indikációval gyermekekre törzskönyvezett gyógyszerek használata nem vet fel kérdéseket. Gyermekbetegekre érvényes indikációval nem rendelkező, de gyermekeken végzett klinikai tanulmányban vizsgált, biztonságosnak és hatékonynak bizonyult gyógyszer használata az orvos legjobb tudása és mérlegelése szerint javasolt. Azon gyógyszerek esetében, ahol klinikai vizsgálatot csak felnőtteken végeztek, egyedileg kell elbírálni az indikációt. Össze kell hasonlítani az indikációs körbe tartozó betegség kockázatát, a kezelés elmaradásának veszélyeit az indikáción túl alkalmazott gyógyszer toxicitásával. Az irányelvben található javaslatok ezen elveknek megfelelően kerültek megfogalmazásra.
IV. Rehabilitáció
V. Gondozás
VI. Irodalomjegyzék
1. Sinkó J, Ludwig E, Nikolova R, Masszi T, Prinz Gy, Rókusz L, Sréter L, Tímár L: A neutropeniás beteg fertőzéseinek megelőzése és kezelése. Az Infektológiai Szakmai Kollégium és a Transzfúziológiai és Hematológiai Szakmai Kollégium közös szakmai protokollja 2009.
2. Trethon A.: A neutropéniás lázas gyermek antiinfektív kezeléséről. Gyermekorvos Továbbképzés, VIII. évf.. 3. szám, 141-145.
3. Castagnola, E, Fontana, V, Caviglia, I, et al. A prospective study on the epidemiology of febrile
4. episodes during chemotherapy-induced neutropenia in children with cancer or after hemopoietic stem cell transplantation. Clin Infect Dis 2007; 45:1296.
5. National Cancer Institute: Common Toxicity Criteria version 2.0, 1999.
6. Auletta JJ, O'Riordan MA, Nieder ML: Infections in children with cancer: a continued need for the comprehensive physical examination. J Pediatr Hematol Oncol. 1999 Nov-Dec;21(6):501-8.
7. Fleischhack G, Kambeck I, Cipic D, Hasan C, Bode U.: Procalcitonin in paediatric cancer patients: its diagnostic relevance is superior to that of C-reactive protein, interleukin 6, interleukin 8, soluble interleukin 2 receptor and soluble tumour necrosis factor receptor II. Br J Haematol. 2000 Dec;111(4):1093-102.
8. Kitanovski L, Jazbec J, Hojker S, Gubina M, Derganc M.: Diagnostic accuracy of procalcitonin and interleukin-6 values for predicting bacteremia and clinical sepsis in febrile neutropenic children with cancer. Eur J Clin Microbiol Infect Dis. 2006 Jun;25(6):413-5.
9. Fleischhack G, Cipic D, Juettner J, Hasan C, Bode U.: Procalcitonin-a sensitive inflammation marker of febrile episodes in neutropenic children with cancer. Intensive Care Med. 2000 Mar;26 Suppl 2:S202-11.
10. Renoult, E, Buteau, C, Turgeon, N, et al. Is routine chest radiography necessary for the initial evaluation of fever in neutropenic children with cancer?. Pediatr Blood Cancer 2004; 43:224.
11. Hughes, WT, Armstrong, D, Bodey, GP, et al. 2002 Guidelines for the use of antimicrobial agents in neutropenic patients with cancer. Clin Infect Dis 2002; 34:730.
12. Prevention and treatment of cancer-related infections. In: National Comprehensive Cancer Network ® NCCN Clinical Practice Guidelines in Oncology TM . (Co-chairs: Segal BH, Baden LR.) 2008.v.1, www.nccn.org.
13. Drgona L, Paul M, Bucaneve G et al.: The need for aminoglycosides in combination with betalactams for high-risk, febrile neutropaenic patients with leukaemia. Eur J Cancer 2007;Suppl.5:13-22.
14. Walsh, TJ, Roilides, E, Groll, AH, et al. Infectious complications in pediatric cancer patients. In: Principles and Practice in Pediatric Oncology, 5th ed, Pizzo, PA, Poplack, DG (Eds), Lippincott Williams & Wilkins, Philadelphia 2006. p.1269.
15. Ramphal, R, Bolger, M, Oblon, DJ, et al. Vancomycin is not an essential component of the initial empiric treatment regimen for febrile neutropenic patients receiving ceftazidime: A randomized prospective study. Antimicrob Agents Chemother 1992; 36:1062.
16. Vancomycin added to empirical combination antibiotic therapy for fever in granulocytopenic cancer patients. European Organization for Research and Treatment of Cancer (EORTC) International Antimicrobial Therapy Cooperative Group and the National Cancer Institute of Canada-Clinical Trials Group. J Infect Dis 1991; 163:951.
17. Feld, R. Vancomycin as part of initial empirical antibiotic therapy for febrile neutropenia in patients with cancer: Pros and cons. Clin Infect Dis 1999; 29:503.
18. Singh-Naz, N, Sleemi, A, Pikis, A, et al. Vancomycin-resistant Enterococcus faecium colonization in children. J Clin Microbiol 1999; 37:413.
19. Mermel, LA, Allon, M, Bouza, E, et al. Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 Update by the Infectious Diseases Society of America. Clin Infect Dis 2009; 49:1.
20. Michael Rybak, Ben Lomaestro, John. C. Rotschafer, Robert Moellering Jr., William Craig, Marianne Billeter, Joseph R. Dalovisio, Donald P. Levine: Therapeutic monitoring of vancomycin in adult patient: A consensus review of the American Socicety of Health-System Pharmacists, the Infecitious Disease Society of America, and the Society of Infectious Diseases Pharmacists. Am J Health-Syst Pharm. 2009; 66:82-98.
21. Klastersky J; Paesmans M; Rubenstein EB; Boyer M; Elting L; Feld R; Gallagher J; Herrstedt J; Rapoport B; Rolston K; Talcott J: The Multinational Association for Supportive Care in Cancer risk index: A multinational scoring system for identifying low-risk febrile neutropenic cancer patients. J Clin Oncol 2000 Aug;18(16):3038-51.
22. Klaassen, RJ, Goodman, TR, Pham, B, Doyle, JJ. "Low-risk" prediction rule for pediatric oncology patients presenting with fever and neutropenia. J Clin Oncol 2000; 18:1012.
23. Lucas, KG, Brown, AE, Armstrong, D, et al. The identification of febrile, neutropenic children with neoplastic disease at low risk for bacteremia and complications of sepsis. Cancer 1996; 77:791.
24. Rackoff, WR, Gonin, R, Robinson, C, et al. Predicting the risk of bacteremia in childen with fever and neutropenia. J Clin Oncol 1996; 14:919.
25. Alexander, SW, Wade, KC, Hibberd, PL, Parsons, SK. Evaluation of risk prediction criteria for episodes of febrile neutropenia in children with cancer. J Pediatr Hematol Oncol 2002; 24:38.
26. Mustafa, MM, Aquino, VM, Pappo, A, et al. A pilot study of outpatient management of febrile neutropenic children with cancer at low risk of bacteremia. J Pediatr 1996; 128:847.
27. Mullen, CA, Petropoulos, D, Roberts, WM, et al. Outpatient treatment of fever and neutropenia for low risk pediatric cancer patients. Cancer 1999; 86:126.
28. Aquino, VM, Buchanan, GR, Tkaczewski, I, Mustafa, MM. Safety of early hospital discharge of selected febrile children and adolescents with cancer with prolonged neutropenia. Med Pediatr Oncol 1997; 28:191.
29. Bash, RO, Katz, JA, Cash, JV, Buchanan, GR. Safety and cost effectiveness of early hospital discharge of lower risk children with cancer admitted for fever and neutropenia. Cancer 1994; 74:189.
30. Lehrnbecher, T, Stanescu, A, Kuhl, J. Short courses of intravenous empirical antibiotic treatment in selected febrile neutropenic children with cancer. Infection 2002; 30:17.
31. Shenep, JL, Flynn, PM, Baker, DK, et al. Oral cefixime is similar to continued intravenous antibiotics in the empirical treatment of febrile neutropenic children with cancer. Clin Infect Dis 2001; 32:36.
32. Paganini, H, Gomez, S, Ruvinsky, S, et al. Outpatient, sequential, parenteral-oral antibiotic therapy for lower risk febrile neutropenia in children with malignant disease: a single-center, randomized, controlled trial in Argentina. Cancer 2003; 97:1775.
33. Ammann, RA, Simon, A, de Bont, ES. Low risk episodes of fever and neutropenia in pediatric oncology: Is outpatient oral antibiotic therapy the new gold standard of care?. Pediatr Blood Cancer 2005; 45:244.
34. Kassa Cs, Sinkó J, Kállay K, Kertész A, Konkoly Thege M, Kriván G: Prevalence of multiresistant pathogens in surveillance and clinical isolates from patients undergoing hematopoetic stem cell transplantation in Hungary: a single-center experience. EBMT 2009 Annual Meeting, Göteborg
35. Wagner, ML, Rosenberg, HS, Fernbach, DJ, Singleton, EB. Typhlitis: a complication of leukemia in childhood. Am J Roentgenol Radium Ther Nucl Med 1970; 109:341.
36. Pizzo, PA, Walsh, TJ. Fungal infections in the pediatric cancer patient. Semin Oncol 1990; 17:6.
37. Marchetti O, Cordonnier C, Calandra T: Empirical antifungal therapy in neutropaenic cancer patients with persistent fever. Eur J Cancer 2007;Suppl.5:32-42.
38. Walsh, TJ, Pappas, P, Winston, DJ, et al. Voriconazole compared with liposomal amphotericin B for empirical antifungal therapy in patients with neutropenia and persistent fever. N Engl J Med 2002; 346:225.
39. Walsh, TJ, Finberg, RW, Arndt, C, et al. Liposomal amphotericin B for empirical therapy in patients with persistent fever and neutropenia. National Institute of Allergy and Infectious Diseases Mycoses Study Group. N Engl J Med 1999; 340:764.
40. Pappas PG, Kauffman CA, Andes D et al: Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America. Clin Infect Dis 2009;48:503-35.
41. De Pauw BE, Walsh TJ, Donnelly JP et al.: Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008;46:1813-21.
42. Thomas KE, Owens CM, Veys PA, Novelli V, Costoli V.: The radiological spectrum of invasive aspergillosis in children: a 10-year review. Pediatr Radiol. 2003 Jul;33(7):453-60. Epub 2003 May 9.
43. Nurzyñska-Flak J, Zawitkowska-Klaczyñska J, Kowalczyk JR.: The radiologic diagnosis of invasive fungal infections in neutropenic children. Ann Univ Mariae Curie Sklodowska Med. 2004;59(2):184-8.
44. Kassa Csaba, Kállay Krisztián, Sinkó János, Járay Balázs, Benyó Gábor, Tóth Ágnes, Goda Vera, Újhelyi Enikő, Faggyas Attila, Kriván Gergely: Invazív diagnosztikai eljárások szerepe őssejt-transzplantált betegek súlyos infekcióinak felismerésében és helyes kezelésében. A Magyar Infektológiai és Klinikai Mikrobiológiai Társaság 2009. évi Kongresszusa.
45. Walsh TJ, Anaissie EJ, Denning DW et al: Tretment of Aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infect Dis 2008;46:327-60.
46. Cordonnier C, Pautas C, Maury S et al.: Empirical versus preemptive antifungal therapy for high-risk, febrile, neutropenic patients: a randomized, controlled trial. Clin Infect Dis 2009;48:1042-51.
47. Karlsson MO, Lutsar I, Milligan PA: Population Pharmacokinetic Analysis of Voriconazole Plasma Concentration Data from Pediatric Studies. Antimicrobial Agents and Chemotherapy, Mar, 2009, p. 935-944.
48. Bucaneve G, Castagnole E, Viscoli C et al.: Quinolone prophylaxis for bacterial infections in afebrile high-risk neutropenic patients. Eur J Cancer 2007;Suppl.5:7-12.
49. Schaad UB, abdus Salam M, Aujard Y, et al: Use of Fluoroquinolones in Pediatrics: Consensus Report of an International Society of Chemotherapy Commission. Pediatr Infect Dis J, 1995, 14(1):1-9.
50. Gubbins PO, Krishna G, Sansone-Parsons A: Pharmacokinetics and Safety of Oral Posaconazole in Neutropenic Stem Cell Transplant Recipients. Antimicrob Agents Chemother, 2006, 50(6):1993-9.
51. Sung, L, Nathan, PC, Lange, B, et al. Prophylactic granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor decrease febrile neutropenia after chemotherapy in children with cancer: A meta-analysis of randomized controlled trials. J Clin Oncol 2004; 22:3350.
52. Schaison, G, Eden, OB, Henze, G, et al. Recommendations on the use of colony-stimulating factors in children: Conclusions of a European panel. Eur J Pediatr 1998; 157:955.
53. Lehrnbecher, T, Welte, K. Haematopoietic growth factors in children with neutropenia. Br J Haematol 2002; 116:28.
54. Ozkaynak, MF, Krailo, M, Chen, Z, Feusner, J. Randomized comparison of antibiotics with and without granulocyte colony-stimulating factor in children with chemotherapy-induced febrile neutropenia: a report from the Children's Oncology Group. Pediatr Blood Cancer 2005; 45:274.
55. Heussner, P, Haase, D, Kanz, L, et al. G-CSF in the long-term treatment of cyclic neutropenia and chronic idiopathic neutropenia in adult patients. Int J Hematol 1995; 62:225.
56. Jayabose, S, Tugal, O, Sandoval, C, et al. Recombinant human granulocyte colony stimulating factor in cyclic neutropenia: Use of a new 3-day-a-week regimen. Am J Pediatr Hematol Oncol 1994; 16:338.
57. Hammond, WP 4th, Price, TH, Souza, LM, Dale, DC. Treatment of cyclic neutropenia with granulocyte colony-stimulating factor. N Engl J Med 1989; 320:1306.
58. Bonilla, MA, Dale, D, Zeidler, C, et al. Long-term safety of treatment with recombinant human granulocyte colony-stimulating factor (r-metHuG-CSF) in patients with severe congenital neutropenias. Br J Haematol 1994; 88:723.
59. Vincze Diána, Kriván Gergely, Kállay Krisztián: Neutropéniás gyermekek lázas epizódjainak prognosztikai tényezői. TDK Konferencia, SE, Budapest, 2010.
60. Carcillo JA, Fields I: Clinical practice parameters for hemodynamic support of pediatric and neonatal patients in septic shock. Crit Care Med, 30, 1365-1378, 2002
61. European Resuscitaion Council: European Pediatric Life Support Course Manual, 3rd Edition, 2006
62. Carcillo JA, Davis AL, Zaritsky A: Role of early fluid resuscitation in pediatric septic shock. JAMA; 266:1242-1245, 1991
63. Han YY, Carcillo JA, Dragotta MA, et al: Early reversal of pediatric-neonatal septic shock by community physicians is associated with improved outcome. Pediatrics; 112:793-799, 2003
64. Dung NM, Day NP, Tam DT, et al: Fluid replacement in dengue shock syndrome: A randomized, double-blind comparison of four intravenous-fluid regimens. Clin Infect Dis; 29:787-794, 1999
65. Dellinger RP, Levy MM, Carlet JM: Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock: 2008; Crit Care Med. 36(1):296-327, 2008
66. Kumar A, Roberts D, Wood KE, et al: Duration of hypotension prior to initiation of effective antimicrobial therapy is the critical determinant of survival in human septic shock. Crit Care Med 34:1589-1596, 2006
67. Regulation (EC) No 1901/2006 of the European Parliament and of the Council of 12 December 2006 on medicinal products for paediatric use and amending Regulation (EEC) No 1768/92, Directive 2001/20/EC, Directive 2001/83/EC and Regulation (EC) No 726/2004
A szakmai irányelv érvényessége: 2014. június 30.


